Текст
Siifiwasserflora
von Mitteleuropa
Begriindet von A. Pascher
Herausgegeben von
H. Ettl • J. Gerloff • H. Heynig
Band 20:
Hausler • Schizomycetes
Gustav Fischer Verlag
Stuttgart • New York • 1982
Schizomycetes
Bakterien
Jiff Hausler
340 Figuren
Gustav Fischer Verlag
Stuttgart • New York • 1982
Anschrift des Verfassers:
Dr. Jin Hausler, CSc.
Vyzkumny ustav vodohospodafsky
Podbabska 30
160 62 Praha 6 - Podbaba
CSSR
Anschrift der Herausgeber:
Dr. rer. nat. Hanus Ettl, CSc, Botanisches Institut
der Tschechoslowakischen Akademie der Wissenschaften,
Arbeitsstatte Brno, CSSR
Prof. Dr. rer. nat. Johannes Gerloff
Bot. Garten u. Bot. Museum Berlin-Dahlem,
Konigin-Luise-Str. 6-8, 1 Berlin 33
Dr. rer. nat. H. Heynig
Bezirks-Hygieneinstitut, Burgstr. 40-41, DDR-4010
X ■' r i -'.: - :0 ',
CIP-Kurztitelaufnahme der Deutschen Bibliothek
Susswasserflora von Mitteleuropa / begr. von
A. Pascher. Hrsg. von H. Ettl ... - Stuttgart ;
New York : Fischer
NE: Pascher, Adolf [Begr.]; Ettl, Hanus [Hrsg.]
Bd. 20. - Hausler, Jiff: Schizomycetes
Hausler, Jifi:
Schizomycetes : (Bakterien) / Jiff Hausler. -
Stuttgart ; New York : Fischer, 1982.
(Susswasserflora von Mitteleuropa ; Bd. 20)
ISBN 3-437-30344-9 v
© Gustav Fischer Verlag: Stuttgart ■ New York • 1982
Wollgrasweg 49, 7000 Stuttgart 70 (Hoh enheim)
Alle Rechte vorbehalten
Satz und Druck: Graph. Grofibetrieb Friedrich Pustet, Regensburg
Einband: Grofibuchbinderei A. Koch, Tubingen
Printed in Germany
ISBN 3-437-30344-9
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail palmtaqwe@rambler.ru
Vorwort der Herausgeber
Die von A. Pascher herausgegebene Siifiwasserflora Deutschlands, Osterreichs
und der Schweiz, deren zweite Auflage dann den Titel Sufiwasser-Flora Mittel-
europas erhielt, gait und gilt noch immer als das Standardwerk der Bestim-
mungsliteratur der Siifiwasserpflanzen, an das sich spatere Floren in Inhalt und
aufierer Gestaltung eng anlehnen. Die Sufiwasserflora hat sich seit dem Erschei-
nen ihrer ersten Bande auf der ganzen Welt einen berechtigten Ruf erworben, ja
sie ist dariiber hinaus zu einem Begriff geworden. Nicht nur Anfanger, sondern
auch Spezialisten, die sich mit Siifiwasserpflanzen und besonders mit Algen
befassen, greifen immer wieder zu dieser Bucherreihe. Dies darf als Beweis fur
die Richtigkeit der Pascherschen Grundkonzeption dienen, die zu verandern
auch heute noch keine Veranlassung besteht. Das bedeutet jedoch nicht, dafi die
Neubearbeitung der SuCwasserflora im einzelnen nicht wesentliche Erweiterun-
gen und Veranderungen erfahren mufite, liegen doch die Erstbearbeitungen
z. T. mehr als 60 Jahre zuriick, wobei nicht alle der geplanten Bande erschienen
sind. Die heutigen Anschauungen fiber die Verwandtschaftsverhaltnisse haben
sich gegenfiber friiheren Vorstellungen ebensosehr gewandelt, wie die Zahl der
Arten, die Kenntnis ihrer Entwicklungsgeschichte oder ihrer okologischen
Anspriiche zugenommen hat. All dies mufite in einer Neuauflage einen Nieder-
schlag finden, zumal wenn sie sich zum Ziel setzt, den neuesten Kenntnisstand
der Systematik der behandelten Gruppen widerzuspiegeln. Es ist daher ver-
standlich, dafi sowohl Zahl und Umiang der Bande als auch die Anzahl der
Abbildungen vermehrt werden mufiten. Dennoch soil und kann die Flora die
monographische Bearbeitung der einzelnen taxonomischen Gruppen nicht er-
setzen. In diesem Sinne mufite auch manches kompilatorisch zusammengetragen
werden, obwohl eine kritische Durcharbeitung stets angestrebt wurde. Viele
Arten sind nur sehr selten gefunden worden, manche iiberhaupt nur von der
Erstbeschreibung bekannt. In diesen Fallen kann nur der erfahrene Kenner einer
Sippe die Angaben in der Literatur zutreffend bewerten. Dennoch wird es stets
Unsicherheiten - wie immer in der Taxonomie - in der Bewertung geben.
Wenn auch der Titel des Werkes beibehalten wurde, so sind doch in vielen
Gruppen, vor allem bei den Algen, wie z. T. auch schon in den ersten beiden
Auflagen, ganz Europa und vielfach auch die iibrigen Kontinente beriicksichtigt.
Dies hat zu einer Ausweitung des Umfangs der Sfifiwasserflora ebenso beigetra-
gen wie die neue Gliederung des Gesamtwerkes, die heutigen taxonomischen
Anschauungen Rechnung tragt, aber auch, wie wir hoffen, die Benutzbarkeit
erleichtert. Dem sollen auch die zahlreichen Abbildungen dienen, die nicht nur
jede Art, sondern meist auch fur das Erkennen wichtige Entwicklungsstadien
wiedergeben.
Das verstarkte Interesse der Gesellschaft an Fragen des Umweltschutzes driickt
sich in einer Zunahme hydrobiologischer Forschungen aus, fur die eine zuverlas-
sige Bestimmungsflora die Voraussetzung ist; wir glauben, dafi hier die
Neuauflage der Sufiwasserflora eine Liicke schliefien kann, die dem praktisch arbei-
tenden Hydrobiologen meist schmerzhaft bewufit wird. Diese Liicke haben
weder die Rabenhorstsche Kryptogamenflora, die ein Torso geblieben ist, noch
die Reihe «Das PhytoplanktojL-des Sufiwassers», die bewufit nur einen Teil der
Formenfulle erfafit. kesein<»r^^h A<* <:;;«- -*i— •' i-:—i.- 1'— ~-«-
VI • Vorwort der Herausgeber
scher Sprache, die fur viele Benutzer sprachlich nicht zuganglich sind und sich
aufierdem meist auf geographisch begrenzten Gebiete beschranken und oft auch
nicht alle bekannten Sippen enthalten.
Andererseits haben wir wegen der vorhandenen Phytoplanktonbande geglaubt,
auf einen besonderen Band «Phytoplankton», wie er von Pascher urspriinglich
geplant war, verzichten zu konnen.
Die Gliederung des Werkes ist auf 23 Bande berechnet, die von der grundlegen-
den Einteilung Paschers ausgeht, aber auch die Klassifikation von Chadefaud
(1960), Christensen (1962) und Bourrelly (1970) beriicksichtigt. Dementspre-
chend sind die einzelnen Hefte eingeteilt. Diese sollen nicht die phylogeneti-
schen Beziehungen wiedergeben, sondern vielmehr der praktischen Orientie-
rung dienen und solche taxonomische Gruppen umfassen, die durch bestimmte,
eindeutig charakterisierte Merkmale zu unterscheiden sind.
Band 1 Chrysophyceae
Band 2 Bacillariophyceae
Band 3 Xanthophyceae I (erschienen)
Band 4 Xanthophyceae II (Vaucheriales) (erschienen)
Band 5 Cryptophyceae und Raphidophyceae
Band 6 Dinophyceae
Band 7 Phaeophyceae und Rhodophyceae
Band 8 Euglenophyceae
Band 9 Chloropnyceae I (Pedinomonadales, Pyramimonadales, Volvocales)
Band 10 Chlorophyceae II (Tetrasporales)
Band 11 Chlorophyceae III (Chlorococcales)
Band 12 Chlorophyceae IV (Ulotrichales)
Band 13 Chlorophyceae V (Chaetophorales, Trentepohliales etc.)
Band 14 Chlorophyceae VI (Oedogoniales)
Band 15 Chlorophyceae VII (Sphaeropleales, Siphonocladales)
Band 16 Conjugatophyceae I (Zygnemales)
Band 17 Conjugatophyceae II (Desmidiales)
Band 18 Charophyceae
Band 19 Cyanophyceae
Band 20 Schizomycetes
Band 21 Mycophyta (Phycomycetes, Fungi imperfecti, Lichenes etc.)
Band 22 Bryophyta
Band 23 Pteridophyta und Anthophyta I (erschienen)
Band 24 Pteridophyta und Anthophyta II (erschienen)
Da fast alle friiheren Mitarbeiter der Sufiwasserflora verstorben sind, mufiten fur
die entsprechenden Gruppen neue Bearbeiter gewonnen werden. Allen, die sich
bereit erklart haben, sich dieser Aufgabe zu unterziehen, haben die Herausgeber
sehr herzlich zu danken, vor allem, da sie nicht verkennen, wie undankbar eine
derartige Aufgabe ist und wieviel Zeit sie beansprucht. Der Dank gilt aber auch
den beiden Verlagen, die bereit waren, mancherlei Wunsche zu akzeptieren,
auch wenn sie zusatzliche finanzielle Belastungen bedeuteten, und die stets
bermiht waren, auftretende Schwierigkeiten zu uberbriicken. Die Herausgeber
haben den Wunsch, dafi sich die neue Edition der Sufiwasserflora ebenso
bewahren moge wie die beiden von A. Pascher redigierten Auflagen. Sie hoffen
daruber hinaus, damit dem Andenken A. Paschers zu dienen, des hervorragen-
den Wissenschaftlers und liebenswurdigen Menschen, dem sie direkt oder
indirekt viel verdanken.
Mit seinen Worten mochten wir uns zum Schlufi an die Benutzer dieses Werkes
wenden: «Irrtumer lassen sich beim besten Willen nicht vermeiden, weder fur
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Vorwort der Herausgeber • VII
den speziellen Bearbeiter, noch fur den Herausgeber, der ein schwer ubersehba-
res grofies Gebiet unmoglich gleichmafiig ubersehen kann. Fur jede sachliche
und wohlgemeinte Anregung und Berichtigung werden Herausgeber und
Bearbeiter immer dankbar sein.»
Im Oktober 1977 H. Ettl • J. Gerloff • H. Heynig • B. Schussnig t
Herausgeber und Verlage gedenken dankbar Professor Bruno Schussnigs, der
sich als einer der Mitherausgeber mit seiner ganzen Person fur diese Neuauflage
eingesetzt hat. Leider war es ihm nicht mehr vergonnt, den Neubeginn der
Sufiwasserflora zu erleben.
Seine aus iiberragendem Wissen geborene, stets wache Kritik hat vieles zur
Klarung allgemeiner Fragen beigetragen. Sie werden wir in Zukunft vermissen.
Fehlen wird uns aber auch der liebenswerte, warmherzige Mensch, dessen
urbaner Geist Schwierigkeiten uberwand.
Wir haben einen Freund verloren.
Vorwort
In der Literatur existiert bislang kein Werk, das sich systematisch mit der
Problematik der Identifizierung der im Wasser lebenden Mikroorganismen
befafit. In der urspriinglichen Ausgabe der Pascherschen «Siif$wasserflora» sind
die Schizomycetes nie erschienen. Der I .Teil von Huber-Pestalozzis «Das
Phytoplankton des Siif$wassers» ist schon veraltet und unvollstandig, und
Krasilnikovs «Opredelitel bakterij i aktionomycetov» befafit sich nicht mit
Bakterien der Gewasser. Die letzte Ausgabe von Bergeys Manual (1974) enthalt
zwar eine Darstellung der Bakterien, die den modernen mikrobiologischen
Anforderungen entspricht, doch wird eine Reihe von typischen wasserbewoh-
nenden Arten von Mikroorganismen entweder ganz iibergangen und nur sehr
kurz behandelt.
Ich habe daher die mir vom G. Fischer-Verlag gebotene Gelegenheit begriifk
und versucht, ein Bestimmungswerk der im Wasser lebenden Bakterien im
Rahmen der Neuausgabe der «Siif5wasserflora von Mitteleuropa» zu schaffen.
Ohne das tiefe Verstandnis und ohne eine Reihe von fachlichen und praktischen
Ratschlagen eines der Herausgeber, Dr. H. Ettl, CSc, hatte sich dieses Werk nur
schwer realisieren lassen. Es sei mir gestattet, ihm an dieser Stelle fur die
freundliche Hilfe, die er mir stets bereitwillig gewahrte, meinen aufrichtigen
Dank auszusprechen. Ferner mochte ich der Leitung des Forschungsinstitutes
fur Wasserwirtschaft in Prag dafiir danken, dafi sie mir ermoglichte, dieses
Bestimmungswerk auszuarbeiten. Mein Dank gebiihrt weiter den verstorbenen
Herren Prof. Z. Cyrus und Prof. Dr. B. Fott Dr. Sc, sowie Doz. Dr. Fr. Kapra-
lek fur ihre fachlichen Ratschlage, Prom. Biol. J. Hauslerova und Herrn J. Po-
chop fur ihre ausgiebige technische Hilfe, Frau Havrankova und Frau Kohnova
fur die fachliche Ubersetzung, Frau Kuchafova, Frau Polockova und Frau
Podhorska fur die Mitarbeit beim Heraussuchen der Literatur und nicht zuletzt
Frau Borovickova fur die Durchsicht und Korrektur des Manuskriptes.
Prag, Herbst 1976 J. Hausler
Seit das Manuskript dieser Arbeit im Herbst 1976 dem Verlag iibergeben wurde,
kam es wegen der grofien Fortschritte in der Mikrobiologie des Wassers zu
zahlreichen neuen wissenschaftlichen Erkenntnissen. Bei einer betrachtlichen
Zahl von Taxa ergaben sich dementsprechend wesentliche Anderungen bezie-
hungsweise Revisionen der Ansichten iiber deren morphologische, physiologi-
sche und biochemische Eigenschaften; dasselbe gilt auch fur ihre taxonomische
Einordnung. AufSerdem wurden zahlreiche neue Taxa beschrieben, wobei es
sich als notwendig erwies, auch einige hohere Taxa (Gattungen, Familien, u. a.)
neu zu definieren.
Diese Anderungen erforderte eine griindliche Auswertung der Weltliteratur
sowie eine ausfiihrliche Revision des gesamten Manuskripts, bevor es in den
Druck gehen konnte.
Prag, Herbst 1980
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Inhalt
I. Allgemeiner Teil 1
1. Vorbemerkungen 1
2. Verfahren beiderBestimmungderMikroben 3
3. ErklarungeinigerFachausdriicke 4
4. Charakteristische Eigenschaften der Bakterien 9
4.1. Morphologie 9
4.2. Zytologie 11
4.3. Physiologische Eigenschaften 12
4.4. Fortpflanzung 12
4.5. Bewegung 13
4.6. Grofie der Bakterien 13
4.7. Verbreitung 13
4.8. Systematische Einordnung der Bakterien 13
II. SpeziellerTeil: Schizomycetes 16
Teil I. Phototrophe Bakterien 16
1. Ordnung Rhodospirillales 16
1. Unterordnung Rhodospirillineae 17
1. FamilieRhodospirillaceae 17
2. Familie Chromatiaceae 38
2. Unterordnung Chlorobineae 92
1. Familie Chlorobiaceae 93
2. Familie Chloroflexaceae 120
Addendum zur Ordnung Rhodospirillales 124
Teil II. Gleitende Bakterien 131
1. Ordnung Myxobacterales 131
1. Familie Myxococcaceae 133
2. FamilieArchangiaceae 134
3. Familie Cystobacteraceae 134
4. Familie Polyangiaceae 134
2. Ordnung Cytophagales 138
1. Familie Cytophagaceae 139
2. Familie Beggiatoaceae 171
3. Familie Leucotrichaceae 185
4. Familie Vitreoscillaceae 201
5. Familie Simmonsiellaceae 211
6. Familie Achromatiaceae 216
7. Familie Thiosiphonaceae 224
8. Familie Pelonemataceae 225
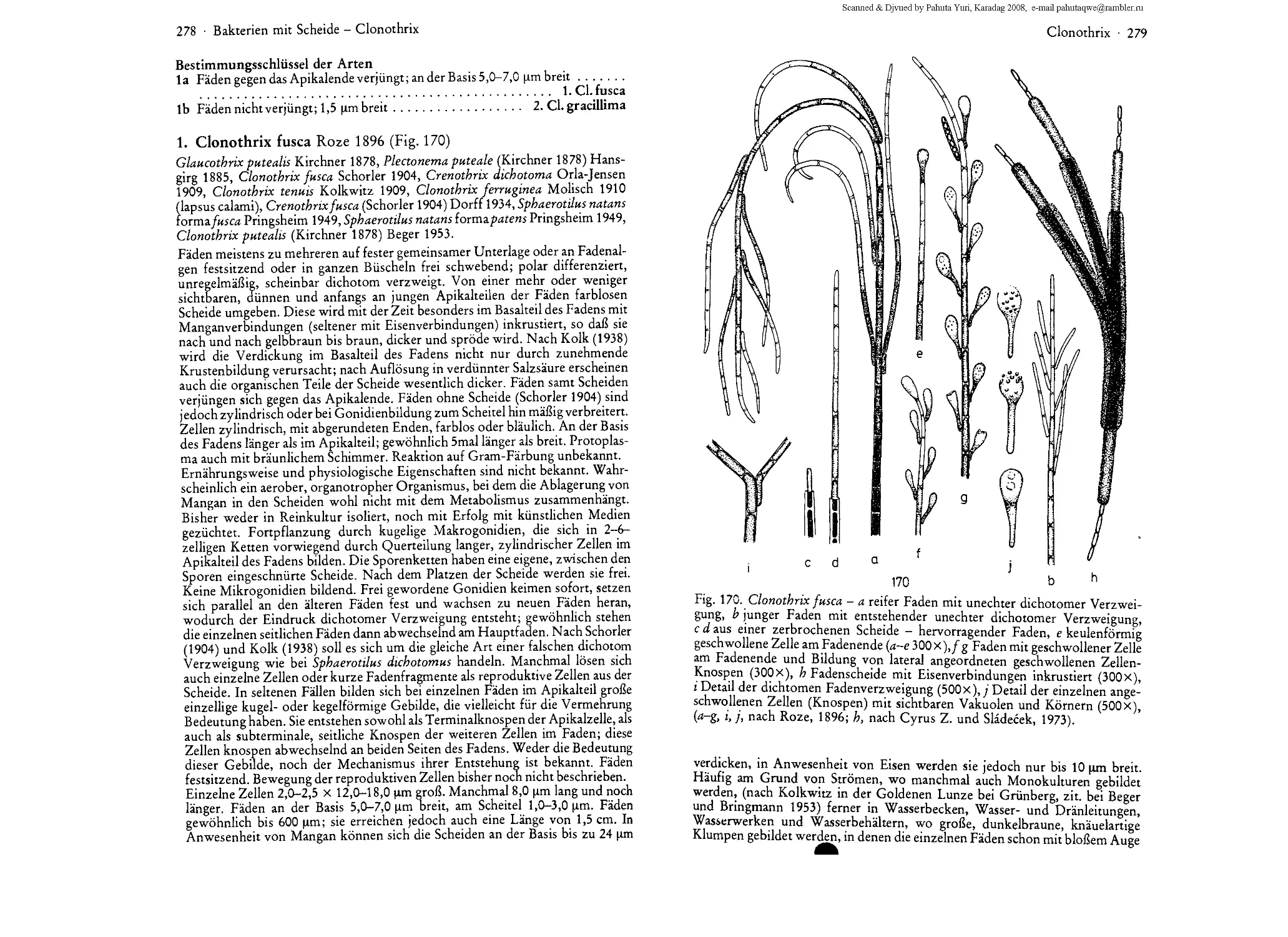
Teil III. Bakterien mit Scheide 246
Teil IV. Knospende Bakterien und Bakterien mit Anhangseln .... 297
Teil V. Spirochaten 363
Ordnung Spirochaetales 363
1. Familie Spirochaetaceae 364
2. Familie LeptosDira^H 378
2 ■ Vorbemerkungen
alle Organismen aufgefuhrt werden (es mufken im Gegenteil ganze Gruppen
ausgelassen werden); dariiber hinaus ist ein phylogenetisches System vor allem
auch deshalb unvorteilhaft, weil es wegen der sich fast iiberstiirzenden neuen
Erkenntnisse auf dem Gebiet der modernen Mikrobiologie schnell veraltet und
systematisch modifiziert werden mufi (siehe z. B. die verschiedenen Ausgaben
von Bergey's Manual bis 1957). Ein weiterer Nachteil eines phylogenetischen
Systems bestiinde darin, dafi es dem Zweck und der Orientierung dieser Schrift
hatte angepafit werden miissen, was notgedrungen zu Unubersichtlichkeit und
in manchen Fallen zu Verwirrungen gefiihrt hatte. Deshalb ist einer kunstlichen
Klassifikation der Organismen in einigen Gruppen der Vorrang gegeben, und die
Organismen wurden dabei auf Grund eines oder mehrerer Merkmale in einer
Gruppe zusammengefafit, ohne auf gegenseitige verwandtschaftliche Zusam-
menhange Riicksicht zu nehmen.
Als Grundlage fiir diese Einteilung wurde die in der 8. Ausgabe von Bergey's
Manual (1974) angefiihrte Methode angewandt, die jedoch in einigen Fallen
modifiziert werden mufite. Der gesamte spezielle Teil wurde in zehn Teile
gegliedert: davon sind Teil I - Teil VI in ihrer Struktur bis auf geringe Ausnah-
men identisch mit Bergey's Manual (1974); die iibrigen Teile (Teil VII-Teil IX)
mufken entsprechend geandert werden.
Bergey's Manual (1974) fiihrt nur jene Arten an, die in den meisten Fallen aus
Reinkulturen bekannt sind; deshalb werden auch ihre biochemischen Eigen-
schaften beschrieben. Die Mehrzahl der Beschreibungen der im Wasser vorkom-
menden Organismen ist hingegen von diesem Standpunkt aus gesehen unzurei-
chend, da sie meistens aus dem Freiland - ohne entsprechende Kulturen -
beschrieben wurden. Daher mufken die einzelnen Teile der Bergeyschen Kon-
zeption erweitert werden, um auch diese Arten entsprechend der Qualitat ihrer
Beschreibung einordnen zu konnen. Unzureichend beschriebene Arten werden
als «Unsichere Arten» aufgefuhrt. Beschreibungen wenig bekannter
Organismen, von Organismen mit unklarer Zuordnung, mit unvollstandiger
Beschreibung oder unrichtiger Einreihung in Arten u. a. mufken ohne jeglichen ver-
wandtschaftlichen Zusammenhang im Teil X «Addendum» zusammengefafk
werden. Dieser Teil besitzt ausnahmsweise auch keinen Bestimmungsschliissel.
In einigen Fallen, wo der Organismus Merkmale aufweist, die fiir zwei Gruppen
zutreffen, (z. B. die Gattung Rhodomicrobium) wurde er nur in einer Gruppe
beschrieben, kann aber anhand der Bestimmungsschliissel in beiden Gruppen
identifiziert werden. Ebenso konnen auch zwei verschiedene Wuchsformen eines
Organismus (z. B. Leptothrix discophora-festshzende und schwebende Faden-
u. a.) nach dem Bestimmungsschliissel identifiziert und unterschieden werden.
Besondere Aufmerksamkeit erfordern die Beschreibungen, die auf
verschiedenen Wuchsformen der Organismen, der Variability ihrer Morphologie, ihrer
Grofie, auf geringen Unterschieden in Emahrungsanspruchen u. a. beruhen,
und die friiher als selbstandige Arten beschrieben wurden. Diese wurden den
Leitarten als Synonyme zugeordnet. Da sie sich jedoch manchmal in einigen
Details von der Beschreibung der Leitart unterscheiden, werden sie hinter der
Leitart angefiihrt. Sie sind petit gedruckt und tragen die gleiche Reihenzahl wie
die Leitart, jedoch wurde ein kleiner Index-Buchstabe hinzugefiigt. Morpholo-
gisch besonders unterschiedliche Formen konnen nach dem Schlussel
identifiziert werden, wo sie unter der Reihenzahl der Leitart mit dem betreffenden
Index angefiihrt sind. Hinter dem Namen der Leitart ist zusatzlich der Name der
unterschiedlichen Form in Klammern angegeben (z. B. la. Planctomyces bekefii
[Planctomyces crassus]). Es mufi betont werden, dafi der Name der so angefuhr-
ten Formen (der zugeordneten Arten) weder taxonomisch noch nomenklato-
risch giiltig ist und nur als Arbeits- oder Laboratoriumsbezeichnung solcher
friiher beschriebener Formen dient. ^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Bestimmung der Mikroben ■ 3
Das gleiche gilt auch dann, wenn Autoren zwei Gattungen vereinigt haben,
wobei sich ihre Beschreibungen in manchen Details etwas voneinander
unterscheiden.
Die Beschreibungen der einzelnen Arten oder hoherer taxonomischer Einheiten
werden durch eine Reihe von Anmerkungen unter Zitierung des betreffenden
Autors erganzt. Dies ist vor allem dort der Fall, wo die Ansichten der Autoren
nicht iibereinstimmen. Bei der Zitierung alterer Autoren kommt es oft vor, dafi
sich der Name des behandelten Organismus inzwischen geandert hat. In solchen
Fallen wird der gegenwartig beniitzte Name angefiihrt; danach wird in
Klammern nach dem Gleichheitszeichen der von dem zitierten Autor gebrauchte
Name angegeben (z. B. «Nach Zopf (1882) soil auch Lamprocystis roseopersicina
[— Beggiatoa roseopersicina] zu Chromatium okenii gestellt werden).
Ein untrennbarer Bestandteil der Beschreibungen sowie der Schlussel sind die
Abbildungen. Bei ihrer Auswahl und Anfertigung wurden die neuesten
Erkenntnisse auf dem Gebiet der Mikrobiologie des Wassers beriicksichtigt, so daf?
die ubernommenen Abbildungen alterer Autoren prazisiert werden mufken.
Um die Variability der Arten moglichst genau darzustellen, werden bei einer Art
oft Abbildungen mehrerer Autoren beniitzt. In manchen Fallen wurden
Abbildungen nach Phasenkontrast- oder elektronenmikroskopischen Aufnahmen
verschiedener Autoren umgezeichnet.
2. Verfahren zur Bestimmung der Mikroben
Die Bestimmung von Mikroorganismen erfordert eine vollkommene Kenntnis
des Organismus, seiner Lebensweise und seines Standortes, seiner okologischen
Anspriiche, seiner morphologischen, physiologischen und biochemischen Ei-
genschaften, sowie der Art der Kultur.
In der iiblichen mikrobiologischen Praxis, die das Ziel hat, eine bestimmte
Bakterie in das gegebene System nach dem Klassifikationsschliissel einzureihen,
ist der Ausgangspunkt die Reinkultur des Organismus, der dann einer Reihe von
diagnostischen Testen unterworfen wird.
Bei Mikroben, die fiir das Wassermilieu typisch sind, ist es in vielen Fallen haufig
sehr schwierig, manchmal sogar ausgeschlossen, eine Reinkultur zu erzielen, da
eine Reihe dieser Organismen bislang noch nicht kultiviert werden konnte.
Deshalb mufi das Schwergewicht auf die morphologischen Merkmale gelegt
werden. Es ist sicher allgemein bekannt, dafi die Bestimmung der Mikroben
allein auf Grund ihrer morphologischen Merkmale nicht nur ein hervorragendes,
modern ausgestattetes Mikroskop voraussetzt, sondern auch eine souverane
Beherrschung der mikroskopischen Technik und der Herstellung nativer, sowie
verschiedenartig gefarbter Praparate.
Bei der Bewertung morphologischer Merkmale wird vor allem der Gesamthabi-
tus und die Form der Zellen festgestellt, die Bildung von Zellaggregaten oder
Mikrokolonien, die Anwesenheit einer Kapsel und die Bildung von Zysten sowie
anderer Formen von Ruhestadien. Wichtig sind ferner Lage und Anzahl von
Geifieln, die Anwesenheit von Pigmenten in den Zellen, die Spurenbildung oder
der Inhalt verschiedener Inklusionen, Gasvakuolen, Bildung von Prostheken,
Stielen, Stengeln oder anderer Auslaufer, das Farbeverhalten nach Gram u. a.
Grofie Aufmerksamkeit mufi auch der Feststellung der Zellmafie, eventuell ihrer
Auslaufer oder Geifieln gewidmet werden und bei schraubenartig gekrummten
Zellen auch den Ausmafien der Windungen. In manchen Fallen mufi auch das
Verhalten in der Kultur beajj^pt werden, ohne das man nicht auskommen kann.
X ■ Inhalt
Teil VI. Spirillen und gekrummte Bakterien 384
1. Familie Spirillaceae 384
2. Familie Spirosomaceae 417
Teil VII. Gramnegative aerobe Stabchen und Kokken 424
1. Familie Pseudomonadaceae 424
2. Familie Azotobacteraceae 430
3. Familie Rhizobiaceae 440
4. Familie Methylomonadaceae 440
5. Familie Halobacteriaceae 441
Teil VIII. Chemolithotrophe Schwefelbakterien 442
Familie Thiobacteriaceae 442
Teil IX. Chemolithotrophe, Eisen und Mangan ablagernde
Bakterien 464
Familie Siderocapsaceae 464
Teil X. Addendum 488
Literaturverzeichnis 517
Namenverzeichnis 572
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
I. Allgemeiner Teil
1. Vorbemerkungen
Aufgabe dieses Bestimmungswerkes ist es, der praktischen Identifizierung der
im Wasser vorkommenden Bakterien zu dienen. Damit es, zumindest in seinen
Grundziigen, in den Rahmen der gesamten Reihe hineinpaik, mufite hauptsach-
lich den morphologischen Merkmalen dieser Organismen Aufmerksamkeit
geschenkt werden; diese Merkmale bildeten auch die Grundlage fur die Bearbei-
tung der Bestimmungsschlussel. Dieses Prinzip scheint zwar in der bakteriologi-
schen Praxis etwas illusorisch zu sein, es lafit sich jedoch bei jenen Arten von
Wassermikroorganismen, die als autochthone Mikroflora betrachtet werden
konnen, dank ihrer aufiergewohnlichen Eigenschaften in den meisten Fallen
erfiillen. Die Organismen, die sich auf Grund dieser Kriterien wenigstens
ungefahr identifizieren lassen, mufiten sorgfaltig ausgewahlt werden; trotzdem
war es bei manchen Gruppen nicht moglicn, sicn nur auf ihre morphologischen
Merkmale zu beschranken, sondern es mufiten in gewissem Umfang auch die
physiologischen und Kultureigenschaften mitberiicksichtigt werden (z. B. bei
der Gattung Caulobacter). Die Identifizierung dieser Organismen-Typen ist nur
annahernd moglich. Die genaue Bestimmung mufi mittels biochemischer Teste
mit Reinkulturen weiter uberpriift werden; deren Beschreibung wird hier so
kurz wie moglich angefuhrt, da sie iiber den Rahmen dieser Arbeit hinausgeht.
Es wird daher empfohlen, die betreffende, in der Beschreibung der einzelnen
Gattungen angefiihrte Fachliteratur zu beriicksichtigen. Auch jene Gruppen von
Organismen (z. B. die Familie Enterobacteriaceae), die nur anhand ihrer bioche-
mischen Eigenschaften identifiziert werden konnen, wurden aus demselben
Grund nicht erwahnt, obwohl sie im Wassermilieu grofie Bedeutung haben.
Organismen, die keine typischen Wasserbewohner sind, wurden ebentalls aus-
geschlossen.
Jedoch wurde dort, wo sonst die taxonomischen Beziehungen der betreffenden
Gruppe nicht erkennbar gewesen waren, cine Ausnahme gemacht. So ist z. B.
bti der Ordnung der Myxobacterales (Teil II; nur eine Art aus der Gattung
Polyangium, P. parasiticum, ein typischer Wasserorganismus. (Von den iibrigen
Arten wurden einige Vertreter erst vor kurzer Zeit gefunden, offenbar als
allochthone, eingeschleppte Mikroflora). Um klar auszudriicken, in welche
Gruppe diese aufiergewonnliche Art gehort, mufiten auch hohere taxonomische
Einheiten kurz beschrieben werden.
Von der allochthonen Mikroflora werden nur jene Arten berucksichtigt, von
denen bekannt ist (oder angenommen werden kann), dafi sie sekundar in das
Wasser eingeschleppt werden (von Regenwasser aus dem Erdboden gespiilt,
durch Abwasser u. a.) und dort haufig vorkommen konnen. Ebenso werden
auch manche, nur im Meerwasser gefundene Arten behandelt, bei denen der
begriindete Verdacht besteht, dafi sie auch im Brack- und Siifiwasser auftreten
konnen. Schliefilich werden auch solche wichtige Arten beschrieben, die bislang
nur aufierhalb von Europa gefunden wurden.
Das grofite Problem bei der grundsatzlichen Konzeption dieses
Bestimmungswerkes war die systematische Einreihung der einzelnen Bakteriengruppen. Die
Einteilung in einzelne physiologische Gruppen (z. B. schwefel-, eisenhaltige
Bakterien u. a.) ist zur Zeit schon vollig iiberholt.
Auch die systematische Einordnung auf der Basis phylogenetischer Beziehungen
ist nicht zweckmafiig; erstens konnen aus den oben angefuhrten Griinden nicht
4 ■ Fachausdriicke
Es ist wichtig, die Art des Wachstums auf verschiedenen flussigen oder festen
Nahrboden zu beobachten, besonders Form und GrofSe der Kolonien, ihre
Farbung und Konsistenz, ihr Wachstum auf Schrag-Agar u. a. Es ist zu beriick-
sichtigen, daf$ eine ganze Reihe der im Wasser lebenden Bakterien zu den sog.
oligocarbophilen Organismen gehort, die nicht auf den iiblichen Nahrboden
wachsen, da deren Nahrstoffkonzentration fiir sie zu hoch ist. Fur derartige
Arten ist eine mehrfache Verdunnune dieser Nahrboden erforderlich, noch
besser ist die Kultur auf speziellen Nahrmedien.
Die physiologischen und biochemischen Eigenschaften der Organismen konnen
nur mit erheblichem Arbeitsaufwand und entsprechenden fachlichen Kenntnis-
sen durch biochemische Teste festgestellt werden, wobei besonders das Verhal-
ten gegeniiber Sauerstoff und Stickstoff, verschiedenen Formen von Kohlen-
stoff, die Fahigkeit atmospharischen Stickstoff zu fixieren, Polysacharide und
Proteine zu hydrolysieren, Fette zu zersetzen usw. untersucht werden. Diese
Identifizierungsmethode mufl in manchen Fallen aufierdem durch serologische
und andere spezielle Teste, sowie durch Experimente an Tieren erganzt werden.
Die Untersuchung dieser Eigenschaften geht jedoch vollig iiber den Rahmen
dieses Bestimmungswerkes hinaus und wird deshalb nur in unumganglichen
Fallen kurz angefiihrt.
3. Erklarung einiger Fachausdriicke
Akran — bei der Ordnung Cyclobacteriales Perfiliev 1960 vorkommende
Struktur in Form eines Radchens oder einer Schlinge, die sich wie ein Lasso um
die Beute zusammenzieht;
Ambitroph —■ als Substrat werden entweder organische oder anorganische
Verbindungen verwertet; muf$ von mixotropher Verwertungsweise unterschie-
den werden (Pringsheim 1952);
Araios — fadige Form; Anfangsstadium im Entwicklungszyklus eines Orga-
nismus aus der Gattung Metallogenium; aus Araios bestehen typische, oft mit
Manganoxiden bedeckte Mikrokolonien. An den Seiten des Araios knospen
kleine kokkenformige Zellen;
Axialfaden — lange, diinne, gleichmafSig breite, fadige Strukturen, die den
Protoplasmazylinder der Spirochaten umwinden. An beiden Zellpolen subter-
minal mit einer scheibenformigen Struktur im Protoplast verankert, wobei sie
mit dem freien Ende iiber die Stelle der Verankerung hinausragen. Sie sollen die
Bewegung verursachen;
Axistyl — Axialfaden bei Leptospiren; mit dem Protoplasmazylinder in eine
gemeinsame Membran eingeschlossen;
Bacterotroph — Ernahrungsweise, bei derzum Wachstum Stoffe erforderlich
sind, die in lebenden Zellen anderer Bakterienarten enthalten sind;
Chemolithotroph — Ernahrungsweise, bei der die zu den Lebensfunktionen
erforderliche Energie durch Oxydation anorganischer Stoffe gewonnen wird; als
Kohlenstoffquelle fiir die Syntnese der Biomasse dient Kohlendioxid;
Chemoorganotroph — Ernahrungsweise, bei der die Energie fiir die
Lebensfunktionen durch Oxydation verschiedener organischer Stoffe gewonnen
wird, die auch als Kohlenstoffquelle fiir die Synthese der Biomasse dienen;
Elektronenakzeptor — Stoff, der bei den Oxydoreduktionsprozessen des
Metabolismus Elektronen von einem anderen Stoff empfangt (und dabei redu-
ziert wird);
Elektronendonator (Donor) — Stoff, der bei den Oxydoreduktionspro-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Fachausdriicke • 5
zessen des Metabolismus einem anderen Stoff Elektronen iibergibt (und dabei
oxydiert wird);
Fermentationsmetabolismus (Fermentation) — anaerober ProzefS, in dem bei-
de aus einem gemeinsamen Praekursor entstandenen organischen Stoffe sowohl
Akzeptor als auch Donor von Elektronen sind. Endprodukte sind vorwiegend
(je nach Fermentierungsart) Alkohole, Sauren oder Ketone;
Fimbrien — von Houwinck (1949) beschriebene, diinne, rigide, nur elektro-
nenmikroskopisch sichtbare Faden, deren Funktion bislang nicht genau bekannt
ist; sie befinden sich an der Zelloberflache. Sie dienen anscneinend der gegensei-
tigen Verbindung der Zellen bei der Entstehung verschiedener Gebilde (Roset-
ten, Coenobien u. a.) oder zur Befestigung der Zellen an der Unterlage; keine
Bewegungsorganellen. Die Termini «Pili», «Filamente», «Pseudogeif5eln» u. a.
haben sich nicht eingebiirgert;
Genophor — Kernstruktur, die bei den Bakterien die Funktion der Chromo-
somen hoherer Organismen (Eukaryonten) erfiillt. Sie enthalt Gene, die in einer
Kreisstruktur angeordnet sind. Im Prinzip einfache Makromolekule von Nu-
kleinsauren;
Gonidien — vorwiegend terminal, auf vegetative Weise entstehende reproduk-
tive Zellen, die sich bei fadigen Bakterien oft gleitend bewegen konnen (Harold
und Stanier 1955). Nach Pringsheim (1949) sollen sie sich aus Zoosporen
entwickeln, die ihre Geifieln verlieren;
Gramnegative Bakterien — Gruppe von Bakterien, die den urspriinglichen
basischen Farbstoff (Gentianaviolett oder Kristallviolett) aus dem Zytoplasma
durch Auswaschen mit Athanol verlieren; das Praparat mu6 mit einem anderen
Farbstoff (Fuchsinrot) gegengefarbt werden; die Bakterien erscheinen rotge-
farbt;
Grampositive Bakterien — Gruppe von Bakterien, die den basischen
Farbstoff auch nach der Einwirkung von Athanol im Zytoplasma behalten. Entschei-
dend ist die Funktion der Zellwand, die bei dieser Gruppe fiir den Farbkomplex
(Kristallviolett und Beize zu einer undurchlassigen Barriere wird; die Bakterien
erscheinen blauviolett gefarbt;
Intrazytoplasmatisches Membransystem — Photoassimilationspigmente tra-
ende Auslaufer der zytoplasmatischen Membran; bei phototrophen Purpur-
akterien vorkommend. Vesikularer, lamellarer, tubularer und thylakoider
Typ;
Involutionsformen — abnorme Zellen bei Mikroorganismen, die unter un-
giinstigen Lebensbedingungen oder bei Einwirkung bestimmter spezifischer
Stoffe entstehen oder vorkommen. Beim Ubertragen in eine optimale Umwelt
entwickeln sich diese Formen in der Regel zu normalen vegetativen
Zellen;
Kapsel — Zellhiille (Hiilse), die aus schleimigem, von der Zelle sekretiertem
Stoff gebildet wird und im engen Kontakt mit der Zelloberflache ist. Je nach der
Wasserloslichkeit dieses Stoffes ist der aufiere Rand der Hiille scharf begrenzt
oder mehr oder weniger verschwommen. Prinzipiell unterscheiden wir drei
Typen: Schleim, echte Kapseln und Mikrohiilsen;
Karyoid - siehe «Nukleoid»;
Knospen — asymmetrische Teilungsweise, bei der die Tochterzelle der Mutter-
zelle nicht gleichwertig ist (Star und Skerman 1965)
— Teilungsweise, die zur Bildung diinner, verzweigter Faden fiihrt,
wodurch primitive Kolonien entstehen (Whittenbury und McLee 1967);
Konsortium — symbiotisches Aggregat zweier verschiedener Organismen,
das sich bei den meisten Lebensfunktionen wie ein Individuum verhalt. Es wird
angenommen, dafi im Konsortium der farblose bakterielle Bestandteil ein Orga-
nismus ist, der Sulfate oder Schwefel reduziert, wodurch den phototrophen
6 • Fachausdriicke
griinen Bakterien H,S zur Verfiigung steht (Pfennig 1975, Widdel und Pfennig
1977, Pfennig und Biebl 1976, Gorlenko und Lokk 1979);
Kriste — spezifisches Organell der Gattung Cristispira. Fruher als eine undu-
lierende Membran angesehen. Es handelt sich jedoch um ein Artefakt, das beim
Farben des Praparates durch Abreifien der Axialfaden vom Protoplasmazylinder
innerhalb der Hullmembran entsteht;
Lamellares Membransystem — flache, plattenartige Struktur; entsteht aus
den Falten des intrazytoplasmatischen Membransystems phototropher
Bakterien. (Siehe auch «intrazytoplasmatisches Membransystem»);
Liman — Kustenzone des Meeres, teilweise oder vollig von einer sandigen
Nehrung eingeschlossen. Das Wasser im Liman hat haufig hohen Salzgehalt;
Lithotroph — nur C02 wird als Kohlenstoffquelle verwertet;
Matrix — schleimiges Lager, das Bakterienzellen oder -gruppen umgibt; in der
Regel ein Exkret der Zellen;
Mikrozyste — bei Myxobakterien eine in eine Kapsel oder in eine feste, zahe
Schleimschicht eingeschlossene Myxospore. Bei Spirochaeten werden von eini-
gen Autoren kugelige, in den Kulturen entstehende Gebilde mit diesem
Terminus bezeichnet;
Monotyp — Stamm des Mikroorganismus, von dem die Artsbeschreibung
abgeleitet wird;
Mukoid (Schleim) — von der Zelle sekretierter Schleim; enthalt Mukoproteide
und Mukopolysaccharide;
Myxospore — Ruhezellen in Fruktifikationsgebilden (= Fruchtkorper) von
Myxobakterien; in der Regel resistenter als die vegetative Zelle;
Nekridium — bei fadigen Organismen ein leerer, nach dem Absterben einer
Zelle entstandener Raum; oft lafk sich an diesen Stellen erkennen, ob der
Organismus eine Scheide besitzt;
Neotyp — Stamm, der den urspriinglichen, nicht rnehr existierenden Typen-
stamm ersetzt; auch die Typenbeschreibung eines bislang nicht in Reinkultur
gezuchteten oder in Herbarien aufbewahrten Organismus;
Nukleoid — Kern Equivalent bei Bakterien; aus Desoxyribonukleinsauren
(DNS) bestehend, die durch Farbung nach Feulgen nachweisbar sind. Veralteter
Ausdruck. Siehe auch «Karyoid»;
Oligocarbophil — geringe, bis sehr geringe Konzentrationen kohlenstoffhalti-
ger Stoffe erfordernde Ernahrungsweise;
Oligothiophil — nur geringe H2S-Konzentrationen zum Wachstum erfor-
dernd;
Pakete — grofiere, rechteckige, prismenformige, aus mehreren Zellen (Kok-
ken) bestehende Gebilde. Meist aus Vierergruppen oder deren Vielfachem
bestehend; entsteht durch Zellteilung in drei senkrecht zueinander liegenden
Ebenen, wobei sich die geteilten Zellen nicht voneinander entfernen;
Photolithotroph — Ernahrungsweise, bei der Lichtenergie zur Synthese der
Biomasse ausgeniitzt, als Kohlenstoffquelle jedoch nur C02 verwertet wird;
Photoorganotroph — Ernahrungsweise, bei der Lichtenergie zur Synthese
der Biomasse una der Lebensprozesse ausgeniitzt, jedoch als Kohlenstoffquelle
verschiedene organische Stoffe verwertet werden;
Poly-P-Hydroxybuttersaure (PHB) — Polyester von |3-Hydroxybuttersaure.
Vorratsstoffe einer ganzen Reihe von Bakterien in Form grower Granula, die im
Phasenkontrast als lichtbrechende Partikel oder lichtmikroskopisch nach Far-
bung mit Sudanschwarz gut sichtbar sind. Siehe auch «Volutin*;
Profundal — Tiefenzone von Seen, in die nicht geniigend Licht eindringt;
deshalb konnen sich dort keine griinen Organismen entwickeln;
Prostheke — fester bis halbfester Auslaufer an der Zelloberflache. Auf den
Auslaufern bilden sich Tochterzellen, in der Regel durch Keimung. Manche
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Fachausdriicke • 7
Autoren bezeichnen mit diesem Terminus auch die Stiele von Caulobacter,
Hyphen bei Hyphomicrobium u. a., die Stengel von Gallionella und Nevskia
jedoch nicht;
Protoplasmazylinder — zylindrische Struktur bei Spirochaeten, die das Pro-
toplasma, den Kemapparat und die iibrigen intrazellularen Organellen ein-
schliefit; von einer dreischichtigen Membran umgeben;
Pseudoplasmodium - bei Myxobakterien vorkommende Struktur; aus
Schleim und Bakterienzellen bestehend; an Plasmodien von Myxomyceten
erinnemd;
Pseudostiel — fadige Struktur von Asticcacaulis, die sich vom Stiel dadurch
unterscheidet, dafi sie kein Gallertpolster besitzt;
Rapidosome — hohle, stabchenformige Ultrastrukturen von unklarer Bedeu-
tung; urspriinglich bei Saprospira beschrieben (Lewin 1963); wahrscheinlich
keine Viren, wie vermutet wurde. Graf (1965) nimmt an, dafi sie einen Bestand-
teil der Zellwand bilden (sich also nicht im Zellprotoplasma befinden); er halt sie
fur Fragmente der Fibrillenstruktur der Zellwand. Diese Fibrillen bilden eine
Art unendlichen Bandes, das sich schraubenformig in einer besonderen Rille auf
der Oberflache der Zellwand dreht, wodurch die Gleitbewegung der Zellen
bewirkt wird;
Respirativer Metabolismus (Respiration) — Oxydoreduktionsprozefi unter
Beteiligung von Sauerstoff (Aerobin), der Endakzeptor von Wasserstoff und
Elektronen ist und in der Regel zu Wasser reduziert wird. Ein besonderer Typ ist
die anaerobe Respiration, bei der nicht Sauerstoff, sondern ein anderer (anorga-
nischer oder organischer) Stoff als Endakzeptor von Elektronen dient. Nur bei
Bakterien vorkommend;
Rosette — Gebilde, in dem sich die Zellen (Zoosporen) wahrscheinlich chemo-
taktisch zu mehr oder weniger regelmafiigen Sternen gruppieren; Zellen sind mit
dem geifielfreien Pol nach der Mitte des Gebildes orientiert. Zellen durch
fadenartige Ultrastrukturen - Fimbrien - aneinander gebunden. Die Rosetten-
bildung ist wahrscheinlich eine gewisse Form des Fortpflanzungsprozesses, bei
dem es zum Austausch von Genen kommt;
Sarcine (Form) — wiirfelformiges oder prismatisches, aus 8 Kokken bestehen-
des Gebilde; entsteht durch Zellteilung in 3 senkrecht zueinander stehenden
Ebenen, wobei sich die Zellen nicht voneinander entfernen;
Scheide — hohle, extrazellulare, rohrenformige, Faden oder Zellketten ein-
schliefiende Struktur. Offen oder geschlossen. In der Regel ist zwischen der
Zellwand und der Scheide ein leerer Raum. Es handelt sich um einen von der
Zelle ausgeschiedenen Stoff, der gewohnlich von schleimiger oder gummiartiger
Konsistenz ist. Bei manchen fadigen Organismen ist die Scheide eisen- oder
manganimpragniert;
Schwarm — bei Myxobakterien vorkommendes Gebilde am Rand von Kolo-
nien, bei denen sich die Zellen gemeinsam iiber die Oberflache eines festen
feuchten Mediums in der Richtung von Zentrum der Kolonie weg fortbewegen;
auch bei manchen Bakterienarten vorkommend;
Sphaeroplast — kugelige Bakterienzellen nach teilweiser oder vollstandiger
Zerstorung der Peptidoglykanschicht der Zellwand; osmotisch sehr empfind-
lich;
Spiculum — gerader, zugespitzter, rigider Auslaufer des Zellendes bei
manchen in Sufiwassermollusken vorkommenden Cristispiren;
Sporangium — bei Bakterien die ganze Zelle oder deren Teil, in dem sich die
Endospore bildet. Bei Myxobakterien eine beutelartige, in einem zarten
Schleimlager oder -membran liegende Struktur, die Myxosporen enthalt;
Sporoid — alterer Ausdruck (Hutchinson und Clayton- 1919) fiir Mikrozyste
bei Myxobakterien; _
10 • Morphologie
kann die Wand namlich zersetzt werden, wobei ein Protoplast entsteht. Die
Zellwand gramnegativer Bakterien wird von zwei Membranen gebildet, zwi-
schen denen eine diinne, rigide Peptidoglykanschicht liegt. Die aufiere Schicht
enthalt Lipoproteine und Lipopolysacharide, wahrend die innere funktionell
eine zytoplasmatische Membran ist.
In unmittelbarem Kontakt mit der Umwelt steht bei den meisten Bakterien die
Oberflachenstruktur - die Kapsel. Sie hat vor allem eine Schutzfunktion; sie ist
stark hygroskopisch und verhindert das Austrocknen der Zelle. Auf Grund der
Ultrastruktur lassen sich drei Typen von Hiillen unterscheiden. Der einfachste
Typ ist eine Schleimhiille, die leicht von der Bakterienoberflache zu entfernen
ist. Sie wird von hochmolekularem amorphem Polymer gebildet. Der zweite
Typ der Kapsel besteht aus einem Polymer mit einer bestimmten Ultrastruktur.
Grampositive Bakterien bilden Kapseln von polysacharidem Typus, gramnega-
tive von polypeptidem. Die Kapsel ist gut farbbar, hat gewohnlich einen scharfen
begrenzten Rand und ist daher mikroskopisch deutlich sichtbar. Der dritte Typ,
die Mikrohullen, sind weder mit zytologischen Methoden noch elektronenmi-
kroskopisch wahrnehmbar. Ihre Existenz lafit sich nur immunologisch bewei-
sen. Sie sind von proteinartigem Charakter.
Bei einer Reihe von Arten der Wassermikroorganismen entwickeln sich an der
Zelloberflache mannigfaltige Auslaufer von verschiedener Bedeutung, deren
Funktion in der Mehrzahl der Falle bislang noch nicht genau bekannt ist. Von
mancheh diesen Strukturen wurde bis vor kurzem angenommen, dafi sie nur ein
anorganisches oder organisches Sekret der Zellen (z. B. Gallionella) sind. Zur
Zeit iiberwiegt jedoch die Ansicht, dafi auch sie ein lebender Bestandteil des
Organismus sind.
Bei zahlreichen Arteii sind die einzelnen Zellen zu charakteristischen Aggregaten
durch ultradiinne, nur elektronenmikroskopisch sichtbare, rigide Fasern (Fimb-
rien) verbunden.
Von diesen Strukturen miissen die Geifieln unterschieden werden, deren
Funktion vor allem in der Fortbewegung der Zellen besteht. Eine Bedingung fur die
Bewegung ist Wasser oder zumindest ein Wasserfilm auf fester Unterlage. Die
Geifieln sind hohle zylindrische Faden, meist mehrmals langer als die Zelle und
mit sehr kleinem Durchmesser. Der Faden besteht aus einigen, miteinander
verflochtenen Fibrillen, die von einer gemeinsamen Hullmembran eingeschlos-
sen sind. Die Geifieln sind meistens schraubenartig gekrummt; die Lange der
Windung ist fur die einzelnen Bakterienarten charakteristisch. Die Hauptsub-
stanz der Geifieln besteht aus Flagellin. Die Geifieln sind mit einem scheibenfor-
migen Gebilde - Kinetosom (Basalkorperchen) - in der Zytoplasmamembran
verankert. Die Geifieln sind bei zahlreichen Arten kein unentbehrlicher
Bestandteil der Zelle; meist kommen sie bei jungen Zellen vor, altere Zellen verlieren sie
leicht und werden dadurch unbeweglich. Zahl und Lage der Geiseln ist verschie-
den und meist spezifisch fur die betreffende Art. Selten konnen die Geifieln im
Phasenkontrast beobachtet werden. Meistens mufi man die Zellen vorher in
einem speziellen Verfahren farben. Die Struktur der Geifieln liegt unter dem
Auflosungsvermogen des Lichtmikroskops; sie kann nur
elektronenmikroskopisch untersucht werden.
Bei den Spirochaeten ubernehmen wahrscheinlich die Axialfaden oder ihre
besondere Form - das Axostyl - die Funktion der Geifieln.
Eine Reihe von Arten bildet Endosporen, hoch refraktile Korperchen im
Zellinneren. Sie sind ziemlich resistent gegen ungiinstige aufiere Faktoren;
extrem niedrige sowie hohe Temperaturen werden sehr gut vertragen. Unter
giinstigen Bedingungen keimen sie zu einer vegetativen Zelle aus. Es handelt sich
um gewisse Formen von Ruhestadien eines Organismus mit erheblich reduzier-
tem Metabolismus. Die Form der Sporen, ihre Lage in der Z^ft| sowie die Art
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Zytologie • 11
der Keimung bilden haufig ein spezifisches Merkmal fur eine bestimmte Art oder
Gruppe von Bakterien. Bei manchen von ihnen (z. B. Clostridium) kommt es
durch das Wachstum der Spore innerhalb der Zelle zu einer typischen
Deformation der Mutterzelle (Sporangium). Eine weniger verbreitete Form von
Ruhestadien sind Zysten; sie haben in der Regel ziemlich dicke Zellhiillen.
4.2. Zytologie
Auf der Oberflache des Protoplasten, unter der Zellwand, befindet sich die
zytoplasmatische Membran. Ihre Funktion besteht darin, dafi sie eine Barriere
zwischen dem Milieu innerhalb und aufierhalb der Zelle bilden. Die
zytoplasmatische Membran hat eine charakteristische Struktur; aus ihr entstehen durch
Invagination Gebilde mit verschiedenem Gliederungsgrad (Mesosome), die mit
der Membran in dauernder Verbindung bleiben. Sie sind besonders auffallig bei
grampositiven Bakterien, wo sie tubulare oder vesikulare Strukturen bilden.
Man schreibt ihnen eine Funktion bei der Bildung der Zellscheidewand, bei der
Zellteilung und der Bildung von Endosporen zu.
Bei photolithotrophen Bakterien liegen die Photoassimilationspigmente in
einem intrazytoplasmatischen Membransystem (in Thylakoiden), das ebenfalls
durch Invagination der zytoplasmatischen Membran entsteht. Es ist den Chloro-
plasten der hoheren Organismen funktionell aquivalent. Bei Purpurbakterien
iiberwiegt der tubulare oder vesikulare Typ dieser Struktur; nur bei manchen
Vertretem kommt ein lamellarer Typ vor. Bei griinen Schwefelbakterien
iiberwiegt der vesikulare Typ, der nicht mehr mit der zytoplasmatischen Membran
verbunden ist. Die Photoassimilationspigmente unterscheiden sich von den
Pigmenten der griinen Pflanzen und der Cyanophyceen. Bakteriochlorophyll a,
b, c, d und Karotinoide iiberwiegen unter ihnen. Niemals enthalten sie
Chlorophyll a und Pigmente aus der Gruppe der Phycobiliproteine.
Unter der Membran liegt das Zytoplasma, ein kompliziertes disperses System, in
dem die Mehrzahl der biochemiscnen Aktivitaten der Zelle ablauft. Im Gegen-
satz zum Zytoplasma der Eukaryonten zeigt es keine Bewegung (zyklische
Str6mung)..Im Zytoplasma liegen freie Ribosomen, die sich von den Ribosomen
der Eukaryonten unterscheiden.
Die Funktion des Zellkemes der Eukaryonten ersetzt das Chromatinmaterial -
Genophor (Ris 1961), das sich deutlich vom echten Zellkern unterscheidet. Es
handelt sich um ein kreisformiges Bakterienchromosom ohne Proteinkompo-
nente. Eine Kernmembran, die den echten Zellkern vom iibrigen Protoplasma
trennt, fehlt.
Das Zytoplasma enthalt ferner eine ganze Reihe verschiedener Einschliisse
(Inklusionen), meist Reservestoffe. Sie haben die Form von Granula; manchmal
bilden sie nur disperse Zonen, in denen die Reservestoffe in Form von unlosli-
chen Polymeren liegen: Poly-P-Hydroxybuttersaure, Glykogen oder ein starke-
ahnliches Polymer. Weiter konnen auch Granula von Poiyphosphaten, Volutin,
manchmal auch CaC03 oder Elementarschwefeltropfchen vorkommen. Der
Typus der Inklusionen ist fur eine bestimmte Art oder Gruppe der Bakterien
spezifisch. Das Zytoplasma phototropher Bakterien enthalt auch Gasvakuolen,
die das spezifische Gewicht des Organismus verringern und ihm dadurch
ermoglichen, frei im Wasser zu schweten.
8 ■ Fachausdrucke
Stengel — Auslaufer der Zellen der Gattungen Gallionella, Nevskia, Sidero-
phacus, der bis vor kurzem vorwiegend nur fiir ein unbelebtes Zellsekret gehalten
wurde; gegenwartig wird er von einigen Autoren als lebender Teil des Organis-
mus betrachtet. Aus feinen, nur elektronenmikroskopisch sichtbaren Faden
bestehend. Oft mit Eisenverbindungen inkrustiert. Unterscheidet sich wesent-
lich vom Stiel der Gattung Caulohacter;
Stiel — fadige, hohle Struktur, lichtmikroskopisch gut sichtbar, bei der
Gattung Caulohacter; eine rohrenformige Verlangerung der Zellwand, in deren
Mitte sich ein plasmatischer Faden befindet; ein lebender Bestandteil der Zelle.
An der Basis wird extrazellular ein adhasiver Stoff in Form eines Gallertpolster
sekretiert. Unterscheidet sich wesentlich vom Stengel bei Gallionella. Auch vom
Pseudostiel bei der Gattung Asticcacaulis zu unterscheiden;
Tafelchen — mehrzelliges, rechteckiges und einschichtiges Gebilde aus vielen
Zellen, meist Kokken; entsteht durch Zellteilung in zwei zueinander senkrech-
ten Ebenen, wobei sich die geteilten Zellen nicht voneinander entfernen. Kann
aus kleineren, regelmafiigen, rechteckigen Gebilden (Klonen) bestehen, z. B. bei
Lampropedia;
Thylakoides Membransystem — in sich selbst geschlossene doppelte Lamel-
len, aus denen das Lamellarsystem aller Chloroplasten besteht. Auch die nitrifi-
zierenden Bakterien haben ein thylakoides intrazytoplasmatisches
Membransystem;
Toroid, — Gestalt mancher Bakterienzellen, in Form eines Hufeisens oder
eines nicht geschlossenen Ringes;
Torus — hufeisenformige, stark eisenimpragnierte Struktur, die die Zelle der
Gattung Ochrobium wie ein Reifen umgibt;
Trichom — wird in der Mikrobiologie in der Regel fiir Faden aus Bakterien,
bei denen die Zellscheidewande nicht vollig entwickelt sind, oder fiir einzellige
fadige Organismen beniitzt. In der Literatur nicht eindeutig verwendeter Be-
griff;
Tubulares Membransystem — tubulare Auslaufer der zytoplasmatischen
Membran; entweder parallel angeordnet oder in unregelmafiigen, dreidimensio-
nalen, netzformigen Gebilden;
Verzweigung, unechte dichotome — entsteht entweder durch das Festsetzen
einer Gonidie (die spater keimt) am Mutterfaden oder durch Platzen der Scheide
bei interkalarer Zellteilung, wobei sich die Zellen aus der Scheide losen und
durch weitere Teilung einen neuen Faden bilden;
Vesikulares Membransystem — sackartige, nach der Zellmitte zu verbreiterte
Einstiilpungen der zytoplasmatischen Membran. Siehe auch «intrazytoplasmati-
sches Membransystem»;
Vibrionen — mafiig hornchenformig gekrummte, bewegliche, keine Sporen
bildende, aerobe sowie anaerobe, gramnegative Bakterien;
Volutin — Reservestoff der Mikroorganismen in Form stark lichtbrechender
Globuli im Protoplasma. Farbt sich mit basischen blauen Farbstoffen violett —
daher der altere Name «metachromatische Granula». Urspriinglich wurde
Volutin bei Spirillum volutans als «Volutanskugel» beschrieben; Meyer (1904) schlug
spater den Terminus Volutin vor. Widra (1959) hielt Volutin fiir anorganische,
mit RNKund aufieren Lipoproteinscheiden kombinierte Polyphosphate.
Martinez (1963) bestimmte chemisch durch fraktioniertes Zentrifugieren, dafi es sich
um Poly-|3-Hydroxybuttersaure ohne Phosphate handelt. Es wird deshalb
empfohlen, den Terminus Volutin nicht zu beniitzen;
Zoogloea-artig — unregelmafiige Gruppierung von Zellen, die in einer Schleim-
matrix liegen; durch ihre Struktur an die Gattung Zoogloea erinnernd.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Morphologie ■ 9
4. Charakteristische Eigenschaften der Bakterien
4.1. Morphologie
Einzellige prokaryontische Organismen mit charakteristischem Zellbau. In
Form einzelner, selbstandiger Zellen vorkommend, charakteristische Aggregate
oder mehr oder weniger lange Faden bildend. Die einzelnen Zellen sind der
Form nach nicht allzu mannigfaltig. Sie konnen kugelig, spindelformig oder
zylindrisch sein. Die zylindrischen, in seltenen Fallen auch die spindelformigen
Zellen sind entweder gerade, hornchenformig gebogen oder mehr oder weniger
stark schraubig gewunden. Vereinzelt kommen auch toroidformige (hufeisen-
oder ringartig gekrummte) Zellen vor.
Nach der Zellteilung - bei manchen Arten regelmafiig, bei anderen nur unter
bestimmten Bedingungen - entfernen sich die Tochterzellen nicht voneinander,
sondern bleiben extrazelullar verschiedenartig zu mehr oder weniger charakteri-
stischen Gebilden verbunden. Je nach dem, in wievielen zueinander senkrecht
stehenden Ebenen sich die Zellen teilen, entstehen Gebilde in Form von Paaren,
Ketten, Tetraden, Paketen, Tafelchen, Trauben bis unregelmafiigen Anhaufun-
gen. Bei einer Reihe von Arten entstehen so charakteristische Gebilde, dafi sie als
systematisches Merkmal dienen konnen. Bei manchen Organismen, die diese
Aggregate bilden (z. B. Lampropedia hyalina) kommt eine sog. Kittschicht vor,
die die eigene Zellwand iiberdeckt; sie ist kein Bestandteil der Zelloberflache,
sondern mit der Zelle nur durch Adhasionskrafte verbunden. Bei (meist grampo-
sitiven) Organismen, die keine Kittschicht bilden, kommt es deshalb zur Bildung
von Aggregaten, weil die Zellen nicht ganz getrennt werden.
Eine Reihe von Mirkoorganismen, die fiir das Wasser typisch sind, bilden
mehrzellige, mehr oder weniger lange, gerade, gekrummte, sowie unregelmafiig
oder wellenformig gebogene oder schraubige Faden-Individuen. Manchmal
konnen bei ihnen auch die Zellscheidewande verschwinden, so dafi Riesenzellen
entstehen. Die Faden sind oft polar differenziert. Die seitliche Begrenzung der
Faden ist entweder parallel, oder gegen das Basal- oder Apikalende verjiingt;
manchmal sind die Faden an den Zellscheidewanden eingeschniirt. Am Basalteil
bildet sich bei aufsitzenden Formen oft ein Gallertpolster aus extrazellularem,
stark adhasivem Material, mit dem die Faden an der Oberflache fester Substrate
befestigt sind. Eine Reihe von Arten hat verzweigte Faden; es handelt sich
entweder um eine echte oder eine falsche dichotome Verzweigung.
Fadige Organismen werden oft von einer Scheide von verschiedener Zusammen-
setzung umgeben, die in manchen Fallen mit Eisen- oder Manganverbindungen
impragniert sein kann. Manche Arten, die pilzhyphenahnliche fadige Auslaufer
bilden, konnen auch myzelahnliche Strukturen bilden.
Die aufiere Form der Zellen wird bei den meisten Arten durch eine feste
Zellwand bestimmt, die jedoch nicht als inerte Struktur mit nur mechanischer
Funktion betrachtet werden kann. Ihre hauptsachliche Bedeutung liegt in der
Kompensierung des inneren osmotischen Drucks der Zelle, mit dem die normale
Funktion der zytoplasmatischen Ultrastrukturen zusammenhangt. Nur
Organismen, die dauernd in einer hypertonischen Umwelt vorkommen (z. B. Halo-
bacterium), besitzen uberhaupt keine Zellwand. Ihre Funktion ubernimmt die
zytoplasmatische Membran. Die wichtigste Komponente der Zellwand ist ein
Peptidoglykan, dessen Struktur der Zellwand einen rigiden Charakter verleiht.
Grundsatzlich lassen sich nach der Lagerung des Mukopeptides zwei Typen von
Zellwanden unterscheiden. Bei grampositiven Bakterien besteht die Wand aus
einer verhaltnismafiig dicken Lage von Peptidoglykan, mit der die
zytoplasmatische Membran in enger Verbindung ist. Durcn die Einwirkung von Lysosym
12 • Physiologische Eigenschaften - Fortpflanzung
4.3. Physiologische Eigenschaften
Die Ernahrungsweise der Bakterien ist wesentlich vielfaltiger als die der hoheren
Organismen. Dies ist eine Folge ihrer erheblichen Anpassungsfahigkeit an die
Umwelt. Im Verhaltnis zum Sauerstoff- als Endakzeptor von Elektronen - sind
die Bakterien aerob, mikroaerophil, fakultativ anaerob sowie anaerob. Der
Metabolismus ist fermentativ oder respirativ; zur Respiration kommt es nicht
nur bei Anwesenheit von Sauerstoff, sondern sie kann auch anaerob sein, wobei
Sauerstoff z. B. durch Nitrat ersetzt werden kann. Eine Reihe von phototrophen
Bakterien ist fahig, die Energie der elektromagnetischen Lichtstrahlung zur
Photosynthese auszuniitzen. Bei photolithotrophen Organismen dienen dabei
nicht Wassermolekiile als Donor von Elektronen (wie bei griinen Organismen),
sondern es wird Schwefelwasserstoff verwendet, der bis zum elementaren
Schwefel oxydiert und intra- oder extrazellular als Reservestoff gespeichert wird.
Photoorganotrophe Bakterien benotigen hingegen als Donor von Elektronen
einfache organische Verbindungen, die als Kohlenstoffquelle dienen konnen.
Chemotrophe Bakterien gewinnen Energie durch Oxydation anorganischer
oder organischer Verbindungen; chemoorganotrophe Bakterien verwerten als
Kohlenstoffquelle sowie auch als Donor von Elektronen eine reichhaltige Skala
verschiedener Verbindungen, wobei als Endakzeptoren von Elektronen bei
aeroben Arten molekularer Sauerstoff, bei anaeroben eines der Intermediarpro-
dukte des Metabolismus auftreten. Chemolithotrophe Bakterien gewinnen
Energie durch Oxydation anorganischer Verbindungen durch molekularen
Sauerstoff; sie fixieren C02 als Kohlenstoffquelle.
Aufierdem existieren mixotrophe Arten, die gleichzeitig verschiedene Kombina-
tionen organischer sowie anorganischer Verbindungen als Kohlenstoff- und
Energiequelle verwerten konnen, sowie ambitrophe Organismen, die entweder
den einen oder den anderen Typ des Substrates verwerten.
Die minimalen Ernahrungsanforderungen sind sehr verschieden und bilden
meistens ein spezifisches Merkmal der Art und der ganzen Gruppe von
Organismen. Auxotrophe Bakterien konnen auf reinen Mineralnahrboden wachsen, die
nur mit einigen spezifischen Stoffen angereichert sind, die die Bakterien nicht zu
synthetisieren vermogen. Parasitische oder pathogene, meist hochspezialisierte
Organismen brauchen dagegen zum Wachstum gewohnlich spezifische
organische Kohlen- und Stickstoffverbindungen, die in einigen Fallen nur schwierig
durch andere Substanzen ersetzt werden konnen.
4.4. Fortpflanzung
Sie ist in der Regel spezifisch fur eine bestimmte Bakteriengruppe. Die haufigste
Fortpflanzungsweise ist die Querteilung, wobei es zu einer zentripetalen Syn-
these der zytoplasmatischen Membran und der Zellwand (Scheidewand) zwi-
schen zwei kiinftigen Tochterzellen kommt. Es scheint, dafi bei dieser Erschei-
nung die zytoplasmatische Membran eine primare Funktion erfullt und diesen
Prozefi durch Invagination in Form eines sich schliefknden Diaphragmas in
Richtung zur Zellmitte beginnt. Die Produkte dieser Teilung sind praktisch
aquivalent. Gelegentlich kommt asymmetrische Teilung vor; manche Autoren
halten auch die Knospung fur eine spezifische Form solcher asymmetrischer
Teilungen.
Bei fadigen Organismen hangt meistens das Wachstum des Fadens mit der
Querteilung zusammen. Die eigentliche Teilung geht mittels spezifischer Repro-
duktionseinheiten vor sich: durch Fadenfragmente, Hormogonien, Gonidien-
oder Konidienbildung, die ebenfalls durch Zellteilung, meist im Apikalteil des
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
"^ Bewegung - Grofie - Verbreitung - Systematik • 13
Fadens, entstehen. Mit der Fortpflanzung der Bakterien hangt wahrscheinlich
auch die Entstehung sternartiger Gebilde (Rosetten) zusammen. Manche
Autoren sind der Ansicht, dafi es bei diesem Akt zur Ubertragung von Genen kommt,
jedoch nie zu einer Gametogenesis und Bildung von Zygoten.
4.5. Bewegung
Die aktive Bewegung der Bakterien im Wasser oder in einer feuchten Umwelt
wird durch Geifieln bewirkt, die meist nur bei jungen Zellen vorhanden sind;
altere Zellen sind gewohnlich unbeweglich. Bei den Spirochaeten wird die
Bewegungsfunktion den Axialfaden zugeschrieben. Eine ganze Gruppe von
Organismen (gleitende Bakterien) ist durch eine spezifisch gleitende, manchmal
mehr oder weniger ruckartige bis zuckende Bewegungsweise charakterisiert, die
nur beim Kontakt des Organismus mit der Oberflache einer festen Unterlage
oder mit der Oberflachenhaut des Wassers auftritt.
Bei einer Reihe von Arten sind nur die reproduktiven Zellen beweglich. Eine
grofie Anzahl von Organismen ist jedoch in alien Entwicklungsstadien vollig
unbeweglich.
4.6. Grofie der Bakterien
Die Ausmafie der Zellen sind sehr variabel. Sie bewegen sich im Bereich
zwischen 0,2 und 10,0 urn; bekannt sind jedoch auch organische Strukturen, die
im Lichtmikroskop nicht zu unterscheiden sind, sowie «Riesenzellen», die
mehrere Dutzende |im messen.
4.7. Verbreitung
Vorkommen und okologische Verbreitung hangen mit der grofien
Anpassungsfahigkeit der Bakterien zusammen. Es kann festgestellt werden, dafi sich die
Bakterien fast jedem Milieu angepafk haben. Im Wasser haben sie eine
spezifische Bedeutung, besonders im Kreislauf biogener Elemente.
4.8. Systematische Einordnung der Bakterien
Diese ist bislang noch nicht vollig geklart. Ursprunglich wurden sie zusammen
mit den Protozoen, Algen und niederen Pilzen auf Grund eines einzigen
speziellen Merkmales - der mikroskopischen Ausmafie - in die Gruppe der
Mikroorganismen gestellt. Spater ordnet man sie den Protista zu, einer den
Tieren und Pflanzen gleichwertigen Gruppe. Umfangreiche zytologische und
biochemische Untersuchungen, die Informationen liber die physiologische
Funktion der einzelnen Zellstrukturen ergaben, sowie elektronenmikroskopi-
sche Untersuchungen machten es moglich, die Protista in Eukaryonta und
Prokaryonta zu differenzieren. Einer der wesentlichen Unterschiede zwischen
diesen beiden Typen ist die Struktur und Organisation des Kernapparates.
Fur die Prokaryonta (Procaryotae), zu denen Cyanophyceen und Bakterien
ezahlt werden, sind vor allem folgende Merkmaie charakteristisch: ihre Nu-
leinsauremoleklile sind nicht in einem echten, mit einer Kernmembran umgebe-
nen Kern angeordnet; die Funktion der Chloroplasten ersetzen Thylakoide, die
kein Chlorophyll enthalten, welches das typische Assimilationspigment griiner
14 • Systematik
Organismen (Pflanzen) ist; die Funktion derMitochondrien erfullen die Auslau-
fer der zytoplasmatischen Membran, die Mesosome. Es kommt auch zu keiner
typisch zyklischen Bewegung des Zytoplasmas.
Stanier et al. (1971) una einige weitere Autoren gliedern auf Grund neuer
wissenschaftlicher Erkenntnisse (besonders der Ultrastruktur) die Gruppe der
Bakterien in zwei Abteilungen des Reiches Procaryotae: Die erste Abteilung
umfafk grune Bakterien, phototrophe Purpurbakterien sowie Blaualgen, wah-
rend nicht phototrophe Bakterien in die zweite Abteilung gestellt werden. Nach
dieser Ansicht werden also die Blaualgen als eine Gruppe phototropher
Bakterien betrachtet und sind in diesem Sinne in Cyanobacteria umbenannt worden.
Diese neue Einteilung des Reiches Procaryotae wurde auch in die letzte Ausgabe
von Bergey's Manual (1974) ubernommen, obwohl es noch immer Meinungs-
verschiedenheiten in dieser Hinsicht gibt und eine Reihe von Autoren sie kritisch
bewertet.
Im Jahre 1978 haben Stanier et. al. (1978) und Stanier in Gibbons und Murray
(1978a) die Einteilung des Reiches Procaryotae nach folgendem Schema prazi-
siert:
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Systematik • 15
C
3
C
-Si
« CO
o a
C rt
**
!T IV
-SJ IV
o
~s c
■5* -e?
S «
a, J
ftj £X
pirilla:
et Trii
71
-S <*>-
^S -3
o c
ii 3
IS
-2 £2
-£ O
■* -3:
C
3
<
^ -J
*Soo
5 c
Si
O
>v
n
>-•
"> 3
*s
£ OS
c c
m °
o
«_,
"O
c
3
icutes
t Fre
67
^ fljflv
O -O ^
M
war
^^
3 £
S 3
°-s
II. Spezieller Teil: Schizomycetes
Teil I. Phototrophe Bakterien
Phylogenetisch wahrscheinlich eng verwandte Mikroorganismengruppe; ihr
gemeinsames Hauptmerkmal ist der photosynthetische Metabolismus, der unter
anaeroben Bedingungen verlauft, wobei reduzierte Schwefelverbindungen
(iiberwiegend Schwefelwasserstoff) zu elementarem Schwefel oder bis zu Sulfa-
ten oxydiert werden. Die Gruppe ist identisch mit der Ordnung Rhodospiril-
lales.
1. Ordnung Rhodospirillales Pfenning
et Triiper 1971
Zellen kugelformig, kurz (manchmal auch lang) stabchen-, hornchen-, bohnen-
oder schraubenformig. Bei einigen Arten kommen spezielle Organellen (sog.
Prostheken) vor. Gleichfalls werden gerade oder schraubig gekrummte Faden
gebildet, die in eine Schleimscheide eingeschlossen sind. Einzelne Zellen meist
farblos, Farbung nur bei grofieren Mengen von Zellen oder in Suspensionen.
Farbe der Zellen oft von den Bedingungen der aufieren Umwelt abhangig
-violett, purpurviolett, purpur, rosarot, orangebraun, braun oder grun. Bei alien
Arten photoassimilierende Pigmente, wie Bakteriochlorophylle und Karotinoi-
de. Pigmente entweder an das innere Membransystem gebunden, das mit der
zytoplasmatischen Membran zusammenhangt, oder in Vesikeln befindlich, die
an der zytoplasmatischen Membrane haften. Letzteres ist fiir die Gattung
Chlorobium charakteristisch. Alle Vertreter dieser Ordnung sind gramnegativ.
Eine Reihe von Arten bildet Schleimkapseln.
Bakterien mit photosynthetischem Metabolismus, der sich vom Metabolismus
der griinen Pflanzen und der Cyanophyceae dadurch unterscheidet, dafi er
grundsatzlich unter anaeroben Bedingungen verlauft, wobei kein molekularer
Sauerstoff gebildet wird. Von der Anwesenheit oxydierbarer Elektronendonato-
ren aufierhalb der Zellen abhangig, wie z. B. reduzierter Schwefelverbindungen,
molekularen Wasserstoffs oder einfacher organischer Verbindungen, insbeson-
dere organischer Sauren. Schwefelwasserstoff oder Sulfide werden bis zu
elementarem Schwefel oxydiert, der von den meisten Arten als Reservestoff
innerhalb, seltener aufierhalb der Zellen in Form von Schwefeltropfen gespei-
chert wird. Kohlendioxid meistens photosynthetisch durch reduktiven Pentoso-
phosphatzyklus oder ahnliche Zyklen assimiliert. Alle Arten wachsen streng
anaerob, jedoch nur unter der Bedingung, dafi genugend Licht zur Verfugung
steht. Metabolismus daher photolithotroph oder photoorganotroph. Manche
Arten konnen im Dunkeln wachsen, erfordern dann jedoch aerobe
Bedingungen. Einige Arten konnen auch atmospharischen Stickstoff fixieren.
Vermehrung bei den meisten Arten durch Teilung. Nur manche Arten vermeh-
ren sich durch Knospung an den Zellpolen, andere durch Knospung oder
Fragmentierung der Faden. Einige Arten sind mittels einer oder mehrerer
Geileln beweglich. Eine Familie bewegt sich gleitend wie farblose organotrophe
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodosspirillineae - Rhodospirillaceae • 17
Flexibakterien. Ausmafie der Zellen recht unterschiedlich, zwischen 0,3 |Xm und
10 |Xm; manchmal auch grofier.
Die Rhodospirillales kommen iiberall in Gewassern, Sumpfen und Schlammen
vor, wo faulende Pflanzen- und Tierreste, Schwefelwasserstoff und Licht vor-
handen sind. Manche Arten vertragen auch hohe Salzkonzentrationen.
Diese Ordnung umfafit alle photosynthetischen Bakterien und ersetzt die friihe-
re Unterordnung Rhodobacteriineae, Breed et. al. 1944. Die Ordnune wird in
zwei Unterordnungen geteilt, die sich hauptsachlich durch den verschiedenen
Pigmentgehalt voneinander unterscheiden.
Bestimmungsschliissel der Unterordnungen
la Purpurfarbene Bakterien, deren Photosynthese durch das Vorhandensein
von Bakteriochlorophyll a oder ibedingt wird
1. Rhodospirillineae(S. 17)
lb Grune Schwefelbakterien, deren Photosynthese durch das Vorhandensein
von Bakteriochlorophyll c und d, den Hauptfaktoren des Bakteriochloro-
phylls, oder ebedingt wird 2. Chlorobineae (S. 92)
1. Unterordnung Rhodospirillineae Pfennig
et Triiper 1971
Purpurfarbene Zellen mit photolithotrophem oder photooreanotrophem
Metabolismus. Photoassimilierende Pigmente Bakteriochlorophyll a oder b und
mehrere Karotinoide in einem verschieden gestalteten Membransystem, das mit
der zytoplasmatischen Membran verbunden ist, gelagert.
Zellen in einem Milieu mit Sulfiden, Schwefelwasserstoff oder Thiosulfat als
Elektronendonatoren ohne das Vorhandensein von organischen Verbindungen
nicht wachstumsfahig; sie speichern auch keinen elementaren Schwefel als
intermediate Verbindung innerhalb der Zellen und sind nicht imstande,
elementaren Schwefel als Elektronendonator zu verwerten. Sie konnen auch in einem
Milieu mit Schwefelwasserstoff wachsen, speichern dann elementaren Schwefel
als Reservestoff in Form kleiner oder grofierer Tropfchen, der weiter bis zu
Sulfaten oxydiert werden kann. Eine Art scheidet Schwefel aufierhalb der Zelle
aus.
Bestimmungsschliissel der Familien
la Zellen einfache organische Verbindungen verwertend; mit Sulfiden als einzi-
gem Elektronendonator nicht wachstumsfahig. Elementarer Schwefel wird
weder in den Zellen gespeichert noch von diesenausgeschieden
1. Rhodospirillaceae (S. 17)
lb Zellen mit Sulfiden und Schwefel als einzigen photosynthetischen
Elektronendonatoren wachstumsfahig. In Anwesenheit von H2S speichern sie
elementaren Schwefel in Form von Tropfchen oder scheiden inn aus, wobei er
weiter bis zu Sulfaten oxydationsfahig ist 2. Chromatiaceae (S. 38)
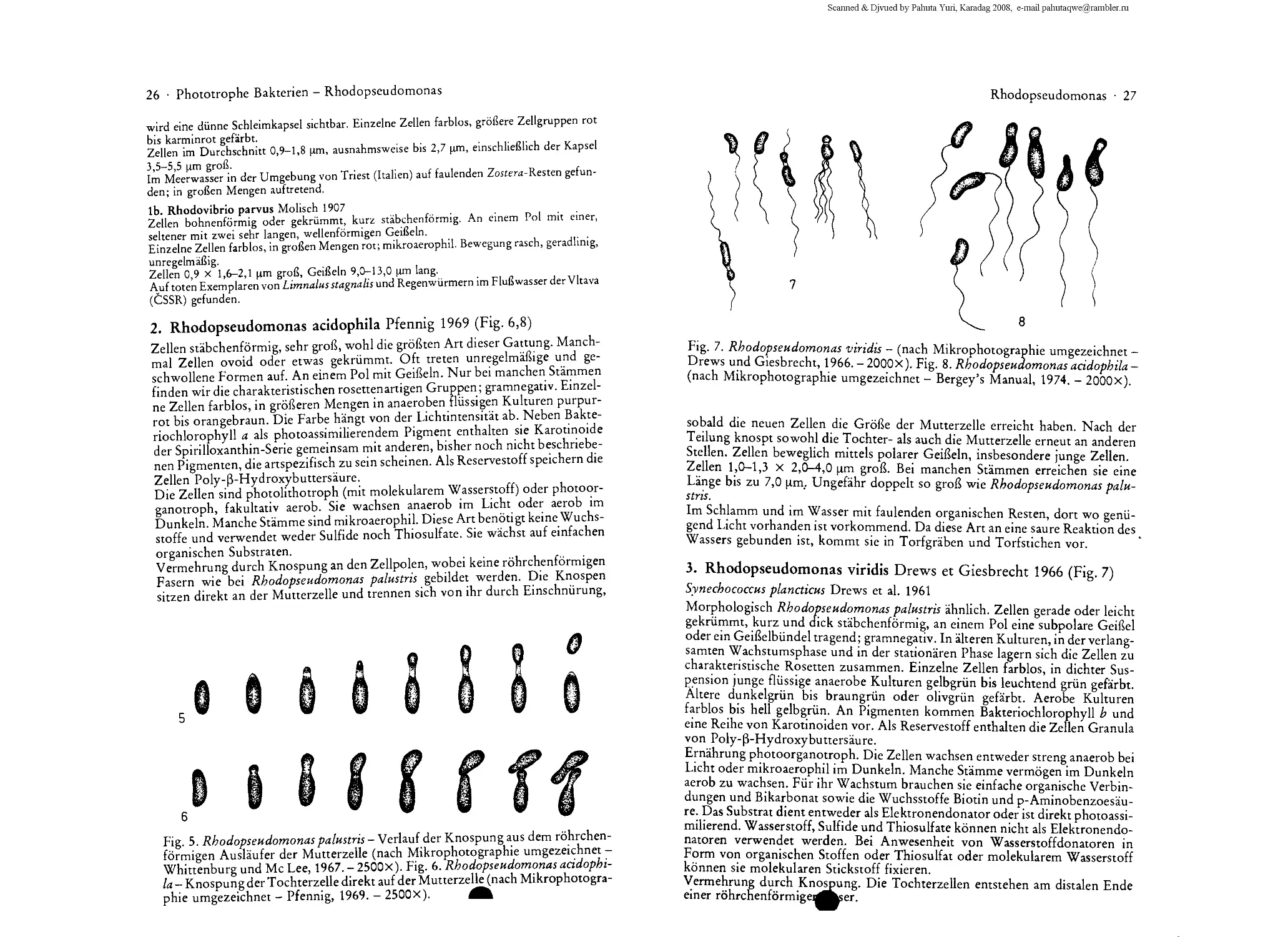
1. Familie Rhodospirillaceae Pfennig et Triiper 1971
Zellen kugelig oder in Form kurzer oder langer Stabchen, auch vibrio- bis
hornchenformig oder schraubig gewunden, verhaltnismafiig klein. Eine Gattung
bildet Zellen in Form des Buchstabens «C» bis zur Form von Ringen. Meistens
18 ■ Phototrophe Bakterien - Rhodospirillaceae
als einzelne Zellen. Bei einer Gattung werden Zellhaufen gebildet, die mittels
feinen Faden verbunden sind, bei einer anderen maulbeerartige Kolonien. Ohne
Gasvakuolen. Zellen zweier Gattungen besitzen polare und die einer Gattung
peritriche Geifieln. Durch rasch eintretende Senkung der Lichtintensitat werden
die Zellen phototaktisch.
Einzelne Zellen gewohnlich farblos, charakteristische Farbung normalerweise
erst bei grofieren Mengen von Einzelzellen deutlich. Als photoassimilierende
Pigmente kommen Bakteriochlorophylle a und b und Karotinoide der Gruppe 1,
2, 4 und einige andere vor. Stamme mit Karotinoidgruppe 1 orangebraun bis
braunlich rot oder rosa bis purpurrot, wahrend Stamme mit Karotinoidgruppe 2
unter anaeroben Bedingungen schmutzig griingelb und unter aeroben Bedin gun-
gen braunlich rot bis purpur gefarbt sind. In den Zellen kommen noch Granula
von Poly-(3-Hydroxybuttersaure, Polysaccharide und Polyphosphate vor.
Zellen ohne Schwefeltropfchen; gramnegativ. Photosynthese bei Licht und in
Anwesenheit spezieller Wasserstoffdonatoren im Medium unter streng
anaeroben Bedingungen. Wachstum im Dunkeln unter anaeroben Bedingungen sehr
schwach. Wachstum im Dunkeln erfordert unbedingt ein aerobes Milieu, an das
sich manche Stamme sehr leicht anpassen lassen. Eine Reihe von Stammen kann
bei Licht mikroaerophil oder auch aerophil wachsen, doch kommt es dann zu
einer bedeutenden Senkung des Pigmentgehaltes.
Die phototrophe Entwicklung hangt von den organischen Verbindungen ab, die
entweder photoassimiliert werden oder als Elektronendonatoren dienen. Es
handelt sich meist um einfache organische Verbindungen (Alkohole, Fettsauren,
Hydroxy- und Ketos'auren) und um Wasserstoff. Bei einigen Arten, wie Quayle
und Pfennig (1975) anfuhren, kann es bei Licht unter anaeroben Bedingungen
auch Methanol sein. In Anwesenheit von Sulfiden und Thiosulfaten als
Elektronendonatoren wird kein elementarer Schwefel als Zwischenprodukt erzeugt
oder nur in beschranktem Mafie. Dieser wird weder zu Sulfaten oxydiert oder als
Elektronendonator verwertet. Bis vor kurzem hat man angenommen, dafi
Schwefelwasserstoff nicht als photosynthetischer Elektronendonator dienen
kann. Hansen und van Gemerden (1972) haben jedoch bewiesen, dafi sie auch auf
anorganischem Medium mit Wachstumsfaktoren und Sulfiden als
Elektronendonatoren wachsen konnen, wobei die Zellen die Sulfide zu extrazellularem,
elementarem Schwefel oder Sulfaten oxydieren. Die Mehrzahl der Stamme
benotigt Wachstumsfaktoren, insbesondere Biotin, p-Aminobenzoesaure,
Thiamin, Nikotinsaure. Bei Licht wird atmospharischer Stickstoff fixiert. Kohl-
miller und Gest (1951), Siegel (1957), Schon (1968, 1969) fuhren an, dafi sie bei
Luftabwesenheit sogar einige Kohlenhydrate vergaren konnen. Vermehrung
durch Teilung oder Knospung.
Durch Geifieln aktiv beweglich. Die Rhodospirillaceae kommen iiberall dort
vor, wo es zu einer intensiven Zersetzung organischer Stoffe kommt. Meistens
treten sie gleichzeitig mit purpurfarbenen Schwefelbakterien auf, sowohl in
stehenden Sufi - oder Salzwassem als auch im Schlamm. Besonders haufig in
Wasserbecken, in die Abwasser einstromen, wo sie dann manchmal an diesen
Stellen eine blutigrote Farbung des Wassers verursachen. In manchen Siifiwas-
serseen bilden sie in einer bestimmten Tiefe, wo es noch genugend Licht gibt und
die Sauerstoffkonzentration niedrig ist, rosafarbene Wasserschichten. Sie wur-
den auch in Meerwasser und in salzigen Gewassern mit einem NaCl-Gehalt von
30% gefunden. In kleineren Mengen auch in Erdboden, insbesondere dort, wo
es von Zeit zu Zeit zu Uberschwemmungen kommt.
Urspriinglich wurde diese Familie, da die Zellen keine Schwefeltropfchen spei-
chern, zur Familie Athiorhodaceae Molisch 1907 gestellt.
Typus familiae: Rhodospirillum Molisch 1907.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodospirillum • 19
Bestimmungsschliissel der Gattungen
la Zellen immereinzeln, keine Aggregate oder Kolonien bildend 2
lb Zellen Kolonien oder Aggregate bildend, mittels feiner Faden miteinander
verbunden 4
2a Zellen gerade, nie schraubig gewunden, sondern kugelig, ellipsoidisch bis
stabchenformigmitabgerundetenEnden . . . 2.Rhodopseudomonas(S.23)
2b Zellen leicht getaummt bis ringformig oder schraubig gewunden 3
3a Schraubig gewundene Zellen, bilden keine Ringe
1. Rhodospirillum (S. 19)
3b Zellen oft hufartig oder ringformig 3. Rhodocyclus (S. 34)
4a Zellen ovoid oder langgestreckt ellipsoidisch, Aggregate bildend, in denen
sie mittels feiner Faden verbunden sind 4. Rhodomicrobium (S. 35)
4b Zellen stabchenformig, maulbeerartige Kolonien bildend
5. Vannielia (S. 37)
1. Rhodospirillum Molisch 1907, emend, van Niel 1944
Phaeospirillum Kluyver et van Niel 1936
Zellen uberwiegend schraubenformig, mit einer (manchmal auch nicht vollstan-
digen) bis mehreren Windungen. Morphologie direkt von den Wachstums- oder
Kulturbedingungen abhangig, wobei morpnologische Anderungen hauptsach-
lich durch das Vorhandensein organischer Stoffe, ihrer Konzentration und den
pH-Wert des Nahrbodens hervorgerufen werden. Zellen lebhaft beweglich, mit
mehreren polaren Geifieln; ohne Gasvakuolen; gramnegativ; Vermehrung durch
Teilung. Einzelne Zellen farblos, grofiere Mengen in verschiedenen Schattierun-
gen rot bis braun gefarbt.
Als Pigmente kommen Bakteriochlorophyll a und Karotinoide der Gruppe 1
vor, die im inneren Membransystem lokalisiert sind. Zellen anaerob phototroph;
meistens verlauft auch im Dunkeln ein Oxydationsmetabolismus unter mikro-
aerophilen bis aeroben Bedingungen. Bei Vorhandensein einfacher organischer
Verbindungen kommt es zur Photosynthese, wobei diese Verbindungen direkt
als Energiequelle fiir die Reduktion des Kohlendioxids verwendet werden.
Manche Stamme sind zum Teil auch imstande, geloste Kohlenwasserstoffe bei
Anwesenheit von Sauerstoff im Dunkeln zu verwerten. Wahrend der
Photosynthese wird kein molekularer Sauerstoff gebildet. Molekularer Wasserstoff kann
als Elektronendonator verwertet werden. Die Mehrzahl der Arten ist nicht f ahig,
in rein anorganischen Medien ausschliefilich autotroph zu wachsen. Wuchsstoffe
sind zusatzlich notig. Manche Arten vertragen einen hohen Salzgehalt (bis zu
30%).
Die Zellgrofie hangt direkt von der Anwesenheit gewisser spezifischer
organischer Stoffe ab. Am haufigsten sind Grofien von 0,3-1,5 X 2,5 - 60,0 |xm.
Die Arten kommen meist in stehendem Sufi- und Salzwasser und im Schlamm
vor, wo sich Pflanzen- und Tierreste in Faulnis befinden und wo genugend Licht
vorhanden ist.
Vertreter dieser Gattung wurden jedoch auch in schwefelhaltigen Grubenwas-
sern in einem Erdolgebiet gefunden.
Typus generis: Rhodospirillum ru.bru.rn (von Esmarch 1887) Molisch 1907.
Wichtigste Literatur: Molisch 1907, Hama 1933, van Niel 1944, Giesberger
1947, Bergey 's Manual 1948, 1957, 1974, Krasil'nikov 1949, Kondrat'eva 1963,
Pfennig 1969.
20 • Phototrophe Bakterien - Rhodospirillum
Bestimmungsschliissel der Arten
la Zellen dunkelrot bis purpurrot, ohne braune Schattierungen; fakultativ
aerob bis mikroaerob 1. Rh. rubrum
lb Zellen orange, rotbraun oder purpurviolett 2
2a Zellen fakultativ aerob, 0,3-0,5 \im breit. Zellkulturen rotbraun oder
purpurviolett gefarbt 2. Rh. tenue
2b Zellen wachsennichtunteraerobenBedingungen 3
3a Zellen h6chstens0,7(im breit 3. Rh. fulvum
3b Zellen uber 0,7(im breit 4
4a Zellen bis zu 1,0 \im breit und 5-10 \im lang 4. Rh. molischianum
4b Zellen 1,2-1,5 \im breit und bis zu 30 (imlang .... 5. Rh. photometricum
1. Rhodospirillum rubrum (von Esmarch 1887) Molisch 1907 (Fig. 1)
Spirillum rubrum von Esmarch 1887, Rhodospirillum giganteum Molisch 1907,
Dicrospirillum rubrum (von Esmarch 1887) Enderlein 1925, Rhodospirillum
longum Hama 1933, Rhodospirillum gracile Hama 1933
Zellen charakteristisch vibrioformig bis schraubig gewunden, mit einer, oft
jedoch auch mit mehreren Windungen. Zellenden abgerundet, GeiRelbundel
tragend. Form und Lange der Zellen sehr verschieden und von aufieren Bedin-
gungen abhangend; ohne Schleimbildung. Grofienanderungen werden vor allem
durch das Vorhandensein mancher D-Aminosauren hervorgerufen.
Unterschiede konnen auch in ein und derselben Kultur auftreten. Ebenso
schwankt die Grofie der einzelnen Windungen der Spirale. Vermehrung durch
Teilung. In alten Kulturen treten entweder Involutionsformen, die unregelma-
fiig eingeschrankt sind, oder verdickte Zellen auf. Solche Zellen sind fleckig und
enthalten Fettinklusionen. Manchmal sind die Zellen verzweigt. Zellen sind
phototaktisch, besonders beweglich sind junge Zellen. Als Reservestoffe kom-
men bei Licht und bei einem Uberschufi an kohlenstoffhaltigen Stoffen (insbe-
sondere Azetat) Butyrat, unter aeroben Bedingungen Granula der Poly-(3-
Hydroxybuttersaure, weiter Polysaccharide und Polyphosphate vor. Anaerobe
fliissige Kulturen sind zuerst hellrosa, spater dunkel purpurrot, wogegen aerobe
Kulturen farblos oder hellrosa sind. Die Pigmentproduktion wird durch Sauer-
stoff und Licht beeinflufk, wobei die Farbung durch Karotinoide, unter denen
Spirilloxanthin vorherscht, hervorgerufen wird. Aufterdem sind Lykopen und
Anhydrorhodovibrin vorhanden. Wasserlosliche Pigmente werden nicht er-
zeugt. Die Kulturen haben einen merklich unangenehmen Geruch, der an
Hefezersetzung erinnert.
Die vorherrschende Ernahrungsart ist photoorganotroph, sie kann jedoch auch
vollig photoautotroph sein. Senr starke Beleuchtung hemmt das Wachstum. Im
Dunkeln, unter anaeroben Verhaltnissen, kann sogar Fermentation stattfinden.
Die Art ist anaerob, im Dunkeln fakultativ aerob oder mikroaerophil. Die
meisten Stamme sind nicht imstande, unter aeroben Bedingungen zu wachsen.
Unter bestimmten Voraussetzungen vermogen die Zellen Wasserstoff auszu-
scheiden, insbesondere bei Anwesenheit organischer Sauren des Krebs-Zyklus.
Atmospharischer Stickstoff wird fixiert. In einem Milieu mit Schwefelwasser-
stoff konnen sie Sulfide zu extrazellularem Schwefel oxydieren, vertragen jedoch
nur eine wesentlich gering Konzentration als purpurne Schwefelbakterien.
Zellen 0,8-1,5 X 2-50 (im, manchmal auch 100 \im grofi; Schraubenwindungen
1,0-4,0 [im breit und 1,0-7,0 \im lang.
Urspriinglich wurde die Art aus dem Korper einer in einem Regenwasserbehalter
ertrunkenen Maus isoliert. Eine recht verbreitete Art, die insbesondere in
stehenden, faulenden Gewassern und im Schlamm auftritt.
Da die Abgrenzung der Art auf Grund der Ausmafie der Zellen bei einem so variablen
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodospirillum 21
Fig.l. Rhodospirillum rubrum - (nach Mikrophotographie umgezeichnet -
Clifton, 1958. - 1000X). Fig. 2. Rhodospirillum tenue - (nach
Mikrophotographie umgezeichnet - Pfennig, 1969. - 2000X). Fig. 3. Rhodospirillum fulvum -
(nach Mikrophotographie umgezeichnet - Pfennig, 1969. - 2000X). Fig. 4.
Rhodospirillum molischianum - (nach Mikrophotographie umgezeichnet -
Pfennig et al., 1965. - 1000X). Geifieln bei den abgebildeten Arten ohne spezielle
Farbung nicht oder kaum sichtbar.
Organismus unzureichend ist, reihte van Niel (1944) hier weitere, friiher als selbstandig
angesehene Arten ein:
la. Rhodospirillum giganteum Molisch 1907
Zellen sehen Rhodospirillum photometricum ahnlich, sind jedoch wesentlich langer und
schmaler, braunrot gefarbt, gewohnlich mit 1-6 schraubenartigen Windungen. Die Lange
schwankt zwischen 9,0 und 70,0 urn und betragt am haufigsten 14,0-20,0 um, die Breite
gewohnlich 1,2 um.
Aus Flufiwasser, das Heu oder Pferdemist enthielt, beschrieben, Vltava bei Praha (CSSR).
lb. Rhodospirillum longum Hama 1933
Zellen sehr lang, oft bis zu 250 um.
lc. Rhodospirillum gracile Hama 1933
Zellen 7-30 um lang.
2. Rhodospirillum tenue Pfennig 1969 (Fig. 2)
Zellen einzeln lebend, leicht gekrummt bis vibrio- oder schraubenformig, mit
einer oder zwei Windungen. Mit polaren Geiseln und lebhaft beweglich.
Vermehrung durch Teilung. Anaerob. Fliissige Kulturen sind braunlich rot, manche
Stamme purpurviolett. Aerobe fliissige Kulturen hingegen farblos bis blafirot.
Die Kulturen haben die Tendenz, Flocken zu bilden und zu sedimentieren. Als
Pigmente kommen Bakteriochlorophyll a und Karotinoide der Spirilloxanthin-
Serie vor. Purpurfarbige Zellen enthalten aufierdem Karotinoide der 4. Gruppe.
Die Ernahrung ist photoorganotroph und photolithotroph mit molekularem
Wasserstoff. Die Zellen wachsen sowohl anaerob bei Licht, als auch
mikroaerophil oder aerob im Dunkeln. Sie benotigen keine Wuchsstoffe.
Zellen 0,3-0,5 X 3,0-60,0 |xm grofi, oft auch langer. Die Schraubenwindungen
sind 0,8-1,0 \im breit und meist 3,0 \im lang.
22 • Phototrophe Bakterien - Rhodospirillum
Kommt im stehenden, faulenden Wasser und im Schlamm vor, am haufigsten im
Teichschlamm. Aus einem Waldteich in der Nahe von Griinenplan (BRD)
isoliert.
3. Rhodospirillum fulvum van Niel 1944 (Fig. 3)
Zellen einzeln lebend, sehr klein und vibrio- oder schraubenformig, meist nur
mit einer Windung; keinen Schleim bildend. Vermehrung durch Teilung.
Anaerobe fltissige Kulturen anfangs orangebraun bis rotbraun, spater dunkelbraun
werdend. Die Farbe der Kolonien auf Agar ist rotbraun. Als Pigmente kommen
Bakteriochlorophyll a und die vorherrschenden Karotinoide Lykopen und
Rhodopin vor. Spirilloxanthin oder wasserlosliche Pigmente, die in die Umge-
bung diffundieren, werden nicht gebildet. Die Ernahrungsart ist photoorgano-
tropn. Fiir ihr Wachstum benotigen die Zellen Licht und anaerobe Bedingungen.
Im Dunkeln konnen die Zellen mikroaerophil unter Beibehaltung der Pigmente
wachsen. Sie vermogen sich jedoch nicht, aeroben Bedingungen anzupassen,
wodurch sie sich vor allem von Rhodospirillum tenue unterscheiden. Fiir ihr
Wachstum ist p-Aminobenzoesaure erforderlich.
Zellen meistens 0,5-0,7 |xm breit und 2,5 |xm lang, manchmal noch langer. Die
Schraubenwindungen sind gewohnlich 1,0-1,6 |xm breit und 1,0-1,5; manchmal
bis zu 3,5 |xm lang.
In ,grofieren Mengen in belichteten faulenden, stehenden Gewassern, sowie in
Pfutzen und im Schlamm, wo sie orangebraune Haute bilden.
4. Rhodospirillum molischianum Giesberger 1947 (Fig. 4)
Zellen charakteristisch schraubenformig, oft mit einer oder zwei Windungen,
manchmal auch vibrioformig. Morphologisch sind sie Rhodospirillum rubrum
sehr ahnlich. Zellgestalt von den aufieren Bedingungen abhangig. Vermehrung
durch Teilung. Die Farbe fliissiger anaerober Kulturen ist orangebraun bis klar
rotbraun. Die Zellen enthalten Bakteriochlorophyll a und Karotinoide, unter
denen Lykopen und Rhodopin vorherrschen. Aufierdem enthalten sie auch
Lykoxanthin, bilden jedoch kein Spirilloxanthin. Die Zellen sind photoorgano-
troph, und entwickeln sich nur unter streng anaeroben Bedingungen und an sehr
gut belichteten Stellen. Sie sind nicht fahig, sich aeroben Bedingungen
anzupassen. Im Dunkeln konnen sie mikroaerophil wachsen, wobei die Pigmente nicht
verschwinden.
Zellen 0,7-1,0 X 5,0-10,0 |xm grofi. Die Windungen sind 1,3-2,5 |Am breit und
4,0-6,0 |Am lang (manchmal sogar 7,0-9,0 |xm).
Vereinzelt in stehenden, faulenden Gewassern und im Schlamm vorkommend.
5. Rhodospirillum photometricum Molisch 1907
Zellen grofi, stark und schraubenformig; meistens mit einer oder zwei verschie-
den grofien Windungen. Die Form hangt von den aufieren Bedingungen ab. An
jedem Pol tragen die Zellen eine Geifiel, die ebenso lang oder langer als die Zelle
ist. Bewegung sehr lebhaft, geradlinig hin- und herschwimmend; phototaktisch.
Vermehrung durch Teilung. Einzelne Zellen sind farblos. Anaerobe fltissige
Kulturen sind klar orangebraun bis rotbraun gefarbt. Als Pigmente kommen
Bakteriochlorophyll a und Karotinoide vor, unter denen Lykopen und
Rhodopin vorherrschen. Weiter wurden auch Lykoxanthin, Lykophyl und Anhydro-
rhodovibrin gefunden; doch bildet sich kein Spirilloxanthin. Zum Wachstum
benotigen die Zellen streng anaerobe Bedingungen und Licht. Sie vermogen
nicht aerob zu wachsen. Im Dunkeln konnen sie mikroaerophil wachsen, wobei
die Pigmente vollkommen erhalten bleiben.
Zellen 1,2-1,5 \im breit und 5,0-30,0 |xm lang; am hai^fcten messen sie 5,0-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodopseudomonas • 23
8,0 [im. 14,0-30,0 |xm lange Zellen treten nicht allzu selten auf. Die
Schraubenwindungen sind gewohnlich 4,0-6,0 |Xm breit und 7,0-10,0 |Xm lang.
In stehenden Gewassern und im Schlamm vorkommend, sehr verbreitet. Die Art
wurde in Flufiwasser (Vltava-CSSR) gefunden, das Heu oder Pferdemist ent-
hielt. Eine Voraussetzung des Vorkommens ist eine 20-30 cm hohe Wasser-
schicht.
Krasil'nikov (1949) halt diese Art fiir identisch mit Rhodospirillum rubrum.
2. Rhodopseudomonas Kluyver et van Niel 1937
Rhodobacillus Molisch 1907, Rhodomonas Kluyver et van Niel 1936
Zellen kugelig oder stabchenformig mit abgerundeten Enden, manchmal mehr
ellipsoidisch oder vibrioformig. Form und Grofie der Zellen von bestimmten
Bedingungen, besonders der Anwesenheit organischer Stoffe und ihrer Konzen-
tration abhangig. Zellen einzeln oder in Paaren auftretend, auch kurze Ketten
bildend. Junge Zellen beweglich, mit einer oder mehreren polaren Geifieln. In
manchen Fallen scheiden die Zellen Schleim aus; ohne Gasvakuolen. Im Licht
wachsende Kulturen sind verschieden gefarbt, von gelbbraun bis dunkelrot. Als
Pigmente kommen Bakteriochlorophyll a und b vor, von den Karotinoiden
hauptsachlich Lykopen, Spirilloxanthin, Rhodopin, Rhodovibrin u. a., die im
inneren Membransystem enthalten sind.
Die Arten sind anaerob phototroph. Manche besitzen im Dunkeln und unter
aeroben Bedingungen einen oxidativen Metabolismus. Die Photosynthese ver-
lauft in Anwesenheit einfacher organischer Stoffe. Organische Sauren konnen
nur dann verbraucht werden, wenn im Medium Bikarbonat vorhanden ist. Als
Elektronendonator wird molekularer Wasserstoff ausgeniitzt. Elementarer
Schwefel kann hingegen als Elektronendonator nicht verwendet werden. Wah-
rend der Photosynthese wird kein molekularer Sauerstoff produziert. Manche
Stamme sind imstande, atmospharischen Stickstoff zu fixieren. Vermehrung
durch Teilung oder durch Knospung. Letztere wird von manchen Autoren als
asymmetrische Teilung betrachtet. Innerhalb der Gattung kann man an den
einzelnen Arten die Entwicklung der wachsenden Kompliziertheit der
Vermehrung von einfacher Teilung bis zur Knospung mit Bildung von Ruhezellen des
Exosporen- oder Zystentyps verfolgen. Darum sind Gorlenko et al. (1976) der
Ansicht, dafi es zweckmafiig ware, die durch Knospung sich vermehrende Arten
(R. palustris, R. viridis, R. acidophila und R. sulfoviridis) aus der Gattung
Rhodopseudomonas herauszunehmen und sie in eine neue selbstandige Gattung
einzureihen.
Die Ausmafie der Zellen betragen meist 0,5-0,7 X 1,0-3,0 |xm.
Recht verbreitete Gattung, die vor allem in stehenden Gewassern und in
Siimpfen, in faulendem organischen Material auftritt. Nicht naher bestimmte
Arten dieser Gattung wurden auch im Grundwasser mit hoherem Sulfatgehalt in
Erdolgegenden gefunden. Als Kohlenstoffquelle dienen ihnen geloste, nicht voll
oxydierte Kohlenwasserstoffe.
Manche Zellen wurden aus Mischkulturen isoliert, in denen sie mit anderen
Bakterien, die ihnen ein anaerobes Milieu sicherten, in enger Symbiose lebten.
Die morphologischen Merkmale der einzelnen Arten sind nicht eindeutig, daher
kann die Bestimmung der Arten nur in groben Ziigen durchgefuhrt werden.
Auch dann mtissen sie in Reinkultur zur Verftigung stehen. Eine genaue
Bestimmung ist nur auf Grund physiologischer und biochemischer Kulturteste
moglich.
Typus generis: Rhodopseudomonas palustris (Molisch 1907) van Niel 1944.
24 • Phototrophe Bakterien - Rhodopseudomonas
Wichtigste Literatur: Molisch 1907, van Niel 1944, Bergey's Manual 1948,
1957, 1974, Krasil'nikov 1949, Scardovi 1950, Osnickaja 1954, Kondrat'eva
1963, Eimhjellen 1933, Liaaen-Jensen 1963, Drews und Giesbrecht 1966, Gies-
brecht und Drews 1966, Pfennig 1968, 1974, 1978, Whittenburg und Mc Lee
1967, Tauschel und Drews 1968, Klemme 1968, Pfennig 1969, Weckesser et al.
1969, Gorlenko 1969, Schmidt 1971, Hansen und Veldkamp 1973, Gorlenko et
al. 1974, Keppen und Gorlenko 1975, Gorlenko et al. 1976, Keppen et al. 1976,
Satoh et al. 1976.
Bestimmungsschliissel der Arten
la Zellen ohne sichtbare Granula 2
lb Zellen mitdeutlichen Granula 10
2a Vermehrung durch Knospung 3
2b Vermehrung durch Teilung 6
3a Kulturen rot, purpurrot, orangebraun bis dunkelbraun gefarbt 4
3b Kulturen gelbgriin, grunoderschmutzig- bisolivbraun 5
4a Als Elektronendonatoren werden Sulfide und Thiosulfat verwendet.
Kulturen rot bis dunkelbraun. Tochterzellen auf rohrchenartigen Fasern entste-
hend 1. Rh. palustris
4b Als Elektronendonatoren werden keine Sulfide und Thiosulfat verwendet.
Kulturen orangebraun bis purpurrot. Tochterzellen direkt auf dem Pol der
Mutterzelle entstehend 2. Rh. acidophila
5a Kulturen gelbgriin, griin oder schmutziggrun; Tochterzellen auf
rohrchenartigen Fasern entstehend 3. Rh. viridis
5b Kulturen olivgrun; Tochterzellen direkt von der Mutterzelle durch
Knospung gebildet 4. Rh. sulfoviridis
6a WachstumfahigohneNaCl 7
6b Wachstumsfahignurmit2,5% NaCl 5. Rh. sulphidophila
7a Zellen kugelformig bis oval. Meist einzeln, nur ausnahmsweise Ketten
bildend 8
7b Zellen ausgesprochen stabchenformig, in eine Schleimkapsel eingebettet. 9
8a Zellendurchmesser 2,0-2,5 |Xtn. Optimaler pH-Wert 6,5-7,5, anaerob
wachsende Kulturen gelbbraun bis griinbraun 6. Rh. sphaeroides
8b Zelldurchmesser 1,6-1,8 \im. Optimaler pH-Wert 4,8-5,6, anaerob
wachsende Kulturen purpurrot 7. Rh. globiformis
9a Zellen oft in zickzack-artig angeordneten Ketten; anaerob wachsende
Kulturen gelbbraun 8. Rh. capsulata
9b Zellen bilden keine zickzack-artig angeordnete Ketten. Anaerob wachsende
Kulturen hellrosa bis pfirsichrot, ausnahmsweise gelbraun
9. Rh. gelatinosa
10a Pleomorphe Zellen, mit deutlichen Kornern, die von den stark lichtbre-
chendenSchwefeltropffhen leicht zu unterscheiden sind
10. Rh. vannielii
10b Zellen nur mit stark lichtbrechenden Granula (wahrscheinlich Schwefel),
die gleichmafiig iiber die ganze Zelle verteilt sind . . 11. Rh. issatchenkoi.
1. Rhodopseudomonas palustris (Molisch 1907) van Niel 1944
(Fig- 5)
(nomen conservandum)
Rhodobacillus palustris Molisch 1907, Rkodobacterium capsulatum Molisch
1907, Rhodovibrio parvus Molisch 1907, Rhodomonas palustris (Molisch 1907)
Kluyver et van Niel 1936
Zellen gewohnlich stabchenformig, in jungen Kulturen sehr kurz undmanchmal
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodopseudomonas • 25
leicht abgerundet. In manchen Fallen sind sie etwas gebogen, auch bilden sie
unregelmafiig gekrummte oder gebogene Stabchen, die an einem oder an beiden
Polen verdickt sind; nicht selten verzweigt. In alten Kulturen werden lange,
verdickte, manchmal verzweigte Mykobakterien-ahnliche Zellen gebildet. In
nahrstoffereichen Medien werden sie wesentlich grofier; gramnegativ. Mit einer
polaren oder subpolaren Geifiel, die bei Anderung der Lebensbedingungen
abgeworfen werden kann. In alten Kulturen, insbesondere bei grofier Zellkon-
zentration, bilden sich charakteristische Rosetten. In diesen sind die Zellen mit
den geifieltragenden Polen verbunden. Aufierdem konnen noch durch Verzwei-
gung der Zellen myzelahnliche Strukturen auftreten. Die Farbe hangt vom Alter
und von aufieren Bedingungen ab und ist veranderlich. Einzelne Zellen sind
farblos, eine grofiere Zellmenge ist hingegen intensiv gefarbt. Anaerobe fliissige
Kulturen sind anfangs leicht rosa, spater rot bis rotbraun. Aerobe fliissige
Kulturen sind farblos bis rosa. Als Pigmente kommen Bakteriochlorophyll a und
verschiedene Karotinoide der Spirilloxanthin-Reihe vor. Manche Stamme erzeu-
gen einen wasserloslichen blauschwarzen Farbstoff, der in das Kulmrmedium
diffundiert und es verfarbt, vor allem, wenn es zu einer Stoning der Synthese des
Bakteriochlorophylls kommt. Als Reservestoff sind Granula von Poly-P-Hy-
droxybuttersaure vorhanden.
Ernahrung photoorganotroph. Die Zellen wachsen anaerob im Licht, konnen
sich aber auch an aerobe Bedingungen anpassen. Manche Stamme verlieren
jedoch die Fahigkeit zur Photosynthese und ernahren sich nur heterotrophe
unter aeroben Bedingungen im Dunkeln. Die optimale Sauerstoffkonzentration
betragt 1-3 mg 02/l. Fur ihr Wachstum benotigen sie einfache organische
Verbindungen (Fettsauren) und Bikarbonate. Als Wuchsstoffe sind p-Amino-
benzoesaure und bei manchen Stammen auch Biotin erforderlich.
Elektronendonatoren sind nicht nur organische Verbindungen, sondern auch Thiosulfat und
andere anorganische Schwefelverbindungen. Schwefelwasserstoff wird zu
Schwefelsaure oxydiert, ohne dafi elementarer Schwefel gebildet wird, wobei die
Zellen eine wesentlich niedrigere Sulfidkonzentration vertragen als die purpur-
nen Schwefelbakterien. Die Zellen wachsen langsam auch in einer Wasserstoffat-
mosphare.
Vermehrung durch Knospung. Die Art besitzt einen Entwicklungszyklus: Junge
Tochterzellen sind deutlich beweglich, wahrend die Mutterzellen unbeweglich
bleiben. In der weiteren Entwicklung tritt bei den Tochterzellen am antapikalen
Pol ein rohrenformiges Gebilde auf, das 1,5-2 mal linger als die Zelle ist. Infolge
anderer Ultrastruktur ist es durchsichtiger als die eigentliche Zelle und von ihr
leicht zu unterscheiden. Spater schwillt das distale Ende des Rohrchens allmah-
lich an, gleichzeitig wird das Plasma dunkler gefarbt, so dafi schliefilich die neue
Struktur hantelformig aussieht. Dann kommt es zur asymmetrischen Teilung,
wobei kleinere Tochterzellen und grofiere Mutterzellen mit mehreren durch-
sichtigen Fortsatzen entstehen. Unter giinstigen Bedingungen trennt sich die
Tochterzelle durch aktive Bewegung der polaren Geifieln von der unbewegli-
chen Mutterzelle und wachst in die Lange, so dafi sie von der Mutterzelle nicht
mehr zu unterscheiden ist.
Junge Zellen 0,6-0,9 X 1,2-2,0 |Xm grofi, altere Zellen konnen eine Lange von
10 |Xm erreichen.
Im Schlamm und in abgestorbenen, in Zersetzung begriffenen Organismen im
Wasser auftretend. Besonders zahlreich ist die Art in Sumpfen und in Fliissen.
Gehort zu den verbreitetsten purpurnen schwefelfreien Bakterien.
Van Niel (1944) hat zu dieser Art noch zwei weitere, urspriinglich als selbstandig beschrie-
bene Arten gestellt:
la. Rhodobacterium capsulatum Molisch 1907
Kurze Stabchen bis Kokken, nur wenig linger als breit, unbeweglich. Bei negativer Farbung
26 ■ Phototrophe Bakterien - Rhodopseudomonas
wird eine diinne Schleimkapsel sichtbar. Einzelne Zellen farblos, grofiere Zellgruppen rot
bis karminrot gefarbt.
Zellen im Durchschnitt 0,9-1,8 [im, ausnahmswelse bis 2,7 um, einschliefilich der Kapsel
3,5-5,5 um grofi.
Im Meerwasser in der Umgebung von Triest (Italien) auf faulenden Zostera-Resten gefun-
den; in grofien Mengen auftretend.
lb. Rhodovibrio parvus Molisch 1907
Zellen bohnenformig oder gekriimmt, kurz stabchenformig. An einem Pol mit einer,
seltener mit zwei sehr langen, wellenformigen GeiCeln.
Einzelne Zellen farblos, in grofien Mengen rot; mikroaerophil. Bewegung rasch, geradlinig,
unregelmafiig.
Zellen 0,9 X 1,6-2,1 (im grofi, Geifkln 9,0-13,0 urn lang.
Auf toten Exemplaren von Limnalus stagnalis und Regenwiirmern im FluCwasser der Vltava
(CSSR) gefunden.
2. Rhodopseudomonas acidophila Pfennig 1969 (Fig. 6,8)
Zellen stabchenformig, sehr grofi, wohl die grofken Art dieser Gattung. Manch-
mal Zellen ovoid oder etwas gekriimmt. Oft treten unregelmafiige und ge-
schwollene Formen auf. An einem Pol mit Geifieln. Nur bei manchen Stammen
finden wir die charakteristischen rosettenartigen Gruppen; gramnegativ.
Einzelne Zellen farblos, in grofieren Mengen in anaeroben flussigen Kulturen purpur-
rot bis orangebraun. Die Farbe hangt von der Lichtintensitat ab. Neben Bakte-
riochlorophyll a als photoassimilierendem Pigment enthalten sie Karotinoide
der Spirilloxanthin-Serie gemeinsam mit anderen, bisher noch nicht beschriebe-
nen Pigmenten, die artspezifisch zu sein scheinen. Als Reservestoff speichern die
Zellen Poly-fi-Hydroxybuttersaure.
Die Zellen sind photolithotroph (mit molekularem Wasserstoff) oder
photoorganotroph, fakultativ aerob. Sie wachsen anaerob im Licht oder aerob im
Dunkeln. Manche Stamme sind mikroaerophil. Diese Art benotigt keine Wuchs-
stoffe und verwendet weder Sulfide noch Thiosulfate. Sie wachst auf einfachen
organischen Substraten.
Vermehrung durch Knospung an den Zellpolen, wobei keine rohrchenformigen
Fasern wie bei Rhodopseudomonas palustris gebildet werden. Die Knospen
sitzen direkt an der Mutterzelle und trennen sich von ihr durch Einschnurung,
Fig. 5. Rhodopseudomonas palustris -V tvlzxxi der Knospung aus dem
rohrchenformigen Auslaufer der Mutterzelle (nach Mikrophotographie umgezeichnet -
Whittenburg und Mc Lee, 1967. - 2500X). Fig. 6. Rhodopseudomonas
acidophila - Knospung der Tochterzelle direkt auf der Mutterzelle (nach
Mikrophotographie umgezeichnet - Pfennig, 1969. - 2500X). ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodopseudomonas ■ 27
Fig. 7. Rhodopseudomonas viridis - (nach Mikrophotographie umgezeichnet -
Drews und Giesbrecht, 1966. - 2000X). Fig. 8. Rhodopseudomonas acidophila -
(nach Mikrophotographie umgezeichnet - Bergey's Manual, 1974. - 2000X).
sobald die neuen Zellen die Grofie der Mutterzelle erreicht haben. Nach der
Teilung knospt sowohl die Tochter- als auch die Mutterzelle erneut an anderen
Stellen. Zellen beweglich mittels polarer Geifieln, insbesondere junge Zellen.
Zellen 1,0-1,3 x 2,0-4,0 |xm grofi. Bei manchen Stammen erreichen sie eine
Lange bis zu 7,0 |xm_. Ungefahr doppelt so grofi wie Rhodopseudomonas
palustris.
Im Schlamm und im Wasser mit faulenden organischen Resten, dort wo genii-
gend Licht vorhanden ist vorkommend. Da diese Art an eine saure Reaktion des
Wassers gebunden ist, kommt sie in Torfgraben und Torfstichen vor.
3. Rhodopseudomonas viridis Drews et Giesbrecht 1966 (Fig. 7)
Synechococcus plancticus Drews et al. 1961
Morphologisch Rhodopseudomonas palustris ahnlich. Zellen gerade oder leicht
gekriimmt, kurz und dick stabchenformig, an einem Pol eine subpolare Geifiel
oder ein Geifielbiindel tragend; gramnegativ. In alteren Kulturen, in der verlang-
samten Wachstumsphase und in der stationaren Phase lagern sich die Zellen zu
charakteristische Rosetten zusammen. Einzelne Zellen farblos, in dichter
Suspension junge flussige anaerobe Kulturen gelbgriin bis leuchtend griin gefarbt.
Altere dunkelgriin bis braungriin oder olivgriin gefarbt. Aerobe Kulturen
farblos bis hell gelbgriin. An Pigmenten kommen Bakteriochlorophyll h und
eine Reihe von Karotinoiden vor. Als Reservestoff enthalten die Zellen Granula
von Poly-(3-Hydroxybuttersaure.
Ernahrung photoorganotroph. Die Zellen wachsen entweder streng anaerob bei
Licht oder mikroaerophil im Dunkeln. Manche Stamme vermogen im Dunkeln
aerob zu wachsen. Fur ihr Wachstum brauchen sie einfache organische Verbin-
dungen und Bikarbonat sowie die Wuchsstoffe Biotin und p-Aminobenzoesau-
re. Das Substrat dient entweder als Elektronendonator oder ist direkt photoassi-
milierend. Wasserstoff, Sulfide und Thiosulfate konnen nicht als Elektronendo-
natoren verwendet werden. Bei Anwesenheit von Wasserstoffdonatoren in
Form von organischen Stoffen oder Thiosulfat oder molekularem Wasserstoff
konnen sie molekularen Stickstoff fixieren.
Vermehrung durch Knospung. Die Tochterzellen entstehen am distalen Ende
einer rohrcnenformigei^^er.
28 • Phototrophe Bakterien - Rhodopseudomonas
Junge Zellen lebhaft beweglich.
Zellen 0,9-1,0 X 1,6-2,0 urn grofi.
Im Schlamm und in belichteten stehenden Gewassern auftretend, sehr haufig
auch im Plankton vorkommend. Isoliert wurde die Art aus schwach sauren
Gewassern - Hinterzartener Moor in der Nahe von Freiburg (BRD).
4. Rhodopseudomonas sulfoviridis Keppen et Gorlenko 1975
Die Zellmorphologie ist vom Entwicklungszyklus abhangig. Vegetative Zellen
sind kurze gerade Stabchen, von denen sich durch Knospung entweder bewegli-
che Zellen mit lophotrichen Geifieln oder in Kapseln eingeschlossene, unbeweg-
liche Zellen mit clem Charakter von Exosporen oder Zysten abtrennen. In alteren
Kulturen bilden sich deutliche Rosetten. Gramnegativ. Als Reservestoffe enthal-
ten sie Kornchen von Poly-(3-Hydroxybuttersaure, die in der verlangsamten
Wachstumsphase gebildet wird. Einzelne Zellen sind farblos, die Suspension der
bei Licht unter anaeroben Bedingungen wachsenden Zellen ist olivgrun gefarbt.
Sie enthalten als Pigment Bakteriochlorophyll b und Karotinoide der Spirillo-
xanthin-Serie, vor allem Spirilloxanthin und Neosporin.
Photoorganotroph. Wachst bei Licht unter anaeroben Bedingungen oder mikro-
aerophil im Dunkeln. Als Elektronendonatoren und Kohlenstoffquelle dienen
verschiedene organische Sauren; ebenfalls Thiosulfat, das direkt zu Sulfat oxy-
diert wird ohne Bildung von elementarem Schwefel als Zwischenprodukt. Als
Wachstumsfaktoren sind Hefeextrakt und einige Vitamine (Biotin, Pyridoxin,
und p-Aminobenzoesaure) erforderlich. Als Stickstoffquelle brauchen sie Am-
monium-Ionen. Aminosauren hemmen das Wachstum. Gut wachsen sie auch in
der Anwesenheit reduzierter Schwefelverbindungen und schwefelhaltigen
Aminosauren.
Vermehrung durch Knospung. Tochterzellen knospen direkt auf den Mutterzel-
len. Komplizierter Entwicklungszyklus: Von den Mutterzellen trennen sich in
der exponentialen Wachstumsphase durch Knospung bewegliche Zellen ab. In
der verlangsamten Wachstumsphase bilden sich unbewegliche, ruhende Zellen,
die in eine Kapsel mit dem Charakter von Exosporen oder Zysten eingeschlossen
sind, und zwar entweder durch Knospung auf den Mutterzellen oder direkt aus
den vegetativen Zellen durch Verdickung ihrer Zellwande. In der stationaren
Phase dominieren Ruhezustande, gleichzeitig erreicht auch die Rosettenbildung
ihr Maximum.
Zelldimensionen nicht angegeben; laut Mikrophotographie etwa 0,8 x 2 |im.
Aus einer Schwefelwasserstoff enthaltenden Quelle isoliert.
5. Rhodopseudomonas sulphidophila Hansen et Veldkamp 1973
Junge Zellen sofort nach der Teilung kugelformig bis ovoid; normale vegetative
Zellen kurz stabchenformig. Die Zelldimensionen sind nicht von der
Kohlenstoffquelle abhangig. Ausnahmsweise bilden sich auch kurze Ketten, die ge-
wohnlich aus 4 Zellen bestehen, jedoch nie zickzack-artig angeordnet wie bei
Rh. capsulata, der sie morphologisch sehr ahnlich sind. Besitzen 1-4 polare
Geifieln; Gramnegativ. Das photosynthetische Membransystem hat Vesikular-
Charakter. Enthalten Bacteriochlorophyll a und Karotinoide, wahrscheinlich
aus der Sphaeroiden-Gruppe. Einzelne Zellen farblos. Die Farbe der Suspension
von unter anaeroben Bedingungen wachsenden Zellen wird schon durch kleine
Mengen von Sauerstoff beeinflufk, der eine gelbbraune bis rote Farbanderung
hervorruft. Aerob wachsende Zellsuspensionen sind hellrot. Als Reservestoff
lagert sich wahrscheinlich Poly-fi-Hydroxybuttersaure ab.
Unter anaeroben Bedingungen ist die Emahrung sowohl photolithotroph als
auch photoorganotroph; unter aeroben Bedingungen nur photoorganotroph.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Rhodopseudomonas • 29
Zahlreiche einfache organische Stoffe konnen verwertet werden: Fettsauren,
Laktat, Glutamat, Glyzerol, einige Zwischenprodukte des Trikarboxyl-Zyklus;
Glukose nur langsam. Einige Stamme verwerten auch Athanol und Propanol.
Photolithotrophes Wachstum auf Wasserstoff, Schwefelwasserstoff und
Thiosulfat als Elektronendonatoren. Grofie Toleranz gegenuber Sulfiden. Elementa-
rer Schwefel wird langsam oxydiert. Sulfide und Thiosulfat werden zu Sulfat
oxydiert ohne Bildung von elementarem Schwefel als Zwischenprodukt. Nicht
verwertet werden: Zitrat, Methanol, Tartrat, Benzoat, Mannit und Sorbitol. Als
Stickstoffquelle dienen Ammonium-Ionen, bei einigen Stammen auch molekula-
rer Stickstoff, nicht jedoch Nitrate. Sulfate konnen assimilativ reduziert werden.
Als Wachstumsfaktoren sind Thiamin, Biotin, Nikotinsaure und
p-Aminobenzoesaure erforderlich; gleichfalls benotigen einige Stamme zum Wachstum
0,01%igen Hefeextrakt. Fur optimales Wachstum ist 2,5% Natriumchlorid
erforderlich; bei geringerer Konzentration wachsen sie langsamer, ohne
Natriumchlorid gar nicht. Die optimale Wachstumstemperatur betragt 30-35 °C.
Die Wachstumsgeschwindigkeit steigt mit steigender Lichtintensitat bis zu
4000 Lux. Der pH-Bereich liegt zwiscnen 5,0 und 8,0; der optimale pH-Wert ist
vom Substrat abhangig. Bei photoorganotrophem Wachstum auf Malat liegt er
bei 5,0-4,5; beim Wachstum auf Sulfiden bei 6,5-8,0.
6. Rhodopseudomonas sphaeroides van Niel 1944 (Fig. 9)
(nomen conservandum)
Rhodorrhagus sphaeroides (van Niel 1944) Brison 1955, Rhodococcus capsulatus
Molisch 1907, Rhodococcus minor Molisch 1907, Rhodosphaera capsulata (Mo-
lisch 1907) Buchanan 1918, Rhodosphaera minor (Molisch 1907) Bergey et. al.
1923, Rhodorrhagus capsulatus (Molisch 1907) Bergey et al. 1925, Rhodorrhagus
minor (Molisch 1907) Bergey et al. 1925, Rhodopseudomonas minor (Molisch
1907) Krasil'nikov 1949, Rhodopseudomonas sphaeroides subsp. denitrificans
Satoh et al. 1976.
Zellen meist einzeln, fast kugelig, auf zuckerhaltigen Medien jedoch ovoid;
Zellgrofie vom Medium abhangig. Auf den Medien, die physiologisch alkalisiert
sind, entwickeln sich unregelmafiige Formen: Stabchen mit Verdickungen und
unregelmafiigen Kriimmungen. Abnormale, fadenformige Zellen auch in
Medien mit einer niedrigen Natriumkonzentration, d. h. 5 pie Na/ml und weniger.
Bei hoheren pH-Werten als 7 wird viel Schleim in Kapselform erzeugt. Kapseln
bei negativer Farbung deutlich. Junge Zellen mit polaren Geifieln. Zellen
gramnegativ. Einzelne Zellen farblos. Die Farbe der anaeroben flussigen
Kulturen ist hell bis schmutzig braungriin, spater dunkelbraun; unter aeroben
Bedingungen sind sie deutlich rot gefarbt. Die braune Farbe der anaeroben Kulturen
andert sich bei Zutritt von Luft rasch und wird leuchtend rot.
Die Farbe der Zellen wird durch den Gehalt an Assimilationspigmenten wie
Bakteriochlorophyll a und Karotinoide der Gruppe 2, einschliefilich der Sphae-
roide und der Hydroxysphaeroiden hervorgerufen. In Kulturen wird ein
wasserlosliches blauschwarzes Pigment vom Porphyrin-Typ gebildet, das in das
Medium diffundiert und es verfarbt. Die Kulturen haben einen charakteristi-
schen, unangenehmen Faulnisgeruch.
Emahrung photoorganotroph. Die Zellen wachsen anaerob bei Licht oder aerob
im Dunkeln, bei optimaler 02-Konzentration von 7,0 mg02/l. Sie sind unter alien
Purpurbakterien am bestandigsten gegen Sauerstoff. Ein sehr geringes
Wachstum kann auch in einer Sauerstoffatmosphare erzielt werden. Sauerstoff unter-
driickt jedoch die Synthese des Bakteriochlorophylls. Fur das Wachstum sind
einfache organische Verbindungen und Bikarbonate notig, sowie Thiamin,
Biotin und Nikotinsaure als Wuchsstoffe. Molekularer Wasserstoff dient als
30 • Phototrophe Bakterien - Rhodopseudomonas
Elektronendonator. Schwefelwasserstoff wird zu elementarem Schwefel oxy-
diert, der aufierhalb der Zellen ablagert wird. Diese Art vertragt eine wesentlich
niedrigere Konzentration als purpurne Schwefelbakterien. Vermehrung durch
Teilung. Zellen in jungen Kulturen mittels polarer GeiKeln aktiv beweglich. Sie
verlieren ihre Beweglichkeit jedoch bald, da vor allem in alkalischen Medien die
ubergrofie Schleimproduktion jede Bewegung verhindert.
Die Grofie der kugelformigen Zellen schwankt zwischen 0,7 und 4,0 |xm, ovoide
Zellen messen 2,0-2,5 X 2,5-3,5 |xm.
In faulenden, stehenden Gewassern und 1m Schlamm vorkommend.
Van Niel (1944) fafite zwei urspriinglich als selbstandig beschriebene Arten zusammen:
6a. Rhodococcus capsulatus Molisch 1907
Rhodosphaera capsulata (Molisch 1907) Buchanan 1918, Rhodorrhagus capsulatus (Molisch
1907) Bergey et. al. 1925, 1939
Zellen kugelig, bei negativer Far-bung Schleimkapseln deutlich. Einzelne Zellen farblos, in
grofieren Mengen rot; unbeweglich.
Zellgrofie durchschnittlich 1,5-1,8 urn, mit Kapsel 3,0-3,6 um.
In einem Heuaufgufi, der mit Wasser aus dem Flufi Vltava (CSSR) angesetzt wurde,
gefunden.
6b. Rhodococcus minor Molisch 1907
Rhodosphaera minor (Molisch 1907) Bergey et al. 1923, Rhodorrhagus minor (Molisch 1907)
Bergey et al. 1925, 1939, Rhodopseudomonas minor (Molisch 1907) Krasil'nikov 1949.
Zellen kugelfbrmig, kleiner als bei Rhodococcus capsulatus; unterscheiden sich von letzterem
hauptsachlich dadurch, dafi sie keine Schleimkapseln bilden.
Zellgrofie 0,8-1,2 urn.
In grofien Mengen im Wasser und Schlamm vorkommend, urspriinglich aus einem
Heuaufgufi mit Wasser aus dem Flufi Vltava (CSSR) beschrieben.
In den letzten Jahren wurde ein Stamm als selbstandige Subspecies beschrieben, die sich nur
in den biochemischen Eigenschaften unterscheidet:
6c. Rhodopseudomonas sphaeroides subsp. denitrificans Satoh et al. 1976
Morphologisch, in der Ultrastruktur, Pigmentzusammensetzung, den erforderlichen
Wachstumsfaktoren wie auch in der Fahigkeit, bestimmte organische Stoffe fur phototro-
phisches Wachstum verwerten zu konnen, stimmt diese Subspecies praktisch mit dem
Typenstamm iiberein. Sie unterscheidet sich nur darin, dafi sie anaerob im Dunkeln Nitrate
zu gasformigem Stickstoff reduziert. Nitrate als Stickstoffquelle fur das Wachstum scheiden
]edoch aus.
Aus einer Abwasserlagune isoliert.
Fig. 9. Rhodopseudomonas sphaeroides - (nach Sc
Fig. 10. Rhodopseudomonas vannielii - (nach Scard
10
egel, 1972. - 2000X)
950.-2000X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodopseudomonas • 31
7. Rhodopseudomonas globiformis Pfennig 1974
Kokkenartige bis ovale Zellen verschiedener Grofie entsprechend den Wachs-
tumsbedingungen. Vor der Teilung bilden sie Diplokokken, manchmal mit der
Tendenz zur Kettenbildung. Polargeifiel. Gramnegativ. Photosynthetisches
intrazytoplasmatisches Membransystem vom Vesikulartyp. Enthalten klassi-
sches Bakteriochlorophyll a mit Phytol als esterifizierendem Alkohol und ein
neues, fur diese Art charakteristisches aliphatisches Methoxylat-Karotinoid.
Einzelne Zellen sind farblos, die Kulturen bei mikroaerophilen Bedingungen
rosarot, bei anaerobem Wachstum purpurrot. Als Reservestoffe werden
Polysaccharide gebildet.
Photoorganotropher Organismus, bei Licht unter anaeroben Bedingungen
wachsend, im Dunkeln mikroaerophil. Unter aeroben Bedingungen kein
Wachstum. Als Kohlenstoffquelle eignen sich am besten Glukonat, Mannitol,
Fruktose und Athanol. Wachst auch auf Glukose, Tartrat, Fumarat, Malat,
Pyruvat und Hefeextrakt, nicht jedoch auf Sulfiden, Fettsauren, Laktat, Zitrat,
Glyzerol, Mannose, Sorbitol, Benzoat und Aminosauren. Das Wachstum wird
schon bei niedrigen Sulfidkonzentrationen gehemmt. Elementarer Schwefel als
Elektronendonator fur photoautotrophe C02- Assimilation kann nicht utilisiert
werden. Sulfatreduktion nicht moglich, daher werden zum Wachstum reduzier-
te Schwefelverbindungen in der Form von Zystein oder Thiosulfat benotigt.
Verschiedene Wachstumsfaktoren erforderlich: Biotin, p-Aminobenzoesaure.
Niedrige Hefeextraktkonzentration (0,05% stimuliert das Wachstum, hohere
(0,1%) inhibiert. Optimale Wachstumstemperatur liegt bei 30-35 CC; bei
40 °C kein Wachstum mehr. pH-Bereich zwischen 4,2 und 6,5, Optimum bei
4,8-5,6 je nach Substrat.
Vermehrung durch Teilung. Junge Zellen mittels polarer Geifiel beweglich.
Zellgrofie von den Wachstumbedingungen abhangig. Unter optimalen
Bedingungen durchschnittlich 1,6-1,8 |xm breit, unter ungiinstigen Bedingungen
entstehen wesentlich grofiere Zellen.
Aus einer heifien Schwefelquelle (pH 3,0) in der Nahe des Gibbon River im
Yellowstone Park (Wyoming, USA) isoliert.
8. Rhodopseudomonas capsulata (Molisch 1907) van Niel 1944
(non Rhodopseudomonas capsulatus (Molisch 1907) van Niel 1944)
Rhodonostoc capsulatum Molisch 1907
Zellen kugelig, oval oder ausgesprochen stabchenformig. Zellgestalt stark vom
pH des Mediums abhangig. Bei pH 7 sind sie kugelig und bilden oft Ketten, die
an Streptokokken erinnern. Ovoide Zellen und Stabchen sind typisch fur hohere
pH-Werte; je hoher der pH-Wert, umso langer sind die Stabchen. Auch die
stabchenformigen Zellen bilden sehr oft Ketten, in denen die Zellen zickzack-
artig angeordnet sind, was fur diese Art charakteristisch ist. An den Polen einiger
Zellen befindet sich ein Material, das die Anheftung und dadurch die sternformi-
ge Rosettenbildung ermoglicht. Bei einem liber 8 liegenden pH-Wert bilden sich
unregelmafiige Faden und reichlich Schleim. Zellen mit farbloser Schleimkapsel.
Falls diese eine oder zwei Zellen umgibt, ist sie kugelformig. Umgibt sie mehrere
Zellen, hat sie eine mehr oder weniger ellipsoidische Gestalt. Als Reservestoff
werden in den Zellen Granula von Poly-P-Hydroxybuttersaure gespeichert.
Bewegliche Zellen haben polare Geifieln. Zellen gramnegativ. Die Farbe der
anaeroben fliissigen Kulturen ist hell braungelb, bei manchen Stammen haben sie
einen griinlichen Stich, spater werden sie mahagoni braun. Im sauerstoffhaltigen
Milieu sind sie dunkelrot bis purpurrot. Anaerob wachsende Zellen andern bei
Zutritt von Luft ihre Farbe schon nach einigen Stunden ins Dunkelrote. Als
Pigmente kommen Bj^fcriochlorophyll a und Karotinoide der Gruppe 2, ein-
32 ■ Phototrophe Bakterien - Rhodopseudomonas
schliefilich der Sphaeroide und Hydroxysphaeroide vor. Es wird kein wasserlos-
liches Pigment gebildet, das das Medium f'arben konnte.
Die Zellen sind photoorganotroph, wachsen anaerob bei Licht oder aerob im
Dunkeln. Sie benotigen einfache organische Verbindungen und Bikarbonat, als
Wuchsstoffe Biotin und Nikotinsaure. Molekularer Wasserstoff kann als Elek-
tronendonator dienen. Atmospharischer Stickstoff kann fixiert werden, was
intensiver (bis dreifach) in Symbiose mit verschiedenen anderen Organismen
{Azotobacter vinelandii u. a.) als in der Reinkultur vor sich geht. Sulfide werden
in geringeren Konzentrationen als bei den Purpurschwefelbakterien verwendet.
Vermehrung durch binare Teilung. Die unbewegliche Mutterzelle teilt sich in
zwei Halften; Tochterzellen beweglich oder unbeweglich. Sonst Zellen meist
unbeweglich, nur wenige bewegen sich mittels einer polaren Geifiel.
Zellen 0,5-1,2 X 2,0-2,5 um grofi (manchmal auch 1,0-1,2 um breit und bis zu
7,0 um lang). Schleimkapseln anfangs 2,7-8,0 |xm breit, konnen jedoch 21,0 |xm
und mehr erreichen.
In der Regel in stehenden Gewassern und im Schlamm vorkommend. Urspriing-
lich wurde diese Art aus Wasser mit faulendem Heu und Blattern von Acer
pseudoplatanus beschrieben.
9. Rhodopseudomonas gelatinosa (Molisch 1907) van Niel 1944
Rhodocystis gelatinosa Molisch 1907
Junge Zellen verhaltnismafiig klein und kurz stabchenformig, oft etwas ge-
kriimmt. Alte Kulturen mit viel grofieren Zellen und Involutionsformen, die
unregelmafiig gekriimmt, oft aufgequollen und knorrig sind.
Rhodopseudomonas palustris ahnlich. Einzelne Zellen produzieren eine grofie Menge Schleim,
der die Zellgruppen zusammenhalt. Die Schleimkapsel wird erst bei negativ
gefarbten Praparaten deutlich. Oft bilden diese Zellgruppen ausgedehnte schlei-
mige, rotgef'arbte Lager. Junge Zellen mit polaren Geiileln. Zellwand mit der
charakteristischen Struktur gramnegativer Bakterien. Die Farbe der Kolonien
unter anaeroben Bedingungen ist hellrosa bis pfirsichrot, ausnahmsweise bis
schmutzig gelbbraun. Als Pigmente kommen Bakteriochlorophyll a und Karoti-
noide der 2. Gruppe vor. Bei Wachstum im Dunkeln hangt die Bildung der
Photopigmente stark vom Partialdruck des Sauerstoffs ab. Dann sind die
Kulturen farblos oder schmutziggelb bis braun. Gelegentlich erzeugen sie einen
wasserloslichen roten Farbstoff. Die Kulturen haben einen durchdringend
scharfen Geruch.
Die Zellen sind photoorganotroph, mikroaerophil bis aerob. Sie wachsen
anaerob im Licht oder mikroaerophil im Dunkeln. Manche Stamme vermogen auch
im Dunkeln aerob zu wachsen. Sie wachsen auf einfachen organischen Substra-
ten, insbesondere auf organischen Sauren des Krebs-Zyklus. Manche Stamme
sind fahig, molekularen Wasserstoff als Elektronendonator zu verwenden. Als
Wuchsstoffe sind Biotin, Thiamin, Pantothenat u. a. notig. Vermehrung durch
Teilung, wobei die Zellen sich einschnliren, ohne Querwande zu bilden. Junge
Zellen mittels Geifieln beweglich.
Zellen sind im Durchschnitt 0,4-0,5 X 1-2,0 um grofi, in alten Kulturen jedoch
bis zu 15 um lang; Involutionsformen erreichen eine Breite von 1 um.
RegelmaSig in stehenden Gewassern vorkommend, wo Organismen in Faulnis
begriffen sind. Eine in Abwassern, faulenden Schlammen und stark eutrophen
Seen recht verbreitete Art. Ursprlinglich aus Wasser mit faulenden Blattefn von
Acer pseudoplatanus beschrieben.
Arten unsicherer Stellung:
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodopseudomonas ■ 33
10. Rhodopseudomonas vannielii Scardovi 1950 (Fig. 10)
Zellen stabchenformig, sehr pleomorph. Morphologie einerseits von der Sauer-
stoffkonzentration, andererseits davon abhangig, ob die Zellen unter autotro-
phen oder heterotrophen Bedingungen wachsen.
In anorganischem festem Medium mit Sulfiden bilden die tief im Agar
(mikroaerophil) wachsenden Zellen sehr lange, schlanke Stabchen, die an die Zellen der
Gattung Cytophaga erinnern. Zellen meist mit zugespitzten Enden. Oft bleiben
sie nach der Teilung verbunden und bilden Faden. Kolonien kreisformig,
ellipsoidisch, etwas lappig und undurchsichtig, Schwefeltropfchen um die
Kolonien ausscheidend; gelbgriin gefarbt. Protoplast der jungen Zellen homogen,
altere Zellen enthalten ein oder mehrere grofie Korperchen von eingedicktem
Zytoplasma. In Kulturen, die alter als 10-15 Tage sind, kommen diese
Korperchen in alien Zellen vor. Mitunter treten in den Zellen auch Schwefeltropfchen
auf, die von den mit Protoplasma gefullten Korperchen leicht zu unterscheiden
sind. Sie sind entweder in der Zellmitte oder terminal gelagert, ihre Zahl
schwankt zwischen 1 und 45 pro Zelle. Manchmal bilden sie grofie anwachsende
Inklusionen, die schliefilich die ganze Zelle ausfiillen, so dafi diese anschwillt.
Aerob wachsende Kolonien auf mineralischen Substraten mit Sulfiden sind
intensiv rot-violett gefarbt; um die Kolonien bildet sich keine Zone von Schwe-
felgranula. Zellen wesentlich kleiner, gerade, fast ohne Inklusionen. Je nach der
Sauerstoffkonzentration werden verschiedene intermediare Kolonietypen ci
bildet.
Auf organischen Medien (Hefeautolysat) erreichen die Zellen ihre Standardlan-
ge. Sie Bilden kleine, gerade, sehr bewegliche Stabchen ohne Inklusionen, ohne
Verzweigungen und ohne Schleimkapseln. Nach 8-10 tagigem Wachstum strek-
ken sich die Zellen in die Lange. Die fliissige Nahrlosung ist anfangs lasurrosa,
spater lachsrosa und schliefilich kraftig pfirsichrosa gefarbt. Zellen gramnegativ.
Ernahrung bei Anwesenheit von Sulfiden als Elektronendonator (die Zellen sind
fakultativ aerob) photolithotroph, oder auf organischen Substraten
photoorganotroph. Als Elektronendonator kann auch elementarer Schwefel dienen. Thio-
sulfate werden nicht verwendet und es werden auch keine Wuchsstoffe benotigt.
Im Dunkeln erfolgt kein Wachstum. Vermehrung durch Teilung. Unter aeroben
Bedingungen wacnsende Zellen sind beweglich; in Abwesenheit von Sauerstoff
und Anwesenheit von Sulfiden bleiben die Zellen unbeweglich.
Zellen aus anaerob oder mikroaerophil wachsenden Kolonien 0,5 x 0,5-6,0 um,
oft auch 12,0-14,0 \im und daruber lang; aerob wachsende Zellen erreichen eine
Maximallange von 1,5 um.
Diese Art wurde aus einer Anreicherungskultur fiir Chromatium isoliert. Sie
kommt im Schlamm und in belichteten stehenden Gewassern mit Sulfidgehalt
vor.
Die systematische Einordnung dieses Oreanismus ist sehr kompliziert. Bisher wurden keine
taxonomischen Vergleichsteste durchgefuhrt. Die Art bedarf weiterer Untersuchungen.
Triiper (1968) halt die Einreihung in die Gattung Rhodopseudomonas fiir einen Irrtum. In
neuesten Arbeiten (Bergey's Manual 1974) wird sie zwar in die Familie Chromatiaceae
gestellt, doch wird man sie, sobald sie isoliert sein wird, umbenennen mussen.
11. Rhodopseudomonas issatchenkoi Osnickaja 1954
Zellen grofie, lange, dicke Stabchen mit abgerundeten Enden bildend. Junge
Zellen leicht gekrummt oder ovoid. Vor der Teilung bilden sie lange Faden.
Geifieln polar.
Jede Zelle mit 2-4 kugelformigen, wahrscheinlich schwefeligen Granula, die
entweder iiber die ganze Zelle gleichmafiig verteilt sind oder einzeln an den
Zellpolen liegen. Granula griinlich und stark lichtbrechend. Einzelne Zellen
34 ■ Phototrophe Bakterien - Rhodocyclus
farblos, in grofieren Mengen sind die im Licht wachsenden Zellen auf festen
Nahrboden dunkelrot. Fliissige Nahrlosungen zeigen zu Beginn eine schwache
Triibung, die sich spater rosa verfarbt; schliefilicn bildet sich ein dunkelrotes
Sediment. Als Pigmente sind Bakteriochlorophyll a und Karotinoide bekannt.
Im Dunkeln wacnsende Zellen enthalten wesentlich weniger Pigmente.
In Anwesenheit von Sulfiden sind die Zellen photolithotroph, auf einfachen
organischen Substraten fakultativ photoorganotroph. Im Dunkeln unter hetero-
trophen Bedingungen wachsen sie langsam. Wuchsstoffe sind nicht notig.
Sulfide werden als photosynthetische Elektronendonatoren beniitzt. Diese Art
kann auch Erdol-Kohlenwasserstoffe verwenden. Vermehrung derart, dafi sich
die Zelle in der Mitte bis auf einen dunnen Faden einschniirt, durch den die
beiden Halften verbunden bleiben. Dann zerreifk er, doch die beiden Tochter-
zellen beriihren einander noch eine zeitlang mit ihren Polen. Erst spater entfer-
nen sie sich voneinander. Die Zellenden runden sich schliefSlich ab. Manchmal
bleiben die Zellen miteinander paarweise oder in kurzen Ketten verbunden. Fast
alle Zellen sind beweglich. Teilweise rotieren sie bei der Vorwartsbewegung;
Geifieln polar.
Zellen im Durchschnitt 0,6 X 3,2 |xm grofi. Jiingere Kulturen enthalten kleinere
Zellen.
Die Art wurde aus einer rosa gefarbten Grubenwasserschicht eines Erdollagers
in einer Tiefe von 1300-1700 m isoliert. Isacenko (1951), der diese Bakterie
isoliert hatte, ist der Meinung, dafi sie aus einer geologischen Periode stammt, in
der das Erdol aus Pflanzenstoffen gebildet wurde. Nach dieser Ansicht miifite es
sich um eine Reliktform handeln.
Die Art erfordert weitere Untersuchungen. Man ist der Ansicht (Bergey's Manual 1974),
dafi diese Bakterie nach erneuter Isolierung und genauer Untersuchung umbenannt und in
die Familie Chromatiaceae eingereiht werden mufi, da es sich um eine typische purpurne
Schwefelbakterie handelt. Triiper (1968) stellt sie zu Ectothiorhodospira mobilis.
3. Rhodocyclus Pfennig 1978
Zellen st'abchenformig, hufartig oder ringformig gekrummt, meist kurz vor der
Teilung entstehend. Morphologisch sind sie den Zellen der Gattung Spirosoma
oder Microcyclus sehr ahnlich. Unter bestimmten Verhaltnissen bilden sich mehr
oder weniger geschlossene, schraubenformige Faden verschiedener Grofie. In
Gegenwart von Sulfiden bilden die schraubenformigen Faden kompakte
Aggregate, bei denen die Form der einzelnen Zellen undeutlich ist. Gramnegativ. Das
photosynthetische Membransystem besteht aus zytoplasmatischen Membranen
mit einer kleinen Anzahl von Invaginationen. Enthalten Bakteriochlorophyll a
und Karotinoide der Rhodopinal-Serie. Anaerob und bei Licht wacnsende
Kolonien sind purpurviolett bis sattviolett. Mit ihrer Farbung erinnern sie an
Rhodospirillum tenue. Aerob wachsende Kulturen sind farblos bis hell lila. Als
Reservestoff lagern sie Poly-P-Hydroxybuttersaure und Polysaccharide ab.
Die Ernahrung ist unter anaeroben Verhaltnissen photoorganotroph, unter
fakultativ Bedingungen jedoch chemoorganotroph. Als Kohlenstoffquelle dien-
ten verhaltnismafiig wenige organische Stoffe: am besten verwendbar sind
Azetat, Butyrat, Pyruvat und Zyklohexankarboxylat sowohl unter aeroben
Verhaltnissen bei Licht als auch unter anaeroben im Dunkeln. Reduzierte
Schwefelverbindungen (Sulfide, Thiosulfat) konnen weder verwertet, noch zu
elementarem Schwefel oder Sulfaten oxydiert werden. Auf den meisten
organischen Fettsauren, Sachariden und Alkoholen erfolgt kein Wachstum. Molekula-
rer Wasserstoff kann als Elektronendonator dienen. Als Wachstumsfaktoren
sind Vitamin B12, p-Aminobenzoesaure und Biotin r^fcendig. Hefeextrakt in
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodomicrobium • 35
einer Konzentration von 0,3% im Substrat stimuliert das Wachstum. Das
Temperaturoptimum liegt bei etwa 30 °C. Der optimale pH-Wert beim
Wachstum auf Azetat betragt 7,2, der pH-Bereich 6,5-7,5.
Vermehrung durch binare Teilung. Alle Zelltypen sind unbeweglich.
Die Zellen sind 0,6-0,7 |xm breit. Hufartige Formationen sind 2,5-3,0 |xm lang.
Die Weite der Ringe betragt 2,0-3,0 |xm.
Wichtigste Literatur: Schmidt 1971, Pfennig 1978.
Eine einzige Art:
Rhodocyclus purpureus Pfennig 1978
Mit den Merkmalen der Gattung.
Aus einer Abwasserlagune einer Schweinemastanlage in Ames (Iowa, USA)
isoliert, wo sie als dominante Bakterienart auftrat und das Wasser purpurrot
farbte.
4. Rhodomicrobium Duchow et Douglas 1949
Erwachsene Zellen zitronenformig, eiformig oder ellipsoidisch. Junge Zellen
hingegen kugelformig, zu Faden verbunden, die ein- oder mehrmal linger als die
erwachsenen Zellen sind. Die Zellen bilden mittels Fasern kugelformige Grup-
en (Mikrokolonien), die Dutzende von Zellen enthalten. Zellen und Fasern
esitzen eine gemeinsame Membran. Der Protoplast der Fasern ist vom Proto-
plasten der eigentlichen Zelle durch eine Querwand getrennt. Zum Unterschied
von den Vertretern der Gattung Hyphomicrobium naben sie einen deutlichen
Kern, der sich vor der Knospung der Tochterzelle teilt. Einige Stamme bilden
unregelmafiige, polygone Zellen mit 3-5 abgerundeten Kanten. Sie bilden kurze
Ketten, die aus ein bis vier oder auch mehr Zellen an einer Faser bestehen. Sie
sind widerstandsfahiger gegen Warme als normale vegetative Zellen. Die termi-
nale Entstehune dieser Zellen ist ahnlich der von Konidiosporen bei Aktinomy-
ceten. Diese Zellen bilden bei der Keimung 1 bis 4 Faden. Meistens treten sie im
Zentrum der Mikrokolonien, ausnahmsweise direkt an den vegetativen Zellen
auf. Die Zellen sind gramnegativ, enthalten Bakteriochlorophyll a, Karotinoide
der Gruppe 1 und P-Karotinoid. Die Kolonien sind auf Agar dunkel orangerot
gefarbt und haben eine rauhe Oberflache. Anaerobe fliissige Kulturen anfangs
triib, spater kornie und flockig, mit lachsrosa bis dunkel orangeroter, sogar
orangebrauner Farbung. Aerobe fliissige Kulturen farblos bis orangebraun.
Die Zellen sind photoorganotroph, fakultativ aerob bis mikroaerophil. Manche
Stamme sind fahig, anaerob bei Licht und mikroaerophil oder aerob im Dunkeln
zu wachsen. Sie konnen auch in Anwesenheit molekularen Wasserstoffs
photolithotroph wachsen. Unter bestimmten Bedingungen bilden sie molekularen
Wasserstoff. Bei Licht benotigen sie Kohlendioxid oder Bikarbonat und einen
einfachen organischen Wasserstoffdonator wie Athanol, Propanol, Butanol und
Salze mancher organischer Sauren. Wuchsstoffe sind nicht notig.
Vermehrung durch Knospung, die am freien Ende der Zelle beginnt, wobei
entweder eine diinne Faser entwickelt wird, oder aber es entsteht ein besonderer
Zweig an einer schon vorhandenen Faser. Am Ende der Faser, die ebenso lang
oder vielfach linger als die Mutterzelle ist, beginnen sich kugelformige Tochter-
zellen zu bilden. Sobald die Tochterzelle die Grofie der Mutterzelle erreicht hat,
entsteht eine neue Faser am freien Pol, was zur Bildung einer baumchenartig
verzweigten Kolonie fiihrt. Je nach den aufieren Bedingungen verbleiben die
erwachsenen Tochterzellen an den Fasern, bilden eine neue Faser am entgegen-
gesetzten Pol oder losen sich als bewegliche Zellen mit peritrichalen Geifieln ab.
Die Bedeutung der b^eglichen Zellen in der Entwicklung ist noch unbekannt.
36 • Phototrophe Bakterien - Rhodomicrobium
Die erwachsenen Zellen bilden gewohnlich drei Tochterzellen: die eine entwik-
kelt sich an der primaren Faser, die aus dem Pol der Mutterzelle hervorwachst,
die anderen durch laterales Wachstum neuer Fasern an der primaren Faser der
ersten Tochterzelle. Da die Zellen die Tendenz haben, nach der Teilung an den
Fasern haften zu bleiben, sind Mikrokolonien der vorherrschende Wuchshabi-
tus. Aufier vegetativen, beweglichen Tochterzellen konnen auf den Fasern
(Hyphen) unbewegliche Ruhezellen des Exosporentyps knospen (Gorlenko
1969, Gorlenko et al. 1974,1976). Sie sind sehr resistent gegen hohere Tempera-
turen und gegen Austrocknung, stark lichtbrechend, schlecht farbbar. Aus dem
Ende einer Hyphe konnen bis 15 Exosporen knospen, die Trauben oder Ketten
bilden.
Zellen alterer Kulturen sind unbeweelich. In jungen Kulturen konnen ovale,
bewegliche Zellen mit peritrichen Geifieln und einem sichtbaren Kern beobach-
tet werden. Nicht nur einzelne Zellen, sondern auch ganze kleine Zellgruppen
bewegen sich.
Wichtigste Literatur: Duchow und Douglas 1949, Murray und Douglas 1950,
Kondrat'eva 1954, Douglas und Wolfe 1959, Bergey's Manual 1957, 1974,
Boatman und Douglas 1961, Zavarzin 1961, Conti und Hirsch 1965, Gorlenko
1969, Gorlenko et al. 1974, 1976.
Eine einzige Art:
Rhodomicrobium vannielii Duchow et Douglas 1949 (Fig. 11)
Mit den Merkmalen der Gattung.
Zellen 1,0-1,2 X 2,0-2,8 |xm grofi. Manche Stamme haben bis zu 4,0 |xm lange
Zellen. Die die Zellen verbindenden Fasern sind ein- bis dreimal so lane wie die
Zellen; meistens 3,0-3,5 |xm lang und 0,3 |xm breit. Grofie der sporenannlichen
Zellen sehr variabel, meistens 0,9-1,2 X 0,1-1,4 |xm.
Im Schlamm und in tieferen Wasserschichten von Fischteichen, Sufiwasserseen
und langsam fliefienden Fliissen. Oft tritt diese Art gemeinsam mit manchen
Arten der Gattung Chromatium auf; urspriinglich wurde sie aus Schlamm
isoliert; auch in Meer- und Brackwasser gefunden.
Zavarzin 1961 nimmt eine Verwandschaft mit den Gattungen Pedomicrobium
und Hyphomicrobium an.
Fig. 11. Rhodomicrobium vannielii - (nach Mikrophotographie umgezeichnet-
Duchov und Douglas, 1949. - 2000X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Vannielia • 37
5. Vannielia Pringsheim 1955
Zellen stabchenformie, mit einer Geifiel, charakteristische Kolonien in Form
von rosigen maulbeerrormigen Biischelchen oder Knaueln bildend, in denen die
Zellen durch Schleim verbunden sind, obwohl sie keine Schleimkapsel besitzen.
Mikrokolonien nicht gleichmafiig gefarbt, in der Mitte rosa, an der Peripherie
fast farblos. Die Mikrokolonien weichen direkter Beleuchtung aus. Wenn die
Kolonien mechanisch zerstort werden, Ziehen sie sich wieder aktiv zu einem
Knauel zusammen. Zellen rund, radial angeordnet, ausgesprochen phototak-
tisch; gramnegativ. Ganze Kolonien aktiv beweglich, mittels Geifieln rotierend.
Es werden Korrelationsimpulse zur Synchronisierung der Geifielbewegung in
eine Richtung angenommen. Kommt im Schlamm und im Siifiwasser vor.
Wichtigste Literatur: Pringsheim 1955,Skerman 1959, Bergey's Manual 1974.
Eine einzige Art:
Vannielia aggregata Pringsheim 1955 (Fig. 12)
Mit den Merkmalen der Gattung.
Kolonien 15-17 |xm grofi, Zellen 1,0 |xm breit und 4,0-6,0 |xm lang.
Die Art kommt im Sufiwasser vor und wurde aus faulendem Wasser mit
Spirogyra-Wmen auf der Weide Coe Fen, unweit von Cambridge (England)
isoliert.
Obwohl in Reinkultur gehalten, wurden mit dieser Art bisher keine taxonomi-
schen Vergleichsteste durchgefuhrt. In Reinkulturen sind einzelne bewegliche
Zellen vorherrschend. Wahrscheinlich eine neue Art der Gattung Rhodopseudo-
monas (Bergey's Manual 1974).
Fig. 12. Vannielia aggregata - (nach Pringsheim, 1955. - 2000X).
Unsichere Gattung:
Rhodomicrospira parva Molisch 1907, in Huber-Pestalozzi 1938
Freilebende stabchenformige, bohnenartig gekrummte Zellen, an jedem Pol mit
einer Geifiel. Einzeln farblos, in grofieren Mengen rot.
Beschreibung unzureichend, vielleicht eine Rhodospirillum-An.
38 • Phototrophe Bakterien - Chromatiaceae
2. Familie Chromatiaceae Bavendamm 1924,
emend. Pfennig et Triiper 1971 (nomen conser-
vandum)
Einzellige Organismen, oft in verschieden geformten vielzelligen Zellgruppen
lebend. Einzelne Zellen kugelig, ovoid, hornchenformig, vibrioartig, kurze bis
lange Stabchen bildend, die gerade oder schraubenformig gewunden sind;
manche Arten bilden Ketten. Alle Arten konnen einzeln wachsen oder charakte-
ristische Zellgruppen (Mikrokolonien) bilden, die oft in einer gemeinsamen
SchleimkapseT liegen. Eine Reihe von Arten ist ziemlich pleomorph; ihre Mor-
phologie nangt von den Wachstumsbedingungen ab. Nach manchen Autoren
wurden mehrere Organismen fur Entwicklungsstadien einer einzigen Art gehal-
ten (z. B. Beggiatoa roseopersicina), oder umgekehrt wurden
Entwicklungsstadien einer Art als selbstandige Arten beschrieben. Bewegliche Formen haben
polare Geifieln; bei den grofiten Formen ist das Geifielbundel auch im Lichtmi-
kroskop ohne spezielle Farbung sichtbar. Sporen werden niemals gebildet.
Eine Reihe von Arten enthalt Gasvakuolen. Zum Wachstum benotigen sie eine
niedrige Sulfidkonzentration und eine geringe Lichtintensitat. Arten ohne Va-
kuolen wachsen hingegen besser bei hoher Konzentration von Sulfiden und bei
starker Lichtintensitat. Einzelne Zellen meist farblos, in grofieren Mengen
jedoch purpurfarbig. Assimilationspigmente sind die griinen Bakteriochloro-
phylle a und b und Karotinoide. Arten mit Karotinoidgruppe 1 sind orange-
braun bis rotbraun oder rosa gefarbt; Arten mit Karotinoiden der Gruppe 2 sind
purpurrot und solche mit der Gruppe 4 purpurviolett. Aufier diesen
Karotinoiden kommt noch das Tetrahydrospirilloxanthin vor. Die Mehrzahl der Arten
speichert in den Zellen als Reservestoff Schwefeltropfchen (Orthorhombide)
und Poly-P-Hydroxybuttersaure. Nur bei der Gattung Ectothiorhodospira wird
elementarer Schwefel aufierhalb der Zellen abgelagert.
Die meisten Arten sind streng anaerob, ausnahmsweise mikroaerophil. Bei
Anwesenheit von Sulfiden oder elementarem Schwefel ernahren sie sich photoli-
thotroph. Als Endprodukt der Oxydation der Schwefelprodukte entstehen
Sulfationen.
Bei Photosynthese wird C02 zu organischen Verbindungen reduziert, jedoch
ohne Bildung von molekularem Sauerstoff. Die meisten Stamme beniitzen
molekularen Wasserstoff als Elektronendonator. Triiper und Peck (1970) geben
an, dafi APS-Reduktase nur fiir die gesamte Familie Chromatiaceae spezifisch
ist.
Viele vermogen eine bunte Palette organischer Verbindungen, auch ohne Gegen-
wart von Schwefelwasserstoff oder elementarem Schwefel, zu photoassimilie-
ren. So gesehen konnen sie als mixotroph gelten. Bei einer Anzahl der Stamme
wird molekularer Stickstoff fixiert. Grofiere Formen brauchen als Wuchsstoff
Vitamin Bi2. Die Vertreter dieser Familie kommen mit geringer Lichtintensitat
aus und sind so dem Leben in tieferen Wasserschichten angepafk. Ihre
Assimilationspigmente konnen Licht mit einer Wellenlange von 800-900 nm verwerten,
so dafi sie die Lichtenergie auch an solchen Stellen auszuniitzen konnen, wo
grune Pflanzen nicht mehr existenzfahig sind.
Vermehrung durch Teilung in einer, zwei oder drei aufeinander senkrechten
Ebenen, wodurch die charakteristischen Zellgruppen (Mikrokolonien) gebildet
werden.
Eine Anzahl der Arten oder zumindest ihrer Entwicklungsstadien ist beweglich.
Durch Schleimbildung verlieren sie ihre Beweglichkeit. Der Schleim wird bei
einer gewissen Sulfidkonzentration und bei starker Lichtintensitat gebildet. Bei
niedriger, fiir jede Art spezifischer H2S-Konzentr^fcn entwickeln die Zellen
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatiaceae ■ 39
Geifieln und werden beweglich. Je niedriger die Lichtintensitat ist, desto hoher
mufi die H2S-Konzentration sein, um Beweglichkeit hervorzurufen.
Ihr Vorkommen ist an Licht, anaerobe Bedingungen, Anwesenheit der reduzier-
ten oder der elementaren Form des Schwefels und faulende organische Stoffe
gebunden. Die Arten kommen in alien Typen von Gewassern und an nassen
Stellen vor, wie z. B. im Schlamm, in Sumpfen, in feuchter Erde, in Pfutzen,
Graben, Wasserbecken, Fischteichen, Seen, Flussen, Flufideltas sowie auch in
Schwefelquellen und im Meer. Unter gewissen Bedingungen vermehren sie sich
so stark, dafi sie dem Wasser eine charakteristische, blutrote Farbe verleihen. Die
Konzentration kann mehr als 100000 Individuen in 1 ml Wasser erreichen. In
tiefen Seen kommt es oft zum Wachstum von Purpurbakterien an der Grenz-
schicht von Schwefelwasserstoff und Sauerstoff. Es wird dort eine bis zu 0,5 m
dicke purpurfarbene Schicht gebildet. In seichten Seen treten gewohnlich pur-
purne Uberziige am Grund und an submersen Pflanzen auf.
Die maximale gemessene Tiefe ihres Vorkommens im Siifiwasser betrug 35 m.
Oft ist ihr Auftreten an den Sulfatgehalt im Wasser gebunden. Durch die
biologische Reduktion der Sulfate zu Schwefelwasserstoff werden die
Purpurbakterien mit Sulfidionen versorgt. Diese Bakterien sind sowohl gegeniiber
hohem Salzgehalt als auch gegeniiber extremen Temperaturen sehr tolerant.
Sie wachsen ebenso unter durchsichtigem Eis, wie auch in heifien Quellen mit
Temperaturen von ungefahr 80 CC.
Als Kriterien zur Unterscheidung der Gattungen dienen: die Entwicklung der
Zellaggregate, ihre Struktur, die Schleimabsonderung und die Bildung von
Schleimkapseln. In letzter Zeit gelang es, die meisten der von Vinogradskij
(1888) beschriebenen Arten in Reinkulturen zu isolieren. Auf Grund eingehen-
der Untersuchungen sind eine neue Gliederung der Gattungen sowie nomenkla-
torische Anderungen notwendig geworden.
Die neue Bezeichnung dieser Familie ersetzt die urspriingliche Bezeichnung
Thiorhodaceae Moliscn 1907, die illegitim ist.
Typus familiae: Chromat'mm Petty 1852.
Bestimmungsschlussel der Gattungen
la In Anwesenheit von H2S wird in den Zellen Schwefel gespeichert 2.
lb In Anwesenheit von H2S wird Schwefel extrazellular abgelagert
10. Ectothiorhodospira (S. 82)
2a Zellen mit Gasvakuolen 3
2b Zellen ohne Gasvakuolen 8
3a Zellen wenigstens in einem der Entwicklungsstadien beweglich, oft Diplo-
kokken bildend 4
3b Zellen niemals beweglich 5
4a Zellen kugelig bis ovoid, maximal 4,0 u.m grofi. Oft Tetraden bis ganze
grofie Aggregate bildend, die in Schleim eingeschlossen sind und bei alteren
Individuen die Form eines Sacknetzes haben. Zellmasse purpurrot gefarbt
9. Lamprocystis (S. 78)
4b Zellen kugelig bis ellipsoidisch, durchschnittlich 7,0 urn grofi. Oft als
Diplokokken oder Drilfinge auftretend. Zellmasse purpurviolett gefarbt . .
ll.Thioporphyra(S. 86)
5a Zellen kugelig bis ovoid 6
5b Zellen stabchenformig, oft grofie Kolonien in Form unregelmafiiger Netze
bildend 8.Thiodictyon(S.75)
6a Zellen mehr oder weniger unregelmafiige oder kugelige Zellgruppen ohne
sichtbareSchleimkapselbildend 7
6b Zellen charakteristische zweidimensionale, rechteckige Plattchen bildend,
40 ■ Phototrophe Bakterien - Chromatium
die aus einzelnen, in eine sichtbare gemeinsame Schleimkapsel eineeschlos-
senen Tetraden bestehen 7. Thiopedia (S. 72)
7a Zellen ohne Pigmente. Einzeln oder in mehr oder weniger kugeligen
Kolonien ohne sichtbare Schleimkapseln lebend . . 12. Hyalobotrys (S. 87)
7b Zellen mit Pigmenten. Auch einzeln lebend, jedoch meist charakteristische
unregelmafiige Zellgruppen ohne ausgepragte Schleimkapseln bildend ....
6. Amoebobacter (S. 67)
8a Zellen wenigstens in manchen Entwicklungsstadien mit Hilfe polarer Gei-
fieln beweglich 9
8b Zellen immerunbeweglich 14
9a Zellen stabchenformig, oval, bohnenformig, ovoid, tonnenformig,
fadenformig, doch nie schraubenartig gewunden 10
9b Zellen schraubenartig gewunden 5.Thiospirillum(S.64)
10a Zellen hauptsachlich einzeln lebend 11
10b Zellen in gemeinsamen Schleimkapseln eingeschlossene Mikrokolonien
bildend 13
11a Zellen zylindrisch, stabchenformig, manchmal bohnenformig 12
lib Zellen spindel- bis fadenformig, unregelmafiig gebogen oder eingeschnurt,
manchmal mit in die Lange gezogenen Enden
1 a. Chromatium (Rhabdochromatium) (S. 41)
12a Zellen hell rosarot gefarbt 1. Chromatium (S. 40)
12b Zellen hell goldgelb oder schmutzig dunkelgelb, hyalin oder grau, aber
niemals rosarot 13.Chromatiopsis(S.88)
13a Zellen in einer gemeinsamen Kapsel Diplokokken oder unregelmafiige
kompakte Gruppen bildend 2. Thiocystis (S. 55)
13b Zellen charakteristische Sarzinen bis Pakete in Schleimkapseln bildend ....
3. Thiosarcina (S. 60)
14a Zellen unregelmafiig feste Konglomerate bildend, ohne sichtbare
Schleimkapseln 14. Thiopolycoccus (S. 90)
14b Zellen regelmafiige Tetraden bildend, aus denen sich manchmal grofie
Kolonien in Form einessackartigenNetzeszusammensetzen 15
15a Zellen Tetraden oder sackartige Kolonien in einer sichtbaren Kapsel bildend
4. Thiocapsa (S. 61)
15b Zellen Tetraden oder Sarzinen ohne sichtbare Schleimkapsel bildend
15.Rhodopedia(S.91)
1. Chromatium Perty 1852
Rhabdomonas Cohn 1875, Rhabdochromatium Vinogradskij 1888
Zellen ovoid, vibrioformig, hornchenformig oder bohnenformig, manchmal
auch tonnenformig. Oft in Form von dicken kurzen Stabchen mit abgerundeten
Enden. Meist einzeln lebend; manchmal auch Paare oder kurze Ketten bildend,
die aus 3-20 Zellen zusammengesetzt sind. Die Kettenbildung wird bei einer
hoheren als 2%igen NaCl-Konzentration gefordert. In alten Kulturen kommt es
selten zur Bildung schleimiger Zellgruppen, die morphologisch an manche
kolonienbildende Gattungen, wie Lamprocystis, Amoebobacter, Thiodyction
und Thiopolycoccus, erinnern. Bei ungiinstigem pH-Wert und hoher H2S-
Konzentration werden verschiedene, oft unregelmafiige Involutionsformen ge-
bildet, die als selbstandige Gaming Rhabdochromatium beschrieben wurden.
Zellen gramnegativ, einzeln schwach rosa gefarbt. Zellsuspension in verschiede-
nen Schattierungen orangebraun bis rosaviolett oder purpurfarben. Als
Pigmente kommen hauptsachlich Bakteriochlorophyll a und Karotinoide vor. Ohne
Gasvakuolen. Als Reservestoff werden Schwefeltropfchen in den Zellen gespei-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatium • 41
chert. Aufierdem kommen auch Granula von Poly-fi-Hydroxybuttersaure und
glykogenahnlichen Polysacchariden vor.
Photosynthese bei Licht und Anwesenheit von Schwefelwasserstoff ohne
Bildung von molekularem Sauerstoff; statt dessen entsteht elementarer Schwefel.
Molekularer Wasserstoff wird als Elektronendonator verwendet. Manche Stam-
me haben die Fahigkeit, atmospharischen Stickstoff zu fixieren. Als Wuchsstoff
wird Vitamin B12 benotigt. In Anwesenheit von Bikarbonat oder Azetat sind die
Zellen fahig, einfache organische Verbindungen wie z. B. Salze organischer
Sauren zu zersetzen. Aminosauren als Kohlenstoffquelle konnen jedoch nicht
verwendet werden.
Zellen mit Hilfe polarer Geifteln beweglich, wobei die Geschwindigkeit ihrer
Bewegung ziemlich bedeutend ist und bei grofien Arten einen Wert von 22-
100 (im/s erreicht. In alten Kulturen verlieren sie gewohnlich ihre Beweglichkeit
und bilden Mikrokolonien.
Vermehrung durch Teilung oder Einschnurung. Manchmal sind die Zellen durch
plasmatische Briicken miteinander verbunden, was fur gehemmte Teilung unter
ungunstigen Bedingungen gehalten wird (Krasil'nikov 1932).
Ausmafie nach den verschiedenen Autoren sehr unterschiediich. In Reinkultu-
ren wurde nachgewiesen, dafi die Zellgrofie von der Konzentration organischer
Verbindungen im Medium abhangt. Eine Bestimmung der Arten nur auf Grund
der Zellgrofie ist deshalb unmoglich.
Typus generis: Chromatium okenii (Ehrenberg 1838) Perty 1852
Involutionsformen, die friiher als selbstandige Gattung Rhabdochromatium aufgefafit
wurden, miissen heute der Gattung Chromatium zugeordnet werden:
la. Rhabdochromatium Vinogradskij 1888
Rhabdomonas Cohn 1875
Zellen meist in Form langer Stabchen oder Faden, manchmal spindelformig, keulenformig
oder vollig unregelmafiig.
Fadenartige Formen treten teilweise eingeschnurt auf, so dafi sie einen perlschnurartigen
Eindruck machen. Zellen gewohnlich von einer durchsichtigen Schleimkapsel umhullt, die
nur bei negativer Farbung sichtbar wird.
Rosa und purpurrot gefarbt, mit Assimilationspigmenten, die hauptsachlich aus Karotinoi-
den und dem Bakteriochlorophyll a zusammengesetzt sind. Bei Anwesenheit von
Schwefelwasserstoff und Licht kommt es zur Photosynthese. Elementarer Schwefel wird als Zwi-
schenprodukt in den Zellen abgelagert. Oft bildet sich eine ganze Skala von Ubergangsfor-
men. Vermehrung durch Teilung oder Einschnurung.
Nur manche Zellen mittels polarer Geifieln beweglich.
Zellen bis zu 58 u,m grofi.
Wichtigste Literatur: Vinogradskij 1888, Migula 1895, 1900, Kolkwitz 1909,
Strzeszewski 1913, Isacenko 1914, 1927, Gicklhorn 1920, 1921, Bavendamm
1924, Bersa 1926, de Rossi 1927, Ellis 1929, 1932, Skuja 1948, 1956, van Niel
1948, Krasil'nikov 1949, Bergey's Manual 1957, 1974, Petrova 1959, Schlegel
und Pfennig 1961, Mosenceva und Kondrat'eva 1962, Cohen-Bazire 1963, Krau
et al. 1963, Liaaen-Jensen und Schmidt 1963, Hurlbert und Lascelles 1963,
Schmidt et al. 1965, Pfennig und Lippert 1966, Aasen und Liaaen-Jensen 1967,
Thiele 1968, Triiper und Jannasch 1968, Triiper und Peck 1970, Osnickaja und
Cudina 1978.
Bestimmungsschlussel der Arten
la Zellen stabchenformig, ovoid, bohnen-, keulen- oder tonnenformig, ent-
weder gerade oder schraubenartig gewunden 2
lb Zellen ziemlich langgestreckt, mit abgerundeten oder in die Lange ausgezo-
genen Enden, schrauben- oder fadenformig, auch unregelmaflig geformt,
manchmal eingeschnurt; in Ketten 19
42 • Phototrophe Bakterien - Chromatium
2a Zellmasseauffallendkraftigpigmentiert 3
2b Zellmasseunauffalligrosapigmentiertoderfarblos 23
3a Zellen nicht schraubenformig gewunden 4
3b Zellen kurz, schraubenformig gewunden, vorherrschend vibrioformig.
Zellmassepurpurviolett gefarbt
lc.Chr. okenii (Thiospirillum violaceum)
4a Halophile Art; benotigt fiir das Wachstum 1-3% NaCl; ohne Salzgehalt
sehrpleomorph 2. Chr. buderi
4b Benotigt zum Wachstum kein NaCl, kann jedochhalotolerantsein 5
5a Zellen in der Mehrzahlbreiterals 2,5 |xm 6
5b Zellen in der Mehrzahl schmaler als 2,5 |xm 15
6a Zellen sowohl im Meer als auch im Siifiwasser lebend, beweglich. Zellbreite
nie 10 um erreichend 7
6b Zellen nur in Meerwasser lebend, unbeweglich; mit riesigen Ausmafsen von
10 x 20-25 \im 10. Chr. gobii
7a Schwefeltropfchen sind nur an den Zellpolen vorhanden 8
7b Schwefeltropfchen mehr oder wenigergleichmafsig in der Zelle verteilt . 10
8a Schwefeltropfchen an beiden Zellpolen; in den sich teilenden Zellen sind sie
auch in derTeilungsebene vorhanden 9
8b Schwefeltropfchen nur am geissellosenZellpolvorhanden
3b. Chr. warmingii (Chr. cuculiferum)
9a Zellen 8,0 x 15,0-20,0 umgrofi 3. Chr.warmingii
9b Zellen nur3,5-4,5 X 5,0-10,0 um grofi
3a.Chr.warmingii (Chr.warmingii forma minus)
10a Protoplast nicht ausgesprochen kornig. Zellmassen purpurrot, vorherr-
schendes Karotinoid Okenon 11
10b Protoplast ausgesprochen kornig
Id. Chr. okenii (Chr. densegranulatum)
11a Protoplast ohne Inklusionen von CaC03 12
lib Protoplast mit Inklusionen von CaC03 11. Chr. linsbaueri
12a Zellen zylindrisch, bohnen- oder tonnenformig 13
12b Zellen keulenformig 4a. Chr. weissei(Chr. obovatum)
13a Zellen schmalerals 4,5 um 14
13b Zellen breiter als 4,5 |xm 1. Chr. okenii
14a Zellen 3,0-4,5 (xmbreit 4. Chr. weissei
14b Zellen schmaler als 3,0 um 5. Chr. minus
15a Zellmassen orangebraun oder braunrot gefarbt, Karotinoide der Spirillo-
xanthin-Serie vorherrschend 16
15b Zellmassen purpurviolett, das vorherrschende Karotinoid ist Rhodopinal.
Zellen 1,8-2,1 x 2,0-3,0 (imgrofi 6. Chr. violascens
16a Zellen kugelig oder ovoid 17
16b Zellen stabchenformig 1,2-1,5 (xmbreit 7. Chr. gracile
17a Zellen mit nur einem Schwefeltropfchen, schmaler als 2,0 |xm, gewohnlich
1,2 (xmbreit 9. Chr. minutissimum
17b Zellen mit mehr Schwefeltropfchen 18
18a Schwefeltropfchen gleichmafsig in der Zelle verteilt; Zellen 2,0 |xm breit
oder breiter 8. Chr. vinosum
18b Schwefeltropfchen zu 2-4 grofkenteils an den Zellpolen; Zellen 1,5-2,0 um
breit 13. Chr. vanda
19a Zellen langgestreckt ohne Inklusionen von CaC03 20
19b Zellen mit Inklusionen von Ca C03, Tropfchen elementaren Schwefels und
Granulavon Poly-|3-Hydroxybuttersaure
11a. Chr. linsbaueri (Rhabd^hromatium linsbaueri)
20a Zellen mehr als 3,0 (im breit ^^ 21
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatium • 43
20b Zellen hochstens 3,0 [im breit
8a. Chr. vinosum (Rhabdochromatium gracile)
21a Zellen vorwiegend schraubenformig, mehr als 20 umlang 22
21b Zellenfadenformig,hochstens 10 umlang
8b. Chr. vinosum (Rhabdochromatium minus)
22a Zellen spindelformigmitleicht verjungten Enden
la. Chr. okenii (Rhabdochromatium roseum)
22b Zellen spindelformig mit lang bis fadenformig ausgezogenen Enden
lb. Chr. okenii (Rhabdochromatium fusiforme)
23a Zellen auch in Massen ohne klare Pigmentation 24
23b Zellen in Massen sehr hell, nicht betontrosa gefarbt ... 12. Chr. molischii
24a Zellen ovoid mit einem klaren Schwefeltropfchen 14. Chr.fallax
24b Zellen stabchenformig, manchmal auch ovoid, Schwefeltropfchen fehlen
ganzlich oder sind nicht deutlich 15. Chr. gliscens
1. Chromatium okenii (Ehrenberg 1838) Perty 1852 (Fig. 13a-b)
Monas okenii Ehrenberg 1838, Rhabdomonas rosea Cohn 1875, Bacterium
sulfuratum Warming 1875, Spirillum violaceum Warming 1875, Bacterium
okenii (Ehrenberg 1838) Trevisan 1879, Rhabdochromatium roseum (Cohn
1875) Vinogradskij 1888, Rhabdochromatium fusiforme Vinogradskij 1888,
Bacillus okenii (Ehrenberg 1838) Trevisan 1889, Mantegazzea winogradskyi
Trevisan 1889, Mantegazzea rosea (Cohn 1875) Trevisan 1889, Pseudomonas
okenii (Ehrenberg 1838) Migula 1895, Thiospirillum violaceum (Warming 1875)
Migula 1900, Chromatium sulfuratum (Warming 1875) Isacenko 1927, Lanke-
steron sulfuratum (Warming 1875) Ellis 1929, Chromatium
densegranulatum Skuja 1948.
Zellen auffallend grofi und breit zylindrisch oder tonnenformig, an den Polen
breit abgerundet; mitunter auch in gesunden Kulturen bohnen- bis nierenformig
gebogen oder keulenformig. Immer einzeln lebend, keine Kolonien bildend. Der
Habitus der Zellen ist vom Gehalt an Schwefeltropfchen abhangig; bei grofierer
Menge sind die Zellen dicker und tonnenformig. Unter ungiinstigen Bedingun-
gen bilden sich lang ausgezogene und oft unregelmafiige Involutionsformen, die
urspriinglich als selbstandige Arten beschrieben wurden. Schwefeltropfchen
gleichmafiig in den Zellen verteilt, ofters sind kleinere Tropfchen in grofierer
Menge vorhanden als umgekehrt. Die Tropfchenmenge hangt von der H2S-
Konzentration im Wasser ab. Bei Licht und Anwesenheit von C02, sowie
Abwesenheit von H2S verschwinden die Schwefeltropfchen allmahlich und die
Zellen werden schlanker. In einem H2S- und Azetat-haltigem Milieu werden als
Reservestoffeauch kleine Granulavon Poly-f5-Hydroxybuttersaure gespeichert,
deren Brechungsindex grofier als der des sie umgebenden Zytoplasmas, jedoch
bedeutend kleiner als der der Schwefelglobuli ist. Diese Granula farben sich gut
mit Sudanschwarz B. Als Reservestoffe bilden die Zellen ferner Polysaccharide
und Polyphosphate.
Zellen mit einer polaren Geifiel, die im Lichtmikroskop gut sichtbar ist. Einzelne
Zellen purpurfarben, in grofierer Menge von weinroter Farbung. Als Assimila-
tionspigmente kommen Bakteriochlorophyll a und Karotinoide der Gruppe 3,
mit vorherrschendem Okenon, vor.
Die Zellen sind obligat phototroph und streng anaerob. Schwefelwasserstoff und
elementarer Schwefel werden als Elektronendonatoren verwendet, nicht ver-
wendet werden Thiosulfate, molekularer Wasserstoff und organische Verbin-
dungen. In Anwesenheit von Schwefelwasserstoff und Bikarbonaten werden
Azetate und Brenztraubensaureverbindungen photoassimiliert. Sulfide und
elementarer Schwefel wedk bis zu Sulfaten oxydiert.
44 • Phototrophe Bakterien - Chromatium
(nachSkuja, 1948.-1200X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatium • 45
tung umzukehren, zieht die Geifiel die Zelle hinter sich her; diese Bewegung ist
jedoch viel langsamer.
Zellgrofie sehr variabel, wobei sich die Angaben verschiedener Autoren wesent-
lichunterscheiden. Gewohnlich 5,0-6,3 X 7,5-15,0 (im grofi, mitunterauch bis
zu 1,0 (im breit und 20 (im lang, besonders vor der Teilung. Geifieln 25-30 (im
lang.
In grofien Mengen in stehenden siifien oder salzigen Gewassern aller Art, auch
im Meere, soweit Schwefelwasserstoff enthalten ist. Kommt auch in Schwefel-
quellen vor. Wohl eine kosmopolitische Art. In Salzwasser sind die Zellen
gewohnlich grofier. Ursprunglich aus einem Bergbach in der Nahe von Ziegen-
nain bei Jena (DDR) isoliert.
Es ist nicht klar, ob alle Formen, die von den einzelnen Autoren identifiziert wurden, als die
gleiche Bakterienart angesehen werden konnen. Schon Vinogradskij (1888) macht auf
Ubergangsformen zwischen dieser Art und Chromatium weissei aufmerksam. Ellis (1932)
halt Chromatium weissei, Chromatium minus, Chromatium minutissimum und
Chromatium graa'/e nurfiir Formen von Chromatium okenii. Triiperund Jannasch 1968stellten auf
Grund biochemischer Untersuchungen fest, dafi Chromatium weissei und Chromatium
okenii identisch sind.
Untersuchungen an Reinkulturen haben bewiesen, dafi Involutionsformen, die friiher als
selbstandige Arten der Gattung Rhahdochromatium betrachtet wurden, der Gattung
Chromatium eoenso zugeordnet werden miissen, wie zwei weitere als selbstandige Arten
beschriebene Organismen:
la. Rhahdochromatium roseum (Cohn 1875) Vinogradskij 1888 (Fig. 14a)
Rhahdomonas rosea Cohn 1875, Bacterium sulfuratum Warming 1875, Mantegazzea
winogradskyi Trevisan 1889, Mantegazzea rosea (Cohn 1875) Trevisan 1889, Chromatium
sulfuratum (Warming 1875) Isacenko 1927, Lankesteron sulfuratum (Warming 1875) Ellis
1932.
Zellen unregelmafiig, oft in der Mitte verbreitert und somit spindel- oder birnenformig;
manchmal mit Tendenz zu fadigem Wachstum. Fadenformen infolge Zellteilungen haufig
eingeschnurt und aus 10-30 Zellen bestehend. Enden der spindelformigen Zellen oft einen
Faden bildend. Farbe rosarot, Pigment in den breiteren Zellteilen gewohnlich starker
konzentriert. Zellen mit Schwefeltropfchen gefullt, ohne CaC03. Altere Zellen mit einer
kleinen Vakuole.
Vermehrung durch Querteilung oder Zerreissen der Faden. Freie Zellen mittels polarer
Geifieln wie Flagellaten beweglich. Lange Faden bewegen sich nur ausnahmsweise. In
manchen Fallen konnen sie abgerissen und abgeschwemmt werden.
Maximale Breite bei spindelformigen Formen 10,0 u,m; bei fadenartigen Formen
gewohnlich 5,0 u,m. Zellen 10,0 bis 30,0 u,m, manchmal sogar bis zu 100,0 um lang.
In Schlamm und in stehendem Sufi- und Salzwasser vorkommend, wo Schwefelwasserstoff
und Licht vorhanden sind. Erstmals im Schlamm des Flusses Saale bei Kahla in Thiiringen
(DDR) gefunden.
lb. Rhahdochromatium fusiforme Vinogradskij 1888 (Fig. 14b)
Mit sehr charakteristischer Zellform, schmal spindelformig, an den Enden in stumpfe
Spitzen auslaufend. Geifieln an einem Pol.
Vermehrung durch Einschniirung der Zellen ohne Bildung von Querwanden. Dabei wird
der mittlere Teil der Zelle in die Lange gezogen, immer mehr eingeengt, bis einefadenformi-
ge Verbindung entsteht. Schliefilich zerreifit der Faden, seine Reste bleiben an den Tochter-
zellen haften.
Zellen 25,0-50,0 ^m lang, im mittleren Teil 8,0-9,0 u,m breit.
Krasil'nikov (1949) betrachtet sie als selbstandige Art, wahrend sie in Bergey's Manual
(1957) der Art Rhahdochromatium roseum zugeordnet wird.
lc. Thiospirillum violaceum (Warming 1875) Migula 1900 (Fig. 13c)
Spirillum violaceum Warming 1875
Zellen klein, dick, an den Enden glatt abgerundet, nur hdrnchenformig gekriimmt; sehr
selten schraubig gedreht, nicht zwei voile Windungen bildend. Farbe der Zellen schmutzig
violett. Plasma fein gekornt, in seltenen Fallen mit stark lichtbrechenden
Schwefeltropfchen.
Zellen 3,0-4,0 x 8,0-10,0 um grofi, Windungen 8,0-10,0 u,m hoch und 1,0-1,5 urn breit.
Mit Hilfe ihrer Geifieln stark beweglich.
46 • Phototrophe Bakterien - Chromatium
Fig. 14. Chromatium okenii- Involutionsformen, beschrieben als: a
Rhabdochromatium roseum - (nach Anagnostidis, 1968. - 800X), b Rhabdochromatium
fusiforme - (nach Vinogradskij, 1888. - 800x).
In H2S - haltigem Schlamm und stehendem Sufi- und Salzwasser vorkommend. Urspriing-
lich im Roskilke Fjord (Danemark) und im Sumpf des botanischen Gartens in Karlsruhe
(BRD) gefunden.
Die Zellgrbfie stimmt bei dieser Art auffallend mit Chromatium okenii iiberein, weshalb sie
Warming (1875) zu dieser Art stellt, ebenso Bergey's Manual (1974).
Id. Chromatium densegranulatum Skuja 1948 (Fig. 13d)
Zellen meistens zylindrisch oder langlich ellipsoidisch, an beiden Enden abgerundet.
Meistens gerade, nur manchmal leicht gekriimmt; nicht selten bleiben die Zellen nach der
Teilung eine gewisse Zeit miteinander verbunden. Geifiel polar und basal gelegen, so lang
wie die Zelle oder l,5mal linger. Zellwand wenig deutlich und sehr dunn; Protoplast
besonders an der Zellperipherie auffallend feinkornig, dunkelgoldrosa oder dunkefgelb
gefarbt, mit wenig lichtbrechenden, feinverteilten Schwefeltropfchen.
Bewegune sehr kraftig. Zellen 4,5-8,0 X 8,0-15,0 u,m grofi.
Im Litoral von Siifiwasserseen mit faulenden Pflanzenresten, wo geniigend Schwefelwasser-
stoff und Licht vorhanden sind. Im See Sabysjon in Uppland (Schweden) gefunden.
Durch ihre Farbe ahnelt diese Art der Gattung Chromatiopsis, unterscheidet sich jedoch
durch die Lage der Geifiel und die Innenstruktur der Zelle. Triiper und Jannasch (1968)
geben an, dafi Zellen von Chromatium okenii, die an Mangel von Vitamin Bu leiden,
morphologisch von dieser Art kaum zu unterscheiden sind und schlagen deshalb vor, sie bei
Chromatium okenii einzureihen.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatium • 47
2. Chromatium buderi Triiper et Jannasch 1968
Zellen aufierlich denen von Chromatium okenii ahnlich, grofi, zylindrisch bis
ovoid, mit abgerundeten Enden; ohne Schleimkapseln, keine Mikrokolonien
bildend. Beweglich, mit einem Biindel polarer Geifieln, die im Lichtmikroskop
sichtbar sind; negativ aerotaktisch. Zellen gramnegativ mit Schwefeltropfchen,
die regelmafiig iiber die ganze Zelle verteilt sind. Einzelzellen sind gelblich bis
grau, Zellmassen purpurviolett bis violettrot gefarbt. Als Pigmente enthalten sie
Bakteriochlorophyll a und Karotinoide der 4. Gruppe, insbesondere War-
mingon.
Diese Art ist gewohnlich phototroph, streng anaerob, halophil; sie benotigt
1-3% NaCl im Nahrmedium. In Medien ohne NaCl ist das Wachstum sehr
begrenzt (bis auf 30%, die Zellmorphologie stark beeinflufit. Oft treten tropfen-
oder spindel- bis faserformige Formen auf, die an Involutionsformen von
Chromatium (= Rhabdochromatium) erinnern. Als Elektronendonator sind
Sulfide oder elementarer Schwef el erforderlich. In Anwesenheit von Sulf iden und
Bikarbonaten werden Azetate oder Salze der Brenztraubensaure photoassimi-
liert. Im Dunkeln wachst der Organismus nicht, fixiert auch keinen molekularen
Stickstoff und ist nicht fahig, organische Verbindungen zu verwerten. Vitamin
B12 wird als Wuchstoff benotigt. Vermehrung durch Teilung.
Zellen zur Zeit des exponentiellen Wachstums 3,5-4,5 x 4,5-9,0 (im grofi. In
der stationaren Wachstumsphase kleiner, 3,0 X 4,0 (im. Geifiel l,5-2,0mal
korperlang.
Im Siifiwasserschlamm und in Sumpfen an Flufimiindungen und an Meeresku-
sten auftretend. Wurde aus Salzwasserschlamm der Academy-Bay auf der Insel
Santa Cruz (Galapagos-Inseln) und von verschiedenen Stellen der Barnstable-
Salzmarsch in der Bucht Cape Cod (Massachusetts, USA) und in Sudkalifornien
isoliert.
3. Chromatium warmingii (Cohn 1875) Migula 1900 (Fig. 15a)
Monas warmingii Cohn 1875, Chromatium cuculliferum Gicklhorn 1920,
Chromatium warmingii forma minus Bavendamm 1924, Monas cucullifera
(Gicklhorn 1920) de Rossi 1927.
Zellen morphologisch Chromatium okenii sehr ahnlich, jedoch robuster,
gramnegativ; mit einer grofien polaren Geifiel, die aus einem Biindel von Fasergeifieln
besteht und im Lichtmikroskop gut sichtbar ist. Bewegung rotierend, sehr
lebhaft.
Protoplast hyalin, dicht und nur an den beiden, deutlich abgerundeten Polen mit
dunkelroten Schwefelkornchen, was fiir diese Art spezifisch ist. Die
Schwefeltropfchen sammeln sich vor der Teilung in der Mitte der Zelle parallel zur
Teilungsebene. Nach der Teilung besitzen die Tochterzellen Schwefelkornchen
wieder an beiden Polen. Einzelzellen graurosa bis hellrosa, die Zellsuspension
purpurviolett gefarbt. Die Farbung wird durch die Pigmente
Bakteriochlorophyll a und Karotinoide der Rodopinalserie verursacht. Die wichtigsten
Karotinoide sind Warmingon und Okenon.
Die Art ist obligat phototroph, streng anaerob. Als Elektronendonatoren ver-
wertet sie Sulfide und elementaren Schwefel, Thiosulfate hingegen nicht. In
Anwesenheit von Sulfiden und Bikarbonat werden Azetate und Salze der
Brenztraubensaure photoassimiliert, nicht aber einfache organische Verbindungen.
Als Wuchsstoffe wird Vitamin B12 benotigt. Vermehrung durch Querteilung.
Die Angaben iiber die Ausmafie der Zellen sind bei verschiedenen Autoren recht
unterscniedlich. Altere Angaben nennen 8,0 x 15,0-20,0 (im, wahrend Schlegel
und Pfennig (1961) 3,5-4,5 x 5,0-10,0 (im und Bergey's Manual (1974) 3,5-4,5
x 5,0-11,0 (im angeben^Die Geifiel ist 1,5-2,0 mal korperlang.
48 • Phototrophe Bakterien - Chromatium
Vor allem im stehenden SUfiwasser vorkommend, das Schwefelwasserstoff
enthalt und dem Licht ausgesetzt ist. Urspriinglich wurde die Art aus Buchten
der danischen Kiiste von Stellen mit faulenden Meeresalgen isoliert, spater wurde
sie auch im Fischteich des Schlofiparkes von Ostrau bei Halle/S. (DDR) ge-
funden.
Fig. 15. Chromatium warmingii - a normal entwickelte Zellen, b mittels
plasmatischer Briicken verbundene Zellen - (nach Bavendamm, 1924.- 1000x),
c Zellen mit Schwefeltropfchen, die nur auf dem antapikalen, nicht geifiel tragen-
den Pol auftreten und als Chromatium cuculliferum beschrieben wurden - (nach
Ellis, 1932.- 1000X).
Nach Bergey's Manual (1974) sollen zu dieser Art noch folgende Sippen gestellt werden:
3a. Chromatium warmingii forma minus Bavendamm 1974 (Fig. 15b)
Zellen dick stabchenformig, mit polaren Geifieln lebhaft beweglich. An den Zellpolen mit
Schwefeltropfchen. Grofie 4,0 X 6,0-10,0 um. Kommt im sulfidhaltigen Wasser vor.
Wurde urspriinglich aus Rohkulturen mit kleinen Zellen isoliert und von Bavendamm (1924)
als neue Form beschrieben. Von Krasil'nikov (1949) zu Chromatium cuculliferum gestellt.
3b. Chromatium cuculliferum Gicklhorn 1920 (Fig. 15c)
Monas cucullifera (Gicklhorn 1920) de Rossi 1927
Zellen kugelig bis kurz stabchenformig oder etwas ovoid. Mit einer Geifiel; durch Rotation
um die Langsachse sich fortbewegend. Schwefeltropfchen nur am geifiellosen Zellpol.
Sowohl einzelne Zellen als auch Zellsuspensionen farblos. Vielleicht vermogen sie unter
optimalen Bedingungen Pigmente zu bilden.
Zellen 4,0 x 6,0-8,0 urn grofi, wobei die Grofie fast konstant bleibt.
Im Wasser mit faulenden Algen in einem Teich des Botanischen Gartens von Graz
(Osterreich) gefunden.
4. Chromatium weissei (Perty 1852) van Niel 1948 (Fig. 16a)
Chromatium weissii Perty 1852, Bacillus weissii (Perty 1852) Trevisan 1889,
Bacterium weissii (Perty 1852) Trevisan 1889, Chromatium okenii forma weissei
Ellis 1932, Chromatium ohovatum Skuja 1948.
Zellen stabchenformig, denen von Chromatium okenii sehr ahnlich, an den
Polen jedoch weniger abgerundet, gramnegativ. Mit einer polaren Geifiel. Pig-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatium • 49
ment violett bis braunrot; Farbe in grofieren Zellmengen deutlicher sichtbar. In
den Zellen sind Schwefeltropfchen vorhanden. Als Wuchsstoff benotigen sie
Vitamin B,2. Als Elektronendonator verwerten sie H2S und elementaren Schwe-
fel, nicht jedoch Thiosulfate.
Zellen 3,0-4,0 X 7,0-9,0 (im grofi; vor der Teilung bis zu 11,5 \im lang.
Dieser Organismus kommt gemeinsam mit Chromatium okenii im Sufi- und
Meerwasser mit geniigend Schwefelwasserstoff und Licht vor; ebenso in Schwe-
felquellen. Aus Gewassern mit faulenden Massen von Chara bekannt.
Nach den biochemischen Vergleichstesten von Triiper und Jannasch (1968) soil diese Art mit
Chromatium okenii identisch sein. Beide Autoren weisen auch auf die Ubereinstimmung
mit Chromatium ohovatum hin, das sich nur durch die eiformige Zellgestalt unterscheidet,
und schlagen die Vereinigung beider Arten vor.
4a. Chromatium obovatum Skuja 1948 (Fig. 16b)
Zellen kurz zylindrisch mit einem erweiterten Ende oder kurz keulenformig bis eiformig; an
beiden Enden abgerundet. Protoplast intensiv rosaviolett, mit mehreren axial angeordneten
Schwefeltropfchen. Die basale polare Geifiel ist ungefahr 1 bis 1,5 mal korperlang und auch
an lebenden Zellen gut sichtbar. Bewegung energisch.
Zellen 3,5-7,0 X 7,0-12,0 um grofi; vor der Teilung bis 22,0 urn lang.
Im Litoral von Sufiwasserseen zwischen faulenden Pflanzenresten nicht selten
vorkommend; benotigt Schwefelwasserstoff und Licht. Urspriinglich in Sabysjon in Uppland
(Schweden) gefunden.
16 / a b
Fig. 16. Chromatium weissei - a Zellen mit normalem Habitus - (nach Anagno-
stidis, 1968. - 1200x), b Zellen mit etwas unterschiedlichem Habitus, als
Chromatium obovatum beschrieben - (nach Skuja, 1948. - 1200X).
5. Chromatium minus Vinogradskij 1888 (Fig. 17)
Bacillus minor (Vinogradskij 1888) Trevisan 1889, Bacterium minus
(Vinogradskij 1888) Trevisan 1889, Chromatium okenii forma minus Ellis 1932.
Zellen verhaltnismafiig klein, sonst sehr schwer von Chromatium weissei unter-
scheidbar; mit einer basalen polaren Geifiel.
50 • Phototrophe Bakterien - Chromatium
Schwefeltropfchen im Protoplasten gleichmafiig verteilt. Einzelne Zellen farblos
oder blafirosa, grofiere Zellmengen purpurrot gefarbt. Als wichtigste Pigmente
kommen Bakteriochlorophyll a und das Karotinoid Okenon vor. Zellen ge-
wohnlich phototroph, streng anaerob. Als photosynthetische Elektronendona-
toren werden Sulfide, elementarer Schwefel und Thiosulfate venvertet. In
Anwesenheit von Sulfaten und Bikarbonat werden Glukose, Azetate und Salze
der Brenztraubensaure photoassimiliert. Andere organische Verbindungen kon-
nen nicht venvertet werden. Die Zellen vertragen bis zu 16% Salzgehalt.
Vermehrung durch Teilung.
Zellen nach Vinogradskij (1888) 3,0 x 3,7-7,0 \im, nach Isacenko (1929) 1,7-3,0
x 8,0 \im, und nach Bergey's Manual (1974) 2,0 x 2,5-6,0 [im grofi.
In H2S-haltigen und belichteten, stehenden siifien und salzigen Gewassern
vorkommend, auch aus Schwefelquellen bekannt.
Da eine Reihe intermediarer Formen gefunden wurde, halt Strzeszewski (1913) die Art fur
identisch mit Chromatium weissei. Ahnlicher Meinung sind auch Triiper und Jannasch
(1968), die auf Grund physiologischer Teste dieser Art als fast identisch mit Chromatium
okenii und Chromatium weissei ansehen. Ellis (1932) bezeichnet sie als eine Form von
Chromatium okenii.
Fig. 17. Chromatium minus - (nach Anagnostidis, 1968. - 1400X). Fig. 18.
Chromatium gracile - (nach Anagnostidis, 1968. - 4000 X).
6. Chromatium violascens Perty 1852
Chromatium violaceum Bergey et al. 1923
Morphologisch Chromatium vinosum sehr ahnlich. Zellen kugelig bis ovoid,
manchmal kurz stabchenformig mit abgerundeten Enden; unterschiedlich grofi.
Mit einer polaren Geifiel, beweglich. Protoplast hyalin, mit gleichmafiig verteil-
ten Tropfchen elementaren Schwefels. Einzelzellen farblos oder leicht violett,
Zellsuspension intensiv purpurviolett bis violett gefarbt. Enthalten als Pigmente
Bakteriochlorophyll a und Karotinoide der Gruppe 4.
Die Zellen sind obligat phototroph, anaerob, mancne Stamme auch aerotolerant.
Als Elektronendonatoren werden Sulfide, Thiosulfat^^lementarer Schwefel,
Sulfate und molekularer Wasserstoff venvertet. ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatium • 51
Vermehrung durch Teilung.
Zellgrofie variabel, am haufigsten 1,8-2,1 x 2,0-3,0 \im grofi.
Aus einem Wassergefafi isoliert, in dem sich faulende Uberreste von Chara
befanden. Triiper und Genovese (1968) fanden diese Art im meromiktischen
Salzwassersee Lake Faro bei Messina auf Sizilien (Italien).
Cohn (1975) ist der Meinung, dafi diese An mit Chromatium vinosum identisch
ist.
7. Chromatium gracile Strzeszewski 1913 (Fig. 18)
Chromatium okenii forma gracile Ellis 1932
Erinnert morphologisch sehr stark an Chromatium vinosum. Zellen klein,
gramnegativ; mit einer polaren Geifiel, beweglich.
Schwefeltropfchen gleichmafiig in der Zelle verteilt. Einzelne Zellen farblos,
grofiere Zellmengen ausgesprochen rot gefarbt. Die Zellen sind phototroph. Als
Elektronendonatoren verwerten sie alle Formen reduzierten Schwefels, moleku-
laren Wasserstoff und einige organische Verbindungen. Vermehrung durch
Teilung.
Grofie der Zellen nach verschiedenen Autoren recht unterschiedlich, meistens
1,0-1,3 X 2,0-6,0 \un.
In Schwefelquellen bei Krakow (Polen) gefunden.
Ellis (1932) halt diese Art fiir eine Form von Chromatium okenii.
8. Chromatium vinosum (Ehrenberg 1838) Vinogradskij 1888
(Fig. 19a)
Monas vinosa Ehrenberg 1838, Monas gracilis Warming 1875, Bacillus vinosus
(Ehrenberg 1838) Trevisan 1889, Rhabdochromatium minus Vinogradskij 1888,
Bacterium vinosum (Ehrenberg 1838) Trevisan 1889, Rhabdochromatium gracile
(Warming 1875) Migula 1900, Rhabdomonas gracilis (Warming 1875) Bergey et
al. 1923.
Zellen kurz stabchenformig, manchmal kokkenartig oder ellipsoidisch, verhalt-
nismafiig klein. Polare Geifiel schlecht sichtbar. Schwefeltropfchen in den Zellen
gleichmafiig verteilt. Einzelzellen farblos, Zellmassen anfangs gelblich bis oran-
gebraun, spater braunrot gefarbt. Die Farbung erinnert an die Farbe schwerer
Rotweine, die mit Wasser verdunnt wurden. Als Assimilationspigmente sind
Bakteriochlorophyll a und Karotinoide der Gruppe 1 vorhanden. Die Involu-
tionsformen wurden als selbstandige Art, Rhabdochromatium gracile, be-
schrieben.
Photosynthetische Elektronendonatoren sind alle reduzierten Formen von
Schwefel und molekularer Wasserstoff. Eine Reihe organischer Verbindungen
kann verwertet werden. Die Zellen haben die Fahigkeit, auch in einem sehr
schmalen Spektrum von blauem und griinem Licht zu wachsen. Geringere
Lichtintensitat hat langsameres Wachstum zur Folge.
Die An kommt in grofieren, pfirsichrot gefarbten Gruppen sowohl in
Schwefelquellen als auch in stehendem Sufi- und Salzwasser mit faulenden organischen
Resten und Schwefelwasserstoff vor. Auch aus Abwasserlagunen, Flufimiindun-
gen und Salzwassersumpfen bekannt. Die am haufigsten vorkommende Chro-
matium-Kn. Urspriingfich in einem Gefafi mit faulenden Algen gefunden.
Nach Bergey's Manual (1957) wurden folgende Involutionsformen dieser Art als
selbstandige Arten beschrieben:
8a. Rhabdochromatium gracile (Warming 1875) Migula 1900 (Fig. 19b)
Monas gracilis Warming 1875, Rhabdomonas gracilis (Warming 1875) Bergey et al. 1923.
Zellen viel kleiner als Rhahdadxromatium roseum auch seltener spindelformig. Gewohnlich
stabchenformig, fadenformi^^lindrisch, gerade oder schwach gekriimmt, an einem Ende
52 ■ Phototrophe Bakterien - Chromatium
manchmal dicker, an den Polen stark abgerundet, oft eingeschniirt. Kurzere Zellen beweg-
lich, mit basaler polarer Geifiel. Unter bestimmten Bedingungen scheiden die Zellen Schleim
aus. Im Protoplast Schwefeltropfchen verschiedener Grofie, die in einer Reihe liegen. Die
Zellen lysieren leicht, wobei aber die Schwefeltropfchen erhalten bleiben. Einzelne Zellen
rosa bis hellrot, Zellmassen sattrot gefarbt.
Zellen 1,8-2,2 x 11,0-33,0 (im grofi, manchmal bis zu 60 (im lang und 2,0-3,0 (im breit.
In stehendem Sufi- und Salzwasser, im Schlamm und in Schwefelquellen vorkommend.
Urspriinglich aus einem Sufiwassersumpf bei Kebenhavn (Danemark) beschrieben.
Bergey's Manual (1957) vereinigt mit dieser Art auch Rhodocapsa suspensa, was nach
Bergey's Manual (1974) ein Synonym fiir Thiodyction elegans sein soil.
8b. Rhabdochromatium minus Vinogradskij 1888 (Fig. 19c)
Zellgestalt ebenso veranderlich wie bei den iibrigen Arten. Zellen verhaltnismafiig klein,
langgestreckt, mit abgerundeten Enden, die gleichzeitig etwas verjtingt sind. Oft werden
Faden mit Andeutungen von Einschniirungen gebildet oder solche, die aus miteinander
verbundenen Zellen bestehen. Zellen rosarot gefarbt, mit sehr geringem Schwefelgehalt und
kleinen Schwefeltropfchen.
Zellen maximal 2,9 (im breit, und 5,0-10,0 (im lang. In stehendem Sufi- und Salzwasser, im
Schlamm und in Schwefelquellen vorkommend. Urspriinglich im Schlamm der Saale bei
Kahla in Thiiringen (DDR) gefunden.
Wahrend Krasil'nikov (1949) diese Art fiir selbstandig halt, wird sie in Bergey's Manual
(1957) mit Rhabdochromatium gracile vereinigt.
Fig. 19. Chromatium vinosum - a Individuen mit normaler Morphologie, b
Involutionsformen als Rhabdochromatium gracile beschrieben, c Involutions-
formen als Rhabdochromatium minus beschrieben. Fig. 20. Chromatium minu-
tissimum — (19c nach Bavendamm, 1924, sonst nach Anagnostidis, 1968. - alle
Figuren 2400X).
9. Chromatium minutissimum Vinogradskij 1888 (Fig. 20)
Bacillus minutissimus (Vinogradskij 1888) Trevisan 1889, Bacterium
minutissimum (Vinogradskij 1888) Trevisan 1889, Chromatium okenii forma
minutissimum Ellis 1932.
Zellen grofitenteils kugelig oder ellipsoidisch, mit einer polaren Geifiel, lebhaft
beweglich; gramnegativ. In der Zellmitte befindet sich ein einziger, sehr kleiner
Schwefeltropfen. Einzelne Zellen farblos, in grossen Mengen auffallend pfir-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chromatium • 53
sichrot gefarbt. Die Farbung erinnert an Chromatium vinosum. Als Assimila-
tionspigmente enthalten sie Bakteriochlorophyll a und Karotinoide. Die Zellen
sind phototroph. Als Elektronendonatoren werden Sulfide, Schwefel, Thiosul-
fate, molekularer Wasserstoff und einige organische Stoffe verwertet. Sie sind
streng anaerob, jedoch aerotolerant. Ihre Lebensfahigkeit bleibt auch bei Kon-
takt mit reinem Sauerstoff erhalten. Als Wuchstoff brauchen sie Vitamin B12.
Zellgrofie 1,0-1,2 X 2,0 urn, nach Isacenko (1914) nur 0,5-0,7 X 0,6-1 urn.
In Schwefelquellen und in stehendem Sufi- und Salzwasser nicht selten
vorkommend.
Unsichere, ungeniigend beschriebene Arten:
10. Chromatium gobii Isacenko 1914
Zellen morphologisch mit Chromatium okenii ubereinstimmend, die unter-
scheiden sich jedoch durch bedeutend grofiere Ausmafie. Mit auffallend grofien
Schwefeltropfchen; in vielen Zellen alterer Kulturen kommen Gebilde vor, die
an farblose Vakuolen erinnern. Sie konnen zentral oder auch polar liegen.
Vermehrung durch Teilung. In alten Kulturen verlauft die Teilung ungewohn-
lich langsam und wird oft nicht zu Ende gefiihrt, so dafi es zu biskuitformigen
Involutionsformen kommt. Diese enthalten keine Schwefeltropfchen und sind
unbeweglich.
Zellen 10,0 X 20,0-25,0 urn grofi.
Aus dem nordlichen Eismeer und dem Moeil'noe - See auf der Insel Kil'din
(Barents-See, UdSSR) isoliert. Wahrscheinlich in alien kuhleren Teilen des
Meeres verbreitet. Dieser Organismus bedarf weiterer Untersuchung.
Die Zellgrofie kann von den Wachstumsbedingungen in einem spezifischen
Milieu beeinflufit werden.
11. Chromatium linsbaueri Gicklhorn 1921 (Fig. 21a)
Rhabdochromatium linsbaueri Gicklhorn 1921, Rhabdomonas linsbaueri
(Gicklhorn 1921) van Niel 1948
Zellen denen von Chromatium okenii ahnlich, stabchenformig oder
ellipsoidisch, mit dicker Gallerthulle. Charakteristisch fiir diese Art ist die Bildung von
einem oder zwei Flecken, die in Form von Schleiminseln an der Zelle beliebig
lokalisiert sind. Unter gunstigen Bedingungen bleibt die Zellgestalt unverandert;
eine seltene Ausnahme sind schraubige Zellen in manchen Kulturen. Bewegung
durch basal gelegene polare Geifieln. Aufier Schwefeltropfchen in der Zellmitte
sind auch amorpne Kalziumkarbonat-Einschlusse vorhanden, die an der Zellpe-
ripherie liegen und wie kugelige, farblose oder lichtblaue, stark lichtbrechende
Korperchen aussehen.
Gleichzeitig treten Granula des gut farbbaren Reservestoffes auf (wahrscheinlich
Poly-fi-Hydroxybuttersaure). Die Bedeutung der CaC03-Inklusionen ist bis-
her nicht bekannt. Es ist zweifelhaft, ob sie im Metabolismus eine aktive Rolle
spielen, da sie nur gelegentlich vorkommen; wahrscheinlich ein Abfallprodukt,
das bei der Synthese von Reservestoffen entsteht. Die Zellen sind phototroph.
Bei der Photosynthese werden als Elektronendonatoren Sulfide verwertet und
bis zu Sulfationen oxydiert. Vermehrung durch Teilung.
Zellen 6,0-8,0 X 15,0 um grofi, Gallerthulle 1,0-2,0 urn dick; Kalkinklusionen
1,0-1,5 um grofi.
In stehendem, H2S-haltigem Siifiwasser vorkommend.
Urspriinglich an sumpfigen Stellen von Stiftental bei Graz (Osterreich)
gefunden. Ellis (1932) fand diese Art in einem Teich mit Kalksteinboden in Epping
Forest bei London (England), wo sie im Herbst einige Wochen lang eine blutrote
Farbung des Wassers verursachte.
54 • Phototrophe Bakterien - Chromatium
Zu dieser Art wurde ein zweiter, als selbstandig aufgefafiter Organismus gestellt:
11a. Rhabdochromatium linsbaueri Gicklhorn 1921 (Fig. 21b)
Rhabdomonas linsbaueri (Gicklhorn 1921) van Niel 1948
Zellen denen von Rhabdomonas rosea sehr ahnlich, unregelmafiig, stabchen- oder spindel-
formig, mit polaren Geifieln. Von Chromatium linsbaueri nur durch die Zellform unter-
scheiabar und dadurch, dafi die Art keine charakteristischen Schleiminseln an der Zellober-
flache bildet.
Zellen 3,0-5,0 |im breit und ungefahr 30,0 \im lang; Geifiel 20,0-30,0 \>.m lang.
In belichtetem stehendem Siifiwasser, das faulende organische Uberreste und Schwefelwas-
serstoff enthalt, vorkommend. Manche Autoren sind der Meinung, dafi im Wasser mit
hohem Kalziumgehalt CaC03 auch innerhalb der Zellen der Involutionsformen von
Chromatium okenii, die fruher als selbstandige Art Rhabdochromatium roseum beschrieben
wurden, gespeichert werden kann. Auch die Ahnlichkeit einer Reihe anderer Merkmale
deutet darauf hin, dafi es sich wahrscheinlich um eine Form handelt, die von denUmweltbe-
dingungen im Freiland abhangt.
Fig. 21. Chromatium linsbaueri- a normal entwickelte Zellen (nach Mikropho-
tographie umgezeichnet - Ellis, 1932. - 1200x), b Involutionsformen als
Rhabdochromatium linsbaueri beschrieben - (nach Skuja, 1948. - 1200X).
12. Chromatium molischii (Bersa 1926) van Niel 1948
Pseudomonas molischii Bersa 1926
Zellen stabchenformig mit Inklusionen von Kalziumkarbonat. Einzelne Zellen
farblos, grofiere Mengen lichtrosa gefarbt. Zellen 2,0-2,5 X 8,0 urn grofi.
In Teichen in Osterreich gefunden. ^^
Wenig bekannter und ungenugend beschriebener^Jganismus.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiocystis • 55
13. Chromatium vanda Osnickaja et Cudina 1978
Zellen meistens kugelig oder ellipsoid mit einer polstandigen Geifiel. Die
Zellgrofie ist vom Kulturalter und Substrat abhangig. Gramnegativ.
In einer Zelle kommen 2—4 Schwefeltropfchen vor, gewohnlich an den Polen.
Die Zellen enthalten auch Granula von Poly-(5-Hydroxybuttersaure als Reserve-
stoff. Zellsuspension in jungen Kulturen rosagelb, in alten violettrot. Als
Assimilationspigmente kommen Bakteriochlorophyll a und Karotinoide der
Spirilloxanthin-Serie vor.
Die Ernahrung ist unter anaeroben Bedingungen photolithotroph, wobei nur
Kohlendioxid verwertet wird; auf Azetat, Malat, Sukzinat, Glukose, Saccharose
und Pepton jedoch auch photoorganotroph. Gleichfalls konnen Schwefelwas-
serstoff und reduzierte Schwefelverbindungen verwertet werden, nicht jedoch
Sulfate, Sulfite und Pyrosulfite.
Vermehrung durch Querteilung.
Zellgrofie 1,5-2,0 x 2,5-3,0 [im.
Junge Zellen sind mittels einer polaren Geifiel beweglich. Im Alter nimmt die
Beweglichkeit ab.
Aus dem Schlamm des Vanda-Sees mit erhohtem Salzgehalt im Wright-Tal
(Antarktis) isoliert.
Arten unsicherer Stellung:
14. Chromatium fallax (Warming 1875) Kolkwitz 1909
Monas fallax Warming 1875
Zellen ovoid, etwas unregelmafiig, mit einer polaren Geifiel, beweglich.
Protoplast mit einem Schwefeltropfen, farblos. Auch grofiere Zellgruppen oder
Suspensionen bleiben rein weifi. Aerophile Art.
Zellen 2,0 (xm breit und mehrere \xm lang.
Bildet in stehendem Wasser in den Strafiengraben auf faulenden Blattern Uber-
zuge. Unter Eis in einem Graben zwischen Faulem See und Hohen-Schonhausen
bei Berlin (DDR) gefunden. Offensichtlich ein nicht photosynthetischer
Organismus; seine Einordnung in die Gattung Chromatium ist zweifelhaft. Auch die
Beschreibung ist unzureichend. Wohl zu den farblosen Schwefelbakterien geho-
rend. Bavendamm (1924) stellt diese Art zur Gattung Thiovulum. Skuja (1956)
ist der Meinung, dafi sie identisch mit Macromonas hyalina ist, die er mit
Macromonas minutissima vereinigt.
15. Chromatium gliscens (Ehrenberg 1838) Kolkwitz 1909
Monas gliscens Ehrenberg 1838
Zellen stabchenformig mit abgerundeten Enden, oder ovoid; farblos.
Schwefeltropfchen selten sichtbar oder uberhaupt fehlend.
Zellen ungefahr halb so grofi wie bei Chromatium okenii. In stadtischen schwe-
felhaltigen Gewassern gefunden. Kolkwitz (1909) betrachtet die Art als ein
farbloses Chromatium. Offensichtlich ein nicht photosynthetischer
Organismus, der zu den farblosen Schwefelbakterien gehort.
2. Thiocystis Vinogradskij 1888
Thiothece Vinogradskij 1888, Thiosphaera Miyoshi 1897
Einzelne Zellen kugelig, kurz zylindrisch oder ovoid, oft vor der Teilung in
Form von Diplokokken, die in einer Schleimkapsel liegen; gramnegativ. Durch
Zellteilung in drei zueiMfcler senkrechten Ebenen entstehen grofie, kompakte,
56 • Phototrophe Bakterien - Thiocystis
mehr oder weniger regelmafiige Mikrokolonien von 4-20 und mehr Zellen, die
von deutlich knorpeligem Schleim umgeben sind. Wenn die Kapseln platzen,
zerfallen die Kolonien oft in kleinere Teilkolonien, die sich wieder mit Schleim
umgeben, oder in aktiv bewegliche Zellen. Manchmal zerfallen die Kolonien
auch innerhalb der Kapseln, aus denen sich dann die beweglichen Zellen
hinauszwangen. In Reinkulturen gewohnlich nur in Form einzelner Chroma-
ri«m-ahnlicher Zellen und Diplokokken vorkommend. Nicht selten sind auch
Tetraden vorhanden, die starK an Thiopedia erinnern, oder Pakete von acht
Zellen, die wiederum der Gattung Thiosarcina ahneln. Aufierdem auch grofie
Zellgruppen vom Aussehen der Amoebobakterien und der Gattung Thiocapsa.
Bewegliche Zellen mit einer polaren Geifiel.
In Anwesenheit von Schwefelwasserstoff speichern die Zellen Tropfchen ele-
mentaren Schwefels; als weitere Reservestoffe kommen Polyphosphate,
Polysaccharide und Poly-f3-Hydroxybuttersaure vor. Ohne Gasvakuolen. Einzelzel-
len praktisch farblos, grofiere Zellmassen orange bis rotbraun oder purpur bis
violett gefarbt. Mit Bakteriochlorophyll a und Karotinoiden der Spirilloxanthin-
Serie und der Gruppe 4, der Warming-Serie. Photosynthese nur in Anwesenheit
von Schwefelwasserstoff; keinen molekularen Sauerstoff, sondern elementaren
Schwefel bildend. Molekularer Wasserstoff kann als Elektronendonator verwer-
tet werden.
Typus generis: Thiocystis violacea Vinogradskij 1888
Dieser Gattung wurde auf Grand der morphologischen Ubereinstimmung und der gleichen
Ultrastruktur auch die ursprunglich selbstandige Gattung Thiothece zugeordnet.
2a. Thiothece Vinogradskij 1888
Zellen, uberwiegend kugelformig, verhaltnismafiig klein. Mikrokolonien werden in grofien
Schleimkapseln angelegt. In den Kolonien liegen die Zellen ziemlich weit voneinander
getrennt und bilden grofie Schleimmengen. Einzelne Zellen sind mittels einer polaren Geifiel
beweglich und erinnern an Chromatium.
2b. Thiosphaera Miyoshi 1897
Zellen ovoid, in eine Schleimkapsel eingebettet. Beschreibung vollkommen unzureichend.
Wichtigste Literatur: Vinogradskij 1888, Migula 1895, Miyoshi 1897, Migula
1900, Isacenko 1914, Lauterbom 1915, Bavendamm 1924, van Niel 1931, Ellis
1932, Hama 1933, Sturm und Orlova 1954, Schmidt et al. 1965, Kondrat'eva
1963, Thiele 1968, Pfennig et al. 1968, Triiper und Jannasch 1968, Pfennig und
Triiper 1969, Pfennig und Triiper 1971, Bergey's Manual 1974.
Bestimmungschliissel der Arten
la Einzelne Zellen imDurchschnittbreiter als 2,0 ^m 2
lb Einzelne Zellen hochstens 1,5 ^m breit; dicht gedrangt in einer gemeinsamen
Schleimkapsel. Meistens durch reichliche Schwefeltropfchen fast schwarz
erscheinend 3. Th. rufa
2a Einzelne Zellen im Durchschnitt 2,1-5,5 ^m breit, Schwefeltropfchen im
ganzen Zellvolumen gleichmafiig verteilt. In den Kapseln Zellen zu vielen
Mikrokolonien angehauft. Schichten purpurviolett 1. Th. violacea
2b Einzelne Zellen durchschnittlich 4,0 ^m grofi, Schwefeltropfchen nur an der
Peripherie der Zelle. Zellen in den Kapseln einzeln. Schichten purpurviolett
2. Th. gelatinosa
1. Thiocystis violacea Vinogradskij 1888 (Fig. 22)
Planosarcina violacea (Vinogradskij 1888) Migula 1895
Zellen kugelig oder eiformig, manchmal unter Einflufi des Milieus abnorm grofi
werdend. Unter ungiinstigen Bedingungen werden unregelm'afiige, kleine Kolo-
Scarmed & Djvued by Pahuta Yuri, Katadag 2008, e-mail pahutaqwe@rambler.ru
Thiocystis • 57
nien gebildet; enthalten in einer gemeinsamen Kapsel bis zu 30 Zellen. Normal
entwickelte Kolonien besitzen jedoch nur 10 bis 20 Zellen in einer Kapsel, in
denen die Zellen kleinere, frei liegende Gruppen bilden. Die Struktur erinnert an
kugelige Formen von Zoogloea. In kleinen Kolonien sind die Zellen in deutlichen
Tetraden angeordnet; in grofien Kolonien finden sich unregelmafiige Gruppen
mit frei liegenden Zellen. Manchmal auch kompakte Massen bildend. Bisweilen
losen sich die Schleimkapseln auf, wobei die Zellen frei werden. Diese sind
entweder durch Geifieln beweglich oder bilden Zoogloea-nrtiee Gebilde. Falls
die Zellen beweglich werden, losen sich die Kapseln gewohnlich nur an einer
Stelle auf, an der sich die Zellen dann hinauszwangen. In Reinkulturen fehlt oft
die charakteristische Kapsel; die Zellen leben meist einzeln und sind beweglich.
Schwefeltropfchen unregelmafiig iiber den ganzen Zellinhalt verteilt. Aktiv
bewegliche Zellen besitzen eine polare Geifiel. Manchmal sind auch kleine
Zellgruppen beweglich. Einzelne Zellen undeutlich purpurfarbig, grofie
Kolonien violett gefarbt. Als Pigmente sind Bakteriochlorophyll a und Karotinoide
der Gruppe 4 mit dem vorherrschenden Rhodopinal vorhanden.
Fig. 22. Thiocystis violacea - a Zellkolonie in Schleimkapsel eingeschlossen
(nach Sturm und Orlova, 1954. - 650 X), b einige kleine Teilkolonien in einer
gemeinsamen Kapsel eingeschlossen (nach Vinogradskij, 1888 aus Ellis, 1932. -
650 x), c Teilansicht einer grofien gemeinsamen Kapsel, mit mehreren Teilkap-
seln und einzelnen Kolonien (nach Anagnostidis, 1968. - 650 x), d bewegliche
Zellgruppen (nach Bavendamm, 1924. - 650x), e einzelne bewegliche Chroma-
tium - ahnliche Zellen stark vergrofiert (nach Schlegel, 1972. - 2400X).
58 ■ Phototrophe Bakterien - Thiocystis
Zellen obligat phototroph, anaerob. Als Elektronendonatoren werden Sulfide
und elementarer Schwefel, bei manchen Stammen auch Sulfite und Thiosulfate
verwendet. In Anwesenheit von Sulfiden und Bikarbonat werden Azetate und
Salze der Brenztraubensaure, bei manchen Stammen auch weitere organische
Verbindungen photoassimiliert. Vermehrung durch Teilung.
Angaben uber die Ausmafte der Zellen sehr unterschiedlich. Nach Bergey's
Manual (1957) 2,5-5,5 [im im Durchmesser; nach Migula (1900) und Ellis (1932)
2,7-5,2 (im; nach Sturm und Orlova (1954) 2,1-2,5 X 3,4-4,0 (im und nach
Bergey's Manual (1974) 2,5-3,0 [im grofi.
Im Schlamm, sowie im Sufi- und Salzwasser mit geniigend Sonnenlicht und
Schwefelwasserstoff vorkommend; oft auch in Schwefelquellen.
2. Thiocystis gelatinosa (Vinogradskij 1888) Pfennig et Triiper 1971
(Fig. 23)
Thiothece gelatinosa Vinogradskij 1888, Thiosphaera gelatinosa Miyoshi 1897,
Lamprocystis gelatinosa (Vinogradskij 1888) Migula 1900, Chromatium sphae-
roides Hama 1933.
Zellen kugelig, unter ungiinstigen Bedingungen durch verspatete Teilung lang-
lich ellipsoidisch. Bei hoher Lichtintensitat und geniigend hoher H2S-Konzen-
tration tiegen die Zellen in einer sproden Gallertkapsel betrachtlichen Umfangs.
Unter ungiinstigen Bedingungen sind sie meistens beweglich, wobei jede Zelle
eine Geifiel besitzt. Wahrend der Teilung scheiden die Tochterzellen eine grofie
Menge Schleim aus, so da6 die einzelnen Zellen dann ziemlich weit voneinander
entfernt sind. Viele kleine gleichgrofie Schwefeltropfchen liegen gleichmafiig
verteilt nur an der Peripherie der Zellen. Als Reservestoff konnen
Polyphosphate, Polysaccharide und Poly-P-Hydroxybuttersaure vor. Farbe der einzelnen
Zellen undeutlich hellrosa, oft grauviolett oder schmutziggelb; Zellsuspensionen
sind hingegen purpurrot. Als Pigmente sind Bakteriochlorophyll a und Karoti-
noide der Okenon-Serie bekannt.
Zellen obligat phototroph, streng anaerob.
Photosynthese in Anwesenheit von Schwefelwasserstoff und unter Bildung
elementaren Schwefels. Molekularer Sauerstoff wird nicht gebildet. Als
Elektronendonatoren werden Sulfide und Schwefel verwertet. In Anwesenheit von
Schwefelwasserstoff werden Azetate und Salze der Brenztraubensaure
photoassimiliert, Thiosulfate dagegen nicht. Diese Art ist leicht halophil und benotigt
eine Konzentration von 1% NaCl. Vermehrung durch Teilung, die nur in einer
Ebene erfolgt. Junge Zellen sind beweglich und trennen sich aktiv von der
Kolonie. Frei bewegliche Zellen sind denen der Gattung Chromatium ahnlich.
Die Beweglichkeit hangt von der Lichtintensitat ab; im Dunkeln sind die Zellen
unbeweglich.
Angaben uber die Zellgrofie recht verschieden. Bergey's Manual (1957) fiihrt
4.0-6,0 X 4,0-7,0 (im an. Nach Isacenko (1914) messen die Zellen im
Durchmesser ungefahr 4,0 [im (ausnahmsweise 5,0-5,5 (im). Pfennig und Triiper
(1971) und ebenso Bergey's Manual (1974) geben ungefahr 3,0 (im, Migula
(1900) und Ellis (1932) 4,2 [im im Durchmesser an. Grofie der Kolonien
durchschnittlich 30,0-35,0 (im.
Vereinzelt im Schlamm stehender Siifi- und Salzwasser bei Lichtzutritt und
Schwefelwasserstoffgehalt; auch in Schwefelquellen vorkommend. Oft ist diese
Art im Hypolimnion meromiktischer Seen vorhanden. Im Habitus ahnelt sie den
Blaualgen der Ordnung Aphanothece.
Wegen morphologischer Ahnlichkeit wurden dieser Art n^h folgende, friiher selbstandige
Arten zugeordnet: ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiocystis • 59
Fig. 23. Thiocystis gelatinosa - a verschiedene Formen der Schleimkapseln (nach
verschiedenen Autoren umgezeichnet - 800 X), b bewegliche Chromatium-
ahnliche Zellen stark vergrofiert; durch Starke Lichtbrechung scheinen die
peripher gelegenen Schwefeltropfchen aus der Zellwand hervorzutreten (nach
Pfennig et al., 1968. - 2000x).
2a. Thiosphaera gelatinosa Miyoshi 1897
Zellen ovoid, in freien Schleimkapseln eingeschlossen und 5,0 x 7,0 (Am grofi. Beschreibung
unzureichend.
2b. Lamprocystis gelatinosa (Vinogradskij 1888) Migula 1900
Zellen ellipsoidisch; bilden keine festen Kolonien, die durch farblose Gallerte zu einer
Kapsel verbunden waren. Zellen mit einer grofien Menge von Schwefeltropfchen, leicht
violett gefarbt; unbeweglich. Vermehrung durch Teilung.
Zellen 5,0 x 7,0 (im grofi.
In verschiedenartigen H2S-haltigen Schlammen vorkommend.
2c. Chromatium sphaeroides Hama 1933
Dieser Organismus wurde in NaCl-hakigem FluGwasser in Hiroshima (Japan) gefunden
und irrtumlich zur Ordnung Chromatium gestellt.
Art unsicherer Stellung:
3. Thiocystis rufa Vinogradskij 1888 (Fig. 24)
Zellen kugelig, sehr klein, rot gefarbt und dunkler als Thiocystis violacea. Die
sehr dichten Zellkolonien liegen in einer Schleimkapsel und sind intensiv violett
oder rot bis braunrotgefarbt; die Zellen speichern eine grofie Menge von
Schwefeltropfchen und^^en dann braun oder fast schwarz aus. Eine gemeinsa-
60 • Phototrophe Bakterien - Thiosarcina
Fig. 24. Thiocystis rufa - Teilansicht einer grofien Schleimkapsel (nach Anagno-
stidis, 1968. - 4000X). Fig. 25. Thiosarcina rosea - (nach Isacenko, 1927. -
4000X).
me Kapsel enthalt gewohnlich eine grofie Anzahl dicht aneinander gedrangter
Zellkolonien.
Zellen durchschnittlich kleiner als 1 [im, nach Sturm und Orlova (1954) 1,2-
1,5 (xm messend.
Im Schlamm, in faulenden Gewassern und besonders in Schwefelquellen vor-
kommend, benotigt Schwefelwasserstoff und Sonnenlicht. Wahrscheinlich han-
delt es sich um den Organismus, den Zopf (1882) als eines der Entwicklungssta-
dien von Beggiatoa roseopersicina beschrieben hatte. Bisher wenig untersucht,
bedarf weiterer Untersuchungen.
3. Thiosarcina Vinogradskij 1888
Rhodosarcina Orla-Jensen 1909, Rhodothiosarcina Ellis 1932.
Zellen kugelig, gewohnlich mit einer Gallerthulle, oft in kleinen, wiirfelformi-
gen Paketen mit 8 bis 64 Zellen angeordnet. Durch das Wachstum der Kolonien
werden die Zellen besser sichtbar, da die Kolonien ihren Umfang dadurch
vergrofiern, dafi die Zellen sich etwas voneinander entfernen. Zellen gramnega-
tiv, ohne Gasvakuolen. Sporen werden nicht gebildet. Die Farbe hangt von der
Menge der in den Zellen vorhandenen Schwefeltropfchen ab. Meist sind die
Zellen purpurrot; bei grofien Mengen von Schwefeltropfchen schwarz werdend.
Als Pigmente enthalten sie Bakteriochlorophyll a und Karotinoide, die den
Zellen eine dunkelpurpurne Farbe verleihen. Zellen anaerob; Photosynthese nur
in Anwesenheit von Schwefelwasserstoff unter Bildung von elementarem
Schwefel in Form kleiner Trdpfchen; letztere nur bei manchen Zellen sichtbar.
Molekularer Sauerstoff wird nicht gebildet, molekularer Wasserstoff dient als
Elektronendonator. Zellen meist unbeweglich, nur selten beweglich. Vermeh-
rung durch Teilung in drei zueinander senkrechten Ebenen. Die Zellen strecken
sich zuerst in die Lange, dann wird eine Trennwand parallel der Langsachse und
darauf parallel der kurzeren Querachse gebildet, wodurch vier Zellen entstehen.
Im Schlamm, im stehenden H2S-haltigen Sufi- und Salzwasser sowie in Schwefel-
auellen.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiocapsa • 61
Wichtigste Literatur: Schroeter 1886, Vinogradskij 1888, Migula 1900, Orla-
Jensen 1909, Bavendamm 1924, Ellis 1932, Krasil'nikov 1949, Bergey's Manual
1957, 1974.
Eine einzige Art:
Thiosarcina rosea (Schroeter 1886) Vinogradskij 1888 (Fig. 25)
Sarcina rosea Schroeter 1886, Sarcina sulphurata Vinogradskij 1887, Sarcina
rosacea Migula 1900, Rhodothiosarcina rosea (Schroeter 1886) Ellis 1932.
Mit den Merkmalen der Gattung.
Zellen im Durchmesser 2,0-3,0 [im grofi, Pakete 10 [im breit; vor der Teilung
Zellen bis 6 [im grofi.
Im Schlamm, im stehenden H2S-haltigen Sufi- und Salzwasser sowie in
Schwefelquellen an Stellen mit geniigendem Lichtzutritt vorkommend. Diese Art ist
haufiger als die iibrigen Purpurschwefelbakterien. Oft bildet sie Uberziige an der
Oberfl ache von Sedimenten und am Grunde.
Urspriinglich bei Duszniky-Zdroj in der Nahe von Klodzko (Polen) gefunden.
4. Thiocapsa Vinogradskij 1888
Zellen kugelig oder leicht avoid, in Schleimkapseln liegend. Sehr oft in Form von
Tetraden auftretend, die durch Zellteilung in zwei zueinander senkrechten
Ebenen entstehen. Unter ungiinstigen Bedingungen, insbesondere in freier
Natur, werden mehr oder weniger unregelmafiige Zellgruppen gebildet, die von
einer gemeinsamen Schleimkapsel umgeben sind. Meistens sind diese
Zellgruppen flach und liegen auf einer Unterlage.
Wahrend des Wachstums platzt die Kapsel und die Zellen werden frei. Zellen
gramnegativ; ohne Gasvakuolen. Als photosynthetische Pigmente kommen
Bakteriochlorophyll a und b und Karotinoide der Spirilloxanthin-Serie vor.
Einzelne Zellen kaum merklich gefarbt, Zellsuspensionen orangebraun, rosa
oder purpurrot.
Die Zellen sind phototroph, anaerob; manche Stamme haben jedoch im Dunkeln
unter mikroaerophilen bis aeroben Bedingungen einen oxydativen Metabolis-
mus. Photosynthese in Anwesenheit von Schwefelwasserstoff, wobei als Zwi-
schenprodukt wahrend der Oxydation der Sulfide elementarer Schwefel ent-
steht. Dieser wird innerhalb der Zelle gespeichert. Molekularer Sauerstoff wird
nicht gebildet, molekularer Wasserstoff kann als Elektronendonator dienen. Vor
alien in stehendem H2S-haltigem Siifiwasser bei Lichtzutritt vorkommend.
Einige Stamme wurden auch aus Meerwasser isoliert.
Diese Gattung besitzt mit der Gattung Thiopedia so viele gemeinsame Merkmale, dafi es
manche Autoren nicht fiir zweckmafiig halten, sie getrennt aufzufuhren. Einige Merkmale
stimmen auch mit denen der Gattung Thiocystis iiberein. Zu dieser Gattung sollten auch
Amoebobacter granula und Rhodopedia tetras gestellt werden.
Typus generis: Thiocapsa roseopersicina Vinogradskij 1888
Wichtigste Literatur: Vinogradskij 1888, Bavendamm 1924, Uphof 1927,
Isacenko 1929, Ellis 1932, Bergev's Manual 1957, 1974, Cohen-Bazire 1963,
Triiper und Pfennig 1966, Eimhjellen et al. 1967, Thiele 1968, Eimhjellen 1970.
Bestimmungsschlussel der Arten
la Zellsuspension rosa gefarbt; Zellen vermdgen unter mikroaerophilen oder
aeroben Bedingungen zu wachsen l.Th. roseopersicina
lb Zellsuspension orange bis orangebraun gefarbt; Zellen sind streng anaerob . .
2. Th. pfennigii
62 • Phototrophe Bakterien - Thiocapsa
1. Thiocapsa roseopersicina Vinogradskij 1888 (Fig. 26a)
Thiocapsa floridana Uphof 1927, Thiocapsa minima Isacenko 1929.
Zellen kugelig, einzelne in Schleimkapseln eingeschlossen. Oft werden Diplo-
kokken, Tetraden, grofie Tochterkolonien oder unregelmafiig angeordnete Zell-
gruppen, die in einer gemeinsamen Gallertkapsel liegen, gebildet. Diese Kapseln
verbinden sich nicht selten zu einer farblosen Schleimmasse oder bilden intensiv
rosarote Uberziige. Gelegentlich losen sich die Schleimkapseln auf, die Zellen
werden frei, sedimentieren und konnen neue, in Kapseln eingeschlossene Kolo-
nien bilden. Einzelne Zellen farblos, in grofieren Mengen deutlich rot gef'arbt.
Als Pigmente kommen insbesondere Bakteriochlorophyll a und Karotinoide der
Gruppe 1 mit vorherrschendem Spirilloxanthin vor. Schwefeltropfchen errei-
chen eine betrachtliche Grofie; aufierdem speichern die Zellen als Reservestoffe
Polysaccharide, Polyphosphate und Granula von Poly-P-Hydroxybuttersau-
re.
Zellen phototroph und anaerob; im Dunkeln vermogen sie mikroaerophil oder
in Anwesenheit von einfachen organischen Verbindungen aerob zu wachsen. Als
photosynthetische Elektronendonatoren dienen Sulfide, Thiosulfate, Schwefel
und molekularer Wasserstoff, wobei eine Reihe organischer Stoffe photoassimi-
liert wird. Sulfite werden nicht verwertet. Vermehrung durch Teilung, die in
aufeinander folgenden Generationen abwechselnd in drei zueinander senkrech-
ten Ebenen innerhalb der Schleimkapsel erfolgt. Zellen unbeweglich.
Zellen 2,5-3,0 [im, haufig auch 1,2-1,5 \un im Durchmesser.
Im Schlamm und in stehendem, faulendem Wasser sowie in Schwefelquellen
vorkommend. In grofieren Mengen gewohnlich rote Uberziige auf Schlamm
bildend. Oft auch in Abwassern, in Abwasserlagunen, in Flufimiindungen und
Fig. 26. Thiocapsa roseopersicina - a unregelmafiig angeordnete Zellgruppe in
einer Schleimkapsel, b Kolonie der beigeordnetenArt Thiocapsa floridana -
(nach Anagnostidis, 1968. - 1000X). ^*
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.i
Thiocapsa • 63
im Brackwasser. Der morphologische Bau ist dem der Cyanophyceen-Gattung
Aphanocapsa ahnlich.
Gorlenko (1974) macht darauf aufmerksam, dafi die Art sich von Amoebobacter
roseus nur durch den Mangel an Gasvakuolen unterscheidet. Er betrachtet dies
als einen Beweis der nahen Verwandtschaft. Auch Pfennig (1970) und Bogorov
(1974) konstatieren eine taxonomische Verwandtschaft wegen ihrer Fahigkeit,
reduzierte Schwefelverbindungen unter mikroaerophilen Bedingungen zu oxy-
dieren.
In Bergey's Manual (1974) werden dieser Art auch folgende, friiher als selbstandig angesehe-
ne Sippen zugeordnet:
la. Thiocapsa floridana Uphof 1927 (Fig. 26b)
Zellen kugelig, unregelmafiige Kolonien in den Gallertkapseln bildend. Einzelne Zellen
hellrot, Zellsuspensionen sattrot gefarbt. Zahlreiche organische Verbindungen wurden
verwertet, aber keine Fettsauren mit mehr als drei Kohlenstoffatomen. Zellen
unbeweglich.
Zellen 1,5 [im im Durchmesser.
Im Schlamm, in stehenden Gewassern und Schwefelquellen, wo geniigend Schwefelwasser-
stoff und Sonnenlicht vorhanden sind.
Wahrscheinlich kosmopolitisch verbreitet; urspriinglich im Sand von Palm Springs,
(Florida, USA) gefunden.
lb. Thiocapsa minima Isacenko 1929
Diese Art wurde aus dem Schlamm des Sakra-Sees (UdSSR) isoliert und beschrieben.
Bogorov (1974) beschreibt einen unterschiedlichen Stamm BBS aus dem Aestuar des Weifien
Meeres. Er unterscheidet sich von dem Typenstamm dadurch, dafi er nicht fahig ist, Sulfate
zu reduzieren sowie molekularen Stickstoff zu fixieren; organische Stoffe dienen nur als
Erganzungsquelle zum Kohlenstoff; im Dunkeln vermag er ohne organische Stoffe nur in
Anwesenheit von Thiosulfat und Bikarbonat zu wachsen. Die Ernahrung ist offenbar
chemolithotroph. Die Bewegung erfolgt sehr charakteristisch in Form von impulsiven
Spriingen, was friiher nur fiir Purpurbakterien mit Gasvakuolen als typisch angesehen
wurde (Pfennig und Triiper 1971).
2. Thiocapsa pfennigii Eimhjellen 1970
Thiococcus sp. Eimhjellen et al. 1967
Zellen in Form von einzelnen Kokken sowie paarweise vorkommend. In der
stationaren Wachstumsphase Zellen gewohnlich kleiner als in der logarithmi-
schen Phase. Vor der Teilung sind sie langlich. Manchmal werden auch Ketten
gebildet, die aus vier bis fiinf Zellen bestehen. Mit dunner Schleimkapsel, die
jedoch erst unter dem Elektronenmikroskop sichtbar wird. Zellen ohne
Gasvakuolen; gramnegativ. In schwefelwasserstoffhaltigem Medium besitzen die
Zellen je ein bis drei zentral gelegene Schwefeltropfchen, durch deren starke
Lichtbrechung flussige Kulturen schwach pigmentiert zu sein scheinen. Einzelne
Zellen farblos, Zellmassen orangebraun, etwa wie getrocknete Aprikosen
gefarbt. Verdichtete Zellsuspensionen erinnern im Aussehen an aufgeloste Schoko-
lade und haben einen angenehmen Obstgeruch. Als photoassimilierendes
Pigment enthalten die Zellen Bakteriochlorophyll b und die Karotinoide Tetrahy-
droxispirilloxanthin und Tetrahydroxispirilloxanthinal.
Die Zellen sind obligat phototroph und streng anaerob. Als
Elektronendonatoren fiir die Photoassimilation dienen Sulfide und Schwefel. In Anwesenheit von
Sulfiden und Bikarbonat konnen sie Azetat und Propionan verwerten.
Thiosulfate und weitere organische Verbindungen werden hingegen nicht verwertet. Die
Zellen wachsen am besten bei weifiem Licht, konnen aber auch bei infrarotem
Licht mit einer Wellenlange von 900 nm gut gedeihen. Wuchsstoffe werden
nicht benotigt. Vermehrung durch Teilung in drei zueinander senkrechten
Ebenen. Zellen unbewij^^h.
64 ■ Phototrophe Baktenen - Thiospirillum
Zellen in der stationaren Phase 0,8-1,0 [xm, in der exponentialen Phase 1,2-
1,5 [xm im Durchmesser. Vor der Teilung strecken sie sich bis auf 2,5 (xm.
Im Schlamm und im H2S-haltigen Wasser bei guter Belichtung vorkommend.
Diese Art wurde aus Flufischlamm isoliert und beschrieben.
5. Thiospirillum Vinogradskij 1888
(non Thiospirillum Janke 1924)
Thiorhodospirillum Fuhrmann 1913, Rhodothiospirillum Ellis 1932
Zellen schraubenformig, gramnegativ. Zellgestalt und Windungen der Schrau-
ben sowie Farbe vollig von den Bedingungen im Milieu abhangig. Unter
ungiinstigen Bedingungen sind die Zellen unbeweglich und wachsen in unregel-
mafiigen, in Schleim eingeschlossenen Zellgruppen. Farbung bei einzelnen
Zellen nicht wahrnehmbar oder sepiabraun bis orangebraun; Zellsupensionen in
verschiedenen Schattierungen von orangebraun bis purpurrot gefarbt. Als Assi-
milationspigmente kommen Bakteriochlorophyll a und die Karotinoide der
Gruppe lb und lc der Spirilloxanthin-Serie vor. Ohne Gasvakuolen; Schwefel-
tropfchen werden als Reservestoff gespeichert.
Die Zellen sind anaerob, phototroph. Photosynthese in Anwesenheit von
Schwefelwasserstoff ohne Bildung molekularen Sauerstoffs. Molekularer Was-
serstoff wird als Elektronendonator verwertet. Sulfide werden bis zur Schwefel-
saure oxydiert. Als Wuchsstoffe benotigen sie Vitamine. Die Arten dieser
Gattung konnen heterotroph wachsen, wobei sie die Fahigkeit, Energie
autotroph zu gewinnen, nicht verlieren. Normal entwickelte Individuen sind infolge
ihrer physiologischen Eigenschaften imstande, Schwarme zu bilden, die an jene
von Chromatium erinnern. Zellen mit Hilfe polarer Geifieln beweglich. Ver-
mehrung durch Querteilung.
Typus generis: Thiospirillum sanguineum (Ehrenberg 1840) Vinogradskij 1888.
Wichtigste Literatur: Ehrenberg 1838,1840, Perty 1852, Cohn 1875, Warming
1875, Trevisan 1879, Vinogradskij 1888, Migula 1900, Zacharias 1903,
Fuhrmann 1913, Buder 1915, Bavendamm 1924, Giefsen 1931, Ellis 1932, Hama
1933, Huber-Pestalozzi 1938, Sturm und Orlova 1954, Skuja 1956, Bergey's
Manual 1957, 1974, Schlegel und Pfennig 1961, Kondrat'eva 1963, Pfennig und
Lippert 1966, Pfennig 1962, Schmidt 1963.
Bestimmungsschliissel der Arten
la Zellen breiter als 2,5 [xm 2
lb Zellen weniger als 2,5 [x breit 3
2a Zellen lang schraubenformig; in Suspensionen klar purpurrot
1. Th. sanguineum
2b Zellen in Suspensionen gelblichbraun bis orangebraun 2.Th.jenense
3a Zellen 1,5-2,5 [xm breit 3.Th. rosenbergii
3b Zellen ungefahr 1,0 [xm breit 4.Th.rufum.
1. Thiospirillum sanguineum (Ehrenberg 1840) Vinogradskij 1888
(Fig. 27)
Ophidomonas sanguinea Ehrenberg 1840, Spirillum sanguineum (Ehrenberg
1840) Cohn 1875, Pseudospirillum uliginosum Zacharias 1903.
Zellen zylindrisch, an den Enden manchmal verjiingt, schraubig gewunden. In
der Regel haben die Zellen je zwei Windungen, oft aber auch nur eine oder
mehrere, wobei die Grofie der Schraubenwindungen verschieden ist. An beiden
Zellenden mit Bundeln polarer Geifieln; Zellen beweglich. Einzelne Zellen
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiospirillum ■ 65
ahnlich wie Chromatium okenii grau bis rosarot gefarbt, wahrscheinlich
Karotinoide der Okenonserie enthaltend. Zellgruppen dunkel purpurrot gefarbt.
Schwefeltropfchen treten sehr haufig auf. Die Zellen sind obligat phototroph,
anaerob. Photosynthese in Anwesenheit von Schwefelwasserstoff unter Bildung
elementaren Schwefels. Als Elelktronendonatoren benotigen sie Sulfide, eventu-
ell molekularen Wasserstoff. Zum Wachstum ist Vitamin B12 erforderlich.
Sulfide oder elementarer Schwefel werden bis zu Sulfationen oxydiert. Vermeh-
rung durch Teilung.
Zellen nach Bergey's Manual (1957, 1974), 2,5-4,0 [xm breit und 10-100 fxm
lang; durchschnittlich 40 [xm lang. Windungen gewohnlich 15,0—40,0[xm hoch
una 1/10 bis 1/2 der Hohe breit. Migula (1900) ftihrt eine Windungshohe von
9,0-12,0 [xm und eine -breite von 2/j der Hohe an. Skuja (1956) fand Exemplare,
die nur l,5-2,5[xm breit, 5,0-15,0 [xm lang und mafiig schraubenformig
gewunden waren.
Im Schlamm, in stehendem Wasser, vor allem aber im Meerwasser und iiberall
dort verbreitet, wo genugend Licht und Schwefelwasserstoff vorhanden sind.
Seltener in Schwefelquellen vorkommend. Urspriinglich wurde die Art aus
Meerwasser bei Cuxhaven, Kiel (BRD) beschrieben, spater auch bei Wismar
(DDR) gefunden.
Ehrenberg (1840), Lauterborn (1915), Buder (1915), Bavendamm (1924) und Skuja (1956)
betonen, dafi sich diese Art von Thiospirillum jenense nur durch die Farbe, die kein
verlafiliches systematisches Merkmal ist, unterscheidet. Buder (1915) und Skuja (1956)
halten sie nur fur eine Farbvarietat von Thiospirillum jenense. Bisher wurden noch keine
Vergleichsstudien an beiden Arten durchgefuhrt, um diese Frage zu klaren.
Fig. 27. Thiospirillum sanguineum - (nach Krasil'nikov, 1947. - 1000X).
Fig. 28. Thiospirillum jenense - (nach Anagnostidis, 1968. - 1000X).
2. Thiospirillum jenense (Ehrenberg 1838) Migula 1900 (Fig. 28)
Ophidomonas jenensis Ehrenberg 1838, Spirillum jenense (Ehrenberg 1838)
Trevisan 1879, Rhodothiospirillum jenense (Ehrenberg 1838) Ellis 1932,
Thiospirillum crassum Hama 1933.
Zellen zylindrisch, schraubenformig gewunden, manchmal an den Enden ver-
66 • Phototrophe Bakterien - Thiospirillum
jtingt. Die Anzahl der Schraubenwindungen betragt 0,5-2,5. Rasch wachsende
Kuhuren enthalten kleine Vibrio-'ahnliche, stets gewundene Zellen von ungef ahr
halber Lange, Normal entwickelte Zellen haben an beiden Enden eine kurze,
starke und steife Geifiel, die aus vielen Fibrillen besteht. Die Anzahl der Fibrillen
in den Biindeln ist verschieden, 4-10, manchmal sogar 20. Das geifieltragende
Zellende ist etwas zugespitzt und enthalt keine Schwefeltropfchen, w'ahrend der
ubrige Zellinhalt von ihnen erfullt ist.
Einzelne Zellen goldgelb, olivgriin, sepiaf arben oder rot-braun; in einigen Fallen
sind die Zellen auch farblos; Zellsuspensionen orangebraun gefarbt. Als Pigmen-
te kommen Bakteriochlorophyll a und Karotinoide der Gruppe 1 mit vorherr-
schendem Rhodopin und Lycopene vor. Aufier Schwefel speichern die Zellen
auch Polysaccharide, Polyphosphate und Poly-P-Hydroxybuttersaure.
Die Zellen sind obligat phototroph, anaerob. Zum Wachstum benotigen sie
Vitamin B12. Als Elektronendonatoren werden Sulfide und elementarer Schwefel
verwertet, Thiosulfate hingegen nicht. In Anwesenheit von Sulfiden und Bikar-
bonat werden auch Azetate assimiliert. Vermehrung durch Querteilung. Bewe-
gung sehr lebhaft, Geifieln nach hinten gerichtet, wobei die Bewegungsstabilitat
wesentlich geringer ist als bei Chromatium. Ruckwartsbewegung ebenfalls
moglich, indem die Geifieln tiber das Hinterende nach vorn umgeschlagen
werden.
Zellen 2,5-4,0 [im breit und 30,0-40,0 [im lang; manchmal bis zu 100 [im lang.
Schraubenwindungen 15,0-40,0 [im lang und 3,0-7,0 [im breit; Geifieln 13-
14 \xm lang.
Reichlich in H2S-haltigem Schlamm, im Salz und vor allem im Siifiwasser
vorkommend, selten auch in Schwefelquellen. Die Art braucht gemigend
Licht. Urspriinglich wurde sie in einem Bach bei Ziegenhain in der Nahe von
Jena (DDR) beschrieben, spater auch in der Nahe von Mannheim (BRD)
gefunden.
Als «systematisches» Merkmal, durch das sich diese Art vor allem von
Thiospirillum sanguineum unterscheidet, kommt nur die Farbe in Betracht. Manche
Autoren sind aber der Meinung, dafi beide Arten nicht zu trennen sind. Szafer
(1910) unterscheidet bei Thiospirillum jenense aufierdem noch eine Form «maxi-
ma», die bis 80 [im lange Zellen hat und die am Grund der Quelle Lubien Wielki
(Polen) gefunden wurde.
Wegen unzureichender Unterscheidungsmerkmale wird zu dieser Art heute auch noch die
folgende gestellt:
2a. Thiospirillum crassum Hama 1933
Zellen 3,7-4,0 x 12,0-40,0 urn grofi, gelbbraun gefarbt. Im Siifiwasser und im Brackwasser
(Flufimiindungen) vorkommend.
3. Thiospirillum rosenbergii (Warming 1875) Migula 1900 (Fig. 29)
Spirillum rosenbergii Warming 1875, Thiospirillum coccineum Hama 1933.
Zellen schraubenformig, meist S-formig gewunden, seltener eine ganze Schrau-
benwindung bildend. Protoplasma oft mit Schwefelgranula. Einzelne Zellen
gelblich-orange bis graurosa, meist durch grofiere Mengen der Schwefelgranula
sehr dunkel gefarbt. Vermehrung durch Teilung. Zellen mittels einer polaren
Geifiel beweglich.
Zellen 1,5-2,5 X 4,0-12,0 [im grofi, Windungen 6,0-7,5 \xm hoch und 3,0-
4,0 [im breit.
Im Schlamm, in H2S-haltigem Sufi- und Salzwasser mit gemigendem Lichtzu-
tritt. Wahrscheinlich sehr verbreitete Art, die aber seltener angeftihrt wird, da sie
nicht so auffallig wie die vorigen Arten ist. Ursnrunglich von der Meereskiiste
Danemarks im Winter isoliert und beschriebe^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Amoebobacter • 67
Wegen unzureichender taxonomischer Merkmale wird nach Bergey's Manual (1974) noch
folgende Art dazugestellt:
3a. Thiospirillum coccineum Hama 1933
Im Flufiwasser mit faulenden Algen in Japan gefunden.
Fig. 29. Thiospirillum rosenbergii - (nach Anagnostidis, 1968. - 2000X).
Fig. 30. Thiospirillum rufum - (Orig. - 2000X).
Art unsicherer Stellung:
4. Thiospirillum rufum (Perty 1852) Migula 1900 (Fig. 30)
Spirillum rufum Perty 1852
Zellen schraubenformig gewunden, mit 1,5 bis 4 Windungen, den Zellen von
Spirillum undula sehr ahnlich. An beiden Polen mit wellenartigen Geifielbiin-
deln. Gallertige rote Flecken bildend. Zellen leuchtend rot gefarbt, ohne
Schwefeltropfchen. Nach Gietzen (1931) sollen sie jedoch vorhanden sein.
Zellen 1,0 X 8,0-18,0 (im grofi, Schraubenwindungen 4,0 (xm breit und 4,0 pirn
lang.
Im Schlamm oder in stehenden Gewassern vorkommend. Manchmal auch an
Brunnenwanden gefunden.
Da bei dieser Art bisher keine Schwefeltropfchen gefunden wurden, ist es wahrscheinlich,
dafi sie zur Gattung Rhodospirillum gehort. Auch die Grofie und die Zellgestalt stimmen mit
denen von Rhodospirillum rubrum iiberein. Die von Gietzen (1931) angefertigten Mikro-
photographien beziehen sich wahrscheinlich auf Thiospirillum rosenbergii. Es sind weitere
genaue Untersuchungen an Reinkulturen, die bislang nicht erzielt wurden, erforderlich.
Morphologisch mit Ectothiorhodospira mobilis iibereinstimmend. Unterscheidet sich aber
von letzterer dadurch, dafi die Schwefeltropfchen nicht extrazellular, sondern innerhalb der
Zellen abgelagert werden.
6. Amoebobacter Vinogradskij 1888 emend. Pfennig
et Truper 1971
Rhodothece Molisch 1907
Zellen kugelig oder ovoid, meistens in charakteristischen Zellgruppen ohne
gemeinsame Schleim^^el. Schleimbildung nur ausnahmsweise bei kleinen
68 • Phototrophe Bakterien - Amoebobacter
Kolonien. Wahrend des Wachstums der kleinen Kolonie platzt die Kapsel, und
die durch Schleim verbundenen Zellen treten langsam aus ihr heraus. Kapseln
zweischichtig, aufiere Schicht stark lichtbrechend. Die Form der Kolonien hangt
nicht nur vom Wachstum ab, sondern auch von der Vermehrung der Zellen und
vom Milieu. Zellen gramnegativ, mit einer ausgepragten zemral gelegenen
Gasvakuole. Im peripheren Teil des Protoplasten lagern sich kleine
Schwefeltropfchen ab. Einzelne Zellen farblos, Zellsuspensionen verschieden rosa schat-
tiert bis purpurn gefarbt. Als photoassimilierende Pigmente sind Bakteriochlo-
rophyll a und Karotinoide, unter denen das Warmingon vorherrscht, vor-
handen.
Die Zellen sind phototroph und anaerob. Photosynthese im Licht und bei
Anwesenheit von Schwefelwasserstoff unter Bildungelementaren Schwefels. Als
Elektronendonatoren dienen Sulfide, eventuell auch molekularer Wasserstoff.
Vermehrung durch Teilung der Zellen, die in einer Ebene verlauft. Zellen in der
Regel unbeweglich. Die Arten dieser Gattung besiedeln Schlamm und kommen
in stehenden H2S-haltigem Wasser bei Lichtzutritt vor.
Eine sehr langsame, schleichende Bewegung der Zellgruppen sowohl innerhalb als auch
aufierhalb der Kapsel wurde von Vinogradskij (1888) als charakteristisches Merkmal fvir
diese Gattung beschrieben. Nach Pfennig (1967) soil es sich nicht um eine Eigenbewegung
handeln. Sie tritt bei alien Vertretern dieser Familie auf, die Gasvakuolen fiihren (Lamprocy-
stis, Thiodktyon, Thiopedia, Amoebobacter).
Vinogradskij (1888) nahm irrtiimlich an, dafs die Zellen durch Plasmafaden verbunden
waren, ohne sie jedoch beobachtet zu haben. Weiter war er der Meinung, dafs die Bewegung
durch Konzentrations'anderungen des H2S im Milieu hervorgerufen wird und von der
eventuellen Anwesenheit kleiner Sauerstoffmengen abhangt. Die Gattung Amoebobacter
wurde nach der urspriinglichen Beschreibung neu definiert, weshalb Amoebobacter bacil-
losus mit stabchenformigen Zellen in die Gattung Thiodktyon umgestellt wird.
Typus generis: Amoebobacter roseus Vinogradskij 1888
Wegen morphologischer Ubereinstimmung wurde in diese Gattung auch die friiher selb-
standige Gattung Rhodothece einbezogen:
6a. Rhodothece Molisch 1907
Zellen kugelig, manchmal ovoid, einzeln oder in grofien Zellgruppen lebend; von einer
Schleimkapselumgeben, die erst bei negativer Farbung sichtbar wird. Zentrale Gasvakuolen
ermoglichen den Zellen, im Wasser oder an der Wasseroberflache frei zu schweben.
Schwefeltropfchen peripher gespeichert. Zellen rosa bis rot gefarbt, mit den Assimilations-
pigmenten Bakteriochlorophyll a und Karotinoiden. Photosynthese unter anaeroben Be-
dingungen und bei Anwesenheit von Schwefelwasserstoff, der zu elementarem Schwefel
oxydiert wird. Vermehrung durch Teilung der Zellen, die in einer Ebene verlauft. Zellen in
den meisten Fallen unbeweglich.
In H2S-haltigen Gewassern und auch im Schlamm bei Lichtzutritt vorkommend.
Bavendamm (1924) und Bergey's Manual (1957) bezeichnen diesen Organismus als ein
Entwicklungsstadium der Gattungen Thiopedia und Lamprocystis.
Wichtigste Literatur: Vinogradskij 1888, Migula 1900, Molisch 1906, 1907,
Bavendamm 1924, Ellis 1932, Sturm und Orlova 1954, Skuja 1956, Bergey's
Manual 1957,1974, Schlegel und Pfennig 1961, Schmidt et al. 1967, Thiele 1968,
Cerny et al. 1969, Pfennig und Triiper 1971.
Bestimmungsschlussel der Arten
la Zellen linger als 1,0 (im
lb Zellen in Form von Kokken, 0,5-1,0 [im im Durchmesser, dichte kompakt
Kolonien bildend 3. A.
2a Schleimkapseln der Zellen ohne Farbung nicht sichtbar
2b Schleimkapseln an lebenden Zellen deutlich, Zellen meistens ellipsoi
Koloniensackartig l.A.
3a Ohne Schleimkapseln, Siifiwasserarten
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Amoebobacter • 69
3b Schleimkapseln vorhanden, doch erst nach negativer Farbung sichtbar, in
salzigen Gewassern vorkommend 2. A. pendens
4a Zellen 2,0-3,0 X 2,5-5,0 (im grofi, Zellgruppen entweder im Form von
Tetraedern oder unregelmafiigen Anhaufungen
la. A. roseus (Rhodothece conspicua)
4b Zellen 1,6 X 2,0 [im grofi, niemals grofiere Zellgruppen bildend, hochstens
in Gruppen von drei Zellen 2a. A. pendens (Rhodothece nuda).
1. Amoebobacter roseus Vinogradskij 1888 (Fig. 31a-c)
Rhodothece conspicua Skuja 1956
Zellen verhaltnismafiig grofi, kugelig oder ovoid, oft Kolonien mit deutlichen
Kapseln ohne aufiere Doppelkontur bildend. Altere Kolonien in Form hohler
kugeliger oder sackformiger Gebilde, die an Entwicklungsstadien von
Lamprocystis erinnern. Manchmalschlupfen die Zellen aus den Kapseln, bilden zunachst
miteinander verbunden, trennen sich spater und entfernen sich voneinander. Die
Zellen besitzen im mittleren Teil auffallende Gasvakuolen. Einzelne Zellen
farblos bis hellrosa, Zellmassen sattrosa gefarbt. Als Pigmente kommen
Bakteriochlorophyll a und Karotinoide der Gruppe 1 vor.
Die Zellen sind obligat phototroph, streng anaerob. Elektronendonatoren sind
Sulfide, Schwefel, Thiosulfat, Sulfite. In Anwesenheit von Schwefelwasserstoff
und Bikarbonat vermogen sie Azetate und Salze der Brenztraubensaure, sowie
einige andere organische Verbindungen zu verwerten. Vermehrung durch
Teilung der Zellen, die in einer Ebene erfolgt. Zellen, die aus den Kapseln geschliipft
sind, bewegen sich langsam. Sonst sind sie unbeweglich.
Zellen nach Bergey's Manual (1957) 2,5-3,5 X 6,0 (im grofi, wahrend nach
Bergey's Manual (1974) ein Zelldurchmesser von 2,0-3,0 urn angegeben wird.
Sturm und Orlova (1954) geben einen Durchmesser von 2,9-3,2 X 3,2-3,4 [im,
Migula (1900) und Ellis (1932) 2,8-3,4 urn an. Sich teilende Zellen sind bis zu
6,0 (im lang.
Im Schlamm und in stehenden H2S-haltigen Gewassern unter giinstigen Licht-
verhaltnissen vorkommend gelegentlich auch in salzigen Gewassern und, in
Schwefelquellen. Keine seltene Art.
Gorlenko (1974), Pfennig (1970) und Bogorov (1974) wiesen auf die taxonomische Ver-
wandschaft mit Thiocapsa roseopersicina hin. Gorlenko (1974) beschreibt einen etwas
unterschiedlichen, mikroaerophilen Stamm BL-3, der aus dem Wasser des meromiktischen
StiGwassersees Belovod (UdSSR) isoliert wurde. Er besitzt die Fahigkeit, im Dunkeln unter
aeroben Bedingungen zu wachsen, wobei er zweimal so grofie Zellen bildet, die mit
Schwefeltropfchen so stark gefiillt sind, dafi Gasvakuolen nicht sichtbar sind. Kein
anaerobes Wachstum im Dunkeln.
Von Schlegel und Pfennig (1961) wurde ein Stamm isoliert, der unter giinstigen Bedingungen
morphologisch mit Amoebobacter roseus iibereinstimmt und in Reinkulturen denen von
Amoebobacter pendens gleicht.
Ferner wurde der folgende Organismus hier eingeordnet:
la. Rhodothece conspicua Skuja 1956 (Fig. 31d)
Zellen kugelig, kurz vor der Teilung ellipsoidisch. Einzeln oder in Paaren, manchmal in
tetraederartigen Gebilden mit vier Zellen, nicht selten auch in dichten, annahernd kugelfor-
migen, unregelmafiigen Zellgruppen. Ohne sichtbare Schleimkapseln. Zellen rosaviolett
gefarbt, mit neuen dunklen Schwefeltropfchen und einer Gasvakuole in der Zellmitte.
Vermehrung durch Teilung in drei zueinander senkrechten Ebenen.
Zellen 2,0-3,0 x 2,5-5,0 [im, Zellgruppen 10,0-20,0 (im grofi.
Sowohl im Plankton als auch im Benthos der Binnengewasser vorkommend. Urspriinglich
aus dem Storacksen-See (Schweden) in 22 m Tiefe gefunden und beschrieben.
Anagnostidis und Overbeck (1966) fanden diese Art meist als «formlose» Zellgruppen im
Plufi-See in Ostholstein (BRD). Doit war sie das ganze Jahr hindurch auch in den oberen
Schichten des Hypolimnions vorhanden.
72 ■ Phototrophe Bakterien - Thiopedia
gend Schwefelwasserstoff und Licht vorhanden sind. In Schwefelquellen wurde
diese Art bislang nicht gefunden. Wie Planktonorganismen frei im Wassern
schwebend. Ursprunglich aus faulenden tierischen Uberresten aus dem Seewas-
ser in der N'ahe von Helgoland (BRD) isoliert. Das Wasser war rosarot gefarbt.
Von Schlege] und Pfennig (1961) wurde ein Stamm isoliert, der in gunstigem Milieu wie
Amoebobacter roseus und in Reinkulturen wie Amoebobacter pendens wachst.
Zu dieser Art zahlen Pfennig und Triiper (1971) noch einen bis jetzt als selbstandig
betrachteten Organismus:
2a. Rhodothece nuda Skuja 1956 (Fig. 32b)
Zellen ellipsoidisch, einzeln lebend oder nach der Teilung kurze Zeit in Paaren beisammen
bleibend; kleiner als bei Amoebobacter pendens (= Rhodothece pendens). Sie bilden weder
ausgesprochene Schleimkapseln, wodurch sie sich von Amoebobacter pendens (=
Rhodothece pendens) unterscheiden, noch Ketten oder grofiere Zellgruppen (maximal 3 Zellen).
Einzelne Zellen hellrosa oder fast farblos, mit einer zentralen Gasvakuole. Vermehrung
durch Teilung der Zellen, die in drei zueinander senkrechten Ebenen verlauft.
Zellen 1,6 X 2,0 nm grofi.
Im Hypolimnion und im Plankton des SuRwassers vorkommend. Ursprunglich aus dem See
Blankvatn bei Oslo (Norwegen) beschrieben. Anagnostidis und Overbeck (1966) fanden
diese Art im Plufi-See in Ostholstein (BRD) vorwiegend als Einzelzellen. Das ganze Jahr
hindurch auftretend und nicht ausschliefilich ans Hypolimnion gebunden.
Art unsicherer Stellung:
3. Amoebobacter granula Vinogradskij 1888 (Fig. 33)
Zellen klein, kugelig, oft Paare bildend. Manchmal zu kompakten Kolonien
vereinigt. Peripheres Zellplasma mit niedrigem Lichtbrechungsindex, so dafi die
Umrisse der kleinen Kokken schlecht sichtbar sind und die Zellform nicht richtig
bestimmt werden kann. Zellkolonien manchmal so kompakt, dafi die einzelnen
Zellen nur schwierig zu erkennen sind. Zellen gewohnlich nur mit einem stark
lichtbrechendem Schwefeltropfen, der fast den ganzen Inhalt ausfullt.
Die Schwefelansammlungen verleihen den Zellen eine dunkle bis schwarze
Farbung. Ohne Schwefeltropfen sind die einzelnen Zellen farblos oder nur ganz
fein pigmentiert.
Zellen 0,5-1,0 [im im Durchmesser.
Im Schlamm und in H2S-haltigen stehenden Gewassern bei Lichtzutritt vorkom-
mend. Auch in Schwefelquellen vorhanden. Die Art ist ziemlich haufig, doch
wurde sie bisher noch nicht in Reinkultur isoliert. Die Beschreibung ist unzurei-
chend und nur nach Freiland-Material erfolgt. Die Eingliederung in die Gattung
Amoebobacter ist problematisch. Da in der Beschreibung keine Gasvakuolen
angegeben werden, sollte sie eher zur Gattung Thiocapsa gestellt werden.
7. Thiopedia Vinogradskij 1888
Einzelzellen kugelig bis ovoid oder kurz stabchenartig. Durch Zellteilung
entstehen regelmafiige Gebilde, die flachen, rechtwinkeligen und einschichtigen
Plattchen verschiedener Grofie ahnlich sind; sie enthalten 4, 8, 16, 32 oder 64
Zellen. Die Zellen sind in typischen Tetraden angeordnet. Manchmal bilden sie
grofie Rechtecke, die aus bis zu 1000 Zellen zusammengesetzt sein konnen; sie
sind von einer Gallerthulle umgeben. Die Zellen in den Tetraden sind an den
Beruhrungsflachen etwas deformiert. Durch mechanischen Druck konnen sie
leicht getrennt werden, so dafi das Plattchen in kleinere Fragmente zerfallt. In
Reinkultur wachsen diese bald zur vollen Grofie heran.
Zellen gramnegativ; unter gunstigen Bedingungen und bei Anwesenheit von
Sulfiden im peripheren Protoplasma mit abgelagerten Tropfchen elementaren
Schwefels gefullt. Aufierdem speichern sie als Reservestoff Granula von Poly-(J-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiopedia ■ 73
Hydroxybuttersaure. Im mittleren Teil der Zelle besitzen sie grofie
Gasvakuolen, insbesondere solche Zellen, die im Plankton leben. Sporen bilden sie nicht.
Die Farbe dieser Zellen ist hellpurpur bis fast schwarz; das hangt von der Menge
des Vorratsschwefels in den Zellen ab. Die Purpurfarbe ist nur in grofien
Ansammlungen gut sichtbar. Einzelzellen sind praktisch farblos, grau; nach
Gietzen (1931) rosa. Sie enthalten Bakteriochlorophyll a und Karotinoide der
Okenon-Serie.
Die Zellen sind obligat phototroph, streng anaerob; nach Untermohl (1925)
mikroaerophil. Vetter (1937) stellte fest, dafi sie 0,2-1,0 mg 02/l benotigen. Ihr
Auftreten in der Tiefe hangt von der Sauerstoffkonzentration ab. Photosynthese
in Anwesenheit von Sulfiden, wobei elementarer Schwefel gebildet wird. Als
Elektronendonator dient auch molekularer Wasserstoff. Vermehrung durch
Zellteilung, die in zwei zueinander senkrechten Ebenen erfolgt. Zellen unbeweg-
lich; nur die aus der Kapsel freigesetzen Zellen bewegen sich. Oft im Schlamm
und in faulendem, stehenden Sufi- und Salzwasser mit Schwefelwasserstoffgehalt
sowie in Schwefelquellen vorkommend.
Wichtigste Literatur: Warming 1875, Vinogradskij 1888,Tre visan 1889, Migu-
la 1900, Kolkwitz 1918, Bavendamm 1924, Utermohl 1925, Knipovic 1926, Ellis
1932, Vetter 1937, Sturm und Orlova 1954, Petrova 1959, Gambarjan 1962,
Rodina 1963, Thiele 1968.
Eine einzige Art:
Thiopedia rosea Vinogradskij 1888 (Fig. 34a-b)
(non Thopedia roseo-persicina Vinogradskij 1888 (1952) - lapsus calami)
Erythroconis littoralis Oersted 1840, Merismopedia littoralis (Oersted 1840)
Rabenhorst 1965, Pediococcus roseus (Vinogradskij 1888) Trevisan 1889, Lam-
propedia rosea (Vinogradskij 1888) de Toni et Trevisan 1889, Planococcus roseus
(Vinogradskij 1888) Migula 1895, Thiopedia sevani Gambarjan 1962, Thiopedia
elongata Rodina 1963.
Mit den Merkmalen der Gattung.
Die einzelnen Zellen messen im Durchmesser 1,0-2,0 [im, wie Migula (1900),
Ellis (1932) und Bergey's Manual (1957) angeben. Nach Bergey's Manual (1974)
sind sie 1,0-2,0 X 1,2-2,5 ^m grofi. Sturm und Orlova (1954) geben Zellausma-
fie von 0,5-0,6 X 1,5 [im in den Tetraden an, die dann durch weiteres Wachstum
bis 1,4 X 2,5-2,9 [im erreichen. Die Tetraden messen 2,1 X 3,0 [im.
Eine in belichteten, H2S-haltigen stehenden Gewassern und im Schlamm in
grofien Massen vorkommende Art. Ursprunglich wurde sie an der Kiiste der
Insel Fyn (Danemark) gefunden und von dort beschrieben. Anagnostidis und
Overbeck (1966) fanden sie in grofien Mengen im Plufi-See in Ostholstein
(BRD). Von Knipovic (1926) sogar in einer Tiefe von 750 m Kaspischen Meer
festgestellt.
Obwohl Vinogradskij (1888) und Migula (1900) unregelmafiige Plattchen beschreiben,
schliefit Gietzen (1931) ihre Existenz aus. Ellis (1932) itihrt an, dafi die Regelmafiigkeit der
Plattchen erst bei alten Kulturen gestort wird. Warming (1876) und Kolkwitz (1918)
beschreiben auch das Auftreten doppelter Ketten. Nach Warming (1875) soil es sich umeine
Abart von Chromatium okenii (= Bacterium sulfuratum) oder um kleine Kolonien von
Lamprocystis roseopersicina (= Clathrocystis roseopersictna) handeln. Migula (1900) stellte
diese Art zur Gattung Merismopedia (Cyanophyceae).
Folgende Arten sind mit Thiopedia rosea zu vereinigen:
a. Thiopedia sevani Gambarjan 1962 (Fig. 34c)
Zellen kugelig oder ovoid, Paare oder Tetraden bildend, die in eine Schleimkapsel einge-
schlossen sina. Manchmal treten die Zellen auch einzeln auf. Letztere sind immer kugelig
und ebenfalls in Schleim eingebettet. Einzelne Zellen farblos, in grofieren Mengen kirschrot
oder dunkelbraun gefarbt. Mit mehreren angehauften Schwefeltropfchen; Zellen ohne
74 ■ Phototrophe Bakterien - Thiopedia
34 c
Fig. 34. Thiopedia rosea - a Entwicklung plattchenformiger Kolonien - (nach
Vinogradskij, 1888. - 1000X), b Zellen bei starkerer Vergrofierung mit sichtba-
ren Gasvakuolen. Zellen durch ubermafiige Anhaufung von Schwefeltropfchen
infolge optischer Brechung schwarz aussehend - (nach Anagnostidis, 1968. -
1500X), c Zellen der beigeordneten Art Thiopedia sevani - (nach Mikrophoto-
graphie umgezeichnet - Gambarjan, 1962. - 1000X), d plattchenformige
Kolonien der beigeordneten Art Thiopedia elongata - (nach Rodina, 1963. - 1000X).
Schwefeltropfchen sind selten. Die Zellen sind anaerob, phototroph. Wahrend der Photo-
synthese werden Sulfide und Sulfite verwertet.
Vermehrung durch Teilung, die in zwei zueinander senkrechten Ebenen erfolgt. Nach der
Teilung bleiben die Tochterzellen lange beisammen, wodurch charakteristische Zellgruppen
gebildet werden. In bestimmten Entwicklungsstadien entstehen bewegliche Zellen. Auch
kleine Kolonien konnen sich bewegen.
Zellen in den Tetraden 2,5-3,5 X 3,5-4,0 urn grofi, einzelne kugelige Zellen 3,5 um im
Durchmesser.
Aus dem schwarzem Schlamm des Sees Malyj Sevan (Armenien, UdSSR) wurde ein Stamm
aus einer Tiefe von 50 m isoliert. Die Art bedarf weiterer Untersuchungen an neuen
Isolaten. Es ist vorlaufig nicht klar, ob Gasvakuolen vorhanden sind. Auch die Art der
Bewegung, die Zusammensetzung der Pigmente u. a. musj^^poch geklart werden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiodictyon • 75
b. Thiopedia elongata Rodina 1963 (Fig. 34d)
Zellen zylindrisch, mit etwas abgerundeten Enden, regelmafiige Plattchen bildend, die in
eine Schleimkapsel eingeschlossen sind.
Zellen 1,7-1,8 X 2,2-2,6 urn grofi.
Im Detritus oligosaprober Sufiwasserseen vorkommend, aus den Seen Solov'evskoe und
Bezymjannoe in der Nahe des Ladoga-Sees (UdSSR) beschrieben.
Ellis (1932) beschrieb als Thiopedia rosea einen sehr ahnlichen Organismus, dessen Zellen
annahernd doppelt so lang wie breit sind.
8. Thiodictyon Vinogradskij 1
Rhododictyon Orla-Jensen 1909
Zellen stabchenformig, mit abgerundenten Enden, manchmal auch spindelfor-
mig. Unter bestimmten Umstanden bilden sie charakeristische, breite, unregel-
mafiig netzformige Zellgruppen vom Habitus der Alee Hydrodictyon. Die Zellen
sind an den Enden in der Weise miteinander verbunden, dafi sie einen mehr oder
weniger spitzen Winkel bilden und zu Netzmaschen geschlossen sind.
Manchmal auch eine kompakte Zellmasse bildend oder in Einzelzellen zerfallend. Ohne
sichtbare Schleimkapseln. Zellen gramnegativ, mit einer zentralen Gasvakuole.
Einzelne Zellen praktisch farblos, Zellsuspensionen in verschiedenen purpurvio-
letten Schattierungen. Mit den Pigmenten Bakteriochlorophyll a und Karotinoi-
den. Schwefeltropfchen werden peripher gespeichert.
Die Zellen sind phototroph, anaerob. Photosynthese bei Licht unter Bildung
elementaren Schwefels. Als Elektronendonatoren dienen Sulfide, Schwefel und
molekularer Wasserstoff. Vermehrung durch Teilung der Stabchen. Zellen in
alien Phasen unbeweglich. In Schwefelquellen und in belichtetem H2S-haltigem
Wasser.
Typus generis: Thiodictyon elegans Vinogradskij 1888
Gorlenko et al. (1974) beschreiben einen unterschiedlichen Stamm (wahrscheinlich eine
neue Art), der aus dem meromiktischen Vejsovom-See (Slavjanskaja-Seen, UdSSR) isoliert
wurde. Zellen in Form grofier Stabchen, 2,5-3,0 X 4,0 H, bilden keine Mikrokolonien;
besitzen Gasvakuolen nur an der Peripherie der Zellen, falls der zentrale Teil Tropfchen
elementaren Schwefels enthalt. Verwerten H2S und Thiosulfat.
Wichtigste Literatur: Lankester 1873, Vinogradskij 1888, Migula 1900, Mo-
lisch 1906,1907, Orla-Jensen 1909, Isacenko 1914, 1927, Ellis 1932, Gorovic-
Vlasova 1933, KrasiPnikov 1949, Sturm und Orlova 1954, Bergey's Manual
1957, 1974, Kondrat'eva 1963, Schmidt et al. 1965, Pfennig et al. 1968, Pfennig
und Triiper 1971.
Bestimmungsschliissel der Arten
la Zellen typische netzartige Kolonien bildend 1. Th. elegans
lb Zellen keine netzartigen Kolonien bildend, meist einzeln
2. Th. bacillosum
1. Thiodictyon elegans Vinogradskij 1888 (Fig. 35a)
Thiodictyon minus Isacenko 1914, Thiodictyon elegans forma minus Isacenko
1927, Thiodictyon elegans forma magna Isacenko 1927.
Zellen diinn stabchenformig, manchmal spindelformig und mit zugespitzten
Enden. Zellgruppen in Form eines unregelmafiigen Netzes. Die Gestalt der
netzartigen Gebilde hangt von den aufieren Bedingungen und dem Schwefelwas-
serstoffgehalt ab. Manchmal kompakte Massen bildend, die in einzelne aktiv
bewegliche Zellen zerfallen konnen. Ohne gemeinsame Kapsel. Einzelne Zellen
schwach grau, Zellmassejmurpurviolett gefarbt. Als photoassimilierende Pig-
76 • Phototrophe Bakterien - Thiodictyon
mente sind Bakteriochlorophyll a und Karotinoide der Rhodopinal-Serie, vor
allem das Warmingon, vorhanden. Zellen enthalten eine grofie Zahl von Gasva-
kuolen und kleinen peripheren Schwefeltropfchen als Reservestoff. Infolge ihrer
Anhaufung kann das Plasma schwarz erscheinen. Aufierdem werden Granula
der Poly-|3-Hydroxybuttersaure gespeichert.
Die Zellen sind obligat phototroph, streng anaerob. Als photosynthetische
Elektronendonatoren dienen Sulfide und elementarer Schwefel, wogegen Thio-
sulfate nicht verwertet werden. In Anwesenheit von Sulfiden und Bikarbonat
konnen auch Azetate und Salze der Brenztraubensaure assimiliert werden.
Photosynthese in Anwesenheit von Schwefelwasserstoff, deren Oxydationspro-
dukt elementarer Schwefel ist. Die typischen netzartigen Zellgruppen wurden
nur an Freilandmaterial beobachtet. In Reinkulturen werden nur formlose
Zellmassen gebildet. Vermehrung durch Teilung, nach der die neu entstandenen
Zellpole zunachst abgerundet sind. Erst nach weiterem Wachstum werden sie
spitz. Von grofien Kolonien reifien sich kleinere wenigzellige Kolonien los, die
zu normalen Kolonien heranwachsen.
Einzelne Zellen konnen sich durch aktive Bewegung von der Gruppe trennen.
Zellen nach Bergey's Manual (1957) 1,5-1,7 X 2,5-5,0 Jim grofi, wogegen
Bergey's Manual (1974) Grofien von 1,5-2,0 X 3,0-8,0 \im angibt.
In stehendem, faulendem H2S-haltigem Wasser, im Schlamm und in Schwefel-
quellen vorkommend.
Isacenko (1927) unterscheidet die Formen minus und magna, (Fig. 35 d) die nur
unterschiedliche ZellgroSe haben.
Zu der genannten Art wurde noch die folgende gestellt:
la. Thiodictyon minus Isacenko 1914
Zellen schwach rosa gefarbt, mit etwas verjungten Enden, ohne grofie periphere Schwefel-
granula. Oft in Zellgruppen oder zu netzartigen Gebilden angeordnet. Zellen nur 1,5 X 2,5-
3,0 |im grofi.
Im Schlamm des Mogil'noe-Sees auf der Insel KiPdin in der Barent-See (UdSSR) gefunden.
Fig. 35. Thiodictyon elegans - a typische netzformige Kolonie - (nach Ellis,
1932. - 1000 X), b Unorganisierte Zellgruppe - (nach Ellis, 1932,1927. - 1000 X),
cZellen bei starker Vergrofierung mit gut sichtbaren Gasvakuolen und
Schwefeltropfchen - (nach Anagnostidis, 1968.- 1800X), d Zellen ohne Gasvakuolen, die
von Isacenko (1927) als forma magna beschrieben wurden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiodictyon • 77
2. Thiodictyon bacillosum (Vinogradskij 1888) Pfennig und Triiper
1971 (Figg.36a-b)
Amoebobacter bacillosus Vinogradskij 1888, Rhodocapsa suspensa Molisch 1906
Zellen kurz stabchenformig; unregelmafiige, in Schleimkapseln eingeschlossene
Zellgruppen bildend, Zellen unbeweglich. Keine netzformigen Kolonien. Mit
einer zentralen Gasvakuole und kleinen peripheren Schwefeltropfchen oder
Granula der Poly-|3-Hydroxybuttersaure. Einzelne Zellen undeutlich gefarbt
oder grau; Suspensionen purpurviolett. Als Pigmente sind Bakteriochlorophyll
a und Karotionoide der Rhodopinal-Serie enthalten.
Zellen obligat phototroph und eng anaerob. Photosynthese in Anwesenheit von
Sulfiden, deren Produkt elementarer Schwefel ist. Elektronendonatoren sind
Sulfide und Schwefel. In Anwesenheit von Sulfiden und Bikarbonat werde
Azetate und Salze der Brenztraubensaure verwertet.
Vermehrung durch Teilung.
Nicht haufig im Schlamm und in stehendem Wasser mit faulenden organischen
Stoffen und Schwefelwasserstoff. Auch in Schwefelquellen zu finden; benotigt
jedoch Licht.
Gorovic-Vlasova (1933) halt diese Art fur identisch mit Lamprocystis rosea. Pfennig und
Triiper (1971) stellen zu dieser Art auch den fruher als selbstandigangesehenen Orga-
nismus:
2a. Rodocapsa suspensa Molisch 1906 (Fig. 36c)
Zellen in Form gerader Stabchen oder sehr mafiig schraubenformig gewunden, an beiden
Enden abgerundet, manchmal auch kugelig. Oft werden Zellpaare gebildet, die an Wiirst-
chen erinnern. Jede Zelle liegt in einer farblosen homogenen Schleimkapsel verschiedener
Dicke. Mitunter bilden einzelne Zellen auch lange, teilweise gebogene Faden. Mit alien
Typen von Ubergangsformen. Auch lange Faden immer einzellig, nur wahrend der Teilung
Kapseln mit zwei, seltener drei bis fiinf Zellen. Kapseln nur nach negativer Farbung sichtbar.
Zellen mit Gasvakuolen, die freies Schweben im Wasser ermoglichen. Im peripheren Plasma
werden Schwefeltropfchen gespeichert, die bisweilen in solcher Menge vorhanden sind, dafi
die Gasvakuolen unsichtbar werden. Sporen werden nicht gebildet. Vermehrung durch
Fig. 36. Thiodictyon bacillosum - a einzelne, stark vergrofierte Zellen mit
Schleimkapsel und Gasvakuole, - (2600 X), b durch Schleim verbundene
Zellgruppen, - (1000X), c die beigeordnete Art Rhodocapsa suspensa, - (1000X), (a
una b nach Anagnostidis, 1968; c nach Ellis, 1932).
78 • Phototrophe Bakterien - Lamprocystis
Teilung. Die Zellen werden nach Austritt aus dem Schleim beweglich. Bewegung durch
Rotation um die Langsachse. Manchmal oszillieren die Zellen nur an einem Ende, wahrend
das andere Ende an einer Unterlage festskzt. In den Schleimkapseln sind die Zellen
unbeweglich.
Zellen 1,8-3,5 x 3,5-180,0 um grofi; am haufigsten 10,0-20,0 um lang. Diese Art gehort zu
den grofiten Purpurbakterien.
Diese Art kommt als Planktonorganismus manchmal in solchen Mengen vor, dafi Wolke
gebildet werden. Aus Meerwasser in der Nahe von Triest (Italien) isoliert, wo sie in grofien
Mengen auf faulender Zostera als rosa- bis pfirsichrote Schicht vorkam.
Bergey's Manual (1957) vereinigt diesen Organismus mit Chromatium vinomm (= Rhabdo-
chromatium gracile), wahrend Bavendamm (1924), Molisch (1906) und Krasil'nikov (1949)
ihn als selbstandige Art anfuhren.
9. Lamprocystis Schroeter 1886
Thtoderma Miyoshi 1897
Zellen kugelig oder ellipsoidisch, oft Diplokokken bildend und in
Schleimkapseln eingeschlossen. Je nach den aufieren Bedingungen bilden sie Tetraden oder
Zellgruppen, die in Schleim eingebettet sind. Die kleinen Zellgruppen ahneln
denen der Gattung Thiocystis. Alte Mikrokolonien sind innen hohl und werden
sackartig. Die Zellgruppen konnen entweder in kleine Haufchen, die selbstandig
beweglich sind, oder auch in bewegliche Einzelzellen zerfallen. In Reinkulturen
kommen meistens im Schleim liegende Einzelzellen vor. Mit polaren Geifieln.
Zellen enthalten Bakteriochlorophyll a und Karotinoide. Zellsuspensionen in
verschiedenen purpurroten Schattierungen. Zellen gramnegativ, mit zentralen
Gasvakuolen.
Die Zellen sind anaerob, phototroph. Photosynthese nur in einem H2S-haltigen
Milieu, wobei elementarer Schwefel gebildet wird und sich als Reservestoff um
die Gasvakuole ablagert. Molekularer Wasserstoff kann als Elektronendonator
dienen. Vermehrune durch Querteilung. In stehendem Wasser, das Sulfide
enthalt und dem Licht ausgesetzt ist, sowie im Schlamm vorkommend. Auch in
Schwefelquellen vorhanden. Vertreter dieser Gattung wurden auch im Schwar-
zen Meer in einer Tiefe von 225 m gefunden. Bislang nur die Leitart ausfuhrlich
beschrieben; die ubrigen Arten sind ungeniigend bekannt.
Typus generis: Lamprocystis roseopersicina (Kutzing 1849) Schroeter 1886
Wichtigste Literatur: Kutzing 1833, 1845, 1849, Cohn 1864, Rabenhorst 1868,
Lankester 1973, 1976, Zopf 1882, Migula 1895, 1900, Miyoshi 1897, Isacenko
1914, Bavendamm 1924, Ellis 1932, Sturm und Orlova 1954, Bergey's Manual
1957, 1974, Gietzen 1931, Krasil'nikov 1949, Kondrat'eva 1963, Pfennig et al.
1968.
Bestimmungsschliissel der Arten
la Kolonien ohne symbiotischeBakterien 2
lb Kolonien mit symbiotischen farblosen, stabchenformigen Bakterien an der
Oberflache 5. L. symbiotica
2a Zellen hochstens 2,5 jimlang 3
2b Zellen ungefahr 4,0 (im lang, Kolonien rot gefarbt 4. L. rubra
3a Kolonien festsitzend 4
3b Kolonien nicht festsitzend, netzformig. Zellen oft durch die Beruhrung mit
den Nachbarkolonien zu Polydern deformiert 1. L. roseopersicina
4a Kolonien in Form roterUberziige auf submersen Grasern 2. L. rosea
4b Kolonien kugelformig, an Faden von Thiothrix nivea 3.L. violacea
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Lamprocystis • 79
1. Lamprocystis roseopersicina (Kutzing 1849) Schroeter 1886
(Fig. 37)
Micraloa rosea Kutzing 1833, Microhaloa rosea (Kutzing 1833) Kutzing 1843,
Cryptococcus roseus (Kutzing 1833) Kutzing 1845, Protococcus roseopersicinus
Kutzing 1849, Palmella persicina Cohn 1864, Pleurococcus roseopersicinus
(Kutzing 1849) Rabenhorst 1868, Cohnia roseopersicina (Kutzing 1849) Winter 1884,
Clathrocystis roseopersicina (Kutzing 1849) Cohn 1875, Planosarcina
roseopersicina (Kutzing 1849) Migula 1900, Clathrococcus roseopersicinus (Kutzing 1849)
Schmidt et Weis 1902.
Zellen kugelig oder eiformig, vor der Zellteilung mehr langlich. In grofiere oder
kleinere Gallertkapseln eingeschlossene Kolonien bildend. Zellen hier dicht
aneinander liegena und polyedrisch abgeplattet. Grofie Kolonien zerfallen in
Zellgruppen, die sich zu einem netzahnlichen Gebilde vereinigen. Sie konnen
auch in einzelne bewegliche Zellen zerfallen, die wieder neue Kolonien entwik-
keln. Manchmal sind auch bewegliche, wenigzellige Gruppen vorhanden. Letz-
tere kommen im Material aus dem Freiland vor, wahrend in Reinkulturen nur
unregelmaSige Zellgruppen gebildet werden. Zellen mit Gasvakuolen und bei
beweglichen Stadien auchmit polaren Geifieln. Einzelne Zellen graurosa, Zell-
massen purpurn, purpurviolett oder violett gefarbt. Als Assimilationspigmente
herrschen Bakteriochlorophyll a und Karotinoide der Lycopenal-Serie vor.
Die Zellen sind obligat phototroph und streng anaerob.
Photosynthese in Anwesenheit von Schwefelwasserstoff und Licht, wobei
elementarer Schwefel gebildet und in Form von Tropfchen gespeichert wird. Als
Reservestoff kommen ferner Granula der Poly-P-Hydroxybuttersaure vor. Als
Elektronendonatoren dienen Sulfide und Schwefel. In Anwesenheit von Sulfiden
und Bikarbonat konnen auch Azetate und Salze der Brenztraubensaure verwer-
tet werden.
Vermehrung durch Zellteilung innerhalb der Kolonien in zwei Ebenen, die
zueinander senkrecht stehen. Zellen in Kolonien unbeweglich, freie Einzelzellen
jedoch mittels einer polaren Geifiel aktiv.
Nach Bavendamm (1924) 2,0-2,5 (im im Durchmesser. Nach Gietzen (1931) bis
zu 3,1 (im, nach Sturm und Orlova (1954) 2,0-3,5 (im und nach Bergey's
Manual (1974) 3,0-3,5 (im grofi. Kolonien sehr verschieden grofi, vom Alter der
Kolonien und vom Milieu abhangig.
In Schwefelquellen, im Schlamm und in stehendem Su6- und Salzwasser mit
faulendem organischen Material vorkommend. Diese Art benotigt Licht zum
Wachstum. Urspriinglich auf faulenden Chara-Arten bei Halle/S. (DDR)
gefunden. Isacenko (1914) fand einen ahnlichen Organismus im Sufiwassersee
Mogil'noe ozero auf der Insel Kil'din in der Barent-See (UdSSR). In grofien
Mengen von Anagnostidis und Overbeck (1966) auch im Plufi-See in Ostholstein
(BRD) beobachtet.
Zopf bezeichnet (1882) diesen Organismus als ein Entwicklungsstadium von
Beggiatoa roseopersicina.
Arten unsicherer Stellung:
2. Lamprocystis rosea (Miyoshi 1897) Migula 1900
Thioderma roseum Miyoshi 1897
Zellen kugelig oder ellipsoidisch mit feinen Schleimkapseln, diinne, matt pur-
purrotc Oberzuge bildend.
Zellen durch sehr kleine Schwefeltropfchen hellrot gefarbt.
Vermehrung durch Zellt^kig. Diese Art ist unbeweglich; doch soil sie nach
80
Phototrophe Baktenen - Lamprocysti.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Lamprocystis ■ 81
Migula (1900) beweglich sein und Schwarme von Zellen bilden, die manchen
Vertretern der Gattung Chromatium ahneln.
Zellen in der Regel 1,5 x 2,5 \im grofi.
In Boden, auf Schlamm und auf submersen Grashalmen und Blattern, aber auch
in den 27 °C warmen Schwefelquellen Jizai-Ju (Japan) gefunden.
Unzureichend beschriebene und schlecht bestimmbare Art. Oft wird sie als
taxonomisches Synonym von Lamprocystis roseopersicina aufgefafit. Gorovic-
Vlasova (1933) halt diesen Organismus fiir identisch mit Thiodiayon hacillosum
(= Amoehohacter haallosus).
3. Lamprocystis violacea (Miyoshi 1897) Migula 1900
Thiosphaenon violaceum Miyoshi 1897
Zellen in Form von Kokken oder ellipsoidisch, kugelige feste Kapseln bildend, in
denen die einzelnen Tochterkolonien durch Gallerte verbunden sind. Zu unre-
gelmafiigen festsitzenden Haufen vereinigt, die an manche Gebilde von Zoogloea
erinnern. Zellen mit einem kleinen polygonalen Schwefeltropfchen; Plasma
hellviolett gefarbt. Vermehrung durch Teilung. Zellbewegung nicht mit Sicher-
heit beobachtet, obgleich Migula (1900) und Ellis (1932) der Ansicht sind, dafi
diese Art beweglich und schwarmfahig ist.
Ellipsoidische Zellen 1,8-2,5 Jim grofi, kugelige Zellen 1,5 Jim im Durchmesser.
Kolonien ungefahr 15,0 \im im Durchmesser.
Auf toten Faden von Thiothrix nivea lebend. Bislang nur einmal in den heifien
Yumoto-Quellen bei Nikko (Japan) gefunden.
Diese Art ist schlecht bestimmbar und unzureichend beschrieben; wahrschein-
lich mit Thiocystis violacea identisch.
4. Lamprocystis rubra (Miyoshi 1897) Migula 1900
Thioderma ruhrum Miyoshi 1897
Zellen ellipsoidisch unbeweglich, hellrot gefarbt. Kolonien rot wie Pfirsichblii-
ten, lederartig, von der Unterlage leicht zu entfernen. Vermehrung durch
Teilung. Unbeweglich; nach Migula (1900) jedoch beweglich und
schwarmfahig.
Zellen 2,0 x 14,0 \im grofi.
In H2S-haltigen Schlammen von Schwefelquellen in Japan gefunden.
Oft wird die Art als Synonym von Lamprocystis roseopersicina angesehen.
5. Lamprocystis symbiotica Ponomarev 1929
Zellen kugelie oder ovoid; purpurviolette, kugelige oder langlich ovale, feste
Kolonien bildend, die im Alter sackartigen Netzen ahneln. An den Kolonien
bildet sich eine Schicht farbloser stabchenformiger, symbiotischer Bakterien, die
senkrecht zur Kolonieoberflache stehen.
Vermehrung durch Teilung. Bewegliche Formen entstehen durch Zerfall alter
Kolonien. Zellen 1,3-3,0 Jim grofi, Koloniegrofie sehr variabel. Die symbioti-
schen Bakterien sind 0,5 x 2,0-30 jim grofi.
Im Wasser auf verschiedenen faulenden Gegenstanden diinne purpurviolette
Uberzuge bildend. Bisher nur an einem Standort (Sernovodsko - Samarskoe See
UdSSR) gefunden und unzureichend beschrieben.
Fie. 37. Lamprocystis roseopersicina - a stark vergrofierte Zellen, mit grofien gut
sichtbaren Gasvakuolen - (nach Anagnostidis, 1968. -1500 x), h-d Entwicklung
von kugelformigen Kolonien (nach Cohn, 1875. - 1350X), e-g Entwicklung
einer netzartigen Kolonie (nach Bavendamm, 1924; Liebmann, 1962. - 1350x),
h eine grofie netzartige Kolonie (nach Cohn, 1875. - 150x).
82 • Phototrophe Bakterien - Ectothiorhodospira
10. Ectothiorhodospira Pel's 1936
Zellen stabchenformig, leicht gebogen oder schraubenartig gewunden, mittels
polarer Geifieln beweglich. Unter ungiinstigen Bedingungen wachsen sie zu
unregelmafiigen Zellgruppen heran, die von Gallertkapseln umgeben sind.
Zellen gramnegativ, ohne Gasvakuolen. Schwefeltropfchen werden nicht im
Protoplasma gespeichert, sondern lagern sich aufierhalb der Zellen in ihrer Nahe
ab. Einzelne Zellen farblos, grofiere Zellmengen in verschiedenen Schattierun-
gen von braun bis rot gefarbt. Als photoassimilierende Pigmente kommen
Bakteriochlorophyll a und Karotinoide der Spirilloxanthin-Serie vor, von denen
das Spirilloxanthin vorherrscht, Zusammensetzung der Karotinoide bei
Ectothiorhodospira shaposhnikovi und Ectothiorhodospira mohilis recht ahnlich.
Die Zellen sind anaerob Photosynthese in Anwesenheit von Schwefelwasserstoff
der zu elementarem Schwefel oxydiert und ins umgebende Milieu ausgeschieden
wird. Elektronendonatoren sind Sulfide oder molekularer Wasserstoff. Zwei
Arten sind halophil, eine Art braucht hingegen kein Salz. Vermehrung durch
Einschniirung und darauffolgende Teilung. Im Schlamm, in Sedimenten und im
Sufi- und Salzwasser uberall dort, wo Schwefelwasserstoff aus faulenden organi-
schen Stoffen zur Verfiigung steht. Einzelne Arten dieser Gattung wurden auch
aus Meerwasser isoliert.
Die Bestimmung der Arten allein auf Grund ihrer morphologischen Eigenschaf-
ten ist recht problematisch. Eine genaue Bestimmung kann nur an Hand von
Kulturen, sowie physiologischer und biologischer Merkmale erfolgen.
Typus generis: Ectothiorhodospira mohilis Pel's 1936
Wichtigste Literatur: Van Niel 1931, Pel's 1936, Cesnokov und Sapoznikov
1936, Sapoznikov 1937, Kondrat'eva 1956, 1963, Kondrat'eva und Malofeeva
1964, Nesterov et al. 1966, Raymond und Sistrom 1967, 1969, Kondrat'eva et al.
1968, Remsen et al. 1968, Triiper und Takacs 1968, Triiper 1968, Cerny et al.
1969, Gusev et al. 1969, 1970, Kondrat'eva und Rubin 1970, Zachvataema et al.
1970, Novikova 1971, Schmidt und Triiper 1971, Firstov et al. 1972, Matheron
und Baulaigue 1972, Uspenskaja und Kondrat'eva 1972, Imhoff und Triiper
1977.
Bestimmungsschliissel der Arten
la Zellen brauchen kein NaCl in den Nahrlosungen oder doch nur in niedriger
Konzentration(biszu3%);mitpolarenGeifielbiindeln 2
lb Zellen extrem halophil, benotigen eine Konzentration von 11-22% NaCl;
mit bipolaren Geifieln 3
2a Zellen in Form kurzer Spirillen; benotigen 2-3% NaCl in den
Nahrlosungen; Optimales pH 7,6-8,0 I.E.mobilis
2b Zellen meist in Form kurzer gerader Stabchen; benotigen weniger als 1%
NaCl im Medium; Optimales pH 8,0-8,5 2. E. shaposhnikovii
3a Zellen enthalten uberwiegend Bakteriochlorophyll a; von Karotinoiden
dominiert Spirilloxanthin. Sulfate werden nicht durch Assimiliation redu-
ziert. Zellen 0,8 Jim breit. Optimales pH 7,4-7,9 3. E. halophila
3b Zellen enthalten uberwiegend Bakteriochlorophyll b; von Karotinoiden
dominiert Rhodopin. Sulfate werden durch Assimilation reduziert. Zellen
0,5-0,6 Jim breit; Optimales pH 8,1-9,1 4. E. halochloris
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Ectothiorhodospira • 83
1. Ectothiorhodospira mobilis Pel's 1936, emend. Triiper 1968
(Kg- 38)
(non Ectothiorhodospira mobile Pels 1936)
Zellen zynlindrisch, m'afiig und kurz schraubenformig gewunden, weniger als
eine Schraubenwindung bildend. Kurz nach der Teilung sind die Zellen vibrio-
formig, wahrend vor der Teilung beide Tochterzellen eine ganze Windung
bilden. In alten Kulturen kommen unregelmafiige, manchmal verzweigte Invo-
lutionsformen vor. Mit einem Biindel polarer Geifieln an beiden Zellpolen;
beweglich.
Zellen gramnegativ, ohne Gasvakuolen. Einzelne Zellen sind farblos, Suspensio-
nen photoautotroph wachsender Zellen deutlich rot gefarbt. Photoheterotroph
wachsende Zellen sind braunrot. Als Pigmente sind Bakteriochlorophyll a und
Karotinoide unter denen Spirilloxanthin vorherrscht, vorhanden. Als Reserve-
stoff werden Polysaccharide, Polyphosphate und Granula der Poly-P-Hydroxy-
butters'aure in den Zellen gespeichert.
Die Zellen sind obligat phototroph, streng anaerob; photoautotroph und auch
fakultativ photoheterotroph. Photosynthese unter Bildung elementaren Schwe-
fels. Als Elektronendonatoren dienen Sulfide, Schwefel, Thiosulfate, Sulfite und
eine ganze Reihe organischer Stoffe. Aufierdem sind die Zellen obligat halophil,
denn sie benotigen 2-3% NaCl im Medium; konnen jedoch auch noch mafiig
wachsen, wenn der Salzgehalt bis zu 14% betragt, wobei sich die Morphologie
der Zellen bis zu einer Konzentration von 10% nicht andert. Bei 1% Salzgehalt
werden die Zellen dagegen unregelmafiig. Ohne NaCl und in Anwesenheit
organischer Stoffe unter aeroben Bedingungen ist kein Wachstum moglich.
Diese Art besitz die Fahigkeit, elementaren Schwefel durch elementares Selen zu
ersetzen, das sie wahrend der Photosynthese zu Selenat oxydiert. Kann Sulfate
durch Assimilation reduzieren. Optimale Wachstumstemperatur 25-29 °C,
optimaler ph-Wert 7,6-8,0.
Vermehrung durch Teilung, nie durch Knospung.
Zellen 0,7-1,0 X 2,0-2,6 Jim grofi. Vor der Teilung werden die Zellen bis zu
4,8 Jim lang. Schraubenwindungen durchschnittlich 1,4 Jim breit und 3,6-=
4,8 [im lang; Pel's (1937) fuhrt 0,6-0,8 X 3,0-6,0 \im als Ausmafie an.
In salzigen Seen, Salzlagern und in Flufimundungen mit Brackwasser
vorhanden. Ausreichende Lichtintensitat und Anwesenheit von Schwefelwasserstoff
sind notig. Ein Stamm wurde von Pel's (193 7) aus einem Lager von Purpurbakte-
rien im gipshaltigen Schlamm des ostlichen Teiles des Sakskoe Sees bei Saki,
Kalamitskij Bucht der Krim (UdSSR) isoliert. Von Triiper (1968) wurden
Stamme aus Salzlagern bei einer Flufimiindung nahe Academic Bay auf der Insel
Santa Gruz (Galapagos) isoliert.
Ein ahnlicher Organismus wurde von van Niel (1931) unter der Bezeichnung
Pseudomonas sp. beschrieben. Ebenso fanden Baas Becking (1925) im Schlamm
des Owen Lake von Sierra Nevada Kalifornien (USA) und Butlin und Postgate
(1954) in gipshaltigem Schlamm des Ain-ez Sania Sees in der Libyschen Wiiste
(Kyrenaika Libyen) ahnliche Organismen. Die von Pel's (1937) isolierten
Stamme sind verloren gegangen; darum wurde diese Art erst nach der Isolierung neuer
Stamme desselben Organismus durch Triiper (1968) als giiltig anerkannt.
Morphologisch Rhodospirillum rubrum ziemlich ahnlich, obgleich die Pigment-
zusammensetzung eher an Rhodopseudomonas palustris erinnert. Von Thiospi-
rillum rufum unterscheidet sich diese Art dadurch, dafi Schwefel aufierhalb der
Zellen ablagert wird.
84 • Phototrophe Bakterien - Ectothiorhodospira
38 39
Fig. 38. Ectothiorhodospira mobilis - (nach Mikrophotographie umgezeichnet-
Remsen et al., 1968. - 4000X). Fig. 39. Ectothiorhodospira halophila - a Zellen
aus einem Milieu mit 22% NaCl, h Zellen aus einem Milieu mit 4% NaCl (nach
Mikrophotographie umgezeichnet - Raymond und Sistrom, 1967. - 4000X).
2. Ectothiorhodospira shaposhnikovii Cerny et al. 1969
Rhodopseudomonas sp. Kondrat'eva 1956
Zellen in Form kurzer, gerader oder manchmal leicht gebogener Stabchen mit
abgerundeten Enden. Durch ein Biindel polarer Geifieln beweglich; gramnega-
tiv. Bei Anwesenheit von Propionsaure sind die Zellen schraubenformig, in
Form von Vibrionen oder Spirillen. Einzelne Zellen farblos, Zellsuspensionen
anfangs gelblich bis orangebraun, spater braunrot oder rosa gefarbt. Als photo-
assimilierende Pigmente sind Bakteriochlorophyll a und Karotinoide vorhan-
den, unter denen das Spirilloxanthin vorherrscht. Bei Wachstum in H2S-halti-
gem Milieu sind die Kulturen triib gelblich, bei H2S-Mangcl verschwindet die
Triibung. Als Reservestoffe werden in den Zellen Poly-|3-Hydroxybuttersaure-
Globuli, Polysaccharide und Polyphosphate gespeichert. Ohne Gasvakuolen.
Die Zellen sind obligat phototroph, anaerob bis fakultativ aerob. Die optimale
Sauerstoffkonzentration betragt 0,3-3,0 mg 02/l. Unter absolut anaeroben Be-
dingungen wachsen die Zellen nur bei Licht. Photosynthese unter Bildung von
Schwefel. Als Elektronendonatoren werden Sulfide, Schwefel, Thiosulfate,
molekularer Wasserstoff und eine Reihe organischer Stoffe verwertet. Atmo-
spharischer Stickstoff wird als einzige Stickstoffquelle fixiert. Vermag durch
Assimilation Sulfate zu reduzieren. Optimale Wachstumstemperatur 30-
35 °C, optimaler pH-Wert 8,0-8,5. 1st nicht halophil; benotigt eine geringere
Salinitat als 1%.
Vermehrung durch Teilung.
Zellen 0,7-0,8 x 1,5-2,5 um grofi, Ausmafk vom Alter der Kultur abhangig.
In Teichen, Seen und in Stauseen, wo Schwefelwasserstoff und genugend Licht
vorhanden sind.
Urspriinglich von Kondrat'eva (1956) als Rhodopseudomonas sp. beschrieben.
3. Ectothiorhodospira halophila Raymond et Sistrom 1969 (Fig. 39)
Zellen in Form kurzer Spirillen, an jedem Pol mit einer Geifiel; wahrscheinlich
auch mit Scheide. Beweglich, gramnegativ und mit vielen Membranlamellen.
Einzelne Zellen farblos, grofiere Zellmengen rosa bis orangebraun gefarbt. Sie
enthalten Bakteriochlorophyll a und Karotionoide, unter denen Spirilloxanthin
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@tambler.nl
Ectothiorhodospira • 85
vorherrscht. Als Reservestoff werden Granula der Poly-P-Hydroxybuttersaure,
niemals jedoch elementarer Schwefel gespeichert. Letzterer wird in Anwesenheit
von Schwefelwasserstoff nur extrazellular abgelagert, kann aber bei Schwefel-
mangel als Reservestoff verwertet werden.
Die Zellen sind obligat phototroph, sind eng anaerob. Photosynthese unter
Bildung elementaren Schwefels. Photosynthetische Elektronendonatoren sind
Sulfide, Schwefel, Thiosulfate und in der Gegenwart von Sulfiden und Bikarbo-
naten auch Azetate und Salze der Bernsteinsaure. Andere organische Substrate
werden nicht verwertet. In Abwesenheit reduzierter Schwefelverbindungen
nicht wachstumsfahig. Vitamin B12 wird nicht benotigt, seine Anwesenheit
stimuliert jedoch das Wachstum. Die Zellen sind extrem halophil und benotigen
gewohnlich eine Konzentration von 14-22% KaCl das Minimum betragt 8-9%.
Bei einer Konzentration von 4% wird das Wachstum eingestellt. Falls die
Konzentration unter 3% sinkt, autolysieren die Zellen. Bei 30% NaCl wachsen
die Zellen noch ohne morphologische Anderungen, jedoch langsamer, wahrend
es bei einer Konzentration unter 8% schon zu deutlichen morphologischen
Veranderungen kommt. Nicht fahig Sulfate durch Assimilation zu reduzieren.
Optimaler pH-Wert furs Wachstum 7,4-7,9. Optimaltemperatur 47 °C.
Vermehrung durch Teilung.
Zellen 0,8 X 5,0 |im grofi.
In Seen mit hoher Salzkonzentration, in Salzlagern, die Sulfide enthalten und
dem Licht ausgesetzt sind. Urspriinglich aus salzinkurstierem Schlamm am Ufer
des Gebirgsees Summer Lake, (Sudoregon, USA) isoliert und beschrieben.
Wahrscheinlich mit dem von van Niel (1931) beschriebenen halophilen, photo-
synthetischen, nicht naher bestimmten Bakterium identisch.
4. Ectothiorhodospira halochloris Imhoff et Triiper 1977
Zellen schraubenartig; mittels 2-3 bipolaren Geifteln beweglich. Gramnegativ.
Intrazytoplasmatisches Membransystem vom Lamellentyp. Einzelne Zellen
farblos, Zellensuspension hellgrun bis grun, dichte Suspension bis braunlich
griin. Als Pigmente enthalten sie meistens Bakteriochlorophyll b, in kleinen
Mengen wahrscheinlich auch Bakteriochlorophyll a, die Karotinoide sind vor
allem durch Rhodopin und seine Methoxy-Derivate vertreten.
Ernahrung unter anaeroben Bedingungen photolithotroph, wobei als einziger
Elektronendonator H2S dient und als einzige Kohlenstoffquelle C02. Sulfide
werden zu elementarem Schwefel oxydiert, der extrazellular abgelagert wird;
nach Erschopfung der Sulfidreserven im Medium wird elementarer Schwefel zu
Sulfaten oxydiert. Auch photoorganotrophes Wachstum ist moglich, wobei als
Elektronendonator und auch als Kohlenstoffquelle Azetat, Propionat, Puryvat,
Sukzinat, Malat und Fumarat dienen. Nicht verwertet werden Saccharide,
Alkohole und hohere Fettsauren, ferner Zitrat, Laktat, und Formiat. Als
Stickstoffquelle dienen NH4-Ionen und Glutamin; Nitrate, Nitrite, Harnstoff,
Glutamat und Asparigin konnen nicht verwendet werden. Sie sind fahig, Sulfate
durch Assimilierung zu reduzieren und auf Sulfaten, Thiosulfaten, elementarem
Schwefel und Sulfiden als Schwefelquelle zu wachsen. Unter anaeroben oder
mikroaerophilen Bedingungen im Dunkeln erfolgt kein Wachstum. Maximales
Wachstum bei pH 8,5, optimaler Bereich 8,1-9,1. Als extrem halophiler Orga-
nismus benotigt er zum maximalen Wachstum 20% Salinitat, zum optimalen
Wachstum 14-20%, bei weniger als 10% kein Wachstum mehr. Optimale
Wachstumstemperatur: 47-50 °C, maximales Wachstum bei 48 °C.
Auf festen Medien bildet er grune linsenartige Kolonien, die anfanglich bei
Anwesenheit von Sulfiden von einem weifilichen kleinen Hof aus elementarem
Schwefel umgeben sind, der dann allmahlich verschwindet, wenn die Kultur
altert.
86 • Phototrophe Bakterien - Thioporphyra
Vermehrung durch Teilung.
Zellen unter normalen Bedingungen 0,5-0,6 X 2,5-8,0 (xm grofi. Die Lange der
Schraubenwindung betragt 3,5-5,0 urn. Zellenlange von den Kultivierungsbe-
dingungen abhangig; unter ungiinstigen Bedingungen 15 (xm oder auch langer.
Aus dem Wasser und Schlamm eines extrem salzhaltigen Natronsees aus Wadi
Natron (Lybien, Agypten) isoliert.
Gattungen unsicherer taxonomischer Stellung:
11. Thioporphyra Ellis 1926
Zellen grofi, kugelig oder etwas ovoid, einzeln oder in Paaren lebend. In seltenen
Fallen auch in Dreiergruppen, in denen die Zellen kleeblattartig oder noch
seltener reihenartig angeordnet sind. Letztere entstehen wahrscheinlich durch
nachtragliche Teilung einer Zelle der Diplokokken. Mit einer dicken, langen,
polaren Geifiel, die wahrscheinlich aus mehreren Fibrillen besteht. Plasma
feinkornig und mit Methylenblau leicht farbbar, peripher gelagert, da die
Zellmitte von einer grofien Gasvakuole ausgefullt wird. Manchmal sind mehrere
Vakuolen vorhanden, so dafi die Struktur der Zellen netzartig aussieht. Vakuole
bei ovoiden Zellen auch exzentrisch gelegen. Schwefeltropfchen in grofier
Anzahl, lichtbrechend, nicht selten die Zelle fast ganzlich ausfiillend. Sie konnen
jedoch auch fehlen, auch bei Zellen, die nicht beschadigt zu sein scheinen. Zellen
mit leicht unterscheidbarer Zellwand, die meist auch ohne Farbung sichtbar ist.
Die Zellwand ist mit einer Gallertschicht bedeckt, die manchmal sehr dunn, auch
bei gefarbten Praparaten kaum sichtbar, und manchmal im Gegenteil wieder sehr
dick ist. Einzelne Zellen nur in seltenen Fallen hellviolett, grofiere Zellmassen
satt violett gefarbt.
Vermehrung durch Querteilung. Die kugeligen Zellen strecken sich in die Lange
und werden dann in der Mine eingeschnurt. Bei vielen Zellen wird die Teilung
nicht vollendet, wodurch Diplokokken oder Dreiergruppen entstehen. Wah-
rend der Teilung wachsen die Tochterzellen bis zur Grofie der Mutterzelle
heran. Manchmal vermehren sie sich auch durch Knospung, wodurch es zu
einem raschen Zuwachs der Individuenzahl in Kulturen kommt. Die Knospung
beginnt mit der Bildung einer Ausstiilpung, aus der allmahlich eine lappenartige,
unregelmafiige Knospe ohne Zellwand hervorgeht. Meistens enthalten die Knos-
pen einen Schwefeltropfen. Wahrend des weiteren Wachstums bleibt die Knospe
mit der Mutterzelle verbunden und bildet so allmahlich eine Diplokokke, oder
aber sie trennt sich ab, und es entstehen dann in den Kulturen viele kleine
bewegliche, kugelformige und ungefahr gleich grofie Zellen. Bewegung durch
schnelle Rotation um die Langsachse mittels der polaren Geifiel.
Wichtigste Literatur: Ellis 1926, 1932.
Eine einzige Art:
Thioporphyra volutans Ellis 1926 (Fig. 40)
Mit den Merkmalen der Gattung.
Zellen annahernd 7,0 \un im Durchmesser, die eigentlichen Knospen werden 2,5
X 3,0 um breit.
Als purpurvioletter Uberzug auf faulenden Meeresalgen im seichten Litoral
gefunden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Hyalobotrys • 87
Fig. 40. Thioporphyra volutans - a Tricoccus in kleeblattformiger Anordung, b
Tricoccus in linearer Anordnung, c Diplococcus noch nicht ganz geteilt, d
Verteilung der Vakuolen in der Zelle, e Schwefeltropfchen an einem Zellpol
konzentriert, / erstes Knospungsstadium, an der Zellperipherie entsteht eine
helle'Stelle, aus der sich die Knospe entwickelt, g Anfang der Ausbuchtung des
gelappten Auslaufers, h Auslaufer mit einem Schwefeltropfen, i abgetrennte
Knospen in noch gelappter Form,; junge Tochterzellen mit schon abgerundetem
Protoplast, k Diplococcus mit drei Gebilden, die als Endosporen gedeutet
werden konnen (nach Ellis, 1932. - 2000X).
12. Hyalobotrys Skuja 1964
Zellen ellipsoidisch oder fast kugelig, einzeln oder in mehr oder weniger
kugelformigen Kolonien; diese enthalten wenige oder auch viele Individuen, die
durch Teilung der Tochterzellen entstehen. Die sichtbare Schleimkapsel fehlt bei
diesem Organismus vollig, oder sie ist sehr dunn, hyalin und zerfliefit. Die
Zellen werden durch hyalinen Schleim zusammengehalten; unbeweglich. Zellen
farblos, mit homogenem Plasma und zentral gelegner, unregelmafiig gelappter^
Gasvakuole; mit stark lichtbrechenden Schwefeltropfchen. Vermehrung durch
Querteilung oder durch Zerfall alterer Kolonien in kleinere Fragmente. Im
Hypolimnion von Sufiwasserseen vorkommend.
Der Gattung Thiocystis sehr ahnlich, von der sie sich dadurch unterscheiden,
dafi die Pigmente und typische Schleimkapseln fehlen, da6 sie keine so dichten,
kugeligen Mikrokolonien bildet und kein bewegliches Stadium aufweist. Dage-
gen sind Gasvakuolen vorhanden.
Wichtigste Literatur: Skuja 1964
Eine einzige Art:
Hyalobotrys hypolimnicus Skuja 1964 (Fig. 44)
Mit den Merkmalen der Gattung.
Zellen 2,0-2,5 X 2,0-3,0 \im grofi, Kolonien mit einem Durchmesser von 10-
30 \un, wobei ein Durchmesser von 30 \un keine Seltenheit ist.
Im Plankton des Hypolimnions von Stauseen mit anderen thiophilen Organis-
men vorkommend. Urspriinglich in grofien Mengen in einer Tiefe von 12-13 m
im See Vuolep Njakajaure (Abisko, Schweden) gefunden.
Der Organismus wurde nur im Freiland material, aber wahrscheinlich nie in
Reinkulturen untersucht. Auch die Angabe, dafi Pigmente fehlen, scheint
problematisch zu sein. Bei einer Reihe von Arten dieser Bakteriengruppe sind
einzelne Zellen farblos. Weitere Untersuchungen sind nach erneuter Isolierung
notwendig. ^^
88 ■ Phototrophe Bakterien - Chromatiopsis
13. Chromatiopsis Skuja 1948
Zellen klein, ovoid bis breit ellipsoidisch oder kurz zylindrisch, mit abgerunde-
ten Enden; vor der Teilung langgestreckt. Einzeln lebend, durch eine starke
Geifiel lebhaft beweglich.
Zellen manchmal hyalin, sonst hell goldgelb, schmutzig dunkelgelb oder grau
gefarbt. Mit gleichmafiie verteilten, lichtbrechenden Schwefeltropfchen. Zell-
wand hyalin und ziemlich rigid. Vermehrung durch Querteilung. In Siifiwasser-
seen sowohl im Plankton als auch im Litoral vorkommend, wo durch Faulnis
organischer Reste reichlich Schwefelwasserstoff gebildet wird. Morphologisch
sind die Zellen teilweise denen von Chromatium ahnlich, durch die Farbe und
Bewegung ahneln sie Tbiospirilum und Chromatium (= Rhabdochromatium).
Die Selbstandigkeit dieser Gattung ist fraglich, vielleicht kann sie noch in die
stark variable Gattung Chromatium einbezogen werden. Erfordert weitere
Untersuchungen.
Typus generis: Chromatiopsis elektron Skuja 1948
Wichtigste Literatur: Skuja 1948, 1956, Pfennig und Lippert 1966, Bergey's
Manual 1974.
Bestimmungsschlussel der Arten
la Zellen grofier als 7,0 urn 2
lb Zellen hochstens 6,0 um grofi. Schwefeltropfchen zentral, Geifiel langer als
die Zelle 1. Ch. elektron
2a Zellen 8,0 bis 14,0 um grofi, Geifiel ungefahr ebenso lang wie die Zelle;
manchmal mit Inklusionen von CaC03, Schwefeltropfchen gleichmafiig
peripher gelegen 2. Ch. maior
2b Zellen 7,0 bis 10,0 um grofi, Geifiel kiirzer als die Zelle, Schwefeltropfchen
an beiden Zellenden. Am geifieltragenden Pol sind die Tropfen wesentlich
grofier 3. Ch. cinerea
1. Chromatiopsis elektron Skuja 1948 (Fig. 41)
Zellen kugelig oder kurz ellipsoidisch, am apikalen Ende mit einer polaren
Geifiel. Wahrscheinlich handelt es sich wie bei Chromatium um ein Gemelbiin-
del. Protoplast intensiv hell goldgelb oder schmutzig dunkelgelb; mit verhaltnis-
mafiig grofien glanzenden, zentral Schwefeltropfchen. Vermehrung durch
Querteilung. Bewegung lebhaft, doch ungleichmafiig zitternd.
Zellen 3,5-5,0 X 4,0-6,0 um grofi, die Geifiel 1,5 mal langer als die Zellen.
An Stellen, wo Schwefelwasserstoff aus faulenden Pflanzenresten im Litoral
gebildet wird. Urspriinglich aus dem Sabysjon-See (Uppland, Schweden) be-
schrieben.
Nach Pfennig und Lippert (1966) sollen ahnliche Formen in den Kulturen
grofien Chromatium Arten, die unter Mangel an Vitamin B12 wuchsen, beobach-
tet worden sein.
2. Chromatiopsis maior Skuja 1956 (Fig. 42)
Zellen ellipsoidisch, am apikalen Ende mit einer polaren Geifiel, den Zellen von
Chromatium linsbaueri oder Chromatium densegranulatum sehr ahnlich.
Protoplast undurchsichtig, goldgrau bis goldgelb gefarbt, mit verhaltnismafiig
grofien Schwefeltropfchen.
Manchmal sind in den Zellen auch CaC03-Kristalle vorhanden, da rneist an der
Peripherie liegen. Vermehrung durch Querteilung der Zellen. Bewegung sehr
lebhaft.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.i
Chromatiopsis • 89
Fig. 41. Chromatiopsis elektron - (nach Skuja, 1948. - 1340X). Fig. 42.
Chromatiopsis maior - (nach Skuja, 1956.- 1340X). Fig. 43. Chromatiopsis cinerea -
(a nach Skuja, 1948. - 1340X, h nach Skuja, 1956. - 1340X).
Zellen 6,6-9,0 X 8,0-14,0 um grofi oder kleiner, Geifiel gewohnlich ebenso lang
wie die Zelle.
Diese Art kommt im Plankton des Hjalstaviken-Sees (Uppland, Schweden)
vor.
Nach Pfennig und Lippert (1966) sollen ahnliche Formen auch in den Kulturen
grofien Chromatium - Arten vorgekommen sein, die unter Mangel an Vitamin
Bi2 wuchsen und die neben Schwefelinklusionen auch Globuli der Poly-P-
Hydroxybuttersaure enthielten.
3. Chromatiopsis cinerea Skuja 1948 (Fig. 43)
Zellen ellipsoidisch oder breit zylindrisch, mit abgerundeten Enden und mit
einer polaren Geifiel. Protoplast hell, gewohnlich licht gelbgrau, grau oder sehr
schwach blaugrau. Glanzende Schwefeltropfchen sind meistens an den
Zellenden angehauft, wobei der vordere Teil der Zelle starker und dichter gefiillt ist, als
90 • Phototrophe Bakterien - Thiopolycoccus
der riickwartige Teil, in dem sie klein und weniger haufig sind. Vermehrung
durch Querteilung in der tief eingeschnlirten Aquatoriale. Die hintere Tochter-
zelle ist etwas kleiner und bildet im friiheren oder spateren Teilungsstadium eine
Geifiel. Bewegung ziemlich gleichmafiig und langsam.
Zellen 6,0-,0x 7,0-10,0 [im grofi, Geifiel Vr-V* der Zellange erreichend.
Im Litoral, wo faulende Pflanzen und Schwefelwasserstoff vorhanden sind. Im
Sabysjon-See (Uppland, Schweden) gefunden. Auch dieser Organismus erinnert
an Vitamin B12 Mangelformen grofier Chromatium-Arten, wie sie von Pfennig
und Lippert (1966) beobachtet wurden.
14. Thiopolycoccus Vinogradskij 1888
Rhodopoly coccus Orla - Jensen 1909
Zellen kugelig, dichte kompakte und unregelmafiig geformte Kolonien bildend.
In jungen Kolonien sind die einzelnen Zellen schwer voneinander zu
unterscheiden; sie werden erst in alteren Kulturen erkennbar. Kolonien innen nicht hohl.
Einzelne Zellen durch Schleim miteinander verbunden, aber keine Kapseln
bildend. Grofie Kolonien bilden unregelmafiige Fortsatze oder Lappen, die in
kleine Zellgruppen zerfallen konnen.
Als photoassimilierende Pigmente kommen Bakteriochlorophyll a und Karoti-
noide vor. Einzelne Zellen sind unmerklich, Zellanhaufungen aber satt rot
gefarbt. Grofie Schwefeltropfchen werden als Reservestoff gespeichert; ohne
Gasvakuolen. Die Zellen sind phototroph, anaerob. Photosynthese in Anwesen-
heit von Schwefelwasserstoff unter Bildung von elementarem Schwefel.
Zellen und Zellkolonien unbeweglich, wodurch sie sich von Amoebobacter
unterscheiden. Auch Zellen, die sich aus dem Verband befreit haben bleiben
unbeweglich und in dessen N'ahe liegen.
46
Fig. 44. Hyalobotrys hypolimnicus - (nach Skuja, 1964. - 2000X). Fig. 45.
Thiopolycoccus ruber- (nach Anagnostidis, 1968. - 1200X). Fig. 46.
Rhodopedia tetras - (nach Skuja, 1956. - 1340X). -~*
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Rhodopedia - Zu streichende Arten ■ 91
Nicht selten im Schlamm und in stehendem Wasser mit faulenden Resten
organischer Stoffe, wo reichlich Schwefelwasserstoff und Licht vorhanden sind.
Auch in Schwefelquellen und im Meer.
Die Beschreibung entspricht in gewisser Hinsicht auch den unbeweglichen
Zellkolonien von Thiocystis oder Thiocapsa.
Wichtigste Literatur: Vinogradskij 1888, Migula 1895,1900, Orla-Jensen 1909,
Isacenko 1914, Bavendamm 1924, Ellis 1932, Sturm und Orlova 1954, Bergey's
Manual 1957, 1974.
Eine einzige Art:
Thiopolycoccus ruber Vinogradskij 1888 (Fig. 45)
Micrococcus ruber Migula 1895 (non Micrococcus ruber Holland 1920)
Mit den Merkmalen der Gattung.
Zellen 1,2 [im im Durchmesser, nach Sturm und Orlova 1,3-1,4 [im grofi.
Isacenko (1914) hat diese Art auch im Sufiwassersee Mogil'noe auf der Insel
Kil'din in der Barent-See (UdSSR) gefunden, wo sie an der Schlammoberflache
Haufen dicht aneinander gedrangter Zellen bildete.
Eine ungeniigend bekannte und unzureichend beschriebene Art; nicht in
Reinkulturen untersucht.
15. Rhodopedia Skuja 1956
Zellen kugelig, vor der Teilung jedoch ellipsoidisch werdend; nach der Teilung
an Halbkugeln erinnernd. Durch feinen Scnleim werden 4,8 oder mehr Zellen zu
Kolonien in Form von Tetraden oder Sarcinen vereinigt. Gemeinsame Gallert-
kapseln wurden auch nach Farbung nicht beobachtet. Zellen rosa oder violett
gefarbt, ohne Gasvakuole, jedoch mit einer Menge kleiner Schwefeltropfchen.
Vermehrung durch Teilung der Zellen, die in zwei bis drei zueinander senkrech-
ten Ebenen erfolgt; in einer Ebene immer simukan. Zunachst werden Tetraden
gebildet, aus denen sich dann Sarcinen entwickeln. Letztere teilen sich erneut in
Tetraden. Zellen unbeweglich,
Diese Art ist den Gattungen Thiopedia und Thiosarcina sehr ahnlich, unterschei-"
det sich jedoch einerseits dadurch, dafi sich die Zellen in drei Ebenen teilen,
Thiopedia jedoch in zwei, andererseits durch das Fehlen von Gasvakuolen.
Wahrscheinlich mufi dieser Organismus, Bergey's Manual (1974) folgend, in die
Gattung Thiocapsa eingeordnet werden.
Wichtigste Literatur: Skuja 1956, Bergey's Manual 1974.
Eine einzige Art:
Rhodopedia tetras Skuja 1956 (Fig. 46)
Mit den Merkmalen der Gattung
Zellen 0,6-0,8 x 1,2 \un im Durchmesser, Sarcinen bis 2,5 \un grofi.
Im Plankton und im Hypolimnion von Sufiwasserseen, wo es zu Schwefelwas-
serstoffbildung kommt. Urspriinglich im See Blankvatn bei Oslo (Norwegen) in
einer Tiefe von 20 m gefunden.
Zu streichende Gattungen und Arten:
Beggiatoa roseopersicina Zopf 1883
Lankesteron roseopersicina (Zopf 1883) Ellis 1932
Kiinstliche Art mit einem komplizierten Entwicklungszyklus, dessen einzelne
Stadien verschiedene Gattungen und Arten von Purpurbakterien, insbesondere
Lamprocystis roseopersicina, Chromatium okenii und die Involutionsformen von
Chromatium okenii {=£faib do chromatium roseum) u. a. darstellen.
92 ■ Phototrophe Bakterien - Chlorobineae
Bacterium rubescens Lankester 1973
Lankesteron rubescens (Lankester 1873) Ellis 1932
Als pleomorphe Art beschrieben. Es handelt sich um einzelne Entwicklungssta-
dien von verschiedenen Arten oder Gattungen der Purpurbakterien, insbesonde-
re Lamprocystis roseopersicina, Amoebobacter u. a.
2. Unterordnung Chlorobineae Pfennig et
Triiper 1971
Griine Schwefelbakterien geringer Grbfie. Zellen kugelig, ovoid oder stabchen-
formig. Bei einer Familie bilden sie flexible, unverzweigte, gleichbleibend breite
Faden mit Schleimscheide. Bewegung erfolgt durch ein charakteristisches Glei-
ten. Bei manchen Gattungen sind Gasvakuolen vorhanden. Kommen sowohl in
der Natur als auch im Labor je nach den Wachstumsbedingungen entweder
einzeln oder in Zellgruppen verschiedener Form und Grofie vor. Bilden in
Abhangigkeit von denUmweltfaktoren Schleimsubstanzen, Zellen gramnegativ;
in H2S-haltigem Milieu werden Schwefeltropfchen als Reservestoff aufierhalb
der Zelle abgelagert. Als weitere Reservestoffe werden Polyphosphate gespei-
chert. Die photosynthetischen Strukturen sind auf einer zytoplasmatischen
Membran angehaufte Vesikula vom Chlorobium-Typ.
Protoplast auch bei einzelnen Zellen auffallend griin oder braun gefarbt. Als
Assimilationspigmente enthalten sie hauptsachlich Bakteriochlorophyll c, d
oder e neben einer kleineren Menge von Bakteriochlorophyll a. Aufierdem
Karotinoide der 5. Gruppe vorhanden, vorwiegend y-Karotin. Vertreter der
Familie Chlorobiaceae enthalten Chlorobacten und braungefarbtes Isoreniraten,
wahrend die Gattungen der Familie Chloroflexaceae kein Chlorobacten besit-
zen. Die Funktion letzterer Pigmente ist nur unvollkommen bekannt, doch wird
angenommen, dafi sie die aufgenommene Lichtenergie auf die Bakteriochloro-
phylle iibertragen (Duysens 1952).
Die Zellen der Typusfamilie sind gewohnlich phototroph, streng anaerob und
gegen Anwesenheit von Sauerstoffspuren aufierst empfindlich; Vertreter der
Familie Chloroflexaceae kbnnen unter aeroben Bedingungen auch chemoorga-
notroph leben.
Schwefelwasserstoff oder elementarer Schwefel werden verwertet und bis zu
Sulfaten oxydiert. Die erforderlichen COi-Konzentrationen sind wesentlich
niedriger als bei den Purpurschwefelbakterien. Die optimale Konzentration
betragt 0,05-0,1%; bei einer Konzentration von 0,2% wird das Wachstum
schon inhibiert.
Eine Reihe von Stammen kann auch molekularen Wasserstoff verwerten. Eine
ganze Reihe einfacher organischer Verbindungen wird in Anwesenheit von
Schwefelwasserstoff und Kohlenwasserstoffen photoassimiliert. Von diesem
Standpunkt aus sind sie mixotroph. Die Anwesenheit organischer Stoffe stimu-
liert gewohnlich das Wachstum. Manche Stamme sind fahig, atmospharischen
Stickstoff zu fixieren. Fur das Wachstum ist Licht unbedingt notig. Die Behaup-
tung (Nadson 1912), dafi sie auch im Dunkeln wachsen konnen, wurde bisher
nicht bestatigt; im Dunkeln uberleben sie nur eine gewisse Zeit. Siifiwasser-
Stamme brauchen fur ihr Wachstum kein NaCl, tolerieren jedoch eine
Konzentration bis zu 3%. Fur normales Wachstum sind auch Kalzium und Magnesium
notig. Bei Eisendefizit wird das Wachstum gehemmt, die Zellen sind dann gelb
gefarbt. Eine Reihe von Stammen verlangen Vitamin B|2. Sie vertragen verscnie-
dene Temperaturen und wurden sogar bei 42 °C in Schwefelquellen gefunden
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chlorobiaceae • 93
(Kaplan 1956). Die optimalen Temperaturen liegen bei 8-15 °C und Erhohun-
gen auf iiber 27 °C rufen schon eine mafiige Abnahme der Zellzahl hervor;
Frost wird jedoch vertragen.
Vermehrung durch Zellteilung, die bei manchen Arten in 2-3 zueinander
senkrecht stehenden Ebenen erfolgt, oder bei den fadenformigen Organismen
durch Trichomfragmentierung.
Die meisten Arten sind unbeweglich. Nur Gattungen aus der Familie
Chloroflexaceae bewegen sich durch charakteristisches Gleiten.
Diese Bakterien kommen in Seen, Teichen, heifien Quellen, Kanalen, Fliissen,
Wasserbecken, Abwasserlagunen, oder auch in Salzseen sowie im Meer vor. Sie
sind iiberall dort zu finden, wo faulende organische Reste vorhanden sind und
deshalb Schwefelwasserstoff entsteht; oft gemeinsam mit purpurnen
Schwefelbakterien. Bei einer Konzentration von 50-100 mg/1 Schwefelwasserstoff bilden
sie die dominierende Mikroflora.
Sehr verbreitete Bakterien, die von den polaren Meeren bis zu den Seen der
Aquatorgegend zu finden sind.
Bestimmungsschliissel der Familien
la Phototrophe griine Bakterien, Zellen kugelig bis stabchenformig, einzeln
oder in Gruppen verschiedener Form und Grofte
1. Chlorobiaceae (S. 93)
lb Phototrophe griine Bakterien, Zellen zylinderformig, bilden feste flexible
Faden, die in Schleimscheiden eingeschlossen sind und sich durch Gleiten
bewegen 2. Chloroflexaceae (S. 120)
1. Familie Chlorobiaceae Copeland 1956
Die Benennung der Familie ersetzt die urspriingliche, illegitime Bezeichnung Chlorobacte-
riaceae. Die Zahl der Gattungen, sowie die Aurfassungen iiber ihre systematische Stellune
hat sich im Laufe der Zeit bei verschiedenen Autoren wesentlich geandert. Geitlei" una
Pascher (1925) betonten die Verwandschaft der griinen Schwefelbakterien mit den Blaualgen
durch ihre Einreihung in die Familie Cyanochlorodinae (= Chlorobacteriaceae). Van Niel
(1931) vertrat andererseits die Meinung, dafi alle Arten zur einer einzigen Gattung
(Chlorobium) gehoren. Spater (Pringsheim 1953, Mechsner 1957) wurden drei Gattungen aner-
kannt: Chlorobium, Microchloris, Clathrochloris. Bergey's Manual (1957) fuhrt die
Gattungen Chlorobium, Pelodictyon und Clathrochloris an, denen auch weitere Gattungen und
Organismen, die «in consortia* leben, zugeordnet werden, wogegen Krasil'nikov (1949),
nur die Gattungen Chlorobium und Pelodictyon behandelt. Diese verschiedenen Ansichten
iiber die systematische Einordnung sind vor allem dadurch bedingt, dafi die Organismen -
mit Ausnahme der Gattungen Chlorobium und Chloropseudomonas - bisher noch nicht in
Reinkulturen untersucht wurden, sondern nur aus Freilandmaterial oder aus Anreichungs-
kulturen bekannt sind.
Typus familiae: Chlorobium Nadson 1906
Bestimmungsschliissel der Gattungen
la Zellen ohne Fortsatze (Prostheken) 2
lb Zellen mit charakteristischen Fortsatzen (Prostheken), mehr oder weniger
sternformig angeordnet 10
2a Zellen ohne Gasvakuole 3
2b Zellen meistens mit einer ausgepragten Gasvakuole 9
3a Zellen unbeweglich, ohne Geifcln 4
3b Zellen deutlich keilformig; Kolonien in Form einschichtiger Hohlkugeln,
mittels polarer Geifieln beweglich ll.Pelosphaera(S. 116)
94 • Phototrophe Bakterien - Chlorobium
4a Zellen in Form von Stabchen oder Vibrionen, ovoid oder kurz ellipsoi-
disch 5
4b Zellen deutlich kugelformig 7
5a Zellen meistens in Form gruner oder brauner Stabchen, manchmal ovoid
oder vibrioformig, griine Formen immeriiber 0,4 Jim breit 6
5b Zellen in Form grim gefarbter, sehr kleiner, nur 0,4 \im breiter Stabchen . . .
6.Microchloris (S. Ill)
6a Zellen meistens in Form kurzer Stabchen, ausnahmsweise kugelig oder
ovoid. Oft Ketten bildend, die manchmal durch Schleim zu einer Mikroko-
lonieverbundensein konnen 1. Chlorobium (S. 94)
6b Zellen in Form kurzer oder langer Stabchen, in Ketten angeordnet, die in
dunnem, leicht zerfliefiendem Schleim zu unregelmafiigen grofien Kolonien
vereinigtsind; Kettenniemals alleinauftreten 7.Peloeloea(S. Ill)
7a Zellen charakteristische Kolonien, Paare oder Tetraden, jedoch niemals
Ketten bildend 8
7b Zellen immer in ausgesprochenen Ketten oder Faden angeordnet, die in
dunnem Schleim liegen und gemeinsame Mikrokolonien bilden
8.Chloronostoc(S. 113)
8a Zellen einzeln in Paaren oder Tetraden, die sich in manchen Fallen zu
tafelformigen Mikrokolonien verbinden 9. Tetrachloris (S. 113)
8b Zellen charakteristische, kugelformige, hohle Kolonien bildend, die aus
einer Zellschicht bestehen. Kolonien in einer Schleimkapsel mit scharf
abgegrenztem Rand 11. Sorochloris (S. 115)
9a Zellen ausgesprochen stabchenformig oder ovoid. Kolonien in Form hohler
perforierter Kugeln und Netzen oder parallel angeordneter Ketten
2. Pelodictyon (S. 101)
9b Zellen klein, meistens kugelig, zu Ketten angeordnet, die oft gitterformige
Haufen bilden 3. Clathrochloris (S. 105)
10a Zellen kugelig oder ovoid, mit grofien dornartigen Fortsatzen (Prosthe-
ken), die nur wahrend der Fortpflanzung gebildet werden; ohne
Gasvakuolen. Keine Kolonien bildend 4. Prosthecochloris (S. 108)
10b Zellen manchmal mit Gasvakuolen. Zu sternformigen Aggregaten verbun-
den 5. Ancalochloris (S. 110)
1. Chlorobium Nadson 1906
Zellen zum grofiten Teil in Form kurzer Stabchen mit abgerundeten Enden.
Manchmal auch kugelformig bis ovoid oder vibrioformig. Morphologie der
Zellen recht pleomorph, von den Wachstumsbedingungen abhangig. Neben
kugeligen oder ellipsoidischen Zellen konnen auch lange Stabchen, manchmal
sogar auch schraubenformig gewundene Involutionsformen vorkommen. Letz-
tere entstehen insbesondere bei ungiinstigen pH-Werten und bei einer hohen
H2S-Konzentration. Oft bilden sie verschieden lange, aus einigen Zellen zusam-
mengesetzte Ketten, wenn sich die Tochterzellen nach der Teilung nicht vonein-
ander getrennt haben. Sowohl Ketten als auch einzelne Zellen sind in Schleim-
kapseln eingeschlossen. Es konnen verschiedenartige Mikrokolonien entstehen,
die oft als neue Arten gruner Schwefelbakterien beschrieben wurden.
Zellen gramnegativ, keine Sporen bildend. Im Protoplasma lagern sich weder
Globuli der Poly-|3-Hydroxybuttersaure noch Tropfchen elementaren Schwe-
fels ab. Zellen leuchtend grim, rotbraun oder braun gefarbt, mit Photoassimila-
tionspigmenten, unter denen Bakteriochlorophyll c und d sowie Karotinoide der
5. Gruppe vorherrschen. Zellsuspensionen satt gelbgrun bis grun oder schokola-
denbraun gefarbt. Zellen ohne Gasvakuolen. j
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chlorobium • 95
Alle Arten sind anaerob. Photosynthese bei Licht und in Anwesenheit von
Schwefelwasserstoff unter Bildung elementaren Schwefels, der in Form kleiner
Granula extrazellular um die Zelle ablagert wird. Dadurch entsteht eine milchige
Triibung des Kulturmediums. Als Elektronendonator kann molekularer Was-
serstoff dienen. Manche Stamme vermogen atmospharischen Stickstoff zu fixie-
ren. Alle Arten brauchen fur ihr Wachstum Vitamin B,2, von dem der Chloro-
phyllgehalt abhangt. Dieses kann weder durch Kobaltionen noch durch Methio-
nin ersetzt werden. Vermehrung durch Querteilung. Zellen unbeweglich, mit
Ausmafien von 0,3-1,1 x 0,7-2,7 (j.m.
Die einzelnen Arten sind in der Natur weit verbreitet. Sie kommen in alien
Typen von Gewassern vor, in denen in Zersetzung begriffene organische Stoffe
und Schwefelwasserstoff enthalten sind. Sowohl im Sufi- und Salzwasser als auch
in Meeren; auch im Erdboden auftretend. Unter natiirlichen Bedingungen bilden
sie im Wasser oft grofie Anhaufungen oder ganze Schichten, die durch ihre griine
oder braune Farbung auffallen, besonders in Salz- und Siifiwasserseen. Durch ihr
massenhaftes Vorkommen spielen sie eine bedeutende Rolle im Stoffkreislauf.
Sie entfernen aus dem Wasser Schwefelwasserstoff und reichern es mit organi-
schen Stoffen an.
Morphologisch ist die Gattung Chlorobium den anderen Gattungen, mit denen
sie viele gemeinsame Formen hat, sehr ahnlich. Kondrat'eva (1963) ist der
Meinung, dafi sie wahrscheinlich unter den Gattungsnamen Pelogloea,
Tetrachloris, Sorochloris, Chloronostoc und Streptococcus varians beschrieben wurde.
Mechsner (1957) ordnet dieser Gattung auch die Gattung Pelodictyon und alle
«in consortia" vorkommenden Formen zu. Puckova et al. (1975) halten es fur
zweckmafiig, die Gattung Chlorobium mit der morphologisch sehr ahnlichen
Gattung Pelodictyon, die sich nur durch die Anwesenheit von Gasvakuolen
unterscheidet, zu einer eigenen neuen Gattung zu vereinigen.
Die einzelnen Arten dieser Gattung, insbesondere die grun gefarbten, konnen
allein anhand morphologischer Merkmale praktisch nicht unterscheiden
werden.
Typus generis: Chlorobium limicola Nadson 1906
Wichtigste Literatur: Ewart 1897, Nadson 1906, 1912, Pel's 1936, Bergey's
Manual 1948, 1957, 1974, KrasiPnikov 1949, Bocher 1949, Robbins et al. 1950,
Bicknell 1952, Larsen 1952, 1953, Butlin 1953, Butlin und Postgate 1953, 1954,
Pringsheim 1953, Mechsner 1957, Kondrat'eva et al. 1958, Saposnikov et al.
1958, Kondrat'eva 1962, Liaaen-Jensen et al. 1964, 1965, Cohen-Basire et al.
1964, Hoare und Gibson 1964, Fedorov 1964, Cole und Hughes 1965, Mandel et
al. 1965, Pfennig und Lippert 1966, Pfennig 1967, 1968, Tomina und Fedorov
1967, Belousova 1968, Triiper und Genovese 1968, Lippert und Pfennig 1969,
Fedorov und Belousova 1969, Guseva et al. 1970, Lindstron et al. 1950 Solov'eva
und Fedorov 1970, Pfennig und Triiper 1971.
Bestimmungsschlussel der Arten
la Zellsuspension sattgriin gefarbt 2
lb Zellsuspension rotbraun oder schokolade bis dunkelbraun gefarbt 5
2a Die Zellen sind nicht imstande, Thiosulfate zu oxydieren 3
2b Die Zellen sind fahig, Thiosulfate zu oxydieren. Kulturen wachsen langsam
(8-10 Tage) 4
3a Zellen meist in Form kurzer Stabchen, manchmal kugelig oder ovoid, 0,7-
1,1 um breit 1. Ch. limicola
3b Zellen hauptsachlich in Form von Vibrionon, 0,5-0,7 (im breit, halophil ....
^^ 2. Ch. vibrioforme
96 ■ Phototrophe Bakterien - Chlorobium
4a Zellen in Form kurzer Stabchen oder Vibrionen, immer einzeln, keine
symbiotischenKolonienbildend 3. Ch. thiosulphatophilum
4b Zellen in Form kurzer Stabchen, kugelig oder ovoid, nur als griine Kompo-
nente des Konsortiums Chlorochromatium aggregation auftretend
4. Ch. chlorochromatii
5a Zellen hauptsachlich in Form kurzer Stabchen, 0,6-1,0 |xm breit. Salze der
Propionsaure werden nicht verwertet 5. Ch. phaeobacteroides
5b Zellen hauptsachlich in Form von Vibrionen, 0,3-0,4 |xm breit. Salze der
Propionsaure werden verwertet 6. Ch. phaeovibrioides
1. Chlorobium limicola Nadson 1906 (Fig. 48)
Streptococcus vanans Ewart 1897
Zellen von verschiedener Grofie und Form, von den Wachstumsbedingungen im
gegebenen Milieu abhangig. Junge Zellen klein, eiformig oder kurz stabchenfor-
mig mit abgerundeten Enden, manchmal etwas gebogen. Zellen oft zu Ketten
verschiedener Lange angeordnet, die Streptokokken ahnlich sehen. Meist in eine
Schleimkapsel eingeschlossen. Die Schleimproduktion, insbesondere ihre Men-
ge, hangt vom Milieu ab. Involutionsformen sind langlich und betrachtlich
gekriimmt. Es gibt auch keil- oder schraubenformige Zellen. Kondrat'eva(1963)
halt auch Chlorobium vibrioforme fur eine Involutionsform. Bisher sind die
genauen Bedingungen, die zur Entwicklung dieser Involutionsformen fuhren
b d
Fig. 48. Chlorobium limicola - a Zellketten in Schleimkapseln - (nach Skuja,
1948. -2000X), b Zellaggregate in Schleimkapseln- (nach Krasil'nikov, 1949. —
2000X), c Involutionsformen - (nach Krasil'nikov, 1949. - 2000X), d einzelne
stabchenformige Zellen mit ausgeschiedenen Schwefeltropfchen- (nach Mikro-
photographie umgezeichnet - Schlegel, 1972. - 4000X).
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chlorobium • 97
unbekannt. Zellen hellgriin gefarbt; unauffallige Pigmentierung oder gelbgrune
Farbung werden durch Eisenmangel oder Vitaminmangel (B12) hervorgerufen.
Zellsuspensionen sattgriin gefarbt. Als Assimilationspigmente kommen Bakte-
riochlorophyll c oder d und eine kleine Menge von Karotinoiden vor, unter
denen das Chlorobacten vorherrscht.
Die Zellen sind streng anaerob, nach Pringsheim (1953) mikroaerophil, photo-
troph. Photosynthese bei Licht, wobei Sulfide zu elementarem Schwefel und
teilweise zu Sulfaten oxydiert werden. Als weitere Elektronendonatoren werden
elementarer Schwefel und molekularer Wasserstoff verwertet. In Anwesenheit
von Schwefelwasserstoff und Bikarbonat kann eine Reihe von Stammen be-
stimmte organische Verbindungen verwerten, wobei ihr Wachstum manchmal
stimuliert wird. Bei H2S-Uberschufi wird elementarer Schwefel auCerhalb der
Zellen gebildet; bei Schwefelwasserstoffmangel kann dieser elementare Schwefel
weiter zu Sulfaten oxydiert werden. Sie konnen jedoch Thiosulfate und ahnliche
Stoffe nicht oxydieren. Fur ihr Wachstum benotigen sie Vitamin B12, das nicht
durch Methionin ersetzt werden kann. Letzteres kann eher inhibierend wirken.
Die pH-Werte mussen zwischen 6,0 und 7,0 liegen. Kolonien auf Agar sind
scheibenformig, griin gefarbt und von einer typischen Aureole umgeben, die
anfangs von Schwefeltropfchen und spater von Kristallen gebildet wird. Kultu-
ren wachsen 4—5 Tage, wodurch sie sich von Chlorobium thiosulphatophilum
unterscheiden. Vermehrung durch Zellteilung. Zellen unbeweglich.
Junge Zellen 0,7-1,1 X 0,9-1,5 (im grofi. Es ist bemerkenswert, daft in Kultu-
ren, die von einer Zelle abstammen, alle Individuen gleich grofi sind.
In faulendem, stehendem Wasser und im Schlamm vorkommend. Diese Art ist
uberall dort weit verbreitet, wo eine verhaltnismafiig hohe H2S-Konzentration
und Sonnenlicht zur Verfugung stehen und wo nach Robbins et al. (1950)
Vitamin B12 in Mengen zwischen 0,1-1,0 (xg/1 auftritt. Das ist die minimale
Konzentration, bei der eine normale Entwicklung moglich ist. Vitamin B12 wird
durch eine ganze Reihe anaerober Bakterien und Aktinomyzeten gebildet. Die
Art wurde urspriinglich aus Schlamm und stehendem Wasser eines Teichs im
botanischen Garten von Leningrad (UdSSR) isoliert; aufierdem auch im Sodon
Lake, Bloomfield Hills (Michigan, USA) gefunden.
Bergey's Manual (1948), ebenso wie Krasil'nikov (1949) vereinigen mit dieser Art auch
Chloronostoc abbreviation, Sorochloris aggregata und Tetrachloris inconstans. Bocher
(1949) halt hingegen Chlorobium limicola fur eine Form von Chloronostoc abbreviatum.
2. Chlorobium vibrioforme Pel's 1936 (Fig. 49)
(non Chlorobium vibrioformis Pel's 1936)
Zellen in Form kurzer Vibrionen, unter ungunstigen Bedingungen sowohl im
Freiland als auch in Kulturen Involutionsformen bildend, die senraubenformig
gewunden oder halbkreis- bis kreisformig gebogen sind. Zellen gramnegativ;
einzeln hellgriin, in Massen sattgriin gefarbt. Mit photoassimilierenden Pigmen-
ten, unter denen Bakteriochlorophy 11 coder d und das Karotinoid Chlorobacten
vorherrschen.
Die Zellen sind obligat phototroph und streng anaerob. Als
photoassimilierenden Elektronendonator verwerten sie Schwefelwasserstoff oder elementaren
Schwefel, aber keine Thiosulfate. In Anwesenheit von Sulfiden und Bikarbona-
ten sind sie imstande, Azetate, manche Stamme auch Salze der Propionsaure, zu
photoassimilieren. Fur ihr Wachstum brauchen sie das Vitamin B12. Sie sind
halophil und benotigen wenigstens 1% NaCl. Vermehrung durch Querteilung.
Zellen unbeweglich.
Zellen 0,5-0,7 x 1,0-2,0 ^m grofi.
Im Schlamm und in stehendem Wasser, vor allem in Salzwassern, bei Licht und
98 ■ Phototrophe Bakterien - Chlorobium
Anwesenheit von Schwefelwasserstoff vorkommend. Urspriinglich aus H2S-
haltigem Salzwasser, in derNahe des Badeortes Kara-Bogaz, an der Ostkiistedes
Kaspischen Meeres (UdSSR) isoliert.
Kondrat'eva (1963) halt diese Art fiir Involutionsformen von Chlorobium limicola. Ein
wenig bekannter Organismus. Seit seiner Entdeckung wurde er erst vor kurzem (Pfennig
und Triiper 1961) erneut beschrieben.
3. Chlorobium thiosulfatophilum Larsen 1952
Chlorobium limicola forma thiosulfatophilum (Larsen 1952) Pfennig et Triiper
1971, Chlorobium vibrioforme forma thiosulfatophilum (Larsen 1952) Pfennig et
Triiper 1971
Zellen in Form kurzer Stabchen mit abgerundeten Enden oder ovoid, manchmal
auch kugelig oder in Form kurzer Vibrionen. Unter ungunstigen Bedingungen
bilden sie Involutionsformen verschiedener Gestalt. Sie haben eine starke
Schleimkapsel mit komplizierter Ultrastruktur. Morphologisch sind sie nicht
von Chlorobium limicola oder Chlorobium vibrioforme zu unterscheiden.
Zellen gramnegativ, mit dichtem, festem Zytoplasma, das eine grofie Menge von
Ribosomen enthalt. Einzelne Zellen hellgrun, Zellmassen sattgriin gefarbt. An
Pigmenten enthalten die Zellen Bakteriochlorophyll c und d und eine kleine
Menge von Karotinoiden, insbesondere das Chlorobacten. Der Gehalt an
griinen Pigmenten hangt vom Wachstumsverlauf ab. Die grofite Menge
enthalten die Zellen in der logarithmischen Wachstumsphase. Als Reservestoff werden
Granula der Poly-f5-Hydroxybuttersaure in den Zellen gespeichert. Nach Sire-
vag und Ormerod (1977) bilden sie wahrend des Wachstums Polyglukose, die in
den Zellen in kornigen Granuolen in Form von 30 (j.m grofien Rosetten abgela-
gert werden. Dieser Reservestoff wird im Dunkeln meist zu Azetat und weiter zu
Pyruvat, Kaproat und Sukzinat fermentiert und dient als Energiequelle.
Die Zellen sind streng anaerob, bei Kontakt mit der Luft sterben sie im Laufe von
3-4 Stunden ab. Sie sind obligat phototroph. Als photoassimilierende Elektro-
nendonatoren verwerten sie Sulfide, Schwefelwasserstoff, elementaren Schwe-
fel, Thiosulfate und weitere sauerstoffhaltige Schwefelverbindungen; ebenso
molekularen Wasserstoff. Bei Uberschufi der angefuhrten
Schwefelverbindungen produzieren sie elementaren Schwefel aufierhalb der Zelle. Elementarer
Schwefel wird bis zu Sulfaten oxydiert. Paschinger et al. (1974) bewiesen die
Moglichkeit der gleichzeitigen Oxydation und Reduktion von Schwefel unter
Bildung von Sulfaten beziehungsweise H2S im Dunkeln und auch bei Licht.
Nach der Reduktion ist elementarer Schwefel der Hauptelektronendonator. Sie
fixieren atmospharischen Stickstoff. Auch vermogen sie in Anwesenheit von
Schwefelwasserstoff und Bikarbonat einige organische Verbindungen zu photo-
assimilieren, insbesondere bei geringer Lichtintensitat. Bei hoherer
Lichtintensitat wirken hingegen manche organische Stoffe inhibierend. Dies kann aber
teilweise oder vollstandig durch Bikarbonatzufuhr reguliert werden. Die Zellen
wachsen auch in Anwesenheit mancher Aminosauren (Prolin, Oxiprolin), die
bei geringer Lichtintensitat als Substrat verwertet werden und sind daher als
mesotroph bis heterotroph anzusehen. Vitamin B12 ist fiir ihr Wachstum erfor-
derlich. Bei Vitaminmangel andert sich ihre Farbe von grasgriin in griingelb bis
goldgelb (die Zellen enthalten nur eine kleine Menge von Bakteriochlorophyll).
Auf Agarnahrboden bilden sie scheibenformige oder dreilappige Kolonien, die
nur selten eine gelbe Aureole haben, wodurch sie sich von Chlorobium limicola
unterscheiden. Fliissige Kulturen wachsen wesentlich langsamer (8-10 Tage) als
bei Chlorobium limicola (4-5 Tage). Vermehrung durch Teilung. Zellen unbe-
weglich. _
Zellgrofie veranderlich, gewohnlich sind die Zell^A,5 \im lang.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chlorobium • 99
Im Sufi-, Salz- und Meerwasser, sowie im Schlamm, dort wo genugend Licht
und Schwefelwasserstoff vorhanden ist, vorkommend.
Auf Grund von Untersuchungen an Reinkulturen, in denen die Zellen sowohl mit
Chlorobium limicola als auch mit Chlorobium vibrioforme morphologisch iibereinstimmen und die
Fahigkeit haben, Thiosulfate zu verwerten, betrachten Pfennig und Triiper (1971) diesen
Organismus als Formen beider genannten Arten und nicht als eine selbstandige Art.
4. Chlorobium chlorochromatii Mechsner 1957
Zellen in Form kurzer Stabchen oder Kokken. Unter natiirlichen Bedingungen
bilden sie gemeinsam mit einer farblosen saprophytischen Bakterie symbiotische
Mikrokolonien in dem Konsortium Chlorochromatium aggregatum, wobei sie
die grune Komponente darstellen. In Reinkulturen ohne symbiotische Bakterie
werden meist Ketten gebildet, die sich mit steigendem Alter der Kultur vergro-
fiern und unregelmafiige Formen annehmen. Zuerst sind die Kolonien sternfor-
mig, aus kurzen Ketten zusammengesetzt, spater bilden sie schleimige Lager, die
aus regelmafiig oder unregelmafiig angeordneten Stabchen bestehen. Oft kann
man auch schraubenformig gewundene Zellen beobachten, die zu unregelmafii-
gen knauelartigen Gebilden aufgewickelt sind. Morphologisch nur schwer von
Chlorobium limicola oder Chlorobium thiosulfatophilum zu unterscheiden.
Zellen gramnegativ, einzeln hellgrun, in Massen sattgriin gefarbt. Die Farbe
junger Kolonien auf Agar ist bei schrager Beleuchtung hell gelbgriin, bei
auffallendem Licht schmutzig blaugriin. Autolysierte oder alte Kolonien sind
gelblich bis braun. Als Pigmente enthalten sie Bakteriochlorophyll c oder d und
eine grofie Menge von Karotinoiden, wodurch sie sich von Chlorobium limicola
und Chlorobium thiosulfatophilum unterscheiden. Die vorherrschenden Karoti-
noid sind Rubixanthin und f5-Karotin. Es werden keine Reservestoffe im Proto-
plasma gespeichert.
Die Zellen sind obligat phototroph, anaerob. Schwefelwasserstoff und
Thiosulfate werden als photoassimilierende Elektronendonatoren verwertet und zu
elementarem Schwefel und dann zu Sulfaten oxydiert. In Anwesenheit von
Bikarbonat als Kohlenstoffquelle wird eine ganze Reihe organischer Stoffe
photoassimiliert, insbesondere Pepton und Apfelsaure; sie sind daher auch
fakultativ heterotroph. Die heterotrophe Ernahrung hangt mit ihrer symbioti-
schen Lebensweise zusammen. In Kultur ist diese Art von Chlorobium
thiosulfatophilum kaum zu unterscheiden. Sie wachst viel langsamer als Chlorobium
limicola, in fliissigen Kulturen 8-10 Tage. Die Zellen schweben; in Mangel-
Kulturen bilden sie dagegen ein Bodensediment im Kulturgefafi. Vermehrung
durch Teilung. Zellen unbeweglich.
Zellen meistens 0,7-0,9 X 0,8-1,1 ^m grofi.
In faulendem Schlamm oder im Sumpf stagnierender H2S-haltiger Gewasser
vorkommend. Im Freiland symbiotische Kolonien bildend, die unter der Be-
zeichnung Chlorochromatium aggregatum bekannt sind. Die Art ist in
Reinkulturen ohne Begleitbakterien lebensfahig. Weitere Untersuchungen sind not-
wendig.
Auf ihre Verwandschaft mit der Gattung Chlorobium hatten schon Buder (1913), van Niel
(1931) und Pringsheim (1955) hingewiesen. Triiper und Pfennig (1971) zweifeln an der
Richtigkeit dieser Einordnung. Kondrat'eva (1963) ist der Meinung, daf? dieser Organismus
schon von Engelmann (1882) als Bacterium chlorinum beschrieben wurde.
5. Chlorobium phaeobacteroides Pfennig 1967 (Fig. 50)
Zellen stabchenformig, mit abgerundeten Enden, manchmal mafiig gekrummt
oder unregelmafiig verlangert. Oft bleiben zwei oder mehrere Zellen beisammen
und bilden mehr oder 'MBWger gebogene Ketten. In der stationaren Wachstums-
100 • Phototrophe Bakterien - Chlorobium
Fig. 49. Chlorobium vibrioforme - a verschiedene Formen einzelner Zellen -
(nach Schlegel, 1972. - 4000X), b schraubenformige Zellformation - (nach
Schlegel, 1972. - 2000X). Fig. 50. Chlorobium phaeobacteroides - a einzelne
Zellen (4000X), b kleine Zellketten (2000x) (beide Figuren nach Schlegel, 1972).
Fig. 51. Chlorobium phaeovibrioides - einzelne Zellen - (nach Mikrophotogra-
phie umgezeichnet - Bergey's Manual, 1974. - 4000x). Fig. 52. Chloropseudo-
monas ethylica - einzelne Zellen mit subpolaren Geifieln - (nach Mikrophoto-
graphie umgezeichnet ( Skalinskij und Kondrat'eva, 1961. - 4000X).
phase sind die Zellen fast kugelformig und die Ketten erinnern an Streptokok-
ken. Morphologisch Chlorobium limicola ahnlich, unterscheidet sich jedoch
durch die braune Farbung. Zellen gramnegativ; einzeln braunlich, in fliissigen
Kulturen anfangs gelblich, spater rotbraun bis schokoladenbraun gefarbt. Durch
Anhaufung von Schwefelglobuli in den Zellen werden die Kulturen milchig trub.
Auf Agar sind die Kolonien dunkelbraun; junge Kolonien sind von einer
weifilicnen Aureole aus Schwefeltropfchen umgeben, die im Laufe des Wachs-
tums vollig verschwindet. Als Assimilationspigmente kommen Bakteriochloro-
phyll d und Karotinoide der 5. Gruppe vor, deren Hauptkomponenten Isorenie-
raten und (in geringer Menge) Chlorobacten bilden. Schwefeltropfchen werden
nicht gespeichert, doch werden sie aufierhalb der Zellen im Medium abgelagert.
Die Zellen sind obligat phototroph, streng anaerob, photolithotroph. In Anwe-
senheit von Schwefelwasserstoff und Bikarbonat konnen sie nach Pfennig (1967)
nur Fruktose und Azetate photoassimilieren, nach Triiper und Genovese (1968)
auch eine Reihe anderer, einfacher organischer Verbindungen. Als Elektronen-
donatoren dienen nach Pfennig (1967) Schwefelwasserstoff, Sulfide und elemen-
tarer Schwefel, jedoch nicht molekularer Wasserstoff oder Thiosulfate. Ebenso-
wenig konnen Propionsaure und organische Verbindungen verwertet werden.
Nach Triiper und Genovese (1968) sollen jedoch Thiosulfate beniitzt werden.
Fur ihr Wachstum benotigen sie Vitamin B]2; fiir manche halophile Stamme ist
1% NaCl erforderlich. Vermehrung durch Teilung. Zellen unbeweglich.
Nach Pfennig (1967) Zellen 0,6-0,7 X 1,3-2,7 |xm, nach Triiper und Genovese
(1968) 0,8-1,0 x 1,5-2,5 \im grofi.
Eine weit verbreitete Art, die im H2S-haltigen Hypolimnium von Sufiwasser und
Salzseen vorkommt. Ihr Auftreten hangt von der Anwesenheit von Licht mit
einer Wellenlange von 460 nm ab. Ursprunglich wurde die Art aus 19 m Tiefe
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pelodictyon ■ 101
des meromiktischen Sees Blankvann (Norwegen) beschrieben. Weiter im Green
Lake bei New York (USA), im Tiberias See (Israel) und im meromiktischen
Salzwassersee Lake Faro bei Messina auf Sizilien (Italien), wo sie eine braunrote
Wasserfarbung hervorrief, gefunden.
Pfennig (1967) ist der Meinung, dafi sie mit dem symbiotischen Organismus
Lauterborniola minima identisch ist, der im Konsortium Pelochromatium ro-
seum lebt.
6. Chlorobium phaeovibrioides Pfennig 1967 (Fig. 51)
Zellen in Form leicht gekriimmter Stabchen oder Vibrionen. Unter bestimmten
Bedingungen bleiben die Zellen beisammen und wachsen zu mehr oder weniger
fest verbundenen Knaulen heran; gramnegativ. Zellsuspension rotbraun bis
dunkelbraun gefarbt. Mit Bakteriochlorophyll d und Karotinoiden der 5.
Gruppe, unter denen das Isorenieraten vorherrscht. Protoplasma ohne
Schwefeltropfchen, die jedoch extrazellular ins Milieu abgesondert werden.
Die Zellen sind obligat phototroph, photolithotroph, streng anaerob. Als
Elektronendonatoren verwerten sie Schwefelwasserstoff und elementaren
Schwefel, der ein Zwischenprodukt der Photosynthese ist.Schwefel wird bis zu
Sulfaten oxydiert. In Anwesenheit von Sulfiden und Bikarbonat werden auch
Azetate und Salze der Propionsaure photoassimiliert; elementarer Wasserstoff
wird nicht verwertet. Fiir ihr Wachstum sind Vitamin B12 und minimal 1 % NaCl
notig. Vermehrung durch Teilung. Zellen unbeweglich.
Zellen meistens 0,3-0,4 X 0,7-1,4 (j.m grofi.
Im Hypolimnion meromiktischer Seen vorkommend. Aus H2S-haltigem Was-
ser, in 7 m Tiefe der Seen Langvikvann und Polden (Norwegen) beschrieben.
2. Pelodictyon Lauterborn 1913
Zellen ausgesprochen stabchenformig oder ovoid. Morphologisch der Gattung
Chlorobium ziemlich ahnlich, jedoch grofier und charakteristische Kolonien
bildend, die in Schleimkapseln eingeschlossen sind. Kolonien mehr oder weniger
kugelig oder in Form gitterahnlicner Gebilde, die jedoch nur unter naturlichen
Bedingungen zu beobachten sind. In Reinkulturen werden keine Kolonien
gebildet. Zellen gramnegativ; einzeln hellgriin, in Zellsuspension ausgesprochen
gelbgriin gefarbt. Als photoassimilierende Pigmente sind Bakteriochlorophyll c
und d und Karotinoide der 5. Serie vorhanden. Zellen mit einer deutlichen
Gasvakuole.
Die Zellen sind phototroph, anaerob. Photosynthese in Anwesenheit von
Schwefelwasserstoff, der zu elementarem Schwefel oxydiert und extrazellular im
Medium in Form von kleinen Tropfchen abgelagert wird. Als Elektronendona-
tor kann auch molekularer Wasserstoff neben Schwefelwasserstoff verwertet
werden. Zellen unbeweglich. Vermehrung durch Teilung in drei Ebenen, so dafi
es zur Bildung charakteristischer Kolonien kommen kann. Im Schlamm und in
stehendem H2S-haltigem Wasser, auch in Schwefelquellen.
Van Niel (1931), Larsen (1952), Bicknell (1952) sind der Meinung, dafi diese
Gattung mit der Gattung Chlorobium identisch ist. Auch Puckova et al. (1975)
sind der Ansicht, dafi Organismen der Gattung Pelodictyon und Chlorobium
sind nur unwesentlich voneinander unterscheiden (Pelodictyon besitzt Gasva-
kuolen, Chlorobium dagegen nicht). Sie schlagen deshalb vor, sie in eine neue
Gattung zu stellen. Krasil'nikov (1949) stellte zu dieser Gattung auch die
Konsortien Chlorochromatium aggregatum und Chlorobacterium symbio-
ticum.
Typus generis: Pelodictyon clathratiforme (Szafer 1911) Lauterborn 1913
102 ■ Phototrophe Bakterien - Pelodictyon
Wichtigste Literatim Schmidle 1901, West und West 1906, Szafer 1910, 1911,
Lauterborn 1913, 1914, 1916, Perfiliev 1914, Kope 1924, Geitler in Geitler und
Pascher 1925, van Niel 1931, Bergey's Manual 1948, 1957, 1974, Krasil'nikov
1949, Larsen 1952, Bicknell 1952, Pringsheim 1953, Skuja 1956, Kondrat'eva
1961, Pfennig und Cohen-Bazire 1967, Pfennig 1967, Gorlenko und Kuznecov
1971, Pfennig und Triiper 1971, Gorlenko 1972, Puckova et al. 1975.
BestimmungsschlUssel der Arten
la Zellsuspension sattgrun gefarbt 2
lb Zellsuspension schokoladenbraun gefarbt, meistens keine durch Schleim
verbundeneMikrokolonien bildend, halophil 3.P. phaeum
2a Zelien typische netzformige Mikrokolonien bildend . 1. P. clathratiforme
2b Zelien keine netzartigen Mikrokolonien bilden 3
3a Zelien unregelmafiigelappige oder kugelige, hohle Aggregate bildend
2. P. luteolum
3b Zelien zweidimensionale plattenformige Aggregate bildend, die aus mehr
oderweniger parallel angeordneten Ketten bestehen .... 4. P. parallelum.
1. Pelodictyon clathratiforme (Szafer 1911) Lauterborn 1913 (Fig. 53)
Aphanothece clathratiformis Szafer 1911, Pelodictyon lauterbornii Geitler 1925
Zelien stabchenformig, manchmal ellipsoidisch, mit einer grofien, breiten Gal-
lertkapsel. Kolonien dreidimensional, netzartig, mit 10 bis 50 (j.m grofien Perfo-
rationen. Diese netzartigen Kolonien entstehen so, dafi sich zuerst durch
allmahliche Teilung eine Zellkette bildet, in der gelegentlich zwei benachbarte
Zelien ihre Wachstumsrichtung andern. In der Lage, die an den Buchstaben „Y"
erinnert, beginnen sie sich gleichzeitig zu teilen, so dafi ein typisches maschenar-
tiges Gebilde entsteht. Unter bestimmten Bedingungen werden Involutionsfor-
men gebildet, die langlich-zylindrisch und verzweigt sind oder nur Anfange
einer Verzweigung zeigen; mitunter sind sie keulenformig und unregelmafiig
dick. Zelien gramnegativ; einzeln hellgrun, in Zellsuspensionen sattgrun gefarbt.
Als Pigmente kommen vor allem Bakteriochlorophyll c oder d und Karotinoide
vor. Protoplasma mit typischen Gasvakuolen, die denen der Schwefelbakterien
sehr ahnlich sehen.
Die Zelien sind obligat phototroph, streng anaerob. Als Elektronendonatoren
werden Sulfide und elementarer Schwefel verwertet, hingegen keine Thiosulfate.
Photosynthese bei Anwesenheit von Schwefelwasserstoff und Licht. Das End-
produkt ist elementarer Schwefel, der in Form kleiner Tropfchen im Milieu
extrazellular ausgeschieden wird. In Anwesenheit von Schwefelwasserstoff und
Bikarbonat werden Azetate photoassimiliert. Es sind eine niedrige PLS-Konzen-
tration und eine niedrige Lichtintensitat erforderlich. Vermehrung durch
Teilung in zwei oder auch drei Tochterzellen, wodurch die charakteristischen
netzartigen Mikrokolonien entstehen. Zelien unbeweglich.
Zelien nach Bergey's Manual (1957) 0,5-1,5 X 2,0—4,0 \im grofi, wogegen in der
letzten Auflage von Bergey's Manual (1974) 0,7-1,2 X 1,5-2,5 |xm grofie Zelien
angegeben werden; langgestreckte Zelien konnen bis zu 9,0 (j.m lang werden.
In stehendem und faulendem Wasser oder im Schlamm, wo geniigend Licht und
Schwefelwasserstoff zur Verfiigung stehen; auch in Schwefelquellen gefunden.
Krasil'nikov (1949) stellt zu dieser Art Clathrochloris sulfurica.
Auf Grund einer Reihe ubereinstimmender Merkmale wurde auch die folgende, friiher als
selbstandig angesehene Art hier eingereiht:
la. Pelodictyon lauterbornii Geitler 1925 (Fig. 53 b)
Unterscheidet sich von der typischen Form nur durch grofiere Zelien: 3,0-6,0 X 0,1-
1,5 ^m. Die Zelien bilden Ketten, die miteinander zu netzartigen Gebilden verflochten sind.
Netzmaschen 8,0-12,0 ^m grofi. In H2S-haltigen Gewass^^fcorkommend.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pelodictyon ■ 103
Fig. 53. Pelodictyon clathratiforme - a Mikrokolonie in Netzform - (nach
Anagnostidis, 1968. - 1750X), b Pelodictyon lauterbornii - Mikrokolonie in
Netzform - (nach Geitler und Pascher, 1925.- 1750X), c Detail von Knotenzel-
len - (nach Schlegel, 1972. - 4000X). Fig. 54. Pelodictyon parallelum - (nach
Geitler und Pascher 1925. - 1750X).
2. Pelodictyon luteolum (Schmidle 1901) Pfennig und Triiper 1971
(Fig. 55)
Aphanothece luteola Schmidle 1901, Schmidlea luteola (Schmidle 1901)
Lauterborn 1913, Pelodictyon aggregatum Perfiliev 1914.
Zelien kugelig, ellipsoidisch, kurz zylindrisch, mit abgerundeten Enden oder in
Form von Vibrionen. Unter natiirlichen Bedingungen bilden die Zelien sehr viel
Schleim, wodurch wolkige oder unregelmafiig lappenformige Mikrokolonien
oder hohlkugelige Aggregate entstehen. Die Zelien bilden eine dichte Schicht.
Auf der Oberflache sind die Kolonien scharf abgegrenzt. In Reinkulturen
kommen vorwiegend Einzelzellen vor. Zelien gramnegativ; einzeln hellgrun
oder gelbgriin, in Massen sattgrun gefarbt. Mit Bakteriochlorophll c und d und
Karotinoiden. Ausgepragte Gasvakuolen vorhanden.
Die Zelien sind obligat phototroph, streng anaerob. Photosynthese bei Licht
und in Anwesenheit von Schwefelwasserstoff; das Endprodukt ist elementarer
Schwefel und wird im Medium abgelagert. Als Elektronendonatoren dienen
Sulfide, Schwefelwasserstoff und elementarer Schwefel. In Anwesenheit von
Sulfiden und Bikarbonat vermogen sie Salze der Propionsaure und Azetate zu
photoassimilieren. Thioj^ate und andere organische Verbindungen werden
104 ■ Phototrophe Bakterien - Pelodictyon
nicht verwertet. Vermehrung durch Teilung. Zellen nicht aktiv beweglich; sie
konnen nur passiv im Wasser fortgeschwemmt werden.
Zellen nach Pfennig und Triiper (1971) 0,6-0,9 X 1,2-2,0 |xm, manchmal 1,0-
1,5 X 2,0—4,0 u,m grofi. Kolonien 100-300 u,m im Durchmesser.
Im Schlamm und in stehenden Gewassern, in denen organisches Material
verfault und Schwefelwasserstoff vorhanden ist.
Krasil'nikov (1949) stellt zu dieser Art auch Pelogloea chlorina und Pelogloea
batillifera.
Fig. 55. Pelodictyon luteolum - a altere hohle Kolonie mit beginnender Lochbil-
dung - (nach Geitler und Pascher, 1925. - 670X), b jiingere kugelformige
Kolonie mit scharf begrenzten Randern - (nach Skuja, 1956.-670x), c einzelne
Zellen- (nach Skuja, 1956.- 1340X), d Detail einer Kolonie- (nach Anagnosti-
dis, 1968. - 1340X).
Bei diesem Organismus sei auch eine friiher als selbstandig angesehene Art eingereiht:
2a. Pelodictyon aggregatum Perfiliev 1914
Zellen gewohnlich stabchenformig, mit Gallertkapseln, in denen die Zellen unregelmafiig
angeordnet sind. Manchmal sind die Kolonien weniger konzentriert oder sogar perforiert
und erinnern an Pelodictyon clathratiforme. Involutionsformen sind gekrtimmt, gabel- und
keilformig, verdickt oder manchmal teilweise verzweigt. Oft mit Vakuolen. Zellen gelbgriin
gefarbt; unbeweglich. Vermehrung durch Teilung.
Zellen ungefahr 1,0-1,5 X 2,0-4,0 um, Kolonien 300-400 (tm grofi; manchmal erreichen sie
eine Grofie von 1 mm.
Im Schlamm und in stehenden, faulenden Gewassern mit hoherer H2S-Konzentration und
bei genugender Lichtintensitat.
3. Pelodictyon phaeum Gorlenko 1972
Zellen in Form kurzer Stabchen, oft leicht gekriimmt und in Form von Vibrio-
nen. Durch unvollkommene Zellteilung kommt es zu spiraligen oder schrauben-
formigen Gebilden, die aus mehreren Zellen bestehen. Kolonien werden nur
unter besonderen Umstanden gebildet, wenn viel Schleim ausgeschieden wird.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Clathrochloris ■ 105
Sie sind rund, unregelmafiig, abgeflacht. In Reinkulturen werden keine
Kolonien gebildet. Einzelne Zellen sind farblos, grofiere Mengen schokoladenbraun
gefarbt. Sie enthalten Bakteriochlorophyll d und Karotinoide, unter denen das
Isorenieraten vorherrscht. Zellen mit Gasvakuolen.
Die Zellen sind phototroph, streng anaerob. Bei der Photosynthese werden als
Elektronendonatoren Sulphide, Schwefelwasserstoff oder elementarer Schwefel
verwertet. Thiosulfate und Sulfite konnen nicht verwertet werden. In Anwesen-
heit von Bikarbonat und Sulfiden werden Azetate photoassimiliert. Diese Art
ist halophil und benotigt eine 3%ige NaCl Konzentration, als Wuchsstoff auch
Vitamin B12. Vermehrung durch Teilung.
Zellen ohne aktive Bewegung, 0,6-0,9 X l,0-2,0(j.m grofi.
Im Metalimnion und Hypolimnion meromiktischer Seen vorkommend. Aus
dem Vejsovo See, im Gebiet des Donee (UdSSR) beschrieben.
Art unsicherer Stellung:
4. Pelodictyon parallelum (Szafer 1911) Perfiliev 1914 (Fig. 54)
Aphanothece parallela Szafer 1911, Pediochloris parallela (Szafer 1911) Geitler
1925
Zellen verhaltnismafiig klein, kugelig, ei- oder stabchenformig; unbeweglich.
Manchmal zu Ketten oder zweidimensionalen Gebilden vereinigt, in denen die
Zellen in parallelen Biindeln angeordnet sind; gelbgriin gefarbt. Vermehrung
durch Teilung.
Zellen ungefahr 0,5-1,0 X 1,0-0-3,0 ^m grofi.
Selten in stehendem, faulendem Wasser mit hoherem H2S-Gehalt; auch in
Schwefelquellen vorhanden. Diese Art benotigt Sonnenlicht. In einer Schwefel-
quelle in der Nahe von Lvov (UdSSR) gefunden.
Skuja (1958) und Starmach (1966) fuhren Pediochloris parallela als selbstandige Gattung an.
Gleichzeitig sind sie der Meinung, dafi diese Art nur eine bestimmte Wuchsform von
Chlorobium limicola ist. Derselben Meinung ist auch Bergey's Manual (1957). Ein wenig
bekannter Organismus, der bisher noch nicht in Reinkultur geziichtet wurde. Weitere
Untersuchungen sind erforderlich.
3. Clathrochloris Geitler 1925
Zellen klein, kugelig oder kurz ellipsoidisch bis ovoid, Ketten bildend, die oft zu
gitterartigen Haufen zusammentreten. Zellen hell, Zellsuspensionen satt
gelbgriin gefarbt; mit kleinen Gasvakuolen, die mit Schwefeltropfchen verwechselt
werden konnen. Bei alteren Zellen entwickelt sich eine grofie zentrale Vakuole.
Die Zellen sind anaerob, phototroph. Photosynthese in Anwesenheit von Licht
und Schwefelwasserstoff, wobei elementarer Schwefel entsteht, der als Reserve-
stoff aufierhalb der Zellen ablagert wird. Die in alteren Arbeiten vorkommenden
Angaben iiber intrazellulare Schwefeltropfchen beruhen auf Verwechslungen
mit Gasvakuolen. In Schwefelquellen, in stehendem und mit faulenden Stoffen
belasteten Sufi- und Salzwasser sowie im Schlamm bei Vorhandensein von
Schwefelwasserstoff und Licht vorkommend.
Typus generis: Clathrochloris sulphurica (Szafer 1911) Geitler 1925
Wichtigste Literatur: Szafer 1911, Geitler in Geitler und Pascher 1925,
Bergey's Manual 1948, 1957, 1974, Skuja 1948, 1956, Mechsner 1957, Kondrat'eva
1961, 1963, Anagnostidis und Overbeck 1966, Starmach 1966, Fjerdingstad
1967.
106 • Phototrophe Bakterien - Clathrochloris
Bestimmungsschliissel der Arten
la Zellen klein, hochstens 0,7 umgrofi 1. CI. sulphurica
lb Zellen grofier als 1,0 (im 2
2a Zellen 1,0-1,5 X 1,5-2,0 |xmgrofi,ohnedeutlicheSchleimkapseln
2. Cl. hypolimnica
2b Zellen durchschnittlich 2,8-4,8 um grofi, mit sehr deutlichen Schleimkap-
seln; Meeresform 5. Cl. marina
1. Clathrochloris sulphurica (Szafer 1911) Geitler 1925 (Fig. 56)
Aphanothece sulphurica Szafer 1911
Zellen klein, meistens kugelie, Ketten bildend, die zu gitterformigen Formatio-
nen vereinigt sind und desnalb Pelodictyon clathratiforme und Pelodictyon
luteolum ahnlich sehen. In H2S-haltigem Milieu (besonders bei giinstiger Kon-
zentration) scheiden die Zellen viel Schleim aus, der charakteristische Kapseln
bildet. Zellen gelbgriin gefarbt.
Urspriinglich nielt man diesen Organismus fur die einzige Art der Familie
Chlorobacteriaceae, bei der Schwefelinklusionen vorkommen. Skuja (1948)
erkannte jedoch, dafi es sich um Gasvakuolen handelt, die ahnlich stark lichtbre-
chend sind wie Schwefeltropfen. Wie alle grunen Schwefelbakterien lagert auch
diese Art elementaren Schwefel als Produkt der Photosynthese in Form kleiner
Tropfchen auCerhalb der Zellen im Milieu ab. Die Zellen sind streng anaerob und
unbeweglich. Vermehrung durch Querteilung.
Zellen gewohnlich 0,5 bis 0,7 (im im Durchmesser.
In Schwefelquellen, in stehenden, faulenden Gewassern und im Schlamm iiberall
dort vorkommend, wo genugend Licht und Schwefelwasserstoff zur Verfugung
stehen.
Urspriinglich in Lubien Wielki bei Lvov (UdSSR) in Schwefelquellen ge-
funden.
Mechsner (1957) und Kondrat'eva (1961,1963) sind der Meinung, dafi die Einreihungdieses
Organismus bei den grunen Schwefelbakterien problematisch ist und dafi es sich auch um
eine Blaualge handeln konnte. In Bergey's Manual (1974) wird diese Art fur wahrscheinlich
identisch mit Clathrochloris hypolimnica gehalten.
56 b
Fig. 56. Clathrochloris sulphurica - a - (nach Geitler und Pascher, 1925. -
2400X), b - (nach Anagnostidis, 1968. - 2400X). ^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Clathrochloris • 107
2. Clathrochloris hypolimnica Skuja 1948 (Fig. 57)
Zellen kurz, zylindrisch oval, mit abgerundeten Enden. Einzeln, in Paaren, zu
dritt oder in groCen Kolonien lebend, die grofkenteils spharisch oder unregelma-
Cig gitterformig oder verzweigt sind. Weder einzelne Zellen noch ganze
Kolonien bilden Gallertkapseln. Obwohl die Schleimkapseln auch durch Farbung
nicht nachweisbar sind, halt man ihre Existenz fur wahrscheinlich, da sonst die
Zellen nicht in den charakteristischen Kolonien zusammengehalten werden
konnten. Zellen hell-gelbgriin, mit zentraler, dunkelroter oder orangefarbener,
glanzender Gasvakuole, jedoch ohne Schwefeltropfchen. Vermehrung durch
einfache Querteilung. Zellen nicht aktiv beweglich.
Zellen 1,0-1,5 x 1,5-2,0 \im grofi.
Im SliCwasser vorkommend, wobei niedrige H2S-Konzentrationen ausreichen.
Auch als frei schwebende Organismen im Hypolimnion meromiktischer Seen
auftretend. Oft auf Schlamm hellgriine Uberziige bildend. Urspriinglich aus
dem Skarsjon See (Uppland, Schweden) und im PluC-See, (Ostholstein, BRD)
gefunden. Der «status dissociatus» wurde im Honsan See (Schweden) beob-
achtet.
Nach Anagnostidis und Overbeck (1966) vermehrt sich diese Art nur im Herbst.
Skuja (1963) beschrieb einen «status dissociatus» bei dem die Zellen zu unregel-
maCigen Aggregaten vereinigt sind, die gemeinsam eine machtige Kolonie mit
regelmafiig verteilten Zellgruppen bilden. Nach Bergey's Manual (1974) ist diese
Art wahrscheinlich mit Clathrochloris sulphurica identisch.
57
Fig. 57. Clathrochloris hypolimnica - a normal entwickelte Kolonie - (nach
Skuja, 1948. - 2000X), b «status dissociatus» - (nach Skuja, 1956. - 2000x), c
einzelne Zellen - (Orig.^^OOOX).
108 • Phototrophe Bakterien - Prosthecochloris
3. Clathrochloris marina Fjerdingstad 1967
Einzelliger Organismus, mit runden oder etwas ovoiden Zellen, die von einer
hyalinen, ziemlich gut sichtbaren Schleimkapsel umgeben sind. Zellen sehr
haufig in lockeren, gitterartigen Aggregaten angeordnet, die jenen von
Clathrochloris sulphurica ahneln. Bei alten Kolonien sind jedoch die Zellen so eng
aneinander geprefk, dafi sie deformiert werden. Manche Kolonien sind dagegen
dem «status dissociatus» von Clathrochloris hypolimnica ahnlich.
Zellen gelbgriin, altere Kolonien leuchtend griin gefarbt. Junge Zellen mit
mehreren (3-5, selten 7) Gasvakuolen. Alte Zellen haben an Stelle der Vakuolen
einen grofien Hohlraum, der durch Lichtbrechung rotschwarz erscheint.
Die Zellen sind obligat phototroph, anaerob. Als Elektronendonatoren verwer-
tet diese Art Sulfide. Wahrscheinlich ist sie nicht imstande, Schwefel oder
Thiosulfate zu oxydieren. Vermehrung durch einfache Zellteilung, wobei zuerst
eine Querwand in der Schleimkapsel gebildet wird und dann erst die Einschnu-
rung der Zellen folgt. Zellen unbeweglich.
Zellen 2,8—4,8 \im im Durchmesser, Schleimkapseln ungefahr 1,0 |j.m, vor der
Teilung bis 3,0 \im dick.
In seichtem, H2S-hakigem Schlamm der Oeresunder Bucht (Danemark, Schwe-
den) in 5-32 m Tiefe gefunden.
4. Prosthecochloris Gorlenko 1970
Zellen kugelig bis ovoid, an der Oberflache mit bis zu 20 grofien, auffallenden,
dornartigen Fortsatzen (Prostheken), die bei der Fortpflanzung entstehen. Die
Enden der Prostheken sind abgerundet, manchmal auch etwas verdickt. Bei alten
Zellen treten aus ihnen Schleimfaden hervor, durch die die Zellen miteinander
verbunden sind. Als wichtigste Pigmente enthaken sie Bakteriochlorophyll a, e,
c und Karotinoide, die in einem photosynthetischen Apparat lokalisiert sind, der
vorwiegend im inneren Teil der Prostheken liegt. Die Prostheken sind eigentlich
Ausbuchtungen der Zellwand und der zytoplasmatischen Membran.
Gasvakuolen wurden nicht beobachtet; keine Sporenbildung. Morphologisch Prostheco-
microhium sehr ahnlich. Bei unvollstandiger Zellteilung entstehen Paare, ver-
zweigte Ketten oder kleine Gruppen, jedoch keine charakteristischen Mikroko-
lonien. Zellen gramnegativ. Protoplasma granuliert, ohne Schwefekropfchen;
diese werden nur extrazellular im Medium um die Zellen abgelagert. Neben
normalen Zellen treten unter gewissen Bedingungen Involutionsformen in Form
grofier kugeliger, fadenartiger oder auch verzweigter Zellen auf, die denen von
Chlorohium ahnlich sehen. Zellen in Schleimkapseln eingeschlossen. In fliissigen
Kulturen tritt durch Abscheidung von Schwefel eine milchige Trubung auf. Auf
Agarnahrboden Kolonien linsenformig, olivgriin gefarbt und von einer gelbli-
chen Schwefelaureole umgeben; sie wachsen 4-5 Tage.
Die Zellen sind obligat photoautotroph, photolithotroph und streng anaerob.
Physiologisch der Gattung Chlorohium sehr ahnlich. Elementarer Schwefel wird
als Produkt der Photosynthese zuerst in der Lipidschicht der Zellwand
abgelagert. Dieser wird als Elektronendonator verwertet, wenn der Schwefelwasser-
stoff im Medium erschopft ist. Bei Uberschufi an Schwefelwasserstoff wird
Schwefel extrazellular in unmittelbarer Nahe der Zellen in Form kleiner, stark
lichtbrechender Tropfchen abgelagert. Als Elektronendonatoren dienen
Schwefelwasserstoff, Sulfide und elementarer Schwefel, jedoch nicht Thiosulfate. In
Anwesenheit von Sulfiden und Bikarbonat konnen auch organische Stoffe
verwertet werden, die das Wachstum stimulieren. Halophil; fur das Wachstum
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Prosthecochloris ■ 109
sind 0,5-7,0% NaCl erforderlich; Konzentrationen von 1-8% werden jedoch
noch toleriert. Vitamin B12 ist als Wuchsstoff unbedingt notig.
Vermehrung durch Querteilung, die in vielen verschieden zueinander orientier-
ten Ebenen verlauft. Bei der Zellteilung entstehen die Prostheken. Zellen
unbeweglich. Im Schlamm und im Brackwasser, sowie in stagnierendem, H2S-
haltigem Wasser.
Typus generis: Prosthecochloris aestuarii Gorlenko 1970
Wichtigste Literatur: Gorlenko und Zilina 1968, Gorlenko 1968,1970, Mathe-
ron una Baulaigne 1972, Puckova und Gorlenko 1976.
Bestimmungsschliissel der Arten
la Zellen enthaken hauptsachlich Bakteriochlorophyll c; Zellsuspension hell-
bis sattgriin 1. P. aestuarii
lb Zellen enthaken hauptsachlich Bakteriochlorophyll e; Zellsuspension dun-
kel- bis schokoladebraun 2. P. phaeoasteroidea
1. Prosthecochloris aestuarii Gorlenko 1970 (Fig. 58)
Zellen kugelig bis ovoid, mit charakteristischen Fortsatzen (Prostheken). Bei
unvollkommener Teilung der Zellen entstehen Zellpaare, verzweigte Ketten
oder unregelmafiige kleine Zellhaufen. Einzelne Zellen sind farblos oder hell-
grun, die Zellsuspension sattgriin. Fliissige Kulturen sind von ausgeschiedenem
Schwefel milchig getriibt. An Pigmenten sind Bakteriochlorophyll c und
Karotinoide vorhanden.
Obligat photolithotrophe Ernahrung unter streng anaeroben Bedingungen. H2S
und elementaren Schwefel dienen als Elektronendonatoren, C02 als Kohlen-
stoffquelle. Auch einige organische Stoffe konnen verwertet werden, besonders
Azetat. Halophil; zum Wachstum wird 2-5% NaCl benotigt, toleriert bis 8%;
aufierdem ist Vitamin B12 erforderlich.
Zellen ohne Prostheken 0,5-0,7 X 1,0-1,2 \im grofi, Prostheken 0,10-0,17 (im
breit und selten langer als der Zelldurchmesser, meistens 0,25 (im.
<f?
o
o
58
59
Fig. 58. Prothecochloris aestuarii- (nach Elektronen-Mikrophotographie sche-
matisiert - Gorlenko und Lebedeva, 1970. - 10000X). Fig. 59. Ancalochloris
perfilievii - (nach Elektronen-Mikrophotographie schematisiert - Gorlenko und
Lebedeva, 1972. - 8000 x).
110 ■ Phototrophe Bakterien - Ancalochloris
Im Schlamm und in stehendem Wasser der Limane, im Brackwasser oder im
Meerwasser vorkommend. Die Art benotigt Schwefelwasserstoff und Licht.
Urspriinglich aus H2S-haltigem Schlamm mit 5% NaCl aus periodisch austrok-
kenden Ufern der Salzwasserlagune Sasyk-Sivas auf der Krim (UdSSR) isoliert.
Auch im Schlamm mit 1,5% NaCl aus der Bucht Sivas am Azowschen Meer
beim Geniceskoje-See (UdSSR) gefunden; Ferner aus Meerwasser, das von
Abwassern einer Erdolraffinerie verunreinigt war, am Gold de Fos bei Marseille
(Frankreich) isoliert.
2. Prosthecochloris phaeoasteroides Puckova et Gorlenko 1976
Verhaltnismafiig kleine, eckige, abgerundete oder auch langliche Zellen, die 10-
20 Prostheken Desitzen. Zellen in eine diinne Schleimkapsel eingeschlossen.
Vermehrung durch Knospenteilung. Manchmal entstehen betrachtlich kleinere
Tochterzellen, was an Knospung erinnert. Gelegentlich bildet sich zwischen den
sich teilenden Zellen ein Fortsatz, aus dem nach der Teilung bei beiden Zellen
Prostheken hervorgehen. Bei unvollstandiger Teilung entstehen verzweigte
Zellketten, deren Konfiguration von der Teilungsebene abhangig ist. Einzelne
Zellen sind farblos; Zellsuspensionen dagegen dunkelbraun bis schokolade-
braun. Bei Ausscheidung von elementarem Schwefel wird die Kultur dunkler
und bekommt einen gelblichen Farbton. Auf Agarboden wachsen dunkelbraune
Tiefenkolonien mit einem weifilichen Anflug von ausgeschiedenem Schwefel.
Pigmente sind Bakteriochlorophyll e und a; von den Karotinoiden iiberwiegt
Isoreniaten.
Streng anaerob mit photolithotropher Ernahrung. H2S wird zu elementarem
Schwefel oxydiert, der aufierhalb der Zelle abgelagert, und weiter zu Sulfaten
oxydiert wird. Aufier H2S konnen als Elektronendonator elementarer Schwefel
oder Thiosulfat dienen. Sulfate werden nicht reduziert. Verwertet werden
Azetat, Pyruvat, Laktat, Fumarat, Fruktose, Malat und Mannit, organische
Stoffe jedoch nur in Anwesenheit von H2S und C02. Zum Wachstum wird
Vitamin B12 benotigt. Als Stickstoffquelle dienen Amoniumsalze, Kaseinhydro-
lysat und Glutamat, jedoch nicht Nitrate und Asparagin. Optimales Wachstum
bei pH-Wert 7,0, sonst im Bereich von 6,0-7,5; Optimaler Salzgehalt 0,5-2,0%,
wachst aber auch im Bereich von 0,2—7,0%.
Zellgrofie 0,3-0,6 X 0,5-0,8 urn; Prostheken 0,13-0,16 ^im breit und 0,07-
0,3 (J.m lang.
Im Plankton des Metalimnions und Hypolimnions von Schwefelwasserstoff
enthaltenden, meromikrischen tiefen Seen mit erhohten Mineralstoffgehalt
vorkommend. Aus dem Mogil'noje See auf der Insel Kil'din in der Barent-See
(UdSSR) und dem Faro-See in Sizilien (Italien) isoliert.
F_s ist nicht ausgeschlossen, dafi dieser Organismus schon friiher beobachtet,
aber mit Chlorobium phaeobacteroid.es verwechselt wurde; unter dem Lichtmi-
kroskop sind die Prostheken nur sehr schlecht sichtbar.
5. Ancalochloris Gorlenko et Lebedeva 1971
Zellen zu charakteristischen, sternartigen Aggregaten vereinigt. An der Zell-
oberflache mit einigen scharf zugespitzten kegelformigen Prostheken, die an der
Basis weniger oder ebenso breit wie die Zellen sind. Prostheken in ihrer Grofie
sehr veranderlich und von den Wachstumsbedingungen abhangig. Zellen in
diinnen Schleimkapseln eingeschlossen; unbeweglich. Einzelne Zellen hellgriin,
in Massen satt grasgriin gefarbt; Zusammensetzung der Pigmente bisher unbe-
kannt. Manchmal mit Gasvakuolen, doch ohne Schwefeltropfen. Sporen werden
nicht gebildet. Unter natiirlichen Bedingungen bilden die Zellen unregelmafiig
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Microchloris - Pelogloea ■ 111
Mikrokolonien, die aus einigen Dutzend Einzelzellen bestehen, deren Randzel-
len langere Prostheken besitzen. Seltener sind Zellen mit langen Prostheken zu
kurzen Ketten angeordnet. In Anreicherungskulturen bilden sie kleine Zellgrup-
pen, bei denen die Prostheken wesentlich kiirzer sind.
Die Zellen sind obligat phototroph, streng anaerob. Elementarer Schwefel wird
aufierhalb der Zellen abgelagert. Als Elektronendonatoren dienen Sulfide und
Schwefelwasserstoff. Vermehrung in Form einer unregelmafiigen Teilung durch
Einschniirung, wobei keine neuen Prostheken entstehen. Dadurch unterscheidet
sich diese Gattung von Prosthecochloris. Nach der Teilung bleiben die Zellen
beisammen und bilden charakteristische Mikrokolonien. Mutterzellen
wesentlich grofier als die Tochterzellen.
Im Metalimnion und Hypolimnion meromiktischer und holomiktischer Seen.
Wichtigste Literatur: Gorlenko und Lebedeva 1971
Eine einzige Art:
Ancalochloris perfilievii Gorlenko et Lebedeva 1971 (Fig. 59)
Mit den Merkmalen der Gattung.
Zellen nach der Teilung meistens 0,5 X 1,0 \im grofi, Prostheken 1,0 bis
hochstens 2,0 (im lang, an der Basis 0,7 (j.m und an der Spitze ungefahr 0,1 [im
breit.
Im Schlamm und in den unteren Wasserschichten meromiktischer Seen; in den
Seen Cernyj Kicier und Bolsoj Kicier (in 10-17 m Tiefe), Kazachstan (UdSSR)
gemeinsam mit anderen griinen Schwefelbakterien. Vorkommen nach Gorlenko
und Lokk (1979) auch in den Tollari-, Mjachki- und Vijtina-Seen im siidostli-
chen Gebiet von Estland (UdSSR).
Gattungen unsicherer taxonomischer Stellung:
6. Microchloris Pringsheim 1953
Zellen in Form kleiner Stabchen, die in einer leicht zerfliefienden Schleimkapsel
locker eingebettet sind. Mikrokolonien in Form von Lagern. Einzelne Zellen.
farblos, in Anhaufungen gelbgriin gefarbt. In fliissigen Kulturen anfangs gelb,
spater olivgriin, im auffallenden Licht griinblau. Mit Bakteriochlorophyll a. In
fliissigen Medien bildet sich am Boden des Kulturgefafies eine Schleimschicht,
die von der dariiber stehenden Fliissigkeit scharf getrennt ist.
Vermehrung durch Querteilung. Zellen unbeweglich.
Wichtigste Literatur: Pringsheim 1953, Bourrelly 1954, Prevot 1966.
Eine einzige Art:
Microchloris nadsonii Pringsheim 1953 (Fig. 60)
Mit den Merkmalen der Gattung.
Zellen 0,4 X 2,3—4,5 (-6,0) (im grofi; die kleinste griine Schwefelbakterie.
In verunreinigtem Wasser vorkommend; urspriinglich in Graben mit Abwassern
bei Cambridge (England) gefunden.
Nach Bergey's Manual (1974) sollte dieser Organismus in die Gattung
Chlorobium eingereiht werden. Weitere taxonomische Untersuchungen sind notig.
7. Pelogloea Lauterborn 1913
Zellen kurz oder lang stabchenformig, kurze Faden oder Ketten bildend, aus
denen unregelmafiige, grofie Kolonien hervorgehen, die von einer diinnen, leicht
112 ■ Photothrophe Bakterien - Pelogloea
fc| €£>' ■••
<!22»
:*&
t
62
61
Fig 60 Microchloris nadsonii - (nach Pringsheim, 1953. - 3000X). Fig. 61.
Pelogloea chlonna - (nach Anagnostidis, 1968. - lOOOx). Fig. 62. Pelogloea
bacillifera - (nach Anagnostidis, 1968. - lOOOx).
zerfliefienden Schleimkapsel umgeben sind. Zellager an Kolonien von Chloro-
nostoc erinnernd, doch besitzt letztere kugelformige Zellen.
Typus generis: Pelogloea chlorina Lauterborn 1913
Wichtigste Literatur: Lauterborn 1913, Geitler und Pascher 1925, Krasil'nikov
1949, Pringsheim 1953, Starmach 1966, Bergey's Manual 1974.
Bestimmungsschlussel der Arten
la Zellen 1,0 X 3,0-8,0 ^m grofi; lockere Kolonien bildend, in denen die Zellen
in kurzen Ketten angeordnet sind 1. P. chlorina
lb Zellen 1,5 X 2,0-4,0 ^m grofi; dichte Kolonien in Schleimkapseln bildend, in
denen die Zellen meist einzeln liegen 2. P. bacillifera
1. Pelogloea chlorina Lauterborn 1913 (Fig. 61)
Pelodictyon chlorinum (Lauterborn 1913) Krasil'nikov 1949
Zellen in Form lingerer und gerader, manchmal auch leicht gekrummter Stab-
chen, die an den Enden mafiig abgerundet sind; zu locker gewundenen, kurzen
Ketten vereinigt und gemeinsam von einer Gallertkapsel umgeben. Mittels
Schleimmassen grofie Kolonien bildend, in denen die Zellketten locker und
unregelmafiig angeordnet sind. Zellen gelbgriin gefarbt. Vermehrung durch
Teilung. Zellen und Kolonien unbeweglich.
Zellen 1,0 X 3,0-8,0 ^m grofi, manchmal langer; Kolonien ungefahr 1 mm
grofi.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chloronostoc - Tetrachloris ■ 113
In H2S-haltigem Wasser vorkommend; wurde im Schlamm mit faulenden Uber-
resten von Chara gefunden.
Pringsheim (1953) gibt eine detaillierte Beschreibung einer Form aus verunreinigtem
Schlamm in Strafiengraben. Diese war in Kultur blaugriin, auch die einzelnen Zellen waren
stark gefarbt. Auf Grund der Farbung hatte er sie zu den Blaualgen der Familie Chroococca-
ceae gestellt. Krasil'nikov (1949) vereinigt diese Art mit Pelodictyon luteum (=Pelodictyon
aggregatum).
2. Pelogloea bacillifera Lauterborn 1916 (Fig. 62)
Zellen kurz stabchenformig, an den Enden abgerundet; unregelmafiige, in
Schleimkapseln eingeschlossene Mikrokolonien bildend. Zellen in den Kolonien
meistens einzeln und dicht gepackt, gelbgriin bis griin gefarbt und
unbeweglich.
Zellen 1,5 X 2,0—4,0 (im grofi; Kolonien bis 1 mm im Durchmesser erreichend.
Im Schlamm stehender Gewasser.
8. Chloronostoc Pascher 1925
Zellen kugelig, kokkenartig; kurze, aus einigen Zellen bestehende Faden oder
Ketten bildend. Teilungsebene der Zellen im Verband nicht immer gleichblei-
bend, Faden daher verschiedenartig und unregelmafiig gekrummt. Zellen mit-
einander nicht fest verbunden, sondern frei nebeneinander liegend. Durch
Druck wird die Fadenstruktur zerstort. Einzelzellen mit einer feinen Zellwand
und von einer Schleimkapsel umgeben. Protoplasma homogen, nur manchmal
mit kleinen Granula; hell gelbgriin. Zellketten durch Schleim zu grofen
Mikrokolonien in Form von Lagern verbunden; Schleim leicht fliissig werdend.
Manchmal sind in den Lagern um die Faden scheidenartige Faltungen der Kapsel
zu sehen. Im ganzen den Lagern von Pelogloea sehr annlich, doch durch die
kugelformigen Zellen verschieden. Vermehrung durch Teilung. Zellen
unbeweglich.
Wichtigste Literatur: Geitler und Pascher 1925, Skuja 1948, 1956, Bocher
1949.
Eine einzige Art:
Chloronostoc abbreviatum Pascher 1925 (Fig. 63)
Mit den Merkmalen der Gattung.
Zellen 1,0 \im im Durchmesser, Lager 30—40 (im grofi.
Im Schlamm, in stehenden faulendem Wasser sowie in Schwefelquellen. Wurde
als einziger dort auftretender Organismus aus faulendem Schlamm entlang der
Traun bei Ischl (Osterreich) beschrieben.
Krasil'nikov (1949) stellt diese Art zu Chlorobium limicola. Skuja (1956) erhalt sie als
selbstandige Gattung aufrecht. In Bergey's Manual (1974) wird sie nicht angefuhrt. Bocher
(1949) halt Chlorobium limicola nur fur eine Form von Chloronostoc abbreviatum.
9. Tetrachloris Pascher 1925
Zellen kugelig oder ellipsoidisch; Paare, am haufigsten jedoch Tetraden oder ihr
Vielfaches bildend. Zellkolonien mit einer feinen Schleimkapsel; manchmal
werden grofie Kolonien gebildet, die in ihrer Form an rechtwinkelige, einschich-
tige Tafeln erinnern. Protoplasma homogen mit nicht naher bekannten Pigmen-
ten. Wahrend der Photosynthese wird Kohlendioxid zu organischen Stoffen
114 ■ Phototrophe Bakterien - Tetrachloris
reduziert. Das Vorkommen der Art ist an Schwefelwasserstoff im Wasser
gebunden.
Nach Pringsheim (1953) gehort die gesamte Gattung zu den Cyanophyceen.
Typus generis: Tetrachloris inconstant Pascher 1925,
Wichtigste Literatur: Pascher in Geitler und Pascher 1925, Skuja 1948, Krasil'-
nikov 1949, Pringsheim 1953, Starmach 1966, Bergey's Manual 1974.
Bestimmungsschliissel der Arten
la Zellen in Paaren oder Tetraden angeordnet 2
lb Zellen tafelformige Kolonien bildend, die in eine Schleimkapsel eingebettet
sind 2. T. merismopedioides
2a Zellen meistens Tetraden oder Paare in einer diinnen Schleimkapsel bildend
1. T. inconstans
2b Zellen einzeln oder nur in Paaren, ohne Schleimkapsel ... 3.T. diplococcus
1. Tetrachloris inconstans Pascher 1925 (Fig. 64)
Zellen kugelig, einzeln oder in Paaren oder Tetraden angeordnet. Ausnahmswei-
se kommen grofie tafelformige Kolonien vor. Zellen oder kleine Kolonien oft
i X\ VW"J
° # 8 °
o g
000000000
00000(3000
0000 000
000
©0
,9000
SGQ0
0000
00
00
0030
65
000000 00
60000000
Q0000000
00000000
00 QQQQeO
00 0G0000
00 000000
00 000800
0000
66
Fig. 63. Chloronostocabbreviatum -a einzelne Zellketten, 2000X, b Kettenko-
lonien in Schleimkapseln, 1000X (nach Geitler und Pascher, 1925). Fig. 64.
Tetrachloris inconstans - (nach Geitler und Pascher, 1925. - 2000X). Fig. 65.
Tetrachloris merismopedioides - (nach Anagnostidis, 1968. - 2000X). Fig. 66.
Tetrachloris diplococcus - (nach Pringsheim, 1953.^JD00X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sorochloris 115
von einer diinnen und festen Schleimschicht umgeben, die eine feine Aureole
bildet. Zellen hell gelbgriin gefarbt; unbeweglich. Vermehrung durch Teilung in
zwei zueinander senkrechten Ebenen. Oft finden sich Zellen, bei denen die
Teilung nicht zu Ende gefiihrt wurde.
Zellen im Durchschnitt 1,5 um grofi, oft jedoch auch grofier (bis 3,0 um).
Auf faulenden Pflanzenresten im Siifiwasser; gewohnlich kleine Lager bildend.
Krasil'nikov (1949) stellt diese Art zu Chlorobium limkola.
2. Tetrachloris merismopedioides Skuja 1948 (Fig. 65)
Zellen oval, vor der Teilung langlich und nach der Teilung kugelig; mit einer
farblosen diinnen Schleimkapsel; es werden Kolonien gebildet, fur die Tetraden
oder ihr Vielfaches charakteristisch sind. Grofie Kolonien haben die Form
einschichtiger Tafeln, die in eine Gallertkapsel eingeschlossen sind. Morpholo-
gisch erinnert diese Art an die Kolonien von Merismopedia minima. Zellen hell
gelbgriin gefarbt, oft auch farblos. Protoplasma junger Zellen homogen oder mit
zerstreuten kleinen Kornern, spater mit einer zentralen Gasvakuole.
Vermehrung durch Teilung, die in zwei aufeinander senkrechten Ebenen verlauft. Zellen
unbeweglich; frei im Wasser schwebend.
Zellen 0,6-0,7 X 0,7-0,9 urn grofi.
Verhaltnismafiig selten zwischen Planktonalgen im Siifiwasser; aus den Seen
Erken und Skarsjon (Schweden) beschrieben.
Farblose Stamme ahneln auffallend Lampropedia hyalina, deren Zellen jedoch
2 um grofi sind. Nach Skuja (1948) steht die Zugehorigkeit zu den Bakterien
nicht eindeutig fest.
3. Tetrachloris diplococcus Pringsheim 1953 (Fig. 66)
Zellen kugelig, oft Diplokokken bildend; ohne Schleimkapseln. Einzelne Zellen
farblos, junge Zellen in Kulturen blaugriin gefarbt. Erst nachdem die Nahrstoffe
erschopft sind, nehmen die Kulturen eine gelbgriine Farbe an. Bakteriochloro-
phyll a und ein blauer, wasserloslicher Farbstoff kommen als Pigmente vor.
Vermehrung durch Teilung. Am Rande eines hangenden Tropfens kann eine
aktive Bewegung der Zellen beobachtet werden; sie sind phototaktisch.
Einzelne Zellen 1,2-1,4 um im Durchmesser, Diplokokken bis 2,0-2,4 um
lang.
Diese Art wurde in einer Schlammprobe gefunden. Ihre Einreihung bei der
Gattung Tetrachloris ist proviso risen. Nach Pringsheim (1953) handelt es sich
wahrscheinlich um eine Blaualge aus der Familie Chroococcaceae.
10. Sorochloris Pascher 1925
Zellen kugelig, manchmal auch etwas langlich, mit feiner Zellwand. Einzeln und
in Paaren von einer dicken mehrschichtigen, weichen Gallertkapsel mit scharf
begrenzten Randern umgeben. In dieser grofie kugelformige oder knauelartige
Zellgruppen bildend. Manchmal sind in einer Kapsel zwei oder mehrere
Kolonien vorhanden. Alte Kolonien sind hohl und bestehen aus einer einzigen
Zellschicht. Morphologisch den Blaualgen der Gattung Microcystis ahnlich.
Einzelne Zellen hell gelbgriin, Kolonien gelbgriin bis braungriin gefarbt;
Protoplasma feinkornig. Vermehrung durch Teilung der Zellen und Zerfall der
Kolonien in kleinere selbstandige Kolonien. Zellen unbeweglich.
Wichtigste Literatur: Pascher in Geitler und Pascher 1925, Krasil'nikov 1949,
Skuja 1956, Starmach £|6, Bergey's Manual 1974.
116 ■ Phototrophe Bakterien - Pelosphaera
Eine einzige Art:
Sorochloris aggregata Pascher 1925 (Fig. 67)
Mit den Merkmalen der Gaming.
Zellen 1,5 um im Durchmesser. Manchmal kommen in den Kolonien neben den
gleichgrofien Zellen auch einige grofiere Zellen vor. Kolonien 10-25 um grofi.
In stehenden Gewassem mit faulenden Pflanzenresten, in Wassergraben, Pfiit-
zen, Siimpfen und eventuell auch im Schlamm. Diese Art wurde nach Material
aus dem Freiland unvollkommen beschrieben. Reinkulturen wurden nicht ge-
wonnen. Seit der Beschreibung wurde auch der Organismus nicht wieder
beobachtet.
Krasil'nikov (1949) vereinigt diesen Organismus mit Tetrachloris inconstans, den Skuja
(1956) als selbstandiges Taxon sieht. Nach Bergey's Manual (1974) miifite er, falls keine
Gasvakuolen vorhanden sind, zur Gattung Chlorobium gestellt werden. Sollte es sich aber
zeigen, dafi Gasvakuolen vorhanden sind, gehort er zu Pelodictyon, was auch Pascher(1925)
schon angedeutet hatte.
67
Fig. 67. Sorochloris aggregata - a selbstandige Kolonie in Schleimkapseln, b-c
Bildung einer Tochterkolonie (nach Geitler und Pascher, 1925. - 1000X).
11. Pelosphaera Lauterborn 1906
Zellen keilformig, mit abgerundeten Enden und einer polaren Geifiel. Kolonien
kugelig oder im Alter langlich oval, aus vielen (100 bis 300) Individuen zusam-
mengesetzt. Zellen an der Oberflache der Kolonien einschichtig, wobei der
Innenraum der Kolonie mit homogenem Schleim ausgefiillt ist. Einzelne Zellen
farblos. Protoplasma homogen, manchmal mit kleinen Granula. Kolonien grau-
bis olivgriin oder leicht strohgelb gefarbt. Die Zellen sind oligothiophil bis
mesothiophil. Vermehrung durch Teilung der Zellen, wodurch die jungen
Kolonien wachsen. Altere Kolonien teilen sich durch Einschniirung in zwei
Tochterkolonien. Kolonien mit Hilfe der polaren Geifieln beweglich, wobei sie
sich um ihre Langsachse drehen.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Arten • 117
Wichtigste Literatur: Lauterborn 1906, Skuja 1948.
Eine einzige Art:
Pelosphaera rotans Lauterborn 1906
Mit den Merkmalen der Gattung.
Zellen 1,5-2,0 X 3,5-5,0 um, Kolonien 10-20 um, vor der Teilung 14-28 um
grofi.
In der Litoralzone H2S-haltiger Siifiwasser, insbesondere solcher mit faulenden
Pflanzenresten.
Die systematische Einordnung dieser Art ist nicht geklart. Skuja (1948) stellt sie
provisorisch in eine selbstandige Familie (Pelosphaeracea) der Ordnung Chlo-
robacteriales, obwohl die Farbe nicht ganz typisch ist.
Unsichere, ungeniigend beschriebene Gattungen und Arten:
Chroobacter vantieghemi Pringsheim 1953 (Fig. 68) (nomen provisorium)
(non Chlorobacter vantieghemi Starmach 1966 - lapsus calami)
Zellen in Form kleiner Stabchen, ohne Schleimkapseln, keine Ketten bildend.
Einzelne Zellen undeutlich gefarbt, in grofieren Mengen dunkel blaugriin; beim
Altern vergilbend. Als Pigmente enthalten sie Bakteriochlorophyll a und einen
wasserloslichen blauen Farbstoff. Vermehrung durch Einschniirung der Zellen.
Ohne aktive Bewegung.
Zellen 0,6-0,8 X 1,2-1,5 um grofi.
Die systematische Einreihung ist problematisch. Pringsheim (1953) stellt sie
wegen der Farbe zu den Blaualgen der Ordnung Chroococcales.
Fig. 68. Chroobacter vantieghemi - (nach Pringsheim, 1953. - 5000X). Fig. 69.
Cylindrogloea solitaria - Zellfaden mit Gallerthiillen - (nach Skuja, 1964 -
1500X).
Cylindrogloea solitaria Skuja 1964 (Fig. 69)
Einfache, sehr diinne, meist gerade und kurze Faden, mit abgerundeten Enden
und einer dicken hyalinen, manchmal auch schwach gelb gefarbten und feinkor-
nigen Schleimscheide. Der eigentliche Faden ist deutlich aus einzelnen Zellen
zusammengesetzt. Terminalzellen morphologisch mit den iibrigen Zellen des
Fadens identisch. Einzelzellen an beiden Enden mafiig abgerundet, 2-5mal
linger als breit, oft voneinander etwas entfernt. Im Gegensatz zu Cylindrogloea
bacterifera enthalten sie keine symbiotischen griinen Bakterien. Die Kapsel ist
118 • Phototrophe Bakterien - Zu streichende Arten
wesentlich diinner. Protoplasma farblos und homogen. Vermehrung durch
Teilung. Unbeweglich, doch frei schwebend.
Einzelne Zellen 0,8-2,5 urn lang und 0,4 [im breit, Faden 30 [im, seltener 50 urn
lang und mit Scheide 2,5-3,5 urn breit; Scheide meist 1,5-1,7 urn dick.
Mit anderen thiophilen Organismen vergesellschaftet im Hypolimnion von
Siifiwasserseen; wurden aus dem See Vuolep Njakajaure (Abisko-Gebiet,
Schweden) beschrieben.
Der Name Cylindrogloea wurde als Laborbezeichnung fur das Konsortium
gewahlt. Da dieser Organismus aber keine Konsortien bildet, ist seine Benen-
nung recht problematisch.
Bacterium chlorophyllophorum Vinberg et Sivko 1952
«Griine Bakterie» Zacharov et Konstantinova 1929
Zellen einzeln, kurz stabchenformig, fast ebenso lang wie breit, griin gefarbt.
Keine Bakteriochlorophylle, sondern, nach Godnev und Vinberg (1951), wie
griine Pflanzen Chlorophyll a und b enthaltend; daneben eine Menge von
Karotinoiden sowie Xanthophyll. Offensichtlich ein phototropher, aerober
Organismus, der bei der Photosynthese Sauerstoff statt elementaren Schwefel
ausscheidet. Er vertragt kein saures Wasser und wachst bei pH 5,7 nicht mehr.
Kleine Zuckerkonzentrationen, wie z. B. 10mg/l Glukose, inhibieren das
Wachstum. Zellen unbeweglich, gramnegativ.
Zellen annahemd 0,5-0,7 [im lang und fast ebenso breit.
Dieser eigenartige Organismus kommt in riesigen Massen als Planktonorganis-
mus biologischer Klaranlagen vor und verleiht dem Wasser eine charakteristische
smaragdgriine Farbung. Seine Entfaltung beginnt erst nach der anaeroben
Zersetzung der organischen Stoffe, zu der Zeit, wo die erste Entwicklungsphase
des Zoo- und Phytoplanktons endet. Es kommt sehr schnell zu einer Massenent-
wicklung und Ausbildung einer Monokultur mit einer Konzentration von bis zu
lOOmg/lundlOO X 10M1000X 106 Einzelzellen je 1 ml Wasser. Der
Organismus ist fur die Selbstreinigung der Abwasser von grofier Bedeutung. Wahr-
scheinlich (Vinberg und Sivko 1952) auch in normalen Wasserbecken, allerdings
nicht in solchen Mengen vorhanden. Das Vorkommen dieses Organismus wurde
erstmalig in biologischen Klaranlagen bei Minsk (UdSSR) von Zacharov und
Konstantinova (1929) beschrieben. Spater wurde dieser Fund mehrmals bestatigt
(Mejin 1932, Kuznecov 1955).
Zacharov und Konstantinova (1929) stellen diese Art zu den griinen Schwefel-
bakterien der Familie Chlorobiaceae. Kondrat'eva (1961, 1963) halt dies nicht
fur richtig, da bei der Photosynthese molekularer Sauerstoff ausgeschieden wird
und normales Chlorophyll vorhanden ist. Bedarf eingehender Untersu-
chungen.
Zu streichende Gattungen und Arten:
Chloropseudomonas Czurda et Maresch 1937 (nomen conservandum)
Zellen kurz, stabchenformig, mit abgerundeten Enden, Einzeln lebend, mor-
phologisch der Gattung Chlorobium sehr ahnlich. Sie unterscheiden sich jedoch
durch die subpolare Geifiel, die mehrmals linger als die Zelle ist; aktiv beweg-
lich. Nach der Teilung entfernen sich die Zellen rasch voneinander, so dafi
niemals Ketten gebildet werden. Ohne Gasvakuolen; keine Sporen bildend.
Zellen gramnegativ, einzeln farblos oder etwas grunlich, Zellsuspensionen inten-
siv gelbgriin gefarbt. Als Photoassimilationspigmente sind Bakteriochlorophyll
c und Karotinoide der 5. Gruppe, vor allem Chlorobakten, vorhanden. Der
Bakteriochlorophyllgehalt hangt von den Wachstumsbedingungen ab; er ist am
grofiten bei Zellen in der logarithmischen Phase und bei heterotrophem
Wachstum. ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Zu streichende Arten • 119
Die Zellen sind streng anaerob, vertragen jedoch auch einige Stunden lang
Kontakt mit der Luft. Bei Licht wird atmospharischer Sauerstoff besser ertragen
als im Dunkeln. Ernahrung phototroph und heterotroph. In Anwesenheit von
Schwefelwasserstoff erfolgt Photosynthese, deren Produkt elementarer
Schwefel ist, der in Form von Tropfchen extrazellular im Medium abgelagert wird. Als
Elektronendonatoren werden Sulfide, Schwefelwasserstoff, elementarer
Schwefel und einige organische Verbindungen verwertet, bei einigen Stammen auch
Thiosulf ate. In Anwesenheit von Schwefelwasserstoff und Bikarbonat wird von
dieser Art eine ganze Reihe organischer Verbindungen, vor allem Athanol, bis zu
einer Konzentration von 1% assimiliert. Das ist ein charakteristisches physiolo-
gisches Merkmal. Organische Verbindungen fordern das Wachstum. Bei Ver-
wertung mancher Zuckerarten und anderer Stoffe produzieren die Zellen mole-
kularen Wasserstoff. Organische Substrate werden als Kohlenstoff- und Elek-
tronenquelle ausgeniitzt. Sie sind auch fahig, atmospharischen Stickstoff (aber
nur bei Licht) in Anwesenheit von Athanol, Essig- oder Oxalsaure zu fixieren.
Fur ein gutes Wachstum benotigen sie Vitamin B12, insbesondere unter photoau-
totrophen Bedingungen und bei Lichtintensitaten von 50-15000 Lux. Niedrige
Lichtintensitaten haben inhibierende Wirkung, sofern der Organismus auf
organische Substraten wachst. Manche Stamme benotigen kein NaCl, andere
sind halophil. Als Reservestoff wird das Polysaccharid Glukan gespeichert.
In Seen, Teichen, Flufimiindungen, in stehendem Sufi- oder Salzwasser, sowie
im Schlamm dieser Gewasser vorkommend. Die Art ist iiberall dort zu finden,
wo Licht, Schwefelwasserstoff und faulende organische Stoffe vorhanden sind.
Wichtigste Literatur: Czurda und Maresch 1937, Bergey's Manual 1948,1974,
Saposnikov et al. 1959, 1960, Skalinskij und Kondrat'eva 1961, Pfennig und
Lippert 1962, Balickaja 1962, Mosenceva und Kondrat'eva 1962, Kondrat'eva
und Gogotov 1962, Kondrat'eva 1963, 1967, Balickaja und Kondrat'eva 1963,
Lianen-Jensen 1964, Uspenskaja und Sumarukova 1966, Holt et al. 1966,
Trocenko 1966, Vanjusin 1966, Uspenskaja et al. 1967, Kondrat'eva et al. 1968,
1970, Trocenko und Kondrat'eva 1968, Pfennig und Triiper 1969, Kondrat'eva
und Gogotov 1969, Kondrat'eva und Trocenko 1969, Gusev et al. 1970,
Zachvataemaja et al. 1970, Tkaceeva und Kondrat'eva 1971, Ivanovskij et al.
1971, Gray et al. 1972, 1973, Gray 1977, Olson 1978.
Eine einzige Art:
Chloropseudomonas ethylica Saposnikov et al. 1960 (Fig. 52)
(non Chloropseudomonas ethylicum Saposnikov et al. 1960)
Chlorobium ethylicum Saposnikov et al. 1959
Mit den Merkmalen der Gattung.
Zellen 0,5-0,7 X 1,0-1,5 um grofi, Geifiel 3-4 mal langer als die Zelle.
Urspriinglich aus dem Schlamm der Flufimundung des Kujal'nik bei Odessa und
aus dem See Saksky auf der Krim isoliert; weiter aus den Limanen von Odessa
und aus dem Schlamm des Sees Sernoje, Kujbysev-Gebiet (UdSSR) bekannt. Der
Name Chloropseudomonas wurde urspriinglich fur die griine bewegliche photo-
synthetische Bakterie vorgeschlagen (Czurda und Maresch 1937). In Bergey's
Manual (1948) wurden die Organismen dieser Gattung zu der Gattung
Chlorobium gestellt, ebenso auch Kulturen, die von Saposnikov et al. (1959) als griine
unbewegliche, stabchenartige photosynthetiscne Bakterien neu beschrieben
wurden, unter der Bezeichnung Chi. ethylicum. Spatere Isolate wurden als
bewegliche 0,8-0,9 x 1,0-1,5 [im grofie Zellen beschrieben (Saposnikov et al.
1960) und als solche in die Gattung Chloropseudomonas gestellt. Gray et al.
1972, 1973 haben jedoch bewiesen, dafi es sich um eine Mischkultur von
beweglichen, farblosen, nicht photosynthetischen griinen Bakterien handelte.
Die griinen Bakterien bejjjchteten sie als Chlorobium limicola.
120 • Phototrophe Bakterien - Chloroflexaceae
Nach Pfennig (1976, miindliche Mitteilung, zit. Olson 1978) handelt es sich in
einigen Kulturen tatsachlich um Chlorobium limicola in anderen jedoch um
Prosthecochloris aestuarii. Die farblose Bakterie wurde dann als ein neuer
Organismus unter dem Namen Desulforomonas acetoxidans beschrieben
(Pfennig und Triiper 1969). Auf Grund dieser Tatsachen hat Gray (1977) vorgeschla-
gen, den Gattungs- und Artnamen Chloropseudomonas ethylica unter «nomina
rejicienda» zu stellen.
Bacterium viride van Tieghem 1880
Als griine unbewegliche Schwefelbakterie beschrieben, doch nach Dangeard
(1890) wahrscheinlich eine kleine Form griiner Algen.
Bacillus virens van Tieghem 1880
Wahrscheinlich auch eine kleine Griinalge.
Bacillus virescens Dangeard 1909
Buder (1913) und Kondrat'eva (1963) halten diese Art fur identisch mit Chloro-
chromatium aggregatum. Ungeniigend beschriebene Art, die nicht mehr identi-
fiziert werden kann.
Bacterium chlorinum Engelmann 1882
Unzureichend beschriebener Organismus, der in einer S/>zrz//«m-Kultur gefun-
den wurde und nicht mehr identifizierbar ist. Nach Buder (1913) und
Kondrat'eva (1963) wahrscheinlich mit Chlorochromatium aggregatum identisch.
2. Familie Chloroflexaceae Triiper 1976
Zylinderformige Zellen bilden stark flexible, unverzweigte Faden verschiedener
Lange, die eine gleichmafiige Breite aufweisen. Bei derTypusgattung sind keine
Querwande sichtbar. Faden in eine Schleimscheide eingeschlossen. Zellen ent-
halten Granula von Poly-fS-Hydroxybuttersaure. Bei einer Gattung im Mittelteil
der Zellen Gasvakuolen vorhanden. Als photosynthetische Strukturen sind
Vesikula des Chlorobium-Typs an der Peripherie der Zelle vorhanden. Enthal-
ten Bakteriochlorophyll c, d oder e und geringe Mengen von Chlorophyll a. Als
Hauptkarotinoid kommt y-Karotin vor, wahrend Chlorobacten vollkommen
fehlt.
Ernahrung phototroph. Die Typusgattung gehort zu den Organismen mit den
verschiedenartigsten Emahrungsarten, die bisher beschrieben wurden. Unter
anaeroben Bedingungen ist sie photoorganotroph; bei Anwesenheit von Sulfiden
photolithotroph; unter aeroben Bedingungen chemoorganotroph. Weder die
physiologischen Eigenschaften noch der Metabolismus sind bisher genau be-
kannt. Die Typusgattung ist thermophil.
Vermehrung aurch Abtrennung von Fadenfragmenten (moglicherweise auch
von selbstandigen Zellen) und inre Freisetzung aus der Scheide.
Zum Unterschied von der Familie Chlorobiaceae ist fur obige Familie eine
gleitende Bewegung charakteristisch, ahnlich wie bei den heterotrophen Flexi-
bakterien.
Vorkommen in heifien alkalischen Quellen, in Stifiwasserseen auf der Schlamm-
oberflache oder freischwebend im Wasser; alle Gattungen meistens in anaero-
bem Milieu.
Typus familiae: Chloroflexus Pierson et Castenholz 1974
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chloroflexus -121
Bestimmungschltissel der Gattungen
la Faden 0,5-1,1 \un breit, Querwande im Lichtmikroskop undeutlich. Sessil
auf einer Unterlage. Keine Gasvakuolen. Enthalten Bakteriochlorophyll a
und c,. Anaerob im Licht wachsende Kulturen sind orange gefarbt
1. Chloroflexus (S. 121)
lb Faden 1,5-2,5 \im breit, Querwande im Lichtmikroskop gut sichtbar. Frei
schwebend. Gasvakuolen. Enthalten Bakteriochlorophyll d oder e. Anaerob
im Licht wachsende Kulturen sind gelbgriin 2. Chloronema(S. 123)
1. Chloroflexus Pierson et Castenholz 1974
Chloroflexis Pierson et Castenholz 1971
Verhaltnismafiig schmale, lange, unverzweigte, betrachtlich flexible,
zylinderformige Faden von sehr variabler Lange und gleichmafiiger Breite. Unter dem
Lichtmikroskop (Phasenkontrast) keine Querwande sichtbar, diese nur elek-
tronmikroskopisch nachweisbar. Gramnegativ. Keine Geifieln. Trichome mit
einer diinnen, schwer sichtbaren Scheide. Zellen enthalten verschiedene Inklu-
sionen in Form von Granula, unter denen wahrscheinlich auch Poly-|3-Hydro-
xybuttersaure vorkommt. Einige Granula sind bei photoorganotrophem Wachs-
tum sudanophil. Ferner enthalten die Zellen eine oder mehrere Membranstruk-
turen ahnlich den tvpischen Mesosomen. Phototroph wachsende Faden
enthalten Vesikula des Chlorobium-Typs, die dicht auf der zytoplasmatischen Mem-
bran angeordnet sind. Unter anaeroben Verhaltnissen und reduzierter Lichtin-
tensitat phototroph wachsende Faden haben dunkelgriine Farbe. Bei hoherer
Lichtintensitat oder unter aeroben Bedingungen sind sie hellorange bis rotoran-
ge. Als Photoassimilationspigmente enthalten sie Bakteriochlorophyll a und c,
(eine neue, bisher nicht bekannte Chlorophyllart) und von Karotinoiden das
|3-Karotin (Primarkarotinoid der Cyanobacteriales), y-Karotin und Glykoside
der y-Karotins. Ein Stamm besitzt jedoch kein Chlorobacten, das sonst typisch
fur griine Schwefelbakterien ist.
Unter anaeroben Bedingungen ist die Ernahrung photoorganotroph; unter
bestimmten Umstanden kann sie auch photolithotroph sein. Im Dunkeln und,
bei Licht unter anaeroben Bedingungen dagegen chemoorganotrophe
Ernahrung. Nicht wachstumsfahig im Dunkeln unter anaeroben Bedingungen. Photo-
synthese wird durch Sulfide stimuliert (Elektronendonatoren bei photosyntheti-
scher C02-Reduktion). Kohlenstoff erhalten sie offenbar aus Stoffen, die von
Blaualgen (Synechococcus, Phormidium), mit denen sie in Symbiose leben,
produziert werden. Die Stickstoffquelle ist bisher noch nicht bekannt. Schwefel
wird aus Sulfaten und Aminosaure entnommen. Thermophil. In den urspriingli-
chen Lokalitaten wurden C02-fixierende Faden noch bei einer Temperatur von
70-72 °C beobachtet. Es scheint jedoch, dafi das Temperaturoptimum bei 52-
60 °C liegt. Vermehrung durch Abtrennung von Fadenfragmenten,
moglicherweise auch von einzelnen Zellen aus der Scheide.
Gleitende Bewegung ist fiir die Gattung sehr charakteristisch. Vorkommen in
heifien alkalischen Quellen, wo sie orangene bis lichtrote Aufwiichse bilden, die
einige mm dick sind, gewohnlich unter einer diinneren Blaualgenschicht liegend,
mit denen sie wahrscheinlich in Symbiose leben. Vermutlich entstehen im Innern
der gemeinsammen Aufwiichse Sulfide (die Blaualge Synechococcus lividus redu-
ziert z. B. Thiosulphat zu H2S); in sulfidreichen Quellen leben sie ohne
Blaualgen (photolithotrophes Wachstum). Morphologisch den Flexibakterien der
GattungHerpetosiphon sehr ahnlich; aufierdem erinnern sie an Blaualgen aus der
Gattung Phormidium.
122 ■ Phototrophe Bakterien - Chloroflexus
Wichtigste Literatur: Brock 1968, 1969, Castenholz 1969, 1973a, 1973b,
Pierson und Castenholz 1971, 1974a 1974b, Halfen et al. 1972, Pierson und
Howard 1972, Walter et al. 1972, Bauld 1973, Bauld und Brock 1973, 1974,
Komarek 1973, Pierson 1973, Madigan et al. 1974, Dubinina und Gorlenko
1975, Gorlenko 1975, Triiper 1976, Pivovarova und Gorlenko 1977, Gloe und
Risch 1978.
Eine einzige Art:
Chloroflexus aurantiacus Pierson et Castenholz 1974
Chloroflexus aurantiacus var. mesophilus Pivovarova et Gorlenko 1977
Mit den Merkmalen der Gattung.
Auf festen Medien bilden sich typische orangefarbene, sich ausdehnende Kolo-
nien, ahnlich den Kolonien anderer Fadenbakterien.
Optimales Wachstum bei pH 7,6-8,4, kein Wachstum bei pH unter 7,0.
Optimaltemperatur 52-60 °C, Maximaltemperatur 65-70 °C, minimale etwa
30-35 °C. Als Kohlenstoffquelle fiir photoorganotrophes Wachstum dienen
vor allem von Blaualgen produzierte Stoffe. Es sind offensichtlich einfache
Verbindungen wie Azetat, Aspartat, Glutamat in geringen Mengen, aufierdem
Glukose, Pyruvat, Glutamat und Laktat. Auf Athanol, Sukzinat, Malat und
Butyrat kein Wachstum. C02 dient ebenfalls als Kohlenstoffquelle.
Bewegung durch charakteristisches Gleiten auf einer Oberflache, wobei auf
Agarmedien (1,5%) eine Geschwindigkeit von 0,01-0,4 utn/Sek. bei 55-60 °C
erreicht wird.
Faden 0,5-1,0 um breit, von unterschiedlicher Lange, allgemein 30-300 urn
lang. Zellen auf Praparaten fiir Elektronenmikroskopie 2,0-6,0 urn lang.
Vorkommen in spezifisch stratifizierten Aufwiichsen, die aus Griinalgen,
Blaualgen und Bakterien bestehen. In heifien alkalischen Quellen mit einer Tempera-
tur von rund 73 °C, jedoch auch in Quellen mit Temperaturen von 50-55 °C.
Bei Temperaturen iiber 50 °C Aufwiichse deutlich geschichtet: Oberflachen-
schicht blaugriin (enthalt die Blaualge Synechococcus Uvidus), darunter eine
orangefarbene Schicht von photosynthetischen, gleitenden Bakterien der
Gattung Chloroflexus. Zum Unterschied von Lokalitaten, wo die iibrigen griinen
Schwefelbakterien vorkommen, ist im Wasser Sauerstoff vorhanden, was durch
die Tatigkeit der symbiotischen Blaualgen verursacht wird.
Urspriinglich gefunden und beschrieben aus einer heifien Quelle im Sokokura
Canyon (District Hakone, Japan), spater auch in einer Reihe von heifien Quellen
in Nordamerika und anderen Teilen der Welt gefunden. Offenbar kosmopoli-
tisch verbreitet.
Zu dieser Art mufi man auch die neu beschriebene Varietat, die sich durch die optimale
Wachstumstemperatur unterscheidet, stellen:
a. Chloroflexus aurantiacus var. mesophilus Pivovarova et Gorlenko 1977
Dunne Faden werden von eng verbundenen zylinderformigen Zellen gebildet. Trichome
gerade oder leicht gewellt, unverzweigt, gleichmafiig breit, mit einer fibularen
Schleimscheide, die am Ende des Fadens gut sichtbar ist. In Anwesenheit von organischen Stoffen und
Thiosulfat lagert sich in der Scheide Eisen(II)sulfid in Form von Granula ab, wodurch sich
der Fadendurchmesser vergrossert. Querwande zwischen den Zellen sind nicht sichtbar,
nicht einmal im Phasenkontrast oder elektronenmikroskopisch. Zellwand typisch fiir
gramnegative Bakterien. Zellen ohne Gasvakuolen. Alte Kukuren enthalten Kornchen von
Poly-p-Hydroxybuttersaure. Photosynthetische Strukturen (Chlorobium - Vesikula) an
der Zellperipherie angeordnet. Bei anaerobem Wachstum enthalten sie als photoassimilie-
rende Pigmente Bakteriochlorophyll c und Karotinoide unbestimmter Zusammensetzung.
Zellsuspension im anaeroben Milieu bei Licht griin, im aeroben Milieu sowohl bei Licht als
auch im Dunkeln rosaorange.
Auf festen Medien bilden sich Tiefkolonien, abeerundet mit auslaufenden Fadenstrahlen.
Auf der Agaroberflache entstehen flache rosafarbige Kolonien mit zungenartigen Auslau-
fern.
Phototrophes Wachstum sowohl unter anaeroben als aucl^^roben Bedingungen auch auf
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chloronema • 123
komplizierten organischen Substraten. Benotigen weder H2S noch Thiosulfat zum
Wachstum. Vermehrung durch Abtrennung grofierer oder kleinerer Teile des Trichoms, die die
Scheide verlassen; der entstandene Raum fiillt sich mit Schleim.
Faden 0,5-1,1 \im breit. Einzelne Zellen 0,5-2,5 \im, meistens 1,0-1,5 (im lang.
Mesophil, wachst im Bereich von 10-40°C. Optimaltemperatur 20-25 °C. Optimaler
pH-Wert 7,0-7,2.
Weit verbreitet auf der Schlammoberflache in stratifizierten Sufiwasserseen mit verschiede-
nem H2S-Gehalt.
Bisher zwei Stamme isoliert, die sich durch die Fadenbreite unterscheiden, nur einer in
Reinkultur. Aus den Seen Belrestjanoe auf der Karelischen Landenge, Konon'er und Cernyj
Kicier (UdSSR) bekannt.
Gattung unsicherer taxonomischer Stellung:
2. Chloronema Dubinina et Gorlenko 1975
Prokaryotische zylinderformige Zellen fest zu einem geraden oder schraubenar-
tigen Trichom vereinigt, in dem die Querwande deutlich zu sehen sind. Gelb-
griin gefarbt; enthalten Bakteriochlorophyll d oder c. Gramnegativ.
Photosynthetische Strukturen in Form von Vesikula des Chlorobium-Typs. Zahlreiche
Gasvakuolen, die im Mittelteil der Zellen vorkommen; sie ermoglichen den
Zellen, im Wasser frei zu schweben. Die Trichome sind von einer Schleimscheide
umgeben, die oft mit Eisenoxiden impragniert ist; sie ist gut sichtbar, besonders
am Ende der Faden, wo sie gewohnlich leer, d. h. ohne Zellen ist. Die Zellwand
besteht aus drei Schichten, die typisch fiir gramnegative Bakterien sind. Als
Reservestoffe enthalten die Zellen Polyphosphat- und Lipidgranula. Ernah-
rungsweise unter anaeroben Bedingungen wahrscheinlich photoorganotroph.
Im Dunkeln kommt auch aerober Metabolismus vor.
Bewegung durch charakteristisches Gleiten. Junge Faden verlassen aktiv die
Scheide.
Vermehrung durch Trennung von Fadenfragmenten oder einzelner Apikalzel-
len. Ziemlich verbreitet an der unteren Grenzschicht des gelosten Sauerstoffs in
Eisenionen enthaltendem Seewasser ohne oder mit Spuren von H2S.
Grofie morphologische Ahnlichkeit besteht nicht nur mit Blaualgen der Gattung
Lyngbya, sondern auch mit farblosen Faden der Gattung Herpetosiphon, ferner
der Gattung Pelonema, die auch Gasvakuolen hat. Aufierdem ahneln sie auch
Leptothrix pseudovacuolata sehr, von der sie sich bei reichlicher Eisenoxidin-
krustation der Scheiden nur schwer unterscheiden lassen. Friiher wurden sie
wahrscheinlich als Blaualgen aus der Gattung Lyngbya betrachtet; Skuja 1956
fiihrt einige Blaualgenarten dieser Gattung an, die Gasvakuolen besitzen, gelb-
griin gefarbt sind und in der anaeroben Zone einiger Schwedischer Seen
vorkommen.
Typus generis: Chloronema giganteum Dubinina et Gorlenko 1975.
Wichtigste Literatur: Dubinina und Gorlenko 1975.
Bestimmungsschlussel der Arten
la Faden gerade oder schraubenartig, 2,0-2,5 urn breit; Bewegung gleitend
einschliefilich der Scheide 1. Chi. giganteum
lb Faden schraubenartig, 1,5-2,0 [im breit; Bewegung durch Gleiten im Innern
einer zylinderformigen Scheide in schraubenformigerBahn
2. Chi. spiroideum
1. Chloronema giganteum Dubinina et Gorlenko 1975
Zylindrische Zellen mit Gasvakuolen, sind fest in Faden vereint, die in eine
Schleimscheide eingeschlossen sind, letztere oft mit Eisenoxiden impragniert.
124 ■ Phototrophe Bakterien - Addendum
Faden entweder gerade oder schraubenartig gekriimmt. Zytoplasmatische Mem-
bran mit photosynthetischen Strukturen (Vesikula des Chlorobium-Typs), die
manchmal auch ins Zytoplasma bei gleichzeitiger Invagination der Membranen
eindringen. Als Reservestoffe enthalten die Zellen Polyphosphat und Lipid-
Granula. Gelbgriin gefarbt; enthalten Bakteriochlorophyll d.
Ernahrung durch anaerobe Photosynthese, wahrscheinlich photoorganotroph,
jedoch auch unter aeroben Bedingungen moglich. Da es bisher nicht gelungen
ist, diesen Organismus in Reinkultur zu halten, wurde sein Metabolismus nur
auf Grund seiner okologischen Verbreitung charakterisiert.
Vermehrung durch Freisetzung eines kurzen Fadenfragments oder einer selb-
standigen Zelle aus der Scheide. Aktiv beweglich durch Gleiten, wobei sich das
ganze Trichom einschliefilich der Scheide bewegt. Junge Faden kriechen
manchmal aus den Scheiden hinaus. Sowohl photo- als auch chemotaktisch.
Einzelne Zellen 2,0-2,5 x 3,5-4,5 um grofi. Faden 150-250 um lang. Bei
schraubenformigen Faden sind die einzelnen Windungen 15-20 um lang und
8-10 um breit.
Vorkommen in Siifiwasserseen mit anaerober Zone. Ursprunglich aus dem
Gluchoe-See (Karelija, UdSSR) beschrieben. Es existieren zwei Fadentypen:
gerade und schraubenformige. Ehe nicht das Problem geklart ist, ob es sich nur
um eine morphologische Variability handelt, konnen sie nicht als selbstandige
Arten aufgefafit werden.
2. Chloronema spiroideum Dubinina et Gorlenko 1975
Zylinderformige Zellen bilden dlinne schraubenartige Faden, von einer geraden,
breiten zylinderformigen Scheide umgeben, die reich mit Eisenoxiden impra-
gniert ist. Der Durchmesser der Windungen des Trichoms wird durch den
Innendurchmesser der Scheide bestimmt. Zellen gelbgriin, enthalten
Bakteriochlorophyll d. Im Zentralteil mit Gasvakuolen.
Ernahrungsweise bisher nicht bekannt, offenbar photoorganotroph. Bewegung
durch typisches Gleiten auf einer schraubenartigen Bahn im Innern der
zylinderformigen Scheide. Junge Trichome, die die Scheide verlassen haben, sind eben-
falls beweglich. Bisher wurde keine Reinkultur erzielt.
Einzelne Zellen 1,5-2,0 x 2,5-3,0 urn grofi; Trichome 150-200 um lang; Lange
der Windung 30-50 urn. Scheidenwand 4,0-6,0 urn dick.
Vorkommen im Hypolimnion oder Metalimnion stratifizierter Sufiwasserseen
ohne H2S. In dem stark humifizierten See Pol'lamba (Karelija, UdSSR) Gefun-
den und von dort beschrieben.
Addendum zur Ordnung Rhodospirillales
In «consortia» lebende Organismen.
Bestimmungsschlussel der Konsortien
la Konsortium aus zwei Bakterientypenzusammengesetzt 2
lb Konsortium aus griinen Bakterien und einem Vertreter der Protozoen
zusammengesetzt
1. consortium Chlorobacteriumsymbioticum (S. 125)
2a Zentrale Wirtszelle im Konsortium in Form eines Stabchens oder Spirillums
3
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chlorobacterium symbioticum • 125
2b Zentrale Wirtszelle des Konsortiums in Form einer fadenformigen Bakterie
oder einer Zellkette 6
3a Zentrale Wirtszelle stabchenformig, mit einer Geifiel 4
3b Zentrale Wirtszelle spirillenfbrmig
4. consortium Chlorochromatium glebulum (S. 128)
4a Die zentrale farblose Bakterie ist von symbiotischen Bakterien des gleichen
Typs umgeben 5
4b Die zentrale farblose Bakterie ist von zwei Schichten symbiotischer
Bakterien umgeben: einer braun gefarbten und einer griin gefarbten
6. consortium Pelochromatium roseoviridis (S. 130)
5a Symbiotische Bakterien griin gefarbt
3. consortium Chlorochromatium aggregattum(S. 127)
5b Symbiotische Bakterien braun gefarbt
5. consortium Pelochromatium roseum(S. 129)
6a Konsortium zylinderformig; die Zentralstelle ist einFadenbakterium
2. consortium Cylindrogloea bacterifera (S. 125)
6b Konsortium flach lamellenformig, aus parallel angeordneten Reihen griiner
und farbloser Zellen bestehend. Farblose Bakterien stabchenformig, bilden
Ketten 7. consortium Chloroplana vacuolata(S. 130)
1. Consortium Chlorobacterium symbioticum Lauterborn 1916
(Fig. 70)
(non Chlorobacterium aggregation Liebmann 1962 - lapsus calami)
Zellen stabchenformig, oft leicht gekriimmt, gelbgriin bis griin gefarbt. An der
Oberflache einiger Protozoen vorkommend und mit ihnen in Symbiose lebend.
An der Oberflache der Wirtszelle bilden sie eine einschichtige Hiille, wobei die
Zellen senkrecht zur Oberflache orientiert sind. Die haufigsten Wirtszellen sind
Amoeben (Amoeba chlorochlamys) oder farblose Flagellaten (vielleicht Mastiga-
moeba). Bisher nicht geniigend bekannt, ob es sich um Schwefelbakterien
handelt oder nicht, wenn auch Lauterborn (1916) sie als phototrophe
Schwefelbakterien klassifizierte. Vermehrung durch Zellteilung. Keine aktive
Bewegung.
Zellen gewohnlich 0,5 x 2,0-5,0 um grofi.
Haufig in stehenden Gewassern, vor allem in Graben, Teichen und Tumpeln.
Nach Krasil'nikov (1949) gehort diese Art zur Gattung Pelodictyon. Van Niel (1957) bezieht
diesen Namen nur auf die griine Komponente des Konsortiums und bezweifelt, dafi es sich
iiberhaupt um Bakterien handelt. Mechsner (1957) ist der Meinung, dafi die griinen Zellen
Chlorobium-Krttn sind. Bergey's Manual (1948) fiihrt sie als Synonym fur die Alge
Chroostipes linearis an, die mit Oicomonas syncyanotica sehr ahnliche symbiotische Verban-
de bildet; die Algenzellen sind jedoch parallel zum Wirtsorganismus orientiert. Aufierdem
beschrieb Pascher (1925) noch zwei weitere Formen symbiotischer Kolonien von Chloro-
bakterien und saprophytischen Bakterienzellen. Die eine (Fig. 70c) wird von griinen Zellen
in Symbiose mit einer kurzen zylindrischen Zelle gebildet, die wahrscheinlich keine Geifiel
hat und Sporen bildet. Sie ist 3,0-4,0 X 8,0-12,0 urn grofi und besitzt eine dickeSchleimkap-
sel, in der dicht gepackt gelb- bis blaugriine, kleine kugelige Zellen liegen, die nur 0,3 um
Durchmesser haben. Sie kommen vor allem im Sommer am Grund stehender Gewasser vor,
in denen faulende organische Reste und geloster Schwefelwasserstoff vorhanden sind. Die
zweite Form (Fig. 70d) enthalt als Hauptorganismus ein Spirillum. Dieses mifit 3,0-4,0 x
15,0-18,0 (im und besitzt ebenfalls eine Schleimhulle, die von mehr oder weniger braungriin
gefarbten, 1,0 um grofien und locker liegenden Zellen besiedelt ist. Einmal ziemlich
reichlich im Schlamm von Altwassern der Vltava bei Praha (CSSR) gefunden.
2. Consortium Cylindrogloea bacterifera Perfiliev 1914 (Fig. 71)
Zellen klein, griin, ovoid oder stabchenformig; zylindrische symbiotische
Kolonien mit einer farblosen Fadenbakterie bildend. Zentrale Fadenbakterie in eine
126 ■ Phototrophe Bakterien - Chlorobacterium symbioticum
70 71
Fig. 70. Consortium Chlorobacterium symbioticum - a auf Amoeba chlorochla-
mys - (1250X), b auf einen farblosen Flagellaten (Mastigamoeba? - 1250X), c
symbiotische Kolonie mit einer geifiellosen Bakterie, die Sporen bilden kann -
(1500X), d symbiotische Kolonie mit einem grofien Spirillum - (1750X) (nach
Geitler und Pascher, 1925). Fig. 71. Consortium Cylindrogloea bacterifera - a,b
fadenformige, von dicker Gallerthiille umgebene Zentralbakterie mit den aufsit-
zenden Chlorobakterien - 650 X, c einzelne Chlorobakterien - 1340X, d-e
Faden im optischen Langsschnitt - 670x (nach Skuja, 1956).
ziemlich grofie Gallertkapsel eingeschlossen, die von einer dichten Schicht
griiner Schwefelbakterien umgeben ist; letztere manchmal auch recht sparlich
vorhanden. Die gesamte Formation liegt gewohnlich noch in einer weiteren
Gallertkapsel. Weder die zentralen, noch die griinen Bakterien bilden Sporen.
Die griinen Bakterien enthalten ein Pigment, das wedejyxiit dem Chlorophyll der
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chlorochromatium aggregatum • 127
griinen Pflanzen, noch mit Bakteriochlorophyl a oder b identisch ist. Skuja
(1956) beobachtete Gasvakuolen. Photosynthese in Anwesenheit von Schwefel-
wasserstoff, wobei in den Zellen keine Schwefeltropfchen gespeichert werden.
Weder die einzelnen Zellen, noch die ganze Formation sind beweglich.
Formation 7,0-8,0 [im breit und bis 50 [im lang, einzelne periphere Bakterien
0,5-1,0 X 2,0-4,0 [im grofi.
In belichtetem Schlamm und in stehendem Wasser mit hoher H2S-Konzentra-
tion. Urspriinglich aus Teichen in der Umgebung von Leningrad (UdSSR)
beschrieben.
Nach Bergey's Manual (1957) sind die griinen Zellen wahrscheinlich mit denen des Konsor-
tiums Chlorobacterium symbioticum und Chlorochromatium aggregatum identisch. Auch
Mechsner (1957) halt diesen Organismus fur ein besonderes Ruhestadium von
Chlorochromatium aggregatum. Triiper und Pfennig (1971) nehmen an, dafi die griine Komponente des
Konsortiums eine Chlorobium- oder Pelodictyon-Kn ist. Van Niel (1957) bezieht die
Bezeichnung des Konsortiums nur auf die griine Komponente.
3. Consortium Chlorochromatium aggregatum Lauterborn 1906
(Fig- 72).
Chloronium mirabile Buder 1914, Chlorochromatium aggregatum forma typica
Geitler 1925, Chlorochromatium aggregatum forma minor Geitler 1925.
Tonnenformige symbiotische Formationen, in deren Mitte sich eine verhaltnis-
mafiig grofie, spindelformige, farblose Bakterie mit polarer Geifiel befindet.
Diese begeifielte Bakterie ist der Lange nach von 8 bis 16 einzelnen griinen
Schwefelbakterien umgeben, die in 6-8 Langsreihen parallel zur Wirtszelle
orientiert sind und 2-4 hintereinanderliegende Ringe um sie bilden. Die griinen
Bakterien sind ovoid oder stabchenformig, mit abgerundeten Enden, unmittel-
bar nach der Teilung jedoch kugelig. Sie liegen in einem Schleimlager, das
manchmal schwach entwickelt ist, manchmal hingegen- besonders bei negativer
Farbung - als grofie farblose Aureole erscheint. Das Konsortium verhalt sich wie
ein Individuum. Gelegentlich konnen diese Formationen unter bestimmten
Bedingungen Ketten oder netzartige Formen bilden. Es erscheint auch moglich,
dafi das Konsortium eine zufallige Kombination zweier Organismen infolge
aufierer Bedingungen ist, da nach einer gewissen Zeit beide Komponenten'
selbstandig existieren konnen. Mechsner (1957) isolierte die griine Komponente
in Reinkultur und nannte sie Chlorobium chlorochromatii. Das Wesen der
zentralen Bakterie ist nicht bekannt, wahrscheinlich handelt es sich um einen
Vertreter von Pseudomonas.
Die Zellen der Schwefelbakterien sind leuchtend gelbgriin. Als Assimilations-
pigmente kommen wahrscheinlich Bakteriochlorophyll c und d vor.
Photosynthese in Anwesenheit von H2S; anaerob. Protoplasma mit zahlreichen metachro-
matischen Kornchen, ohne Gasvakuolen. Die innere Zelle, die als farblos
beschrieben wird, kann nach Angaben Pringsheims (1953) wie eine Purpurbak-
terie leicht pigmentiert sein.
Vermehrung durch simultane Teilung beider symbiotischer Organismen.
Konsortium durch die begeifielte farblose Bakterie aktiv beweglich. Falls die zentrale
Bakterie gekriimmt ist, verlauft auch die Bewegung nicht geradlinig.
Griine Zellen 0,5-1,0 X 1,0-2,5 [im; symbiotische Formation gewohnlich 2,5-
5,0 X 7,0-12,0 [im grofS.
Im Schlamm und in faulendem, stehendem Wasser mit verhaltnismafiig hoher
H2S-Konzentration und geniigend Licht.
Buder (1913) und Kondrat'eva (1963) sind der Meinung, dafi der griine Organismus mit
Bacillus virescens und Bacterium chlorinum identisch ist. Geitler (1925) unterscheidet zwei
Formen: -typica*, die der von Lauterborn (1906) beschriebenen Form entspricht (5,0-7,0 X
128 ■ Phototrophe Bakterien - Chlorochromatiurn glebulum
9,0-12,0 urn) und "minor" nach der Beschreibung dervon Buder (1913) beobachteten Form
(2,0-2,5 X 5,0 urn). Eine Unterscheidung der Formen ausschliefilich nach der GrofSe der
symbiotischen Kolonien ist unbegrundet. Geitler und Pascher (1925) beschrieben weitere
Formen, und zwar eine mit kugeligen, 1 um grofien griinen Zellen und eine andere mit
ebenfalls kugeligen, aber2 um grofien griinen Bakterien, diesymbiotischeFormationenvon
6,0-7,0 X 15,0 um GrofSe bilden. In Anreicherungskulturen bildeten sie dichte Wolkchen.
Krasil'nikov (1949) hatte diese Art in die Gattung Pelodictyon iiberfiihrt. Mechsner (1957)
ist der Meinung, dafi die griinen Bakterien auf der farblosen begeiSelten Bakterie parasitie-
ren. Er nimmt ferner an, dafi das Ruhestadium mit Cylindrogloea bacterifera identisch ist.
Triiper und Pfennig (1971) bezweifeln die Richtigkeit der Einordnung der griinen Kompo-
nente des Konsortiums in die Gattung Chlorobium.
f g
a
72 73
Fig. 72. Consortium Chlorochromatiurn aggregation - a, d, e normales Ausse-
hen der symbiotischen Kolonie, b symbiotischer Organismus vor der Teilung, c
nach der Teilung, f-g optischer Querschnitt eines Exemplars mit 6 una 8
longitudinalen Reihen der Hullbakterien (nach Skuja, 1948. - 1700X). Fig. 73.
Consortium Chlorochromatiurn glebulum - a verschiedene Ausbildungen der
hufeisenformigen Verbande, b die im Schleim liegenden Exobakterien und die
mikrospiraartige Zentralbakterie nach vorsichtigem Zerquetschen des Verban-
des unter dem Deckglas (nach Skuja, 1956. - 1340X).
4. Consortium Chlorochromatiurn glebulum Skuja 1956 (Fig. 73)
Zellen kokkenartig oder kurz ellipsoidisch, oft etwas gekrummt, nach der
Teilung kugelig; gelbgriin gefarbt. Auf der Oberflache einer zentralen Bakterie
sitzen unregelmafiig zerstreut 7-40 solcher Zellen und bilden mit ihr gemeinsam
eine symbiotische Kolonie. Das zentrale Spirillum ist farblos und mit einer
polaren Geifiel versehen. Die ganze Kolonie ist in Schleim eingebettet, der durch
Eisenhydroxyd verfarbt sein kann; Kolonie spharisch oder langlich oval, vor der
Teilung sichelformig gekrummt und leicht schraubig gewunden. Protoplasma
der griinen Organismen oft mit einer zentralen Gasvakuole und griinem Assimi-
lationspigment. Protoplasma der zentralen farblosen Zelle homogen, ohne
auffallende Struktur. Vermehrung durch Teilung, wobei sich die ganze Kolonie
gleichzeitig mit der zentralen Bakterie teilt. Kolonie mittels der polaren Geifiel
des farblosen, zentralen Spirillums langsam beweglich.
Griine Zellen 0,5-0,6 X 0,7-1,0 [im, zentrale farblose Zelle 0,6-0,7 X 3,0-
5,0 [im grofi, vor der Teilung bis 8,0 [im lang; Kolonie 3,0-4,0 X 4,0-8,0 [im
grofi.
In grofieren Tiefen von Siifiwasserseen vorkommend. Im Plankton des Sees
Hjalstaviken (Schweden) und im Kononer See (UdSSR) gefunden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pelochromatium roseum ■ 129
Skuja (1956) weist auf die morphologische Ahnlichkeit zwischen den griinen Bakterien und
Pelodictyon luteolum (=Pelodictyon aggregatum) hin. Triiper und Pfennig (1971) halten es
nicht fur erwiesen, dafi die griine Komponente des Konsortiums zur Familie Chlorobiaceae
gehort, da sie bisher weder in Rein- noch in Anreicherungskulturen geziichtet und unter-
sucht wurde. DieSymbiose der griinen Zellen mit einem farblosen, 3,0-4,0 X 15,0-18,0 [im
grofien Spirillum wurde schon von Pascher (1925) beschrieben (siehe Chlorobacterium
symbioticum).
5. Consortium Pelochromatium roseum Lauterborn 1913 (Fig. 47)
Pelochromatium roseum var. minor Skuja 1956
Tonnenformige oder zylindrische, an den Enden etwas zugespitzte symbiotische
Kolonien, die aus einer inneren stabchenformigen, an beiden Enden stumpf
zugespitzten, farblosen, oft leicht gekriimmten Bakterie und Schwefelbakterien
bestehen. Letztere oft in Paaren, die durch Teilung entstehen und den Mantel urn
die farblose Wirtszelle bilden. Die Zellen der Schwefelbakterien sind kurz oder
lang ellipsoidisch, manchmal in Form von Vibrionen. Sie sind mehr oder weniger
regelmafiig in einigen Quer- oder Langsreihen um die zentrale Zelle angeordnet.
Gewohnlich sind fiinf Langsreihen vorhanden; manchmal jedoch liegen sie so
dicht aneinander, dafi man sie voneinander nicht unterscheiden kann (Utermohl
1927). Die innere Zelle besitzt eine ungefahr korperlange polare Geifiel. Unter
bestimmten ungiinstigen Bedingungen kann sich die Wirtszelle aus dem Mantel
der Schwefelbakterien befreien. Die gesamte symbiotische Kolonie ist in eine
Schleimkapsel eingeschlossen, die durch Eisenhydroxyd leicht gefarbt wird.
Morphologisch an Chlorochromatiurn aggregatum erinnernd.
Die Schwefelbakterien haben keine Gasvakuolen. Ihr Protoplast ist braunrosa
bis braun gefarbt. Die Assimilationspigmente sind wahrscheinlich aus Bakte-
riochlorophyll d und Karotinoiden der 5. Gruppe zusammengesetzt. Sowohl die
Schwefelbakterien als auch die farblose Wirtszelle vermehren sich durch simulta-
ne Querteilung. Kolonien aktiv beweglich; Bewegung durch die polare Geifiel
der farblosen Wirtszelle.
Zellen der Schwefelbakterien 0,4-0,5 X 0,5-0,9 [im, die symbiotische zentrale
Zelle gewohnlich 1,0-1,5 X 4,0-8,0 [i grofi; Anagnostidis und Overbeck (1966)
geben Grofien von 1,0-2,0 X 5,0-8,0 [im an; die ganze Kolonie gewohnlich 1,8-
3,0 X 4,0-9,0 [im grofi.
In Siisswasserseen, die Schwefelwasserstoff enthalten, oft massenhaft
vorkommend. Solche symbiotische Formationen wurden urspriinglich in den osthol-
steinschen Seen gefunden und von dort beschrieben: Krummensee, Kolksee,
Edebergsee, Jensensee, Hoftsee (BRD). Im Hoftsee kamen sie in solchen
LI C rj
Fig. 47. Consortium Pelochromatium roseum - a normal entwickeltes Konsor-
tium - (nach Skuja, 1956. - 1340 X), b optischer Querschnitt - (nach Lauterborn,
1915. - 1340X), c vorsichtig zerquetschtes Konsortium. In der Mine ist die
Wirtszelle Endosomapalleum deutlich zu sehen, um die herum sich die Purpur-
bakterien - Lauterborniola minima - befinden - (nach Skuja, 1956. - 1340X), d
das von Skuja als forma minus beschriebene Konsortium - (nach Skuja, 1948. -
2000X).
130 • Phototrophe Bakterien - Pelochromatium roseoviridis
Mengen vor (bis zu 9000 Individuen in einem ml), dafi sie eine Wasserfarbung
hervorriefen. Im Edebergsee wurden bis 200000 Individuen je ml gefunden.
Nach Anagnostidis und Overbeck (1966) im Herbst in den belichteten Schichten
des Hypolimnions auftretend.
Utermohl (1924) bezeichnete die Wirtszelle als Endosoma palleum (non Endonema palleum
Skuja 1956) und die Schwefelbakterien als Lauterbomiola minima. Auf Grund ihrer braunen
Farbung war er der Ansicht, dafi man sie in die Gruppe der Phaeobakterien einordnen sollte.
Dies lennen Huber-Pestalozzi (1938) und Skuja (1956) ab, sie stellen den Organismus zur
Familie der Chlorobacteriaceae, da es hier mehrere ahnliche Konsortien gibt. Bergey's
Manual (1948) fiihrt diese als Addendum zu den Thiorhodaceae an, manchmal auch bei der
Familie Athiorhodaceae eingereiht. Pfennig (1967) und spater Triiper und Pfennig (1971)
sind auf Grund der Absorbtionsspektren der Ansicht, dafi diese Schwefelbakterie mit
Chlorobium phaeobacteroides identisch ist. Gorlenko (1975, miindl. Mit.) ist der Meinung,
dafi in der Mitte der Kolonie eine farblose, sulfatreduzierende Bakterie vorhanden ist.
6. Consortium Pelochromatium roseoviridis Gorlenko et Kuznecov
1971
Symbiotische Formation aus drei verschiedenen Organismen, deren Grundlage
eine bewegliche, heterotrophe, farblose, stabchenformige Bakterie bildet, die
von zwei Schichten photosynthetischer Bakterien bedeckt wird. Die eine Schicht
besteht aus braunen Zellen, die an Chlorobium phaeobacteroides erinnern, die
andere aus griinen, Pelodictyon luteolum ahnlichen Zellen. Beide Arten von
Schwefelbakterien enthalten Gasvakuolen.
In einer Tiefe von 11-12 m im Kononer See (UdSSR) gefunden.
7. Consortium Chloroplana vacuolata Dubinina et Kuznecov 1976
Flache, unbewegliche, symbiotische, lamellenartige Formationen, die aus zwei
Typen symbiotischer Bakterien bestehen. Gewohnlich sind die kiirzeren griinen
Zellen der Lange nach von Ketten farbloser Zellen umgeben. Sehr oft besteht
auch das Konsortium aus parallel und abwechselnd angeordneten Reihen von
griinen und farblosen Bakterien. Von unterschiedlicher Grofie: aus einigen
wenigen Zellen bis zu grofien Formationen von 300-400 Zellen griiner
Bakterien. Griine Bakterien stabchenartig, unbeweglich, enthalten Gasvakuolen; 0,6-
0,8 X 1,2-2,0 [im grofi. Als Pigment ist Bakteriochlorophyll coder d vorhanden.
Wahrscheinlich gehoren sie in die Gattung Pelodictyon. Den zweiten Bestandteil
des Konsortiums bilden lange, diinne unbewegliche Stabchen, die auch
Gasvakuolen besitzen. Zellen 0,35-0,45 X 3,0-6,0 u.m grofi. Sie haben die Tendenz,
lange kettenformige Faden zu bilden. Gewohnlich sind die farblosen Zellen in
der Menge der griinen Zellen schwer zu unterscheiden. Aus diesem Grunde ist es
sehr wahrscheinlich, dafi diese Konsortien friiher als Mikrokolonien von
Pelodictyon parallelum angesehen wurden.
Beschrieben wurde das Konsortium zuerst aus dem Lesnaja Lamba-See (Kareli-
ja, UdSSR), wo es im bakteriellen Plankton sehr verbreitet ist. Gorlenko und
Lokk (1979) melden das Vorkommen auch aus den Seen Tollari, Mjachki und
Bijtina in der siidostlichen Region von Estland (UdSSR). Kommt in anaeroben
Zonen des Wassers in grofieren Tiefen bei geringer Lichtintensitat und niedriger
H2S-Konzentration vor.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Teil II. Gleitende Bakterien
Mehr oder weniger kiinstliche Gruppe von Organismen, die ein gemeinsames
Hauptmerkmal besitzen: eine spezifische gleitende Bewegung, deren Prinzip
bisher nicht ganz klar ist. Auf Grund des Vorkommens spezifischer Korperchen
(Rapidosomen) in der Ultrastruktur der Zellwand einiger Vertreter dieser
Gruppe entwickelte Graf (1961, 1965) die Theorie, dafi die Bewegung durch Streifen
eines klebrigen Stoffes (Schleim? Protoplasma?) entsteht, der in speziellen Rillen
in einer Schraubenbahn die Zelloberflache umkreist, wodurch sich die Zelle um
die Langs achse dreht.
In ahnlicher Weise erklaren auch Ridgway (miindl. Mitteilung - cit. Lewin,
1974), Simon und White (1971) die Bewegung.
Die Gruppe enthalt zwei Ordnungen, wovon die Myxobacterales und Cytopha-
gales letztere den Grofiteil der Gattungen einschliefit, die friiher (Bergey's
Manual 1957) in die Ordnung Beggiatoales eingeordnet waren; ferner Vertreter
der Gattung Cytophaga, die urspriinglich bei der Ordnung Myxobacterales
eingereiht, wurden. Hinzu kommen die neu beschriebene Gattungen: Flexibac-
ter, Herpetosiphon, Flexitrix undSporocytophaga. Die Gattung Saprospira wurde
friiher zur Ordnung Spirochaetales gerechnet.
1. Ordnung Myxobacterales Thaxter 1892, emend.
Stanier 1957
Einzellige, stabchenformige, manchmal kugelige, in einem typischen, mehr oder
weniger festen Schleimlager eingeschlossene Mikroorganismen. Einzelne Zellen
gleichmafiig zylindrisch, mit stumpfen oder verschmalerten Enden, elastisch
und flexibel; gramnegativ. Plasma homogen, im Gegensatz zu den iibrigen
Bakterien mit einem deutlich differenzierten Zellkern. Zellwand elastisch, nicht
rigid. Unter ungiinstigen Bedingungen (Anaerobiose, hohes Alter der Kultur,
hohe Temperatur, Anwesenheit einiger Kationen) autolysieren sie oder bilden
Spharoplasten. Die Zellen vertragen keine Thermofixierung und f arben sich nach
den iiblichen Verfahren schlecht, weshalb fur Untersuchungen Phasenkontrast
zu verwenden ist.
Eine charakteristische Eigenschaft dieser Gruppe von Mikroorganismen ist die
Bildung von Fruchtkorpern. Diese findet gewohnlich in Ruhestadien statt; diese
Fruktifikationsgebilde sind auch bei Ruhezellen (= Myxosporen) enthalten. Sie
bilden sich aus mehr oder weniger konsistentem Schleim und Zellen unter
spezifischen, bisher nicht geklarten Bedingungen. Sie kommen in zwei Typen
vor. Vorwiegend sind es ganz einfache Schleim- und Zellenmassen, die
Ruhezellen (sogenannte Mikrozysten) in Form verkiirzter eingekapselter Stabchen oder
kugelformiger Zellen enthalten. Diese unterscheiden sich von den vegetativen
Zellen durch hohere Refraktibilitat und hohere optische Dichte. Rund um die
Mikrozysten bildet sich gewohnlich eine starke Schleimkapsel aus.
Ferner sind die Fruktifikationsgebilde die Folge eines Entwicklungszyklus, der
wesentlich komplizierter ist, als es bei den iibrigen Bakterien der Fall ist. Nach
Vollendung der vegetativen Vermehrung treten die Zellen dicht zusammen und
bilden bewegliche Gebilde (Schwarme), die auch als Pseudoplasmodien bezeich-
net werden. In ihnen konzentrieren sich die Zellen zu dichten kleinen Gruppen,
die von einer dicken Schleimhulle umgeben sind. Stufenweise gewinnen sie eine
runde, manchmal auchi«atige Form und wandeln sich in Zystensporangien um.
132 ■ Gleitende Bakterien - Myxobacterales
Sie enthalten Ruhezellen (Myxosporen), die sich besonders bei einigen Gattun-
gen von den vegatativen Zellen nur wenig unterscheiden. Bei anderen Arten
haben sie den Charakter von Mikrozysten. Diese Zysten haben eine feste,
verhaltnismafiig rigide Zellwand. Einige Zysten-Sporangien, die von einer ge-
meinsamen Zellwand umschlossen sind, bilden dann ein Fruktifikationsgebilde,
einen Fruchtkorper. Dieser ist oft deutlich gelb, orange, rot, braun u. a. gefarbt,
was durch die in ihm enthaltenen Karotinoide und Melanine bewirkt wird. Ohne
photosynthetische Pigmente. Oft makroskopische Ausmafie erreichend und
gewohnlich auf der Oberflache des Kulturmediums oder des natiirlichen
Substrates auf einfachen oder baumartig verzweigten Stielen (Sporangiophoren)
wachsend.
Sie sind chemoorganotroph, streng aerob. Energiegewinnung durch respirati-
ven, niemals durch fermentativen Metabolismus. Eine typische Eigenschaft
dieser Gruppe ist die Bildung von Enzymen, die Makromolekule von Proteinen,
Nukleinsauren, Fettsaureestem, Polysachariden, manchmal, auch von Zellulose
hydrolysieren. Die meisten Arten sind imstande, lebende oder auch tote,
gramnegative und grampositive Bakterienzellen, die keine Schleimkapsel bilden,
sowie Hefezellen zu zersetzen. Nach Shilo (1970) konnen sie auch die vegetati-
ven Zellen einiger Blaualgenarten lysieren. Sie besitzen die Fahigkeit, die Bio-
masse der Zellen als einzige Ernahrungs- und Energiequelle auszuniitzen.
Imseneckij und Kuzjurina (1951) haben festgestellt, dafs dieser Prozefi in zwei
Phasen verlauft und bezeichnen ihn als Bakteriotrophie. Meistens wachsen diese
Organismen nicht auf iiblichen Kulturmedien, sondern nur auf solchen, deren
Zusammensetzung ihrer natiirlichen Lebensweise entspricht. Vor allem solche
Arten, die die Lyse von Bakterien hervorrufen, verlangen spezifische, lebend
oder tote Bakterienzellen enthaltende Medien. Die meisten von ihnen wachsen
auch auf Nahrboden, die enzymatisch hydrolysierte Proteine enthalten. Einige
benotigen komplexe Amionosauren. Meistens brauchen sie keine Vitamine.
Keine von dem die Lyse von Bakterien bewirkenden Arten ist fahig, Kohlenhy-
drate zu verwerten, weder als Kohlenstoff- noch als Energiequelle. Trotzdem
stimulieren diese Stoffe ihr Wachstum, wenn sie dem Kulturmedium zugefiigt
werden. Ob ein Medium geeignet ist, lafit sich nach der Bildung der Fruktifika-
tionsstadien beurteilen. Gewohnlich sind die fiir das Wachstum vegetativer
Zellen geeigneten Medien nicht fiir die Entwicklung der Fruktifikationsgebilde
geeignet. Diese bilden sich gewohnlich nur auf wesentlich starker verdiinnten
Medien.
Vegetative Myxobakterienkolonien (Pseudoplasmodien) haben dank der Be-
weglichkeit der Zellen, ein charakteristisches Aussehen. Die Kolonien sind
gewqhnlich flach, diinn und breiten sich auf der Agaroberflache aus. Ihre
Peripherie ist haufig gelappt. Vermehrung durch Querteilung oder Einschnii-
rung. Zellen mit charakteristischer Gleitbewegung, die jedoch nur an der
Wasserflache oder an einer festen Unterlage sichtbar wird. Zellen aus fliissigen
Medien sind gewohnlich unbeweglich. Ohne deutliche Geifieln und ohne Loko-
motionsorganellen. Reichenbach (1965) fand bei einer Art (Archangium viola-
ceum) Rapidosomen, von denen Graf (1965) behauptet, dafi sie Fragmente von
Zellorganellen sind, die durch ihre Fibrillenstruktur die Zellbewegung bewir-
ken. Zellen gewohnlich im Durchschnitt schmaler als 1,5 |xm.
Die meisten Arten sind weit verbreitet; sie kommen im Boden, auf Mist und
verwesendem Pflanzenmaterial, Baumrinden oder Tierexkrementen vor. Einige
Arten leben in enger Beziehung zu Wasserstoff bakterien. Siehaben eine iiberein-
stimmende morphologische Zellstruktur (Zavarzin und Zilina - 1971) und
verwerten in Kulturen abgestorbene Zellen von Wasserstoffbakterien. Noch vor
kurzem nahm man an, dafi im Wasser nur eine Art (Polyangium parasiticum)
vorkommt. Aus den wenigen friiheren Angaben (Jeffers 1964, Shilo 1970) war es
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Myxococcaceae ■ 133
nicht klar, ob es sich nur um ein zufalliges Vorkommen handelte. Arbeiten
tschechoslowakischer Mikrobiologen (Lecianova 1974, 1978, 1980, Kopfivik
und Vychodilova 1979, Miklosovicova 1979) beweisen jedoch, dafi Vertreter
aller vier Gattungen nicht nur in Abwassern (besonders in landwirtschaftlich
verunreinigten Wassern), sondern auch im Oberflachen- und Grundwasser
vorkommen.
Die Taxonomie beruht auf der Ausbildung der Fruktifikationsgebilde, obwohl
bekannt, dafi diese oft von den Umwelt- und Wachstumsbedingungen abhangig
ist. Die Identifizierung mufi sehr sorgfaltig an Hand von Reinkulturen durchge-
fiihrt werden. Entwickelte Fruktifikationsgebilde der einen Art konnen mit
mehr oder weniger entwickelten Fruktifikationsgebilden anderer Arten ver-
wechselt werden. Die biologischen Eigenschaften der meisten Arten sind unbe-
kannt. Manche Autoren haben friiher in diese Ordnung auch zellulolytische,
gleitende Bakterien einbezogen, die jetzt nach Bergey's Manual (1974) die
selbstandige Ordnung Cytopnagales bilden. Die Ordnung wird in vier Familien
eingeteilt.
Wichtigste Literatur: Jahn 1924, Geitler 1925, Krasil'nikov 1949, Bergey's
Manual 1957, 1974, Dworkin 1966, Kiihlwein und Reichenbach 1966, Mc
Curdy 1969, Peterson 1969.
Bestimmungsschlussel der Familien
la Vegetative Zellen konischverschmalert, Mikrozysten bildend 2
lb Vegetative Zellen ihrer ganzen Lange nach einheitlich breit; mit stumpf
gerundeten Enden. Myxosporen den vegetativen Zellen sehr ahnlich
4. Polyangiaceae (S. 134)
2a Mikrozysten kugelig oder ellipsoidisch 1. Myxococcaceae (S. 133)
2b Mikrozysten stabchenformig 3
3a Mikrozysten nicht in Sporangien vorkommend . 2. Archangiaceae (S. 134)
3b Mikrozysten in Sporangien auftretend 3. Cystobacteraceae(S. 134)
1. Familie Myxococcaceae Jahn 1924
Vegetative Zellen schlank, gerade oder gegen die Enden zu leicht verjiingt;
flexible Stabchen mit abgerundeten Enden. Myxosporen in Form von
Mikrozysten. Diese sind kugelig oder ellipsoidisch, stark lichtbrechend, nie in
Sporangien eingeschlossen. Zellen chemoorganotroph; Metabolismus respirativ, streng
aerob. Sie sind bakteriolytisch; nie Zellulose hydrolysierend. Im Boden und im
Mist, auch auf Baumrinden und faulenden Pflanzenresten vorkommend.
Eine einzige Gattung:
Myxococcus Thaxter 1892
Typus generis: Myxococcus fulvus (Cohn 1875) Jahn 1911.
Bis vor kurzem war das Vorkommen im Wasser nicht bekannt. Lecianova (1974,
1978), Kopfivik und Vychodilova (1977), Vychodilova und Kopfivik (1978),
Bernatova (1977) bewiesen aber ihr haufiges Vorkommen in Oberflachen- und
Grundwassern.
134 ■ Gleitende Bakterien - Archangiaccac - Cystobacteraceae - Polyangiaceae
2. Familie Archangiaceae Jahn 1924
Vegetative Zellen in Form schlanker Stabchen mit abgerundeten Enden.
Mikrozysten ellipsoidisch, kugelig oder kurz stabchenformig, stark lichtbrechend und
optisch dicht. Keine Sporangien bildend. Fruktifikationsgebilde von verschiede-
ner Grofie, unregelmafiig, manchmal gelappt. In ihrem Habitus erinnern sie an
die Struktur des Gehirns oder verflochtener Gedarme; ohne Schleimhiille. Im
Boden und im auf Boden liegendem Mist; ferner auf Baumrinden vorhanden.
Eine einzige Gattung:
Archangium Jahn 1924
Typus generis: Archangium gephyra Jahn 1924.
3. Familie Cystobacteraceae Mc Curdy 1970
Vegetative Zellen stabchenformig, an beiden Enden verjiingt, flexibel.
Mikrozysten lichtbrechend, optisch dicht, in Sporangien als charakteristische Stabchen
eingeschlossen. Sporangien entweder einzeln oder gruppenweise festsitzend
oder von einer Schleimhiille umgeben oder auf Sporangiophoren einzeln oder in
kleinen Biischeln entwickelt. Sporangiophoren einfach oder verzweigt. Zellen
bakteriolytisch, weder Zellulose noch Agar zersetzend. Sie sind fahig, auf
kiinstlichen Medien mit enzymatisch hydrolysierten Proteinen zu wachsen.
Uberwiegend im Boden und im Mist vorkommend.
Die Familie schliefit alle Arten ein, die aus den vegetativen Zellen Mikrozysten
von ahnlichem Aussehen bilden.
Mit drei Gattungen:
1. Cystobacter Schroeter 1886
Typus generis: Cystobacter fuscus Schroeter 1886
2. Mellitangium Jahn 1924
Typus generis: Mellitangium boletus Jahn 1924
3. Stigmatella Berkeley et Curtis 1875
Typus generis: Stigmatella auriantica Berkeley et Curtis 1875
4. Familie Polyangiaceae Jahn 1924, emend.
Mc Curdy 1974
Vegetative Zellen in Form zylindrischer Stabchen. Myxosporen den vegetativen
Zellen ahnlich; weder lichtbrechend noch optisch besonders dicht; ohne
Schleimkapseln. Sporangien festsitzend, einzeln odj^n Gruppen; von einer
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Polyangium ■ 135
gemeinsamen Hiille (Wand) umschlossen; einzeln oder in kleinen Biischeln auf
einfachen oder verzweigten Sporangiophoren. Nicht alle Arten konnen Bakte-
rienzellen lysieren. Einige Stamme hydrolysieren Zellulose, andere brauchen
Vitamin B12 und wahrscheinlich auch andere Faktoren. Vegetative Kolonien
hydrolysieren Agar. Uberwiegend im Boden oder auf Exkrementen und Mist
vorkommend, eine Art auch im Wasser.
Typus familiae: Polyangium Link 1809
Bestimmungsschliissel der Gattungen
la Im Boden, Kompost, auf Exkrementen und Mist vorkommend 2
lb Ausschliefilich im Siifiwasservorkommend 1. Polyangium (S. 135)
2a Sporangien festsitzend, Zellen in Form von Kokken
2. Nannocystis (S. 137)
2b Sporangien stielformig, Zellen in Form von Stabchen
3. Chondromyces (S. 138)
1. Polyangium Link 1809
Vegetative Zellen zylindrisch mit abgerundeten stumpfen Enden. Pseudoplas-
modien bilden vor Ende der Vegetationsperiode Sporangien, die entweder
einzeln oder in Gruppen, oft in einer gemeinsamen Hiille oder in einem
Schleimlager liegen.
Myxosporen erinnern an vegetative Zellen, sind weder lichtbrechend noch
optisch dicht; ohne Schleimkapseln. Die Zellen sind fahig, Zellulose zu zerset-
zen, tun dies aber selten; sie hydrolysieren auch Agar. Die Gattung schliefk eine
grofiere Anzahl von Arten ein. Meistens treten sie auf Exkrementen, im Boden
und Mist auf. Nur eine Art ist aus dem Siifiwasser bekannt.
Typus generis: Polyangium vitellinum Link 1809
Nur eine einzige Sufi was serart:
Polyangium parasiticum Geitler 1925 (Fig. 74)
Vegetative Zellen in Form langer, zylindrischer, gerader, an den Enden abgerun-
deter Stabchen; von einer diinnen Schleimschicht umgeben, die nur bei negativer
Farbung sichtbar wird.
Innerhalb der Zellen sind an beiden Polen runde, stark lichtbrechende Korper-
chen vorhanden, die wahrend der ganzen Entwicklung des Individuums dort
verbleiben. Mit Methylenblau farben sie sich dunkelblau.
Myxosporen sind den vegetativen Zellen ahnlich; sie sind jedoch kleiner. Der
Organismus bildet Pseudoplasmodien auf abgestorbenen oder in Zersetzung
befindlichen Faden der Sufiwasseralge Cladophora fracta.
In der Entwicklung der Pseudoplasmodien lassen sich zwei Stadien beobachten:
ein vegetatives (saprophytisches) und ein reproduktives (parasitisches). Das
vegetative Stadium enthalt parallel angeordnete Zellen, die ganze Masse
bewegt sich relativ lebhaft in charakteristischen Schwarmen. Diese umspannen
in einzelnen Stromen die Faden, sie umschlingen sie und vereinigen sich stellen-
weise zu einer einheitlichen Masse. Die Zellen sind in ihnen parallel zur
Fadenoberflache angeordnet. Aus unbekannten Griinden haufen sich manchmal
an einigen Stellen Gruppen von vertikal orientierten Zellen an. Nach einiger Zeit
nehmen sie jedoch wieder die urspriingliche Lage ein.
Das Reproduktionspseudoplasmodium ist eine Schleimmasse, in der die Zellen
unregelmafiig angeordnet sind. In unmittelbarer Nahe des Wirtes sind sie
vertikal orientiert. Zu bestimmten Zeiten bilden sie Zysten-Sporangien, die in
farblosen Schleimkapseln liegen. Die reifen Zysten enthalten unregelmafiig
angeordnete Zellen-Myxaaaoren und Fettropfchen. Ihre Wand ist rotbraun gefarbt
136 • Gleitende Bakterien - Polyangium
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Nannocystis • 137
und hat eine doppelte Kontur. Bei den unreifen Zysten sind die Zellen in der
aufieren Schicht senkrecht zur Zystenwand orientiert. Die Ernahrungsweise ist
vom Entwicklungsstadium abhangig. Im vegetativen Stadium kommt es zu einer
starken Zellvermehrung. Das Pseudoplasmodium breitet sich dann auf gesunde
Faden aus und greift, sobald es aufhort sich zu bewegen, die Zellwand der
Wirtsalge an; es bildet in ihr ein schmales Loch, durch das die ganze Masse der
Myxobakterienzellen in die Zelle der Alge eindringt. Wenn das
Pseudoplasmodium nicht allzu grofi ist, tritt es vollstandig in die Zelle ein und umgibt den
plasmolysierten Protoplast. Dieser farbt sich gelb, und stufenweise wird der
ganze Zellinhalt zerstort. Mit der Zeit kontrahiert sich das Pseudoplasmodium,
rundet sich ab, bis es endlich eine braungefarbte Zyste bildet. Grofie Pseudoplas-
modien bleiben teilweise auf der Zelloberflache, wobei der Zellinhalt allmahlich
ausgesaugt und auch die Zellwand aufgelost wird. Wenn es so grofi ist, dafi es
mehr als eine Zelle umfafit, dringt es allmahlich in diese ein, doch nie gleichzeitig
in mehrere Zellen. Grofie Pseudoplasmodien zerfallen in mehrere Zysten, die
sich gleichzeitig bilden. Sie sind entweder hintereinander angeordnet, so wie
urspriinglich die Algenzellen orientiert waren, oder ihre Anordnung ist unregel-
mafiig. Das ist dann der Fall, wenn sie nicht ganz in die Zelle eindringen konnten.
Selten treten sekundare Zysten auf. Manchmal konnen selbstandige Zysten in
einem gewissen Abstand von toten Faden gefunden werden.
Oft kann man Algenfaden antreffen, bei denen sich das vegetative
Pseudoplasmodium iiber das Reproduktionstadium bewegt. In den Faden werden jedoch
nur solche Zellen angegriffen, die in direktem Kontakt mit dem Reproduktions-
stadium stehen. Beide Plasmodien-Typen sind in ihrem Verhalten vollig selb-
standig.
Die gesamte Entwicklung des Organismus dauert etwa drei Wochen. Wahrend
dieser Zeit kommt es gewohnlich zum Absterben samtlicher Algenfaden. Die
Anhaufung der braunen Zysten ist mit blofiem Auge sichtbar. Bisher ist es nicht
gelungen, den Organismus zu kultivieren. Er wurde nur nach Material vom
natiirlichen Standort beschrieben. Die Zellen vermehren sich durch Quertei-
lung. Sie bewegen sich genau, wie die ubrigen Myxobakterien relativ langsam
1 (xm in 2—4 Minuten. Dabei gleiten sie intermittierend, d. h. sie bewegen sich
eine Weile, um dann fur einige Zeit wieder in den Ruhezustand uberzugehen. In
Schwarmen wechseln sie einander bei der Bewegung ab.
Einzelne Zellen 0,5-0,7 X 4,0-7,0 (xm grofi; selten nur 3,0 (xm lang. Sporangien
15-20, gewohnlich 25-50 (xm grofi.
Der Organismus kommt in Sufiwassertiimpeln und Teichen vor, wo er auf
Cladophora fracta parasitiert. Er wurde in einem kleinen Teich in einer Ziegel-
tongrube in Vosendorf bei Wien (Osterreich) gefunden. Es ist bisher nicht
bekannt, ob er nur an einen einzigen spezifischen Wirt, d. h. nur eine Algenart
aus der Gattung Cladophora gebunden ist.
2. Nannocystis Reichenbach 1970
Vegetative Zellen in Form kurzer stumpfer Stabchen oder Kokken; freie
Sporangien bildend. Nur im Erdboden vorkommend.
Mit einer einzigen Art:
Nannocystis exedens Reichenbach 1970.
4 Fig. 74. Polyangium parasiticum - a vegetatives und reproduktives
Pseudoplasmodium auf Cladophora-Fadtn, b—g Entwicklung una Bildung von Cysten an
zwei Zellen von Cladophora, h-k verschiedene Formen von Cysten, / Cysten-
kette an einem Cladophora-Fzden, m Cystenkette im Innern eines Cladophora-
Fadens, (a 500X, im ubrigen 375x vergr., nach Geitler, 1925).
138 ■ Glekende Bakterien - Chondromyces - Cytophagales
3. Chondromyces Berkeley et Curtis 1874
Vegetative Zellen in Form zylindrischer Stabchen mit stumpfen Enden. Sporan-
gien entweder frei oder in kleinen Biischeln auf einzelnen oder verzweigten
Sporangiophoren vorhanden. Auf faulenden Pflanzenresten im Erdboden, auf
Exkrementen und Mist.
Typus generis: Chondromyces crocatus Berkeley et Curtis 1874
2. Ordnung Cytophagales Leadbetter 1974
Organismen in Form einzelliger gramnegativer Stabchen oder mehrzelliger
Faden. Manche Arten bilden Hormogonien, Gonidien oder Ruhezellen. Im
Gegensatz zu den Myxobacterales entstehen hier niemals Fruktifikationsgebil-
de. Ziemlich flexibel. Ernahrungsweise chemolithotroph, chemoorganotroph
oder mixotroph. Uberwiegend aerob, obwohl es auch anaerobe Arten gibt.
Manche Arten leben in Symbiose mit anderen Organismen, andere sind parasi-
tisch. In Bezug auf Wachstumsfaktoren verhalten sie sich heterogen. Manche
Arten wachsen ausreichend nach Zusatz von Ammoniumsalzen, andere erfor-
dern spezielle Wachstumsfaktoren.
Die meisten Arten bewegen sich gleitend auf fester Unterlage oder an der
Wasseroberflache, manche Arten verhaltnismafiig schnell (mehr als 10 um/min)
andere nur 2 |J,m/min oder noch langsamer. Eine Gruppe dieser Organismen
zeigt eine typische «Riittelbewegung». Der Bewegungsmechanismus ist
noch nicht genau bekannt. Meistens auf faulendem Pflanzenmaterial sowohl im
Erdboden als auch im Wasser, in Mist oder in Exkrementen von Saugetieren und
Vogeln auftretend. Selten kommen auch pathogene Arten vor.
Die Klassifikation dieser Organismen ist bisher noch ungeklart. Es ist offensicht-
lich, dafi die Familien Beggiatioaceae, Leucotrichaceae, Simonsiellaceae, Vitre-
oscillaceae eewisse phylogenetische Beziehungen zu den Blaualgen zeigen; sie
besitzen jedoch keine photoassimilierenden Pigmente. Die Familie Cytophaga-
ceae ist wahrscheinlich anderer Herkunft. Alle Organismen dieser Ordnung
miissen noch sorgfaltig untersucht werden, besonders hinsichtlich ihrer bioche-
mischen Eigenschaften. Soriano (1945), spater Soriano und Lewin (1965) stellten
die meisten Vertreter zur Ordnung Flexibacteriales.
Bestimmungsschliissel der Familien
la Zellen kugelig oder oval, grofi, uberwiegend beweglich
6. Achromatiacae (S. 216)
lb Zellen stabchenformig oder schraubenformig, manchmal auch zu Faden
vereinigt 2
la Einzelne Zellen oder Faden mit Karotinoiden .. l.Cytophagaceae(S. 139)
2b Nur Faden bildend;ohneKarotinoide 3
3a Meistens im Verdauungstrakt und Mundhohle von Wirbeltieren und in
Exkrementen von Pflanzenfressernvorkommend
5. Simonsiellaceae (S. 211)
3b Uberwiegend im Wasser vorkommend 4
4a Faden festhaftend, einzellig; mit Schwefeltropfchen. An den Enden werden
Gonidien gebildet 7. Thiosiphonaceae (S. 224)
4b Faden frei oder festhaftend, immermehrzellig 5
5a Faden oder Gonidien Rosetten bildend, die mit einem Ende an einer festen
Unterlage haften 3^^icotrichaceae (S. 185)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Cytophagaceae ■ 139
5b Weder Faden noch Gonidien Rosetten bildend 6
6a Faden uberwiegend zylindrisch, einzeln oder zu Biischeln vereinigt, Zellen
mit Schwefeltropfchen 2. Beggiatoaceae (S. 171)
6b Faden zylindrisch oder mit eingeschniirten Scheidewanden; Zellen ohne
Schwefeltropfchen 7
7a Scheidewandemeistdeutlichsichtbar 4. Vitreoscillacae(S.201)
7b Scheidewandemeistschlechtsichtbarodervolligundeutlich
8. Pelonemataceae (S. 225)
1. Familie Cytophagaceae Stanier 1940, emend.
Leadbetter 1974
Organismen entweder einzellig in Gestalt langer, flexibler, an den Enden
verjiingter Stabchen, die gerade, leicht gewellt oder schraubenartig gekriimmt
sind, oder in Form mehrzelliger Faden, die ebenfalls gerade oder
schraubenformig sind. Faden manchmal verzweigt oder mit einer Scheide. Bei einigen
Vertretern kommt ein komplizierter Entwicklungszyklus vor. Drei morpholo-
gisch sehr ahnliche Arten (Sporocytophaga, Sphaerocytophaga und Sphaeromy-
xa) bilden als einzige Vertreter dieser Familie wahrend ihrer Entwicklung
Mikrozysten. Bisher wurde angenommen, dafi Mikrozysten durch einfache
Verkurzung stabchenformiger Zellen zu einem kugeligen Gebilde entstehen.
Graf (1962) und Bauer (1962) zeigten aber mit Hilfe des Elektronenmikroskops,
dafi sie durch Knospung polar oder subpolar an der Zellflanke entstehen. Inre
Bedeutung besteht darin, dafi es nach einer gewissen Zeit der vegetativen
Fortpflanzung bei der Bildung von Mikrozysten zur autogamen Verschmelzung
der Kerne kommt, worauf eine Reduktionsteilung folgt, die die Kombination
der Gene beeinflufk. Die Mikrozysten entstehen als kleine Knospen auf
vegetativen Zellen. Je eine Zelle besitzt immer nur eine Mikrozyste, die mit der Zeit
grofier wird und dann die absterbende Mutterzelle verlafit. Freie Mikrozysten
sind unbeweglich und ohne Zellwand. Sie keimen durch Bildung fingerartiger
Auslaufer, die erneut zu vegetativen Zellen werden.
Ein gemeinsames Merkmal dieser Familie ist das Vorhandensein verschiedener
Karotinoid-Typen, durch die die Organismen in verschiedenen Schattierungen
gelb, orange und rot gefarbt sind. Grammnegativ. Ernahrungsweise
chemoorganotroph. Respirativer oder fermentativer Metabolismus. Individuen ohne
Scheide bewegen sich durch ein charakteristisches Gleiten. Vor allem im Sufi- und
Meerwasser sowie im Erdboden vorkommend. Die ganze Familie ist
verhaltnismafiig wenig bekannt. Am besten wurden bisher die Zellulose zersetzenden
Organismen (Cytophaga) erforscht, die eine einheitliche okologisch-physiologi-
sche Gruppe bilden. Ansonsten sehr schwer identifizierbar und in ihren bioche-
mischen Eigenschaften und Anspriichen nicht genugend bekannt. Morphologi-
sche Beschreibungen beruhen meistens auf dem Aussehen gefarbter Praparate,
und beziehen oft eine Reihe von Artefakten ein. Urspriinglich umfafite die
Familie nach Stanier (1940) nur die Gattung Cytophaga.
Bestimmungsschliissel der Gattungen
la Keine Mikrozysten bildend 2
lb Mikrozysten bildend 7
2a Zellen einzeln, stabchenformig und flexibel 3
2b Zellen Faden bildei^ 5
140 • Gleitende Bakterien - Cytophaga
3a VorkommendimBodenoderimWasser 4
3b Nur in der Mundhohle vorkommend 7. Capnocytophaga (S. 169)
4a Agar,ZelluloseundChitinwerdenhydrolysiert ... 1.Cytophaga(S. 140)
4b Agar, Zellulose und Chitin werden nicht hydrolysiert
2.Flexibacter(S. 146)
5a Faden unter gewissen Bedingungen, wenigstens teilweise mit einer
Scheide 6
5b Scheide niemals vorhanden, Faden schraubenartig gekriimmt, beweglich . . .
5. Saprospira(S. 156)
6a Faden dichotom verzweigt 3.Herpetosiphon(S. 154)
6b Faden nicht verzweigt 4. Flexithrix (S. 156)
7a Strengaerob 8
7b Strenganaerob 8. Sphaerocytophaga(S. 169)
8a Mikrozysten werden einzeln gebildet 6. Sporocytophaga (S. 163)
8b Mikrozysten werden in Ketten gebildet 9. Sphaeromyxa(S. 170)
1. Cytophaga Vinogradskij 1929, emend. Lewin 1969
Zellen in Form einzelner kurzer oder langgezogener, feiner flexibler Stabchen,
gegen die abgerundeten Pole leicht konisch verschmalert. Spindelformige Zellen
mit scharf zugespitzten Enden entstehen als Artefakte in fixierten Praparaten.
Unter gewissen Bedingungen manchmal fadenformige Involutionsformen bil-
dend, die teilweise an Mikrozysten erinnern. In Form unverzweigter, abgerun-
deter und gedrungener Gebilde nur an gefarbten Praparaten zu beobachten.
Ohne Scheide, nicht schraubenartig gekriimmt. Keine Ruhestadien bildend. Die
sehr schwache Refraktibilitat ist wahrscheinlich eine Folge der fehlenden Zell-
wand. Ohne Geifieln. Zellsuspension gelb, orange oder rot gefarbt. Urspriing-
lich wurde in der Literatur angefiihrt, dafi es sich um Karotinoide handelt.
Achenbach et al. (1974) gibt an, dafi drei Pigmente vorhanden sind, von denen
Flexirubin dominiert; ihrer Zusammensetzung nach sind es jedoch keine
Karotinoide. Zellen mit den meisten Anilinfarbstoffen gut farbbar. Gramnegativ.
Streng aerob (meistens im Erdboden lebende Arten) oder fakultativ anaerob (in
Meer vorkommende Arten). Ernahrungsweise chemoorganotroph. Metabolis-
mus respirativ. Molekularer Sauerstoff (eventuell Nitrate) dient als Elektronen-
akzeptor. Einige Arten haben einen fermentativen Metabolismus. Sie konnen
Agar, Zellulose, Chitin, Karboxymethylzellulose und Alginate hydrolysieren
oder depolymerisieren. Manche Arten brauchen organische Wachstumsfakto-
ren. Sie sind imstande, aufier Zellulose auch einige einfache Kohlenhydrate oder
Peptide als Energiequelle zu verwerten. Die Fahigkeit einiger Stamme
Saccharose zu verwerten, tritt zuriick, wenn sie auf leichter assimilierbaren Stoffen
kultiviert werden. Auf Nahrboden mit giinstigen Kohlenstoffverbindungen
bilden sie extrazelullare Polymerverbindungen, wodurch die Viskositatfliissiger
Medien und die Schleimigkeit von Kolonien auf Agar verursacht wird.
Fortpflanzung durch Einschnurung, wobei sich die zwei Tochterzellen allmah-
lich voneinander entfernen. Bewegung durch ein charakteristisches Gleiten.
Einzelne losgeloste Zellen sind selten beweglich, obwohl sie manchmal bis zu
10 u,m von den iibrigen entfernt gefunden werden. Sie bewegen sich meistens in
geschlossenen Reihen (Schwarme von 20-30 Zellen), und zwar in gleicher
Richtung und mit gleicher Geschwindigkeit, wobei die erste Reihe die Bewegung
der iibrigen Zellen bestimmt.
Es ist nicht bekannt, wie die Bewegung der Zellen koordiniert wird. Die
einzelnen Schwarme erscheinen in den Kolonien als finger- oder lappenformige
Auslaufer. Stabchen ungefahr 0,3-0,7 X 5,0 u,m grofi.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Cytophaga • 141
Wahrscheinlich haufig in Erdboden, in Sufi- und Meerwasser; meistens auf
verwesendem Pflanzenmaterial; bei mikrobiologischen Analysen oft ubersehen.
Rubencik (1933) fand sie auch im Boden von Riesenfeldern, wo sie am Reini-
gungsprozefi von Abwassern beteiligt waren. Aus Sufiwasser ist bisher nur die
Art Cytophaga johnsonae bekannt. Es ist jedoch sehr wahrscheinlich, dafi
besonders in Abwassern und im Schlamm auch eingeschleppte Arten gefunden
werden konnen, die urspriinglich aus Erdboden beschrieben wurden.
Die Anzahl der gultie beschriebenen Arten ist fraglich, da bisher die Begrenzung der
Gattung Cytophaga sehr unklar ist. Ebenso fraglich ist auch ihre taxonomische Einteilung.
So wird sie im Bergey's Manual (1957) zu den Myxobacterales, von Hutchinson und
Clayton (1919) zu den Spirochaetales und von Bokor (1930) zu den Actinomycetales
gestellt. Bergey's Manual (1974) ordnet dieser Gattung auch einige weniger bekannte, im
Meer vorkommende Arten der Gattung Microscilla zu.
Die Arten lassen sich kaum allein nach den morphologischen Eigenschaften
bestimmen; es ist notig, wenigstens auch die Merkmale der Kulturen zu beriick-
sichtigen.
Typus generis: Cytophaga hutchinsoni Vinogradskij 1929
Wichtigste Literatur: Hutchinson und Clayton 1919, Vinogradskij 1929,
Bokor 1930, Krzemieniewska 1930, 1933, Stapp und Bortels 1934, Stanier 1940,
1942, 1947, 1957, Bachmann 1955, Veldkamp 1961, Anderson und Ordal 1961,
sonano una Lewin 1965, Lewin 1969, Strohl und Tait 1978.
BestimmungsschlUssel der Arten
la Im Erdboden oder Sufiwasser vorkommend 2
lb Auf den Kiemen von Siifiwasserfischen vorkommend 8. C. aquatilis
2a Zellen verwerten Starke 3
2b Zellen konnen keine Starke verwerten 5
3a Mit satt gelben Pigment 4
3b Mit cremefarbenem bis hellgelbem Pigment 5. C. albogilva
4a Zellulose wird zersetzt 6. C. deprimata
4b Zellulose wird nicht zersetzt. Meistens im Boden oder Sufiwasserschlamm
vorkommend 2. C. johnsonae
5a Zellmasse gelb oder orange gefarbt 6
5b Zellmasse rosa oder olivgriin gefarbt 7
6a Meistens im Boden vorkommend, mit gelbem Pigment
l.C. hutchinsonii
6b Mit hell orangefarbenem Pigment 4. C. aurantiaca
7a Zellmasse rosa gefarbt 3. C. rubra
7b Zellmasse olivgriin gefarbt 7. C. tenuissima
1. Cytophaga hutchinsonii Vinogradskij 1929 (Fig. 75a)
(non Cytophaga hutchinsonii Imseneckij und Solnceva 1930),
Cytophaga lutea Vinogradskij 1929, Cytophaga sihestris Stapp und Bortels
1934, Cytophaga anularis Stapp und Bortels 1934, Cytophaga flavicula Stapp
und Bortels 1934, Cytophaga crocea Stapp und Bortels 1934.
Zellen stabchenformig, flexibel, zart, einzeln, sich an den Enden leicht verjiin-
gend. In alten Kulturen abnormal lange Faden, oder kokkenartige Formen
(Sphaeroplasten) bildend.
Protoplasma mit Anilinfarbstoffen gut und gleichmafiig farbbar. Zellen mit
gelbem Pigment aus der Gruppe der Karotinoide. Gramnegativ.
Metabolismus respirativ; molekularer Sauerstoff dient als Endakzeptor von
Elektronen. Als Kohlenstoff- und Energiequelle wird Zellulose, Zellobiose und
142 • Gleitende Bakterien - Cytophaga
Glukose verwendet. Agar und Starke werden nicht zersetzt. Streng aerob.
Benotigt keine organischen Wachstumsfaktoren. Auf festen Boden mit Zellulose
(Filtrierpapier) oder Glukose werden stark schleimige bis gummiartige, hellgel-
be, glanzende Kolonien gebildet. Auf Filtrierpapier verlauft die Hydrolyse so
schnell, dafi altere Teile der Kolonien durchsichtig erscheinen. Auf Boden mit
Glukose werden scheibenformige, hervortretende Kolonien gebildet. In fliissi-
gen Nahrlosungen kommt es zu Schleimausscheidungen, wodurch die Nahrlo-
sungen viskos werden. Der Schleim lost sich allmahlich in eine opaleszente
Losung auf. Auf submersem Filtrierpapier wird das Wachstum an der Oberfla-
che scnon nach 3-5 Tagen als gelber Fleck sichtbar. In Nahrlosungen mit
Glukose werden spater dichte schleimige Membranen an der Oberflache
gebildet. Kulturen wenig widerstandsfahig. Nach einigen Wochen autolysieren sie,
so dafi sie sich nicht mehr umimpfen lassen. Fortpflanzung durch Einschniirung.
In jungen Kulturen bewegen sich die Zellen bei 30 °C in Schwarmen, die aus der
Peripherie der Kolonie herauskriechen.
Einzelne Zellen 0,3-0,5 X 2,0-10,0 |J,m grofi; in der Lange ziemlich verander-
lich.
Haufig im Erdboden vorkommend. Allgemein verbreitet. Kommt vermutlich
auch in Abwassern und im Oberflachenwasser vor, wohin die Zellen vom
Regenwasser aus dem Boden gesplilt werden. Von Rubencik (1933) in Boden
von Rieselfeldern gefunden.
Fig. 75. Cytophaga hutchinsonii - a (nach Mikrophotographie umgezeichnet -
Krzemieniewska, 1933. - 4000X), b als Cytophaga lutea beschriebene Form;
Zellen zu typischen Schwarmen zusammengesetzt (nach Mikrophotographie
umgezeichnet - Vinogradskij, 1929. - 4000 X), c als Cytophaga anularis
beschriebene Form (nach Mikrophotographie umgezeichnet-Stapp und Bortels, 1934.-
4000X). a.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Cytophaga ■ 143
Stanier (1942) stellte zu dieser Art noch:
la. Cytophaga lutea Vinogradskij 1929 (Fig. 75b)
Lange, diinne Zellen ohne sichtbare Verstarkung des mittleren Teiles; an den Enden
zugespitzt; leicht gebogen. Mit gelbem Pigment. Nur einmal als Reinkultur aus Wiesenbo-
den isoliert. Die Kultur starb nach 2 Monaten ab. Selten vorkommend.
lb. Cytophaga silvestris Stapp et Bortels 1934
(non Cytophaga sylvestris Stapp et Bortels 1934)
Zellen stabchenformie; mit gelbem Pigment. Bilden in Kulturen unter gewissen Bedingun-
gen seesternartige Getilde, die grofie Ausmafie erreichen. Ohne Mikrozysten.
Zellen 0,2-0,3 x 3,0-7,0 um grofi.
In Waldboden gefunden.
lc. Cytophaga anularis Stapp et Bortels 1934 (Fig. 75c)
Vegetative Zellen in Form seesternformiger Gebilde, vielleicht auch Mikrozysten bildend
(?). Beweglichkeit nimmt mit dem Alter der Kolonien ab. Mit gelbem Pigment. Unter
gewissen Bedingungen rollen sich die Zellen ringartig zusammen.
Zellen 0,3—0,3 X 2,5-5,0 um grofi, die ringformigen Gebilde messen im Durchmesser 1,0-
1,2 um.
Aus Laubwaldboden isoliert.
Id. Cytophaga flavicula Stapp et Bortels 1934
Zellen mit gelbem Pigment. Aus Waldstreu isoliert.
le. Cytophaga crocea Stapp et Bortels 1934
Zersetzt intensiv Zellulose. Besitzt ein gelbes Pigment. Aus Wiesenstreu eines Waldes bei
Gottingen (BRD) isoliert.
2. Cytophaga johnsonae Stanier 1947
(non Cytophaga johnsonii Stanier 1957),
Promyxohacterium johnsonii (Stanier 1947) Krasil'nikov 1949, Cytophaga
johnsonae var. denitrificans Stanier 1947, Promyxohacterium johnsonii var. aenitrifi-
cans (Stanier 1947) Krasil'nikov 1949.
Vegetative Zellen in Form diinner, schwach lichtbrechender, flexibler Stabchen.
In der ganzen Lange gleichmafiig breit, mit abgerundeten Enden. Zellen grofi-
tenteils nicht merklich gekriimmt, manchmal nur leicht hakig gebogen oder
gelegentlich in der Form des Buchstabens Y. In alteren Kulturen werden
regelmafiig Spharoplasten gebildet, die manchmal schon in den friihen Entwick-
lungsstadien sichtbar sind und mit der Zeit schnell iiberhand nehmen. Zellen in
der Masse gelb gefarbt, mit Pigmenten aus der Gruppe der Karotinoide. Proto-
plasma mit Anilinfarben gleichmafiig farbbar. Gramnegativ.
Metabolismus respirativ; molekularer Sauerstoff dient als Endakzeptor von
Elektronen. Als Kohlenstoff- und Energiequelle wird eine ganze Reihe von
Kohlenhydraten, Polysacchariden und vor allem Starke verwertet. Zellulose und
Agar werden nicht verwertet, doch wird Chitin hydrolysiert. Aktiv proteoly-
tisch, doch nur auf armen Medien. Konventionelle Nahrboden sind zu konzen-
triert, sie verlangsamen das Wachstum. Als Stickstoffquelle reichen jedoch
Ammoniumsalze oder Nitrate aus. Kulturcharakteristik und Morphologie der
Kolonien werden erheblich von der Konzentration und der An der Nahrstoffe
beeinflufk. Auf Agar mit Chitinzusatz ist schon nach wenigen Tagen die Stelle
des zersetzten Chitins gut sichtbar. Die Kolonien liegen in einem seichten
Krater. Bei einer Agarkonzentration von 1% ist die Beweglichkeit der Zellen
dermafien verlangsamt, dafi sich isolierte, flache Kolonien bilden. Bei 1,5-2,0%
Agargehalt bedeckt sich die ganze Agar-Oberflache binnen 36-48 Stunden mit
einer diinnen Zellschicht. Auf Agar mit Hefeextrakt sind die Kolonien bis zu 5-6
Tagen konvex, glatt, glanzend und mit glatten Randern. Spater bildet sich an
ihren Randern ein Saum gleitender Zellen. Auf Agar mit niedriger
Konzentration von Pepton sind die Zellen beweglich. Bei 0,5% Pepton sind die Kolonien
leicht erhoht, mit e'yggi breiten Saum, bei 0,25% sind sie fast ohne deutliche
144 ■ Gleitende Bakterien - Cytophaga
Grenzen. Bewegung der Zellen typisch gleitend, von der Konzentration der
Nahrstoffe und des Agars abhangig.
Junge vegetative Zellen 0,2-0,4 X 1,5-15,0 |j,m grofi. Auf geeigneten Medien
iiberwiegt eine Zellange von 8,O--12,0 |j,m. Auf konventionellen Nahrboden mit
hoher Nahrstoffkonzentration wachst die Art in Form sehr kurzer Stabchens,
die nach den morphologischen Eigenschaften in die Gattung Flavobacterium
eingereiht werden konnten.
Kommt im Erdboden, im Siifiwasserschlamm und in Mischdiinger vor. Wahr-
scheinlich allgemein verbreitet.
Hierher gehort auch die folgende Varietat:
2a. Cytophaga johnsonnae var. denitrificans Stanier 1947
Promyxohacterium johnsonii var. denitrificans (Stanier 1947) Krasil'nikov 1949.
Morphologie wie bei der Leitart. Unterscheidet sich durch den Metabolismus, indem sie
Chitin nur teilweise verwertet und die Fahigkeit hat, unter anaeroben Bedingungen Nitrate
zu denitriefizieren und als Endakzeptoren von Elektronen zu beniitzen. In Abwesenheit
von Nitraten aerob.
3. Cytophaga rubra Vinogradskij 1929
Einzelne, flexible, schwach lichtbrechende Stabchen. Bei alten Kulturen kom-
men Spharoplasten vor. Protoplasma mit Anilinfarbstoffen gleichmafiig farbbar.
Zellen in Massen rosa gefarbt, Karotinoide enthaltend. Gramnegativ.
Metabolismus respirativ; molekularer Sauerstoff Endakzeptor von Elektronen. Als Koh-
lenstoffquelle wird Zellulose, Zellobiose, Glukose, Mannose und Xylose
verwertet. Braucht keine organischen Wachstumsfaktoren. Lost Agar auf. Zersetzt
Starke nicht. Streng aerob. Auf zellulosehaltigem Agar sowie in fliissigen
Nahrlosungen auf wenig Schleim bildend. Filterpapier wird nur teilweise
zersetzt. Kolonien auf Agar mit Glukose hellrosa, klein, bis 2 mm im Durchmesser;
im Agar versinkend. Fliissige Nahrlosungen seidig getriibt, hellrosa. Papier in
Nahrboden wird mazeriert, aber nicht vollig zersetzt. Das starkste Wachstum
auf Papier erfolgt an der Oberflache, die meisten Zellen schweben jedoch im
Medium.
Vegetative Zellen 0,5-0,7 x 3,5-11,0 |j,m grofi. Die Lange ist sogar innerhalb
einer Kultur veranderlich, am haufigsten betragt sie 7,0 |j,m.
Allgemein in Erdboden vorhanden. In das Wasser kann die Art durch Regen -
oder Abwasser eingeschwemmt werden.
Unsichere Arten:
4. Cytophaga aurantiaca Vinogradskij 1929
Mycococcus cytophagus (Hutchinson et Clayton 1919) Bokor 1930 (?)
Dunne, flexible Stabchen, an den Enden leicht verjiingt. Morphologisch
Cytophaga hutchinsonii sehr ahnlich. Gramnegativ. Zellen in der Masse durch
Pigment aus der Gruppe der Karotinoide deutlich orange gefarbt. Auf Mineralsi-
likagel bilden sich schon nach kurzer Zeit auf dem Filtrierpapier schleimige
orangefarbene Flecken. Das Papier wird schnell durchsichtig, die Zersetzung
geht schnell und intensiv vor sich. Starke wird nicht zersetzt.
Zellen 1,0 x 6,0 - 8,0 urn grofi.
Kommt seltener als Cytophaga hutchinsonii im Erdboden vor. Auch in Boden
von Rieselfeldern gefunden (Rubencik 1933), wo sie sich am Reinigungsprozefi
beteiligte.
Eine wenig untersuchte Art, vor allem was die biochemischen Eigenschaften
anbelangt; wird von Lewin und Lounsbery (1969) mit Flexibacter aurantiacus
fur identisch gehalten.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Cytophaga ■ 145
5. Cytophaga albogilva Fuller et Norman 1943
Lange, gramnegative, biegsame Stabchen mit zugespitzten Enden. Auf Starke-
agar cremefarbene bis hellgelbe Kolonien bildend. Verwertet aufier Zellulose
eine ganze Reihe von Zuckerarten und Polysacchariden (Starke). Gelatine
langsam verfliissigend.
Bewegung durch typisches Gleiten.
Zellen 0,3-0,5 x 4,5-7,5 urn grofi.
Im Erdboden und in Kompost vorkommend. Wahrscheinlich allgemein
verbreitet.
6. Cytophaga deprimata Fuller et Norman 1943
Lange, gramnegative, flexible Stabchen mit verjiingten Enden.
Zellen durch Karotinoiden gelb gefarbt. Verwertet Zucker und Polysaccharide,
mit Ausnahme von Zellulose. Verfliissigt Gelatine. Bewegung gleitend.
Zellen 0,3-0,5 x 5,5-10,0 \i grofi.
Im Boden auf verwesendem Pflanzenmaterial vorkommend.
7. Cytophaga tenuissima Vinogradskij 1929
Morphologische Beschreibung nur ungenau bekannt. Unterscheidet sich von
den iibrigen Arten durch abnorme Lange. Erzeugt auf Silikagelen mit
Filtrierpapier griinlich oder olivgriin gefarbten Schleim. Zersetzt Zellulose, aber nicht
Starke. In feuchtem Waldhumus in Schweden gefunden. Kommt wahrscheinlich
selten vor.
8. Cytophaga aquatilis Strohl et Tait 1978
Flexible Stabchen ohne Geifieln. In alten Kulturen kommen auch abnorm lange
Stabchen oder kokkenartige Formen vor, die Mikrocysten ahnlich sind. Weder
Fruktifikationsstadien noch Mikrocysten bildend. Je nach der Sauerstoffkon-
zentration sind die Kulturen gelb, orange oder hellbraun gefarbt; bei anaeroben
Wachstum ohne Pigmente. Das Hauptpigment ist kein Karotinoid, es ahnelt
dem Flexirubin.
Fakultativ anaerob. Eine breite Palette von Karbohydraten und Alkoholen
oxydierend. Produzieren oxydativ Sauren aus Maltose und Glukose, jedoch
nicht aus Saccharose, Zellobiose, Laktose, Galaktose oder Manitol. Hydrolysie-
ren Karboxylmethylzellulose, Starke, Kasein, Gelatine und Pepton, in geringem
Mafie auch Chitin. Zellulose und Agar werden nicht hydrolysiert. Alginat wird
nicht verwertet. Konnen unter anaeroben Bedingungen bei Anwesenheit von
Glukose und Hefeextrakt oder wahrend der Nitratreduktion wachsen. Nitrate
werden reduziert und werden auch als Stickstoffquelle beniitzt. Optimale
Wachstumstemperatur 20 °C, bei 0 c und 37 °C kein Wachstum.
Zellen meistens 0,5 x 0,8 |J,m grofi; Grofienbereich 0,5-0,75 x 5,0-15,0 |j,m.
Bewegung durch charakteristisches Gleiten.
Der Organismus wurde aus den Kiemen von Siifiwasserfischen isoliert. Pathoge-
nitat ist bisher nicht bewiesen, obwohl sie angenommen werden kann.
Ahnliche Stamme von fakultativ anaeroben Cytophagen wurden schon von Borg
(1960) auf Lachskiemen gefunden. Auch er konnte bei ihnen keine Pathogenitat
nachweisen, setzte sie jedoch voraus.
Ausgesprochene Meeresarten: C. krzemieniewskae, C. diffluens, C. lytica, C
salmonicolor, C fermeMarts; unsichere Meeresarten: C. haloflava, C rosea, C
sensitiva, C. latercula, Microscilla argenaria, M. sericea, M. furvescens; die
Beschreibungen werden hier nicht angefuhrt.
146 • Gleitende Bakterien - Flexibacter
2. Flexibacter Soriano 1945, emend. Lewin 1969
Flexible Stabchen oder Faden, bis zu tausendfacher Vergrofierung ohne sichtba-
re Segmentierung (nur bei einer Art im Phasenkontrast sichtbar). lm Elektronen-
mikroskop sind jedoch 3—4 Septen in jedem Faden klar zu erkennen. Die
Fadenl'ange hangt offenbar von der Temperatur, der chemischen Zusammenset-
zung des Mediums und des Wachstumstadiums ab. Ohne Verzweigung; bei
einer Art verzweigen sich die Faden ausnahmsweise auch ohne Scheide und
Geisseln. Ruhestadien nicht bekannt. Wahrend der exponentiellen Wachstums-
phase teilen sich die Faden in der Mitte ohne Riicksicht auf ihre Lange und die
Wachstumsbedingungen. Am Ende des exponentiellen Wachstums kommt eine
Fragmentierung der Faden vor. Sie konnen jedoch auch Zelltrennw'ande bilden
ohne zu wachsen; dadurch kann sich die Lange des Fadens den Aufienbedingun-
gen anpassen. Erhoht sich die Kultivierungstemperatur wahrend des
exponentiellen Wachstums, so werden Zelltrennwande gebildet, die F'aden zerfallen
meistens in 3—4 Teile, manchmal auch in sehr kurze Zellen. Im Gegensatz dazu
inhibiert die Herabsetzung der Temperatur die Bildung von Zelltrennwanden,
begrenzt aber nicht das Wachstum des Fadens, d. h. die Zellen verlangern sich.
Es scheint, dafi Organismen dieser Gattung zyklische morphologische Um-
wandlungen durchmachen. In jungen Kulturen sind bewegliche lange Faden
vorhanden, in 'alteren Kulturen vorwiegend kurze Stabchen. Gramnegativ.
Ohne photosynthetische Pigmente; Zellsuspensionen gelb, orange, rosaoder rot
gefarbt. Urspriinglich vermutete man Karotinoide, aber Achenbach et al. (1974)
bewiesen, dafi 3 Pigmente enthalten sind, wobei Flexirubin vorherrscht, was er
als systematisches Merkmal fur die Gattung ansieht. Ihrer Zusammensetzung
nach sind es keine Karotinoide. In den Zellen werden weder Granula noch
Schwefeltropfchen abgelagert. Chemoorganotroph; streng aerob. Metabolismus
gewohnlich respirativ. Molekularer Sauerstoff dient als Endakzeptor von Elek-
tronen. Eine Art ist sowohl respirativ als auch fermentativ. Polymerisierte Stoffe
(Agar, Zellulose, Chitin, Alginate) werden nicht zersetzt. Physiologie und
Metabolismus bisher sehr wenig bekannt.
Fortpflanzung durch einfache Fragmentierung in relativ lange Tochterfaden.
Reproduktionsgebilde, Sporen und Mikrozysten werden nicht gebildet. Bewe-
gung gleitend, wobei sich die Faden biegen oder wellen. Zellen oder Faden
gewohnlich 0,5 |j,m breit (unter 1,0 |j,m). Lange veranderlich, 5,0-100,0 |j,m
oder mehr erreichend. Septen im Faden 10-30 |J,m voneinander entfernt.
Meistens auf verwesenden Siifiwasser- und Meeresalgen an der Kiiste, in heifien
Quellen u. a. vorkommend.
Die Gattung umfafit zwei urspriinglich als selbstandig beschriebene Gattungen:
Flexibacter (Zellulose zersetzend) und Microscilla (zersetzt keine Zellulose).
Sonst sind, wie Lewin (1969) zeigte, beide Arten unter gewissen Bedingungen
morphologisch, in ihrer Pigmentzusammensetzung und in ihren Nahrungsan-
spriichen nicht zu unterscheiden. Pringsheim (1951) halt sie nicht fur Bakterien.
Die meisten dieser Arten bediirfen noch weiterer Untersuchungen.
Die Identifizierung der Arten allein auf Grund morphologischer Merkmale ist
problematisch. Es ist notwendig, wenigstens die Merkmale der Kulturen zu
beriicksichtigen.
Typus generis: Flexibacter flexilis Soriano 1945
Wichtigste Literatur: Davis 1933, Imseneckij und Solnceva 1936, Ordal und
Rucker 1944, Garnjobst 1945, Soriano 1945, 1947, Stanier 1947, Pringsheim
1949, 1951, Anderson und Ordal 1961, Bauer 1962, Fox und Lewin 1963, Lewin
1969, Lewin und Lounsbery 1969, Mandel und Lwn 1969, Simon und White
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
, Flexibacter ■ 147
1971, Poos et al. 1972, Achenbach 1974, Lewin 1974, Bergey's Manual 1974,
Reichenbach und Golecki 1975.
Bestimmungsschliissel der Arten
la Siifiwasser-Formen 2
lb Meeres-oderBrackwasser-Formen 11
2a Zellmasse orange gefarbt 3
2b Zellmasse anders gefarbt 5
3a Nicht auf MedienmitMeerwasserwachsend 4
3b Auch auf MedienmitMeerwasserwachsend 8.F1. elegans
4a Braucht bei Wachstum in Kulturen organischeWachstumsfaktoren
1. F. flexilis
4b Beim Wachstum in Kulturen keine Wachstumsfaktoren erforderlich
2. Fl. tractuosus
5a Zellmasse gelb gefarbt 6
5b Zellmasse nicht gelb gefarbt 8
6a Streng aerob 7
6b Fakultativanaerob 3. Fl. succinicans
7a Katalase bildend 9. Fl. aurantiacus
7b Keine Katalase bildend 10. Fl. sancti
8a Zellmasse rosa gefarbt 7. Fl. giganteus
8b Zellmasse nicht rosa gefarbt 9
9a Zellmasse rot gefarbt 10
9b Zellmasse gelbgriin gefarbt, fiirFische pathogen 4. Fl. columnaris
10a Wachst nicht auf Medien mit Meerwasser ll.Fl. roseolus
10b Wachst auch auf Medien mit Meerwasser 12. Fl. ruber
11a Im Phasenkontrast sichtbare Septen in den Faden; Faden manchmal ver-
zweigte, spiralenartigeFormationen bildend; Zellmasse pfirsichorange . . .
6. Fl. polymorphus
lib Im Phasenkontrast keine Septen in den Faden sichtbar 12
12a Zellmasse gelb gefarbt 5. Fl. aggregans
12b Zellmasse rosa gefarbt 13. Fl. litoralis
1. Flexibacter flexilis Soriano 1945 (Fig. 76)
Flexibacter flexilis var. algavorum Gromov et al. 1972
Flexible Stabchen oder Faden ohne sichtbare Querwande.
Zellmasse durch das Karotinoid Saproxantin iiberwiegend orange (manchmal
auch rosa oder rot) gefarbt. Streng aerob, chemoorganotroph, mit respirativem
Metabolismus. Braucht einige Aminosauren als Wachstumsfaktoren.
Zellfaden 0,5 X 10,0-50,0 urn grofi.
Kommt im Boden und im Siifiwasser vor.
Lewin (1969) beschrieb zwei Varietaten: «pelliculosus» und «iolanthae», die sich
nur durch einige biochemische Teste, eventuell in ihrer Pigmentation
unterscheiden.
la. Flexibacter flexilis var. algavorum Gromov et al. 1972
Unterscheidet sich von der Leitart durch die Fahigkeit, Blaualgen aus der Gattung Anabae-
na, Phormidium, Nostoc zu lysieren; sie werden bei direktem Kontakt der beiden
Organismen lysiert. Bei Ziichtung auf Blaualgenkulturen entsteht eine allmahlich sich verbreiternde
Zone, an deren Randern zerstorte, von Bakterien umgebene Blaualgenzellen gefunden
werden. In der Mitte der Zone befinden sich vollkommen zerstorte Zellen. Am empfindlich-
sten gegen Lyse sind Vertreter der Gattung Nostoc, bei der die Zellen im Laufe von 3—4
Tagen vollkommen zerfallen.
148 - Gleitende Bakterien - Flexibacter
2. Flexibacter tractuosus (Lewin 1969) Leadbetter 1974
Microscilla tractuosa Lewin 1969
Nicht segmentierte, flexible Zellen in Gestalt von Stabchen oder Faden. Zellmas-
se ist durch Karotinoide, von denen Saproxantin iiberwiegt, orange gefarbt.
Streng aerober, chemoorganotropher Organismus mit vollig respirativem Me-
tabolismus, Benotigt keine organischen Wachstumsfaktoren. Tolerant gegen
Salzgehalt, vertragt auch eine doppelte Salzkonzentration des Meerwassers.
Zellen 0,5 |j,m breit und bis 40,0 |J,m lang.
Kommt im Salz- und Siifiwasser vor.
3. Flexibacter succinicans (Anderson et Ordal 1961) Leadbetter 1974
Cytophaga succinicans Anderson et Ordal 1961
Junge vegetative Zellen in der Gestalt von Stabchen mit abgerundeten Enden. In
alteren Kulturen sind die Zellen breiter und kiirzer; aufier diesen kommen auch
Spharoplasten vor. Zellen nicht flexibel, rigid wie normale Bakterienzellen.
Ohne Geifiel; keine Mikrozysten bildend. Gramnegativ. Unter aeroben Bedin-
gungen Zellmassen dunkelgelb bis gelb-orange gefarbt; unter anaeroben Zell-
massen weifi. Farbung durch Karotinoide.
Fakultativ anaerob; wachst gut auch unter aeroben Bedingungen. Metabolismus
respirativ (molekularer Sauerstoff wird als Endakzeptor von Elektronen be-
niitzt) oderfermentativ. Braucht in einer anaeroben Umwelt Kohlenhydrate, die
in Anwesenheit von Kohlendioxid zu Bernstein-, Essig- und Ameisensaure
fermentiert werden. Zellulose wird nicht fermentiert, Agar nicht hydrolysiert.
Benotigt wahrscheinlich organische Wachstumsfaktoren. Kolonien auf Agar
diinn, verschwommen, transparent, im reflektierten Licht regenbogenartig
gefarbt und eine kaleidoskopische Brechung des reflektierten Lichtes aufweisend.
An den Randern bilden sich Zellschwarme in Form von Auslaufern.
Morphologic der Kolonien veranderlich, von der Konzentration der Nahrstoffe und des
Agars, sowie von Temperatur und Feuchtigkeit abhangig. Zellen durch charak-
teristisches Gleiten beweglich. Ohne geniigende Feuchtigkeit nicht beweglich.
Oft bewegen sie sich in einer Entfernung von 1-3 Zellangen abwechselndvor-
und riickwarts.
Junge Zellen 0,5 x 4,0-6,0 |j,m grofi. Alte Kulturen enthalten Zellen von 0,7 x
2,0 |j,m.
Im Siifiwasser vorkommend. Als Saprophyt aus den Kiemen ziehender Lachse in
Snake River (Idaho, USA) und von Forellen und Lachsen in Aquarien isoliert.
4. Flexibacter columnaris (Davis 1922) Leadbetter 1974 (Fig. 81)
Bacillus columnaris Davis 1922, Chondrococcus columnaris (Davis 1922) Ordal et
Rucker 1944, Cytophaga columnaris (Davis 1922), Garnjobst 1945
Meist in Form von langen, schlanken Stabchen mit abgerundeten Enden; nie
spindelformig. Aufierdem kommen auch fadenformige, segmentierte oder nicht
segmentierte Formen vor, sowie verzweigte Zellen oder ringformige Gebilde.
Bei letzteren ist es nicht klar, ob es sich um Involutionsformen handelt. Bei
ringformigen Gebilden erweckt der sekretierte Schleim oft den Eindruck, als ob
es sich um Kokken oder Mikrozysten handelte.
Gramnegativ, Zellen homogen; enthalten Partikel, die mit Sudan nicht farbbar
sind. Zellmassen durch Karotinoide gelbgriin gefarbt.
Metabolismus wahrscheinlich respirativ; molekularer Sauerstoff dient als
Endakzeptor von Elektronen. Vermutlich aerob. Zucker wird nicht fermentiert,
Glukose wird oxydiert. Pathogen fur lachsartige Fische (Salmoniden). In fliissi-
gen Medien Zellen rigid, gerade oder leicht gekriimmt und leicht an verschiede-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Flexibacter ■ 149
nen Partikeln haftend oder miteinander verklebt. Manchmal bilden sich an den
Wanden der Kulturgefafie Gebilde, die Seeigeln ahneln. In alteren Kulturen
entstehen baumartig verzweigte Auslaufer. An toten Fischen oder am Rand
infizierter Wunden von Fischen entstehen typische Gebilde in der Gestalt von
Stabchen bis zu Verastelungen (Heureuter), die ein fur diese Art spezifisches
Merkmal darstellen. Diese Gebilde wurden friiher fiir Fniktifikationsgebilde
gehalten, weshalb der Organismus zu den Myxobacterales gestellt wurde.
Fortpflanzung durch Querteilung in zwei gleich grofie Tochterzellen. Vor der
endgiiltigen Teilung bilden die Tochterzellen oft eine «V»-formige Formation,
die fiir diese Art ebenfalls charakteristisch ist. Bewegung von der Umwelt
abhangig. In fliissigen Medien Bewegung nur bei niedriger Nahrstoffkonzentra-
tion. Auf Glas wird bei einer Temperatur von 20 °C eine Geschwindigkeit von
12-94 |j,m/min, durchschnittlich 60 |j,m, erreicht. Die Organismen bewegen sich
in Schwarmen.
Zellen gewohnliche 0,2 X 5,0-12,0 |J,m grofi; Faden sogar bis 163 |irn lang.
Kurzeste Zellen nur 2,0 |j,m lang. In Peptonhaltigen Medien 0,2-0,4 |j,m x
8,0 |j,m grofi. Auf Agar durchschnittlich 10,0 |J,m lang. Altere Kulturen
enthalten 12,0-20,0 |j,m lange Zellen.
Im Sufiwasser als Parasit lachsartiger Fische (Salmoniden) in oberflachlichen
Wunden von Binde- und Hautgeweben vorkommend.
Fig. 81. Flexibacter columnaris - a-h vegetative Zellen, i-k verzweigte Zellen, /-5
tiitenformige oder verschiedenartig gekriimmte Involutionsformen, (alles nach
demLeben, nach Garnjobst, 1945.- 2500 x), t Gestalt einer fadenformigen Zelle
nach Vitalfarbung mit Neutral-Rot (nach Garnjobst, 1945. - 2500X).
150 ■ Gleitende Bakterien - Flexibacter
5. Flexibacter aggregans (Lewin 1949) Leadbetter 1974
Microscilla aggregans Lewin 1969
Zellen in Form von flexiblen Stabchen, manchmal Faden bildend. Mit typischen
Anhaufungen. Zellmasse durch Karotinoide, von denen Zeaxanthin iiberwiegt,
gelb gefarbt. Streng aerob, chemoorganotroph, mit respirativem Metabolismus.
Sauerstoff als Elektronenakzeptor. Braucht keine Wachstumsfaktoren. Halo-
phil; fiir das Wachstum ist die halbe bis doppelte Salzkonzentration des Meer-
wassers erforderlich.
Zellen 0,5 |xm breit und bis 100 |xm lang.
Meeresorganismus.
Lewin (1969) beschrieb eine Varietat «catalatica», diesich von der typischen Art
dadurch unterscheidet, dafi sie fiir das Wachstum oreanischen Stickstoff braucht
und Katalase bildet. Weiter weist Lewin (1969) auf die auffallende Ubereinstim-
mung mit der Wuchsform von Flexithrix dorothae hin, die auf kohlenhydratrei-
chen Medien wachst.
6. Flexibacter polymorphus Lewin 1974
Flexible, zylindrische oder unter bestimmten Bedingungen selten lateral ver-
zweigte Faden. Lateralzweige kurz; vom Hauptfaden in einem Winkel von
120 ° abgehend. Faden mit abgerundeten Enden. Keine Geifieln. Zellsepten im
Phasenkontrast sichtbar. Morphologie stark von den Wachstumsbedingungen
abhangig. Unter bestimmten Kulturbedingungen bilden sich linksdrehende,
schraubenartig gekriimmte Faden; manchmal in der Fadenmitte Zellen, die
abgeflacht und bedeutend breiter sind als die normalen Zellen. Auf einigen
Medien entstehen kurze, hochaktive Zellgebilde, die der Gattung Cytophaga
ahnlich sind. Bei hoherem ph-Wert entstent in den Zellteilen an jedem Pol ein
stark lichtbrechendes Granulum, das wahrscheinlich aus Karbohydraten oder
Lipiden, jedoch nicht aus Poly-|3-Hydroxybuttersaure zusammengesetzt ist.
Die urspriinglich isolierten Kulturen waren weifi; bei Licht wachsende Kulturen
sind pfirsichorange gefarbt, durch das karotinoidahnliche Pigment Saproxan-
thin, das charakteristisch fiir die Gattung Saprospira ist.
Offenbar organotroph, anaerob, benotigen kein Licht zum Wachstum. Falls
Glukose die einzige Kohlenstoffquelle ist, werden weder Nitrate noch Ammo-
niumionen als Stickstoffquelle verwertet, sie benotigen jedoch Glutamat oder
Asparagin. Als Wachstumsfaktor ist Cobalamin erforderlich; Zellulose, Starke,
Agar, Algin und Gelatine werden nicht hydrolisiert. Zum Wachstum wird eine
Salinitat von 2,0-7,5% benotigt; pH-Wert im Bereich von 7,0-8,5; Temperatur-
optimum 32 °C.
Vermehrung durch Fadenfragmentierung. Bewegung durch Gleiten auf einer
Unterlage. Bei einer Temperatur von rund 20 °C betragt die Geschwindigkeit
2-8 (xm/sec, wobei der ganze Faden nach links rotiert. Die Fortbewegung ist
erfolgt entweder in einer Richtung oder sie andert sich plotzlich, wobei oft die
Richtung geandert wird. Faden 1,2 (xm breit und bis einige Hunderte von (xm
lang. Zellsepten voneinander 3,5 (xm entfernt, abgeflachte Zellen bis 5 (xm breit;
Fadenfragmente 10—40 (xm lang. Durchmesser der Granula in den Zellen 0,4—
0,8 nm.
Vorkommen vorlaufig nur aus dem Meer bekannt. Typenstamm aus der Faden-
masse von Beggiatoa alba auf faulenden Tunicaten in La Paz Baja (California,
Mexico) isoliert.
Morphologisch Beggiatoa leptomitiformis sehr ahnlich, besitzt und bildet aber
keine Schwefelkorner.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Flexibacter • 151
Art unsicherer taxonomischer Stellung:
7. Flexibacter giganteus Soriano 1945 (Fig. 77)
Organismus aus flexiblen Stabchen oder Faden bestehend. Zellmassen rosa
gefarbt, Karotinoide enthaltend.
Streng aerob, chemoorganotroph, mit respirativem Metabolismus. Als
Wachstumsfaktoren sind eine ganze Reihe von Aminosauren erforderlich.
Zellen 0,5 |xm breit und bis 50,0 fxm lang.
Siifiwasserart.
Reichenbach und Golecki (1975) beschreiben diesen Organismus als 0,75-
0,9 (xm breite und mehr als 100 (xm lange Faden mit stumpfen Enden. Der
Umstand, dafi er keine Scheide besitzt, als Pigment ein orangefarbenen Karoti-
noid enthalt, (zum Unterschied von den iibrigen Arten der Gattung Flexibacter),
fiihrt sie zu der Ansicht, dafi er mit Herpetosiphon aurantiacus identisch ist, von
dem er sich nur durch die Breite der Faden unterscheidet. Darum schlagen sie
vor, den Namen Herpetosiphon aurantiacus zu andern und ihn in H. giganteus
umzubenennen.
Fig. 76. Flexibacterflexilis - (nach Soriano, 1945. - 2500X). Fig. 77. Flexibacter
giganteus - (nach Soriano, 1945. - 2500 X). Fig. 78. Flexibacter elegans - (nach
Soriano, 1945. - 2500X). Fig. 79. Flexibacter aureus - (nach Soriano, 1954. -
2500X). Fig. 80. FlexiJ^ter albuminosus - (nach Soriano, 1945. - 2500X).
152 • Gleitende Bakterien - Flexibacter
Unsichere Arten:
8. Flexibacter elegans Soriano 1945 (Fig. 78)
Flexible Stabchen oder Faden. Zellmasse durch Karotinoide orange gefarbt.
Streng aerob. Metabolismus wahrscheinlich respirativ; Agar, Starke, Alginate
werden nicht hydrolysiert, jedoch wird Gelatine verfliissigt. Tolerant gegeniiber
Salzgehalt. Wachst auch auf Medien mit Meerwasser.
Zellen 50,0 |J,m lang.
Kommt im Siifiwasser vor.
Achenbach et al. (1974) beschreiben morphologische Umwandlungen von lan-
gen, nicht durch Septen geteilten Faden, die spater bis zu kurzen Stabchen
fragmentieren.
9. Flexibacter aurantiacus (Borg 1960) Lewin 1969
Cytophaga psychrophila Borg 1960
Flexible Stabchen oder Faden. Zellmasse gelb gefarbt, Karotinoide enthaltend.
Streng aerober Organismus mit respirativem Metabolismus. Zellulose wird nicht
hydrolysiert, jedoch Gelatine verfliissigt. Bildet Katalase.
Zellen 5,0-20,0 \im lang.
Siifiwasserart.
Ursprunglich zur Gattung Cytophaga gerechnet; von Lewin und Lounsbery (1960) umge-
stelft, da Zellulose nicht zersetzt wird. Diese Autoren sind auch der Meinung, dafi
Cytophaga aurantiaca ebenfalls zu dieser Art gestellt werden sollte. Lewin (1969) unter-
scheidet aufier der typischen noch zwei weitere Varietaten: «copepodarum», die im
Meerwasser vorkommt und «excathedrus», ein SiiSwasser- und Bodentyp, der keine Katalase
bildet. Lewin nimmt welter an, dafi der Organismus mit Sphaeromyxa xanthochlora
identisch oder verwandt sein konnte.
10. Flexibacter sancti Lewin 1969
Stabchen oder flexible Faden; Zellmassen durch Karotinoide gelb gefarbt. Streng
aerob; mit respirativem Metabolismus. Verfliissigt Gelatine und Karboxy-
methylzellulose; Agar und Alginate werden nicht gelost, Starke verschiedenartig
hydrolysiert. Bildet keine Katalase.
Zellen 5,0-50,0 urn lang.
Siifiwasserart.
Cytophaga johnsonae ziemlich ahnlich, zersetzt jedoch kein Chitin.
11. Flexibacter roseolus Lewin 1969
Flexible, stabchenformige Zellen. Zellmassen rot, Karotinoide enthaltend.
Streng aerober Organismus mit respirativem Metabolismus. Verfliissigt
Gelatine, bildet keine Katalase. Halotolerant, wachst auch auf Medien mit
Meerwasser.
Zellen 50 |j,m lang.
Siifiwasserart.
12. Flexibacter ruber (Fox et Lewin 1963) Lewin 1969
Flexibacter rubrum Fox et Lewin 1963
Flexible Stabchen bis Faden. Zellen mit Karotinoiden, in grofieren Mengen rot
gefarbt. Streng aerober Organismus mit respirativem Metabolismus.
Hydrolysiert Starke und verfliissigt Gelatine. Bildet keine Katalase. Wachst nicht auf
salzhaltigen Medien.
Zellen ca 50 |J,m lang.
Siifiwasserorganismus. In den heifien Quellen Kotlafjorden (Island) gefunden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Flexibacter - 153
13. Flexibacter litoralis (Fox et Lewin 1963) Lewin 1969
Microscilla litoralis Fox et Lewin 1963
Flexible Stabchen. Zellen mit rosafarbenen Pigment, das aus Karotinoiden
besteht. Streng aerober Organismus mit respirativem Metabolismus. Bildet viel
Schleim; verfliissigt Gelatine. Lost weder Karboxymethylzellulose, noch Starke,
Alienate oder Agar. Bildet keine Katalase.
Zellen 50 |j,m lang.
Kommt in Meer - oder Brackwasser vor. In der Laguna Salada (Mexiko)
gefunden.
Unsichere, ungeniigend beschriebene Arten:
Flexibacter aureus Soriano 1945 (Fig. 79)
Zellen in Form kurzer, feiner, angesichts ihrer Lange sehr wenig flexibler
Stabchen. Zellmassen goldgelb gefarbt.
Zellen 0,3-0,4 X 3,0-5,0 \im grofi.
Unzureichend beschrieben.
Flexibacter albuminosus Soriano 1945 (Fig. 80)
Zellen in Form verhaltnismafiig kurzer, feiner Stabchen; wenig flexibel.
Zellmasse milchweifi gefarbt.
Zellen 0,3-0,4 X 4,0-10,0 \un grofi.
Unzureichend beschrieben.
Flexibacter marinum (Pringsheim 1949) Fox et Lewin 1963 (Fig. 82)
Vitreoscilla marina Pringsheim 1949, Microscilla marina (Pringsheim 1949)
Pringsheim 1951.
Farblose Trichome ohne sichtbare Segmentierung. Zellmasse durch Karotinoide
orange gefarbt. Streng aerobe Art mit respirativem Metabolismus. Verwertet
weder Karboxymethylzellulose, noch Starke, Agar oder Alginat. Verfliissigt
Gelatine. Halophil, braucht fur das Wachstum die im Meerwasser enthaltenen
Salze. Aktive Gleitbewegung ohne Rotation; die Faden biegen und wellen sich.
Oft ist die Bewegung so schnell, dafi sie sich zeichnerisch nicht erfassen lafit.
Faden 50 |j,m lang.
Aus Kulturen mit Diatomeen bekannt, die in der Nahe von Brighton (England)
isoliert wurden. Wenig untersucht, da die Kultur nicht erhalten werden konnte.
Bisher nicht wieder beobachtet.
82 83
Fig. 82. Flexibacter marinum - (nach Pringsheim, 1951. - 1000X). Fig. 83.
Microscilla agilis - Darstellung einer typischen Trichombewegung um eine
Detritpartikelherum, mit dem die Trichome wahrend der Bewegung verbunden
bleiben (nach Pringsheim, 1951. - 500x).
154 ■ Gleitende Bakterien - Herpetosiphon
Ungeniigend beschriebene Gattungen unsicherer taxonomischer Stellung,
die aber wahrscheinlich zur Gattung Flexibacter gehoren:
Microscilla agilis Pringsheim 1951 (Fig. 83)
Dunne, farblose Faden, die auch in gefarbten Praparaten keine sichtbare Seg-
mentierung aufweisen. Der ganzen Lange nach an einer Unterlage befestigt; kein
freies Ende; Rotation fehlt. Gramnegativ. Bewegung durch auffallendes Gleiten,
das durch Biegung der Zellen (ahnlich wie bei Spirochaeta plicatilis) hervorgeru-
fen wird.
Faden 0,6-0,8 urn breit und 12,0-70,0 um lang.
Im Siillwasser mit faulenden Pflanzenresten vorkommend.
Im Wasser von Straftengraben in Coldham/Common bei Cambridge (England)
gefunden. Auf faulenden Resten von Cladophora chlorohydra vorhanden. 1st
Microscilla marina sehr ahnlich. Bisher nicht in Reinkultur geziichtet.
Microscilla flagellum (Pringsheim 1949) Pringsheim 1951
Vitreoscilla flagellum Pringsheim 1949
Feine Trichome, mit einem Ende festsitzend. Das freie Ende bewegt sich ahnlich
wie eine Flagellatengeillel; der ganze Organismus bewegt sich gleitend, wobei er
seine Gestalt sowie die Richtung der Bewegung andert. Gramnegativ.
Trichome nur 0,3-0,4 \xm breit; verschieden lang. Die kiirzeren nicht linger als
10 [im. Lange Trichome sind so gekrummt, dafi es nicht moglich ist, sie zu
messen, sind jedoch sicherlich langer als 100 (im.
Kommt im Siillwasser auf Algen vor, wo sie manchmal die Faden von Oscillato-
ria, Phormidium, Anabaena vollig umschlingen. Lange Trichome sind oft
zwischen den Faden von Myxophyceen in ruhigen Gewassern vorhanden.
Nicht in Reinkultur geziichtet.
Promyxobacterium flavum Imseneckij et Solnceva 1936
Flexible Zellen, stabchenformig; Enden stumpf oder zugespitzt, was von der
Emahrungsweise und dem Alter der Kultur abhangt. Manchmal Faden bil-
dend.
Bisher wenig bekannter Organismus mit unklarer Eingliederung. Nicht in
Reinkultur geziichtet.
Promyxobacterium lanceolatum Imseneckij et Solnceva 1936
Ursprunglich fiir eine Bakterie ohne Sporenbildung, spater fiir eine Myxobakte-
rie gehalten. Wenig bekannter Organismus unklarer Eingliederung.
3. Herpetosiphon Holt et Lewin 1968, emend. Lewin
et Leadbetter 1974
Faden mehrzellig, unverzweigt. Sie erreichen praktisch eine unendliche Lange.
An den Fadenenden oder in der Mine des Fadens, wo sein Zusammenhang
unterbrochen ist, mit einer hyalinen Scheide, die nur im Phasenkontrast sichtbar
ist. Manchmal auch als selbstandige Zellen in der Form von Stabchen
vorkommend. Ohne Geifieln. Ruhestadien nicht bekannt. Gramnegativ. Zellmasse
durch Vorhandensein verschiedener Karotinoide gelb bis orange gefarbt.
Emahrungsweise chemoorganotroph, Metabolismus gewohnlich respiratiy,
Wasserstoff dient als Endakzeptor von Elektronen. Streng aerob. Obwohl die
Art nicht photosynthetisch ist, tritt sie dort auf, wo geloste Stoffe in sehr
niedrigen Konzentrationen vorhanden sind. Es kann angenommen werden, dafi
Stoffe verwertet werden, die extrazellular von in unmittelbarer Nahe wachsen-
den Blaualgen erzeugt werden. Es ist nicht bekannt, ob Agar, Alginate und
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Herpetosiphon • 155
Chitin zersetzt werden. Zellulose wird von manchen Arten zersetzt, Karboxy-
methylzellulose depolymerisiert und Starke hydrolysiert; Gelatine wird verfliis-
sigt. Meeresarten brauchen fiir ihr Wachstum Salze aus Meerwasser. Individuen
ohne Scheide bewegen sich auf fester Grundlage durch charakteristisches
Gleiten. Faden 0,7-1,5 (im breit, Lange variable, von 5,0 (im bis 150 (im, kann aber
auch grofier sein. Im Sufiwasser und Meerwasser, sowie im Boden
vorkommend.
Kann nach Lewin (1969) als apochlorotische Parallele der Blaualge Lyngbya
betrachtet werden. Mit Riicksicht darauf, dafi Reichenbach und Golecki (1975)
zu dieser Gattung auch Vitreoscilla proteolytica stellen, definieren sie diese
Gattung neu: Organismus Faden verschiedener Lange bestehend gewohnlich
500 (im lang 0,5-1,5 (im breit, aus einzelnen Zellen bestehend. Im Inneren der
Faden bilden sich Nekridien; an diesen Stellen kommt es zur Fragmentierung der
Faden. Bewegung durch Gleiten, eine schleimige Spur hinterlassen. Kolonien
deutlich rot.
Typus generis: Herpetosiphon aurantiacus Holt et Lewin 1968
Wichtigste Literatur: Copeland 1936, Holt und Lewin 1968, Lewin 1969,1970,
Bergey's Manual 1974, Reichenbach und Golecki 1975.
Bestimmungsschlussel der Arten
la Zellulose wird nicht zersetzt l.H. aurantiacus
lb Zellulose wird zersetzt, thermotolerant (60-80 °C) 2. H. geysericola
1. Herpetosiphon aurantiacus Holt et Lewin 1968
Unverzweigte, flexible Faden, die eine Scheide besitzen und eine bedeutende
Lange erreichen, aus prokaryotischen, zylindrischen Zellen bestehend.
Gramnegativ. Protoplasma ohne Granula und ohne Schwefeltropfchen. Enthalt oran-
gefarbenes Pigment, das aus Karotinoiden besteht. Scheide weder mit Eisen-
noch mit Manganverbindungen impragniert.
Streng aerob, chemoorganotroph. Hydrolysiert Zellulose, Starke jedoch nicht.
Fiir das Wachstum sind komplexe Medien erforderlich. Bildet auf Agar flache,
ausgedehnte Kolonien mit scheinbar spiraliger Struktur. Fortpflanzung durch
Teilung, durch Bildung neuer Quersepten.
Faden bewegen sich gleitend auf fester Grundlage. Sie scheinen sich auch mit der
Scheide zu bewegen. Innerhalb der Scheide sind die Faden nicht beweglich.
Zellen 1,0-1,5 X 5,0-10,0 \m\ grofi, Faden bis 500 (im lang oder noch langer.
Aus Brunnenwasser, Kuhmist, Thermalquellen sowie von Meereskusten iso-
liert. Ursprunglich in schleimigen Uberziigen von Chara in Birch Lake bei
Minneapolis (Minesota, USA) gefunden.
Erinnert stark an Blaualgen der Gattung Lyngbya. Von Lewin (1969) fiir einen
Bodenorganismus gehalten.
Reichenbach und Golecki (1975) sehen keine Unterschiede zwischen diesem
Organismus und Flexibacter giganteus; sie stellen ihn in eine Art unter der
Bezeichnung H. giganteus. Sie sind auch der Meinung, dafi mit ihm Vitreoscilla
proteolytica identisch ist.
2. Herpetosiphon geysericola (Copeland 1936) Lewin 1969
(non Herpetosiphon geysericolus (Copeland 1936) Lewin 1969),
Phormidium geysericola Copeland 1936
Faden lang, nicht verzweigt, flexibel mit hyaliner Scheide, die in eine schleimar-
tige Matrix ubergeht. Scheidewande schlecht sichtbar, undeutlich. Zellen abge-
rundet. An den Fadenenden weder gekrummt noch verbreitert. Faden meistens
156 ■ Gleitende Bakterien - Flexithrix - Saprosp^
gerade, parallel angeordnet, weder gekriimmt, noch an den Scheidewanden
eingeschnurt. Sie bilden dichte, 10 cm und sogar noch breitere, stellenweise bis
5 mm dicke Uberziige, die an Felsen von Thermalquellen festsitzen. Faden
parallel zur Felsenoberflache angeordnet. In Kulturen behalten die Faden die
gleichen Eigenschaften. Protoplasma homogen, ohne Inklusionen. Zellmassen
durch Karotinoide, von denen das Spirilloxanthin iiberwiegt, pfirsichfarben.
Chemoorganotroph, streng aerob. Zersetzt Zellulose, depolymerisiert Karbo-
xymethylzellulose und hydrolysiert Starke. Einfache Kohlen- und Stickstoff-
quellen sind fiir das Wachstum nicht ausreichend. L-Lysin scheint das Wachs-
tum zu stimulieren. Der Organismus ist fahig, Bakterienzellen der Gattung
Aerobacter zu lysieren. Thermotolerant oder thermophil.
Faden 0,5-10-150 (im lang oder noch linger.
Von orangefarbenen Fadenbuscheln aus Thermalquellen in Guadalupe Canyon
(Baja California, Mexiko) isoliert. Urspriinglich auf Phormidium in den
Thermalquellen im Yellowstone Park (USA) beschrieben.
Ausgesprochene Meeresarten: H. cohaerens, H. persicus, H. nigricans. Die
Beschreibungen werden hier nicht angefuhrt.
4. Flexithrix Lewin 1969
Faden mit unechter dichotomer Verzweigung, meist in Scheiden eingeschlossen.
Faden mehrzellig und verhaltnismafiig lang. Ruhestadien nicht bekannt. Gram-
negativ. Zellmasse durch Karotionoide, unter denen Zeaxanthin iiberwiegt, gelb
getarbt. Streng aerob, chemoorganotroph, mit respirativem Metabolismus. Fiir
das Wachstum ist Meerwasser mit einer 0,5-2,0-f achen Salzkonzentration erfor-
derlich. Zellen ohne Scheide, beweglich.
Einzelne Zellen 0,3-0,5 X 5,0-15,0 (im grofi; Faden mit Scheide 0,5 (im breit
und bis 500 (im oder noch langer.
Meeresorganismus.
Nach Lewin (1969) soil der Organismus seine typische Struktur nur in Medien mit geringem
Kohlenhydrat-Gehalt (0,01%) beibehalten. Bei hoheren Konzentrationen kann er in flussi-
gen Medien in Form selbstandiger Zellen ohne Scheide wachsen, die in Bezug auf Pigmentie-
rung und Ernahrungserfordernissen nicht von Flexibacter aggregans zu unterscheiden sind.
Die taxonomische Einordnung ist daher nicht ganz geklart. Die Merkmale vereinigen
sowohl die der fadenartigen als auch der gleitenden Bakterien.
Wichtigste Literatur: Lewin 1969, Lewin 1970.
Eine einzige Art:
Flexithrix dorothae Lewin 1969.
Mit den Merkmalen der Gattung.
5. Saprospira Gross 1911, emend. Lewin 1962
Faden vielzellig, lang, flexibel, nicht verzweigt und schraubenformig gestaltet;
Windungen verhaltnismafiig niedrig. Immer ohne Scheide, auch ohne Geifieln
oder axialen Faden. Sporen werden nicht gebildet, obwohl Gross (1911) Sporen-
bildung annahm, was wahrscheinlich auf Verwechslung von Sporen mit degene-
rierten Zellen, die gewohnlich kugelig sind zuruckzufuhren ist. Unter ungiinsti-
gen Bedingungen zerfallen die Faden in einzelne Fragmente, wobei es zu ihrer
Autolyse kommt. Ruhestadien nicht bekannt. Gramnegativ. Protoplasma auf
gefarbten Praparaten quer gestreift, was eine konstante, von der Art der
Preparation unabhangige Eigenschaft ist. Ohne photoassimilierende Pigmente.
Zellmasse jedoch durch Karotinoide gefarbt. Zellen ohne deutliche Zellwand. Bei
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Saprospira • 157
Autolyse lassen sich mit dem Elektronenmikroskop besondere Korperchen
(Rapidosomen) beobachten, von denen Graf (1961) annimmt, dafi es Uberreste
spezieller Bewegungsorganellen sind.
Chemoorganotroph; streng aerob, mit respirativem Metabolismus. Molekularer
Sauerstoff dient immer als Endakzeptor von Elektronen. Ziemlich hohe Ernah-
rungsanspruche, da eine ganze Reihe von essentiellen Stoffen benotigt wird. Die
Mehrzahl der Stamme vertragt keinen erhohten Salzgehalt nur wenige benotigen
ihn. Wachstum auf Agarboden (1%) diffus, oberflachlich; die Kolonien haben
ein charakteristisches Aussehen: ihre Ran der bilden lappenformige oder gefaser-
te Auslaufer. Vermehrung durch unregelmafiige Fragmentation, Querteilung.
Bewegung durch typischesGleiten, mit einerGeschwindigkeitvon 2,0-3,0(im/s
bei 25 °C. Wahrend der Bewegung biegt sich der Faden ahnlich wie bei
Beggiatoa oder Oscillatoria und rotiert zugleich um die Langsachse.
Faden gewohnlich 0,8-1,5 (im breit und 10-500 (im lang. Auch innerhalb eines
Stammes (einer Kolonie) gibt es Individuen von verschiedener Lange.
In faulendem organischem Material im Sufi- und Salzwasser vorkommend.
Bergey's Manual (1957) stellt diese Gattung zur Familie Spirochaetacae, Lewin (1962)
hingegen in die selbstandige Familie Saprospiraceae, wobei er in diese Gattung auch
Achroonema spiroideum unter den Namen Saprospira spiroidea (Skuja 1948) Lewin 1962
einreiht. Lewin (1965) ist der Ansicht, dafi auch Spirulina albida und Spirochaeta plicatilis
hierher gestellt werden miifiten. Ihm zufolge handelt es sich um nicht photosynthetische
Formen der Blaualgengattung Spirulina. Lewin (1969) stellte fest, dafi in Kulturen manche
Formen ihre Schraubenform verlieren und sodann der Beschreibung der Gattung Flexithrix
entsprechen.
Typus generis: Saprospira grandis Gross 1911
Wichtigste Literatur: Gross 1911, Dimitroff 1926, Soriano 1945, Soriano und
Lewin 1945, 1965, Bergey's Manual 1957, 1974, Lewin 1962, 1963, 1965, 1969,
1972, Stewart 1963, Lewin und Mandel 1970.
Bestimmungsschlussel der Arten
la NurimSiifiwasservorkommend;Zellmasserosapigmentiert 2
lb Sowohl imSiifi- als auch im Meerwasser vorkommend 3
2a Starke wird hydrolysiert. Faden bis 150 (manchmal bis 500) (im, Windungen
7,0-17,0 (im lang 2. S. thermalis
2b Starke wird nicht hydrolysiert. Faden maximal 50 (im, Windungen 3,0-
9,0 (im lang 3. S. albida
3 a Faden mit deutlich abgerundeten oder stumpfen Enden 4
3b Faden mit deutlich zugespitzten Enden 7
4a Faden lang. Starke wird nicht hydrolysiert 5
4b Faden kurz, bis 36 (im, Windungen 2,0-3,0 (imlang 5. S. nana
5a Zellen mit orangefarbenem Pigment. Bewegung schnell. Faden durch-
schnittlich 100 (im, Windungen4,0-9,0 (imlang 1. S. grandis
5b Zellen mit gelbemPigment. Faden 50-150 (imlang 6
6a Streng halophil; praktisch unbeweglich. Windungen 4,0-9,0 (im lang; Fa-
denenden abgerundet 4. S. toviformis
6b Bewegung energisch. Windungen 3,0—4,0 (im lang. An den Fadenenden
entwickeln sich spharische Gebilde 6. S. flammula
7a Regelmafiige Schraubenbahn, gewohnlich mit 3 Windungen. Chromatinma-
terial in Transversalstreifen-und blocken, aber auch in den Fadenspitzen . . .
7. S. punctum
7b Unregelmafiige Schraubenbahn, gewohnlich mit 6 Windungen. Chromatin-
material nur in breiten Streifen , 8. S. lepta
158 • Gleitende Bakterien - Saprospira
1. Saprospira grandis Gross 1911 (Fig. 84)
Lange, mehrzellige, schraubenformige Organismen, die der ganzen Lange nach
eine konstante Breite haben; Lange sehr variabel. An den Enden abgerundet und
stumpf. Bei jedem einzelnen Individuum sind die Windungen mehr oder weniger
regelmafiig und gleich lang, bei verschiedenen Individuen - auch in der gleichen
Kultur - jedoch verschieden lang. Die in der Literatur angefuhrte grofte Variabi-
litat in der Lange und Breite der Windungen ist wahrscheinlich durch die
Fixierungs- und Farbungsweise der Praparate gegeben; Windungen rechtslaufig.
Gewohnlich besitzt ein Individuum 3-5 Windungen, hochstens jedoch 13.
Manchmal sind die Zellen auch gerade gestreckt. Nach Lewin (1962) sind diese
Organismen vielzellig, was man nur an absterbenden Kulturen beobachtet kann.
Protoplasma ohne axiale Fasern. In grofieren Zellmengen (Kulturen) durch
Karotinoide, unter denen Saproxanthin vorherrscht, rosa-orangefarben. Einzel-
ne Zellen ohne deutliche Zellwand, die in nativen Praparaten als ein schattenarti-
ger Saum rund um die Zelle erscheint. An gefarbten Praparaten kann man eine
Struktur in Form von Querstreifen beobachten. Dieser Charakter bleibt auch bei
verschiedener Preparation gleich. Chromatin in schmalen, quer orientierten,
Fig. 84. Saprospira grandis - kammerartige Struktur der Faden an gefarbten
Praparaten. Die verschiedenen Groften der Schraubenwindungen sind durch die
verschiedene Art der Praparation und Farbung des Materials verursacht (nach
Dimitroff, 1926. - 700x). Fig. 85. Saprospira albida - (nach Dobell, 1912. -
700 X) a-b normales Aussehen des schraubenformigen Organismus, c
Individuum vor dem Zerfall in kurze Segmente, d Individuumjn Segmente zerfallend, e
Kurze Individuen. ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Saprospira • 159
gleichmafiig voneinander entfernten Streifen. Am Scheitel der Faden fand Gross
(1911) stark farbbare Stellen, die als Polkappen bezeichnet wurden. Diese
bestehen ebenfalls aus Chromatinmaterial.
Streng aerober, chemoorganotropher Organismus. Braucht fur das Wachstum
keine Vitamine. Eine Reihe von Aminosauren, sowie einige nicht bestimmte
Komponenten des Hydrolysates von Nukleinsauren der Hefen sind essentielle
Wuchsstoffe. Es ist wahrscheinlich, dafi an natiirlichen Standorten Aminosauren
aufgenommen werden, die in extrazellularen Metabolaten anderer Organismen
entnalten sind. Es wird angenommen, dafi fur das Wachstum freie Aminosauren
im Wasser nicht geniigen wurden, da ihre Konzentration bedeutend niedriger als
erforderlich ist. Auf Agarboden werden Kolonien anderer Organismen angegrif-
fen und lysiert. Halophil, benotigt Meerwasser. Manche Formen sind halotole-
rant; sie vertragen einen Salzgehalt, der das 0,5-2,0-fache des Salzgehaltes des
Meerwassers betragt. Manche Stamme wachsen auch auf salzlosen Medien.
Lewin (1962) fand in Kulturen, dafi viele Stamme ihre schraubenformige Gestalt
verlieren und sie nicht erneut wiedergewinnen. Darin sind sie mit Flexibacter
identisch. Junge Kulturen in fliissigen Medien bilden eine seidige Triibung.
Kulturen auf Agar bilden reichlich Schleim. Vermehrung durch Querteilung.
Organismen durch Rotation um ihre Langsachse beweglich; langere Faden
konnen sich auch biegen.
Durchschnittlich 100 |xm lang; ein Teil iiberschreitet jedoch diese Lange
bedeutend, bis zu 500 |xm. Gewohnlich 0,8-1,2 |irn breit. Die Lange der Windung
schwankt zwischen 4,0 und 9,0 |xm, am haufigsten um 6,0-6,5 \im. Die Breite
der Windung bleibt in der Regel konstant bei 2,0 |xm. Einzelne Zellen 1,0-
1,5 |xm lang.
Eine gewohnlich iibersehene Bakterie der Meereskiiste, wo sie oft im Sand, der
durch organische Stoffe verunreinigt ist, oder in Blaualgenklumpen vorkommt.
Urspriinglich aus dem Verdauungstrakt von Austern isoliert. Es ist nicht ausge-
schlossen, daft sie auch im Sufi wasser vorkommt, worauf Kulturexperimente auf
salzlosen Medien hindeuten. Morphologisch Saprospira toviformis sehr ahnlich.
2. Saprospira thermalis Lewin 1965 (Fig. 86)
Faden mehrzellig, schraubenformig, flexibel, mit stumpfen Enden. Gramnega-
tiv. Zellmasse durch Karotinoide, unter denen Ketokarotinoide und Xantophyll
iiberwiegen, rosa gefarbt; Intensitat der Farbung von Nahrungsbedingungen,
besonders von essentiellen Nahrstoffen, sowie von der Lichtintensitat ab-
hangig.
Streng aerob, chemoorganotroph. Von Polysacchariden wird Starke und Agar
zersetzt, jedoch nicht Zellulose. Scheidet extrazellular proteolytische Enzyme
aus, durch die Kolonien saprophytischer Organismen zersetzt werden, wobei
ahnlich wie bei den Myxobacterales, essentielle Stoffe gewonnen werden
konnen. Als Kohlenstoffquelle wird eine Reihe von Sacchariden verwertet. Fur das
Wachstum ist eine Reihe essentieller Aminosauren erforderlich. Auf Medien
ohne 1-Cystein entsteht ein Geruch, der an den des Pilzes Phallus impudicus
erinnert.
Obwohl der Organismus aus heiften Quellen isoliert wurde, betragt die Maxi-
maltemperatur im Laboratorium 35-37 °C. Eine 10 Minuten lang einwirkende
hohere Temperatur vernichtet bereits alle Zellen. Bei hoheren Temperaturen
zerfalien die Organismen in einzelne Zellen, offensichtlich durch Zersetzung der
Stoffe, aus denen die Scheidewande bestehen. Erhohter Salzgehalt wird nicht
vertragen. Schon 25% Salz im Meerwasser unterdriickt das Wachstum. Bildet
auf speziellem, festem, essentielle Stoffe enthaltendem Nahrboden ziemlich
schleimige, rosafarb^^Kolonien mit unregelmafiigem, zerfranstem Rand. In
160 • Gleitende Bakterien - Saprospira
fliissigen Nahrlosungen scheiden alte Kolonien eine Menge von extrazellularem
Schleim aus, wodurch das Medium ziemlich viskos wird. Junge Kulturen bilden
in fliissigen Medien eine seidige Triibung.
Faden 1,0 X 10-150 urn grofi, einzelne Zellen 2,0-5,0 urn lang. Windungen lm
Durchschnitt 1,5-2,5 urn breit und 7,0-17,0 ^m lang.
Ausgesprochener Suflwasserorganismus. Urspriinglich aus der Thermalquelle
Kotlajoktur (Island) und dem Aquadukt bei Costa Rica (Mexiko) isoliert.
Lewin (1965) vermutet, dafi es sich bei dem von Lauterborn (1916) als Pelonema
spirale beschriebenen Organismus de facto urn tote Faden dieser Art handelt.
Fig. 86. Saprospira thermalis - (nach Mikrophotographie umgezeichnet -
Lewin, 1965. - 1600X), a normales Aussehen des Organismus, b Zerfall des
Organismus in kurze Segmente. Fig. 87. Saprospira toviformis - (nach
Mikrophotographie umgezeichnet - Lewin und Mandel, 1970. - 1600X). Fig. 88.
Saprospira flammula - (nach Mikrophotographie umgezeichnet- Lewin, 1965. -
1600X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Saprospira • 161
3. Saprospira albida (Kolkwitz 1909) Lewin 1962 (Fig. 85)
Spirulina albida Kolkwitz 1909,SaprospiraflexuosaDobeW 1912(nonSaprospira
flexilis DobeW 1912)
Grofkenteils kurze, schraubenformige Faden mit 4-16, meistens jedoch 8
Windungen. Scheide fast unsichtbar. Durch Zentrifugation konzentrierte Zellsu-
spension infolge enthaltener Karotinoide hellrosa gefarbt. Physiologische Eigen-
schaften wenig bekannt. Vermutlich ein aerober, chemoorganotropher
Organismus. Lost Agar und Alginate nicht auf, verflussigt Gelatine. Braucht nur eine
schwache Nahrstoffkonzentration; hohere Konzentration organischer Stoffe
hemmt das Wachstum. Eine Reihe essentieller Aminosauren fiir das Wachstum
ist erforderlich. Bildet in fliissigen Medien eine weifie Triibung. Kultur recht
kompliziert. Bewegung langsam und schraubenartig. Manche Faden biegsam,
insbesondere die langeren.
Zellen 0,7-1,0 X 2,0-3,0 |xm grofi; Faden 10-50 |xm lang, manchmal noch
langer; Windungen 1,5-2,0 |im breit und 3,0-9,0 |xm lang.
In verunreinigtem oder schlammhaltigem Wasser, oft in grofien Mengen auch im
Belebtschlamm biologischer Klaranlagen.
Nach Lewin (1962) gehort dieser Organismus in die Gattung Saprospira. Die Einordnung
bei der Gattung Spirulina wird fiir unrichtie gehalten. Von Dyar (1947) falschlich unter der
Bezeichnung Spirochaeta plicatilis beschrieben. Erfordert weitere Untersuchungen.
4. Saprospira toviformis Lewin et Mandel 1970 (Fig. 87)
Kommt Saprospira grandis morphologisch sehr nahe. Lange, mehrzellige,
schraubenformig gestaltete Organismen. Windungen meistens rechtsgewunden,
manche Individuen auch linksgewunden. Gramnegativ.
Zellmasse durch Karotinoide, unter denen ein dem Saproxanthin ahnliches
Karotinoid uberwiegt, satt gelb bis orange gefarbt.
Streng aerob, chemoorganotroph; hydrolysiert im Gegensatz zu Saprospira
grandis Karboxymethylzellulose. Braucht eine Reihe von Aminosauren als
Wuchsstoffe, benotigt jedoch die im Hydrolysat von Hefenukleinsaure enthalte-
nen Faktoren nicht. Halophil, erfordert eine Salzkonzentration, die der
Konzentration im Meerwasser gleicht oder doppelt so hoch ist. Schon eine Senkung
des Salzgehaltes um 50% bringt das Wachstum zum Stillstand.
In fliissigen Kulturen in Biischeln wachsend, die leicht sedimentieren.
Supernatant klar, gelb gefarbt. Kolonien auf Agar wenig schleimig.
Bewegung sehr trage, lethargisch; erscheint unbeweglich.
Zellen 0,8 X 1,0-2,5 |xm grofi, Faden 10-500 [i lang. Windungen 1,5 |xm breit
und 4,0-9,0 |xm hoch.
Obligater Meeresorganismus; im Sand an der Kiiste von Neuseeland gefunden.
Unsichere Arten:
5. Saprospira nana Gross 1911
Schraubenformige, verhaltnismafiig kurze Organismen, mit hochstens 16
Windungen. Sporenbildung nicht beobachtet.
Erwachsene Individuen im Durchschnitt nur 36 |xm, Windungen 2,2-3,0 |xm
lang. In verunreinigtem Meerwasser; urspriinglich in foraminophorem Sand
gefunden. Moglicherweise auch in verunreinigtem Sufiwasser vorhanden.
6. Saprospira flammula Lewin 1965 (Fig. 88)
Faden lang, diinn, schraubenformig, aus einigen Zellen bestehend, farblos. Mit
sehr schwacher Neigung zur Fragmentation. Auf den Faden entstehen, meist
162 • Gleitende Bakterien - Saprospira
terminal und nur ausnahmsweise interkalar, verdickte spharische Gebilde. Zell-
masse goldgelb gefarbt. Wahrscheinlich aerober, chemoorganotropher Organis-
mus; Asparagin und eine Reihe weiterer Stoffe sind fur das Wachstum erforder-
lich. Halophil, benotigt 3 g/1 NaCl, kann jedoch auch ohne Salze wachsen.
Wahrscheinlich thermophil.
Einzelne Zellen 1,0 x 2,0-3,0 urn grofi. Faden 10-500 urn lang. Windungen
1,5 nm breit und 3,0-4,0 nm lang.
Sowohl im Sufi- und Salzwasser als auch im Boden vorkommend. Urspriinglich
aus derThermalquelle Orakei Korako (Neuseeland) isoliert. Bisher nur aus dem
Gebiet von Australien bekannt.
Weitere Untersuchungen sind dringend notig.
7. Saprospira punctum Dimitroff 1926 (Fig. 89)
(non Saprospira puncta Dimitroff 1926)
Morphologisch Saprospira grandis ziemlich ahnlich. Faden sehr lang, gleichma-
fiig breit, nur mit scharf zugespitzten Enden. Bei manchen Individuen
Windungen der Schraubenbahn regelmafiig, breit angeordnet. Gewohnlich 3, manchmal
jedoch auch 2,5-6 Windungen. Bei anderen Individuen sind nur Teile des Fadens
schraubenformig gebaut, wahrend der Rest gerade ist. Nicht schraubenformige
c d
90
Fig. 89. Saprospira punctum - nach gefarbten Praparaten (nach Dimitroff, 1926.
- 800X). Fig. 90. Saprospira lepta - nach gefarbten Praparaten (nach Dimitroff,
1926. - 2000X), a-b normale Zellform, c-d Zellform^die als var.A beschrieben
wurde. ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sporocytophaga • 163
Faden sind S- oder C-formig gekriimmt. Terminalteile der Faden immer gerade.
Chromatin als dunkler gefarbte Stellen unregelmafiig im Faden verteilt und als
schmale transversale Streifen oder breite Blocke abgesondert. Abstande zwi-
schen diesen Streifen ziemlich grofi. Chromatin auch in den Fadenenden, denen
es das Aussehen einer Lanzettspitze verleiht. Wo das Chromatin im Faden breite
Blocke bildet, ist die Zellwand eingeschniirt. Obwohl der eigentliche Fortpflan-
zungsprozefi nicht beobachtet wurde, kann man nach gefarbten Praparaten auf
Vermehrung durch Querteilung schliefien. Bewegungsweise nicht beobachtet.
Faden 0,9-1,2 |xm breit, 60-100 |xm lang; am haufigsten kommen ca 80 |xm lange
Individuen vor. Windungen 4,0-8,0 |xm lang.
In Austern vorkommend, oft recht haufig.
Morphologisch Spirochaeta tapetos und Spirochaeta ostrae recht ahnlich. In
Bergey's Manual (1974) wird die Ansicht geaufiert, dafi dieser Organismus zu
den Spirochaten gehort.
8. Saprospira lepta Dimitroff 1926 (Fig. 90)
Morphologie nur nach fixierten und gefarbten Praparaten bekannt; Faden von
charakteristischer Gestalt. Windungen der Schraubenbahn sehr unregelmafiig,
gewohnlich 6 an einem Faden (3,5-10), Fadenenden zu spitzen Polen verjiingt;
manche Individuen ausnahmsweise mit weniger zugespitzten Enden oder mit
einem spitzen und einem stumpf verjiingten Ende. Gewohnlich zu unregelmafii-
gen Gebilden zusammengerollt; oft biegt sich ein Ende um und bildet auf diese
Weise eine Schlinge, wahrend der Rest gerade ist. Chromatin in breiten Quer-
streifen, die durch helle, nicht farbbare schmale Streifen getrennt ist. Nichtge-
farbte Fadensegmente an der Pheripherie des Fadens leicht ausgebaucht. Fort-
pflanzune nicht beobachtet; wahrscheinlich durch Querteilung.
Bewegungsweise ebenfalls unbekannt.
Faden 0,5 |xm breit und 54—92 |xm lang, meistens jedoch 70 |xm. Windungen
5,0-13,0 |xm, meistens 8,0 |xm lang, 1,6-2,8 |xm breit.
In Austern bei Baltimore (Maryland, USA) gefunden.
Dimitroff (1926) beschrieb eine weitere Varietat «A», die sich durch die Gestalt
des Fadenendes sowie die Breite und Anzahl der Windungen unterscheidet.
Bergey's Manual (1974) ist der Ansicht, dass die Organismen zu den Spirochaten
gehoren.
Art unsicherer taxonomischer Stellung:
Saprospira gigantea (Warming 1875) Soriano et Lewin 1965
Spirochaeta gigantea Warming 1875, Spirillum giganteaum (Warming 1875)
Trevisan 1889 (non Spirillum giganteum Migula 1900), Spirillum No. 4 Kutscher
1895.
Grofier, flexibler, schraubenartiger Organismus mit scharf eingeschnittenen
Enden. Besitzt eine grofie Anzahl von Windungen; das grofite beobachtete
Exemplar hatte 16 Windungen. Protoplasma fein gekornt, ohne Granula.
Faden ca. 3 |im dick und bis 300 |xm lang. Windungen 7,0-9,0 [un breit und ca
25,0 |xm lang.
Sehr unzureichend beschrieben.
6. Sporocytophaga Stanier 1940
Flexible, stabchenformige, stets selbstandige Zellen, mit abgerundeten Enden.
In alteren Kulturen konnen sowohl die Bildung von Spharoplasten als auch
durch Lyse zerstor^^ellen beobachtet werden. Unter den vegetativen Zellen
164 • Gleitende Bakterien - Sporocytophaga
kbnnen Ruhestadien in Form kugeligen bis ellipsoidischer Mikrozysten gefun-
den werden, die sich aber nur dann bilden, wenn Glukose oder Zellulose als
Kohlenstoif- und Energiequelle vorhanden sind. Gramnegativ. Ernahrung che-
moorganotroph. Strene aerob. Metabolismus entweder respirativ (molekularer
Sauerstoff dient als Endakzeptot von Elektronen) oder fermentativ. Als Kohlen-
stoff- und Energiequelle kann eine Reihe von Sacchariden, Zellulose und Starke
verwertet werden. Es ist nicht bekannt, ob auch Agar oder Chitin verwertet
werden kann. Aminosauren, Pepton, Hefeextrakt dienen nicht als Kohlenstoff-
quelle. Organische Wachstumsfaktoren werden nicht benotigt. Vegetative Zel-
len bewegen sich in gleicher Weise wie die Vertreter der Gattung Cytophaga.
Zellen gewohnlich 0,3-0,5 X 5,0-8,0 \im grofi.
Aus Kulturen dieser Organismen wurden einige Arten von begleitenden Mi-
kroorganismen isoliert. Es wurde bewiesen, dafi gemischte Kulturen Zellulose
effektiver zersetzen konnen. Eingehend wurde nur die Art Sporocytophaga
myxococcoides untersucht.
Typus generis: Sporocytophaga myxococcoides (Krzemieniewska 1933) Stanier
1940
Wichtigste Literatur: Hutchinson und Clayton 1919, Vinogradskij 1929, Bo-
kor 1930, Krzemieniewska 1930,1933, Imseneckij und Solnceva 1936, Stapp und
Bortels 1934, Stanier 1940,1942, Fuller und Norman 1943, Ostertag 1952, Bauer
1962, Graf 1962, Knorr und Graf 1962, Graf und Stiirzenhofecker 1964, 1965,
Graf und Sukatsch 1965, Lewin 1969, Hofsten, Berg und Beskow 1971, Trzilova
und Miklosovicova 1973, 1974, Bergey's Manual 1974.
Bestimmungsschlussel der Arten
la Kugelige Mikrozysten bildend 2
lb Ellipsoidische Mikrozysten bildend; Zellmasse orange gefarbt
4. S. ellipsospora
2a Zellulose wird nicht zersetzt, hingegen Starke 3
2b Zellulose wird zersetzt, Starke nicht 1. S. myxococcoides
3a Mikrozysten vereinzelt; Kolonien regenbogenfarbig schimmernd; Zellen auf
nahrstoffreichenMedienmitstielartigen Auswikhsen
2. S. cauliformis
3b Mikrozysten in traubenformigenAggregaten; Kolonien gelb gefarbt
3. S. congregata
1. Sporocytophaga myxococcoides (Krzemieniewska 1933) Stanier
1940 (Fig. 91)
Spirochaeta cytophaga Hutchinson et Clayton 1919, Mycococcus cytophagus
(Hutchinson et Clayton 1919) Bokor 1930, Cytophaga myxococcoides
Krzemieniewska 1933, Cytophaga globulosa Stapp et Bortels 1934, Cytophaga hutchinso-
nii Imseneckij et Solnceva 1936 (non Cytophaga hutchinsonii Vinogradskij
1929), Mycococcus hutchinsonii (Imseneckij et Solnceva 1936) Imseneckij et
Solnceva 1940, Proactinomyces cytophagus (Bokor 1930) Krasil'nikov 1941,
Sporocytophaga myxococcoides a Akashi 1960, Sporocytophaga myxococcoides P
Akashi 1960.
Vegetative Zellen in Form flexibler, schwach lichtbrechender, selbstandiger
Stabchen mit abgerundeten Enden. Zellen gerade, bogenartig oder S-formig
gestaltet; am Ende leicht verjiingt. Selten werden schraubenartige Formen
gefunden, von denen angenommen wird, dafi sie unter ungunstigen Bedingun-
gen entstehen. Stanier (1960) halt sie fur Artefakte. In alten Kulturen konnen
Spharoplasten oder sehr lange Zellen gefunden werden. Als Ruhestadien werden
kugelige Mikrozysten gebildet, die meistens in alteren Kulturen in grofieren
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sporocytophaga • 165
Mengen zu linden sind. Vinogradskij (1929) und Bokor (1930) hielten sie fur
Kontaminate. Die Bildung von Mikrozysten ist eine der Phasen des Entwick-
lungszyklus. Die Zellen werden zunachst verkiirzt, spater kugelig; schliefilich
entsteht eine stark lichtbrechende, schleimige, die Zelle umgebende Kapsel.
Unter giinstigen Bedingungen keimen die Mikrozysten, wobei die Zellen die
Kapsel an der Stelle verlassen, wo sie aufgelost wird. Nach dem Ausschlupfen
der Zelle wird die Kapsel aufgelost. Die Zelle verlangert sich allmahlich zu einem
Stabchen mit runden, nicht verjungten Enden. Selten finden sich auch verzweig-
te Zellen. Mikrozysten konnen auch ohne Ruheperiode keimen. Unter gewissen
Bedingungen bilden die vegetativen Zellen Rosetten. Gramnegativ in alien
Entwicklungsphasen. Zellen mit homogenem Protoplasma, mit Anilinfarbstof-
Fig. 91. Sporocytophaga myxococcoides - Entwicklungszyklus - Bildung von
Mikrocysten (nach Krzemieniewska, 1929. - 5000 X), a vegetative Zelle nach
dem Leben, b-c vegetative Zelle nach gefarbtem Praparat. Der gefarbte
Protoplast enthalt an den Enden, manchmal auch in der Mitte Agglomerationen von
Chromatin. Das Zellende farbt sich nicht, d, e spateres Stadium - das Chroma-
tinmaterial sammelt sich in der Zellmitte, wo es eine und auch mehrere Aggloma-
rationen bildet, / allmahliche Verkiirzung der stabchenformigen Zellen und
Bildung spharischer Zellen, g Anhaufung des Chromatinmaterials in der Nahe
der Zellpole, h spharische Zellen, i Bildung einer Gallerthiille urn die spharische
Zelle,;' Mikrocyste mit getrennter Scheide, k Stadium der Mikrocyste vor der
Keimung, / Keimung der Mikrocyste, m allmahliches Wachstum der ausgekeim-
ten Zellen; sie unterscheiden sich von den normalen vegetativen Zellen durch
stumpfe Enden, n Involutionsformen.
166 • Gleitende Bakterien - Sporocytophaga
fen gut farbbar, am besten mit der Farbemethode nach Giemsa. Protoplast der
Mikrozysten ebenfalls gleichmafiig farbbar. Im Zeitraum, in dem sich die Zellen
verkiirzen und abrunden, hauft sich das Chromatinmaterial in Streifen oder
zentral gelegenen Flecken an. Zellmasse, wahrscheinlich durch Karotinoide,
gelb gefarbt.
Streng aerob, chemoorganotroph. Als Kohlenstoff- und Energiequelle wird
Zellulose, Zellobiose und Glukose verwertet. Weder Agar noch Starke oder
Chitin werden zersetzt. Das Wachstum einiger frisch aus dem Freiland isolierter
Stamme ist an die Verwertung von Zellulose gebunden. Glukose kann nicht
verwertet werden. In Populationen kommen jedoch Mutanten vor, die diese
Fahigkeit besitzen und sich in Kulturen mit Glukose bald vermehren. Sie haben
die Fahigkeit, ohne Rucksicht auf das verwendete Substrat Glukose sowie
Zellulose anzugreifen. Auf Filtrierpapier in Mineralsilikatboden nach 4-5 Tagen
glanzende, hellgelbe Flecken bildend. Der zentrale Teil der Kolonien wird
allmahlich transparent. In flussigen Losungen ist an der Oberflache am
Filtrierpapier ein hellgelber Fleck zu bemerken. Ober die Oberflache wachsen die
Organismen nicht, losen aber allmahlich das Papier auf. Auf Agar kommt es zum
Versinken der Kolonien. Vegetative Zellen und Mikrozysten, die auf Zellulose
wachsen, sind bedeutend kleiner, als die auf Glukose geziichteten. Sowohl in
flussigen, als auch auf festen Medien wird reichlich Schleim ausgeschieden.
Fliissiee Medien werden daher viskos.
Fortpflanzung durch Querteilung in der Zellmitte. Bewegung durch typisches
Gleiten.
Vegetative Zellen meistens 0,3-0,5 X 3,0-5,0 urn grofi. Manchmal bis 8,0 ^m
lang. Mikrozysten im Durchschnitt 1,3-1,6 ^m und die eigentlichen, von ihnen
eingeschlossenen Zellen 1,0 |xm messend.
Obgleich in der Literatur angefuhrt wird, dafi der Organismus allgemein in
Erdboden verbreitet ist, vertritt Ostertag (1952) die Ansicht, dafi es sich urn
einen typischen Wasserorganismus handelt, der sich mafigebend an der Zerset-
zung von Zellulose im Wasser beteiligt.
Mangels ausreichender systematischer Merkmale mussen zu dieser Art auch
la. Sporocytophaga myxococcoides a Akashi 1960 und
lb. Sporocytophaga myxococcoides (3 Akashi 1960
gesteflt werden. Beide Typen wurden aus dem Pansen von Rindern, Schafen und Ziegen
isoliert.
2. Sporocytophaga cauliformis Knorr et Graf 1962
Mittelmafiig grofie, stabchenformige Zellen mit sehr ausgepragter Pleomorphic.
Sie bilden auf nahrstoffarmen Medien stabchen- bis fadenformige, manchmal
spindelformige, flexible, bewegliche Zellen ohne feste Zellwand, die in gefarbten
Praparaten oft in U- oder S-Form vorkommen. In flussigen Medien oft Rosetten
bildend. Aufierdem ist eine parallele Anordnung der Zellen mit plasmatischer
Briickenbildung zu beobachten. In 6-8 Tage alten Kulturen entstehen
Mikrozysten als eine Phase des Lebenszyklus. Sie sind zusammen mit vegetativen Zellen
gleichmafiig in den Kulturen verteilt.
Die Zellen wachsen auf nahrstoffreichen Medien, wie 10% Blutagar, in Form
unbeweglicher Stabchen, auf denen binnen 2-3 Tagen mehr oder weniger lange,
biegsame, stielartige Auslaufer heranwachsen, die am Ende knopfartig gedrun-
gen sind, so dafi sie teilweise an die Vertreter der Gattung Caulohacter erinnern.
Die Funktion dieser Auslaufer ist noch unbekannt. Die Fahigkeit, sich an
anderen Mikroorganismen festzusetzen und ihr Plasma als Kohlenstoff- und
Energiequelle auszunutzen, wurde bisher noch nicht bewiesen. AulSer diesen
Formen sind in grofier Anzahl spindelformige Zellen zu finden, die manchmal
als sich teilende Tochterzellen zusammenhangen. Sj»haben einen charakteristi-
Scarmed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sporocytophaga • 167
schen Entwicklungszyklus. Ohne Geifieln. Gramnegativ in alien Entwicklungs-
stadien. Protoplasma mit Gebilden, die Kernen aquivalent sind (Nukleoide).
Auf spezifischen Nahrboden mit gelben, orangefarbenen, roten und rosafarbe-
nen Pigmenten (wahrscheinlich Karotinoide).
Ernahrungsweise chemoorganotroph. Aerobe Mikroben mit respirativem sowie
fermentativem Metabolismus. Als Kohlenstoff- und Energiequelle dient eine
Reihe von Zuckerarten, verschiedene Stamme verwerten verschiedene Arten.
Zellulose wird nicht hydrolysiert und Agar nicht zersetzt, wohl aber Starke. Der
Grofkeil der Stamme verfliissigt Gelatine mehr oder weniger schnell. Je nach den
physiologischen Eigenschaften lassen sich die verschiedenen Stamme in zwei
Typen einteilen. Der erste Typ (etwa 75%) umfafk Stamme, die Glukose sowie
die ubrigen Zuckerarten ohne Gasbildung in Sauren spalten und in bedeutendem
Mafi Katalase produzieren. Der zweite Typ (etwa 25% der Stamme) hat keine
Fermentationseigenschaften und produziert nur beschrankt Katalase. Beide
Typen sind ausgepragt psychrophile Organismen. Bei einer Temperatur von
37 ° wachsen sie nicht, bei 30 ° ist das Wachstum eingeschrankt. Das
Optimum setzt bei 22° ein. Auch bei 10° ist das Wachstum teilweise begrenzt.
Graf und Sukatsch (1965) fanden bei beiden Typen einen Stoff polypeptider
Struktur, der statisch auf Protozooen wirkt, una bei dem zweiten Typ einen
Stoff mit antibakteriellen Eigenschaften. Auf nahrstoffarmen Boden werden
anfangs hauchdiinne Flecken gebildet, die bei einer bestimmten Beleuchtung was
durch die parallele Anordnung der Zellen verursachte wird. Unter einem
bestimmten Einfall-Winkel des Auflichtes sind sie smaragdgriin. Spater haben
die Kolonien ein glasiges, schleimiges, unregelmafiiges, knolliges Zentrum. Alte
Kolonien sind gelb pigmentiert; stets mit einem Schwarmsaum. Auf reichen
Medien ist das Wachstum atypisch, uppig, sehr schleimig; ohne Schwarmsaum.
Kolonien dunkelgelb bis orangerot pigmentiert. In flussigen Nahrlosungen
zeigen sie eine gleichmafiige Trubung. Auf der Oberflache niemals mit hautarti-
gem oder schimmelahnlichem Belag. In alteren Kulturen entsteht ein gelbes
Sediment.
Fortpflanzung stabchenformiger Zellen in armen Medien durch einfache
Querteilung. In reichen Medien entfernen sich die Zellen wahrend der Teilung zuerst
voneinander, wobei zwischen ihnen eine Verbindungsstelle (der kiinftige Stiel)
entsteht. An der Stelle der nachsten Teilung bildet sich in der Mine dieser
Verbindungsstelle eine kugelformige Wucherung, aus der spater nach der
Teilung das knopf artige Ende der beiden Auslaufer hervorgeht. Im weiteren Verlauf
der Teilung kommt es hier zu einer Einschnurung, sodafi zwei stielformige
Zellen entstehen. Auf armen festen Medien Bewegung typisch gleitend. Die
Bewegung ist vom Alter der Kultur und von anderen Faktoren abhangig, und
erreicht eine Geschwindigkeit bis zu 2,0-2,5 urn/s. Zellen in reichen Medien
sitzen mit dem Auslaufer fest und bewegen ihr freies Ende peitschenartig.
Stabchenformige Zellen 0,16-0,25 X 4,0-10,0 urn grofi; auch iiber 10,0 urn
lange Zellen kommen vor.
In alien Binnengewassern weit verbreitet, wobei ihr Anteil an der ubrigen
Mikroflora in den oberen Schichten bis zu 7 m Tiefe 2,3%, in einer Tiefe von
60 m 5,8% betragt. Weiter in Sandfiltern von Klaranlagen gefunden (uberwie-
gend ein Glukose nicht fermentierender Typ), auch auf der Haut und den
Kiemen von Felchen, Barschen und Weififiscnen sowie auf Phytoplankton im
Litoral. Der Glukose fermentierende Typ tritt in sauerstoffreicher Umwelt auf
oder als Saprophyt oder Symbiont auf Zooplankton, wahrend der Glukose nicht
fermentierende Typ mehr in einer sauerstoffarmeren Umwelt (Tiefen) und auf
Pflanzenmaterial vorkommt. Tritt auch oft im Trinkwasser auf, wo diese Art
ursprunglich entdeckt wurde. Graf und Stiirzenhofecker (1965) halten inn fur
einen mikrobiellen Lidikator des Trophiegrades.
168 • Gleitende Bakterien - Sporocytophaga
Die Tatsache, dafi er in gewohnlichen Boden in der Gestalt von stabchen- oder
spindelformigen Zellen vorkommt, erklart, warum dieser Organismus bisher
iibersehen wurde. Graf (1962) vermutet, dafi auch Sphaeromyxaxanthochlora zu
dem zweiten Typ dieser Art gestellt werden mufi. Weitere Untersuchungen sind
erforderlich.
Unsichere Arten:
3. Sporocytophaga congregata Fuller et Norman 1943
Sporocytophaga congregata subsp. maroonicum Akashi 1960
Lange, flexible Stabchen mit verjiingten Enden. Bildet runde Mikrozysten in
Gestalt traubenformiger Aggregate innerhalb der Kolonien. Gramnegativ.
Zellen enthalten gelbes, wahrscheinlich aus Karotinoiden bestehendes Pigment.
Streng aerober, chemoorganotropher Organismus mit respirativem Metabolis-
mus. Biochemisch mit dem zweiten Typ von Sporocytophaga cauliformis darin
identisch, dafi aus einer Reihe von Zuckerarten weder Saure noch Gas produziert
wird. Auch Zellulose wird nicht zersetzt. Zersetzt jedoch Agar und verfliissigt
Gelatine binnen 3 Tagen. Bildet auf Starkeagar rauchfarbene, spater gelbe,
unregelmafiig abgerundete, leicht konkave Kolonien. Nicht bei alien Kolonien
bildet sich ein Schwarmsaum; ofter kommt er bei alteren Kolonien (7 Tage) vor.
Der Rand der Kolonien ist daher anfangs glatt, spater oft unregelmafiig gelappt.
Vegetative Zellen innerhalb der Kolonien in Schwarmen (Reihen) zusammen mit
den Mikrozysten liegend. Bewegung typisch gleitend.
Vegetative Zellen 0,5-0,7 X 5,5-8,0 ^tm grofi. Mikrozysten grofier als die Breite
der vegetativen Zellen.
Aus Erdboden isoliert.
Zu dieser Art gehort auch:
3a. Sporocytophaga congregata subsp. maroonicum Akashi 1960
Vegetative Zellen gramnegativ, in Form langer, flexibler Stabchen mit verjiingten Enden.
Immer einzeln; kugelformige Mikrozysten bildend. Protoplasma fein granuliert. Streng
aerob. Verwertet eine Reihe von Zuckerarten und Zellulose. Auf Filtrierpapier im Kultur-
medium kastanienbraune Flecken bildend, anfangs an der Wasserflache, spater auch unter
der Oberflache. Im Pansen von Rindern, Ziegen und Schafen gefunden.
4. Sporocytophaga ellipsospora (Imseneckij et Solnceva 1936)
Stanier 1942
Cytophaga ellipsospora Imseneckij et Solnceva 1936
Einzelne flexible, bewegliche Zellen in Gestalt von Stabchen mit abgerundeten
Enden. Sehr schwach lichtbrechend, noch weniger als Sporocytophaga myxococ-
coides. Ovale Mikrozysten bildend. Gramnegativ. Zellen mit orangefarbenem
Pigment (Karotinoide).
Streng aerober, chemoorganotropher Organismus. Biochemische Eigenschaften
nicht naher bekannt. Verwertet Zellulose; die iibrigen Kohlenhydrate wurden
nicht getestet. Bildet auf einem Silikatmineralmedium mit Filtrierpapier glanzen-
de, scnleimige, orangefarbene Kolonien. Im Laufe der Zeit wird der mittlere Teil
durch die Auflosung der Papierfasern durchsichtig. In fliissigen Medien mit
submersem Filtrierpapier bilden sich auf der Wasserflache oder iiber ihr
orangefarbene Flecken. Die gefarbten Gebiete verbreiten sich nach oben und werden
allmahlich transparent.
Zellen im Durchschnitt 0,45 x 7,5 urn, Mikrozysten 0,9 x 1,65-1,80 ^tm grofi.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Capnocytophaga - Sphaerocytophaga • 169
7. Capnocytophaga Leadbetter et al. 1979
Einzelne, kurze oder lange, flexible Stabchen mit abgerundeten oder gespitzten
Enden. Manchmal Faden mit einer Scheide bildend; gelegentlich schraubenartig
gewunden. Ruhestadien unbekannt. Zellsuspension gelb oder hellrosa gefarbt.
Gramnegativ.
Chemoorganotroph. Metabolismus fermentativ, wobei Azetat oder Sukzinat
das Endprodukt ist. Dextran, Glykogen, Inulin, Starke werden fermentiert.
Agar una Zellulose wird nicht abgebaut. Zum Wachstum werden Wachstums-
faktoren benotigt. Fakultativ anaerob; auch an der Luft wachsend.
Bewegung durch typisches Gleiten.
Zellen 0,4-0,6 x 2,5-5,7 \im grofi.
In der Mundhohle des Menschen vorkommend.
Drei Arten:
1. Capnocytophaga ochracea Leadbetter et al. 1979
2. Capnocytophaga sputigena Leadbetter et al. 1979
3. Capnocytophaga gingivalis Leadbetter et al. 1979
Gattungen unsicherer taxonomischer Stellung:
8. Sphaerocytophaga Graf 1961
Gramnegative, ziemlich flexible Zellen mit variabler Morphologie. Entweder
fadenformig mit abgerundeten Enden oder in Gestalt einer mafiigen Spindel mit
zugespitzten Enden, dann stark an Fusobakterien erinnernd. Ihre Flexibility ist
so gro£, dal? sie unter gewissen Bedingungen wie Spirochaten schraubenartig
gekriimmt sein konnen. In 6-7 Tage alten Kulturen kommen Mikrozysten vor.
Vegetative Zellen und Mikrozysten ohne Zellwand, nur mit dichterem Plasma an
der Peripherie der Zellen. Nukleoide lassen sich bei ihnen klar nachweisen.
Vegetative Zellen und Mikrozysten farben sich gut mit Anilinfarbstoffen. Streng
anaerob. Fermentative Tatigkeit sehr schwach. Pathogen; sie rufen beim
Menschen und hoheren Wirbeltieren akute sowie chronische Entziindungen der
Mundhohle hervor. Gegeniiber Phagozyten und Leukozyten weisen sie zytoly-
tische Eigenschaften auf.
Auf Blutagar graugelbe bis gelbe Kolonien mit einem typischen Schwarmsaum
bildend. Auf anorganischen Nahrboden wachst der Organismus nicht. Zellulose
wird nicht zersetzt. Bewegung durch typisches Gleiten. Fadenformige Zellen
bewegen sich schneller als die spindelformigen. Ausmafie der Zellen verander-
lich, 0,2-0,3 X 3,5-8,0 ^m, Mikrozysten im Durchschnitt 0,3-3,0 ^m grofi. In
der Mundhohle des Menschen oft gemeinsam mit Spirochaten und
Fusobakterien vorkommend.
Urspriinglich (Prevot 1940, Mac Donald 1953, Berger 1956) wurde diese Gat-
tung zur Gattung Fusobacterium gestellt. Gins (1942) reihte sie bei den Spirillen
als Spirillum buccale ein. Shmamine (1912) hielt sie fur Spirochaten. Weitere
Untersuchungen sind erforderlich
Typus generis: nicht angegeben.
Wichtigste Literatur: Shmamine 1912, Prevot 1940, Gins 1942, Mac Donald
1953, Berger 1956, Graf 1961, 1962, Soriano und Lewin 1965.
Mit zwei Arten, die sich nur durch die Gestalt der Zellen unterscheiden:
170 • Gleitende Bakterien - Sphaeromyxa
1. Sphaerocytophaga filiformis Graf 1961
Fadenformige Zellen mit abgerundeten Enden. Wahrscheinlich mit Spirillum
buccale identisch.
2. Sphaerocytophaga fusiformis Graf 1961
Spindelformige Zellen mit spitzen Enden, morphologisch Fusobakterien ahn-
lich.
9. Sphaeromyxa Bauer 1962
Flexible, dunne, stabchenformige, einzeln lebende Zellen variabler Lange; ohne
Geifieln. Obwohl keine feste Zellwand vorhanden ist, wird ihre Gestalt von
einer etwa 13 nm starken Hiille bestimmt, die nach der Autolyse der Zelle als
leeres Rohrchen sichtbar wird, in dem sich Reste des Zytoplasmas befinden. An
den Flanken oder Polen der vegetativen Zellen bilden sich in alteren Kulturen (5-
7 Tage) kugelformige Gebilde (Mikrozysten). Sie entstehen zunachst als kleine
Knospen, vergrofiern sich allmahlich und runden sich ab, bis sie sich schliefllich
abtrennen. Junge Mikrozysten homogen, altere mit dunklen hufeisen- bis
ringformigen Partikeln. Manchmal bleiben die Mikrozysten an der Mutterzelle
hangen, so dafl ganze Kettchen entstehen, ahnlich wie bei der Fragmentation der
Hyphen von Aktinomyceten. Mikrozysten entstehen zunachst im Mittelteil der
Kofonie; wahrscheinlich durch Nahrungsmangel und die Anhaufung toxischer
Stoffe induziert. Zellen mit gelbem Pigment (wahrscheinlich Karotinoide). Sie
farben sich gut mit Anilinfarbstoffen. Nach Farbung mit Giemsa konnen
Nukleoide beobachtet werden.
Chemoorganotrophe Organismen, streng aerob mit respirativem Metabolismus.
Sie verwerten als Kohlenstoff- und Energiequelle eine Reihe von Sacchariden
und Zellulose. Wenn keine Zellulose zur Verfiigung steht, wird auch Starke
verwertet. Pepton dient als Kohlenstoff- und Stickstoffquelle. Als Stickstoff-
quelle genugen auch Ammoniumsalze oder Nitrate. Verfliissigen Gelatine.
Wachsen auf nahrstoffarmen Agar in flachen, gelappten Kolonien mit einer
verzweigt wurzelartigen Innenstruktur. An den Randern der Kolonien sind
Schwarme zu beobachten, die an geschlossene Reihen erinnern. Die parallele
Anordnung der Zellen strahlt bei einem bestimmten Einfall-Winkel des Auf-
lichts einen griindlichen Glanz aus, der den Kolonien mit gelbem Pigment eine
gelbgriine Farbe verleiht. Auf reichen Medien kommt es zur chaotischen
Anordnung der Zellen; Kolonien gelb. Auf nahrstoffarmen Boden bewegen sich die
vegetativen Zellen mit einer Geschwindigkeit von 2,0-2,5 |xm/s abwechselnd
vor und zuriick, wobei der ganze Schwarm die gleiche Ordnung einhalt. Auf
reichen Medien bewegen sie sich nicht.
Wichtigste Literatur: Bauer 1962, Graf und Stiirzenhofecker 1964, Lewin
1969.
Eine einzige Art:
Sphaeromyxa xantochlora Bauer 1962
Mit den Merkmalen der Gattung.
Vegetative Zellen 0,16-0,25 |xm breit; die Lange ist variabel. Junge Zellen 7,0-
10,0 |xm lang; altere Kulturen enthalten lange Zellen. Mikrozysten je nach ihrem
Alter im Durchschnitt 0,1-1,5 |xm grofi.
Aus berieselten Feldern, Schlammproben, sowie aus Uberziigen auf der Fullung
von Tropfkorpern isoliert.
Von Graf und Stiirzenhofecker (1964) mit dem Typus von Sporocytophaga
cauliformis fur identisch gehalten. Lewin (1969) weist auf die Moglichkeit der
Identitat mit Flexibacter aurantiacus hin. ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Beggiatoaceae - Beggiatoa • 171
2. Familie Beggiatoaceae Migula 1894
Organismen, deren Zellen zu langen Faden angeordnet sind. Einzelne Zellen
sind im lebenden Zustand in den Faden meistens nicht sichtbar, sondern werden
erst an fixierten und gefarbten Praparaten oder im Phasenkontrast deutlich.
Zellen an den Fadenenden oft verjiingt und abgerundet. Morphologisch, insbe-
sondere in ihrem Fadenbau der Blaualgenfamilie Oscillatoriaceae sehr ahnlich.
Zellen gramnegativ, ohne Assimilationspigmente und Karotinoide; aerob oder
mikroaerophil. Ernahrungsweise mixotroph oder organotroph. Metabolismus
vollig auf Respiration aufgebaut; molekularer Sauerstoff dient als endgiiltiger
Akzeptor der Elektronen. Manche Stamme sind typische Sulfurikationsorganis-
men, die ihre Energie auch durch Oxydation von Schwefelwasserstoff zu
elementarem Schwefel gewinnen. Die freigesetzte Energie wird fur die Synthese
organischer Stoffe aus C02 verwendet. Bei Uberschufi von Schwefelwasserstoff
wird elementarer Schwefel als Reserve (als metabolisches Zwischenprodukt) in
Form von tropfenformigen Inklusionen innerhalb der Zellen gespeichert; dieser
wird bei Mangel an Schwefelwasserstoff weiter bis zu Sulfaten oxydiert. Aufier-
dem kommt als Reservestoff Poly-|3-Hydroxybuttersaure vor.
Vermehrung durch Querteilung der Zellen oder durch Fragmentation der
Faden; spezielle Reproduktionsorgane nicht bekannt. Bewegung durch ein
charakteristisches Vorwartsgleiten wie bei den Oscillatoriaceen.
Systematische Einreihung dieser Organismen bisher recht unklar, von manchen Autoren
wegen ihrer ahnlichen Struktur fur apochlorotische Blaualgen gehalten. Schon Migula
(1894) reihte diese Gruppe bei den Oscillatoriaceae ein, da viele aufierliche Merkmale den
beiden Gattungen Beggiatoa und Oscillatoria gemeinsam sind. Dennoch werden dieBeggia-
toaceen heute von den meisten Forschern zu den Bakterien gestellt, da sie durch ihre
Ernahrungsweise und die Fahigkeit, Schwefelwasserstoff zu oxydieren, den Bakterien naher
stehen. Eine definitive Losung der systematischen Einordnung werden erst weitere Unter-
suchungen bringen konnen.
Typus familiae: Beggiatoa Trevisan 1842
Bestimmungsschlussel der Gattungen
la TrichomeohneSchleimscheide 2
lb Trichome mit einer Schleimscheide 3
2a Trichome gerade oder nur gebogenen, nie schraubig gewunden
1. Beggiatoa (S. 171)
2b Trichome schraubig gewunden 3. Thiospirillopsis (S. 183)
3a Trichome einzeln, unterer Fadenteil in eine konische, der Basis zu sich
verjiingende Scheide eingeschlossen, die oft von Eisenverbindungen inkru-
stiertist 4.Thionema(S. 184)
3b Trichome in Bundeln; in einer gemeinsamen Schleimkapsel eingeschlossen . .
2.Thioploca(S. 180)
1. Beggiatoa Trevisan 1842 (nomen conservandum)
Zellen zylindrisch, gleichmafiig breite, segmentierte, farblose, nicht festhaftende
Faden bildend. Segmentierung der Faden eewohnlich nur an gefarbten
Praparaten sichtbar. Einzeln vorkommend, doch konnen manchmal auch Anhaufungen
in Form weifier oder cremefarbiger Massen gebildet werden. Vorsichtig von der
Unterlage abgenommen, behalten die Faden ihre filzige Formation. Durch
mechanisches Schutteln losen sich die einzelnen Faden aus den Verbanden,
bilden jedoch nach einigen Stunden erneut typische Knauel. Auch ohne Unterla-
172 • Gleitende Bakterien - Beggiatoa
ge verwickeln sich die freien Faden zu Knaueln. Bisher wurden Scheiden nicht
eindeutig festgestellt, obwohl manchmal Schleimlager auftreten. Zellen mit
diinner dunkler Membran, ohne ausgesprochene Zellwand. Protoplasma mit
amorphen Granula lipoiden Materials verschiedener Grofie, die sich mit Sudan-
schwarz B farben. An Hand von Reinkulturen wurde festgestellt, dafi bei
Beggiatoa heterotrophe respektive mixotrophe Ernahrune vorherrscht und dafi
nur ausnahmsweise manche Stamme streng autotroph wachsen konnen. Mit rein
respirativem Metabolismus, wobei molekularer Sauerstoff als Elektronenakzep-
tor verwertet wird. Ernahrungsweise von okologischen Bedingungen abhangig;
an die Ernahrungsweise ist die Speicherung von Reservestoffen gebunden. Bei
niedriger Konzentration von organischen Stoffen und in Anwesenheit von
Schwefelwasserstoff werden in den Zellen Schwefeltropfchen, aber nur sehr
wenig Poly-P-Hydroxybuttersaure in Form von Granula gespeichert.
Cataldi (1940), Faust und Wolfe (1961), Scotten und Stokes (1962) haben
bewiesen, dafi Beggiatoa-Zellen unter gewissen Kulturbedingungen uberhaupt
keine Schwefeltropfchen enthalten, was gewisse Schwierigkeiten bei der Identiri-
zierung von Freilandmaterial hervorrufen kann. Bei hoherer Konzentration
organischer Stoffe im Medium wird eine grofie Menge von
Poly-P-Hydroxybuttersaure als Reservestoff gespeichert. Die Zellen sind aerob oder mikroaerophil;
manche Stamme brauchen gewisse Wuchsstoffe. Wachstum erfolgt nur bei
niedriger H2S-Konzentration.
Vermehrung durch Querteilung der Zellen, wodurch der Faden in die Lange
wachst und darauffolgende Fragmentation der Faden (Bildung von Hormogo-
nien). Bewegung der Faden ganz spezifisch (durch charakteristisches Gleiten)
und vom Kontakt mit der Unterlage abhangig. Oft ist die Bewegung mit einer
Rotation der Faden um die Langsachse verbunden.
Die Identifizierung der einzelnen Arten ist mit gewissen Schwierigkeiten
verbunden, da sie nach der Zellgrofie, insbesondere der Zellbreite erfolgt. Es
existiert eine ganze Reihe intermediarer Typen.
Typus generis: Beggiatoa alba (Vaucher 1803) Trevisan 1845
Wichtigste Literatur: Trevisan 1845, Vinogradskij 1887, 1888, 1889, Biitschli
1890, Migula 1900, Molisch 1912, Keil 1912, Nadson 1914, Lauterborn 1916,
Bavendamm 1924, Koppe 1924, Liebetanz 1925, Uphof 1927, Ellis 1932, Klas
1937, Huber-Pestalozzi 1938, Cataldi 1940, Johnson und Baker 1947, Bergey's
Manual 1948, 1947, 1974, Krasil'nikov 1949, Pringsheim 1951, 1957, 1967,
Scotten 1951, Bahr und Schwartz 1956, Skuja 1956,1964, Faust und Wolfe 1961,
Lewin 1962, Scotten und Stokes 1962, Pringsheim und Wiessner 1963, Rodina
1963, Kowallik und Pringsheim 1966, Starmach 1966, Anagnostidis 1968.
Bestimmungsschlussel der Arten
la Trichome im Durchmesser schmaler als 15 (xm 2
lb Trichome im Durchmesser breiter als 15 \xm 7
2a Durchmesser der Trichome 1,2 |xm nicht iiberschreitend 3
2b Durchmesser der Trichome 1 ^m iiberschreitend, jedoch nicht 15 |xm errei-
chend 4
3a JedeZelle meist mit einer grofieren Menge kleiner Schwefeltropfchen
2. B. minima
3b Jede Zelle nur mit einem grofieren, stark lichtbrechenden Schwefeltropfen . .
3. B. uniguttata
4a Trichome breiter als 1 |xm, aber schmaler als 5 n 5
4b Trichome breiter als 5 |xm, jedoch schmaler als 15 \xm ... 4. B. arachnoidea
5a Faden meistens weifie oder graue Oberziige auf faulenden organischen
Stoffen bildend 6
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Beggiatoa • 173
5b Faden einzeln vorkommend, leicht schraubig gewunden und an den Enden
lang zugespitzt 5. B. arctoalpina
6a Trichome iiber 1 |xm breit, in den meisten Fallen jedoch nicht breiter als
2,5 |xm 6. B. leptomitiformis
6b Trichome breiter als 2,5 |xm, jedoch nicht breiter als 5,0 urn l.B.alba
7a Zellen tonnenformig 7. B. mirabilis
7b Zellen zylindrisch 8. B. gigantea
1. Beggiatoa alba (Vaucher 1803) Trevisan 1845 (Fig. 92)
Oscillatoria alba Vaucher 1803, Hygrocrocis vandelii Meneghini 1833, Beggiatoa
punctata Trevisan 1842, Beggiatoa raineriana Meneghini 1846, Beggiatoa alba
var. marina Cohn 1865, Beggiatoa alba var. spiralis Hansgirg 1892, Beggiatoa
marina Molisch 1912.
Sehr lange, der ganzen Lange nach gleichmafiig breite, farblose Faden, die auf
einer Unterlage festsitzen. Einzelne Zellen im optischen Querschnitt meist
quadratisch, nach der Teilung kiirzer als breit; Terminalzellen abgerundet. Ohne
aufiere Scheide; die Aufienwand der Trichome jedoch sehr steif. Segmentierung
der Faden nur im Phasenkontrast deutlich, oder dann, wenn der Organismus in
einem Milieu mit wenig oder ohne Schwefelwasserstoff wachst. Im H2S-reichen
Milieu machen reichliche Schwefeltropfchen die Segmentierung unkenntlich.
Aktiv bewegliche Trichome auch mit einer Menge grofier, stark lichtbrechender
Granula, die an Oltropfchen erinnern und sich mit Sudanschwarz B farben. Alte,
unbewegliche Faden enthalten solche Granula nur in geringer Zahl. Faden
konnen nicht mechanisch geteilt werden, einzelne Fragmente sind nicht lebens-
fahig. Sporen werden nicht gebildet.
Ernahrungsweise bisher wenig bekannt. Nach neueren Arbeiten scheint sich die
Art mixotroph oder vollig organotroph zu ernahren. Es wird eine Reihe von
Hexosen, Pentosen, Disacchariden, Aminosauren und organischen Sauren
verwertet, jedoch sind niedrige Konzentrationen erforderlich. Konventionelle
Nahrmedien mit hohen Konzentrationen inhibieren das Wachstum, wogegen es
durch Erddekokt oder durch Kalziumsalze in einer Konzentration von 0,01%
stimuliert wird. Die Faden sind aerob und unter anaeroben Bedingungen nicht
wachstumsfahig. Hohere H2S-Konzentrationen vertragen sie nicht. Obwohl
nicht einmal niedrige H2S-Konzentrationen unbedingt erforderlich sind, gedei-
hen sie bei solchen doch besser als in Gewassern ohne H2S. Andere Schwefelver-
bindungen wirken inhibierend. In Nahrlosungen bilden die Anreicherungskul-
turen typische Fadenknauel, die ungefahr 1 mm grofi werden und in denen die
Trichome sehr aktiv beweglich bleiben. Niemals im Medium gleichmafiig ver-
teilt. Auf festen Nahrboden bilden sie Kolonien aus parallel angeordneten Faden
oder aus wirbelartigen Formationen. Bewegung durch charakteristische,
gleitende Wellenbewegung nur auf fester Unterlage; Geschwindigkeit bis zu 3,0-
4,0 |xm/s.
Trichome 2,5-5,0 |xm breit, meistens 3,0-3,8 \im. Einzelne Zellen 3,0-9,0 |xm
lang, nach der Teilung kiirzer oder ebenso lang wie breit; Faden eine Lange von
einigen mm erreichend.
In Sufi- und Salzwasser mit faulenden organischen Stoffen und geringer H2S-
Konzentration. Wahrscheinlich kosmopolitisch verbreitet. Oft auch in
Thermal- oder Schwefelquellen, wo kreideweifie oder graue und lederartige Uberzii-
ge gebildet werden. In grofien Mengen auch in Sumpfen, in verunreinigten
Gewassern, Abwassern, biologischen Klaranlagen usw. Urspriinglich in einer
Thermalquelle in Aix (Frankreich) gefunden.
Ellis (1932), der Auffassung Zopfs (1882) folgend, war der unrichtigen Meinung, dafi es sich
um eine sehr pleomorphe Art handele, deren Faden unter bestimmten Bedingungen in kleine
174 • Gleitende Bakterien - Beggiatoa
oder grofie Kokken, kurze Stabchen oder ovoide schraubenartige Elemente zerfallen, die
beweglich oder unbeweglich sein konnen. Weiter nahm er auch eine Vermehrung durch
Endosporen an.
Manchmal wird urn die Faden viel Schleim abgesondert, so dafi diese Art dann schlecht von
Thiothrix zu unterscheiden ist.
Krasil'nikov (1949) stellte ebenso wie Bavendamm (1924) zu diesem Organismus auch
folgende Art:
la. Beggiatoa marina Molisch 1912
Im Salzwasser auf faulende Algen vorkommend. Fadenbreite 2,0-4,0 urn, Fadenlange 290-
350 urn, manchmal bis zu 2000 urn. In Triest (Italien) gefunden.
Fig. 92. Beggiatoa alba - verschiedene Fadenformen, a, c normaler Habitus mit
deutlichen Querwanden, b Faden mit abnormal langen Zellen, Querwande
undeutlich, d Faden mit langeren Zellen, Segmentierung nicht erkennbar, e
Faden mit angehauften Schwefeltropfchen,/Faden mit unmerklicher
Segmentierung, ? Faden, der langerer Zeit in einem H2S-freiem Milieu war und keine
Schwefeltropfchen enthalt (Orig. - 1000X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Beggiatoa • 175
2. Beggiatoa minima Vinogradskij 1888 (Fig. 93)
(non Beggiatoa minima Warming 1875)
Beggiatoa minor Uphof 1927
Faden auffallend diinn schmaler als 1,0 urn, gleichmafiig breit, unsegmentiert
erscheinend. Einzelne gewohnlich, 1,0 urn lange Zellen nach spezieller Farbung
erkennbar. Bewegung langsam durch Vorwartsgleiten.
Anagnostidis (1968) fiihrt Ausmafie von 0,5-1,0 p, selten 1,2 urn an.
Rodina (1963) fand diesen Organismus in oligosaproben und oligotrophen Seen
in der Umgebung des Ladoga-Sees (UdSSR), wo er verschieden grofie Anhau-
fungen bildete. Die Fadenbreite war verschieden, manchmal hochstens 0,5 (im,
wobei die Schwefeltropfchen den ganzen Zellraum ausfullten, manchmal bis zu
1,2 um. Einige Faden waren 60-70 urn lang und nicht segmentiert, andere
deutlich gegliedert.
Migula (1900) ist der Meinung, dafi die Art mit Beggiatoa leptomitiformis
identisch ist.
2a. Beggiatoa minor Uphof 1927
Faden nur 0,2-0,3 (im breit und 80-100 (im lang; Zellen mit sehr wenigen
Schwefeltropfchen, 1,0 (im lang. Bewegung sehr langsam. Aus den Quellen von Wekiwa Springs und Palm
Springs (Florida, USA) beschrieben.
3. Beggiatoa uniguttata Koppe 1924 (Fig. 96)
Faden undeutlich segmentiert, einzelne Zellen im optischen Schnitt grofitenteils
quadratisch, manchmal etwas linger als breit. In ihrer Struktur Beggiatoa
minima sehr ahnlich; sie unterscheiden sich von dieser Art jedoch dadurcn, dafi
in jeder Zelle nur ein grofier, stark lichtbrechender Schwefeltropfen enthalten ist,
der die ganze Zelle ausfullen kann. Bewegung sehr kraftig und schnell. Zum
Unterschied von der eeradlinigen und gleitenden Bewegung von Beggiatoa
minima ist sie hier schlangelnd.
Faden 0,5-1,0 (im breit.
Vereinzelt am Grund und im Schlamm eutropher Seen, in denen genugend
Schwefelwasserstoff enthalten ist, besonders in der Litoralzone, aber auch im
Pelagial.
4. Beggiatoa arachnoidea (Agardh 1827) Rabenhorst 1865 (Fig, 97)
Oscillatoria arachnoidea Agardh 1827, Oscillaria versatilis Kutzing 1843,
Beggiatoa versatilis (Kutzing 1843) Trevisan 1845, Beggiatoa pellucida Cohn 1865,
Beggiatoa major Vinogradskij 1888, Beggiatoa arachnoidea var. uncinata Hans-
girg 1888, Beggiatoa arachnoidea var. marina Hansgirg 1890.
Faden gleichmafiig breit; einzelne Zellen grofitenteils ebenso lang wie breit oder
unbetrachtlich kiirzer. Eine markante Segmentierung kann erst nach Spezialfar-
bung oder an Faden mit wenigen Schwefeltropfchen Deobachtet werden. Termi-
nalzellen abgerundet und deutlich verjungt.
Faden 5,0-14,0 (im breit, und bis 150 (im lang, einzelne Zellen 5,0-7,0 urn
lang.
In H2S-haltigen Sufi- oder Salzwassern und in Schwefelquellen vorkommend.
Bildet mit blofiem Auge gut sichtbare, kreideweifie und spinngewebeartige
Uberziige. Aus den Thermalquellen von Karlovy Vary (CSSR) beschrieben.
Skuja (1956) unterscheidet zwei Typen. Der eine, sehr oft im Plankton vorkommend, hat
gerade, 5,0-7,0 (im dicke Faden, deren einzelne Zellen 0,75 bis 2x so lang wie breit sind.
Der zweite Typus tritt im Hypolimnion oder im Bodenschlamm der Litoralzone auf und hat
6,0-10,0 (im breite Faden, die an den Enden stark verjungt und teilweise schraubig
gewunden sind. Uphof (1927) beschreibt eine Form, deren Zellen eine Breite von 5,0-
176 • Gleitende Bakterien - Beggiatoa
Fig. 96. Beggiatoa unigutata - a Detail des Fadenendes (nach Koppe, 1924. -
5000x), b, c einzelne Fadenteile (nach Anagnostidis, 1968. -b 2400X c 1350x).
Fig. 97. Beggiatoa arachnoidea - Aussehen der Apikalteile. (Nach Skuja, 1956. -
1350X).
7,0 um und eine Lange von 8,0-10,0 um erreichen. Faden sehr beweglich, 90-800 um lang.
Zellen mit kleinen und grofien Schwefelgranula von 0,3-0,5 oder 1,0-1,5 um Durchmesser.
Koppe (1924) und Ellis (1932) beobachteten Gallertpolster.
4a. Beggiatoa major Vinogradskij 1888
Faden 5,0-9,0, seltener 14,0 um breit, mit einer deutlich sichtbaren Scheide, obwohl die
Zellen mit Schwefeltropfchen gefiillt sind. Von Koppe (1924) im Bodensee in 100-175 m
Tiefe gefunden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Beggiatoa • 177
5. Beggiatoa arctoalpina Skuja 1964 (Fig. 94)
Faden oft einzeln, sehr lang, meistens gerade, manchmal unregelmafiig gebogen
und etwas schraubig gewunden. Zellwande nur schwer sichtbar, an den Trenn-
wanden nicht eingescnniirt. Fadenenden ahnlich wie bei Beggiatoa arachnoidea
lang zugespitzt. Terminalzellen mafiig kugelformig erweitert und abgerundet.
93 94 95
Fig. 93. Beggiatoa minima - verschiedene Fadenformen - (nach Rodina, 1963;
1965. - 1000X). Fig. 94. Beggiatoa arctoalpina - (nach Skuja, 1964. - 1000X).
Fig. 95. Beggiatoa leptomitijormis - (nach Rodina, 1963. - lOOOx).
178 ■ Gleitende Bakterien - Beggiatoa
Einzelne Zellen zylindrisch, 1-3 X langer als breit, an den Fadenspitzen noch
langer. Protoplasma farblos, hyalin mit wenigen, stark lichtbrechenden Schwe-
feltropfchen. Oft in einer Zelle nur ein Schwefeltropfen. Faden lebhaft beweg-
lich.
Einzelne Faden bis 4 mm lang und 2,0-2,8 manchmal bis 3,8 um breit; apikale
Fadenteile bis auf 1,5 um verschmalert; gelegentliche Schraubenwindungen 5,0-
10,0 urn breit und 70,0-95,0 urn lang.
In Sedimenten, am Grund und in unteren Wasserschichten von Tiimpeln und
Seen in Nordskandinavien. Aus Hochgebirgsseen und Tiimpeln des Bergmassivs
Nuolja-Latnjatjarro - Kapastjarro-Liktatjarro in Lappland bei Abisko (Schwe-
den) beschrieben.
6. Beggiatoa leptomitiformis (Meneghini 1842) Trevisan 1842
(Fig. 95)
Oscillatoria leptomitiformis Meneghini 1842, Beggiatoa media Vinogradskij
1888.
Faden gleichmafiig breit; Zellen im optischen Langsschnitt quadratisch, nur nach
dem Entfernen der Schwefeltropfchen oder in ihrer Abwesenheit sichtbar.
Terminalzellen gewohnlich abgerundet. NaCl-Konzentrationen bis zu 16%
werden toleriert.
Faden 1,0-2,5 um breit, einzelne Zellen 4,0-8,0 um lang.
In grofien Mengen in alien H2S-haltigen Sufi- und Salzwassern vorkommend und
weifie Uberziige bildend. Am haufigsten im Schlamm, aber auch in Schwefel-
quellen zu finden. Aus den Euganeischen Thermen bei Padua, Abano Terme
(Italien) beschrieben. Rodina (1963) fand in den oligotrophen Seen in der
Umgebung des Ladoga-Sees (UdSSR) zwischen normal entwickelten Faden auch
solche, deren Zellen 8,0-12,0 um lang und 2,5-5,0 urn breit waren.
Bavendamm (1924) stellt zu diesem Organismus auch die von Vinogradskij beschriebene:
6a. Beggiatoa media Vinogradskij 1888
In den Zellen fanden Butschli (1890) und Nadson (1914) starkeahnliche Stoffe. Dies macht
weitere Untersuchungen erforderlich.
7. Beggiatoa mirabilis Cohn 1875, emend. Klas 1937 (Fig. 98)
Beggiatoa maxima Uphof 1927
Faden gerade, nur manchmal den Unebenheiten der Unterlage angepafit, ge-
kriimmt; unter giinstigen Verhaltnissen gleichmafiig breit. Unter ungiinstigen
hingegen tonnenformig werdend.
Segmentierung gewohnlich auch ohne Farbung gut sichtbar.
Terminalzellen verjungt und abgerundet, manchmal gebogen.
Faden 15,0-25,5 um, nach Bavendamm (1924) sogar 16,0-45,0 um breit (am
haufigsten 17,0 um); Zellen 5,0-13,0 um, meistens 8,5 um lang (oft kiirzer als
breit).
In HjS-haltigem Meer- oder Brackwasser. Don auf faulenden Algen schneewei-
fie Uberziige bildend, die an Spinnweben erinnern. Auch in Meerwasser-
Aquarien gefunden. Wahrscheinlich nicht auf Meerwasser begrenzt.
Krasil'nikov (1949) stellt auch Beggiatoa gigantea hierher.
7a. Beggiatoa maxima Uphof 1927
Faden 10,0-20,0 (Am breit, Zellen 12,0-20,0 (Am lang. Die Grofienunterschiede zwischen
Beggiatoa arachnoidea und Beggiatoa mirabilis werden durch diese Art teilweise iiber-
briickt. Faden 100-1000 (Am, manchmal auch langer.
Schwefelkornchen innerhalb der Zellen bei verschiedenen Individuen verschieden grofi,
jedoch wenigstens dqppelt so erofi, wie bei Beggiatoa arachnoidea (0,5-4,0 (Am). Eine Reihe
dieser Globuli hat ein zentrales, ziemlich lichtbrechende|^}rperchen, um das Schwefel
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Beggiatoa • 179
&%$
^
°<S&
m
98 99
Fig. 98. Beggiatoa mirabilis - (nach Anagnostidis, 1968. - 450x). Fig. 99
Beggiatoa gigantea - (nach Mikrophotographie umgezeichnet - Schlegel, 1972. -
ausgeschieden wird. Bei kleinen Globuli sind sie nicht sichtbar. "Diese Art kommt in Form
einzelner Faden vor, sie bildet keine Lager.
Siifiwasser-Art, die aus den Wekiwa Springs, (Florida, USA) beschrieben wurde.
8. Beggiatoa gigantea Klas 1937 (Fig. 99)
Faden betrachtlich breit; gesunde Faden gleichmafiig breit, wogegen sie unter
ungunstigen Verhaltnissen angeschwollen sein konnen; deutlich segmentiert.
Terminalzellen gewohnlich abgerundet.
180 • Gleitende Bakterien - Thioploca
Faden nach Klas (1937) 26,4-42,9 ^m, nach Bergey'Manual (1957) sogar 26,4-
55,0 u.m am haufigsten jedoch 35,0-40,0 \im breit. Einzelne Zellen 5,0-
13,0 u.m, meistens 8,5 u.m lang.
In H2S-haltigem Meerwasser, insbesondere auf faulenden Meeresalgen. Krasil'-
nikov (1949) stellt diese Art zu Beggiatoa mirabilis.
2. Thioploca Lauterborn 1907
Faden grau, flexibel, morphologisch den Faden von Beggiatoa sehr ahnlich.
Faden parallel oder durcheinander zu Biindeln verwoben, die in eine gemeinsa-
me, breite, farblose Schleimscheide eingeschlossen sind. Scheide deutlich, an der
Aufienseite mit Detritus, vielleicht auch mit Eisen- oder Manganoxiden bedeckt
(Perfiliev 1965). Einzelne Faden auch mit ganz schmaler und weicher Scheide, an
der Detritus-Teilchen besonders leicht hangen bleiben. Auch Ubergangsformen
zwischen ein- und vielfaserigen Individuen sind zu finden. Gelegentlich verlas-
sen die Faden die Scheide, so dafi auch leere Scheiden zu finden sind. Faden ohne
Scheide langere Zeit lebensfahig und morphologisch von den entsprechenden
Beggiatoa-Arten kaum zu unterscheiden. Mafigebende Unterschiede nur in ihrer
Ultrastruktur. Faden seementiert, aus zylindrischen Zellen zusammengesetzt
und der ganzen Fadenlinge nach gleichmafiig breit. In einer gemeinsamen
Scheide konnen sowohl gleiche als auch verschieden breite Faden auftreten.
Terminalzelle oft verjiingt, abgerundet. Faden farblos, ohne photoassimilieren-
de Pigmente.
Metabolismus anscheinend vom gleichen Typus wie Beggiatoa. Die Faden sind
aerob, in ihrer Mehrheit mikroaerophil. Molekularer Sauerstoff dient als letzter
Elektronenakr.eptor. Im H2S-haltigen Milieu werden innerhalb der Zellen
Schwefeltropfchen, meist in grofierer Zahl, gespeichert. Nach Koppe (1924)
dauert ihre Bildung lange, der Zerfall geht jedoch in Abwesenheit oder bei
Erschopfung des Scnwefelwasserstoffs im Medium schnell vor sich. Faden ohne
Schwefelinklusionen sind gegeniiber Schwefelwasserstoff chemotaktisch. Ele-
mentarer Schwefel wird zu Sulfaten oxydiert. Faden durch charakteristische
Gleitbewegung aktiv beweglich. Einzelne Faden konnen sich unabhangig von-
einander auch innerhalb der Scheide bewegen. Im Siifiwasser und brakischen
Wasser, sowie im Schlamm vorkommend, sofern Kalziumkarbonat und eine
niedrige H2S-Konzentration vorhanden sind. Nach Perfiliev (1965) in den
Reduktions- und Oxydationszonen des Schlammes, wobei in der Oxydations-
zone die Faden vertikal, und in der Reduktionsschicht horizontal gelagert sind.
Ihre Beweglichkeit ermoelicht ihnen, eine fur sie optimale H2S- und Sauerstoff-
Konzentration aufzusucnen.
Erinnert stark an die Blaualgen Hydrocoleum und Microcoleus der Familie Oscillatoriaceae,
Lauterborn (1907), Vislouch (1911), Koppe (1924) und Bavendamm (1924) haben bei
manchen Arten eine blaugriine Farbung beobachtet. Thioploca kann von Beggiatoa auf
Grund unterschiedlicher Ultrastruktur eindeutig getrennt werden. Ellis (1932) ist der
Ansicht, dafi es sich in diesem Fall um eine Ubergangsform zwischen Bakterien und
Blaualgen handelt.
Typus generis: Thioploca schmidlei, Lauterborn 1907
Wichtigste Literatur: Lauterborn 1907, Vislouch 1911, Kolkwitz 1912,
Bavendamm 1924, Koppe 1924, Huber-Pestalozzi 1938, Maier 1963, Maier und
Murray 1965, Perfiliev 1965, Starmach 1966, Skerman 1967, Anagnostidis 1968.
Bestimmungsschlussel der Arten
la Faden in der gemeinsamen Scheide mit einheitlichemDurchmesser 2
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thioploca • 181
lb Faden in der gemeinsamen Scheide mit verschiedenen (gewohnlich zwei)
Durchmessern 4. Th. mixta
2a Fadendicke unter 5,0 \im 3
2b Fadendicke 5,0-9,0 \im l.Th. schmidlei
3a Fadendicke grofier als 2,0 \im, jedoch nicht iiber 5,0 \im .... 2.Th. ingrica
3b Fadendicke kleiner als 2,0 |im 3. Th. minima.
1. Thioploca schmidlei Lauterborn 1907 (Fig. 100).
Faden in einer gemeinsamen Gallertscheide, die an der Oberflache in regelmafii-
gen Abstanden eingeschniirt ist, so dafi der Eindruck entsteht, dafi der Organis-
mus aus ringformigen Gebilden zusammengesetzt ist. Fadenzahl in der Scheide
sehr variabel. Erwachsene Faden segmentiert, junge Faden unsegmentiert er-
scheinend. Zellen ublicherweise 1 bis 1,5 mal linger als breit. Fadenenden
verjiingt; oft enthalten die Faden so viele Schwefeltropfchen, dafi sie schwarz
gefarbt erscheinen. Einzelne Faden bewegen sich nebeneinander in der Scheide
100 u U
Fig. 100. Thioploca schmidlei - a schraubenformiges, gekriimmtes Fadenbiin-
del, das in einer ringformig gegliederten Schleimkapsel liegt- (nach Ellis, 1932
und Mikrophotographie von Liebmann, 1962. - 250 X), b freier, einzelner Faden
in einer Kapsel (nach Ellis, 1932. - 1000X), c Fadenbiindel in einer nicht
ringformigen gegliederten Kapsel (nach Anagnostidis, 1968. - 250X).
182 • Gleitende Bakterien - Thioploca
durch charakteristische Gleitbewegung. Unter bestimmten Bedingungen treten
sie aus der Scheide aus und bilden nach Ellis (1932) wahrscheinlich Zentren fiir
neue Mikrokolonien; ihre Entwicklung wurde bisher jedoch nicht beobachtet.
Einzelne Faden 5,0-9,0 (im breit, Zellen gewohnlich 5,0-8,0 (im lang; Gallert-
scheide 50-100 (im im Durchmesser und sogar bis einige Zentimeter lang.
Im Sufi-, Brack- und Meerwasser, besonders im Schlamm, der Schwefelwasser-
stoff und Kalziumkarbonat enthalt, vorkommend. An verschiedenen Standorten
in Mitteleuropa haufig gefunden. Von Lauterborn (1907) urspriinglich aus dem
Untersee in einer Tiefe von 15-20 m und im Schlamm des Rheins im Hafen von
Kehl bei Strafiburg (BRD) beschrieben.
Faden dem Habitus nach Beggiatoa arachnoidea ahnlich; sie unterscheiden sich
jedoch vor allem durch die nicht schraubig gewundenen Enden.
2. Thioploca ingrica Vislouch 1911 (Fig. 101).
Bildet Fadenbiindel, mit 10-20 Faden, die in einer Gallertscheide eingeschlossen
sind. Faden segmentiert, an den Enden verjiingt. Nach Vislouch (1911) blaugriin
gefarbt, nach den iibrigen Autoren farblos. Faden in der Scheide beweglich.
Fadenbiindel mit Scheide, bis 80,0 (im breit und rund 1 cm lang. Einzelne Faden
2,0-4,5 (im breit, Zellen 1,5-8,0 (im lang.
Im H2S-haltigen Sufi- und Salzwasserschlamm weifie oder grauweifie Lager
bildend. Aus dem Bodensee sowie aus der Miindung der Neva bei Leningrad
(UdSSR), dem Hafen Gulf bei Gdansk, (Polen) und aus dem Erie-See (Kanada)
beschrieben.
Einzelne Faden sind Beggiatoa alba sehr ahnlich, von der sie sich nach Maier und
Murray (1965) durch ihre Ultrastruktur und die verjiingten Enden unterschei-
det. Ellis (1932) stellt zu dieser Gattung auch Thioploca minima und Thioploca
mixta.
3. Thioploca minima Koppe 1924
Bildet in gemeinsamer Gallertscheide eingeschlossene Fadenbiindel mit unter-
schiedlicher Anzahl von Faden. Faden in Gheder segmentiert; doch kann die
Segmentierung erst nach Entfernung der Schwefeltropfchen durch Preparation
beobachtet werden.
Einzelne Faden 0,8-1,5 (im, Scheide bis 30 urn breit. Fadenbiindel in der
Scheide bis 600 (im, Segmente 1,0-2,0 (im lang.
In H2S-haltigem Sufi- und Salzwasserschlamm des Bodensees (in 10 m Tiefe)
und des Erie-Sees (Kanada).
Einzelne Faden sind Beggiatoa leptomitiformis und Beggiatoa minima sehr
ahnlich.
Art unsicherer Stellung:
4. Thioploca mixta Koppe 1924
Fadenbiindel aus Faden von ziemlich unterschiedlicher Grofie gebildet, die in
einer gemeinsamen Gallertscheide eingeschlossen. Sowohl die Anzahl der Faden
als auch das Verhaltnis zwischen den beiden Fadentypen in der gemeinsamen
Scheide ist sehr verschieden. Breitere Faden deutlich segmentiert, wogegen die
schmaleren zwar auch segmentiert sind, was jedoch erst nach Preparation
sichtbar wird.
Scheide bis zu 50 (im breit. Der eine Fadentyp 6,0-8,0 (im breit, mit 5,0-8,0 (im
langen Segmenten. Der andere Fadentyp ungefahr 1,0 (im breit, mit 1,0-2,0 [im
langen Segmenten.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiospirillopsis ■ 183
101 102
Fig. 101. Thioploca ingrica - a nach Bavendamm, 1924. - 500X, b nach
Anagnostidis, 1968. - 500x). Fig. 102. Thiospirillopsis floridana - (nach Uphof,
1927.-2000X).
Im H2S-haltigem Sufi- und Salzwasserschlamm. Im Bodensee in 10 m Tiefe und
im Lake Constance (Kanada) gefunden.
Die brekeren Faden dieser Art sind auffallend Beggiatoa arachnoidea, die schmaleren Faden
Beggiatoa leptomitiformis ahnlich. Deshalb wird sie von einigen Autoren fiir eine Uber-
gangsform zweier Organismen gehalten. Der gleichen Ansicht ist Maier in Bergey's Manual
(1974), der einen ahnlichen Organism us im Schlamm des Erie-Sees (Kanada, USA) gefunden
hatte, der jedoch aus etwas breiteren Faden (1,0 (im und 2,0—4,5 (Am) zusammengesetzt
war.
Gattungen unsicherer taxonomischer Stellung:
3. Thiospirillopsis Uphof 1927
Zellen farblos, zu langen, einreihigen, regelmafiig schraubenformigen Faden
angeordnet; Segmentierung ohne Farbung schlecht sichtbar. Terminalzellen
184 ■ Gleitende Bakterien - Thionema
abgerundet. Metabolismus nicht bekannt; wahrscheinlich mikroaerophiler Or-
ganismus mit Respirationsmetabolismus. Protoplasma mit einer grofien Zahl
von Schwefelglobuli; ohne photoassimilierende Pigmente. Bewegung charakte-
ristisch: durch Oszillation des oberen Fadenendes wird eine Drehung der Faden
um ihre Langsachse erzielt (ahnlich einem sich drehenden Korkzieher). Im
ganzen der Blaualgen-Gattung Spirulina ahnlich.
Wichtigste Literatur: Uphof 1927, Bergey's Manual 1957
Eine einzige Art:
Thiospirillopsis floridana Uphof 1927 (Fig. 102)
Mit den Merkmalen der Gattung.
Faden 2,0-3,0 (im breit, 20-450 (im lang (auch linger), Segmente 3,0-5,0 (im
lang.
Im sandigen Boden von Schwefelquellen oder im Siifiwasser mit geniigend H2S-
Gehalt. Wahrscheinlich auch im Meereswasser vorkommend. Ursprunglich in
den Schwefelquellen von Wekiwa Springs und Palm Springs (Florida, USA)
gefunden.
Die Beschreibung dieses Organismus ist unzureichend; weitere Untersuchungen
sind erforderlich.
4. Thionema Kolkwitz 1938
Bildet vielzellige, unverzweigte Faden, deren unterer Teil von einer festen,
deutlichen Scheide bedeckt ist. Scheiden insbesondere in ihrem oberen Teil
hellbraun, rauh, oft mit anklebenden Detrituskornern. Farbung durch Eisenver-
bindungen verursacht; ohne Eisen sind die Scheiden hell und farblos. Schon an
kleinen, keimenden Faden werden die an der Basis gewohnlich konisch verjiing-
ten Scheiden gebildet, Faden mit dem basalen Ende direkt an einer festen
Unterlage haftend, manchmal an der Basis hakenformig gebogen, aber immer
ohne Gallertpolster. Einzelne Zellen langer als breit, oder im optischen Langs-
schnitt quadratisch. Faden ohne Scheide morphologisch nur schwer von Sphae-
rotilus zu unterscheiden. Faden ohne Pigmente. Protoplasma gewohnlich mit
einer groCen Menge von Schwefeltropfchen, so dafi die Zellen ganz schwarz
erscheinen. Schwefeltropfchen in Reihen angeordnet oder unregelmafiig ver-
teilt.
Nach Kolkwitz (1938) ein autotropher Organismus, der Schwefelwasserstoff zu
elementarem Schwefel oxydiert.
Wahrscheinlich handelt es sich jedoch, wie bei anderen Vertretern dieser Fami-
lie, um eine mixotrophe Ernahrungsweise. Vermehrung durch Fadenfragmenta-
tion, aber auch durch Teilung einzelner Zellen.
Wichtigste Literatur: Kolkwitz 1938
Eine einzige Art:
Thionema vaginatum Kolkwitz 1938 (Fig. 103)
Mit den Merkmalen der Gattung.
Faden gewohnlich 300-700 (im, ausnahmsweise bis zu 1 mm lang, 1,5-2,0 (im
breit; Scheiden meistens 200-300 (im lang, im oberen, breitesten Teil 3,6-
4,0 (im breit; Zellen 2,0 X 4,0 (im grofi.
Bisher nur bei Teltow im Teltowkanal (DDR) gefunden, in grofieren Mengen an
den Ufern, insbesondere auf Beton- und Holzwanden, gemeinsam mit Thio-
thrix. Ganz besonders auf Amblystegium und Cladophora graugelbe bis grau-
weisse Uberziige bildend. Wahrscheinlich ein recht verbreiteter, doch wenig
beachteter Organismus.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@tambler.ru
Leucotrichaceae ■ 185
Fig. 103. Thionema vaginatum - verschiedene Fadenformen, a, d Faden mit
Schwefeltropfchen, b, c verschieden lange Hiillen an Faden ohne
Schwefeltropfchen, e keimender Faden, / Beginn der Kapselbildung, g Einschniirung des
Fadenfragmentes, h zerrissene Kapsel auf einem Faden ohne Schwefeltropfchen,
i leere Kapsel (nach Kollkwitz, 1924. - 500x).
3. Familie Leucotrichaceae Buchanan 1957
Kurze, zylindrische bis stabchen- oder eiformige Zellen, die lange, farblose,
unverzweigte, strukturell und funktionell polarisierte Faden bilden; letztere
entweder der ganzen Lange nach gleich breit oder dem apikalen Ende zu etwas
186 • Gleitende Bakterien - Leucothrix
verjiingt. Am basalen Teil gewohnlich mit einem Gallertpolster, mit dem sie an
festem Substrat oder einem Wirtsorganismus festhaften. Einzelne Zellen in den
Faden sterben gelegentlich ab und autolysieren, wodurch sogenannte Nekridien
entstehen. Faden mit feinen Scheiden, die erst nach spezieller Farbung des
Praparates sichtbar werden. Wahrscheinlich im nativen Praparat breiter als im
gefarbten. Am apikalen Ende bilden die Faden Gonidien (Reproduktionszellen),
die sich chemotaktisch zu strahlenformigen Gebilden (Rosetten) ansammeln.
Unter natiirlichen Bedingungen konnen sie nur selten beobachtet werden, in
kunstlichen Kulturen dagegen haufig. In nahrstoffreichen Medien werden kno-
tenartige Strukturen gebildet. Vermehrung durch Gonidien oder Hormogo-
nien.
Streng aerobe, typische Wasserorganismen mit chemoorganotropher bis chemo-
lithotropher Ernahrungsweise.
Nach Pringsheim (1949) sollen sie farblose Parallelen zur Familie Oscillatoriaceae darstellen.
Dies ist jedoch aufierst problematisch, da sich die Blaualgen nicht durch Gonidien fortpflan-
zen. Im wesentlich spricht daher die Mehrzahl der Merkmale dafiir, dafi es sich um
apochlorotische Blaualgen der Familie Rivulariaceae handelt. Peskov (1948) stellt sie
irrtiimlicherweise gemeinsam mit Caryophanon zu den Caryophanales.
Typus familiae: Leucothrix Oersted 1844
Bestimmungsschliissel der Gattungen
la Festhaftende Trichome, in H2S-haltigem Medium nicht mit Schwefeltropf-
chengefiillt, Querwande deutlich 1. Leucothrix (S. 186)
lb Festhaftende Trichome, in H2S-haltigem Medium mit Schwefeltropfchen
gefullt, manchmal so stark, dafi die Querwande undeutlich sind
2.Thiothrix(S. 190)
1. Leucothrix Oersted 1844
Stabchenformige bis zylindrische Zellen, die deutlich gegliederte, lange, oft
unregelmafiig gebogene oder gewellte unverzweigte Faden bilden. Sie sind
farblos und haben deutliche Querwande. Altere Faden sind an der Basis erwei-
tert und verjungen sich gegen das apikale Ende. Einzelne Zellen autolysieren
manchmal in den Faden, so dafi Nekridien entstehen. Dies bestatigt die vielzelli-
ge Struktur der Faden. Nach Brock (1969) ohne typische Scheide, obwohl es
manchmal (fehlende Zellen in den Faden) scheint, dafl eine Scheide gebildet
wird.
Harold und Stanier (1955) stellten fest, daK die Faden in Reinkulturen keine Scheide bilden,
geben jedoch zu, dafi unter natiirlichen Bedingungen eine solche vorhanden sein kann.
Pringsheim (1957) gibt an, dafi Scheiden nicht einmal in Praparaten, die mit Nigrosin negativ
gefarbt wurden, sichtbar waren. Sie treten nur dann in Erscheinung, wenn im nativen
Praparat kleine bewegliche Bakterien vorhanden sind, die dann bei der Bewegung an die
Scheiden anstofien. Scheide ungefahr 3 mal breiter als der Faden. Mit Methylenblau gefarbt
ist die Scheide hellrosa, der Faden jedoch indigoblau, wodurch eine Ahnlichkeit mit
Sphaerotilus natans entsteht. Die Scheide ist gelatineweich, so daK der Faden in wachstums-
fahige Fragmente zerteilt werden kann. Obwohl Brock und Conti (1969) auch bei Untersu-
chungen mit dem Elektronenmikroskop keine Scheide fanden, geben sie zu, dafi manche
Stamme eine solche haben.
Die Faden verflechten sich oft zu zopfartigen Gebilden, die dichte Knauel
bilden. Sie konnen auch dichte Biindel bilden, die aus einigen hundert parallel
angeordneten Faden mit schnurartiger Struktur bestehen. Snellen und Raj (1970)
stellten fest, dafi sich diese Strukturen bei Kalziummangel im Milieu bilden. In
den schnurartigen Strukturen kommt es zu sa^Sartigen Ausbuchtungen der
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leucothrix • 187
Zellwand, wodurch die Zellen verschiedener Faden physiologischen Kontakt
gewinnen. Manchmal tritt auch eine Fusion der Zellen ein. In Reinkulturen auf
Medien mit hoherem Anteil an organischen Stoffen entstehen an den verflochte-
nen Faden morphologisch ungewohnliche, knotenartige Gebilde. Mit dem
Altern der Kulturen nimmt die Zahl dieser Bildungen zu; die dort auftretenden
Faden sind dichter verflochten und schliefilich vereinigen sich die Zellen im
Knotengebiet und bilden coenocytische, zwiebelartige Gebilde.
Aufierdem entstehen interkalar in den Faden in unregelmafiigen Abstanden grofie Zellen
oder Anhaufungen mehrerer grofier Zellen, die an Schwellungen erinnern. Nach Pringsheim
(1957) kommensie dortvor, wo die Faden gebrochen oder scharf abgebogen sind; sie sollen
eine Art von «Heilung» der Faden darstellen, die durch die Plasmolyse der zerstorten Zellen
hervorgerufen wird. Der ausgetretene Zellinhalt umgibt sich mit einer neuen plasmatischen
Membran. Solche Schwellungen entstehen unter Bedingungen, unter denen es zu keiner
Entstehung knotenartiger Strukturen kommt. Wahrend die Septen im Faden bei normalen
Zellen senkrecht zur Langsachse des Fadens orientiert sind, sind die Zellsepten bei diesen
Gebilden in beliebigen Winkeln angeordnet. Sie treten bisweilen auch isoliert auf, und zwar
dann, wenn der Faden an beiden Enden dieser Gebilde abbricht. An den Enden langer Faden
konnen spindelformige oder keulen- bis kegelformige quergestreifte Gebilde auftreten. Sie
alle entstehen entweder durch Verschmelzen der Nachbarzellen in der Fadenbiegung oder
durch Vergrofierung einer Zelle. Nach Snellen und Raj (1970) entstehen sie im Laufe einiger
Stunden. Nach Brock (1964) gehen aus ihnen neuen Faden hervor.
Die Faden haften mit Hilfe wenig deutlicher Gallertpolster an verschiedenen
Unterlagen: entweder an der Grenzschicht des Wassers, an den Wanden von
Kulturgefafien oder an Detritus. Am haufigsten kommen sie jedoch als Epiphy-
ten an verschiedenen makroskopischen Algen vor. Die Gallertpolster werden
erst nach spezieller Farbung sichtbar. Pringsheim (1957) empfiehlt Farbung mit
Kongorot, Brocks (1969) mit Fluorochrom-Primulin und Beobachtung im
Fluoreszenzmikroskop bei blauem Licht (Gallertpolster leuchten rot).
Einzelne Terminalzellen vollkommen entwickelter Faden runden sich ab und es
entstehen aus ihnen ovoide bis kugelige Gonidien, die sich durch aktive
Bewegung vom Faden trennen. Vor der Abtrennung der Gonidien beginnt sich das
Fadenende wellenformig zu bewegen. Die Gonidien fallen entweder einzeln ab,
oder bilden (ofters) kurze Ketten. Diese zerfallen dann manchmal in einzelne,
aktiv bewegliche Gonidien. Geifieln wurden jedoch nicht gefunden. Bei geeigne-
ter Kalziumkonzentration im Medium, niedriger Konzentration der Nanrstoffe
und geniigender Anzahl der Gonidien bilden diese, wahrscheinlich
chemotaktisch, sternformige Rosetten. Dies ist ein Teil des Entwicklungszyklus. Jedoch
ist das Wachstum unabhangig von der Bildung solcher Rosetten, denn auch
einzelne kurze Faden sind imstande zu wachsen. Die Gonidien in den Rosetten
sind durch ihre Gallertpolster verbunden, die aus einer bisher unbekannten
Substanz bestehen. Auf festen Nahrboden entstehen infolge der Unbeweglich-
keit der Gonidien keine Rosetten.
Die Rosettenbildung beginnt zunachst mit einer Anhaufung der Gonidien zu knauelartigen
Gebilden, die jedoch auch wieder zerfallen konnen. Spater setzen sie sich mittels der
entstehenden Gallertpolster fest. Jede Gonidie keimt dann zu einem vielzelligen Faden, der
so lange wachst, bis er selbst wieder Gonidien abstofit. Dies dauert ungefahr 12 Stunden. Die
Rosettenbildung hangt von der Zahl der Medium vorhandenen Gonidien ab. Bei Abstanden
von iiber 60 jun zwischen den einzelnen Gonidien ist deren chemotaktischer Einflufi schon
so begrenzt, dafi es zu keiner Rosettenbildung kommt. In solchem Fall ehtwickelt sich ein
selbstandiger Faden. Das beweist, dafi die Rosetten sich nicht durch Teilung der Basalzelle
(Gonidie) in mehrere Ebenen bilden. Nach Johnson, et al. (1971) keimen die Gonidien bei
geringem Nahrungsangebot zu kurzen, steifen, querwandlosem aus. Manchmal kommt es
nach Pringsheim (1957) zur Entwicklung scheinbar verzweigter Faden, die dadurch
entstehen, dafi sich die Gonidien an keimende Faden in der Rosette ansetzen (sie dringen jedoch
nicht bis in die Rosettenmitte vor) und so die Bildung einer neuen, sekundaren Rosette
anregen.
188 • Gleitende Bakterien - Leucothrix
In den Zellen wird niemals Schwefel abgelagert. In alterer Literatur (Molisch
1912) wird angegeben, dafi Schwefeltropfchen bei Vorhandensein geniigender
Sauerstoffmengen an der Fadenoberflacne abgelagert werden. Harold und Sta-
nier (1955) und spater auch eine Reihe weiterer Autoren, bewiesen aber in
Kulturversuchen, dafi die Zellen nicht imstande sind, Schwefelwasserstoff zu
oxydieren.
Sie sind streng aerob, chemoorganotroph. Ihr Metabolismus ist ausschliefilich
respiratorischer Art. Als Kohlenstoffquelle verwerten sie eine Anzahl einfacher
organischer Stoffe. Mangel an Kalziumionen hat die Anderung der physiologi-
schen und morphologischen Eigenschaften zur Folge. Der Bedarf an Kalzium ist
so spezifisch, dafi man dieses auch nicht durch Magnesium oder andere Ionen
ersetzen kann. Auch Erhohung der Nahrstoffkonzentration im Medium bewirkt
morphologische Veranderungen. Bei hohen Konzentrationen bilden sich lange
Faden und die Gonidienbildung wird wesentlich verzogert. Rosetten werden
kaum gebildet, hingegen entstehen oft schnurartig verflochtene Faden mit
knotenartigen Strukturen. Natriumchlorid ist fur das Wachstum dieser Art
unbedingt erforderlich. Die optimale Konzentration betr'agt 1,5-1,6%, jedoch
werden auch Konzentrationen von 0,3-6,0% vertragen; iiber 3,0% treten
morphologische Veranderungen ein. Das Temperaturoptimum liegt bei 25 °C;
das Maximum betragt 30-35 °C. Minimales Wachstum ist noch bei 0 °C
moglich. Stamme, die von warmen Standorten isoliert wurden, wachsen jedoch
nicht unter 15 °C.
In flussigen Nahrlosungen wachsen sie in Form langer Faden, die sich an den
Gefafiwanden festsetzen, sowie auf der Grenzschicht der Wasseroberflache. Auf
festen Boden bilden sie kleine Kolonien mit einem maximalen Durchmesser von
2 mm, die aus einzelnen Faden zusammengesetzt sind, deren Anordnung an das
Papillarmuster der Fingerspitzen erinnert. Die Kolonien sind kompakt, wo-
durch sie sich von den Kolonien der Vitreoscillaceae unterscheiden.
Fortpflanzung durch Gonidienbildung. Die Faden entwickeln sich durch die
Teilung der Gonidienzellen in einer Ebene. Die Teilung beginnt mit der Bildung
einer transversalen Querwand, die senkrecht zur Langsachse des Fadens orien-
tiert ist. Alle Zellen im Faden, nicht nur apikalen Teils, sind imstande sich zu
teilen. Faden unbeweglich. Gonidien im flussigen Medium aktiv beweglich mit
typische gleitender Bewegung auf der Unterlage. Auf festen Nahrboden sind die
Gonidien unbeweglich, werden jedoch nach Ubertragung in ein fliissiges
Medium beweglich. Wahrscheinlich ist der Zeitabschnitt ihrer aktiven Beweglich-
keit zeitlich begrenzt.
Wichtigste Literatur: Molisch 1912, Nadson und Krasil'nikov 1932, Krasil'ni-
kov 1949, Harold und Stanier 1955, Oppenheimer 1955, Bergey's Manual 1957,
1974, Pringsheim 1957, 1966, Lewin 1959, Brock 1964, 1966, 1967, 1969,
Anderson und Heffernan 1965, Brock und Mandel 1966, Cyrus Z. 1968, Brock
und Conti 1969, Kelly und Brock 1969, Snellen und Raj 1970, Johnson et al.
1971, Cyrus Z. und Sladecek 1973.
Eine einzige Art:
Leucothrix mucor Oersted 1844 (Fig. 104)
Beggiatoa oerstedii Rabenhorst 1865, Beggiatoa mucor (Oersted 1844) Trevisan
1879, Leptotrichia mucor (Oersted 1844) Trevisan 1889, Chlamydothrix longissi-
ma Molisch 1912, Pontothrix longissima (Molisch 1912) Nadson et Krasil'nikov
1932, Leptothrix longissima (Molisch 1912) Prevot 1955, Leucothrix cohaerens
Pringsheim 1957, Leucothrix dissolvens Pringsheim 1966, Leucothrix laqueus
Pringsheim 1966
Mit den Merkmalen der Gattung.
Faden sehr lang, oft iiber 100 u,m; manchmal sogar 5000 |im. An der Basis 3,0-
Scarmed &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leucothrix • 189
3,5 \im, an der Spitze 1,5-2,0 [im breit. Ausmasse sehr variabel. Einzelne Zellen
1,0-1,5 (im lang.
Nach Meinung der meisten Spezialisten treten sie nur im Meerwasser mit
faulendem Pflanzenmaterial oder als Epiphyten auf bestimmten makroskopi-
Fig. 104. Leucothrix mucor - a vegetative Faden bei guten Ernahrungsbedin-
gungen - (nach Pringsheim, 1957. - 1000 X), b interkalare Bildung grofier Zellen,
die wie ein Geschwulst am Faden aussehen (nach Krasil'nikov, 1949. - 1000X), c
ein Teil des Fadens mit beginnender Bildung der Reproduktionsstadien - (nach
Pringsheim, 1957. - 1000X), d differenzierte Apikalteile des Fadens in der
Reproduktionszelle - Hormogonie - (nach Pringsheim, 1957. - 1000X), e
verschiedene Formen einer mehrzelligen Hormogonie - (nach Pringsheim, 1957.
- 1000x),/eine aus zwei Zellen bestehende Hormogonie- (nach Pringsheim,
1957. - 1000X), g einzellige Hormogonien - (nach Pringsheim, 1957. - 1000X),
h alter Faden mit aufsitzenden jungen Faden - (nach Pringsheim, 1957. -100 X), i
Rosetten - (nach Pringsheim, 1966. - 1000x),; Faden mit Gallertpolster- (nach
Pringsheim, 1966. - 1000X), k Gruppe sessiler Faden mit gemeinsamen
Gallertpolster - (nach Pringsheim, 1966. - 1000X).
190 • Gleitende Bakterien - Thiothrix
schen Meeresalgen, vor allem Rotalgen auf. Wahrscheinlich wird die Wirtsalge
dabei nicht beschadigt. Sie sind im litoralen Bereich, vor allem in der Brandungs-
zone aufierst verbreitet. Ihr Verbreitungsgebiet reicht von den tropischen Ozea-
nen bis zu den Polarmeeren. Beger und Bringman (1953) schreiben diesem
Organismus im Meer die gleiche Bedeutung zu, die Sphaerotilus nutans im
SufTwasser hat. Sehr oft trifft man ihn als Epiphyt an benthischen Schalentieren
oder an befruchteten Eiern von Rochen, Dorschen u. a. Obwohl Brock (1966)
diese Art als ausgesprochenen Meeresorganismus betrachtet, existieren Berichte
uber seine Isolierung aus Abwassern. Razumov (unpubl., zit. Krasil'nikov 1949)
isolierte ihn aus stadtischen Abwassern. Ebenso geben Cyrus Z. (1968), Cyrus
Z. und Sladka (1970) Cyrus Z. und Sladecek (1973) an, dafi er oft in durch
organische Stone verunreinigtem Siifiwasser oder in Abwassern, insbesondere
im Belebtschlamm biologischer Klaranlagen vorkommt. Da diese Funde nur auf
Grund der morphologischen Eigenschaften identifiziert wurden, ist eine Uber-
priifung der Angaben im Labor notwendig. Auch Eikelboom (1975) betrachtet
diese Angaben als unrichtig und ist der Meinung, dafi diese Organismen mit dem
von ihm provisorisch als «Typ - 021 N» beschriebenen Organismus identisch
sind.
Morphologisch ist diese Art den Faden von Thiothrix, die keine Schwefelglobuli
enthalten, sehr ahnlich.
Die morphologischen und physiologischen Eigenschaften hangen in bedeutendem MaKe
vom Wachstumsmilieu ab. Pringsheim (1957, 1966) wies auf entscheidende Unterschiede
zwischen den einzelnen Isolaten hin. Dies erschwert wesentlich die morphologische Be-
schreibung und taxonomische Einordnung. Die Polymorphic ist wahrscheinlich auch die
Ursache, daK der gleiche Organismus unter unterschiedlichen Namen von verschiedenen
Autoren beschrieben wurde.
Ahnelt auffallend der Blaualge Lynghya kuetzingii. Pringsheim (1966) ist daher der
Meinung, daK man diese Organismen zu den apochlorotischen Blaualgen stellen sollte.
la. Leucothrix cohaerens Pringsheim 1957 (Fig. 105)
Lange breite und feste Faden von oft bizarrer Gestalt bildend. Fragmentierung nicht so
haufig wie bei Leucothrix mucor. Faden bilden Nekridien, an deren Stelle die Faden
zerfaflen. Rosettenformige Kolonien verhaltnismaKig selten; Gallertpolster seltener sicht-
bar. Beim Bruch des Fadens bilden sich interkalar groKe Zellen bizarrer Form, was bei
Leucothrix mucor nicht so haufig auftritt. Auf Nahrboden bilden sie im Laufe von 24
Stunden fast unbegrenzt lange Faden, die ziemlich koharent sind. Auf sehr reichen Medien
entstehen die Gondien sehr spat oder praktisch iiberhaupt nicht. Fortpflanzung durch
Gonidien.
Faden bis 6,0-7,0 (Am breit und einige mm lang.
Kommt in durch organische Stoffe verunreinigtem Meerwasser und auf faulendem Pf lanzen-
material vor. Im Hafen von Split (Jugoslawien) in der Miindung des Abflufikanals der
Schwefelthermes gefunden.
Pringsheim ist der Meinung (1966), daK diese Art als Chlamydothrix longissima vonMolisch
(1912) und unabhangig davon von Nadson und Krasil'nikov (1932) als Pontothrix longissima
beschrieben wurde. Er meint auch, daK sie mit Phragmidiothrix multiseptata identisch sei.
lb. Leucothrix dissolvens Pringsheim 1966
Bildet lange Faden, die eine Neigung zu auffallendem Zerfall in kurze Zellketten zeigen.
lc. Leucothrix laqueus Pringsheim 1966
Sehr lange Faden, die sich zu einer groKen Zahl von Schlingen verwickeln.
2. Thiothrix Vinogradskij 1888
Zylindrische bis stabchenformige Zellen, die unbewegliche, deutlich segmen-
tierte, unverzweigte Trichome mit klar abweichenden basalen und apikalen
Teilen bilden. Diese sind von einer feinen, dunnenSchleimscheide umgeben, die
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiothrix ■ 191
allmahlich dicker wird. Mit einem festen Schleimplattchen an festen Unterlagen
haftend. In H2S-reichem Milieu sind die einzelnen Zellen mit Schwefeltropfchen
gefiillt, manchmal so stark, dafi die Segmentierung des Fadens undeutlich wird.
In H2S-armen Medien verschwinden die Schwefeltropfchen sehr rasch, so dafl
Fig. 105. Leucothrix mucor- verschiedene Entwicklungsstadien der beigeordne-
ten Art Leucothrix cohaerens, a Teil eines sehr langen Fadens mit unregelmaflig
gebildeten Zellen, b Fadenteile mit Bildung niedriger, teilweise abgerundeter
Zellen, c Nekridienbildung in gesunden Faden, d Fadenteil, in dessen Kriim-
mung knotenformig angeschwollene Strukturen entstehen, e vielzellige Hormo-
gonie, / mehrzellige Hormogonie, g einzellige Hormogonie, h interkalare
Kettenbildung, die in kurzer Zeit in Hormogonien zerfallt, i selten vorkommen-
de rosettenformige Hormogonien mit Gallertpolstern.
192 • Gleitende Bakterien - Thiothrix
die Organismen irrtumlicherweise fiir Leucothrix gehalten werden konnten, der
sie morphologisch sehr ahnlich sehen. Ebenso wie die vorige Gattung bilden sie
Rosetten, die durch chemotaktisch bedingte Anhaufune der Gonidien zu knau-
elformigen Gebilden, in denen die einzelnen Gonidien zu Faden keimen,
entstehen. Die Gonidien werden am apikalen Ende des Fadens gebildet. Zu-
nachst trennt sich ein 8,0-10,0 urn langer Teil ab, der jedoch eine Zeitlang in der
Scheide verbleibt. In dieser Entwicklungsperiode zeigt der Faden eine zitternde
Bewegung, die bald in eine Pendelbewegung iibergeht. Damit beginnt der
terminale Teil sich von der Fadenachse oft so stark abzubeugen, dafi er parallel zu
dieser verlauft. Das Fadenfragment setzt sich dann an einer Unterlage test, wobei
sich der apikale Teil des Mutterfadens immer mehr abbiegt, bis die Scheide, die
bisher die beiden Fadenteile verband, reifit. Der Mutterfaden zieht sich dann,
wie eine gespannte Sehne, zuriick. Die Gonidien bleiben eine Weile beweglich
(1-3 Stunden). Dann setzen sie sich an einer Unterlage fest und beginnen zu
wachsen.
Allem Anschein nach obligatorisch chemoautotrophe Organismen; doch wurde
dies noch nicht an Reinkulturen iiberpriift. In Rohkulturen werden radiale
Kolonien gebildet, in denen die Faden strahlenformig aus der Mine hinauswach-
sen. Fortpflanzung durch Gonidien, die morphologisch an Bazillen erinnern.
Faden unbeweglicn, an einer Unterlage festsitzend. Gonidien nach ihrer Tren-
nung vom Faden durch spezifische Gleitbewegungen beweglich, solange sie
keine Gallertpolster bilden und sich festsetzen.
Vor allem in stromendem Sufi- und Salzwasser mit verhaltnismafiig hoher H2S-
Konzentration vorkommend. Im Siifiwasser am haufigsten in Schwefelquellen
vorhanden. Oft auch in Abwassern oder im Belebtschlamm biologischer Klaran-
lagen. Im Meerwasser oft an der Oberflache verschiedener Algen festsitzend.
Physiologisch sind diese Organismen sehr wenig untersucht, da bisher keine
Reinkulturen erzielt wurden. Deshalb werden die einzelnen Arten nach den
morphologischen Merkmalen, insbesondere nach der Fadenbreite bestimmt.
Dieses systematische Merkmal ist jedoch unzureichend, da die Fadenbreite recht
variabel ist. Manche Arten iiberlappen sich und einige Arten miissen als unsicher
angesehen werden. Auch die Einteilung nach dem Vorkommen (Salz- oder
Siifiwasser) ist sehr problematisch.
Faden dieser Organismen konnen mit manchen Arten der Gattung Beggiatoa
verwechselt werden. Sie unterscheiden sich jedoch vor allem dadurch, dafi die
Faden von Beggiatoa beweglich sind. Pringsheim (1949) reiht Thiothrix in eine
selbstandige Familie Thiotrichaceae ein.
Typus generis: Thiothrix nivea (Rabenhorst 1865) Vinogradskij 1888
Wichtigste Literature Rabenhorst 1865, Vinogradskij 1888, Trevisan 1889,
Hansgirg 1890, Miyoshi 1897, Migula 1900, Molisch 1912, Peterson 1921,
Bavendamm 1924, Koppe 1924, Uphof 1927, Ellis 1932, Klas 1936, Peskov 1948,
Bergey's Manual 1957,1974, Pringsheim 1949, Harold und Stanier 1955, Rodina
1963, Bland und Staley 1978.
Bestimmungsschliissel der Arten
la Organismus hauptsachlich im Siifiwasser vorkommend 2
lb Organismus hauptsachlich im Meerwasser vorkommend 7
2a Faden farblos 3
2b Faden intensivviolettgefarbt ll.Th. violacea
3a Faden in ihrer gesamten Lange von zylindrischen Zellen gebildet 4
3b Faden werden teilweise oder in ihrer gesamten Lange von kugelformigen,
ovoiden oder spindelformigen Zellen gebildet 6
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiothrix • 193
4a Faden breiter als 1,5 |xm, in der Regel in der Mittelpartie 1,7 |xm
1. Th. nivea
4b Faden schmalerals 1,5 |xm 5
5a Trichome imDurchmesserungefahr 1,0 [im 2. Th. tenuis
5b Trichomdurchmesserunter 0,5 urn
3. Th. tenuissima oder 4. Th. minutissima
6a Faden mit ovoiden und spindelformigen Zellen 5. Th. undulata
6b Faden mit kugeligen Zellen oder Zellen, die in ihrer Form an die Glieder einer
Fahrradkette erinnern 6. Th. torquis
7a Trichomdurchmesseruber 15 |xm 7. Th. voukii
7b Trichomdurchmesserunter 1,5 urn 8
8a Trichomdurchmesseruber 1,8 |xm 9
8b Trichomdurchmesserunter 1,8 um 8.Th. marina
9a EinzelneFadensegmenteca25 urn(19-33 urn)lang . 9. Th. longiarticulata
9b Einzelne Fadensegmenteungefahr 1,0 umlang 10. Th. annulata
1. Thiothrix nivea (Rabenhorst 1865) Vinogradskij 1888 (Fig. 106)
Hygrocrocis nivea Kiitzing 1843, Beggiatoa nivea Rabenhorst 1865
Lange und alte Trichome an der Basis breit, sich zum Apex hin gleichmafiig
verjungend. Kurze Faden hingegen der ganzen Lange nach gleich breit, mit einer
diinnen Gallertscheide. Segmentierung nicht sichtbar solange die Faden Schwe-
feltropfchen enthalten. In der Nahe der Spitze sind die Segmente langer und zur
Basis hin kiirzer. An der Basis sind die Faden mit Gallertpolstern versehen,
durch die sie an einer Unterlage festhaften.
Vermehrung durch Gonidien oder durch kurze Fragmente, die aus 2 bis 4 Zellen
zusammengesetzt sind. Diese Fragmente bleiben entweder an der Unterlage
neben den Mutterfaden oder direkt an den Mutterfaden haften, wodurch ring-
formige Gebilde entstehen.
Altere und lange Faden sind an der Basis 2,0-3,0 urn, in der Mine 1,7 urn und an
der Spitze 1,4-1,5 urn breit. Jiingere und kurze Faden sind ungefahr 1,7 urn
breit. Einzelne Zellen im Apikalteil 8,0-16,0 urn lang. Fadenfragmente, durch
die sich der Organismus fortpflanzt, erreichen eine Lange von 15-r40 urn.
Fadenfragmente sind nach Bland und Staley (1978) Gonidien, die schon
Vinogradskij (1888) beschrieben hat. Durch sie pflanzt sich der Organismus fort; sie
erreichen eine Lange von 15-40 urn. Scheide bis 60 urn breit.
Im Siifiwasser, wo Schwefelwasserstoff durch Faulnis organischer Stoffe entsteht
(faulendes Wasser, Abwasser, faulende Algen), oder in Schwefelquellen
vorkommend. Wahrscheinlich eine kosmopolitische Art.
Miyoshi (1897) beschreibt eine Varietat «verticillata». Ellis (1932) verbindet mit dieser Art
Thiothrix tenuis und Thiothrix tenuissima, da sie im gleichen Medium auftreten und er die
Breitenunterschiede bei den Faden nicht fiir mafigebend halt. Rodina (1963) fand in den Seen
in der Umgebung des Ladozskoe ozero (UdSSR) etwas abweichende Organismen. Direkt
neben den Gallertpolstern wurden im Faden einige kugelige Zellen gefunden, auf die lange,
zylindrische Zellen folgten, die bis zu 5 (Am breit waren. Nach diesen verschmalerten sich die
Zellen sichtbar zum apikalen Fadenteil hin.
2. Thiothrix tenuis Vinogradskij 1888 (Fig. 107)
Beggiatoa alba var. uniserialis Engler 1883, Leptotrkhia tenuis (Vinogradskij
1888) Trevisan 1889 (non Leptotrichia tenuis (Weinberg et al. 1937) Prevot 1940)
Trichome gleichmafiig breit, oft dichten Bewuchs bildend, der an Filz erinnert.
Einzelne Faden segmentiert. Faden meist 1,0-1,1 urn breit, Fadensegmente 4,0-
5,0 |xm lang.
In mit H2S-haltigem Siifiwasser, vor allem aber in Schwefelquellen. Wurde auch
196 • Gleitende Bakterien - Thiothrix
5. Thiothrix undulata Rodina 1963 (Fig. 108)
Sehr lange Faden mit abgerundeten Enden, aus langlichen Zellen zusammenge-
setzt. Zellen ellipsoidisch oder spindelformig. Mit charakteristischen Gallertpol-
stern. Fortpflanzung durch Teilung mit Scheidewandbildung, manchmal auch
Teilung durch Spaltung. An einer Unterlage festhaftend, unbeweglich.
Zellange variabel, meistens sind die Faden 3,0-4,0 nm x 8,0-14,0 \x,m grofi.
Im Detritus von Siifiwasserseen vorkommend. Aus kleinen Seen in der Umge-
bung von Ladozskoe ozero (UdSSR) beschrieben.
109
108
Fig. 108. Thiothrix undulata - verschiedener Habitus der Faden - (nach Rodina,
1963; 1965. - 1000x). Fig. 109. Thiothrix longiarticulata - verschiedenes
Aussehen der Faden - (nach Rodina, 1963. - lOOOx).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiothrix • 197
6. Thiothrix torquis Rodina 1963 (Fig. 112)
Thiothrix torquis forma minor Rodina 1963
Trichome an ihrer Basis mit einer ovalen Zelle, die ein typisches Gallertpolster
bildet und mit diesem an einer Unterlage festhaftet. Sie enthalt dichteres Proto-
plasma und besitzt eine verdickte Zellwand. Dann folgen im Faden kugelige,
manchmal ovale Zellen, die mit Schwefeltropfchen gefullt sind. Sehr oft enthalt
der Faden in seinem grofiten Teil Zellen, die in ihrer Form an die Glieder einer
Fahrradkette erinnern. Faden sehr lang, meistens der ganzen Lange nach gleich-
mafiig breit.
Faden 5,0-8,0 \x,m breit.
Im Detritus von Siifiwasserseen und -wehren, in Staubecken und Fischteichen
vorkommend; in der UdSSR gefunden.
Rodina (1963) unterscheidet eine weitere Form, die jedoch der Leitart beigeordnet werden
kann:
6a. Thiothrix torquis forma minor Rodina 1963 (Fig. 112b)
Unterscheidet sich durch kleinere Zellen und dadurch, dafi in den Faden haufiger ovale oder
teilweise eingekerbte Zellen auftreten, die an die Glieder einer Fahrradkette erinnern. Zellen
3,0-4,0 urn breit.
7. Thiothrix voukii Klas 1936 (Fig. 110)
Trichome sehr breit und lane, der ganzen Lange nach gleichmafiig breit. Im
lebenden Zustand dicht mit Schwefeltropfchen gefullt. Segmentierung der Faden
dicht und auch an lebendem Material deutlich. Segmente grofitenteils langer als
breit; im optischen Langschnitt quadratisch. Auch bei hohem Schwefelgehalt
sind die einzelnen Zellen im Faden gut sichtbar. In der Regel sind die Faden an
den Querwanden leicht eingekerbt. Basalzelle meist tonnenformig erweitert.
Ahnliche Zellen konnen jedoch auch in der Mine des Fadens beobachtet werden
oder im apikalen Teil, wo sie gewohnlich das Anfangsstadium der Gonidienbil-
dung kennzeichnen. Terminalzelle deutlich abgerundet und etwas langer als die
folgenden Zellen. Faden mit ihrem basalen Teil an verschiedenen Algen oder
Detrituspartikeln festhaftend. Dichte, haarige bis filzige, weifie bis graue Belage
bildend. Bewegliche Faden bisher noch nicht beschrieben.
Trichome meistens 15-17 pirn breit; es kommen jedoch auch Trichome mit
30 pirn Breite vor. Segmente 15-30 \\m lang (am haufigsten 19-23 \x,m). Faden-
lange bis zu 10 mm.
Im Wasser mit H2S-Gehalt, bisher nur im Meerwasser gefunden. Urspriinglich
gemeinsam mit anderen Thiothrix-Arten in der Miindung des Abflufikanales der
Thermen der Schwefelbader in Split (Jugoslawien) gefunden.
Dem Habitus nach erinneren die Faden dieser Art an Beggiatoa mirabilis. Sie
unterscheiden sich jedoch dadurch, dafi sie nicht beweglicn sind und an einer
Unterlage festhaften.
8. Thiothrix marina Molisch 1912
Faden relativ kurz und diinn, der ganzen Lange nach gleichmafiig breit. Nicht
selten in Form weifier Filzbelage in Meerestiefen, in denen genugend Schwefel-
wasserstoff und faulendes Pflanzenmaterial vorhanden sind, vorkommend. Oft
sind die Faden an den basalen Teilen durch die Gallertpolster miteinander
verbunden, so dafi sie strahlenformige oder strauchartige Kolonien bilden.
Faden 0,8-1,3 jim breit und 130-300 urn, ausnahmsweise bis 500 \xm lang.
Im Meereswasser mit faulendem Pflanzenmaterial (Zostera) gefunden.
Nach Bavendamm (1924) und Krasil'nikov (1949) handelt es sich nur um eine
Form von Thiothrix tenuis, die im Salzwasser auftritt.
198 ■ Gleitende Bakterien - Thiothrix
a b
110
Fig. 110. Thiothrix voukii - a, b Scheitel verschieden breiter, dicht mit
Schwefeltropfchen gefiillter Faden, c Basalteil der Faden mit Gallertpolstern, d abnormale
Zellen im Faden (nach Klas, 1936. - 500x).
9. Thiothrix longiarticulata Klas 1936 (Fig. 109)
Trichome der ganzen Lange nach gleichmafiig dick, einzelne Zellen immer langer
als breit. Von Thiothrix annulata unterscheidet sich diese Art durch die gleich-
mafiige Breite der Faden, durch den Mangel an knotenartigen Schwellungen und
die auffallige Variabilitat in der Zellange. Manchmal findet man aber auch
Fadenstiicke mit gleichmafiig langen Zellen. Faden deutlich segmentiert, doch ist
die Segmentierung der Faden am besten nach Auflosung der Schwefeltropfchen
in Alkohol sichtbar.
Schwefeltropfchen meistens in der Mine der einzelnen Zellen und nicht an den
Zellwanden liegend, so dafi der Eindruck entsteht, als ob der Faden unterbro-
chen ware. Die mit Schwefel gefullten Zellen sind dunkelgriin bis schwarz,
wahrend die schwefelfreien Stellen farblos sind. Faden wie bei den iibrigen Arten
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiothrix • 199
durch Gallertpolster an einer Unterlage haftend. Apikale Fadenzellen stark
abgerundet. Die Art kommt sehr oft in grofien filzigen Massen vor und erinnert
an kleine oder grofiere Wattebausche. Fortpflanzung durch Gonidien wurde
bisher nur selten beobachtet. Bewegliche Stadien unbekannt.
Faden 3,3-6,6 \un (am haufigsten 4,2 \im) breit und 6-8, seltener 10 mm lang.
Einzelne Segmente erreichen eine Lange von 19,0-33,0 Jim.
Vor allem in Salzwasser, das Schwefelwasserstoff enthSlt, vorkommend. Ur-
spriinglich gemeinsam mit Thiothrix voukii und Thiothrix nivea auf faulenden
Algen, Detritus und besonders auf Blaualgen in der Mundung des Abflufikanals
der Schwefelthermalbader von Split (Jugoslawien) gefunden. Rodina (1963) fand
einen mit dieser Art ubereinstimmenden Organismus im Detritus der Seen, die in
der Nahe des Ladozskoe ozero (UdSSR) liegen.
Fig. 111. Thiothrix annulata- a auf Detritus aufsitzende Faden, b rosettenformi-
ge Formationen (nach Molisch, 1922. - 750x).
200 ■ Gleitende Bakterien - Thiothrix
lO.Thiothrix annulata Molisch 1912 (Fig. Ill)
Trichome lang bis sehr lang, an der Basis diinner und auch an der Spitze sich
verjiingend; mittels spezieller Gallertpolster an Detritus befestigt. Segmente sehr
kurz, mit einer grofien Anzahl sehr kleiner Schwefeltropfchen. Altere Trichome
sind mit Schwefeltropfchen so stark gefiillt, dafi die Segmente nicht voneinander
unterschieden werden konnen. In den Trichomen bilden sich manchmal schmale
ryi
m
m
I
I
m
1
113
112
Fig. 112. Thiothrix torquis - a Faden mit verschiedenen Zellformen, b die
«minor» Form (nach Rodina, 1963; 1965.-lOOOx). Fig. 113. Thiothrix violacea
- a Apikalteil der Faden, b ein Faden, an desen Apikalteil sich eine Gonidie
abgetrennt hat und noch durch Schleim mit dem Mutterfaden verbunden bleibt.
Die Schwefeltropfchen erscheinen wegen starker Lichtbrechung wie aus der
Zelloberflache hervortretend (nach Ellis, 1932. - lOOOx).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Vitreoscillaceae ■ 201
Zonen ohne Schwefeltropfchen neben solchen, die mit diesen Tropfchen dicht
gefiillt sind. Dadurch entsteht eine ringformige Trichomstruktur. Oft sind alte
Trichome gekriimmt oder an manchen Stellen ahnlich verdickt wie die Knoten an
Grashalmen. Junge Faden bilden strahlenformige Kolonien.
Rosetten.
Trichome 3,0-5,0 pirn (meist 5,0 pun) an der Basis nur etwa 2,0 pirn und an der
Trichomspitze 1,8 pirn breit. Lange iiber 5 mm. Fadensegmente kurz, nur
1,0 \xm lang, Gallertpolster ungefahr 3,5 [im.
Auf faulenden Algen, wo sie weifie bis graue Belage bilden. Im Siifiwasser wurde
diese Art bislang nicht gefunden, obwohl ihr Vorkommen auch dort wahr-
scheinlich ist. Urspriinglich im Meer bei Triest (Italien) gefunden. Bavendamm
(1924) fand sie an Algen in einem Salzwasserbrunnen in der Umgebung von
Berlin in Sperenberg (Brandenburg, DDR).
Unsichere Arten:
11. Thiothrix violacea Ellis 1932 (nomen provisorium) (Fig. 113)
Faden gleichmafiig breit, auf einer Unterlage festsetzend ohne spezielles
Gallertpolster. Querwande nur an alteren Faden oder bei Faden sichtbar; die keine
Schwefeltropfchen enthalten; bei jungen Faden kann auch eine Gallertscheide
vorkommen.
Plasma der Zellen homogen, mit gleichmafiig verteilten Schwefeltropfchen. Alte
Faden ohne Schwefelglobuli, jedoch mit einer grofien Zahl hohler Granula
unbekannter Herkunft. Zellplasma violett gefarbt.
Altere Faden vermehren sich durch terminale Teilung, wobei stabchenformige
Gonidien entstehen. Nach der Trennung bleibt der Kontakt der Gonidien mit
den Mutterfaden durch ein Schleimband erhalten, wobei die Scheide offen bleibt.
Jiingere Faden vermehren sich auch durch interkalare Teilung. Fortpflanzung
wahrscheinlich auch durch ellipsoidische Endosporen. Sie wurden als selbstan-
dige Zellen, die an der Scheide alter Faden angesetzt waren, beobachtet; Kei-
mung wurde jedoch nicht festgestellt.
In fliefiendem, von Abwassern verunreinigtem Wasser in Possil Marsh bei
Glasgow (Schottland) gefunden. Nach dem Bau sanitarer Einrichtuhgen an
diesem Flufi verschwand der Organismus; seither nicht wieder gefunden.
4. Familie Vitreoscillaceae Pringsheim 1949
Zellen zu farblosen, elastischen, flexiblen Faden vereinigt. An Arten der Gattung
Beggiatoa erinnernd, von denen sie sich dadurch unterscheiden, dafi sich niemals
Schwefeltropfchen in den Zellen anhaufen, auch wenn sie unter gleichen Bedin-
gungen wachsen. Morphologisch auch den Blaualgen der Gattung Oscillatoria
ahnlich, doch ohne Assimilationspigmente. Zellen wahrscheinlich ohne Zell-
wand (Pringsheim 1951), was ihnen eine erhebliche Biegsamkeit verleiht. Einige
Arten mit zylindrischen, andere mit tonnenformigen Zellen, so dafi die Faden
einer Wurstkette ahneln. Faden der ganzen Lange nach gleichmafiig breit. Faden
mit tonnenformigen Zellen zerfallen leicht in kurze Fragmente, wogegen Faden
mit zylindrischen Zellen bis zu einer fast unbegrenzten Lange wachsen konnen.
Zellen gramnegativ, schwach lichtbrechend, was wahrscheinlich durch hohen
Wassergehalt und die Abwesenheit von Zellwanden bedingt ist. Die Faden
scheiden sehr viel Schleim aus, was einigen Autoren zufolge auch ihre Bewe-
gungsweise erklart, zumal sich auf festen Nahrboden Spuren verfolgen lassen,
202 • Gleitende Bakterien - Vitreoscilla
die vom ausgeschiedenen Schleim stammen. Auf Agarboden mit geringem
Gehalt an organischen Stoffen bilden sie krause, gewellte oder spiralformige
Kolonien, wogegen auf Boden mit hoher Nahrstoffkonzentration tropfenformi-
ge, den iibrigen Bakterienkolonien ahnliche Kolonien gebildet werden. Fort-
pflanzung durch Hormogonien.
Ein fur diese Familie charakteristisches Merkmal ist ihre spezifische, unregelma-
fiige Gleitbewegung. Die Richtung der Bewegung andert sich. Das Bewegungs-
prinzip wurde noch nicht vollig geklart. Die Bewegung erfolgt in der Ubergangs-
zone zwischen der festen und fliissigen, oder der resten und gasformigen Phase.
Steifere Formen bewegen sich hauptsachlich in gerader Richtung, nur ihr freies
Ende umschreibt eine Kegelbahn. Weniger rigide Formen andern ihre Gestalt
wahrend der Bewegung.
Die verschiedenen Arten kommen in Wasser mit faulender organischer Materie
sowie im Schleim anderer Organismen vor; sie wurden in schwebenden
Kolonien von Chroococcaceae, in Kuhmist, sowie in gediingtem Boden gefunden.
Pringsheim (1951) vermutet, dafi es sich urn eine umfangreiche Gruppe von Organismen
handelt, deren Vertreter bisher noch nicht alle entdeckt wurden. Er nimmt an, da(f auch die
Gattung Achroonema hierher gehort. Auch die Gattung Microscilla, die nach Bergey's
Manual (1974) sowohl zur Gattung Flexibacter, als auch zur Gattung Cytophaga gestellt
wird, soil nach Pringsheim (1951) hierher gehoren. Soriano und Lewin (1965) reihen diese
Organismen gemeinsam mit anderen Gleitmikroben in eine neu aufgesteilte Ordnung
Flexibacterales ein.
Typus familiae: Vitreoscilla Pringsheim 1949
BestimmungsschliJssel der Gattungen
la Trichome deutlich gegliedert 2
lb Trichome nicht deutlich gegliedert; einzellig; bei Bewegung gerade bleibend
3.Flexoscilla(S.211)
2a Zwischen den Zellen kein leerer Raum; Zellen zylindrisch oder tonnenfor-
mig. Faden haufiggebogen 1. Vitreoscilla (S. 202)
2b Zwischen den Zellen leere Zwischenraume. Faden nur in diesen elastischen
Bindungen gebogen 2. Bactoscilla (S. 210)
1. Vitreoscilla Pringsheim 1949
Faden farblos, deutlich in zylindrische oder tonnenformige Zellen geteilt, die
manchmal an den Querwanden eingeschniirt sind. Einige Arten erinnern an
Faden von Leucothrix. Arten mit tonnenformigen Zellen ahneln Beggiatoa
mirabilis, solche mit zylindrischen Zellen Beggiatoa alba. Sie unterscheiden sich
von ihnen vor allem dadurch, dafi sie keine Schwefeltropfchen in den Zellen
anhaufen. Einige Faden, die deutliche Einschniirungen an den Zellquenvanden
aufweisen, erinnern an Pilzhyphen der Gattung Torula. Zellgrofie und Faden-
lange sowie die Morphologie der Kolonien sind von der Temperatur abhangig.
Hoh ere Temperaturen rufen auffallende morphologische Veranderungen her-
vor: an den Fadenenden, manchmal auch in der Faoenmitte bilden sich sphari-
sche Korperchen, von denen manche keimen oder sich durch Einschnurrung
vermehren. Zellen gramnegativ; oft mit schwach lichtbrechenden Globuli als
Reservematerial.
Chemoorganotroph, mit ausschliefilich respirativem Metabolismus. Nur auf
komplexen Medien wachsend. Metabolismus bisher nur wenig bekannt.
Obligate Konsumenten von Peptiden und Aminosauren; in definierten Medien
wird zum Wachstum ein Aminosauregemisch benotigt. Darum kommen sie nur
dort vor, wo Proteine zersetzt werden. Schwach alkalisches Milieu wird bevor-
zugt (pH 7,5-7,7). —
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Vitreoscilla • 203
Aus Schwefelwasserstoff keine Schwefeltropfchen bildend und keine Proteine
zersetzend. In fliissigen Medien sind die Faden zu zopfartigen Gebilden ver-
flochten. Auf Agarboden bilden sie zungenformig gelappte, netzfofmige oder
spiralis* angeordnete Kolonien.
Fortpflanzung durch Fadenfragmente, Hormogonien (ahnlich wie Leucothrix),
die jedoch nicht an der Unterlage festsitzen, sondern an beiden Polen zu einem
Faden heranwachsen.
Charakteristische Gleitbewegung. Nur eine Art ist unbeweglich. In Erdboden,
in verunreinigtem Siifrwasser, besonders in faulenden organischen Stoffen,
ferner in Abwassern und im Schlamm von Klaranlagen. Einige Formen sind auch
aus Meerwasser bekannt.
Die Arten werden auf Grund morphologischer Eigenschaften identifiziert,
obwohl sie sich auch durch Nahrungsanspruche unterscheiden. Lewin (1969)
stellt sie zur Familie Flexibacteriaceae, Bergey's Manual (1974) dagegen zur
Familie Beggiatoaceae.
Typus generis: Vitreoscilla beggiatoides Pringsheim 1949
Wichtigste Literatur:Pringsheim 1949, 1951, 1957, Costerton et al. 1961,
Hageage und Murray 1962, Brzin 1966,1967, Webster und Hackett 1966, Lewin
1969, Burnham und Hageage 1967, Graf und Perschmann 1970, Dietrich und
Biggins 1971, Mayfeld und Kester 1972.
BestimmungsschliJssel der Arten
la Trichome ohne Pigment; zersetzen Eiweifistoffe nicht 2
lb Trichome mit einem gelben bis orangeroten Pigment; zersetzen Eiweifistoffe
7. V. proteolytica
2a Trichome schlank, im Durchmesser weniger als 4,0 uxn, meistens bis 3,0 urn
3
2b Trichome robust; breiter als 4,0 \xm 9
3a Trichome im Durchmesser 2,0 (tm oder breiter 4
3b Trichome im Durchmesser mehr als 2,0 jtm, jedoch hochstens 2,5 (-3,0) pun
breit 2. V. moniliformis
4a Trichome deutlich beweglich ■. . 5
4b Trichome mit langsamer oder kaum wahrnehmbarer Bewegung 7
5a Trichome im Durchmesser iiber 1,2 \im breit 6
5b Trichome im Durchmesser 1,2 nm breit 3. V.filiformis
6a Zellen 3,0—4,0, oft auch 6,0 jimlang 4. V. catenula
6b Zellen 30,0-70,0 jim lang 5. V. paludosa
7a Trichome lassen sich auf kiinstlichen Medien kultivieren; Bewegung lang-
sam, aber deutlich 8
7b Trichome lassen sich nicht auf kiinstlichen Medien kultivieren; Bewegung
kaum wahrnehmbar 8. V. stricta
8a Trichome im Durchmesser ca. 2,0 jun breit 1. V. beggiatoides
8b Trichome im Durchmesser schmaler als 1,6 \im 6. V. stercoraria
9a Trichome bis 4,0 jim breit; Bewegung trage 9. V. conica
9b Trichome breiter als 4,0, gewohnlich 6,0-7,0 nmjlebhaft beweglich
10. V. major
1. Vitreoscilla beggiatoides Pringsheim 1949 (Fig. 114)
Faden zylindrisch, verschieden lang, an den Querwanden deutlich eingeschniirt,
gewohnlich in einer Entfernung von 4,0-5,0 \un. Selten mit innerer Struktur.
Einzelne Zellen zylindrisch; Scheitelzellen oft abgerundet. An der Oberflache
der Faden wirdjjgi negativer Farbung eine weiche, diinne Schleimschicht
204 • Gleitende Bakterien - Vitreoscilla
deutlich. Dunne Faden sind gewohnlich auch kiirzer (10 ^m) und bestehen aus
zwei Segmenten. Die meisten Faden sitzen an Unterlagen fest. Gramnegativ;
Protoplasma farblos. Junge Faden ohne Innenstruktur, alte mit vielen Granula.
Bei Anwendung spezieller Farbeverfahren lafit sich ein Nucleoid beobachten.
Chemoorganotroph; wachst gut in flussigen sowie auf festen Nahrboden mit
Bouillon, Hefeextrakt und Pepton in niedrigen Konzentrationen. Kohlenhydra-
te haben auf das Wachstum keinen Einflufi; bei hohen Konzentrationen wirken
sie inhibierend. In flussigen Medien werden meistens Faden von fast unbegrenz-
ter Lange gebildet. Dank ihrer schwachen Lichtbrechung bilden sie praktisch
keine Triibung. Auf Agarboden sind die Faden spiralig gewellt oder haarlocken-
artig. Auf feuchter Agaroberflache breiten sich die Faden von der Inokulations-
stelle iiber die ganze Oberflache aus. In Tropfen kondensierten Wassers bilden
sie auf schragem Agar einen spinnwebartigen Belag.
Fortpflanzung durch Fragmentation der Faden in kurze, an Hormogonien
erinnernde Teilstucke. Faden aktiv beweglich. Bewegung besonders im hangen-
den Tropfen sichtbar. Sie ist langsam, aber bestandig, in Richtung der Langsach-
se. Die Richtung kann ohne ersichtlichen Grund verandert werden. Wenn ein
Fadenende hangenbleibt, bewegt sich das andere indem es eine Kegelbahn
umschreibt. Die Faden bewegen sich gleitend nebeneinander, was ihre parallele
11Z, 115 116
Fig. 114. Vitreoscilla beggiatoides - bewegliche Faden verschiedener Lange -
(nach Pringsheim, 1951. - 1000X). Fig. 115. Vitreoscilla moniliformis - a
normale Faden, b Involutionsformen (nach Pringsheim, 1951. - lOOOx).
Fig. 116. Vitreoscilla stercoraria - a verschiedene Fadenformen - (lOOOx), b
langer, unregelmafiig gekriimmter Faden - (500 x) (nach Pringsheim, 1951).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Vitreoscilla • 205
Anordnung auf der Agaroberflache erklart. Bewegung mit einer Geschwindig-
keit von ca 2,0 jun/s.
Faden ca 2,0 [im breit, manchmal breiter oder schmaler; Lange sehr variabel,
iiber 150 [im, doch ist ihre wirkliche Lange durch Biegungen schwer feststellbar.
Unter ungiinstigen Bedingungen nur 10 [im lang.
Im Freiland in stehendem Siifiwasser mit Schwarzschlamm, auf faulendem
organischem Material, in Abwassern, im Schlamm. Oft in Gesellschaft von
Beggiatoa alba, Leptothrix discophora, Sphaerotilus natans u. a. Aus faulenden
Wasserpflanzen in Coldham Common (Cambridge, England) isoliert und be-
schrieben.
2. Vitreoscilla moniliformis Pringsheim 1951 (Fig. 115)
Trichome in ihrer Form Streptokokken-Ketten ahnlich. Sie bestehen aus einer
begrenzten Anzahl stabchenformiger Zellen, die durch durchsichtige Querwan-
de getrennt sind. Sie erinnern auffallend an einen Kranz von Wiirsten. Einzelne
Zellen unregelmafiig geformt, nur wenig langer als breit. Manchmal ziemlich
lang und dann zylindrisch. Die Faden zerfallen oft, sodafi man Fragmente mit 4
bis 5 Zellen finden kann. Gramnegativ. Auf Agar bilden sie kreisformige
zonierte Kolonien. Wachstum nicht immer charakteristisch und oft auch diffus.
Rander der Kolonien mit zungenformigen Auslaufern, wahrend innerhalb der
Kolonien ein Gebiet von zusammengerollten Faden vorhanden ist. Kolonien
gelblich gefarbt und perlmuttartig glanzend. In flussigen Medien bilden sie eine
deutliche Triibung im Sediment.
Fortpflanzung durch Teilung, der eine Einschniirung der Zellen vorangeht. Oft
ist die Stelle der kiinftigen Teilung schon lange vorher sichtbar. Trichome aktiv
beweglich. Bewegung jedoch sehr gering, ca 2 nm/min. Faden als Ganze
beweglich, auch wenn sie nicht unversehrt erscheinen und kurze Risse haben. Nur in
jungen Kulturen zu beobachten.
Ketten bis 150 pirn, grofitenteils jedoch nur 30 ^m lang. Kugelige oder kurz
stabchenformige Zellen meist 2,2 bis 2,5 \xm, offers auch 2,8 bis 3,0 \xm breit;
lange zylindrische Zellen bis 15,0 ^m lang.
In faulendem organischem Material, manchmal auch in Abwassern vorkom-
mend. Aus Kuhmist isoliert.
3. Vitreoscilla filiformis Pringsheim 1951
Faden zylindrisch, in ihrer Lange unbeerenzt; regelmafiig kommen auch kurze
Faden vor. Trichome sehr elastisch una fest, aus zylindrischen, kurzen Zellen
bestehend. Gramnegativ. Auf festen Agarboden bilden sie kleine kreisformige
Kolonien mit zerfransten Randern, die mit einer Platinose ganz abgehoben
werden konnen. In flussigen Medien wachsen sie gewohnlich am Boden des
Kulturgefafies. Am besten gedeihen sie in einem Medium aus Kuhmist.
Fortpflanzung durch Fadenfragmente. Trichome beweglich; Bewegung gleitend, an
den freien Fadenenden schaukelnd.
Faden durchschnittlich 1,2 [im breit.
Kommt in Kulturboden und verunreinigten Gewassern oder Abwassern vor.
Entdeckt in Anreicherungskulturen (biphasische Kulturen nach Pringsheim),
die mit Wasser aus dem Teich des botanischen Gartens in Cambridge (England)
angesetzt wurden. Auch im Erdboden gefunden.
Kann leicht mit Bacillus macroides (= Lineola longa) verwechselt werden, von
dem sie sich durch Fehlen von Geifieln unterscheidet.
206 ■ Gleitende Bakterien - Vitreoscilla
Fig. 117. Vitreoscilla catenula - a Fadenbiindel - (500x), b einzelne Faden -
(500x), c Involutionsformen - (lOOOx), d Detail der Faden - (lOOOx) (nach
Pringsheim, 1951).
4. Vitreoscilla catenula Pringsheim 1951 (Fig. 117)
Trichome zylindrisch, ihrer ganzen Lange nach gleichmafiig breit; Faden zwi-
schen den tonnenformigen Zellen leicht eingeschniirt, perlschnurartig ausse-
hend. Die Trichome zerfallen in kleinere Fragmente und wachsen nur bis zu
einer bestimmten Lange heran. Sehr lange Faden kommen selten vor. Zellen in
alten Faden kugelformig, breit, an Involutionsformen erinnernd. Gramnegativ.
Am besten wachsen sie auf Medien aus Kuhmist. Fortpflanzung durch Faden-
fragmente, die kiirzer als bei Vitreoscilla beggiatoides sind. Bewegung durch
charakteristisches Gleiten.
Faden 1,5 bis 2,0 nm breit. Zellen 3,0 bis 4,0 nm, manchmal auch 6,0 \xm lang.
Die Lange der Trichome lafit sich nicht genau bestimmen.
In faulendem organischem Material in Abwassern. Im Wasser aus Strafiengraben
und im Kuhmist auf Wiesen bei Cherry Hinton in der Nahe von Cambridge
(England) gefunden und beschrieben. Durch die Zellgestalt an die Blaualge
Pseudanabaena tenuis erinnernd.
Kann auch leicht mit Bacillus macroides (= Lineola longa) verwechselt werden;
unterscheidet sich jedoch durch die kurzen geifiellosen Zellen.
5. Vitreoscilla paludosa Pringsheim 1951 (Fig. 118)
Trichome sehr lane, einzelne Zellen zylindrisch, oft leicht gekriimmt. Faden an
den Querwanden leicht eingeschniirt und dort leicht abbrechend. Manchmal
auch verzweigt. Alte Zellen mit kugeligen I^feern. Gramnegativ. Auf Agarbo-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Vitreoscilla ■ 207
den bestehen junge Kolonien aus parallel orientierten Faden. Kolonien gestreckt
spindelformig, zugespitzt, manchmal in Form des Buchstabens Y. Altere
Kolonien mit konzentrischer Innenstruktur, die an Gehirnwindungen erinnert. An
den Randern mit zungenartigen Auslaufern. In flussigen Medien wachsen die
Faden vor allem an den Wanden des Gefafies oder bilden flockenartige Sedimen-
te. Faden sehr aktiv beweglich.
Trichome 1,8-2,0 pirn breit, 300 pirn und dariiber lang. Zellen gewohnlich 30,0-
70,0 pirn lang.
Oft in faulendem organischem Material, mit dem sie in Abwasser verschleppt
werden konnen. Im Miihlteich Flatford Mill Field Centre (England) gefunden.
Fig. 118. Vitreoscilla paludosa -a Faden normal entwickelt- (1000 x), b Faden
mit Kornchen - (1000 x), c Verzweigung der Faden unter anomalen Bedingun-
gen - (1000 x), d das sich im Laufe der Zeit andernde aufiere Aussehen der
Trichome (nach Pringsheim, 1951).
6. Vitreoscilla stercoraria Pringsheim 1951 (Fig. 116)
Ein ziemlich polymorpher Organismus, mit recht unterschiedlich langen Faden.
Trichome aus stabchenartigen Zellen bestehend, mitunter Zellen wiirstchenfor-
mig, nur wenig langer als breit. Trichome meistens der ganzen Lange nach
gebogen, oft haarnadelformige, lockige Klumpen bildend. Terminalzellen der
Faden nicht differenziert. Gramnegativ. Auf Agarboden bilden sie dichte
Kolonien, die miteinander durch ein dichtes Fadennetz verbunden sind
(charakteristisches Merkmal dieser Art). Kolonien spiralformig, robust. Altere Kolonien
gelblich durchsichtig, wobei es zur Autolyse der Zellen komme. In flussigen
Medien ist das Wachstum zunachst fadenformig, spater flockenartig. Bewegung
sehr langsam, ca 2 pim/min.
Trichome 1,2-1,5 ^m breit und bis 100 \\,m lang. Zellen bis 12,0 \\m lang oder
noch langer.
In faulendem organischem Material, in Kot, Mist und Abwassern vorkommend.
Urspriinglich au^Mist isoliert. Teilweise Vitreoscilla catenula ahnlich.
(
208 • Gleitende Bakterien - Vitreoscilla
Arten unsicherer taxonomischer Stellung:
7. Vitreoscilla proteolytica Graf et Perschmann 1970
Lange, sehr flexible Faden, deutlich in einzelne Zellen segmentiert. Flexibility
nicht nur auf die Zelltrennwand beschrankt, sondern gleichmafiig iiber den
ganzen Faden. Bei negativer Farbung mit Tusche eine Schleimkapsel sichtbar.
Bei Farbung mit Methylenblau bleiben einige Stellen in der Mine und an der
Peripherie der Zelle ungefarbt. Gramnegativ. An den Fadenenden und manch-
mal auch in der Fadenmitte kommen oft leere Stellen vor, deren Ursprung nicht
ganz klar ist. Die leeren Stellen bedeuten jedoch nicht, dafi der Faden sich in einer
Scheide befindet, da eine Scheide iiberhaupt nicht vorhanden ist. Zellen enthal-
ten ein gelbes, manchmal rosa- oder orangefarbenes Pigment (sehr wahrschein-
lich ein Karotinoid). Es wird bei Faden gebildet, die sowohl im Dunkeln als auch
im Licht wachsen.
Aerober, organotropher Organismus mit bedeutender proteolytischer als auch
lipolytischer Aktivitat. Verflussigt Gelatine; (3-Haemolyse auf Blutagar. Karbo-
hydrate werden nur sehr gering ohne Saurebildung zersetzt. Schwefelwasserstoff
wird nicht gebildet. Zum Wachstum benotigt er eine optimale Temperatur von
30 °C; bei 39 °C kein Wachstum mehr. Optimaler pH-Wert 7,2.
Auf festen spezifischen Medien bildet er charakteristische netzformige Kolonien
mit grofien Maschen. Auf den ublichen Kulturmedien wachst er nicht. In
flussigen Medien bildet er schwach miteinander verbundene Fadenballchen, die
teilweise im Medium schweben, teilweise sedimentieren. Bewegung durch typi-
sches Gleiten wie bei Flexibakterien.
Vermehrung durch Fadenfragmentierung.
Faden 0,6-1,2 \x,m breit.
Aus der oberen Wasserschicht des Bodensees an mit Abwasser verunreinigten
Stellen isoliert.
Nach Graf und Perschmann (1970) wahrscheinlich identisch mit einem nicht
naher bestimmten Organismus, der von Braun et al. (1969) studiert wurde,
ebenso mit Herpetosiphon aurantiacus. Reichenbach und Golecki (1975) be-
trachten ihn auch als identisch mit Herpetosiphon aurantiacus, nicht jedoch zur
Gattung Vitreoscilla gehorend.
8. Vitreoscilla stricta Pringsheim 1949 (nomen provisorium)
(Fig. 119)
Feste, zahe, kurze Faden mit deutlichen Zellen. Zellen l-l,5mal langer als breit.
Terminalzellen abgerundet. Trichome leicht gekrummt. Gewohnlich mit einem
Ende festhaftend, wobei das freie Ende im Wasser pendelt. Manchmal haften
beide Enden am Detritus und es bildet sich ein hufeisenformig gebogener Faden.
Gramnegativ; ohne Bewegung.
Trichome im Durchschnitt 1,6-1,8 pim breit, hochstens 30 \\,m lang. In Sufi
wasser mit faulendem Pflanzenmaterial. Urspriinglich bei Wray Castle und in
Flatford Mill (England) gefunden.
9. Vitreoscilla conica Pringsheim 1951 (nomen provisorium)
(Fig. 120)
Trichome gewohnlich breit, Zellen tonnenformig. Terminalzellen meist langer
und apikal verjiingt. Gramnegativ. Protoplasma mit lichtbrechenden Vakuolen.
Gleitbewegung nicht allzu deutlich und von der Temperatur abhangig.
Faden 4,0 \xm breit und 20,0-50,0 pirn lang.
Im Sufiwasserschlamm. Im Schlamm eines Teiches in Siidafrika gefunden, der
wahrend der Trockenperiode austrocknete.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Vitreoscilla ■ 209
Fig. 119. Vitreoscilla stricta - a Apikalteil des Fadens - (2000x), b mit beiden
Enden auf Detritusteilchen aufsitzende Trichome (nach Pringsheim, 1951).
Fig. 120. Vitreoscilla conica - Apikalteil des Fadens. In drei Zellen sind stark
lichtbrechende Vakuolen dargestellt. (Nach Pringsheim, 1951. -' 2000x).
Fig. 121. Vitreoscilla major - a Apikalteil der Trichome - (2000 x), b buschfor-
miges Wachstum der Faden - (175x) (nach Pringsheim, 1951).
10. Vitreoscilla major Pringsheim 1951 (nomen provisorium)
(Fig. 121)
Trichome farblos und verhaltnismafiig lang, mit Zellen, die kurzer als breit sind.
Terminalzelle abgerundet, in Gestalt einer abgeflachten Halbkugel.
Detritusteilchen, die an der Fadenoberflache haften bleiben, bewegen sich kngsam der Mitte
zu, wo sie sich - ahnlich wie bei den Blaualgen der Gattung Oscillatoria oder den
Bakterien der Gattung Beggiatoa - anhaufen. Zellen mit einigen lichtbrechenden
Granula, meist an den Querwanden. Gramnegativ. Kontinuierliche Wellenbe-
wegung> bei der die Fadenenden im Sinne des Uhrzeigers rotieren.
Zell en Dis 5,0 um lang; Faden gewohnlich 6,0—7,0 urn breit.
Im Sufiwasserschlamm. Urspriinglich im Schlamm eines fast ausgetrockneten
Grabens in Cherry Hinton in Cambridge (England) gefunden.
Morphologisch Thiothrix-Anen ahnlich, von denen sie sich durch ihre
kontinuierliche Wellenbewegung unterscheiden.
210 • Gleitende Bakterien - Bactoscilla
Gattungen unsicherer taxonomischer Stellung:
2. Bactoscilla Pringsheim 1949 (nomen provisorium)
Trichome sehr diinn, kurz, aus gramnegativen, rigiden stabchenformigen Zellen
bestehend. Deutlich durch dicke Scheidewande aus plastischem, elastischem
Material segmentiert, was die Biegung der Faden ermoglicht, und den Faden das
Aussehen von Ketten mit Intervallen zwischen den Zellen gibt. Bindematerial
nicht einmal bei Anwendung von Immersionsobjektiven gut sichtbar. Zellen
ohne sichtbare Struktur. Ohne Geifieln, wodurch sich dieser Organismus von
der sonst sehr ahnlichen Lineola articulata unterscheidet. Bewegung charakteri-
stisch, gleitend unter gleichzeitiger Biegung der Faden. Da die Zellen rigid sind,
biegt sich der Faden nur an den Scheidewanden wie in Gelenken. Im Ganzen an
die Biegung des Ellbogens oder der Glieder einer Fahrradkette erinnernd. Falls
der Faden nur an einem Ende festgeheftet ist, knickt er gliederartig ab; die
Ungewohnlichkeit dieser Bewegung verrat ihn. Das Bewegungsprinzip wurde
bisher noch nicht geklart.
Wichtigste Literatur: Pringsheim 1949, 1950, 1951.
Fig. 122. Bactoscilla flexibilis - a Anderung der Fadenform - (1500x), b
bogenformig gekriimmte Trichome - (1500x), c Anderung de Fadenform -
(350x), d Trichombundel- (350x)(nach Pringsheim, 1951). Fig. Ui.
Flexoscilla mucronata - (nach Pringsheim, 1951. - ^jgx).
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Flexoscilla - Simonsiellaceae • 211
Eine einzige Art:
Bactoscilla flexibilis Pringsheim 1949 (Fig. 122)
Bactoscilla mobilis Pringsheim 1951
Mit den Merkmalen der Gattung.
Trichome nur 0,4-0,5 \xm breit und verschieden lane. In beschrankter Anzahl
einige Male in schleimigen Massen des Ausflusses des Teiches Clay Pond bei
Freshwater Biol. Assoc. Laboratory, Wray Castle, Ambleside, ferner im Ober-
flachenfilm des Schwarzschlammes aus Flatford Mill Field Centre und im
gemischten Material aus einem Ententeich bei Colchester (England) gefunden.
3. Flexoscilla Pringsheim 1951 (nomen provisorium)
Dunne, zarte, mittelmafiige lange, wahrscheinlich einzellige Faden. An beiden
Enden verjiingt, an den Polen jedoch stumpf. Zellwand wenig deutlich. In
Anwesenheit von Schwefelwasserstoff an den Wanden des Kulturgefafies nahe
der Oberflache wachsend. Bewegung schnell, ohne dafi sich die Faden biegen.
Bergey's Manual (1957) fiihrt die Gattung Flexoscilla unrichtig als Synonym der
Gattung Cytophaga an.
Wichtigste Literatur: Pringsheim 1951.
Eine einzige Art:
Flexoscilla mucronata Pringsheim 1951 (Fig. 123)
Mit den Merkmalen der Gattung.
1,0 \x,m breit und 12,0-15,0 \x,m lang.
In einer Kultur mit faulenden Algen in Cambridge (England) gefunden.
5. Familie Simonsiellaceae Steed 1962
Zellen scheibenformig, abgeflachte Faden bildend, die auf fester Unterlage
gleiten. Die Familie umfafst meistens Bakterien, die in der Mikroflora des
Verdauungstraktes und der Mundhohle von Menschen, Huf- und Nagetieren
sowie Geflugel vorhanden sind, von wo sie sekundar in Abwasser verschleppt
werden konnen. Hierher gehoren Organismen (die Gattungen Simonsiella und
Alysiella), die morphologisch an die Blaualgen der Gattung Oscillatoria erin-
nern. Wegen ihrer aktiven Gleitbewegung werden sie heute zur Ordnung
Cytophagales gestellt. Aus rein praktischen Griinden wurden in dieser Arbeit
die beiden unsicheren Gattungen Oscillospira und Caryophanon gemeinsam mit
den Gattungen Simonsiella und Alysiella zur Familie Simonsiellaceae zusammen-
gefafk. Alle hierein gereihten Organismen sind wenig bekannt, ihre taxonomi-
sche Einteilung ist sehr zweifelhaft; weitere Untersuchungen sind erforderlich.
Typus familiae: Simonsiella Schmid 1922
Bestimmungsschlussel der Gattungen
la Bewegung typisch gleitend, Zellen ohne Geifieln 2
lb Bewegung mit Hilfe peritricher Geifieln 3
2a Faden aus eng aneinander gedrangten Zellen bestehend; Endzellen abgerun-
det 1. Simonsiella (S. 212)
2b Faden aus 2 mafiig voneinander entfernten Zellpaaren bestehend; Endzellen
nicht abgerundet 2. Alysiella (S. 213)
3a KeineSporen bildend; strengaerob 3. Caryophanon(S. 213)
3b Sporenbildend; anaerob 4.Oscillospira(S. 215)
212 • Gleitende Bakterien - Simonsiella
1. Simonsiella Schmid 1922
Faden deutlich abgeflacht mit dicht aneinander gedrangten Zellen und mit
abgerundeten Endzellen. Teilungseinheiten, die an Hormogonien mit abgerun-
deten Enden erinnern; Sporen werden nicht gebildet. Ohne Kapseln una ohne
Geifieln. Gramnegativ. Chemoorganotrophe Organismen mit fermentativem
Metabolismus; streng aerob. Wachstumsbedingungen nicht bekannt, jedoch ist
fiir das Wachstum Serum oder Blut erforderlich. Bewegung gleitend auf fester
Grundlage. Zellen 0,4—0,7 x 2,0-4,0 \xm grofi. Als unschadliche Saprophyten in
der Mundhohle des Menschen und von Tieren vorkommend.
Typus generis: Simonsiella muelleri Schmid 1922
Wichtigste Literatur: Schmid 1922, Peskov 1948, Krasil'nikov 1949, Bergey's
Manual 1957, 1974.
Bestimmungsschlussel der Arten
la Zellen0,4-0,7 x 2,0-3,0 nmgrofi 1. S. muelleri
lb Zellen0,6 x 3,0-4,0 x 1,0-1,5 nm 2. S.crassa
1. Simonsiella muelleri Schmid 1922
Caryophanon muelleri (Schmid 1922) Peskov 1948, Oscillospira muelleri
(Schmid 1922), Krasil'nikov 1949
Zellen scheibenformig, dicht aneinander gedrangt, kleine Kettchen in Form
abgeflachter Faden mit abgerundeten Endzellen bildend. Diese Faden teilen sich
in kurze Segmente, die an Hormogonien erinnern und gewohnlich aus 4 Zellen,
4 Zellpaaren oder auch der doppelten Zahl bestehen. Zellen oft, besonders in
Kolonien, zu kleinen Rollen zusammengerollt. Mueller (1911) beschrieb dunkle
Granula in der Zellmitte. Simons (1922) halt sie jedoch fiir Artefakte.
Gramnegativ.
Zellen chemoorganotroph mit fermentativem Metabolismus. Streng aerob. Auf
Blutagar bilden sie eine schmale haemolytische Zone. Bei Beriihrung mit einer
festen Unterlage bewegen sich die Zellen gleitend.
Zellen 0,4-0,7 [im hoch und 2,0-3,0 pirn breit; Faden 2,0-3,0 nm breit und
gewohnlich 3,0-16,0 \x,m lang. Es kbnnen auch langere Zellen vorkommen.
Saprophytische Bakterien in der Mundhohle von Menschen und Wirbeltieren,
von wo sie in Abwasser eingeschleppt werden konnen.
Krasil'nikov (1949) stellt diese Art zur Gattung Oscillospira, Peskov (1948) zur
Gattung Caryophanon.
2. Simonsiella crassa Schmid 1922 (Fig. 124)
Caryophanon crassa (Schmid 1922) Peskov 1948.
Zellen scheibenformig, dicht zu flachen Faden vereinigt. Letztere teilen sich in
Segmente, die an Hormogonien erinnern und abgerundete Endzellen haben. An
den Enden sind die Faden manchmal gekriimmt.
Gramnegativ. Zellen chemoorganotroph, aerob, mit fermentativem
Metabolismus. Fiir gutes Wachstum ist die Anwesenheit von Blut oder Serum erforderlich.
Bewegung gleitend, wenn der Faden mit seiner flachen Seite mit der festen
Unterlage in Beriihrung kommt.
Zellen 0,6 pun hoch und 3,0-4,0 x 1,0-1,5 \im grofi; Faden 3,0-4,0 [im breit
und 1,0-1,5 pirn dick.
In der Mundhohle von Tieren vorkommend. Morphologisch Simonsiella
muelleri ziemlich ahnlich.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Alysiella - Caryophanon • 213
2. Alysiella Langeron 1923
Zellen abgeflacht, scheibenformig, zu eng aneinander geschlossenen Paaren
vereinigt, die den flachen Faden verband. Fadenlange veranderlich; Endzellen
wie die iibrigen Zellen geformt, nicht abgerundet. Keine Sporen und keine
Kapseln bildend. Gramnegativ. Chemoorganotrophe, streng aerobe
Organismen mit fermentativem Metabolismus. Fiir gutes Wachstum ist Blut oder
Blutserum im Medium erforderlich. Sie konnen eine Reihe von Zuckerarten in
Sauren umwandeln, bilden jedoch kein Gas. Bewegung auf fester Unterlage
gleitend. In der Mundhohle verschiedener Haustiere, wie Pferden, Kiihen,
Schweinen, Ziegen, Schafen, Kaninchen und Meerschweinchen.
Wichtigste Literatur: Schmid 1922, Langeron 1923, Grasse 1924, Peskov 1948,
Bergey's Manual 1957, 1974.
Eine einzige Art:
Alysiella filiformis (Schmid 1922) Langeron 1923 (Fig. 125)
Simonsiella filiformis Schmid 1922, Caryophanon filiformis (Schmid 1922)
Peskov 1948
Mit den Merkmalen der Gattung. Peskov (1948) stellt diesen Organismus zur
Gattung Caryophanon.
Unsichere Gattungen und Arten:
3. Caryophanon Peskov 1939
Mehrzellige, dicke, manchmal sogar betrachtlich lange Faden bildend, die
infolge einzelner bazillarer Einheiten abwechselnd dunkel und hell gestreift sind.
Fadenende leicht verschmalert und abgerundet.
Die dunklen Streifen sind eigentlich innere Zellquerwande. An manchen Stellen
ist die Bildung der Querwande durch Einschnurung zu beobachten. Streifung
auch an lebendem ungefarbtem Material sichtbar. Anzahl der protoplasmati-
schen scheibenformigen Einheiten im Faden sehr veranderlich, was von der
Lange und vom Alter des Fadens sowie von den Lebensbedingungeh abhangt.
Faden auch von einer verschiedenen Anzahl unterschiedlich langer Kettchen,
kurzer Faden oder einzelner Zellen gebildet. Die morphologische Mannigfaltig-
keit wird von der Periodizitat der Organismenentwicklung bedingt. Am Anf ang
des Wachstums nach der Uberimpfung kommt es zuerst zur Erhohung der
Zellenzahl (Segmente) im Trichom. Danach folgt eine Periode der Trichomtei-
lung in kurze Fadenfragmente, die dann die iibliche Lange erreichen und wieder
fragmentieren. Darauf erscheinen Faden mit konusartigen Polen. In der statio-
naren Phase entstehen Faden mit verlangerten Zellen. In der Periode der
Autolyse der Kulturen bilden sich Faden mit 2-3 kokkenartigen Zellen. Mit den
Entwicklungsphasen hangt auch der Gehalt an sudanophilen Inklusionen mit
Lipidcharakter zusammen.
Nach Peskov und Marek (1972) besteht die Zellwand aus mehreren Schichten,
von denen die aufiere deutlich gewellt ist. Unter ungiinstigen Bedingungen oder
bei Zugabe und 10% Pferdeserum bilden sich kugelformige einzellige Struktu-
ren. Grofie und Gestalt des Organismus von den Wachstumsbedingungen
abhangig. Nach mehrfachem Umimpfen der Kultur im Laboratorium vermin-
dert sich die Grofie der Faden im Vergleich mit der frisch isolierten Kultur
betrachtlich. (Sie kann nur 1,0 \x,m im Durchmesser erreichen). Sowohl Faden als
auch einzelne Zellen besitzen peritriche Geifieln. Sporen werden nicht gebildet.
Allgemein werden sie fiir gramnegativ gehalten, obwohl nach Becker et al. (1967)
214 • Gleitende Bakterien - Caryophanon
124 125 126 127
Fig. 124. Simonsiella crassa - kurze Faden (nach Mikrophotographie umge-
zeichnet aus Bergey's Manual, 1974. - 750x). Fig. 125. Alysiella filiformis - a
obere Fadenende urn 90° gedreht, sodafi der engere Teil zu sehen ist, b Faden
von der breiteren Seite gesehen, c kurze Faden aus einer jungen Kolonie (nach
Mikrophotographie umgezeichnet aus Bergey's Manual, 1974. - 750x).
Fig. 126. Caryophanon latum - verschieden lange Faden nach dem Leben -
(orig. - 750x). Fig. 127. Osallospira guilliermondii - zwei Faden mit Endospo-
ren - (nach Krasil'nikov, 1949. - 750X).
die Zellwande eine fiir grampositive Bakterien typische Zusammensetzung
haben sollen.
Faden mit metabolisch aktiven zytoplasmatischen Granula (wahrscheinlich
Mitochrondrien). Bei Wachstum auf reichen, flussigen Medien wird Poly-fJ-
Hydroxybuttersaure synthetisiert, die auch in Form von Granula im Plasma
abgelagert wird. Kernapparat in Form eines Chromatingebildes. Nuklearstruk-
turen bei scheibenformigen Zellen ebenfalls scheibenformig, bei sphanschen
Zellen kugelig. Mit gelbem, aus Karotinoiden bestehendem Pigment. Streng
aerober, chemoorganotropher Organismus mit respirativem Metabolismus. Es
ist nicht bekannt, ob es sich urn einen saprophytischen oder pathogenen
Organismus handelt. Sauerstoff dient als Endakzeptor von Elektronen. Essig-,
Butter- und Poly-P-Hydroxybuttersaure werden als Kohlenstoff- und Energie-
quelle verwertet. Andere kohlenstoffhaltige Verbindungen werden schlecht,
Zucker, Zellulose sowie Starke iiberhaupt nicht verwertet. Auf speziellem,
Diinger enthaltendem Medium werden 1,5 mm breite, gelblich-braune, un-
durchsichtige, konvexe Kolonien, mit zottigen Randern und korniger Oberfla-
che gebildet, die in reflektiertem Licht glanzen.
Fortpflanzung durch Querteilung. Bewegung- auch der sehr langen Faden durch
Geiffeln; spharische Strukturen hingegen weniger beweglich. Vor allern in
frischem (nur einige Tage altem) Kuhmist vorhanden; wahrscheinlich auch im
Mist anderer pflanzenfressender Tiere.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Oscillospira ■ 215
Wichtigste Literatur: Peskov 1939, Pringsheim und Robinov 1947, Sail und
Mudd 1955, Provost und Doetsch 1962, Peskov et al. 1966, 1972, 1973, 1978,
Peskov und Marek 1972, Sechovcov und Zarikova 1978.
Eine einzige Art:
Caryophanon latum Peskov 1939 (Fig. 126)
Caryophanon tenue Peskov 1939, Caryophanon suhlatum Peskov et al. 1967
Mit den Merkmalen der Gattung.
Protoplasmatische Teile des Tricnoms (helle Streifen) 0,6-1,8 pirn lang, Scheide-
wande (dunkle Ringe) gewohnlich 0,15-0,3 pirn dick; spharische Zellen im
Durchmesser 3,0 [tm. Faden ca. 3,0 [tm breit und 6,0-30,0 pirn lang.
Urspriinglich aus Kuhmist isoliert, Umgebung von Moskau (UdSSR). Die
Zellen werden auch in Abwasser und durch diese in Oberflachengewasser
verschleppt (aus Schlachthofen, landwirtschaftlichen Betrieben u. a.).
Der Organismus wird von einem spezifischen Phagen befallen, unter dessen Einflufi
wesentlich grofiere, spindel- bis kugelformige oder abgeflachte Zellen entstehen, was mit
Storungen der normalen Teilung zusammenhangt. Kann bei oberflachlicher Beobachtung
mit der Gattung Beggiatoa verwechselt werden.
Peskov (1939) und Peskov et al. (1967) beschrieben zwei weitere Organismen, die jedoch
unzureichend klassifiziert sind und daher nach Bergey's Manual (1974) der folgenden Art
zugeordnet werden miissen:
la. Caryophanon tenue Peskov 1939
Dieser Organismus ist Caryophanon latum sehr ahnlich. Unterscheidet sich durch
wesentlich schlankere Faden und durch die nicht gewellte aufiere Schicht der Zellwand (letztere
liegt parallel zur inneren Schicht). Wird ebenfalls von einem spezifischen Phagen befallen,
der sich gegenuber Caryophanon latum inaktiv verhalt.
Faden nur 1,5 (im breit.
In frischem Kuhmist vorkommend, von dort auch beschrieben. Wahrscheinlich in Exkre-
menten pflanzenfressender Tiere weit verbreitet. Schon Bergey's Manual (1957) fiihrt an,
dafi es sich wahrscheinlich nur um eine Form von Caryophanon latum handelt, die auf
ungeeigneten Kulturmedien sehr schmale Trichome bildet.
Peskov et al. (1978) vertreten jedoch die Ansicht, dafi die Vereinigung der Arten C. latum
und C. tenue nur durch unzureichende Kenntnisse der Morphologie erfolgt ist.
lb. Caryophanon sublatum Peskov et al. 1967
Unterscheidet sich von der Leitart nur durch einen spezifischen Phagen, der sich nur
gegenuber diesem Organismus, nicht aber gegenuber den iibrigen Typen aktiv verhalt.
4. Oscillospira Chatton et Perard 1913
Faden kurz, robust, aus diinnen, bikonkaven, scheibenformigen Zellen beste-
hend, die mafiig voneinander entfernt und durch eine kleine Querwand getrennt
sind. Faden zylindrisch oder an einem der Enden leicht verjiingt, oft gekriimmt,
Fadenenden deutlich abgerundet; Endzellen halbkugelig. Wahrend des Wachs-
tums des Fadens sterben manche Zellen ab und wandeln sich in leere Nekridien
um, wobei sie die Trichome in Hormogonien-ahnliche Gebilde teilen. Faden mit
peritricher Begeifielung. Zellen gramnegativ. Zellplasma homogen oder fein
gekornt. Nach Farbung wird ahnlich wie bei Blaualgen in den Zellen ein
zentrales Korperchen sichtbar. Manchen Faden enthalten Endosporen, die an
beliebigen Stellen djs Fadens gebildet werden und immer parallel zu seiner
Langsachse liegen. An der Stelle, wo sich die Spore befindet, ist der Faden leicht
verbreitert. Sporen entstehen wahrscheinlich durch Verschmelzen von zwei oder
drei benachbarten Zellen. Selten sind im Faden zwei oder mehr Sporen
vorhanden. Trichome mit Sporen werden ziemlich selten gefunden. Die Sporen sind
lichtbrechend und resistent gegen Farbung, sie sind oval und haben eine deutli-
che Wand. Zellenenthalten in grofierer Menge Polysacharide.
216 ■ Gleitende Bakterien - Achromatiaceal^r
Wahrscheinlich anaerob oder mikroaerophil; Ernahrungsweise bisher unbe-
kannt. Konnte bislang nicht in Reinkultur gehalten werden und ist nur aus dem
Freiland bekannt. Fortpflanzung durch Querteilung der Zellen, durch Hormo-
gonien, einzelne Zellen sowie Sporen.
Aktive Bewegung durch peritrich angeordnete Geifieln. Im Verdauungstrakt
von Pflanzenfressern vorkommend. Urspriinglich in einem Meerschweinchen
gefunden.
Von der Gattung Caryophanon unterscheiden sich diese Organismen durch
grofiere Ausmafie, durch die Bildung von Endosporen und anaerobe Lebens-
weise.
Wichtigste Literatur: Chatton und Perard 1913, Krasil'nikov 1949, Moir und
Masson 1952, Bergey's Manual 1957, 1974.
Eine einzige Art:
Oscillospira guilliermondii Chatton et Perard 1913 (Fig. 127)
Oscillaria caviae Simons 1920
Mit den Merkmalen der Gattung
Einzelne Zellen 1,0-2,0 \im lang und 3,0-6,0 ^m breit; Faden 3,0-6,0 \im breit
und 10,0—40,0 \im lang, manchmal auch linger, doch werden 100 (xm nicht
iiberschritten. Sporen 2,5 x 4,0-5,0 \x.m grofi.
6. Familie Achromatiaceae Massart 1901
Zellen einzeln, grofi, kugelig bis ovoid oder kurz zylindrisch mit abgerundeten
Enden. Ohne spezielle Bewegungsorganellen und ohne photosynthetische Pig-
mente. In den Zellen sind Schwefeltropfchen und unter gewissen Bedingungen
auch andere Inklusionen eingeschlossen. Ausdauernde Entwicklungsstadien
sind nicht bekannt, Zellen gramnegativ. Sie sind chemoautotroph,
mikroaerophil. Schwefelwasserstoff und Sulfite werden als Elektronendonatoren verwer-
tet. Durch die Oxydation des Schwefelwasserstoffs zu elementarem Schwefel
oder sogar freier Schwefelsaure wird Energie gewonnen. Fortpflanzung durch
einfache Einschnurung der Zellen. Bewegung sehr langsam walzend. Ausmafie
ziemlich variabel. Sowohl im Sufi- als auch Salzwasser, das Schwefelwasserstoff
enthalt, vorkommend.
Die systematische Einordnung ist bisher ungeklart. Es wurden auch unbewegli-
che Zellenanhaufungen, die manchmal in einem Schleimlager eingebettet sind,
beschrieben, die Skuja (1948) Achromatium oxaliferum zuordnete, wahrend
Devide (1952) sie als selbstandigen Organismus, Tbiogloea ruttneri beschrieb.
Ob es sich um eine blofie Wucnsform oder eine selbstandige Gattung handelt,
wird erst durch weiteres Studium festzustellen sein.
Typus familiae: Achromatium Schewiakoff 1893
Bestimmungsschlussel der Gattungen
la Zellen grofi, farblos, einzeln, sich langsam walzend fortbewegend
1. Achromatium (S. 217)
lb Zellen grofi, farblos, grofiere unbewegliche Anhaufungen, meist in einem
Schleimlager, bildend 2. Thiogloea (S. 221)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Achromatium ■ 217
1. Achromatium Schewiakoff 1893
Zellen einzeln, kugelig oder zylindrisch mit abgerundeten Enden, Ausmafie
gewohnlich auffallend grofi, farblos, ohne spezielle photosynthetische Pigmen-
te. An giinstigen Standorten enthalten die Zellen kleine Schwefeltropfchen und
grofie, kugelige CaC03-Globuli. Sie bilden wahrscheinlich keine Ruhestadien.
In alterer Literatur wird angegeben, dafi keine Lokomationsorganellen vorhan-
den sind, obwohl schon Wislouch und Zacharias (1913) an jungen Exemplaren
eine Geifiel beobachtet hatten. Auch Skuja (1948) fand Zellen mit einer Geifiel
und glaubte dafi dies Zoosporen seien. De Boer et al. (1971) fanden jedoch mit
dem Elektronenmikroskop in der die Zellen ungebunden Gallert peritrich
Fibrillen, die Geifielfunktion haben. Zellen mikroaerophil, chemolithotroph; sie
brauchen Schwefelwasserstoff als Elektronendonator. Schwefelwasserstoff oxy-
dieren sie zu elementarem Schwefel und diesen bis zu freier Schwefelsaure.
Bisher ist es nicht gelungen, sie in Reinkultur zu ziichten. Vermehrung durch
einfache Einschnurung in der Zellmitte.
Bewegung, sofern sie uberhaupt auftritt, langsam, walzend rotierend. Ihre
Geschwindigkeit hangt vom Substrat ab.
Die Grofie der Zellen ist sehr variabel. Kommt im Siifiwasser, im Brack- und
Meerwasser, sowie im Schlamm vor.
Auf Grund unterschiedlicher Zellgrofie wurde eine ganze Reihe von Arten beschrieben.
Doch hat sich gezeigt, dafi es eine ganze Reihe von Obergangstypen gibt: deshalb wurden
alle Formen in zwei Arten zusammengefafit. Als Kriterium diente das Vorkommen oder das
Fehlen von CaC03-Inklusionen, obwohl auch dieses diagnostische Merkmal nicht ganz
eindeutig ist. So ist bisher nicht ganz klar, ob die CaC03 Inklusionen sich bei der gleichen
Art immer oder nur unter bestimmten Bedingungen bilden. Bisher sind Formen, die
Inklusionen enthalten, nur aus Siifiwasser bekannt. Klas (1951) halt die Organismen ohne
CaC03-Inklusionen fiir eine eigene Gattung: Thiophysa.
Die systematische Einordnung ist problematisch. Die bisher bekannte Gleitbewegung ohne
Lokomotionsorganellen berechtigte zu einer Einordnung unter die gleitenden Organismen
(Bergey's Manual, 1974), wahrend der Fund peritrich angeordneter Fibrillen im Zellschleim
fiir die Einreihung in eine andere Gruppe spricht. Das alles erfordert weitere Untersu-
chungen.
Typus generis: Achromatium oxaliferum, Schewiakoff 1893
Wichtigste Literatur: Schewiakoff 1893, Zacharias 1898, Migula 1900, Massart
1913, Virieux 1913, West und Griffiths 1909, 1913, Nadson 1913, Bersa 1920,
Nadson und Wislouch 1923, Bavendamm 1924, Kope 1924, Skuja 1948,
Krasil'nikov 1949, Klas 1951, Bergey's Manual 1957, 1974, De Boer et al. 1971.
Bestimmungsschlussel der Arten
la Zellen mit grofien kugelformigen CaCOj-Inklusionen, im Schlamm von
Sufi- und Brackwasser vorkommend 1. A. oxaliferum
lb Zellen ohne CaC03-Inklusionen, am haufigsten im Meer vorkommend . . . .
2. A. volutans
1. Achromatium oxaliferum Schewiakoff 1893 (Fig. 128)
Modderula hartwigi Frenzel 1897, Hillhousia mirabilis West et Griffiths 1909,
Hillhousia palustris West et Griffiths 1913, Achromatium gigas Nadson 1913
Zellen ovoid oder kugelig, oft, und zwar meistens vor der Teilung, auch kurz
zylindrisch mit halbkugelig abgerundeten Enden. Zellen in Form und Grofie
variabel. Neben Zellen normaler Grofie kommen auch «Riesenformen» vor.
Zwischen diesen Extremen gibt es eine ganze Reihe von Ubergangen. Unter
normalen Verhaltnissen enthalten die Zellen kleine Tropfchen elementaren
218 ■ Gleitende Bakterien - Achromatium
Fig 128 Achromatium oxaliferum - a normaler Zellhabitus - die Grofienunter-
schiede sind betrachtlich - (800X), b ein ausgehungertes Exemplar - (800X), c
eine sich teilende Zelle - (800 x), d Flagellatenstadien, vonSkuja als Zookomdien
betrachtet - (800 x), e Teilung der Protoplasten innerhalb der verscnleimenden
Zellwand und die Ausbildung von zahlreichen endosporenartigen Zellen -
(475 x) /verschieden ausgebildete Haufchen von Kleinzellen bzw. heranwach-
sender junger Zellen - (475x) - (nach Skuja, 1948; 1956; 1964).
Schwefels und grofie kugelige CaCOrInklusionen, die stark lichtbrechend sind
Schewiakoff (1893) hielt sie irrtumlicherweise fur Kalziumoxalat. Befindet sich
der Organismus in einem Milieu mit schwacher H2S-Konzentration und mufi tur
die Energiedeckung die Schwefeltropfchen abbauen, so verschwinden die
CaCO,-Inklusionen friiher als die Schwefeltropfchen.
Zellen gramnegativ.
Der Organismus ist mikroaerophil, chemoauto^kh, oxydiert Schwetelwasser-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Achromatium ■ 219
stoff und Sulfide zu elementarem Schwefel und diesen weiter zu freier Schwefel-
saure. Bisher wurden keine Reinkulturen erzielt. Vermehrung durch einfaches
Einschniiren in der Zellmitte senkrecht zur Langsachse der Zelle. Zellen beweg-
lich, sie rotieren auf einer festen Unterlage ruckweise um ihre Langsachse.
Bewegung langsam, wahrscheinlich mittels peritricher Geifieln, die von Schleim
umhullt sind.
Die Grofie der in dieser Art vereinigten Organismen ist sehr variabel. Wahrend
Schewiakoff (1893) fiir Achromatium oxaliferum eine Grofie von 9,0-22,0 (xm x
15,0—43,0 (xm angibt, fiihrt Zacharias (1898) eine Lange von 70,0 (xm an und
Warmig (1875) und Virieux (1913) sprechen sogar von 95,0 [xm. Koppe (1924)
beobacntete 48,0 (xm lange und 30,0 (xm breite Zellen; die kleinsten beschrieb er
als kugelige Zellen mit 3,0 \i im Durchmesser. Nadson (1913) beschrieb eine
102,0 (xm grofie Form und schlagt daher vor, die grofieren Formen in die Art
Achromatium gigas einzureihen. Daneben unterscheiden West und Griffith
(1913) unter dem Namen Hillhousia mirabilis Organismen, die 20,0-33,0 x
42,0-86,0 (xm grofi sind und unter Hillhousia palustris jene, die 14,0 x 25,0 (xm
erreichen. Bersa (1920), Nadson und Wisloucn (1923) beschrieben andererseits
eine kontinuierliche Reihe von Ubergangsformen und waren daher der Mei-
nung, dafi es sich um eine einzige Art handelt.
Die Art ist weit verbreitet. Sie kommt im Sufi- und Brackwasser, insbesondere
im Schlamm und Sumpf, an Lehmstatten in Torfstichen und in humushalti-
gen Wassern vor. Nach Nadson und Wislouch (1923) auch im Salzwasser
vorhanden. Zellen mit CaC03-Inklusionen besitzen ein hohes spezifisches
Gewicht und sind deshalb blofi am Grund im Schlamm zu finden, in dem sie,
wenn sie Sauerstoff benotigen, chemotaktisch wandern. Urspriinglich wurde die
Art im Altrhein bei Neuhofen (BRD) gefunden.
Skuja (1948) beschrieb vielzellige Anhaufungen, die wahrscheinlich mit Thio-
gloea ruttneri identisch sind.
2. Achromatium volutans (Hinze 1903) van Niel 1948 (Fig. 129)
Thiophysa volutans Hinze 1903, Thiophysa macrophysa Nadson 1913, Thio-
sphaerella amylifera Nadson 1913, Thiophysa minor Feldmann 1946, Thiophysa
gigantea Klas 1951
Farbloser einzelliger Organismus von kugeliger, ovoider, elliptischen Gestalt
der in verschiedenen Teilungsstadien biskuitartige Form annimmt. Mit doppel-
ter, klar sichtbarer Zellwand, die ungefahr 1,0 (xm stark ist und zwei Konturen
zeigt; sie zeigt Pektinreaktion. Diese Art besitzt eine grofie, zentrale Vakuole.
Das Protoplasma enthalt kleinere oder grofiere Mengen von Schwefeltropfchen,
jedoch niemals CaC03-Inklusionen. Geifieln wurden bisher noch nicht
beschrieben. Verhalten gegeniiber Gramfarbung nicht bekannt. Der Organismus
ist mikroaerophil, chemoautotroph. Als Energiequelle verwendet er Schwefel-
wasserstoff oder Sulfide. Diese werden zu Schwefel und weiter zu Schwefelsaure
oxydiert. Reinkulturen wurden bisher nicht erzielt.
Vermehrung durch einfache Einschniirung in der Zellmitte; die geteilten Zellen
sind in der Teilungsebene zuerst abgeflacht, und haben die Form einer Halbku-
gel; erst nach einer gewissen Zeit runden sie sich ab. Bewegung durch langsame
Rotation entlang der Zellachse.
Zellgrofie ziemlich variabel, zwischen 3,0 und 87,5 |xm.
Hauptsachlich im Schlamm von Salzwassern mit H2S-Gehalt vorkommend. Die
physiologischen Eigenschaften sowie das Auftreten dieser Art sind bisher un-
klar. Es ist moglich, dafi die Art auch in Siifiwasserbecken und Fliissen vor-
kommt. Der urspriingliche Fundort liegt in der Umgebung von Castellamare in
der Bucht von Neapgl (Italien), im seichten Wasser in der Nahe einer Schwefel-
quelle im Meer. ^^
220 ■ Gleitende Bakterien - Achromatium
Fig. 129. Achromatium volutans - a aussehen des normalen Zelltypus. Einige
abgebildete Individuen in verschiedenen Teilungsstadien (nach Anagnostidis,
1968. - 500x), b beigeordnete Art Thiosphaerelfa amylifera - (nach Krasil'ni-
kov, 1940. - 500X), cBeigeordnete Art Thiophysa gigantea- (nach Klas, 1951.-
500X).
Lange Zeit wurde diese Art fiir die einzige gehalten. Spater wurde eine Reihe «neuer» Arten
beschrieben, die sich nur in ihrer Grofie unterscheiden und deshalb hier wieder zu einer
einzigen Art zusammengefafit wurden.
2a. Thiophysa macrophysa Nadson 1913
Morphologisch stimmt dieser Organismus fast vollig mit der Leitart uberein. Bei der
Zellteilung kommt es jedoch nicht zu einer Abflachung der Tochterzellen, sondern diese
sind gleich nach der Teilung kugelig. Zellen 21,0-40,0 \im grofi.
Gefunden wurde sie am Grund der Bucht von Ichasal (Hapsaler Meerbusen), Estland
(UdSSR).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiogloea • 221
2b. Thiosphaerella amylifera Nadson 1913 (Fig. 129b)
Zellen kugelig oder ellipsoidisch. Zellwand sehr dick und stark lichtbrechend. An ihrer
Oberflache konnte eine Schleimschicht vorhanden sein. Protoplasma hell stahlgrau, oder
graugriin, verschiedene Mengen unterschiedlich grofier Schwefeltropfchen enthaltend.
Aufier ihnen kommen noch starkeahnliche Inklusionen vor, die durch Jod blau bis dunkel
violett gefarbt werden. Vermehrung durch Querteilung - Einschniirung. Bewegung durch
langsame, ruckartige Rotation um die Langsachse der Zelle.
Kommt an gleichen Stellen wie die Leitart vor. Wurde im Hapsaler Meerbusen, Estland
(UdSSR) gefunden.
2c. Thiophysa minor Feldmann 1946
Kleine Zellen, die morphologisch mit der Leitart identisch sind. Zellen 3,0-7,0 \im grofi. In
Marokko gefunden.
2d. Thiophysa gigantea Klas 1951 (Fig. 129c)
Einzellige Organismen mit kugeligen bis ellipsiodischen Zellen. Zellwand ungefahr 1,0 \im
dick mit deutlicher doppelter Kontur. Schwefeltropfchen verschieden grofi und unregelma-
fiig angeordnet. Ohne Geifieln.
Vermehrung durch Einschniirung. Tochterzellen kugelig, nicht abgeflacht. Bewegung
langsam, um die Langsachse der Zellen rotierend.
Ausmafie auffallend grofi, kugelige Formen 50,0-80 \im im Durchmesser, ellipsoidische
Formen 40,0-90,0 pim lang. Ein aufiergewohnlich grofier Individuum zeigte Ausmafie von
192,5 X 178,5 (im.
Im sandigen Schlamm eines natiirlichen schwefelhaltigen Salzwasserbeckens der Thermal-
quelle Mokosica bei Dubronik (Jugoslawien) gefunden.
Gattungen unsicherer taxonomischer Steilung:
2. Thiogloea Devide 1952
Einzellige, farbige Organismen, die grofie Kolonien in einer gemeinsamen
Gallertkapsel bilden. Zellen kugelig, ovoid bis kurz zylindrisch mit abgerunde-
ten Enden. Manchmal spindelformig oder unregelmaiSig geformt (Involutions-
formen). Mit diinner Zellwand, ohne zentrale Vakuole. Protoplasma entweder
farblos oder (bei der grofieren Art) graugriin gefarbt, meistens grofie Schwefel-
globuli enthaltend. Sowohl einzelne Zellen als auch Kolonien unbeweglich. Im
Su6- und Salzwasser vorkommend.
Die Gattung umfafit insgesamt drei Arten, unter denen die grofite, Thiogloea ruttneri, der
Gattung Achromatium auffallend ahnlich ist. Die kleinere Art Thiogloea ragusina erinnert
an manche pigmentfreie Arten der Familie Rhodothiorhodaceae, was durch Mangel an
Schwefelwasserstoff bei gleichzeitig hohen Temperaturen hervorgerufen werden kann. In
diese Gattung schliefit Devide (1952) unberechtigterweise als dritte Art auch Thiohacterium
bovista ein. Andererseits ist die Berechtigung der ganzen Gattung problematisch.
Typus generis: Thiogloea ruttneri Devide 1952
Wichtigste Literatur: Devide 1952
Bestimmungsschliissel der Arten:
la Zellen 2,0-6,0 x 2,0-10,0 \x.m grofi, schleimige, aus einigen Dutzenden
Individuen bestehende Kolonien bildend l.Th. ruttneri
lb Zellen 0,7-1,3 x 3,0-8,0 \im grofi, schleimige, kugelige, aus vielen Hunder-
ten von Individuen zusammengesetzte Kolonien bildend . . 2. Th. ragusina
1. Thiogloea ruttneri Devide 1952 (Fig. 131)
Zellen kugelig, ellipsoidisch oder kurz stabchenformig mit abgerundeten Enden.
Kolonien bildend, die aus einigen Dutzenden von Individuen bestehen, die in
einer gemeinsamen Schleimkapsel eingeschlossen sind. Manchmal werden auch
222 ■ Gleitende Bakterien - Thiogloea
kurze Ketten gebildet. Junge Kolonien sind kompakt, altere hingegen lockerer,
spater ganz zerfliefien. Die einzelnen Zellen bilden dann den Ausgangspunkt
neuer Kolonien. Meist haften sie an einer Unterlage. Zellwand sehr diinn; nur bei
den grofieren Individuen kann ihre doppelte Kontur beobachtet werden -
ungefahr 0,2-0,4 ^m dick. Zellplasma grungrau und zahflussig, homogen, in
seltenen Fallen enthalt es kleine Granula, die wahrscheinlich aus Kohlennydra-
ten bestehen. Aufierdem enthalten sie grofie, (2,0-4,0 \im im Durchmesser)
kugelige Schwefelglobuli.
Der Organismus ist wahrscheinlich mikroaerophil, chemolithotroph; bislang
nicht in Reinkultur geziichtet.
Vermehrung durch einfache Teilung; bei den Involutionsformen treten manch-
mal Knospungen auf. Einzelne Zellen und Kolonien unbeweglich.
Zellgrofte variabel, kugelige bis ovoide Zellen gewohnlich 2,0-6,0 X 2,0-
10,0 [im grofi. Bei hoher H2S-Konzentration entstehen Involutionsformen, die
spindelformig, lang ausgezogen und unregelmafiig sind. Solche Individuen
werden bis zu 10,0-20,0 \im grofi. Sich teilende spindelformige Zellen sind bis
zu 30-70 \im lang. 1
Fig. 130. Thiogloea ruttneri - a sehr junge Kolonie, b altere Kolonie, c neun
Individuen vom Rande einer grofteren Kolonie, d verschieden grofse Individuen
aus einer Mikrokultur, e-i Involutionsformen. In den Formen g und h sind
Kohlenhydratkorner deutlich.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiogloea • 223
Zum ersten Mai wurde dieser Organismus in einer Mikrokultur von Beggiatoa
alba gefunden. Ursprunglich wurde er fur ein Zerfallprodukt der Faden von
Beggiatoa oder fur eine abnormale Wuchsform gehalten. Spater wurde die Art
freilebend im Schlamm der Schwefelquelle in Mokosica bei Dubrovnik (Jugosla-
wien) gefunden.
Der Organismus ist den Kolonien von Achromatium oxaliferum, die Skuja
(1948) darstellte, auffallend ahnlich. Es ist durchaus moglich, da6 beide Formen
identisch sind; weitere Untersuchungen sind erforderlich.
2. Thiogloea ragusina Devide 1952 (Fig. 130)
Zellen klein, stabchenformig, im lebenden Zustand sind die Zellkonturen nur
schwierig zu erkennen. Es sind nur 2—4 Schwefeltropfchen sichtbar; es ist nicht
erkennbar, ob auch Kohlenhydrate enthalten sind. Zellwand wenig deutlich. Es
werden mikroskopische, kugelige oder linsenformige Kolonien mit einer groften
Menge (Hunderten bis Tausenden) von Zellen, die in eine gemeinsame Schleim-
kapsel eingeschlossen sind, gebildet. Gewohnlich sind die Zellen in den Kolo-
Fig. 131. Thiogloea ragusina - a eine junge Kolonie; von den Zellen sind
praktisch nur die Schwefeltropfchen zu sehen, b, c einzelne Zellen aus zwei
verschiedenen Kolonien nach Auflosen des Schwefels mit Alkohol und nachtrag-
licher Ubertragung inj^asser (nach Devide, 1952. - 2000X).
224 • Gleitende Bakterien - Thiosiphonaceae
nien gleichmafiig verteilt. Die Kapseln farben sich mit Gentianaviolett. Alte
Kolonien sind grofi, werden aufgeblaht und zerfallen schliefilich. Aus den
Fragmenten entstehen dann neue Kolonien. Vermehrung verhaltnismafiig sehr
rasch durch Teilungen. Zellen unbeweglich.
Zellen gewohnlich 0,7-1,3 x 3,0-8,0 ^m grofi, Kolonien relativ klein, die
grofiten von ihnen messen etwa 1,0 mm im Durchmesser, d. h. sie liegen an der
Sichtbarkeitsgrenze des blofien Auges.
Dieser Organismus wurde urspriinglich auch in einer Mikrokultur von Beggia-
toa alba eefunden und wurde fiir Bacterium bovista gehalten. Das Material der
Mikrokultur stammte aus dem Schacht einer Schwefelquelle in Mokosica bei
Dubrovnik (Jugoslawien). Die Berechtigung dieser Art ist sehr fraglich.
Unsichere Familien, Gattungen und Arten der Ordnung Cytophagales:
7. Familie Thiosiphonaceae Klas 1936
Nach Klas (1936) eine natiirliche Ubergangsstufe zwischen den einzelligen
Organismen der Familie Achromatiaceae und den fadenformigen vielzelligen
Beegiatoaceae.
Bisner nur eine Gattung bekannt:
Thiosiphon Klas 1936
Der Organismus bildet verhaltnismafiig dicke, farblose, unbewegliche, an einer
Unterlage festhaftende Faden. In ihrem Aussehen erinnern sie an pigmentlose
siphonale Algen. Faden ohne Querwande, die nicht einmal mit speziellen
Farbstoffen sichtbar gemacht werden konnen, so dafi sie wahrscheinlich aus
einer einzigen Zelle bestehen. Sie sind verschieden breit, verjtingen sich jedoch
gleichmafiig dem apikalen Ende zu. Der basale Teil bildet keine Gallertpolster,
ist jedoch manchmal kegelformig zugespitzt. Unter gunstigen Bedingungen sind
in lebenden Individuen zahlreiche grofie Schwefeltropfchen enthalten, die einen
Durchmesser von 2,0 (im erreichen. Art der Ernahrung bisher wenig bekannt.
Nach dem Vorkommen des Organismus kann man annenmen, dafi sein Metabo-
lismus dem der Gattung Beggiatoa ahnlich ist.
Fortpflanzung durch Gonidien, die durch zentripetale Einschniirung der Faden
vom apikalen Ende aus entstehen. Die Faden schniiren sich in unregelmafiigen
Abstanden ein, so dafi die Gonidien verschieden grofi werden. Gewohnlich kann
man an einem Exemplar alle Stadien der Gonidienbildung finden. Oft kommt es
vor, dafi sich die zweite Gonidie friiher abtrennt, als die erste, wodurch es zur
Bildung biskuitformiger Gebilde kommt. Die Gonidien sind an den Enden
abgerundet, manchmal tragen sie Zellwandreste an der Einschnurstelle. Die
Gonidienbildung hangt nicht von der Fadenlange ab, doch zerfallt der ganze
Faden in Gonidien.
Die Gonidien haben keine Bewegungsorganellen und sind daher in alien Ent-
wicklungsstadien unbeweglich. Durch die Stromung des Wassers werden sie an
neue Standorte gebracht, wo sie sich an Detritusteilchen ansetzen und zu neuen
Faden auskeimen. Im H2S-haltigen Wasser und in Abwassern vorkommend;
einzeln oder ofters in dichten Fadenknaueln.
Wichtigste Literatur: Klas 1936
Eine einzige Art:
Thiosiphon adriaticum Klas 1936 (Fig. 132)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pelonemataceae • 225
Fig. 132. Thiosiphon adriaticum - normaler Habitus auf fester Unterlage festhaf-
tender Faden. Am Apikalende ist eine Abschnurung der Gonidien zu sehen
(nach Klas, 1936. - 50x).
Mit den Merkmalen der Gattung.
Faden an der Basis 17,0-53,0 [im breit; apikaler Teil 13,0-30,0 [im dick;
gewohnlich 1000-1500 (im lang. Gonidien meistens 13,0—30,0 x 30,0—60,0 (im
grofi.
Als nitrophile Epiphyten an Pflanzen- und Tierresten im Wasser von Schwefel-
quellen, die von Abwassern verunreinigt werden. Sie bilden in der Regel dichte
Anhaufungen strahlenformig angeordneter Faden. Manchmal auch einzeln
vorkommend.
Sie wurden im Abflufikanal der Schwefelhaltigen Thermalquelle in Split
(Jugoslawien), die von Abwassern verunreinigt wird, gefunden. Bisher nicht wieder
gefunden; darf weiterer Untersuchungen.
8. Familie Pelonemataceae Skuja 1956
Fadenformige Organismen, mit langen, unverzweigten, vielzelligen, farblosen
Trichomen, die bei manchen Arten in festen Gallertscheiden eingeschlossen
sind. Faden entweder gerade oder gebogen, mitunter auch schraubenartig
gewunden. Meistens ohne FSrbung deutlich. Faden einzeln oder zu Bandern
226 ■ Gleitende Bakterien - Pelonema
oder Bundeln vereinigt. In den meisten Fallen nicht festsitzend, sondern frei
schwebend. Bei einer Gattung Faden durch Gallertpoister anhaftend. Zellen
zylindrisch, zum grofiten Teil mit farblosem und homogenem Protoplasma.
Durch Lichtbrechung wird eine blauliche Farbung vorgetauscht. Oft mit Gasva-
kuolen, die durch Lichtbrechung rot gefarbt erscheinen. Querwande in den
Faden manchmal deutlich, ein anders Mai schlecht sichtbar. Ohne Schwefel-
tropfchen. Reinkulturen wurden bisher nicht erzielt.
Fortpflanzung durch Hormogonien oder verschieden lange Fadenfragmente;
Vermehrung auch durch Hypnozysten, die aus vegetativen Zellen entstehen.
Manche Arten sind beweglich; Bewegung gleitend, wobei die Faden langsam urn
ihre Langsachse rotieren. Im Siifiwasserseen, Becken, Fischteichen, oft in fau-
lenden Massen abgestorbener Algen vorkommend.
Wahrscheinlich aus apochlorotischen Blaualgen hervorgegangen, offensichtlich
mit langer phylogenetischer Entwicklung. Systematische Einordnung proble-
matisch. Neue Untersuchungen an Reinkulturen sind erforderlich.
Typus familiae: Pelonema Lauterborn 1916
Bestimmungsschlussel der Gattungen
la Faden einzeln, niemals Biindel bildend 2
lb Faden immerzu Biindel vereinigt 3
2a Trichome unbeweglich oder wenig beweglich, ohne deutliche Segmentie-
rung. Zellen gewohnlich lang, ohne Gasvakuolen, Hypnozysten werden
nichtgebildet 1. Pelonema (S. 226)
2b Trichome beweglich, oft deutlich segmentiert. Zellen relativ kurz, ohne
Gasvakuolen. Manchmal Hypnozysten bildend ... 2. Achroonema (S. 230)
3a Trichome im Wasser frei schwebende Biindel bildend, die die Form wellig
gebogener oder schraubenfbrmig gewundener Bander haben
"... 3.Peloploca(S.237)
3b Trichome festsitzende Biindel bildend. Faden mit ihren unteren Halften in
einer gemeinsamen Gallertscheide sitzend, die oberen Teile in einzelne
Trichome differenziert 4. Desmanthos (S. 244)
1. Pelonema Lauterborn 1916
Zellen stabchenformig farblos, mit glatter feiner Wand, die vielzellige, unver-
zweigte, gerade oder gebogene Faden bilden, die der ganzen Lange nach
gleichmafiig breit sind. An den Querwanden etwas eingeschnurt. Faden niemals
Biindel bildend, in diinne, feine Gallertscheiden eingeschlossen. Protoplasma
farblos und homogen, manchmal mit Gasvakuolen, die durch Lichtbrechung
rotlich erscheinen.
Fortpflanzung durch Fadenfragmentation; Hypnozysten werden nicht ge-
bildet.
Meist unbeweglich, nur ausnahmsweise sind manche Arten langsam beweglich.
An der Wasseroberflache und Siifiwasserteichen und -seen mit geringem Sauer-
stoffgehalt.
Soriano und Lewin (1965) sind der Ansicht, daft sich, da diese Organismen
unbeweglich sind, die Beschreibung moglicherweise auf tote Flexibakterien oder
farblose Blaualgen bezieht.
Typus generis: Pelonema tenue Lauterborn 1916
Wichtigste Literatur: Lauterborn 1916, Koppe 1924, Skuja 1948, 1956, 1958,
Bergey's Manual 1957, 1974
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pelonema • 227
Bestimmungsschlussel der Arten
la Faden an den Querwanden leicht eingeschnurt, sehr lang, 300-600 (xm ... 2
lb Faden an den Querwanden nicht eingeschnurt, verhaltnismafiig kurz,
maximal bis zu 200 (xm 4
2a Zellen auffallend langer als breit; mit einer Gasvakuole 3
2b Zellen isodiametriscn oder nur wenig langer als breit; mit mehreren
Gasvakuolen. Faden 500 (xm und mehr lang 2. P. pseudovacuolatum
3a Zellen 3,0-19,0 [xm lang; Faden 1,9-2,2 (xm breit und gewohnlich nicht iiber
300 [xmlang l.P.tenue
3b Zellen 5,0-16,0 (xm lang; Faden 1,0-1,7 (xm breit und 600 oder mehr [xm lang
3. P. aphane
4a Faden nicht schraubenartig gewunden 5
4b Faden schraubenartig gewunden und hochstens 160 (xm lang .. 6. P. spirale
5a Zellen 1,5-6,0 (xm lang; Faden 0,6-0,7 (xm breit und bis 120 (xm lang
4. P. subtilissimum
5b Zellen 2,0-6,0 |xm lang; Faden 2,0 (xm breit und selten 200 (xmlang
5. P. hyalina
1. Pelonema tenue Lauterborn 1916 (Fig. 133)
Faden gerade oder schwach und unregelmafiig gebogen; an den Enden verjiingt,
an den Querwanden manchmal auffallend eingeschnurt. Zellen mit einer unre-
gelmafiigen, rotlichen Pseudovakuole, die den Zellinhalt fast ganzlich ausfullt.
Beim Zentrifugieren des Materials verschwinden die Vakuolen. Protoplasma
hyalin, stark lichtbrechend oder mit einigen feinen Kornchen.
Im Wasser mit geringem 02-Gehalt sind die Faden beweglich, sonst scheinen sie
unbeweglich. Bewegung langsam rotierend, 20 bis 30, ausnahmsweise bis 60 (xm
pro Minute.
Faden 1,8-2,2 [xm breit und oft bis zu 300 [xm lang. Zellen 2,0 x 8,0-12,0
(19,0) [xm grofi.
In Siifiwasserteichen und -seen mit faulenden Algen. Auch im Hypolimnion von
Siifiwasserseen und im Schlamm von Brackwassern. Urspriinglich in
Fischteichen mit faulenden Chara-Kesten in der Rheinebene (BRD) gefunden.
2. Pelonema pseudovacuolatum Lauterborn 1916 (Fig. 134)
Faden gerade oder leicht und unregelmafiig geknimmt; an den Enden gerade,
weder verjiingt noch erweitert. Apikalzellen abgerundet, an den Querwanden
eingeschnurt. Zellen 1 bis 2 mal langer als breit, zylindrisch oder tonnenformig
und farblos. Mit einigen kleinen, unregelmafiigen Gasvakuolen, die scharf
abgegrenzt sind und durch Lichtbrechung rotlich erscheinen. Zytoplasma hyalin
und homogen hell-blaulich erscheinend. Bewegung wurde nicht Deobachet.
Faden 500 [xm lang und 1,5-2,0 [xm breit. Zellen 2,0-40,0 [xm lang.
Im Sufi wasser, in grofieren Tiefen, im Schlamm von Seen, gelegentlich auch im
Plankton vorkommend.
3. Pelonema aphane Skuja 1956 (Fig. 135)
Faden lang, gerade oder leicht gebogen. Fadenenden gerade abgestiitzt, weder
verjiingt noch erweitert; in Ausnahmsfallen sind die Apikalzellen abgerundet.
An den Querwanden sind die Faden manchmal leicht eingeschnurt. Zellen
zylindrisch, wobei die Gliederung der Faden durch die einzelnen Querwande
gut erkennbar ist, besonders bei alteren Zellen, wo die Gasvakuolen in eine
einzige grofie Vakuole zusammenfliefien, die den Grofiteil der Zelle ausfullt.
Protoplasma farblos, Imogen, Gasvakuolen axial gelagert, infolge der Licht-
228 ■ Gleitende Bakterien - Pelonema
Fig. 133. Pelonema tenue - a normales Aussehen des Apikalteiles des Fadens-
(670 X ),b Detail des Fadenteils, c Aussehen des Fadens nach Zentrifugierung; die
Gasvakuolen verschwinden - (670X) (nach Skuja, 1956). Fig. 134. Pelonema
pseudovacuolatum - (nach Skuja, 1956. - 670X). Fig. 135. Pelonema aphane-a,
b,d normales Aussehen des Apikalteils des Fadens - (670 x), c Detail des
Fadenteils - (1000X) (nach Skuja, 1956).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pelonema • 229
brechung purpurfarben erscheinend. Faden grofkenteils unbeweglich, sehr sel-
ten langsam beweglich.
Faden gewohnlich 1,0-1,7 (xm breit und 600 (xm lang, manchmal auch langer;
Zellen 5,0-16,0 (im lang.
Im Hypolimnion tiefer Seen frei schwebend oder im Benthos. Wahrend der
Wasserzirkulation im Friihling kommen sie auch in den oberen Schichten vor.
Urspriinglich wurden sie im Storacksen See (Schweden) gefunden.
4. Pelonema subtilissimum Skuja 1956 (Fig. 136)
Faden kurz, einzeln; Querwande wenig deutlich oder iiberhaupt nicht erkenn-
bar. Fadenenden gerade oder leicht verjtingt, ausnahmsweise abgerundet. Zellen
zylindrisch, 2 bis 8 mal langer als breit. Protoplasma farblos, homogen oder mit
zerstreuten feinen Kornern; oft auch mit einer zentralen Vakuole, die durch die
136 a 138
Fig. 136. Pelonema subtilissimum - (nach Skuja, 1956. - 670x). Fig. 137.
Pelonema hyalina - a 670x, b 2000X (nach Koppe, 1922). Fig. 138. Pelonema
spirale - a 2000 x, b 670 x (nach Huber - Pestalozzi. - 1938).
230 ■ Gleitende Bakterien - Achroonema
Verbindung mehrerer Vakuolen entsteht. In solchen Fallen fiillt die Vakuole den
grofken Teil der Zelle aus. Nicht/aktiv beweglich.
Faden 0,6-0,7 [xm breit und 15,0-18,0(120) [xm lang; Zellen 1,5-6,0 [xm lang.
Faden zwischen anderen Hypolimnion-Organismen frei schwebend. Im Blank-
vatn See bei Oslo (Norwegen) gefunden.
5. Pelonema hyalina Koppe 1924 (Fig. 137)
Faden gerade, einzeln und keine Biindel bildend.
Protoplasma hyalin, mit einer groflen rotlichen Vakuole, die die Form eines
Prismas mit abgerundeten Kanten hat.
Faden unbeweglich oder nur sehr langsam beweglich.
Zellen 2,0 x 4,0-6,0 (xm grofl; Faden 200 (xm und mehr lang.
Im Schlamm tiefer algenreicher SiifSwasser. Diese Art wurde in einer Tiefe von
17-21 m in der oberen Schlammschicht des Kl. Ploner Sees, Schleswig-Holstein
(BRD) gefunden.
Unsichere Art:
6. Pelonema spirale Lauterborn 1916 (Fig. 138)
Faden schraubenartig gewunden. Zellen mit vielen langen Gasvakuolen.
Faden 1,0-1,5 X 40,0-160 (xm grofl; Lange der Windungen gewohnlich 8,0-
14,0 [xm.
Im Sufiwasser mit grofien Mengen von Chara.
Aus Fischteichen in der BRD beschrieben. Die Berechtigung dieser Art ist
fraglich.
Lewin (1965) gibt an, dafi die Faden rotlich sind; er nimmt an, dafl es sich um tote
Faden von Saprospira thermalis handelt.
2. Achroonema Skuja 1948
Fadenformige, farblose, vielzellige Organismen, die niemals Fadenbundel bil-
den. Faden immer einzeln und im Wasser frei schwebend; niemals festsitzend.
Ohne Scheide. Faden gerade oder leicht gebogen, manchmal mit unregelmafii-
gen, selten mit regelmafligen schraubenformigen Windungen; nie verzweigt. An
den Querwanden sind die Faden meist leicht eingeschnurt.
Querwande bisweilen schlecht erkennbar. Fadenenden manchmal gleichmafiig
verjiingt. Apikalzellen abgerundet, ohne Verdickung der Zellwand.
Zellen mit feiner, glatter Zellwand. Protoplasma farblos, homogen oder feinkor-
nig. Nur selten mit einer Gasvakuole. In der Zellmitte ist das Protoplasma
gewohnlich dicht. Reinkulturen wurden bislang nicht erzielt.
Vermehrung durch Fadenfragmente oder Hormogonien. Nur einige Arten
bilden interkalar Hypnozysten. Faden beweglich; nur selten unbeweglich.
Bewegung gleitend und mit langsamer Rotation um die Langsachse der Faden
verbunden. Im Plankton des Siifiwassers oder im Grundschlamm. Manche Arten
wurden auch in industriellen Abwassern gefunden (Hausler 1968).
Ihre systematische Einordnung ist nicht ganz eindeutig. Wahrscheinlich handelt es sich um
apochlorotische Blaualgen. Skuja (1948,1956) stellt sie zu den Bakterien. Soriano und Lewin
(1905) sind der Meinung, dafi alle geraden Formen in die GanungVitreoscilla eingeordnet
werden sollten.
Typus generis: Achroonema spiroideum Skuja 1948
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Achroonema ■ 231
Wichtigste Literatur: Kirschner 1896, Koppe 1924, Skuja 1948,1956, Starmach
1966, Bergey's Manual 1974
Bestimmungsschlussel der Arten
la Faden mehr oder weniger regelmafiig schraubenformig gewunden
1. A. spiroideum
lb Faden gerade oder schwach und unregelmafiig gebogen 2
2a Faden an den Querwanden deutlich eingeschnurt 3
2b Faden an den Querwanden nicht eingeschnurt 9
3a F'aden bilden Dauerzellen (Hypnozysten) 4
3b Faden bilden keine Hypnozysten 6
4a Zellwand der Hypnozysten braun; Faden 2,5 |xm breit, Zellen 2,5-4,5 (xm
lang; Protoplasma hyalin 2. A. sporogenum
4b Zellwand der Hypnozysten farblos 5
5a Dauerzellen kurz und tonnenformig, 3,5 (xm breit, Faden um 2,0-2,7 (xm
breit, Protoplasma deutlich kornig 3. A. inaequale
5b Dauerzellen lang zylindrisch, nicht breiterals die Faden (1,4—2,0 |xm)
4. A. lentum
6a Zellen, linger als breit 7
6b Zellen isodiametrisch, oder kiirzer als breit; Faden 1,8-2,0 (xm breit
5. A. simplex
7a Protoplasma homogen 8
7b Protoplasma -in der Zellmitte dunkler; Faderi 2,0-3,5 um breit, deutlich
gegliedert 6. A. articulatum
8a Faden 2,5-3,0 |xm breit, mit nicht sichtbarer Segmentierung
7. A. gotlandicum
8b Faden 5,0-6,8 |xm breit, oft in kurze Fragmente zerfallend
8. A. macromeres
9a Faden hochstens 2,5 (xm breit 10
9b Faden 3,5-4,2 (xm breit; Zellen 4,0-10 (xm lang; Protoplasma dicht und fein
gekornt 9. A. splendens
10a Protoplasma homogen 11
10b Protoplasma grob gekornt 12
11a Faden gerade, 0,7-1,2 |xm breit. Zellen 2,5-8,0 |xm lang . 10. A.aneustum
lib Faden gerade, 2,0 (xm breit, Zellen 2,0-6,0 |xmlang .... 11. A.profundum
12a Faden gerade, 2,0-2,5 (xm breit, Zellen 5,0-10,0 (xmlang
9. A. splendens forma tenuior
12b Faden leicht gebogen, 1,5-1,6 breit; Zellen 3,0-12,0 |imlang
12. A. proteinforme
1. Achroonema spiroideum Skuja 1948 (Fig. 139)
Saprospira spiroidea (Skuja 1948) Lewin 1962
Faden lang, einzeln, freischwebend oder im Schleim verschiedener Algen le-
bend, unregelmafiig gebogen, oder in regelmafiigen, langen Spiralen gewunden.
Fadenenden nicht verjiingt, sondern abgerundet. Querwande sehr schlecht
sichtbar, so dafi die Faden nicht gegliedert erscheinen. Querwanden nicht
eingeschnurt. Protoplasma farblos, homogen oder fein granuliert. Faden lebhaft
beweglich - etwa 600 |xm pro Minute.
Faden 0,3-0,5 (im breit und 10-250 (im lang. Schraubenwindungen 2,9-5,7 (xm
breit und 9,0-25,0 |xm lang. Zellen mehrmals linger als breit; 0,3-0,5 x 3,0-
15,0 |xm grofi.
Frei beweglich zwisd^n anderen Planktonarten, kommt jedoch auch auf den
232 ■ Gleitende Bakterien - Achroonema
Fig 139. Achroonema spiroideum - zwei Faden, der eine unregelmafiig gebogen,
der andere schraubenformig (nach Skuja, 1948. - 2000X). Fig. 140. Achroonema
sporogenum - Faden mit mehreren reifen, braun gefarbten Dauerzellen. (nach
Skuja, 1956. - 670X). Fig. 141. Achroonema inaequale -a,b die angeschwolle-
nen Zellen, bzw. Fadenpartien stellen wahrscheinlich sich weiter entwickelnde
Dauerzellen dar, c normales Aussehen des Fadens (nach Skuja, 1956. - 670X).
Fig. 142. Achroonema lentum - a Faden mit deutlichen Querwanden, b Faden
mit undeutlichen Querwanden (nach Skuja, 1956. - 670x).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Achroonema ■ 233
Schleimhiillen von Griinalgen vor. Als Fundort werden die Seen Erxen und
Valloxen (Uppland, Schweden) angegeben.
Lewin (1962, 1965) halt diese Art fiir Saprospira spiroidea (Skuja 1948) Lewin 1962. Brunei
(1949) rand ahnliche Organismen, die sich jedocn in ihren AusmaBen unterschieden - die
Faden waren 1,0-1,5 um breit. Pringsheim (1951) ist der Meinung, dafi sie in die Familie
Vitreoscillaceae gehort.
2. Achroonema sporogenum Skuja 1958 (Fig. 140)
Faden lang, gerade oder fast gerade, an den deutlichen Querwanden auffallend
eingeschnurt. Fadenenden gerade, weder verjungt, noch erweitert. Apikale
Zellen abgerundet, Zellen in den Faden zylindrisch. Protoplasma hyalin, mit
deutlich differenziertem Ektoplasma und groberem, hellerem Endoplasma.
Wahrscheinlich ein heterotropher Organismus. Fortpflanzung durch Hormo-
gonien oder Hypnozysten, die tonnenformig, zylindrisch oder gestreckt sind
und die eine glatte, braune, zweischichte, aus Exospor und Endospor bestehende
Zellwand besitzen. Hypnozysten an den Enden leicht abgerundet; einzeln oder
zu 2-3 in Reihen interkalar gebildet. Faden beweglich.
Zellen ebenso breit, wie lang oder 1,75 x langer als breit; 2,5 x 2,5-4,0 \i grofi.
Hypnozysten 2,5-2,8 X 2,7-5,0 \un grofi.
Im Benthos der Binnengewasser, urspriinglich zwischen faulenden Blattern von
Wasserpflanzen in einem Bach unweit Riga (Lettland, UDSSR) gefunden.
3. Achroonema inaequale Skuja 1956 (Fig. 141)
Faden gerade oder mafiig gebogen, lang, einzeln; Querwande deutlich; Faden an
hier mehr oder weniger deutlicn eingeschnurt. Fadenenden weder verjungt noch
erweitert; Apikalzellen breit abgerundet. Einzelne Zellen verschieden lang. Oft
trennt in alteren Faden kurze, leicht spindelformig angeschwollene, 2 bis 6
zellige Fragmente auf, die durch tiefere Einschniirungen vom ubrigen Trichom
getrennt sein konnen. Es werden kurze tonnen- bis plattchenartige
Hypnozysten mit verhaltnismafiig diinne, glatten, farblosen Wanden gebildet. Gewohn-
lich breiter als die Faden. Protoplasma farblos, fein aber dicht gekornt. Fort-
flanzung durch Fadenfragmente und Hypnozysten. Faden gleichmafiig beweg-
ch, mit einer Geschwindlgkeit von etwa 135 (xm pro Minute.
Fadenbreite 2,0-2,7 (im; Fadenlange oft 1 bis 3 mm. Zellen 0,75 1,5 mal langer
als breit, 2,0-2,7 x 1,5-2,0 \xm grofi. Hypnozysten 3,5-4,0 (xm breit und 2,5-
4,5 um lang.
Zwischen ubrigen Arten des Sufiwasserplanktons vorkommend, auch im Hypo-
limnion eutropher Seen. Fundort Norrviken (Schweden).
4. Achroonema lentum Skuja 1956 (Fig. 142)
Fiden gerade oder gebogen, an den der Querwanden deutlich eingeschnurt;
letztere sind meist sehr gut sichtbar, verdickt, hyalin und verbinden als kurze
Briicken die zylindrischen Gliederzellen. Fadenenden gerade, weder verjungt
noch erweitert. Endzellen abgerundet, iibrige Zellen zylindrisch. Es werden
zylindrische Hypnozysten mit einer diinnen, farblosen Zellwand gebildet.
Protoplasma farblos oder etwas grau gefarbt; Korner wahrscheinlich aus Volutin
bestehend.
Vermehrung nach Skuja (1964) durch Fadenfragmente, Hormogonien oder
Hypnozysten. Bewegung langsam, gleichmafiig; manchmal scheinen die Faden
bewegungslos zu sein.
Faden 1,4-2,0 \im breit; Zellen 3,0-12,0 (xm, seltener bis 12,0 \un lang. Hypno-
mten 2,0-2,5 x 5,0-10,0 (im grofi.
I Firei schwebend zwischen anderen Organismen des Sufiwasserplankton oder -
&
234 ■ Gleitende Bakterien - Achroonema
benthos im Hypolimnion tiefer Seen oder Teiche. Fundort Lushavet
(Schweden).
5. Achroonema simplex Skuja 1956 (Fig. 143)
Faden einzeln, gerade oder gebogen, verschieden lang, an den Querwinden
wenig aber deutlich eingeschnurt. Zellwinde sehr gut sichtbar, sogar im nativen
Praparat. Fadenenden gerade, manchmal verjiingt oder erweitert. Apikalzellen
stumpf zugespitzt, iibrige Zellen kurz, tonnenformig. Protoplasma farblos oder
griulich, homogen oder kaum merkbar granuliert; haufig an den Zellrandern
dunkler und dichter. Faden grofkenteils unbeweglich, nur selten sehr schwach
beweglich.
Faden 1,8-2,0 (xm breit. Zellen meist ebenso lang wie breit, manchmal jedoch
0,75-1,5 X linger als breit; 1,9-2,0 X 1,5-3,0 [xm grofi.
Im Hypolimnion von Siifiwasserseen frei zwischen dem iibrigen Plankton
schwebend, doch vor allem im Schlamm vorkommend. Fundort Norrviken
(Schweden).
6. Achroonema articulatum Skuja 1956 (Fig. 144)
Faden gerade oder fast gerade, ausnahmsweise gebogen; lang und beweglich.
Zellwande sehr deutlich, hyalin und dick. An den Querwanden sind die Faden
deutlich eingeschnurt. Fadenenden manchmal verjiingt, oder erweitert.
Apikalzellen kegelformig abgerundet, iibrige Zellen kurz zylindrisch, an den Enden
mifiig abgerundet; ihre Grofie ist variabel. Meist haben diinne Faden lingere
Zellen, wahrend breite Faden kurze Zellen besitzen. Protoplasma farblos mit
auffallender Struktur. Das Ektoplasma ist dichter und dunkler. Nach der
Zellmitte zuliegt eine weitere Plasmaschicht,die fast hyalin ist und das dunklere,
fein gekornte und graue Zentrum umgibt. Es entsteht eine Art dunkler Axial-
streifen, der sich als Zentralstrang durch den ganzen Faden zieht.
Faden langsam beweglich, etwa 35-50 (xm pro Minute.Faden 2,0-3,5 (xm breit
und 100-350 (xm lang. Einzelne Zellen 2,8-13,0 (xm lang, 0,75-4 mal linger als
breit.
Sufiwasserorganismus, der im Benthos und Hypolimnion von Seen vorkommt.
Zur Zeit der Fruhjahrszirkulation tritt er auch in den oberen Wasserschichten
auf. Fundorte Laksjon Munktosjon, Narrviken (Schweden).
7. Achroonema gotlandicum Skuja 1956 (Fig. 145)
Faden lang, fast gerade oder mifiig gebogen, ziemlich fest und leicht zerbrech-
lich. Faden an den Querwanden mehr oder weniger deutlich eingeschnurt.
Fadenenden weder verjiingt noch erweitert. Apikalzellen abgerundet, iibrige
zylindrisch und sehr lang.
Ektoplasma manchmal hyalin, Endoplasma graulich und dicht granuliert. Bewe-
gung verhiltnismifiig scnnell durch Rotation um die Langsachse der Faden.
Faden 2,5-3,0 (xm breit; Zellen 9,0-12,0 (xm lang, 5-7 mal linger als breit.
Im Benthos oder auf Grundschlamm von Siifiwasserseen; urspriinglicher
Fundort im Hypolimnion des Sigwalde trisk, Gotland (Schweden).
8. Achroonema macromeres Skuja 1956 (Fig. 148)
Fadenformiger Organismus, der entweder als Einzelfaden frei schwebend auf-
tritt oder im Benthos diinne, farblos bis weifiliche Aggregate bildet. Faden in
ihrer Linge variabel, aus wenigen Zellen bestehend oder bis einige mm errei-
chend; gerade oder leicht gebogen. An den Querwinden mehr oder weniger
deutlich und regelmifiig eingeschnurt. Mit dua^f Gallertscheide. Zellenden
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Achroonema • 235
Fig. 143. Achroonema simplex - (nach Skuja, 1956. - 670x). Fig. 144.
Achroonema articulatum - Fiden mit verschieden geformten Zellen (nach Skuja, 1956. -
670X). Fig. 145. Achroonema gotlandicum - (nach Skuja, 1956. - 670X).
Fig. 146. Achroonema splendens - a Apikalteil des Fadens - (670x), b, c
Fadenteil mit deutlichen Querwinden - (1000X), d *tenuior» - Form -
Apikalteil des Fadens- (670x) (nach Skuja, 1956). Fig. 147. Achroonemaproteiforme-
(nach Skuja, 1956. - 670X).
gerade, nicht erweitert. Apikalzellen abgerundet, iibrige Zellen zylindrisch,
verschieden lang oder tonnenformig.
Protoplasma farblos, in ein hyalines Ektoplasma und fein gekorntes, grauliches
Endoplasma differenziert. Mit groben Kbrnern, wahrscheinlich aus Volutin,
Manchmal, besonder^ltere Faden, auch mit Gasvakuolen. Zellwand fein porbs.
236 • Gleitende Bakterien - Achroonema
Fie. 148. Achroonema macromeres - verschiedene Ausbildungen von Faden,
Zellen und Protoplasten, sowie Fragmentation der Faden. Bei dem mit *
gekennzeichneten Faden sind ausnahmsweise gebildete Gasvakuolen in den
Zellen vorhanden - (nach Skuja, 1956. - 670X).
Fortpflanzung durch Hormogonien oder verschieden lange Fadenfragemente.
Faden beweglich mit einer Geschwindigkeit von 80-150 urn pro Minute.
Faden einige um bis 5 mm lang. Zellen 5,0-6,8 um breit und 7,0-15,0 um,
manchmal sogar 4,0-19 um lang; 1-3 mal, vor der Teilung 4 mal linger als breit.
Im Hypolimnion von Siifiwasserseen, zur Zeit der Friihjahrszirkulation des
Wassers auch im Epilimnion. Gelegentlich auch unter anderen Organismen im
Plankton oder im Benthos von Fischteichen und anderen stehenden Gewissern.
In Hallaren und anderen Seen Schwedens gefunden und von hier beschrieben.
9. Achroonema splendens Skuja 1956 (Fig. 146)
Achroonema splendens forma tenuior Skuja 1956
Fiden gerade oder gewunden, lang, regelmifiig, beweglich. Ohne Scheide.
Fadenenden erweitert oder verjiingt una auch gebogen. Apikalzellen immer
abgerundet, iibrige Zellen kurz zylindrisch, Querwinde ziemlich fein aber meist
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Peloploca • 237
doch sichtbar. Fiden an den Querwinden nicht eingeschniirt. Protoplasma
hyalin, fein granuliert, nur selten mit groben Kornern. Wahrscheinlich ein
thiophiler Organismus. Durch Drehung um ihre Lingsachse bewegen sich die
Faden mit einer Geschwindigkeit von etwa 200 bis 300 um pro Minute.
Zellen 1-2,5 X linger als breit, 3,4-4,2 X 4,0-10,0 urn grofi. Fiden 1000 um und
mehr lang.
Im Schlamm oder im Heleoplankton von Fischteichen, die Schwefelwasserstoff
enthalten. Urspriinglicher Fundort in einem Waldwassergraben bei Uppsala
(Schweden).
Skuja (1956) unterscheidet eine Form «tenuior», die mit der Art zu vereinigen ist:
9a. Achroonema splendens forma tenuior Skuja 1956. (Fig. 146d)
Mit schmaleren Faden (2,0-2,5 ^m) und grobkornigen Plasma; Zellen 5,0-10,0 |im lang.
10. Achroonema angustum (Koppe 1924) Skuja 1956
Oscillatoria angusta Koppe 1924
Faden gerade und gewohnlich sehr lang. An den Querwinden nicht oder
unmerklich eingeschniirt. An den Enden etwas verjiingt. Zellwinde zwischen
den Zellen erst nach spezieller Priparation (JJK) sichtbar. Endzellen leicht
abgerundet. Protoplasma farblos, homogen oder sehr feinkornig. Bewegung
gleichmifiig, mit ansehnlicher Geschwindigkeit.
Zellen 2-5 X linger als breit. Faden 0,7-1,2 um breit, Zellen 2,5-8,0 \i lang.
Im Hypolimnion von Seen und im Schlamm.
Starmach (1966) stellt diese Art zu Oscillatoria.
11. Achroonema profundum (Kirchner 1896) Skuja 1956
Oscillatoria profunda Kirchner 1896
Faden gerade oder manchmal regelmifiig wellig gebogen. An den Querwanden
nicht eingeschniirt; diese sind ohne besondere Priparation kaum zu erkennen.
Protoplasma farblos oder griulich, mehr oder weniger homogen. Fiden
beweglich, gleichmifiig um ihre Lingsachse rotierend, was besonders bei gebogenen
Fiden deutlich ist.
Fiden 2,0 um breit und 2,0-6,0 u lang. Zellen 1-3 X linger als breit.
Im Tiefenwasser von Seen und im Schlamm.
12. Achroonema proteiforme Skuja 1956 (Fig. 147)
Fiden durch relativ grobe mattglinzend Kornchen (Volutin) fleckig beschei-
nend, grofitenteils lang, unregelmifiig gebogen, ohne Scheiden. Fadenenden
weder verjiingt noch erweitert, doch auffallend abgerundet. Zellwinde zwischen
den Zellen wenig ausgeprigt, so dafi der Faden ungegliedert erscheint. An den
Querwinden nicht eingeschniirt. Protoplasma farblos, mifiig gekornt; mit
kleinen Volutinkornern, die in Reihen angeordnet sind. Fiden langsam aktiv
beweglich, um ihre Lingsachse rotierend, 50 bis 60 um pro Minute.
Fiden 1,3-1,6 \im breit und meistens 200-300 um lang. Manchmal bis 600 um
lang. Zellen 2 bis 8 mal linger als breit, 1,3-1,6 X 3,0-130 um grofi.
Am Grund stehender Binnengewisser oder auch als Planktonorganismus vor-
kommend. Fundort Girdefjirden (Schweden).
3. Peloploca Lauterborn 1913
Fiden mit stibchenformigen oder zylindrischen Zellen variabler Linge,
manchmal mit diinner Schleimscheide una zu Biindeln vereinigt. Diese Biischeln oder
238 • Gleitende Bakterien - Peloploca
Garben ahneln mitunter ein- oder zweischichtigen flachen Bandern. Faden in
den Bundeln seitwarts fest verbunden, sodafi das ganze Gebilde fest und starr ist.
Faden an den Querwanden nicht eingeschniirt. Protoplasma homogen oder fein
gekornt. Mancnmal mit einer Gasvakuole, die infolge der Lichtbrechung rot
erscheint. Zellwande diinn und fein. Reinkulturen wurden bisher nicht erzielt.
Die Arten sind nur von naturlichen Fundorten bekannt.
Vermehrung durch Fragmentaion der Biindel. Unbeweglich, frei im Wasser
schwebend.
Meist in Teichen, in denen Chara in grofkren Mengen vorkommt und zu faulen
beginnt. Kann leicht iibersehen werden, da die Fadenbiindel an Pflanzenreste
mit Leitbiindeln erinnern.
Typus generis: Peloploca undulata Lauterborn 1913
Wichtigste Literatur: Lauterborn 1913, Skuja 1956, Bergey's Manual 1957,
1974.
Bestimmungsschlussel der Arten
la Faden ohne deutliche Gallertscheide, meistens parallel in bandformigen
Biindel vereinigt 2
lb Faden mit deutlicher Gallertscheide, oft schraubenartig gewunden und
miteinander verbunden 4
2a Fadenbiindel bandformig, regelmafiig gewellt 1. P. undulata
2b Fadenbiindel flach, nicht gewellt 3
3a Fadenzerfallen in kleine Fragmente; Zellen ohne Gasvakuolen . 2.P.fibrata
3b Faden zerfallen nicht, bleiben fest zu Bundeln verbunden; Zellen mit
Gasvakuolen 3. P. taeniata
4a Biindel klein, schwach gebogen oder S-formig geknimmt; Zellen und Schei-
de ohne Gasvakuolen 4. P. ferruginea
4b Biindel machtig dick, regelmafiig schraubenartig gewunden; Zellen ohne
Gasvakuolen, doch sind sie in der Gallertscheide vornanden . . 5. P. pulchra
1. Peloploca undulata Lauterborn 1913 (Fig. 150)
Faden gewohnlich schraubenartig gewunden und parallel gestreifte regelmafiig
wellig gebogene Biindel bildend, die die Form ein- oder mehrschichtiger Bander
haben. Faden an den Querwanden nicht eingeschniirt. Protoplasma farblos,
homogen, mit einer zentralen Vakuole.
Zellen 1,0 X 6,0-10,0 urn groB. Fadenbiindel bis zu 10,0 urn breit und 60-
150 urn lang.
In SuKwasserteichen mit Massenauftreten von Chara verbreitet, in Teichen in
der BRD gefunden.
Ihrem Habitus nach ahnelt diese Art Peloploca taeniata.
2. Peloploca fibrata Skuja 1956 (Fig. 151)
Fadenbiindel farblos, fein, rigid, anfangs aus einer, spater aus mehreren Faden-
schichten zusammengesetzt. Oft in Form flacher, leicht und unregelmafiig
gewundener Bander. An den Enden gewohnlich in einzelne Faden zerfasert.
Apikalzellen abgerundet. Ihrem Aussehen nach ahneln sie mazerierten
Leitbiindeln hoherer Pflanzen. Einzelne Faden an den undeutlichen Querwanden
eingeschniirt; Faden sprode, jeweils von zarten einer Scheide umgeben. Faden in
den Bundeln parallelangeordnet und durch diinne, sehr feinen und schlecht
sichtbaren Scheiden miteinander verbunden. Oft kommt es bei einzelnen Faden
zur Fragmentation. Fragmente kurz, aus wenigen Zellen zusammengesetzt.
Protoplasma farblos, hyalin, homogen; ohne zenuale Vakuole.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Peloploca • 239
Biindel 1,5-3,0 um dick, 17 um breit und 600 urn, in Ausnahmefallen bis zu
1000 um lang. Selten erreicht ihre Lange sogar mehr als 1 mm. Fadenzellen 0,4-
0,6 urn breit und 0,4-3,0 urn lang. Gewohnlich 5 mal linger als breit; manchmal
jedoch ebenso lang wie breit.
Fig. 149. Peloploca taeniata -a,b zwei einschichtige, flache Verbande- (340X),
c,a einzelne, isolierte Faden - (340 X), e Detail eines einzelnen Fadens. Die
Einschnurungen an den Querwanden, sowie die Konturen der Gasvakuolen
treten scharfer hervor - (2700X) - (nach Skuja, 1956). Fig. 150. Peloploca
undulata - a Ende eines Fadenbiindels - (1000 X), b Einzelzelle mit wandstandi-
gem, diinnem Plasma - belag und durch zarte Plasmabriicken abgegrenzten
vakuolenartigen Binnenraumen - (2000X) (nach Liebmann, 1962).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
i-'eiopioca • it 1
In Hypolimnion und Benthos eutropher Fischteiche und Stauseen, ofters auch in
Belebtschlammbecken biologischer Klaranlagen. Originalfundorte, Munkbos-
jon und Storacksen (Schweden).
3. Peloploca taeniata Lauterborn 1913 (Fig. 149)
Faden bilden unbewegliche Biindel, die aus einer Fadenschicht oder mehreren
miteinander verwachsenen, parallel angeordneten Fadenschichten bestehen.
Biindel in Form von Bandern, abgeflacht, gerade oder leicht gewellt. Ziemlich
biegsam, fest und nicht sprode. Manchmaf durch die Gasvakuolen der Zellen
gezittert erscheinend. An den Enden nicht in einzelne Faden zerfasert. Gewohn-
lich ragen nur einzelne Faden aus dem Biindel heraus. Einzelfaden ohne nach-
weisbare eigene Scheide, aber in eine gemeinsame Scheide eingeschlossen und
mittels dieser miteinander zusammenliegend. Die Scheide ist ohne spezielle
Farbung nicht sichtbar. Das ganze Biindel ist noch in eine sekundare Scheide
eingeschlossen. An den Querwanden sind die Faden wenig, jedoch deutlich
eingeschniirt. An den Enden nicht verjiingt. Einzelne Zellen zylindrisch und
verschieden lang. Bei den Faden tritt keine Fragmentation auf. Zellen in den
Faden sehr deutlich, da sie eine grofle, zentrale, rotliche Gasvauole enthalten.
Nach der Zentrifugierung verschwindet zwar die Vakuole, dafiir werden die
Querwande deutlich. Protoplasma hyalin, homogen. Durch Lichtbrechung
erscheint es blaulich oder griinlich.
Faden 0,6-1,0 \im breit, sehr lang. Fadenbiindel bis 1 mm lang, oft 3,0-15,0 urn
breit und 1,0-3,0 urn stark. Einzelne Zellen 3,0-10,0 \im lang, oft auch kurzer
oder linger. Sekundare Scheide bis 5,0 nm dick.
In Siifiwasserteichen, in denen Chara in grofien Mengen auftritt. Die Art wachst
auch auf faulenden Zellmassen von Beggiatoa, Thiospira, Zoogloea und anderen
in Massen auftretenden Organismen. Sie tritt auch im Schlamm und im
Hypolimnion von Seen auf. Sie wurde zuerst in Teichen in der BRD gefunden.
4. Peloploca ferruginea Skuja 1956 (Fig. 152)
Faden typische Fadenbiindel bildend, Biindel fest, rigid, bogenartig gebogen
oder gekrummt, leicht abgeflacht. Die Biindel bestehen aus 2-7 parallel
angeordneten Faden. Einzelne Faden mit wenig deutlichen Querwanden und andiesen
nicht eingeschniirt. An den Enden nicht verjiingt. Apikalzellen abgerundet.
Faden einzeln in einer homogenen, hyalinen, manchmal durch Eisenablagerun-
gen leicht braunlich verfarbten Scheide eingeschlossen. An lebenden Faden sind
die einzelnen Zellen schlecht zu sehen. Protoplasma farblos, homogen oder sehr
fein gekornt; ohne zentrale Gasvakuole.
Einzelne Faden 0,3-0,5 nm breit. Scheiden 0,6 nm breit, sodafi der Faden mit
der Scheide 1,0-1,5 f«n breit wird. Fadenbiindel 300 nm lang oder langer und
3,0-10,0 f*m breit. Zellen ebenso lang wie breit, oder 2 bis 3 mal langer als breit;
0,3-1,5 [im lang.
Verstreut im Benthos oder im Hypolimnion eutropher Seen zwischen anderen
Organismen. Ofters auch im Belebtschlamm von Klaranlagen. Urspriinglicher
Fundort: Lushavet (Schweden).
5. Peloploca pulchra Skuja 1956 (Fig. 153)
Faden parallel verwachsen, regelmafiige schraubenartig gewundene, leicht abge-
flachte Biindel bildend. Diese bestehend meistaus 4 bis 10, seltener aus 15 Faden,
A Fig. 151. Peloploca fibrata - zwei einschichtige, flache Fadenverbande, die in
kurze Stiicke fragmentiert sind (nach Skuja, 1956. - 1340X).
242 • Gleitende Bakterien - Peloploca
ill
iS!
;|
152
1
Fig. 152. Peloploca ferruginea - a Verband von Fadenbandern - (135 X), b Detail
der Einzelfaden - (1000X), c einzelne Bander - (470X) (nach Skuja, 1956).
deren Enden leicht verjiingt sind. Manchmal ragen aus den Biindelenden einige
Faden hervor. Windungen der Spirale linkslaufig. Biindel sehr steif, da die Faden
vollkommen in eine braunliche, feste Gallertscheide eingeschlossen und mitein-
ander verwachsen sind; sie konnen nur sehr schwer in einzelne Faden zerteilt
werden. Faden an den schlecht sichtbaren Querwanden leicht eingeschniirt, an
den Enden nicht verjiingt. Protoplasma hyalin, farblos, homogen oder fein
gekornt, ohne Gasvakuole. Biindel leicht glanzend, was durch kleine C02-
Blaschen in der Scheide verursacht wird. Vermehrung durch Fragmentation der
Biindel.
Fadenbiindel bis 400 \im lang und gewohnlich 3,0-20,0 ^.m breit und 3,0-
15,0 um dick. Einzelne Windungen 3,0-20,0 [xm breit und 30,0-57,0 um lang.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Peloploca • 243
Faden einschliefilich der Primarscheide 1,5-1,8 n-m breit; einzelne Faden 0,4-
0,6 um dick. Zellen bis 4 mal linger als breit; 0,4-0,6 mal 0,4-2,4 ^.m grofL
Im Hypolimnion eutropher Seen oder im Benthos tieferer Teiche, oft auch in
Abwassern, besonders in Belebtschlammanlagen.
Urspriinglich im Honsan See (Schweden), gefunden; Anagnostidis und Over-
beck (1966) fanden sie im Pluss-see (Ostholstein, BRD).
153
Fig. 153. Peloploca pulchra - a schraubenartig geformte biindelformige Verban-
de - (70x), h, c dasselbe - (35x), d, e Detail eines Fadens mit vakuolisierter
Gallerthulle - (2000x),/Querschnitt durch das Bundel - (2000 X) (nach Skuja,
1956).
244 • Gleitende Bakterien - Desmanthos
4. Desmanthos Skuja 1958
Polar differenzierte Faden, die aus farblosen, meist isodiametrischen Zellen
zusammengesetzt sind und garbenartige Biindel bilden, deren unterer Teil in
einer gemeinsamen Gallertscheide eingeschlossen ist. Biindel zum grofken Teil
aus 7-10 Faden bestehend, in seltenen Fallen ist die Zahl grofier oder kleiner.
Faden mit den konisch zugespitzten basalen Teil der Scheide auf festen Unterla-
gen festsitzend. Gewohnlich ist an solchen Stellen die gemeinsame Scheide diinn
und ohne Farbung schwer sichtbar; manchmal, wahrscheinlich durch fein
gefalltes Eisenhydroxyd, leicht gelblich gefarbt. Im Schlamm ist das
Fadenbiindel bis zur unteren Halfte der Scheide eingebohrt. In diesem Falle ist die Scheide
gut sichtbar, da an ihrer Oberflache Sandkornchen und Schlammteilchen kleben;
sie ist auch wesentlich dicker und hyalin. Basale Fadenzelle abgerundet und
kegelformig verjiingt. Oberer Teil der Faden ohne Scheide; gewohnlich in
verschiedene Richtungen gebogen; an Lokalitaten mit fliefkndem Wasser biegen
sie sich in Richtung des Wasserstromes. Nach dem Apikalende zu verjiingen sie
sich allmahlich konisch. Apikalzelle kopfchenartig erweitert, abgerundet; mit
etwas verdickter, einfacher Wand. Im mittleren Teil verlaufen die Faden parallel
und die Zellen sind isodiametrisch. An den Querwanden sind keine Einschnii-
rungen zu bemerken. Zellwande fein und wenig deutlich.
Zellprotoplasma farblos, was an solchen Biindeln zu sehen ist, bei denen mehrere
Faden iibereinander liegen. Das Ektoplasma erscheint gewohnlich etwas dunkler
als das Endoplasma. In seltenen Fallen sind feine gleichmafiig verteilte Granula
von Reservestoffen, vorhanden; ohne Gasvakuolen.
Bislang wurden keine Reinkulturen erzielt; der Organismus ist nur aus dem
Freiland bekannt. Physiologische Eigenschaften unbekannt. Wahrscheinlich ist
fur das Wachstum relativ reines, ziemlich mineralstoffreiches Wasser, mit H2S-
Gehalt erforderlich.
Fortpflanzung unbekannt, wahrscheinlich durch Fragmentation der Faden und
durch Hormogonien. Nach Bergey's Manual (1974) soil die Fortpflanzung
durch Langsteilung der Faden vor sich gehen. Fadenbiindel unbeweglich, wobei
die freien Fadenteile passiv im Wasser hin und her schwingen. Bei vorsichtigem
Zerzupfen des Biindels kann man eine gleitende Bewegung der einzelnen Faden
beobachten.
Wichtigste Literatur: Skuja (1958)
Eine einzige Art:
Desmanthos thiocrenophylum Skuja 1958 (Fig. 154)
Mit den Merkmalen der Gattung.
Fadenbiindel am basalen Teil, ohne Schleimscheide, 6,0-8,0 ^m breit; ihre
Lange schwankt zwischen 50 und 160 |xm. Einzelne Faden am basalen Teil
1,5 nm, am Apikalteil nur 0,5 ^m breit. Im mittleren Fadenteil Zellen meistens
isodiametrisch oder bis 1,5 mal langer als breit. Im apikalen Teil sind die Zellen
manchmal kiirzer als breit, im basalen Teil dagegen 2-4 mal langer als breit.
Bisher nur aus den Schwefelquellen des Badeortes Kemeri in Litauen (UdSSR)
bekannt.
Fig. 154. Desmanthos thiocrenophilum - a, b zwei Exemplare von Fadenbiin- ^
deln, urspriinglich an einer festen Unterlage festsitzend - (500X), c, d zwei
Exemplare von Fadenbundeln aus Schlamm mit deutlicher Gallerthiille am
unteren Ende, an den Sandkornchen und Detritus haften- (500 X), e Apikalteil
der Faden - (1000X),/Basalteil der Faden - (1000X) (nach Skuja, 1958).
Teil III. Bakterien mit Scheide
Farblose, gramnegative Bakterien, die zylindrische, konische oder sich spindel-
formig verjiingende, elastische, polar differenzierte sowie undifferenzierte
Faden bilden. Durch ihren Habitus an Algen oder Blaualgen erinnernd, wohin
auch manche Arten in der alteren Literatur gestellt wurden. Bei den meisten
Arten sind die Faden von Gallertscheiden umgeben, die manchmal mit Eisen-
oder Manganverbindungen (Oxiden ?) impragniert sein konnen. Eine Ausnahme
bilden die Gattung Toxothrix, wo friiher das Mucoidsekret mit einer Scheide
verwechselt wurde, und die Gattung Lieskella, bei der die Individuen in eine
reichlich impragnierte Schleimhulle eingeschlossen sind. Einige Arten mit
unechter dichotomer Verzweigung. Manche vermehren sich durch bewegliche
Zellen, die eine polare oder subpolare Geifiel oder ein Geifielbiischel besitzen.
Sie bilden weder Endosporen noch einen anderen Typus von Ruhestadien. Sie
sind als festhaftende oder auch freischwebende Organismen iiberwiegend im
Siifiwasser, manche Arten jedoch auch im Meerwasser vorhanden.
Dieser Teil stellt eine kiinstliche Gruppe von Organismen dar, die keinen phylogenetischen
Zusammenhang besitzen. Sie umfafit zwei friiher selbstandige Familien, von denen die
Chlamydobacteriaceae die Gattungen Sphaerotilus, Leptothrix und Toxothrix
eingeschlossen und zu denen Skuja (1956) auch die Gattung Ophryothrix stellte, sowie die Familie
Crenotrichaceae, die die Gattungen Phragmidiothrix, Crenothrix und Clonothrix vereinigt.
Die systematische Einteilung der fadigen Bakterien dieser Gruppe, sowie ihre Bestimmung
verursacht bisher grofie Schwierigkeiten. Eine Reihe von Autoren aufiert verschiedene,
manchmal auch widersprechende Ansichten dariiber, wo ein bestimmter Organismus
einzureihen ist oder welche beschriebene Arten oder Gattungen vereinigt werden sollen.
Das Problem besteht vor allem darin, dafi diese Organismen einander sehr ahnlich sind und
ihre physiologischen Eigenschaften vorlaufig nicht ausreichend bekannt sind, da sie nur
schwer in Reinkulturen unter natiirlichen Bedingungen zu erhalten sind. Die ganze Gruppe
bedarf weiterer sorgfaltiger Untersuchungen. Deshalb wurde bisher auch noch kein wissen-
schaftlicher Name fur die zusammengefafite Gruppe vorgeschlagen.
Bestimmungsschlussel der Gattungen
la Reproductive Zellen selbstandig, mittels polarer Geifieln oder eines Biindels
von subpolaren Geifieln beweglich 2
lb Reproduktive Zellen selbstandig, nicht mittels polarer GeiKeln beweglich . 3
2a In den Scheiden werden nur ausnahmsweise Eisenverbindungen abgelagert..
1. Sphaerotilus (S. 247)
2b In den Scheiden werden reichlich Eisen- und Manganverbindungen
abgelagert 2. Leptothrix (S. 256)
3a Faden an fester Unterlage haftend 4
3b Faden nicht festsitzend, freiim Wasser schwebend 7
4a Scheiden inkrustiert 5
4b Scheiden nicht inkrustiert 6
5a Faden zumScheitelhinverjiingt 3. Clonothrix (S. 277)
5b Faden gegen den Scheitel verbreitert 4. Crenothrix (S. 281)
6a Faden nicht als Epiphyt auf Wirtsalgen festsitzend
5. Phragmidiothrix (S. 284)
6b Faden epiphytisch auf Wirtsalgen festsitzend .... 6. Ophryothrix (S. 285)
7a Bewegung der Faden gleitend; Scheide inkrustiert 8
7b Faden unbeweglich; Scheide nicht inkrustiert
7. Haliscomenobacter (S. 287)
8 a Faden scheiden Schleim in Form von strickartig verflochtenen Biindeln aus ..
8. Toxothrix (S. 289)
8b Faden in einer mit Eisenverbindungen stark inkrustierten Schleimhulle
eingebettet; Zellenzickzackartig angeordne^^. 9. Lieskella (S. 292)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sphaerotilus • 247
1. Sphaerotilus Kutzing 1833
Cladothrix Cohn 1875 (non Cladothrix Nuttal 1849, non Cladothrix Watson
1880)
Lange, farblose, gerade oder mafiig gebogene Faden, gewohnlich auf unterge-
taucnten Gegenstanden festsitzend, wo sie schmutzig-weifie bis gelbbraune oder
braune schleimige Biischel bilden, die fahnenartig im stromenden Wasser fluten.
Oft auch im Wasser frei schwebende Biischel bildend. In den meisten Fallen
verzweigen sich die Faden mehr oder weniger dichotom. Unechte dichotome
Verzweigung kann dadurch entstehen, dafi die Scheitelzellen aus der Scheide
gedrangt werden oder die Scheide zerreifit und eine der Zellen sich loslost, am
Faden festsetzt und zu einem neuen Faden heranwachst. Die Verzweigung wird
durch Umwelteinflusse bewirkt. Gewohnlich bilden sich im stehenden Wasser
mit geringem Gehalt an organischen Stoffen oder in wenig konzentrierten
Nahrlosungen die reichverzweigten Stamme von Sphaerotilus dichotomus. Die
Art der Verzweigung hangt mehr von den Kulturbedingungen ab als von der
Spezifitat des Stammes.
Im Freiland mit normalem Nahrstoffgehalt besitzen die Faden eine zarte, der
ganzen Fadenlange nach gleichmafiig breite Scheide. Diese bildet eine diinne,
hyaline, lichtbrechende, koharente, zahe Rohre, die sich ohne Beschadigung in
scharfen Winkeln biegen kann. Die glatten Innenflachen der Scheiden neigen
dazu, an den einzelnen Faden zu haften. Die meisten Autoren geben an, dafi sie
weder mit Eisen- noch mit Manganoxiden inkrustiert sind. Nach Pringsheim
(1949) sollen jedoch auch farblose Scheiden eine positive Berlinerblau-Reaktion
zeigen. Die Scheide entwickelt sich nur bei isoliert (Skerman et al. 1957) oder in
einem nahrstoffarmen Milieu (Mulder und van Vaen 1963) wachsenden Faden.
Bei Faden, die in dichten Ansammlungen wachsen, lost sich die Scheide auf
(Skermann et al. 1957). Im nahrstoffreichen Milieu, z. B. in reichen Kulturme-
dien (Mulder und van Veen 1963), wird die Scheide praktisch iiberhaupt nicht
ausgebildet. Auch junge Faden (Pringsheim 1949) sind ohne Scheide.
In Gewassern, die durch organische Stoffe verunreinigt sind und einen hoheren Gehalt an
zweiwertigem Eisen haben,Ttonnen die Scheiden durch Eisenoxide inkrustiert sein; dieser
Prozefi ist hochstwahrscheinlich nicht an den Metabolismus des Organismus gebunden. Im
Laufe der Krustenbildung wird die Scheide starker lichtbrechend und dicker, wobei sie sich
allmahlich gelb bis rostbraun farbt. In diesem Stadium kann der Organismus mit Leptothrix
ochracea verwechselt werden. Die Scheiden sind bei Sphaerotilus jedoch viel linger, weniger
briichig und die Tendenz der Zellen, die Scheide zu verlassen, ist bedeutend geringer. Der
Eisengehalt in den Scheiden kann bis zu 0,71% erreichen; Mangan wird in den Scheiden
nicht akkumuliert. Beger und Bringmann (1953) fanden an Hand von elektronenmikrosko-
pischen Untersuchungen der Scheidenstruktur, dafi sich das Eisen gleichmafiig an der
ganzen Oberflache der Scheiden ansetzt. Soweit keine Zellen vorhanden sind, verkiirzen
sich die Scheiden durch Schrumpfung und sind dann bis um 50% breiter. Die chemische
Zusammensetzung war lange unbekannt. Nach Romano und Peloquin (1963) bestehen die
Scheiden aus einem Komplex von Proteinen, Polysacchariden und Lipiden; durch ihre
Zusammensetzung sind sie den Kapseln gramnegativer Bakterien ahnlich.
Die Faden sind polarisiert. An ihrem Basalende geht die Scheide in ein Gallert-
polster iiber, mit dem die Faden an der Unterlage haften. Dies widerlegt die in
der Literatur allgemein verbreitete Ansicht, dafi beide Fadenenden dieses
Organismus gleich gestaltet seien (Skermann et al. 1957, Stokes 1954).
Unter gewissen, bislang unbekannten Umstanden konnen die Faden, ahnlich
wie Leucothrix, rosettenartige Formen bilden (Skermann et al. 1957).
Im Innern der Scheide befindet sich der eigentliche Bakterienfaden, der aus einer
Kette zylindrischer, gerader, gramnegativer Zellen mit mafiig abgerundeten
Enden besteht. Meistens liegen die Zellen eng aneinander. Sie sind innerhalb des
Fadens gleich gestaltet und gleich grofi. Jedoch sind die Ausmafie insgesamt sehr
248 • Bakterien mit Scheide - Sphaerotilus _
variabel und stark von den Wachstumsbedingungen abhangig. In nahrstoffrei-
chen Medien werden Faden mit grofien Zellen gebildet.
Junge Zellen bilden keine Querwande; ihr Protoplasma ist der ganzen Lange nach homogen.
Sie wachsen in jungen Kukuren bei ausreichender Nahrstoffmenge zu groflen, nicht
segmentierten Faden heran. Beim Altern der Kultur entstehen (laut Tkacenko und Drubl-
jancec 1959) im Faden zunachst gleichmaflig verteike, kettenartige Verdichtungen des
Protoplasmas, an deren Stelle nach einer gewissen Zeit Querwande gebildet werden. Der
Faden wandelt sich allmahlich in eine Kette stabchenformiger Zellen, die durch diinne
Plasmabriicken verbunden bleiben. Spater konnen die Zellen vollig voneinander getrennt
werden; und es bilden sich zwischen ihnen grofiere oder kleinere Abstande. Bisweilen wird
die Regelmafligkeit der Kette durch das Absterben einzelner Zellen gestort. Beim Altern
zerfallen auch die Scheiden (wahrscheinlich durch die Wirkung der Exoenzyme der Zellen)
und die Zellen losen sich aus demVerband. Sofern die Scheiden mit Eisen inkrustiert sind,
unterbleibt der Zerfall; die Migration der Zellen aus der Scheide wird verhindert (Stokes
1954). In alteren, nahrstoffarmen Kukuren konnen manchmal Riesenzellen und globulare
Formen gebildet werden, iiber deren Bedeutung bis jetzt nichts bekannt ist.
Bei lebenden Faden liegen die Scheiden den Zellen eng an. Die in der Literatur verbreitete
Ansicht, dafi zwischen dem Bakterienfaden und der Scheide ein ziemlich grofier Zwischen-
raum besteht, ist auf in fixierten Praparaten entstandene Artefakte zuruckzufiihren.
Manchmal sind in der Scheide 2-3 Zellketten zu finden.
Die aus den Scheiden austretenden Zellen sind durch ein Biindel von 8-14-(20)
subpolaren, selten auch polaren Geifteln aktiv beweglich, was im Phasenkontrast
gut zu sehen ist. Einzelne Geifteln sind schraubenartig zusammengerollt, so daft
sie wie eine einzige dicke, lange Geifkl wirken. Geifielbundel ohne eigene
Scheide. Die Abtrennung einzelner Geifkln vom Biindel ist kein Artefakt
(Stokes 1954), sondern geschieht beim Anhalten der Bewegung oder bei Gegen-
wart von H2S. Wahrend der Bewegung befindet sich das Biindel am hinteren
Zellpol und ist gewellt. Es bewegt sich auch bei ruhenden Zellen. Wahrscheinlich
entwickelt sich das Geifklbiindel noch in der Scheide, bevor die Zellen diese
verlassen. Es handelt sich um eine echte Lokomotionsorganelle, nicht um
Schleimstreifen, wie Pijper in Knaysi (1951) vermutete.
Protoplasma homogen, manchmal grob gekornt. Im nahrstoffreichen Milieu,
besonders bei einem hohen Verhaltnis von C:N, enthalt es eine grofk Anzahl
lichtbrechender Granula verschiedener Grofie. Diese kommen sowohl in Zellen
aus jungen als auch aus alteren Kukuren vor; im Hellfeld sind diese Granula
hellgelb, im Phasenkontrast hingegen erscheinen sie als weifte Partikel auf
dunklem Hintergrund. Manchmal fiillen sie die Zelle vollig aus.
Manche Autoren halten sie fur Fettropfchen, da sie sich mit Sudanschwarz B farben;
wahrscheinlich handelt es sich eher um Globuli von Poly-p-Hydroxy-Buttersaure. In
alterer Literatur werden sie irrtumlich fur ein Stadium der Sporenbildung gehalten. Das
Verhaltnis C:N hat keinen Einflufi auf ihre Grofie; manche Stamme bilden kleine, andere
grofie Globuli. In nahrstoffarmer Umwelt enthaken die Faden keine Globuli; bringt man
Faden mit Globuli in ein solches Milieu, schwinden sie schnell. Neben diesen Stoffen
speichert Sphaerotilus als Reservestoff noch Polysaccharide. Im Phasenkontrast konnen
auflerdem bei kleinen Zellen 2, bei grofien 4 der Zellange nach orientierte schwarze Granula
beobachtet werden. Diese spielen eine wichtige Rolle bei der Anhaufung von Schwefekropf-
chen bei Gegenwart von H2S. Zunachst bilden sich rund um die Granula kreisformige
Zonen, aus denen in kurzer Zeit Globuli hervorgehen, die denen von Beggiatoa ahnlich sind.
Es werden ein oder mehrere Schwefekropfchen gebildet, jedoch kann die ganze Zelle durch
sie ausgefiilk werden. In alteren Kukuren kommt Schwefel in Form von Kristallen auch
aufierhalb der Zellen im Medium vor. In einem 02-hakigen Medium werden die Schwefel-
tropfchen schnell abgebaut. In der Zellwand befinden sich elektronenoptisch sichtbare, sehr
zarte, haarahnliche Strukturen, die gewohnlich alle in eine Richtung gekriimmt sind. Ihre
Funktion wurde bisher noch nicht geklart.
Chemoorganotropher Organismus, mit respirativem, niemals fermentativem
Metabolismus. Streng aerob, wachst jedoch auch bei geringer Sauerstoffkonzen-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sphaerotilus • 249
tration zufriedenstellend (6 mg 02/l reicht zu gutem, 0,1-2,0 mg 02/l zu
schwachem Wachstum). Molekularer Sauerstoff ist der einzige Universalakzep-
tor von Elektronen: er kann nicht durch Nitrate ersetzt werden, die hier zu
Nitriten reduziert werden. Stokes (1954) erreichte auf festen Nahrboden auch
unter anaeroben Bedingungen schwaches Wachstum. Unter anaeroben Bedin-
gungen gehaltene lebende Faden sterben nicht ab. Bisher ist es nicht klar, ob
durch Oxydation von zweiwertigem Eisen wahrend seiner Speicherung in den
Scheiden Energie gewonnen wird oder nicht; dennoch wird der Organismus von
Pringsheim (1952) als ambitroph bezeichnet. Manganverbindungen werden
nicht oxydiert, obwohl die Kolonien beim Wachstum auf Boden mit MnC03,
wie Mulder und van Veen (1963) anfiihren, leicht braun gefarbt sind. Demgegen-
iiber stellten Pringsheim (1949) und Stokes (1959) fest, dall Mn das Wachstum
inhibiert. Ebenso ungeklart bleibt die Frage, ob nicht auch durch Oxydation von
Schwefelwasserstoff (H2S) zu elementarem Schwefel Energie gewonnen wird.
Moglicherweise ist dies nur eine Abwehrreaktion des Organismus gegen die
Toxizitat von Schwefelwasserstoff (H2S). Oxydation von elementarem Schwefel
zu Sulfaten wurde nicht beobachtet.
Als Energie- und Kohlenstoffquelle wird eine bunte Skala organischer Verbin-
dungen verwertet, unter denen Alkohole, organische Sauren und Zuckerarten
iiberwiegen. Als Stickstoffquelle konnen anorganische Verbindungen (Ammo-
niak, Nitrate) in Anwesenheit von Vitamin B12 oder Methionin, die nicht durch
Kobalt ersetzt werden konnen, dienen. Das Ausmall der Verwertung anorgani-
scher Stoffe als Stickstoffquelle ist von der Energiequelle abhangig. Bisher fehlt
hierfiir eine Erklarung. Sphaerotilus wachst viel besser auf Nahrboden mit
organischer Stickstoffquelle, vertragt allerdings keine hohen Konzentrationen
(schon eine 2%ige Peptonlosung inhibiert das Wachstum). Er ist jedoch tolerant
gegeniiber hoheren Kohlenhydratkonzentrationen und kann diese auch bei
verhaltnismafiig hohen Konzentrationen verwerten, womit eine enorme Pro-
duktion von Biomasse verbunden ist. Obwohl friiher angenommen wurde, dall
der Organismus Wachstumsfaktoren selbst synthetisieren konne, wird sein
Wachstum doch von einigen, nicht naher bekannten, im Kaseinhydrolysat
enthaltenen Aminosauren stimuliert; DL Aminosauren wirken dagegen inhibie-
rend. Auch im Bodenextrakt enthaltene Mineralverbindungen wirken stimulie-
rend. Es wurde eine Reihe von Stammen unterschieden, die sich durch ihre
Fahigkeit, verschiedene organische Stoffe als Kohlenstoff- oder Stickstoffquelle
zu verwerten, und durch ihre biochemischen Eigenschaften auszeichnen.
Das Wachstum ist bei einer Temperatur von 30 °C optimal; bei 15° und
40 °C gering, bei 5 °C und 46 °C wird es eingestellt. Optimale pH-Werte
liegen bei 6,4-8,1; bei pH 5,6 wachst der Organismus nicht mehr, wogegen er bei
pH-Werten von 9-10 noch langsam zu wachsen vermag. Auf Agarnahrboden
werden von unmittelbar aus dem Freiland isolierten Faden charakteristische,
braun gefarbte, filzartige Kolonien mit einem Durchmesser von 1,0-1,5 mm
gebildet, die aus Bundeln schlingenartig verflochtener Faden bestehen.
Wachstum langsam. Kolonien vom R-Typus. Nach Umimpfung dissoziieren sie zu
einem R- so wie einem S-Typus. Kolonien vom S-Typus sind halbkugelig, glatt,
glanzend, mit regelmafiigem Rand; sie werden nur aus selbstandigen Zellen
gebildet. Nahrboden mit geringen Mengen organischer Stoffe bewirken eher das
Wachstum von Kolonien des R-Typus, wahrend der S-Typus haufiger auf
nahrstoffreichen Medien wachst (Stokes 1954). Kolonien vom R-Typus erinnern
an die Kolonien von Bacillus mycoides oder Vitreoscilla. In fliissigen Nahrlosun-
gen verlauft das Wachstum wesentlich schneller.
Fortpflanzung durch Fragmentation der Faden sowie durch bewegliche Zellen,
die sich durch Querteilung im Faden innerhalb der Scheide bilden, von wo sie
dann aktiv ausschliipfen. Eine gewisse Zeit schwimmen sie in der Nahe des
250 ■ Bakterien mit Scheide - Sphaerotilus
Fadens, setzen sich dann an einer Unterlage fest und keimen zu einem neuen
Faden aus. Die beweglichen Zellen sind Stabchen mit deutlich abgerundeten
Enden; ihr Habitus erinnert an die Gattung Pseudomonas. Pringsheim (1949) ist
der Ansicht, daft diese Art der Fortpflanzung nur bei jener Form vorkommt, die
friiher als Sphaerotilus nutans bezeichnet wurde und die eine weiche Scheide
besitzt, wahrend bei der als Sphaerotilus dichotomus bezeichneten Form, die
feste Scheiden hat, die Zellen innerhalb der Scheiden bleiben. Hierdurch entsteht
die unechte dichotome Verzweigung. Eine weitere Form der Fortpflanzung ist
die Bildung von Gonidien, die manchmal mit beweglichen, stabchenformigen
Zellen verwechselt werden. Gonidien werden sowohl am Scheitel als auch an den
Flanken junger Faden gebildet, wo zunachst, wahrscheinlich durch Knospung,
ein sich allmahlich vergrofkrnder Auswuchs gebildet wird, der sich dann durch
Teilung in eine kleine aus einzelnen kugeligen, beweglichen Gonidien bestehen-
de Traube umwandelt. Der mittlere Teil der Gonidien besteht aus dichterem
Protoplasma, ihre Oberflache ist wahrscheinlich von Schleim umgeben (Tkacen-
ko und Drubljanec 1959). Obschon diese Entdeckung mit Hilfe des Elektronen-
mikroskops geschah und die Gonidienbildung lichtmikroskopisch schwierig zu
beobachten ist, wurde sie schon von Biisgen (1894) beschrieben. Nach Biisgen
bildet sich in der Scheide am Faden ein geschwulstahnliches Gebilde, auf dem
eine Gruppe von Gonidien wachst, die sofort keimen und somit ein kleines
Buschel von Faden entstehen lassen konnen, der am Mutterfaden haftet. Ahnlich
beschrieb auch Eidam (1876) die Bildung kleiner, kugeliger, scharf umrissener
und stark lichtbrechender Partikel, die zu zarten Faden keimen und am
Mutterfaden haften. Stokes (1954) erklart den Fund dieser Gebilde bei beiden Autoren
als Verwechslung mit Granula von Poly-P-hydroxi-Buttersaure. Ruhestadien
nicht bekannt. Faden unbeweglich. Bewegung nur bei reproduktiven Zellen
durch ein Bundel subpolarer Geifkln.
Weit verbreiteter Organismus in alien Typen von Siifiwassern, die durch organi-
sche Stoffe verunreinigt sind. Am haufigsten in der Stromung unterhalb der
Miindung von Abwassereinleitungen von Zellulose- und Zuckerfabriken, Mol-
kereien, Starkefabriken u. a., besonders in gut durchliiftetem Wasser (Wehre,
Stromschnellen), wo gewaltige Uberziige am Bodengrund und auf untergetauch-
ten Gegenstanden gebildet werden. Demoll und Liebmann (1952) geben an, daf?
die Produktion an Biomasse in der Nahe eines Betriebes, der taglich 100 t
Zellulose erzeugt, bis zu 70 t pro Tag erreicht. Aufkrdem werden in fiiefiendem
Wasser fadenartige Flocken oder Fadenklumpen gebildet, die zusammen mit
abgerissenen Biischeln an ruhigen Stellen des Stroms sekundare Verschmutzun-
gen verursachen. Der Organismus ruft auch das Absterben von Fischeiern und
Fischbrut hervor, dadurch daft sich die Faden an deren Oberflache festsetzen
und so die freie Bewegung und die Sauerstoffzufuhr einschranken (Lincoln und
Foster 1943, Rasmussen 1955). Auch ist der Organismus die Ursache des grauen
Stars bei Fischen, die in standig verunreinigtem Wasser leben. Ferner fiinrt die
Infektion der Kiemen bestimmter Wasserinsekten durch Sphaerotilus-F'iden
zum schnellen Schwund dieser Insekten und damit zusammenhangend zum
starken Ruckgang der Fischproduktion. Fadige Uberziige in der Gestalt dichter
Buschel spielen in freien Gewassern auch eine wesentliche hygienische Rolle; im
netzartigen Gewirr der Faden halt sich eine Reihe von Organismen einschliefilich
solcher, die fur den Menschen pathogen sind und die sich hier unter giinstigen
Bedingungen erheblich vermehren konnen.
Kommt auch in Abwassern und Klaranlagen vor, wodurch viele technische
Schwierigkeiten entstehen (Zuwachsen von Tropfkorpern, Blahschlammbil-
dung u. a.)
Pringsheim (1949a, 1949b) gelangte auf Grund von Kukurexperimenten zur Ansicht, dafi
die meisten fadenformigen Bakterien mit Ausnahme dg^^ttung Crenothrix in die Gattung
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sphaerotilus • 251
Sphaerotilus gestellt werden konnen. Er teilte sie deshalb nach ihrer Empfindlichkeit
gegeniiber Mangan in zwei Formenkreise. Formen, die durch Anwesenheit von Mangan
inhibiert werden, fafite er in der Art Sphaerotilus natans mit 5 unterschiedlichen Formen
zusammen. Organismen, die Mangan in den Scheiden speichern, d. h. Lepthothrix discopho-
ra, Leptothrix crassa und Leptothrix echinata, fafite er in der Art Sphaerotilus discophorus mit
4 Formen zusammen. Daneben unterschied er noch die urspriinglich als Toxothrix trichoge-
nes beschriebene Art als Sphaerotilus trichogenes, und die von Cataldi (1939) geziichtete
Leptothrix ochracea-Vorm von der von Kiitzing (1843) beschriebenen Leptothrix ochracea
und anderte ihren Namen in Sphaerotilus ochraceus ab. - Schoph et al. (1965) fanden in
Pyriten verlassener Kohlenbergwerke einen Organismus, den sie fur eine fossile Art hielten
und Sphaerotilus catenulatus Schoph et al. 1965 nannten.
Wichtigste Literatur: Kiitzing 1833, 1843, 1849, de Brebisson 1849, Cohn
1870,1875, Eidam 1879, Zopf 1884,1892, Hansgirg 1888, Biisgen 1894, Fischer
1895, Migula 1895, 1900, Schikora 1899, Hoflich 1901, Linde 1913, Zikes 1915,
Koppe 1924, Butcher et al. 1932, Naumann 1932, Smit 1934a, 1934b, Beger
1935, Kolkwitz 1935, Biswas 1937, Lackey und Wattie 1940, Lincoln und Foster
1943, Wuhrmann 1946, Pringsheim 1949, 1952, 1957, Wuhrmann und Kostler
1950, Pijperin Knaysi 1951, Demoll und Liebmann 1952, Bahr 1953, Beger und
Bringmann 1953, Stokes 1954, Gaufin und Farzwell 1955, Hohnl 1955, 1956,
Rasmussen 1955, Prave et al. 1956, Wiirtz 1956, Bergey's Manual 1957, 1974,
Razumov 1957, 1961, Scheuring 1957, Skermann et al. 1957a, 1957b, Tkacenko
und Drubljanec 1959, Waitz und Lackey 1959, Dondero et al. 1961, Romano
und Peloquin 1963, Mulder et al. 1962, Mulder und van Veen 1962a, 1962b,
1963, Okrend und Dondero 1964, Doetsch 1966, Mandel et al. 1966, Pasveer
1968, Hausler 1972, Eikelboom 1975.
Eine einzige Art:
Sphaerotilus natans Kiitzing 1833 (Fig. 155)
(non Sphaerotilus natans Sack 1925)
Sphaerotilus lacteus Kiitzing 1843, Sphaerotilus thermalis Kiitzing 1843,
Sphaerotilus glaucus Kiitzing 1849, Sphaerotilus ochraceus Brebisson 1849 (non
Sphaerotilus ochraceus Pringsheim 1949), Cladothrix dichotoma Cohn 1875 (non
Cladothrix dichotoma Mace 1888), Cladothrix dichotoma var. leptochaeteformis
Hansgirg 1888, Sphaerotilus roseus Zopf 1892, Cladothrix natans (Kiitzing 1833)
Migula 1895, Streptothrix fluitans Migula 1895, Cohnidonum dichotomum Mez
1898, Sphaerotilus fluitans (Migula 1895) Schikora 1899, Chlamydothrixfluitans
(Migula 1895) Migula 1900, Leptothrix fluitans (Migula 1895) Schoenichen et
Kalberlah 1900, Sphaerotilus dichotomus (Cohn 1875) Migula 1900, Sphaerotilus
natans var. cladothrix Butcher 1932, Sphaerotilus natans var. depauperatus
Butcher 1932, Sphaerotilus natans var. transiens Butcher 1932, Sphaerotilus
natans var. typica Butcher 1932, Sphaerotilus natans var. vulgaris Butcher 1932,
Sphaerotilus paludosus Smith 1934, Sphaerotilus tenuis Beger 1935, Cladothrix
dichotoma f. major Biswas 1937, Sphaerotilus natans f. dichotoma Pringsheim
1949, Sphaerotilus natans f. eutrophica Pringsheim 1949, Sphaerotilus natans f.
typica Pringsheim 1949, Sphaerotilus natans f. roseus (Zopf 1892) Beger 1953,
Cladothrix fluitans (Migula 1895) Razumov 1961, Cladothrix rosea (Zopf 1892)
Razumov 1961.
Mit den Merkmalen der Gattung.
Ausmafie der Zellen sehr variabel. Die meisten Autoren geben eine Grofie von
0,7-2,5 X 3,0-10,0 \im an, wobei Stokes (1954) anfiihrt, daft die Zellen in
Kulturen eine Lange bis zu 16,0 ^m erreichen konnen. Nach Stokes (1954)
bilden die Geifkln ein 0,2 ^m starkes Bundel und sind 80-90 H-m lang. Riesen-
zellen (Mulder und van Veen 1963) messen bis 8,0 X 27,0 nm. Scheide meist 1,0-
2,0 (un, manchmal jedoch bis 4,0 H-m dick. Fadenlange kann 500 bis 1000 \un
erreichen.
252 • Bakterien mit Scheide - Sphaerotilus
Fig. 155. Sphaerotilus natans - a gallertiges frei im Wasser flutendes Fadenbiin-
del (nach Liebmann, 1962. -15X ),b dichotom verzweigte Faden als Sphaerotilus
dichotomus beschrieben (nach Cyrus Z., 1969. - 250X), c unverzweigte Faden
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sphaerotilus • 253
Urspriinglich wurde mit dem Namen Sphaerotilus natans ein Organismus
bezeichnet, der lange, unverzweigte oder nur selten dichotom verzweigte Faden
besitzt und deren zarte, schleimige, verhaltnismafiig breite und feste, schwer
sichtbare Scheiden so aneinanderhaften, dafi kompakte, schleimige, schmutzig-
weifk bis braunliche, pinselartige Biischel entstehen. Manchmal bilden sie frei
schwebende schleimige Klumpen. Sie kommen meistens in starker verunreinig-
ten stillen sowie fliefienden Sufiwassern, unter Kanalmiindungen, in Abwassern,
in Belebtschlamm vor. Urspriinglich aus verunreinigtem Wasser der Elbe bei
Magdeburg (DDR) beschrieben.
In einer ganzen Reihe von Arbeiten gelang es verschiedenen Autoren (Vinogradskij 1888,
Fischer 1895, Migula 1895, Rullman 1904 u. a.) zubeweisen, dafidie Gntt\mgenSphaerotili4S
und Cladothrix identisch sind. Die Arbeiten weiterer Autoren (Hoflich 1901, Linde 1913,
Zikes 1915, Bahr 1953, Beger und Bringmann 1953, Stokes 1954, Hohnl 1956, Wiirtz 1956,
Razumov 1957) bewiesen deutlich die Richtigkeit der schon von Kolkwitz (1909) sowie von
Naumann (1932) formulierten Annahme, dafi Sphaerotilus dichotomus (= Cladothrix
dichotoma) und Sphaerotilus natans identisch seien. Besonders Pringsheim (1949) bewies
dies eindeutig auf Grund von Kulturexperimenten, bei denen sich die eine Form in die
andere umwandeln liefi. Dem stehen jedoch die Angaben von Brif (1936) und Cataldi (1937)
gegeniiber, die beide Typen diagnostisch unterscheiden.
Razumov (1961) fafit die Gattungen Sphaerotilus und Cladothrix zu einer Gattung unter der
Bezeichnung Cladothrix zusammen. Den Namen Sphaerotilus will er dem friiher als
Sphaerotilus paludosus beschriebenen Organismus und den Stammen von Sphaerotilus
natans, mit denen Brif (1936), Ruchhoft und Watkins (1928) und Razumov (1935) arbeite-
ten, belassen. Den Unterschied zwischen den Gattungen Cladothrix und Sphaerotilus in
dieser Auffassung erblickt er vor allem darin, dafi Cladothrix mineraliscnen Stickstoff
verwerten kann, wahrend Sphaerotilus als Energiequelle organische Stoffe benotigt.
Die Tatsache, dafi bei diesem Organismus unter gewissen Bedingungen in den Scheiden
Eisen abgelagert wird, fuhrte einige Autoren zur irrigen Ansicht, dafi er mit Leptothrix
ochracea identisch sei (vor allem Pringsheim 1949, Stokes 1954, Hohnl 1955, 1956 u. a.).
Pringsheim (1949) anderte daher den Namen Leptothrix ochracea in Sphaerotilus natans
forma ochracea. Mulder und van Veen (1963) bewiesen jedoch an Hand von Kulturen, dafi
dies ein Irrtum ist.
Beger und Bringmann (1953) wiesen mit Hilfe der Elektronenmikroskopie die unterschiedli-
che Scheidenstruktur der Gattungen Leptothrix und Sphaerotilus nach. Dem widerspricht
jedoch der Befund von Mandel et al. (1966), die auf Grund der Zusammensetzung derDNA
zu dem Schlufi gelangten, dafi Leptothrix ochracea ein mit Sphaerotilus natans eng,verwand-
ter Organismus ist, und die ihn daher zur Gattung Sphaerotilus stellen.
Ahnlicn unrichtig anderte Pringsheim (1949a, 1949b) auch den Namen Leptothrix sidero-
pous in Sphaerotilus natans, da er ihn fiir junge Faden von Sphaerotilus natans hiek und den
Namen Clonothrix fusca in Sphaerotilus natans forma patens und spater in Sphaerotilus
natans forma fusca um. Bei alien diesen Formen hiek er ihre Empfindlichkeit gegeniiber der
Anwesenheit von Mangan im Kulturmedium fiir das wichtigste taxonomische Merkmal.
Razumov (1957) war der Ansicht, dafi es problematisch sei, Cladothrix dichotoma von
^als Sphaerotilus natans beschrieben (nach Cyrus Z., 1969. - 250X), d Fadende-
tail; Scheide und Gallertpolster gut sichtbar (nach Mikrophoto umgezeichnet -
Hirsch und Pankratz, 1970. - 1000X), e Detail eines dichotom verzweigten
Fadens (nach Cyrus Z., 1969.- 1000x),/"Entlassungbeweglicher Zellen aus der
Scheide des Mutterfadens (nach Kollkwitz, 1915. - 1000X), g bewegliche Zellen
mit Biindeln subpolar angebrachter Geifieln (nach verschiedene Autoren -
1000X), h Faden mit sehr feinen Scheiden aus verunreinigtem Wasser, i Faden in
sehr feiner Scheide, die nur an der Stelle der Unterbrechung der Zellkette
sichtbar ist,; Faden mit mehreren Zellketten in einer schlecht sichtbaren Scheide
(h-j nach Pringsheim, 1952. - 1000X), k Faden mit unregelmafiig angeordneten
Zellen (nach Linde, 1913. - 1000X), / Zellen der «S»-Typus-Kolonien aus
nahrstoffreichen Medien (nach Mikrophoto umgezeichnet - Mulder und van
Veen, 1963.- 1000X).
254 • Bakterien mit Scheide - Sphaerotilus
Leptothrix ochracea und Leptothrix crassa zu trennen. Ferner hielt er die neuen, von
Kalinenko (1945, 1946) entdeckten Arten (Leptothrix issatschenkoi, Leptothrix sihirica und
Leptothrix moscvaensis) fiir heterotrophe Varianten der Gattung Sphaerotilus. Butcher et al.
(1932) vereinigten sogar Crenothrix polyspora unter dem Namen Sphaerotilus natans var.
prolifera mit Sphaerotilus.
Die wenig bekannten Organismen Leptothrix parasitica, Haliscornenobacter hydrossis (=
Streptothrix hyalina), Leptothrix epiphytica halt Pringsheim (1949) fiir junge Faden von
Sphaerotilus natans. Beger und Bnngmann (1953) stimmen dem zu. Ebenso bezeichnete
auch Sphaerotilus fluitans, Sphaerotilus tenuis und Leptothrix lopholea als zu Sphaerotilus
natans gehorig. Pasveer (1968) aufierte die Ansicht, dafi fadenformige Stamme von
Escherichia coli aus fliefiendem Wasser als Sphaerotilus beschrieben wurden, was von Heukelekian
(1968) scharf zuriickgewiesen wurde. Zopf (1882) hielt diesen Organismus auf Grund von
Beobachtungen an Kulturen fiir pleomorph; er beschrieb das Vorkommen von Mikrokok-
ken, Vibrionen, Spirillen und Spirochaeten zusammen mit den stabchenformigen Zellen.
Bei der Identifizierung kann Sphaerotilus leicht mit einigen Arten der Gattung Thiothrix
verwechselt werden. Die morphologische Ahnlichkeit ist jedoch nur scheinbar, da Thiothrix
zum Unterschied von Sphaerotilus echte Faden bilden. Eine Verwechslung ist auch mit der
jedoch iiberwiegend im Meerwasser vorkommenden Leucothrix moglich und schliefilich bei
oberflachlicher Beobachtung auch mit Bacillus mycoides, da auch bei diesem das
Vorkommen einer Scheide beschrieben wurde (Kalinenko 1952).
Ahnlich fanden Lackey und Wattie (1940) im Belebtschlamm Faden, die von Vertretern der
Gattung Bacillus gebildet sind. Eikelboom (1975) macht darauf aufmerksam, dafi
Sphaerotilus natans bei oberflachlicher Beobachtung (besonders bei Blahschlammbildung) leicht mit
einer ganzen Reihe von gramnegativen und grampositiven fadenbildenden, manchmal in
eine Scheide eingeschlossenen Bakterien verwechselt werden kann. Diese Organismen
wurden noch nicht griindlich erforscht und beschrieben; ihre Morphogenese ist sehr variabel
und von den Kulturbedingungen abhangig.
Folgende, urspriinglich als selbstandig beschriebene Arten oder Formen miissen wegen
unzureichender diagnostischer Unterschiede zu dieser Art gestellt werden:
a. Sphaerotilus dichotomus (Cohn 1875) Migula 1900 (Fig. 155a)
Cladothrix dkhotoma Cohn 1875 (non Cladothrix dichotoma Mace 1888), Cohnidonum
dkhotomum Mez 1898, Sphaerotilus natans var. cladothrix Butcher 1932, Sphaerotilus
natans forma dichotoma Pringsheim 1949.
Dunne, zarte, reich dichotom verzweigte Faden bilden farblose oder weifiliche, frei
schwebende Flocken oder einen weifilicnen bis graubraunen Belag auf untergetauchten
Gegenstanden oder Pf lanzen. Sie haben eine diinne, deutlich sichtbare Scheide und kommen
meistens in weniger verunreinigten, stillen oder langsam fliefienden Gewassern, in Siimpfen,
Tiimpeln u. a. vor. Oft zwischen verwesenden Algen, weniger haufig in Abwassern zu
finden; ofter in aktiviertem Schlamm schwach belasteter aerober Belebungsanlagen.
Koppe (1924) beschrieb bei Uberziigen, die aus einer Tiefe von 40-70 m gewonnen wurden
(ostholsteinische Seen, BRD), eine hell blaugriine Farbung, die auch von Schmidle (1903) bei
Material aus dem Nyasasee (Siidafrika) erwahnt wurde.
b. Sphaerotilus natans var. depauperatus Butcher 1932
Eine Hungerform von Sphaerotilus natans. Im Abwasser gefunden.
c. Sphaerotilus natans var. transiens Butcher 1932
Eine Ubergangsform zwischen Sphaerotilus natans und Zoogloea ramigera (Pringsheim
1949). Aus Abwasser beschrieben.
Hochstwahrscheinlich auf der Beobachtung einer Mischkultur im Abwasser gemeinsam
vorkommender Organismen, beruhend.
d. Cladothrix dichotoma var. leptochaeteformis Hansgirg 1888
Gerade, oder leicht gekriimmte Faden einfach oder diinn strahlenformig verzweigt, wobei
sich bald Seitenf'aden vom Hauptfaden abtrennen. An der Basis sind die Hauptfaden dicker.
Mit schleimiger, durch abgelagerte Eisenverbindungen gelb bis rostbraun gefarbter
Scheide.
Auf untergetauchten Balken wurden in dem Flufi Vltara bei Praha sowie bei Sudomefice,
Tabor und in Oscillatoria-Kulturen aus der Vltara bei Modrany (CSSR) gefunden, wo siean
der Oberflache schwebende gelbliche Flocken bildeten.
e. Cladothrix dichotoma forma major Biswas 1937
Eine Form, die ein morphologisches Zwischenglied zwischen Sphaerotilus natans und
Sphaerotilus dichotomus sein konnte. Lange zylindrischeijklen, die, falls aneinanderhaf-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sphaerotilus • 255
tend, manchmal dichotom strahlenformig verzweigt, zum Teil scheinverzweigt sind. Mit
deutlicher Scheide. Zellen deutlich oval, mit breit abgerundeten Enden, durch eine transpa-
rente Querwand voneinander getrennt. Protoplasma homogen. Faden einschliefilich der
Scheide 2,0-3,0 p,m breit. Zellen 4,0-8,0 (- 12,0) urn lane.
Im See Gordomah (5330 m) im Himalaja bei Thangu, Sikkim (Indien) beschrieben, in der
Uferzone gemeinsam mit Leptothrix ochracea.
f. Sphaerotilus fluitans (Migula 1895) Schikora 1899
Streptothrix fluitans Migula 1895, Chlamydothrix fluitans (Migula 1895) Migula 1900,
Leptothrix fluitans (Migula 1895) Schoenichen et Kalberlah 1900, Cladothrix fluitans
(Migula 1895) Razumov 1961.
Faden sehr diinn, festsitzend, mit reichlicher dichotomer Verzweigung. Scheide weich; aus
ihr losen sich kugelige Gonidien, die an der aufieren Schicht der Scheide haften, wo sie
keimen. Schikora (1899) hielt sie fiir Sporen. Unter bestimmten Bedingungen kann der
Organismus ziegelrot gefarbt sein (Kolkwitz 1909).
Zellen 3,0 X 6,0-7,0 p,m grofi, Faden bis 1 cm lang.
Verhaltnismafiig selten in schnell f liefiendem Wasser, gewohnlich auf untergetauchtem Holz
oder Wasserpflanzen festhaftend. Wachst laut Schikora (1899) zufriedenstellend auch bei
+ 1 °C. Migula (1900) berichtet iiber das Vorkommen in Siimpfen. Pringsheim (1949) halt
den Organismus fiir keimende Stadien von Leptothrix ochracea (= Sphaerotilus natans f.
ochracea).
g. Sphaerotilus roseus Zopf 1892
Cladothrix rosea (Zopf 1892) Razumov 1961, Sphaerotilus natans iorms, roseus (Zopf 1892)
Beger 1953.
Je nach den Umweltverhaltnissen morphologisch mit Sphaerotilus natans oder Sphaerotilus
dichotomus identischer Organismus. Im Wasser mit geringer Verunreinigung sind die Faden
diinn und verzweigt; bei starkerer Verschmutzung dicker und nicht verzweigt. Unterschei-
det sich von der Leitart durch rosa, pfirsichfarbene, zinnober- bis karotten- oder ziegelrote
Farbung, die besonders bei grofieren Anhaufungen des Organismus auffallt. Die Farbewird
durch ein nicht naher bestimmtes Pigment bewirkt, das nach Absterben der Zellen in das sie
umgebende Wasser iibergeht. Nach Beger und Bringmann (1953) wird die Farbung nicht
von anhaftenden fremden Organismen verursacht, wie Pringsheim (1949) vermutete.
Zellen 0,7-1,0 p,m breit, nach Kolkwitz (1909) bis 2,0 p,m.
Urspriinglich aus der Oder bei Miinchberg (DDR) beschrieben. Gewohnlich an einem
anderen, in Massen vorkommenden Organismus festsitzend (Sphaerotilus natans, Lepto-
mituslacteus u. a.). Verhaltnismafiig selten, am haufigsten an kleinen Lokalitaten zu finden.
Eine Ubersicht der Fundorte wird von Beger und Bringmann (1953) gegeben. In der CSSR
auf dem Wehr im Flufi Stfela bei Kaznejov unterhalb der Einmiindung des Abwasserkanak
eines Betriebes fiir Zitronensaureherstellung gefunden, wo er haufig in Gesellschaft von
Leptomitus lacteus, Sphaerotilus natans und Fusarium aquaeductum vorkam; von letzterem
deutlich durch Farbung unterschieden.
h. Sphaerotilus paludosus Smit 1934
Im Wasser frei schwebende Faden; nie an einer Unterlage festsitzend. Kugelige oder
federartige Kolonien in Form von Wattebauschen bildend, die, wenn sie grofier sind,
sedimentieren. Der Bakterienf aden ist in eine diinne, vollig unsichtbare Scheide eingeschlos-
sen, die sich nicht einmal in gefarbten Praparaten feststellen lafit; ihr Vorhandensein ist
jedoch anzunehmen, da die Zellen im Faden ziemlich voneinander entfernt sind und der
Faden dennoch nicht zerfallt. Mineralischer Stickstoff kann nicht verwertet werden; der
Organismus braucht zusatzliche Wachstumsfaktoren.
Faden 1,2-1,5 p,m breit.
Kommt meistens wahrend der kalten Jahreszeit im Wasser vor. Nach Smit (1934) ist die Art
dieHauptursache von Blahschlammbildung in stark belasteten Belebungsanlagen. Razumov
(1961) ist der Meinung, dafi sie im Blahschlamm auf Flocken wachst, die aus Sphaerotilus
dkhotomus (= Cladothrix dichotoma) bestehen.
Eikelboom (1975) macht auf die auffallige Ubereinstimmung mit dem Organismus, den er
als «Typ - 1863» bezeichnet, aufmerksam. Er charakterisiert ihn als kurze Zellenkettchen,
die Streptokokken ahnlich sind. Eine Scheide hat er nicht beobachtet. Die Faden schweben
frei zwischen Belebtschlammflocken.
L Sphaerotilus tenuis Beger 1935
Diinne, unverzweigte Faden, ca 0,8 u breit, in aktiviertem Schlamm Blahschlammbildung
verursachend. Von Pringd^im (1949) als keimende Faden von Sphaerotilus natans angese-
256 • Bakterien mit Scheide - Leptothrix
hen. Eikelboom (1975) betrachtet diesen Organismus als identisch mit seinen Isolaten, dieer
als «Typ- 1701» bezeichnet, bei den en sich nur selten Verzweigungen bemerkbar machten,
und die eine Zellgrofie von 0,5-0,9 X 2,5-3,5 urn aufwiesen.
j. Sphaerotilus glaucus Kiitzing 1849
Frei schwebende, blaulich graue, aneinanderhaftende Fadenflocken. In Pfiitzen bei
Karlsruhe (BRD) gefunden.
k. Sphaerotilus lacteus Kiitzing 1843
Milchig gefarbte, weiche, gewellte, aneinanderhaftende, frei schwebende schliipfrige
Fadenflocken. In den Thermalquellen (+ 45 °C) von Abano Terme bei Padua (Italien) gefunden.
1. Sphaerotilus thermalis Kiitzing 1843
Dunkel gefarbte, frei schwebende Fadenflocken; Scheiden schleimig, aneinanderhaftend. In
fliefiendem Thermalwasser in den Quellen von Abano Terme bei Padua (Italien) und in
Baden-Baden (BRD) gefunden.
m. Sphaerotilus ochraceus de Brebisson 1849
Frei schwebende braune Fadenflocken. In der Umgebung von Falaise (Frankreich) in
verunreinigtem Wasser gefunden.
2. Leptothrix Kiitzing 1843
Detoniella Trevisan 1889, Chlamydothrix Migula 1900
Gerade oder schraubenformig gekriimmte Faden, die bei manchen Arten unyer-
zweigt, bei anderen jedoch dichotom verzweigt sind; mit zylindrischer Scheide,
die anfangs diinn und farblos ist, spater aber dick, lichtbrechend, glatt oder rauh,
gelb bis ockerbraun wird, da sie entweder durch Eisenhydroxid, Manganoxide
oder durch beide zugleich inkrustiert ist. Wenn die impragnierte Scheide eine
bestimmte Dicke erreicht, hemmt sie wahrscheinlich den Stoffwechsel des
Organismus, weshalb die Zellen bei manchen Arten die Tendenz haben, die
Scheide zu verlassen. Man findet dann eine Menge mehr oder weniger langer
leerer, rohrenartiger, stark lichtbrechender, homogener, durchsichtiger Gebilde
im ockerfarbenen Sediment, besonders im eisen- und manganreichen Milieu
(Quellen, Wasserwerke, Wasserleitungen u. a.). Scheiden verhaltnismafiig spro-
de, leicht brechend, so dafi lange Scheiden selten zu finden sind; auch ist es
schwierig, ihre Lange zu bestimmen. In verdiinnte HCl sind sie nicht restlos
loslich, wie Cholodnyj (1924, 1953) irrtumlich annahm. Die Ultrastruktur der
Scheide (Beger und Bringmann 1953) weist darauf hin, dafi die Inkrustation der
Scheiden zunachst an Strukturelementen (Fasern) erfolgt und erst spater, bei
vergrofierter Breite der Scheide, in granulierter Form auf ihrer Oberflache.
Dadurch unterscheidet sie sich wesentlich von den Scheiden der Gattung
Sphaerotilus. Nach Mulder und van Veen (1963) weist das Vorkommen von Scheiden
wahrscheinlich auf einen Mangel an organischen Stoffes hin. In nahrstoffreichen
Medien werden sie manchmal iiberhaupt nicht gebildet. In Abwesenheit von
zweiwertigem Eisen und bei geringem Gehalt anorganischen Stoffen sind sie
diinn, farblos. Eine Art bildet ein gut entwickeltes Gallertpolster.
In den Scheiden befindet sich eine Kette von stabchenformigen, deutlich ge-
trennten farblosen Zellen, die in der Regel 2 mal langer als breit sind. Manchmal
kommen sie auch als kurze bewegliche, hochstens aus 8 Zellen bestehende
Ketten vor oder als frei schwimmende, einzelne Zellen oder Zellpaare. Die
Bewegung erfolgt mit Hilfe einer polaren Geifiel; nur eine Art hat ein subpolares
Biindel mehrerer Geifieln. Nicht selten kommen lange Faden vor, bei denen sich
keine einzelnen Zellen unterscheiden lassen. Cholodnyj (1924) halt sie fur
Riesenzellen. Nach Mulder und van Veen (1963) kommen sie dann vor, wenn der
Faden die Scheide zu bilden beginnt. Bei Faden mit dicker Scheide sind die Zellen
meist kurz. Bei deutlich gegliederten Faden sind die Zellen nach Cholodnyj
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 257
(1924) durch diinne plasmatische Briicken verbunden. Ruhestadien nicht be-
kannt. Zellen gramnegativ; das Protoplasma der meisten Arten enthalt Globuli
von Poly-|3-Hydroxy-Buttersaure als intrazellulares Reservematerial.
Ernahrungsweise bislang noch nicht befriedigend geklart. Diese Frage ist praktisch seit der
Zeit umstritten, als Vinogradskij (1888) die Theorie vom autotrophen Wachstum eisenhalti-
ger Bakterien entwickelte, der an Hand der Ergebnisse von Kulturexperimenten auch neuere
Autoren zuneigen. Zur Zeit iiberwiegt jedoch die Ansicht (gestiitzt auf die Ergebnisse einer
ganzen Reihe von Autoren (Lieske 1919, Cataldi 1939, Gamer und Schwartz 1956,
Kalinenko 1946,1956, Hohnl 1955, 1956, Rouf und Stokes 1964, Stokes und Johnson 1965
u. a.), dafi diese Organismen chemoorganotroph wachsen konnen, was auch schon von
Molisch (1892, 1910) festgestellt wurde. Johnson und Stokes (1966) und Habib Ali und
Stokes (1971) geben an, dafi Leptothrix-Arten fahig sind, sich sowohl auf chemoorganotro-
phe, als auch (bei Anwesenheit von essentiellen Vitaminen) auf chemolithotrophe Weise zu
ernahren. Verbindungen von dreiwertigem Mangan wirken stimulierend bei chemoorgano-
trophem Wachstum. Hohe Konzentrationen iiben dagegen eine inhibitive Wirkung aus, was
die Autoren darauf zuriickfiihren, dafi der Organismus bestrebt sei, iiberfliissige Ionen in
der Umgebung zu oxydieren; deshalb werden sie in der Scheide abgelagert. Die Stimulierung
des Wachstums ware danach die Folge eines gesteigerten Metabolismus, denn (zweiwerti-
ges) Mangan ist als Kofaktor einer Reihe von Enzymen bekannt. Prave (1957) sowie Prave
und Rippel-Baldes (1956) gelangten hingegen zu dem Schlufi, dafi die Organismen organi-
sche Stoffe in geringen Konzentrationen als Kohlenstoff- und Stickstoffquelle verwerten
und durch Oxydation von zweiwertigem Eisen und Mangan als chemosynthetische
Bakterien, die zur Synthese ihrer eigenen Biomasse unentbehrliche Energie gewinnen. Mulder
und van Veen (1963, 1965) und Mulder (1964) halten sie fur vollig chemoorganotrophe
Organismen; die Oxydation von Eisen und besonders von Mangan erklaren sie als eine
Funktion eines proteinartigen Stoffes auf der aufieren Schicht der Scheide; sie schliefien
jedoch die Mogfichkeit nicht aus, dafi es sich um blofie Adsorption von auf chemischem
Wege ausgefalltem Eisenhydroxyd handelt, was einige Autoren (z. B. Kalinenko 1956) als
einzig richtige Erklarung der Ablagerung von Eisen und Mangan in den Scheiden betrach-
ten. Nach Johnson und Stokes (1966) wird die Fahigkeit der Zellen, zweiwertiges Mangan
zu oxydieren, von induzierten Enzymen katalysiert.
In den letzten Jahren geht aus den Arbeiten von Dubinina (1978a,b,c,d) hervor, dafi der
Metabolismus dieser Organismen eindeutig organotroph ist; die Oxydation-von Eisen oder
Mangan bringt ihnen keinen Energieeewinn, sondern hat eine physiologische Bedeutung bei
der Detoxikation von H2O2, das bei der Oxydation organischer Stoffe ausgeschieden wird.
Metabolismus eindeutig respirativ, niemals fermentativ; Endakzeptor von Elek-
tronen ist immer molekularer Sauerstoff, streng aerob, obwohl Eisen oder
Mangan auch bei geringem Sauerstoffdruck oxydiert werden kann. Eine ganze
Reihe organischer Stoffe (Zucker, organische Sauren) wird verwertet, aber deren
Skala ist bei weitem nicht so breit, wie bei der Gattung Sphaerotilus. Zum
Unterschied von der Gattung Sphaerotilus, die nicht imstande ist Mangan zu
oxydieren, oxydieren sie zweiwertige Eisen- und Manganverbindungen. Die
Mehrzahl der Stamme benotigt organische Stoffe als Stickstoffquelle, obwohl
manche von ihnen auch anorganische Verbindungen verwerten konnen. Einige
Arten brauchen nach Stokes und Johnson (1965) verschiedene Wachstumsfakto-
ren (Biotin, Thiamin, Adenin, Guanin und Cyanokobalamin oder Methionin).
Eine Reihe von Arten wurde in Reinkulturen geziichtet. Der Charakter der
Kolonien ist von der Spezifitat des Stammes, der Zusammensetzung des
Mediums, der Konzentration der organischen Stoffe und der Einsatzmenge abhan-
gig. Die iiblichen Nahrboden erlauben kein gutes Wachstum; dies erfolgt erst bei
einer Senkung der Nahrstoffkonzentration auf mindestens die Haifte. Der
inhibitive Einflufi der gewohnlichen Medien ist eine Folge der grofien Menge in
ihnen enthaltener freier Aminosauren (Dondero 1961, Mulder und van Veen
1963). Verlangt zum Wachstum eine geringere Temperatur als die Gattung
Sphaerotilus. Das Optimum betragt 23-25 CC; bei 5 ° und 40 °C wachst der
Organismus nicht mehr, bei 34 °C nur schlecht. Bei verlangerter Inkubation ist
auch bei 5 °C noch Wachstum moglich (Stokes 1954). Der optimale pH-Wert
258 • Bakterien mit Scheide - Leptothrix
fur das Wachstum liegt bei 7,0-7,9, langsames Wachstum tritt bei pH 6,0-6,4
oder 8,2-8,6 ein; wachst nicht mehr bei pH 4,0-5,0 und 9,0-9,8.
Fortpflanzung durch Fadenfragmentation oder Bildung von aktiv beweglichen,
selbstandigen Zellen, Zellpaaren oder kurzen Ketten, die die Scheide des Mutter-
fadens aktiv verlassen.
In langsam fliefienden oder stehenden Siifiwassern, Strafiengraben, Siimpfen, im
Brunnenwasser, in Wasserwerkseinrichtungen oder Wasserleitungen, Dranlei-
tungen und Quellen vorkommend; iiberall dort, wo das Wasser zweiwertiges
Eisen oder Mangan enthalt. Weit verbreitet.
Die auch von einigen anderen Autoren (Hohnl 1955, 1956, Stokes 1954, Razumov 1935,
1957, u. a.), unterstiitzte Ansicht Pringsheims (1949), dafi die Gattung Leptothrix mit der
Gattung Sphaerotilus identisch sei, ist gegenwartig unhaltbar; sie wurde durch eine Reihe
von Arbeiten widerlegt. Beide Gattungen haben ihre Berechtigung, denn sie unterscheiden
sich durch die Ultrastruktur der Scheide, durch die Fahigkeit Mangan zu oxydieren, den
Bedarf an Wachstumsfaktoren, die Fahigkeit einige organische Stoffe zu verwerten, durch
das Temperaturoptimum usw.
Kutzing (1843) stellte diese Gattung urspriinglich zu den Algen.
Typus generis: Leptothrix ochracea (Roth 1797), Kutzing 1843.
Wichtigste Literatur: Roth 1797, Kutzing 1843, 1847, Naegeli 1849, Raben-
horst 1865, Thuret 1875, Vinogradskij 1888, 1922, Trevisan 1889, Hansgirg
1890, 1892, Molisch 1892, 1910, 1925, Migula 1895, 1900, Miyoshi 1897,
Hieronymus 1898, Schoenichen et Kalberlah 1900, Ellis 1908, Schwers 1908,
1912, Benecke 1912, Lieske 1912, 1919, Wille 1913, 1918, Setchelund Gardner
1918, Naumann 1921, 1928, Cholodnyj 1924, 1926, 1953, Perfiliev 1925, Dorff
1934, Beger 1935, Razumov 1935, 1957, Cataldi 1939, Schorr 1939, Kalinenko
1939, 1945, 1946, 1949, 1956, Breed 1948, Skuja 1948, 1956, 1964, Krasil'nikov
1949, Pringsheim 1949a, 1949b, 1957, Beger und Bringmann 1953, Stokes 1954,
Gamer und Schwartz 1956, Hohnl 1955,1956, Gamer und Schwartz 1956, Prave
und Rippel - Baldes 1956, Prave 1957, Sokolova 1959, Dondero 1961, Mulder
und van Veen 1963, 1965, Mulder 1964, Rouf und Stokes 1964, Kalbe, Keil und
Thiele 1965, Savel'eva 1965, Stokes und Johnson 1965, Johnson und Stokes 1966,
Stokes und Powers 1967, Habib Ali und Stokes 1971, 1972, Hausler 1972,
Bergey's Manual 1974, Dubinina 1978a,b,c,d.
Bestimmungsschliissel der Arten
la Fadengerade, niemals schraubenartiggekriimmt 2
lb Faden schraubenartig gekriimmt; nurselten gerade 16
2a FadenfreiimWasserschwebendoderimBenthos;niemalsfestsitzend . . 3
2b Faden an verschiedenenUnterlagenfestsitzend 10
3a Faden in normal temperierten Gewassern vorkommend 4
3b Faden in Thermalquellen (37 °C) vorkommend 6. L. thermalis
4a Faden mit Scheide bis 3 (xm breit 5
4b Faden mit Scheide iiber 4 (xm breit 6
5a Zellen im Faden 0,8-1,0 x 2,0-3,0 (5,0) (xmgrofi; Scheiden glatt
1. L. ochracea
5b Zellen im Faden 0,8-1,3 x 5,0-12,0 (xm grofi; Scheiden nicht glatt, rauh,
stark durch Manganoxide impragniert 2. L. pseudoochracea
6a Faden dichotom verzweigt; Scheide an beiden Enden konisch verjiingt,
breit, an der Oberflache rauh, gelb bis braun
3.L.discophora(schwebendeFaden)
6b Faden ohne dichotome Verzweigung 7
7a Scheidenoberflache rauh ^^ 8
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 259
7b Scheidenoberflache verschwommen; Scheide nur in der Nahe mancher
Zellen im Faden inkrustiert 7. L. levissima
8a Zellen im Faden iiber 1,5 (xm breit .. 8. L. pseudovacuolata var. subrecta
8b Zellen im Faden schmaler als 1,5 (xm 9
9a Scheide zweischichtig; nur die aufiere Schicht mit Eisenverbindungen
inkrustiert. Zellen durch eine schmale Schleimschicht voneinander getrennt.
In verunreinigten Gewassern 9. L. cylindracea
9b Scheide durch Manganverbindungen stark inkrustiert; granuliert. Zellen
eng aneinander liegend. In reinen und verschmutzten Gewassern, sowie in
Abwassern und im Belebtschlamm vorhanden 4. L. cholodnii
10a Faden senkrecht ohne Gallertpolster an der Wirtsalge festsitzend 15
10b Faden durch Gallertpolster an der Wirtsalge haftend 11
11a Einzelne Faden mit eigenem Gallertpolster 12
lib Mehrere Faden auseinemgemeinsamenPolsterwachsend 14
12a Scheiden diinn, nur anfder Fadenbasis inkrustiert 13.L. sideropous
12b Scheiden dick, langs des gesamten Fadens inkrustiert 13
13a Faden wenig oder iiberhaupt nicht dichotom verzweigt; Zellen hochstens
1,0 (xm breit 3. L. discophora (festsitzende Faden)
13b Faden mit reichlicher dichotomer Verzweigung; Zellen 1,4 (xm breit oder
breiter 14. L. major
14a Scheide nicht bis zum Scheitel des Fadens verjiingt; gleichmafiig inkrustiert;
Kolonien festsitzend 5. L.lopholea
14b Scheide bis zum Scheitel des Fadens verjiingt; Inkrustierung an der Basis
starker; schwebende Kolonien 10. L. echinata
15a Faden fein, ohne Scheide 15. L. parasitica
15b Faden in dicker, schleimiger Scheide ohne Inkrustierung
16. L. epiphytica
16a Fadenfrei 17
16b Faden nur aufWirtsalgen vorkommend, die sie schraubenartig umwinden . .
17.L.volubilis
17a Zellen im Faden iiber 1,5 (xm breit 8. L. pseudovacuolata
17b Zellen im Faden hochstens 1,0 (xm breit 18
18a Zellen im Faden0,3-0,4 (xm breit ll.L.skujae
18b Zellen im Faden ca. 0,9 (xm breit 12. L. winogradskii
1. Leptothrix ochracea (Roth 1797) Kutzing 1843 (Fig. 156)
Conferva ochracea Roth 1797, Lyngbya ochracea (Roth 1797) Thuret 1875,
Detoniella ochracea (Roth 1797) Trevisan 1889, Oscillatoria ochracea (Roth
1797) Greville 1889, Leptotrichia ochracea (Roth 1797) Trevisan 1889, Chlamy-
dothrix ochracea (Roth 1797) Migula 1900, Cladothrix ochracea (Roth 1797)
Chester 1901, Crenothrix ochracea (Roth 1797) Jackson 1902, Conidiothrix
ochracea (Roth 1797) Benecke 1912, Beggiatoa ochracea (Roth 1797) Breed 1948,
Sphaerotilus ochraceus Pringsheim 1949, Sphaerotilus natans f. ochracea (Roth
1797) Pringsheim 1949.
Faden lang und diinn, aus Ketten zylindrischer, farbloser, gleich breiter Zellen
bestehend. Faden niemals dichotom verzweigt. Nur als Planktonorganismus frei
im Wasser schwebend. Junge Faden von einer zarten, schleimigen, glatten
Scheide umschlossen, die zunachst farblos, spater mit allmahlich zunehmender
Ablagerung von Eisen- oder Manganoxiden gelb bis braun gefarbt ist. Sie ist iiber
die ganze Lange des Fadens gleich breit, sprode, leicht zerbrechlich, so dafi sich
ihre Lange schwer bestimmen lafit. Bei einem gewissen Alter der Scheide wird sie
von den Zellen mit einer Geschwindigkeit von rund 1 (xm/min. verlassen; die
ausgewanderten Zellen bilden neue Scheiden. Daher sind gewohnlich solche
Exemplare zu finden, bei denen nur ein Teil des Fadens in der sonst leeren
260 • Bakterien mit Scheide - Leptothrix
Scheide vorkommt. Es ist auch keine Seltenheit, dafi in Rohkulturen bis 90%
leere Scheiden gefunden werden; im Freiland bilden die leeren Scheiden, da sie
sich langsam zersetzen, rostbraune, watteartige oder geschichtete Bodensedi-
mente; diese enthalten sehr wenige lebende Zellen. Die leeren Scheiden erschei-
nen im Mikroskop als klar umrissene, grau gefarbte, rohrenformige Gebilde.
Unter gewissen Umstanden, nach Mulder una van Veen (1963) gewohnlich zur
Zeit der Scheidenbildung, hat der Bakterienfaden keinen Querwande, so dafi er
eine einzige gigantische, hyphen-ahnliche Zelle bildet. Zellen gramnegativ;
Protoplasma nomogen.
Ernahrungsweise cnemooreanotroph; Metabolismus respirativ. Organische
Stoffe werden als Kohlenstoff- und Stickstoffquelle verwertet, durch Oxydation
von Eisen wird Energie fur die Synthese der eigenen Biomasse gewonnen. Der
Organismus ist nicht imstande auf organischen Medien ohne zweiwertiges Eisen
zu wachsen; in reinen Mineralmedien ist er dagegen nicht fahig, die Biomasse nur
unter Verwendung von Kohlendioxid zu bilden (Prave 1957). Als
Stickstoffquelle konnen in Anwesenheit von essentiellen Vitaminen auch Mineralstoffe
verwertet werden. Zweiwertiges Eisen lafit sich durch zweiwertiges Mangan erset-
zen; es mufi jedoch zum gleichen Energiegewinn wesentlich mehr Mangan
oxydiert werden. Der Organismus vertragt kein saures, sondern braucht eher ein
neutrales oder schwach alkalisches Milieu. Bislang noch nicht in Reinkultur
gewonnen.
Fortpflanzung vorlaufig nicht genau bekannt. Die Angaben in der Literatur
beziehen sich auf Leptothrix discophora (= Leptothrix crassa), die oft mit
Leptothrix ochracea verwechselt wurde. Pringsheim (1949) fiihrt an, dafi sich der
Organismus durch bewegliche Zellen (Zookonidien) vermehrt, die sich an
verschiedenen untergetauchten Gegenstanden oder am Mutterfaden festsetzen
und zu diinnen Faden auskeimen. Solche Faden ohne Scheiden wurden als
Leptothrix parasitica beschrieben. Ist ihre Basis mit Eisen inkrustiert, werden sie
als Leptothrix sideropous oder, wenn sie strahlenformig von einem Zentrum
ausgehen, als Leptothrix echinata bezeichnet. Jedoch ist dies noch an Hand von
Kulturen zu iiberpriifen.
Zellen 0,8-1,0 X 2,0-3,0 (xm grofi, in seltenen Fallen bis 5,0 urn lang. Faden
400-500 urn, haufig auch iiber 1 cm lang. Ohne Scheide sind junge Faden
0,8 (xm, altere 1,0 (xm breit. Die Breite der Scheide ist veranderlich; bei alten
Faden erreichen reichlich inkrustierte Scheiden eine Breite bis 1,8-2,4, in
seltenen Fallen auch 3,0 urn.
Kosmopolitisch verbreitete Art. In stehenden oder langsam fliefienden, verhalt-
nismafiig kiihlen, eisen- oder manganhaltigen Sufiwassern als Planktonorganis-
mus vorkommend. Kalinenko (1946) gibt an, dafi der Organismus auch in
Fliissen ohne Eisengehalt vorkommen kann.
In der alteren Literatur (Vinogradskij 1888, Molisch 1910, Lieske 1910, Cholodnyj 1926,
Dorff 1934 u. a.) wird diese Art mit Leptothrix discophora (= Leptothrix crassa) verwechselt.
Die Rohkukur, mit der Cataldi (1939) arbeitete und die sie als Leptothrix ochracea beschrieb
ist nach Bergey's Manual (1974) wahrscheinlich Leptothrix pseudovacuolata. Pringsheim
(1949) behauptet ebenfalls, dafi sich dieser Organismus vollig vom gelaufigen Typ
Leptothrix ochracea unterscheidet und bezeichnet ihn als Sphaerotilus ochraceus Pringsheim 1949
(non Sphaerotilus ochraceus Brebisson 1849), in der Meinung, dafi die Gattung Leptothrix
mit der Gattung Sphaerotilus identisch sei. Er anderte dann (1949) den Namen dieses
Organismus in Sphaerotilus natansf. ochracea um. Schwers (1908) nahm irrtiimlicherweise
an, dafi er mit Gallionella ferruginea identisch ist.
2. Leptothrix pseudoochracea Mulder et van Veen 1963 (Fig. 157)
Faden aus farblosen, zylindrischen Zellen bestehend, morphologisch Leptothrix
ochracea ziemlich ahnlich. Zellen jedoch robuster, an Zellen von Sphaerotilus
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 261
156 157 158
Fig. 156. Leptothrix ochracea - a leere Scheide, b Faden die Scheide verlassend
(Orig. - 1500X). Fig. 157. Leptothrix pseudoochracea - die rauhe Scheidenober-
flache durch Mn02 - Kornchen verursacht (nach Mikrophoto umgezeichnet -
Mulder und van Veen, 1963. - 1500X). Fig. 158. Leptothrix discophora - a
Scheide ohne Inkrustationen; nur an Stellen der Unterbrechung der Zellketten
sichtbar, b Scheide inkrustiert, c Scheide sehr stark inkrustiert; mit grob granu-
lierter Oberflache, (nach Mikrophoto umgezeichnet - Rouf und Stokes, 1964. -
1500X), d im Plankton schwebender Faden - als Leptothric crassa beschrieben
(nach Cholodnyj, 1926. - 1500X).
natans erinnernd. Auch die Scheiden erinnern an die Scheiden der im Freiland
gefundenen Leptothrix ochracea. Verhaltnismafiig kurz, glatt, anhaftend,
manchmal mit nydratisiertem Eisenhydroxyd inkrustiert; in diesem Fall gelb-
braun gefarbt. Die Mehrzahl der Scheiden ist gewohnlich leer. In zweiwertiges
Mangan enthaltendem Milieu sind sie durch Granula von Manganoxiden auf der
Oberflache mafiig gekornt. Die Zellen haben eine starke Tendenz, die Scheiden
zu verlassen und neue zu bilden. Die beweglichen selbstandigen Zellen haben
eine polare Geifiel; sie konnen auch Streifen oder kurze, bewegliche, aus bis zu 8
Zellen bestehende scheidenlose Ketten bilden.
Physiologische Eigenschaften sind aus Reinkulturen bekannt. Auf nahrstoffar-
men Agarboden mit 0,1% Pepton und 0,1 Glukose bilden die bescheideten
Faden Kolonien in Gestalt konzentrischer Ringe. Auf Agarboden mit zweiwer-
262 • Bakterien mit Scheide - Leptothrix
tigem Mangan bilden sie braune, fadige, manchmal auch iiber 10 mm breite
Kolonien, die an jene vonSphaerotilus nutans erinnern. DerOrganismus reagiert
nicht auf erhohte Nahrstoffkonzentration im Medium durch grofieren Zuwachs
an Biomasse und unterscheidet sich dadurch wesentlich von Sphaerotilus natans.
Fortpflanzung durch lebhaft bewegliche Zellen.
Zellen 0,8-1,3 x 5,0-12,0 urn grofi.
In langsam fliefienden, nicht verunreinigten, eisenhaltigen Gewassern; in Gra-
ben, Teichen, sowie Fliissen. Kann auch in mafiig verunreinigtem Wasser sowie
in Brunnen vorkommen.
Mulder und van Veen (1963) halten es fur moglich, dafi diese Art, obwohl sie sich
physiologisch und teilweise auch morphologisch von Leptothrix ochracea
unterscheidet, doch mit ihr identisch ist.
3. Leptothrix discophora (Schwers 1912) Dorff 1934 (Fig. 158)
Leptothrix meyerii Ellis 1908, Megalothrix discophora Schwers 1912, Cladothrix
reticularis Naumann 1921, Leptothrix crassa Cholodnyj 1924, Chlamydothrix
discophora (Schwers 1912) Naumann 1929, Sphaerotilus reticularis (Naumann
1921) Cataldi 1939, Sphaerotilus discophorus (Schwers 1912) Pringsheim 1949.
Verschieden lange, schlanke, oft unregelmafiig gebogene Faden. Meistens mit
Hilfe eines Gallertpolsters an untergetauchten Gegenstanden, Wasserpflanzen
oder einer Haut an der Oberflache festsitzend; auch frei im Wasser schwebend.
Mit einer schmalen, engen, schleimigen Scheide, die in einem Eisen- oder
Manganverbindungen enthaltenden Milieu allmahlich recht breit und iippig
wird. Die Scheiden sind schwach lichtbrechend, an der Oberflache unregelmafiig
rauh bis granuliert (niemals glatt), durch die abgelagerten Mangan- undEiseno-
xide goldgelb bis dunkelbraun gefarbt. Dunne farblose Scheiden, in der die
Zellen leicht zu sehen sind, kommen verhaltnismafiig selten vor; gewohnlich nur
in einem Milieu ohne Manganverbindungen. In dieser Form sind sie schwer zu
sehen, schwerer als bei Sphaerotilus natans, und zwar nur dort, wo im Faden eine
Zelle fehlt oder die Zellen weiter voneinander entfernt sind. Bei festsitzenden
Zellen sind die Scheiden an der Basis breit und verjiingen sich allmahlich zum
Apikalende; bei schwebenden Faden verjiingen sie sich konisch oder spindelfor-
mig gegen beide Enden. Es konnen jedoch auch der ganzen Lange nach gleich
breite Faden vorkommen. Die Art der Impragnierung erweckt den Eindruck, als
ob die Scheide aus zwei Schichten besteht, von denen nur die aufiere Auflagerun-
gen von Oxyden enthalt, wahrend die innere aus dichterem, kompakterem
Material besteht. Das Ende der Scheide ist offen; oft ragt noch ein Teil des
nackten Fadens hervor, der nach und nach die diinne, schleimige Scheide bildet.
Altere Faden sind dichotom verzweigt, wobei ungeklart bleibt, ob diese Ver-
zweigung nicht durch Gonidien bewirkt wird, die an der Oberflache des
Mutterfadens zu einem jungen Faden auskeimen. Haufig ist die Aufienschicht
aufgelost, so dafi der Faden dann nur in einer diinnen, rohrenartigen Scheide
steckt, die wahrscheinlich die urspriingliche Schutzscheide darstellt (Cholodnyj
1953). Die chemische Zusammensetzung der Scheiden ist noch unbekannt.
Innerhalb der Scheide befindet sich der eigentliche Bakterienfaden, der aus
zylindrischen farblosen Zellen besteht, die sich morphologisch kaum von
Leptothrix ochracea unterscheiden. Riesenzellen wurden nicht gefunden. Zellen
gewohnlich schwer sichtbar, da die inkrustierten Scheiden undurchsichtig sind.
Aufierdem kommen selbstandige, stabchenformige Zellen mit abgerundeten
Enden vor, die sich mit Hilfe einer polaren Geifiel bewegen. Es handelt sich urn
reproduktive Zellen; morphologisch sind sie den Vertretern der Gattung Pseu-
domonas ahnlich. Manchmal treten sie in Paaren auf. Zellen gramnegativ. Mit
einer Menge lichtbrechender, sudanophiler^Granula von Poly-|3-Hydroxy-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 263
Buttersaure, die nach Stokes und Power (1967) nur in Anwesenheit von Glukose
als Energiequelle gebildet werden.
Altere Angaben, dafi es sich um einen heterotrophen Organismus handelt,
erwiesen sich als falsch. Er ist chemoorganotroph, streng aerob, mit respirativem
Metabolismus. Er verwertet eine Reihe von organischen Stoffen, besonders
Zucker, Alkohole und Fettsauren als Kohlenstoff- und Energiequelle. Nur
einige Stamme konnen anorganische Stickstoffverbindungen als einzige Stick-
stoffquelle verwerten, jedocn weisen auch diese in Anwesenheit organischen
Stickstoffs ein besseres Wachstum auf. Einige Wachstumsfaktoren, besonders
Vitamine der Reihe B, sowie einige nicht naher definierte, im Bodenextrakt
enthaltene Mineralstoffe sind erforderlich. Bislang wurde nicht befriedigend
geklart, ob der Organismus fahig ist, durch Oxydation von zweiwertigen Eisen-
und Manganionen Energie zur Synthese der Biomasse zu gewinnen. In Reinkul-
turen geziichtet. Auf Mn++ enthaltendem Agar sind die Kolonien rotbraun,
fadig (Typ R) und 0,5-2 mm grofi. Auf Agar mit Glukose und Pepton bleiben
die Kolonien sehr klein, 0,1-0,3 mm, haben glatte Rander (Typ S) und bestehen
aus selbstandigen stabchenformigen-Zellen. Auf den ublichen bakteriologischen
Nahrboden wachst der Organismus nur bei einer Verdiinnung auf die Halfte
oder mehr. Auf eine hohere Konzentration des Substrats im Medium reagiert der
Organismus nicht durch erhohte Produktion von Biomasse.
Fortpflanzung durch Zookonidien, die nach Verlassen der Scheide kurze Zeit im
Wasser rund um den Mutterfaden schwimmen, sich sodann festsetzen und zu
einem neuen Faden auszukeimen beginnen, der sich allmahlich mit einer Scheide
umgibt. Manchmal verlafit der Mutterfaden die Scheide und zerfallt in unbeweg-
liche Zellen, die wieder durch Teilung zu einem Faden heranwachsen.
Zellen im Faden nach Rouf und Stokes (1964) 0,8-1,0 x 2,5-9,8 um, nach
Gamer und Schwartz (1956) 0,6-0,9 x 1,3-2,6 um, nach Mulder und van Veen
0,6-1,4 x 1,0-12,0 urn, nach Bergey's Manual (1974) 0,5-1,0 x 1,0-6,0,
meistens 0,6-0,8 X 2,0-4,0 um grofi. Faden im Durchschnitt 300 um
(manchmal bis 2,25 mm) lane und 8-12 um, ausnahmsweise einschliefilich der Scheide
15-22 um breit; Gallertpolster 0,3-0,5 um dick und 10-12 um breit. Nicht
inkrustierte Scheiden nur bis ungefahr 1,0 um dick.
Eine im Freiland sehr haufig vorkommende Art, ebenso wie Leptothrix
ochracea; in langsam fliefienden oder stehenden, nicht verunreinigten Gewassern, an
Wasserpflanzen oder anderen untergetauchten Gegenstanden festsitzend; nicht
so auffallig, da die leeren Scheiden keine so ausgedehnten Lager bilden; daher
ofters iibersehen. Junge Faden lassen sich auch leicht auf dem Wasserspiegel
stehender Gewasser beobachten.
Cholodnyj (1924) aufierte die Ansicht, dad schon Vinogradskij (1888) mit dieser Art
arbeitete, sie aber irrigerweise fiir Leptothrix ochracea hielt und daf5 es sich bei den Kulturen,
mit denen Molisch (1910) arbeitete, um Leptothrix crassa handelte. Krasil'nikov (1948) halt
den Namen Leptothrix discophora fiir ein Synonym von Leptothrix crassa, die er zusammen
mit Leptothrix issatschenkoi zu Leptothrix ochracea stellt. Johnson und Stokes (1966) halten
die Art Leptothrix cholodnii fiir ein Synonym von Leptothrix discophora. Pringsheim (1949a,
1949b) stellte diese Art (als Sphaerotilus discophorus) zur Gattung Sphaerotilus, bei der er
insgesamt 4 Formen unterscheidet: forma eutrophica (Sphaerotilus natans ahnlich, mit sehr
diinnen Scheiden), forma manganifera (die eigentliche Leptothrix discophora), forma arach-
noides (bei niedrigem Gehalt an organischen Stoffen und Mangan spinnwebartige Uberziige
bildend) und forma ochraceoides (an Leptothrix ochracea erinnernd, in einer Umgebung mit
geringem Mangangehalt vorhanden). Gickelhorn (1937), Scheer (1934) und Preobrazenskaja
(1937) verwechseln sie in ihren Abbildungen mit Leptothrix ochracea. Naumann (1921)
verbindet sie mit Clonothrix fusca. Beger und Bringmann (1953) sind der Meinung, daft auch
Cladothrix reticularis Naumann 1921 (= Sphaerotilus reticularis (Naumann 1921) Cataldi
1939) ein Synonym dieser Art ist.
264 • Bakterien mit Scheide - Leptothrix
Dorff (1934) stellte zu dieser Art auch die folgenden Arten:
3a. Leptothrix crassa Cholodnyj 1924
Faden aus zylindrischen Zellen bestehend. Zunachst von einer diinnen, farblosen Scheide
eingeschlossen, die spater recht breit wird und durch deponierte Eisenverbindungen rost-
braun gefarbt ist. Scheide gewohnlich kiirzer als bei Leptothrix ochracea, aber wesentlich
breiter. Verjiingt sich zum freien Fadenende. Aufiere Oberflache der Scheide uneben;
Scheide nicht aus homogenem Stoff bestehend und wesentlich starker gelbbraun gefarbt. In
sumpf igen, humusreichen Eisengewassern vorhanden; vertragt hohe Konzentrationen orga-
nischer Stoffe gut.
Wahrend die Mehrzahl der Autoren diese Art als ein Synonym von Leptothrix discophora
betrachtet, wird sie von Razumov (1957) gemeinsam mit Leptothrix issatschenkoi fur eine
Art der Gattung Sphaerotilus gehalten. Kalinenko (1956) behauptet auf Grund von Kultur-
versuchen, dafi es in Reinkulturen zu morphologischen Veranderungen kommen kann, so
dafi die Zellen denen von Leptothrix crassa gleichen.
Cholodnyj (1953) nimmt an, dafi mit der Hauptart auch die folgende, als selbstandig
beschriebene Art identisch ist:
3b. Leptothrix meyerii Ellis 1908
Leptothrix ochracea sehr ahnlich, durch grobe, recht breite, impragnierte Scheiden ver-
schieden.
Faden 2,0-3,0 Jim breit und 40-70 nm lang, ausnahmsweise auch langer. Auflagerungen
zunachst ziemlich durchsichtig, was wahrscheinlich durch ubermafiige Schleimbildung
bewirkt wird.
4. Leptothrix cholodnii Mulder et van Veen 1963
Fadiger Organismus, mehr oder weniger lange Ketten von zylindrischen,
farblosen, in Scheiden eingeschlossenen Zellen bildend; die Scheiden sind der ganzen
Lange nach gleich breit, in Anwesenheit von Mangan stark durch Manganoxide
inkrustiert, die manchmal in der Umgebung der Scheiden ein zusammenh'angen-
des Lager bilden. Die Oberflache der Scheiden ist uneben, rauh, deutlich
granuliert. Faden nicht festsitzend. Aufier den Faden kommen auch selbstandige
(wahrscheinlich reproduktive) Zellen vor, die mit Hilfe einer polaren, diinnen
Geifiel aktiv beweglich sind. Ausmafie der Zellen je nach den einzelnen Stammen
veranderlich. Das Zellprotoplasma enthalt Granula von Poly-(5-Hydroxy-But-
tersaure als intrazellulares Reservematerial.
Chemoorganotropher, aerober Organismus, der fahig ist, ziemlich hohe
Konzentrationen organischer Stoffe bei gleichzeitiger hoher Produktion von Bio-
masse zu verwerten. Er erinnert dadurch an Sphaerotilus nutans und unterschei-
det sich durch diese Eigenschaft von Leptothrix discophora. Von Sphaerotilus
natans unterscheidet er sich durch die Fahigkeit, Mangan zu oxydieren, das er in
manganreichem Milieu in grofien Massen nicht nur innerhalb, sondern auch
aufierhalb der Scheiden ablagert (Mulder und van Veen 1963). In an organischen
Stoffen armen manganhaltigen Boden wachst er wie eine typische Leptothrix
discophora. Auf nahrstoffarmen und nahrstoffreichen, festen Boden bildet er
grofie, bis 5 (xm breite, runde Kolonien, deren Rander fadiger sind als die Mitte.
Auf manganhaltigen Medien sind die Kolonien f'adig, braun bis schwarzbraun.
Zellen 0,9-1,3 X 2,0-5,0 urn grofi.
In nicht verunreinigtem, eisenhaltigem, mafiig fliefiendem Siifiwasser vorkom-
mend. Kann jedoch auch aus fliefiendem verunreinigtem Wasser sowie aus
Belebtschlamm isoliert werden.
Von Johnson und Stokes (1966) als Synonym von Leptothrix discophora ange-
sehen.
5. Leptothrix lopholea Dorff 1934 (Fig. 159)
Leptothrix lopholea f. diminuta Beger 1953
Im Freiland strauchformige Kolonien mit radial angeordneten, kurzen, zarten,
der ganzen Lange nach gleich breiten, mafiig gebogenen Faden bildend. An
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 265
einem gemeinsamen robusten Gallertpolster haften mit dem Basalende (5) — 10 —
12 Faden, die sich nicht dichotom verzweigen. Gallertpolster gewohnlich starker
als die Scheiden durch Eisen- und Manganoxide impragniert. Scheiden bei den
jiingeren Kolonien glatt, bei den alteren rauh, gelb bis braun, undurchsichtigund
langs des ganzen Fadens gleichmafiig inkrustiert. Scheitel der Faden stumpf
abgerundet. Ausnahmsweise verlassen die Faden die Scheiden (Dorff 1934).
Faden aus zylindrischen, farblosen, verhaltnismafiig kleinen Zellen bestehend.
Manchmal bilden sich keine Querwande im Faden oder sie sind schlecht zu
sehen, so dafi der Eindruck entsteht, der Faden werde von einer Riesenzelle
gebildet. Die sich aus dem Faden losenden reproduktiven Zellen sind durch ein
subpolar stehendes Biindel diinner Geifieln aktiv beweglich und erinnern an die
reproduktiven Zellen von Sphaerotilus natans. Ebenfalls stabchenformig, mit
deutlich abgerundeten Enden.
Ernahrungsweise chemoorganotroph, Metabolismus respirativ. Physiologische
Eigenschaften aus Reinkulturen bekannt. Bei der Steigerung der Nahrstoffkon-
zentration in den Medien steigt die Produktion von Biomasse nicht
proportional; sie bleibt praktisch gleich. In fliissigen Medien bilden die knauelartigen
Kolonien feine Flocken von pilzartigem Aussehen. Bei den Faden, die strahlen-
formig aus einem gemeinsamen Polster hervorkommen, tritt oft unechte dicho-
tome Verzweigung auf. Die Faden konnen einzeln an einem Gallertpolster
vorkommen (Bergey's Manual 1974, Mikrophotographie S. 139); sie erinnern
dann auch in typischen Kolonien stark an Leptothrix sideropous.
Fig. 159. Leptothrix lopholea - strauchartige Kolonie mit radial angeordneten,
durchbogenen, in Scheiden eingeschlossenen Faden; *diminitta» Form (nach
Dorff, 1934.- 1500x).
266 ■ Bakterien mit Scheide - Leptothrix
Auf Agarboden, die zweiwertiges Mangan enthalten, geht die Inkrustierung der
Scheiden mit Manganoxiden langsamer vor sich. Daher sind die Kolonien
zunachst weifi, spater schwarzbraun. Sie sehen den Kolonien von Sphaerotilus
nutans ziemlich ahnlich, sind jedoch kleiner. Auf an organischen Stoffen reichen
Medien wachsen die Kolonien schlecht.
Zellen nach Dorff (1934) 0,5-1,0-1,3 um, nach Bergey's Manual (1974), wo die
Ausmafie anhand von Reinkulturen angefiihrt werden, 1,0-1,4 x 3,0-6,0 urn
grofi. Fadenl'ange nach Dorff (1934) 20-33 urn; mit Scheide rund 1,5 um breit;
das gemeinsame Polster gewohnlich ca. 5 um breit.
Sowohl in reinen, als auch in verunreinigten, langsam fliefienden Gewassern
vorkommend. Auch aus Belebtschlamm isoliert.
Die Faden des Organismus sind morphologisch sehr schwer von Sphaerotilus nutans zu
unterscheiden. Er unterscheidet sich praktisch nur durch physiologische Eigenschaften: er
reagiert wenig auf erhbhte Konzentration organischer Stoffe im Medium und oxydiert
zweiwertige Manganverbindungen. Beger und Bringmann (1953) lehnen die Ansicht Prings-
heims (1949) ab, der diesen Organismus fiir eng verwandt mit Leptothrix sideropous halt.
Darauf wiirde jedoch auch die auff allende morphologische Ubereinstimmung der von Dorff
(1934) veroffentlichten Abbildungen von Leptothrix sideropous mit der Mikrophotographie
von Mulder und van Veen in Bergey's Manual (1974) hinweisen. Krasil'nikov (1949)
vereinigt diese Art zusammen mit Leptothrix pseudovacuolata und Leptothrix echinata mit
der Art Leptothrix voluhilis. Lieske (1912) bildet diese Art irrtiimlich als Siderocapsa treuhii
ab.
Wegen ungeniigender taxonomischer Unterscheidung mufi zu dieser Art auch die folgende,
als selbstandiges Taxon beschriebene Form gestellt werden:
5a. Leptothrix lopholea forma diminuta Beger 1953
Faden 0,3 jim breit, mit undeutlichen Zellen, charakteristische strauchartige Kolonien
bildend, mit einem Durchmesser von (6) - 7 - 10 - (11) um, in denen sich selten 5, meistens
10-30 an einem gemeinsamen Polster festsitzende Faden befinden. Scheiden uber die ganze
Lange des Fadens gleichmafiig breit, gelb bis rotbraun, in Anwesenheit von Mangan
schwarzbraun gefarbt. Bei stark inkrustierten Kolonien bilden sich rostbraune Klumpen,
deren Ursprung schwer festzustellen ist.
Unsichere Arten:
6. Leptothrix thermalis (Molisch 1925) Dorff 1934
Chlamydothrix thermalis Molisch 1925
Zellen bilden feine unverzweigte Faden, die oft in Biindeln vereinigt sind. Sie
besitzen eine mit Eisenverbindungen inkrustierte Scheide. Gelb bis zimtbraun.
Faden 0,4-0,5 um breit.
In warmen Eisenquellen (37-74 °C) auftretend, wo sie dichte filzige Uberziige
bilden. Aus Japan beschrieben.
Einen ahnlichen Organismus fand schon Miyoshi (1897) und meinte, dail er mit Leptothrix
ochracea verwandt sei. Cholodnyj (1953) nimmt an, dafi es sich - sofern diese Organismen
tatsachlich in die Gattung Leptothrix gehbren - um einen Fall von thermophilen eisenhalti-
gen Bakterien handelt.
Unzureichend beschriebener, wenig bekannter Organismus.
7. Leptothrix levissima Kalbe, Keil et Thiele 1965 (Fig. 161)
Einfache, unverzweigte, gerade, seltener etwas gekrummte Faden. Unbeweg-
lich, freischwebend. Von einer dicken, schleimigen, farblosen, anfangs homoge-
nen Scheide umgeben, die innen aus dichterem Material besteht als an der
Oberflache. Ihr Rand ist nicht scharf begrenzt, sondern verschwommen. In der
Scheide befinden sich oft optisch dichte Granula, wahrscheinlich Eisen(III)hy-
droxid. Zunachst treten sie an der Innenseite der Scheide auf; vergrofiern sich
stufenweise, bis sie schliefilich grofie, knotige^fcregelmafiige, nur einen Teil des
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 267
160
Fig. 160. Leptothrix major - dichotom verzweigte Faden; Scheide gemeinsam
fiir zwei Faden (nach Beger und Bringmann, 1952.-250X). Fig. 161. Leptothrix
levissima - in einem Faden im Innern der Scheide dunkles Granulum -
wahrscheinlich aus Eisen(III)-Hydroxid (nach Kalbe et al., 1965. - 2000X).
Fadens bedeckende Krusten bilden. Es scheint, daft nur manche Zellen im Faden
die Krustenbildung stimulieren. Zellen in Form farbloser, hyaliner Stabchen mit
abgerundeten Polen; Protoplast homogen, weder Vakuolen noch Granula ent-
haltend; haufig in grofieren Abstanden voneinander innerhalb der Scheide
liegend. Infolge der betrachtlichen Breite der Scheide ist die Begrenzung der
Zellen nicht deutlich. Physiologische Eigenschaften noch nicht beschrieben.
Nur nach morphologischen Memmalen aus dem Freiland bekannt.
Wahrscheinlich chemoorganotroph.
Zellen 0,17-0,4 x 3^^12,0 urn grofi; meistens 7,0 urn lang. Allerdings wurden
268 • Bakterien mit Scheide - Leptothrix
auch nur 0,4-0,8 (xm lange Zellen gefunden. Die Scheide selbst ist bis 2,0 \im
dick. Fadenlange am haufigsten 60 (xm, manchmal bis 105 (xm. Fadenbreite
4,5 (xm.
Diese Art wurde unter dem Eis bei einer Wassertemperatur von 0,1-0,5 °C in
massenhafter Entwicklung in einem Ententeich in Grofi-Stove bei Rostock
(DDR) gefunden.
8. Leptothrix pseudovacuolata (Perfiliev 1925) Dorff 1934 (Fig. 162)
Spirothrix pseudovacuolata Perfiliev 1925, Leptothrix pseudovacuolata var. sub-
recta Skuja 1956
Farblose, freie Faden, regelmafiig schraubenformig gewunden, manchmal gera-
de, unverzweigt; in den Scheiden auch ohne Farbung deutlich sichtbar. Scheiden
durch Eisenverbindungen stark inkrustiert, gelb gefarbt, undurchsichtig. An-
zahl der Schraubenwindungen betrachtlich schwankend (2-13), meistens 5-7.
Zellen an den Enden abgerundet. Manchmal werden auch Riesenzellen mit einer
diinnen Zellwand gebildet. Protoplasma kornig. Nach der ursprunglichen Be-
schreibung mit einer zentralen Gasvakuole; nach Bergey's Manual (1974) wur-
den wahrscheinlich die Globuli von Poly-f5-Hydroxy-Buttersaure fur Gasva-
kuolen gehalten. Uber physiologische Eigenschaften ist bisher nichts Genaues
bekannt. Der Organismus ist chemoorganotroph, wahrscheinlich mikroaero-
phil, da er an Standorten mit geringer Sauerstoffkonzentration vorkommt. Nach
Beger und Bringmann (1953) mit denselben Nahrungsanspriichen wie
Leptothrix echinata.
Faden 85-250 (xm lang; Zellen nach Perfiliev (1925) 1,2 (xm breit, nach Dorff
(1934) 1,7-2,8 X 3,5-30,0 (xrn grofi. Windungen der Schraubenbahn bis 20-
24 (xm breit, seltener nur 15 (xm. Faden mit der Scheide 7,0-17,0 (xm breit.
In oberen Schlammschichten von Gewassern mit hoherem Mangan- und Eisen-
gehalt oder im Benthos tiefer Seen mit niedrigem Sauerstoffdruck. Manchmal in
solchen Mengen vorhanden (bis 2000 Zellen in 1 ml), dafi Wasserbliiten gebildet
werden (Beger und Bringmann 1953). Urspriinglich von Petrodvorec (fruher
Alt-Petershof) in der Umgebung von Leningrad (UdSSR) beschrieben; von
Dorff (1934) im Sakrower See bei Potsdam (DDR) gefunden. Spater von einer
Reihe weiterer Lokalitaten angegeben.
Morphologisch an Pelonema pseudovacuolatum erinnernd. Sokolova (1959) schlagt vor,
diese Art aus der Gattung Leptothrix auszuscheiden, stimmt jedoch nicht einer Zuordnung
zur Gattung Sphaerotilus zu, wie dies Pringsheim tat (1949), sondern lafit den
ursprunglichen Namen Spirothrix pseudovacuolata. Nach Bergey's Manual (1974) wahrscheinlich mit
Leptothrix discophora identisch. Krasil'nikov (1949) stellt die Art gemeinsam mit Leptothrix
lopholea und Leptothrix echinata zu Leptothrix volubilis.
Mangels grofierer Unterschiede wird mit einbezogen:
8a. Leptothrix pseudovacuolata var. subrecta Skuja 1956
Gerade oder mafiig gekrtimmte Faden bildend, nie schraubenformig gewunden. In den Seen
Hallaren, Honsan, Laksjon, Mattsbosjon, Munkbosjbn (Schweden) gefunden.
Fig. 162. Leptothrix pseudovacuolata - a Form mit geraden Faden (900x), b ►
Form mit spiralig gewundenen Faden (1400x) (nach Skuja, 1948). Fig. 163.
Leptothrix cylindracea - a zwei Stiicke ein und desselben Fadens, b Leptothrix
cylindracea forma «tenuior» (nach Skuja, 1954. - 1340x).
270 • Bakterien mit Scheide - Leptothrix
9. Leptothrix cylindracea Skuja 1956 (Fig. 163)
Leptothrix cylindracea f. tenuis Skuja 1956
Einzelne, unbewegliche, frei schwebende, gerade oder leicht gekriimmte Faden.
Mit verjiingten oder nicht verjiingten Enden. Gallertscheide zylindrisch, oft mit
Eisenoxid impragniert, anfangs hyalin, spater gelb gefarbt, wobei eine innere,
etwa 1,0 um dicke Schicht farblos bleibt. Das erweckt den Eindruck, als ob zwei
Scheiden vorhanden waren. Trichome regelmafiig leicht eingeschniirt und durch
hyaline Querwande geteilt. Zellen zylindrisch und nur gering voneinander
entfernt. Protoplasma farblos oder griinlich, homogen oder feinkornig, ohne
zentrale Gasvakuole. An den Zellenden mit kleinen Komchen, wahrscheinlich
Volutin. Physiologische Eigenschaften nicht beschrieben. Nur aus dem Freiland
bekannt.
Trichome ohne Scheide etwa 1,0-1,5 um, mit der Scheide in der Mitte des
Fadens 4,0-6,0 urn breit. Einzelne Zellen 1,0-1,5 x 5,0-10,0 um grofi.
Siifiwasserorganismus; in Benthos vorkommend.
Skuja (1956) beschrieb noch eine dunnere Form, die wegen unzureichender taxonomischer
Unterschiede zu streichen ist:
9a. Leptothrix cylindracea forma tenuis Skuja 1956
Organismus bis 250 (im lang, mit der Scheide 4 urn breit. Faden 0,7-0,8 um breit, Zellen 3
bis 7mal breiter als lang. Protoplasma farblos, homogen, ohne Vakuolen. Auch im Benthos
vorkommend.
10. Leptothrix echinata Beger 1935 (Fig. 164)
Faden fein, diinn, verhaltnismafiig kurz; apikal stumpf abgerundet. Grofie,
kugelige, frei schwebende Kolonien bildend. In diesen wachsen aus einer
gemeinsamen kleinen Fufiplatte strahlenformig 20-50 Faden, die radspeichenar-
tig angeordnet sind. Faden nicht dichotom verzweigt; manchmal unregelmafiig
und in der Nahe der freien Fadenenden leicht korkenzieherartig gekriimmt;
dadurch kommt es leicht dazu, dafi mehrere Kolonien zu Gruppen vereinigt
werden und grofie, dunkel rotbraune Flocken bilden. Scheiden an der Basis
verdickt, sich in distaler Richtung merklich verjiingend, da die Veratzung an der
Basis beginnt. Vor allem wird Mangan-, weniger haufig Eisenoxid abgelagert. In
jedem Faden werden nach Auflosung dieser Stoffe durch verdiinnte Salzsaure
eine Gallertscheide sowie die in sie eingelagerten einzelnen isodiametrischen
oder etwas langeren Zellen sichtbar. Zellfaden aus 3-6 farblosen, kurzen Stab-
chen bestehend, die in einer Reihe angeordnet sind. Querwande auch nach
Farbung undeutlich und wahrscheinlich im Basalteil vollkommen fehlend.
Haufig ist der Basalteil der Scheide leer und Zellfaden sind nur im jiingeren Teil der
Scheide vorhanden.
Physiologische Eigenschaften bislang unbekannt. Wahrscheinlich chemoorga-
notroph, mikroaerophil. Nach Beger (1935) kann der Organismus auch auf
manganhaltiger Peptonlosung geziichtet werden. Fortpflanzung sowohl durch
vegetative Einschniirung der Kolonien, als auch durch unbewegliche Konidien,
die sich von den teilweise aus der Scheide hervorkommenden Fadenenden
abtrennen (Skuja 1956). Konidien einzeln, kugelig oder kurze Ketten von
2-3 Zellen bildend.
Faden mit Scheide an der Basis 0,8 um dick, am Scheitel hochstens 0,5 urn breit
und meist mehr oder weniger zugespitzt; Fadenlange 5,0-10,0 um. Zellen 0,2-
0,4 x 0,4-1,0 um grofi. Kolonien 5,0-20,0 um, am haufigsten 18,0-20,0 um im
Durchmesser; Konidien 0,4-0,5 um grofi.
Urspriinglich aus dem Wasserwerk in Frankfurt a.d.O. (DDR) beschrieben,
spater an mehreren Standorten, in Wasserwerkseinrichtungen, sowie als Plank-
tonorganismus, besonders in grofieren Tiefen in Jjj^vasserseen mit mangelhalti-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 271
gem Grund gefunden. Bursche (1949) beschrieb das massenhafte Vorkommen
von Kolonien, die an der Gallerte von Aphanocapsa festsafien, aus dem Miiggel-
see bei Berlin (DDR).
Da die Kolonien dieser Art gewohnlich stark inkrustiert sind, wird die Art oft iibersehen
oder fur ein anorganisches Gebilde gehalten. Pringsheim (1949) hielt sie fur eine junge Form
von Leptothrix ochracea (= Sphaerotiltts nutans f. ochracea), was Beger und Bringmann
(1953) durch Untersuchungen der Ultrastruktur der Scheiden widerlegten. Die Scheiden
sind ebenso wie bei den iibrigen Arten der Gattung Leptothrix mit Metalloxiden in
granulierter Form impragniert. Wahrscheinlich eng verwandt mit Leptothrix lopholea. Nach
Bergey's Manual (1974) sind diese beiden Arten wahrscheinlich sogar identisch, obwohl an
anderer Stelle angegeben wird, dafi der Name ein Synonym von Metallogenium personatum
ist. Krasil'nikov (1949) stellt diese Art zusammen mit Leptothrix pseudovacuolata und
Leptothrix lopholea zu Leptothrix volubilis.
164
165
Fig. 164. Leptothrix echinata - a Kolonien nach dem Auslosen der Eiseninkru-
station durcn Salzsaure; die Faden zeigen terminale Bildung von unbeweglichen
Gonidien, h Kolonien mit normalen Eiseninkrustationen (nach Skuja, 1956. -
1340X). Fig. 165. L^thrix skujae - (nach Skuja, 1948. - 1000X).
272 • Bakterien mit Scheide - Leptothrix
11. Leptothrix skujae (Skuja 1948) Beger 1953 (Fig. 165)
Leptothrix tenuissima Skuja 1948 [non Leptothrix tenuissima (Vinogradskij
1888) Hansgirg 1890 = Gallionella tenuissima Vinogradskij 1888; non L.
tenuissima Naegeli 1849 = Hypheothrix tenuissima (Naegeli 1849) Rabenhorst
1865 = Lyngbya tenuissima (Naegeli 1849) Hansgirg 1892]
Faden nicht festsitzend, nur sehr selten verzweigt, frei im Plankton. Sie umwin-
den einander schraubenformig. Ohne Scheide. Fadenenden gerade, nicht ver-
jiingt; Endzellen abgerundet. Scheide hyalin oder gelbbraun bis dunkelbraun
gefarbt; oft machtig, distal verjiingt. Zellen in Form farbloser Stabchen. Proto-
plasma hyalin, kleine, zerstreute Korner enthaltend. Physiologische Eigenschaf-
ten unbekannt, aus dem Freiland beschrieben.
Faden nur 0,3-0,4 um, Fadenscheide oft bis 18,0 um breit. Zellen 0,3-0,4 X
1,5-10,0 um grofi.
Im Siifiwasserplankton vorkommend; sehr verbreitet in der Litoralzone, verein-
zelt in pelagischem Plankton. In Store Halsjon (Uppland, Schweden) gefunden.
12. Leptothrix winogradskii Cataldi 1939
Zellen bilden lange, frei schwebende Faden in Scheiden. Gramnegativ, vertragt
kein stark saures Milieu. Gedeiht am besten bei pH 5,0 bis 9,8; aerob. Benotigt
zum Wachstum C02. Auf Agarboden mit Eisenammoniumzitrat stark fadige
Kolonien bildend. Zellen beweglich, wahrscheinlich mit polaren Geifieln,
0,9 (xm breit. Scheide 1,5 um dick.
Im warmen Siifiwasser (Optimum 37 °C) vorkommend; wahrscheinlich sehr
verbreitet. Sehr wenig bekannter, unzureichend beschriebener Organismus.
Arten unsicherer Stellung:
13. Leptothrix sideropous (Molisch 1910) Benecke 1912 (Fig. 166)
Chlamydothrix sideropous Molisch 1910, Gallionella sideropous (Molisch 1910)
Naumann 1921, Sphaerotilus natans forma sideropous (Molisch 1910) Prings-
heim 1949
Verhaltnismafiig lange, diinne, unverzweigte, in diinner, farbloser, durchsichti-
ger Scheide eingescnlossene Faden bildend. Durch ein Gallertpolster mit der
Fadenbasis an festen Unterlagen haftend. Eisenoxide (Manganoxide?) in be-
trachtlichen Massen nur im Basalteil der Scheide und im Gallertpolster. Nach
Cholodnyj (1926) soil deshalb die Eisenoxydation nicht mit dem Metabolismus
des Organismus zusammenhangen. Aus dem Gallertpolster wachsen ein Faden
oder meistens mehrere (2-7) Faden hervor. Zellen gramnegativ. Protoplasma
farblos, hyalin, homogen; ohne Vakuolen. Bei manchen Faden bilden sich in den
Terminalzellen dunkle, dicke, lichtbrechende, ovale Korperchen, die als Endo-
sporen beschrieben wurden. Sie liegen nicht ganz axial in den Zellen, sondern
zickzack- oder schraubenformig; Ursprung und Funktion bediirfen noch der
Klarung.
Ein aerober Organismus, dessen Wachstum durch Anwesenheit von Kohlendioxid gefor-
dert wird. Er vertragt kein saures Milieu; der optimale pH-Wert fur das Wachstum liegt bei
Fig. 166. Leptothrix sideropous - a Faden mit Gallertpolster- Seitenansicht, b ►
Faden mit altem, lappenformig gegliedertem Gallertpolster, c junger Faden, d
eine Gruppe ausgewachsener Faden mit gemeinsamer, inkustierter Basalscheibe;
ein Faden mit Sporenbildung (a-d 1340x), e Detail eines sporenbildenden
Fadenstiicks (2700x) (a und b nach Cholodnyj, 1926; sonst nach Skuja, 1956).
274 • Bakterien mit Scheide - Leptothrix
8,0. Physiologische Eigenschaften nicht genau bekannt. Savel'jeva (1965) emwickelte eine
quantitative Kulturmethode zu seiner Bestimmung. Unregelmafiig abgegrenzte, kreisfbrmi-
ge Kolonien, von deren Randern kleine Mikrokolonien auslaufen.
Zellen 0,5-0,9 X 2,0-5,0 um grofi; Faden bis zu 600 um lang. Endosporen 0,5-
0,7 X 1,0-2,0 um; Gallertpolster 6,0-30,0 um grofi.
Als sessiler Organismus auf verschiedenen Wasserpflanzen und submersen
Gegenstanden oder als Neustonorganismus am Wasserspiegel vorkommend; die
Faden hangen frei herab und das Gallertpolster haftet an der Wasseroberflache.
In Siifiwassern weit verbreitet.
Noch wenig erforschter Organismus; Untersuchungen in Reinkulturen sind erforderlich.
Seine Einreihung in die Gattung Leptothrix ist problematisch, jedoch auch die von Prings-
heim (1949) vorgeschlagene Einreihung bei der Gattung Sphaerotilus als Sphuerotilus nutans
forma sideropous ist zweifelhaft. Nach Pringsheim (1949) soil es sich um keimende Faden
von Leptothrix ochracea (= Sphaerotilus nutans f. ochracea) handeln; auch hielt er diesen
Organismus fur eine mit Leptothrix lopholea eng verwandte Art, was aber Beger und
Bringmann (1953) bezweifeln. Bei letzter sitzt eine grofie Anzahl von Faden an einem
gemeinsamen Polster und die einzelnen Faden sind der ganzen Lange nach inkrustiert.
Naumann (1921) stellte diese Art irrtiimlicherweise zur Gattung Gallionella. Die UberfUh-
rung in die Gattung Leptothrix erfolgte nicht durch Cholodnyj (1926), sondernschondurch
Benecke (1912). Ein von Mulder und van Veen (1963) unter dem Namen Leptothrix
geziichteter Stamm ist dieser Art morphologisch auffallend ahnlich.
14. Leptothrix major Dorff 1934 (Fig. 160)
Faden beweglich, sehr lang und in Scheiden; an der Basis ein Gallertpolster
bildend, mit dessen Hilfe sie auf Unterlagen festsitzen. Reich dichotom ver-
zweigt, ahnlich wie Sphaerotilus natans (= Cladothrix dichotoma), so dafi
Fadenbiindel entstehen. Fadeh aus stabchenartigen Zellen bestehend. Manchmal
werden Riesenzellen gebildet. Faden einzeln bisweilen auch zu zweit in der
Scheide. Scheiden gegen die Spitze verjiingt, und mit Eisen- und Manganverbin-
dungen impragniert; hell bis braun gefarbt, undurchsichtig; in HCllosen sich die
Scheiden nicht restlos auf. Protoplasma der Zellen kornig, Pseudovakuolen
enthaltend. Heterotropher oder mixotropher Organismus. Physiologische
Eigenschaften wenig bekannt, nur aus dem Freiland beschrieben.
Stabchenartige Zellen 1,4 x 5,0-10 um grofi, Riesenzellen bis 75 um lang. Faden
einschliefilich der Scheide bis 12,0 um breit, 1 cm lang oder linger.
Auf dem Grunde von Fliissen vorkommend; Beger und Bringmann (1953)
fanden diese Art im Riidersdorfer Graben bei Berlin (DDR) unterhalb des
Einlaufes hauslicher Abwasser. Sie stimmen nicht mit Pringsheim (1949) iiber-
ein, der die Art fur identisch mit Leptothrix ochracea halt und sie daher zu
Sphaerotilus natans (= Cladothrix dichotoma) stellt.
15. Leptothrix parasitica Kiitzing 1847 (Fig. 169)
Farblose oder hell gelbliche bis griinliche, sehr diinne, leicht gekrummte oder
gerade Faden, meistens undeutlich in zylindrische, lange Zellen gegliedert; an
den Scheiden von Blaualgen, am haufigsten aus der Familie Scytonemaceae, als
Epiphyten oder auch Parasiten festsitzend und hier farblose oder schmutzig
gelbliche, lockere Buschel bildend.
Im Durchschnitt 1,0 um breit und 95,4-137 urn lang.
Verhaltnismafiig weit verbreitete Art. Nach Pringsheim (1949) handelt es sich
um junge, keimende Faden von Leptothrix ochracea (= Sphaerotilus natans f.
ochracea).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptothrix • 275
16. Leptothrix epiphytica (Migula 1895) Schoenichen et
Kalberlah 1900 (Fig. 168)
[non Leptothrix epiphytica (Hieronymus 1898) Dorff 1934 = Lyngbya
epiphytica Hieronymus 1898 = Chlamydothrix epiphytica (Hieronymus 1898)
Naumann 1928 = Leptothrix volubilis Cholodnyj 1924]
Streptothrix epiphytica Migula 1895 = Chlamydothrix epiphytica (Migula 1895)
Migula 1900.
Zellen lange, kettchenartige, farblose, gerade, diinne, gewohnlich von einer
dicken, schleimigen Scheide umschlossene Faden bildend. Faden mit dem
Basalende an der Oberflache verschiedener Algen senkrecht festsitzend, am
haufigsten an Vertretern der Gattung Oedogonium, Tolypothrix u. a. Sie windet
sich nie um die Wirtsalge und hauft kein Eisen in den Scheiden an zum
Unterschied von Leptothrix volubilis Cholodnyj 1924 (= Leptothrix epiphytica
(Hieronymus 1898) Dorff 1934), mit der sie in der Literatur sehr oft verwechselt
wird. Bildet niemals Kolonien. Nur aus dem Freiland beschrieben. Vielleicht ein
chemoorganotropher, epiphytischer Organismus.
Recht verbreitet, an Algen festsitzend.
Sehr wenig bekannte, unzureichend beschriebene Art. Krasil'nikov (1949) stellt sie
irrtumlicherweise zu Leptothrix volubilis. Pringsheim (1949), sowie Beger und Bringmann (1953)
halten sie fur junge Stadien von Sphaerotilus natuns. Weitere, sorgfaltige Untersuchungen
sind erforderlich. Die Einreihung in die Gattung Leptothrix ist problematisch.
17. Leptothrix volubilis Cholodnyj 1924 (Fig. 167)
a Lyngbya epiphytica Hieronymus 1898 [non Lyngbya epiphytica Wille 1913 =
Lyngbya nordgaardii (Wille 1913) Wille 1918 = Lyngbya willei (Wille 1913)
Setcnel et Gardner 1918]
b Chlamydothrix epiphytica (Hieronymus 1898) Naumann 1928 [non
Chlamydothrix epiphytica (Migula 1895) Migula 1900 = Streptothrix epiphytica
Migula 1895 = Leptothrix epiphytica (Migula 1895) Schoenichen et Kalberlah
1900]
c Leptothrix epiphytica (Hieronymus 1898) Dorff 1934 [non Leptothrix
epiphytica (Migula 1895) Schoenichen et Kalberlah 1900 = Streptothrix epiphytica
Migula 1895 = Chlamydothrix epiphytica (Migula 1895) Migula 1900]
Zellen stabchenartig, farblos; lange zylindrische, unverzweigte Faden bildend,
die schraubenartig Algen wie Oedogonium oder Tolypothrix oder andere
submerse Gegenstande umwinden. Faden von Scheiden mit starker Eiseninkrusta-
tion umgeben; gelb bis braun gefarbt, undurchsichtig, kornig. Die alten
Scheiden werden von den Faden verlassen und kommen dann nur noch leer vor.
Zellen 1,0 x 2,0 um grofi, Faden mit Scheiden ungefahr 3,0 urn breit.
Auf verschiedenen Algen lebend.
Krasil'nikov (1949) stellt hierher auch die Arten Leptothrix pseudovucuolutu, Leptothrix
lopholea, Leptothrix echinatu und Leptothrix epiphyticu. Cholodnyj (1953) halt diesen
Organismus fur eine Ubergangsform zwischen fadigen Bakterien und Blaualgen aus der
Familie Oscillatoriaceae; den Bakterien ahnelt er durch den Mangel an Assimilationspig-
menten. Beger und Bringmann (1953) halten ihn fur eine Alge und empfehlen, seinen
urspriinglichen Namen Lyngbyu epiphyticu Hieronymus 1898 beizubehalten. Leicht mit
Lyngbyu inconspicuu zu verwechseln, die an verschiedenen Algen, am haufigsten an den
«Nitellae opacae» festsitzt. Deren Faden sind 0,6-0,8 |xm breit, die Scheide ist ebenfalls hell
gelbbraun gefarbt. Sie unterscheidet sich jedoch dadurch, dafi die Zellfaden ohne Scheide
nur 0,5-0,7 (x, breit und an den Querwanden leicht eingeschniirt sind; Zellen bis 4 mal
linger als breit; Protoplasma ausgesprochen blau oder griin. Apikalzelle extrem abgerundet.
Skuja (1964) beschrieo eine Form mit diinneren (0,8-1,0 (xm breiten) Faden, die in lockeren
Windungen auf Algen, besonders der Gattung Oedogonium vorkommt. Mit sehr diinner
Scheide; Zellen isodiametrisch oder etwas kiirzer, bzw. langer als breit (0,7-1,5 |xm lang).
276 • Bakterien mit Scheide - Leptothnx
Fig. 167. Leptothrix voluhilis - a Faden umwindet eine Oedogonium-Faden
(nach Cholodnyj, 1926. - 500X), b Faden an Tolypothrix (nach Cholodnyj,
1926. - 500 X), c (nach Beger und Bringmann, 1952. - 500 X), d Fadendetail (nach
Skuja, 1964. - 1000X). Fig. 168. Leptothrix epiphytka - (nach Migula, 1900. -
1000X). Fig. 169. Leptothrix parasitica - (nach Schoenichen und Kalberlah,
1909. - 1000X).
An den Querwanden sind die Faden eingeschniirt. Blaugriin gefarbt. In den Seen Nord-
schwedens vorkommend.
Unsichere, unzureichend beschriebene Arten:
Leptothrix moscvaensis Kalinenko 1945
Morphologisch Leptothrix ochracea ahnlich. Unterscheidet sich nur physiolo-
gisch: es werden weder Glyzerin noch Starke verwertet und keine Nitrite
reduziert. Anwesenheit von Eisen fur das Wachstum ist nicht erforderlich.
In der Quelle des Kirchhofs von Ostankino in Moskau (UdSSR) gefunden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Clonothrix ■ 277
Leptothrix issatschenkoi Kalinenko 1945
Morphologische Beschreibung fehlt. Verwertet Saccharose, Maltose, Laktose,
Mannitol, Glyzerol. Hydrolysiert Starke, verfliissigt Gelatine. Reduziert
Nitrate, jedoch keine Nitrite. Braucht kein Eisen zum Wachstum. Im Flufl Jenisej und
seinen Nebenfliissen Bazaicha und Kaca (UdSSR) gefunden.
Leptothrix sibirica Kalinenko 1946
Morphologische Beschreibung nicht vorhanden. Verwertet Glukose,
Saccharose, Maltose, Laktose, Mannitol, Glyzerol. Verfliissigt Gelatine. Hydrolysiert
keine Starke. Reduziert Nitrate, jedoch keine Nitrite. Kein Eisen zum
Wachstum erforderlich.
Im Flufi Jenisej und seinen Nebenfliissen Bazaicha und Kaca (UdSSR)
gefunden.
Leptothrix punni Kalinenko 1949
Morphologische Beschreibung unzureichend. Mit Eisenkonkretionen an den
Faden. Bildet Sporen, die nach 15 miniitigem Erwarmen auf 90 °C ihre Lebens-
fahigkeit einbiifien. Grampositiv. Verwertet Glukose, Saccharose, Laktose,
Mannitol. Wachst gut auf Peptonagar. Hydrolysiert Starke. Verfliissigt Gelatine
in Schichten. Wachst gut in Anwesenheit von Eisen, benotigt es aber nicht. Die
an den Faden unter Laboratoriumsbedingungen entstehenden Konkretionen
unterscheiden sich nicht von den im Freiland gefundenen.
Im See Punnis im Gebiet der Karelischen Seen (UdSSR) gefunden.
Leptothrix wernadskyi Kalinenko 1949
Morphologische Beschreibung fehlt. An den Faden bilden sich
Eisenkonkretionen. Die Sporen gehen bei 90 CC nach 15 miniitiger Erwarmung zugrunde.
Grampositiv. Verwertet Glukose, Saccharose, Laktose, Mannitol. Wachst gut
auch auf Peptonagar. Schwach starkelosend. Verfliissigt Gelatine in Schichten.
Wachst bei Anwesenheit von Eisen, sowie auch ohne Eisen. Die Konkretionen
an den Faden aus Laboratoriumskulturen unterscheiden sich nicht von denen
natiirlicher Standorte.
In den Karelischen Seen (UdSSR) gefunden.
3. Clonothrix Roze 1896
Festsitzende Faden bilden grofiere oder kleinere Gruppen, die auf einer gemein-
samen Basis sitzen; manchmal reifien sie sich in ganzen Klumpen los, die frei im
Wasser schweben. Entweder zum Apikalende hin mehr oder weniger konvergie-
rend oder zylindrisch. Mit diinner Scheide, die sich gegen die Basis verbreitert
und iiberwiegend mit Mangan-, weniger haufig mit Eisenverbindungen inkru-
stiert ist. Zellen zylindrisch, am Fadenscheitel manchmal abgerundet. Das
Protoplasma erscheint im Phasenkontrast farblos oder blaulich. Vermehrung
durch Abtrennung einzelner Zellen, durch Gonidienbildung. Die aus dem Faden
gelosten Gonidien keimen, setzen sich an den Scheiden alter Faden fest, sodafi
die Faden scheinbar dichotom verzweigt sind. In Siifiwassern oder auf Pferde-
mist vorkommend.
Typus generis: Clonothrix fusca Roze 1896
Wichtigste Literatur: Kirchner 1878, Hansgirg 1885, Roze 1896, Schorler
1904, Kolkwitz 1909, 1915, Molisch 1910, Naumann 1921, Lieske 1922,
Cholodnyj 1924, 1953, Dorff 1934, Kolk 1938, Krasil'nikov 1949, Pringsheim 1949,
Beger und Bringmann 1953, Bergey's Manual 1957, 1974.
278 • Bakterien mit Scheide - Clonothrix
Bestimmungsschliissel der Arten
la Faden gegen das Apikalendeverjiingt; an der Basis 5,0-7,0 um breit
1. CI. fusca
lb Faden nicht verjiingt; 1,5 |xm breit 2. Cl. gracillima
1. Clonothrix fusca Roze 1896 (Fig. 170)
Glaucothrix putealis Kirchner 1878, Plectonema puteale (Kirchner 1878) Hans-
girg 1885, Clonothrix fusca Schorler 1904, Crenothrix dichotoma Orla-Jensen
1909, Clonothrix tenuis Kolkwitz 1909, Clonothrix ferruginea Molisch 1910
(lapsus calami), Crenothrixfusca (Schorler 1904) Dorff 1934, Sphaerotilus natans
formzfusca Pringsheim 1949, Sphaerotilus natans {ormapatens Pringsheim 1949,
Clonothrix putealis (Kirchner 1878) Beger 1953.
Faden meistens zu mehreren auf fester gemeinsamer Unterlage oder an Fadenal-
gen festsitzend oder in ganzen Biischeln frei schwebend; polar differenziert,
unregelmafiig, scheinbar dichotom verzweigt. Von einer mehr oder weniger
sichtbaren, diinnen und anfangs an jungen Apikalteilen der Faden farblosen
Scheide umgeben. Diese wird mit der Zeit besonders im Basakeil des Fadens mit
Manganverbindungen (seltener mit Eisenverbindungen) inkrustiert, so dafi sie
nach und nach gelbbraun bis braun, dicker und sprode wird. Nach Kolk (1938)
wird die Verdickung im Basakeil des Fadens nicht nur durch zunehmende
Krustenbildung verursacht; nach Auflosung in verdiinnter Salzsaure erscheinen
auch die organischen Teile der Scheide wesentlich dicker. Faden samt Scheiden
verjiingen sich gegen das Apikalende. Faden ohne Scheide (Schorler 1904) sind
jedoch zylindrisch oder bei Gonidienbildung zum Scheitel hin mafiig verbreitert.
Zellen zylindrisch, mit abgerundeten Enden, farblos oder blaulich. An der Basis
des Fadens langer als im Apikalteil; gewohnlich 5mal linger als breit. Protoplas-
ma auch mit braunlichem Schimmer. Reaktion auf Gram-Farbung unbekannt.
Ernahrungsweise und physiologische Eigenschaften sind nicht bekannt. Wahr-
scheinlich ein aerober, organotropher Organismus, bei dem die Ablagerung von
Mangan in den Scheiden wohl nicht mit dem Metabolismus zusammenhangt.
Bisher weder in Reinkultur isoliert, noch mit Erfolg mit kiinstlichen Medien
geziichtet. Fortpflanzung durch kugelige Makrogonidien, die sich in 2-6-
zelligen Ketten vorwiegend durch Querteilung langer, zylindrischer Zellen im
Apikalteil des Fadens bilden. Die Sporenketten haben eine eigene, zwischen den
Sporen eingeschniirte Scheide. Nach dem Platzen der Scheide werden sie frei.
Keine Mikrogonidien bildend. Frei gewordene Gonidien keimen sofort, setzen
sich parallel an den alteren Faden fest und wachsen zu neuen Faden heran,
wodurch der Eindruck dichotomer Verzweigung entsteht; gewohnlich stehen
die einzelnen seitlichen Faden dann abwechselnd am Hauptfaden. Nach Schorler
(1904) und Kolk (1938) soil es sich um die gleiche Art einer falschen dichotom
Verzweigung wie bei Sphaerotilus dichotomus handeln. Manchmal losen sich
auch einzelne Zellen oder kurze Fadenfragmente als reproduktive Zellen aus der
Scheide. In seltenen Fallen bilden sich bei einzelnen Faden im Apikalteil grofie
einzellige kugel- oder kegelformige Gebilde, die vielleicht fur die Vermehrung
Bedeutung haben. Sie entstehen sowohl als Terminalknospen der Apikalzelle, als
auch als subterminale, seitliche Knospen der weiteren Zellen im Faden; diese
Zellen knospen abwechselnd an beiden Seiten des Fadens. Weder die Bedeutung
dieser Gebilde, noch der Mechanismus ihrer Entstehung ist bekannt. Faden
festsitzend. Bewegung der reproduktiven Zellen bisher noch nicht beschrieben.
Einzelne Zellen 2,0-2,5 x 12,0-18,0 |im grofi. Manchmal 8,0 |xm lang und noch
langer. Faden an der Basis 5,0-7,0 um breit, am Scheitel 1,0-3,0 |xm. Faden
gewohnlich bis 600 |xm; sie erreichen jedoch auch eine Lange von 1,5 cm. In
Anwesenheit von Mangan konnen sich die Scheiden an der Basis bis zu 24 |xm
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Clonothrix • 279
Fig. 170. Clonothrix fusca - a reifer Faden mit unechter dichotomer
Verzweigung, b junger Faden mit entstehender unechter dichotomer Verzweigung,
c d aus einer zerbrochenen Scheide - hervorragender Faden, e keulenformig
geschwollene Zelle am Fadenende (a-e 300x),/g Faden mit geschwollener Zelle
am Fadenende und Bildung von lateral angeordneten geschwollenen Zellen-
Knospen (300 x), h Fadenscheide mit Eisenverbindungen inkrustiert (300 x),
i Detail der dichtomen Fadenverzweigung (500 x),; Detail der einzelnen ange-
schwollenen Zellen (Knospen) mit sichtbaren Vakuolen und Kornern (500 x),
(a-g, i, j, nach Roze, 1896; h, nach Cyrus Z. und Sladecek, 1973).
verdicken, in Anwesenheit von Eisen werden sie jedoch nur bis 10 |jrn breit.
Haufig am Grand von Stromen, wo manchmal auch Monokulturen gebildet
werden, (nach Kolkwitz in der Goldenen Lunze bei Griinberg, zit. bei Beger
und Bringmann 1953) ferner in Wasserbecken, Wasser- und Dranleitungen,
Wasserwerken und Wasserbehaltern, wo grofie, dunkelbraune, knauelartige
Klumpen gebildet werden, in denen die einzelnen Faden schon mit blofiem Auge
280 • Bakterien mit Scheide - Clonothrix
zu erkennen sind. Kommt meistens gemeinsam mit Crenothrix polyspora vor
und ist an Gebiete gebunden, die Manganverbindungen im Boden enthalten.
Nur selten findet man bei einem Organismus in der Literatur so viele Verwechslungen oder
Irrtumer. Roze (1896) beschrieb diesen Organismus urspriinglich als eine Blaualge (blau
Farbung). Schorler (1904) beschrieb irrtiimlicherweise einen ahnlichen Organismus als
Eisenbakterie, jedoch unter dem Namen Clonothrix fusca, denn er stellte den blaulichen
Farbton nicht fest. Obwohl Kolkwitz (1909) ihn nicht als identisch mit Cladothrix dichoto-
ma ansah, veroffentlichte er seine Abbildung unter diesem Namen; Molisch (1910) benannte
diese iibernommene Abbildung inkorrekt als Clonothrix ferruginea, was auch von Janke
(1924) ubernommen wurde. Naumann (1921) gab unter der Abbildung von Leptothrix
discoforus irrtiimlich den Namen Clonothrix fusca an. Lieske (1922) hat zwei verschiedene
Organismen, Crenothrix polyspora und Clonothrix fusca, unter dem Namen Clonothrix
fusca abgebildet. Cholodnyj (1926, 1953) halt die Art Clonothrix fusca Roze fur identisch
mit Leptothrix crassa, hingegen die Form Clonothrix fusca Schorler fur eine Modifikation
von Crenothrix polyspora, was Krasil'nikov (1949) ubernahm. Dorff (1934) hingegen hat die
Existenz einer selbstandigen Gattung Clonothrix nicht anerkannt und ordnete diesen
Organismus als selbstandige Art der Gattung Crenothrix zu; erst Kolk (1938) unterscheidet
rich tig beide Organismen als selbstandige Gattungen. Pringsheim (1949) halt diesen
Organismus vollig unrichtig fiir eine Form von Sphaerotilus natans. Beger und Bringmann (1953)
hielten ihn ohne vergleichende Untersuchung fiir identisch mit Glaucothrix putealis und
anderten seinen Namen in Clonothrix putealis. Orla-Jensen (1909) ordnete diesen
Organismus als neue Art der Gattung Crenothrix (Cr. dichotoma) zu.
Beger und Bringmann (1953) halten Clonothrix fusca fiir ein spateres Synonym eines
Organismus, der praktisch die gleichen Eigenschaften hat und daher dieser Art zugeordnet
werden mufi:
la. Glaucothrix putealis Kirchner 1878
Plectonema puteale (Kirchner 1878) Hansgirg 1885, Clonothrix putealis (Kirchner 1878)
Beger 1953
Fadenformiger, wenig verzweigter Organismus, mit zunachst diinnen, farblosen, spater
dicken und fast undurchsichtigen braungelben Scheiden. Protoplasma hellblaulich, gelb-
griinlich oderfarblos. Zellen 2,0-4,0 urn breit. Faden einschliefilich Scheide 3,0-5,0 (im, in
seltenen Fallen bis 8,0 (im breit. In Brunnen, in kleinen Bachen auf Steinen und unterge-
tauchtem Holz vorkommend. Urspriinglich als Blaualge bezeichnet, spater vom gleichen
Autor (Kirchner 1891) fiir eine Bakterie gehalten. Hansgirg (1885) und nach ihm Geitler
(1932) reihten ihn bei den Blaualgen in die Gattung Plectonema ein.
lb. Clonothrix tenuis Kolkwitz 1909
Crenothrix tenuis (Kolkwitz 1909) Dorff 1934
Dieser Organismus ist mit Clonothrix fusca identisch, unterscheidet sich von ihm nur durch
wesentlich schmalere Faden. Die Art ist mit Clonothrix fusca zu vereinigen. In verschmutz-
ten Gewassern vorkommend. Nach Dorff (1934) identisch mit Glaucothrix putealis.
Unsichere, ungeniigend beschriebene Art:
2. Clonothrix gracillima West et West 1898
Cladothrix gracillima (West et West 1898) West et West 1904
Dunne Faden, die sich zum Scheitel hin niemals verjiingen. Scheiden diinn,
farblos, fest, vermogen Eisen einzulagern. Faden dichotom verzweigt; seitliche
Zweige biegsam, abwechselnd festsitzend; auf ihnen wieder abwechselnd festsit-
zende sekundare Zweige. Zellen zylindrisch und hell blaulich gefarbt.
Faden 1,5 |xm dick. Zellen 1,5 x 4,5-6,0 |xm grofi.
Urspriinglich aus Pferdemist isoliert.
Von Beger und Bringmann (1953) fiir identisch mit Sphaerotilus natans forma
ochracea Pringsheim 1949 gehalten, jedoch nicht als identisch mit Leptothrix
ochracea (Roth 1797) Kiitzing 1843 angesehen. Die Giiltigkeit der An ist
ungeklart und problematisch. Untersuchungen des Organismus in Reinkultur
sind erforderlich.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Crenothrix • 281
4. Crenothrix Cohn 1872
Lange, gerade oder schwach gekriimmte Faden, an einer Unterlage festsitzend,
von der sie sich manchmal in Form dichter Biischel losreifien konnen. Elastisch
im Wasser flutend. Fadenbreite auch innerhalb eines Biischels sehr veranderlich.
Meistens gegen die Basis verjiingt; am freien Apikalteil sind manche Faden
trompetenformig verbreitert. Die jiingsten Faden erinnern in ihrem Habitus an
Leptothrix. Sie verzweigen sich niemals, obwohl ihre Gruppierung manchmal
eine Verzweigung vortauscht. Jeder Faden hat eine sehr diinne, hyaline, farblose
Scheide, an der sich mit der Zeit, meistens an der Fadenbasis, Eisen (Ill)hydroxid
oder, weniger haufig Manganoxide ablagern; manchmal beide gemeinsam.
Scheide deshalb gewohnlich an der Basis Breiter und gelbbraun bis rostbraun
gefarbt; mit doppelter Kontur, zahe. Diinne Faden haben - besonders am
Scheitel- eine praktisch kaum sichtbare Scheide. Diese ist dort deutlich, wo sich
abgestorbene Zellen im Faden befinden; sie hat dann das Aussehen eines leeren
Rohres. Nach Cohn (1870) soil die Scheide am Scheitel des Fadens geschlossen
sein und erst dann platzen, wenn die reproduktiven Zellen den Faden verlassen.
Diese Feststellung wurde jedoch von anderen Forschern nicht bestatigt.
Faden mit einer Reihe zylindrischer oder scheibenformiger Zellen, die dicht
aneinander liegen, so dafi sie im optischen Schnitt kantie erscheinen. Obwohl die
Zellen meistens isodiametrisch sind, ist ihre Lange recnt variabel. Protoplasma
farblos, homogen oder fein gekornt. Bei alteren Individuen befindet sich dichtes
Protoplasma nur an der Peripherie der Zellen, der zentrale Teil ist mit einer
farblosen Fliissigkeit gefiillt, so dafi die Zellen hohl erscheinen. Farbung nach
Gram bislang nicht gepriift.
Physiologiscne Eigenschaften unbekannt. Wahrscheinlich ein aerober, che-
moorganotropher Organismus, bei dem die Eisenablagerung in den Scheiden
unabhangig vom Metabolismus ist. Wolfe (1960) vermutet, dafi die Ablagerung
ahnlich wie bei der Gattung Sphaerotilus vor sich geht. In Reinkulturen noch
nicht kultiviert.
Vermehrt sich einerseits dadurch, dafi sich die Endzellen des Fadens abrunden
und entweder einzeln oder in Gruppen zu mehreren aus der Scheide gleiten, sich
an neuen Stellen festsetzen und so einen neuen Faden bilden. Andererseits durch
Gonidien, die keine sichtbare aktive Bewegung aufweisen; sie werden nur durch
die Wasserstromung verbreitet. Die Gonidien entstehen in den Apikalzellen des
Fadens durch Zellteilung in einer oder mehreren Ebenen. Je nach Art der Teilung
bilden sich zwei Typen von Gonidien: entweder in Form von Kokken oder von
kurzen Stabchen, deren Ausmafie recht veranderlich sind. Sie entstehen
praktisch in alien Faden. Mikrogonidien als die am haufigsten vorkommenden
Reproduktionszellen entstehen meist in dickeren Faden. Zunachst verbreitern
sich die Faden an den Stellen etwas, wo Mikrogonidien entstehen und die Zellen
beginnen sich dann in einer zu Langsachse senkrechten Ebene zu teilen; so bilden
sich scheibenartige Zellen, deren Hohe Vr-Vi der Breite betragt. Diese Zellen
teilen sich nach und nach weiter in zwei zueinander senkrechten Ebenen, so dafi
aus einer Ausgangszelle 16 kleine Zellen entstehen, die sich allmahlich abrunden.
Die entstandenen Mikrogonidien bleiben zunachst an ihrem Entstehungsort,
verschieben sich spater zum Scheitel des Fadens, den sie dann vollig ausfiillen;
schliefilich verlassen sie die Scheide. Wahrend der Entwicklung der Gonidien
verbreitert sich die Scheide gewohnlich trompetenformig. Nach Ausstofiung der
Mikrogonidien bleibt die leere Scheide noch eine gewisse Zeit bestehen; sie sieht
dann wie eine leere, konische Hiilse aus, in der sich hochstens einige vereinzelte
Gonidien befinden. Wahrend die Scheide am Scheitel des Fadens leer ist, kann
die Teilung und die Reproduktion der Gonidien auf tiefer im Faden liegende
Zellen ubergreifen.
282 • Bakterien mit Scheide - Crenothrix
Makrogonidien bilden sich meist in diinneren Faden in der Weise, dafi sich die
einzelnen Zellen im Apikalteil des Fadens abrunden und in zwei, hochstens vier
Reproduktionseinheiten teilen. Sie sind daher wesentlich grofier, haufen sich
jedoch ebenfalls innerhalb der Scheide am Scheitel des Fadens an, den sie dann
verlassen. Im Wasser bleiben sie in kleinen Haufen lange vor dem offenen
Fadenende hangen, bis sie sich langsam gleitend in der Umgebung zerstreuen.
Der Makrogonidien produzierende Faden ist nicht keilformig verbreitert. Bei
sehr schmalen Faden (unter 3,0 |xm) entsteht nur eine Makrogonidie, die manch-
mal mafiig eingeschniirt ist. Die Makrogonidien verlassen dann nacheinander
den Faden. Die Gonidien keimen in der Regel sofort nach Verlassen des Fadens.
Die Mikrogonidien sind kugelige oder kurz ellipsoidische, farblose Zellen, deren
zartes, homogenes Protoplasma eine zentrale Vakuole besitzt. Manche sind
nicht vollig geteilt, so dafi ihre Gestalt an eine Semmel erinnert. Die
Makrogonidien sind kurz zylindrische Zellen; auch sie besitzen eine zentrale Vakuole. Sie
sind ebenfalls nicht vollig geteilt und bilden paarige Gebilde. Manchmal werden
die Gonidien durch SchTeim zu einer Zoog/oea-artigen Masse verbunden.
Keimende Gonidien festsitzend, Streptokokken-ahnlich; aus 2-8 Zellen beste-
hend, die sich meistens alle im Teilungsstadium befinden. Wenn sich die
Gonidien auf der Scheide eines alteren Fadens festsetzen und dort keimen,
entsteht der Eindruck einer falschen dichotomen Verzweigung des Fadens.
Cohn (1872) vermutet, dafi aus Mikrogonidien diinne, aus Makrogonidien
dickere Faden entstehen. Cohn (1872) beobachtete auch eine weitere, wahr-
scheinlich weniger verbreitete Fortpflanzungsweise. Am Fadenscheitel vergro-
fiert sich die letzte Zelle wesentlich. Sie ist gewohnlich sehr lang (bis 7mal linger
als breit) und hat eine keulenformige oder ellipsoidische Gestalt. Aus dieser Zelle
keimt ein kurzer, farbloser Faden, dessen Aussehen an Blaualgen der Gattung
Oscillatoria erinnert; er bewegt sich durch charakteristisches Gleiten; eine
Scheide ist nicht sichtbar.
Haufig vorkommender und weit verbreiteter Organismus. In stehenden Gewas-
sern mit geringem Gehalt an organischen Stoffen sowie mit Eisen- und Mangan-
salzen. Orla-Jensen (1909) stellte zu dieser Gattung auch Clonothrix fusca unter
dem Namen Crenothrix dichotoma.
Wichtigste Literatur: Rabenhorst 1853, 1865, Cohn 1872, Zopf 1879, Migula
1900, Jackson 1902, Rullmann 1907, 1912, Kolkwitz 1909, Molisch 1910,
Harder 1919, Lieske 1922, Cholodnyj 1924,1926,1953, Dorff 1934, Kolk 1938,
Krasil'nikov 1949, Pringsheim 1949, Bergey's Manual 1957, 1974, Wolf 1960.
Eine einzige Art:
Crenothrix polyspora Cohn 1872 (Fig. 171)
Leptothrix kiihniana Rabenhorst 1853, Hypheothrix kiihniana (Rabenhorst
1853) Rabenhorst 1865, Crenothrix kiihniana (Rabenhorst 1853) Zopf 1879,
Crenothrix manganifera Jackson 1902, Sphaerotilus nutans var. prolifera
Butcher 1932.
Mit den Merkmalen der Gattung.
Die Ausmafie der Faden betragen an der Basis 1,0-9,0 um, am Scheitel, wo sie
verbreitert sind, 4,0-9,0 |xm. Meistens sind sie 2-3 mm lang, konnen jedoch eine
Lange von 1,0 cm erreichen. Zellen gewohnlich 2,0-5,0 |xm breit und 0,5—4 mal
so lang. Mikrogonidien durchschnittlich 1,0-2,0 |xm, manchmal jedoch nur 0,6-
0,8 |xm grofi; Makrogonidien erreichen im Durchschnitt bis 5,0 |xm. Manchmal
kommen auch intermediate Gonidientypen vor.
Die Art tritt in stehenden Gewassern mit geringer Konzentration organischer
Stoffe bei Anwesenheit von Eisen- oder Manganverbindungen auf; besonders in
Wasserleitungen, wo sie manchmal bei starkem Wachstum Storungen verur-
sacht. Auch oft in Dranleitungen, Brunnen, Wasserwerken, Quellen, sowie
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Crenothrix • 283
!i 1*V Crenothnxpohspora-a Fadenbiindel vondeneneinigeFaden Makro-
und Mikrogonidien bilden (500x), b Faden mit Mikrogonidien gefiilk; an der
f /^m^ °^ *Tmen M!kr°g°nidien zu spinnwirtelaLnlichen Fadenbiindeln
r,h(M \ Uk-Tumdie {m°X) ,(nach Ru"mann, 1907), d keulenartiges
lOOOx) Wahrscheinlich von reproduktiver Bedeutung (nach Cohn, 1872 -
verhaltnismafiig reinen Oberflachengewassern gefunden. Weit verbreiteter
Organismus.
ctorS S nl3) Ahh-uraSll,nik°V (^V- Vereinig,enLdieSe A" ^'"hlicherweise mit
RuZVnTnqnlf Dle.Abublld,ung.en "J d« Literatur fuhren leicht zu Irrtumern: Bei
Rullmann (1904) - wenig charaktenstische Aufnahmen - handelt es sich moglicherweise um
Leptothr* ochracea. Von Lieske (1922) werden auf S. 49 C^^KS
gememsam als Entwicklungsstadien von Clonothrix fusca abgebildet. Auch die AbbiUW
Ws M° nualffi' NHUmar (l92u!)' ^T1'11'^ <1949) Sind -"tkhend N^h
Gl!21^nT {T\ l S'e durC^ 'hre Teilung an die Gattungen Dermatophilus und
Ceodermatophilus der Actmomycetales sowle an die Gattung BlJtococcus erinnern.
284 • Bakterien mit Scheide - Phragmidiothrix
Zopf (1879) halt diese Art fur identisch mit Leptothrix kiihmana. Falls weitere Untersuchun-
gen zeigen sollten, dafi dies tatsachlich der Fall ist, hatte das Epitethon «kiihniana»
Vorrang.
a. Leptothrix kiihniana Rabenhorst 1853
Hypheothrix kiihniana (Rabenhorst 1853) Rabenhorst 1865, Crenothrix kiihniana
(Rabenhorst 1853) Zopf 1879
Mafiig gekrummte Faden, einzeln oder in mehr oder weniger dichten, graugefarbten
Anhaufungen vorkommend. Faden mit breiter f arbloser Scheide; Eisenoxide anhauf end und
sich dann Draunlich verfarbend.
Faden 2,5-3,0 \im, Scheide 10,5 \im breit.
Aus einer Dranleitung in Deutschland beschrieben.
Bergey's Manual (1957) stellte zu dieser Art auch:
b. Crenothrix manganifera Jackson 1902
In Wasser mit hohem Mangangehalt vorkommend.
Nach Beger und Bringmann (1953) identisch auch mit:
c. Sphaerotilus natans var. prolifera Butcher 1932
Besonders in schmutzigen Gewassern vorkommender Organismus, von wo er auch
beschrieben wurde.
5. Phragmidiothrix Engler 1883
Faden gegliedert, farblos, lang, nicht verzweigt. Festhaftend, mit den freien
Enden im Wasser flutend. Bildet grauweiKe, polsterartige Belage.
Die freien Enden konnen breiter sein als der Basalteil, der Faden verschmalert
sich dabei jedoch nicht allmahlich. Von einer diinnen, feinen, farblosen Schleim-
scheide umschlossen. Lagert keine Eisen- und Manganverbindungen ein. Zellen
verschieden grofi, scheibenformig, klein. Querwande deutlich. Protoplast ent-
halt hyaline Granula und ist von einer diinnen, farblosen Zellwand umgeben.
Bislang nur aus dem Freiland bekannt; Reinkulturen wurden nicht erzielt.
Physiologische Eigenschaften daher unbekannt. Halophil; wahrscheinlich
anaerob.
Fortpflanzung durch unbewegliche Gonidien, die aus vegetativen Zellen, durch
deren Teilung in drei senkrecht zueinander stehenden Ebenen hervorgehen. So
bilden sich kleine sarcinenartige Gruppen von fast wiirfelartigen Zellen. Durch
Querteilung der Zellen und ihr Wachstum innerhalb des Fadens entsteht eine
lokale Schwellung. Migula (1900) fiihrt an, daK es unter gewissen Bedingungen
zur Keimung der Gonidien innerhalb der Fadenscheide und dadurch zu einer
scheinbaren Verzweigung der Faden kommen kann. Die freien Gonidien bilden
manchmal, bevor sie zu keimen beginnen, Zoog/oe^-artige Massen. Kommt
iiberwiegend in Meerwasser vor, das mit organischen Stoffen verunreinigt ist;
nicht selten.
Wichtigste Literatur: Engler 1883, Migula 1900, Pringsheim 1966, Bergey's
Manual 1974.
Eine einzige An:
Phragmidiothrix multiseptata (Engler 1882) Engler 1883 (Fig. 172)
Beggiatoa foetida Fiorini-Mazzanti 1874, Beggiatoa multiseptata Engler 1882,
Crenothrix marina Hansgirg 1890, Crenothrix multiseptata (Engler 1882) Hans-
girg 1891, Crenothrix foetida (Fiorini-Mazzanti 1874) Hansgirg 1891
Mit den Merkmalen der Gattung.
Junge Faden 1,5 |xm, altere an der Basis 2,0-5,0 urn und an der Spitze 5,0-
6,0 |xm breit. An Stellen, wo Zellteilungen erfolgen, gewohnlich 6,0 \im breit;
ihre Lange kann einige mm erreichen. Zellen 1,5-4,0 \xm breit; ihre Lange
betragt % bis Vi der Breite. Gonidien 1,0 |xm im Durchmesser. Urspriinglich
wurden f estsitzende, weiRe Flecken bildende Faden auf lebenden Individuen von
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Ophryothrix ■ 285
Fig. 172. Phragmidiothrix multiseptata - a b Faden mit verschieden grofien
Zellen, c Fadenende mit Gonidienbildung, d Gonidienbildung und Beginn ihrer
Keimung in der Scheide, e Zoog/oea-artige Anhaufung von Gonidien (nach
Hansgirg, 1890.- 1000X).
Gammarus locusta gefunden, die in F^S-haltigem verunreinigtem Meerwasser
im «Weissen Grund» und «Todten Grund» der Kieler Forde (BRD) gesammelt
wurden. Beger (1957) fand diese Art oft auf Algen im nordlichen Adfriatischen
Meer. Pringsheim (1966) nimmt an, dafi sie mit Leucothrix mucor (= Leucothrix
cohaerens) identisch ist.
Gattungen unsicherer taxonomischer Stellung:
6. Ophryothrix Borzi 1878
Faden zart, kurz, polar differenziert; als epiphytische Organismen an verschie-
denen Algen festsitzend. In eine sehr zarte Scheide eingeschlossen, die bei der
Art Ophryothrix thuretiana manchmal schleimig wird. Am Basalteil, mit dem sie
an der Wirtsalge festhaften, sind die Faden verbreitert; Zellen langlich. Im
Apikalteil der Faden liegen ovale Zellen, von denen sich einzelne bewegliche
Gonidien oder Ketten abtrennen. Nur aus dem Freiland bekannt. Reinkulturen
wurden nicht erzielt. Physiologische Eigenschaften unbekannt. Wahrscheinlich
286 • Bakterien mit Scheide - Ophryothrix
aerob. Fortpflanzung durch Gonidienbildung oder durch kurze Fadenfragmen-
te. Als Epiphyten an verschiedenen Siifiwasseralgen gefunden.
Systematische Einreihung problematisch. Weitere sorgfiltige Untersuchungen
sind erforderlich.
Typus generis: Ophryothrix thuretiana Borzi 1878
Wichtigste Literatur: Borzi 1878, Trevisan in de Toni und Trevisan 1889, Skuja
1956, 1964.
Bestimmungsschliissel der Arten
la Faden kurz, bis 20 um, leicht gekrummt 2
lb Faden lang, stark gekrummt, bis zusammengerollt, bis 60 umlang
2. O. curvata
2a Faden hochstens 15 um lang; Zellen 0,4—0,5 um breit, im Basalteil 2—4 x
linger als breit 1. O. thuretiana
2b Faden hochstens 20 um lang; Zellen 0,3-0,5 um breit, im Basalteil 1-2 x
linger als breit 3. O. media
1. Ophryothrix thuretiana Borzi 1878
Leptotrichia thuretiana (Borzi 1878) Trevisan 1889, Leptothrix thuretiana (Borzi
1878) Hansgirg 188S.
Fiden kurz, fein, mit einem Ende an verschiedenen Fadenalgen oder an den
Endzellen dicker Oscillatorien festsitzend. Freies Ende gewohnlich mehr oder
weniger gekrummt. In eine sehr feine, farblose, durchsichtige, leicht verschlei-
mende Scheide eingeschlossen. Fiden polar differenziert, Basalteil der Fiden
etwas breiter und aus lingeren Zellen als im Apikalteil bestehend, wo die Zellen
kiirzer und an den Querwinden leicht gekrummt sind. Fortpflanzung durch
Gonidienbildung am Fadenende und durch kurze Ketten aus wenigen Zellen, die
Geifieln haben.
Fiden bis 15 um lang und 0,5-0,6 um dick. Einzelne Zellen 0,4—0,5 um breit
und 2—4 mal linger (im Basalteil); am Apikalende sind die Zellen ebenso breit wie
lang und wesentlich kleiner.
Als Epiphyt auf Planktonalgen und Blaualgen in stehenden Gewissern, beson-
ders in der Litoralzone vorkommend. Von Skuja (1954) in den Seen Hjilstaviken
und Hallaren (Schweden) gefunden. Borzi (1878) stellt diesen Organismus zu
den Algen.
2. Ophrythrix curvata Skuja 1956 (Fig. 173)
Fiden einzeln, farblos, nicht von Gallerte umhiillt, aber in einer feinen Scheide
liegend. Junge Fiden fast gleichmifiig breit. Altere Fiden zum Apikalteil hin
leicht verjiingt. Fiden nicht gerade, sondern verschieden gekrummt oder gewun-
den. Mit dem Basalteil an verschiedenen Planktonalgen festsitzend, besonders an
Closterium libellula. Zellen im Basalteil 2—4 mal linger als breit, fast oval,
homogen. Fortpflanzung entweder durch einzellige Gonidien oder durch kurze
kettenihnliche Fadenfragmente. Abgebrochene Fadenfragmente beweglich,
wahrscheinlich mit Hilfe peritricher Geifieln. Gonidien trennen sich durch
schwingende Bewegungen.
Fiden bis 80 urn lang. Zellen 0,8-1,3 um lang.
In stehenden Gewissern vorkommender Organismus, wo er als Epiphyt auf
verschiedenen Grunalgen des Planktons auftritt. Einmal im See Lingsjor
(Schweden) gefunden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Haliscomenobacter • 287
Fig 173. Ophryothrix curvata - Faden auf Closterium libellula festsitzend und
tiudung aktiv beweghcher Gonidienketten (nach Skuja, 1954. - 1340X)
Fig. 174. Ophryothrix media-a em kleines Fadenbuschel (2000x), b terminale
Abschnurung der Gonidien (2500x) (nach Skuja, 1964).
3. Ophryothrix media Skuja 1964 (Fig. 174)
Vielzellige, unverzweigte, einfache, zum Scheitel hin sich leicht verjiingende
haden. Mit dem Basalteil an verschiedenen Algen festsitzend. Meistens gerade
oder sehr wenig gebogen, elastisch. Mit zarter, hyaliner, glatter Scheide. Zellen
im Basalteil des Fadens meistens 1,5-2,0 mal linger als breit, Querwinde sehr
wenig eingeschnurt. Im Apikalteil Zellen isodiametrisch oder wenig breiter als
lang und ausgesprochen eingeschnurt. Protoplasma homogen, farblos Fort-
prlanzung entweder durch einzellige Gonidien oder durch kurze
Fadenfragmente, die sich im Apikalteil des Fadens bilden. Fiden unbeweglich, festsitzend.
Etwa 0,3-0,5 um breit und 10-20 um (manchmal auch iiber 30 um) lang.
Nicht selten in Sufiwasserseen vorkommend. An verschiedenen planktischen
Desmidiaceen festsitzend, besonders an Sphaerozosma aubertianum. Aus dem
See Vittangijirvi (Schweden) beschrieben.
7. Haliscomenobacter van Veen et al. 1973
Streptothrix Cohn 1875, emend. Migula 1895 (non Streptothrix Corda 1839, non
Streptothrix Cohn 1875), Chlamydothrix Migula 1900
Zellen in Form diinner, zarter, gramnegativer Stibchen. Dunne, gerade oder
scnari geknickte, zah^nbewegliche Faden bildend, die sich nur selten verzwei-
288 • Bakterien mit Scheide - Haliscomeno^^er
gen (in stationaren Kulturen); seitliche Zweige der Faden gewohnlich sehrkurz,
wesentlich kiirzer als der Hauptfaden. Faden in einer diinnen, im Phasenkon-
trast schwer erkennbaren hyalinen Scheide; niemals mit Eisen- oder Manganoxi-
den inkrustiert. Freie Zellen aufierhalb der Scheide nur selten vorkommend;
weder Geifieln noch Bewegung konnten beobachtet werden. Bilden keine
Ruhestadien. Zellen mit karotinoiden Pigmenten unbestimmter Zusammenset-
zung.
Streng aerober, chemoorganotropher Organismus mit respirativem, niemals
fermentativem Metabolismus, bei dem Luftsauerstoff als Elektronenakzeptor
beniitzt wird. Verwertet eine Reihe von organischen Stoffen als Kohlenstoff-
und Energiequelle. Als Stickstoffquelle geniigen Nitrate oder Ammoniumsalze,
besser gedeiht der Organismus in Anwesenheit einer organischen
Stickstoffquelle. Benotigt zum Wachstum Thiamin und Vitamin BI2. Auf festen, nahrstoffar-
men Nahrboden werden kleine (0,5 mm), fadige Kolonien gebildet. Auf nahr-
stoffreichen Boden entstehen 1,0-3,0 mm grofie, hellrosa gefarbte Kolonien, bei
denen nur die Rander fadig sind. Wachst gut in der verhaltnismafiig breiten
Temperaturspanne von 8-30 °C, mit einem Optimum bei 25-27 °C.
Weit verbreitet in Sufi- und Abwassern. Besonders haufig im Belebtschlamm von
Abwasserreinigungsanlagen der Fleischindustrie oder von Gewassern mit ho-
hem Eiweifigenalt. Urspriinglich aus Siimpfen verhaltnismafiig selten
vorkommend beschrieben.
^ ^ / /
\ N/ . \ / /
175
Fig. 175. Haliscomenobacter hydrossis - Faden aus Belebtschlammflocke her-
vorragend (Orig. 700x). Fig. 176. Lieskella bifida - a doppelte Zellkette,
b Zellkette mit starker Inkrustation (nach Perfiliev, 1926. - 2000 x).
I
ff
176
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Toxothrix • 289
Wichtigste Literatur: Migula 1895, 1900, Corda 1839, Schoenichen und Kal-
berlah 1900, Pringsheim 1949, Beger und Bringmann 1953, Mulder et al. 1971,
van Veen et al. 1971, 1973, Bergey's Manual 1974, Eikelboom 1975.
Eine einzige Art:
Haliscomenobacter hydrossis van Veen et al. 1973 (Fig. 175)
Streptothrix hyalina Migula 1895, (non Streptothrix hyalina Corda 1839), Chla-
mydothrix hyalina (Migula 1895) Migula 1900, Leptothrix hyalina (Migula 1895)
Schoenichen et Kalberlah 1900 (non Leptothrix hyalina Reinsch 1876).
Mit den Merkmalen der Gattung.
Zellen 0,35-0,45 x 3,2 - 4,6 urn grofi; Faden mit Scheide 0,5-0,8, meistens
0,6 urn breit.
Faden watteartige Anhaufungen bildend, die gewohnlich zwischen anderen
fadigen Organismen vorkommen. Nach Pringsheim (1949) soil es sich um nicht
vollig entwickelte Faden von Sphaerotilus natans handeln. Weitere Untersu-
chungen sind erforderlich. Taxonomische Einreihung bisher nicht vollig geklart.
In Bergey's Manual (1974) wird dieser Organismus unter dem Namen
Streptothrix hyalina Migula 1895 gefiihrt. Van Veen (1973) macht jedoch darauf
aufmerksam, dafi dieser Name nicht gultig ist, da unter dieser Bezeichnung
schon ein Pilz (Corda 1839) beschrieben wurde, und schlagt darum den Namen
Haliscomenobacter hydrossis vor.
8. Toxothrix Molisch 1925
Aus farblosen, stabchenformigen Zellen bestehende Faden. Gewohnlich bogen-
artig oder in Form des Buchstaben «U» gekriimmt. Durch Ausscheiden eines
mukoiden Sekretes entstehen charakteristische, strickartige, facher- oder korb-
chenartige Gebilde. Strickartige Biindel aus Sekretstreifchen bestehend, die
friiher fiir Scheiden der Faden gehalten wurden; sie werden auch in Anwesenheit
von Bakterienfaden allmahlich mit Verbindungen von dreiwertigem Eisen im-
pragniert. In verdunnter Salzsaure werden sie nicht restlos aufgelost. Bei einer
Art liegen diese Gebilde in Schleimlagern, die nicht mit Eisen inkrustiert sind.
Physiologische Eigenschaften unbekannt. In relativ kiihlen Gewassern mit
Eisenverbindungen.
Typus generis: Toxothrix trichogenes (Cholodnyj 1924) Beger 1953
Wichtigste Literatur: Cholodnyj 1924, 1926, 1953, Molisch 1925, Naumann
1925, Teichmann 1935, Pringsheim 1949, Beger in Beger und Bringmann 1953,
Balasova 1968, Krull et al. 1970, Bergey's Manual 1957, 1974.
Bestimmungsschliissel der Arten
la Faden 200-400 um lang; strickartige Streifen eines mukoiden Stoffes aus-
scheidend, der allmahlich mit Eisen inkrustiert wird. Ohne Schleimlager . . .
1. T. trichogenes
lb Kurze, einschliefilich der ausgeschiedenen Streifen mukoiden Stoffes in
einem ovalem Schleimlager liegende Faden 2. T. gelatinosa
1. Toxothrix trichogenes (Cholodnyj 1924) Beger 1953 (Fig. 177)
Leptothrix trichogenes Cholodnyj 1924, Toxothrix ferruginea Molisch 1925,
Chlamydothrix trichogenes (Cholodnyj 1924) Naumann 1925, Sphaerotilus
trichogenes (Cholodnyj 1924) Pringsheim 1949.
Aus spezifischen, strickartigen oder zopfartig verflochtenen, unverzweigten,
gewohnlich bogenformigen Streifenbiinaeln bestehender Organismus. Manch-
290 • Bakterien mit Scheide - Toxothrix
mal von facherformiger Gestalt, die aus einer Menge schraubenartig gewundener
und auf einer Seite bogenformiger Streifen besteht, die sich allmahlich miteinan-
der zu dickeren, verzweigten Biindeln verbinden. Oft erinnert das Gebilde, vor
allem wenn es in grofierer Menge vorkommt, durch seinen Habitus an einen
Reisstrohbesen. Es konnen auch Gebilde in Form des Buchstaben «U» entste-
hen, die entweder aus einem einfachen strickartigen Biindel von Streifen beste-
hen oder am haufigsten - im gebogenen Teil aus einer grofieren oder kleineren
Anzahl von einzelnen diinneren, nebeneinander liegenden und stufenweise
hufeisenartig gebogenen Streifenbiindeln. Ihre Gestalt erinnert dann an ein
Korbchen, ein Vogelnest oder einen Soldatenhelm. Oft sind zwei verschieden
gebogene Biindel von Streifen zu finden, die genau parallel verlaufen. Bei alien
Formen ist die Anzahl der Streifen in den Biindeln sehr verschieden und
entsprechend variiert auch der Durchmesser der Biindel.
In der alteren Literatur (Cholodnyj 1924, 1953, Teichmann 1935, Beger und Bringmann
1953) wurde angenommen, daB diese Gebilde Tubularscheiden des eigentlichen Bakterien-
fadens sind. Die strickartige Struktur entsteht aber dadurch, da(5 die sich rund um den
Bakterienfaden bildende primare Scheide, die aus parallel gelagerten langen Fasern von
ausgeschiedenem Eisenhydroxid besteht, nach einer bestimmten Zeit ihrer Entwicklung der
Lange nach in einzelne Streifen spaltet; diese rollen sich dank ihrer Elastizitat zu engen
Rollchen zusammen, aus denen sich dann die hohle, sekundare, strickartige Scheide um den
Bakterienfaden bildet. Unter ungiinstigen Bedingungen verlafit der Bakterienfaden die
Scheide, wobei er einige anliegende Streifen der Scheide mit hinauszieht. Dadurch entstehen
die verschiedenen schlingenartigen Gebilde.
In den letzten Jahren stellten jedoch Krull et al. (1970) durch unmittelbare Beobachtung
lebender Organismen fest, dafi die charakteristischen Gebilde in Wirklichkeit aus einer
Mukoidsubstanz bestehen, die vom Bakterienfaden an mehreren Stellen der beiden Enden in
Form schmaler Streifen ausgeschieden wird. Da der Faden um seine Langsachse rotiert,
sehen die erwahnten Strukturen wie strickartige Biindel von Faden aus, die sich bisweilen
facherartig offnen konnen. Die korbchen- oder helmartigen Gebilde entstehen durch
Produktion eines schleimartigen Stoffes an beiden Enden des U-formig gebogenen Fadens,
der sich mit dem gebogenen Teil vorwarts bewegt, wobei seine Enden symmetrisch rotieren.
Ahnlich entstehen auch die parallelen Gebilde. Die exkretierten Schleimstreifen werden im
Lauf der Sommermonate allmahlich mit Eisenhydroxid auch bei Abwesenheit von
Bakterienfaden - inkrustiert, sodafi die urspriinglich farblosen Strukturen gelb bis braun werden:
gleichzeitig werden sie immer zerbrechlicher und diinner. In den Wintermonaten kommt es
zu keiner Krustenbildung.
Den eigentlichen Organismus bilden lange, farblose, stark flexible, sich gleitend
bewegende, aus bis zu 40 zylindrischen, verhaltnismafiig kurzen Zellen beste-
hende Faden. An jedem Fadenende befinden sich dunkle, nicht naher bestimmte
Strukturen. Gram-Reaktion unbekannt. Oft kommen auch Riesenzellen in
Gestalt von langen ungegliederten Faden vor. Gleichzeitig gibt es auch Faden,
die aus Zellen sehr verschiedener Lange bestehen.
Chemoorganotroph, psychrophil, optimal bei einer Temperatur von 5-10 °C,
niedrigem Sauerstoffgehalt und geringer Konzentration von organischen Stoffen
wachsend. Reinkulturen wurden von Balasova (1968) isoliert, die physiologi-
schen Eigenschaften sind jedoch bisher unbekannt. Oxydation von zwei- zu
dreiwertigem Eisen und die darauffolgende Einlagerung in die exkretierten
Schleimstrukturen hangt wahrscheinlich nicht mit dem Metabolismus des
Organismus zusammen. Fur das Wachstum ist jedoch die Anwesenheit von Eisen im
Fig. 177. Toxothrix trichogenes - a-d lebende Faden im Phasenkontrast gese- ►
hen, e-h verschiedene Formen seilformig gedrehter Biindel eines aus dem Faden
exkretierten Gallertstoffs, der friiher als Tubularscheide des Fadens angesehen
wurde, i parallel angeordnete Bander (nach verschiedenen Autoren; alles
1350X). —
292 • Bakterien mit Scheide - Lieskella
Wasser erforderlich. Fortpflanzungsweise nicht bekannt. Angaben iiber beweg-
liche Gonidien in der alteren Literatur sind problematisch.
Faden gleitend, um ihre Langsachse rotierend. Hufeisenformig gebogene Faden
bewegen sich mit dem gebogenen Teil des Fadens vorwarts.
Zellen nach Krull et al. (1970) 0,5-0,75 x 3,0-6,0 |xm grog; nach Angaben von
Cholodnyj (1924, 1953) nur 1,0-2,0 |xm lang. Faden 200-400 |xm lang. Schleim-
streifen in der strickartigen Struktur gewohnlich 0,2 |xm dick, ganze Biindel ca
2,0 |xm breit.
Weit verbreitete Art. An den verschiedensten Standorten (Waldbachen, Moo-
ren, Brunnen mit eisenhaltigem Wasser, Wiesentiimpel, in schnell fliefienden
Bachen an der Oberflache von Steinen u. a.) vorkommend. Auch haufig in
Reisfeldern gefunden. In Massen in Wasserwerkeinrichtungen (Enteisungsanla-
gen u. a.) vorhanden; er wird jedoch don oft iibersehen, da die mit Eisen reich
inkrustierten «Scheiden» schwer zu erkennen sind. Urspriinglich in Sedimenten
des Wasserbeckens der Belebungsanlage Dnjepr (UdSSR) gefunden. Von
Cholodnyj (1924) aus dem Wasser bei der Universitat von Sendrai (Japan) be-
schrieben.
Die taxonomische Anordnung dieses Organismus ist bisher problematisch. Pringsheim
(1949) stellte ihn unrichtigerweise in die Gattung Sphaerotilus. Balasova (1968) nimmt an
Hand der ahnlichen Ultrastruktur des sekretierten Schleimes an, dafi er zur Gattung
Gallionella gehort. Krull et al. (1970) halten die Einordnung in die Familie Chlamydobacte-
riaceae fur unberechtigt, da sie auf einer falschen Interpretation der gekrummten,
strickartigen «Scheiden» beruht. Sie stellen den Organismus - als mit der Gattung Herpetosiphon
verwandt - zu den «Gleitbakterien»
2. Toxothrix gelatinosa Beger 1953
Diese Art bildet verhaltnismafiig kurze, aus zylindrischen Zellen bestehende
Faden und - wahrscheinlich ebenso wie die vorhergehende Art - facherartig
angeordnete, verzweigte, aus einer gemeinsamen verbreiterten Basis herausra-
gende Biindel von strickartigen, eiseninkrustierten Streifen eines mukoiden
Stoffes. Die «Scheiden» sind gleich lang (gewohnlich alle in eine Richtung
bogenartig gekriimmt) und liegen in einem Schleimlager von ovalem oder
ovoidem Umrifi, das kein Eisen enthalt. Selten sind auch Lager zu finden, in
denen einzelne, verstreute «Scheiden» liegen.
Gesamtlange des Lagers ca. 30 |xm; facherartige Scheidengebilde gewohnlich
22 |xm lang. Einzelne Streifenbiindel 1,5-1,7 |xm breit. Zellen, sofern sie sichtbar
sind, 0,5 x 3,0 |xm grofi.
In eisenhaltigen Gewassern vorkommend.
Sideromyces glomerata ziemlich ahnlich sehend, unterscheidet sich von dieser jedoch durch
die eiseninkrustierten Schleimlager und die darin liegenden, nicht verzweigten und unregel-
mafiig zusammengerollten Faden. Ein bisher wenig bekannter Organismus, der weiter
untersucht werden mu6; Bergey's Manual (1974) stellt ihn zu Toxothrix trichogenes.
9. Lieskella Perfiliev 1926
Zellen stabchenformig, mit abgerundeten Enden. Meistens Ketten bildend, die
sich oft zu zweit parallel nebeneinander legen oder sich gegenseitig schraubenar-
tig umwinden. Manchmal auch zu kugeligen, knauelartigen Gebilden verfloch-
ten oder grofie, eisenimpragnierte Lager bildend. Faden in einer gemeinsamen,
gelblich gefarbten Schleimkapsel liegend, die oft eine grofie Anzahl kleiner
Eisenhydroxidgranula enthalt. Einzelne Zellen wenig deutlich. Erst nach Auflo-
sen des Eisenhydroxids mit verdiinnter Salzsaure sind sie als zickzack-formig
angeordnete Zellketten zu sehen. Freie einzelne Zellen kommen verhaltnismafiig
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Lieskella • 293
selten vor. Protoplast gut mit Methylenblau farbbar, wobei an beiden Zellpolen
Granula (wahrscheinlich Volutin) erscheinen. Die Strukturen des Protoplasten
lassen sich schwer untersuchen, da jedes - auch stark verdiinnte - Fixierungsmit-
tel die Struktur schnell zerstort. Die Faden zerfallen in vollig unregelmafiig
angeordnete, deformierte Reste einzelner Zellen; deshalb ist das Resultat der
Gram-Farbung unbekannt. Der Organismus lafit sich nur «in vivo» mit Hilfe
eines Perfiljev-Peloskops gut beobachten. Nur aus dem Freiland bekannt.
Faden langsam, ahnlich wie manche Blaualgen beweglich. Aus ihrem Milieu
versetzt, separieren sie sich aktiv und schnell aus den Mikrozonen, in denen sie
vorkommen.
Weit verbreitet und ganzjahrig haufig in der Uferzone von Seen mit hoherem
Eisengehalt, in einer Tiefe von 0,5-1,2 m vorkommend. In oberen Schlamm-
schichten spezifische, aus 10-15 Kettchen bestehende Mikrozonen bildend, die
durch Eisenhydroxid und an diesem haftende Schlammteilchen vollkommen
maskiert sind. Das erklart auch, warum der Organismus seit seiner Beschreibung
bis zur Erfindung des Peloskops nicht wieder gefunden wurde.
Wichtigste Literatur: Perfiliev 1926, 1927, Dorff 1934, Perfiliev und Gabe
1961, Bergey's Manual 1974.
Eine einzige Art:
Lieskella bifida Perfiliev 1926 (Fig. 176)
Lieskella bifilaris (Perfiliev 1926) Dorff 1934
Mit den Merkmalen der Gattung.
Zellen 0,6 x 2,0-3,0 |xm grofi.
Diese Art wurde urspriinglich aus den Oberschichten des Schlammes der Teiche
in der Umgebung von Alt-Petershof bei Leningrad (UdSSR) beschrieben. Spater
von Perfiliev und Gabe (1961) in einer Reihe von Lokalitaten in der UdSSR
gefunden. Von Skerman (nicht veroffentlicht - zit. Bergey's Manual 1974) in der
Oberschicht des Schlamms im See Lake Windermere (England) gefunden.
180
Fig. 178. Sideromyces glomerata - schematisiert (nach Naumann, 1929).
Fig. 179. Mycothrix abundans - schematisiert (nach Naumann, 1929). Fig. 180.
Mycothrix clonotrichoides ~ schemztisien (nach Naumann, 1921. —alles 1000X).
294 • Bakterien mit Scheide - Unsichere Arten
Die systematische Zuordnung ist noch problematisch. Von Perfiliev und Gabe
(1961) in die neu vorgeschlagene Ordnung Cyclobacteriales eingereiht.
Unsichere, ungeniigend beschriebene Gattungen und Arten:
Sideromyces glomerata Naumann 1929 (Fig. 178)
Gallionella ferruginea forma trichoidea Naumann 1921, Gallionella glomerata
forma trichoidea Naumann 1921, Mycogallionella glomerata Naumann 1921,
Sideromyces glomerata forma trichoidea Naumann 1929
Unverzweigte, gewellte oder unregelmafiig gebogene Faden, einzeln oder in
Gruppen von einigen Individuen in einem mit Eisenverbindungen stark inkru-
stierten Schleimlager. Eisenkrusten bilden sich auch unmittelbar in den Zellwan-
den. Sowohl Physiologie als auch Fortpflanzungsweise unbekannt.
Einzelne Faden 0,5 um breit und 15-25 um lang. AusmaSe der Zellen nicht
angegeben.
Im Neuston von Siifiwasserseen vorkommend. Sehr wenig bekannter,
ungeniigend beschriebener Organismus. Erinnert ziemlich stark an Toxothrix gelatino-
sa, die jedoch facherartige «Faden» hat und kein Eisen im Schleimlager ablagert.
Mycothrix abundans Naumann 1921 (Fig. 179)
Zellen stabchenformig, Ketten bildend, von einer dicken Schleimschicht umge-
ben, in der Eisen abgelagert wird. Zellen 0,5 X 2,5 urn grofi.
In den Siimpfen des Gebietes von Aneboda (Schweden) gefunden. Unzurei-
chend beschriebener Organismus.
Mycothrix clonotrichoides Naumann 1921 (Fig. 180)
Zellen keilformig, in einer Schleimkapsel liegend; 1,5-3,5 um lang, dick, an
einem Ende verbreitert. Schleimkapsel durchschnittlich bis 15 um breit.
Im Neuston von SiiKwasserseen in Schweden, von Beger (1935) auch im Wasser-
werk in Frankfurt a.d.O. (DDR) gefunden. Sehr wenig bekannter, ungeniigend
beschriebener Organismus.
Sphaerothrix latens Perfiliev 1927 (Fig. 181)
Der Organismus bildet typische, feste, regelmafiige, brotlaibformige, flache bis
rundliche, geschwulstartige Kolonien mit konzentrischer Struktur, die aus einer
grofien Zanl radial angeordneter, feiner, dichotom sich verzweigender, mit
Doppelkontur (wahrscheinlich Scheiden) versehener Faden bestehen, die stark
mit Eisenhydroxid inkrustiert sind. Faden aus kleinen, kurzen, stabchenformi-
gen Zellen zusammengesetzt, was besonders an der Peripherie der Kolonien
beobachtet werden kann. Faden mit Salzsaure leicht zersetzbar. In ihrer Struktur
sind sie den Faden von Toxothrix trichogenes ahnlich. Mit Gentianaviolett gut
farbbar.
Zellen 1,5-2,0 X 0,06 um grofi; Kolonien bis zu einem Durchmesser von
3 mm.
In Torfwassern; urspriinglich im Torfsee Seliger in der Nahe von Leningrad
(UdSSR) gefunden.
Nach Dorff (1934) sollte dieser Organismus in die Gattung Leptothrix eingereiht
werden, weil er Scheiden und dichotom verzweigte Faden hat. In Bergey's
Manual (1957) wird er unrichtigerweise zu Gallionella ferruginea gestellt. Wenig
bekannter Organismus.
Nostocoida limicola van Veen 1973 (nomen provisorium)
Kokkoide bis ovoide Zellen. Jede Zelle ist durch Querwande geteilt, die nur
unter dem Elektronenmikroskop sichtbar sind. Enthalten weder Thylakoide i
noch photosynthetische Pigmente. Bilden keine Zysten. Zellen sind zu unregel- ]
maKig gekriimmten, manchmal verzweigten Ketten vereinigt. Grampositiv. j
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Arten • 295
Fig. 181. Sphaerothrix latens - a Kolonie Langsschnitt, b Kolonie Querschnitt
(nach Perfiliev, 1927. - 60 x).
Scheide wurde nicht beobachtet. Vermehrung durch Teilung nur in einer
senkrecht zur Langsachse der Kette stehenden Ebene.
Einzelne Zellen 0,3-0,6 x 0,7-1,5 um grofi. Im natiirlichen Milieu sind die
Ketten maximal 200 |im lang, in stationaren Kulturen 600-900 um.
Kommt nicht in schwimmendem Belebtschlamm vor. Weiteres Studium erfor-
derlich. Morphologisch den Blaualgen ahnlich.
Microthrix parvicella van Veen 1973 (nomen provisorium)
Feine, im Verlauf der Faden unregelmafiig breite, unbewegliche, gekriimmte
Faden, wahrscheinlich ohne Scheide. Grampositiv. Im Lichtmikroskop keine
, Trennwinde sichtbar; unter dem Elektronenmikroskop sind jedoch kurze zylin-
296 • Bakterien mit Scheide - Unsichere ^pn
derformige Zeilen unterscheidbar, die Granula enthalten (Volutin und ein nicht
ni'her identifizierter Reservestoff). ..
Verwertet stickstoffhaltige Substanzen in Klaranlagen und oxydiert sie zu
zSlen 0,^0,6 x 0,7-1,8 (xm grofi, Faden 0,^0,6 (xm breit und bis 30C-500 (xm
Vorkommen im schwimmenden Belebtschlamm.
We teTsS udium erforderlich. Wahrscheinlich identischmit dem O^tmsmus.
den Pasveer (1969a, 1969b) als Fadenform von Escherichia coh angesehen hat,
(Eikelboom 1975).
Scanned * Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Teil IV. Knospende Bakterien und
Bakterien mit Anhangseln
Vollig kiinstliche Gruppe ohne phylogenetische Verwandtschaft. Sie vereinigt
verschiedene Organismengruppen auf Grund zweier gemeinsamer Merkmale:
Fortpflanzung durch Knospung und Bildung verschiedener Arten von
Anhangseln. Es handelt sich einmal um eine Reihe schon lange bekannter Organismen,
bei denen sich jedoch die systematische Einordnung infolge neuester Erkennt-
nisse grundlegend geandert hat, zum anderen umfafit die Gruppe vor kurzem
beschriebene, bisher wenig bekannte Organismen.
Ohne Erfolg blieb der Versuch, sie in hohere Taxa einzugliedern. Fast alle hier
eingereihten Organismen bediirfen weiterer sorgfaltiger Untersuchungen.
Bestimmungsschliissel der Gattungen
la Zeilen bilateral symmetrisch 2
lb Zeilen radial symmetrisch 16. Angulomicrobium (S. 353)
2a Zeilen mit Auslaufern verschiedenen Typs 3
2b Zeilen ohne Auslaufer, Tochterzellen unmittelbar auf der Mutterzelle
knospend 18
3a Zelle mit Prostheken, fadigen Auslaufern in Gestalt von Hyphen, Stengeln*
oder Stielen* 4
3b Aus jungen beweglichen Zeilen keimen Faden als Grundeinheit der Mikro-
kolonie des Organismus; am Faden lateral und terminal Tochterzellen
knospend 16
4a Zeilen Prostheken oder fadige Auslaufer bildend 5
4b Zeilen mit Stielen* oder Stengeln'1' 10
5a Zeilen mit fadigen Auslaufern oder Hyphen 6
5b Zeilen kegel-oder pfeilformige Hyphen bildend 9
6a Organismus ohne Assimilationspigmente; fadige Auslaufer in Gestalt von
Hyphen ohne Scheidewande 7
6b Organismus mit purpurfarbenen Assimilationspigmenten; Hyphen mit
Scheidewanden RhodornicroDiurn(sieheTeilI,S.35)
7a Fur das Wachstum werden nahrstoffreiche Nahrboden, besonders'Peptide
benotigt 1. Hyphomonas (S. 288)
7b Reiche Nahrboden sind fiir das Wachstum nicht erforderlich 8
8a Hyphen nur am Zellpol 2. Hyphomicrobium (S. 289)
8b Reich verzweigte Hyphen an der ganzen Zelloberflache
3. Pedomicrobium (S. 305)
9a Prostheken pfeilformig, 3 mal linger als die Zelle; Organismus fakultativ
aerob, Metabolismus fermentativ 4. Ancalomicrobium (S. 308)
9b Prostheken kegelformig, ungefahr ebenso lang wie die Zelle; aerob;
Metabolismus respirativ 5. Prosthecomicrobium (S. 309)
10a Stiele* sind Bestandteile der Zeilen; halmartig 11
10b Stengel* nicht halmartig; scheinbarexkretiert 13
11a Zeilen stabchen-, spindel- oder birnenformig oder limonoid 12
lib Zeilen, schraubenfbrmig 6.Thiodendron(S.311)
12a Zeilen stabchen-, spindel- oder birnenformig oder limonoid; Stiel meist
* Zur Beachtung: die Begriffe «Stiel» und «Stengel» werden hier in unterschied-
lichem Sinne gebraucht. Sie bezeichnen Organellen, die sich in Struktur und
Funktion wesentlich unterscheiden (siehe auch unter 1.3 «Erklarung einiger
Fachausdriicke»).
298 • Knospende Bakterien - Hyphomonas
polar; am Basalteil des Stiels ein Gallertpolster; Zucker wird nicht in Sauren
umgewandelt 7.Caulobacter(S. 312)
12b Zellen dicke, gerade, zylindrische Stabchen; Stiel («Pseudostiel») excen-
trisch polar; Basalteil des Stiels ohne Gallertpolster; Zucker wird in Sauren
umgewandelt 8. Asticcacaulis (S. 321)
13a Stengel konischgegen die Basis verjiingt 14
13b Stengel der ganzen Lange nach gleichmafiig breit, meist lang 15
14a Stengel lang, oft gekriimmt 9. Siderophacus (S. 322)
14b Stengel kurz; Zellen bilden lappige Kolonien 10. Nevskia(S. 323)
15a Stengel bandartig oder zylindrisch; keine radial angeordneten Kolonien
bildend ll.Gallionella(S.325)
15b Stengel diinn, gleichmafiig breit oder zur Basis hin verbreitert, lang; radial
angeordnete Kolonien bildend 12. Planctomyces (S. 336)
16a Fur das Wachstum ist Anwesenheit von Pilzhyphen erforderlich; seestern-
bis spinnenartig gelappte, stark mit Mangan inkrustierte Kolonien bildend
17.Metallogenium(S.354)
16b Anwesenheit von Pilzhyphen zum Wachstum nicht erforderlich; Kolonien
verschieden geformt 17
17a Gelappte, Zoogloea-artige Kolonien mit Gitterstruktur
18.Caulococcus(S.359)
17b Kolonien ziemlich polymorph, am haufigsten in Gestalt eines Maiglock-
chenblattes 19. Kusnezovia (S. 360)
18a Ohne Assimilationspigmente 19
18b Mitpurpurfarbigen Assimilationspigmenten
Rhodopseudomonas(SieheTeilI,S.23)
19a Epiphyt auf Diatomeen; kegelformige Mutterzelle schniirt kugelige
Knospen ab 21. Chamaesiphonosira (S. 361)
19b Nicht als Epiphyt lebend 20
20a Chemoorganotrophe Organismen 21
20b Chemolithotrophe Organismen; oxydieren N02 zu N03
Nitrobacter**
21a Kugelige bis tropfchenformige Zellen bilden unsymmetrische Paare mit
einer grofien und einer kleinen Zelle. Kommt in Fakalien und im Darmin-
haltvonMenschenundGefliigelvor 20. Gemmiger(S.360)
21b Zellen mit anderen Eigenschaften, bilden Kolonien 22
22a Rosettenartige Kolonien bildend 23
22b Keine Rosetten bildend; Kolonien lappig bis blumenkohlformig
13. Pasteuria (S. 344)
23a Zellen schraubenformig 14. Seliberia(S. 346)
23b Zellen stabchen- oder keulenformig, nie schraubenformig
15. Blastobacter (S. 349)
1. Hyphomonas Pongratz 1957
Morphologisch der Gattung Hyphomicrohium sehr ahnlich. Zellen gram-nega-
tiv, farblos, Ovoid, elliposoidisch oder birnenformig; vom schmaleren Pol
wachst eine gerade oder leicht gewellte Hyphe aus, die manchmal wie eine
Pilzhyphe verzweigt ist. Altere Kulturen enthalten Involutionsformen, (Riesen-
zellen, spindelformige oder dreieckige Zellen), deren Hyphen reich verzweigt
sind. An den Distalenden der Hyphen bilden sich, ahnlich wie bei der Gattung
*'■'' Nicht angefiihrt, da er anhand morphologischer Merkmale nicht identifiziert
werden kann.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Hyphomicrobium ■ 299
Hyphomicrohium, Knospen (Tochterzellen). Abgetrennte junge Zellen sind
mittels einer subpolaren Geifiel beweglich, die auch nach Bildung der Hyphe oft
an der Zelle und an ihren neugebildeten Tochterzellen haften bleibt. Es kommt
dann vor, dafi die bewegliche Mutterzelle die Hyphe mit der Tochterzelle hinter
sich her schleppt. Gelegentlich interkalare Knospen bildend. Direkte Knospung
ohne Hyphen oder mit sehr kurzen Hyphen ebenfalls vorkommend. Protoplast
homogen, altere oder Involutionszellen enthalten Kornchen und Vakuolen.
Zellen mit Anilinfarben gut farbbar.
Aerober, heterotropher Organismus. Fur das Wachstum werden Nahrboden
benotigt, die reich an Nahrstoffen (vor allem Peptiden, Blutserum, Blutagar
u. a.) sind. Wachst nicht auf armen Medien. Auf festen Medien werden «S» und
«R» Kolonien gebildet. Zellen in «S» Kolonien mit sehr stark ausgepragten, mit
Karbolfuchsin sich gut farbenden Schleimkapseln; Hyphen oder knospende
Zellen ohne solche Kapseln. Optimale Temperatur bei 37 °C, pH-Werte bei
7,0-7,4. Wachst nicht bei niedrigen pH-Werten.
Zellen 0,6-1,0 [xm breit und ungefahr 1,0 [xm lang. Hyphen 2,0 \i lang; sie
konnen jedoch auch bis 8,0 (xm lang werden.
Nur ein einziges Mai aus dem Sekret der Nasenschleimhaut des Menschen
isoliert; nicht pathogen. Theoretisch konnte er in Badern, Rekreations- und
Schwimmbecken u. a. eingeschleppt werden.
Wichtigste Literatur: Pongratz 1957, Zavarzin 1961, Bergey's Manual 1974.
Eine einzige Art:
Hyphomonas polymorpha Pongratz 1957,
Hyphomicrobium polymorphum (Pongratz 1957) Zavarzin 1961
Mit den Merkmalen der Gattung.
Zavarzin (1961) reiht diesen Organismus an Hand der morphologischen
Eigenschaften in die Gattung Hyphomicrobium ein.
2. Hyphomicrobium Stutzer et Hartleb 1898
Organismen mit charakteristischem Entwicklungszyklus. Aus stabchenformi-
gen Zellen mit abgerundeten Enden oder aus kugeligen bis ovalen oder ellipsoidi-
schen Zellen wachst an einem Pol (selten an beiden) eine fadenformige Hyphe
aus, an deren Ende sich Tochterzellen durch Knospung entwickeln. Manchmal
verzweigen sich die Hyphen oder die Tochterzellen entstehen interkalar.
Tochterzellen nach Abtrennung von der Mutterhyphe mittels einer polaren oder
subpolaren Geifiel aktiv beweglich.
Ernahrung chemoorganotroph. Aerobe Organismen mit Respirationsmetabo-
lismus. Sperl und Hoare (1971) isolierten einen nicht naher bestimmten Stamm,
der sich an anaerobes mit Denitrifikation verbundenes Wachstum anpassen
kann. Nur eine unsichere Art - H. indicum - ist fahig, Zucker zu fermentieren.
Grofitenteils sind sie imstande, oligocarbophil mit C02 als einziger Kohlenstoff-
quelle zu wachsen. Organische Stoffe werden meistens nur in geringen Konzen-
trationen verwertet. Harder et al. (1973) geben an, dafi er zu methylotrophem
Wachstum fahig ist.
Vermehrung ausschliefilich durch Knospung; Angaben in der alteren Literatur
uber das Vorkommen von Querteilungen sind darauf zuriickzufuhren, dafi die
Hyphe sehr kurz und schlecht sichtbar ist. Nur bei H. indicum kommt
Fragmentation von Riesenzellen in Stabchen vor. Weit verbreitete Organismen in Erdbo-
den, Sufi- und Meerwasser; Ubiquisten; tolerant gegeniiber unterschiedlichen
Konzentrationen von Salzen una organischen Nahrstoffen, sowie gegeniiber
verschiedenen Wassertiefen und Temperaturen.
300 • Knospende Bakterien - HyphomicrWRim
Zavarzin (1963) halt die fadenformigen Auslaufer (Hyphen) fiir homolog mit den Faden, die
sich bei der Gattung Metallogenium bilden und schlagt vor, sie «Araios» zu nennen. Unter
bestimmmten spezifischen Bedingungen konnen auf Grund morphologischer Eigenschaften
Organismen der Gattungen Pedomicrobium, Hyphomonas und Rhodomicrobium mit dieser
Gattung verwechselt werden. Bauld et al. (1971), Tyler und Marshall (1967), Bauld und
Tyler (1971) nehmen an, dafi Pedomicrobium nur eine Form der Gattung Hyphomicrobium
ist, bei der ein betrachtlicher Pleomorphismus angenommen werden kann. Tyler und
Marshall (1967) isolierten einen der Gattung Pedomicrobium ahnlichen Stamm aus einer
Rohrleitung beim Lake Williams King (Tasmanien), wo zwei Grundformen unterschieden
werden: die «Zellform» entspricht der Beschreibung der Gattung Hyphomicrobium; die
«Kolonieform» ist der Gattung Pedomicrobium ahnlich. Die Verfasser geben an, da6 diese
Formen auch nach mehrfacher Uberimpfung auf dasselbe Medium ihre Eigenschaften
behalten; sie andern sich jedoch markant, wenn ein anderes Medium verwendet wird. Bauld
und Tyler (1971) folgern daraus, dafi dieser Pleomorphismus die taxonomischen Unter-
schiede zwischen den Gattungen Hyphomicrobium, Pedomicrobium und Rhodomicrobium
verwischt.
Zavarzin (1960) nimmt an, dafi Hyphomicrobium eine Ubergangsform zwischen Bakterien
und Pilzen ist. Stutzer und Hartleb (1898) waren der Meinung, dafi die Hyphen das echte
Mycel und die bakteriellen Zellen Chlamydosporen sind. Auch Mevius (1953) halt es fiir
moglich, dafS es sich um einen primitiven Pilz handelt.
Monosov und Kudinova (1976) isolierten einen etwas unterschiedlichen Organismus, der
auf Methanol als einziger Kohlenstoffquelle zu wachsen vermag. Zellen oval, 0,8 X 1,6-
1,8 (i grofi; einige haben einen konischen Pol; aus ihm wachst eine 10-12 u,m lange Hyphe,
deren Oberflache eine schraubenartige Struktur hat; Windungslangeder Spirale0,2-0,3 u,m.
An dem entgegengesetzten Ende der Hyphen knospen Tochterzellen. Nachdem diese die
Grofie der Mutterzelle erreichen, trennen sie sich mit einem Teil der Hyphe oder auch ohne
sie ab. Manchmal verzweigt sich die Hyphe, so daft einige Tochterzellen gleichzeitig
entstehen. In alten Kulturen kann man einen parasexuellen Prozefi beobachten: zwei Zellen
vereinigen sich an jenen Polen, an denen die Hyphen fehlen; an der Kontaktstelle bildet sich
ein Konjugationskanal, wodurch Merozygoten entstehen.
Typus generis: Hyphomicrobium vulgare Stutzer et Hartleb 1898
Wichtigste Literatur: Rullmann 1897, Stutzer und Hartleb 1898, 1899, King-
ma-Boltjes 1934, 1936, Henrici und Johnson 1935, Bomeke 1939, Zobell 1943,
Duchow und Douglas 1949, Engel und Mevius jr. 1951, Mevius 1953, Geitler
1965, Naveke und Engel 1955, Zavarzin 1960,1961,1963, Guillard und Watson
1962, Kaffka 1962, Hirsch und Conti 1964, Leifson 1964, Weisrock und Johnson
1966, Naveke 1957, Tyler und Marshall 1967, Whittenbury und Mc Lee 1967,
Hirsch 1968, Hirsch und Rheinheimer 1968, Johnson und Weisrock 1969, Bauld
und Tyler 1971, Bauld et al. 1971, Sperl und Hoare 1971, Mandel et al. 1972,
Moore und Hirsch 1972, Harder et al. 1973, Siskina und Trocenko 1974,
Monosov und Kudinova 1976, Moore und Staley 1976, Romanova et al. 1978.
Bestimmungsschlussel der Arten
la Zellen beweglich, in Erdboden und in Sufrwasser vorkommend, Rosetten
bildend oder sessil auf verschiedenen Gegenstanden. In flussigen Medien
einen Oberflachenfilmbildend,nieTrubungenhervorrufend
1. H. vulgare
lb Meeresorganismus; keine Rosetten bildend und nicht sessil auf unterge-
tauchten Gegenstanden vorkommend, nur Trubunghervorrufend 2
2a Benotigt zum Wachstum hauptsachlich Ca++ und Mg++; auf Sacchariden als
C-Quellelangsamwachsend;alsC-QuelleSukzinatverwertend
2. H. neptunium
2b Benotigt kein Ca++ und Mg++ zum Wachstum; auf Sacchariden kraftig
wachsend und Sauren bildend; als C-QuelleZitrateverwertend
3. H. indicum
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Hyphomicrobium • 301
1. Hyphomicrobium vulgare Stutzer et Hartleb 1898 (Fig. 182)
Nitrosobacterium formae-novae Rullmann 1897
Reife Zellen in Form farbloser kurzer Stabchen mit abgerundeten Enden oder
kugelig, ellipsoidisch, ovoid, bohnenformig oder langlich spindelformig. (Anga-
ben iiber die morphologischen Eigenschaften der Zellen bei den einzelnen
Autoren etwas unterschiedlich, was offensichtlich durch die Charakteristik des
entsprechenden Stammes verursacht wird). An einem Pol, seltener an beiden
Polen, wachst in Richtung der Zellachse ein fadenformiger Auslaufer, der
Pilzhyphen ahnlich ist. In einigen Fallen sind die Hyphen verzweigt; nicht
segmentiert und von der Zelle nicht durch eine Querwand abgetrennt; sowohl
Hyphe als auch Zelle haben eine gemeinsame Zellwand, das Protoplasma geht
direkt aus der Zelle in den Faden iiber. Protoplasma homogen, mit Karbolfuch-
sin gut, mit Anilinfarben schlecht farbbar. Angaben iiber die Gram-Farbung
abweichend, wohl gram-negativ. Protoplasma mit zwei Granulaarten: grofie
lichtbrechende Granula, die aus Poly-|5-Hydroxybuttersaure bestehen und sich
am Ende der Zelle in der Nahe der Hyphe befinden und kleine, dichte,
metachromatische Granula in der Zellmitte. Diese Inklusionen sind in bewegli-
chen Zellen selten. Bei alteren Kulturen kommen manchmal Zellen mit zwei
Kornern vor, womit sie dann den Zellen der Gattung Blastocaulis ahnlich sind.
Die Art besitzt einen charakteristischen Entwicklungszyklus. Grundsatzlich
vermehrt sie sich durch Knospung. Angaben in der alteren Literatur iiber
Querteilung sind falsch, da es bei eingehender Beobachtung immer moglich ist,
eine sehr kurze Hyphe zwischen den Zellen zu finden. Bei der Vermehrung
entstehen nie zwei morphologisch iibereinstimmende Zellen (Hirsch und Conti
1964).
Fig. 182. Hyphomicrobium vulgare- Entwicklungscyklus nach Zavarzin, 1961.
-3000X).
Die Knospung verlauft derart, dafi zuerst eine knopfartige Schwellung am Ende der Hyphe
entsteht, die dann allmahlich nachwachst und sich in eine Tochterzelle umwandelt; diese ist
immer kleiner als die Mutterzelle, in Richtung zur Hyphe konisch verschmalert, tropfen-
oder birnenformig, manchmal leicht gebogen. Am freien Ende der Tochterzelle entsteht
kurz vor der Abtrennung von der Mutterhyphe eine subpolare, verhaltnismafiig kurze
302 ■ Knospende Bakterien - Hyphomicrobium
Geifiel, die im Dunkelfeld deutlich hervortritt. Vor der Abtrennung beginnt sich die
Tochterzelle leicht schaukelnd zu bewegen, bis sie sich von der Hyphe ablost. Die
abgetrennte Tochterzelle schwimmt schnell in einer Zickzack-Bahn weg, wobei sie ein
kleines Stuck der Mutterhyphe mitschleppt. Nach kurzer Zeit aktiver Bewe-
gung vereinigen sich die Tochterzellen und bilden typische Rosetten; sie vereinigen sich mit
den geifieltragenden Zellpolen, wobei an Stelle der Geifiel eine plasmatische Briicke zwi-
schen den Zellen gebildet wird (Zavarzin 1961). Bisher ist noch nicht klar, ob die Rosetten-
bildung mit Karyogamie (geschlechtlicher Fortpflanzung) zusammenhangt. Nach Zavarzin
(1960,1961) haben wahrend der Rosettenbildung die lichtbrechenden Kornchen im Innern
der Zelle offensichtlich eine bestimmte Funktion, so daft er annimmt, daft sie Nuclei sind.
Gestalt und Grofie der Tochterzellen sind fur den entsprechenden Stamm des Organismus
spezifisch. Zellmorphologie und besonders Hyphenlange ist andererseits ganz von den
Kulturbedingungen und vom Alter der Kultur abhangig. Auf schlecht verwertbaren Sub-
straten entstehen lange Hyphen und praktisch keine Knospen, wahrend auf leicht
verwertbaren Substraten kurze Hyphen gebildet werden und Knospungen haufig auftreten. Auch
das Alter der Kultur hat Einflufi auf die Lange der Hyphen. In Kulturen mit langenHyphen
konnen sich an bestimmten Stellen der Hyphen flache, verstarkte Anschwellungen bilden,
die wahrscheinlich interkalare Knospen sind.
Nach einiger Zeit entsteht bei manchen Stammen an der Stelle, an der sich die Tochterzelle
von der Mutterhyphe gelost hat, erneut eine knopfartige Schwellung, aus der sich nach 10-
15 Stunden wieder eine neue Tochterzelle entwickelt. Nach Angaben von Kingma-Boltjes
(1936) konnen so bis zu 8 Tochterzellen gebildet werden.
Manchmal bleibt aus bisher unbekannten Griinden die Knospe dauernd mit der Mutterzelle
verbunden, oder es kommt sogar zur Bildung kurzer Ketten oder kreuzformiger Gebilde.
Der Mechanismus des gegenseitigen Anhaftens der schwimmenden Zellen ist bisher unbe-
kannt; Licht inhibiert jedoch diesen Prozefi (Hirsch und Conti 1964). Aufierden konnen
schwimmende Zellen an verschiedenen organischen und anorganischen Substraten (submer-
sen Objekten) festsetzen. Zobell (1943) stellte fest, daft dieser Prozefi so rasch verlauft, dafi
die Zellen im freien Wasser nur schwer angetroffen werden konnen.
Ernahrung chemoorganotroph, streng aerober Organismus mit Respirations -,
niemals mit Fermentationsmetabolismus; er ist jedoch fahig, oligokarbophil auf
Mineralmedien ohne zusatzliche Kohlenstoffquelle zu wachsen. Benotigt zum
Wachstum Kohlendioxyd. Kann auch einfache organische Stoffe verwerten,
durch deren Oxydation Energie gewonnen und alle Komponenten der Biomasse
aus Q - Stoffen synthetisiert werden. Einige im Bodenextrakt enthaltene
Mineralstoffe scheinen das Wachstum zu stimulieren. Halo- und osmotolerant;
vertragt verhaltnismafiig hohe Konzentrationen verschiedener Salze, besonders
Nitrate, ohne Wachstumsinhibition. Das erklart auch, warum die Art so oft als
Begleiter von nitrifizierenden Bakterien auftritt (haufiger in Kulturen von
Nitrobaaer, seltener in Kulturen von Nitrosomonas). Sie verwertet niedrige
Konzentrationen von Salzen organischer, vor allem fliichtiger, Sauren sowie
Alkohole. Am besten gedeiht sie auf Ameisensaure und Methanol, schlecht
hingegen auf Sacchariden, Glycerol und normalen Nahrboden bei iiblichen
Konzentrationen. In Anwesenheit von Nitraten kann diese Art anaerob
wachsen, gedeiht gut mit NH4, N02 und N03 als einziger Stickstoffquelle. Das
Temperaturoptimum liegt bei 25-30 °C, wobei ein Wachstum im Bereich von
15-30 °C moglich ist.
Auf Agarboden bilden diese Organismen auch nach langer Inkubation nur kleine
Kolonien. Ihre Oberflache ist anfangs glanzend, spater kornig und bildet Falten
in Form konzentrischer Ringe. Kolonien schmutzig weifi, spater braun. In
fliissigen Medien keine Triibung hervorrufend, sondern nur an der Oberflache in
Form einer Haut wachsend, die in alteren Kulturen zu Boden sinkt. Die
Isolierung von Reinkulturen ist sehr schwierig. Hirsch und Conti (1964) haben
eine Methode zur Isolierung von Sammel- und Reinkulturen ausgearbeitet.
Die Ausmafie der reifen Zellen sind nach Bergey's Manual (1974) 0,5-1,0 X 1,0-
3,0 urn. Hirsch und Conti (1964) geben eine Lange von 0,6-5,0 um an, wobei
gelegentlich 0,75-2,0 X 2,0-5,0 um groile Zellen auftreten konnen. Hyphen mit
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Hyphomicrobium ■ 303
konstanter Breite von 0,2-0,3 urn (nach Farbung 0,3-0,4 urn); ihre Lange reicht
von minimalen Werten bis zu einigen Hunderten um.
Weit verbreiteter Organismus in Erdboden und Gewassern. Urspriinglich von
Rullmann (1897), spater auch von Stutzer und Hartleb (1898) aus Erdboden als
nitrifizierende Bakterie isoliert. Spater von Henrici und Johnson (1935) im
Wasser als Aufwuchs an submersen Objekten. Nach Kingma-Boltjes (1934,
1936) im Belebtschlamm und im Wassertropfen eines langere Zeit tropfenden
Wasserleitungshahns. Geitler (1954, 1965) fand diesen Organismus in der
Schleimhulle der verhaltnismafiig seltenen Siifiwasser- Rotalge Kyliniella latvica
im Lunzer Untersee (Osterreich), in Seen von Lettland (Schweden) und in
Nord amenka. Hirsch und Rheinhammer (1968) fanden ihn auf den Scheiden von
Gloeocapsa, Tyler und Marshall (1967) auf einer Reihe von Algenarten. Zavarzin
(1961) berichtet uber sein Vorkommen im Neuston.
Die urspriingliche Kultur ist fur weitere Studien nicht zuganglich. Die Beschreibung
spaterer Isolate unterscheidet sich bei verschiedenen Autoren etwas von der ursprunglichen
des von Stutzer und Hartleb (1898) beschriebenen Organismus hinsichtlich der morphologi-
schen und physiologischen Eigenschaften sowie in einigen Einzelheiten des Entwicklungs-
zyklus. Es ist moglich, dag unter der Hezeichnung Hyphomicrobium vulgare mehrere Arten
verborgen sind, wie Hirsch in Bergey's Manual (1974) angedeutet hat.
Siskina und Trocenko (1974) kultivierten einen etwas unterschiedlichen Stamm, der
Methanol und Methylamin als einzige Kohlenstoff- und Energiequelle verwertet. Zellen ellipsoid,
0,8-1,4 X 0,5-1,0 (im grofi; durch 1,0-1,5 um lange Hyphen verbunden. Junge Zellen
mittels einer einzigen Polargeifiel beweglich. Pleomorphismus ahnlich wie bei der Gattung
Pedomicrobium. Es kommen sowohl Zellen mit zwei Hyphen vor, als auch interkalare
Verzweigung der Hyphen sowie typische Knospung. Rosettenbildung wurde nicht beob-
achtet. Das bestatigt die Ansicht von Bauld und Tyler (1971), dafi die morphologischen
Eigenschaften allein diese Gattung nicht geniigend charakterisieren konnen.
Unsichere Arten:
2. Hyphomicrobium neptunium Leifson 1964 (Fig. 183)
Reife Zellen abgerundet bis oval oder leicht ovoid, farblos; ohne G.eifiel. Mit
einer Hyphe, manchmal unter bestimmten Bedingungen auch mehreren
Hyphen, die maximal die dreifache Lange der Mutterzelle erreichen. Hyphenende
am Anfang der Knospung zu einer ovoiden Verdickung anschwellend, aus der
sich nach einiger Zeit eine Tochterzelle entwickelt, die kleiner als die Mutterzelle
ist; sie hat eine (sehr selten zwei) gewellte polare Geifiel, die am freien Pol
entsteht, seltener aber auch lateral stehen kann. Schliefilich trennt sich die Zelle
von der Mutterzelle und entfernt sich aktiv, sehr lebhaft schwimmend. Nach
einer bestimmten Zeit verliert sie die Geifiel und rundet sich ab, setzt sich aber
nicht fest. Sobald die erste Tochterzelle von der Hyphe abgetrennt worden ist,
kann die Mutterzelle an derselben Stelle eine neue Tochterzelle hervorbringen -
der Zyklus wiederholt sich dann. Leifson (1964) bezeichnet ihn als «Mutterzy-
klus». Die abgetrennte Tochterzelle entwickelt einige Zeit nach dem Verlust der
Geifiel ebenfalls eine Hyphe, auf der durch Knospung eine Mutterzelle entsteht:
«Tochterzyklus». Hyphen auf den Mutterzellen oft so kurz, dafi die
Tochterzellen durch Knospung direkt an der Mutterzelle zu entstehen scheinen. Manchmal
bildet die Tochterzelle die Hyphe friiher, noch bevor sie sich von der Mutterzelle
abtrennt; an der Hyphe kann dann eine weitere Tochterzelle mit Geifiel
entstehen, so dafi sie eine Gruppe von drei Zellen bilden.
Chemoorganotropher, aerober Organismus mit Respirationsmetabolismus.
Halotolerant; gedeiht gut auf Medien mit Meerwasser, da als lebenswichtige
Elemente Magnesium und Kalzium benotigt werden, daher auch gut auf Mine-
ralboden wachsend, die diese Elemente enthalten. Vitamine sind nicht erforder-
lich. Wachst bei Temperaturen zwischen 20-40 °C (optimal 30-37 °C); der
304 ■ Knospende Bakterien - Hyphomicrob™
giinstigste pH-Wert liegt bei 8,0; jedoch werden auch pH-Werte zwischen 6,0
und 9,5 vertragen. Aus normal vorkommenden Zuckern keine Sauren bildend;
Gelatine wird nicht verfliissigt, Starke und Zellulose nicht hydrolysiert. Nitrate
werden nur zu Nitriten reduziert. Auf Aearboden entstehen anfangs farblose,
spater braune, erhohte, halbdurchsichtige bis undurchsichtige Kolonien, die bis
1,5 |.im grofi sind. In flussigen Medien bilden nur sehr junge Kulturen einen
Oberflachenfilm, sonst verursachen sie Triibung.
Reife Zellen messen im Durchmesser 1,0 [xm. Die Hyphen sind verschieden lang
(gewohnlich 1,0-2,0 (xm), manchmal erreichen sie eine Lange von einigen [xm.
Diese Art wurde aus einer Meerwasserprobe aus dem Hafen von Barcelona
(Spanien) isoliert.
Wnittenbury und McLee (1967) betrachten sie wegen ihrer morphologischen
Ahnlichkeit als farblose Parallele zu Rhodopseudomonas palustris. Moore und
Hirsch (1972) nehmen auf Grund der Ahnlichkeit in der Zusammensetzung der
DNS an, daft diese Art in die Gattung Hyphomonas eingereiht werden sollte.
183 b a
Fig. 183. Hyphomicrobium neptunium - a Entwicklung des «Mutterzyklus»,
b Entwicklung des «Tochterzyklus» (nach Mikrofoto umgezeichnet - Leifson,
1964. -2000X).
3. Hyphomicrobium indicum Johnson et Weisrock 1969
Hyphomicrobium indium Weisrock et Johnson 1966
Pleomorpher Organismus, der auf Agarboden gram-negative Stabchen mit
abgerundeten Enden bildet. In flussigen Medien, seltener auch auf festen Boden
sind die Zellen kugelig, gram-negativ, durch verschieden lange Faden miteinan-
der verbunden. Manchmal entstehen an Faden und knospenden Zellen netzartige
Formationen, die der Gattung Rhodomicrobium ahneln. Aufierdem bilden sich
sowohl in flussigen als auch auf festen Medien nach 6-9 stundiger Kultur sehr
lange, fadenformige Riesenzellen; obwohl diese nicht segmentiert sind, zerfallen
sie nach einiger Zeit in gleich grofie Zellen, die den ublichen Stabchen-Formen
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pedomicrobium • 305
gleichen. Ihre Bedeutung ist nicht bekannt; entweder gehoren sie in den Ent-
wicklungszyklus des Organismus, oder es handelt sich um Ivolutionsformen.
Rosetten werden nie gebildet, sondern nur Aggregate kugeliger Zellen. Es
kommen weder Sporen noch andere Formen von Ruhestadien vor. Protoplasma
der meisten Zellen mit gram-positiven lichtbrechenden Granula unbekannter
Herkunft. Zellen mit Kristallviolett gut farbbar; nicht saureresistent.
Chemoorganotropher Organismus mit Respirations- und Fermentations-Meta-
bolismus. Wachst nicht mit Aminosauren als einziger Stickstoffquelle; einige
Aminosauren inhibieren sogar das Wachstum. Aus Glukose, Maltose und
Saccharose werden anaerob Sauren gebildet, Pentosen werden nicht verwertet.
Weder Starke noch Gelatine werden hydrolysiert, Zitrate nicht reduziert. Die
Art ist halophil und benotigt zum Wachstum 50-100% Meerwasser. Sie wachst
im Temperaturbereich von 4-25 °C (25 °C optimal) und bei pH-Werten von
4,5-9,5. Auf festen Boden werden 1-2 mm breite, diinne, weifie bis cremefarbe-
ne Kolonien gebildet, die im Alter dunkler (gelb) werden. In flussigen Medien
keine Oberflachenhaut, sondern nur eine Triibung und in einigen Fallen ein
schleimiges Sediment bildend.
Vermehrung durch Knospung und Zerfall der langen Riesenzellen in kurze
Stabchen. Kugelige Zellen una kurze Stabchen mittels polarer Geifieln beweg-
lich. Stabchen und lange fadenformige Individuen unbeweglich.
Stabchen 0,7-1,0 X 2,0-6,0 [xm grofi. Riesenzellen 40-50 (xm lang, Kokken mit
einem Durchmesser von 1,0-1,25 (xm, die verbindenden Faden 0,5-2,0 [xm
lang.
Gerunden in einer Kolonie von Hyphomicrobium neptunium aus dem Schlamm
des Indischen Ozeans aus 400 m Tiefe.
Hirsch und Rheinheimer (1968) sind der Meinung, dafi dieser Organismus zu
einer selbstandigen Gattung gehort, sich in seinen Eigenschaften wesentlich von
der Gattung Hyphomicrobium unterscheidet. Dies bestatigten auch Mandel,
Hirsch und Conti (1972) auf Grund der Zusammensetzung der DNS-Base.
Unsichere, ungeniigend beschriebene Art:
Hyphomicrobium manganoxidans Eleftheriadis et al. 1976
Nicht naher beschriebener Organismus, dessen Wachstum von der Anwe'senheit
zweiwertiger Manganionen abhangig ist, die oxidiert werden. Als Kohlenstoff-
quelle dienen Harnstoff, Methylamin, Formiat, C02 oder Bikarbonat. Die
Optimaltemperatur betragt 37-44 °C.
Aus heifien Quellen auf der Franz-Josef-Kolonade in Bad Gastein (Osterreich)
isoliert.
3. Pedomicrobium Aristovskaja 1961
Reife Zellen kugelig, ellipsoidisch, ovoid oder birnen- bis bohnenformig, selten
langlich stabchenformig mit abgerundeten Enden. Miteinander durch reich
verzweigte, lange, fadenartige Auslaufer-Hyphen verbunden, so dafi sie
netzartige Mikrokolonien bilden. Aus jeder Zelle wachsen drei bis vier (selten auch
mehr) Hyphen. Mikrokolonien von ausgeschiedenen Eisen- oder Manganoxi-
den bedeckt; sowohl Zellen als auch Hyphen konnen gewohnlich nach Auflo-
sung der Ablagerungen mittels verdiinnter Salz- oder Oxalsaure und nachfolgen-
der Gentianviolett- oder Erythrosinfarbung sichtbar gemacht werden. Zellen
unregelmafiig farbbar, gram-negativ.
Physiologische Eigenschaften wenig bekannt. Wahrscheinlich
chemoorganotropher Organismus; auf mineralischen Nahrboden ohne organischen Kohlenstoff
nicht wachsend, sondern in Gegenwart von Organomineral-Komplexen von
306 ■ Knospende Bakterien - Pedomicrobium
Fulvo- oder Ulminsauren. Mikroaerophil oder arob. Anhaufung von Eisen-
oder Manganverbindungen ist spezifisch; nach Aristovskaja (1963) bedingt
durch Oxydation zweiwertiger lonen zum Zweck der Energiegewinnung. Auf
festen Nahrboden mit Organomineral-Komplexen entstehen nach 3-4 wochiger
Kultur kleine, gelbbraune bis dunkelbraune Kolonien mit lappenformigen oder
gefransten Randern, die im Innern des Agars wachsen. Sie wachsen sehr langsam
und erst nach einigen Monaten erreichen sie einen Durchmesser von etwa
0,5 mm. Auf normalen Boden wachsen sie nicht. Bisher ist es noch nicht
gelungen, eine Reinkultur zu isolieren; unter Laborbedingungen stirbt der
Organismus nach einigen Uberimpfungen ab.
Vermehrung durch Knospung; an den Hyphenenden bildet sich anfangs eine
kugelige oder leicht eiformige Tochterzelle, die, wenn sie die Grofie der Mutter-
zelle erreicht hat, weitere Hyphen produziert, worauf sich der Prozefi wieder-
holt. Bei manchen Stammen erfolgt die Bildung der Knospen unmittelbar an den
Mutterzellen. Wird von den Mutterzellen eine Querwand gebildet, so hat es den
Anschein, als ob sie sich auch durch Teilung vermehren (Aristovskaja 1961), die
simultan mit der Knospung verlauft. Bergey's Manual (1974) gibt an, dafi sich die
Tochterzellen von den Mutterzellen abtrennen konnen und dann mittels einer
polaren Geifiel beweglich sind; herangewachsen, entwickeln sie Hyphen, und
der Reproduktionsprozefi verlauft dann in normaler Weise.
Urspriinglich aus Podzolboden beschrieben und in diesen weit verbreitet. Hirsch (1968)
isolierte ahnliche eisenhydroxidbildende Organismen sowohl aus Meerwasser als auch aus
Siifiwasser. Tyler und Marshall (1967) und Tyler (1970) halten sie fiir die hauptsachlichen
Urheber der Manganablagerungen in Wasserleitungsrohren; die Zellen haften an den
Rohrwanden einesteils infolge elektrostatischer Ladung, anderenenteils durch Ausschei-
dung von Schleimstoffen. Oft kommen sie an den Hyphen eines nicht naher bestimmten
Pilzes vor, an dessen Oberflache sie senkrecht orientiert sind, wobei sie durch hyalinen
Schleim festgehalten werden, der von dem Pilz abgeschieden wird. Hirsch (in Bergey's
Manual 1974) berichtet iiber Funde in Bachen, sowie im Teich- und Seewasser in Lower
Michigan (USA), in Seen im Norden der BRD und auch im Brackwasser in Woodmont bei
New Haven (Connecticut, USA). Morphologisch der Gattung Hyphomicrobium sehr
ahnlich, weshalb auch Bauld, Tyler und Marshall (1971) und Tyler una Marshall (1967) sie
als zu dieser Gattung gehorig betrachten.
Typus generis: Pedomicrobium ferrugineum Aristovskaja 1961
Wichtigste Literatur: Aristovskaja 1961, 1963, Tyler und Marshall 1967,
Hirsch 1968, Hirsch und Rheinheimer 1968, Tyler 1970, Bauld et al. 1971,
Bergey's Manual 1974.
Bestimmungsschliissel der Arten
la Reife Zellen bis 0,4 (im breit; Knospen nur an Hyphenspitzen entstehend;
Zellen mit Manganverbindungen bedeckt 2. P. manganicum
lb Reife Zellen 0,6 (xm breit oder breiter 2
2a Tochterzellen an Hyphenspitzen gebildet; Mutterzellen 0,6-2,0 urn breit;
mit Eisenverbindungen(Hydroxid?) bedeckt 1. P. ferrugineum
2b Tochterzellen sowohl an Hyphenspitzen als auch an den Mutterzellen durch
Knospung entstehend; Mutterzellen 0,6-1,0 \im breit; sowohl mit Eisen- als
auch Manganverbindungen bedeckt 3. P. podsolicum
1. Pedomicrobium ferrugineum Aristovskaja 1961 (Fig. 184)
Reife Zellen farblos, kugelig bis eiformig, oder selten in Form kurzer Stabchen
mit abgerundeten Enden; aus ihnen wachsen 1-4 (oder auch mehr) Hyphen, an
deren Enden (manchmal auch interkalar) durch Knospung eiformige oder
kugelige Tochterzellen entstehen. Nach der Ablosung von der Mutterhyphe sind
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pedomicrobium • 307
sie mittels einer polaren Geifiel beweglich. Das Protoplasma der Mutterzellen
farbt sich (mit Gentianviolett oder Erythrosin) unregelmafiig, das der
Tochterzellen satt und gleichmafiig.
Auf festen Nahrboden wachsen unter der Oberflache kleine braunliche
Kolonien, die nach einigen Wochen nur 0,5 mm im Durchmesser erreichen. Sie sind
von Eisenverbindungen bedeckt, die sich auf den Mutterzellen, selten auch an
den Hyphen ablagern. Mangan wird nicht oxydiert und lagert sich auch nicht an
der Zelloberflache ab.
Zellen 0,6-2,0 (im, Hyphen 0,2 (im breit.
In der Gegend von Leningrad (UdSSR) als charakteristischer Reprasentant von
Sand-Podzolboden gefunden; die Art ist der haufigste Vertreter dieser Gattung
und weit verbreitet. Es kommen geographische Rassen vor, die sich sowohl in
der Form der Zellen als auch in der Breite der Hyphen unterscheiden.
Fig. 184. Pedomicrobium ferrugineum - (nach Zavarzin, 1961. - 3000X). ,
2. Pedomicrobium manganicum Aristovskaja 1961
Reife Zellen farblos, klein, gewohnlich kugelig oder kurz ovoid, selten ellipso-
idisch. Aus ihnen wachsen 1-4 (manchmal auch mehr) Hyphen, an denen sich
eine kugelformige Tochterzelle bildet; es kommen auch interkalare Zellen vor.
Hyphen sehr oft reich verzweigt und verschieden lang. Mikrokolonien sehen
Pedomicrobium ferrugineum ziemlich ahnlich; sie unterscheiden sich dadurch,
dafi an den Mutterzellen Manganverbindungen, niemals Eisenverbindungen
abgelagert werden. Auf Agarboden mit Organomineral-Komplexen von Hu-
minsauren wachsen sie langsam in Form von schwarzen Kolonien, die nach
einigen Monaten Kultur ca. 0,5 mm im Durchmesser erreichen. Mit scharf
abeegrenzten Randern.
Zellen nur 0,4 \im, Hyphen weniger als 0,2 (im breit.
Aus der Gegend von Leningrad (UdSSR) aus Sand-Podzolbbden isoliert.
Kommt, obwohl weit verbreitet, verhaltnismafiig selten vor.
3. Pedomicrobium podsolicum Aristovskaja 1963
Mutterzellen abgerundet, selten ovoid; miteinander durch sehr diinne kurze
Hyphen verbunden. An jeder Zelle sind 1-4 Hyphen vorhanden. Hyphen
meistens sehr wenig oder iiberhaupt nicht verzweigt.
308 ■ Knospende Bakterien - Ancalomicrobium
Kolonien auf Agarboden den Kolonien von Pedomicrobium jerrugineum sehr
ahnlich, von denen sie sich jedoch dadurch unterscheiden, dafi sie an den
Mutterzellen sowohl Eisen- als auch Manganverbindungen ablagern. Vermeh-
rung durch Knospung; die kugeligen Tochterzellen entstehen an den Hyphenen-
den oder seltener direkt an der Mutterzelle. Manchmal sind die Hyphen so kurz,
dafi ganze Trauben von Tochterzellen verschiedener Grofie rund um die
Mutterzelle gebildet werden.
Zellen grofkenteils weniger als 0,5-1,5 [xm, Hyphen 0,2 [xm breit.
Verhaltnismafiig selten in Podzolboden vorkommend, aus denen sie auch isoliert
wurde.
4. Ancalomicrobium Staley 1968
Einzelliger, unbeweglicher, gram-negativer Organismus, aus dessen fast kugeli-
ger Zelle 2-9 pfeilformige Auslaufer (Prostheken) auswachsen, die sich gegen die
Spitze verjiingen, meistens 3x langer als der Zelldurchmesser sind und stumpf
abgerundete Enden haben. Prostheken gerade oder leicht gebogen, manchmal
gabelformig verzweigt; Arme der Gabel nicht gleich lang. Ohne Gallertpolster;
im Wasser frei schwebend. Protoplast manchmal mit kompliziert zusammenge-
setzten Gasvakuolen, deren Bildung wahrscheinlich von den Kulturbedingun-
gen abhangig ist. Zellen mit Vakuolen sind kleiner.
Chemoorganotropher Organismus; fakultativ anaerob; unter bestimmten Be-
dingungen auch streng anaerob wachsend. Zum Wachstum ist als Kohlenstoff-
und Energiequelle sowie als Wachstumsfaktor Panthotensaure erforderlich. Als
einzige Stickstoffquelle konnen Ammoniumionen verwertet werden. Glukose
wird fermentativ verwertet; Nitrate werden nicht reduziert. Optimale Wachs-
tumstemperatur etwa 30 °C; Temperaturbereich 6-39 °C. Bei 42 °C kein
Wachstum mehr. Optimaler pH-Wert 6,9-7,3; wachst bei pH-Werten zwischen
6,3-7,5. Auf Agarboden werden weifie, undurchsichtige, abgerundete, konvexe
Kolonien mit glatten Randern gebildet.
Vermehrung durch Knospung. Tochterzellen entstehen immer an der gleichen
Stelle der Mutterzelle, nie an den Prostheken. (Es wurde nur ein einziges
Exemplar mit knospender Zelle an der Prostheke gefunden). Tochterzelle
zunachst ohne Prostheken; diese entwickeln sich im weiteren Wachstumsverlauf
gleichzeitig mit der Bildung der Zellwand; vor der Abtrennung besitzt die
Tochterzelle 1-4 Prostheken. Die Abtrennung der Tochterzelle erfolgt durch
transversale Teilung erst dann, wenn sie die Grofie der Mutterzelle erreicht hat.
Im Sufiwasserplankton; vermutlich sich von Exkreten des Phytoplanktons
ernahrend. Wahrscheinlich weit verbreitet.
Wichtigste Literatur: Stefanov und Nikitin 1965, Staley 1968
Eine einzige Art:
Ancalomicrobium adetum Staley 1968 (Fig. 185)
Mit den Merkmalen der Gattung
Zelle ungefahr 1,0 [xm im Durchmesser; Prostheken meistens 3,0 [xm lang und
etwa 0,25 (xm breit.
Stefanov und Nikitin (1965) fanden einen ahnlichen Organismus in einer Erdbo-
denlosung.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Prosthecomicrobium • 309
5. Prosthecomicrobium Staley 1968
Einzellige, farblose, gram-negative, im groben Umrifi kugelige Mikroorganis-
men; sie bilden eine grofiere Zahl von Prostheken mit stumpfen, abgerundeten
Enden, die radial aus der Zelle in alle Richtungen wachsen. Prostheken gewohn-
hch etwas kiirzer als der Zelldurchmesser, jedoch manchmal auch langer; es
handelt sich um lebende Teile der Zellen, die von der Zellwand umgeben sind.
Unter bestimmten Bedingungen besitzen die Zellen eine Art Gasvakuolen.
Einige Stamme enthalten ein Pigment.
Chemoorganotroph, obligat aerob, mit Respirations-, niemals mit Fermenta-
tionsmetabolismus. Benotigt Wuchsstoffe und Vitamine. Verwertet eine ganze
310 • Knospende Bakterien - Prosthecomicrobium
Reihe organischer Stoffe. Vermehrung durch Querteilung. Sowohl beweglich als
auch unbeweglich, Bewegliche Formen mit charakteristischer taumelnder Bewe-
gung; mit einer polaren oder subpolaren Geifiel.
Organismen dieser Gattung wurden bei direkter Beobachtung von Siifiwasser-
plankton-Proben gefunden; wahrscheinlich ernahren sie sich von Exkreten
anderer Organismen.
Typus generis: Prosthecomicrobium pneumaticum Staley 1968
Wichtigste Literatur: Staley 1968
Bestimmungsschliissel der Arten
la Unbewegliche Zellen, mit Gasvakuolen; Kolonien nicht pigmentiert.
Prostheken ebenso lang wie der Zelldurchmesser 1. P. pneumaticum
lb Bewegliche Zellen, ohne Gasvakuolen; Kolonien gelb oder rot. Prostheken
halb so lang wie der Zelldurchmesser 2. P. enhydrum
1. Prosthecomicrobium pneumaticum Staley 1968 (Fig. 186)
Zellen unbeweglich kugelig oder oval, gram-negativ ca. 1,0 [im im Durchmes-
ser; an der Oberflache mit einer Menge konisch verjiingter Prostheken, die radial
angeordnet sind, so dafi die Zellen wie stachelige Kugeln aussehen; Prostheken
ungefahr ebenso lang wie der Zelldurchmesser oder kiirzer gewohnlich 0,7 [irn
lang und an der Basis 0,25 \»m breit; in einigen Fallen auch viel langer (bis zu
2,5 (jm). Enden der Prostheken stumpf, abgerundet. In Laborkukuren werden
keine Prostheken gebildet oder aber nur in geringer Zahl. Ohne Ruhestadien.
Protoplasmamit spindelformigen Vesikeln, die im Phasenkontrast Gasvakuolen
ahnlicn sehen, da sie nur sehr geringe Lichtbrechung zeigen. Ohne Pigmente.
Die Zellen verwerten als Kohlenstoff- und Energiequelle eine breite Skala
organischer Stoffe. Saccharide werden nie in Sauren umgewandelt und Starke
wird nicht hydrolisiert. Zum Wachstum brauchen sie Wachstumsfaktoren, vor
allem Vitamin B^, Thiamin und Biotin. Als Stickstoffquelle konnen sie bei
Anwesenheit von Vitaminen sowie organischen Kohlenstoff- und Energiequel-
len NH4+, jedoch nicht N03" verwerten. Unter anaeroben Bedingungen wach-
sen sie nicht. Wachstum bei Temperaturen zwischen 9 °-45 °C, maximales
Wachstum bei 30 °C. Tolerierter pH-Bereich 6,0-7,2; optimales Wachstum bei
pH 6,0-6,5.
Auf festen Nahrboden wachst der Organismus in verschieden grofien, weifien,
durchsichtigen sowie auch undurchsichtigen Kolonien. Die Variation in der
Farbung wird durch die unterschiedliche Menge der Gasvakuolen hervorgeru-
fen. Kolonien kreisformig, konvex, mit glattem Rand. Im fliissigen Medium
entsteht unter stationaren Kulturbedingungen ein Oberflachenfilm, da die
Gasvakuolen die Zellen an die Wasseroberflache tragen. Vermehrung durch
Querteilung.
Wahrscheinlich weit verbreiteter Organismus. Kommt im Siifiwasserplankton
vor.
Nikitin et al. (1966) fanden in einer Bodenlosung einen sehr ahnlichen
Organismus.
2. Prosthecomicrobium enhydrum Staley 1968 (Fig. 187)
Zellen kugelig oder kurz-oval, an der ganzen Oberflache mit einer grofien Zahl
kurzer Prostheken besetzt, so dafi die Oberflache gezahnt oder gesagt aussieht.
Prostheken mit ausgepragt abgerundeten Enden; kurzer als die Halfte des
Zelldurchmessers. Ruhestadien nicht beobachtet. Protoplasma ohne
Gasvakuolen; jedoch mit gelbem oder rotem Pigment, das nur bei einer grofieren Ansamm-
lung von Zellen (Kolonien) sichtbar wird. Ohne ander£ Einschliisse.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiodendron -311
186
187
Fig. 186. Prosthecomicrobium pneumaticum - (nach Elektronen-Mikrophoto
schematisiert - Staley, 1968. - 10000X), Fig. 187. Prosthecomicrobium
enhydrum -(nach Elektronen-Mikrophoto schematisiert - Staley, 1968.- 10000X).
Die Zellen verwerten im Umgangsprozefi eine ganze Reihe organischer Stoffe.
Zum Wachstum sind Wachstumsfaktoren, vor allem Vitamine - besonders
Thiamin - erforderlich. Als Stickstoffquelle konnen sie, in Anwesenheit von
Vitaminen und organischen Energiequellen, zwar Ammoniumionen, jedoch
keine Nitrate verwerten. Unter anaeroben Bedingungen wachst dieser
Organismus nicht. Wachstum erfolgt in einem Temperaturbereich von 9-37 °C, wobei
eine Temperatur von 30 °C optimal ist. Erfordert pH-Werte, die um den
Neutralpunkt liegen; unter pH 6,6 wachst die Art nicht.
Auf festen Medien entstehen runde, konvexe Kolonien mit glatten Randern die
weifi, gelb oder rot gefarbt sind. In fliissigen Kulturen tritt unter stationaren
Bedingungen eine gleichmafiige Triibung ohne Oberflachenfilm auf; in alteren
Kulturen werden Sedimente gebildet. Vermehrung durch Querteilung. Mit einer
charakteristischen, taumelnden, zappelnden Bewegung; dabei auch umkippend
oder sich in Kreisen bewegend. Die Bewegung wird durch die unregelmafiige
Oberflache und durch die subpolar sitzende Geifiel verursacht.
Zellen ohne Prostheken ungefahr 1,0-1,5 \tm breit; Prostheken etwa 0,25 \xm
breit und 0,25 |im hoch, manchmal auch mehr.
Im Siifiwasserplankton, wahrscheinlich weit verbreitet.
6. Thiodendron Perfiliev et Gabe 1961
(non Thiodendron Lackey et Lackey 1961)
Zellen in Form schlanker, langer Vibrionen oder Spirillen, ausgepragt schrau-
benformig gekriimmt mit 0,5-4 Windungen. Aus den beiden konisch verjiingten
Enden wacnsen gerade oder haufiger unregelmafiig gewellte bis gebogene, oft
sehr lange Faden hervor, die manchmal auch verzweigt sind. Der Faden, durch
den der Organismus an einer festen Unterlage angeheftet ist, ist wesentlich langer
als der freie. Es wurden jadial aneeordnete Kolonien. Hie pin ocmpln.im«
312 ■ Knospende Bakterien - Caulobacter
Gallertpolster besitzen, gebildet. Junge Zellen durch Geifieln beweglich. Ruhe-
formen nicht beschrieben.
Physiologische Eigenschaften unbekannt. Aerob bis mikroaerophil; zum
Wachstum ist Schwefelwasserstoff erforderlich; deshalb wahrscheinlich mixo-
troph.
Auf festem Nahrboden entstehen kugelige konvexe, grauweifie bis blauweifie
Kolonien mit konzentrisch angeordneten und abwechselnd hellen und dunklen
Zonen. Die Banderung wird durch Ablagerung von kolloidalem Schwefel, dem
Oxydationsprodukt von Schwefelwasserstoff, hervorgerufen. In
Schwefelquellen erreichen die Kolonien binnen 3-4 Tage eine Grofie bis zu 4 cm. Vermehrung
nicht beschrieben; es wird angenommen, dafi sie ahnlich wie bei der Gattung
Caulobacter erfolgt. Nach Perfiliev (1969) ist ein typischer Entwicklungszyklus
vorhanden: bewegliche Zellen in Form von Vibrionen (Grofie 1X3-7 jxm);
zoogloales Stadium; hyphomikrobiales Stadium mit Bildung diinner Faden, auf
denen Tochterzellen knospen.
Urspriinglich aus natiirlichen Schwefelquellen in der Nahe des Cekraskoe Ozero
auf der Kercenskij Halbinsel, Krym (UdSSR) beschrieben und isoliert. Ferner in
Torflagern, Schlamm, Sand im Wasser und anderen Siifiwasserlokalitaten gefun-
den. (Hippl, cit. Bergey's Manual 1974) fand diese Art im Schlamm und im
Wasser der Teiche in der Umgebung von Gottingen (BRD).
Wichtigste Literatur: Perfiliev und Gabe 1961, Perfiliev 1969, Bergey's Manual
1974
Eine einzige Art:
Thiodendron latens Perfiliev et Gabe 1961 (Fig. 188)
Mit den Merkmalen der .Gattung
Faden 0,15-0,25 \un breit. Zellmafie nicht angegeben; nach der Mikrophotogra-
phie in Bergey's Manual (1974) sind die Zellen ungefahr 0,4-0,5 X 2,0-8,0 [xm
grofi; Schraubenwindungen 0,8-1,0 [xm breit.
Wenig bekannter Organismus, der weiteres Studium erfordert. Morphologisch
mit der Gattung Caulobacter verwandt.
7. Caulobacter Henrici et Johnson 1935 (Fig. 189, 190)
Einzelliger, gramnegativer Organismus; Zellen stabchenfbrmig mit deutlich
abgerundeten Polen oder spindelformig, limonoid oder vibrioid. Obwohl die
Zellform fur die einzelnen Arten spezifisch ist, sind die morphologischen
Merkmale einer Sippe nicht vollig konstant, sondern von den Wachstumsbedin-
gungen abhangig. Unter Nahrstoffmangel verlangern sich die Zellen gewohnlich
(sie werden vibrioid), und umgekehrt entstehen bei hoheren Nahrstoff-Konzen-
trationen limonoide Formen (Poindexter 1964). An einem Pol der Zelle wird ein
diinner Stiel von unterschiedlicher Lange gebildet, dessen Langsachse als Fort-
setzung der Zellangsachse verlauft. Er ist eine direkte Fortsetzung der Zelle und
ebenso wie die Stielmembran ihr lebender Bestandteil (Houwink 1951). Die
Stiellange ist von vielen Faktoren direkt abhangig; so ist in einem nahrstoffarmen
Milieu oder in Mischkulturen mit anderen Organismen der Stiel langer und kann
20-30 oder mehr u,m erreichen. Larson und Pate (1975) sind der Meinung, dafi
die Lange des Stiels von der Konzentration des anorganischen Phosphats beein-
flufit wird. Im Innern des Stiels ist ein feines Mark, das jedoch keine unbewegli-
che Geifiel ist, wie Zavarzin (1961) irrtiimlich angenommen hat. Am Distalende
des Stiels befindet sich ein aus stark adhasivem extrazellularem Material beste-
hendes Gallertpolster, mit dem der Organismus sich an verschiedenen submer-
sen Gegenstanden oder an anderen Organismen festheftet. Oft vereinigen sich
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Caulobacter • 313
Fig. 188. Thiodendron sp. - nicht naher bestimmte Art aus Teichschlamm (nach
Mikrophoto umgezeichnet- Bergey's Manual, 1974.-2000X). Fig. 189.
Caulobacter sp. - Entwicklungszyklus (nach Zavarzin, 1961. - 2000X). Fig. 190.
Caulobacter sp.(?) - spindelformige Zellen einer bisher nicht naher bekannten
Art, die keine beweglichen Stadien hat (nach Mikrophoto umgezeichnet- Bout
etal., 1970.-2000X).
die Zellen mittels des Gallertpolsters zu dichten rosettenformigen Populationen,
die aus 2-J00 Zellen zusammengesetzt sind und deren Bedeutung bisher nicht
ganz klar ist. Die Distalenden der meist gleich langen Stiele der einzelnen Zellen
sind dann in einem gemeinsamen Gallertpolster fest verankert.Bisweilen
vereinigen sich die Zellen nicht zu Rosetten sondern nur paarweise; das fiihrte zu der
Annahme, dafi sich zwei Zellen mit einem gemeinsamen Stiel bilden (Gromov
1964) konnten oder dafi es sich hierbei um eine Art geschlechtlicher Fortpflan-
zung (Kopulation) handelt (Nemec und Bystricky 1963). Mit dem Elektron-
Mikroskop wurde nachgewiesen, dafi es sich nur um die Vereinigung der
Gallertpolster und nicht um die Vereinigung der Stiele handelt. Die Rosettenbil-
dung ist von der Temperatur abhangig, bei 30 °C bilden sich grofie Rosetten,
bei 5 °C iiberhaupt keine.
Die Tendenz, sich an anderen Mikroorganismen anzuheften, liefi eine Reihe von Autoren
vermuten, dafi Parasitismus vorliegt. Hund und Kandler (1956) stellten fest, dafi nur gram-
positive Bakterien angegriffen werden, gram-negative Bakterien und Aktinomyzeten dage-
gen nicht. Neben Bakterien werden zahlreiche andere Organismen (Protozoen, Hefen,
Pilzhyphen u. a.) befallen, sehr oft auch Griin- und Blaualgen. Nach Zavarzin (1961) wird
die Oberflache der Wirtszelle verandert und durchlassig fiir lytische Wirkstoffe, was dann
zur Zelldestruktion fuhrt. Demgegenuber betrachtet Poindexter (1964) diese Organismen
als Ektokommensalen, die an der Oberflache von Algen festhaften, so mit den Algensekre-
ten in engen Kontakt kommen und sie als Nahrstoff verwerten konnen.
314 ■ Knospende Bakterien - Caulobacter
Sie sind jedoch auch imstande, sich an toten Objekten, vor allem an Glas,
anzuheften, an deren Oberflache organische Stoffe adsorbiert werden (Zobell
1946). Ruhestadien nicht bekannt. Im Plasma kommen oft grofie Poly-p-
Hydroxybuttersaure-Granula vor; sie sind stark lichtbrechend und mit Sudan-
Schwarz B gut farbbar. Einige Stamme haben als Reservestoff kleine Polysaccha-
rid-Granula. Einzelne Zellen sind farblos; Kolonien hingegen bei einer Reihe
von Arten gelb, rosa, orange bis rot gefarbt. Die Farbung wird durch Karotinoi-
de verursacht. Einige Stamme produzieren aufierdem braune bis rotbraune, in
den Nahrboden diffundierende Pigmente.
Chemoorganotrophe Organismen, streng aerob, mit Respirationsmetabolis-
mus; nicht anaerob wachsend. Als Energie- und Kohlenstoffquelle verwerten sie
eine Reihe organischer Stoffe in sehr geringer Konzentration (0,05-0,1%).
Hohere Konzentrationen (1%) inhibieren das Wachstum. Im Unterschied zur
Gattung Asticcacaulis bilden sie aus Zuckern keine Sauren. Als Stickstoffquelle
konnen sie NH4+-Ionen verwerten. Molekularen (Luft-)Stickstoff assimilieren
sie nicht, stimulieren jedoch als Begleitorganismen die Stickstoffixierung in
Blaualgen-Kulturen, z. B. von Nostoc (Bunt 1961). Zum Wachstum brauchen
sie meistens einen ganzen Komplex von Wachstumsfaktoren, vor allem Vitamine
der B-Gruppe unci Aminosauren, die im Hydrolysat von Kasein enthalten sind.
Die erforderlichen Wachstumsfaktoren sind meistenteils spezifisch fur die ein-
zelnen Arten. Wahrscheinlich sind sie nicht imstande, Aminosauren zu syntheti-
sieren (Hund und Kandler 1956). Gegeniiber dem osmotischen Druck sind sie
tolerant und konnen daher auch in destilliertem Wasser wachsen. Nur Isolate aus
Meerwasser erfordern eine NaCl-Konzentration von 0,5-1,0%. Der Tempera-
turbereich liegt zwischen 15 und 35 °C, ausnahmsweise bis 37 °C, das
Optimum bei 20-25 °C. Einige Stamme gedeihen auch gut bei 5-25 CC; das
Optimum ist dann 15-20 °C. Der pH-Bereich liegt zwischen 6-9, Optimum
bei pH 7.
Die Isolierung von Reinkulturen wurde von Poindexter (1964) beschrieben. Auf
festen Medien sind die Kolonien rundlich, konvex und glanzend. Sie erreichen
innerhalb einiger Tage einen Durchmesser von 3-5 mm. Einige Arten sind
farblos, andere gelb bis rot. In fliissigen Medien bilden sie eine Oberflachenhaut,
die den Wanden des Kulturgefafies anhaftet. Die Kulturen enthalten grofitenteils
bewegliche Zellen, eine grofie Anzahl von Rosetten und wenige Exemplare mit
Stielen.
In alten Kulturen treten morphologische Veranderungen auf. Die Zellen sind
faden- oder schraubenformig. Manchmal bilden sie Zellketten, zwischen denen
Stiele auftreten konnen. Ofters kommen gestielte Zellpaare vor.
Vermehrung durch asymmetrische Querteilung; die Tochterzelle entsteht durch
Einschniirung, und zwar am entgegengesetzten Pol, an dem die Mutterzelle den
Stiel entwickelt hat. Die Tochterzelle bildet noch vor der Abtrennung eine polare
Geifiel, deren Entwicklung im Augenblick der Abtrennung der Tochterzelle
beendet ist; jedoch kommt es oft vor, dafi die Tochterzelle noch vor der
Abtrennung beweglich wird und dann die Mutterzelle mit dem Stiel hinter sich
her schleppt. Nach einiger Zeit, gewohnlich nach dem Festhaften der Zelle an
einer festen Unterlage, bildet die Tochterzelle der Stelle, wo die Geifiel ent-
springt, einen Stiel; die Geifiel verschwindet dann. Vereinzelt bleibt am Distal-
ende des Stieles noch eine Geifiel erhalten.
Zellen meistens 0,4—0,5 X 1,0-2,0 \im grofi, Stiel ungefahr 0,15 \nm breit.
Im Sufi wasser weit verbreiteter Organismus, manchmal in sehr grofier Anzahl
vorkommend. Beljajev (1967) fand in den Talsperren der Wolga-Kaskade so-
wohl im Wasser als auch im Schlamm 100-10000 Individuen in 1 ml. Kommt in
Fliissen, Kanalen, in Brunnen- und Grundwasser, in Teichen und Wasserleitun-
gen vor: ebenso in Gefafien mit destilliertem W^ser auftretend. Wurde auch im
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Caulobacter ■ 315
Meerwasser und in Erdboden angetroffen; Aristovskaja (1962) fand ihn z. B. im
Friihjahr und Herbst im Boden (Podzole) der Karelischen Landenge (UdSSR).
Auch im Verdauungstrakt von Asseln gefunden.
Noch bevor Poindexter (1964) weitere Arten dieser Gattung beschrieb, unterschieden einige
Autoren bei Caulobacter vibrioides mehrere Typen, von einigen sogar noch Subtypen
(Henrici und Johnson 1935, Poindexter 1964, Krasil'nikov und Beljajev 1970). Graf (1961,
1962) ist der Meinung, dafi alle Formen, die von Houwink (1951) als parasitar bezeichnet
wurden, in die Ordnung Cytophagales gehoren; er macht auf die auffalfige morphologische
Ahnlichkeit mit Sporocytophaga cauliformis aufmerksam. Bont, Staley und Pankratz (1970)
fanden im Teichwasser einen Stamm mit spindelformigen Zellen, der keine beweglichen
Stadien hatte und sich nur symmetrisch in zwei Zellen mit Stielen teilte. Ein ahnlicher, oder
vielleicht vollig identischer Organismus (Fig. 190) wurde von Henrici und Johnson (1935)
im Lake Alexander (USA) beobachtet. Aus einer Tiefe von 13 m beschrieben sie 3 Typen,
die sich in der Grofie unterschieden. Sie bildeten umfangreiche Kolonien; die Grofie der
Zellen erreichten ungefahr 0,4—0,9 x 2,8-8,1 ^m. Wahrscheinlich handelt es sich urn eine
neue Gattung. Schmidt und Stanier (1965) beschrieben spezifische Phagen fiir die Gattung
Caulobacter und Asticcacaulis. Zavarzin (1961) machte auf eine gewisse Ubereinstimmung
mit Pseudomonas radiobacter aufmerksam.
Typus generis: Caulobacter vibrioides Henrici et Johnson 1935
Wichtigste Literatur: Jones 1905, Omeljanskij 1914, Henrici und Johnson
1935, Zobell und Upham 1944, Zobell 1946, Krasil'nikov 1949, Houwink und
Iterson 1950, Houwink et al. 1950, Houwink 1951, 1952, 1955, Jasuzumi et al.
1952, Bowers et al. 1954, Bystricky 1954, Grula et al. 1954, Kander et al. 1954,
Hund und Kandler 1956, Bergey's Manual 1957,1974, Jannasch und Jones 1959,
1960, Jones 1960, Bunt 1961, Graf 1961, 1962, Zavarzin 1961, Zavarzina 1961,
Aristovskaja 1962, Leifson 1962, Stolp und Petzold 1962, Stove und Stanier
1962, Gromov 1963, 1964, Nemec und Bystricky 1963, Leifson et al. 1964,
Poindexter 1964, Schmidt und Stanier 1965, Beljajev 1967, Krasil'nikov und
Beljajev 1967, 1970, 1971, Schmidt 1968, Staley 1968, Bont et al. 1970.
Bestimmungsschliissel der Arten
la Reife Zellen stabchenformig 14
lb Reife Zellen nicht stabchenformig .2
2a Vibrioide oder limonoide Zellen 3
2b Spindelformige Zellen 12
3a ^um Wachstum sind spezifische Wachstumsfaktoren erforderlich 4
3b Zum Wachstum werden keine Wachstumsfaktoren benotigt; Kolonien
farblos 5. C. crescentus
4a B-Vitamine erforderlich 5
4b Keine B-Vitamine erforderlich 9
5a Benotigen Riboflavin; Zellen vibrioid oder limonoid 6
5b Kein Riboflavin erforderlich; Zellen nur vibrioid 8
6a Zellen vibrioid; Kolonien grauweifi 1. C. vibrioides
6b Zellen limonoid 7
7a Kolonien ohne Pigmente
1. C. vibrioides (ein nicht naher beschriebener Stamm)
7b Kolonien hellgelb la. C. vibrioides (var. limonus)
8a Kolonien hellgelb 2. C. henrici
8b Kolonien dunkelgelb 2a. C. henrici (var. aurantiacus)
9a Zellen immer vibrioid; brauchen zum Wachstum Biotin; Kolonien farblos
3. C. intermedius
9b Zellen an der Polen verjiingt; beim gleichen Stamm einige Zellen vibrioid,
andere gerade; benotigen kein Biotin; Kolonien durchsichtig 10
10a Verwerten Saccharide 11
316 ■ Knospende Bakterien - Caulobacter
10b Verwerten keine Saccharide; Kolonien hellgoldgelb
4b. C. subvibrioides (Typ I)
11a Kolonien orange 4. C. subvibrioides
lib Kolonienfarblos 4a.C.subvibrioides(var.albus)
12a Wachstumsfaktoren erforderlich 13
12b Keine Wachstumsfaktoren erforderlich; Kolonien farblos
6. C. leidyi
13a Kolonien hell- bisdunkelgelb 7. C.fusiformis
13b Kolonien goldgelb 7a. C. fusiformis (Typ II)
14a Benotigen NaCl (Meeroreanismen) 15
14b Benotigen kein NaCl (Simwasserorganismen) 16
15a Nicht empfindlich gegeniiber Senkungen der NaCl-Konzentration;
verwerten Aminosauren als C-Quelle; hydrolisieren Starke; Kolonien farblos
8. C. halobacteroides
15b Empfindlich gegeniiber Senkungen der NaCl-Konzentration; verwerten
keine Aminosaure als C-Quelle; hydrolysieren keine Starke; Kolonien
farblos 9. C. maris
16a Stiele am Zellpol zentral angebracht 17
16b Stiele beim gleichen Stamm bei manchen Zellen in der Mitte des Poles, bei
anderen exzentrisch angebracht; Kolonien dunkelorange bis rot
10. C. variabilis
17a Verwerten Pentosen 18
17b Verwerten keine Pentosen 19
18a Verwerten Salze der Essig-undBernsteinsaure; Kolonien gelb
11. C. bactericides
18b Verwerten keine Salze der Essig-undBernsteinsaure; Kolonien farblos . . . .
11a. C. bactericides (Typ III)
19a Verwerten Maltose und Saccharose; Kolonien hellgelb
lie. C. bactericides (Typ V)
19b Verwerten nicht Maltose und Saccharose; Kolonien dunkelgelb
_llb. C. bactericides (Typ IV)
1. Caulobacter vibrioides Henrici et Johnson 1935 (Fig. 191)
Bacillus flagellatus Omeljanskij 1914, Pseudomonas flagellata (Omeljanskij
1914) Krasil'nikov 1949, Bacterium flagellatum (Omeljanskij 1914) Houwinket
van Iterson 1950, Caulobacter vibrioides var. limonus Poindexter 1964.
Zellen lang, schlank, gramnegativ, farblos, vibrioid, leicht bis hornchenformig
gebogen. Einige Stamme mit ovoiden oder limonoiden Zellen. Reife Zellen mit
einem schlanken halmformigen Auslaufer, dem sog. Stiel, der an einem Pol
befestigt ist und am Distalende mit einem Gallertpolster aus extrazellularem
adhasivem Material versehen ist. Durch das Gallertpolster werden gewohnlich
die Zellen an einer festen Unterlage oder an verschiedenen Organismen festge-
halten; in fliissigen Kulturen sind die Zellen oft miteinander verbunden und
bilden dann spezifische rosettenformige Aggregate. Tochterzellen durch eine
polare Geifiel beweglich.
Protoplasma enthalt Granula von Poly-f3-Hydroxybuttersaure.
Der Organismus braucht fur sein Wachstum unbedingt Riboflavin (Vitamin B2)
sowie nicht naher bekannte Faktoren, die in Hefeextrakt enthalten sind. Gedeiht
gut im pH-Bereich von 6-9 bei optimaler Temperatur von 30 °C. Reduziert
keine Nitrate, bildet kein Indol. Kolonien abgerundet, glatt, leicht konvex, glanzend,
in der Mitte fein gekornt, oben grauweifi gefarbt, in der Mitte und auf der Unter-
seite gelbbraun. Auf Schragagar wachst der Organismus fadenformig, grauweifi,
glanzend und klebrig. Stamme mit limonoiden Zellen bilden farblose Kolonien.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Caulobacter ■ 317
Fig. 191. Caulobacter vibrioides - Kolonie in Rosettenform. (Orig. - 2750 x).
Vermehrung durch asymmetrische Querteilung der Zellen, wobei eine Tochter-
zelle mit einer polar en Geifiel gebildet wird.
Reife Zellen 0,5-1,2 x 1,5-3,0 ym grofi.
Kommt bisweilen in grofier Zahl in verschiedenen Siifiwassertypen wahrend des
ganzen Jahres vor.
Diese Bakterie wurde schon von Jones (1905) ohne Angabe eines Namens beschrieben; der
Stiel wurde lrrtiimlich fur eine lange polare GeiBel gehalten, mit einer GroBe von 0,5-0,7 x
1,5-3,0 |im. Omeljanskij (1914) beschrieb denselben Organismus unter der Bezeichnung
Bacillus flagellars; er erhielt ihn aus einer Kultur von Purpurschwefelbakterien aus
Flufiwasser. Auch er hielt den Stiel fur eine lange GeiBel. Zavarzina (1961) stellte fest, dafi
der Organismus spezifische Phagen iibertragt, die eine Lyse verschiedener Algenzellen, an
denen er als Epiphyt sitzt, hervorruft.
Henrici und Johnson (1935) beschrieben eine Form, deren Zellen an einem Pol keulenformig
angeschwollen sind. Diese Form kommt verhaltnismafiig selten vor, dann aber in grofier
Zahl. Wird als Involutionsform von Caulobacter vibrioides angesehen. Im Lake Alexander
(USA) gefunden.
Krasil'nikov (1949) stellt hierher auch die Art Caulobacter subvibrioides, da er deren
morphologische Eigenschaften fur nicht bestandig halt.
Zur Leitart wird wegen ihrer sehr geringen Unterschiede noch die folgende Form gestellt:
la. Caulobacter vibrioides var. limonus Poindexter 1964.
Zellen kurz, ovoid oder limonoid; Kolonien hellgelb. Als Wachstumsfaktor wird Riboflavin
benbtigt.
2. Caulobacter henrici Poindexter 1964
Caulobacter henrici var. aurantiacus Poindexter 1964
Reife Zellen vibrioid, Kolonien der meisten Stamme sattgelb; eine kleine Anzahl
von Stammen bildet hellgelbe Kolonien.
Zum Wachstum wird kein Riboflavin (Vitamin B2) benotigt; jedoch ist Vitamin
318 ■ Knospende Bakterien - Caulobacter
B12 erforderlich. Zwei Stamme sind Intermediartypen zwischen Caulobacter
vibrioides und Caulobacter henrici.
Ein weiterer Stamm mufi zu dieser Art gestellt werden; er wurde als selbstandige, Taxon
beschrieben:
2a. Caulobacter henrici var. aurantiacus Poindexter 1964
Mit ungewohnlich kleinen Zellen; die nur 0,4-0,8 (im breit sind; Kolonien rotgelb gefarbt.
3. Caulobacter intermedius Poindexter 1964
Reife Zellen verhaltnismafiig kurz, vibrioid. Kolonien farblos. Den Arten
Caulobacter henrici und Caulobacter vibrioides ziemlich ahnlich. Zum Wachs-
tum benotigt er nicht naher bestimmte Wachstumsfaktoren, die im Hefe-
Autolysat enthalten sind; braucht kein Riboflavin (Vitamin B2); Biotin stimuliert
sein Wachstum (Unterschied zu Caulobacter vibrioides); benotigt auch kein
Vitamin B]2 (Unterschied zu Caulobacter henrici).
4. Caulobacter subvibrioides Poindexter 1964
Caulobacter subvibrioides var. albusPo'mdexter 1964, Caulobacter subvibrioides
(«Typ I») Poindexter 1964.
Reife Zellen an den Polen verjiingt; bei manchen Individuen desselben Stammes
vibrioid gekrummt, bei anderen gerade. Kolonien dunkelorange, hell goldgelb
oder farblos. Zum Unterschied von den iibrigen Arten durchsichtig. Zum
Wachstum brauchen sie einen Komplex nicht naher bestimmter
Wachstumsfaktoren, der nicht durch ein Gemisch von Vitaminen der B-Serie, Aminosauren,
Purin- und Pyrdimidin-Basen ersetzt werden kann.
Zellen ungefahr 0,6-0,8 urn breit.
Krasil'nikov (1949) betrachtet diesen Organismus nur als eine morphologische
Modifikation von Caulobacter vibrioides, die durch Anderungen der Kulturbe-
dingungen hervorgerufen wurde.
Poindexter (1964) beschrieb weitere, wenig unterschiedliche Formen:
4a. Caulobacter subvibrioides var. albus Poindexter 1964
Unterscheidet sich nur durch nicht pigmentierte Kolonien.
4b. Caulobacter subvibrioides («Typ I»)
Kolonien hell goldgelb pigmentiert. Der Stamm kann keine Saccharide verwerten.
5. Caulobacter crescentus Poindexter 1964 (Fig. 192)
Reife Zellen deutlich vibrioid, schlank. Kolonien farblos. Stiele der Zellen 2,0-
3,0 urn lang. Zum Wachstum ist kein spezifischer Wachstumsfaktor
erforderlich. Als einzige Art dieser Gattung mit der Fahigkeit, aliphatische Alkohole mit
Q-Cs-Ketten zu verwerten. Schmidt (1968) beschrieb einen Mutationsstamm
mit extrem langen Stielen, der auf einem komplexen Medium mit begrenzter
Phosphorkonzentration wuchs. Die Stiele dieses Stammes waren bis 20 um lang.
Schmidt (1973) sowie Jones und Schmidt (1973) fanden als Ultrastruktur in den
Stielen Querbander, die aus konzentrisch angeordneten, alternierenden hellen
und dunklen Zonen bestehen.
6. Caulobacter leidyi Poindexter 1964
Reife Zellen kurz spindelformig, an den Enden stark zugespitzt, nicht ge-
kriimmt. Stiele sehr Kurz, kaum die Halfte der Zellange erreichend. Kolonien
farblos, gut auf Mineralboden wachsend, die Glukose ohne Wuchsstoffe
enthalten. Saccharose wird nicht verwertet.
Aus dem Verdauungstrakt von Asseln isoliert.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Caulobacter • 319
7. Caulobacter fusiformis Poindexter 1964 (Fig. 193)
Caulobacter fusiformis («Typ II») Poindexter 1964
Zellen schlank, ausgepragt spindelformig, mit zugespitzten Enden, gerade, nie
gekrummt.
Kolonien hell- bis dunkelgelb; ohne die Fahigkeit Saccharide zu verwerten,
hingegen aber Butanol. Zum Wachstum brauchen sie einen Komplex organi-
scher Wachstumsfaktoren, der nicht durch ein Gemisch von Vitaminen der
B-Serie, Aminosauren, Purin- und Pyridin-Basen ersetzt werden kann.
Die von Henrici und Johnson (1935) aus dem Lake Alexander (USA) beschriebe-
nen Organismen sind wahrscheinlich identisch mit dem Organismus, den Bont
et al. (1970) beschrieben haben; wahrscheinlich eine selbstandige Gattung.
Poindexter (1964) beschrieb aufierdem einen wenig unterschiedlichen Typ:
7a. Caulobacter fusiformis («Typ II»).
Unterscheidet sich nur durch goldgelb pigmentierte Kolonien.
8. Caulobacter halobacterioides Poindexter 1964
Reife Zellen in Form schlanker Stabchen, Caulobacter bactericides ahnlich.
Kolonien farblos. Zum Wachstum ist ein Komplex organischer
Wachstumsfaktoren erforderlich, der nicht durch ein Gemisch von Vitaminen der B-Serie und
Aminosauren ersetzt werden kann. Benotigt 0,5-3,0 NaCl; 4,0% NaCl inhi-
biert das Wachstum. Starke wird hydrolisiert, Nitrate zu Nitriten unter aeroben
Bedingungen reduziert. Aminosauren werden als Kohlenstoffquelle verwertet.
Gegeniiber einer Senkung des osmotischen Druckes wenig empfindlich. Bei
Verdiinnung von Meerwasser auf 15% wird noch 70% der Biomasse gebildet.
Aus Meerwasser isoliert.
9. Caulobacter maris Poindexter 1964
Reife Zellen in Form schlanker Stabchen, Caulobacter bacterioides sehr ahnlich.
Kolonien farblos. Zum Wachstum braucht dieser Organismus organische
Wachstumsfaktoren, die nicht durch ein Gemisch von B-Vitaminen und
Aminosauren ersetzt werden konnen; benotigt 1,0-4,0 NaCl; hydrolisiert keine
Starke. Nitrate werden zu Nitriten anaerob reduziert. Verwertet keine organische'n
Sauren und keine Aminosauren als Kohlenstoffquelle; empfindlich gegeniiber
Senkung des osmotischen Druckes. Bei Verdiinnung von Meerwasser auf 25%
bildet sich nur 30% der Biomasse, bei Verdiinnung auf 10% wird das Wachstum
eingestellt.
Aus Meerwasser isoliert.
10. Caulobacter variabilis Poindexter 1964
Reife Zellen in Form dicker Stabchen. Lage der Stiele am Zellpol recht variabel.
Bei einigen Individuen eines Stammes sind die Stiele zentral, bei anderen
exzentrisch. Kolonien dunkelorange bis rot. Physiologisch Caulobacter
bacterioides und Caulobacter subvibrioides ahnlich.
Zellen 0,5-0,6 x 1,0-2,0 urn grofi (Krasil'nikov und Beljajev 1970).
11. Caulobacter bacterioides Poindexter 1964 (Fig. 194)
Caulobacter bacterioides («Typ III») Poindexter 1964, («Typ IV») Poindexter
1964, («Typ V») Poindexter 1964.
Reife Zellen in Form schlanker Stabchen mit abgerundeten Enden. Kolonien
farblos, gelb oder orange. Der Organismus benotigt einen Komplex organischer
Wachstumsfaktoren, der nicht durch ein Gemisch von Vitaminen der B-Serie,
320 • Knospende Bakterien - Caulobacter
Fig. 192. Caulobacter crescentus - Zellen an Bakterienzelle sitzend (Orig. -
7000X). Fig. 193. Caulobacterfusiformis- (nach Elektronen-Mikrophoto sche-
matisiert - Poindexter, 1964. - 10 000 x). Fig. 194. Caulobacter bacterioides -
Zellen an einer Bakterienzellkette sitzend (nach Mikrophoto umgezeichnet -
Poindexter, 1964. - 6000X). Fig. 195. Asticcacaulis excentrkus - ein Exemplar
mit einer Geifiel auf Pseudostiel (nach Elektronen-Mikrophoto umgezeichnet -
Poindexter, 1964. - 10000X).
Aminosauren, Purin- und Pyridinbasen ersetzt werden kann. Verwertet Gluko-
se, Pentosen und Salze der Essig- und Bernsteinsaure.
Zellen nach Poindexter (1964) 0,5 x 1,5-2,5 um grofi.
Henrici und Johnson (1935) beschrieben sehr ahnliche Organismen aus dem
Lake Alexander (USA), die sie als Caulobacter sp. bezeichneten. Es handeltsich
um zwei Typen, von denen der eine kurze, gerade, stabchenformige Zellen mit
sehr kurzen Stielen hatte (Zellen ungefahr 0,5-0,7 x 1,0-2,5 um grofi; Stiele 0,7-
1,7 um lang), der andere besafi Zellen in Form grofier Stabchen mit deutlich
abgerundeten Enden (Zellen 0,7 x 3,3-4,2 um grofi). Beide Typen ziemlich
selten, aber in grofien Mengen.
Innerhalb dieser Art kann man noch einige weitere Typen unterscheiden, die Poindexter
(1964) wie folgt bezeichnete:
11a. Caulobacter bacterioides («Typ III»)
Kolonien farblos; das Wachstum wird durch Biotin stimuliert. Verwertet kein Athanol und
keine Salze der Essig- und Bernsteinsaure, hingegen Pentosen.
lib. Caulobacter bacterioides («Typ IV»)
Kolonien dunkel goldgelb. Verwertet weder Maltose, noch Saccharose oder Pentosen.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Asticcacaulis • 321
lie. Caulobacter bacterioides («Typ V»)
Zellen ahnlich wie Caulobaaer variabilis (Stiele jedoch immer zentral) und Caulobaaer
baaerioides (Zellen jedoch kiirzer und starker). Kolonien hellgelb pigmentiert. Verwertet
Maltose und Saccharose, jedoch keine Pentosen.
8. Asticcacaulis Poindexter 1964
Gramnegative Zellen in Form dicker, gerader, zylindrischer, farbloser Stabchen
mit stumpfen oder leicht verjiingten Enden. Aus einem Zellpol wachst exzen-
trisch ein verschieden langer Stiel; Lange artspezifisch, aber auch von den
Kulturbedingungen abhangend. Manchmal ist der Stiel lateral an der Zelle
angebracht. Gewohnlich verlauft seine Achse nicht als Fortsetzung der Langs-
achse der Zellen, sondern bildet mit ihr einen mehr oder weniger scharfen
Winkel, manchmal auch einen rechten Winkel. Strukturell ist er den Stielen der
Gattung Caulobacter ahnlich, unterscheidet sich jedoch dadurch, dafi sich am
Distalende nie Gallertpolster bilden; deshalb nennt ihn Poindexter (1964) « Pseu-
dostiel», wahrend Pate et al. (1973) ihn als identisch mit Prostheken ansehen, wie
sie Staley (1968) fur die Gatung Prosthecomicrobium und Ancalomicrobium
definiert hat. Adhasives, extrazellulares Material, das zum Festhalten des Orga-
nismus an Unterlagen dient, entsteht an polarer oder subpolarer Stelle direkt an
der Zelle. Zellen an verschiedenen festen submersen Gegenstanden haftend;
einzeln oder in dichten Populationen vorkommend; Rosetten bildend. Ruhesta-
dien nicht bekannt. Protoplasma ohne karotinoide Pigmente. Als Reservestoffe
dienen Granula von Poly-|3-Hydroxybuttersaure. Zellwand aus zwei Schichten
bestehend.
Chemoorganotropher, streng aerober Organismus mit Respirationsmetabolis-
mus. Von organischen Wachstumsfaktoren ist nur Biotin erforderlich. Als
Energie- und Kohlenstoffquelle verwertet er eine Reihe organischer Stoffe,
jedoch nur in geringen Konzentrationen; schon eine l%ige Konzentration
inhibiert das Wachstum. In saccharidhaltigem Milieu bildet er Sauren, wodurch
er sich vor allem von den Arten der Gattung Caulobacter unterscheidet. Gedeiht
auch bei niedrigem osmotischen Druck gut und vermehrt sich sogar in destillier-
tem Wasser. Wachst bei 15-35 °C, wobei das Optimum zwischen 25-30 °C
liegt. Der optimale pH-Wert betragt 7,0, der Wachstumsbereich wird mit 6-9
angegeben. Auf festen Nahrboden werden kreisformige, konvexe, glanzende,
farblose Kolonien gebildet.
Vermehrung durch asymmetrische Querteilung der Zellen mit Pseudostiel.
Tochterzelle kiirzer, mit einer exzentrisch angebrachten polaren Geifiel. Spater
beginnt sich ein Stiel zu bilden, die Zelle wird unbeweglich. In dichten
Populationen werden Rosetten gebildet, aus denen die sich entwickelnden Stiele
strahlenformig herausragen. Im natiirlichen Milieu wurde dieser Organismus
bisher noch nicht gefunden; es wird angenommen, dafi sein Vorkommen dem
der Gattung Caulobacter ahnelt, er aber im Meerwasser fehlt. Wurde aus einer
Siifiwasserkultur mit Arten der Gattung Caulobacter isoliert. Urspriinglich als
exzentrischer Typ der Gattung Caulobacter beschrieben.
Typus generis: Asticcacaulis excentrkus Poindexter 1964
Wichtigste Literatur: Poindexter 1964, Pate und Ordal 1965, Schmidt und
Stainer 1965, Pate et al. 1973, Larson und Pate 1975.
Bestimmungsschlussel der Arten
la Ein Zellpol mit einem exzentrisch stehenden Pseudostiel . 1. A.excentricus
lb Mit 2 gegeniiberstehenden Pseudostielen (Prostheken), die senkrecht zur
Langsachseangeordnetsind 2. A.biprosthecum
322 • Knospende Bakterien - Siderophacus
1. Asticcacaulis excentricus Poindexter 1964 (Fig. 195)
Mit den Merkmalen der Gattung.
Zellen 0,5-0,7 x 1,0-3,0 nm grofi; Stiel etwa 0,5 ^m lang. Schmidt und Stanier
(1965) beschrieben einen spezifischen Phagen, der Lyse bei Zellen der Gattung
Asticcacaulis, nicht jedoch bei Caulobacter hervorruft.
2. Asticcacaulis biprosthecum Pate et al. 1973
Starke, gerade zylindrische Stabchen mit abgerundeten Enden. Spezifischer
dimorpher Entwicklungszyklus. An einem Pol (wo sich vorher eine Geifiel
befand) bildet sich ein Gallertpolster, mit dem die Zelle an der Unterlage haftet.
Senkrecht zur Langsachse werden zwei gegeniiberstehende Prostheken gebildet,
deren Funktion die Vergrofierung der Zelloberflache zur besseren Aufnahme
von Nahrstoffen ist. Wahrend der Teilung bildet sich an der Tochterzelle eine
polare Geifiel, bevor sich die Tochterzelle von der Mutterzelle trennt. Die
Teilungsebene liegt gewohnlich so, dafi die Prostheken bei der Mutterzelle
verbleiben. Es kommt jedoch auch vor, dafi die Tochterzelle die Prostheken
erhalt; die anhaftende Mutterzelle bildet dann nur noch normale Tochterzellen
ohne Prostheken. Diese bewegen sich oftmals schon vor der Trennung von der
Mutterzelle. Auf der Tochterzelle befinden sich bereits in der plasmatischen
Membran determinierte Stellen fur die kiinftige Prosthekenbildung. Nach der
Trennung bewegt sich die Tochterzelle frei mittels einer Geifiel; die Mutterzelle
teilt sich eventuell wieder. Nach einiger Zeit wirft die Tochterzelle die Geifiel ab
und setzt sich mit einem Gallertpolster fest, worauf sich der oben geschilderte
Vorgang wiederholt.
Aerob, organotroph, offenbar mit Respirationsmetabolismus. Anaerob nicht
wachstumfahig, auch nicht bei Anwesenneit von Nitraten. Nitrate werden nicht
reduziert. Als Kohlenstoff- und Energiequelle kann nur eine ziemlich begrenzte
Zahl von organischen Stoffen verwertet werden; am besten wachst die Art auf
Maltose una Fruktose, ebenso auf Milchsaure und Brenztraubensaure. Als
Stickstoffquelle konnen nur Aminosauren dienen, wahrend die anderen keinen
Einflufi auf das Wachstum haben oder es sogar inhibieren. Fiir optimales
Wachstum ist eine Temperatur von 30 °C und ein pH-Wert von 7,2 erforder-
lich.
Grbfie der Zellen von den Autoren nicht angegeben.
Kommt in Wasser mit extrem niedrigem Gehalt an organischen Stoffen vor.
Der Organismus wurde schon friiher von Pate und Ordal (1965) als Asticcacaulis,
Stamm C-19, beschrieben.
9. Siderophacus Beger 1944
Zellen oval, stabchenformig, manchmal linsenformig; am Ende eines unver-
zweigten Stengels sitzend; auf der Oberflache mit Eisenablagerungen. Nie in
Form schraubenformiger Bander. Im Querschnitt rund oder oval. Der basale
Teil des Stengels schmaler als der apikale. Stengel einem Substrat aufsitzend.
Kolonien aus mehreren Stengeln bestehend. Mixotroph. Fortpflanzung durch
Teilung; nach der Teilung trennen sich die Zellen vom Stengel. In eisenhaltigen
Gewassern vorkommend.
Wichtigste Literatur: Dorff 1934, Beger 1944, Bergey's Manual 1974.
Eine einzige Art:
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Nevskia ■ 323
Siderophacus corneolus (Dorff 1934) Beger 1944 (Fig. 196)
Gallionella corneola Dorff 1934
Mit den Merkmalen der Gattung.
Zellen 0,6-1,0 X 2,5-3,0 \im grofi. Stengel 15-30 [im lang. Nach Zavarzin
(1961) der Gattung Planctomyces (= Blastocaulis) nahestehend. Hirsch (1972)
weist auf morphologische Ahnlichkeit mit Planctomyces stranskae hin. Nach
Bergey's Manual (1974) soil dieser Organismus mit der Gattung Nevskia ver-
wandt sein.
10. Nevskia Famintzin 1892
Zellen stabchenformig, einseitig gallertige Stoffe ausscheidend, die einen
senkrecht zur Langsachse der Zelle orientierten hyalinen Stengel bilden. Stengel mehr
oder weniger dichotom verzweigt, infolge Teilung erwachsener Zellen. Zum
Scheitel hin keulenformig verbreitert. Meistens lappige bis Zoogloea-artige
Kolonien bildend. Physiologische Eigenschaften bisher unbekannt, da keine
Reinkulturen erzielt wurden. Fortpflanzung nur durch Querteilung. Verhaltnis-
mafiig wenig bekannt. Nach Bergey's Manual (1974) soil der als Siderophacus
corneolus beschriebene Organismus mit dieser Gattung verwandt sein.
Typus generis: Nevskia ramosa Famintzin 1892
Wichtigste Literatur: Famintzin 1892, Koch und Hosaeus 1894, Migula 1900,
Henrici und Johnson 1935, Krasil'nikov 1949, Scarr 1949, Bergey's Manual
1957, 1974, Babenzien 1965, 1967
324 • Knospende Bakterien - Nevskia (
Bestimmungsschliissel der Arten
1 a Im SUfiwasserneuston, Stengel sich in 1 % KOH auf losend . . 1. N. ramosa
lb Uberwiegend in Rohzuckersirup oder Saftvorkommend; Stengel wird durch
Erwarmungaufgelost 2. N.pediculata
1. Nevskia ramosa Famintzin 1892 (Fig. 197)
Gallionella ramosa (Famintzin 1892) Krasil'nikov 1949
Erwachsene Zellen gram-negativ, oft in Form leicht gekriimmter Stabchen.
Scheiden werden unter gewissen, bisher unbekannten Bedingungen aus gallerti-
gem Material gebildet, das eine Kapsel um die Zelle bildet; meistens scheiden die
Zellen jedoch an einer Seite mehr Sekret aus, so daft stielartige Strange entstehen,
auf deren Langsachse die Zellen mit ihrer langeren Achse senkrecht orientiert
sind. Stengel hyalin und oft dichotom verzweigt; niemals mit Eisen inkrustiert.
Gewohnlich bis 80 ^m grofie, kugelige, scheiben- oder schalenformige bzw.
mehr oder weniger lappige Mikrokolonien bildend, bei denen die einzelnen
Stengel aus einer gemeinsamen Basis herauswachsen. Stengel nach vorheriger
Behandlung mit Athanol in 1% KOH loslich. Mit wassriger Methylenblaulo-
sung gut farbbar. Unter bisher noch unbekannten Bedingungen verlassen man-
che (junge?) Zellen die Mikrokolonien; sie sind durch 1-3 polare Geifieln
beweglich und finden sich nicht nur an der Wasseroberflache, sondern auch
unterhalb des Wasserspiegels; wahrscheinlich sind sie Ausgangspunkt neuer
Kolonien.
Die Zellen enthalten in verschiedener Anzahl kugelige, stark lichtbrechende,
sporen-ahnliche Globuli, die aber weder aus Schwefel, noch aus Poly-f5-Hydro-
xy-Buttersaure bestehen. Sie erinnern an Fett-Tropfchen und sind in 70%
Athanol loslich. Nach Henrici und Johnson (1935) aus atherischen Olen beste-
hend. Gut farbbar nach Burdon. Nach Farbung mit Methylviolett wird die
Zellwand deutlich.
Zellen streng aerob. Henrici und Johnson (1935) erzielten in Anreicherungskul-
turen durch Zugabe von NaS ein besseres Wachstum. Babenzien (1965, 1967)
stimulierte das Wachstum durch Zugabe von 0,1% Natriumlaktat oder -azetat.
Braucht zum Wachstum eine Temperatur von ungefahr 28 CC und leicht sauere
pH-Werte von 5,9-6,6. Reinkulturen wurden nicht erzielt.
Fortpflanzung durch Querteilung der Zellen, nie durch Knospung. Kolonien
unbeweglich, supraneustisch.
Zellen 0,7 X 2,4-2,7 ^m grofi; manchmal bis 12 ^m lang. Gewohnlich 2-6mal
linger als breit. Henrici und Johnson (1935) beschrieben auch kleinere, aber
sonst morphologisch identische Formen (1,0 X 3,0-4,0 |xm).
Im Siifiwasser im Neuston vorkommend, manchmal auf dem Wasserspiegel
Schaum bildend. Urspriinglich im Aquarium des botanischen Gartens in Peters-
hof in der Nahe von Leningrad (UdSSR) gefunden.
Unsichere Art:
2. Nevskia pediculata (Koch et Hosaeus 1894) Henrici et Johnson
1935
Bacterium pediculatum Koch et Hosaeus 1894, Bacilluspedunculatus Scarr 1949,
Gallionella pediculata (Koch et Hosaeus 1894) Krasil'nikov 1949
Zellen diinn, kurz stabchenformig, senkrecht zur Langsachse auf dicken, durch-
sichtigen, kurzen, manchmal gebogenen, zum Scheitel hin regelmafiig verbrei-
terten Stengeln aus gallertartigem Zellsekret sitzend. Chemische Zusammenset-
zung der Stengel bisher unbekannt; durch Warme sich auflosend. Nach Farbung
mit Methylenblau eine strickartige Struktur zeigend. Manchmal dichotom ver-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Gallionella • 325
zweigt. Bisher nicht in Reinkulturen geziichtet. Fortpflanzung durch
Querteilung der Zellen. Bewegliche Zellen nicht bekannt.
Ausmafie der Zellen werden nicht angegeben; nach der urspriinglichen Abbil-
dung wohl im ublichen Bereich liegend.
Im Sirup einer Zuckerraffinerie als Zoogloea-aruees Gebilde gefunden, makro-
skopisch an Leuconostoc mesenteroides erinnernd; kann von dort in Abwasser
verschleppt werden.
Sehr wenig bekannt und unzureichend beschrieben.
Krasil'nikov (1949) stellte diesen Organismus unrichtig zur Gattung Gallionella. Koch und
Hosaeus (1894) verwiesen auf einige mit Betabacterium vermiforme (= Bacterium vermifor-
me) identische Eigenschaften. Nach Bergey's Manual (1957) als Vertreter der Gattung
Lactobacillus angesehen.
11. Gallionella Ehrenberg 1838 (nomen conservandum)
Gaillionella Ehrenberg 1836, Gloeotila Kutzing 1849, Didymohelix Griffith
1853, Gloeosphaera Rabenhorst 1854, Spirophyllum Ellis l907,Nodofolittm Ellis
1908, Spirosoma Ellis 1908
Organismen mit sehr kompliziertem, bisher wenig bekanntem Entwicklungs-
zyklus. Zellen meist bohnen- bis nierenformig, weniger haufig ellipsoidisch bis
stabchenformig abgeflacht; ahnlich wie Vibrio propelierartig gebogen, was nach
Cholodnyj (1953) nur nach Auflosung des an ihrer Oberflache abgelagerten
Eisenhydroxids sichtbar wird. An den Enden langer Stengel senkrecht zur
Langsachse der Zellen haftend. Zellen mit dem Stengel nicht fest verbunden, so
daft auch Stengel ohne Zellen zu finden sind. Ohne scharfe Konturen; verhaltnis-
mafiie transparent, sotdafi sie oft nur durch an ihrer Oberflache abgelagerte
Partikel von Eisenverbindungen wahrnehmbar sind; gramnegativ.
Stengel ziemlich pleomorph, anscheinend von den Wachstumsbedingungen
abhangig. Sehr zart, zerbrechlich, besonders bei alteren Individuen, bei denen
die Zerbrechlichkeit durch Ablagerung von Eisenverbindungen gesteigert wird.
Mardanjan und Balasova (1971) nahmen an, daft die amorphen
Eisenverbindungen chemisch an die feine Oberflachenstruktur der Stengel gebunden sind, wo sie
die Funktion eines Schutzskeletts haben. Frisch gebildete Stengel sind farblos,
altere gelb- bis rostbraun gefarbt; sie zerfallen leicht in kleinere Fragmente, die in
der alteren Literatur als selbstandige Organismen beschrieben worden sind. Ihr
unterschiedliches Aussehen fiihrte zur Bechreibung vieler Arten. Prinzipiell
lassen sich nur zwei Typen von Stengeln unterscheiden: ein bandartiger una ein
zylindrischer. Sie konnen gerade oder verschiedenartig gebogen, dichotom
verzweigt, doldenformig oder schraubenartig gekriimmt sein. Sie sind verschie-
den lang und haften mit einem stark inkrustierten Gallertpolster am basalen Teil
des Stengels auf beliebigen festen Unterlagen im Wasser fest. Lange Stengel
fluten im Wasser und umwinden sich oft gegenseitig. Wenn mehrere Individuen
gleichzeitig an einer Stelle wachsen, bilden sich nach einiger Zeit knauelartige
Anhaufungen Von Stengeln, aus denen nur ihre Enden mit den Zellen hervor-
ragen.
Uber die Beschaff enheit der Stengel besteht bis heute keine einheitliche Ansicht. Cholodnyj
(1924,1953), dessen Ansicht von einer ganzen Reihe von Autoren ubernommen wurde, halt
den Stengel fur ein transparentes Exkret der Zelle in Form eines Eisen(III)hydroxyd-
Hydro^els. Dieses wird standig durch mehrere Poren an der konkaven Seite der Zelle in
Form eines Bandes ausgeschieden, wahrend die zweiwertigen Eisenverbindungen aus dem
sie umgebenden Medium von der konvexen Seite absorbiert werden. Mit gelbem Blutlau-
gensalz zeieen die Stengel Berlinerblau-Reaktion. Die schraubenfdrmige Gestalt des
Stengels ist nach Cholodnyj (1924, 1953) durch die vibrioide Kriimmung der Zelle gegeben, die
326 • Knospende Bakterien - Gallionella
Lange der Windungen ist unmittelbar vom Grad der Kriimmung der Zelle abhangig. Junge,
noch mehr oder weniger kugelige Tochterzellen scheiden den Stengel in Form eines Fadens
mit kreisformigem Querschnitt aus. Wahrend des Wachstums der Zellen verbreitert er sich,
bis er schliefilich bandformig wird. Nach Rohrer (1952) wird die schraubenformige Gestalt
durch das langsame Rotieren der am Ende der Stengel befindlichen Zellen verursacht.
Elektronenmikroskopische Untersuchungen zeigten jedoch, dafi die Stengel aus parallel
angeordneten, sich gegenseitig schraubenformig umwindenden, manchmal auch verzweig-
ten, mit Eisenoxid bedeckten Fibrillen bestehen. Vatter und Wolfe (1956) sahen eine
segmentierte Struktur der Fibrillen und bestatigten so teilweise die Beobachtung von
Perfiliev (1926), der behauptete, dafi sich stabchenformige Zellen in den Faden befinden.
Hanert (1968) schliefit nicht aus, dafi bei Fehlen typischer Terminalzellen deise Fibrillenseg-
mente die Funktion reproduktiver Einheiten haben konnen. Nach Rohrer (1952) ist die
Struktur der Stengel netzartig. Hanert (1970) beobachtete an der Stelle, wo der Stengel mit
einem Gallertpolster an der Unterlage festsitzt, eine grofie Zahl kugeliger, mit Eisenoxid
inkrustierter Partikel, die mit den von Balasova (1967, 1969) beschriebenen Partikeln
identisch waren, die in Laboratoriumskulturen an den Enden der einzelnen Fibrillen
auftraten. Van Iterson (1958) und spater auch andere Autoren zeigten, dafi Bakterienzellen
verschiedener Grofie nicht nur terminal an den Enden, sondern auch durch laterale
Knospung an den Flanken der Stengel entstehen, was Ellis (1907) fur Gonidienbildung hielt.
Balasova (1967,1969) nimmtan, dafi die kleinen, an der Basis des Stengels liegenden Partikel
sich aus den feinen, gekriimmten, diinnen Fibrillen entwickeln, wahrend die lateral
befindlichen knospenden (?) Tochterzellen aus langen Faden entstehen; diese Faden bilden sich aus
dem zarten Zentralfaden (Hanert 1970), ahnlich wie bei der Gattung Metallogenium.
Aufierdem wurden in den Kulturen filtrierbare Korpuskeln, ahnlich wie bei der Gattung
Mycoplasma, beobachtet; wahrscheinlich handelt es sich um eines derEntwicklungsstadien.
Auch sackchenartige Gebilde (Sporangien entsprechend), gefiillt mit diesen filtrierbaren
Partikeln, wurden gefunden (Van Iterson 1958).
Zwischen dem Stengel und der apikalen Zelle liegt nach Hanert (1970) eine Ubergangszone,
in der die Fibrillen sich an der Mitte der konkaven Seite der Zellen festheften; manche
Fibrillen dringen in das Innere der Zelle ein, wo sie mit kleinen Granula enden; Balasova
(1969) ist der Ansicht, dafi die Fibrillen aus diesen Granula entstehen.
Neben fadigen Formen wurde auch eine Zoogloea-anige Wuchsform beschrieben (Perfiliev
1926, Aristovskaja 1965, Balasova 1967), die nach Perfiliev (1926) bewegliche, geifielartige
Zellen produziert.
Die Stengel wachsen verhaltnismafiig schnell. So gibt Cholodnyj (1924, 1953) an, dafi sie in
einer Stunde fast die 30fache Lange der Zelle, d. h. bis 18,0 urn erreichen. Hanert (1974)
beobachtete das Wachstum der Stengel bei Anwesenheit von Fe2+ und unter mikroaero-
philen Bedingungen. Bis zur ersten Abtrennung der apikalen Zelle betragt der Zuwachs des
Stengels 40-60 urn/St, bei gut wachsenden Kulturen sogar 80-90 urn/St. Das Wachstum des
Stengels hort nach der dritten oder vierten Teilung der Apikalzelle auf. So entsteht ein 2200-
2900 urn langer Stengel. Die Teilung der Apikalzellen der ersten Generation verlauft
synchron; in der zweiten Generation tritt schon bei der Teilung ein Zeitintervall von 2-5
Stunden auf.
Zellen mit typischem, kornigem Plasma, das sich mit alien iiblichen Farbstoffen
gut farbt. Mit Jod farbt es sich gelb bis braun. Mit 2-4 kugeligen, scharf
begrenzten, 90-260 nm grofien Granula (Elementarkorperchen) und mehreren
Granula von 30-65 nm Durchmesser.
Wahrscheinlich chemolithotroph; oxydiert zweiwertiges Eisen zu dreiwerti-
gem, wobei C02 assimiliert wird. Mikroaerophil, kann noch bei einer Konzen-
tration von 1 mg 02/l gut wachsen. Eine hohere Konzentration als 2,75 mg 02/l
inhibiert das Wachstum bereits. Optimale pH-Werte bei 6,0-7,0. Psychrophil;
oft auch bei sehr geringen Temperaturen (unter Schnee und Eis) wachsend; auch
thermophile Arten wurden beschrieben. Vermae Mangan - gleich in welcher
Form - nicht zu oxydieren. Von Balasova (1969) durchgefuhrte Versuche zeigen
jedoch, dafi unter gewissen Umstanden besonders manche Entwicklungsstadien
fahig sind, heterotroph zu wachsen oder sqgar innerhalb der Zellen der Begleit-
mikroflora zu parasitieren (Balasova und Cerni 1970).
In der lezten Zeit wurden Rein- und Anreicherungskulturen gewonnen. Hanert (1968)
isolierte eine Kultur, in der nicht naher bestimmte Pseudomonaden als Begleitmikroflora
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Gallionella • 327
vorhanden waren. Diese Mikroflora iibte auf die Kultur eisenhaltige Bakterien eine stimulie-
rende Wirkung aus, die der Autor vor allem in der Senkung des Sauerstoffspiegels erblickt.
Die typische Struktur des Organismus bildet sich nur unter bestimmten Kulturbedingungen
aus; schon eine geringe Veranderung dieser Bedingungen fiihrt zu atypischem Wachstum,
meist ohne Terminalzellen; diese kommen vor allem in Freilandfunden vor. Beim Ansetzen
des Ultrafiltrats der Kultur entstehen auf Agarboden kleine Kolonien mit polymorphen
Zellen sehr unterschiedlicher Grofie; in fliissigen Nahrlosungen sind die Zellen rund und
scheibenformig, aber ebenfalls von verschiedener Grofie. Bei Zugabe von Pferdeblutserum
zu den Nahrboden (Balasova 1969) entsteht eine fadige Wuchsform, die dem aus dem
Freiland stammenden verflochtenen Stengel von Gallionella sehr ahnlich ist und sich nur
durch einen grofieren Durchmesser des Stengels von dieser unterscheidet.
Fortpflanzung durch Querteilung der Zellen, wobei zwei kugelige, morpholo-
gisch gleiche Tochterzellen entstehen, die jeweils einen Stengel produzieren, so
dafi eine dichotome Verzweigung entsteht. Unter gewissen Bedingungen tren-
nen sich die Tochterzellen vom Stengel. Daneben kann die Vermenrung
wahrscheinlich durch laterale Knospung kleiner Zellen an den Stengelflanken, sowie
durch Bildung filtrierbarer Partikel erfolgen. Nach Hanert (1968) konnen sie
sich auch durch Fragmentation segmentierter Fibrillen im Stengel vermehren;
dies entspricht teilweise der schon von Lieske (1911) geaufierten Ansicht, nach
der sie sich durch Fragmentation der Faden in einzelne Teile fortpflanzen, die zu
neuen Individuen heranwachsen.
In der alteren Literatur wird meistens angefuhrt, dafi die Zellen unbeweglich sind oder sich,
an den Stengeln festgeheftet, langsam um ihre eigene Achse drehen. Nach Rohrer (1952) sind
die aus dem Stengel gelbsten Zellen durch eine bis zwei polar, subpolar bis lateral stehende
Geifieln aktiv beweglich. Ahnliche Ansichten veroffentlichten schon Ellis (1907) und
Teichmann (1933).
Haufig vorkommend, meist in kiihlen, verhaltnismafiig reinen, oligotrophen,
zweiwertiges Eisen enthaltenden Gewassern (Quellen, Brunnen, Wasserwer-
ken, Rohrleitungen u. a.). An Standorten, wo die Wassertemperatur von der
Umwelt beeinflufit wird, treten sie meist in den Friihlingsmonaten auf,
besonders kurz nach der Eis- und Schneeschmelze; in Brunnen und Quellen das ganze
Jahr hindurch vorhanden, oft die Gesellschaft mit Leptotbrix ochracea. Kann
durch starke Vermehrung Kalamitaten im Wasserleitungsnetz verursachen.
Aristovskaja (1964) fand die gleichen Organismen auch im Erdboden; sie nimmt
an, dafi sich der Organismus in den unteren, bisweilen eisenfreien Bodenschich-
ten, wo er manchmal in Massen vorhanden ist, an heterotrophe Ernahrungsweise
angepafit hat.
Seit der Entdeckung dieses Organismus wird in der Literatur iiber seine morphologischen
und physiologischen Eigenschaften, sowie iiber seine systematische Einreihung diskutiert.
Ehrenberg (1836) beschrieb ihn ursprunglich als eine mit der Gattung Melosira verwandte
Kieselalge; spater wurde er von mehreren Autoren als Blaualgen- oder Algenart
beschrieben. Allgemein nahm man an, dafi der schraubenformige Faden(Stengel) eine Kette von
Zellen darstellt. Griffith (1853) und spater Migula (1897) wiesen jedoch oarauf hin, dafi diese
scheinbare Gliederung des Fadens eine optische Tauschung ist. Migula (1897) machte als
erster auf zwei Formen von Stengeln aufmerksam - den bandformigen und den zylindri-
schen; Ellis (1907) hielt diese Merkmale fur ausreichend zur Aufstellung zweierselbstandi-
ger Gattungen. Cholodnyj (1953) lehnt dagegen die Existenz der zylindrischen Form als
Irrtum ab.
Balasova (1968) stellt zu dieser Gattung auch die Gattung Toxothrix. Aristovskaja (1965)
schlagt vor, auch die Gattung Seliberiaaiev einzureihen. Zavarzin (1961, 1965) stellt diese
Gattung neben die Gattung Metallogenium. Balasova (1968) und Zavarzin (1961, 1965)
machen auf einige, mit der Gattung Mycoplasma identische Merkmale aufmerksam. Walsh
und Mitchell (1973) nehmen an, dafi der gewohnlich GalUonella-Kuhuren verunreinigende
Organismus meistens ein eisenoxydierendes Metallogenium ist.
Die Systematik der bislang beschriebenen Arten beruht auf der Gestalt des Stengels. Die
Giiltigkeit einiger Arten ist zweifelhaft. In Kulturen lassen sich nur zwei Arten unterschei-
328 • Knospende Bakterien - Gallionella
den: Gallionella ferruginea und Callionella filamenta. Ein etwas kurioser Fund wird von
Schopp et al. (1965) angefuhrt: die in Pyriten gefundene fossile Art Gallionella pyritica.
Typus generis: Gallionella ferruginea Ehrenberg 1836
Wichtigste Literatur: Ehrenberg 1836, 1838, Stiebel 1839, 1841, Ralfs 1843,
Kiitzing 1844, 1849, Rabenhorst 1847, 1854, Brebisson 1853, Griffith 1853,
Kirchner 1848, Hansgirg 1888, de Toni und Trevisan 1889, Migula 1897, 1900,
Lafar 1906, Ellis 1907, 1908, Lieske 1911, Gicklhorn 1920, Naumann 1921,
Cholodnyj 1924, 1929, 1953, Enderlein 1925, Perfiliev 1926, Fair und Whipple
1927, Butkevic 1928, Palm 1933, Teichmann 1933, Beger 1937, 1949, Rippel-
Baldes 1947, Krasil'nikov 1949, Rohrer 1952, Beger und Bringmann 1953,
Rodina 1953, Skuja 1956, Vatter und Wolfe 1956, Bergey's Manual 1957, 1974,
van Iterson 1958, Vouk 1960, Perfiliev und Gabe 1961, Zavarzin 1961, 1965,
Aristovskaja 1964, 1965, Schoph et al. 1965^ Balasova 1967, 1968, 1969, Hanert
1968, 1970, 1973, 1974, Balasova und Cerni 1970, Dubinina 1969, 1970,
Mardanjan und Balasova 1971, Walsh und Mitchell 1973.
Bestimmungsschliissel der Arten
la Zellen bohnenformig 2
lb Zellen in Form von Kokken oder ovalen Stabchen 8
2a Stengel verzweigt 3
2b Stengel unverzweigt 7
3a Stengel dichotom verzweigt 4
3b Stengel in Form einerkompliziertenDolde 3. G. umbellata
4a Stengel schraubenformig gekriimmt, bandartig 5
4b Stengel nicht schraubenformig gekriimmt; kurz, dick 4. G. minor
5a Zellen klein, hochstens 2,0 [xmbreit; Stengel schmalerals die Zelle 6
5b Zellen verhaltnismafiiggrofi, 3,0-3,5 [imbreit; Stengel breiteals Zelle
5. G. major
6a Stengel aus 40 oder mehr Fibrillen bestehend; gelb bis braun gefarbt; terminal
nicht verbreitert 1. G. ferruginea
6b Stengel farblos; an der Stelle, an der die Zelle haftet, facherartig verbreitert . .
6. G. tenuicaulis
7a Stengel zylindrisch, aus 3-8 parallel angeordneten Fibrillen bestehend, die
schraubig miteinanderverflochtensind 2. D. filamenta
7b Stengel diinn, fadenartig, abwechselnd aus zickzackartigen und geraden
Abschnitten bestehend 7. G. scheminzkyi
8a Siifiwasserorganismen; Zellen in Form von Kokken; Stengel schraubig ge-
dreht, unverzweigt 8. G. infurcata
8b Meeresorganismen; Zellen in Form von ovalen Stabchen 9
9a Stengel stark schraubig gedreht, wenig verzweigt, zu netzartigen Gebilden
vereinigt 9. G. reticulosa
9b Stengel weniger schraubig gedreht, haufig verzweigt, apikal sich verjiingend
10. G. tortuosa
1. Gallionella ferruginea Ehrenberg 1838 (Fig. 198)
Gaillionella ferruginea Ehrenberg 1836, Gallionella ferruginea Ehrenberg 1838,
Monas gallionella Stiebel 1839, Gallionella spirida Stiebel 1841, Melosira ochra-
cea Ralfs 1843, Gloeotila ferruginea (Ehrenberg 1838) Kiitzing \S44,Didymohe-
lix ferruginea (Ehrenberg 1838) Griffith 1853 (sensu Fair et Whipple 1927, et
Rippel-Baldes 1947), Melosira minutula Brebisson 1853, Gloeosphaera
ferruginea Rabenhorst 1854, Spirulina ferruginea (Ehrenberg 1838) Kirchner 1878,
Spirochaete ferruginea (Ehrenberg 1838) Hansgirg 1888, Spirillium ferrugineum
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Gallionella • 329
Fig. 198. Gallionela ferruginea - a Teil eines dichotomisch verzweigten Stieles
(1000X), b-d Verlauf der Zellteilung (2500x) (nach Cholodnyj, 1926).
332 • Knospende Bakterien - Gallionella {
In Reinkultur (Balasova 1967) kultiviert; die Art behielt wahrend der Kultur
(l'/i Jahre) ihre Eigenschaften. Verhaltnismafiig seltene Art. Aus dem Wasser
von Entwasserungsanlagen in den Siimpfen des Uberschwemmungsgebietes
Jachromski in der Umgebung von Moskau (UdSSR) isoliert.
Diese Art wurde wahrscheinlich zuerst von Migula (1897) beobachtet. Dies lafit
sich aus seinen Abbildungen sowie aus der Tatsache, dafi er sie spater (Migula
1900) in die Gattung Chlamydotbrix einreihte, schliefien. Ellis (1907) hielt dieses
Taxon fiir Gallionella ferruginea, wahrend er fur die eigentliche Gallionella
ferruginea den Namen Spirophyllum ferrugineum vorschlug.
Unsichere Arten:
3. Gallionella umbellata Beger 1949
Gallionella ferruginea Ehrenberg 1838 sensu Palm 1933
Am Stengelende 5-6 nierenformige Zellen. Stengel mit 5-6 kleinen Asten, die
eine Dolde bilden. Durch weitere Zellteilung entstehen neue Dolden, so dafi
altere Kolonien aus einer einzigen, grofien zusammengesetzten Dolde bestehen.
Fortpflanzung durch Teilung in einer Ebene.
Zellen gewohnlich 1,0 \im grofi.
Vorwiegend in tropischen eisenhaltigen Gewassern vorkommend.
4. Gallionella minor Cholodnyj 1924 (Fig. 200)
Zellen denen von Gallionella ferruginea sehr ahnlich; nach der Teilung bleiben
sie langere Zeit nebeneinander liegen, so dafi sie Diplokokken-ahnliche Paare
bilden. Stengel kiirzer, dicker und gerade, dichtotom verzweigt, selten schrau-
benartig geareht; im Querschnitt biskuitformig. Altere Zellen entfernen sich
voneinander, so dafi die Zweige der Stengel einen rechten oder stumpf en Winkel
bilden. Sie sind von einer zarten gallertigen Scheide umgeben, die zahlreiche
Partikel von Eisenverbindungen enthalt; bei starkerer Inkrustierung wird die
Oberflache der Zellen dadurch rauh bis warzig. Oft ist dies nur am basalen Teil
des Stengels der Fall. Fortpflanzung durch Querteilung. Einzelne Zellen sowie
ganze Mikrokolonien unbeweglich. Entweder festgeheftet oder im Wasser frei
schwebend.
Zellen 0,5-0,6 x 1,2-1,5 \im grofi; Zweige der Stengel 20-30 \im lang.
In eisenhaltigen Gewassern und Quellen vorkommend.
Die Berechtigung der Artist sehr zweifelhaft. Nach Arbeitenvon Perfiliev und Gabe (1961)
kann durch Anderung der Wachstumsbedingungen die Wuchsform von Gallionellaferrugi-
nea in Gallionella minor verandert werden. Auch Balasova (1968) erzielte durch Anderung
der Kulturbedingungen Gallionella minor- Formen aus Gallionella filamenta -Kulturen.
Das von Krasil'nikov (1949) angefuhrte systematische Merkmal- Gallionella minor besitze
keine schraubenformig gewundenen Stengel - ist unzutreffend, da bei einem einzigen
Exemplar auf verschiedenen Zweigen sowohl schraubenformige als auch gerade bandartige
Stengel zu sehen sind. Perfiliev (1926) hielt Gallionella minor fiir eine atypische Wuchsform
von Gallionella ferruginea.
5. Gallionella major Cholodnyj 1929 (Fig. 201)
Zellen bohnen- oder nierenformig, an den Enden bandartiger, schraubig gedreh-
ter, breiter, verzweigter Stengel haftend; einzelne Zweige recht unterschiedlich
lang. Oft sind in Mikrokolonien auch anomale Riesenzellen vorhanden, die
durch Teilungshemmungen entstehen; diese Zellen haben die gleiche Gestalt wie
die normalen, sind aber ungefahr doppelt so grofi. Die Stengel, an denen sie
haften, sind entsprechend breit, obwohl sie einen Teil der Kolonie bilden, deren
iibrige Zweige normal entwickelt sind.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Gallionella • 333
Die Windungen am basalen Teil des Stengels linger als am apikalen, was
Cholodnyj (1953) auf verschiedenes Alter zuriickfuhrt.
Die Stengel erscheinen im Mikroskop wie aus Tropfen zusammengesetzt, deren
schmales Ende aus einem weiteren «Tropfen» hervorkommt. Zellen mitiiblichen
Anilinfarben gut farbbar; Stengel bleiben ungefarbt. Protoplasma mit einer oder
mehreren Vakuolen, die nach Gicklhorn (1920) Eisen (Ill)hydroxyd enthalten.
Fortpflanzung durch Querteilung; die an den Stengeln haftenden Zellen drehen
b a
201 202
Fig. 200. Gallionella minor-a Teil des Stieles, der bisher nicht mit
Eisenverbindungen impragniert ist (nach Mikrophoto umgezeichnet - Cholodnyj, 1953. -
2000x), b Teil des Stieles an dessen Basalteilen starke Inkrustationen sich
anzulagern beginnen (nach Mikrophoto umgezeichnet - Cholodnyj, 1953. -
2000 x). Fig. 201. Gallionella major-a normaJe Zelle an Stielenden, b anomale,
gigantische Zelle mit entsprechend starkem Stiel (nach Mikrophoto
umgezeichnet- Cholodnyj, 1953. -2000X). Fig. 202. Gallionellascbeminskyi (nach Vouk,
1960.-2000X).
336 • Knospende Bakterien - Planctomyces
mann (1921) unterscheidet zwei Formen. Die Form «trichoidea» hatunregelma-
fiig gebogene Faden, die sich zu grofieren Gruppen vereinigen. Identisch mit
Sideromyces glomerata Naumann 1929. Rostfarbene Flecken bildend. Die Form
«bacillaria» hat Zellen in Gestalt von Bazillen, Vibrionen oder Spirillen, die bei
dichter Anhaufung ebenfalls Faden bilden. Auf submersen Gegenstanden
rostfarbene Flecken hervorrufend. Es konnen alle Ubergangsformen zu Gallionella
ferruginea beobachtet werden.
Offensichtlich ungeniigend beschriebener, der Gattung Leptotbrix nahe stehen-
der Organismus. Nach Beger und Bringmann (1953) aus der Gattung Gallionella
auszuschliefien.
12. Planctomyces Gimesi 1924 (Fig. 204, 205, 206)
Blastocaulis Henrici et Johnson 1935, Actinothrix Novacek 1938
Charakteristische, kugelige Mikrokolonien in Rosettenform, meist aus langen,
diinnen, elastischen, geraden oder leicht gekriimmten, bei der Mehrzahl der
Arten unverzweigten Stengeln, die mit dem basalen Teil an einem gemeinsamen
Zentrum festsitzen, aus dem sie radial in alle Richtungen strahlen; an ihrem
distalen Ende sitzen ein bis zwei (selten auch drei oder mehr) Zellen; meist bilden
diese ein kurzes Kettchen, sie konnen jedoch auch in mehreren Ebenen neben-
einander liegen. Manchmal kommen auch einzelne Stengel mit nur einer Zelle
vor. Die Anzahl der Stengel in den Kolonien ist recht variabel; die Kolonie kann
bis zu 50 Individuen umfassen. Am basalen Ende des Stengels wird ein Gallert-
polster vermutet, das bislang jedoch noch nicht eindeutig nachgewiesen wurde.
Stengel wahrscheinlich von den Zellen ausgeschieden. Bei der Mehrzahl der
Arten ist der Stengel, besonders im alteren Teil, mit Eisen inkrustiert; bisweilen
auch ganze Kolonien. Zellen farblos, kugelig oder kurz ellipsoidisch, selten
bimenformig. Das Plasma erscheint homogen, jedoch farbt sich der freie Zellpol
intensiver. Auch junge Tochterzellen rarben sich intensiv. Stengel nicht
farbbar.
Wahrscheinlich heterotroph, aerob benotigt nur geringe Mengen organischer
Stoffe im Milieu. Physiologische Eigenschaften unbekannt, da keine Reinkultu-
ren erzielt werden konnten.
Fortpflanzung durch terminale, manchmal auch laterale Knospung; die Tochter-
zelle erscheint zunachst in Form einer leichten Schwellung, die sich allmahlich
vergrofiert, um schliefilich die Grofie der Mutterzelle zu erreichen. Abgetrennte
Tochterzellen sind nicht aktiv beweglich; meist gleiten sie zur Basis des Mutter-
stengels hinab, wo sie sich festsetzen und einen eigenen Stengel ausbilden. In
Siifiwasserseen, Staubecken, Teichen; saisonmafiig, am Ende des Sommers und
in den ersten Herbstmonaten auftretend. Kosmopolitisch.
Die Gattung wurde urspriinglich bei den Siifiwasserpilzen eingeordnet; Gimesi
(1924) hielt die Zellen fur Sporangien. Identisch vein Actinothrix und Blastocaulis.
Unter der Bezeichnung Blastocaulis sp. (Fig. 205) beschrieben Henrici und
Johnson (1935) einen Organismus mit keulen- bis birnenformigen Zellen, die mit
dem schmaleren Pol an ungleich langen, diinnen, manchmal auch unregelmafiig
gebogenen Stengeln festsitzen. Die Stengel setzen sich an festen Unterlagen fest,
wobei facherartige Gebilde entstehen.
Typus generis: Planctomyces bekefii Gimesi 1924
Wichtigste Literatur: Gimesi 1924, Henrici und Johnson 1935, Novacek 1938,
Razumov 1948, 1949, Krasil'nikov 1949, Ruttner 1952, Wawrik 1952, 1956,
Guseva 1955, 1956, Skuja 1956, 1964, Sokolova 1959, Fott und Komarek 1960,
Heynig 1961, 1979, Zavarzin 1961, Hortobagyi 1965, Kalbe et al. 1965, Hirsch
und Rheinheimer 1968, Hirsch 1972, Bergey's Manual 1974.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Planctomyces • 337
205 206
Fig. 204. Planctomyces sp. - Entwicklungszyklus - schematisch dargestellt
(nach Guseva, 1953, bearbeitet von Zavarzin, 1961.- 1500X). Fie. 205.
Planctomyces sp. - mit birnenformigen Zellen (nach Henrici und Johnson, 1935. -
1500X). Fig. 206. Planctomyces sp. - als einzelne Zellen mit Stengeln vorkom-
mend (nach Henrici und Johnson, 1935. - 150X).
Bestimmungsschlussel der Arten
la Kolonien aus Zellen mit Stengeln gebildet, die an einem gemeinsamen
Gallertpolster festsitzen; ohne Schleimhiille 2
lb Kolonien maulbeerartig, in eine zarte Schleimhiille eingebettet; um die
unregelmafiig geformte, wahrscheinlich aus Eisen (Ill)hydroxid bestehende
Partikel angehauft sind 5. Pi. ferrimorula
2a Zellen breiter als 0,7 (im 3
2b Zellen schmaler als 0,7 (im 7
338 • Knospende Bakterien - Planctomyces
3a Stengel bis 10 nm lang 4
3b Stengel sehr kurz; Zellen kugelig bis ellipsoidisch; Zentrum der Kolonien
stark durch Eisenverbindungen inkrustiert, die den grofieren Teil des
Stengels oderihnganz bedecken 2. PL condensatus
4a Stengel der ganzen Lange nach gleichmafiig breit, wenig inkrustiert
1. PL bekefi
4b Stengel konischverjiingt 5
5a Stengel an der Basis breiter 6
5b Stengel an der Basis schlanker; Zelle in einerVertiefungsitzend
lc. PI. bekefi (PL stranskae)
6a Stengel schlank, sich pfeilformig zum Apex hin verschmalernd, wenig
inkrustiert la. PL bekefi (PL subulatus)
6b Stengel robust, konisch, stark inkrustiert lb. PI. bekefi (PL crassus)
7a Stengel schmaler als die Zellen, mitunter dichotom verzweigt, gerade;
Kolonien meistvielzahlig 3. PL kljasmiensis
7b Stengel ebenso breit wie die Zellen, meist bogenformig; Kolonien aus
mehreren Individuen bestehend 4. PL gracilis
1. Planctomyces bekefii Gimesi 1924 (Fig. 207)-
Blastocaulis sphaerica Henrici et Johnson 1935, Actinothrix globulifera Novacek
1938, Planctomyces subulatus Wawrik 1952, Planctomyces stranskae Wawrik
1952, Planctomyces crassus Hortobagyi 1965.
Charakteristische kugelige Mikrokolonien in Form radial angeordneter, sternar-
tiger Rosetten. Aus einer gemeinsamen zentralen Basis (Hirsch und Rheinheimer
1968, vermuten die Existenz eines Gallertpolsters) laufen strahlenformig in alle
Richtungen 4-20 (ausnahmsweise bis 50) fadenformige, elastische, unverzweig-
te, gerade oder bogig gekriimmte, der ganzen Lange nach gleichmafiig breite,
scharf umrissene, farblose, verschieden lange Stengel. Oft durch Eisen
inkrustiert, die Inkrustation beginnt am altesten Teil des Stengels, d. h. an seiner
Basis, die dadurch verbreitert wird. Die Verlangerung des Stengels geht von der
Mitte der Rosette aus. Die Inkrustation kann verschieden intensiv sein und hangt
wahrscheinlich vom Alter des Organismus ab. Kolonien immer ohne Schleim-
hiille. Am distalen Teil der Stengel haften farblose, kugelige, Gonidien- oder
Exosporen-ahnliche Zellen. Meist kommt nur eine Zelle, selten auch drei oder
mehrere vor. Wenn mehrere vorhanden sind, sind sie meistens in Richtung der
Langsachse des Stengels in Form eines kurzen Kettchens angeordnet; in zentrifu-
galer Richtung nimmt die Grofie der Zellen ab. Manchmal konnen die Zellen
auch in drei senkrecht zueinander liegenden Ebenen orientiert sein. Zwischen
den Zellen ist ein deutlicher, scheinbar leerer Zwischenraum, da der verbindende
Faden schwer sichtbar ist. Es besteht jedoch eine feste Verbindung, die sich
mechanisch nur schwer unterbrechen lafit. Die Zellen konnen sich von den
Stengeln losen. Protoplasma homogen; bei Farbung zeigt sich jedoch eine
Differenzierung. In der Nahe des Stengels schwacher farbbar. Junge Zellen
intensiv, gleichmafiig farbbar. Gram-positiv, altere Zellen jedoch gram-negativ.
Wawrik (1952) nahm an, dafi sie sich nicht fixieren lassen, jedoch konnte Heynig
(1961) sie mit Erfolg mit Jodjodkaliumazetatgemisch fixieren. Kalbe et al. (1965)
stellten elektronenmikroskopisch fest, dafi die Stengel eine gezahnte Oberflache
aufweisen, und dafi aus den Zellen ultradiinne, widerstandfahige, frei endende
Faden auslaufen, die ungefahr ebenso lang wie die Stengel sind. Uber ihre
Funktion ist bislang nichts bekannt.
Physiologische Eigenschaften wenig bekannt. Aerob, oft psychrophil,
wahrscheinlich heterotroph. Nach Wawrik (1952) fordert Anwesenheit von Eisen im
Milieu das Wachstum. Reinkulturen wurden nicht erzielt. Nur aus dem Freiland
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Planctomyces • 339
bekannt, wo der Organismus bei pH Werten von 6,8-10,4 und einer Temperatur
von 6,7-23 °C wachst.
Fortpflanzung durch terminale oder laterale, oft vielfache Knospung. Entwick-
lungszyklus (nach Wawrik, 1952): Die Tocherzelle, die sich aus der Mutterkolo-
nie gelost hat, keimt zu einem kurzen Faden, dem Stengel; dieses Stadium ist
verhaltnismafiig selten zu finden. Haufiger findet man Exemplare mit zwei
Stengeln, die einen Winkel von 120° bilden. Ein dritter Stengel wachst nach
einiger Zeit wieder unter dem gleichen Winkel heran. Der vierte bildet sich
zwischen zwei Stengeln, sodafi ein asymmetrischer Stern entsteht, der sich mit
der Zeit zu einem symmetrischen Kreuz entwickelt. Schon bei einem Exemplar
mit zwei Stengeln kann die Knospung der Tochterzellen beobachtet werden. Die
erwachsenen, vom Stengel abgetrennten Tochterzellen sind wahrscheinlich un-
beweglich, desgleichen die Kolonien; sie schweben nur passiv.
Zellen 1,0-2,0 (im im Durchmesser, Stengel 0,8-1,0 (im breit und 2,7-6,0
(-10,0) nm lang. Kolonien 10,0-22,0 \nm breit.
Im Plankton in jeder Tiefe, in Siifiwasserseen, Staubecken und Teichen, am
haufigsten am Ende des Sommers und in den Herbstmonaten vorkommend, die
eine geringe Menge geloster organischer Stoffe im Wasser erfordert. Offensicht-
lich kosmopolitisch verbreitet, wegen ihrer geringen Grofie jedoch oft iiberse-
hen. Urspriinglich aus dem Plankton des Sees Lagymanyos in der Nahe von
Budapest (Ungarn) beschrieben.
Fig. 207. Planctomyces bekefii - verschiedene Ausbildung der Kolonien sowie
die terminale Entwicklung neuer Verbande (nach Skuja, 1956. - 1340X).
Gimesi (1924) meinte, dafi diese Art zu den sporulierenden Pilzen (Hyphomycetes) gestellt
werden sollte. Henrici und Johnson (1935) beschrieben diesen von ihnen im Hypolimnium
des Lake Alexander (USA) gefundenen Organismus unter dem Namen Blastocaulis
sphaerica den sie in die Ordnung Caulobacteriales einreihten.Novacek (1938) stellte die Funde aus
dem Teich Hlad bei Studenec (CSSR) und aus einem Teich in der Umgebung von Treble
(CSSR) unter dem Namen Actinothrix globulifera zu den fadenformigen Bakterien in die
Nahe der Gattung Leptothrix.
Henrici und Johnson (1935) beschrieben aufierdem einen Organismus, der in Form einzel-
ner, kugeliger, ovaler oder birnenformiger Zellen auftritt; die Zellen haben einen Stengel,
mit dem sie am Substrat festgeheftet sind. Es handelt sich wahrscheinlich um das Anfangssta-
dium der Entwicklung einer Kolonie (Fig. 206).
340 ■ Knospende Bakterien - Planctomyces
Fott und Komarek (1960) und Hirsch (1972) fiihren als Synonyme dieser Art einige weitere,
friiher als selbstandige Art en beschriebene Organismen auf, die nur unbedeutende morpho-
logische Unterschiede aufweisen:
la. Planctomyces subulatus Wawrik 1952
Kolonien aus mehreren, an der Basis breiteren, gegen das Ende pfeilformig verjiingten,
eiseninkrustierten Stengeln bestehend, an deren Scheitel kleine kugelige Zellen oder kurze
Zellkettchen haften.
Zellen 1,0-1,5 um, Stengel ungefahr 1,0 |xm breit. Mikrokolonien (nach Wawrik 1952) 8,8-
22,0 um grofl.
Diese Art wurde aus einem Fischteich (Elisateich oder Schleiferteich) in der Nahe von
Schrems (Osterreich) beschrieben, wo sie zusammen mit Planctomyces bekefii reichlich
vorkam. Auch auf Java im See Ngebel 750 m ii.d.M. und im Talbecken Tjigom Bong
(Ruttner 1952) sowie in der Umgebung von Paris (Bourelly, zit. Wawrik 1952) in dem
kleinen Talbecken Etang des Ursines im Bois de Meudon gefunden.
Fott und Komarek (1960), Hortobagyi (1965) und Hirsch (1972) sind der Ansicht, da8 die
Art in den Variationsbereich von Planctomyces bekefii fallt.
lb. Planctomyces crassus Hortobagyi 1965 (Fig. 208)
Mikrokolonien Stengel bildend, die an der Basis breit sind und sich gegen das distale Ende
konisch verjiingen. Am Ende sitzen kleine kugelige Zellen, die manchmal kurze, bis aus 7
Zellen bestehende Kettchen bilden. In einer Kolonie sind 6-16 Stengel, mit meist geraden
und glatten Wanden vereinigt. Kolonien grofkenteils kugelig, seltener ellipsoidisch; meist
stark vererzt.
Einzelne Zellen 1,3-1,7 |xm im Durchmesser; Stengel an der Basis 0,7-2,0 [un breit und bis
3,3 um lang.
Urspriinglich aus einem Teich in der Nahe von Buzsak (Ungarn) beschrieben.
Ein ahnlicher, offenbar identischer Organismus mit konischen Stengeln wurde schon von
Henrici und Johnson (1935) beschrieben; Skuja (1956) hielt diesen Organismus fur Dauer-
stadien, Novacek (1938) fur «formae diversae stati iuvenilis» von Planctomyces bekefii.
Sokolova (1959) san offensichtlich den gleichen Organismus fur einen Vertreter der Gattung
Gallionella an.
208 209
Fig. 208. Planctomyces bekefii - Form, die als selbstandige Art Planctomyces
crassus beschrieben wurde, a Zellstengel vollkommen mit Eisenverbindungen
inkrustiert (nach Hortobagyi, 1965. - 2000 x), b Individuen mit nur teilweiser
Inkrustation der Stengel (nach Novacek, 1938. - 2000 x). Fig. 209. Planctomyces
bekefii - als selbstandige Art Planctomyces stranskae beschriebene Form (nach
Novacek, 1938. -2000X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Planctomyces • 341
lc. Planctomyces stranskae Wawrik 1952 (Fig. 209)
Radial angeordnete Mikrokolonien aus keil- bis keulenformig gestalteten Stengeln, die sich
zum Scheitel hin facherartig verbreitern; die eigentlichen Zellen auf den Stengeln in einer
konkaven Vertiefung festsitzend.
Zellen ca 1,5 um breit, der Stengel im breitesten Teil 1,0 Um. Mikrokolonien erreichen
durchschnittlich 8,8-12,0 um.
Urspriinglich im Plankton eines Fischteichs bei Stojespaly in der Nahe von Kolin (CSSR)
gefunden.
Novacek (1938) hielt diesen Organismus fur eine «forma atypica» von Planctomyces bekefii.
Auch Fott und Komarek (1960) und spater Hortobagyi (1965) sind der Ansicht, da6 sein
Habitus im Bereich der Variability von Planctomyces bekefii liegt. Heynig (1961) bestimmte
unter diesem Namen unrichtig Blastobacter henricii (= Planctomycesguttaeformis). Hirsch
(1972) ist dagegen der Ansicht, da6 er in die Gattung Siderophacus gehort.
2. Planctomyces condensatus Skuja 1964 (Fig. 210)
Typische, kugelige oder leicht ovale Kolonien bildend, von deren Mitte radial
angeordnete, schleimige, sehr diinne und zarte Stengel mit kleinen kugeligen
Zellen an den Enden ausgehen. Eine Kolonie besteht meist aus 4—16 Zellen. Die
Stengel, an deren Enden Zellen festsitzen, sind sehr kurz, nur 2-3mal linger als
der Durchmesser der Zellen. Die Mitte der Kolonie ist mit einer braungelb
gefarbten Anhaufung von Eisenverbindungen (meist Eisenhydroxid)
inkrustiert; sie ist mehr oder weniger kugelig bis polyedrisch und umschliefit auch die
gallertigen Stengel, so dafi die Zellen scheinbar unmittelbar an der Eiseninkrusta-
tion haften. Einzelne Zellen kugelig, farblos, hyalin. Mit sehr glatter, zarter, und
transparenter Zellwand. Das Plasma erscheint daher homogen.
Fortpflanzung nicht genau bekannt. Die Art vermehrt sich wahrscheinlich durch
Knospung, wobei die Terminalzellen einen kurzen Auslaufer bilden, der sich
spater durch Abschniirung von den Mutterzellen trennt. Daneben Vermehrung
durch Zerfall der Mutterzellen in 2-4 Gonidien.
Kolonien entweder kugelig (5,0-7,0 |tm im Durchmesser) oder leicht oval (7,0-
10,0 |irn lang). Einzelzellen erreichen einen Durchmesser von 0,7-1,7 |tm. Der
inkrustierte zentrale Teil der Kolonie mifit meist 1,5-2,0 |tm im Durchmesser,
erreicht mitunter aber bis 4,0 pirn.
Bisher nur im Siifiwassersee Vuolep Njakajaure, Abisko (Schweden) in einer
g&
o
o
©
<b°
%.
210 a
Fig. 210. Planctomyces condensatus - a verschiedene Ausbildung der Kolonien
mit zentraler Inkrustationsbildung. Bei einigen Exemplaren terminale Entwick-
lung neuer Verbinde (nach Skuja, 1964. - 1200X), b Kolonien eines
Organismus, den Sokolova (1959) provisorisch in die Gattung Pasteuria einreihte (nach
Sokolova, 1959.- 1200x).
342 • Knospende Bakterien - Planctomyces
Tiefe von 10 m und dariiber sowie im Michigan-See (USA) gefunden. Denselben
Organismus beobachtete wahrscheinlich schon Sokolova (1959) im See Glubo-
koe in der Nahe von Moskau (UdSSR) und reihte ihn provisorisch in die Gattung
Blastobacter.
3. Planctomyces kljasmiensis (Razumov 1949) Hirsch 1972 (Fig. 211)
Gallionella planctonica Razumov 1948 in Krasil'nikov 1949, Gallionella
kljasmiensis Razumov 1949, Blastocaulis kljasmiensis (Razumov 1949) Zavarzin 1961.
Zellen klein, kugelig oder kurz ellipsoidisch, an sehr diinnen, langen Stengeln
festsitzend; ellipsoidische Zellen liegen dabei mit ihrer Langsachse senkrecht zur
Achse des Stengels. Stengel selten dichotom verzweigt; manchmal kann die
Verzweigung auch zweiter Ordnung sein. Stengel gerade, mitunterschraubenar-
tig gedreht, durchsichtig, gallertartig; zu einem gemeinsamen Zentrum konver-
gierend, so dafi sie zusammen mit den Zellen eine charakteristische, scheiben- bis
kugelformige Mikrokolonie mit strahlig angeordneten Stengeln bilden. In einer
Mikrokolonie sind 5-50 Zellen vorhanden. Die Stengel sind gewohnlich merk-
lich schmaler als der Durchmesser der Zellen; durch Eisenverbindungen inkru-
stiert. Kolonien aus Oberflachenschichten des Wassers verhaltnismafiig wenig
inkrustiert; jene aus den unteen Schichten (vom Grund) zeigen jedoch starke
Inkrustationen; ihre Oberflache ist grob, rauh; die Stengel sind bisweilen leicht
Fig. 211. Planctomyces kljasmiensis - verschiedene Kolonien in Wasserproben
aus Oberflachen- und Bodenschicht (nach Razumov, 1949. - 1600X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Planctomyces • 343
gekriimmt. Protoplasma mit Karbolerythrosin gut farbbar, bei manchen Indivi-
duen farbt sich der dem Stengel anliegende Teil der Zelle nicht. Stengel mit
Erythrosin nicht farbbar, gibt jedoch positive Berlinerblau-Reaktion.
Physiologische Eigenschaften bislang unbekannt; es ist nicht klar, ob die Eisen-
ablagerung mit Energiegewinn verbunden ist oder vollig unabhangig vom Meta-
bolismus des Organismus verlauft. Nur aus dem Freiland bekannt und beschrie-
ben; tritt am haufigsten in den Sommermonaten bei einer Wassertemperatur von
14—23 °C und bei pH Werten von 7,0-8,5 auf. Wahrscheinlich aerob bis
mikroaerophil, auch noch bei einer Sauerstoffkonzentration von 0,7 mg/1 vor-
kommend. Reinkulturen bisher nicht erzielt.
Fortpflanzung durch Knospung (Guseva 1955, 1956). Tochterzellen nicht aktiv
beweglich, nur von der Wasserstromung getragen oder zur Stengelbasis gleitend
und so eine seesternartige Kolonie bildend.
Zellen 0,3-0,5 \im breit, mitunter auch grofier; Stengel schmaler. Kolonien
erreichen einen Durchmesser von 8,0-20,0 [im.
Im Planktom von Siifiwasserseen und in Staubecken, manchmal in Massen
vorkommend; nach Razumov (1949) erreicht die Konzentration bis zu 8000
Individuen in 1 1 Wasser). Urspriinglich im Kljazminer Staubecken am «Kanal
imeni Moskva», nordlich von Moskau (UdSSR), wo die Art reichlich in alien
Horizonten vorhanden war, gefunden. Sokolova(1959) fand im See Glubokoe in
der Nahe von Moskau einen ahnlichen Organismus, den sie provisorisch als
Gallionella sp. bezeichnete. Aus einem gemeinsamen Zentrum gehen strahlenar-
tig einige, ca. 5,0-7,0 [im lange, an der Basis wesentlich verbreiterte Stengel
hervor, die an den Enden 1,5 X 2,5 |irn grofie Zellen tragen. Anzahl der Stengel
verschieden. Stengel eiseninkrustiert. Bedarf noch weitererUntersuchungen. Es
handelt sich jedoch offensichtlich um eine als Planctomyces crassus beschriebene
Form von Planctomyces bekefii.
4. Planctomyces gracilis Hortobagyi 1965 (Fig. 212)
Sehr diinne, lange, meist bogen- bis sichelformige, selten gerade Stengel, die zu
3-5 vereinigt, Rosetten bilden. Stengel der ganzen Lange nach so breit wie die
kleinen kugeligen Zellen, von denen je eine (selten bis drei) an ihren Enden
festsitzt.
Zellen 0,3-0,6 [im grofi, Stengel 0,3-0,4 [im breit und bis 11,0 um lang.
Urspriinglich im Herbst in Teichen bei Buzsak (Ungarn) gefunden.
Art unsicherer systematischer Stellung:
5. Planctomyces ferrimorula Wawrik 1956 (Fig. 213)
Kugelige, farblose oder hell blaugriine Zellen bilden unregelmafiig angeordnete,
dicht gehaufte, maulbeerartige Kolonien, die in eine zarte Schleimhulle einge-
bettet sind. Zu der Kolonie liegen regelmafiig gestaltete, wahrscheinlich aus
Eisen(III)hydroxid bestehende Partikel, die eine geschichtete Struktur aufwei-
sen; sie losen sich vollig in 10%iger HC1 auf. In grofieren Kolonien mit 100 oder
mehr Individuen sind die Zellen so zusammengedrangt, dafi sie deformiert
werden. Zellen selbst nicht mit Eisen(III)hydroxid inkrustriert, altere Kolonien
konnen jedoch davon bedeckt sein. Eine organische Verbindung der Zellen mit
der Mitte der Kolonien (etwa durch Stengel) wurde niemals festgestellt. Oft sind
anfiingliche Entwicklungsstadien - kleine schleimige Flocken - zu finden, in
denen je eine Partikel von Eisen(III)hydroxid und eine Zelle dicht nebeneinander
liegen. Manchmal kommen auch Kolonien mit einer grofieren Anzahl (2-3)
zentraler Partikel vor, offensichtlich das Endstadium der Entwicklung. Die
Schleimkapsel ist bei negativer Farbung des Praparats deutlich sichtbar.
Physiologische Eigenschaften unbekannt. Wahrscheinlich heterotroph, aerob.
344 • Knospende Bakterien - Pasteuria
Fig. 212. Planctomyces gracilis - verschiedene Kolonien (nach Hortobagyi,
1965. - 2500X). Fig. 213. Planctomyces ferrimorula - a-e Kolonienentwick-
lung, g-h verschiedene Kolonien; in der Mine der Kolonien Partikeln von Eisen
(III) - Hydroxid (nach Wawrik, 1956. - 2500 x).
Einzelne Zellen 0,5-1,5 \im breit; eisenhaltige zentrale Granula erreichen einen
Durchmesser von 1,0-8,0 \im (am haufigsten 4,0-5,0 \im, in seltenen Fallen 7,0-
8,0 urn). Durchmesser der Kolonien (12,0)-15,0-20)0 pun.
In Teichen des Waldviertels (Osterreich) in ca. 1000 m Hohe ii.d.M. gefunden.
Besonders im Niveau des Wasserspiegels, im Sommer, bei einer Wassertempera-
tur von 13-14 °C. Diese Art ist im Aussehen Planctomyces condensatus sehr
ahnlich, die sich jedoch durch die Anwesenheit von Stengeln und die geringere
Zellzahl sowie die fehlende Kapsel unterscheidet. Sie erinnert auch an die
Blaualge Aphanothece microsphaera, die Ruttner (1952) im Sundsee fand.
Die Zuordnung zur Gattung Planctomyces ist problematisch. Hirsch (1972) ist
der Ansicht, dafi es sich um eine vollig selbstandige, neue Gattung handelt.
Bedarf weiterer Untersuchungen.
13. Pasteuria Mecnikov 1888, emend. Hirsch 1971
Zellen fast kugelig, ovoid, birnenformig oder keilformig; am breiteren Ende ab-
gerundet, am schmaleren zugespitzt und mit einem sehr kurzen Gallertstengel
(Gallertpolster), mit dem der Organismus am Substrat oder an den Zellen
anderer Individuen haftet. Es entstehen so trauben- oder blumenkohlartig
gelappte Kolonien, die unter bestimmten, bisher unbekannten Bedingungen in
kleinere Kolonien oder einzelne Zellen zerfallen. Zellen ohne Pigmente; Reak-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Pasteuria • 345
tion auf Gram-Farbung bisher nicht eindeutig bestimmt. Am breiteren Zellpol
optisch weniger dicht und daher heller. In der alteren Literatur wird angegeben,
dafi Endosporen gebildet werden, die sich ahnlich wie die Basidiosporen der
Basidiomyceten abtrennen.
Aerobe, chemoorganotrophe Organismen mit Respirationsmetabolismus, die
eine Reihe von Zuckern als Kohlenstoff- und Energiequelle verwerten. Staley
(1973) erzielte zwar Isolate, doch beruhen die bisherigen Beschreibungen auf
Funden aus dem Freiland. Friiher hat man angenommen, dafi sie sich durch
Langsteilung der Zellen (wodurch lappenformige Mikrokolonien entstehen)
oder durch Endosporen vermehren. Hirsch (1971) betrachtet die knauelformi-
gen Gebilde (Mikrokolonien) als Anhaufungen flacher Kristalle; als einzige
Vermehrungsart gibt der Knospung an, die terminal oder seitlich am abgerunde-
ten Zellende erfolgt.
Obwohl in der alteren Literatur angegeben wird, dafi sowohl die Kolonien als
auch Zellen in alien Stadien unbeweglich sind, berichtet Staley (1973), dafijunge,
von der Mutterzelle abgetrennte Knospen mittels einer am breiteren Zellende
entspringenden polaren Geifiel beweglich sind. Sokolova (1959) fand im Glubo-
koe-See, Moskauer Gebiet (UdSSR), einen Organismus, den sie provisorisch in
diese Gattung einreihte; in der Mine der Kolonie der kugelformigen Zellen
befindet sich ein mit Eisenoxiden gesattigter Gallertklumpen. Es handelt sich
offenbar um den gleichen Organismus, der spater als Planctomyces condensatus
Skuja 1964 beschrieben wurde (Fig. 210b).
Wichtigste Literatur: Mecnikov 1888, Zobell und Allen 1933, Henrici und
Johnson 1935, Zobell und Upham 1944, Krasil'nikov 1949, Bergey's Manual
1957, 1974, Sokolova 1959, Hirsch 1972, Staley 1973.
Eine einzige Art:
Pasteuria ramosa Mecnikov 1888, emend. Hirsch 1971 (Fig. 214)
Mit den Merkmalen der Gattung.
Zellen nach alteren Literaturangaben 1,0-2,0 x 4,0-5,0 \im grofi; nach Bergey's
Manual (1974) 1,0-5,0 x 3,0-6,0 um.
Kommt in den Mund- und Korperhohlen von Siifiwasserkrustaceen vor, fur die
sie wahrscheinlich pathogen sind. Urspriinglich in Daphniapulex und Daphnia
magna gefunden und danach beschrieben. Hirsch (1972) fand ahnliche
Organismen auf Daphnien aus dem Lake Erie (Sud-Michigan, USA) und aus England.
9 #99^ § &0$
Fig. 214. Pasteuria ramosa -Entwicklungszyklus (nach Bergey's Manual, 1974).
Staley (zit. in Bergey's Manual 1974) berichtet iiber morphologisch ahnliche
Bakterien, die an submersen Gegenstanden festgeheftet waren. Auch Hennci
und Johnson (1935) fanden im Alexander-See (Minnesota, USA), auf submersen
Objekttragern solche Formen. Zobell und Allen (1933) und Zobell und Upham
(1944) entdeckten sie auch im Meer.
Nach Migula (1900) gehort die Gattung Pasteuria zu den Myxomycetes oder Mvxobacteria-
les. Henrici und Johnson (1935) weisen auf die Ahnlichkeit mit der Blaualge Cbamaesiphon
hin. Sie beschrieben einige weitere Typen, die irrtumlich in die Gattung Pasteuria eingeord-
net wurden. Zavarzin (1961) stellte jedoch auf Grund sorgfaltiger Studien fest, dafi sie mcht
zu dieser Gattung gehoren und stellte sie darum in die neue Gattung Blastobacter. Staley
(1973) diskutiert die Verwandtschaft von Pasteuria ramosa und Blastobacter benricii und
bezweifelt die Berechtigung der Gattung Blastobacter.
Wenig bekannte Organismen; bedurfen weiterer Untersuchungen.
14. Seliberia Aristovskaja et Parinkina 1963
Fur die Organismen dieser Gattung sind stemartige Zellagglomerate charakteri-
stisch. Morphologisch sind sie den Mikrokolonien von Planctomyces kljasmien-
sis (= Gallionella planctonica) auffallend ahnlich, unterscheiden sich jedoch von
dieser vor allem dadurch, dafi die radialen Teile der Gebilde aus langen,
schraubenartig gedrehten stichartigen Zellen gebildet werden. In der Mitte der
sternartigen Formationen befindet sich manchmal eine kugelformige bis ovale
Zentralzelle.
Die distalen Teile der schraubenartigen Zellen tragen eine oder mehrere (gele-
gentlich sogar Trauben) runde generative Zellen, deren Durchmesser grofier als
der der Mutterzelle ist. Nach dem Auftreten dieser generativen Zellen sterben die
Mutterzellen grofkenteils ab. Die generativen Zellen keimen, wachsen zu Stab-
chen heran und lassen neue Rosetten entstehen; manchmal vermehren sie sich
durch Knospung und es entstehen so Zoog/oea-artige Formationen. Unter
bestimmten Umstanden konnen bei einer Art die Zellagglomerate machtige
Ablagerungen von Eisenverbindungen aufweisen.
Chemoorganotrophe, fakultativ anaerobe Organismen, die zu ihrem Wachstum
keine organischen Wuchsstoffe brauchen. Sie wachsen auf speziellen Nahrbo-
den, die organo-minerale Komplexe von Huminstoffen enthalten, auf Bodenex-
trakten, agarisiertem Wasser oder sehr stark (lOfach) verdiinnten iiblichen
Kulturmedien (Bouillon, Pepton u. a.). Optimaltemperatur betragt 24-
25 °C.
Vermehrung hauptsachlich durch Knospung der Tochterzellen (Generativzel-
len) an den Enden der strahlig angeordneten, schraubenartig gedrehten
Mutterzellen in den Rosetten. Unter bestimmten, bisher unbekannten Bedingungen
entstehen generative Zellen auch durch Querteilung der Zellenden in der
Rosette. Die «generativen» Tochterzellen sind eine Zeitlang mittels einer polaren
Geifiel beweglich; es sind kurze Stabchen, die gleichfalls schraubenartig gedreht
sind.
Bisher wenig bekannte, wahrscheinlich sowohl im Boden als auch im SiiiSwasser
sehr verbreitete Organismen.
Typus generis: Seliberia stellata Aristovskaja et Parinkina 1963
Wichtigste Literatur: Aristovskaja und Parinkina 1963, Aristovskaja 1964,
Gromov 1964, Hirsch und Pankratz 1970, Sanzieva und Zavarzin 1971, Savelje-
va und Nozevnikova 1972, Hirsch in Bergey's Manual 1974.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
seiiDem • **/
Bestimmungsschlussel der Arten
la Zellen 0,5-0,7 |Ambreit:ausschliefilichchemoorganotropherOrganismus . .
1. S. stellata
lb Zellen nur 0,3 \im breit; Organismus mixotroph; vermag CO und H2 zu
oxydieren 2. S. carboxydyhydrogena
1. Seliberia stellata Aristovskaja et Parinkina 1963 (Fig. 215)
Lange stabchenformige Zellen, die im Elektronenmikroskop wie schraubenartig
gedrehte Seile aussehen. Ihre Grofie hangt von den Wachstumsbedingungen ab.
In einem Milieu mit Organo-Mineral-Komplexen von Fulvosauren sind sie
betrachtlich lang, in einem Milieu mit Ulminosaure kurz. In den meisten Fallen
bilden sie Rosetten, von denen fadenartige Zellen nach alien Richtungen aus der
gemeinsamen Mitte ausgehen. Daneben kommen seltener selbstandige, meistens
mittels einer polaren Geifiel bewegliche Zellen vor; bisweilen treten unregelma-
fiige Zellen auf, die Mykobakterien ahnlich sind oder auch Zellen, die Tendenz
zu dichotomer Verzweigung zeigen. Bei den Rosetten fanden Aristovskaja und
Parinkina (1963) keine lokomotorischen Organellen, jedoch beschrieb Gromov
(1964) das Vorkommen von Geifieln.
Protoplasma mit Erythrosin gut farbbar; kornig.
Die Rosetten kommen in drei Typen vor: bei dem einen bilden sich etwa nach 7-10 Tagenan
den Enden der radial angeordneten Zellen (durch Knospung) ovale oder kugelformige
generative Zellen. Ihr Durchmesser ist gewohnlich grofier als der der Mutterzelle. Vereinzelt
entstehen sie auch an den Lateralseiten der Zellen. Sie werden meist einzeln, selten auch zu
2-3 in einer Reihe liegend gebildet. In der Mitte der Rosette kann man eine ovale oder
kugelige Zelle sehen, von der strahlenartig stabchenformige, schraubig gedrehte Zellen
ausgehen. In ihrer Form und Grofie erinnert sie an neu entstehende Zellen an den distalen
Enden der stabchenformigen Zellen. Die Zentralzelle ist besonders gut bei solchen Rosetten
zu sehen, deren Oberflache von abgelagerten Eisenverbindungen bedeckt ist. Nach dem
Entstehen der generativen Zellen sterben nach einiger Zeit die Mutterzellen ab und autoly-
sieren. Die losgelosten generativen Zellen schwimmen fort, wachsen heran und beginnen
nach einiger Zeit zu knospen. Dabei erscheint an einem Pole zuerst ein kleiner Auswuchs,
der sich allmahlich zu einer Tochterzelle entwickelt, die mit der Mutterzelle verbunden
bleibt. An der Basis der Tochterzelle entwickelt sich nun ebenfalls eine Knospe, die zu einer
neuen Tochterzelle auswachst; der Prozefi wiederholt sich so lange, bis ein zweiter
Rosetten-Typ ohne Zentralzelle entsteht. In manchen Fallen wachst die generative Zelle
gleichzeitig in verschiedenen Ebenen, sodafi eine wenigzellige kleine Rosette entsteht, in der
sich die generative Zelle zu einer Zentralzelle entwickelt (Rosette des ersten Typs).
Gleichzeitig mit den geschilderten Rosetten-Typen kommen aufierdem Rosetten vor, die
aus Zellen zusammengesetzt sind, die mit einem Pol in der gemeinsamen Mitte vereinigt
sind, ohne jedoch miteinander verbunden zu sein. Der Mechanismus der Bildung dieser
Rosetten ist nicht klar. Alle Typen der Rosettenbildung sind Glieder eines Entwicklungs-
zyklus, der bisher ungeniigend bekannt ist.
Auf Nahrboden fur saprophytische Mikroben wachst die Art nicht, nur auf
lOfach verdiinnter Bouillon oder Peptonwasser, in denen sie eine gleichmafiige
Triibung bildet, an der Rosettengebilde und einzelne Zellen beteiligt sind. Auf
festen Nahrboden der gleichen Zusammensetzung bildet sie einen trockenen
weifien «Anflug» aus sehr kleinen Zellea(l,0-2,0 |xm), die aus vielen Individuen
zusammengesetzte Rosetten bilden. Die Morphologie der Zellen, die auf diesen
Boden wachsen, ist jedoch von der der Zellen des natiirlichen Milieus verschie-
den. Die Zellen haben oft eine unregelmafiige Form; bisweilen bilden sie lange
Faden. Generative Zellen werden gewohnlich nicht gebildet. Den natiirlichen
Verhaltnissen ahneln Nahrboden mit Organo-Mineral-Komplexen der Humin-
, iiuren, auf denen der Organismus anfangs in Form punktartiger, farbloser
I Kolonien wachst, die aus einer grofien Anzahl von 5—10 oder mehr Zellen
i enthaltenden Rosetten bestehen; diese Rosetten sind Asterbliiten ahnlich.
I Akkumulierung von Eisenverbindungen findet nur in Anwesenheit einer beglei-
i
348 • Knospende Bakterien - Seliberia
Fig. 215. Seliberia stellata - Typ einer sternformigen Kolonie mit Zentralzelle
(nach Elektronen-Mikrophoto umgezeichnet, Aristovskaja, 1964. - a 4000X, b
2000X), c Typ einer sternformigen Kolonie mit Zentralzelle; an den Enden der
strahlenformig angeordneten Zellen entstehen kokkenartige Tochterzellen (nach
Aristovskaja, 1964. - 2000X), d Reproduktionszelle mit Geifieln; auffallige
schraubenformige Struktur (nach Elektronen-Mikrophoto umgezeichnet -
Hirsch und Pankratz, 1970 - 10000X).
tenden Mikroflora statt, zu der haufig Arten der Gattung Pedomicrobium
gehoren. Reinkulturen zeigen gewohnlich keine Ablagerungen von Eisenverbin-
dungen.
Aufier durch Knospung, bei der die oben erwahnten generativen Zellen
entstehen, vermehrt sich diese Art auch durch Querteilung der vegetativen Zellen in
den Rosetten; in einer bestimmten Entfernung von der Rosettenmitte bildet sich
in der Zelle eine Querwand; die so entstandene Tochterzelle bleibt einige Zeit
mit der Mutterzelle verbunden, beginnt dann sich hin und her zu bewegen, bis
sie sich von der Mutterzelle lost und mit Hilfe einer polaren Geifiel aktiv
wegschwimmt. Sie hat eine charakteristische, polar angeordnete Innenstruktur
(wahrscheinlich Kernapparat).
Zellen 0,5-0,7 x 1,0-12,0 \xm grofi.
Gewohnlich ein Bodenorganismus, der an der Umbildung von Humus beteiligt
ist. Urspriinglich aus dem Boden isoliert. Hirsch und Pankratz (1970) fiihren den
Fund eines ahnlichen Organismus aus einer eisenhaltigen Quelle in Michigan
(USA) an. Hirsch berichtet in Bergey's Manual (1974) iiber Funde aus einem
Behalter mit destilliertem Wasser und aus einem kleinen Waldteich.
Aristovskaja (1964) beschrieb eine etwas abweichende Form aus dem Waldbo-
den der Tundra, die nicht ganz vollkommene Rosetten bildet und bei der es
haufiger zur Knospung generativer Zellen kommt, die dann an den Enden der
vegetativen Zellen ganze Trauben bilden. Bevor sie entstehen, verdickt sich das
ganze Zellenende; mit der Zeit trennen sich die Tochterzellen ab und wachsen zu
Stabchen oder bilden, wenn sie weiter knospen, ein Zoog/oea-artiges Gebilde,
das aus kugelformigen Zellen verschiedener Grofie zusammengesetzt ist. Es
handelt sich wahrscheinlich urn eine selbstandige Art.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Blastobacter • 349
2. Seliberia carboxydohydrogena Sanzieva et Zavarzin 1971
Kleine, leicht gekrummte, gramnegative Stabchen verschiedener Lange. Sie
bilden charakteristische Rosetten, die dadurch entstehen, dafi sich die Stabchen
an einer gemeinsamen Basis festheften. Bewegliche Zellen oval; gewohnlich
kiirzer als die unbeweglichen Zellen. Schraubenformig gedreht, so dafi sie
seilartig aussehen. An einem Pol ist ein Klappchen aus adhasivem Material
vorhanden.
Mixotropher Organismus, der CO und H2 zu oxydieren vermag. Er wachst in
einer C0+O2-Atmosphare jedoch langsamer als in einem Gemisch von H2 + 02.
Von organischen Kohlenstoff- und Energiequellen werden nur einige organische
Sauren (grofkenteils Bestandteile des Krebs-Zyklus) verwertet. Auf Alkoholen
und Zuckern wachst er nicht. Typisch oligotroph; hohe Konzentrationen
organischer Stoffe werden nicht vertragen. Vermehrung durch Knospung der
Tochterzellen, die mittels einer langen subpolaren Geifiel lebhaft beweglich
sind.
Zellen 0,3 x 0,8-2,0 \im grofi.
Wurde aus einer Belebtscnlammlage zur Reinigung von Stadtabwassern in der
Ljubiner Klaranlage «Mosocistovod», Moskva (UdSSR) isoliert.
15. Blastobacter Zavarzin 1961 (Fig. 219)
Reife Zellen stabchenformig, keilformig oder keulenformig, manchmal leicht
gebogen oder tropfenformig. Einige Individuen vereinigen sich mit dem schma-
leren Pol an einer gemeinsamen Basis. Conti und Hirsch (1965) und Zavarzin
(1961) nehmen die Existenz eines Gallertpolsters an. Dadurch bilden sie einfache
Rosetten; in deren Mitte sich gewohnlich ein glanzender Korper befindet. Ohne
Stiele. Das breitere Ende der Zellen ist auffallig abgerundet. Bildet weder Sporen
noch andere Ruhestadien. Im Protoplasma sind nach Farbung abgerundete
Granula deutlich sichtbar. Physiologische Eigenschaften bisher wenig bekannt.
Optimales Wachstum erfolgt in Zonen mit reduziertem Eisen und bei pH 6,2.
Vermehrung nur durch Knospung. Tochterzellen (Knospen) kugelig bis ovoid,
klein; sie werden am breiteren Zellpol gebildet. Henrici und Johnson (1935)
nahmen irrtumlicherweise an, dafi sie sich durch Langsteilung vermehren, wobei
Rosetten entstehen.
Diese wenig bekannten Organismen wurden urspriinglich ohne nahere Artbestimmung zur
Gattung Pasteuria gestellt. Zavarzin (1961) reihte sie in seine neue Gattung Blastobacter ein,
in die er als Blastobacter sp. auch zwei wenig bekannte, ungeniigend beschriebene
Organismen aufnahm, die sich von der Hauptart etwas unterschieden. Es sind dies einerseits
Fig. 219a) kurze Stabchen (0,5-1,1 x 1,2-2,6 um grofi), an deren Basis sich ein grofies
acherartiges Gallertpolster befindet, zum anderen eine Form (Fig. 219b), deren Zellen sich
an einem Ende verjiingen; diese Enden nehmen auch schlechter Farbstoffe an. Zellen nach
den Abbildungen 0,5, 12 x 0,7-2,8 um grofi.
Eine weitere Form, die nach Zavarzin (1961) zur Gattung Blastobacter gehort, beschrieb
Sokolova (1959) als Pasteuria sp. Sie bedarf jedoch ebenso wie die vorhergehenden Formen
weiterer Untersuchungen. Hochstwahrscheinlich handelt es sich aber um den spater als
Planctomyces condensates beschriebenen Organismus (Fig. 210b).
Typus generis: Blastobacter henricii Zavarzin 1961
Wichtigste Literatur: Henrici und Johnson 1935, Zobell und Upham 1944,
Sokolova 1959, Kriss 1959, Heynig 1961, 1979, Zavarzin 1961, Conti und
Hirsch 1965, Hortobagyi 1965, Whittenbury et al. 1970, Hirsch 1972, Namsa-
350 • Knospende Bakterien - Blastobacter
raev und Zavarzin 1972, Bergey's Manual 1974, Hajdn 1974, Miiller 1977,
Loginova und Trocenko 1979, Schmidt und Starr 1979.
Bestimmungsschlussel der Arten
la Bildet keine Rosetten 2
lb Bildet Rosetten, scheidet keine Polysaccharide extrazellular aus; Kolonien
auf Agar mit Glukoseweifi l.B.henrici
2a Hat immer (oder manchmal) Kapseln; reduziert N03 zu N02, scheidet
extrazellular Polysaccharide aus 3
2b Hat keine Kapseln; reduziert N03 nicht zu N02; scheidet Polysaccharide
nicht extrazellular aus 2. B. denitrificans
3a KolonienaufAgar mit GlukoseweifijverwertetQ-Stoffe
3. B. capsulatus
3b KulturenaufAgarmitGlukosegelb;verwertetkeineC2-Stoffe
4. B. viscosus
1. Blastobacter henricii Zavarzin 1961 (Fig. 216)
Planctomyces guttaeformis Hortobagyi 1965
Zellen stabchenformig oder oval bis keilformig, zu charakteristischen Rosetten
vereinigt. Gramnegativ. Keine Kapseln bildend; extrazellulare Polysaccharide
werden nicht ausgeschieden.
Streng aerob, chemotroph. Als einzige Kohlenstoff- und Energiequellen dienen
organische Cn-Stoffe, nicht jedoch CpStoffe. Hydrolisiert keine Zellulose,
Starke und Gelatine. Nitrate werden zu Nitriten reduziert. Als optimale Wachs-
tumstemperatur benotigt er 36 °C; toleriert Temperaturen zwischen 13 und
43 °C. Optimaler pH-Wert 6,9. Kolonien auf Agar mit Glukose sind weifi
gefarbt.
Vermehrung durch Knospung; Tochterzellen unbeweglich. Reife Zellen 0,7-1,0
X 2,0-4,5 |im grofl; nach Miiller (1977) 0,6-0,8 X 1,5-2,3 (Am, knospende
Tochterzellen 0,3 [Am im Durchmesser.
Kommt verhaltnismafiig haufig in Plankton von Gewassern mit Eisengehalt und
geringer Konzentration organischer Stoffe, in Waldbachen, Talsperren, Seen,
Teichen u. a. vor. Urspriinglich vom Alexander-See (Minnesota, USA) aus 13 m
Tiefe von Henrici und Johnson (1935) beschrieben. Zobell und Upham (1944)
und Kriss (1959) fanden sie auch in grofieren Tiefen im Ozean. Zavarzin (1961)
erhielt eine Anreicherungskultur aus einem Waldbach mit eisenhaltigem Wasser
aus Nordrufiland.
Namsaraev und Zavarzin (1972) nehmen an, da6 diese Art mit Methylosinus trichosporium
Whittenbury 1970 (Fig. 218) identisch ist, die Median als einzige Kohlenstoff- undEnergie-
quelle verwerten kann.
Wegen geringer morphologischer Unterschiede (die physiologischen sind nicht untersucht
worden), ist die Art mit einem von Hortobagyi (1965) beschriebenen Organismus zu
vereinigen, von dem Hortobagyi annimmt, da6 es sich um einen Pilz handelt:
la. Planctomyces guttaeformis Hortobagyi 1965 (Fig. 217)
«Sporangiophoren» sind tropfenformig; im Myzel sind 3-7 «Sporangiophoren», die mitden
verjiingten Enden in der Mitte des Myzel zusammentreffen. Breitere Enden abgerundet; an
ihnen bilden sich kugel- bis tropfenformige «Sporen», die mit der breiteren Seite anhaften.
Aus ihnen kann ein neues Myzel hervorgehen, das noch mit dem Muttermyzel verbunden
ist. «Sporangiophoren» 1,0-1,6 X 2,8-4,7 um grofi.
Urspriinglich in Teichen bei Buzsak (Ungarn) gefunden.
Heynig (1961) fand wahrscheinlich denselben Organismus in einem Teich in Hayn bei
Stolberg, Harz (DDR), wo er in grofier Zahl gleichzeitig mit Planctomyces bekefii und
starker gruner Vegetationsfarbung auftrat. Terminal waren die Zellen dieses Organismus
stark licntbrechend und ohne knospende Tochterzellen; die Zelloberflache einiger Exempla-
re war verschieden stark mit Eisenverbindungen inkrustiert. Stark inkrustierte Individuen
waren braun gefarbt. Einzelne Zellen etwa 1,0 um breit, Koloniendurchmesser 5,0-6,0 \ua.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Blastobacter • 351
Fig. 216. Blastobacter henrici - einzelne Zellen und verschiedene Rosettenfor-
men; an einigen Zellen knospende Tochterzellen (nach Henrici und Johnson,
1935, und Zavarzin, 1961. 2500x). Fig. 217. Organismus als Planctomyces
guttaeformis beschrieben; an den Zellpolen der Rosetten bilden sich neue
Tochterzellen bis Tochterrosetten (nach Hortobagyi, 1965. - 2500X). Fig. 218.
Organismus, der als Methylosinus trichosporium beschrieben wurde - a Zellro-
setten (nach Mikrophoto umgezeichnet - Namsaraev und Zavarzin, 1972. -
2500X), b Zellrosetten, an deren Apikalenden Tochterzellen knospen (nach
Mikrophoto umgezeichnet - Whittenbury et al., 1970. - 2500X). Fig. 219. Zwei
verschiedene Organismen nach Henrici und Johnson (1935) beschrieben, die
Zavarzin (1961) als nicht naher bestimmte Art in die Gattung Blastobacter
eingereiht hat.
Kolonien grofitenteils mit 5-10 Zellen. Wurde irrtiimlich als Planctomyces stranskae be-
zeichnet, worauf schon Hortobagyi (1965) aufmerksam machte.
Nach Hirsch (1972) ist die Einordnung dieses Organismus in die Gattung Planctomyces
uberhaupt fraglich; er halt ihn fur eine wohl selbstandige Gattung. Dafiir spricht auch die
Arbeit von Hajdu (1974), deren Ergebnisse von Heynig (1979) bestatigt werden. Beide
352 • Knospende Bakterien - Blastobacter i
Autoren fanden bei diesem Organismus auf den apikalen Polen der Zellen charakteristische
Stacheln mit einem Durchmesser von 0,1-0,2 nm und bis zu 12 ^uri Lange. Dadurch
unterscheidet er sich wesentlich von der Gattung Planctomyces, bei der bisner ahnliche
Bildungen nicht beschrieben wurden. Hajdu (1974) betrachtet diese Stacheln als Prostheken
und mochte daher den Organismus in die Gattung Hyphomicrobium stellen. Weitere
Einzelheiten zur Ultrastruktur dieses Organismus erbrachten die Untersuchungen von
Schmidt und Starr (1979). Sie betrachten ihn vorlaufig als einen Morphotyp der «Blastocau-
lis-Planctomyces-Gruppe*. Zur definitiven taxonomischen Einordnung dieses Organismus
sind jedenfails weitere Studien erforderlich.
2. Blastobacter denitrificans Miiller 1977
Zellen stabchenformig bis ovoid; gramnegativ weder Rosetten noch Kapseln
bildend. Polysaccharide werden nicht extrazellular ausgeschieden.
Streng aerob, chemotroph. Verwertet als einzige Kohlenstoff- und Energiequel-
le Methanol, Formiat, Formamid, aufierdem zahlreiche C„-Stoffe. Zellulose,
Starke und Gelatine werden nicht hydrolysiert. Nitrate werden zu molekularem
Stickstoff reduziert. Optimale Wachstumstemperatur 41,2 °C, Temperaturbe-
reich 13-46 °C. Optimaler pH-Wert 6,8-7,2.
Kolonien auf Agar mit Glukose sind weifi gefarbt. Vermehrung durch Knos-
pung; junge Tochterzellen sind beweglich. Zellen 0,6-0,8 X 1,5-2,3 \im grofi.
3. Blastobacter capsulatus Miiller 1977
Zellen stabchenformig oder ovoid; keine Rosetten bildend. Gramnegativ.
Tochterzellen unbeweglich. Zellen in eine ausgepragte Kapsel eingeschlossen. Schei-
det Polysaccharide nicht extrazellular aus. Streng aerob, chemoorganotroph. Als
einzige Kohlenstoffquelle dienen organische Cn-Stoffe, nicht jedoch C,-Stoffe.
Zellulose, Starke und Gelatine werden nicht hydrolisiert. Nitrate werden zu
Nitriten reduziert. Zum Wachstum benotigt er Temperaturen von 13—46 °C,
wobei 27 °C das Optimum ist. Optimaler pH-Wert 7,3-7,8.
Kolonien auf Agar mit Glukose sind weifi gefarbt. Vermehrung durch Knos-
pung, Tochterzellen unbeweglich. Zellen 0,7-0,9 x 1,5-2,3 \im grofi.
4. Blastobacter viscosus Loginova et Trocenko 1979
Pleomorphe, unbewegliche, gramnegative Stabchen. Manchmal kommen Mi-
krokapseln vor. Keine Rosetten bildend. Zytoplasma enthalt Ribosomen, Va-
kuolen und Polyphosphat-Kornchen. Einzelne Zellen sich farblos, Zellsuspen-
sion dagegen durch nicht naher bestimmtes Pigment gelb gefarbt.
Streng aerob, mit lithotrophem wie auch organotrophem Metabolismus. Methy-
lotroph; Methanol wird in einer Konzentration von 0,5-1,0 (4,5)% als einzige
Kohlenstoff- und Energiequelle verwertet. Schwaches Wachstum auch auf
anderen CrStoffen (Methylamin, Dimenthylamin, Formiat u. a.), aufierdem
auch auf Cn-Verbindungen (Alkoholen, Sacchariden, organischen Sauren).
Wachsen nicht auf Azetat, Propionat, Zitrat und L- oder DL- Aminosauren. Als
Stickstoffquelle dienen Amoniumionen, Pepton und die meisten Aminosauren.
Gelatine, Starke und Milch werden nicht zersetzt. Lithotrophes Wachstum in
Wasserstoff-, Sauerstoff- und C02-Atmosphare moglich. Nitrate werden zu
Nitriten reduziert. Beim Wachstum auf Methanol und Glukose wird ein aus
Galaktose, Glukose, Rhamnose, Xylose und glukuronischen Sauren zusammen-
gesetztes Heteropolysaccharid synthetisiert, das extrazellular ausgeschieden
wird. Optimale Wachstumstemperatur 28-30 °C; pH 6,8-7,2.
Auf festen Medien bilden sich abgerundete konvexe, glanzende, undurchsichti-
ge, glatte und schleimige Kolonien mit ungeteilten Rand. In fliissigen Medien
erfolgt homogenes Wachstum; in alten Kulturen bildet sich ein schleimiges
Sediment.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Angulomicrobium • ii>i
Vermehrung durch Knospung an verschiedenen Stellen der Zelle. Die Bildung
der Tochterzelle beginnt dadurch, dafi eine zytoplasmatische Membran in die
Zellwand hineinwachst; darauf folgt die Abtrennung einer ovalen unbewegli-
chen Zelle. In reichen Kulturen kommt es infolge unvollstandiger Trennung der
Tochterzellen zu pleomorphen Gebilden.
Zellen 0,5-0,9 x 1,0-3,2 |wri grofi.
Eine Kultur wurde aus dem Belebtschlamm des Bajkal - Zellulose - Papier -
Kombinats (UdSSR) isoliert.
16. Angulomicrobium Vasil'eva et al. 1979
Unbewegliche polygonale Zellen mit radialer Symmetrie in Form eines regelma-
fiigen Tetraeders mit abgerundeten Enden; einzeln oder paarweise, gramnegativ.
Weder Sporen noch andere Ruhestadien bildend. Zellwand typisch fur
gramnegative Bakterien: sie besteht aus einer aufieren dreischichtigen Membran, einer
rigiden Schicht, und immer aus einer dreischichtigen zytoplasmatischen
Membran. Die inneren zytoplasmatischen Membransysteme liegen in Form von
Schlingen der Wand an.
Aerober, chemotropher Organismus mit Respirationsmetabolismus. Als
Kohlenstoff- und Energiequelle werden verschiedene Karbohydrate, Aminosauren,
organische Sauren una Alkohole verwertet. Der Typenstamm vermag auf
Glukose als einziger Kohlenstoff- und Energiequelle onne besondere Wachstums-
faktoren zu wachsen; die iibrigen Stamme benotigen zum Wachstum Hefeex-
trakt. Karbohydrate mit komplizierten Molekiilen werden nicht verwertet,
sondern nur Monosaccharide. Der Typenstamm kann Methanol und Formiat
sowie Stoffwechsel von methylotrophen Bakterien als Nahrungsquelle ver-
wenden.
Benotigt zum Wachstum eine Temperatur von 15-35 °C, wobei das Optimum
bei 28-30 °C liegt. Optimaler pH-Wert 6,8-7,0.
Kolonien auf festen Medien sind weifi, abgerundet, schleimig und mit Perlmut-
terglanz.
Vermehrung durch Knospung an der Spitze des Tetraeders. An der Mutterzelle
bildet sich anfangs ein koniscner Auslaufer, der sich allmahlich in eine Tpchter-
zelle verwandelt. Wenn diese die Grofie der Mutterzelle erreicht hat, bildet sich
ein Septum, wodurch die Tochterzelle abgetrennt wird. Dann knospen beide
Zellen wieder an der Trennungsstelle, so dafi ihre Polaritat erhalten Dleibt.
Vorkommen im Schlamm, Torf und Sufiwasser.
Wichtigste Literatur: Whittenbury und Nicoll 1971, Namsaraev und Zavarzin
1972, 1974, Stanley et al. 1976, Lafickaja und Vasil'eva 1976, Vasil'eva et al.
1979.
Eine einzige Art:
Angulomicrobium tetraedrale Vasil'eva et al. 1979
Mit den Merkmalen der Gattung
Bei den Zellen des Typenstammes («Tetraedron») ist eine Tetraederseite 1,1-
1,5 |xm lang, bei dem Stamm 1109 dagegen 0,9-1,2 urn.
Morphologisch dem Bodenmikroorganismus Stella humosa sehr ahnlich, von
dem er sich nur durch Knospung und gewisse physiologische Eigenschaften
unterscheidet.
Die Gattung wurde anhand der Eigenschaften des Typenstammes Z-2821 beschrieben, der
aus der Biozonose von methylotrophen methanoxydierenden Bakterien unter dem Arbeits-
namen «Tetraedron» (Namsaraev und Zavarzin 1972) isoliert wurde. Vergleichsstudien
haben gezeigt, dafi er mit dem Stamm NCHB 1755, den Whittenbury und Nicoll (1971) aus
354 • Knospende Bakterien - Metallogenium
reinem Wasser isolierten, nahezu identisch ist; er erhielt den Arbeitsnamen "Mushroom-
shaped bacterium». Ebenso sind die aus Schlamm isolierten Stamme WAL-4 und WAL-13
(Stanley et al. 1976) damit identisch.
Vasil'eva et al. (1979) stellen zu dieser Gattung auch den Stamm 1109, den Lafickaja und
Vasil'eva (1976) aus dem Torfschlamm iiberfluteter Wiesen des Moskva-Flusses isolierten,
und der sich etwas von dem Typenstamm unterscheidet. Die Zellen haben die Form eines
flachen Tetraeders mit abgerundeten Spitzen. Die Zellwand besitzt keine rigide Schicht,
dafur ist die Mittelschicht der Aufienmembran ungewohnlich dick. Zum Unterschied von
dem Typenstamm verwertet er auch Disaccharide, nicht aber Methanol und Glycerol.
Gelatine wird nicht hydrolysiert. Beim Wachstum auf Glukose als einziger Kohlenstoff-
und Energiequelle benotigt er Wachstumsfaktoren (Hefeextrakt). Bei der Knospung ent-
steht eine Tochterzelle immer an einer Spitze der tetraedrischen Mutterzelle.
Wenn auch zwischen diesen Stammen bestimmte Unterschiede bestehen, werden sie von
Vasil'eva et al. (1979) nicht als zwei selbstandige Arten angesehen.
Gattungen unsicherer systematischer Stellung:
17. Metallogenium Perfiliev 1952 (Fig. 220)
Polymorphe Orgamsmen mit sehr kompliziertem, bislang noch unvollkommen
beschriebenem Entwicklungszyklus. Die typischsten una am haufigsten gefun-
denen Formen bilden auffallende, stern- oder spinnenartige bis lappige Mikro-
kolonien; sie bestehen aus einem zentralen plasmatischen zonobiotischen «K6r-
per», aus dem einzelne radial angeordnete, mehr oder weniger gebogene Faden
ausgehen, die sich gelegentlich (Perfiliev 1951) verzweigen. Die Faden sind an
dem Ende, mit dem sie mit dem zentralen Gebilde verbunden sind, breiter als an
den Apikalenden, die sich konisch verjiingen. Zavarzin (1961, 1963, 1964) und
Zavarzin und Epichina (1963) stellten elektronenmikroskopisch fest, dafi die
Mikrostruktur dieser Organismen aus zwei Hauptteilen besteht: aus diinnen
Faden (Araios) und kleinen, kugeligen, lateral auf dem Araios keimenden Zellen;
diese Kokken konnen wieder zu Faden auskeimen. Aufier diesen typischen
Kolonien bilden sie unter gewissen Umstanden Zoog/oea-artige Kolonien, die
aus vielen miteinander verflochtenen und gedrehten Faden bestehen.
Mikrokolonien zeigen gewohnlich starke Ablagerungen von Manganoxiden und
sind deshalb braun bis schwarz gefarbt. Die Ablagerung der Oxiden beginnt im
Zentrum der Mikrokolonien und an der Basis des Araios; daher sind die Faden
am basalen Teil wesentlich dicker; bei intensiver Krustenbildung entstehen so
lappige Gebilde. Zur mikroskopischen Beobachtung mussen die Krusten in
verdiinnter (0,2-1,0%) Oxalsaure aufgelost werden. Plasma farblos, in Anwe-
senheit von Mangan stark lichtbrechend. Gramreaktion unbekannt. Mit Karbol-
gentianaviolett gut, mit Methylenblau (alkoholischen, sowie wassriger Losung)
sowie Gentiana- oder Kristallviolett relativ schwach farbbar.
Physiologische Eigenschaften bisher nicht genau bekannt. Manganverbindun-
gen werden stark, Eisen wahrscheinlich iiberhaupt nicht oxydiert. Ein hetero-
tropher Organismus, dessen Wachstum durch die Anwesenheit lebender
Hyphen nicht naher identifizierter Pilze sowie durch Manganverbindungen stimu-
liert wird. Es vermag jedoch in Reinkulturen ohne diese Stimulantien- allerdings
sehr langsam - zu wachsen; doch sind dann komplexe Medien mit Pferdeblutse-
rum una Starke, die zur Kultur von Mycoplasma beniitzt werden, erforderlich.
Die Reaktion des Mediums mufi annahernd neutral sein und zwischen pH 6,0-
7,8 liegen.
Manchmal verbleiben die Knospen am Mutterfaden und keimen zu einem Araios
aus; so entstehen Tochtermikrokolonien zweiter bis vierter Ordnung. Bei
alteren Kulturen entstehen durch Fragmentation des Endes des Araios Kettchen
von kokkenartigen Zellen, die sich auch durch wiederholtes Knospen der noch
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Metallogenium • 355
Fig. 220. Metallogenium sp. - Entwicklungsschema: a kleinste Kokkenformen,
b Fadenform - «Araios», c am «Araios» knospende Tochterzellen, d Rosetten-
ebilde, e lappenformiges Gebilde,/spateres Stadium des lappenformigen Ge-
ildes in Rosettenform, g grofte Kokkenzelle, h Knospung von Tochterzellen
an kokkenformigen Zellen, i Fragmentation des Zellinnaltes in kleine
Kokkenformen.
am Faden festsitzenden kokkenartigen Zelle bilden konnen. Durch Kombina-
tion beider Vorgange konnen verzweigte Zellkettchen entstehen. Pleomorphe,
lappige oder spinnenartige Mikrokolonien, die oft mit Manganoxidablagerungen
bedeckt sind, entstehen durch vielfach wiederholte Keimung. In Mischkulturen
mit Pilzhyphen kommen sehr haufig kugelige Zellen sehr unterschiedlicher
Grofie vor. Sie entstehen auf fadigen Formen und vermehren sich entweder
durch Keimune oder durch Umwandlung grofier Zellen in eine Art Sporangium,
dessen Inhalt durch Fragmentation des Zytoplasmas eine grofie Zahl kleiner
Kokken bildet, die nach dem Platzen der Zellwand der Mutterzelle frei werden.
Bei Knospung oder Fragmentation der kugeligen Zellen entstehen oft Zoogloea-
356 • Knospende Bakterien - Metallogenium
artige Zellaggregate. Manchmal kommen ziemlich grofie kugelige Zellen mit
Vakuolen vor. Dubinina (1970) halt diese fiir Involutionsformen.
Aufierdem entstehen durch Zerfall grofier abgeflachter Zellen filtrierbare, unter
0,1 [Am grofie Granula (Dubinina 1969). Die Granula wachsen in fliissigen
Nahrlosungen nach einigen Tagen zu Zellen von normaler Grofie heran, die oft
unregelmafiig gestaltete Zellhaufen bilden.
Die Tochterzellen-Knospen sind nach Loslosung vom Mutterfaden beweglich
und zwar nach Perfiliev und Gabe (1961) wohl mit Hilfe von Geifieln; jedoch
wurden diese noch nicht nachgewiesen.
Auf der nordlichen Halbkugel weit verbreitete Organismen. In den unteren
Schlammschichten und im Plankton von Siifiwasserseen und Teichen, sowie im
Erdboden gefunden. Wahrscheinlich von betrachtlicher Bedeutung bei der
Bildung von Manganerzen.
Nach Walsh und Mitchell (1973) kann auch zweiwertiges Eisen oxydiert werden. Toleriert
niedrige pH-Werte; wachst optimal bei pH 4,1 und bildet mit Eisen inkrustierte Faden ohne
den charakteristischen zentralen zoenobiotischen «K6rper». Organismus ist ein gewohnli-
cher Begleiter in Gallionella-Kulturen, was dazu beitrug, da6 einige seiner Eigenschaften
irrtumlicherweise einer ungewohnlichen Form der Gattung Gallionella zugeschrieben
wurden.
Die taxonomische Einordnung dieser Gattung ist vollig unklar. Einzelne Auto-
ren (Skerman 1967, Balasova 1968, 1969, Dubinina 1969, 1970) weisen auf den
Zusammenhang mit der Ordnung Mycoplasmatales, besondern mit der Gattung
Acholeplasma hin.
Typus generis: Metallogenium personatum Perfiliev 1959
Wichtigste Literatur: Perfiliev 1952, 1959, Guseva 1955, 1956, Aristovskaja
und Parinkina 1961, Perfiliev und Gabe 1961, Zavarzin 1961, 1963, 1964,
Aristovskaja 1963, Zavarzin und Epichina 1963, Kossaja 1967, Skerman 1967,
Balasova 1968, 1969, Dubinina 1969, 1970, Mircik et al. 1970, Gorlenko und
Kuznecov 1971, Bergey's Manual 1974.
Bestimmungsschlussel der Arten
la Gerade oder leicht gebogene, unverzweigte, zum Apex hin verjiingte Faden,
in denen nach Auflosung der Manganoxide die Zellstruktur erkennbar ist.
Anwesenheit von lebenden Pilzhyphen zum Wachstum nicht unbedingt
erforderlich 1. M. personatum
lb Faden ziemlich stark gebogen, gekrummt, verzweigt. Ohne Zellularstruk-
tur. Nur in Anwesenheit lebender Pilzhyphen, Hefe oder anderer Bakterien
wachsend 2. M. symbioticum
1. Metallogenium personatum Perfiliev 1959 (Fig. 221)
Metallogenium invisum Perfiliev 1952
Polymorpher Organismus; die Struktur liegt an der Grenze der Auflosung des
Lichtmikroskops und kann nur mit dem Elektronenmikroskop beobachtet
werden. Nach Perfiliev und Gabe (1961) in vier verschiedenen Entwicklungssta-
dien vorkommend, die sich vor allem durch die Struktur der Mikrokolonien
unterscheiden. Das erste, verhaltnismafiig wenig bekannte Stadium bilden
einzelne, mit Hilfe von Geifieln bewegliche, kokkenartige Zellen. Das zweite,
trichospharische, am haufigsten vorkommende Stadium entsteht dadurch, dafi
Kokken zu Faden (Araios) auskeimen, die strahlenformig aus dem zonobioti-
schen Zentrum hervorkommen. Wahrend des weiteren Wachstums entstehen
scheibenformige, lappige, oft polyspharische Mikrokolonien mit einer Anzahl
von Tochtermikrokolonien. An den Faden bilden sich durch Knospung terminal
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgrambler.
Metallogenium • 357
oder lateral wieder kugelige Zellen. Die Faden der jungen trichospharischen
Mikrokolonien tragen manchmal an ihren Enden begeifielte Zellen und schwe-
ben frei im Plankton. Meistens wachsen sie jedoch zu einer lappigen Mikrokolo-
nie heran. Das dritte Stadium entsteht dadurch, dafi die lappigen Auswiichse sich
allmahlich zu einer einzigen kompakten Masse verbinden, an deren Oberflache
reichlich Manganverbindungen abgelagert werden.
Die Mikrokolonien sind rund und hockerig. In diesem Stadium ist der lebende
Organismus oft schwer zu erkennnen. Manchmal ragen lange Araios aus ihm
heraus, auf denen neue trichospharische Stadien entstehen. Das vierte Stadium
ist Zoogloea-anlg. Es unterscheidet sich von den iibrigen deutlich durch die
geringe Koharenz der Kolonien, die entweder aus mehr oder weniger breiten,
flachen, verzweigten Fadenbiindeln oder aus einschichtigen, Zoogloea-anigen
Gebilden mit unregelmafiigen Konturen entstehen. Alle Stadien konnen auch
unmittelbar aus beweglichen Zellen hervorgehen und diese wieder bilden. Aufier
diesen Stadien nehmen Perfiliev und Gabe (1961) noch ein fiinftes, ein Ruhesta-
dium, an, in dem sich grofte kugelige lichtbrechende, bewegliche Zellen bilden.
Aerob, heterotroph, benotigt offensichtlich eine ganze Reine von Wuchsstoffen,
die von Pilzen erzeugt werden oder durch Zersetzung von Pilzhyphen entstehen
und durch komplexe, Serum und hydrolisierte Starke enthaltende Nahrlosungen
ersetzt werden konnen. Fortpflanzung iiberwiegend durch Knospung, wobei
manchmal bewegliche Zellen entstehen.
Grundelemente (Kokken) im Durchmesser selten 0,02 ^m, am haufigsten 0,03-
0,05 [im. In Kettchen vorkommende Zellen gewohnlich 0,03-0,25 ^m im
Durchmesser, sporangienartige Zellen 0,5-0,6, selten 0,8 |Am. Araios ca. 0,02-
0,25 [Am breit, Lange 1,0-2,0, selten 5,0 |Am. Die Anwesenheit von Mangan
stimuliert das Langenwachstum bis zu 12,0 |«n. Zonobien konnen im Durch-
Fig. 221. Metallogenium personatum - an den Fadenenden knospen Tochterzel-
len oder bilden sich Kolonien der zweiten Ordnung; schematisiert (nach
Zavarzin, 1961. - 2500x). Fig. 222. Metallogenium symbioticum - drei verschiedene
Ausbildungen der Kolonien; schematisiert (nach Zavarzin, 1961. - 2500X).
358 • Knospende Bakterien - Metallogenium
messer nach Dubinina (in Bergey's Manual 1974) 10 ^m, nach Perfiliev und
Gabe (1961) bis 1 mm erreichen.
Weit verbreitet; iiberwiegend in der oberen, oxydierten Schlammschicht, oder
auf der Schlammoberflache in Siifiwasserseen, Staubecken und Teichen vorkom-
mend. Ebenfalls im Plankton. Im Meer bisher noch nicht gefunden. Urspriing-
lich aus dem Schlamm des Sees Ukshezero (im Siiden derKarelo-finnischen SSR)
beschrieben. Diese Organismen konnen nach Guseva (1956) im Plankton in
grofier Zahl auftreten, bis zu 8 Millionen Individuen in 1 ml Wasser. Aristovska-
ja und Parinkina (1961) isolierten sie aus dem Erdboden, wo sie sich unmittelbar
auf den Hyphen von Pilzen entwickeln.
Nach Mircik et al. (1970) soil er am haufigsten als Begleitmikroflora der Hyphen folgender
Pilze auftreten: Coniothyrium fuckelii, Mycogone nigra, Fusarium kiihni, Altemaria geophi-
la, Cephahsporium sp. und weitere sterile Myzelien. Die Pilze verlieren gewohnlich inren
charakteristischen Habitus. Dubinina (1970) gibt an, da6 er auch auf anderen Pilzen oder
Bakterien (parasitisch?) vorkommen kann. Gorlenko und Kuznecov (1971) berichten iiber
Funde im See Kononer (UdSSR) in einer Tiefe von 22,5 m, wo der Organismus ausschliefi-
lich auf Oscillatoria prolifera parasitiert (?).
In Bergey's Manual (1974) wird Metallogenium personatum als Leptothrix
echinata angesehen.
2. Metallogenium symbioticum Zavarzin 1961 (Fig. 222)
Polymorpher Organismus mit mehreren Entwicklungsstadien. Das Grundsta-
dium bilden einzelne kugelige Zellen, die nach der Abtrennung vom Mutterfa-
den beweglich sind. Es ist unklar, ob sie eine Geifiel besitzen. Nach einiger Zeit
wachst aus der kugeligen Zelle, deren Oberflache von abgelagerten Manganver-
bindungen rauh ist, der Faden (Araios) heraus, der nach Zavarzin (1963) die
Grundstruktur des Organismus bildet. Faden gerade, mehr oder weniger gebo-
gen, jedoch niemals schraubenformig gedreht. Ohne Zellularstruktur. Verein-
zelt wachsen aus der Zelle parallel mehrere Araios hervor. Es entstehen dann
rund um die Faden Krusten von Manganoxiden, die spater eine zusammenhan-
gende Scheide bilden. Da der Faden standig weiterwachst, ist er am Ende diinn,
ohne Inkrustationen, wahrend er sich zur Basis hin konisch verbreitert. Die
Scheide kann an der Basis bis 10 mal breiter sein als der eigentliche Faden. Dieses
Stadium kommt verhaltnismafiig selten vor. Haufiger treten Mikrokolonien des
trichospharischen Stadiums mit radial angeordneten Araios auf, die aus dem
zentralen «K6rper» der Kolonien hervorkommen; dieser wird wahrscheinlich
von einer zonobiotischen Anhaufung kugeliger, von Manganoxidablagerungen
bedeckter Zellen gebildet. Die aus dem Zentrum kommenden Faden befinden
sich gewohnlich in verschiedenen Wachstumsstadien. Allmahlich verwandelt
sich dieses Stadium in eine mehr oder weniger formlose, chaotische Anhaufung
von Zellen und stark verkrummten, betrachtlich manganinkrustierten Faden, in
der die Struktur nur sehr schwer zu erkennen ist. Die Inkrustierungen fullen
auch den Raum zwischen Faden und Zellen aus.
Aerob, mesophil, heterotroph. Benotigt zum Wachstum pH-Werte zwischen
6,0-8,0 (Optimum 6,8-7,2) sowie Polysacharide (Starke, Glykogen, Zellulose,
Agar, Inulin, Gummiarabikum) in hoheren Konzentrationen. Glukose wird
schon in geringen Konzentrationen verwertet. Oxydiert Manganverbindungen
energisch, jedoch nur in sehr geringen Konzentrationen; hohere
Konzentrationen werden schlecht vertragen. Wachst am besten auf schwer loslichen Salzen,
z. B. Mangan(II)karbonat oder Mangan(II)oxalat in einer Konzentration bis
0,02%. Kossaja (1967) bewies, dafi die Oxydation von Mangan von der Lebens-
tatigkeit des Organismus abhangt und nicht durch Autooxydation bewirkt wird.
Kupferspuren stimulieren das Wachstum schon in einer Konzentration von
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Caulococcus • 359
0,1 ng CuS04. Der Einflufi der iibrigen oligodynamischen Elemente ist unbe-
deutend. Fur das Wachstum ist die Anwesenheit von symbiotischen sterilen
Pilzhyphen, die bisher noch nicht naher bestimmt werden konnten, unentbehr-
lich. Ohne Pilzhyphen, bzw. ohne andere Bakterien vermag der Organismus
nicht zu wachsen. Parasitismus in Form von intrazellularem Wachstum wird
angenommen.
Kolonien auf Agarboden mit konzentrischer Struktur; es wechseln Zonen, die
iiberwiegend von Pilzhyphen gebildet werden, mit solchen ab, die Manganorga-
nismen aufweisen. Zonotien von Metallogenium haben in diesen Kolonien eine
mehr oder weniger spindelformige Gestalt. In flussigen Nahrlosungen mit 2%
Starke oder 1-2% Gummiarabikum langsam wachsend. Zunachst wachsen die
Pilzhyphen, spater entwickeln sich die Kokken des Manganorganismus, die die
Kulturflussigkeit triiben. Wahrend des Wachstums keimt aus den Kokken ein
Araios, das allmahlich durch Manganoxide inkrustiert wird; es entsteht so ein
Prazipitat, das am Boden des Kulturgefafies sedimentiert.
Fortpflanzung durch Knospung. Knospen der Tochterzellen lateral, seltener
terminal auf dem Araios entstehend, und auf einem kurzen Stiel festsitzend.
Nach einiger Zeit losen sie sich ab und werden beweglich.
Bewegliche Zellen etwa 0,5-1,0 |tm grofi. Araios an der Basis 1,0-2,0 ^m, am
Terminalende 0,1 \m\ dick. Mikrokolonien einige Dutzend \>m im Durch-
messer.
Im Schlamm von Siifiwasserseen, in Staubecken, Sumpfen, sowie in Erdboden
vorkommend. Urspriinglich in Sumpfen in der Umgebung von Moskau
(UdSSR) gefunden.
18. Caulococcus Perfiliev 1959
Kleine kugelige, von Gallerte umgebene Zellen, durch sehr feine, manchmal
dichotom verzweigte Faden miteinander verbunden. In derMehrzahl Zoogloea-
artige Gebilde (Mikrokolonien) bildend, die meistens mit Mangan- und Eisen-
verbindungen inkrustiert sind. Mikrokolonien verschieden gestaltet; am
haufigsten kommen stark inkrustrierte, schwarze, unregelmafiig gestaltete bis runde
Kolonien mit zahlreichen kokkenartigen Zellen vor; weniger haufig sind radial
gelappte Kolonien mit einer geringen Zahl von Kokken; verhaltnismafiig selten
treten kugelige Kolonien mit fadiger Struktur auf. Der Rand der Kolonien ist oft
durch dichotom verzweigte Faden gefurcht. Farbung nach Gram unbekannt.
Mikroaerophil, iiberwiegend Mangan (80-90%), in geringerem Mafie gleichzei-
tig auch Eisen (10-20%) oxydierend. Reinkulturen wurden nicht erzielt. Nur
aus unmittelbarer Beobachtung in den Mikrokapillaren des Peloskops bekannt
(Perfiliev und Gabe 1961). Fortpflanzung durch Knospung. Komplizierte,
olymorphe Entwicklung. Einzellige Stadien (Knospen) sind eine Zeitlang
eweglicn; Bewegungsweise bisher jedoch unbekannt.
Die Gattung wurde urspriinglich ohne Angabe der Art beschrieben (Perfiliev
1959).
Wichtigste Literatur: Perfiliev 1959, 1964; Perfiliev und Gabe 1961; Zavarzin
1961; Bergey's Manual 1974.
Eine einzige Art:
Caulococcus manganifer Perfiliev 1964
Mit den Merkmalen der Gattung.
Einzelne Zellen mit 0,5 |tm Durchmesser, die die Zellen verbindenden Faden
0,1 um breit; Mikrokolonien einen Durchmesser von 1,3 mm erreichend.
Urspriinglich im See Khepo-Jarvi (Karelo-finnische SSR) in unteren Erzablage-
360 • Knospende Bakterien - Kusnezovia'
rungen gefunden. Haufig in der oberen Schlammschicht unmittelbar iiber der
Reduktionszone oder im Wasser direkt iiber der Schlammoberflache in Siifiwas-
serseen vorkommend.
Wenig bekannter Organismus unklarer systematischer Stellung. Nach Zavarzin
(in Bergey's Manual 1974) soil es sich wahrscheinlich um eine weitere Art der
Gattung Metallogenium handeln. Hirsch (in Bergey's Manual 1974) stellt ihn in
die Nahe von Acholeplasma. Zavarzin (1961) hielt die die Zellen verbindenden
Faden fur ein Artefakt.
19. Kusnezovia Perfiliev 1959
Kokkenartige oder kurz ellipsoidische Zellen, einschichtige Zoog/oe^-artige
Mikrokolonien bildend, in denen die Zellen mittels feiner Faden miteinander
verbunden sind. Mikrokolonien mit Hilfe eines kurzen Stiels festsitzend; von
aufierordentlich veranderlicher Gestalt: pfeilformig razemos, an denThallus der
Flechte Cetraria islandica erinnernd, manchmal auch an ein Maiglockchenblatt
oder an ein kurzstieliges Glas mit gesagtem Rand; bisweilen keulen- oder
kandelaberformig. Faden in Mikrokolonien aus einer Reihe ovaler, kleiner
Korperchen bestehend. Mikrokolonien reichlich mit Mangan- und Eisenverbin-
dungen inkrustiert. Farbung nach Gram unbekannt. Mit Karbolgentianaviolett,
nach vorherigem Auflosen der Mangan- und Eisenablagerungen mit verdiinnter
Oxalsaure, gut farbbar.
Physiologische Eigenschaften wenig bekannt. Mikroaerophiler Organismus,
dessen Wachstum durch verwesende Pilzhyphen stimuliert wird. Mangan und
Eisen wird energisch oxydiert; es ist bisher nicht bekannt, ob bei diesem Vorgang
Energie gewonnen wird. Reinkulturen wurden nicht erzielt. Nur aus unmittel-
barer Beobachtung im Peloskop bekannt.
Fortpflanzung wahrscheinlich nur durch Knospung, die in den maiglockchen-
blattformigen, reichlich kokkenartige Strukturen enthaltenden Mikrokolonien
beobachtet wurde. Komplizierte Entwicklung in mehreren Stadien. Junge Zell-
knospen beweglich. Ursache der Bewegung unbekannt. Im Schlamm, schwarze
horizontale Zonen bildend, ziemlich selten vorkommend.
Gattung urspriinglich ohne Angabe der Art beschrieben.
Wichtigste Literatur: Perfiliev 1959, 1964; Perfiliev und Gabe 1961; Aristovs-
kaja 1963; Bergey's Manual 1974.
Eine einzige Art:
Kusnezovia polymorpha Perfiliev 1964
Mit den Merkmalen der Gattung.
Kokken 0,5-1,5 |xm breit; die sie verbindenen Faden ungefahr 0,1-0,2 ^m im
Durchmesser.
Urspriinglich in Schlammproben aus dem See Ukshezero (Karelo-finnische SSR)
in Laboratoriums-Rohkulturen gefunden.
Nach Aristovskaja (1963) kann die Bildung von Faden eine Reaktion des
Organismus auf die spezifische Umwelt von (Schlamm oder Boden) sein; der
Organismus ist bemuht, mit dem Faden jenen Raum zu iiberbriicken, in dem
keine Nahrstoffe mehr vorhanden sind und sich schadliche Stoffwechselproduk-
te angehauft haben. Nur junge Zellen ernahren die Kolonien, denn die alten
Zellen sind durch die Metallablagerungen gegen die Umwelt isolieft.
20. Gemmiger Gossling et Moore 1975
Kugelige oder tropfenformige Zellen, sehr oft in Paaren vorkommend, in denen
eine Zelle wesentlich grofier ist als die andere, so dafi das ganze Gebilde einem
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Chamaesiphonosira • 361
Kegel oder einer unsymmetrischen Hantel ahnelt. Oft kommen auch Ketten mit
8-10 Zellen vor, in denen die unsymmetrischen Paare durch kleinere Zellen
miteinander verbunden sind. Einzelzellen oder verlangerte Zellen kommen nur
gelegentlich vor. Junge Zellen sind gramnegativ, altere grampositiv. Die Zell-
wand ist typisch fur gramnegative Bakterien. Zwischen den Zellpaaren befinden
sich Querwande. Bilden keine Sporen. Besitzen keine Geifieln, sind unbeweg-
lich.
Streng anaerob, chemoorganotroph mit fermentativem Metabolismus. Als Koh-
lenstoff- und Energiequelle dient eine Reihe von Sacchariden (meist Glukose,
Fruktose und Maltose), die zu organischen Sauren (besonders Ameisen- und
Buttersaure) bis zu einem pH-Wert von 5,0-5,4 fermentiert werden. Fermen-
tiert auch Milchsaure und Aminosauren. Hydrolysiert keine Eiweifistoffe und
Lipide. Reduziert nicht Nitrate.
Vermehrung wahrscheinlich durch Knospung, wobei die Tochterzelle sich
abschnurt. Vorkommen in Fakalien gesunder Menschen oder im Darminhalt
von Huhnern; von dort Einschleppung in Oberflachengewasser oder Abwasser
moglich.
Wichtigste Literatur: Gossling und Moore 1975
Eine einzige Art:
Gemmiger formicilis Gossling et Moore 1975
Mit den Merkmalen der Gattung.
Die grofieren Zellen in den unsymmetrischen Paaren 0,6-1,2 um im Durchme-
ser, die kleineren 0,2-0,8 um; 1,0-2,3 um lang.
Taxonomische Stellung des Organismus bisher nicht klar. Gossling und Moore
(1975) schlagen vor, inn in die Familie Veillonellaceae zu stellen, deren
Definition durch die Einreihung von Organismen, die sich durch Knospung teilen,
zu erganzen ware.
21. Chamaesiphonosira Geitler 1975
Leicht kegelformige, langgestreckte, farblose Zelle, gerade oder schwach-gebo-
gen mit dem breiteren, leicht abgestutzten basalen Ende festsitzend. Voll
entwickelt besteht ein Individuum aus einem schwach kegeligen strickartigen
Teil, der mit seiner breiteren abgerundet-abgestutzten Basis festsitzt und an
seiner freien Spitze Knospen abschnurt, die bis zu 30 eine Kette bilden. Der
Tragerteil kann aber auch viel friiher zur Knospenbildung ubergehen, so dafi es
Individuen gibt, die scheinbar nur aus Knospen bestehen. Manchmal treten
Jugendformen auf, deren Basalteil noch nicht die typische Dicke und oft auch
nicht die kegelige Gestalt erreicht hat, aber schon Knospen bildet. Die Art der
Anheftung ist unklar; manchmal scheint es ein winziges knopfchenformiges
Polster zu sein. Eine Zellwand ist nicht erkennbar. Im Hinblick auf die geringe
Zellgrofie ist die Zellstruktur lichtmikroskopisch nicht zu beobachten.
Kommt als sehr spezialisierter Organismus auf Diatomeenschalen vor. Leere
Schalen abgestorbener Diatomee, die oft reichlich vorhanden sind, sind niemals
bewachsen, was besagt, dafi der Epiphyt zu seinem Gedeihen eine lebende Zelle
benotigt.
Morphologisch den Blaualgen der Gattung Chamaesiphon ahnlich.
Typus generis: Chamaesiphonosira cymbetlicola Geitler 1975
Wichtigste Literatur: Scherffel 1907, Geitler 1975
362 • Knospende Bakterien - Chamaesiphonosira
Bestimmungsschliissel der Arten
la Mutterzelle an der Basis 0,5 ^.m dick; Knospen 0,3 ^m breit; Epiphyt auf die
Diatomee Cymbella cesatispezialisiert 1. Ch. cymbellicolla
lb Mutterzelle an der Basis 2 ^m dick; Knospen 1 ^m breit; Epiphyt auf die
Diatomee Epithemia turgida spezialisiert 2. Ch. hyalina
1. Chamaesiphonosira cymbellicola Geitler 1975
Mit den Merkmalen der Gattung.
Der Tragerteil kann bis zu 4 ^m, selten bis 5 \im lang werden, bevor er Knospen
abschniirt. An der Basis etwa 0,5 \im dick. Tochterzellen leicht querellipsoid
oder kugelig, im Durchmesser 0,3 \im. Die sich ablosende terminale Knospen-
zelle ist meist etwas grofier und immer kugelig.
Die Art kommt ausschliefilich auf lebenden Zellen der Diatomee Cymbella cesati
vor, trotz reichlichem Angebot vieler anderer ahnlicher Diatomeen und anderer
Algen. Es handelt sich also um einen sehr spezialisierten Epiphytismus. Gefun-
den beim Studium von Gallertkolonien von Ophrydium versatile (Ciliaten) aus
dem Lunzer Untersee (Niederosterreich), wo neben anderen Diatomeenarten in
grofier Anzahl auch Cymbella cesati vorkam.
Bisher war es mit Rucksicht auf den spezifischen Charakter des Vorkommens
dieses Organismus noch nicht moglich, elektronenmikroskopische Studien
durchzufiinren. Darum betrachtet Geitler (1975) die angefiihrte Beschreibung
als provisorisch.
2. Chamaesiphonosira hyalina (Scherffel 1907) Geitler 1975
Chamaesiphon hyalinus Scherffel 1907
Mit den Merkmalen der Gattung.
Mutterzelle bedeutend grofier als bei der vorhergehenden Art. An der Basis etwa
2 ^im dick und etwa 5 ^m lang; Knospen 1 ^.m breit.
Kommt als Epiphyt auf lebenden Zellen der Diatomee Epithemia turgida vor. In
Prope Iglo (Ungarn) gefunden.
Urspriinglich wurde der Organismus zu der Blaualgengattung Chamaesiphon
gestellt. Geitler (1975) machte jedoch auf die Ubereinstimmung mit der Gattung
Chamaesiphonosira aufmerksam.
Unsichere, ungenttgend beschriebene Gattung und Art:
Thiobacter unigutatum Perfiliev et Pels 1936
Kleine, durch dunne Faden verbundene Zellen, ahnlich wie bei Hyphobakterien.
In Salzseen auf der Krym und in der Kara-Bogaz-Gol-Bucht des Kaspischen
Meeres (UdSSR) gefunden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Teil V. Spirochaten
Eine Gruppe, die wahrscheinlich phylogenetisch verwandte Organismen um-
fafit. Zellen diinn, relativ lang, korkenzieherartig gewunden. Ohne Geifieln,
jedoch mittels axialer Fibrillen beweglich. Streng aerob, fakultativ anaerob oder
streng anaerob; chomoorganotroph, saprophytisch oder verschiedentlich auch
als saprophytischer Kommensalen. Als Parasit oder pathogener Organismus an
einen Wirtsorganismus gebunden.
Diese Gruppe ist mit der Ordnung Spirochaetales identisch.
Ordnung Spirochaetales Buchanan 1917
Zarte, flexible, einzellige, gramnegative, schraubenformig gewundene korken-
zieher-artige Organismen mit einer oder mehrerer Windungen. Manche Arten
bilden nur flache Wellen. Mitunter auch in Ketten vorkommend, in denen die
einzelnen Individuen durch die aufiere Hulle miteinander verbunden sind. Die
Zellbasis wird von einem, eine oder mehrere axiale Fibrillen umwindenden,
Protoplasmazylinder gebildet. Die Fibrillen sind im Protoplasmazylinder ge-
wohnlich miteinander subterminal derart verankert, dafi sie sich in der Zellmitte
kreuzen. Die freien Enden der axialen Fibrillen konnen bei manchen Arten iiber
das Ende des Protoplasmazylinders hinausragen, so dafi sie Geifieln vortau-
schen. Sowohl die axialen Fibrillen als auch der Protoplasmazylinder sind von
einer Hulle umgeben. Unter gewissen Bedingungen bilden sie kugelige Korper-
chen, die entweder frei vorkommen oder terminal mit der Zelle verbunden sind
oder auch in der Zellmitte auftreten. Innerhalb der aufieren Hulle ist der
Protoplasmazylinder eingerollt; wahrscheinlich handelt es sich hierbei um Invo-
lutionsformen. Einige Arten der Gattung Cristispira besitzen ein spezifisches
Organell, eine Kriste, die man fruher fur einen besonderen Typus der undulie-
renden Membran gehalten hat. Elektronenmikroskopische Untersuchungen
haben jedoch gezeigt, dafi es sich (besonders in fixierten und gefarbten Prapara-
ten) um Artefakte handelt, die dadurch entstehen, dafi sich die axialen Faden
innerhalb der Hulle vom Protoplasmazylinder losreifien oder aus der geplatzten
Hulle austreten.
Das Protoplasma kann wegen seines niedrigen Lichtbrechungsindexes nur mit
Phasenkontrast oder im Dunkelfeld beobachtet werden. Manche Arten sind mit
den ublichen Farbstoffen schlecht farbbar und konnen nur nach Giemsa gefarbt
werden. Eine Reihe von Arten enthalt Inklusionen, die in gefarbten Praparaten
Querstreifung der Zellen vortauschen. Endosporen werden nicht gebildet.
Zellen aerob, fakultativ anaerob oder eng anaerob, chemoorganotroph. Mehrere
Arten wurden bislang noch nicht kultiviert. Nahrungsanspriiche verschieden.
Fortpflanzung durch Querteilung; die Angaben in der alteren Literatur iiber
Langsteilung sind falsch. Praktisch sind alle Arten beweglich. Bewegung
wahrscheinlich durch die axialen Fibrillen bedingt. Drei Arten von Bewegungen
konnen unterschieden werden: schnelles Rotieren um die Langsachse einer
Schraubenbahn (an einen rotierenden Korkenzieher erinnernd), Vorwarts- oder
Ruckwartsbewegung und verschiedene Biegungen der Zelle. Die Ausmafie der
Zellen sind, besonders die Lange, von der Umwelt oder der Art der Kultur
abhangig. Als saprophytische Arten im Freiland vorkommend oder kommensal
bis parasitisch lebend. Manche Arten sind auch fur den Menschen pathogen.
In Bergey's Manual (1957) wurde die Ordnung Spirochaetales nach der Zellgrofie in zwei
Familien geteilt: Spirochaetaceae, 30-500 |im grofie Zellen umfassend, und Treponemata-
364 • Spirochaten - Spirochaetaceae
ceae mit nur 4,0-16,0 urn grofien Zellen. Da jedoch die Zellgrofie, wie Untersuchungen
geteilt haben, recht veranderlich und von den Wachstumsbedingungen sowie dem Alter der
Kultur abhangig ist und dariiber hinaus die Ultrastruktur aller Arten zahlreiche gemeinsame
Merkmale aufweist, sollen nach Canale-Parola et al. (1968) alle Gattungen dieser Ordnung
in einer einzigen Familie zusammengefafit werden.
Pillot (1965) schlug auf Grund des Studiums morphologischer Eigenschaften der Vertreter
dieser Ordnung vor, die Familie Leptospiraceae zu definieren. Da die Publikation jedoch
ungiiltig war, erneuerte Hovind-Hougen (1979) diesen Vorschlag; die neue Familie enthalt
die zwei Gattungen Leptospira und Leptonema.
Bestimmungsschliissel der Familien
la Streng oder fakultativ anaerob, Zellenden nicht hakenformig gebogen; zwei
oder mehr axiale Fibrillen 1. Spirochaetaceae (S. 364)
lb Streng aerob; Zellenden hakenformig gebogen; nur zwei axiale Fibrillen ....
2. Leptospiraceae (S. 378)
1. Familie Spirochaetaceae Swellengrebel 1907
Mit den Merkmalen der Ordnung.
Anaerob oder fakultativ anaerob; saprophytische, kommensale oder parasitische
Organismen.
Typus familiae: Spirochaeta Ehrenberg 1895
Bestimmungsschliissel der Gattungen
la Saprophytisch;mit2axialen Fibrillen 1. Spirochaeta(S. 364)
lb Kommensalbisparasitisch,mitmehrals2axialenFibrillen 2
2a KommensalbeiWeichtieren;mitrundlOOaxialenFibrillen
2.Cristispira(S.374)
2b Bei Weichtieren nicht vorkommend; meist pathogen fur Saugetiere, Vogel,
sowie fur den Menschen 3
3a Parasitisch bis pathogen; meist von Lausen oder Zecken iibertragen; seltener
durch unmittelbaren Kontakt; mit 15-20 parallelen axialen Fibrillen zwi-
schenderzytoplasmatischenMembranundderelastischenHiille
3. Borrelia (S. 377)
3b Kommensal bis pathogen; im Verdauungstrakt, in der Mundhohle oder in
den Genitalien von Saugetieren und Menschen vorkommend; mit 3-7 axialen
Fibrillen 4. Treponema (S. 378)
1. Spirochaeta Ehrenberg 1835
Spirochaeta Dujardin 1841, Spirochaete Cohn 1872 (non Spirochaete Hansgirg
1888), Ehrenbergia Gieszczykiewicz 1939.
Einzelne, einzellige, gramnegative Organismen. Zellen verhaltnismafiig diinn,
lang, stark flexibel, schraubenformig gedreht. Die Zellbasis wird von einem
protoplasmatischen Zylinder gebildet, der entweder in einer Schraubenbahn um
2 axiale Fibrillen herum oder gemeinsam mit ihnen gewunden ist. Sowohl der
Protoplasmazylinder als auch die axialen Fibrillen werden von einer selbstandi-
gen oder gemeinsamen Membran eingeschlossen. Die axialen Fibrillen sind
subterminal, an jedem der beiden Pole verankert; in der Zellmitte konnen sie sich
kreuzen. Nach Joseph und Canale-Parola (1972) besteht eine strukturelle Ahn-
lichkeit zwischen Fibrillen und Geifieln. Einige Arten bilden in Kulturen unter
gewissen Bedingungen kugelige Korperchen, die entweder frei oder in Verbin-
dung mit der Zelle vorkommen.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Spirochaeta • 365
Zellen nicht quer gestreift und an den Enden nicht hakig gekriimmt. Eine Art
bildet ein karotinoid-artiges, gelborangenes Pigment.
Streng oder fakultativ anaerob. Chemoorganotroph; weder parasitisch noch
pathogen. Uberwiegend Kohlenhydrate fermentierend. Inwieweit Wuchsstoffe
oder andere Stoffe benotigt werden, ist bisher noch nicht genau bekannt. Der
grofite Teil der Arten, mit Ausnahme der Typusart, wurde in Reinkulturen
gezuchtet. Eine Art ist thermophil. Fortpflanzung durch Querteilung. Wahr-
scheinlich mit Hilfe von axialen Fibrillen beweglich; teils um die Langsachse sich
drehend, teils durch verschiedenartige Biegungen der Zellen sich bewegend
(Schwingen, Wellenbewegungskrummung u. a.). Zellen 0,2-0,75 x 5,0-500 urn
grofi. In verunreinigten Sufi- und Salzwassern, besonders dort, wo sich aus
verwesendem organischem Material H2S bildet. Oft in Spulwasser und Abwas-
sern oder Belebtschlamm vorhanden.
Canale-Parola et al. (1968) empfehlen die Gattung in zwei selbstandige Gattungen aufzutei-
len, von denen die eine streng anaerobe, die andere fakultativ anaerobe Arten umfassen
wiirde.
In der alteren Literatur wurden auf Grund morphologischer Eigenschaften auch pathogene,
parasitische oder kommensale Arten von Spirochaeten in diese Gattung eingereiht. Spater
gaben Untersuchungen der biochemischen und physiologischen Eigenschaften, dafi die an
einen Wirt gebundenen Arten sich von den chemoorganotrophen unterscheiden und daher
zu anderen Gattungen gestellt werden miissen.
Typus generis: Spirochaeta plicatilis Ehrenberg 1833.
Wichtigste Literatur: Ehrenberg 1833, Cohn 1872, de Toni und Trevisan 1889,
Cantacuzene 1910, Zuelzer 1911, 1912, 1925, 1928, Dobell 1912, Wolbach und
Binger 1914, Uhlenhut und Zuelzer 1921, Adelmann 1922, Bergey et al. 1923,
Enderlein 1925, Zuelzer und Oba 1925, Dimitroff 1926, Vinzent 1926, Zuruk-
zoglu 1930, Gieszczykiewicz 1939, Dujardin 1841, Dyar 1947, Brisou 1955,
Bergey's Manual 1957. 1974, Veldkamp 1960, Lewin 1962,1965, Hanson 1965,
Pillot 1965, Canale-Parola, Holt und Udris 1967, Canale-Parola, Udris und
Mandel 1968, Holt und Canale-Parola 1968, Breznak und Canale-Parola 1969,
1972, 1975, Hespell und Canale-Parola 1970, Joseph und Canale-Parola, 1972,
Greenberg und Canale-Parola 1976, Cwyk und Canale-Parola 1979, Hovid-
Hougen 1979.
Bestimmungsschliissel der Arten
la Organismus nicht halophil 2
lb Organismus halophil und saprophytisch 6. Sp. halophila
2a Zellen bis 0,35 \im breit 3
2b Zellen breiter als 0,4 urn 5
3a Streng anaerob; kein Pigment bildend 4
3b Fakultativ anaerob; im Licht und bei Zutritt von 02 gelborangefarbenes
Pigment bildend 2. Sp. aurantia
4a Fermentiert Glukose zu Athanol, Essig- und Milchsaure; Bemsteinsaure
wird nicht gebildet; exogene C02-Quelle nicht erforderlich
3. Sp. stenostepta
4b Fermentiert Glukose zu Essig-, Milch und Bemsteinsaure; bildet Athanol
nur in unbedeutendenMengen; exogene C02-Quelle erforderlich
4, So zuclzcrnc
5a Thermophil (52-56 °C) .'..'. 7. Sp. daxensis
5b Nicht thermophil 6
6a Vorhandensein von NaCl erforderlich 7
6b NaCl nicht erforderlich 8
366 • Spirochaten - Spirochaeta
7a Streng anaerob, fermentiert Glukose zu Athanol und Essigsaure; Zellen 0,4-
0,5 x 5,5-7,0 um grofi 5. Sp. litoralis
7b Fakultativ anaerob; Zellen 0,5 x 100-200 um _. . .
la. Sp. plicatilis (Sp. marina)
8a Zellen 0,5-0,75 x 100-300 (500) um; Protoplasma mit zahlreichen meta-
chromatischen Granula 2b. Sp. plicatilis (Sp. eurystrepta)
1. Spirochaeta plicatilis Ehrenberg 1833 (Fig. 223)
Spirulina plicatilis (Ehrenberg 1833) Cohn 1853, Spirochaete plicatilis (Ehrenberg
1833) Cohn 1872, Spirillum portae Mantegazza sensu de Toni et Trevisan 1889,
Spirochaeta eurystrepta Zuelzer 1912, Spirochaeta marina Bergey et al. 1923,
Spirochaeta plicatilis var. plicatilis (Ehrenberg 1833) Zuelzer 1912, Spirochaeta
plicatilis var. eurystrepta Zuelzer 1912, Spirochaeta plicatilis var. marina Zuelzer
1912, Treponema plicatilis (Ehrenberg 1833) Enderlein 1925, Ehrenbereia
plicatilis (Ehrenberg 1833) Gieszczykiewicz 1939, Spirillum plicatile (Ehrenberg
1833) Dujardin 1941, Spirochaeta portae Brisou 1955, Saprospira plicatilis
(Ehrenberg 1833) Lewin 1965.
Zellen einzeln, lang, schraubenartig gedreht, mit kreisformigem Querschnitt
und abgerundeten Enden. Mit regelmafiigen primaren Windungen, die auch
wahrend der Bewegung erhalten bleiben. Aufierdem konnen auch sekundare
Windungen oder Wellen gebildet werden. Sie besitzen zwei axiale, subterminal
in einem plasmatischen Zylinder verankerte Fibrillen, die sich in der Zellmitte
uberkreuzen. Protoplasma ohne karotinoidartige Pigmente; ohne metachroma-
tische Granula und Fettinklusionen. Nach Loeffler gut farbbar; die Zelle ist
jedoch nach der Farbung dreimal breiter; auch mit anderen Anilinfarbstoffen gut
farbbar.
Kenntnisse iiber physiologische Eigenschaften des Organismus unvollstandig da
nicht in Reinkultur geziichtet. Vermutlich obligat bis fakultativ anaerob, da in
anaerober oder sauerstoffarmer Umwelt vorkommend. Fortpflanzung durch
Querteilung in zwei Individuen; der ganze Akt verlauft sehr rasch. Oft kommt
Fig. 223. Spirochaeta plicatilis - verschiedene Zellformen (nach Zuelzer, 1912. -
500X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Spirochaeta • 367
es, besonders bei langeren Individuen, auch zu Teilungen in mehrere (5-15)
Tochterzellen. Nach der Teilung bleiben diese (Zuelzer 1912) eine Zeitlang
miteinander verbunden; spater trennen sie sich voneinander und bewegen sich in
alle Richtungen. Bewegung erfolgt durch Rotieren um die Langsachse und durch
Wellenbewegung des Protoplasmazylinders.
Zellen 0,5-0,75 x 100-200 um; selten bis 500 um lang. Windungen 1,5 um
hoch, 2,0 um breit.
Gewohnlich in betrachtlichen Mengen in Siimpfen und in verunreinigtem, H2S-
haltigem Wasser vorhanden. Haufig gemeinsam mit Schwefelbakterien. Ur-
spriinglich aus «uberwintertem» Wasser beschrieben.
Die von Dyar (1947) unter dem Namen Spirochaeta plicatilis beschriebene Art (Starr und
Skerman 1965) gehort nach Lewin (1962) zur Gattung Saprospira (Saprospira albida).
Blakemore und Canale-Parola (1973) isolierten aus brakischem Schlamm einen Sulfide
enthaltenden Stamm, den sie als «Typ B» bezeichneten. Er unterscheidet sich dadurch, dafi
die axialen Faden ein Biindel bilden, das nur am Zellpol verankert ist, keine transversalen
Septa hat und streng aerob lebt, wahrend die Leitart entweder fakultativ anaerob (Toleranz
fur niedrigen Sauerstoffgehalt) oder mikroaerophil ist. Der als «Typ B» bezeichnete Stamm
kann zusammen mit einem, der Spirochaeta plicatilis identischen Stamm im Innern einer
Masse von lysierenden Beggiatoa-F'iden vor. Er ist offenbar chemotaktisch, denn er
sammelt sich in grofien Mengen um die lysierenden Faden.
Angesichts der sehr geringen morphologischen Unterschiede, die vermutlich durch Um-
weltfaktoren verursacht werden, stellt Zuelzer (1912) und nach ihr auch Canale-Parola et al.
(1968) zu dieser Art zwei weitere als selbstandig angesehene Arten:
la. Spirochaeta marina Bergey et al. 1923
Spirochaeta plicatilis var. marina Zuelzer 1912
Zellen zylindrisch, schraubenformig, mit abgerundeten Enden. Mit einer axialen Fibrille.
Protoplasma mit kleinen und unregelmafiig verteilten Granula, wahrscheinlich aus Volutin
bestehend. Mit Anilinfarbstoffen gut farbbar. Optimale Wachstumstemperatur 20 °C.
Nur bei geringer Sauerstoffkonzentration wachsend. Zellen 0,5 X 100-200 |im grofi.
Im Meerwasser vorkommend.
lb. Spirochaeta eurystrepta Zuelzer 1912
Spirochaeta plicatilis var. eurystrepta Zuelzer 1912
Zylindrische, schraubenformig gedrehte Zellen mit einer (?) langlichen Axialfibrille.
Windungen schmaler als bei Spirochaeta plicatilis. Protoplasma mit Anilinfarbstoffen gut
farbbar. Enthalt weniger Volutingranula als Spirochaeta plicatilis. Zellen 0,5-300 um grofi.
Optimale Wachstumstemperatur 20 °C.
In Siimpfen und stark verunreinigten H2S-haltigen Wassern.
2. Spirochaeta aurantia Vinzent 1926 (Fig. 224)
Spirochaeta aurantia var. aurantia (Vinzent 1926) Breznak et Canale-Parola
1975, Spirochaeta aurantia var. stricta Breznak et Canale-Parola 1975.
Schraubenartig gewundene, gramnegative Stabchen; Windungen locker (steil
ansteigend), unregelmafiig; nur junge Kulturen zeigen mehr oder weniger
regelmafiige Windungen. An den Zellen befinden sich zwei axiale Fibrillen, von
denen jeweils eine an einem der Pole herauswachst und die sich in der Zellmitte
kreuzen. In Kulturen bilden sich, besonders in der stationaren Wachstumsphase,
spharische Korperchen, die entweder mit der Zelle verbunden sind oder
selbstandig werden. Zum Unterschied von den iibrigen Arten dieser Gattung wird
ein gelborangegefarbtes karotinoidartiges Pigment besonders unter aeroben
Wachstumsbedingungen und im Licht gebildet, das sein Entstehen stimuliert.
Fakultativ anaerobe Organismen mit fermentativem und wahrscheinlich auch
respirativem Metabolismus. Als Kohlenstoff- und Energiequelle wird eine Reihe
von Zuckerarten verwertet. Glukose wird anaerob besonders zu Athanol,Aze-
tat, Kohlendioxyd und Wasserstoff, ferner Ameisen- und Milchsaure, Azeton
und Diazetyl fermentiert. Mit Ausnahme von Brenztraubensaure verlauft die
368 • Spirochaten - Spirochaeta
Fermentierung nach dem Embden-Meyerhof-Schema. Die wachsenden Zellen
fiihren eine voUstandige Oxydation von Glukose unter aeroben Bedingungen
durch, wobei rund die Halfte des Kohlenstoffes aus der Glukose zum Bestandteil
der Biomasse wird; iiber Vt des assimilierbaren Kohlenstoffs befindet sich in
Zell-Lipiden, die bis 29-36% der Trockensubstanz der Biomasse bilden.
Stickstoff wird aus Aminosauren gewonnen; anorganischer Stickstoff kann nicht
verwertet werden. Aminosauren konnen nicht als Kohlenstoffquelle dienen.
Zum Wachstum sind Biotin und Thiamin erforderlich. Optimale Wachstums-
temperatur 30 °C, wobei die Temperaturspanne 15°-37° betragt. Bei 37 °C
streckt sich der Organismus und die Windungen verschwinden. Optimale pH-
Werte liegen bei 7,0-7,3.
Tiefenkolonien auf festen Nahrboden weifi, kugelig, feder- bis flaumanig;
Durchmesser ungefahr 1 mm. Aerob wachsende Kolonien 2-4 mm im Durch-
messer, gelborange, abgerundet, mit leicht unregelmafiigen Randern, teilweise
in den Agar hineinwachsend, mit erhohtem Mittelteil. Bei geringer Kohlenhy-
dratkonzentration sind die Kolonien grofier und haben die Tendenz, in den Agar
einzudringen; die Pigmentierung ist dann wenig deutlich oder unsichtbar.
Lebhaft beweglich. Breznak und Canale-Parola (1975) stellten fest, dafi sie
chemotaktisch sind und besonders auf die Anwesenheit von Karbohydratkon-
zentration im Medium.
Zellen 0,3 x 5,0-35 ^m. Wahrend der exponentiellen Wachstumsphase sind die
meisten Zellen 10-20 ^m lang. Kugelige Korperchen haben durchschnittlich
einen Durchmesser von 0,5-2,0 ^m.
In Abwassern und stark verunreinigten Gewassern kommend. Urspriinglich aus
dem Schlamm eines Ententeichs isoliert.
Canale-Parola et al. (1968) isolierten zwei morphologisch etwas unterschiedliche Stamme
mit regelmafiigen, dichten, feinen Windungen.
Breznak und Canale-Parola (1975) isolierten zwei Stamme, die sich voneinander durch die
Lange und Breite der Windungen unterscheiden, und beschrieben sie als selbstandige
Varietat:
2a. Spirochaeta aurantia var. aurantia (Vinzent 1926) Breznak et Canale-Parola 1975
Mit den Merkmalen der Leitart; leicht spiralig gewunden.
2b. Spirochaeta aurantia var. stricta Breznak et Canale-Parola 1975
Von der Leitart durch enge Windungen unterschieden die eine deutlich geringere Breite und
auch Lange haben. Auch der Gehalt an Guanin und Cytosin ist geringer.
3. Spirochaeta stenostrepta Zuelzer 1912 (Fig. 225)
Treponema stenostrepta (Zuelzer 1912) Enderlein 1925, Spirochaeta fulgurans
Dobell 1912, Spirochaeta stenostrepta var. marina Zuelzer 1925
Zellen gramnegativ, schraubenformig, mit regelmafiigen, stabilen, dichten,
feinen Windungen. Aufierdem bilden sie, besonders wahrend der Bewegung, breite
sekundare Windungen oder Wellen, wobei die primaren Windungen ebenfalls
gut sichtbar bleiben. In Kulturen kommen gelegentlich auch kugelige
Korperchen vor, die selbstandig oder aber mit den Zellen verbunden sind. An der
Zelloberflache befinden sich zwei axiale Fibrillen, die subterminal aus dem
Protoplasmazylinder herauswachsen und sich in der Zellmitte kreuzen. Die
aufiere Membran umgibt den Protoplasmazylinder samt den Axialfibrillen. Pro-
toplasma ohne Pigmente.
Streng anaerob mit fermentativem Metabolismus. Verwertet werden eine Reihe
von Kohlenhydraten, vor allem Zuckerarten. Aminosauren und andere organi-
schem Sauren werden nicht fermentiert, dagegen aber Glukose zu Athanol,
Essie- und Milchsaure, Kohlendioxid und Sauerstoff. Bernsteinsaure wird nicht
gebildet. Die Fermentierung bis zur Brenztraubensaure verlauft nach dem
klassischen Embden-Meyerhof-Schema. Benotigt wird eine organische Stick-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Spirochaeta • 369
stoffquelle; Wachstum erfolgt nur auf komplexen Medien bei Anwesenheit von
nicht naher bekannten Wachstumsfaktoren aus Hefeextrakt. Biotin, Riboflavin
und Vitamin B12 stimulieren das Wachstum. Wachst bei Temperaturen zwischen
15-40 CC; das Optimum liegt bei 35-37 CC, der optimale pH-Wert des
Mediums bei 7,0-7,5.
In flussigen Kulturen paaren sich die Organismen gelegentlich. Sie verdrehen
sich miteinander, gelegentlich verdreht sich auch ein Individuum selbst an seinen
Enden. Auf festen Nahrboden sind die tiefen Kolonien weifi, kugelig, flaum- bis
federartig, ungefahr 2 mm im Durchmesser; seltener treten auch kleine Kolonien
ohne diese charakteristischen Eigenschaften auf.
Zellen wahrend der logarithmischen Wachstumsphase meist 0,2-0,3 x 15,0—
45,0 nm grofi. Zellen unter 15,0 jun kommen ebenfalls vor. In der spaten
logarithmischen und der stationaren Wachstumsphase werden die Zellen bis zu
300 [im lang. Kugelige Gebilde im Durchmesser 1,0-3,0 ^m breit.
In verunreinigten, H2S-haltigen Gewassern. Urspriinglich aus dem Schlamm
eines Siifiwasserteiches isoliert.
Zuelzer (1925) halt die im Meerwasserlebenden Organismen fur eine
selbstandige Varietat "marina*.
Zuelzer (1925) stellt zu dieser Art auch die folgende, friiher als selbstandig beschriebene Art:
3a. Spirochaeta fulgurans Dobell 1912
Erinnert morphologisch an Spirochaeta plicatilis, ist jedoch kleiner. Mit regelmafiigen,
dichten Windungen. Ein verhaltnismafiig langer, ziemlich biegsamer Organismus von sehr
variabler Form. Bildet oft auch sekundare Schraubenwindungen oder Wellen des Protoplas-
ma farblos oder durch Lichtbrechung hell griinlich. Nach Giemsa oder mit Eisenhamatoxy-
lin gut farbbar. Ohne metachromatische und regelmafiige Windungen.
Braucht H2S-haltiges Milieu, das wahrscheinlich seine Aktivitat stimuliert. Fortpflanzung
durch Querteilung, lange Individuen teilen sich in mehrere, an Treponema erinnernde
Tochterzellen. Der Teilungsakt verlauft sehr rasch. Sehr lebhaft beweglich, was die Beob-
achtung nativer Praparate erschwert. Bewegung in Richtung der Langsachse der Zelle bei
gleichzeitiger Biegung des Protoplasmazylinders.
vm
22L 225 226
Fig. 224. Spirochaeta aurantia - verschiedene Zellformen: manche Zellen bilden
kugelformige Korpuskeln (nach Mikrophoto umgezeichnet - Canale-Parola,
1968. - 1500x). Fig. 225. Spirochaeta stenostrepta - nach Mikrophoto
umgezeichnet - Canale-Parola, 1968. - 1500x). Fig. 226. Spirochaeta zuelzerae -
(nach Mikrophoto umgezeichnet - Canale-Parola, 1968. - 1500x).
370 • Spirochaten - Spirochaeta
Zellen 0,25-0,30 x 50 |imgrofi. JungeTochterzellenim AugenblickderTeilung 3,0-6,0 urn
lang. Zellen selten bis 200 u.m lang. Windungen praktisch gleich breit una hoch (0,8-
0,9 urn).
4. Spirochaeta zuelzerae (Veldkamp 1960) Canale-Parola et al. 1968
(Fig. 226)
Treponema zuelzerae Veldkamp 1960
Zellen schraubenformig gewunden, gramnegativ; in der exponentiellen Wachs-
tumsphase mit ziemlich stabilen, regelmafiigen primaren Windungen. Sekundare
Windungen oder Wellen sind selten una unregelmafiig. In der stationaren
Wachstumsphase werden kugelige Korperchen gebildet, die gewohnlich an
einem Zellende befestigt sind. An der Zelloberflache befinden sich zwei subter-
minal verankerte axiale Fibrillen, die sich in der Zellmitte uberdecken. Proto-
plasma ohne Karotinoidpigmente.
Streng aerob mit fermentativem Metabolismus. Verwertet eine Reihe von Koh-
lenhydraten, vor allem Zuckerarten. Glukose wird zu Essig-, Milch- sowie
Bernsteinsaure, Kohlendioxyd und Wasserstoff fermentiert. Athanol wird nur
in kleinen Mengen erzeugt. Anorganische Stickstoffquellen (NH4+ und N03~)
werden nicht verwertet; braucht komplexe Stickstofiquellen, z. B. Hefeextrakt;
animalische Medien (Blut, Serum, Inhalt des Pansen u. a.) sind jedoch nicht
bekannt. Eine Zugabe von CO2 ist jedoch fur das Wachstum unbedingt notig.
Optimale Wachstumstemperatur 37-40 °C; wachst bei 20 °C langsam, bei
45 °C nicht mehr. Optimaler pH-Wert bei 7,0-8,0.
Kolonien unter der Oberflache auf Agarboden weifi, federartig, kugelig; sie
haben die Tendenz in das Medium hineinzuwachsen. Gelegentlich kommen
auch scheibenformige Kolonien vor.
Zellen meist 0,2-0,35 x 8,0-16,5 urn grofi; vereinzelt treten jedoch auch nur
2,0-3,0 um lange Zellen auf; in alten Kulturen kommen haufig bis 80 urn lange
Zellen vor. Auch dann, wenn die Kulturen massiv beimpft werden, erreichen die
Zellen eine Lange bis zu 45 urn. Kugelige Korperchen gewohnlich 3,0—4,0 um
im Durchmesser.
Als frei lebende Spirochaete in H2S-haltigem schlamm von Siifiwasserteichen
oder -becken vorkommend. Ursprtinglich als kontaminierender Organismus aus
einer Kultur griiner photosynthetischer, aus dem Schlamm eines Teiches gewon-
nener Bakterien isoliert.
Obwohl wesentlich kiirzer, erinnert der Organismus durch seinen Habitus stark
an Spirochaeta stenostrepta; er hat auch dieselben okologischen Anspruche.
Serologisch ist er zu einem gewissen Grad Treponema palidum ahnlich. Er
besitzt ein proteinartiges Antigen, das auf Syphillis-Serum positiv reagiert.
Canale-Parola et al. (1968) isolierten einen morphologisch ahnlichen
Organismus (Stamm Z4), der sich nur in einigen physiologischen Merkmalen unterschei-
det. So braucht er keine exogene C02-Quelle, unterscheidet sich durch die
Zusammensetzung der DNS und produziert aus Glukose Essig-, Bernstein-,
sowie Ameisensaure, Athanol, C02 und H2.
5. Spirochaeta litoralis Hespell et Canale-Parola 1970
Zellen einzeln, schraubenformig, gramnegativ, ziemlich flexibel; in der
exponentiellen Wachstumsphase mit dichten, regelmafiigen Windungen sehr locker.
Mit zwei axialen Fibrillen; jede von ihnen haftet (subterminal) mit scheibenfor-
migen Strukturen an einem Pol des Protoplasmazylinders; ahnlich wie bei
Spirochaeta stenostrepta umwinden sie den Protoplasmazylinder und ragen iiber
sein Ende hinaus. Manchmal (selten) hat eine Zelle an einem Pol zwei, am
anderen eine Fibrille. Die aufiere Hiille umgibt den Protoplasmazylinder samt
den Fibrillen. In der stationaren Wachstumsphase oder unter ungiinstigen
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Spirochaeta • 371
Bedingungen (Anwesenheit vom Sauerstoff) werden kugelige Korperchen
gebildet. Protoplasma ohne Pigmente.
Obligat anaerob, mit eng fermentativem Metabolismus. Fermentiert eine Reihe
von Zuckerarten und anaerer Kohlenhydrate; Glukose wird zu Athanol, Azetat,
Kohlendioxid sowie Wasserstoff und ferner zu Spuren von Laktat, Formiat und
Pyruvat fermentiert. Als Stickstoffquelle konnen Ammonium-Ionen verwertet
werden, Nitrate dagegen kaum. Zum Wachstum sind Niazin, Thiamin, Biotin
und Kalziumpanthotenat als Wuchsstoffe erforderlich. Panthotenat kann durch
das Koenzym A ersetzt werden, das Wachstum ist jedoch dann schwacher.
Aufierdem ist fur das Wachstum die Anwesenheit von Na+und von Cl"Ionen
erforderlich. Wachst nicht in Medien mit weniger als 0,05 mol NaCl; die
optimale Konzentration ist 0,35 mol. Na+ kann weder durch K+, noch durch
andere Ionen ersetzt werden. Stark empfindich gegeniiber Anwesenheit von
Sauerstoff; in Kulturmedien ist daher die Anwesenheit reduzierender Substan-
zen erforderlich, von denen Na2S oder L-Cystein am vorteilhaftesten sind;
weniger geeignet sind Thioglykolat oder 1-Askorbinsaure. Optimale
Wachstumstemperatur 30 °C; wachst nicht mehr bei 5° und 40°. Optimaler pH-
Wert bei 7,0-7,5.
Auf Agar werden unter der Oberflache kugelige, federartige, cremefarbene, im
Durchschnitt 1-5 mm im Durchmesser messende Kolonien gebildet. Aus zuge-
gebenem Na2S entsteht ein diffuser Hof von elementarem Schwefel, der die
Kolonie umgibt. Anaerob kultivierte Oberflachenkolonien sind abgerundet; sie
wachsen teilweise in den Agar ein; sie sind cremefarben, 2-5 mm grofi, mit
erhohter Mitte.
Zellen sehr lebhaft beweglich; sie rotieren um die Langsachse des
schraubenformig gewundenen Protoplasmazylinders oder biegen sich auf verschiedene
Weise.
Zellen 0,4-0,5 x 5,5-7,0 um grofi. Kugelige Gebilde 2,0-3,5 um im
Durchmesser.
Urspriinglich aus schwarzem, Sulfide enthaltendem Schlamm im Meer aus
Luquillo Beach in der Nahe von San Juan, Insel Puerto Rico (USA) isoliert.
6. Spirochaeta halophila Greenberg et Canale-Parola 1976
Einzelne, flexible, mittellange, schraubenartig gedrehte Zellen mit abgerundeten
Enden. Manchmal treten auch aus zwei bis drei Zellen zusammengesetzte Ketten
auf, besonders bei jungen Zellen. Windungen regelmafiig. Zellen beweglich. Sie
besitzen zwei subterminal verankerte axiale Fibrillen, die sich in der Zellmitte
kreuzen. Eine Aufienscheide umgibt die axialen Fibrillen sowie den plasmati-
schen Zylinder. In alten Kulturen, in der stationaren Wachstumsphase oder in
bei ungeeigneter Temperatur wachsenden Kolonien werden kugelige
Korperchen gebildet, die an einem Zellende festsitzen sind. Gramnegativ.
Aerober oder fakultativ anaerober, organotropher Organismus. Als Energie-
quelle werden Karbohydrate, aber nicht Aminosauren verwertet. Glukose wird
zu Wasserstoff, Kohlendioxid, Aethanol, Azetat und in geringer Menge zu
Milchsaure fermentiert. Bei aerobem Wachstum verlauft eine unvollstandige
Oxidation zu Kohlendioxid und Azetat. Das Wachstum wird durch Disacchari-
de stimuliert; sie dienen als Wachstumssubstrat. Monosaccharide oder
Polysaccharide, auch Aminosauren sind nicht verwertbar. Der Organismus ist streng
halophil mit spezifischen Anforderungen an Na+, CI", Ca2+ und Mg2+-Ionen.
Die optimale Zusammensetzung der Salze im Medium ist 0,75 mol NaCl 0,2 mol
MgSO», 0,01 mol CaCl2. Wenn keine Salze zur Verfugung stehen, erfolgt kein
Wachstum, die Zellen des Inokulums unterliegen der Lyse. Bei anaerobem
Wachstum werden Nitrate zu Nitriten reduziert.
Kolonien auf festen Medien wachsen in den Agar hinein. Bei aerobem Wachstum
372 • Spirochaten - Unsichere Arten
sind sie durch Karotinoide rot gefarbt; an ihrer Peripherie befindet sich eine
Zone von diffusem Wachstum. Die Kolonien messen 2-6 mm im Durchmesser.
Bei anaeroben Verhaltnissen wachsen die Kolonien unter der Agaroberflache; sie
sind weifi, kugelig, diffus. Es treten auch Mutanten auf, die aerob ohne Pigment
wachsen.
Die Zellen sind 0,4 X 15,0-30,0 u,m grofi; die Lange kann zwischen 5,0 u,m und
bis 60,0 um variieren. Die Windungen der Spirale sind 1,8 um lang und 0,5 ^m
breit. Zellen lebhaft beweglich; sie weisen einerseits eine undulierende
Bewegung auf, andererseits rotieren sie um die Langsachse (wie ein sich drehender
Korkenzieher).
Der Organismus wurde aus dem an der Sinaikiiste der Bucht bei Elat (Israel)
liegenden, sehr salzigen Solar Lake isoliert.
Unsichere Arten:
7. Spirochaeta daxensis Cantacuzene 1910
Zellen schraubenformig, grofi, mit mindestens einer langlichen axialen Fibrille.
Zellenden zugespitzt. Protoplasmazylinder abgeflacht. Thermophiler
Organismus, bislang noch nicht kultiviert.
Zellen 0,5-2,5 x 30-100 um grofi.
Als frei lebende Spirochaete auf Algenbiischeln, am Grund heifier Quellen
(52°-56°) in Dax (Frankreich) beobachtet. Der Organismus haftet oft mit
einem Pol an Algen, wahrend das andere Ende im Wasser flutet. Oft auch auf der
Oberflache von Algenbiischeln kriechend oder unentwirrbare Haufen bildend.
Der Organismus wurde nicht wieder gefunden. Wegen unzureichender Be-
schreibung wird er von Canale-Parola et al. (1968) nicht anerkannt. Auch in
Bergey's Manual (1974) nicht angefiihrt.
Unsichere, ungeniigend beschriebene Arten:
Spirochaeta agilis Adelmann 1922
Morphologisch Spirochaeta huccalis ahnlich. 15-20 ^.m, nach der Teilung nur
6,0-9,0 um lang. Sehr schnell beweglich, Fortpflanzung durch Querteilung. Im
Schlamm eines Teiches in Kiel - Iltisbriicke auf der Kieler Forde (BRD)
gefunden.
Spirochaeta elusa Wolbach et Binger 1914
Treponema elusum (Wolbach et Binger 1914) Bergey et al. 1923
Zellen verhaltnismafiig klein, schraubenformig, sehr biegsam. Kleinere Formen
mit 1-2, grofiere mit 4—8 Windungen. In alteren Kulturen bilden sich an den
Zellen sowohl festsitzende als auch selbstandige kugelige Korperchen. Optimale
Wachstumstemperatur 30 °C. Fortpflanzung durch Querteilung.Lebhaft vor-
und riickwarts beweglich; rotiert um seine Achse. Grofiere Formen wellenartig
beweglich. Nicht pathogen.
Zellen 4,0-15,0 ^m lang; Windungen 0,5-1,0 ^m breit und 1,5-2,0 ^m lang.
In Wasser aus dem Jamaicateich in Boston (USA) gefunden.
Spirochaeta gigantea Warming 1875
Spirillum giganteum (Warming 1875) Trevisan 1889 (non Spirillum giganteum
Migula 1900)
Schraubenformiger Organismus mit geraden, gestutzten Enden. Protoplasma
fein granuliert. Ziemlich flexibel; mit bis zu 16 Windungen.
Zellen ungefahr 3,0 X 40,0 ^m-Windungen 2,5 um hoch und 7,0-9,0 um breit.
An der danischen Kiiste gefunden.
Spirochaeta graminea Zuelzer 1925
Morphologisch Spirochaeta stenostrepta ahnlich, jedoch mit breiteren
Windungen und weniger lichtbrechendem Protoplasma.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Arten • 373
Zellen 0,25 x 100 um grofi.
Am Grund von Fliissen, besonders bei Zersetzung von Zellulose, die mit der
Bildung von Methan verbunden ist. Haufig auch in Sumpfen und Mooren.
Urspriinglich aus einen Grasaufgufi beschrieben.
Zuelzer (1925) unterscheidet noch die im Meerwasser lebende Varietat
"marina*.
Spirochaeta minima Dobell 1912
(non Spirochaeta minima (de Beaure-paire-Aragao et Vianna 1913) Petit 1928)
Eine sehr kleine Spirochaetenart. Durch Aussehen, Bewegung sowie Fortpflan-
zungsweise Spirochaeta fulgurans ahnlich. Protoplasma farblos. Im Lichtmikro-
skop sehr schlecht sichtbar. Mit Eisenhaematoxylin gut farbbar. Fortpflanzung
wahrscheinlich durch Querteilung; es wurden segmentierte Formen gefunden.
Teilung lebender Individuen wurde nicht beobachtet. Extrem schnell beweglich,
was die Untersuchungen erschwert.
Zellen 2,0-2,6 ^.m lang, 0,5 um breit. Die kleinsten Individuen weniger als
2,0 \im lang, ihre Breite praktisch nicht mefibar.
Aus dem Sufiwasser des Flusses Granta, (Cambridge, England) beschrieben.
Spirochaeta pseudobuccalis Uhlenhuth et Zuelzer 1921
Im Sufiwasser als saprophytischer Organismus vorkommend. Morphologisch
Treponema huccale (= Spirochaeta huccalis), die in der Mundhohle des Men-
schen vorkommt, sehr ahnlich.
Spirochaeta pseudogallinarum Uhlenhuth et Zuelzer 1921
Im Sufiwasser vorhanden. Saprophyt. Morphologisch der vogelpathogenen
Borrelia anserina (= Spirochaeta gallinarum) ahnlich.
Spirochaeta pseudohebdomadis Zuelzer et Oba 1925
Etwas langer als Leptospira hehdomadis (= Spirochaeta hehdomadis), doch
dieser sehr ahnlich. Lebt im Morast, dort wo sich Papierfasern unter Entwick-
lung von Methan zersetzen. In Langenargen am Bodensee (BRD) gefunden.
Spirochaeta pseudopallida Uhlenhuth et Zuelzer 1921
Saprophytischer, der pathogenen Borrelia recurrentis (= Spirochaeta recurrentis)
ahnelnder Organismus.
Spirochaeta pseudorefringens Uhlenhuth et Zuelzer 1921
Sufiwassersaprophyt, der nicht pathogenen Treponema refringens (=
Spirochaeta refringens) ahnlich.
Spirochaeta sumatrana Zuelzer 1928
Ahnelt Spirochaeta plicatilis. Windungen so dicht, dafi sie miteinander ver-
schmelzen und schwer sichtbar sind; dadurch an die pathogene Leptospira
icterogenes (= Spirochaeta icterogenes) erinnernd.
Zellen 4,0 x 40,0-50,0 ^m grofi.
An der Ostkuste von Sumatra in verschiedenen Wasserarten vorkommend. In
Europa verhaltnismafiig selten. Vereinzelt auf den Rieselfeldern der Stadt Berlin
gefunden.
Spirochaeta vivax (Dobell 1912) Zuelzer 1925
Treponema vivax Dobell 1912
Farbloser, enorm flexibler, ziemlich beweglicher Organismus. Meist
schraubenformig mit 6 oder auch mehreren dichten, oder 1-2 lockeren Windungen. Durch
seine morphologischen Eigenschaften an kleine pathogene Stamme der Gattung
Treponema erinnernd. Farbt sich mit Giemsa rot. Bei lebenden Individuen
wurde keine Teilung beobachtet. Aus gefarbten, fixierten Praparaten lafit sich
auf Fortpflanzung durch Querteilung schliefien. Bei schneller Bewegung erin-
376 • Spirochaten - Cristispira
2,4 nm breit. Die Ausmafie variieren je nach den Fixierungs- und Farbenme-
thoden.
Im Verdauungstrakt der Muschel Anodonta mutahilis; mehrmals auch in Au-
stern gefunden.
2. Cristispira spiculifera (Schellack 1909) Gross 1910 (Fig. 228)
Spirochaeta spiculifera Schellack 1909
Schraubenformiger Organismus. Beide Zellpole zu feinen Terminalfaden ver-
jiingt. Chromatinmaterial in breiten Querstreifen. Ohne Kriste, wahrscheinlich
nicht sichtbar, da mit iiblichen Farbstoffen nicht farbbar. Bewegung und Fort-
pflanzungsweise nicht beschrieben. Zellen 0,7 x 28,0-35,0 um grofi. Windun-
gen 6,4 ^m lang und 2,0 ^m breit.
In der Muschel Anodonta mutahilis gefunden.
Arten unsicherer taxonomischer Stellung:
3. Cristispira pusilla (Schellack 1909) Gross 1910
Spirochaeta pusilla Schellack 1909
Spirochaeten mit zugespitzten Enden. Fortpflanzung durch Querteilung. Zellen
0,3-0,4 X 12,0-14,0 \un grofi. Im Verdauungstrakt der Sufiwassermuschel
Anodonta mutahilis. Die gleiche oder sehr ahnliche Art kommt im Darm von
Cyclas sp., Uniopictorum, Lima inflata, Lima hians, Ostrea edulis und Tapes sp.
vor.
Schellack (1909) halt diese Art fur identisch mit Cristispira hartmanni (=
Spirochaete hartmanni), die in der Meeresmuschel Pinna squamosa vor-
kommt.
4. Cristispira pachelabrae de Mello 1921
Spirochaete mit gekammerter Struktur, mit undulierender Membran (?) und
5-15 Windungen.
In der Siifiwassermuschel Pachelabrae moesta in Nova Goa (Indien) gefunden.
3. Borrelia Schwellengrebel 1907
Spiroschaudinnia Sambou 1907, Cacospira Enderlein 1917, Entomospira Ender-
lein 1917, Spironema Bergey et al. 1923.
Einzeln lebende, einzellige, gramnegative, schraubenformige Organismen; mit
3-10 mehr oder weniger lockeren, oft ungeraden, unregelmafiigen Windungen.
An der zytoplasmatischen Membran befinden sich unter der aufieren schaumar-
tigen Hiille 15-20 parallele Fibrillen, die sich schraubenformig um den plasmati-
schen Zylinder winden. Protoplasma mit Anilinfarbstoffen gut farbbar, vor
allem, wenn sie mit Phenol kombiniert werden.
Streng anaerober Organismus. Metabolismus fermentativ, Nahrungsanspriiche
und Wachstumsfaktoren bei den meisten Arten bisher unbekannt. Wachst nur
auf komplexen Kulturmedien mit naturlichen, animalischen Eiweisstoffen, man-
che Arten nur auf Hiihnerembryonen. Erforderliche Wachstumstemperatur2Q-
37 °C, wobei der Bereich von 28—30° optimal ist. Bewegung durch gleichzei-
tiges Rotieren des Protoplasmazylinders nach einer Seite und Rotieren der
Fibrillen nach der entgegensetzten; aufierdem durch Wellenbewegung oder
Biegung der Zellen.
Zellen 0,2-0,5 x 3,0-20,0 \un grofi, selten bis 1,0 ^.m breit und bis 25,0 urn lang.',
i
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Borrelia • 377
fchen p8raVaerSderliCh' abMng'g VOn der Herstellungsweise des mikroskopi-
Meist als Parasiten von Saugetieren, Vogeln sowie des Menschen vorkommend
Sie werden seltener durch unmmelbaren Kontakt als vielmehr durch Lause oder
Zecken ubertragen. Im Wasser nicht frei vorkommend
Elw7' ? tr? T°/Zta,e ~ verschleden lange Individuen, nach gefarbten
PWaten (nacK Dobell, 1912. - 1500X). Fig. 228. Cnstispira spiculifera - nach
verschiedenen gefarbten Praparaten (nach Dobell, 1912. - 1500X) Fig 229
Jreponema sp. - schematisiert (nach Zuelzer, 1921. - 1500X). Fig 230
Leptospira sp. - TeU des protoplasmatischen, um das Axostyl sich windenden Zylin-
tfers (nach Elektronen-Mikrophoto - Czekalowski, 1963. - 50000X)
378 • Spirochaten - Treponema - Leptospiraceae
In der gegenwartigen Veterinar- und mikrobiologischen Literatur werden diese
Organismen oft falschlich mit dem Gattungsnamen Spirochaeta bezeichnet.
Typus generis: Borrelia anserina (Sakharoff 1891), Bergey et al. 1925.
Da die zur Gattung gehorenden Arten nicht frei im Wasser vorkommen, wird
auf eine Beschreibung der einzelnen Arten verzichtet.
4. Treponema Schaudinn 1905 (Fig. 229)
Spironema Vuillemin 1905, Microspironema Stiles et Pfender 1905
Einzellige, selbstandige, gramnegative, stabchenformige Organismen mit
schraubenformigem Protoplast. Meist mit dichten, regelmafiigen (mitunter auch
unregelmafiigen) Windungen. An den Enden des Protoplasmazylinders haften
(1)—3—7 axiale Fibrillen.In alteren Kulturen konnen kugelige Gebilde, ahnlich
wie bei der Gattung Spirochaeta, vorkommen. Zellen im Nativpraparat nur im
Dunkelfeld oder Phasenkonzentrat sichtbar. Nach Giemsa schlecht, nach Ryn's
gut farbbar. Die meisten Arten wurden in Reinkulturen geziichtet. Streng
anaerob, chemoorganotroph, mit fermentativem Metabolismus. Als Energie-
quelle werden Aminosauren sowie Kohlenhydrate verwertet. Bewegung wahr-
scheinlich mit Hilfe der axialen Fibrillen.
Zellen 0,09-0,5 x 5,0-20,0 um.
Uberwiegend in der Mundhohle, im Verdauungstrakt und in den Genitalien
verschiedener Tiere oder des Menschen vorkommend. Manche Arten sind
pathogen fiir den Menschen. Leben nicht frei im Wasser. Die Klassifikation der
Gattung ist unzureichend und die Identifizierung der Arten schwierig.
Typus generis: Treponema pallidum (Schaudinn et Hoffmann 1905) Schaudinn
1905.
Die Beschreibungen der einzelnen Arten werden hier nicht aufgefiihrt.
2. Familie Leptospiraceae Hovind-Hougen 1979
Einzelne flexible Zellen schraubenformig gewunden, beweglich, gramnegativ.
Beide Zellenden hakenformig gebogen. Zwei axiale, subterminal verankerte
Faden, an jedem Pol der Zelle je einer vorhanden; in der Zellmitte iiberdecken sie
sich.
Aerobe oder mikroaerophile chemoorganotrophe Mikroorganismen. Zum
Wachstum werden hohere Fettsauren (mit C]4 und mehr) als hauptsachlich
Energie- und Kohlenstoffquelle benotigt. Als Kohlenstoffquelle konnen Am-
monium-Ionen besser als Aminosauren genutzt werden; auch Purine werden
verwertet.
Die Familie setzt sich aus frei lebenden saprophytischen Organismen sowie aus
fiir Mensch und Tier pathogenen Organismen zusammen.
Typus familiae: Leptospira Noguchi 1917
Bestimmungsschliissel der Gattungen:
la Axiale Fibrillen sind durch ein Basalkorperchen mit zwei Paaren von schei-
benformigen Strukturen verankert, wie Geifieln bei gramnegativen Bakte-
rien; Zellen ohne zytoplasmatische Tubuli. Enthalten 35,2-41,2 mol %
Guanin und Cytosin ... 1. Leptospira (S. 379)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptospira • 379
lb Axiale Fibrillen sind durch ein Basalkorperchen mit einem Paar von schei-
benformigen Strukturen verankert, wie Geifieln bei grampositiven Bakte-
rien; Zellen mit zytoplasmatischen Tubuli enthalten 51,2-53,0 mol %
Guanin und Cytosin 2. Leptonema (S. 380)
1. Leptospira Noguchi 1917 (Fig. 230)
Einzellige, ziemlich flexible, schraubenformige, gramnegative Organismen.
Meist beide Zellenden, seltener nur das eine hakig gebogen oder auch fast
rechtwinklig zur Langsachse stehend. Auf manchen Nahrboden verlieren einige
Stamme diese charakteristische Eigenschaft und sind gerade.Windungen in der
Mehrzahl so dicht, dafi sie an die Struktur eines Seils erinnern. Querschnitt des
Protoplasmazylinders ungefahr kreisformig. Der Zylinder windet sich gegen
den Uhrzeigersinn um das Axostyl. Dieser besteht aus zwei axialen, subterminal
mit einem 40-70 um grofien Knoten verankerten Fibrillen; der Knoten ist mit
einer Serie scheibenformiger Strukturen verbunden. Die freien Enden der
Fibrillen enden ungefahr in der Zellmitte. Sowohl der Protoplasmazylinder als auch
das Axostyl haben eine gemeinsame aufiere Hiille. Die Fibrillen bestehen aus
einem zarten, von einer Hiille umgebenen, ungefahr 20-25 mm breiten Innen-
mark. Das Axostyl hat wahrscheinlich die Funktion einer Geifiel, an die auch
seine Ultrastruktur erinnert. In den Zellen ist das Zytoplasma, die Membran und
das Kernmaterial wahrnehmbar. Nach Giemsa schlecht farbbar. Im Dunkelfeld
schon bei lOOfacher Vergrofierung gut zu beobachten, Phasenkontrast scheint
weniger geeignet zu sein. Bei Durchlicht nicht sichtbar. Zellen besitzen keine
zytoplasmatischen Tubuli. Axiale Fibrillen sind durch ein Basalkorperchen mit
zwei Paaren von scheibenformigen Strukturen, wie die Geifieln bei
grampositiven Bakterien, verankert. Sie enthalten 35,2-41,2 Mol % Guanin una Cytosin.
Streng aerobe, chemoorganotrophe Organismen, mit respirativem
Metabolismus. Als wichtigste Energie- und Kohlenstoffquelle dienen Fettsauren, beson-
ders ungesattigte, 15-16 C enthaltende Sauren. Gesattigte Sauren werden nur
dann verwertet, wenn keine ungesattigten zur Verfiigung stehen. Als Stickstoff-
quelle kann NH^ verwertet werden. Fiir das Wachstum sind Thiamin, Vitamin
B12, verschiedene Metallsalze, bei manchen Stammen auch noch bisher unbe-
kannte Faktoren erforderlich. Optimaltemperatur 28-30 °C; 40 °C wirkt
schon schadigend auf die Zellen; 56 °C ist letal fiir pathogene Stamme. Sapro-
phytische Stamme brauchen geringere Temperaturen. Optimale pH-Werte lie-
gen bei 7,2-7,4. Fortpflanzung durch Querteilung, wobei die entstehenden
Tochterzellen heftig schwingen und sich biegen. Bewegung auf dreierlei Art:
vorwarts und riickwarts schwimmend, um die Langsachse rotierend und durch
Biegung der Zelle; in fliissigen Medien schlangelnd. Beim Rotieren um die
Langsachse beschreibt das hakig gebogene Zellende verschiedene Bahnen. Zellen
meist 0,1 x 6,0-20,0 um grofi; Windungen 0,2-0,3 um breit und 0,3-0,5 um
hoch.
Im Blut in Cerebrospinalflussigkeit und im Urin gefunden sowie in Organen
infizierter Menschen oder Tiere (pathogene Stamme); saprophytische Stamme in
Oberflachengewassern vorkommend. Manche pathogene Stamme konnen im
Wirt, ohne ihm zu schaden, das ganze Leben lang als natiirliches Infektionsreser-
voir existieren. Es ist fraglich, ob sie in diesem Fall als Kommensalen oder
Parasiten leben. Die Taxonomische Gliederung der Gattung ist noch unklar.
Wichtigste Literatur: Stimson 1907, Wollbach und Binger 1914, Inada und Ido
1915, Inada et al. 1916, Hiibener und Reiter 1916, Uhlenhut und Fromme 1916,
Noguchi 1917, 1918, 1919, 1928, Castellani und Chalmers 1919, Gonder und
380 • Spirochaten - Leptonema
Gross 1919, Lehmann und Neumann 1920, 1927, Uhlenhut und Zuelzer 1921,
Brumpt 1922, Zuelzer 1925, Vinzent 1926, Wenyon 1926, Ford 1927.
Eine einzige Art:
Leptospira interrogans (Stimson 1907) Wenyon 1926
Spirochaeta interrogans Stimson 1907, Spirochaeta biflexa WoUbach et Binger
1914, Spirochaeta icterohaemorrhagiae japonica Inada et Ido 1915, Spirochaeta
icterogenes Uhlenhuth et Fromme 1916, Spirochaeta icterohaemorrhaggiae
Inada et al. 1916, Spirochaeta nodosa Hubener et Reiter 1916, Leptospira
icterohaemorrhagiae (Inada et al. 1916) Noguchi 1917, Leptospira biflexa (WoUbach et
Binger 1914) Noguchi 1918, Leptospira icteroides Noguchi 1919, Treponema
icterogenes (Uhlenhuth et Fromme 1916) Gonder et Gross 1919, Sporoschaudin-
nia icterohaemorrhagiae (Inada et al. 1916) Castellani et Chalmers 1919,
Spirochaeta icterohaemorrhagica Lehmann et Neumann 1920, Spirochaeta
pseudoicterogenes Uhlenhut et Zuelzer 1921, Spirochaeta pseudoicterogenes var. aquatilis
Uhlenhut et Zuelzer 1921, Treponema icteroides (Noguchi 1919) Brumpt 1922,
Treponema interrogans (Stimson 1907) Brumpt 1922, Treponema ictero-ha-
emorrhagica (Lehmann et Neumann 1920) Brumpt 1922, Treponema nodosum
(Hubener et Reiter 1916) Brumpt 1922, Spirochaeta icterogenes var. marina
Zuelzer 1925, Spirochaeta pseudoicterohaemorrhagiae Vinzent 1926, Leptospira
nodosa (Hubener et Reiter 1916) Ford 1927, Leptospira icterogenes (Uhlenhut et
Fromme 1916) Ford 1927, Spirochaeta icteroides (Noguchi 1919) Lehmann et
Neumann 1927, Leptospira interrogans (Stimson 1907) Noguchi 1928,
Leptospira pseudoicterogenes (Uhlenhut et Zuelzer 1921) Noguchi 1928.
Mit den Merkmalen der Gattung.
Mangels deutlicher Unterschiede werden einige friiher als selbstandige Arten beschriebene
Taxa derzeit in einer einzigen Art (Bergey's Manual 1974) vereinigt, obwohl etwa4 Grup-
pen von Stammen existieren, die als Arten unterschieden werden konnen. Bislang wurden
sie jedoch nicht benannt.
Mit den pathogenen Stammen vereinigte schon Zuelzer (1928), da keine morphologischen
Unterschiede Destehen, den folgenden frei lebenden, saprophytischen Organismus:
a. Leptospira biflexa (WoUbach et Binger 1914) Noguchi 1918
Spirochaeta biflexa WoUbach et Binger 1914, Spirochaeta pseudoicterogenes Uhlenhut et
Zuelzer 1921, Spirochaeta pseudoicterogenes var. aquatilis Zuelzer 1921, Spirochaeta
pseudoicterohaemorrhagiae Vinzent 1926, Leptospira pseudoicterogenes (Uhlenhuth et Zuelzer
1921) Noguchi 1928.
Morphologisch mit der Leitart fast identisch. In mehr oder weniger verunreinigtem Siifi-
und Salzwasser (Meerwasser) vorkommend; nicht frei im Wasser schwebend, sondern in
Kontakt mit einer festen Unterlage lebend. Deshalb am haufigsten in der oberen Schichtvon
Schlamm oder im schleimigen Uberzug von Wasserpflanzen und submersen Gegenstanden
vorkommend. Oft auch in Abwassern, bei Selbstreinigungsprozessen in Fliissen (nach
Ablauf der ersten stiirmischen Zersetzungsreaktionen), in schwach belasteten Belebungsan-
lagen im Belebtschlamm, in Uberziigen von Tropfkorpern u. a. Im Freiland haufig gemein-
sam mit Lamprocystis roseopersicina, Thiospirillum sanguineum, Zoogloea ramigera, Thio-
thrix u. a., haufig auf Proteinpartikeln in der oberen Schlammschicht,oft gemeinsam mit
Beggiatoa alba und Beggiatoa arachnoidea. Nach Zuelzer (1928) soil die Anwesenheit von
H2S reichliche Vermenrung ermoglichen, weil das Wachstum der iibrigen Mikroflora
unterdriickt wird.
2. Leptonema Hovind-Hougen 1979
Flexible, schraubenartig gewundene Zellen, gramnegativ. Die Zellenden sind
hakenformig gebogen. Sie haben zwei axiale Fibrillen, die subterminal durch ein
Basalkorperchen mit einem Paar von scheibenformigen Strukturen verankert ist,
so wie die Geifieln bei grampositiven Bakterien. Sie besitzen zwei Paar zytoplas-
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Arten • 381
matische Tubuli, die dicht an den zytoplasmatischen Membranen liegen. Sie
enthalten 51,2-53,0 mol % Guanin und Cytosin.
Sie sind obligat aerob oder mikroaerophil, chemoorganotroph. Zum Wachstum
werden Serum oder hohere Fettsauren mit langer C-Kette (CH oder mehr)
benotigt.
Fur einige Tiere sind sie pathogen, aufier Nagetieren und Rindern.
Wichtigste Literatur: Pillot 1965, Hanson 1965, Tripatky und Hanson 1972,
1973 a, 1973 b, Hanson et al. 1974, Hovind-Hougen 1979.
Eine einzige Art:
Leptonema illini Hovind-Hougen 1979.
Leptonema serotyp illini Hanson 1965.
Mit den Merkmalen der Gattung:
Negativ gefarbte Zellen sind 0,1 x 13,0-21,0 ^m grofi. Die Lange der Windun-
gen betragt 0,6 ^m und ihre Breite 0,1 ^m. Urspriinglich aus dem Harn kranker
Stiere isoliert.
Unsichere, ungeniigend beschriebene Gattungen und Arten:
Spirophis Nagler 1909
Ziemlich flexibler Organismus, der im Ruhezustand das charakteristische Auss-
sehen von Spirochaeten mit unregelmafiigen Windungen hat. Zellenden abge-
rundet. In fixierten und gefarbten Praparaten wirken lange Zellen an einigen
Stellen wie zerbrochen; wahrscheinlich kontrahiert sich die Axialfibrille wah-
rend der Fixierung unregelmafiig, so dafi die starker gedehnten Stellen heller
erscheinen. Axialfibrille an lebenden Individuen schraubenformig, dem
Organismus ein charakteristisches Aussehen verleihend. Bei lOOOfacher Vergrofie-
rung (Olimmersion) gut sichtbar. Fortpflanzung nicht beschrieben.
Fig. 231. Spirophis minima - verschiedene Exemplare (nach Nagler, 1909—
382 ■ Spirochaten - Unsichere Arten
Ein typisches Merkmal dieses Organismus ist die sich standig andernde Bewe-
gungsweise. Bald bewegt er sich schlangelnd, bald rollt er sich zu Schlingen
zusammen oder bewegt sich vor- oder riickwarts wie ein rotierender Korkenzie-
her; auch biegt er sich auf verschiedene Weise oder kriimmt sich nach alien
Seiten.
Die Einreihung dieses Organismus in die Gattung Spirochaeta ist problematisch,
wenn auch manche Merkmale an sie erinnern; Nagler (1909) schlagt deshalb den
Gattungsnamen Spirophis vor, obwohl er ihn selbst bei Spirochaeta einreihte.
Eine einzige Art:
Spirophis minima (Warming 1875) Lauterborn 1916 (Fig. 231)
Beggiatoa minima Warming 1875 (non Beggiatoa minima Vinogradskij 1888),
Spirochaeta flexibilis Nagler 1909, Spirobacillus minimus (Warming 1875)
Lauterborn 1913, Spirillum flexible (Nagler 1909) Mace 1913, Spirophis flexibilis
Bocher 1949.
Mit den Merkmalen der Gattung.
Zellen 20-70 um lang.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Arten ■ 383
Im Schlamm des Faulen Sees (Schweiz) gefunden und beschrieben.
Bei oberflachlicher Beobachtung kann der Organismus leicht mit Spirochaeta
plicatilis verwechselt werden.
Pseudospira Dobell 1912
Lange, feine, sehr flexible, fadenformige Organismen. Zylinderformige Zellen
mit kreisformigem Querschnitt, ihre Enden leicht verjiingt. Protoplasma farb-
los, Hyalin; mit mehreren grofien, stark lichtbrechenden, mit Methylenblau gut
gefarbten Inklusionen; sonst homogen. In gefarbten Praparaten wird eine
typische Kammerstruktur sichtbar; die Kammern sind verschieden grofi, ebenso
die Trennungssepten. Fortpflanzung durch Querteilung mit vorangehender
Einschnurung.
Sehr schnell, schlangenartig, vor- und riickwarts beweglich. Wahrend der
Bewegung bildet der Organismus eine verschiedene Anzahl von Wellen, die den
Eindruck erwecken, als ob er schraubenformig gewunden sei. Niemals um die
Langsachse rotierend. In Ruhe ist der Organismus gewohnlich gerade gestreckt.
Auch wenn sich der Organismus nicht bewegt, kann sich seine Zelle von einem
Ende zum anderen langsam wellen.
Eine einzige Art:
Pseudospira serpens Dobell 1912 (Fig. 232)
Mit den Merkmalen der Gattung.
Zellen 0,8 X 66,0 um grofi, meist 35,0 um lang. Einreihung sehr problematisch.
Beschreibung unzureichend.
Glaucospira Lagerheim 1892
Morphologisch Spirochaeta plicatilis sehr ahnlich; unterscheidet sich jedoch von
ihr durch das Vorhandensein des blaugriinen Pigments Phycocyanin. Faden
schmal, schraubenformig, sehr lebhaft beweglich. Ungefahr 2,0 um breit.
Beschreibung vollig unzureichend. Wie Dobell (1912) bestatigt, handelt es sich bei
der Farbangabe offensichtlich um einen Irrtum; die blaugriine Farbung wurde
wahrscheinlich durch optische Tauschung im unkorrigierten optischen System
verursacht.
Es wurden zwei Arten beschrieben: G. agilissima und G. tenuior, wobei sich
letztere nur durch geringere Breite unterscheidet.
Seit der Beschreibung nicht wieder beobachtet.
* Fig. 232. Pseudospira serpens - a natives Praparat, b nach Giemsa gefarbtes
PrSparat, c-d plasmolysiertes Praparat nach Giemsa gefarbt, e Methylenblau
gefarbtes Praparat - metachromatische Kornchen sichtbar, / mit Methylenblau
gefarbtes Praparat - Kammerstruktur gut sichtbar, g mit Methylenblau gefarbtes
Praparat - Teilungsstadium. (nach Dobell, 1912. - 2000X).
Teil VI. Spirillen und gekrummte Bakterien
Die Gruppe der schrauben- oder S-formig gekriimmten Organismen enthalt
zwei Familien, die nicht miteinander verwandt sind: Spirillaceae und Spirosoma-
ceae sowie eine Reihe taxonomisch unsicherer Organismen.
Bestimmungsschliissel der Familien
la Bewegliche, schraubengedrehte Zellen mit weniger als einer bis mehreren
Windungen; an einem oder an beiden Zellpolen Geifieln
1. Spirillaceae (S. 384)
lb Unbewegliche, gerade, leicht gebogene oder vibrioide Stabchen ringformige
Gebilde bildend. Oftin Form «3» oder «8» 2. Spirosomaceae(S.417)
1. Familie Spirillaceae Migula 1894
Rigide, verschieden grofie, S-formig gekrummte bis schraubengedrehte Zellen
mit mehr oder weniger abgerundeten Enden. Windungen weniger als eine bis
mehrere; nach Querteilung oft Kettchen bildend. Geifieln einzeln oder in
Biindeln an einem oder an beiden Zellpolen. Protoplasma der meisten Arten mit
grofieren oder kleineren, dunklen, lichtbrechenden Granula aus Poly-P-Hydro-
xybuttersaure. Nach Lewis (1940) enthalten einige Stamme auch Fettinklusio-
nen, die den Zellen nach Farbung, eine wabenartige Struktur verleihen. Granula
in einer oder zwei Reihen oder spiralig angeordnet. Zellen immer gramne-
gativ.
Einige Arten sind streng aerob oder obligat mikroaerophil; Sauerstoff dient als
Endakzeptor der Elektronen. Andere Arten sind anaerot. Alle Arten chemoor-
ganotropli. Karbohydrate werden nicht fermentiert, obwohl sie von einigen
Arten oxydiert werden konnen. Einige Arten vermogen Pigmente aus aromati-
schen Aminosauren zu bilden, andere Arten enthalten auch ein wasserlosliches,
gelbgriines, fluoreszierendes Pigment. Manche Sippen wachsen bei Vorhanden-
sein einer einzigen Kohlenstoff- oder Stickstoffquelle, andere benotigen ein
komplexes Medium.
Vermehrung durch Querteilung.
Die meisten Arten bewegen sich mit Hilfe von Geifieln. Die Ruck- und
Vorwartsbewegung ist mit Drehung der Zelle um ihre Langsachse verbunden
und erinnert an einen rotierenden Korkenzieher.
In Sufi- und Salzwassern (Meeren) sowohl als freilebende als auch saprophyti-
sche Organismen vorkommend. Einige Arten sind parasitisch oder fur Mensch
und Tier pathogen; andere leben als Kommensalen. Zu dieser Familie werden als
unsichere Arten auch Organismen unsicherer taxonomischer Stellung gerechnet,
obwohl sie mit ihr nur einige, vor allem morphologische Eigenschaften
(schraubenformig gedrehte Zellen) gemeinsam haben. Weitere sorgfaltige Studien sind
daher erforderlich. Beschreibungen der parasitischen und pathogenen
Organismen werden hier nicht gegeben.
Typus familiae: Spirillum Ehrenberg 1832
Bestimmungsschliissel der Gattungen
la Zellen einzeln lebendjkeine Kolonien bildend 2
lb Zellen immer Kolonien oder Aggregate bildend 13
2a Zellen durch Geifieln beweglich 3
2b Zellen unbeweglich, ziemlich grofi; ohne Geifieln; bilden ovale Sporen;
kommen im Rektalteil des Verdauungstraktes von Froschen vor
11. Sporospirillum(S.414)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Spirillum ■ 385
3a Zellen zylinder- oder stabchenformig, schraubig gebogen oder gedreht;
ohne Kern 4
3b Zellen schraubenformig, an den Polen verjiingt; mit deutlichem Kern; mit je
einer Geifiel an jedem Pol 10. Paraspirillum(S.413)
4a Streng aerob oder mikroaerophil 5
4b Streng anaeroberOrganismus; trittim Verdauungstrakt von Hundenauf . .
7. Anaerobospirillum (S. 411)
5a Geifieln in Biindeln an beiden, seltener an einem Zellpol (ausnahmsweise
nur je eine Geifiel an beiden Polen); Zellen enthalten Granula aus Poly-p%
Hydroxybuttersaure 6
5b Nur eine Geifiel an einem oder an beiden Zellpolen 10
6a MolekularerStickstoff wird nicht fixiert 7
6b Fixiert molekularen Stickstoff 9. Azospirillum (S. 412)
7a Zellen schmaler als 1,5 |xm; Geifieln meistens nur im Dunkelfeld sichtbar.
Streng aerob 8
7b Zellen breiter als 1,5 |xm; Geifieln schon im Phasenkontrast sichtbar.
Mikroaerophil 1. Spirillum (S. 385)
8b Organotrophe Organismen 9
8b Streng lithotropher, acidophiler Organismus
8. Leptospirillum (S. 411)
9a Sufiwasserorganismen, die bei einer Konzentration von 3% NaCl nicht
mehr wachsen 2. Aquaspirillum (S. 396)
9b Meeresorganismen, die noch bei einer Konzentration von 9,75% NaCl
wachsen 3. Oceanospirillum (S. 407)
10a Zellen maximal 0,8 (xm breit, ohne Granula; kommensale, parasitische oder
pathogene Organismen 11
10b Zellen 1,5 (im breit; an einem zugespitzten Ende eine Geifiel tragend. Am
breiteren Pol grofie Granula imlnneren des Protoplasmas
Microspira larvalis (S. 417)
11a Aerobe Organismen; parasitieren an den vegetativen Zellen von Bakterien
oder an Algen 12
lib Mikroaerophile bis anaerobe Organismen; kommen im Verdauungstrakt,
indenGenitalienundderMundhohledesMenschenundderTierevor.. . .
4. Campylobacter (S. 408)
12a Parasitieren an Bakterien 5. Bdellovibrio (S. 409)
12b Parasitieren an Algen 6. Vampirovibrio (S. 410)
13a Kolonien aus hornchenformig gebogenen Zellen bestehend 14
13b Kolonien in Form von facherartigen, flachen Aggregaten, die aus S-formig
gebogenen, leicht spindelformigen Zellen bestehen; am schmaleren Ende
des Aggregats mit einer gemeinsamen Geifiel
. 12.Pelosigma(S.414)
14a Primarkolonien ringformig, Sekundarkolonien unregelmafiige Anhaufun-
gen bildend; in eine dunne mukoide Kapsel eingeschlossen
13. Brachyarcus (S. 415)
14b Kolonien in Form kleiner Kugeln, Sekundarkolonien werden nicht gebil-
det; Schleim undeutlich 14.Pseudoromeria(S.416)
1. Spirillum Ehrenberg 1832
Zellen rigid, gram-negativ, in Form eines Korkenziehers schraubenformig und
regelmafiig gedreht, mit weniger als einer bis mehreren Windungen. Durch an
beiden Polen vorhandenen Biindel polarer Geifieln (bis 75) beweglich; Geifieln
leicht gebogen. Schon im Phasenkontrast und in negativ gefarbten Praparaten
deutlicn. Zellenden gewohnlich leicht verjiingt. Zellwand sehr deutlich, beson-
386 ■ Spirillen - Spirillum
ders im Dunkelfeld. Bilden weder Sporen noch entsprechende Ruhestadien.
Kokkoide Formationen in alteren Kulturen nicht vorherrschend wie dies bei
einigen Arten der Gattung Aquaspirillum der Fall ist. Protoplasma kornig; ohne
Piemente. Oft (besonders in alteren Zellen) enthalt es grofie, dunkle, stark
lichtbrechende Korner von Poly-p-Hydroxybuttersaure. Nach Lewis (1940)
kommen daneben mit Anilinfarbstoffen nicht farbbare Fettinklusionen vor.
Fettropfen entweder in einer Axialreihe (manchmal auch in zwei Reihen) oder in
Form einer Spirale angeordnet, die im optischen Schnitt eine Zickzack-Anord-
nung vortauscht. Nach Farbung bietet sie das Bild einer wabenartigen Struktur.
Obligat mikroaerophiler Organismus, der einen Sauerstoffgehalt von nur 1-9%
benotigt. Ernahrung chemoorganotroph mit strengem Respirationsmetabolis-
mus. Molekularer Sauerstoff dient als Endakzeptor der Elektronen. Anerob
wachst er nicht einmal in Anwesenheit von Nitraten; mikroaerotaktisch. Bisher
wurde der Organismus noch nicht auf vollstandig definierten Medien kultiviert;
seine Ernahrungsanspriiche sind daher nicht genau bekannt. Nitrate werden
nicht zu Nitraten reduziert. Kohlenhydrate werden weder fermentiert noch
oxydiert. Das Wachstum wird schon durch niedrige Konzentrationen von Na+
inhibiert; gleichfalls wirken Phosphate in grofieren Konzentrationen als 0,003
mal inhibierend (Cole und Rittenberg 1971). Bei hoherer NaCl-Konzentration
als 3% wachst der Organismus nicht. Er hydrolysiert Starke; Gelatine wird in
4 Tagen verflussigt. Aus aromatischen Aminosauren werden keine Pigmente
gebildet, ebenso auch nicht das fluoreszierende wasserlosliche Pigment. Die
optimale Temperatur liegt bei 30 °C. Der Organismus wachst nicht unter 10 °
und nicht iiber 42 °C. Begrenztes Wachstum bei 25 °C und 37 °C. Wachst
gut in einem aus Kasein bereiteten Medium, in dem Kasein das Pepton ersetzt;
Kasein kann nicht durch ein Gemisch entsprechender Aminosauren ersetzt
werden, da offenbar ein noch unbekannter Faktor erforderlich ist.
Vermehrung durch Querteilung. Die Vor- und Riickwartsbewegung der Zellen
wird von einer schnellen Rotation begleitet, wobei die Geifieln einen Kegelman-
tel umschreiben. Eine orientierte Bewegung wird durch Koordination der
Bewegung der vorderen und hinteren Geifieln ermoglicht. Die Koordination
kann nach Krieg et al. (1967) und Caraway und Krieg (1972) durch einige
spezifische Verbindungen reversibel beeinflufit werden.
Urspriinglich bestand die Gattung Spirillum aus einer heterogenen Organismengruppe,
deren Mitglieder nur die charakteristische Zellform gemeinsam hatten. In einer Reihe von
Fallen war die Beschreibung unzureichend, da nur die morphologischen Merkmale angege-
ben waren, und die urspriinglich beschriebenen Stamme nicht mehr vorhanden sind. In einer
Reihe von Fallen war die taxonomische Einordnung problematisch. Hyleman et al. (1973)
teilten die Arten, bei denen es moglich war physiologische und biochemische Studien
durchzufuhren, in drei Gattungen; diese Einteilung wurde, im Unterschied zu Bergey's
Manual (1974), auch in dieser Arbeit iibernommen. Aerobe Siifiwasserorganismen wurden
in der Gattung Aquaspirillum zusammengefafit; Meeresarten in der Gattung Oceanospirill-
um (wozu noch einige unsichere Arten, die nur im Meere vorkommen, gestellt wurden).
Nach dieser Einteilung verblieb in der eigentlichen Gattung Spirillum als einzige StilSwasser-
art, nur das obligat mikroaerophile Spirillum volutans. Zur gleichen Gattung sind fernereine
ganze Reihe von Organismen gestellt worden, deren Einteilung problematisch ist. In einigen
Arbeiten, so auch in Bergey's Manual (1974), wird in diese Gattung auch ein pathogener
Organismus - Spirillum minor Carter 1888 eingeordnet, dessen taxonomische Stellung
strittig ist. Er wird hier jedoch nicht aufgefuhrt.
Wichtigste Literatur: Ehrenberg 1832, 1838, Cohn 1875, Certes 1882, Winter
1884, Sorokin 1887, Carter 1888, Kutscher 1895, Lehmann und Neumann 1896,
Migula 1900, Nakanishi 1901, Matzuschita 1902, Schwellengrebel 1907, Wis-
louch 1914, Kolkwitz 1915, Enderlein 1917, 1925, Zettnow 1918, Noguchi
1921, Koppe 1924, Beijernick 1925, Dimitroff 1926, Ford 1927, Schroder 1932,
Giesberger 1936, Lewis 1940, Myers 1940, Skuja 1948,1956, Krasil'nikov 1949,
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Arten ■ 387
Cay ton und Preston 1955, Rodina 1956, Williams und Rittenberg 1956, 1957,
Bergey's Manual 1957, 1974, Vladimirova 1960, Terasaki 1961, Rittenberg und
Rittenberg 1962, Becking 1963, Krieg et al. 1967, Cole und Rittenberg 1971,
Caraway und Krieg 1972, Cyrus und Sladecek 1973, Hylemon et al. 1973.
Eine einzige Art:
Spirillum volutans Ehrenberg 1832 (Fig. 233).
Vibrio spirillum Miiller 1786, Spirillum ehrenbergi Matzuschita 1902, Dicrospi-
rillum volutans (Ehrenberg 1832) Enderlein 1917.
Mit den Merkmalen der Gattung.
Zellen nach 18-stundiger Kultur (bei Messung im Phasenkontrast) 1,4-1,7 x
14,0-60,0 (j,m grofi (Hylemon et al. 1973); Windungen 5,0-8,0 (xm breit und
16,0-28,0 urn lang. Williams und Rittenberg (1954) geben als Zellgrofie 1,5-2,0
x 17,0-33 \im, Migula (1900) soear 70,0 \im an.
In stehenden und faulenden Sufswassern und in Siimpfen vorkommend.
Urspriinglich (als Neotyp) aus einem Teich in Virginia (USA) und aus einer
Miscnkultur aus dem Wasser eines Zuckerraffinerie-Kiihlturms in England
isoliert.
Dieser Organismus ist die grofite Spirillum-Art und eine der langsten bekannten
Arten, gleichzeitig eine der groftten Mikroben iiberhaupt. Die Isolierung in
Reinkulturen war erst mit der Erfindung der Kapillarmethode (Rittenberg und
Rittenberg 1962) moglich.
Unsichere, ungeniigend beschriebene Arten.
Spirillum amyliferum van Tieghem 1879.
Leicht gebogene bis schraubenformige rigide Zellen mit 2—4 Windungen. Mit
4 Windungen ist die Zelle gewohnlich im Teilungsstadium. Mittels einer (?)
polaren Geifiel an jedem Polaktiv beweglich. Protoplasma mit Reservestoffen,
die Starkekornern ahnlich sind (?). Aufierdem entstehen, wie Migula (1900)
anfuhrt, in den Zellen stark lichtbrechende, dunkelkonturierte Sporen. Jede
Zelle bildet eine Spore; falls zwei vorhanden, ist die Zelle im Teilungsstadium.
Zuerst vergrofiern sich die Sporen bei der Keimung, spater bilden sie einen
gebogenen Keimling, der sich mit der Zeit schraubenartig kriimmt. Das
Protoplasma wird wahrend der Wachstumsphase durch Jod blau gefarbt mit Ausnah-'
me eines Punktes an jedem Zellpol, an dem spater die Sporen entstehen; wahrend
der Teilung farbt sich das Protoplasma gelb. Physiologie unbekannt, da nicht in
Reinkultur gezuchtet. Nach Migula (1900) ist dieser Organismus zu anaerobem
Wachstum fa'hig. Vermehrung durch Teilung und Bildung einer Querwand in
der Mitte der langen Zelle. Vor der Teilung kommen sich beide Enden der Zellen
naher und umwinden einander. Die in der Mitte entstehende Querwand ver-
schleimt allmahlich, bis sich beide Halften voneinander trennen, wobei der
Schleimrest gewohnlich an einem Pol der Tochterzelle verbleibt.
Zellen 1,2-1,5 \im breit; Windungen 3,4-4,0 \im breit und 6,0-9,0 (xm lang.
In schleimigen Sedimenten von faulenden stehenden Gewassern vorkommend.
Falls ein ahnlicher Organismus wiedergefunden werden sollte, waren vor allem
die Sporenbildung una die Art des Reservestoffes an Hand von Reinkulturen zu
iiberpriifen.
Spirillum azotocolligens Rodina 1956 (Fig. 238).
Leicht gebogene, allgemein bewegliche, grampositive Stabchen. Protoplasma
kornig; es enthalt grofie Korner, sehr ahnfich den bei der Gattung Azotobacter
vorkommenden; stark lichtbrechend; nicht aus Glykogen bestehend, sondern
offenbar Fettropfchen. Die Zellen vermogen atmospnarischen Stickstoff zu
fixieren. Die Fixierungsintensitat ist bei den einzelnen Stammen verschieden; sie
schwankt zwischen 4 bis_10, auch 12 mg N2/g Mannitol; bei ein und demselben
388 ■ Spirillen - Unsichere Arten
238 c e d
Fig. 238. Spirillum azotocolligens - a Wuchsform auf flussigem Medium von
Fedorov, b Wuchsform auf festem Medium von Fedorov, c Wuchsform auf
Fleischpeptonbouillon, d Wuchsform auf Fleischpeptongelatine nach zweitagi-
eer Kul tur, e Wuchsform auf Fleischpeptongelatine (nach Rodina, 1956. -
1000X).
Stamm ist sie jedoch stabil und bleibt lange Zeit konstant. Auf stickstofflosen
Medien gut wachsend; Humate sind nicht erforderlich. Auf festen Medien einen
weifilichen Aufflug bildend. Kolonien klein, weifilich, leicht konvex, trocken.
In fliissigen Nahrlosungen starke Triibung hervorrufend. Alle Stamme wachsen
auch als heterotrophe Organismen auf Medien, die Eiweifistickstoff enthalten,
bilden jedoch hier oft schon in jungen Kolonien Involutionsformen. Zellen
grofier, in die Lange gezogen, manchmal voller Korner; gewohnlich besitzen sie
auch eine grofiere Anzahl von Windungen oder sind bauchig bzw. spindel-
formig.
Zellen beweglich, wobei die Beweglichkeit auch in alten Kulturen nicht verloren
8eht-
Zellausmafie leicht variabel; die grofiten Individuen sind 4,6-6,65 x 1,3-
1,95 um, die kleinsten 3,9-5,5 x 1,3-2,0 urn grofi.
Diese Art wurde aus Wasserbecken des Krasnodarskij Bezirkes (UdSSR) iso-
liert.
Azospirillum lipoferum (= Spirillum lipoferum) ziemlich ahnlich, das sich aber
von Spirillum azotocolligens dadurch unterscheidet, dafi es in stickstofflosen
Medien Humate benotigt und in organischen Medien normale vegetative Zellen,
aber keine Involutions zellen bildet.
Spirillum camillae Cyrus et Sladecek 1973 (Fig. 236).
Zellen, zylindrisch, sehr diinn, schraubenformig, gewohnlich mit 2-3
Windungen. Bei einer grofieren Zahl von Windungen handelt es sich fast stets um
Doppel-Individuen, die durch Teilung der Mutterzelle entstanden sind und noch
einige Zeit zusammenhangen, bevor sie sich trennen. Protoplasma farblos, fein
Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Unsichere Arten • 389
gekornt. Physiologische Eigenschaften nicht bekannt. Organismus nur auf
Grand der morphologischen Merkmale beschrieben. Reinkultur noch nicht
erzielt. Vermehrung durch Querteilung; Zellen bleiben manchmal paarweise
zusammen. Lebhafte charakteristische, drehende Bewegung wie ein rotierender
Korkenzieher.
Zellen 0,8 um breit und 50-100 urn lang; mit 2-3 Windungen, die 5 urn breit und
26 um lang sind.
Meistens zusammen mit organischen Stoffen in stark verunreinigten Gewassern,
sehr oft gemeinsam mit anderen Arten der Gattung Spirillum.
Spirillum coprophilum Migula 1900.
Vibrio No 2 Kutscher 1895, Vibrio canus Matzuschita 1902, Vibrio suis Ford
1927.
Schraubenformige, immer bewegliche Zellen, mit 0,5-2,0 Windungen. Nur an
einem Pol befindet sich ein aus leicht gekrummten Geifieln bestehendes Bundel;
Geifieln des ofteren auch in zwei Bundel zusammengefafit. Zellen an den Polen
abgerundet. Aerober Organismus; auf Agar sind die Oberflachenkolonien klein,
in der Mitte gelb, an den Randern farblos, mit fein gezahntem Rand. Tiefer
liegende Kolonien sind gelbgriin, fein gekornt, abgerundet oder spindelformig.
Auf Gelatine sind Tiefenkolonien gelbgriin bis griin mit leicht gewelltem oder
scharf begrenztem Rand. Altere Kolonien sind gelber und homogener.
Oberflachenkolonien fein, transparent mit lappenformigem Rand.
Stichkulturen sind dick und zeigen die Form eines weifien Fadens; am unteren
Rand kann man einzelne Kolonien unterscheiden. An der Oberflache kann man
einzelne Kolonien unterscheiden. An der Oberflache ist ein weifi glanzender,
lappenformiger Aufwuchs vorhanden.
Ausmafte ungefahr 1,0 x 4,0-6,0 um.
In Jauche gefunden; kann von hier in Oberflachenwasser verschleppt werden.
Krasil'nikov (1949) vereinigt mit dieser Art auch Vibrio No 3 Kutscher (1895),
was nach Migula (1900) ein Synonym fur Spirillum mobile Migula (1900) ist.
Spirillum crassum Terasaki 1961.
(non Spirillum crassus Veillon et Repaci 1912 = Vibrio crassus (Veillon et Repaci
1912) Prevot 1940)
Dicke, schraubenformige, gramnegative Zellen mit stumpfen Enden;
Windungen (1-6) regelmafiig, eng. Bei einigen Individuen mit Volutin-Kornern. Auf
Festen Medien sind die Zellen kurzer. An beiden Polen Bundel von 10-20
Geifieln, die Bewegung in beide Richtungen ermoglichen. Aerober, chemoorga-
notropher Organismus mit Respirationsmetabousmus. Aus Kohlenhydraten
werden keine Sauren gebildet. Optimale Wachstumstemperatur 38-40 CC.
Geringes Wachstum noch bei 45 °C, jedoch nicht mehr bei 48 CC. Optimaler
pH-Wert 6,5-8,5, Wachstum im Bereich von pH 5,8-9,4. Verwertet Asparagin
und Harnstoff als einzige Stickstoffquelle. Anorganischer Stickstoff wird nicht
assimiliert. Als Kohlenstoff- und Energiequelle finden organische Sauren und
Zucker Verwendung.
24 Stunden alte Zellen aus Bouillonkulturen sind 1,3-1,5 x 10,0-40,0 (auch
100) (im grofi. Windungen 1,3-1,5 um breit und 6,0-7,0 urn lang. Zellen aus
Agarkulturen nur 3,0-15,0 urn lang.
Aus faulender Fliissigkeit der SufTwasserschnecke Cipangopaludina malleata
isoliert.
Spirillum endoparagogicum Sorokin 1887 (Fig. 237).
Ein Spirillum mittlerer Grofie mit 2-3 Windungen, an jedem Pol je eine nach
{odfiirbung sichtbare Geifiel; wahrscheinlich handelt es sich um ein Geifiel-
liindel.
390 ■ Spirillen - Unsichere Arten
Fig. 233. Spirillum volutans - mit verschieden grofien Poly-(3-Hydroxy-Butter-
saure-Kornchen. (Orig. - 2000X). Fig. 234. Spirillum kolkwitzii - a natives-
Praparat, b nach Geifielfarbung, c nach Volutinrarbung (nach Wislouch, 1914. -
1000X). Fig. 235. Spirillum kutscheri - (nach Mikrophoto - Migula, 1900-
2000X). Fig. 236. Spirillum camillae - (nach Cyrus und Sladecek, 1973. lOOOx)
Fig. 237. Spirillum endoparagogkum - a junge Zellen, b Endosporen bildende
Zellen, c keimende Endosporen im Innern der Mutterzelle (nach Sorokin, 1890.
- Vergrofierung nicht angegeben).
Im Protoplasma bilden sich kokkoide Sporen, die unter bestimmten Umstanden
noch im Innern der Mutterzelle keimen. Keimlinge zunachst gerade, spater
schraubenformig werdend.
In faulendem Wasser gefunden, das im modernden Holz eines ausgehohlten
Stammes von Populus niger aufgestaut war. ^^
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Unsichere Arten ■ 391
Physiologische Eigenschaften nicht bekannt, obwohl Dimitroff (1926) an-
nimmt, dafi Sorokin (1887) seine Beobachtungen an Hand von Reinkultur
durchgefuhrt hatte.
Spirillum giganteum Migula 1900 (nomen illegitimum)
(non Spirillum giganteum (Warming 1875) Trevisan 1899 = Spirochaeta gigantea
Warming 1875)
Grofie schraubenformige Zellen mit 8 langen, leicht gewellten, zu einem polaren
Bundel vereinigten Geifieln. Protoplasma deutlich kornig; es enthalt zahlreiche
Korner in zickzackformiger Anordnung, die dem Protoplasma ein wabenformi-
ges Aussehen verleihen. Schwellengrebel (1907) halt die Korner fur Volutin,
ebenso Zettnow (1918). Nakanishi (1901) betrachtet sie jedoch als Vakuolen.
Auf Agar bildet der Organismus spindelformige, kornige, tiefe Kolonien. Auf
Gelatine sind die tiefen Kolonien griinbraun, scharf begrenzt und kornig.
Oberflachenkolonien sind weifi mit griinbrauner Mitte, grobkornig, mit lappen-
formigen Randern. Um die Kolonien herum sinkt die Gelatine etwas ein.
Stichkulturen sind den oberen 2A fein und weifi, im unteren Drittel steril. An der
Oberflache findet sich ein weifier, porzellanartiger, stark lappiger Aufwuchs;
Gelatine um die Stichkultur herum leicht eingesunken.
Grofie nicht angegeben.
In Jauche gefunden.
Spirillum gigas Certes 1882.
Sehr lange, schraubenformige Zellen, mit 20-140 Windungen.
Bewegung typisch schraubig mittels polarer Geifieln.
Zellen 150-160 \im, manchmal bis 400 urn lang. Einzelne Windungen 4-6 urn
breit.
In Zisternenwasser in Aden (Siid-Jemen) gefunden. Sehr unzureichende Be-
schreibung. Wahrscheinlich ein Organismus, der nicht in die Gattung Spirillum
gehort.
Spirillum kolkwitzii Wislouch 1914 (Fig. 234).
Zellen schraubenformig; an beiden Enden mit je einem Bundel polarer Geifieln.
Die Anzahl der Windungen betragt zwischen 1 und 5. Das Plasma der jungen
Zellen ist homogen; bei alteren Zellen treten Volutin und Vakuolen auf.
Zellen 30,0-50,0 x 2,0-2,5 urn grofi. Windungen 9,0-14,0 um breit und 18,0-
24,0 (im lang.
In Gewassern mit faulenden Algen vorkommend. Unvollstandig beschrieben.
Spirillum kutscheri Migula 1900 (Fig. 235).
Spirillum undula majus Kutscher 1895.
Zellen gramnegativ, dick, schraubenformig, mit 2-6 Windungen. Morpholo-
gisch Spirillum undula sehr ahnlich, aber etwa um 'A grofier. In Reinkulturen
kommen neben gekrummten Zellen auch ganz gerade vor. Oft bilden sie auch
sehr lange, schmale schraubenformig gedrehte Faden. Beweglich mittels eines
Biindels von polaren Geifieln an beiden Enden. Protoplasma enthalt Volutinkor-
ner. Aerober, chemoorganotropher Organismus, der auf Agar abgerundete,
feine Kolonien bildet, in denen schon bei geringer Vergrofierung einzelne Zellen
zu erkennen sind. Spater werden die Kolonien in der Mitte gelbbraun. In
fliissigen Medien starkes Wachstum. Verwertet als Substrat Apfel- und
Bernsteinsaure. Als Stickstoffquelle werden auch Ammoniumionen
verwertet.
Zellen 1,5 urn breit und bis 7,5 um lang. Windungen 3,0-4,5 urn breit und 10,5-
12,5 (im lang.
Kommt in Wasser mit verwesenden Stoffen, faulenden Flvissigkeiten, Abwas-
sern und Jauche vor^^
392 • Spirillen - Unsichere Arten
Spirillum mancuniense Cayton et Preston 1955.
Schraubenformige, gramnegative Zellen. Grofitenteils in Form kleiner Vibrien
mit 0,25-0,5 Windungen. Manchmal kommen Individuen mit 2-3 Windungen
vor, seltener mit 30-40 Windungen. Beweglich mit Hilfe von Biindeln polarer
Geifieln an einem oder an beiden Polen.
Protoplasma mit den iiblichen Anilinfarbstoffen gut farbbar. Enthalt Vakuolen
und Volutinkorner, die sich manchmal zu kurzen, dicken, gekriimmten, die
Zellgestalt deformierenden Gebilden vereinigen. Ohne Fettinklusionen. Aer-
ober, fakultativ aerober, aber auch anaerober Organismus mit chemoorganotro-
pher Ernahrungsweise. Senkung des Luftdrucks auf 60 mm Quecksilbersaule
fiihrt zu besserem Wachstum; ohne Luftzufuhr langsamer wachsend. Optimale
Wachstums-Temperatur 28 °C; bei 36 °C wachst er langsam, bei 44 °C nicht
mehr. Nitrate werden nicht reduziert, es wird keine Katalase gebildet und
Glukose wird nicht fermentiert; die Bildung von Indol unterbleibt; Gelatine
wird langsam verfliissigt. In fliissigem Bouillon-Medium wachst der
Organismus nicht. NaCl inhibiert schon bei einer Konzentration von 0,5% das
Wachstum.
Zellen 0,7-1,0 X 2,0-300,0 um grofi. Windungen 2,0-3,0 um breit und 7,0-
8,0 um lang.
Aus faulendem gemahten Gras isoliert (Manchester, England).
Spirillum mobile Migula 1900.
Vibrio No 3 Kutscher 1875, Vibrio hyos Ford 1927.
Kleine, lebhaft bewegliche, an den Enden abgerundete Vibrien. Mit 3-8 feinen,
leicht gebogenen, in einem Biindel zusammengefafiten Geifieln. Protoplasma
stark gekornt mit der Tendenz Vakuolen zu bilden. Auf Agar sind tief e Kolonien
griingelb, spindelartig, mit verschieden grofien, am Rand lappenformigen Aus-
laufern. Oberflachenkolonien sind klein, unregelmafiig begrenzt, fein gekornt.
Altere Kolonien sind in der Mitte braun, faltig und mit stark lappigen Randern.
Stichkultur in Gelatine im oberen Teil breiter und schleierartig getriibt von hier
federformige Auslaufer ausgehend. An der Oberflache langsame Verfliissigung
der Gelatine mit Kraterbildung. Ausmafie nicht angegeben.
In Jauche gefunden.
Spirillum ostrae Noguchi 1921 (Fig. 240).
Schlankes kleines Spirillum mit 3-4 wenig ausgepragten Windungen. Zellenden
in gefarbten Praparaten in feine Faden auslaufend.
Zellen 1,0 x 7,0-21,0 um grofi; meistens 10 um lang.
Im Verdauungstrakt von Austern.
Spirillum rugula (Miiller 1786) Winter 1884.
Vibrio rugula Miiller 1786, Dicrospirillum rugula (Miiller 1786) Enderlein 1925.
Lange, leicht aber deutlich gebogene, seltener schraubenformige Zellen mit 2-3
Windungen und fein getupftem bis kornigem Protoplasma. Lebhaft beweglich
durch Biindel von 8-15 Geifieln an beiden Polen. Keine Sporen bildend. Nach
Lewis (1940) lagern sich Fett- und Volutinkornchen ab. Aerober, chemoorgano-
tropher Organismus. Auf Agarmedien wachst er verhaltnismafiig rasch (binnen
24 Stunden). Auf Gelatine bildet er tiefe, abgerundete bis ovale gelblich gefarbte
Kolonien mit auslaufenden Randern. Die Gelatine wird nicht verfliissigt.
Oberflachenkolonien sind weifi bis cremefarben, ebenfalls mit auslaufenden Randern.
In flussigen Medien langsam wachsend.
Zellen 0,9-1,5 X 5,0-15,0 urn grofi. Windungen 3,0-4,0 um breit.
Kommt massenhaft im Wasser vor. Koppe (1924) erwahnt Funde im faulenden
Schlamm des Ploner Sees, Schohsees, Drecksees und des Klinkerteiches in
Ostholstein (BRD).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@i
Unsichere Arten ■ 393
Spirillum sporiferum Migula 1900.
Lange, gerade, leicht gebogene bis mafiig schraubenformig gewundene Zellen
mit 2—4 Windungen. Bewegung lebhaft, mittels eines Biindels von 10-15 lang en,
schwach gebogenen polaren Geifieln.
Altere Zellen werden unbeweglich und teilen sich durch Querwande in kurze
Gebilde, die 2mal linger als breit sind. In diesen entstehen kokkenartige bis ovale
Sporen, die ebenso breit wie die Zelle sind. Keimung wurde nicht beobachtet.
Nach Reifung der Sporen zerfallen die Zellen und bilden eine schleimige Kapsel,
in der sich die Sporen als stark lichtbrechende Korper befinden. Manchmal
entstehen auch Sporen in nicht gegliederten Zellen. Ausmafie werden in der
Beschreibung nicht angegeben.
Nur einmal in garenden Bohnen gefunden.
Nach Krasil'nikov (1949) ist es nicht ausgeschlossen, dafi es sich um eine normale
sporulierende Bakterie handelt; trotzdem stellt er diesen Organismus Spirillum
kolkwitzii zu.
Spirillum tenerrinum Lehmann et Neumann 1896.
Spirillum No 1 Kutscher 1895, Spirillum subtilissimum Migula 1900, Vibrio
subtilissimus (Migula 1900) Ford 1927.
Sehr kleines Spirillum. Zellen S-formig, an den Enden zugespitzt. Lebhaft
beweglich. Bildet manchmal auch Zellbiindel mit 3-4 Windungen. Geifieln
konnten auch nach Farbung nicht gefunden werden. Auf Agarboden bildet die
Art tiefe, farblose oder leicht gelbe, spindelartige, kleine Kolonien mit kleinen
Auslaufern. Oberflachenkolonien klein, fein gekornt, scharf umgrenzt, mit
winzigen Tropfchen bedeckt. Stichkultur in Gelatine fadenformig, weifi; seit-
warts laufen wolkchenartige Biischelchen aus. An der Oberflache tritt eine
trichterformige Verfliissigung der Gelatine auf.
In Jauche una Schweinemist gefunden.
Spirillum tenue Ehrenberg 1838 (Fig. 241).
Schraubenformig gedrehte, gramnegative Zellen verschiedener Lange; die regel-
mafiige, feine Windungen von verschiedener Anzahl bilden. Beweglich; an
jedem Zellpol mit einem Biindel von 2-5 Geifieln.
Protoplasma mit Volutinkornern (?). Aerober, wahrscheinlich chemoorgano-
tropher Organismus. Als Kohlenstoff- und Energiequelle verwertet er eine
Reihe von Salzen organischer Sauren. Produziert Katalase und bildet aus
Glukose und Fruktose Sauren. Auf Agar entstehen kleine glatte Kolonien. Gelatine
wird nicht verfliissigt. Vladimirova (1960) macht auf die Fahigkeit zu autotro-
phen Wachstum wanrend gleichzeitiger Oxydation von Schwefelwasserstoff zu
Sulfaten und C02-Reduktion aufmerksam. Beim Wachstum auf organischen
Substraten geht die Fahigkeit, sich an autotrophe Ernahrungsweise zu adaptie-
ren, nicht verloren. Dienen Ammoniumsalze als einzige Stickstoffquelle, so
braucht der Organismus ein spezifisches kohlenstoffhaltiges Substrat um wach-
sen zu konnen. Nitrate werden zu Nitriten reduziert. Bei heterotrophem
Wachstum liegt das Temperaturoptiumum bei 30-37 °C, bei autotrophem nur
bei 20-25 CC. Kommt auf verwesenden Pflanzenresten im Wasser vor.
Zellbreite 0,5-0,7 um. Hinsichtlich der Zellange kommen grofie Unterschiede in
den Angaben verschiedener Autoren vor. Krasil'nikov (1949) gibt 4,0-15,0 urn
an, in Bergey's Manual (1957) fehlen Langenangaben. Skuja (1948,1956) berich-
tet von einer Lange von 10-75 und 35-70 um, Koppe (1924) von bis zu 120 um.
Nach Vladimirova (1960) ist die Zellange bei heterotropher Ernahrung wesent-
lich geringer als bei autotropher. Windungen sind nach Bergey's Manual (1957)
1,5-1,8 um breit, nach anderen Autoren 2,0-3,0 um und 3,5-5,0 um lang.
Krasil'nikov (1949) stellt zu dieser Art auch Spirillum virginianum und Spirillum
rugula.
394 ■ Spirillen - Unsichere Arten
Fig. 239. Azospirillum lipoferum - a junge, leicht deformierte Zellen, auf zuk-
kerreichem Milieu kultiviert, mit Kornchen von Poly-6-Hydroxy-Buttersaure,
b Zellen auf Medium mit Malat kultiviert; Kultur spharische CaC03-K6rnchen
enthaltend, c schraubenformige bewegliche Zellen aus iiberwiegend stickstoff-
haltigem Medium (Bouillon); Zellen onne Inklusionen, d bewegliche Zellen aus
Laktat-haltigem Medium; Zellen enthalten Inklusionen von Poly-p-Hydroxy-
Buttersaure-Kornchen ( nach Beijerinck, 1925. - lOOOx). Fig. 240. Spirillum
ostrae - (nach Dimitroff, 1926. - lOOOx). Fig. 241. Spirillum tenue - (nach
Krasil'nikov, 1949. - lOOOx). Fig. 242. Spirillum theophilii - (nach Cyrus und
Sladecek, 1973. - lOOOx). Fig. 243. Spirillum undula - (nach Krasil'nikov, 1949.
- 100X). Fig. 244. Spirillum virginianum - (nach Dimitroff, 1926. - lOOOx).
Spirillum theophilii Cyrus et Sladecek 1973 (Fig. 242).
Lange stabchenformige Zellen mit 1—4 Windungen. An beiden Zellpolen mit je
einem Geifielbiindel, an dem man im Phasenkontrast 2-3 Geifieln unterscheiden
kann. Sie sind gewohnlich kiirzer als die Zelle. Protoplasma farblos, fein
granuliert. Physiologische Eigenschaften nicht bekannt, da Reinkulturen nicht
erzielt wurden. Nur nach morphologischen Merkmalen beschrieben. Bewegung
lebhaft.
Zellen 0,8-1,0 X 20,0-50,0 |im grofi; Windungen 7^0-10,0 urn breit und
17,0(xmiang. —
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Arten ■ 395
Ahnelt Aquaspirillum serpens; letzteres ist jedoch kiirzer und besitzt mehrere
Geifleln im Biindel.
Spirillum undula (Miiller 1773) Ehrenberg 1832 (Fig. 243).
Vibrio undula Miiller 1773, Spirillum undula minor Kutscher 1895.
Zellen grofl, robust, schraubenformig, mit losen, grofltenteils linksdrehenden
Windungen. Es wurden auch rechtsdrehende Formen beschrieben. Mit 0,5-1,0,
ausnahmsweise auch mit 1,5-3 Windungen; selten mit 2-5 Windungen. An
jedem Pol mit einem Biindel von 3-9 (-15) Geifieln. Protoplasma junger Zellen
nicht gekornt, altere Zellen enthalten sowohl Fett als auch Volutinkorner (?) in
zickzackartiger Anordnung. Aerober bis fakultativ aerober Organismus. Litera-
turangaben iiber physiologische Eigenschaften sind nicht einheitlich. Dimitroff
(1926) und Bergey's Manual (1957) fiihren als Optimaltemperatur 25 °C an;
Myers (1940) 32 °C. Nitrate werden nicht reduziert und Indol wird nicht
gebildet. Nach Myers (1940) ist der Organismus aerob, nach Bergey's Manual
(1957) fakultativ aerob. Offenbar eine chemoorganotrophische Art, die als
Kohlenstoff- und Energiequelle eine Reihe von organischen Stoffen braucht. Als
Stickstoffquelle werden Asparagin oder Ammoniumionen benotigt. Athanol,
wird nach Giesberger (1936) verwertet, nach Myers (1940) jedoch nicht. Nach
Migula (1900) bilden sich an der Agaroberflache in der Mitte griinbraune, an den
Randern farblose, grobkornige Kolonien mit gezahntem Rand. Nach Myers
(1940) sind die Kolonien abgerundet, glatt, ungeteilt, konvex, durchsichtig, nach
Bergey's Manual (1957) grauweifi.
Zellen verschieden grofi, meistens im Bereich von 0,9-1,5 X 5,0-20,0 (xm.
Koppe (1924) gibt eine Breite bis zu 2,0 (im an. Windungen 3,0-3,6 (im breit
una 4,0-8,0 (im lang.
Der unter diesem Namen angefiihrte Organismus wurde in Jauche, in modern-
den Blattern, in Wasserpfiitzen, in Griinhausern und Graben gefunden; Bergey's
Manual (1957) gibt als Fundorte stehende und faulende Gewasser an.
Es ist vollig klar, daft die Bestimmung allein auf Grund morphologischer
Merkmale zweifelhaft und dafi Spirillum undula offensichtlich eine Sammelart
ist. Der urspriinglich beschriebene Stamm steht nicht mehr zu Verfiigung.
Cohn (1875) sieht keinen Unterschied zwischen diesem Organismus und Vibrio
prolifer Ehrenberg (1838). Krasil'nikov (1949) ordnet noch die selbstindige Art
Aquaspirillum serpens hier ein. Kutscher (1895) nannte eine kleinere Form
Spirillum undula minor.
Spirillum virginianum Dimitroff 1926 (Fig. 244).
Zellen schraubenformig, nicht biegsam, gramnegativ; in jungen Kulturen mit
0,5-3,0 Windungen, in alteren Kulturen bis zu 7 Windungen. Zellenden
abgerundet, im iibrigen verlaufen die Zellkonturen parallel. An jedem Pol eine
Geifiel, die fast ebenso lang wie die Zelle ist. Bei erwachsenen Individuen ist sie
etwas kiirzer, bei jungen langer. Bei einigen jungen Zellen tritt die Geifiel nur an
einem Pol auf. In alten Kulturen entwickeln sich geifiellose, kokkenartige
Gebilde. Das Protoplasma der Zellen lafk sich mit Gentianaviolett und Karbol-
fuchsin gut farben. Nach Lewis (1940) sind Fett- und Volutinpartikel vorhan-
den. Die Zellen enthalten einen lichtbrechenden axialen Faden, der parallel zur
Zellachse verlauft, jedoch nicht bis an die Pole reicht.
Chemoorganotropher, aerober bis fakultativ aerober Organismus. Als Kohlen-
stoffquelle werden Salze der Milch- und Zitronensaure verwertet. Nitrate
werden nicht reduziert. Optimaltemperatur nach Dimitroff (1926) 18 °C, nach
Bergey's Manual (1957) 35 °C.
Wahrend der Vermehrung verlangsamt sich die Bewegung der Zelle; das Zyto-
plasma entfernt sich in deji Mitte von der entstehenden Querwand, wobei
gleichzeitig der ganze Mitt^Bl der Zelle vibriert. Spater beginnen beide Pole zu
396 ■ Spirillen - Aquaspirillum
oszillieren und die Zelle schniirt sich in der Mine ein. Tochterzellen bleiben nach
der Trennung einige Zeit beisammen, trennen sich spater durch heftiges Zucken
und entfernen sich voneinander.
Die charakteristische Bewegung ist die eines sich drehenden Korkenziehers. Die
Richtung der Bewegung kann plotzlich geandert werden.
Zellen 0,6-0,9 x 3,0-11,0 um grofi. Krasil'nikov (1949) fiihrt eine Breite von
0,9-1,2 |xm an. Windungen 1,2 um breit und 4,0-5,0 um lang.
Kommt im Schlamm sowie im Verdauungstrakt von Austern vor.
2. Aquaspirillum Hylemon et al. 1973
Zellen schraubenformig oder nur schraubig gekriimmt, rigid, gramnegativ; mit
Hilfe eines Geifielbiindels an einem oder beiden Polen sich bewegend. Eine Art
mit vielen Geifieln, die iibrigen Arten nur mit einigen Geifieln je Geifielbiindel.
Einige Arten zeigen wahrend des Wachstums morphologische Anderungen.
Wahrend des Alterns andern sich die schraubenformigen Zellen allmahlicn in
ovale bis kokkoide Formen um. Nach Ubertragung in frisches Medium keimen
sie zu normalen Zellen aus. Diese Gebilde zeichneten Williams und Rittenberg
(1957) als Mikrozysten, das sie den spharischen Formen der Gattung Sporocyto-
phaga ahneln. Nach Williams und Rittenberg (1956) entstehen vegetative Zellen
entweder durch Verkiirzung und allmahliche Abrundung der Zellen, oder durch
Bildung seitlicher Auslaufer, in die allmahlich das Plasma der ganzen Zelle
iibertritt, oder aber durch gegenseitiges Umwinden und Verbindung zweier
Individuen, aus denen ein oder mehrere kokkoide Gebilde entstehen (sexueller
Mechanismus?). Das Plasma aller Arten, mit der Ausnahme von Aquaspirillum
gracile, enthalt Poly-(3-Hydroxybuttersaure-Granula.
Chemoorganotrophe Organismen mit strengem Respirationsmetabolismus;
molekularer Sauerstoff ist der Endakzeptor der Elektronen. Einige Arten wach-
sen in Anwesenheit von Nitraten anaerob. Kohlenhydrate werden nicht fermen-
tiert; einige Arten konnen diese beschrankt oxydieren. Kasein und Starke
werden nicht hydrolysiert. Bei einer Konzentration von 3% NaCl wird das
Wachstum eingestellt. Katalase positiv, manchmal nur schwach. Optimaltempe-
ratur bei den meisten Arten 30 °C. Alle Arten wurden in Reinkulturen geziich-
tet und untersucht.
Vermehrung durch Querteilung. Zellen 0,2-1,5 um breit, Zellenlange unter-
schiedlich bei verschiedenen Arten. Kokkoide Gebilde meistens 0,8-5,0 um im
Durchmesser. Nur Siifiwasser-Arten.
Da dieses Werk der Bestimmung der Mikroorganismen vor allem nach ihren
morphologischen Merkmalen dienen soil, wurde hierauf auch im Schliissel
Rucksicht genommen. Trotzdem war es erforderlich, auch einige der unentbehr-
lichen biochemischen Teste mit einzubeziehen. Die Bestimmung der einzelnen
Arten nach diesem Schliissel kann jedoch nur eine annahernde sein; zur genauen
Bestimmung mussen weitere Teste verwendet werden, die in der speziellen
Literatur zu finden sind. Organismen dieser Gattung wurden urspriinglich in die
Gattung Spirillum eingeordnet.
Typus generis: Aquaspirillum serpens (Miiller 1786) Hylemon et al. 1973.
Wichtigste Literatur: Winter 1884, Migula 1900, Giesberger 1936, Lewis 1940,
Myers 1940, Krasil'nikov 1949, Bergey's Manual 1957, 1974, Williams und
Rittenberg 1956, 1957, Williams 1958, 1959, Terasaki 1961, 1969, 1972, 1973,
1979, Leifson 1962, Pretorius 1963, Leifson et al. 1964, Canale Parola et al. 1966,
Hylemon et al. 1973, Kumar et al. 1974, Stength et al. 1976, Aragno und Schlegel
1978a, 1978b.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Aquaspirillum • 397
Bestimmungsschliissel der Arten
la Organismus aerob; optimale Wachstumstemperatur bis 30 °C 2
lb Organismus aerob, jedoch mikroaerophile Bedingungen bevorzugend;
optimale Temperatur bei 41 °C 2. A. bengal
2a Zellen mit mehr als 1 Windung 3
2b Zellen mit weniger als 1 Windung 15
3a Zellen hochstens 0,3 um breit 3. A. gracile
3b Zellen breiter als 0,4 (xm 4
4a Zellen mit hochstens 2 Windungen 5
4b Zellen mit mehr als 2 Windungen 10
5a Zellen in Anwesenheit von N03 anaerob wachsend 6
5b Zellen in Anwesenheit von NO3 nicht anaerob wachsend 8
6a Ein braunes, wasserlosliches Pigment aus Tryptophan oder Tyrosin bildend
4. A. itersonii
6b Kein Pigment aus Tryptophan oder Tyrosin bildend 7
7a Gelatine verflussigend;GeifielnimPhasenkontrast nicht sichtbar
15. A. psvchrophilum
7b Gelatine nicht verflussigend;GeifielnimPhasenkontrast sichtbar
16. A. fasciculum
8a Kann Co2 nicht als Kohlenstoffquelle verwerten 9
8b Co2 wird als Kohlenstoffquelle verwertet 17. A. autotrophicum
9a Verwertet Glutamat und Aspartat als einzige Kohlenstoffquelle in
Anwesenheit von NH4 1. A. serpens
9b Glutamat und Aspartat werden nicht als einzige Kohlenstoffquelle in
Anwesenheit von NH| verwertet 5. A. sinuosum
10a Zellen hochstens 0,7 (xm breit 11
10b Zellen breiter als 0,9 (xm; keine Sauren aus Fruktose bildend; in alteren
Kulturen iiberwiegen kokkoide Formen 13
11a Anzahl der Windungen mindestens 4; in alteren Kulturen iiberwiegen
kokkoide Formen 6. A. pereerinum
lib Anzahl der Windungen mindestens 1; in alteren Kulturen kokkoide Form
nicht iiberwiegend 12
12a Nitrate werden nur zu Nitriten reduziert 7. A. aquaticum
12b Nitrate werden vollkommen reduziert 8. A. dispar
13a Als einzige Kohlenstoffquelle wird in Anwesenheit von NH| Sukzinat
oder Glutamat verwertet 14
13b Als einzige Kohlenstoffquelle wird in Anwesenheit von NH1 weder
Sukzinat noch Glutamat verwertet
13a. A. giesbergeri (Spirillum graniferum)
14a Sukzinat wird in Anwesenheit von NH4 nicht, Glutamat verschieden
verwertet; bei 42 °C kein Wachstum mehr 9. A. anulus
14b Als einzige Kohlenstoffquelle wird in Anwesenheit von NH4+ sowohl
Sukzinat als auch Glutamat verwertet; bei 42 °C Wachstum nicht begrenzt
10. A. putridiconchylium
15a Zellen hochstens 0,5 um breit 16
15b Zellen breiter als 1,0 (xm 17
16a Geifieln (meistens 1) an beiden Polen; Granulierung im Plasma sichtbar;
kokkoide Formen iiberwiegen in alteren Kulturen; fluoreszierendes,
wasserlosliches Pigment wird gebildet 11. A. polymorphum
16b Geifieln nur an einem Pol; Granulierung im Plasma nicht sichtbar;
kokkoide Formen in alteren Kulturen nicht iiberwiegend; fluoreszierendes
Pigment wird nicht gebildet 12. A. delicatum
17a Granula werden nur ausnahmsweise gebildet; Sukzinat, Fumarat, Malat,
398 • Spirillen - Aquaspirillum
Laktat und Malonat werden in Anwesenheit von NH4 nicht als einzige
Kohlenstoffquellen verwertet; bildet kein fluoreszierendes Pigment;
wachst nicht bei 42 °C 13. A. giesbergii
17b Granula werden stets gebildet; Sukzinat, Fumarat, Malat, Laktat und
Malonat werden als Kohlenstoffquelle verwertet; wachst beschrankt auch
bei 42 °C 14. A. metamorphum
1. Aquaspirillum serpens (Miiller 1786) Hylemon et al. 1973 (Fig. 245)
Vibrio serpens Miiller 1786, Spirillum serpens (Miiller 1786) Winter 1884,
Spirillum serpens var. serpens Williams et Rittenberg 1957, Spirillum serpens var.
azotum Williams et Rittenberg 1957
Zellen lang, zart, schraubenformig, mit einer, hochstens zwei Windungen.
Migula(1900) gibtbis zu4 Windungen an. Plasma mit dunklen Kornern Poly-p-
Hydroxybuttersaure; zytologisch Spirillum volutans ziemlich ahnlich. Nach
Lewis (1940) selten auch mit Fettinklusionen. Im hangenden Tropfen kann
Schwarmbildung beobachtet werden, ein fur diese Art spezifisches Merkmal.
Zellen beweglich, mit je einem Geifielbiindel (bis 14 Geifieln enthaltend) an den
Polen. Geifieln unter dem Mikroskop in vivo nur im Dunkelfeld und auch nur
bei einigen Stammen sichtbar. Im Elektronenmikroskop ist die gleiche Grund-
struktur der Geifieln wie bei Proteus vulgaris zu beobachten. Kokkoide Formen
in alteren Kulturen nicht in der Oberzahl.
Streng aerober Organismus, auch in Anwesenheit von Nitraten nicht anaerob
wachst. Nitrate werden nicht reduziert. Bildet keine Sauren aus Kohlenhydra-
ten. Gelatine wird von einigen Stammen in 4 Tagen verfliissigt. Zwischenpro-
dukte des Trikarboxylzyklus werden nur in geringen Mafien oder iiberhaupt
nicht als einzige Kohlenstoffquelle verwertet, von den Aminosauren nur Gluta-
mat und Aspartat, falls NH| als Stickstoffquelle vorhanden ist. Nitrate,
Hamstoff und einige Aminosauren kann der Organismus nicht als Stickstoffquelle bei
Gegenwart von Sukzinat und Malat verwenden. Aus aromatischen Aminosauren
bildet er keine Pigmente; nur einige wenige Stamme bilden ein fluoreszierendes,
wasserlosliches gelbgriines Pigment. Die optimale Wachstumstemperatur liegt
bei 30 °C. Bei 25 °C und 37 °C wachst der Organismus langsam, bei 10 °C
und 42 °C iiberhaupt nicht.
Zellen 0,6-1,1 x 5,0-35,0 um grofi; Windungen der Spirale 1,2-2,8 um breit
und 3,5-12,0 urn lang.
Kommt in verunreinigtem Siifiwasser, stehendem Wasser und Jauche, in Stau-
becken, Abwassern, Seen oder Graben vor.
Williams und Rittenberg (1957) haben zwei Varietaten beschrieben:
la. Spirillum serpens var. serpens Williams et Rittenberg 1957
Entspricht der Leitart.
lb. Spirillum serpens var. azotum Williams et Rittenberg 1957
Schraubenformige gramnegative Zellen mit Inklusionen und 2 bis 3 breiten Windungen,
bipolare Geifselbiindel.
Unterscheidet sich von der Typusvarietat durch die Fahigkeit, Stickstoffverbindungen zu
verwerten; verfliissigt Gelatine; wachst gut auf Pepton und kann NH4, NOj, Harnstoff
und Asparagin als Stickstoffquelle verwerten. Als Kohlenstoffquelle werden Brenztrauben-,
Milch- una Apfelsaure gut verwertet, weniger intensiv dagegen Azetate, Propionate,
Butyrate, Sukzinate und Fumarate. Zucker, Glycerol, Athanol, Zitrate und Malonate
werden nicht assimiliert.
Optimale Wachstumstemperatur 32 °C, begrenztes Wachstum noch bei 40 °C. Wachs-
tum zwischen pH-Wert 6,5 und 9.0.
Zellen 0,8-0,9 X 10,5-16,5 \im grofi. Windungen 1,5-2,0 um breit und 5,0-5,6 um lang.
Aus Siifiwasser isoliert.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@i
Aquaspirillum • 399
2. Aquaspirillum bengal Kumar et al. 1974
Zellen rigid, grofi, schraubenformig, gramnegativ. In alteren Kulturen kokkoide
Gebilde nicht vorherrschend. Plasma mit Kornchen von Poly-p-Hydroxybut-
tersaure. Lebhaft beweglich, mit Geifielbiindeln an beiden Polen. Geschwindig-
keit der Bewegung 40-52 u.m/sec.
Aerober, jedoch mikroaerophile Bedingungen bevorzugender Organismus. In
Anwesenheit von Nitraten nicht anaerob wachsend. Nitrate werden nicht
reduziert. Aus Kohlenhydraten werden keine Sauren gebildet. Gelatine wird
nicht binnen 4 Tagen verfliissigt. In Anwesenheit von NH4 vermag er, organi-
sche Produkte des Trikarboxylzyklus und eine Reihe von Aminosauren als
einzige Kohlenstoffquelle zu verwerten. Mit Ausnahme von Histidin, Asparagin
und Harnstoff kann eine Vielzahl von Aminosauren bei Gegenwart von Sukzina-
ten und Malaten als einzige Stickstoffquelle dienen. Aus Tyrosin oder
Tryptophan wird ein hellbraunes wasserlosliches Pigment gebildet, fluoreszierende
Pigmente fehlen. Optimale Wachstumstemperatur 41 CC. Bei 15°-30°C
wird das Wachstum verlangsamt, mit steigender Temperatur beschleunigt.
Unter 10 ° und uber 45 °C wachst die Art nicht. Optimaler pH-Wert 7,2; pH-
Bereich des Wachstums 6,0-8,4.
Zellen 0,9-1,2 x 5,2.22,0 um lang.
Aus einem Sufiwasserteich in Westbengalen isoliert.
Morphologisch an Aquaspirillum putridiconchylium erinnernd.
3. Aquaspirillum gracile (Canale-Parola et al. 1966) Hylemon
et al. 1973 (Fig. 246)
Spirillum gracile Canale-Parola et al. 1966
Zellen diinn, schraubenformig, mit 3-5 Windungen. In alteren Kulturen sind
kokkoide Formen nicht vorherrschend. Plasma hochstwahrscheinlich ohne
Korner von Poly-p-Hydroxybuttersaure. Beweglich; an jedem Pol ein Geifiel-
biindel.
Streng aerobe Art; auch in Anwesenheit von Nitraten nicht anaerob wachsend.
Reduziert Nitrate nur zu Nitriten. Wandelt Glukose, Galaktose und Arabinose
in Sauren um, andere Kohlenhydrate jedoch nicht. Gelatine wird nicht binnen
4 Tagen verfliissigt. In Anwesenheit von NH| kann die Art keine organischen
Substanzen als einzige Kohlenstoffquelle verwenden; ebensowenig bei
Gegenwart von Sukzinat und Malat als einzige Stickstoffquellen. Aus aromatischen
Aminosauren bildet sie keine Pigmente, ebenso wird kein fluoreszierendes
Pigment produziert. Die optimale Temperatur betragt 30 °C; eingeschranktes
Wachstum ist noch bei 25 °C und 37 °C moglich; bei 10 ° und 42 °C wachst
die Art nicht mehr.
Zellen 0,2-0,3 x 4,0-14,0 um grofi. Windungen 0,5-2,0 um breit und 2,8-
3,5 um lang.
Wegen ihrer Zartheit und Flexibility passiert sie Filter (z. B. aus Zelluloseester)
mit einer Porengrofie von 0,45 urn, diese Eigenschaft kann man zur Isolierung
von Reinkulturen benutzen, indem man Agarplatten mit einem Filter bedeckt,
durch das die Zellen dann in den Agar hineinwandern.
4. Aquaspirillum kersonii (Giesberger 1936) Hylemon et al. 1973
(Fig. 247)
Spirillum itersonii Giesberger 1936, Vibrio kersonii (Giesberger 1936) Krasil'ni-
kov 1949, Spirillum itersonii subsp. itersonii Williams et Rittenberg 1957,
Spirillum itersonii subsp. vulgatum Williams et Rittenberg 1957, Aquaspirillum
itersonii subsp. niponicum (Terasaki 1973) Terasaki 1979, Spirillum itersonii
subsp. niponicum TeraaJy 1973
400 • Spirillen - Aquaspirillum
Zellen schraubenformig oder S-formig; mit weniger als 1-2 Windungen. Plasma
mit dunklen Kornern von Poly-(3-Hydroxybuttersaure. Altere Kulturen enthal-
ten kokkoide Gebilde. Clark-Walken (1969) nimmt an, dafi sie als Ergebnis der
Induktion defektiver Phagen entstehen. An jedem Pol haben die Zellen ein
Biindel polarer Geifieln.
Aerober Mikroorganismus, der in Anwesenheit von Nitraten auch anaerob zu
wachsen vermag. Nitrate werden nur zu Nitriten reduziert. Aus Glycerol und
Fruktose werden Sauren gebildet, nicht aber aus den iibrigen Kohlenhydraten.
Gelatine wird binnen 4 Tagen nicht verfliissigt. Eine Reihe organischer Verbin-
dungen wird als einzige Kohlenstoffquelle in Anwesenheit von NH| verwertet;
gleichfalls eine grofie Auswahl von Stoffen als einzige Stickstoffquelle, wenn im
Substrat Sukzinat und Malat vorhanden sind. Einige Stamme konnen als
N-Quelle auch Nitrate verwenden. Aus Tryptophan oder Tyrosin wird ein
wasserlosliches Pigment gebildet und gleichfalls ein fluoreszierendes gelbgriines
Pigment. Die optimale Wachstumstemperatur betragt 30 °C; bei 25° und
37 °C wachst die Art langsam, bei 10 ° und 42 °C nicht mehr.
Zellen 0,4-0,6 X 2,0-7,0 um grofi. Windungen 1,2-1,6 um breit und 3,0-
3,5 um lang.
Urspriinglich aus dem Wasserbehalter eines Warmhauses, der mit Wasser aus
dem Mississippi (USA) gefiillt war, isoliert.
Krasil'nikov (1949) stellt diese Art als Vibrio itersonii zu Vibrio aestuarii.
Williams und Rittenberg (1957) unterscheiden zwei Unterarten, Terasaki (1973) eine dritte:
4a. Spirillum itersonii subsp. itersonii Williams et Rittenberg 1957. Die Unterart istnicht
fahig, Nitrate als Stickstoffquelle zu verwerten.
4b. Spirillum itersonii subsp. vulgatum Williams et Rittenberg 1957. Unterscheidet sich
durch die Fahigkeit, Nitrate als Stickstoffquelle zu verwerten.
4c. Aquaspirillum itersonii subsp. nipponicum (Terasaki 1973) Terasaki 1979
Spirillum itersonii subsp. nipponicum Terasaki 1973.
Unterscheidet sich in der Zellange; 0,5-0,8 \im (meistens 0,5-0,6 Jim). Kokkoide Gebilde
entstehen erst spater (in alten Kulturen erst nach zwei Wochen zahlreich). Gefunden im
faulenden Aufgufi der Siifiwasserbach in Huratacho, Hiroshima (Japan) und der Muschel
Corbicula japonica aus Osaka (Japan).
5. Aquaspirillum sinuosum (Williams et Rittenberg 1957)
Hylemon et al. 1973 (Fig. 248)
Spirillum sinuosum Williams et Rittenberg 1957
Zellen schraubenformig, gramnegativ, mit 1-2 Windungen und mit Geifielbiin-
deln an beiden Polen. Plasma mit Inklusionen von Poly-p-Hyderoxybuttersau-
re. In alteren Kulturen sind kokkoide Gebilde nicht vorherrschend.
Streng aerobe Art; auch in Anwesenheit von Nitraten nicht anaerob wachsend.
Nitrate werden nicht reduziert. Bildet keine Sauren aus Kohlenhydraten.
Gelatine wird binnen 4 Tagen nicht verfliissigt. Als einzige Kohlenstoffquelle werden
in Anwesenheit von NH| nur einige Zwischenprodukte des Trikarboxylzyklus
(Malat, Oxalazetat, Brenztraubensaure) verwertet, Aminosauren als
Kohlenstoffquelle hingegen nicht. Nitrate, Harnstoff oder Aminosauren konnen nicht
als Stickstoffquelle mit Sukzinat und Malat im Substrat verwendet werden. Aus
aromatischen Aminosauren werden keine Pigmente produziert; gleichfalls kein
fluoreszierendes, wasserlosliches Pigment. Optimale Wachstumstemperatur
30 °C, beschranktes Wachstum bei 25° und 37 °C; wachst nicht mehr bei
10 ° und 42 °C.
Zellen 0,6-0,9 x 5,0-42,0 um grofi. Windungen 1,4-3,5 um breit und 8,5-
10,5 um lang.
Als Siifiwasser-Art isoliert.
Unterscheidet sich serologisch nicht von Aquaspirillum giesbergeri.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Aquaspirillum ■ 401
6. Aquaspirillum peregrinum (Pretorius 1963) Hylemon
et al. 1973 (Fig. 249)
Spirillum peregrinum Pretorius 1963, Aquaspirillum peregrinum subsp.
integrum (Terasaki 1973) Terasaki 1979, Spirillum peregrinum subsp. integrum
Terasaki 1973
Zellen rigid, schraubenformig, gramnegativ, mit 4-5 Windungen. In alteren
Kulturen herrschen kokkoide Formationen vor. Mittels polaren Geifielbiindel
an beiden Polen beweglich. Plasma mit dunklen Kornern von Poly-(3-Hydroxy-
buttersaure.
Streng aerobe Art; auch in Gegenwart von Nitraten nicht anaerob wachsend.
Nitrate werden nicht reduziert. Aus Fruktose werden Sauren gebildet, aus
anderen Kohlenhydraten hingegen nicht. Gelatine wird binnen 4 Tagen nicht
verfliissigt. Verwertet eine ganze Reihe von Zwischenprodukten des
Trikarboxylzyklus als einzige Kohlenstoffquelle in Anwesenheit von NH|. Eine Reihe
von Aminosauren werden als Stickstoffquelle bei Gegenwart von Sukzinat und
Malat beniitzt, Harnstoff jedoch nicht. Aus Phenylalanin, aber nicht aus
Tryptophan oder Tyrosin wird ein gelbes, wasserlosliches Pigment produziert.
Gleichfalls wird ein fluoreszierendes gelbgriines wasserlosliches Pigment
gebildet. Optimale Temperatur 30 °C; langsames Wachstum bei 25 ° und 37 °C.
Bei 10 ° und 42 °C erfolgt kein Wachstum mehr.
Zellen 0,5-0,7 x 5,0-22,0 urn grofi. Windungen 3,5-4,0 um lang und 1,4-
1,6 um breit.
Urspriinglich aus Teichwasser isoliert.
Terasaki (1973, 1979) unterscheidet die Unterart:
6a. Aquaspirillum peregrinum subsp. integrum (Terasaki 1973) Terasaki 1979
Spirillum peregrinum subsp. integrum Terasaki 1973
Kokkoide Gebilde als vornerrschende Zellform werden in Kulturen erst nach 28 Tagen
gebildet. Aufgefunden im faulenden Aufgufi der Muschel Cipangopaludina chinensis laeta in
Hiroshima (Japan).
7. Aquaspirillum aquaticum Hylemon et al. 1973 (Fig. 250)
Zellen schraubenformig, mittels bipolarer Geifielbiindel beweglich. Plasma mit
dunklen Kornern von Poly-(3-Hydroxybuttersaure. In alteren Kulturen
kokkoide Formen nicht vorherrschend.
Streng aerober Organismus, auch mit Nitraten nicht anaerob wachsend. Nitrate
werden nur zu Nitraten reduziert; aus Kohlenhydraten werden keine Sauren
gebildet. Gelatine wird binnen 4 Tagen nicht verfliissigt. Kann keine einzelnen
Kohlenstoffquellen ausniitzen, auch wenn als Stickstoffquelle NH4 zugegeben
wird, ebenso keine einzelne Stickstoffquelle, wenn Sukzinat und Malat
vorhanden sind. Bildet keine Pigmente aus aromatischen Sauren; produziert aber ein
fluoreszierendes wasserlosliches Pigment.
Zellen 0,5-0,6 x 2,5-13,0 um grofi; Windungen 0,8-10,0 um breit und 2,5-
5,0 (im lang.
Aus Sufiwasser isoliert.
8. Aquaspirillum dispar Hylemon et al. 1973 (Fig. 251)
Zellen schraubenformig, mittels bipolarer Geifielbiindel beweglich. Plasma mit
Kornern von Poly-p-Hydroxybuttersaure. Kokkoide Gebilde iiberwiegen in
alteren Kulturen nicht.
Streng aerobe Art; auch mit Nitraten wachst sie nicht anaerob. Nitrate werden
vollkommen reduziert. Bildet keine Sauren aus Kohlenhydraten. Gelatine wird
binnen 4 Tagen nicht verfliissigt. Als einzige Kohlenstoffquelle konnen in
Anwesenheit von NH4" eine Reihe von Zwischenprodukten des Trikarboxylzy-
402 ■ Spirillen - Aquaspirillum
Fig. 245. Aquaspirillum serpens - (nach Mikrophoto umgezeichnet- Hylemon,
1973. - 2000X). Fig. 246. Aquaspirillum gracile - (nach Mikrophoto
umgezeichnet - Canale-Parola et al., 1966. - 2000x). Fig. 247. Aquaspirillum itersonii-
(nach Mikrophoto umgezeichnet - Hylemon, 1973. - 2000X). Fig. 248.
Aquaspirillum sinuosum - (nach Mikrophoto umgezeichnet - Hylemon, 1973. -
2000 X). Fig. 249. Aquaspirillum peregrinum - (nach Mikrophoto umgezeichnet
- Pretorius, 1963, und Hylemon, 1973. - 2000X). Fig. 250. Aquaspirillum
aquaticum - nach Mikrophoto umgezeichnet - Hylemon, 1973. - 2000X).
Fig. 251. Aquaspirillum dispar- (nach Mikrophoto umgezeichnet - Hylemon,
1973. - 2000X). Fig. 252. Aquaspirillum anulus - (nach Mikrophoto
umgezeichnet - Hylemon, 1973 und Williams 1959. - 2000X). Fig. 253. Aquaspirillum
putridiconchylium - (nach Mikrophoto umgezeichnet - Hylemon, 1973. -
2000X).
klus und ahnliche Verbindungen, sowie auch einige Aminosauren verwertct
werden. Als einzige Stickstoffquelle wird in Anwesenheit von Sukzinat und
Malat (aber nicht von Nitraten) eine Reihe von Aminosauren assimiliert. Bildet
kein Pigment aus aromatischen Verbindungen; produziert jedoch ein fluoreszie-
rendes, wasserlosliches Pigment.
Zellen 0,5-0,7 X 3,1-3,8 \xm grofi; Windungen 1,0-1,4 [an breit und 2,0-
2,5 \un lang.
Aus Siifiwasser isoliert.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaq\
Aquaspirillum • 403
9. Aquaspirillum anulus (Williams et Rittenberg 1957) Hylemon
et al. 1973 (Fig. 252)
Spirillum anulus Williams et Rittenberg 1957
Zellen kornchenformig oder S-formig mit weniger als einer Windung. Schrau-
benformige Zellen haben bis zu 6 Windungen. Plasma mit Inklusionen von
Poly-B-Hydroxybuttersaure. Kokkoide Formen in alteren Kulturen nicht vor-
herrschend. An jedem Pol befinden sich Geifielbundel, die nur im Dunkelfeld zu
sehen sind.
Streng aerobe Art, wachst anaerob auch nicht bei Anwesenheit von Nitraten, die
auch nicht reduziert werden. Bildet keine Sauren aus Kohlenhydraten. Gelatine
wird binnen 4 Tagen nicht verfliissigt. Aus dem Trikarboxylzyklus wird nur
eine beschrankte Anzahl von Zwischenprodukten verwertet, von den
Aminosauren nur Glutamat als einzige Kohlenstoffquelle in Anwesenheit von NHJ.
Nur einige Aminosauren (Glutamat), jedoch weder Nitrate noch Harnstoff,
konnen als Stickstoffquelle bei Anwesenheit von Sukzinat oder Malat dienen.
Aus aromatischen Aminosauren werden keine Pigmente gebildet, auch kein
wasserlosliches gelbgriines, fluoreszierendes Pigment. Optimale Temperatur
30 °C. Bei 10 ° und 42 °C wachst die Art nicht mehr, bei 25 " oder 37 °C
nur geringfiigig.
Zellen 1,1-1,5 X 4,0-52,0 \im grofi. Windungen 1,7-4,0 \im breit und 5,0-
13,0 urn lang.
Aus Teichwasser isoliert.
10. Aquaspirillum putridiconchylium (Terasaki 1961) Hylemon
et al. 1973 (Fig. 253)
Spirillum putridiconchylium Terasaki 1961
Zellen in Form von Vibrionen mit abgerundeten Enden, S- oder schraubenfor-
mig, gewohnlich mit 3, hochstens mit 4 Windungen, gramnegativ. Plasma
einiger Individuen mit dunklen Granula von Poly-P-Hydroxybuttersaure. In
alteren Kulturen iiberwiegen vegetative Zellen, aber nicht kokkoide Formen. An
jedem Pol befindet sich ein Geifielbiindel, das nur im Dunkelfeld oder nach
Farbung sichtbar ist. Junge Zellen besitzen gewohnlich an jedem Pol nur eine
einzige Geifiel; mit dem Alter der Kultur nimmt die Anzahl der Geifieln zu.
Streng aerober Organismus; auch bei Anwesenheit von Nitraten nicht wach-
send. Nitrate werden nicht reduziert und aus Kohlenhydraten keine Sauren
gebildet. Gelatine wird binnen 4 Tagen nicht verfliissigt. Verwertet eine breite
Skala von Zwichenprodukten des Trikarboxylzyklus und ahnliche
Verbindungen als einzige Kohlenstoffquelle in Anwesenheit von NHJ". Einige
Aminosauren werden als Stickstoffquelle beniitzt, wenn Sukzinat oder Malat vorhanden
sind. Es werden keine Pigmente, auch keine wasserloslichen fluoreszierenden
gelbgriinen Pigmente gebildet. Optimale Temperatur 30 °C. Langsames
Wachstum bei 25 ° und 37 °C, sehr langsam bei 42 °C; bei 10 °C und 45 °C
nicht mehr wachsend. Die Zellen bewegen sich sehr rasch gleichmafiig vor- und
riickwarts und rotieren dabei entgegen dem Uhrenzeigersinn.
Zellen 0,9-1,2 X 4,0-22,0 \nm grofl; Windungen 6,0-7,0 \im lang, 1,8-2,0 (im
breit. Auf Agarboden sind die Zellen stets kiirzer.
Urspriinglich aus einem faulenden Sufiwasser-Weichtier, Semisulcospira benso-
nii, isoliert.
Morphologisch kann der Organismus sehr leicht mit Spirillum undula, Spirillum
virginianum. Aquaspirillum giesbergeri (= Spirillum graniferum),
Aquaspirillum sinuosum oder Aquaspirillum serpens verwechselt werden.
404 • Spirillen - Aquaspirillum
11. Aquaspirillum polymorphum (Williams et Rittenberg 1957)
Hylemon et al. 1973 (Fig. 254)
Spirillum polymorphum Williams et Rittenberg 1957
Zellen schraubenformig, weniger als eine Windung bildend. Meistens mit je
einer Geifiel an den Polen. Plasma mit Granula von Poly-|3-Hydroxybuttersau-
re. In alteren Kulturen iiberwiegen kokkoide Formen.
Streng aerober Organismus, auch in Gegenwart von Nitraten nicht anaerob
wachsend. Nitrate werden nur zu Nitriten reduziert. Bildet keine Sauren aus
Kohlenhydraten. Gelatine wird binnen 4 Tagen nicht verfliissigt. Als einzige
Kohlenstoffquelle werden in Anwesenheit von NHJ nur Salze der Apfelsaure,
Azetat und eine beschrankte Anzahl von Aminosauren verwendet. Als einzige
Stickstoffquelle wird eine ganze Reihe von Aminosauren in Anwesenheit von
Sukzinaten und Malaten beniitzt. Pigmente werden aus aromatischen
Aminosauren nicht produziert; es wird jedoch ein wasserlosliches fluoreszierendes
Pigment gebildet. Optimale Temperatur 30 °C; beschranktes Wachstum bei
25 °C und 37 °C. Bei 10 ° und 42 °C wachst die Art nicht mehr.
Zellen 0,3-0,5 X 3,5-8,4 \im grofi, Windungen 0,5-0,8 urn breit.
Aus Teichwasser isoliert.
12. Aquaspirillum delicatum (Leifson 1962) Hylemon
et al. 1973 (Fig. 255)
Spirillum delicatum Leifson 1962
Zellen leicht schraubenformig gekrummt, mit weniger als einer Windung.
Bewegung mit Hilfe von 1-6 polstandigen Geifieln, die nur an einem Pol sitzen.
Nur in Teilungsstadien finden sich Individuen mit Geifielbiindeln an beiden
Polen. Plasma ohne sichtbare Granula von Poly-|3-Hydroxybuttersaure, ob-
wohl die chemische Reaktion auf diese Verbindung positiv ist. In alteren
Kulturen kokkoide Formen nicht iiberwiegend.
Streng aerobe Art, die auch in Gegenwart von Nitraten nicht anaerob wachst.
Nitrate werden nur zu Nitriten reduziert. Sauren aus Kohlenhydraten werden
nicht gebildet. Gelatine wird binnen 4 Tagen nicht verfliissigt. In Anwesenheit
von NHJ vermag die An als einzige Kohlenstoffquelle eine Reihe von Zwi-
schenprodukten des Trikarboxylzyklus und verwandter Verbindungen zu ver-
werten, nicht aber Aminosauren. Als einzige Stickstoffquelle beniitzt sie eine
ganze Reihe von Aminosauren sowie Nitraten bei Anwesenheit von Sukzinat
und Malat. Bildet keine Pigmente aus aromatischen Aminosauren, gleichfalls
kein fluoreszierendes Pigment. Optimale Temperatur 30 °C, beschranktes
Wachstum bei 25° und 37 °C; bei 10° und 42 °C wachst die Art nicht
mehr.
Zellen 0,3-0,5 X 3,0-5,0 urn grofi, Windungsbreite 0,4-0,7 um.
Urspriinglich aus destilliertem Wasser isoliert.
13. Aquaspirillum giesbergeri (Williams et Rittenberg 1957)
Hylemon et al. 1973 (Fig. 256)
Spirillum giesbergeri Williams et Rittenberg 1957, Spirillum graniferum Williams
et Rittenberg 1957
Zellen schraubenformig oder in Form leicht gekrummter Stabchen und kleiner
Vibrionen. Grofitenteils mit weniger als einer Windung; gramnegativ. Zu alteren
Kulturen herrschen die kokkoiden Gebilde nicht vor. Einige Stamme enthalten
nur ausnahmsweise im Plasma dunkle Granula von Poly-|3-Hydroxybuttersau-
re, andere enthalten sie dagegen regelmafiig. Bewegung durch Geifielbiindel an
beiden Polen; Geifieln konnen nur im Dunkelfeld erkannt werden.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@i
Aquaspirillum • 405
Fig. 254. Aquaspirillum polymorphum - (nach Mikrophoto umgezeichnet -
Hylemon, 1973. - 2000X). Fig. 255. Aquaspirillum delicatum - (nach
Mikrophoto umgezeichnet - Hylemon, 1973. - 2000X). Fig. 256. Aquaspirillum
giesbergeri - (nach Mikrophoto umgezeichnet - Hylemon, 1973. - 2000X).
Fig. 257. Aquaspirillum metamorphum - (nach Mikrophoto umgezeichnet -
Hylemon, 1973. - 2000X). Fig. 258 Paraspirillum vejdovskii - (nach Dobell,
1912.-2000X).
Streng aerober Organismus, von dem einige Stamme auch mikroaerophil wach-
sen konnen. Anaerob wachst er auch nicht in Anwesenheit vom Nitraten.
Nitrate werden nicht reduziert. Bildet keine Sauren aus Kohlenhydraten.
Gelatine wird binnen 4 Tagen nicht verfliissigt. Verwendet nur einige Zwischenpro-
dukte (Brenztraubensaure) des Trikarboxylzyklus als einzige Kohlenstoffquelle
in Anwesenheit von NHJ. Aminosauren werden als Kohlenstoffquelle nicht
verwertet. Als Stickstoffquelle konnen bei Anwesenheit von Sukzinat und Malat
nur einige Aminosauren dienen, Nitrate dagegen nicht. Aus aromatischen
Aminosauren werden keine Pigmente gebildet, auch kein fluoreszierendes gelb-
griines, wasserlosliches Pigment. Optimale Temperatur 30 °C, beschranktes
Wachstum bei 25 °C und 37 °C. Bei 10° und 42 °C erfolgt kein Wachstum
mehr.
Zellen 1,1-1,4 X 4,0-40,0 u grofi, Windungen 2,0-5,0 um breit.
Urspriinglich aus Teichwasser isoliert.
Hylemon et al. (1973) stellen zu dieser Art noch eine weitere, die serologisch iibereinstimmt:
13a. Spirillum graniferum Williams et Rittenberg 1957
Zellen schraubenformig, mit 1-3 Windungen. Bewegung durch Geifielbiindel an beiden
406 • Spirillen - Aquaspirillum
Polen. Geifieln nur im Dunkelfeld sichtbar. Plasma regelmafiig mit Granula von Poly-(5-
Hydroxybuttersaure. Streng aerober Organismus. Optimale Temperatur 30 °C. Bei 10°
und 42 °C wachst er nicht mehr.
Zellen 1,0-1,2 X 7,0-25,0 \im grofi, Windung 3,5-4,2 ^m breit und 7,0-8,4 ^m lang.
Aus Siifiwasser isoliert.
Serologisch identisch auch mit Aquaspirillum sinuosum.
14. Aquaspirillum metamorphum (Terasaki 1961)
Hylemon et al. 1973 (Fig. 257)
Spirillum metamorphum Terasaki 1961
Morphologisch ist dieser Organismus Aquaspirillum gieshergeri und Spirillum
kutscheri ahnlich. Junge Kulturen enthalten schraubenformige Zellen oder zu
einer Schraubenlinie gewundene Zellketten; nach Rekultivierung selten schrau-
benformig, meistens S-formig, grofitenteils mit weniger als einer Windung.
Gramnegativ. Plasma der meisten Zellen mit dunklen Granula der Poly-p-
Hydroxybuttersaure, am haufigsten in 48 Stunden alten Zellen. Kokkoide
Stadien iiberwiegen in alteren Kulturen nicht. An beiden Polen befinden sich
Geifielbiindel, die sich gut nach Loffler farben lassen. Junge Zellen besitzen 1-3
Geifieln im Biindel; die Anzahl der Geifieln wachst mit dem Alter der Kultur.
Streng aerober Organismus, wachst anaerob nicht einmal in Anwesenheit von
Nitraten. Nitrate werden nicht reduziert und aus Kohlenhydraten werden keine
Sauren gebildet. Gelatine wird binnen 4 Tagen verfliissigt. Verwertet eine grofie
Zahl von Zwischenprodukten des Trikarboxylzyklus und eine Reihe von
Aminosauren als einzige Kohlenstoffquelle, wenn als Stickstoffquelle NH^ vorhan-
den ist. Als Stickstoffquelle werden nur einige Aminosauren beniitzt, falls
Sukzinat oder Malat vorhanden sind. Nitrate und Harnstoff kann die Art nicht
verwerten. Bildet keine Pigmente aus aromatischen Aminosauren, produziert
jedoch ein gelbgriin fluoreszierendes, wasserlosliches Pigment. Optimale
Temperatur 30 °C; bei 25° und 37 °C wachst die Art langsam, bei 10° und
45 °C iiberhaupt nicht.
Zellen mit weniger als einer Windung 1,1-1,3 X 4,0-9,0 |xm; Windungsbreite
2,8-3,0 \im.
Kommt in verunreinigten Siifiwassern vor. Ursprunglich aus faulender Fliissig-
keit aus dem Siifiwasser-Weichtier Corbicula japonka isoliert.
15. Aquaspirillum psychrophilum (Terasaki 1973) Terasaki 1979
Spirillum psychrophilum Terasaki 1973
Kurze schraubenformige (rechtsdrehende) oder S-formige Zellen; meistens mit
l,5Windungen in 48 Stunden alten Kulturen. Seltener kurze Stabchen oder
schraubenformige Zellen mit zwei Windungen. Beweglich mittels bipolarer
Geifielbiindel. Gramnegativ. Keine metachromatischen Granula bildend.
Kokkoide Gebilde in alten Kulturen nicht vorherrschend.
Anaerobes Wachstum in Anwesenheit von Nitraten, die zu Nitriten reduziert
werden; dabei entsteht Gas. Sauren werden aus Karbohydraten nicht gebildet.
Nicht wachstumsfahig auf organischen Sauren, Sacchariden und Alkoholen als
einziger Kohlenstoffquelle. Harnstoff, Asparagin, Nitrate oder Nitrite werden
nicht als Stickstoffquelle assimiliert. Askulin, Hippurat, Starke und Kasein
werden nicht hydrolysiert. Kein Wachstum bei Anwesenheit von 2% NaCl.
Hefeautolysat stimuliert das Wachstum. Wachstum erfolgt im Temperaturbe-
reich von 2-26 °C, Optimum bei 20 °C und bei pH 5,5-9,0.
Zellen 0,7-0,9 x 1,5-14,0 (im grofi. Meist 3,5-8,5 ^m lang. Windungslange
5,5-6,5 |xm, Breite 1,0-1,4 |x.
Isoliert aus einem Aufgufi des in der Antarktis gefundenen Mooses Ceratodon
purpureus.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@i
Aquaspirillum • 407
16. Aquaspirillum fasciculum Strength et al. 1976
Stabchen mit polaren Geifielbiindeln, Schatten bei schrager Beleuchtung oderim
Phasenkontrast sichtbar. Geifieln weisen eine charakteristische schraubenartig-
wellige Bewegung auf, die von der Basis zur Spitze der Geifiel fortschreitet.
Obwohl die Aktivitat der Geifieln sehr grofi ist, bewegen sich die Zellen nur
langsam. Bei der Vorwartsbewegung umgibt das apikale Geifielbiindel in weiten
Windungen die Zelle, wahrend das distale Geifielbiindel sich frei hinter der Zelle
bewegt. Verandert die Zelle die Richtung, so andert sich die Bewegungsweise der
Geifieln entsprechend. In Ruhestellung winden sich die Geifieln wie eine Uhrfe-
der auf. Die Bewegung der Zellen ist auf kurze Strecken geradlinig. Das
Protoplasma enthalt sichtbare Poly-p-Hydroxybuttersaure-Granula. Alte
Kulturen weisen kokkoide Gebilde auf.
Obligat aerober Organismus mit Respirationsmetabolismus; Sauerstoff wirkt als
Endakzeptor der Elektronen. Chemoorganotroph. Anaerob wachstumsfahig
bei Anwesenheit von Nitraten, die zu Nitriten reduziert werden. Wachst nicht
bei Anwesenheit von 1% NaCl. Gelatine wird nicht verfliissigt. Askulin,
Hippurat, Tributyrin, Kasein und Starke werden nicht hydrolysiert. Karbohy-
drate werden nicht assimiliert, wohl aber Zwischenprodukte des
Trikarboxylzyklus (aber nicht Zitrat und a-Ketoglutarat); ferner dienen Valerat, Poly-P~
Hydroxybuttersaure und einige Aminosauren als einzige Kohlenstoffquelle.
Nitrate, Amonium-Ionen wie auch Aminosauren konnen als Stickstoffquelle
benutzt werden.
Zellen 0,7-0,9 x 5,0-10,0 \im grofi. In alten Kulturen kommen bis zu 42 |xm
lange Zellen vor.
In Teichwasser gefunden.
Wahrscheinlich identisch mit Stammen, die Houwink (1953), Jarosch (1969) und
Strenght und Krieg (1971) beschrieben haben.
17. Aquaspirillum autotrophicum Aragno et Schlegel 1978
Zellen mittelgrofi, gekriimmt bis schraubenformig (rechtsdrehend). Junge
Zellen langer als eine Windung, altere bedeutend langer. Gramnegativ. Beweglich
durch Geifielbiindel (1-5) an beiden Polen. Im Innern des Zytoplasmas Granula
von Poly-p-Hydroxybuttersaure.
Streng aerob; chemoorganotroph mit strengem Respirationsmetabolismus, wo-
bei Sauerstoff der Endakzeptor der Elektronen ist. Anaerob auch nicht in
Anwesenheit von Nitraten wachsend. Kann auch fakultativ chemolithotroph
sein, wobei Wasserstoff der Elektronendonator ist und Kohlendioxid die Kon-
lenstoffquelle. Bei organotropher Ernahrung wird als Kohlenstoff- und Energie-
quelle eine ganze Reihe von organischen Sauren und Aminosauren assimiliert.
Saccharide und Alkohole werden weder verwertet noch fermentiert. Als einzige
Stickstoffquelle konnen Harnstoff, Asparagin und NHJ sowie NOj-Ionen
dienen. Starke, Kasein, Gelatine, Askulin oder extrazellulare Poly-P-Hydroxy-
buttersaure werden nicht hydrolysiert. Bildet keine wasserloslichen Pigmente.
Zum Wachstum ist eine Temperatur von 10-35 °C (Optimum bei 28 °C)
erforderlich.
Zellen in der Jugend 0,6-0,8 x 2,0-5,0 |xm grofi, altere Zellen bis 50 |xm lang.
Windungen der Spirale 3,0—4,0 \im lang.
Aus einem kleinen eutrophen See bei Neuchatel (Schweiz) isoliert.
3. Oceanospirillum Hylemon et al. 1973
Feste schraubenformige Zellen, mit Geifielbiindeln an beiden Polen, beweglich,
gramnegativ. Plasma mit Poly-P-Hydroxybuttersaure-Granula.
408 ■ Spirillen - Campylobacter
Chemoorganotropher, streng aerober Organismus mit Respirationsmetabolis-
mus; Luftsauerstoff ist der Endakzeptor von Elektronen. Kohlenhydrate wer-
den weder oxydiert noch fermentiert. Auch bei Anwesenheit von Nitraten
vermogen die Zellen nicht anaerob zu wachsen. Produzieren Katalase. Kasein
und Starke werden nicht hydrolysiert. Zum Wachstum brauchen sie Meerwas-
ser, Sie gedeihen noch gut bei einer Konzentration von 9,75% NaCl. Eine Art,
Oceanospirillum minutulum, wachst sogar bei einer Konzentration von 12,75%
NaCl. Zellbreite 0,3-1,2 urn; Lange bei einzelnen Arten verschieden. Alle Arten
sind ausschliefilich marin.
Typus generis: Oceanospirillum linum (Williams et Rittenberg 1957) Hylemon
et al. 1973.
Wichtigste Literatur: Williams und Rittenberg 1957, Watanabe 1959, Hylemon
et al. 1973.
Die Gattung umfafit folgende Arten, die urspriinglich in die Gattung Spirillum
eingeordnet wurden. Es handelt sich um Arten, die in Meerwasser vorkommen.
Eine Beschreibung wird deshalb hier nicht gegeben:
Oceanospirillum linum (Williams et Rittenberg 1957) Hylemon et al. 1973.
Spirillum linum Williams et Rittenberg 1957, Spirillum atlanticum Williams et
Rittenberg 1957.
Oceanospirillum beijerinckii (Williams et Rittenberg 1957) Hylemon et al.
1973.
Spirillum beijerinckii Williams et Rittenberg 1957.
Oceanospirillum minutulum (Watanabe 1959) Hylemon et al. 1973.
Spirillum minutulum Watanabe 1959.
Oceanospirillum japonicum (Watanabe 1959) Hylemon et al. 1973.
Spirillum japonicum Watanabe 1959.
Oceanospirillum maris Hylemon et al. 1973.
Oceanospirillum multiglobuliferum (Terasaki 1973) Terasaki 1979.
Spirillum multiglobuliferum Terasaki 1973.
Oceanospirillum pusillum (Terasaki 1973) Terasaki 1979.
Spirillum pusillum Terasaki 1973.
Oceanospirillum pelagicum (Terasaki 1973) Terasaki 1979
Spirillum pelagicum Terasaki 1973.
Oceanospirillum hiroshimense (Terasaki 1973) Terasaki 1979.
Spirillum hiroshimense Terasaki 1973.
Arten unsicherer systematischer Stellung:
Spirillum lunatum Williams et Rittenberg 1957.
Spirillum curvatum Williams et Rittenberg 1957.
Spirillum maritimum Watanabe 1959.
Spirillum halophilum Watanabe 1959.
4. Campylobacter Sebald et Veron 1963
Zarte, schraubenformige, gramnegative Stabchen mit 1 oder mehr Windungen.
Kurze Zellen S-formig. In alten Kulturen entstehen kokkoide Gebilde. Eine
polare Geifiel an einem oder an beiden Polen, 2-3 mal langer als die Zelle.
Chemoorganotropher, mikroaerophiler bis anaerober Organismus. Nur einige
Stamme wachsen gelegentlich aerob. Kohlenhydrate werden weder fermentiert
noch oxydiert. Energie gewinnen sie aus Aminosauren oder Zwischenprodukten
des Trikarboxylzyklus. Serum ist nicht erforderlich. Gelatine wird nicht verfliis-
sigt, Harnstoff nicht hydrolysiert. Einige Arten sind pathogen fur Mensch und
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Bdellovibrio • 409
Tier. Zellen meistens 0,2-0 X 0,5-5,0 (8,0) um grofi. Vorhanden im Verdau-
ungstrakt, in der Mundhohle und den Genitalien von Menschen und Tieren.
Typus generis: Campylobacter fetus (Smith et Taylor 1919) Sebald et Veron
1963.
Die Gattung umfafit 3 Arten, von denen zwei in einige Unterarten unterteilt
werden. Beschreibungen werden hier nicht gegeben.
Gattungen unsicherer systematischer Stellung:
5. Bdellovibrio Stolp et Starr 1963 (Fig. 259)
Organismen mit kompliziertem Entwicklungszyklus; teils von einer Wirtszelle
abhangige parasitische Stamme, teils auch nicht parasitische organotrophe
Organismen. Kleine, einzelne, leicht gebogene, stabchenformige Zellen mit abgerun-
deten Enden, die sich mittels einer polaren Geiffel in einer Scheide bewegen. Eine
solche Zelle sucht eine gramnegative Wirtszelle auf, heftet sich an ihrer Wand an
und dringt spater zwischen die Zellwand und die zytoplasmatische Membran
ein. In diesem Stadium beginnt das Wachstum; die Zelle wachst zu einem langen
Faden heran, der schraubenformig gekriimmt ist und den grofieren Teil der
Wirtszelle ausfiillt. Zum Schlufi kommt es zur Fragmentierung, die Wirtszelle
platzt, wobei die Tochterzellen frei werden.
Die vom natiirlichen Standort isolierten Stamme sind immer parasitisch; im
Labor wurde jedoch eine Anzahl vom Wirt unabhangiger oder faktultativ
parasitischer Mutanten erzielt. Chemoorganotrophe, aerobe Organismen mit
Respirationsmetabolismus, Parasitische Stamme benotigen spezifische Wirtszel-
len, in denen sie sich vermehren. Je nach Grofie der Wirtszelle entsteht eine
Fig. 259. Bdellovibrio sp. - Entwicklungszyklus (nach Bergey's Manual, 1974).
410 • Spirillen - Vampirovibrio
entsprechende Anzahl von Tochterzellen (aus Escherichia coli 3-4, aus Aquaspi-
rillum serpens 17-20).
Optimale Wachstumstemperatur 30 °C, bei 37 °C Wachstum bereits be-
grenzt. Zellen 0,25-0,4 x 0,8-1,2 um grofi.
Guelin et al. (1968) beschrieben einen ahnlichen parasitischen Organismus fiir
zwei Arten von Clostridium.
Typus generis: Bdellovihrio bacteriovoms Stolp et Star 1963.
Wichtigste Literatur: Stolp et Star 1963, Scherff et al. 1966 Starr und Baigent
1966, Burnham et al. 1968, Burger et al. 1968, Shilo 1969, Seidler et al. 1969,
1972, Seidler und Starr 1969, Diedrich et al. 1970, Rittenberg 1972, Bergey's
Manual 1974, Taylor et al. 1974.
Bestimmungsschliissel der Arten
la Proteasenaktivitat 3-10 Einheiten; als Wirtszellen dienen enterische Bakte-
rienoder Vertreter der Gattung Pseudomonas 1. B.bacteriovorus
lb Proteasenaktivitatmehr als 20 Einheiten 2
2a Proteasenaktivitat 20-50 Einheiten, als Wirt dient Escherichia coli; Katalase
positiv 2. B. stolpi
2b Proteasenaktivitat 100 Einheiten, als Wirt dienen Vertreter der Gattung
Pseudomonas; Katalasenegativ 3. B. starrii
1. Bdellovibrio bacteriovorus Stolp et Starr 1963
Mit den Merkmalen der Gattung
Die von Wirten abhangigen Stamme benotigen als Wirtszellen enterische Bakte-
rien oder Vertreter der Gattung Pseudomonas. Von Wirten unabhangige Stamme
produzieren eine sehr kleine Menge extrazellularer proteolytischer Enzyme; sie
sind geniigend lebensfahig. Isolierte Zellen der von Wirten abhangigen Stamme
sind ohne Wirtszellen kaum lebensfahig. Katalase positiv, aber auch negativ. Das
Genom hat die Grofie von 60% der Zellen von Escherichia coli. G + C-Gehalt:
49,5-51,5 mol %. Extrazellulare Proteasenmenge betragt 3-10 Einheiten.
Taylor et al. (1974) isolierten eine Reihe von Stammen aus Meerwasser; alle
benotigen 70-100 mol NaCl, wobei Natrium nicht durch Kalium ersetzt werden
kann. Als Wirtszellen dienen Gattungen der Familie Enterbacteriaceae, ferner
Pseudomonas, Vibrio und Aeromonas.
2. Bdellovibrio stolpii Seidler et al. 1972
Der Typenart morphologisch sehr ahnlich. Unterscheidet sich aber durch die
Grofie der Genome: 67% der Zelle von Escherichia coli und durch den G +
C-Gehalt: 41,8 mol %. Katalase positiv. Als Wirtszelle dient ausschliefilich
Escherichia coli. Extrazellulare proteolytische Aktivitat betragt 20-50
Einheiten.
3. Bdellovibrio starrii Seidler et al. 1972
Morphologisch dem Typenstamm sehr ahnlich.
Unterscheidet sich durch die Grofie der Genome: 75% der Zelle von Escherichia
coli; G + C-Gehalt: 43,5 mol %. Katalase negativ. Als Wirtszelle dient nur
Pseudomonas; Proteolytische Aktivitat betragt 100 Einheiten.
6. Vampirovibrio Gromov et Mamkaeva 1972
Kleine gekriimmte Vibrionen oder kurze einzelne Stabchen. In einem Entwick-
lungstadium mittels einer Geifiel ohne Scheide beweglich. Gramnegativ. Heftet
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Leptospirillum • 411
sich an Zellen eukaryonter Algen (Chlorella), hat einen komplizierten Entwick-
lungszyklus als Parasit. Entwickelt sich im Innern der Wirtszelle und bildet
dabei lange schraubenformige Gebilde, die schliefilich in kleine Vibrionen
zerfallen. Die Entwicklung des Parasiten ruft eine Lyse der Wirtszelle hervor.
Ohne Wirt nicht wachstumsfahig. Chemoorganotropher, aerober Organismus;
offenbar mit Respirationsmetabolismus.
Vermehrung durch Teilung.
Wichtigste Literatur: Mamkaeva 1966, Gromov und Mamkaeva 1972, 1980,
Burham und Robinson 1974, Coder und Starr 1978, Nikitin und Nikitina 1978,
Mamkaeva und Rybalcenko 1979.
Eine einzige Art:
Vampirovibrio chlorellavorus (Gromov et Mamkaeva 1972) Gromov et
Mamkaeva 1980.
Bdellovibrio chlorellavorus Gromov et Mamkaeva 1972.
Mit den Merkmalen der Gattung.
Zellen 0,3-0,4 X 0,8-1,5 u.m grofi. Vorkommen im Siifiwasser; prasentiert auf
einigen Stammen der Gattung Chlorella.
Bisher nur 4 Stamme bekannt. Typenstamm aus einer Massenkultur von
Chlorella vulgaris aus der Umgebung von Leningrad (UdSSR) isoliert.
7. Anaerobospirillum Davis et al. 1976
Schraubenformige Zellen mit abgerundeten Enden. An beiden Polen Geifielbiin-
del; beweglich. Zellen einzeln; manchmal Stabchen oder kokkoide Stadien
bildend. Ohne Endosporenbildung.
Fermentativer Metabolismus. Streng anaerob, chemoorganotroph. Hauptpro-
dukt des Metabolismus ist Sukzinat und Azetat, ferner in geringerem Mafie
Milch- und Ameisensaure.
Vorkommen im Dickdarm von Hunden.
Wichtigste Literatur: Davis et al. 1976.
Eine einzige Art:
Anaerobospirillum succiniciproducens Davis et al. 1976
Mit den Merkmalen der Gattung.
Zellen 0,6-0,8 X 3,0-8,0 um grofi, manchmal bis 20 um lang. Lange der
Spiralwindung 1,3-1,7 urn, Breite 0,9-1,1 um.
8. Leptospirillum Markosjan 1972
Organismus mit typischem Entwicklungszyklus. Junge Zellen enthalten vor
allem kleine Zellen in Form von Vibrionen oder Spirillen mit einer Windung,
seltener mit zwei oder (ausnahmsweise) drei bis vier Windungen. Es kommen
auch Pseudokokken vor, die besonders bei starker Senkung des pH-Werts (unter
pH 2,0) entstehen. Im Lichtmikroskop sehen sie wie kokkoide Gebilde aus, im
Elektronenmikroskop sind deutlich Ringe zu erkennen, die durch die Verbin-
dung der Enden der Vibrionen entstehen. In der spaten Exponentialphase
herrschen Spirillen mit einer grofieren Windungszahl vor. Bei Storungen im
Teilungsprozefi (z. B. durch Temperaturerhohung iiber 35 °C) entstehen
lange, schraubenformige Faden (Zellketten). Einzelne Zellen sind mittels einer
verhaltnismaflig starken p^ttandigen Geifiel beweglich. Gramnegativ.
412 • Spirillen - Azospirillum
Aerober, acidophiler, streng lithotropher Organismus. Energiegewinnung
durch Oxydation des zweiwertigen Eisens (FeS04) zu dreiwertigem. Eisen aus
sulfidischen Mineralen werden nicht verwertet, auch nicht das im Kristallgitter
der Minerale gebundene Eisen. Vermogen Eisensulfid nur in Mischkulturen mit
Thiobakterien zu oxydieren (z. B. mit Thiobacillus organoparus). Organische
Stoffe konnen nicht als Energiequelle genutzt werden. Thiosulfat, andere redu-
zierte Schwefelverbindungen oder elementarer Schwefel werden nicht verwertet.
Als Stickstoffquelle dient vorwiegend Ammoniumsulfat; Wachstum auf Nitra-
ten und Harnstoff verlauft nur langsam.
Vermehrung durch Teilung einer spirillenformigen Zelle, in zwei Vibrionen.
Vorkommen in sauren Grubenwassern von Kupferbergwerken.
Wichtigste Literatur: Markosjan 1972, Balasova et al. 1974.
Eine einzige Art:
Leptospirillum ferrooxidans Markosjan 1972.
Mit den Merkmalen der Gattung.
In seinem Entwicklungszyklus an Nitrosospira briensis erinnernd. Zum
Wachstum wird ein sehr niedriger pH-Wert im Bereich von 1,5-4,0 (Optimum 2,5-3,0)
benotigt. Physiologische Eigenschaften denen von Thiobacillus ferrooxidans
sehr ahnlich.
Zellen 0,3-0,6 .x 1,0-3,5 \im grofi. Der Kriimmungsgrad, die Windungsgrofie
wie auch ihre Anzahl sind sehr variabel.
Typenstamm aus dem Grubenwasserder Kupferfundstelle Alaverd (Armenische
SSR) isoliert.
9. Azospirillum Krieg 1977
Grofie, lange, gramnegative, schraubig oder nur geringfugig gewundene Stab-
chen mit 0,5-2 Windungen. Die Morphologie der Zelle hangt von den Kulturbe-
dingungen ab. Auf an Zucker reichen Medien und bei geringem Stickstoffgehalt
haben die Zellen nach Becking (1963) die Form leicht gekriimmter Stabchen; sie
sind mit Granula von Poly-P-Hydroxybuttersaure oft so stark gefiillt, dafi die
Zellgestalt dadurch deformiert wird. Beijerinck (1925) nahm an, dafi es sich bei
den Inklusionen um Fettropfchen handelt. Auf Medien mit hohem
Stickstoffgehalt bilden sich lange, schraubenformige Zellen ohne Inklusionen. Nach Rodina
(1956) ist in stickstofflosen Medien die Anwesenheit vom Humaten erforderlich.
Unter bestimmten Bedingungen enthalten die Zellen Inklusionen von Kalzium-
karbonat. Beweglich durch ein Biindel polarer Geifieln. Streng aerober
Organismus. Fixiert atmospharischen Stickstoff nur bei Anwesenheit von 0,01-0,005%
Hefeextrakt. Molekularer Wasserstoff inhibiert teilweise die Stickstoffbindung.
Becking 1963). Fur das Wachstum sind einige bisher unbekannte Wachstums-
aktoren erforderlich, nicht aber Biotin und Pyridoxin. Die optimale Tempera-
tur liegt bei 22 °C. Kolonien auf Agarmedien sind abgerundet, klein und
kirschrot.
Einordnung und Klassifizierung des Organismus sind schwierig und bisher nicht
abgeklart. Beijernick (1925) nimmt an, dafi er mit Azotobacter vinelandii
verwandt ist. Demgegeniiber stellt ihn Becking (1963) in die Nahe von Desulfo-
vibrio gigas. Krieg (1977a, 1977b) fiihrte auf Grund des Studiums von mehr als
60 Isolaten eine Reklassifizierung durch und stellte den Organismus in eine
selbstandige Gattung.
Typus generis: Azospirillum lipoferum (Beijernick 1925) Krieg 1977.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Paraspirillum ■ 413
Wichtigste Literatur: Beijernick 1925, Bergey et al. 1930, von Biilow und
Dobereiner 1975, Dobereiner und Day 1976, Okon et al. 1976, Sampaio et al.
1976, Krieg 1977a, 1977b, Neyra et al. 1977, Magalhaes et al. 1978.
Bestimmungsschlussel der Arten
la Unter anaeroben Bedingungen werden Nitrate zu Nitriten reduziert, wobei
Gas produziert wird; in Boden dergemafiigten Zone vorkommend
1. A. lipoferum
lb Unter anaeroben Bedingungen werden Nitrate zu Nitriten ohne Gaserzeu-
gung reduziert. Nitrate sammeln sich im Medium an; in Boden derTropen-
zone vorkommend 2. A. brasiliense
1. Azospirillum lipoferum (Beijerink 1925) Krieg 1977 (Fig. 239)
Spirillum lipoferum Beijerinck 1925, Azotobacter spirillum Beijerinck 1925,
Chromatium lipoferum (Beijerinck 1925) Bergey et al. 1930
Mit den Merkmalen der Gattung.
Alle Stamme fixieren Luftstickstoff bei gleichzeitiger Reduktion der Nitrate zu
Nitriten und Gasproduktion.
Vorkommen in Boden der gemafiigten Zone.
Okon et al. (1976) teilen die provisorisch bestimmten Stamme wie bei Spirillum
lipoferum in drei Gruppen. A. lipoferum ist identisch mit Gruppe II.
2. Azospirillum brasiliense Krieg 1977
Reduziert Nitrate zu Nitriten ohne Gasproduktion; Nitrite werden im Medium
akkumuliert.
Vorkommen in Boden der Tropenzone.
Identisch mit den Gruppen I und III, in die Okon et al. (1976) die provisorisch
bestimmten Stamme von Spirillum lipoferum geteilt haben.
10. Paraspirillum Dobell 1912
Zellen in Form einer schraubenformig gewundenen oder S-formig gebogenen
Spindel. An den Enden stumpf zugespitzt, in der Zellmitte erweitert. Zellen
formveranderlich. Manchmal fast gerade stabchenformig, manchmal stark ge-
kriimmt. In der Protoplastenmitte mit einem ellipsoidischen Kern; das umge-
bende Zytoplasma bleibt hyalin. Viele Volutinkornchen sind zwischen der
hyalinen Protoplasmaschicht und den zwei Zellpolen angehauft.
Weder die Ernahrungsweise noch andere physiologische Eigenschaften sind
bekannt. Der Organismus wurde aus dem natiirlichen Mileu beschrieben, bisher
aber nicht kultiviert. Vermehrung durch Teilung mit vorangehender Kerntei-
lung. Bewegung durch je eine polare Geifiel an den Polen Vor- und Riickwarts-
bewegung gleich intensiv. Zellen scheinen bei der Bewegung rigid zu sein,
konnen aber die Art der Kriimmung verandern. Im Siifiwasser vorkommend.
Wichtigste Literatur: Dobell 1912, Skerman 1959.
Eine einzige Art:
Paraspirillum vejdovskii Dobell 1912 (Fig. 258).
Mit den Merkmalen der Gattung.
Zellen 8,0-25,0 \un lang, meistens aber 15,0 ^m; in der Mitte 1,5-2,0 \im breit.
Dieser Organismus wurde nur einmal in Oscillatorien-Kulturen gefunden, die
aus dem River Granta bei Cambridge (England) gewonnen wurden.
Die taxonomische Eingliederung bei den Spirillaceae, wie dies Dobell (1912)
414 • Spirillen - Sporospirillum - Pelosigma
vorgeschlagen hat, ist im Hinblick auf das Vorkommen eines echten Kernes
(sorern es sich wirklich um einen echten Kern handelt) sehr problematisch.
11. Sporospirillum Delaporte 1964
Eine der grofken Mikroorganismen. Zellen lang, robust, schraubenformig. In
jeder Zelle entsteht ein Gebilde, das an Sporen erinnert und im reifen Zustand
oval und oft entsprechend derZellgestalt gekriimmt ist. Bei der Sporenkeimung
bildet sich in der Zellwand an einer Stelle, die der Spore benachbart ist, eine
Offnung, deren Durchmesser kleiner als die Sporenlange ist; die Spore nahert
sich relativ schnell der Offnung, dreht sich mit einem Pol zu ihr hin und schliipft
hinaus oder wird hinausgedriickt. Plasma homogen mit kleinen Kornchen;
manchmal Vakuolen enthaltend. Wahrend des Wachstums der Zelle kann man
die Fragmentation des Plasmas in einige Teile beobachten. Aus diesen ent-
wickeln sich spater die Sporen. Kommt im Rektum des Verdauungstraktes von
Froschen vor.
Wichtigste Literatur: Collin 1913, Delaporte 1964.
Eine einzige Art:
.Sporospirillum proeclarum (Collin 1913) Delaporte 1964 (Fig. 260).
Spirillum proeclarum Collins 1913, Bacillospira proeclarum (Collins 1913) Hol-
lande 1933.
Mit den Merkmalen der Gattung.
Zellen 3,0-5,0 x 30-100 urn, Sporen 3,0-5,0 x 9,0-12,0 um grofi. Ein bisher
noch sehr wenig erforschter Organismus unsicherer systematischer Stellung.
12. Pelosigma Lauterborn 1913
Zellen schlank bis fadenformig, farblos oder hellgrau, gewohnlich leicht
gekriimmt oder S-formig. Sie kommen nicht einzeln vor, sondern bilden meistens
mehrgliederige, manchmal auch sehr robuste Aggregate, in denen die einzelnen
Zellen zu viert (oder einem Mehrfachen von 4) Seite an Seite angeordnet sind.
Gewohnlich sind die Zellen an einem Ende dicht aneinander gedriickt, so dafi das
Gesamt-Aggregat einseitig zugespitzt ist, wahrend am gegeniiberliegenden Pol
die Zellen voneinander mehr oder weniger entfernt liegen, so dafi das Gebilde
etwas an einen S-formig gebogenen Facher oder an ein Pflanzenblatt erinnert.
Am verjiingten Ende besitzt das Aggregat ein Bewegungs-Organell(-Geil?el?)
von dem Lauterborn (1913) iiberzeugt ist, dafi es aus einem Geifielbiindel
zusammengesetzt ist. Gramfarbung nicht bekannt.
Physiologische Eigenschaften oder Ernahrungsweise unbekannt, da bisher keine
Reinkulturen erzielt wurden. Vermehrung durch synchrone Teilung des Aggre-
gats, Tochteraggregate entfernen sich nach der Teilung schnell voneinander.
Bewegung mittels einer Geifiel (?) bedingt durch den Habitus des Aggregats
langsam, flatterig und unter gleichzeitiger Rotation des Aggregates um die
Langsachse. Oft mit langeren Ruhepausen.
Kommt im Schlamm und auf dem oberen Film des Schlammes in Sufi- und
Brackwassern vor. Hirsch (Zit.: Bergey's Manual 1974) fand einen Vertreter
dieser Gattung in den Teichen von Norddeutschland (BRD) und in Lower
Michigan (USA).
Typus generis: Pelosigma cohnii (Warming 1875) Lauterborn 1913.
Wichtigste Literatur: Lauterborn 1913, 1916.
Scanned &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@i
Brachyarcus • 415
Bestimmungsschliissel der Arten:
la Zellaggregate 1,2-4,0 um breit 1. P. cohnii
lb Zellaggregate 8,0-10,0 um breit 2. P. palustre
1. Pelosigma cohnii (Warming 1875) Lauterborn 1913
Spiromonas cohnii Warming 1875
Graugebarbte, abgeflacht-bandformige, nach links S-formig bis schraubenartig
gedrente Zellen; meistens mit 1,25 Windungen, selten auch mit mehreren.
Schraubenlinie steil, Windungen 6-9 x hoher als breit. Zellenden zugespitzt,
ausnahmsweise breit und stumpf gerundet. In facherartigen Aggregaten
angeordnet, die an dem zugespitzten Ende eine gemeinsame Geifielhaben. Verhalt-
nismafiig schnelle Teilung in Tochteraggregate.
Einzelne Zellen 0,23-0,35 x 9,9-30,0 um grofi; Aggregate 1,2-4,0 um breit und
9,0-30 um lang; Windungen gewohnlich 9,0-20 um hoch und 1,2-3,5 um
breit.
Organismus urspriinglich im faulenden Brackenwasser-Schlamm bei Kalund-
borg, Vejle, Hofmansgare und Limfjord (Danemark) gefunden.
Die Erstbeschreibung stammt von Warming (1875), der den Organismus zu den
. Flagellaten der Gattung Spiromonas stellte.
2. Pelosigma palustre Lauterborn 1916
Morphologisch Pelosigma cohnii sehr ahnlich. Aggregate flach, giirtelformig,
jedoch machtiger: 8,0-10,0 um breit und 20,0-25,0 um lang.
Urspriinglich im faulenden Schlamm eines mit Chara besiedelten Teiches bei
Ludwigsnafen (BRD) gefunden.
Hirsch (Zit.: Bergey's Manual 1974) ist der Meinung, dafi diese Art de facto von
mehreren Aggregaten der Pelosigma cohnii gebildet wird und dafi daher beide
Arten vereinigt werden sollten. Er fand in norddeutschen Teichen (BRD)
19,5 um lange, 5,0-11,0 um breite Aggregate, die aus 0,23-0,31 um breiten
Zellen zusammengesetzt waren.
13. Brachyarcus Skuja 1964
Zellen mehr oder weniger bogenformig gekriimmt, farblos. Zu zweit oder viert
in Gruppen oder Zonobien vereinigt. Gruppen kreis- oder ringformig. Zono-
bien zu mehreren in einen gemeinsamen hyalinen Schleimhulle zu Kolonien von
unbestimmtem Umrifi vereinigt. Primare und sekundare Verbande nach aufien
unscharf begrenzt. Bei fortgesetzter Teilung der Zellen in den primaren Verban-
den entstehen mi turner auch dichte Haufchen von Tochterverbanden, die paket-
oder knauelformig aussehen konnen. Die Kolonien sind stets mikroskopisch.
Plasma farblos, homogen. In der Zellmitte fast immer mit einer Gasvakuole, die
an den Randern gewohnlich gekerbt ist und infolge Lichtbrechung dunkelrot
glanzt. Oft enthalt das Plasma eine grofiere Menge Kleiner Schwefeltropfchen.
Physiologische Eigenschaften unbekannt, da Reinkulturen bisher nicht gewon-
nen wurden und die Beschreibung nach dem natiirlichen Material erfolgte. Aus
der Beschreibung kann man jedoch schliefien, dafi es sich um einen mikroaero-
philen oder anaeroben Organismus handelt. Vermehrung einerseits durch Zell-
teilung, anderseits durch Simultanteilung des Zonobiums in Tochterkolonien.
Zellteilung erfolgt im Zonobium nicht immer synchron. Zellen unbeweglich.
Auch die Kolonien weisen keine aktive Bewegung auf. Kommt als Planktonor-
ganismus in der dystrophischen Zone des Hypofimnions von Seen zusammen
mit anderen thiophilen Qreanismen vor.
416 • Spirillen - Pseudoromeria
Wichtigste Literatur: Skuja 1964, Bergey's Manual 1974.
Eine einzige Art:
Brachyarcus thiophilus Skuja 1964 (Fig. 264).
Mit den Merkmalen der Gattung.
Einzelne Zellen grofkenteils 1,0 x 1,5-2,5 |xm grofi; Primarkolonien 3,0-
6,0 urn breit. Sekundarkolonien, oft hockerartige Aggregate bildend, im Durch-
schnitt grofier als 100 urn.
Gefunden im See Vuolep Njakajaure, Lappland (Schweden) in einer Tiefe von
12-13,5 u. Hirsch fiihrt in Bergey's Manual (1974) eigene Funde aus einigen
Mergelseen und Teichen in Michigan (USA) und im Pluss-See (BRD) an.
Der Blaualgen-Gattung Tetrarcus (Chroococcaceae) sehr ahnlich. Obwohl der
Organismus keine Assimilationspigmente hat, ordnet ihn Skuja (1964) in die
Familie Thiocapsaceae ein.
26/. 265
Fig. 264. Brachyarcus thiophilus - verschieden grofie Kapseln; in den Zellen
deutliche Gasvakuolen (nach Skuja, 1964. - 2500X). Fig. 265. Microspira larva-
lis - (nach Skuja, 1956. - 1340x).
14. Pseudoromeria Cyrus et Sladecek 1973
Zellen zylindrisch, an den Polen abgerundet, leicht hornchenformig gekrummt,
3-4 mal linger als breit. Zwei oder mehr Zellen formen sehr oft Gebilde, die
dichten Knaueln ahnlich sind. Schleimhullen wenig deutlich. Plasma hyalin,
homogen oder fein granuliert. Vermehrung durch Teilung. Bewegung nicht
beobachtet. Kommt in Abwassern, in biologischen Klaranlagen und in stark
verschmutzten Oberflachengewassem zusammen mit Sphaerotilus natans (=
Sphaerotilus dichotomus) vor.
Wichtigste Literatur: Cyrus und Sladecek 1973.
Eine einzige Art:
Pseudoromeria cyrusiana Cyrus et Sladecek 1973 (Fig. 266).
Mit den Merkmalen der Gattung.
Zellen 1,0 x 2,5-4,5 ^m grofi, kniuelformige Kolonien erreichen einen Durch-
messer von 10,0-15,0 Jim.
Seamed &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Spirosomaceae -417
Organismus unsicherer systematischer Stellung:
Microspira larvalis Skuja 1956 (Fig. 265).
Zellen zylindrisch, meist an einem Pol zugespitzt, am anderen kugelig
abgerundet; halbmondformig gebogen oder leicht schraubenformig gedreht mit 0,5-1
Windung. Am zugespitzten Ende eine polare Geifiel, die ungefahr ebenso lang
wie die Zelle ist. Plasma grau, hyalin; mit 3-6 Granula eines volutinartigen
Stoffes; Granula in Form regelmafiiger quer angeordneter Klumpen; oft vereini-
gen sie sich an einem peripher gelegenen schraubenformigen Biindel. Die Zelle
sieht dadurch wie gegliedert aus. Am Apikalende ist ein grofier, stark lichtbre-
chender, aus Volutin zusammengesetzter Korper vorhanden, der der Zelle ein
charakteristisches Aussehen verleiht. Physiologische Eigenschaften unbekannt;
wurde nur nach dem Freiland-Material beschrieben. Vermehrung durch Quer-
teilung. Bewegung langsam bis lebhaft durch typische langsame, welligrotieren-
de Umwalzungen des bogig gekriimmten Korpers, was an das wellige Kriechen
erinnert.
Zellen 1,5 x 4,5-10,0 jim grofi.
Okologisch kann der Organismus als oligothiophil bezeichnet werden. Er
kommt im Hypolimnion von Siifiwasserseen vor. Wurde bisher noch nicht in
Schwefelquellen entdeckt. Urspriinglich in dem See Honsan (Schweden) in einer
Tiefe von 12-13 m gefunden.
Die Einreihung in die Gattung Vibrio (= Microspira) ist sehr problematisch. Der
Organismus entspricht dem Charakter dieser Gattung weder hinsichtlich seiner
morphologischen noch seiner physiologischen Eigenschaften.
Fig. 266. Pseudoromeria cyrusiana - (nach Cyrus und Sladecek, 1973. - 2000x).
2. Familie Spirosomaceae Larkin et Borrall 1978
Gerade, leicht gebogene oder vibrioide Stabchen mit abgerundeten Enden;
Krummungsgrad verschieden, variiert auch in ein und derselben Kultur. Das
gemeinsame Merkmal der ganzen Familie ist die Bildung von ringformigen
Gebilde. Sie entstehen dadurch, dafi bei den schraubenformig gewundenen
418 ■ Spirillen - Spirosoma
Zellen mit sehr schmalen Windungen sich die gegeniiberliegenden Pole iiberdek-
ken, was aber im Lichtmikroskop nicht sichtbar ist. Oft haben sie vor der
Teilung die Form einer «3» oder «8». Unbeweglich. Ruhestadien nicht bekannt.
Gramnegativ. Eine Art bildet Kapseln.
Chemoorganotrophe, streng aerobe Organismen mit Respirationsmetabolis-
mus. Aus Sacchariden bilden sie unter aeroben Bedingungen Sauren. Zum
Wachstum sind komplexe Medien und eine optimale Temperatur von 22-25 °C
erforderlich, wobei die Minimaltemperatur 5 °C und die Maximaltemperatur
37 °C betragen.
Meist im Siifiwasser oder im Boden vorkommend; eine Art auch im Meer-
wasser.
Typus familiae: Spirosoma Migula 1900, emend Larkin et al. 1977.
Bestimmungsschliissel der Gattungen
la AnaeroberOrganismus;phototroph 2
lb AeroberOrganismus; nicht phototroph 4
2a Zellsuspension purpurrot Rhodocyclus(sieheTeilI.,S.34)
2b Zellsuspension griin oder braun 3
3a Zellen mit Gasvakuolen Pelodictyon(SieheTeilI.,S. 101)
3b Zellen ohne Gasvakuolen Chlorobium(SieheTeilI.,S. 94)
4a Organismus chemoorganotroph 5
4b Organismus mehtylotroph, bildet Exosporen
Methylosinus(SieheTeilVII.,S.440)
5a Kolonienauf komplexen Agarmedien nicht rosa gefarbt 6
5b Kolonien auf komplexen Agarmedien rosa 7
6a Zellen ohne Kapseln; Kolonien gelb. Aus Alkoholen werden aerob Sauren
gebildet 1. Spirosoma (S. 418)
6b Zellen besitzen Kapseln; Kolonien farblos, weifi bis cremefarbig; aus
Alkoholen werden aerob keine Sauren gebildet 4. Microcyclus (S. 422)
7a Gelatine wird verfliissigt 2. Flectobacillus (S. 419)
7b Gelatine wird nicht verfliissigt 3. Runella(S.421)
1. Spirosoma Migula 1900, emend. Larkin et al. 1977 (Fig. 261)
(non Spirosoma Ellis 1908)
Gramnegativer Organismus, der in verschiedenen Formen vorkommt. Charak-
teristisch ist die Form vollig geschlossener Ringe. Oft entstehen auch Zellen, die
hufeisenformig oder die Form der Buchstaben C, S oder der Zahlen «3»und «8»
aufweisen. Ferner kommen auch schraubenartige Gebilde vor, die aus 10 oder
mehr Zellen zusammengesetzt sind. Gelegentlich konnen vereinzelt auch gerade
oder nur leicht gebogene Stabchen auftreten. Zwischen den einzelnen Zellen
Zellquerwande sehr deutlich sichtbar. Unter bestimmten Kulturbedingungen
entstehen lange fadenartige, aber keine ringformigen Gebilde. Unbeweglich,
ohne Geifieln. Bilden eine gut erkennbare Kapseln aus, in die manchmal
Anhaufungen von Zellgruppen eingeschlossen sind. Streng aerobe Organismen
mit Respirationsmetabolismus. Chemoorganotroph. Unter anaeroben
Bedingungen wachsen sie auch nicht bei Anwesenheit von Nitraten, die nicht reduziert
werden. Unter aeroben Bedingungen werden Sauren aus Sacchariden, aber nicht
aus Alkoholen gebildet. Gelatine und Starke werden hydrolysiert, Zellulose und
Chitin dagegen nicht. Als einzige Kohlenstoffquelle konnen Sukzinat, Tartrat,
Malonat una Glyzerolphosphat dienen. Azetat, Benzoat, Zitrat, Formiat, Pro-
pionat, Methylamin und Methanol werden nicht uliliziert.
Auf komplexen Medien bilden sie runde, konvexe, glatte, schleimige, manchmal
klebrige Kolonien mit einem Durchmesser von 2-3 mm, mit glattem Rand und
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Flectobacillus • 419
einer engen farblosen peripheren Zone. Durch ein im Wasser unlosliches
Pigment, das wahrscheinfich aus Karotinoiden besteht, gelb gefarbt. In fliissigen
Medien entsteht ein gelbes Sediment, das nach dem Durchschiitteln eine gleich-
mafiige gelbe Triibung hervorruft. Die morphologischen Merkmale sind von den
Kulturbedingungen abhangig. Optimale Wachstumstemperatur 22-25 CC. Bei
37 °C wachst dieser Organismus nicht mehr, bei 7 "C nur sehr begrenzt.
Vorkommen im Wasser und Boden.
Wichtigste Literatur: Weibel 1887, Eisenberg 1891, Migula 1894,19OO,0rskov
1928, Claus 1967, Claus et al. 1968, Raj 1970.
Eine einzige Art:
Spirosoma linguale (Eisenberg 1891) Migula 1894.
Vibrio linguale Eisenberg 1891, Microcyclus flav us Raj 1970.
Mit den Merkmalen der Gattung.
Einzelzellen leicht gekriimmt, 0,5-1,0 X 3,0-6,0 \im grofi. Die zu einer Spirale
gebogenen Zellen oder lange, wenig gekriimmte Zellen sind 0,5-1,0 X 5,0-
10,0 ^m grofi, selten bis 50,0 \im lang. Die Ringe haben einen Aufiendurchmes-
ser von 1,5-3,0 \im. Die hufeisenahnlichen Gebilde sind 0,5-0,8 \un breit und
3,0 \im lang.
Der Organismus wurde aus dem Wasser tiefer Brunnen in der Stadt Long Beach
(Kalifomien, USA) isoliert. Als erster beschrieb Weibel (1887) diesen
Organismus; Migula (1894) stellte ihn in die Gattung Spirosoma. Da die Isolate verloren
gegangen sind, wurde die Gattung Spirosoma annuliert. 0rskov (1928) definierte
die Gattung Microcyclus. Claus (1967) und Claus et al. (1968) beobachteten
ahnliche Organismen in Reinkultu'ren, betonten aber, dafi sie durch ihre Eigen-
schaften eher der Gattung Spirosoma als Microcyclus entsprechen.
2. Flectobacillus Larkin et al. 1977
Sowohl gerade als auch gekriimmte Stabchen verschiedener Lange bildend. Der
Kriimmungsgrad ist sehr variabel, auch in ein und derselben Kultur. Oft «C»-
oder hufeisenformig. Die Ringform ist nur scheinbar; sie entsteht im Lichtmi-^
kroskop durch Uberdeckung entgegengesetzter Pole der spiralenformig gewun-
denen Zelle. In jungen, 24-48 Stunden alten Kolonien kommen auch schrauben-
formige Formen vor. In alteren Kulturen entstehen selten schraubige Faden-
strukturen, die bis zu einigen zehn \im lang sind; die Bildung von Ringen ist
selten. Gramnegativ und unbeweglich, ohne Geifiel; nicht flexibel. Ruhestadien
nicht bekannt. Vor der Teilung mit deutlichen Querwanden. Keine Kapselbil-
dung. Zellen mit den ublichen Farbstoffen gut farbbar. Streng aerober, che-
moorganotropher Organismus mit Respirationsmetabolismus. Im anaeroben
Milieu nicht wachstumsfahig. Nitrate werden nicht reduziert. Unter streng
aeroben Bedingungen bildet dieser Organismus aus einigen Zuckern Sauren.
Starke wird hydrolysiert und Gelatine verfliissigt.
Auf komplexen Agarmedien sind die Kolonien hell- bis mittelrosa gefarbt; das
Pigment ist nicht wasserloslich.
Tritt im Siifi- und im Meerwasser auf.
Typus generis: Flectobacillus major (Gromov 1963) Larkin et al. 1977.
Wichtigste Literatur: Gromov 1963, Raj 1976, Larkin et al. 1977, Borral und
Larkin 1978.
Bestimmungsschliissel der Arten
la Zellen 0,6-1,0 X 1,5-5,0 \im grofi; ringformige Gebilde 5,0-10,0 \im; im
Sufi wasser, benotigtkein NaCl 1. Fl. major
420 ■ Spirillen - Flectobacillus
lb Zellen 0,3-0,7 X 1,0-5,0 urn groK, ringformige Gebilde 0,8-1,5 urn; im
Meerwasser, benotigt 1,5-3,0% NaCl 2. Fl. marinus
1. Flectobacillus major (Gromov 1963) Larkin
et al. 1977 (Fig. 263)
Microcyclus major Gromov 1963
Mit den Merkmalen der Gattung.
Bildung von aeroben Sauren aus Kohlenhydraten, jedoch nicht aus Alkoholen.
Gelatine, Starke, Askulin und Tributyrin werden hydrolysiert, Zellulose und
Chitin dagegen nicht. Sukzinat kann als einzige Kohlenstofrquelle dienen, ferner
werden Azetat, Benzoat, Zitrat, Formiat, Propionat, Tartrat, Malonat, Glyze-
rolphosphat, Methylamin und Methanol assimiliert. Auf komplexen Medien
bilden sich hellrosafarbene, runde, gewolbte, glatte, schleimige, glanzende,
transparente Kolonien mit glattem Rand und homogenerStruktur. Durchmesser
der Kolonien bis zu 5 mm. Wird aus einer alten Kultur uberimpft, so entstehen
Kolonien von hochstens 2 mm Durchmesser; sie sind orange gefarbt, matt, mit
runzeliger Oberflache und leicht lappigem Rand. In ihnen iiberwiegen gerade,
fadenformige Strukturen. In fliissigen Medien ist das Wachstum flockig; Bildung
eines Oberflachenhautchens. In alteren Kulturen sinken die Zellen zuBoden, wo
sie ein lockeres Sediment bilden. Wachst gut bei 24 °C.
Zellen 0,6-1,0 x 1,5-5,0 \im grofi. Gelegentlich kommen auch langere Zellen
vor. Ringformige Gebilde mit einem Durchmesser von 5,0-10,0 \im.
Der Organismus wurde in einer Scenedesmus-Kuhur gefunden, die aus dem
Wasser des Cukodskoe See (UdSSR) isoliert wurde.
260
263
Fig. 260. Sporospirillum proeclarum - a junge Zellen, b Zellen mit Plasma-
Fragmentation, c Zellen mit Sporenbildung (nach Krasil'nikov, 1949. - 1000x).
Fig. 261. Organismus als Spirosoma sp. beschrieben (nach Mikrophoto umge-
zeichnet - Claus und Claus, 1968. - 2000x). Fig. 262. Microcyclus aquaticus -
(nach Mikrophoto umgezeichnet - Hirsch und Pankratz, 1970. - 2000X).
Fig. 263. Flectobacillus major - (nach Mikrophoto umgezeichnet - Gromov,
1963. - 2000X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Runella • 421
2. Flectobacillus marinus (Raj 1976) Borral et Larkin 1978
Microcyclus marinus Raj 1976
Einzelne Zellen selten gerade oder leicht gebogen, stabchenformig mit abgerun-
deten Enden; oft entstehen kipfelformige Gebilde in «C»-Form, ofters auch
scheinbare Ringe mit einander uberdeckenden Zellpolen; selten auch schrauben-
formig gebogene , aus zehn oder mehr Zellen zusammengesetzte Faden. Bildet
keine Kapseln, keine Ruhestadien, ohne Geifiel, unbeweglich, nicht flexibel;
ohne Gasvakuole. Gramnegativ.
Gelatine wird hydrolysiert, nicht aber Polysaccharide. Aus Pepton wird Ammo-
niak gebildet. Azetat, Zitrat, Malonat, Pyruvat, Sukzinat, Fumarat, Malat,
Tartrat werden verwertet. Auf komplexen Medien entstehen glatte, runde,
opake, wachsartige, kleine (weniger als 2 mm Durchmesser), durch ein was-
serunlosliches Pigment rosa gefarbte Kolonien. Im fliissigen Medium bildet sich
ein klebriges Sediment und eine Triibung. Fur das Wachstum wird 1,5-3,0%
NaCl benotigt; mehr als 5% hemmen das Wachstum. Bei ungeniigendem NaCl-
Angebot wachst er in der Form von langen schraubigen Faden.
Stabchenartige Zellen 0,3-0,7 x 1,0-5,0 \im grofi; ringformige Gebilde 0,8-
1,5 \im breit mit einem Innendurchmesser von 0,3-0,6 pirn. Die hufartigen oder
«C»-formigen Gebilde sind 0,8-1,3 \im breit.
Vorkommen im Meerwasser. Erstmals aus dem Stillen Ozean isoliert.
3. Runella Larkin et Williams 1978
Gerade bis vibrioformig oder mondsichelformig gebogene Stabchen. Kriim-
mungsgrad sehr variabel, auch in ein und derselben Kultur. Manchmal konnen
sich die Zellenden iiberdecken, wodurch ringformige Gebilde entstehen. Selten
treten auch spiralformige Zellen mit zwei bis drei Windungen auf, gelegentlich
auch lange, schraubenformige Faden. Ruhestadien nicht bekannt. Zellen nicht
flexibel, unbeweglich und ohne Geifieln. Gramnegativ.
Streng aerober Organismus mit Respirationsmetabolismus. Chemoorgano-
troph. Unter anaeroben Bedingungen nicht wachstumsfahig. Nitrate werden
nicht reduziert. Aus einigen Karbohydraten (vor allem Glukose, Maltose,
Saccharose und Inulin) werden aerob Sauren gebildet, aus Arabinose, Xylose,
Fruktose, Sorbose, Zellobiose, Laktose, Melibiose, Trehalose, Dextrin und
anderen dagegen nicht.
Als Kohlenstoffquelle konnen Azetat, Benzoat, Zitrat, Formiat, Glyzerolphos-
phat, Methylamin, Propionat, Sukzinat, Tartrat, Malonat und Metanol dienen.
Starke wird hydrolysiert, nicht aber Zellulose, Agar, Chitin, Kasein und
Askulin.
In Glukose, Hefeextrakt und Pepton enthaltenden Agarmedien werden blafiro-
safarbene Kolonien gebildet; das Pigment ist nicht wasserloslich.
Vorkommen in Siifiwasser.
Wichtigste Literatur: Larkin und Williams 1978, Larkin und Borrall 1978.
Eine einzige Art:
Runella slithyformis Larkin et Williams 1978.
Mit den Merkmalen der Gattung.
Einzelne Zellen 0,5-0,9 x 2,0-4,5 \im grofi. Ringformige Gebilde haben einen
Durchmesser von 2,0-3,0 \im. Schraubenformige Faden sind 14 \im lang.
Der Typenstamm wurde aus in Sufi wasser eingetauchten Gegenstanden in der
Nahe von Baton (Siid-Louisiana, USA) isoliert.
Morphologisch ahnelt er Vibrio, unterscheidet sich jedoch dadurch, daft er
422 • Spirillen - Microcyclus
unbeweglich, nicht fermentativ und aerob ist sowie ein rosafarbenes Pigment
bildet. Von der Gattung Spirosoma unterscheidet er sich dadurch, dafi er
Gelatine nicht hydrolysiert; Spirosoma bildet ein gelbes Pigment. Morpholo-
gisch ist er auch der Gattung Flectobacillus ahnlich, unterscheidet sich jedoch
durch die fehlende Hydrolyse von Gelatine.
Gattung unsicherer taxonomischer Stellung:
4. Microcyclus 0rskov 1928, emend. Larkin et al. 1977
Mehr oder weniger gebogene Stabchen mit runden Enden. Seltener treten
hufeisenahnliche Gebilde oder scheinbar geschlossene Ringe auf, die durch
Uberdeckung gegeniiber liegender Pole der schraubenartig gewundenen Zellen
entstehen. Fadenformige Gebilde werden nicht beobachtet. Gramnegativ. Ohne
Geifieln unbeweglich, nicht flexibel. Ohne deutlich sichtbare Kapsel. Ruhesta-
dien treten nicht auf. Einige Stamme besitzen Gasvakuolen (van Ert und Staley
1971).
Streng aerobe, chemoorganotrophe Organismen mit Respirationsmetabolismus.
Aus einigen Karbohydraten oder Alkoholen werden aerob Sauren gebildet.
Starke wird nicht hydrolysiert und Gelatine nicht verfliissigt. Auf komplexen
Medien bildet der Organismus kleine abgerundete, olartige, erhohte Kolonien
mit lappigen Randern, die farblos oder hellcremefarben sind. Stamme mit
Gasvakuolen bilden weifie Kolonien. In fliissigen Medien entsteht ein Oberfla-
chenhautchen, das nach dem Schiitteln eine flockige Suspension bildet. Biotin
stimuliert das Wachstum. Temperaturbereich zwischen 5 und 43 °C, Optimum
22-25 °C.
Vermehrung durch Teilung.
Vorkommen im Boden und Wasser.
Wichtigste Literatur: 0rskov 1928, Claus et al. 1968, Nikitin 1971, van Ert und
Staley 1971, Namsarajev und Zavarzin 1972, Kottel und Raj 1973, Namsarajev
1973, Puckova et al. 1975, Konopka et al. 1976, Larkin et al. 1977, Namsarajev et
al. 1977, Loginova et al. 1978, Namsarajev und Nozevnikova 1978.
Eine einzige Art:
Microcyclus aquaticus 0rskov 1928 (Fig. 262)
Renobacter vacuolatum Nikitin 1971, Microcyclus Z 238 Namsarajev et Zavarzin
1972.
Als Kohlenstoffquelle dient eine ganze Reihe von Karbohydraten; nach Nikitin
(1971) verwerten einige Stamme sogar Methanol. Manche Stamme (mit Gasva-
kuole) beniitzen als Stickstoffquelle auch Ammoniumionen. Nitrate werden zu
Nitriten reduziert.
Die gekrummten Stabchen sind 0,5-1,0 X 1,0-3,0 \im grofi; bisweilen auch
linger. Die ringartigen Gebilde haben einen Durchmesser von 0,7-3,0 |im.
Vermehrung durch Teilung.
In grofien Mengen in Waldseen, Siifiwasserteichen und auch im Boden vorkom-
mend.
Van Ert und Staley (1971) beschrieben unbewegliche, vibrioide Organismen mit
Gasvakuolen, die sie zur Art Microcyclus aquaticus stellten.
Konopka et al. (1976) fanden eine bewegliche Mutante mit einer polaren Geifiel und
Gasvakuolen, wachst bei Temperatur unter 20 °C. Beim Wachstum iiber 20 °C hat der
Grofiteil der Individuen eine Geifiel, verliert aber die Gasvakuolen. Diese Stamme erfordern
weiteres Studium; sie sind wohl mit Microcyclus aquaticus verwandt, lassen sich aber derzeit
noch nicht sicher einordnen. Da die fehlende Bewegungsfahigkeit ein taxonomisches
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Microcyclus • 423
SSiiwieSssist> ist die ste,,ung der Gatwng »*"**» - ** ^
-ngirty
Teil VII. Gramnegative aerobe Stabchen
und Kokken
Diese Gruppe umfafk fiinf Familien, von denen hier nur die Vertreter der ersten
zwei Familien behandelt werden (Pseudomonadaceae und Azotobacteraceae),
die im Wasser vorkommen und sich zumindest annahernd nach morphologi-
schen, bzw. Kulturmerkmalen identifizieren lassen. Die Vertreter der weiteren
drei Familien (Rhizobiaceae, Methylomonadeceae, Halobacteriaceae) sowie
Gruppen unsicherer Gattungen werden nicht besprochen, denn entweder sind
zu inrer Identifizierung physiologische und biochemische Tests mit grofiem
Arbeitsaufwand erforderfich, oder sie kommen nicht im Wasser vor.
Bestimmungsschlussel der Familien
la Zellen grofi, pleomorph, ovoide Stabchen bis Kokken; altere Kulturen in
Paaren, Tetraden oder Paketen; Zysten bildend; fixieren N2 ohne symbioti-
sche Pflanzen 2. Azotobacteraceae (S. 430)
lb Zellen klein bis mittelgrofi; in Form von Stabchen oder Kokken, meist
einzeln. Keine Zysten bildend; N2 nur mit symbiotischen Pflanzen fixierend
2
2a An Wurzeln oder Stengeln von Pflanzen symbiotische oder pathogene
Knotchen bildend 3. Rhizobiaceae (S. 440)
2b An Wurzeln oder Stengeln von Pflanzen keine Knotchen bildend 3
3a Halophil;benotigtbis 12% NaCl 5. Halobacteriaceae (S. 441)
3b NaCl fur das Wachstum nicht erf orderlich 4
4a Eine Breite Skala organischer Stoffe verwertend, jedoch nicht Verbindungen
mit nur einem Kohlenstoff-Atom (Methan, Methanol)
1. Pseudomonaceae (S. 424)
4b Nur Methan oder Methanol verwertend. . 4. Methylomonadaceae (S. 440)
1. Familie Pseudomonadaceae Winslow et al. 1917
Zellen in Form von geraden oder mafiig gekriimmten gramnegativen Stabchen
oder Kokken. Zellenden in der Regel mehr oder weniger abgerundet. Bewegung
mittels polarer Geifieln. Mit unloslichen sowie wasserloslichen Pigmenten, von
denen letztere (Fluoreszenspigmente) ins Kulturmedium diffundieren. Keine
Zysten bildend.
Meist chemoorganotrophe, streng aerobe Organismen. Respirativer Metabolis-
mus; nicht fahig zu fermentativem Stoffwechsel. Luftstickstoff wird nicht
fixiert. Als Kohlenstoff- und Energiequelle wird eine breite Skala von Kohlen-
stoffverbindungen (mit Ausnahme von Verbindungen mit einem Kohlenstoff-
Atom) verwertet. Als Stickstoffquelle dienen verschiedene organische wie auch
anorganische Verbindungen. Sie wachsen in einem Temperaturbereich von
4—43 °C. Manche Arten konnen begrenzt auch bei geringerer Temperatur
wachsen. Gewohnlich im Erdboden sowie im Meer- und Sufi wasser vorkom-
mend. Zahlreiche Arten sind pathogen fiir Pflanzen und Tiere; manche Vertreter
pathogen oder fakultativ pathogen auch fiir den Menschen.
Typus familiae: Pseudomonas Migula 1894
Bestimmungsschlussel der Gattungen
la Zellen einzeln, keine in eine Schleimmatrix eingeschlossene Mikrokolonien
bildend 2
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@i
Pseudomonas - Xanthomonas • 425
lb Zellen bilden verschiedenartig gestaltete, meist kugelige oder geweihartig
verzweigte Mikrokolonien, die in eine Schleimmatrix eingeschlossen sind . . .
3.Zoogloea(S.426)
2a Zellen vorwiegend im Erdboden oder im Wasser vorkommend; mit einer
oder auch mehreren polaren Geifieln 1. Pseudomonas (S. 425)
2b ZeUen vorwiegend in Pflanzen oder Pflanzenprodukten vorkommend ... 3
3a Pathogen fiir Pflanzen; mit einer polstandigen Geifiel; Athanol wird nicht zu
Essigsaure oxydiert 2. Xanthomonas (S. 425)
3b Nicht pathogen fur Pflanzen; mit einem Biindel polarer Geifieln; Athanol
wird zu Essigsaure oxydiert 4. Gluconobacter (S. 430)
1. Pseudomonas Migula 1894 (nomen conservandum)
Chlorobacterium Guillebeau 1890 (non Chlorobacterium Lauterborn 1916),
Liquidomonas Orla-Jensen 1909, Loefflerella Holden 1935.
Zellen einzeln, gerade oder mafiig gebogen, niemals schraubenformig. Ohne
Scheide. Keine Prostheken bildend. Mit Ruhestadien. Gramnegativ. Mittels
einer polaren Geifiel oder eines Biindels polarer Geifieln beweglich. Manche
Arten produzieren losliche oder nicht losliche, manchmal fluoreszierende Pig-
mente, die in das Kulturmedium diffundieren konnen.
Chemoorganotroph oder (seltener) fakultativ chemolithotroph, H2 und CO als
Energiequelle verwertend, Metabolismus ausschliefilich respirativ. Streng aerob;
molekularer Sauerstoff dient als Endakzeptor von Elektronen. Es kommen
jedoch auch Arten vor, die zu anaerober Respiration durch Denitrifikation
befahigt sind; in einem solchen Fall sind Nitrate Akzeptoren von Elektronen.
Als Kohlenstoff-, Stickstoff- und Energiequelle wird eine breite Skala
organischer Stoffe verwertet. Die Zellen vermogen Polysacharide, Chitin
sowie verschiedene aromatische Stoffe zu verwerten. Zellen 0,5-1,0 X 1,5—4,0 um
grofi.
Zahlreiche Arten auch im Wasser vorkommend, wo sie sich besonders am
Kreislauf biogener Elemente und an Selbstreinigungsprozessen beteiligen. Mor- •
phologisch sind alle Arten ziemlich ahnlich; verlafilich konnen sie nur an Hand
lhres Kulturverhaltens, sowie ihrer physiologischen und biochemischen Eigen-
schaften bestimmt werden.
Typus generis: Pseudomonas aeruginosa (Schroeter 1872) Migula 1900.
Bergey's Manual (1974) fiihrt insgesamt 29, in vier Sektionen eingeteilte Arten
an, rerner 237 Arten als «Species incertae sedis». Auf Beschreibung der Arten
wird hier verzichtet.
2. Xanthomonas Dowson 1939
Phytomonas Bergey et al. 1923
Zellen in Form einzelner, gramnegativer, gerader Stabchen. Keine Scheiden
bildend. Ruhestadien unbekannt. Mittels einer polaren Geifiel beweglich.
Gewohnlich ein gelbes Pigment enthaltend, das meist bei Wachstum auf festen
Medien in Erscheinung tritt.
Chemoorganotrophe, streng aerobe Organismen, mit respirativem, niemals
fermentativem Metabolismus. Molekularer Sauerstoff dient immer als
Endakzeptor von Elektronen. Sie wandeln manche Kohlenhydrate in Sauren um und
verwerten auch organische Sauren. Die meisten Arten verwerten Starke. Nitrate
werden nicht reduziert. Wuchsstoffe sind erforderlich. Optimaltemperatur 25-
37 °C. Zellen 0,2-0,8 X 0,6-2,0 um grofi. Meist pathogen fiir Pflanzen.
Typus generis: Xanthomonas campestris (Pammel 1895) Dowson 1939.
426 • Gramnegative Bakterien - Zoogloea
Bergey's Manual (1974) ftihrt 5 Arten an und 148 Arten als «Species incertae
sedis». Artbeschreibungen werden hier nicht aufgefuhrt.
3. Zoogloea Itzigsohn 1867
(non Zoogloea Cohn 1854),
Winogradskya Trevisan 1889.
Zellen in Form gerader, gramnegativer und pigmentierter Stabchen, vorwiegend
mit abgerundeten, mancnmal stumpfen oder zugespitzten Enden. In der Jugend
beweglich, mit einer polaren Geifiel an einem der beiden Enden. Altere Zellen
pleomorph, Protoplasma oft sudanophile Granula von Poly-|3-Hydroxy-But-
tersaure enthalten und daher verschiedentlich deformiert. Grofie und Anzahl der
Granula hangen vom Alter der Zellen und ihren Wachstumsbedingungen ab
(Crabtree et al. 1965). Weder Sporen noch Zysten bildend. In einem an organi-
schen Stoffen reichen Milieu (sowohl im Freiland als auch in manchen Kulturme-
dien) umgeben sich die Zellen mit einer durchsichtigen, festen (manchmal auch
schleimigen), gelatinosen Matrix aus einer hoch polymerisierten exozellularen
Substanz; sie bilden so makroskopische, unregelmafiige flockige Kolonien, die
entweder kompakt, bisweilen auch traubenartig sein konnen, fingerartige Aus-
laufer haben oder baum- oder geweihformig verzweigt sind. Die Form der
Matrix ist nach Friedman und Dugan (1968) von den Wachstumsbedingungen
abhangig und kann deshalb nicht als Charakteristikum fur die einzelnen Arten
dienen. Flocken entweder frei schwebend oder an der Oberflache submerser
Gegenstande festsitzend. Elektronenmikroskopisch wurde festgestellt, dafi die
Zellen in der Matrix durch extrazellulare Fasern miteinander verflochten sind
(Friedman et al. 1969). Kapseln werden nur bei einem Stamm (Crabtree und
McCoy in Bergey's Manual 1974) gebildet, in anderen Fallen konnten sie auch
nicht mittels negativer Farbung festgestellt werden; es wurde auch kein Schleim-
lager gefunden. Flockung vor allem stark vom Verhaltnis C : N im Kulturme-
dium abhangig. Bei einem hoheren Verhaltnis als 10 : 1 erfolgt typischer
Flockenwuchs; bei geringerem Verhaltnis als 5 : 1 disperses Wachstum (!);
dieses auch vom Alter der Kultur sowie vom Zustand des Isolates abhangig (Unz
1971).
Chemoorganotropher, streng aerober Organismus mit respirativem Metabolis-
mus; molekularer Sauerstoff dient als Endakzeptor von Elektronen. Auch in
Anwesenheit von Nitraten nicht anaerob wachsend. Reduziert keine Nitrate.
Verwertet als Energie- und Kohlenstoffquelle eine ganze Reihe von Kohlenhy-
draten sowie die Salze einiger Fettsauren. Hydrolysiert weder Starke noch
Zellulose. Verfliissigt keine Gelatine und hydrolysiert weder Kasein noch
koaguliertes Eiweifi. Zum Wachstum ist Vitamin B!2 erforderlich. Biotin stimu-
liert das Wachstum. In Anwesenheit von Vitaminen konnen eine Reihe von
Aminosauren als einzige C- und N-Quelle verwertet werden; auch NH| kann
unter den gleichen Bedingungen als einzige Stickstoffquelle dienen. Optimale
Temperatur 28-30 °C; bei 10 CC verlauft das Wachstum langsam, bei 45 °C
wird es eingestellt. Bei einer Konzentration von 3% NaCl ist noch Wachstum
moelich, nicht aber bei 6%. In flussigen Nahrlosungen wird unter stationaren
Kulturbedingungen an der Oberflache eine sprode Haut aus spitzenartigen
Flocken gebildet, die sich an der Wand des Kulturgefafies festhaften. In Schiittel-
kulturen entstehen Flocken, deren Bildung durch Gegenwart schnell oxydierba-
rer Kohlendydrate stimuliert wird. Ohne Triibung. Auf festen Boden entstehen
strohfarbene bis gelbbraune, 2-3 mm breite, an der Oberflache gewellte trocke-
ne, lederartig zahe Kolonien mit einer deutlichen Vertiefung in der Mitte. Sie
sind so kompakt, dafi sie beim Uberimpfen mit einer Ose im ganzen von der
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Zoogloea • 427
Agaroberflache abgeheben werden konnen. Allgemein als Ubiquisten im Wasser
vorkommend, das von organischen Stoffen verunreinigt ist, namentlich in
Abwassern, im Belebtschlamm und in von Abwassern verschmutzten Oberfla-
chengewassern.
Die Giiltigkeit des Gattungsnamens ist zweifelhaft. Cohn (1854) gab ihn auf, da er
vermutete, daft es sich nur um eine Wuchsform von Micrococcus handelt. Spater wurde er
von Itzigsohn (1867) wieder aufgenommen, jedoch ohne ausreichende Beschreibung, die
erst von Bloch (1918) geliefert wurde. Billroth (1874) war bemiiht, den Namen durch die
Benennung Coccoglia oder Gliacoccus zu ersetzen, die sich jedoch nicht eingebiirgert haben.
Die von Trevisan (1889) vorgeschlagene Bezeichnung Winogradskya ist ein ungultiges
Synonym.
Bis vor kurzem wurde den Organismen dieser Gattung oft die Funktion der Flockenbildung
im Belebtschlamm zugesprocnen. Wie schon McKinney (1956) zeigte, hangt jedoch die
Bildung der Zoog/oea-Matrix nicht mit der Flockung zusammen, da zahlreiche Organismen
Flocken bilden, ohne eine Matrix zu produzieren. Auch die Arbeiten von Eckenfelder und
O'Connor (1961), Hynes (1960), Hawkes (1963) und zahlreicher anderer Autoren bewei-
sen, daft die Bildung Zoog/oea-artiger Kolonien nur eine Wuchsform einer ganzen Reihe von
Mikroorganismen ist, die Flocken im Belebtschlamm bilden. Da die von Itzigsohn (1867)
beschriebenen Stamme nicht mehr zur Verfugung stehen, dient gegenwartig der von
Crabtree und McCoy (1967) vorgeschlagene Neotyp als Grundlage der, Beschreibung.
Zur genauen Identifizierung dieser Organismen miissen, physiologische und
biochemische Eigenschaften untersucht werden; da die morphologischen Eigen-
schaften allein nicht gentigen.
Typus generis: Zoogloea ramigera Itzigsohn 1868, emend. Bloch 1918.
Wichtigste Literatur: Cohn 1854,1872, Itzigsohn 1868, Billroth 1874, Trevisan
1889, Kolkwitz 1911, Johnson 1914, Bloch 1918, de Rossi 1927, Beger 1928,
Butterfield 1935, Butterfield et al. 1937. Wattie 1943, Krasil'nikov 1949, Rich
1955, McKinney 1956, Bergey's Manual 1954, 1974, Dugan und Lundgren 1960,
Hynes 1960, Eckenfelder und O'Conner 1961, Hawkes 1963, Dias und Bhat
1964, Crabtree et al. 1965, 1966, Crabtree und McCoy 1967, Unz und Dondero
1967a, 1967b, Zwirbulis und Hatt 1967, Friedman und Dugan 1968, Friedman et
al. 1969, Unz 1971.
Bestimmungsschliissel der Arten
la Kolonien vorwiegend geweihartig verzweigt; eine Reihe von Kohlenhydra-
ten einschliefilich Maltose, Saccharose und Laktose wird oxydiert; Harnstoff
wird nicht hydrolysiert 1. Z. ramigera
lb Kolonien kugelig oder gelappt; die Zellen oxydieren eine Reihe von Kohlen-
hydraten, jedoch keine Maltose, Saccharose oder Laktose; hydrolysieren
Harnstoff 2. Z. filipendula
1. Zoogloea ramigera Itzigsohn 1867, emend. Bloch 1918 (Fig. 267)
Zoogloea camea Kolkwitz 1911, Zoogloea compacta Kolkwitz 1911, Zoogloea
uva Kolkwitz 1911, Zoogloea ramigera var. camea Johnson 1914, Zoogloea
ramigera var. compacta Johnson 1914, Zoogloea ramigera var. uva Johnson
1914, Bacterium zoogloeae ramigerae Bloch 1918, Pseudomonas zoogloeae
ramigerae (Bloch 1918) de Rossi 1927, Winogradskya ramigera (Itzigsohn 1867)
Trevisan 1889, Bacterium ramigerum (Itzigsohn 1867) Krasil'nikov 1949.
Stabchen mit stumpfen oder mafiig zugespitzten Enden. Jupge Zellen aktiv
beweglich, mit einer langen, geraden Geifiel an einem oder an beiden Polen. Eine
grofie Anzahl von Zellen bildet charakteristische, geweihartig verzweigte Flok-
ken, in denen die Zellen in einer schleimigen durchsichtigen Matrix liegen; Zellen
durch feine extrazellulare Faden miteinander verbunden, gramnegativ, ohne
Kapsel.
428 • Gramnegative Bakterien - Zoogloea
Sie oxydieren eine Reihe organischer Stoffe, besonders Kohlenhydrate, ein-
schliefilich Maltose, Saccharose und Laktose; hydrolysieren weder Starke noch
Zellulose. Gelatine wird nicht verfliissigt und Harnstoff nicht hydrolysiert.
Aminosauren werden nur in Anwesenheit von Vitaminen, besonders B!2, als
Kohlenstoff- und Stickstoffquelle verwertet. Eiweifistoffe werden nicht zer-
setzt.
Zellen 0,5-1,0 + 1,0-3,0 urn groft.
Meistens in Abwassern und im Belebtschlamm als willkommene Flocken verfe-
stigender Organismus vorhanden, ferner in faulenden, stehenden Gewassern
u. a. Gedeiht am besten in gut durchliifteter Medien mit hoherer Gehalt an
organischen Stoffen.
Fig. 267. Zoogloea ramigera - (nach Cyrus und Sladecek, 1973. - 50x) -
a geweihformiger Wuchs, b Detail eines Teils der schleimartigen Matrix, in der
die einzelnen Zellen deutlich sind fnach Cyrus und Sladecek, 1973. - 1000X),
cjunge mittels polarer Geifiel bewegliche Zellen (nach Elektronen-Mikrophoto
umgezeichnet - Unz, 1971. - 5000X). Fig. 268. Zoogloea sp. Wachsform, von
einigen Autoren als Zoogloea filipendula bezeichnet (nach Cyrus und Sladecek,
1973. - 50X). Fig. 269. Zoogloea sp. - Wuchsform, von einigen Autoren als
Zoogloea uva bezeichnet (nach Cyrus und Sladecek, 1973. - 50 X).
Wie Unz (1971) berichtet, wird die taxonomische Einordnung dadurch kompliziert, dafi
Zoogloea ramigera nur eine Wuchsform einiger nicht miteinander verwandter Bakterienar-
ten sein kann. (Rich 1955, Dugan und Lundgren 1960, Dias und Bhat 1964 u.a.) wahrend der
Gesamthabitus der Beschreibung von Zoggloea ramigera entspricht, bestehen in den
biochemischen Eigenschaften gewisse Differenzen, die darauf hinweisen, dafi es sich bei
dem nicht untersuchten Material nicht immer um Reinkulturen handelte, die angesichts der
Kompaktheit der Flocken auch nur schwer erzielt werden konnen. Die gegenwartige
Nomenklatur beruht auf einem von Crabtree und McCoy (1967) vorgeschlagenen Neotyp,
der jedoch von Friedman und Dugan (1968) als zur Gattung Pseudomonas gehorend
betrachtet wird, da seine Beschreibung nicht vollig mit jener von Itzigsohn (1868) iiberein-
stimmt. Die charakteristischen Merkmale sind variabel und von der Kultur abhangig; die Art
Seamed &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@i
Zoogloea • 429
wachst periodisch dispergiert und geht allmahlich in eine flockige Form mit amorphen oder
auch geweihartig verzweigten Kolonien. Geweihartige Kolonien kommen ofter bei frischen
Isolaten vor; bei Laborstammen sind sie seltener. In Ubereinstimmung mit Unz und
Dondero (1967a, 1967b) wird davor gewarnt, Zoogloea ramigera nur nach morphologischen
Merkmalen zu bestimmen wollen. Ein von Unz (1971) isolierter Stamm, den er als den
korrekten Neotyp us ansieht, hydrolysiert im Gegensatz zum Neotyp Crabtree und McCoy
(1967) Harnstoff, Gelatine und Kasein.
Johnson (1914) unterscheidet drei Varietaten, die wegen fehlender Unterscheidungsmerk-
male der Leitart zugeordnet werden miissen:
la. Zoogloea ramigera var. carnea Johnson 1914.
Zoogloea carnea Kolkwitz 1911 (nomen provisorium)
Grofie, makroskopische,fleischfarbene, aus kurzen, 1,5 \im dicken Stabchen bestehende
Kolonien, an den Randern von Schmutzwassergraben auftretend.
lb. Zoogloea ramigera var. compacta Johnson 1914.
Zoogloea compacta Kolkwitz 1911 (nomen provisorium).
Kleine, mikroskopische, gelatinose Biischel aus kurzen stabchenformigen Zellen.
lc. Zoogloea ramigera var. uva Johnson 1914 (Fig. 269).
Zoogloea uva Kolkwitz 1911 (nomen provisorium).
Kugelige bis traubenformige Kolonien mit verschiedenartig gestalteter Oberflache (warzig,
glatt, gelappt u. a.), Kolonien erbsen- bis kirschgrofi. Aus langen, iiber 1,0 ^m breiten
Stabchen bestehend. An submersen Wurzeln und verschiedenen Stengeln vorkommend.
2. Zoogloea filipendula Beger 1928 (Fig. 268)
Zellen in Form von Kokken oder kurzen Stabchen mit abgerundeten oder auch
verjiingten Enden. Junge Zellen mittels langer gewellter Polargeifiel beweglich.
Nach der urspriinglichen Beschreibung von Beger (1928) ein traubenartiges
Konglomerat kugeliger 3—4 mm grofier Kolonien bildend. Kolonien in der Mitte
meist hohl. Oft kommen auch an der Kolonienoberflache andere Bakterienarten,
z. B. eisenhaltige Bakterien vor, die dann dem ganzen Gebilde eine spezifische
Farbung verleihen. Chemoorganotropher, eine Reihe von Kohlenhydraten oxy-
dierender Organismus; oxydiert jedoch weder Maltose, noch Saccharose oder
Laktose. Hydrolysiert Harnstoff.
In stehenden Gewassern auf Wurzeln von Filipendula ulmaria (Beger 1928),
sowie in Abwassern, industriellen Abwassern und Belebtschlammflocken
vorkommend.
Beger (1928) beobachtete die Art auch in Brunnen in der Nahe Berlins. Seiner
Meinung nach unterschied sie sich durch die Morphologie der Mikrokolonien
geniigend von Zoogloea ramigera.
Zu streichende Art:
Zoogloea termo (Miiller 1786) Cohn 1854.
Monas termo Miiller 1786, Bacterium termo (Miiller 1786) Ehrenberg 1832,
Bacillus termo (Miiller 1786) Trevisan 1889, Bactrillum pseudo-termo Fischer
1895
Zellen klein, in Form von Bazillen, farblos, transparent; sie bilden einen klumpigen, knauel-
oder traubenformigen schleim; manchmal losen sich einzelne Gebilde aus der Anhaufung.
Beschreibung sehr unklar, so dafi der Organismus nicht identifiziert werden kann. Nach
Skuja (1956), der sich jedoch auf Kruse (1896) und Butterfield (1935) bezieht, handelt essich
um mafiig spindelformige, eine gemeinsame Schleimkolonie bildende Zellen; die Kolonieist
hyalin und verzweigt. Zellen mit kornigem Protoplasma, 1,0 x 4,0-10,0 um groG; Kolonie
bis 1000 \im lang. Ob die Skujasche Sippe mit Zoogloea termo (Miiller 1786) Cohn 1854
identisch ist, scheint mehr als fraglich. Selbst die Identitat mit der von Butterfield
untersuchten Form ist nicht sicher. Im Wasser des Sees Dalalven zwischen Gasinge und Utsund
(Schweden), manchmal reichlich, in den Spatherbst- und den ersten Friihjahrsmonaten
gefunden.
430 ■ Gramnegative Bakterien - Gluconobacter - Azotobacteraceae
4. Gluconobacter Asai 1935, emend. Asai et al. 1964
Acetomonas Leifson 1954
Zellen gramnegativ, in alteren Kulturen manchmal schwach positiv;
stabchenformig oder ellipsoidisch; einzeln oder in Paaren oder Ketten. In alteren
Kulturen werden Involutionsformen gebildet. Mittels eines Biindels von 3-8
polaren Geifieln beweglich. In seltenen Fallen besitzen sie nur eine Geifiel oder
sind unbeweglich. Chemoorganotrophe, streng aerobe Organismen mit respira-
tivem Metabolismus. Molekularer Sauerstoff dient als Endakzeptor von Elektro-
nen. Athanol wird zu Essigsaure oxydiert, Azetate und Laktate jedoch nicht zu
C02. Manche Stamme erzeugen 2- oder 5-Ketoglukonsaure und ein wasserlosli-
ches braunes Pigment. Optimaltemperatur 25-30 °C, tolerierte eine Tempera-
turspanne von 7-41 °C. Optimaler pH-Wert bei 5,5-6,0. Zellen 0,6-0,8 X 1,5-
2,0 um grofi.
In Blumen, Friichten, Gemiise, Bier, Most, Wein, Weinessig, Hefe u. a. vor-
kommend. Auch in Gartenboden.
Typus generis: Gluconobacter oxydans (Henneberg 1897) De Ley 1961.
Artbeschreibungen entfallen.
2. Familie Azotobacteraceae Pribram 1933
(non Azotobacteriaceae Pribram 1933)
Zellen von unterschiedlicher Grofie mit deutlichem Pleomorphismus; durch ihre
Struktur an manche Blaualgen oder Hefen erinnernd. Uberwiegend grofi,
stabchenformig oder ovoid; oft in Paaren, Tetraden, Paketen oder Ketten.
Durch peritrichale oder polare Geifieln beweglich; manche Arten unbeweglich.
Gramnegativ oder gramvariabel. Keine Sporen bildend; einige Arten bilden
Zysten und Schleimkapseln. Manche Arten erzeugen braune, zimtfarbene, rosa
oder griinblaue Pigmente, die gelegentlich in den Nahrboden diffundieren.
Einige Arten bilden auch ein wasserlosliches, fluoreszierendes Pigment, das im
ultravioletten Licht entweder griin oder weifi aufleuchtet.
Obligat aerobe, chemoorganotrophe Organismen, die atmospharischen Stick-
stoff zu fixieren vermogen. Die Stickstoffbindung wird durch Senkung der
Kohlenhydratkonzentration oder des Sauerstoffdrucks wirksamer. Energie wird
meist aus Kohlenhydraten, Alkoholen und organischen Sauren gewonnen, die
zu C02 und H20 oxydiert werden. Proteolytisch nicht aktiv. Sie gedeihen am
besten in Anwesenheit von atmospharischem Stickstoff oder einfacher Stick-
stoffhaltiger Verbindungen. Manche Arten konnen NOJ nicht verwerten.
Organische Wachstumsfaktoren sind nicht erforderlich; zur Stickstoffbildung
ist jedoch Molybdan notig, das in manchen Fallen durch Vanadium ersetzt
werden kann. Im Erdboden und im Wasser vorkommend, manche Arten an der
Oberflache der Blatter von Pflanzen lebend.
Typus familiae: Azotobacter Beijerinck 1901
Bestimmungsschliissel der Gattungen
la Zellen grofi, ovoid, meist extrazellularen Schleim bildend. Protoplasma ohne
lipoideGranula. Wachstumintensiv 2
lb Stabchen klein, sehr adhasive, schleimige oder gummiartige Substanzen
erzeugend. Protoplasma mit lipoidenGranula. Wachstum langsam 3
2a Zellen Zysten bildend; falls ein fluoreszierendes Pigment gebildet wird,
erscheintesim ultravioletten Licht griin l^|obacter(S.431)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Azotobacter • 431
2b Zellen keine Zysten bildend; falls ein fluoreszierendes Pigment gebildet
wird, erscheint es im ultravioletten Licht weifi 2. Azomonas(S. 436)
3a LipoidelnklusionennurandenPolen 3. Beijerinckia (S. 438)
3b LipoidelnklusionenreichlichinderganzenZelle 4. Derxia (S. 439)
1. Azotobacter Beijerinck 1901
Parachromatium Beijerinck 1903, Azotomonas Orla-Jensen 1909 (non Azoto-
monas Stapp 1940).
Organismen mit bemerkenswertem Pleomorphismus. Junge Zellen ovoid oder
kurz stabchenformig, mit abgerundeten Enden altere Zellen kokkoid. Einzeln
oder in Paaren unregelmafiigen Anhaufungen, selten in Ketten mit mehr als
4 Zellen. Besonders altere Zellen von einer machtigen Schleimkapsel umgeben.
Keine Endosporenbildung. Nach Lawrence (1955) werden bei alteren Kulturen
filtrierbare Partikel gebildet, aus denen normale Kulturen geziichtet werden
konnen. Ihre Grofie betragt ungefahr ein Viertel der vegetativen Zellen. In einem
Milieu, das geniigend Stickstoffverbindungen enthalt, konnen dickwandige,
gegen Austrocknen widerstandsfahige Zysten entstehen (Jensen 1954). Layne
und Johnson (1964) beobachteten, dafi die Zystenbildung vor allem durch
Mangel an Mineralstoffen und durch Senkung des Gehaltes an Kohlenhydraten
(Saccharose) im Medium hervorgerufen wird. Die Zystenwand besteht aus zwei
Schichten (Intine und Exine), die besonders bei Kultur auf festen Nahrboden
sichtbar werden. Die Zystenbildung wird nach Hitchins und Sadoff (1970) durch
die Anwesenheit von Poly-f5-Hydroxybuttersaure im Medium induziert. Junge
Zellen mit Hilfe peritricher Geifieln beweglich. Altere Zellen verlieren ihre
Beweglichkeit. Gramnegativ oder gramvariabel. Manche Arten bilden ein
wasserlosliches fluoreszierendes, im ultravioletten Licht griin erscheinendes
Pigment. Andere Arten bilden ein wasserlosliches, zimtfarbenes bis braunes,
manchmal auch schwarzes Pigment, das alteren Kolonien eine typische Farbung
verleiht. Protoplasma mit einer grofien Anzahl von Granula.
Obligat aerobe Organismen; Wachstum jedoch auch bei niedrigem
atmospharischen Sauerstoffdruck. Eine charakteristische Eigenschaft ist die Bindung mole-
kularen Stickstoffs aus der Atmosphare, wobei mindestens 10 mg N2 je g
verbrauchten Kohlenhydrates fixiert werden. Stickstoff kann auch aus NHj,
NOj oder Aminosauren verwertet werden. EiweiCstoffe werden nicht zersetzt.
Kohlenhydrate und andere stickstofffreie Stoffe (Alkohole und organische
Sauren) werden zu C02 und H20 mineralisiert. Die fur das Wachstum erforder-
liche Optimaltemperatur betragt 20-30 °C. Toleriert pH-Werte zwischen 5,5-
8,5, wobei das Optimum bei 7,0-7,5 liegt. Fortpflanzung durch Teilung mit
vorangehender Einschniirung. Im Erdboden und im Siifiwasser vorkommend.
Eine Art auch aus dem Meerwasser beschrieben.
Schon Beijerinck (1901) machte auf eine Reihe von Eigenschaften aufmerksam, die mit
denen der Blaualgen aus der Familie der Chroococcaceae iibereinstimmen, Fischer (1905)
auf solche, die sie mit der Gattung Aphanocapsa gemeinsam haben und Bacinskaja und
Kondrat'eva (1941) auf Ahnlichkeiten mit der Gattung Gloeocapsa. Heinze(1906)hieltdiese
Organismen sogar fiir farblose Blaualgen. Imseneckij (1946) charakterisierte die mit den
Algen ubereinstimmenden folgendermafien: Fixierung von Luftstickstoff, Form und Grofie
der Zellen, Teilungsmodus der Zellen, Bildung von Kapseln und Zoog/oea-artigen Ge-
bilden.
Es wurde eine ganze Reihe von Arten beschrieben, deren Merkmale jedoch nicht charakteri-
stisch genug sind, um sie als selbstandige Arten anzuerkennen; sie wurden deshalb zu
anderen Arten gestellt. Urspriinglich schlofi diese Gattung auch Arten der Gattung Azomo-
nas ein.
Typus generis: Azotobactm^chroococcum Beijerinck 1901.
432 • Gramnegative Bakterien - Azotobacter
Wichtigste Literatur: Beijerinck 1901, 1903, Lipman 1904,1909, Fischer 1905,
Heinze 1906, Lohnis und Westermann 1909, Orla-Jensen 1909, Lohnis und
Hanzawa 1914, Lipman und Burgess 1915, Lohnis und Smith 1923, Yamagata
und Itano 1923, Buchanan 1925, Aso und Yoshida 1928, Kluyver und van
Reenen 1933, Smith 1934, Winogradskij 1938, Bacinskaja und Kondrat'ev 1941,
Imseneckij 1946, Bergey's Manual 1948, 1957, 1974, Suskina 1948, 1949,
Krasil'nikov 1949, Imseneckaja 1950, Panosjan 1950, KrasiPnikov et al. 1952,
Tchan 1953, Jensen 1954, Jensen und Petersen 1954, Lawrence 1955, Shutter und
Wilson 1955, Johnstone und Fishbein 1956, Byckovskaja und Skljar 1959,
Rubencik 1959, Kolesko 1960, Okuda und Bobayashi 1961, Vancura 1961,
Becking 1962, Blinkov 1962, Cohen und Johnstone 1964, Layne und Johnson
1964, Psenin 1964, Dobereiner 1966, Chan et al. 1970.
Bestimmungsschlussel der Arten
la ImErdboden oder imSiifiwasser vorkommend 2
lb NurimMeerwasservorkommend 5. A. miscellum
2a Kein wasserlosliches, in ultraviolettem Licht griin fluoreszierendes Pigment
bildend 3
2b Bildetein griin fluoreszierendes, wasserlosliches Pigment 4
3a Kolonien braun bis schwarzbraun gefarbt; Zellen keine Ketten bildend;
Starke und Mannitol verwertend 1. A. chroococcum
3b Kolonien zimtfarben; Zellen haufig Ketten bildend; Starke und Mannitol
nicht verwertend 2. A. beijerinckii
4a Im Erdboden sowie im Wasser vorkommend; Zellen in Form von Stabchen;
Mannitol und Rhamnose verwertend 3. A. vinelandii
4b In der Rhizosphare des brasilianischen Grases Paspalum notatum
vorkommend 4. A. paspali
1. Azotobacter chroococcum Beijerinck 1901 (Fig. 270)
Azotobacter woodstownii Lipman 1904, Bacillus azotobacter Lohnis et Hanzawa
1914, Bacillus chroococcus (Beijerinck 1901) Buchanan 1925, Azotobacter uni-
capsulare Bacinskaja et Kondrat'ev 1941, Azotobacter galophilum Suskina 1949,
Azotobacter nigricans Krasil'nikov 1949, Azotobacter araxii Panosjan 1950.
Junge Zellen aus 24 Stunden alter Kultur in Form kurzer Stabchen mit abgerun-
deten Enden. Wie Krasil'nikov et al. (1952) elektronenmikroskopisch bewiesen,
sind sie mit Hilfe peritricher Geifieln beweglich. Die Anzahl der Geifieln ist je
nach Stamm verscnieden. Insgesamt lassen sich 3 Typen unterscheiden: 1. zahl-
reiche lange Geifieln, 2. weniger lange Geifieln, 3. zahlreiche kurze Geifieln. In
alteren Kulturen kokkenformig, oft paarweise, manchmal auch Dreiergruppen,
Tetraden oder sarzinenartige Pakete bildend. Von einer festen, dicken Schleim-
kapsel umschlossen. Haufig auch in Form von Zysten mit dicker Membran
vorkommend. Gewohnlich durch ein braunes, nicht wasserlosliches Pigment
gefarbt. Unter ungiinstigen Wachstumsbedingungen entstehen Involutionsfor-
men von verschiedener Gestalt und Grofie. Protoplasma mit 3-4 lichtbrechen-
den Granula von Reservestoffen (Glykogen), die in der Regel den Raum der
Zelle ganz oder zum grofieren Teil ausfiillen.
Stickstoff wird bei verschiedenen Stammen mit verschiedener Intensitat fixiert
(0,3-18 mg N2 je g verwerteter Glukose). Als Stickstoffquelle konnen auch
einige anorganische Verbin'dungen verwendet werden. Nitrate werden zu Nitri-
ten reduziert, Kohlenhydrate, Alkohole und organische Sauren zu CO2 und
H20 oxydiert. Die Zellen verwerten Starke (ein spezifisches Merkmal) sowie
Mannitol, jedoch keine Rhamnose. Gelatine wird nicht verfliissigt; Eiweifistoffe
werden nicht zersetzt. Es wird kein wasserlosliches fluoreszierendes Pigment
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
AzotoDacter • tjj
gebildet, wohl aber auf Ashby-Agar ein braunes bis braunschwarzes Pigment,
das nur bei manchen Stammen in den Nahrboden diffundiert. Einige Stamme
sind halotolerant bis halophil. Junge Kolonien konvex, glatt, schleimig mit der
Tendenz zu zerfliefien, rarblos oder milchig getriibt. Altere Kolonien fest;
allmahlich durch ein braunes Pigment gefarbt und schliefilich dunkelbraun
(manchmal bis schwarz) werdend. Oberflache faltig oder gefurcht. Stabchenfor-
mige Zellen gewohnlich 2,0 X 5,0 \im grofi.
In alien, besonders in gut bearbeiteten Bodentypen vorkommende Art. Auch in
Gewassern vorhanden.
Vancura (1961) entdeckte im Kulturfiltrat einen, die Keimung und das Wachs-
tum mancher griiner Pflanzen stimulierenden Stoff. Chan et al. (1970) stellte fest,
dafi das Wacnstum von Azotobacter chroococcum in Anwesenheit mancher
Arten der Gattung Pseudomonas inhibiert wird, was fur die Okologie beider
Organismen von Bedeutung ist.
Fig. 270. Azotobacter chroococum - a einzelne charakteristische Stadien des
Wachstumszyklus (nach Fedorov, 1952. - 2000 X), b Zysten (nach Krasil'nikov,
1949. - 2000X), c Involutionsformen (nach Krasil'nikov, 1949. - 2000X),
d Schleimkapseln im Negativ-Praparat (nach Fedorov, 1952. - 2000X), e sarci-
naformige Gebilde aus alter Kultur (nach Krasil'nikov, 1949. - 2000X).
Lohnis und Smith (1923) und Hofer in Bergey's Manual (1948) ordnen dieser Art auch
Azotobacter beijerinckii und Hofer ferner Azotobacter hilgardii und Azotobacter smymii
zu.
Hofer in Bergey's Manual (1948) und Krasil'nikov (1949) stellen zu dieser An auch die
folgende friiher als selbstandig beschriebene Sippe:
la. Azotobacter woodstownii Lipman 1904
Unterscheidet sich morphologisch nicht von der Leitart; die Fahigkeit Luftstickstoff zu
fixieren ist nur sehr gering (0,5-1,0 mg N2 je g verwerteter Glukose).
Rubencik (1959) vereinigt mit Azotobacter chroococcum auch weitere Arten:
lb. Azotobacter unicapsulare Bacinskaja et Kondrat'ev 1941.
Unterscheidet sich von der Leitart nur durch spezifische Kapselbildung.
lc. Azotobacter galophilum Suskina 1948.
Unterscheidet sich morphologisch nicht von der Leitart. Protoplasma homogen. Zimtfar-
434 ■ Gramnegative Bakterien - Azotobacter
ben bis braun. Pigment in den Kulturboden diffundierend. Halophiler Organismus; fixiert
Stickstoff nur in Boden mit 3% NaCl in einer Menge von 3 mg N2 je g verwerteterGlukose.
Blinkov (1962) ist der Ansicht, dafi sich der Organismus allmahlich durch Adaptierung aus
Azotobacter chroococcum entwickelt hat.
Id. Azotobacter nigricans Krasil'nikov 1945.
Morphologisch von der Leitart nicht unterscheidbar. Zellen mit langen Geifieln, vielfach
langer als der Zelldurchmesser, kreisformig eingerollt (Krasil'nikov et al. 1952). Braunes
Pigment diffundiert ins Kulturmedium. Halotoleranter Organismus mit geringer Bindung
von Luftstickstoff (2,0-3,0 mg N2 je g verwerteter Glukose). In den Boden von Mittelasien
vorkommend. Imseneckaja (1950) ist der Ansicht, dafi es sich nur um einen spezifischen
Stamm von Azotobacter chroococcum handelt.
le. Azotobacter araxii Panosjan 1950.
Unterscheidet sich von der Leitart nur dadurch, dai! er auf Nahrboden, der Extrakt aus
Salzboden enthalt, eiformige Zellen ohne Schleimkapsel bildet. In Salzboden in Armenien
(UdSSR) vorkommend. Panosjan (1950) deutet an, dafi es sich moglicherweise nur um einen
spezifischen Stamm handelt.
2. Azotobacter beijerinckii Lipman 1904
Azotobacter" beijerinckii acido-tolerans Tchan 1953, Azotobacter beijerinckii
achromogenes Jensen et Petersen 1954.
Junge Zellen in Form von Stabchen mit abgerundeten Enden. Altere Zellen kurz
ellipsoidisch bis kugelig. Nicht beweglich, wahrscheinlich ohne Geifieln. Ein-
zeln, auch Paare oder kurze Ketten bildend, die nach Lipman (1904) an
Streptococcus erinnern. Keine Pakete bildend. Mit verhaltnismafiig grofier Kapsel. Bei
Wachstum auf Salzen organischer Sauren oder Athanol entstehen Zysten mit
grauer schattierung und weniger dichter Zellhaut.
Protoplasma kleine Granula lipoider Natur enthaltend, die sich mit Sudan III
gut farben.
Fixierung von atmospharischem Stickstoff verhaltnismafiig intensiv; fixiert 10-
14 mg N2 je g verwerteter Glukose. Eine Reihe organischer Stoffe, vor allem
Kohlenhydrate und Salze organischer Sauren, gut verwenbar, nicht jedoch
Starke, Laktose, Arabinose, Mannitol noch Rhamnose. Wenig tolerant gegen-
iiber Sauren. Nitrate inhibieren das Wachstum nicht. Junge Kolonien weifi,
matt, pastos. Altere Kolonien anfangs schmutziggelb, spater braungelb, rostfar-
ben oder braunrot bis zimtfarben. Pigment diffundiert nicht in den Nahrboden.
Es wird kein wasserlosliches fluoreszierendes Pigment produziert. Fortpflan-
zung durch Einschniirung der Zellen mit anschliefiender Teilung.
Junge Zellen nach Byckovskaja und Skljar (1959) 2,0-2,5 X 4,0-4,5 \im grofi;
altere Zellen 2,5-3,0 X 4,0-4,5 \im. Lipman (1904) gibt Ausmafie mit 2,0-3,0 X
4,0-8,0 p.m an.
In Boden und im Siifiwasser vorkommend.
Von Lohnis und Smith (1923) und Hofer in Bergey's Manual (1948) sowie von Krasil'nikov
(1949) Azotobacter chroococcum zugeordnet. Jensen und Petersen (1954) sind der gleichen
Ansicht; die grofieren Ausmafie der Zellen und die Kettenbildung betrachten sie als eine
Stammvariation. Aso und Joshida (1928) sind ebenfalls der Meinung, dafi er auf Grund
serologischer Eigenschaften zu Azobacter chroococcum gestellt werden sollte.
Tchan (1953) und Jensen und Petersen (1954) beschrieben Stamme,die sich geringfiigig von
der Leitart unterscheiden:
2a. Azotobacter beijerinckii acido-tolerans Tchan 1953.
Der Organismus ist wesentlich widerstandsfahiger gegenuber Sauren als die Leitart. Andere
Unterschiede gibt es nicht.
2b. Azotobacter beijerinckii achromogenes Jensen et Petersen 1954.
Unterscheidet sich von der Leitart durch fehlende Pigmentbildung; auf Agarmedien sind die
Kolonien weifi oder gelblich gefarbt.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Azotobacter ■ 435
3. Azotobacter vinelandii Lipman 1904
Azotobacter hilgardii Lipman 1909, Azotobacter vitreum Lohnis et Westermann
1909, Azotobacter smyrnii Lipman et Burges 1915, Azotobacter fluorescens
Krasil'nikov 1949.
In jungen Kulturen, bewegliche Stabchen, in alteren Kulturen Zellen wesentlich
kiirzer, bis kokkenartig; die Stabchenform iiberwiegt jedoch. Haufig in Paaren
vorkommend. Weder Pakete noch andere Formationen bildend; immer einzeln.
Zysten sowie Schleimkapseln bekannt. Nach Cohen und Johnstone (1964)
enthalt der Schleim Galakturonsaure, a,D-Glukone und Rhamnose; in geringe-
ren Mengen auch Hexuronsaure und Scorbinsaure, wodurch sich diese Art von
den anderen Arten der Gattng unterscheidet.
Zellen beweglich, mit langen peritrichen Geifieln, deren Anzahl verschieden ist
(Krasil'nikov et al. 1952). Plasma homogen, schwach lichtbrechend. gewohnlich
1-2 kleine Granula enthaltend.
Aerober Organismus; fixiert atmospharischen Stickstoff. Manche Stamme ver-
mogen auf eiweifihaltigen Nahrboden zu wachsen. Gelatine wird nicht verfliis-
sigt. Verwertet Mannitol und Rhamnose, jedoch keine starke. Kolonien glatt,
glanzend, schleimig, farblos; ein wasserlosliches, fluoreszierendes, griinlich
gefarbtes Pigment enthaltend. Im ultravioletten Licht mit deutlich griiner Fluo-
reszenz. Kolesko (1960) stellte fest, dafi dieser Organismus wahrend des Wachs-
tums ausschliefilich Kolonien mit radial angeordneten Zellen bildet.
Zellen 0,8-1,0 X 2,0-3,0 \im grofi.
Im Erdboden, oft auch in Gewassern vorkommend. Okuda und Bobayashi
(1961) zeigten, dafi in gemischten Kulturen mit Rhodopseudomonas capsulata die
Bindung von Luftstickstoff um ein Vielfaches hoher ist als in Reinkulturen.
Lohnis und Smith (1923) und Hofer in Bergey's Manual (1948) vereinigten diese Art mit
Azomonas aeilis (= Azotobacter agilis), was von zahlreichen Autoren (Vinogradskij 1938,
Kluyver unci van Reenen 1933, Krasil'nikov 1949, Shutter und Wilson 1950, Jensen 1954,
Johnstone und Fishbein 1956) widerlegt wurde. Imseneckaja (1950) stellte zwischen beiden
Arten antagonistische Beziehungen fest.
Smith (1934) ordnete dieser Art die folgende Arte zu:
3a. Azotobacter vitreum Lohnis et Westermann 1909.
Zellen kugelig oder mafiig ellipsoidisch, mitunter stabchenformig. Einzeln oder in langen
Ketten. Nur unter gewissen Umstanden beweglich. Plasma homogen, hell, mit einer
Vakuole. Auf Ashby-Agar schleimige, transparente, wie ein Wassertropfen konvexe
Kolonien bildend. Gedeiht auch gut auf eiweishaltigen Medien, auf denen die Kolonien weifi,
spater hellbraun oder rotgelb, glatt, pastos sind. Pigment diffundiert in den Boden. Gelatine
wird nicht verfliissigt. Stickstofffixierung von geringer Intensitat (0,5 mg N2 je g
verwerteter Glukose).
Selten im Erdboden vorkommend.
Ferner sind nach Rubencik (1959) die folgenden, nur wenig unterschiedlichen Arten hier
einzureihen:
3b. Azotobacter smyrnii Lipman et Burgess 1915.
Zellen stabchenformig, 1,2 x 1,8 um grofi, oft kurze Ketten, weniger haufig Paare bildend.
Ohne Zysten. Kolonien glatt, konvex, matt glnzend, farblos oder gelbbraun gefarbt. Ein
gelbgriines, losliches, ins Medium diffundierendes fluoreszierendes Pigment bildend. Stick-
stoff-fixierung nur 0,8-1,8 mg N2 je g verwerteter Glukose. Im Erdboden vorkommend,
weniger haufig im Wasser.
In Bergey's Manual (1948) falschlich Azotobacter chroococcum zugeordnet.
3c. Azotobacter hilgardii Lipman 1909.
Junge Zellen 0,8-1,0 x 3,0-8,0 um grofi, oft Paare bildend, altere Zellen in Form von
Kokken. Kolonien weifi, glatt, flach oder leicht konvex. Mitunter lederartig. Altere
Kolonien gelblich gefarbt. Wasserlosliches fluoreszierendes gelbgriines Pigment produzie-
rend, das in das Medium diffundiert. Stickstoffbindung intensiv. Im Boden, mitunter auch
im Wasser vorkommend.
436 • Gramnegative Bakterien - Azomonas
Imseneckaja (1950) stellt hierher auch:
3d. Azotobacter fluorescens Krasil'nikov 1949.
4. Azotobacter paspali Dobereiner 1966
Grofie ovoide Stabchen. Stark pleomorph, auch in jungen Kulturen. Mittelgrofie
Kokken oder verhaltnismafiig sehr lange Faden, sowie zahlreiche intermediare
Formen bildend. Alle Formen durch peritriche Geifieln beweglich. Schleimkap-
seln bildend, in alteren Kulturen auch Schleim. In Kolonien wird ein wasserlosli-
ches, im ultraviolettem Licht griin fluoreszierendes Pigment gebildet. Weder
Starke, noch Manitol oder Rhamnose verwertend.
Im Erdboden und in der Rhizosphare des brasilianischen Grases Paspalum
notatum vorkommend.
5. Azotobacter miscellum Psenin 1964
Junge Zellen einzeln oder paarweise; in Form kurzer, dicker Stabchen mit
abgerundeten Enden, manchmal ellipsoidisch. Mit Hilfe von peritricher Geifieln
beweglich. Haufig eine terminal oder exzentrisch gelagerte Vakuole enthaltend.
Altere Zellen sind kurzer und bilden Dreiergruppen, Tetraden, Fiinfergruppen
ode/ Pakete. Sie bilden auch Zysten. In fliissigen Nahrboden entstehen aus
4-14 Zellen bestehende, Azomonas agilis-'ihnYiche Ketten. Plasma junger Zellen
homogen; durch Lichtbrechung hellgrunlich erscheinend. Bei alteren Zellen
mafiig gekornt.
Kolonien auf mannitolhaltigem festem Boden zunachst weifi, spater gelbgriin,
griinorange bis griinbraun. Auf Boden mit Glukose cremefarben, spater hell- bis
schwarzbraun. Aufierdem ein griines, wasserlosliches, in den Nahrboden dif-
fundierendes Pigment bildend.
Zellen auf fliissigen Boden 2,1-5,1 X 1,7-2,9 \im grofi. Auf Agarboden mit
gleicher Zusammensetzung sind sie grofier (2,2-5,2 X 1,5-3,5 [Un).
Im Schwarzen Meer gefunden, wo der Organismus manchmal in Massen vor-
kommt.
2. Azomonas Vinogradskij 1938
Azotococcus Tchan 1953
Zellen in Form grofier, kurzer Stabchen, haufig ovoid oder fast kugelig. Deutlich
pleomorph. Einzeln oder in Ketten vorkommend. Plasma feinkornig, Vakuolen
enthaltend. Weder Endosporen, noch Zysten bildend. Unter spezifischen Be-
dingungen wird reichlich kapsularer Schleim ausgeschieden. Mit Hilfe
peritricher Geifieln beweglich; eine Art besitzt nur eine einzige polare Geifiel. Gramne-
gativ oder gramvariabel.Manche Arten bilden ein wasserlosliches, griinliches, im
ultravioletten Licht weifi fluoreszierendes Pigment.
Aerobe, jedoch auch bei gesenktem Sauerstoffdruck gedeihende Organismen.
Sie binden atmospharischen molekularen Stickstoff; Fixierungsintensitat betragt
ca. lOmg N2 je g verwerteter Glukose. Eiweifistoffe werden nicht zersetzt,
Gelatine wird nicht verfliissigt. Sie verwerten eine Reihe von Kohlenhydraten,
die sie zu COj und H20 oxydieren. Die fur das Wachstum erforderliche
optimale Temperatur betragt 20-30 °C. Toleriert pH-Werte von 4,5-9,0,
wobei das Optimum bei 7,0-7,5 liegt. Haufig im Wasser, weniger haufig im
Erdboden (nur eine Art) vorkommend.
Organismen dieser Gattung wurden ursprtinglich in die Gattung Azotobacter eingeordnet.
Vinogradskij (1938) venvies jedoch auf den wesentlichen Unterschied- keine Zystenbildung
- und begriindete daher eine selbstandige Gattung. Auch die Ergebnisse serologischer
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Azomonas • 437
Versuche(Aso und Yoshida- 1928) weisenauf dieBerechtigungderErrichtungeinerneuen
Gattung hin.
Typus generis: Azomonas agilis (Beijerinck 1901) Vinogradskij 1938
Wichtigste Literatur: Beijerinck 1901, Lohnis und Westermann 1909, Lohnis
und Smith 1923, Aso und Yoshida 1928, Kluyver und van den Bout 1936,
Vinogradskij 1938, Krasil'nikov 1949, Derx 1951, Krasil'nikov et al. 1952,
Tchan 1953, Jensen 1955, Bergey's Manual 1957, 1974, Zajceva et al. 1959,
Kolesko 1960, Baillie et al. 1962, Becking 1962, Cohn und Johnsone 1964.
Bestimmungsschlussel der Arten
la Wasserlosliches, im ultravioletten Licht weifi fluoreszierendes Pigment
bildend 2
lb Kein wasserlosliches, im ultravioletten Licht weifi fluoreszierendes Pigment
bildend; verwertet weder Starke, noch Mannitol oder Rhamnose; Geifieln
nur an einem Zellpol 2. Az. insignis
2a Weder Starke, noch Mannitol oder Rhamnose verwertend; Zellen mit perit-
richen Geifieln; vorwiegend im Wasser vorkommend 1. Az. agilis
2b Mannitol verwertend; Zellen mit einer polaren Geifiel; vorwiegend im
Erdboden vorkommend 3. Az. macrocytogenes
1. Azomonas agilis (Beijernick 1901) Vinogradskij 1938
Azotobacter agilis Beijernick 1901 (non Azotobacter agile Beijernick 1901),
Azotobacter agile var. atypica Kluyver et van den Bout 1936, Azotobacter agile
war.jakutiae Krasil'nikov 1949, Azotococcus agilis (Beijernick 1901)Tchan 1953,
Azotococcus agile var. atypica (Kluyver et van den Bout 1936) Tchan 1953.
Zellen grofi, kugelig oder mafiig ovoid. Dem Aussehen nach an manche Mona-
den erinnernd. Nach elektronenmikroskopischen Untersuchungen von
Krasil'nikov et al. (1952) mit Hilfe peritricher Geifieln aktiv beweglich. Beijernick
(1901) nahm irrtumlich an, dafi sie ein Geifielbiindel an einem Pol besitzen,
Lohnis und Westermann.(1909) beschrieben das Vorhandensein nur einer einzi-
gen Geifiel. Zellen haufig Paare bildend oder in kurzen Ketten vorkommend.
Keine Zysten, jedoch Schleimkapseln bildend. Der Schleim besteht vorwiegend
aus eine Galaktose- oder Rhamnosepolymer (Cohen und Johnstone 1964).
Zajceva et al. (1959) stellten fest, dafi die Zusammensetzung von der Art der
Stickstoffquelle abhangt. Protoplasma hell, fein gekornt. Vakuolen enthaltend.
Ohne Granula von Reservestoffen.
Fixiert atmospharischer Stickstoff sehr intensiv, bis 10 mg N2 je g verwerteter
Glukose. Vermag jedoch keine Nitrate als Stickstoffquelle zu verwerten (Bek-
king 1962). Kohlenhydrate werden zu C02 und H20 oxidiert; Starke, Mannitol
una Rhamnose werden nicht verwertet, Gelatine wird nicht verfliissigt.
Kolonien glatt, trocken oder mafiig feucht, glanzend. Ein anfangs rosa farbenes,
spater blaugriines bis dunkelblaues, in das Medium diffundierendes Pigment
bildend, aufierdem ein wasserlosliches, griinliches, im ultravioletten Licht weifi
fluoreszierendes Pigment. Nach Kolesko (1960) liegen die Zellen wahrend der
ganzen Entwicklungszeit locker und seesternartig angeordnet in der Kolonie.
Junge Zellen im Durchmesser 4,0-6,0 \\m grofi.
Vorwiegend in Gewassern vorkommend.
Lohnis und Smith (1923) reihen bei dieser Art auch Azotobacter vinelandii,
Krasil'nikov (1949) Azotobacter vitreum ein.
Krasil'nikov (1949) unterscheidet eine weitere Form, die angesichts der wenigen Unterschei-
dungsmerkmale mit der Art zu vereinigen ist:
438 ■ Gramnegative Bakterien - Beijerinckia
la. Azotobacter agile var. jakutiaeKrasil'nikov 1949
Zellen ziemlich klein; oft lange Ketten bildend. Kolonien rotgelb bis gelbbraun, seltener hell
violett gefarbt; Pigment diffundiert in das Medium. Es wird kein fluoreszierendes Pigment
gebildet. Stickstoffixierune intensiv (10 mg N, je g verwerteter Glukose). In den Boden der
Jakutischen Republik (UdSSR) gefunden.
Ferner ist die folgende Varietat einzubeziehen:
lb. Azotobacter agile var. atypica Kluyver et van den Bout 1936
Azotococcus agile var. atypica (Kluyver et van den Bout 1936) Tchan 1953.
Von der Leitart unterscheidet sich dieser Stamm nur dadurch, dafi er kein Pigment bildet.
2. Azomonas insignis (Derx 1951) Baillie et al. 1962
Azotobacter insigne Derx 1951, Azotococcus insigne (Derx 1951) Tchan 1953
Zellen stabchenformig oder langlich ellipsoidisch, verhaltnismafiig grofi. Meist
einzeln, mitunter Paare bildend. Sehr beweglich mit Hilfe von zwei Geifieln oder
eines Geifielbundels an einem Pol. Bewegung charakteristisch; die Zellen
drehen sich um ihre Achse. Ohne Zysten. Extrazelularer Schleim wird wenig
oder uberhaupt nicht gebildet. Verwerten weder Mannitol noch Rhamnose.
Kolonien klein (1 mm im Durchmesser), durch blaugraues, in den Nahrboden
diffundierendes Pigment gefarbt. Alternde Kolonien werden braun. Es wird
kein* fluoreszierendes Pigment gebildet.
Zellen 1,6-2,0 X 2,5-3,8 \im grofi.
Nur in SuCwasser vorkommend.
Manche Autoren vereinigen diesen Organismus, zusammen mit Azomonas
macrocytogenes, mit Beijerinckia indica (= Azotobacter indicum). Rubencik
(1959) ist der Ansicht, dafi er in die Gattung Pseudomonas gehort.
3. Azomonas macrocytogenes (Jensen 1955) Baillie et al. 1962
Azotobacter macrocytogenes Jensen 1955, Beijerinckia macrocytogenes (Jensen
1955) Rubencik 1959.
Junge Zellen ovoid bis kugelig, grofi. Sie erreichen bei Vorhandensein von
Athanol im Nahrboden sehr grofie Ausmafie. Meist in einer gemeinsamen,
machtigen Schleimkapsel eingeschlossene Paare, in jungen Kulturen sarzinenar-
tige Pakete bildend. Junge Zellen unbeweglich; Zellen, die die sich auflosende
Kapsel verlassen, sind mit Hilfe einer polaren Geifiel beweglich. Ohne Zysten.
Protoplasma junger Zellen homogen; altere Zellen stark lichtbrechende Granula
von Reservestoffen enthaltend.
Verwertet Mannitol, jedoch keine Rhamnose. Aus Kohlenhydraten (Sacharose)
werden Sauren gebildet, denen gegeniiber sich der Organismus ausgesprochen
tolerant verhalt. Fixiert bis 15 mg N? je g verwerteter Glukose.
Kolonien durch ein blafirosafarbenes, wasserlosliches, in das Medium
diffundierendes Pigment gefarbt, das im ultravioletten Licht weifi fluoresziert.
Zellen im Durchschnitt 2,0-2,5 \im, auf athanolhaltigen Nahrboden bis 5,0-
10,0 jtm breit.
Isoliert aus sauren Boden. Im Wasser bislang noch nicht gefunden.
3. Beijerinckia Derx 1950
Zellen gerade oder in Form leicht gekrummter ovoider Stabchen mit deutlich
abgerundeten Enden, auch birnenartig gestaltet; gramnegativ. Unter gewissen
Umstanden werden grofie, manchmal verzweigte, gabelformige Zellen gebildet.
Mit grofien Granula von lipoidem Charakter(Poly-f5-Hydroxy-Buttersaure) an
jedem Zellpol. Mitunter kommen kokkenartige Zellen ohnj^ese Granula vor.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ra
Derxia • 439
Sie sind teils beweglich, teils unbeweglich. Bei Stammen, bei denen Geifieln
beobachtet wurden, sind diese peritrich angeordnet. Sie bilden Zysten, die eine
einzige Zelle enthalten. Kapseln enthalten mehrere Zellen. Der Schleim der
Kapsel ist stark adhasiv. Kolonien grofi, gefurcht, mit einer Menge festen,
adhasiven elastischen Schleimes, was das Uberimpfen erschwert. Bei manchen
Stammen ist der Schleim gekornt. Wachstum auf Kulturmedien langsam. In
fliissigen Nahrlosungen wird eine homogene, stark viskose, gelartige Flussigkeit
gebildet.
Streng aerober Organismus, gedeiht jedoch auch bei gesenktem Sauerstoffdruck.
Atmospharischer Stickstoff wird nur auf stickstoffreien Medien fixiert; dazu ist
Molybdan erforderlich, das nicht durch Vanadium ersetzt werden kann. Kann
kein NO^ verwerten. Von Kohlenhydraten werden Glukose, Fruktose und
Saccharose von alien Stammen verwertet. Organische Stoffe werden zu CO?
oxydiert, wobei eine kleine Menge von Essigsaure gebildet wird. Gegeniiber
Sauren sehr tolerant. Die das Wachstum erforderliche Temperatur liegt bei 10-
35 °C (Optimum bei 20-30 °C).
Zellen 0,5-1,5 X 1,7-4,5 um grofi.
Typus generis: Beijerinckia indica (Starkey et Derx 1939) Derx 1950.
In Lateritboden, meist in der heifien Zone vorkommend.
Wichtigste Literatur: Starkey und De 1939, Derx 1950, 1953, Kaufmann und
Toussaint 1951, Green und Willson 1953, Jensen 1954, Tchan 1957, Dobereiner
und Ruschel 1958, Roy 1958, Becking 1959, Petersen 1959, Rubencik 1959,
Becking 1962, Barooah und Sen 1964, Hilger 1965, De Ley und Park 1966,
Materassi et al. 1966, Lopez und Becking 1968, Bergey's Manual 1974.
Die Gattung umfafit insgesamt vier Arten, die ohne Beschreibung angefiihrt
werden:
1. Beijerinckia indica (Starkey et De 1939) Derx 1950
Azotobacter indicum Starkey et De 1939, Azotobacter lacticogenes Kauffmann
et Toussaint 1951, Azotobacter acida Roy 1958, Beijerinckia acida (Roy 1958)
Petersen 1959, Beijerinckia congensis Hilger 1965.
2. Beijerinckia mobilis Derx 1950.
(non Beijerinckia mobile Derx 1950)
3. Beijerinckia fluminensis Dobereiner et Ruschel 1958
4. Beijerinckia derxii Tchan 1957
Beijerinckia venezuelae Materassi et al. 1966.
4. Derxia Jensen et al. 1960
Stabchen gramnegativ, mit abgerundeten Enden. Einzeln oder in kurzen Ketten.
Ausgesprochen pleomorph. Junge Zellen mit homogenem Zytoplasma, altere
mit licntbrechenden Einschliissen von lipoidem Charakter. Mit Hilfe einer
polaren Geifiel beweglich.
Kolonien auf Agar anfangs schleimig, durchsichtig, spater getriibt, erhoht, mit
gefurchter Oberflache. Mahagonibraun gefarbt. In fliissigen Medien wird visko-
ses Material gebildet.
Streng aerob, jedoch auch bei geringerem Sauerstoffdruck wachsend. Verwertet
eine breite Skala organischer Stoffe; die zu CO, und einer geringen Menge von
Saure (Essigsaure) oxydiert werden. Stickstoff wird auf stickstoffreien Medien
fixiert; sie brauchen Molybdan oder Vanadium. Optimaltemperatur 25-
35 °C.
Zellen 1,0-1,2 X 3,0-6,0 \im grofi. In tropischen Boden vorkommend.
Typus generis: Derxia gummosa Jensen et al. 1960.
440 • Gramnegative Bakterien - Rhizobiaceae - M^Bf lomonadaceae
Wichtigste Literatur: Jensen et al. 1960, Roy und Sen 1962, De Ley und Park
1966, Bergey's Manual 1974.
Bislang wurden zwei Arten beschrieben; die Beschreibungen werden hier nicht
angeftihrt:
1. Derxia gummosa Jensen et al. 1960
2. Derxia indica Roy et Sen 1962.
3. Familie Rhizobiaceae Conn 1938
Gramnegative Stabchen; mit Hilfe einer polaren oder subpolaren Geifiel oder
von 2-6 peritrichen Geifieln beweglich. Endosporen werden nicht gebildet. In
Anwesenheit von Kohlenhydraten wird in der Regel eine grbfiere Menge von
Schleim produziert.
Aerobe Organismen; eine ganze Reihe von Kohlenhydraten verwerten. Die in
die Gattung Rhizobium gehorenden Organismen verursachen die Ausbildung
von knotigen Auswuchsen (Knollchen) an den Wurzeln von Pflanzen der
Familie Fabaceae, wo sie intrazellular zusammen mit der Pflanze (Symbiose)
molekularen Luftstickstoff an solche Substanzen binden, die die Pflanze
verwerten kann. Zellen in diesen Auswuchsen gewohnlich als Involutionsformen
vorhanden.
Alle Arten der Gattung Agrobacterium (mit Ausnahme von Agrobacterium
radiobacter, das in der Rhizosphare vorkommt) bilden an den Wurzeln und
Stengeln verschiedener Pflanzenfamilien gallenartige Tumore; es handelt sich um
intrazellulare Parasiten.
Die Identifizierung der unmittelbar aus den Knollchen isolierten Organismen ist
gewohnlich nicht schwierig, da sie auf den betreffenden Wirt spezialisiert sind.
Unmittelbar aus dem Boden gewonnene Isolate sind dagegen schwer zu identifi-
zieren.
Typus familiae: Rhizobium Frank 1889.
Die Familie enthalt zwei Gattungen; ihre Beschreibungen werden hier nicht
aufgefiihrt:
1. Rhizobium Frank 1889 (nomen conservandum)
2. Agrobacterium Conn 1942 (nomen conservandum)
4. Familie Methylomonadaceae Leadbetter 1974
Methanomonadaceae Breed 1957.
Bakterien, die nur organische Verbindungen mit einem Kohlenstoff-Atom
(Methan, Methanol) als C-Quelle verwerten.
Obwohl sie auch im Wasser vorkommen konnen, lassen sie sich nicht an Hand
morphologischer Merkmale identifizieren.
Bergey's Manual (1974) fuhrt nur zwei Gattungen an:
1. Methylomonas Leadbetter 1974
Methanomonas Orla-Jensen 1909
2. Methylococcus Leadbetter 1974
Aufierdem wurden drei weitere Gattungen beschrieben (Whittenbury et al.
1970), deren Taxonomie noch nicht geklart ist:
3. Methylosinus Whittenbury et al. 1970
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Halobacteriaceae • 441
4. Methylocystis Whittenbury et al. 1970
5. Methylobacter Whittenbury et al. 1970
Typus familiae: Methylomonas Leadbetter 1974.
Die Beschreibungen der Gattungen werden hier nicht aufgefiihrt.
5. Familie Halobacteriaceae Gibbons 1974
Gramnegative Stabchen und Kokken, die zum Wachstum eine hohe Konzentra-
tion (12%) von NaCl erfordern. Sie enthalten Karotinoide, unter denen Bacte-
noruberin iiberwiegt. Chemoorganotrophe, streng aerobe Organismen mit
respirativem Metabolismus. Physiologische Eigenschaften bisher wenig be-
kannt. Kolonien rosa oder in verschiedenen schwarzen Schatierungen gefarbt. In
NaCl-reichem Milieu vorkommend; in Salzwasserseen, Salzgruben, im Toten
Meer, in eingesalzten Nahrungsmitteln, salzkonserviertem Leder u. a.
Typus familiae: Halobacterium Elazari-Volcani 1957.
Die Beschreibungen der Arten und Gattungen werden hier nicht aufgefiihrt.
Teil VIII. Chemolithotrophe Schwefelbakterien
Bakterien mit verschiedenen morphologischen Eigenschaften, deren gemeinsa-
mes Merkmal die Fahigkeit ist, die zu lebenswichtigen Funktionen notwendige
Energie durch Oxydation von Schwefelwasserstoff oder anderer reduzierter
Schwefelverbindungen zu gewinnen. Mit der Ausnahme der Gattungen Thioba-
cillus und Sulpholobus wird Schwefel in Form von kleinen Tropfchen intrazellu-
lar als Reservestoffe abgelagert.
In der alteren Literatur wurden diese Organismen in die Familie der Thiobacteriaceae
eingeglieder:. Der Name der Familie is: jedoch ungiikig, da er den Vorschriften des
«International Code of Nomenclature of Bacteria» nicht entspricht. Auch wurden nicht bei
alien Gattungen Reinkulturen erzielt, so dafi ihre Einordnung in eine gemeinsame Familie
problematisch bleibt. Bergey's Manual (1974) fiihrt aus diesen Griinden den Namen dieser
Familie nicht an. Es wird die Meinung vertreten, dafs nur die Gattung Thiobacillus in die
monogenerische Familie Thiobacillaceae eingereiht werden kann, wahrend die anderen
Organismen nur als «unsichere Arten» angegliedert werden konnen.
Trotz dieser Vorbehalte wird in dieser Arbeit aus rein praktischen Griinden der
Familienname Thiobacteriaceae beibehalten, da er sowohl in der mikrobiologi-
schen als auch limnologischen Literatur weit verbreitet ist.
Familie Thiobacteriaceae Janke 1924
(non Thiobacteriaceae Orla-Jensen 1909)
Zellen in Form kleiner oder grofier zylindrischer Stabchen, mitunter ovoid bis
kugelig, gekriimmt oder schraubenformig gedreht. Bei einer Gattung ist an der
Oberflache der Zellwand der schraubenformigen Zellen ein Organell vorhan-
den, die einer Krista ahnlich ist. Bei einer anderen Gattung entstehen an
kueeligen Zellen lappenformige Gebilde. Manchmal sind die stabchenformigen
Zellen in eine Gallerthiille eingeschlossen. Faden werden nie gebildet. Farblos,
ohne Pigmente. Einige Arten mit polaren Geifieln. Meist gramnegativ.
Streng autotroph, chemolithotroph bis mixotroph. Ihre Energie gewinnen sie
durch Oxydation von Schwefelwasserstoff oder anderer, teilweise reduzierter
Schwefelverbindungen. Die meisten Gattungen lagern Schwefeltropfchen als
Zwischenprodukt im Innern der Zellen ab. Zwei Gattungen oxydieren diese
Stoffe bis zu freier Schwefelsaure oder zu Sulfaten, wobei kein Schwefel in den
Zellen abgelagert wird. Eine Reihe von Arten ist aktiv beweglich.
Sie kommen im Sufi-, Brack- und Meerwasser, in Schwefelquellen, Abwassern,
Grubenwasser, Schlamm und Boden vor - iiberall dort, wo geniigend H2S aus
faulenden organischen Uberresten oder elementarer Schwefel und reduzierte
Schwefelverbindungen vorhanden sind. Nur von Thiobacillus und Sulfolobus
sind Reinkulturen erzielt worden. Sie unterscheiden sich grundsatzlich in ihren
physiologischen Eigenschaften. Nach Bergey's Manual soil (1974) die Gattung
Thiobacillus in die selbststandige Familie Thiobacillaceae eingegliedert werden.
Typus familiae: Thiobacterium Janke 1924.
Bestimmungsschliissel der Gattungen
la Zellen mit Schwefeltropfchen 2
lb Zellen ohne Schwefeltropfchen; sie gewinnen ihre Energie durch Oxydation
reduzierter oder teilweise reduzierter Schwefelverbindungen, die bis zu
freier Schwefelsaure oder zu Sulfaten oxydiert werden 6
2a Zellen stabchenformig oder oval bis kugelig ^^ 3
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiobacterium • 443
2b Zellen grofi, schraubenartig oder gekriimmt 5
3a Zellen durch Geifieln beweglich, nicht in Gallerthullen 4
3b Zellen unbeweglich, in einer gelatineartigen Gallerthiille
1. Thiobacterium (S. 443)
4a Zellen langlich zylindrisch, mit polaren Geifieln
2. Macromonas (S. 446)
4b Zellen kugelig bis ovoid; falls Geifieln vorhanden, sind dieseperitrich
3.Thiovulum(S.451)
5a Zellen ohne Krista-ahnliches Organell 4. Thiospira (S. 453)
5b Zellen an der Oberflache innernalb der Spirale mit einer Fake, die einer
Krista ahnelt 5. Taphrospira (S. 458)
6a Zellen kugelig mit verschieden, lappenformigen Ausbuchtungen
6. Sulfolobus (S. 459)
6b Zellen in Form von Vibrionen, Spirillen oder geraden Stabchen 7
7a Zellen in Form beweglicher Stabchen 8
7b Zellen in Form von Vibrionen oder Spirillen
8. Thiomicrospira (S. 461)
8a Zellen gramnegativ 7. Thiobacillus (S. 460)
8b Zellen grampositiv 9.Sulfobacillus(S.461)
1. Thiobacterium Janke 1924
Thiodendron Lackey et Lackey 1961 (non Thiodendron Perfiliev et Gabe 1961)
Farblose stabchenformige Bakterien, deren Zellen von einer gelatineartigen
Gallertkapsel umgeben sind. Bisweilen bilden sie blasenformige, in eine
gemeinsame Schleimmatrix eingeschlossene Kolonien, die entweder kugelig sina(sofern
der Organismus frei im Wasser schwebt) oder eine dendroide Form haben, wenn
sie an einer Unterlage im fliefienden Wasser haften. Ruhestadien bisher unbe-
kannt. Zellen mit einem oder mehreren Schwefeltropfchen. Einige Arten, deren
Einreihung in diese Gattung problematisch ist, lagern Schwefeltropfchen extra-
zellular ab. Bisher wurden keine Reinkulturen erzielt, so dafi die
physiologischen Eigenschaften nicht bekannt sind. Unbeweglich. In Sufi- und Meerwasser
vorkommend.
Typus generis: Thiobacterium bovista (Molisch 1912) Janke 1924.
Wichtigste Literatur: Molisch 1912, Janke 1924, Ellis 1932, Devide 1952,
Bergey's Manual 1957, 1974, Lackey et Lackey 1961.
Bestimmungsschliissel der Arten
la Zellen mit Schwefeltropfchen 2
lb Zellen ohne Schwefeltropfchen; diese werden aufierhalb der Zelle abgelagert
3
2a Kolonien frei schwebend, kleine blasenartige Kugeln 1. Th. bovista
2b Kolonien dendroid, an Unterlagen festhaftend
la. Th. bovista (Thiodendron mucosum)
3a An der Wasseroberflache Zoogloea-artige Formationen bildend
2. Th. cristalliferum
3b An der Wasseroberflache netzartige Formationen bildend
3. Th. retiformans
1. Thiobacterium bovista (Molisch 1912) Janke 1924 (Fig. 271)
Bacterium bovista Molisch 1912, Thiobacillus bovistus (Molisch 1912) Ellis 1932,
Thiogloea bovista (Molisch 1912) Devide 1952, Thiodendron mucosum Lackey
et Lackey 1961 ^^
444 • Schwefelbakterien - Thiobacterium
Verhaltnismafiig kleine stabchenartige Zellen mit abgerundeten Enden, manch-
mal auch langlich ellipsoidisch. Charakteristische Mikrokolonien in Form hoh-
ler, blasenartiger Kugeln bildend, die aus Tausenden von Zellen zusammenge-
setzt sind. An Bakterienformationen erinnernd, die von Miiller-Thurgau (1908)
aus Obstweinen beschrieben wurden. Kolonien verschieden grofi, manchmal
mit blofiem Auge sichtbar. Sie treten einzeln auf oder in Gruppen, die dadurch
entstehen, dafi sich eine Kolonie durch eine Art Knospung in zwei Teile teilt.
Schleimasse an der Kolonieoberflache dicht, so dafi es den Anschein hat, als ob
die Kolonie von einer feinen Wand umgeben ware. Innen enthalten die blasen-
formigen Kolonien eine klare Fliissigkeit. Im Auflicht sind sie weifi gefarbt, im
Durchlicht blauschwarz bis schwarz; diese Farbung wird durch Schwefeltropf-
chen verursacht. Im Alter werden die Blasen perforiert, bekommen Risse und
zerfallen; die Zellen werden dann frei. Zellen mit 1-4 Schwefeltropfchen.
Protoplasma mit einer wasserigen Losung von Gentianaviolett gut farbbar,
wogegen die Gallertmasse praktisch nicht gefarbt wird.
Physiologische Eigenschaften wenig bekannt. Als Energiequelle wird Schwefel-
wasserstoff verwertet, der zu freiem Schwefel oxydiert und als Reservestoff in
der Zelle abgelagert wird. Bisher wurden keine Reinkulturen erzielt. Vermeh-
rung durch Zellteilung, Kolonien durch Knospung. Zellen sowie Kolonien
unbeweglich.
Zellen 0,6-1,5 X 2,0-5,0 (xm grofi. Kolonien verschieden grofi; im Durchschnitt
bis 4,0 (xm.
Meistens im H2S-haltigen Brack- oder Meerwasser nahe der Wasseroberflache
Koloniengruppen bildend. Wahrscheinlich weit verbreitet. Gefunden und
beschrieben wurde dieser Organismus aus dem Hafengebiet von Terst (Jugosla-
vien), wo er reichlich vertreten war.
Bergey's Manual (1974) stelk hierher auch den als selbstandige Art beschriebenen
Organismus:
la. Thiodendron mucosum Lackey et Lackey 1961 (Fig. 271f)
Zellen stabchenformig, mit abgerundeten Enden. Umgebende, gelatineartige Schleimmasse
besondere dendroide Formationen bildend, in denen die einzelnen Zellen unregelmafiig
angeordnet sind, jedoch grofitenteils parallel zur Achse der Kolonie. Zellen gewohnlich an
den Enden der einzelnen Verzweigungen angehauft, so dafi diese dunkler erscheinen als der
distale Teil der Kolonie, der manchmal iiberhaupt keine Zellen mehr enthalt. Sowohl in den
distalen Teilen als auch in alteren, reicher verzweigten Kolonien sind die Zellen wesentlich
grofier, bis dreimal so grofi. Kolonien mit ihrem distalen Ende an einer Unterlage festhaf-
tend; ohne Gallertpolster. Junge Kolonien keulenformig und nicht verzweigt; alte Kolonien
stark verzweigt und an Zoogloea ramigem erinnernd. Grampositiv, jedoch schlecht farbbar.
Protoplasma vollkommen nomogen, mit fast gleichem Lichtbrechungsindex wie der die
Zellen umschliefiende Schleim. Dadurch emsteht im Mikroskop der Eindruck, dafi die
Schleimmasse selbst mit Schwefeltropfchen gefiillt ist. In einem schwefelwasserstoffreien
Milieu, in dem die Schwefeltropfchen schwinden, sind die Zellumrisse deutlicher. Zellen mit
verschieden grofien Schwefeltropfchen; altere, grofie Zellen enthalten bis zu 20, kleinere
Zellen 3-8 Tropfchen, die in den Zellen in einer Reihe axial angeordnet sind.
Physiologische Eigenschaften nicht bekannt. Offenbar chemotropher Organismus, der
seine Energie durch Oxydation von Schwefelwasserstoff gewinnt und das Oxydationspro-
dukt, d. h. elementaren Schwefel innerhalb der Zellen als Reservestoff ablagert, unci bei
H2S-Mangel wieder verwendet. Bisher wurden keine Reinkulturen erzielt; auf normalen
Nahrmedien sterben die Kolonien binnen einiger Tage ab. Vermehrung durch Zelleinschnii-
rung. Bewegung bisher nicht beobachtet, obgleich Lackey et Lackey (1961) meinen, dai? die
Kolonien aus urspriinglich beweglichen Zellen entstehen, die erst spater unbeweglich
werden.
Zellen 1,0-2,5 X 3,0-9,0 (im, Kolonien bis 2, ausnahmsweise 3 mm grofi.
In einer 29 °C warmen Quelle «Warm Mineral Spring» in der Umgebung von Venice
(Nordwest-Florida, USA) und im Flufi unterhalb der Quelle gefunden. Kolonien ofters an
Blaualgenfaden haftend. Spater wurde ein Massenauftreten in der Litoralzone in Titusville
(Florida, USA) beobachtet, wo die Art in stark verunreinigtem, 13 °C warmen Meerwasser
unterhalb einer Krabbenfleisch verarbeitenden Fabrik auftrat.
Seamed & Djvued by Pahuta Yuri, Kaiadag 2008, e-mail pahutaqwe@rambler.ru
Thiobacterium • 445
Fig. 271. Thiobacterium bovista - a einzelne und zusammenhangende blasen-
formige Kolonien (nach Molisch, 1912. - 25X), b Snick einer Blasenhaut mit
eingelagerten Bakterien, c einzelne Zellen mit Schwefeltropfchen (nach Molisch,
1912. - 1500X), d-e Teil einer strauchartigen Kolonie der als Thiodendron
mucosum beschriebenen Wuchsform (nach Lackey und Lackey, 1961. - 500X),
/verschieden alte Kolonien der Thiodendron mucosum Wuchsform, an Faden
der Blaualge Lyngbya festsitzend (nach Lackey und Lackey, 1961. - 500X).
446 • Schwefelbakterien - Macromonas
Unsichere Arten:
2. Thiobacterium cristalliferum (Gicklhorn 1920) Janke 1924
Bacterium cristalliferum Gicklhorn 1920
Stabchenformige Bakterien, manchmal leicht gekriimmt. Schwefeltropfchen
werden aufierhalb der Zelle abgelagert. Kolonien entstehen an der Oberflache
von Gewassern, die Kaliumsulfid enthalten. Kolonien konnen erhebliche Grofie
erreichen. Unbeweglich.
Zellen 0,3-0,5 X 1,0-2,4 pm, Kolonien durchschnittlich bis 800-1500^1X1
grog.
Vor allem in kultivierten Erdboden (Gartenboden), von wo sie sekundar auch ins
freie Wasser gelangen konnen.
3. Thiobacterium retiformans (Gicklhorn 1920) Janke 1924
Bacterium retiformans Gicklhorn 1920
Stabchenformige Bakterien mit Schwefeltropfchen zwischen einzelnen Zellen.
Schleimige Kolonien, die ahnlich wie Zoogloea oder wie Netze auf der Wasser-
oberflache ausgebreitet liegen. Unbeweglich.
Zellen 0,5-1,0 X 2,0-4,5 |xm grofi. In Erdboden, von wo sie dann auch sekundar
in Wasser, das Kaliumsulfid enthalt, eingeschleppt werden konnen.
2. Macromonas Utermohl et Koppe 1924
Zellen zylindrisch, mit abgerundeten Enden oder bohnenformig. Meistens
ziemlich grofi. Als Einschliisse Kalziumkarbonatkornchen, manchmal auch
gemeinsam mit Schwefeltropfchen. Zellen mit einer polaren, ohne spezielle
Preparation sichtbaren Geifiel, die ebenso lang oder langer als die Zelle ist.
Ruhestadien nicht bekannt.
Mikroaerophil; physiologische Eigenschaften nur wenig bekannt, da nicht unter
Laborverhaltnissen kultiviert; nur aus dem Freiland beschrieben. Vermehrung
durch Einschrankung mit darauf folgender Teilung der Zellen. Beweglich, einige
Arten sogar ziemlich rasch. Im Siifiwasser mit niedrigem Sauerstoffgehalt,
grofitenteils im Hypolimnion und in der oberen Schlammschicht.
Die Berechtigung einiger Arten ist problematisch, da sie meist nur auf Morpho-
logie und Abmessungen beruht. Weitere eingehende Untersuchungen an Rein-
kulturen sind erforderlich.
Typus generis: Macromonas mobilis (Lauterborn 1915) Utermohl et Koppe
1924.
Wichtigste Literatur: Andres 1907, Lauterborn 1915, Bersa 1920, Gicklhorn
1920, Janke 1924, Koppe 1924, Ellis 1932, Huzel 1936, Deflandre 1937, Skuja
1948, 1956, Ciferri 1960.
Bestimmungsschlussel der Arten
la Zellen gestreckt ellipsoidisch, bohnenformig oder zylindrisch 2
lb Zellen fang spindelformig 3. M. fusiformis
2a Zellen hochstens 6 (xm breit 3
2b Zellen breiter als 6 jxm, Geifiel ohne Farbung sichtbar 1. M. mobilis
3a Zellen 3-6 |xm breit, langeGeisel erst nach speziellerFarbungsichtbar
2. M. bipunctata
3b Zellen hochstens 3 |xm breit 4
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Macromonas • 447
4a Zellen 1,8-5,0 |xm lang, mit 2-4 lichtbrechenden Korpern, die an ihren
Enden zugespitzt sind. Planktonorganismus 4. M. minutissima
4b Zellen 4,0-7,0 |xm lang, selten mit Einschliissen von CaC03; in Thermal-
quellenvorkommend 5. M. thermalis
1. Macromonas mobilis (Lauterborn 1915) Utermohl
et Koppe 1924 (Fig. 274, 275)
Achromatium mobile Lauterborn 1915, Microspira vacillans Gicklhorn 1920,
Thiovibrio vacillans (Gicklhorn 1920) Janke 1924
Fig. 274. Macromonas mobilis - a-d verschiedene Hungerformen, e normal
entwickeltes Exemplar mit CaC03-Inklusionen (nach Skuja, 1964. - 1500x).
Mikroaerophil, benotigen Schwefelwasserstoff als Energiesubstrat, der zu ele-
mentarem Schwefel oxydiert wird. Genauere Informationen iiber ihre physiolo-
gischen Eigenschaften fehlen vorlaufig. Reinkulturen wurden nicht erzielt.
Vermehrung durch Einschniirung nach einem geringen Langenwachstum der
Zelle. Tochterzellen anfangs miteinander durch hyaline Materie verbunden; mit
der Zeit sich voneinander entfernend, bis sie sich dann endgultig trennen. Aktiv
beweglich, doch verhaltnismafiig langsam, etwa 800 (xm/min, was wahrschein-
lich durch das grofie Gewicht der Zelle verursacht wird.
448 • Schwefelbakterien - Macromonas
Zellen bis 6,0-14,0 X 10,0-30,0 \im grofi, meist jedoch 9,0 X 20,0 [im.
Im Litoral und in den oberen Schlammschichten von Gewassem, die elementa-
ren Schwefel oder andere Schwefelverbindungen und Ca-Ionen enthalten. Ur-
sprunglich im Universitatsgarten in Graz (Osterreich) gefunden.
Fig 275. Macromonas mobilis- einige Exemplare mit CaCOj-Inklusionen (nach
Skuia 1956 - 1340X). Fig. 276. Macromonas bipunctata - a einige Exemplare
mit normalem Habitus (nach Skuja, 1956. - 1340X), b zwei ausgehungerte
Exemplare ohne CaCOj-Inklusionen (nach Skuja, 1948. - 1340X), c Form, die
ursprunglich als Macromonas gicklhornii beschrieben wurde (nach Skuja, 1956. -
1340X). Fig. 277. Macromonas minutissima - zwei Wuchsformen mit verschie-
denen Zellgrofien (nach Skuja, 1956. - 1340X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.m
Macromonas • 449
Virieux (1913) hielt sie irrtiimlicherweise fur «Zoosporen» von Achromatium
oxaliferum.
2. Macromonas bipunctata (Gicklhorn 1920) Utermohl
et Koppe 1924 (Fig. 276)
Pseudomonas bipunctata Gicklhorn 1920 (non Pseudomonas bipunctatus
Gicklhorn 1920), Macromonas gicklhornii Skuja 1956
Farblose zylindrische Zellen mit abgerundeten Enden; vor der Teilung
birnenformig. Mit einer sehr feinen polaren Geifiel am basalen Ende, die ohne spezielle
Farbung nur schwer zu senen ist. Unter giinstigen Umstanden ist sie im
Dunkelfeld sichtbar; 10-15 (im lang.
Zellen mit 1-4 CaC03-Einschliissen, die in Form grofier, stark lichtbrechender
Kugeln auftreten, wobei die ganze Zelle ausgefiillt werden kann. Schwefeltropf-
chen wurden nicht beobachtet.
Skuja (1948) halt diese Inklusionen fur Leukosin und konnte in den Zellen dicht
unter der Zellwand Schwefeltropfchen beobachten.
Vermehrung durch Einschniirung in der Zellmitte; die Tochterzellen sind eine
Zeitlang birnenformig. Langsam aktiv beweglich, gewohnlich 600 (xm/min., um
die Langsachse der Zelle rotierend.
Zellen 3,0-6,0 x 7,0-23,0 (im grofi.
Sowohl in Gewassern mit ausreichendem CaC03-Gehalt, als auch in oberen
Schlammschichten. Aus Teichen mit faulendem Pflanzenmaterial beschrieben.
Skuja (1956) stellt zu dieser Art (mangels ausreichenden Studienmaterials) auch die neu
beschriebene:
2a. Macromonas gicklhornii Skuja 1956, die sich vor allem durch ihre Abmessungen (nur
2,5-3,0 X 8,0-11,0 (im grofi) umerscheidet. Zellen ellipsoidisch, an beiden Enden zuge-
spitzt (nach der Teilung nur an einem Ende), leicht gebogen. Mit zwei distalen, zugespitzten
Einlagerungen, zwischen denen in der Zellmitte mehrere oder nur wenige
Schwefeltropfchen liegen. Geifiel linger als die Zelle.
Unsichere Arten:
3. Macromonas fusiformis Deflandre 1937 (Fig. 278)
Zellen schmal spindelformig, an beiden Enden auffallend verjiingt. Meistens mit
einer polaren Geifiel, vor der Teilung jedoch mit zwei Geifieln. Protoplasma mit
einer grofieren Menge von Reservestoffen in Form kugeliger oder scneibenarti-
ger, stark lichtbrechender Korperchen (3-10), die in einer Reihe mitunter
wellenartig-angeordnet sind. Zwischen ihnen liegen verstreut
Schwefeltropfchen. Vermehrung durch Einschniirung der Zellen. Geifiel nach hinten gerich-
tet, Bewegung rasch, mit Drehung um die Langsachse.
Zellen 1,6-1,9 x 15,0-25,0 \im grofi.
Siifiwasserart.
Skuja (1956) beschrieb eine weitere Form, die etwas grofier ist, und die Reservestoffe
unregeimafiig eingelagert hat. Huzel (1937) bezeichnete einen ahnlichen Organismus als
Macromonas sp., der Macromonas bipunctata sehr ahnlich ist und sich nur durch die lange
spindelartige Gestalt umerscheidet.
4. Macromonas minutissima Skuja 1956 (Fig. 277)
Zellen in Form kleiner langlicher Stabchen, manchmal oval oder birnenformig,
oft asymmetrisch, an den Enden abgerundet, leicht verjiingt. Zellwand sehr
diinn, hvalin und elatt. Protoplasma farblos, mit einem, zwei oder selten vier
stark licntbrechenaen Kornern, die an den Enden zugespitzt sind. Aufierdem an
der Peripherie mit Schwefeltropfchen. Bewegung langsam mittels einer polaren
Geifiel.
450 ■ Schwefelbakterien - Macromonas
278
Fig. 278. Macromonas fusiformis - a Teils in Querteilung, b eine etwas abwei-
chende Form (nach Skuja, 1956. - 1340X).
Zellen 1,0-2,0 X 1,8-5,0 urn grofi.
Als Planktonorganismus nicht selten in mittleren Tiefen von Siifiwasserseen.
Benotigt eine hohe Schwefelwasserstoff-Konzentration; auch in Schwefelquel-
len vorkommend. In einigen Seen im nordlichen Schweden (Norrviken, Ullevif-
jarden, Tjarnatjarn, Tjarnsjon, Lushavet und Mattsbosjon) gefunden.
Skuja (1956) halt diesen Organismus fur oligo- bis mesothiophil und betrachtet ihn als
wahrscheinlich identisch mit der wenig bekannten Art Chromatium fallax, die auch mit
Macromoas hyalina und mit Macromonas thermalis identisch sein soil.
5. Macromonas thermalis (Andres 1907) Ciferri 1960
Nephrococcus thermalis Andres 1907, Pseudomonas hyalina Gicklhorn 1920,
Macromonas hyalina (Gicklhorn 1920) Utermohl et Koppe 1924
Zellen farblos, ovoid, iiberwiegend zylindrisch mit abgerundeten Enden; ein-
zeln lebend. Mit einer polaren Geiftel, die erst nach spezieller Farbung deutlich
wird und 3,0-6,0 [xm lang ist. Morphologisch ist diese Art Macromonas bipunc-
tata und Macromonas mobilis ahnlich. Protoplasma selten mit CaC03-Einlage-
rungen. Vermehrung durch Einschniirung. Bewegung so langsam, daft Andres
(1907) die Zellen fur unbeweglich hielt.
Zellen 3,0-5,0 X 8,0-12,0 urn groft.
Aus 39 °C heiften Thermalquellen in Bormio (Italien) beschrieben.
Wahrscheinlich mit Macromonas minutissima identisch.
Andres (1907) vereinigt diesen Organismus mit:
5a. Macromonas hyalina (Gicklhorn 1920) Utermohl et Koppe 1924
Pseudomonas hyalina Gicklhorn 1920
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiovulum • 451
Nur durch die Zellgrofie (2,0-2,5 X 4,0-6,0 (im) umerschieden. Sehr kleine Exemplare
(1,0-2,0 (im) beschrieb Koppe (1924) aus dem Schlamm der Salzgraben des Brennermoores
bei Oldesloe (Holstein, BRD).
Gicklhorn (1920) begriindet die Abtrennung einer eigenen Art durch das Fehlen von
Intermediarformen. Skuja (1956) halt diesen Organismus fur identisch mit Chromatium
fallax., und auch mit Macromonas minutissima.
3. Thiovulum Hinze 1913
(non Thiovolum Hinze 1913)
Zellen kugelig oder ovoid bis ellipsoidisch, oft ziemlich flach, einzeln lebend.
Zellwand scharf umgrenzt. Allgemein wird angegeben, daft zahlreiche Geifteln
vorhanden sind, die etwa ein Drittel der Zellange erreichen. Faure-Fremiet und
Rouiller (1958) haben sie jedoch im Elektronenmikroskop nicht gesehen. Ruhe-
stadien nicht bekannt. Gramnegativ. Protoplasma mit feiner schnurartiger
Struktur, die kreuzweise die Zellen durchwindet. Oft ist das Protoplasma nur an
einem Pol der Zelle konzentriert, wahrend der andere Pol eine grofte Vakuole
enthalt. Mit Schwefeleinschlussen (in orthorhombischer Form), die manchmal
nur an einem Pol konzentriert sind, manchmal die ganze Zelle ausfiillen. In
Zellen, die kleine Mengen von Schwefeltropfchen enthalten, kommen an der
Peripherie dunkelgriine rundliche Stellen verschiedener Grofte vor.
Wahrscheinlich sind dies Reservestoffe in Form von Polysacchariden. Am hinteren Pol
befindet sich ein fadenformiges Organell (antapikales Korperchen), das im
Elektronenmikroskop klar hervortritt; seine Funktion ist bisher noch nicht
zufriedenstellend geklart. Im Lichtmikroskop erscheint es als spharisches,
1,0 [mti groftes Korperchen. Wahrscheinlich wirkt es bei der Fortbewegung der
Zelle mit.
Mikroaerophiler Organismus, der Schwefelwasserstoff als Energiequelle ver-
wertet. La Riviere (1963) gelang es, Reinkulturen zu erzielen. Vermehrung
durch Einschniirung, die spater zur Teilung fiihrt.
Bewegung wahrscheinlich mit Hilfe von peritrichangeordneten Geifteln, durch
Rotation um die Langsachse der Zelle. Zellgrofte variabel. In Siift- und Meerwas-
ser, das freien Schwefelwasserstoff enthalt.
Typus generis: Thiovulum majus Hinze 1913.
Wichtigste Literatur: Warming 1875, Migula 1900, Hinze 1913, Lauterborn
1915, Ellis 1932, Bergey's Manual 1957, 1974, La Riviere 1963, Skuja 1964,
Faure-Fremiet und Rouiller 1958, Bergey's Manual 1974.
Bestimmungsschlussel der Arten
la Zellen 5,0-25,0 nm groft, mit grofterer Anzahl von Schwefeltropfchen
1. Th. majus
lb Zellen klein (nur 1,5-3,0 [xm), mit hochstens zwei Schwefeltropfchen
2. Th. spora
1. Thiovulum majus Hinze 1913 (Fig. 272)
(non Thiovolum majus Hinze 1913)
Monas muelleri Warming 1875, Achromatium muelleri (Warming 1875) Migula
1900, Thiovulum minus Hinze 1913, Thiovulum muelleri (Warming 1875)
Lauterborn 1915
Einzelliger, kugeliger bis ovoider Organismus, mit peritricher Begeiftelung.
Gramnegativ. Im Auflicht weift, im Durchlicht schwarz erscheinend. Zytoplas-
ma gewohnlich an einem Ende der Zelle konzentriert, wahrend am anderen Ende
eine grofte Vakuole vorhanc^ist. Mit Schwefeltropfchen, die gewohnlich am
452 • Schwefelbakterien - Thiovulum
vorderen Ende (in Richtung der Zellbewegung) angehauft sind. Faure-Fremiet
und Rouiller (1958) fanden im Elektronenmikroskop an einem der Zellpole eine
fadenformige Ultrastruktur, von der sie annehmen, dafi es sich um ein Fortbewe-
gungsorganell handelt.
Mikroaerophil, gegeniiber Sauerstoff stark chemotaktisch. Fiir ihr Wachstum ist
Schwefelwasserstoff erforderlich, den sie als Energiequelle verwerten und zu
elementaren Schwefel oxydieren. In Nahrlosungen bilden sie charakteristische
spinnennetzartige Aufwiichse an der Grenze der Sauerstoff oder Schwefelwas-
serstoffe ist schwierig. Physiologische Eigenschaften wenig bekannt. Vermeh-
rung durch Einschniirung. Durch rasche Rotation aktiv beweglich. Geifieln
bisher nicht gefunden, obwohl die Bewegungsart auf solche hinweist.
ZellennachHinze(l913) 1,0-18,0 ^m X 9,0-17,0 ngrofS; nach Vereinigung mit
den iibrigen, friiher als selbstandig beschriebenen Arten 5,0-25,0 (xm grofi.
Sowohl im Sufi- als auch Meerwasser mit Schwefelwasserstoffgehalt in der Nahe
des Wasserspiegels und in der Litoralzone. Grofitenteils grauweifie Belage auf
faulenden Algen bildend. Urspriinglich im Wasser des Golfes von Neapel
(Italien) gefunden.
Da es eine Reihe von Obergangsformen gibt (die sich nur in der Grofie unterscheiden),
vereinigte Janke (Bergey's Manual 1957) mit Thiovulum majus auch folgende, friiher als
selbstandig angesehene Arten:
la. Thiovulum muelleri (Warming 1875) Lauterborn 1915
Monas muelleri Warming 1875, Achromatium muelleri (Warming 1875) Migula 1900
Nach Hinze (1913) Zellen 4,9-10,2 X 6,3-12,8 (im grofi. Warming (1875) fiihrt Dimensio-
nen von 5,6-14,0 (im an. Im faulenden Material an der Kiiste von Danemark gefunden.
Bavendamm (1924) reiht bei Thiovulum muelleri auch Chromatium fallax ein, das voneiner
Reihe von Autoren zur Gattung Macromonas gestellt wird. Nach Hinze (1913) mit Volvox
punctum identisch.
lb. Thiovulum minus Hinze 1913
Nach Hinze Zellen 9,6-11,0 X 7,2-9 (im grofi und mehr kugelformig.
Aus dem Golf von Neapel (Italien) beschrieben, wo sie regelmafiig zusammen mit
Thiovulum muelleri auftreten.
272
Fig. 272. Thiovulum majus - (nach Anagnostidis, 1968. 800X). Fig. 273.
Thiovulum spora - (nach Skuja, 1964. - 2500X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@iambler.ru
Thiospira • 453
2. Thiovulum spora Skuja 1964 (Fig. 273)
Kugelige oder ellipsoidische, manchmal ovoide Zellen, die gewohnlich zwei
verhaltnismafiig grofie Schwefelkorner enthalten. Protoplasma vollig durchsich-
tig, fein. Schwefelkorner stark lichtbrechend, sehr dunkel oder rotschwarz
gefarbt erscheinend; grofitenteils exzentrisch gelagert. Zellwand ebenfalls sehr
rein, diinn und farblos. Geifiel ohne Farbung nicht sichtbar, wahrscheinlich
apikal.
Vermehrung durch einfache Langsteilung, die gewohnlich am Vorderende der
Zelle anfangt. Bewegung durch die Geifiel, mafiig schnell, wobei die ganze Zelle
stark vibriert.
Zellen im Durchschnitt 1,5-3,0 ^m breit.
In Siifiwasserseen von Nordschweden in grofieren Tiefen. Aus dem Vuolep
Njakajaure-See (Abisko Schweden) beschrieben.
4. Thiospira Vislouch 1914
Sulfospirillum Kluyver et van Niel 1936, Thiospirillum Janke 1924 (non Thiospi-
rillum Vinogradskij 1888)
Zellen in Form von Spirillen mit abgerundeten Enden, gewohnlich mit 0,5-3
lockeren Windungen; farblos, mit einer oder mehreren polaren Geifieln,
manchmal ein ganzes Geifiel-Biindel vorhanden. Bilden keine Ruhestadien.
Protoplasma in H2S-haltigen Milieu mit grofier Menge von Schwefeltropfchen, die
gewohnlich in einer Reihe axial angeordnet sind.
Ernahrungsweise chemolithotroph. Schwefelwasserstoff wird als Energiequelle
verwendet und bis zu elementarem Schwefel oxydiert. Wahrscheinlich
mikroaerophil. Fast nur aus dem Freiland bekannt, weshalb ihre physiologischen
Eigenschaften und ihr Metabolismus wenig geklart sind. Reinkulturen wurden
bisher nicht erzielt. Vermehrung durch Querteilung, ebenso wie bei anderen
Spirillen. Meistens lebhaft beweglich.
In H2S-haltigen Gewassern mit faulenden Pflanzenresten.
In vielen Einzelheiten den Purpurbakterien der Gattung Thiospirillum ahnlich.
Daraus kann man schliefien, dafi die Vertreter der Gattung Thiospira Parallelfor-
men der Gattung Thiospirillum sind, die ihre Pigmente verloren haben. Der
Nachweis ist jedoch nur anhand von Reinkulturen zu fiihren. Die Arten werden
derzeit nur auf Grund ihrer Morphologie unterschieden, so dafi die Berechti-
gung einiger Arten problematisch ist. Dubinina (1980, pers. Mitteilung) stellt
einige Arten in die Gattung Aquaspirillum.
Typus generis: Thiospira winograaskyi (Omeljanskij 1905) Vislouch 1914.
Wichtigste Literatur: Omeljanskij 1905, Kolkwitz 1909, Molisch 1912,
Vislouch 1914, Gicklhorn 1920, Bavendamm 1924, Kluyver et van Niel 1936, Ellis
1932, Krasil'nikov 1949, Skuja 1956, Bergey's Manual 1957, 1974.
Bestimmungsschlussel der Arten
la Spirillumgrofier als 15 (xm 2
lb Spirillum bis 15 (xm grofi 4
2a Spirillum robust, 20-60 (xm grofi, mit vielen scheibenformigen, reihig ange-
ordneten Schwefeltropfchen 1. Th. winogradskyi
2b Spirillum 15-35 (xmgrofi, Schwefeltropfchen in einer Reihe 3
3a Uberwiegend linksdrehende Windungen, Zellen in der Mitte 0,8-1,0 (xm
breit 2. Th. tenuis
3b Uberwiegend rechtsdrehende Windungen, Zellen in der Mitte 1,0-1,3 |im
breit 3. Th. dextrogyra
454 ■ Schwefelbakterien - Thiospira
4a Zellen mit mehreren Schwefeltropfchen; ZentrumderZellennicht hyalin . 5
4b Zellmitte hyalin, manchmal mit Schwefeltropfchen; an beiden Enden des
Protoplasten je ein grofSes Volutinkornchen 4. Th. bipunctata
5a Zellen mit Schwefeltropfchen, die in einer Reihe entlang der ganzen Zellen-
lange angeordnet sind 6
5b Zellen mit unregelmafiigverteilten Schwefeltropfchen .... 5. Th. propera
6a Zellen mit einer perlenschnurartigen Reihe von Schwefeltropfchen 7
6b Je ein Schwefeltropfchen in jeder Zellbiegung 6. Th. sulphurica
7a Zellen 1,0-1,5 ^.m breit; 1-2 polareGeifieln 7. Th. agilis
7b Zellen 1,8-2,0 (xm breit; 1 polareGeifiel 8. Th. agilissima
1. Thiospira winogradskyi (Omeljanskij 1905)
Vislouch 1914 (Fig. 279)
Thiospirillum winogradskyi Omeljanskij 1905, Thiogloeobactron burmiensc
Andres 1907, Spirillum granulatum Molisch 1912, Thiospirillum granulatum
(Molisch 1912) Bergey 1925, Sulfospirillum winogradskyi (Omeljanskij 1905)
Kluyver et van Niel 1936
Zellen stabchenformig, an den Enden zugespitzt, farblos oder fast farblos bis
ganz leicht braungriin. Mit zahlreichen scheibenformigen Schwefeltropfchen,
wodurch die Zellen dunkel bis schwarz gefarbt erscheinen. An einem oder an
beiden Zellenden mit einem Biindel polarer Geifieln, die den Eindruck einer
einzigen Geifiel erwecken. Regelmafiig linksdrehend gewunden, mit 0,5-2,5
Windungen, meistens mit 1 Windung. Eine der grofiten Spirillen. Hochstwahr-
Fig. 279. Thiospira winogradskyi - a einige Exemplare mit normalem Habitus,
b eine etwas abweichende Form aus dem See Lushavet (nach Skuja, 1956. -
1340x).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiospira ■ 455
scheinlich mikroaerophil und gegeniiber Sauerstoff stark chemotaktisch. Leb-
haft beweglich mit Drehung um die Langsachse.
Zellen 1,5-3,5 x 20-60 \im grofi; Schraubenwindungen 7-12 (im hoch und 15-
17 |im lang (manchmal 22-28 (im).
Meistens in schwefelhaltigen Heilschlammen, ebenso in Schichten knapp iiber
H2S-haltigem Schlamm von Sufi- und Meerwasser. Schwefelwasserstoff wird als
Energiequelle benotigt und bis zu elementarem Schwefel oxydiert. In grofieren
Mengen triiben sie Wasser grauweifi. Ofters zusammen mit Chromatium weissei
vorkommend. Im Schlamm aus dem Liman in der Umgebung von Odessa
(UdSSR), spater (Molisch 1912) auch in Heustadl im Prater von Wien (Oster-
reich) gefunden.
Omeljanskij (1905) stellte diesen Organismus irrtiimlich zur Gattung Thiospirillum Vino-
gradskij 1888 und empfahl, in diese auch die farblosen Spirillen einzuordnen, dieelementa-
ren Schwefel speichern. Bruder (1915) nimmt an, dafi dieser Organismus ein schwach
gefarbtes Thiospirillum jenense ist.
2. Thiospira tenuis Skuja 1956 (Fig. 282)
Zellen stabchenformig, gleichmafiig breit, mit regelmafiigen linksdrehenden
Schraubenwindungen; an den Enden leicht verjiingt, mit 0,5-3 Windungen. Mit
1 bis 2 polaren Geifieln. Thiospira agilis ziemlich ahnlich, jedoch kleiner und mit
kiirzeren Windungen. Protoplasma farblos; mit zahlreichen, reihenartig ange-
ordneten Schwefeltropfchen. Bewegung sehr lebhaft.
Zellen 0,8-1,0 X 15,0-30,0 (im grofi; Windungen 7-9 \im breit und 7-11 \im
In mittleren Tiefen von Siifiwasserseen, in grofier Anzahl im Munkbosjon-See
(Schweden) in einer Tiefe von 14 m gefunden.
3. Thiospira dextrogyra Skuja 1956 (Fig. 280)
Thiospira dextrogyra var. leptosoma Skuja 1956
Zellen stabchenformig, mit rechtsdrehenden Schraubenwindungen, an den
Enden leicht verjiingt bis stumpf abgerundet, mit 1 bis 2 Windungen. Mit 1 bis 2
polaren Geifieln, die ein Drittel oder ein Viertel der Zellange erreichen. Morpho-
logisch Thiospira winogradskyi ahnlich, jedoch ist letztere kleiner und besitzt
linksdrehende Windungen. Plasma hyalin mit grofien, reihenartig angeordneten
Schwefeltropfchen; kleine Tropfchen liegen zerstreut. Bewegung lebhaft.
Zellen 1,0-1,3 x 15,0-35,0 \im grofi; Windungen der schraubigen Zellen 5,0-
8,0 (im breit und 14,0-16,0 (im hoch.
In mittleren Tiefen oder in der Litoralzone von Siifiwasserseen; benotigt H2S. In
den Friihjahrsmonaten im Tjarnatjarn-See (Schweden) vorkommend.
Skuja (1956) beschrieb aufierdem eine etwas abweichende Varietat, die diinnere aber langere
Zellen hat:
3a. Thiospira dextrogyra var. leptosoma Skuja 1956
Zellen 0,7-0,9 X 20,0-40,0 um grofi; mit 0,5-2 Windungen, die 5,0-9,0 um breit und 17,0-
20,0 um lang sind.
In den Seen Norrviken, Storacksen und in einem verwachsenen Graben im Stadtpark von
Uppsala (Schweden) gefunden.
4. Thiospira bipunctata (Molisch 1912) Vislouch 1914 (Fig. 281)
Spirillum bipunctatum Molisch 1912, Thiospirillum bipunctatum (Molisch 1912)
Ellis 1932
Zellen klein, farblos, leicht gekriimmt, an den Enden deutlich verjiingt. Kriim-
mung wenig auffallend, so dafi die Zellen bei einer bestimmten Lage nur
456 • Schwefelbakterien - Thiospira
280
Fig. 280. Thiospira dextrogyra - a normaler Habitus des Organismus, b eine
etwas abweichende Form, als Varietat «leptosoma» beschrieben (nach Skuja,
1956- 1340X).
kornchenformig aussehen. Gewohnlich mit nur 0,5-1 Windung. Altere Zellen
besitzen an jedem Ende eine polare Geifiel; junge Zellen haben die Geifiel nur an
einem Ende. An beiden Polen des Protoplasten ein grofies metachromatisches
Volutin-Korn. Zellmitte hyalin, mit 1-9 kleinen Schwefeltropfchen. Nach
Molisch (1912) konnen diese seltener auch an beiden Zellpolen vorkommen. Die
hyaline Zone tritt besonders bei Zellen ohne Schwefeltropfchen hervor. Energie
wird durch Oxydation von Schwefelwasserstoff zu elementarem Schwefel ge-
wonnen. Wahrscheinlich mikroaerophil. Vermehrung durch Querteilung. Leb-
haft beweglich, im Wasser dichte Schwarme bildend.
Zellen 1,7-2,4 X 6,6-14,0 (im grofi.
In Salz- und Brackenwassern mit geniigend Schwefelwasserstoff. Im Meerwasser
und im Schlamm in Triest (Italien) gefunden.
Skuja (1948) ist der Meinung, daf$ sie wahrscheinlich mit Taphrospira elongata
identisch ist und dafi sie in die Gattung Taphrospira gehort. Eine ahnliche
Meinung hat schon Bavendamm (1924) geaufiert, der keinen Unterschied zwi-
schen Thiospira bipunctata und Taphrospira elongata finden konnte.
281
Fig. 281. Thiospira bipunctata - Zellen mit zwei grofien polaren Volutininklu-
sionen und kleinen Schwefeltropfchen in der Zellmitte (nach Molisch, 1922. -
1340X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiospira • 457
Unsichere Arten:
5. Thiospira propera Hama 1933 (Fig. 285)
Schraubenformige Zellen mit 0,5-1 Windung. An einem Pol ein Biindel von 4—5
Geifteln, die langer als die Zelle sind. Protoplasma farblos. Schwefeltropfchen
unregelmafiig verteilt. Physiologische Eigenschaften nicht beschrieben.
Bewegung sehr energisch, durchschnittlich 150 (x/sec.
Zellen 1,3 x 5,0-7,0 \im groft; Geifteln 7,0-8,0 (im lang.
Im Fluftwasser mit hoherer Salzkonzentration vorkommend.
Unzureichende Beschreibung.
Fig. 284. Thiospira agilissima - (nach Anagnostidis, 1968. - 2000X). Fig. 285.
Thiospira propera - (nach Hama, 1933.-2000X). Fig. 286. Thiospira sulphurka
- (nach Isacenko, 1951. - 2000X).
6. Thiospira sulphurica Isacenko 1929 (Fig. 286)
Schraubenformige Zellen mit je einem Schwefeltropfchen in jeder Biegung.
Zellen 1,7 X 17,0 (xm grofi; Windungen um 7,0 (xm lang.
Im Cokrakskoe See, Krim, Halbinsel Kercenskij (UdSSR) gefunden.
Unzureichende Beschreibung; es handelt sich wahrscheinlich um einen
Organismus aus einem schwefelwasserstoffarmen Milieu.
7. Thiospira agilis (Kolkwitz 1909) Bavendamm 1924 (Fig. 283)
Thiospirillum agile Kolkwitz 1909
Zellen stabchenformig, schraubig geknimmt, mit 0,5-2 Windungen. An den
Enden sind die Zellen abgerundet zugespitzt. Mit 1-2 polaren Geilkln, die
kiirzer als die Zelle sind.
Verhaknismafiig grofte Schwefeltropfchen enthaltend, die perlschnurartig ange-
ordnet sind. Protoplasma farblos. Sehr beweglich.
Bavendamm (1924) fiihrt eine Zellbreite von 1,0 (xm an, nach Skuja (1956) sind
die Zellen 1,0-1,5 X 4,0-10,0 (im groft. Die Schraubenwindung ist 4,0-6,0 (xm
breit und 4,0-8,0 |xm hoch.
In stehenden Gewassern vorkommend; bei Massenauftreten rufen sie eine
milchige Triibung im Wasser hervor. Als Fundort wird der Faule See in Hohen-
458 ■ Schwefelbakterien - Taphrospira
282 283
Fig. 282. Thiospira tenuis - (nach Skuja, 1956. - 1340X). Fig. 283 Thiospira
agilis - (nach Skuja, 1956. - 1340X).
Schonhausen bei Berlin (DDR) angegeben. Nach Koppe (1924) kommt dieser
Organismus auch in humusreichen Waldtiimpeln vor.
Nach Bavendamm (1924) Spirillum undula morphologisch sehr ahnlich. Die
Berechtigung der Art ist zweifelhaft, da ihre Beschreibung unzureichend ist.
Wahrscheinlich mit Thiospira agilissima identisch.
8. Thiospira agilissima (Gicklhorn 1920) Bavendamm 1924 (Fig. 284)
Spirillum agilissimum Gicklhorn 1920, Thiospirillum agilissimum (Gicklhorn
1920) Ellis 1932
Zellen schraubenformig gewunden, mit 0,5-1,5 Windungen. Eine polare Geifiel.
Eine der kleinsten Spirillen, die Schwefelwasserstoff verwerten. Schwefeltropf-
chen in den Zellen verhaltnismafiig grofi und in einer Reihe angeordnet. Jede
Zelle enthalt 4—12 solcher Tropfchen. Zellwand sehr zart, Zellumrisse deshalb
wenig deutlich. Physiologische Eigenschaften wenig bekannt. Hohere Schwefel-
wasserstoff-Konzentrationen haben keinen Einflufi auf besseres Wachstum.
Sehr beweglich.
Zellen 1,8-2,0 X 6,0-11,0 u.m grofi; gewohnlich 10,0 \im lang, selten (nach
Behre 1963) bis 20 um lang.
Siifiwasserart. Im Schlofiparkteich von Annenschlofi in Graz (Osterreich) ge-
funden.
Vielleicht mit Thiospira agilis identisch. Die Eigenstandigkeit dieser Art ist
problematisch, da die Beschreibung unzureichend ist. Weitere Beobachtungen
sind notig.
5. Taphrospira Skuja 1948
Die hierher gestellten Organismen sind der Gattung Thiospira sehr ahnlich; sie
besitzen die Form schraubenformiger Spirillen, mit leicht zugespitzten Enden.
An der Oberflache der Zellwand befinden sich zwei parallele Falten mit scharfen
Kanten, die an der Innenseite der Windung der schraubenartig gekrummten
Zelle folgen; sie erinnern an die Kriste von Spirochaeten.
Protoplasma an beiden Polen mit Anhaufungen von Volutinkornchen;
Schwefeltropfchen in der Zellmitte.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sulfolobus • 459
Wichtigste Literatur: Skuja 1948, 1956
Eine eine einzige Art:
Taphrospira elongata (Perfiliev 1923) Skuja 1948 (Fig. 287)
Thiospira elongata Perfiliev 1923
Zellen schlank, auffallend schraubig gebogen; mit 0,5-1,5 niedrigen
Windungen. Altere Zellen an beiden stark verjiingten Enden mit je einer polaren Geifiel;
junge Zellen mit nur einer Geifiel. An der Oberflache der Zellwand ziehen sich
von einem Zellende zum anderen Falten hin. Zellen farblos, an den Enden mit 1
oder 2 Ansammlungen von Volutinkornern. Uberwiegend zentral gelegen 1 bis
4 Schwefeltropfchen (selten auch mehr vorhanden). In vielen Zellen fehlen beide
Einschliisse. H2S wird benotigt und zu Schwefel oxydiert. Beweglich.
Zellen nach Perfiliev (1923) 1,2-1,5 X 12,0-28,0 urn, nach Skuja (1948, 1956)
1,5-2,0 X 10-21 urn grofi.
Im Sufiwasser und im Schlamm vorkommend. Ursprunglich an der Oberflache
eines H2S-haltigen Schlammes, im SufSwasser bei Leningrad (UdSSR) ge-
funden.
Friiher wurde dieser Organismus zur Gattung Thiospira gerechnet. Da er jedoch
als einziger Vertreter ein Krista-ahnliches Organell Desitzt, bildete Skuja (1948)
eine neue Gattung.
Fig. 287 Taphrospira elongata - a-d Zellhabitus unter normalen Bedingungen
eTeilung,/Zelle mit einem einzigen Schwefeltropfchen, g Hungerform aus
einem Milieu ohne Schwefelwasserstoff (nach Skuja, 1948. - 1700X).
6. Sulfolobus Brock et al. 1972
Zellen mehr oder weniger regelmafiig kugelig, mit vielen lappenformigen Aus-
buchtungen. Morphologisch den Zellen von Thermoplasma ahnlich, die sich
jedoch durch eine betrachtlich grofiere Lichtbrechung und regelmafiig kugelige
Zellen unterscheiden. Zellen sehr wenig lichtbrechend, mit einer spezifischen
Struktur der Zellwand ohne Peptidoglykan. Einzelne lappenformige Auslaufer
sind besonders im Elektronenmikroskop gut sichtbar. Gramnegativ.
Aerob, fakultativ autotroph. Als einzige Energiequelle wird elementarer
Schwefel verwertet und zu freier Schwefelsaure oxydiert, wobei die Zellen entweder
einzeln oder in Traubenverbanden an den Schwefelkristallen haften. Im Fluores-
zenz-Mikroskop sind sie nachFarbung mit Akridinorange gut erkennbar. Das
460 • Schwefelbakterien - Sulfolobus
Wachstum auf Schwefel wird durch Zugabe von Kohlendioxid oder von Hefeex-
trakt stimuliert. Die Zellen konnen auch heterotroph wachsen, wobei als
Energiequelle Hefeextrakt Trypton, Pepton, Kasein-Hydrolysat, bestimmte
Aminosauren und Saccharide verwertet werden, die nur in verhaltnismafiig
geringer Konzentration vorhanden zu sein brauchen. Eine Konzentration von
0,25% hat bereits eine Verminderung des Wachstums zur Folge. Phosphate
inhibieren das Wachstum schon bei einer Konzentration von 0,1 %. Zugabe von
Schwefel stimuliert das Wachstum.
Stark azidophil, optimaler pH-Wert bei 2,0-3,0; jedoch werden auch Werte
zwischen 0,9 und 5,8 vertragen. Durch Bildung von Schwefelsaure kann der
Organismus in Kulturen mit hoheren pH-Werten diese den optimalen anpassen.
Thermophil, benotigt eine Temperatur von 55-80 °C; ausnahmsweise wachst
er auch bei 85 °C. Die optimale Temperatur betragt 70-75 °C. Sie liegt stets
niedriger als die Temperatur am naturlichen Standort (Mosser et al. 1974).
Vermehrung durch transversale Trennung der lappenartigen Auslaufer. Zellen
ohne Bewegung.
Zellgrofie verhaltnismafiig konstant, 0,8-1,0 um. Sowohl im Freiland gefundene
als auch in Kulturen geziichtete Zellen haben praktisch dieselben Dimensionen.
Kommt in sauren, tnermalen, schwefelhaltigen Quellen, sowie im Wasser als
auch im Boden ihrer nachsten Umgebung vor. An den meisten Standorten in so
grofien Mengen auftretend, dafi bei mikroskopischer Untersuchung des Wassers
oder der Sedimente die Zellen gut zu sehen sind. Urspriinglich aus «Locomotive
Spring* im Yellowstone National Park (USA) bei einer Temperatur von 83 °C
und bei einem ph-Wert von 2,4 isoliert. Spater mehrmals aus sauren, thermalen
Standorten (sowohl Wasser als auch Boden) isoliert. Die meisten Isolate stamm-
ten aus dem Yellowstone National Park (USA), aber auch aus Italien, Dominica
und El Salvador. Wahrscheinlich als wichtiger geochemischer Faktor bei der
Bildung von Schwefelsaure aus elementarem Schwefel weit verbreitet. Bohlool
(1975) fand den Organismus in heifien Quellen auf Neuseeland.
Wichtigste Literatur: Brock, Brock, Belly und Weiss 1972.
Eine einzige Art:
Sulfolobus acidocaldarius Brock et al. 1972.
Mit den Merkmalen der Gattung.
Mit keiner bisher beschriebenen Bakterienart naher verwandt.
7. Thiobacillus Beijerinck 1904
(non Thiobacillus Ellis 1932, Sulfomonas Orla-Jensen 1909)
Zellen klein, stabchenformig, mit polaren Geifieln. Weder Sporen noch andere
Ruhestadien bildend. Gramnegativ. Energie durch Oxydation von reduzierten
oder teilweise reduzierten Schwefelverbindungen (Sulfide, elementarer
Schwefel, Thiosulfate, Polythiosulfate und Sulfite) gewinnend. Das Endprodukt dieses
Oxydations-Reduktionsprozesses sind Sulfate oder freie Schwefelsaure. Unter
bestimmten Bedingungen konnen sie elementaren Schwefel und Polythiosulfate
als Intermediar-Produkte anhaufen. Eine Art, Thiobacillus ferrooxidans,
verwertet auch Verbindungen von zweiwertigem Eisen als Elektronendonatoren.
Die meisten Arten sind streng lithotroph; als Kohlenstoffquelle dienen nur C02
oder Karbonate, benotigen sowohl einen anorganischen Elektronendonator als
auch Elektronenakzeptor. Einige Arten sind fakultativ autotroph und konnen
organische Verbindungen assimilieren. Eine Art ist mixotroph und braucht als
Energiequelle fur ihr Wachstum reduzierte Schwefelverbindungen gemeinsam
mit organischen Verbindungen als Kohlenstoffquelle. Alle Arten obligat aerob,
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thiomicrospira - Sulfobacillus ■ 461
nur Thiobacillus denitrificans kann im anaeroben Milieu an Nitrate gebundenen
Sauerstoff verwerten. Eine Reihe von Stammen ist halophil oder halotolerant
und thermophil.
Die meisten Arten wurden in Reinkulturen geziichtet.
Vermehrung durch Teilung. Meist mittels polarer Geifieln beweglich. Im Meer-
und Siiftwasser, im Schlamm, im Boden, in sauren Grubenwassern, in hauslichen
und industriellen Abwassern, in Schwefelquellen und anderen Standorten;
iiberall dort, wo Schwefelwasserstoff aus faulenden Pflanzen- und Tierresten
gebildet wird.
Typus generis: Thiobacillus thioparus Beijerinck 1904.
Wichtigste Literatur: Bergey's Manual 1957, 1974, Vishniac und Santer 1957.
Morphologisch sind die einzelnen Arten dieser Gattung nicht zu unterscheiden
und werden deshalb hier nicht angefiihrt.
8. Thiomicrospira Kuenen et Veldkamp 1972
Zellen in Form von Vibrionen oder Spirillen mit weniger als einer Windung. Bei
suboptimalen Nahrstoffbedingungen entstehen sehr lange Spirillen mit einigen
Windungen. Nicht sporenbildend. Die meisten Stamme sind mittels einer
polaren Geifiel beweglich, einige jedoch unbeweglich. In den Zellen befinden
sich keine Schwefelgranula. Aerobe Organismen mit chemolithotrophem oder
chemoorganotrophem Metabolismus. Bei lithotrophem Wachstum dient C02
als Kohlenstoffquelle und reduzierte Schwefelverbindungen als Energiequelle
(Thiosulfat, Sulfide, Tetrathionat und Molekularschwefel). Das Endprodukt der
Oxydation sind Sulfate; bei hoheren Thiosulfat-Konzentrationen wird auch
moiekularer Schwefel gebildet. In geringem Mafi erfolgt auch organotrophes
Wachstum auf Azetat, Sukzinat und Aminosauren. Saccharose, Glukose, Fruk-
tose, Ribose, Glyzerol u. a. beeinflussen das Wachstum nicht. Zum Wachstum
ist 1,5-3,0% NaCl notwendig. Der optimale pH-Wert betragt 6,5-7,5; bei pH
unter 5,0 beginnt die Lyse der Zellen. Die optimale Temperatur liegt bei 28-
30 °C.
Auf Mineralagar mit Thiosulfat werden kleine weifie, in den Agar hineinwach-
sende Kolonien gebildet, die von schmalen Schwefelhofen umgeben sind.
Wichtigste Literatur: Kuenen und Veldkamp 1970, 1972, 1973.
Eine einzige Art:
Thiomicrospira pelophila Kuenen et Veldkamp 1972.
Mit den Merkmalen der Gattung.
Zellen in Form von Spirillen, 0,2 X 3,0-4,0 (xm grofi; die vibrioiden Zellen sind
0,2 X 1,0-2,0 um groft. Grofie Spirillen sind 10-20 ^m lang.
Aus der Oberschicht des Schlammes einer von der Flut uberschwemmten
Meeressandbank im Wadden Zee (Holland) isoliert.
Physiologisch ist die Art Thiobacillus thioparus sehr ahnlich, unterscheidet sich
aber morphologisch von ihr. Auch Thiobacillus coproliticus ahnlich,
unterscheidet sich jedoch von ihm dadurch, dafi sie nicht mixotroph wachst.
9. Sulfobacillus Golovaceva et Karavajko 1978
Sehr polymorpher Organismus. Junge, auf pyrithaltigen Nahrboden wachsende
Kulturen bestehen meist aus Stabchen mit runden, manchmal auch spitzen
462 ■ Schwefelbakterien - Unsichere Art
Polen; Zellgrofie betrachtlich schwankend. Sehr oft werden Paare gebildet.
Altere Kulturen enthalten kokkoide, birnen- oder hantelformige Zellen; sie
bilden oft aus verschiedenen Zellformen zusammengesetzte Ketten (Kokken bis
lange Stabchen). Einige Zellen haben die Tendenz sich zu verzweigen. Durch
unvollstandige Teilung entstehen Zellaggregate in Form von Pallisaden, geboge-
nen Ketten, Ringen oder in «Y»-Form. Es werden kugelige oder leicht ovale
Sporen gebildet, die terminal, subterminal oder parazentral liegen und die
Sporangien mehr oder weniger erweitern. Zellen unbeweglich, mit einer Mikro-
kapsel. Zellwand ohne Aufienmembran. Grampositiv. Im Unterschied zur
Gattung Thiobacillus, der sie sonst ahnlich sind.
Streng aerober Organismus, der ohne Sauerstoff nicht einmal bei Anwesenheit
von Nitraten wachstumsfahig ist. Fakultativ chemolithotroph; als Energiequelle
werden elementarer Schwefel, Eisen und sulfidische Minerale verwertet, an
denen er mittels Schleim haftet. Der Schleim wird hochstwahrscheinlich nur an
dem Teil der Zellen produziert, der mit dem Mineral in Beriihrung kommt. Es
werden keine Wachstumsfaktoren benotigt, Hefeextrakt stimuliert jedoch
betrachtlich seine Aktivitat. Nach kurzer Adaptionszeit vermag er auch chemoor-
ganotroph zu wachsen, wobei Glukose, Saccharose oder Glutamin nicht nur als
Energie- sondern auch als Kohlenstoffquelle dienen konnen. Er ist azidophil,
wobei ein pH-Wert von 1,9-2,4 optimal ist. Bei pH unter 1,9 und hoher als 3,0
vermindert sich seine Aktivitat stark. Er ist thermophil; die optimale Wachs-
tumstemperatur betragt 50 °C, die maximale 60 °C. Bei Temperaturen von
20 °C und 60 °C ist er praktisch inaktiv.
Sehr thermoresistent durch Sporenbildung; vertragt auch dreifache Sterilisation
von je 30 Minuten in stromendem Dampf oder 30 Minuten bei 110 °C. Abto-
tend wirkt erst eine Temperatur von 121 °C wahrend 30 Minuten. Er kommt in
Grubenwassern von sulridischen Bergwerken vor.
In diese Gattung kann wahrscheinlich als selbstandige Art auch der autotrophe, sporulieren-
de Organismus gestellt werden, der provisorisch als Thiobacillus thermophilica imschenets-
kii (Egorova und Derjugina 1963) identifiziert wurde.
WichtigsteLiteratur: Egorova und Derjugina 1963, Golovaceva und Karavajko
1977, 1978, Brierley und Le Roux 1977, Golovaceva 1979 a, 1979 b, 1979 c.
Eine einzige Art:
Sulfobacillus thermosulfidooxidans (Golovaceva et Karavajko 1977),
Golovaceva et Karavajko 1978.
Thiobacillus thermosulfidooxidans Golovaceva et Karavajko 1977.
Mit den Merkmalen der Gattung.
Die vegetativen Zellen sind meistens 0,6-0,8 x 1,0-3,0 \am grofS. Die Sporen
messen 0,7 x 0,7-0,8 \im.
Isoliert wurde diese Art von einem Fundort sulfidischer Erze in Mikolaevskovo
(UdSSR).
In einer Reihe von Merkmalen ahnelt diese Art Thiobacillus ferrooxidans; stimmt
auch weitgehend mit dem «Thiobacillus-like» iiberein, der von Brierley und Le
Roux (1977) beschrieben wurde und aus heifien Quellen von Island stammt.
Unsichere, ungeniigend beschriebene Gattung und Art:
Thiospirillum pistiense Czurda 1935.
Czurda (1935) beschrieb unter diesem Namen leicht schraubenformig gewunde-
ne, 1,0-1,2 x 14,0-22,0 \un grofie Stabchen, die eine polare Geifiel besitzen. Im
Protoplasma lebender wie auch mit Karbolfuchsin getarbter Zellen sind kugelige
Inklusionen sichtbar, die fast so grofi wie der Zelldurchmesser sind.
Aus Sulfaten oder molekularem Schwefel, die als Energiequelle verwendet
werden, wird intensiv H2S produziert. Wachstum nur auf C02-reichen und
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Unsichere Art ■ 463
sauerstoffarmen Medien bei einer Temperatur von 48 °C; bisher wurde noch
keine Reinkultur erzielt.
Tritt in dichten, schleimigen Anhaufungen auf. Der geifiellose Zellpol haftet am
Schleim fest; mit dem freien Ende drehen sich die Zellen aus dem Schleim heraus,
wobei die Geifiel eine langsame, kreisformige Bewegung ausfuhrt.
Aus einer sulfathaltigen Thermalquelle in Piestany (CSSR) beschrieben und
isoliert.
Kuznecov (1955) und Zavarzin (1972) fiihren unter diesem Namen einen
Organismus an, der Faden bildet, die aus grofien schraubenartig gewundenen Zellket-
ten bestehen. Die Zellen drehen sich oft an der Verbindungsstelle innerhalb der
Kette um; dadurch verflechten sich die Faden allmahlich miteinanderund bilden
einige cm lange, zottige, weifie Anhaufungen, die von dem ausgeschiedenen, die
Faden bedeckenden Schwefel verfarbt sind. Bei Temperaturen iiber 70 °C setzt
sich der Schwefel nicht ab; sind dann die Fadenanhaufungen rot gefarbt.
Obligat thermophiler Organismus; nach Zavarzin (1972) wachst er nicht unter
50 °C. Die Maximaltemperatur betragt 75 °C. Kommt nur an Stellen mit
starker Wasserstromung vor; benotigt eine schwach alkalische Reaktion. Nach
Zavarzin (1972) gehort er zu den Organismen, die Schwefelverbindungen zu
elementarem Schwefel oxydieren. Kuznecov (1955) nahm an, dafi es sich bei
diesem Organismus um die in Thermalquellen in Kamtschatka, in den Karpathen
und auf den Kurylischen Inseln (UdSSR) auftretenden Thermophilen handelt.
Die Identitat wie auch die Taxonomie des Organismus sind ziemlich unklar. Mit
der Gattung Thiospirillum aus der Familie Chromatiaceae (siehe Teil I) hat er
nichts gemeinsam. Zavarzin (1972) betrachtet ihn irrtumlich als synonym mit
Thermus aquaticus (Siehe Teil X), der chemoorganothroph ist.
Teil IX. Chemolithotrophe, Eisen und Mangan
ablagernde Bakterien
Organismusgruppe, die Eisen- oder Manganverbindungen in Schleimkapseln
oder als extrazellulare Substanz ablagern. Die physiologische Grundlage dieser
Erscheinung ist bisher nicht genau bekannt. Die Gruppe ist identisch mit der
Familie Siderocapsaceae.
Familie Siderocapsaceae Pribram 1929
Einzellige Organismen. Zellen kugelig, ellipsoidisch oder kurz stabchenformig,
oft in eine ± dicke Gallertkapsel eingeschlossen. Sie scheiden Eisen- oder
Manganverbindungen (Oxide), manchmal auch beide Elemente gleichzeitig aus,
mit denen die Gallertkapseln impragniert werden. Zellen ohne Kapseln lagern sie
als extrazellulares Material ab. Bei manchen Gattungen wird dabei auf der Kapsel
ein Ring in Form eines Kettengliedes oder Hufeisens gebildet. Die Morphologie
dieser Mikroben ist am besten nach Auflosung der Eisen- und Manganimpragna-
tionen durch schwache Sauren erkennbar. Junge Zellen einiger Art besitzen
polare Geifleln, mit denen sie sich bewegen. Grolkenteils chemolithotroph oder
organotroph; nur einige Arten wurden in Reinkulturen geziichtet. In eisenhalti-
gen Gewassern frei schwebend oder an untergetauchten Gegenstanden festhaf-
tend.
Die bisher benutzten taxonomischen Kriterien, die auf der Ablagerungsweise
der Eisen- und Manganverbindungen basierten, sind zweifelhaft. Die Identifi-
zierung der Arten erfolgt an Hand der Morphologie der Organismen; biologi-
sche Teste sowie physiologische Eigenschaften der Zellen sind bisher wenig
bekannt. Einige Arten sind in der Natur so stark verbreitet, dafi ihnen grofie
biologische Bedeutung bei der Bildung von eisen- und manganhaltigen Erzen
zukommt.
Typus familiae: Siderocapsa Molisch 1910
Bestimmungsschlussel der Gattungen
la Zellen mit Gallerthullen, die mit Eisen- und Manganverbindungen inkru-
stiertsind 2
lb Zellen ohne Gallerthullen, Eisenverbindungen in den Zellwanden, an der
Zelloberflache oder im Medium ablagernd 7
2a Zellen in Form von Kokken oder kurz ellipsoidischen Zellen: Kolonien eine
gemeinsame Kapsel bildend, in der Eisen- und Manganoxide abgelagert
werden 1. Siderocapsa (S. 465)
2b Zellen in Form von Bacillen oder lang ellipsoidischen Zellen 3
3a Zellen lagern die Metalloxide in einem feinen Kapseltorus ab, der den
Zellrand deutlich hervorhebt 4
3b Zellen mit Kapsel, abernieeinen Torus formend 5
4a Torus die ganze Zelle umhiillend 2. Naumaniella (S. 474)
4b Torus in Hufeisenform 4. Ochrobium (S. 478)
5a Zellen in der Kapsel Ketten bildend 6
5b Zellen unregelmafiige Kolonien in einer gemeinsamen Kapsel bildend
5. Sideromonas (S. 479)
6a Ketten ellipsoidischer Zellen in eine Kapsel eingeschlossen, die die Form der
Zellen beibehalt 6. Sideronema(S. 483)
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderocapsa ■ 465
6b Zellen in Paaren oder kurzen Ketten; gewohnlich am Wasserspiegel vorkom-
mend 7. Ferribacterium (S. 483)
7a Zellen kugelig, Vermehrung durch Teilung 3.Siderococcus(S.477)
7b Zellen stabchenformig 8. Siderobacter (S. 485)
1. Siderocapsa Molisch 1909
Zellen kugelig bis ellipsoidisch, in einer Schleimkapsel, die durch Eisen- oder
Manganoxide oder durch beide Metalle gleichzeitig impragniert ist. Zellen in den
Kapseln entweder einzeln oder manchmal in grofieren oder kleineren, mehr oder
weniger unregelmaftigen Kolonien lebend. Einzelne Kapseln konnen von einer
sekundaren Kapsel umgeben sein, so dafi dann grofie Kolonien gebildet werden.
Die Metalloxide werden an der Oberflache sowohl der primaren als auch
sekundaren Kapsel abgelagert. Zellen immer farblos, Kapseln je nach dem
Gehalt an Oxiden gelb bis braun gefarbt.
Aerob, jedoch auch bei herabgesetzter Sauerstofftension wachsend. Ablagerun-
gen von Eisen oder Mangan erfolgen durch Oxydation organischer Verbindun-
gen dieser Metalle (Humate) an der Oberflache der Kapseln. Es handelt sich
daher um organotrophe Organismen und nicht, wie bisher angenommen wurde,
um autotrophe. Fur ihr Wachstum benotigen sie ein neutrales oder leicht
alkalisches Milieu. Bis vor kurzem wurden sie noch nicht in Reinkulturen
geziichtet, sodafi ihre physiologischen Eigenschaften unbekannt sind.
Bewegung wurde nie oeobachtet.
In eisenhaltigen Gewassern, oft als Epiphyten auf griinen Wasserpflanzen oder
anderen untergetauchten Gegenstanden oder als frei schwebende Organismen
im Plankton oder Neuston, manchmal auch im Benthos vorkommend.
Cholodnyj (1926) betrachtete sie als zufallige Ansammlung verschiedenartiger Bakterien, an
denen sie auf chemischem Wege ausgefalltes Eisen absetzt, was von Naumann (1928)
widerlegt wurde. Hardman und Henrici (1939) zeigten entgegen den Angaben von Dorff
(1934), dafi sie auch im fliefienden Wasser wachsen konnen. Dubinina (1974) stellte auf
Grund von Versuchen mit Reinkulturen fest, dafi sie von A rthrobacter globiformis nicht zu
unterscheiden sind und Svorcova (1975a, 1975b) bewies, dafi einzelne Arten dieser Gattung
einander vollig gleichen, so dafi ihre Eigenstandigkeit zur Zeit problematisch ist. Viele
wurden bisher nicht in Reinkulturen geziichtet.
Zdanov und Dubinina (1975) isolierten zwei Bakterienstamme in Reinkulturen, die auf
Grund morphologischer Eigenschaften in die Gattung Siderocapsa gestellt werden konnten.
Aufgrund eines detaillierten Studiums morphologischer, physiologischer wie auch biologi-
scher Kultivierungseigenschaften gelangten sie jedoch zu der Ansicht, dafi sie zu der
Gattung Arthrobacter gestellt werden miissen. Sie sind der Meinung, dafi die bisher
beschriebenen Formen der Eisenbakterien, die als selbstandige Arten von Siderocapsa
angefiihrt wurden, de facto nur Wachstumsformen des neu beschriebenen, pleomorphen
Organismus Arthobacter siderocapsulatus Zdanov et Dubinina 1975 sind. Diese Meinung
wird besonders durch die Tatsache gestiitzt, dafi die Taxonomie der Gattung Siderocapsa nur
auf morphologische und okologiscne Eigenschaften gegriindet ist und dafi es zwischen den
einzelnen Arten eine ganze Reihe von Ubergangsformen sowie eine Variabilitat der
Eigenschaften an naturlichen Standarten gibt. Darum ist nach Dubinina et al. (1973), Zdanov und
Dubinina (1975), Dubinina und Zdanov (1975), Dubinina (1978) die Giiltigkeit derGattung
Siderocapsa, eventuell auch der ganzen Familie Siderocapsaceae in Frage gestellt.
Typus generis: Siderocapsa treubii Molisch 1909
Wichtigste Literatur: Molisch 1909, 1910, Cholodnyj 1926, 1953, Naumann
1921, Redinger 1931, Dorff 1934, Ruttner 1937, Hardman und Henrici 1939,
Skuja 1948, 1956, Beger 1949, Pringsheim 1949, Wawrik 1956, Sokolova 1959,
Drake 1965, Kalbe, Keil und Thiele 1965, Dubinina 1974, Svorcova 1975a,
1975b, Bergey's Manual 1974.
466 ■ Eisenbakterien - Siderocapsa
Bestimmungsschliissel der Arten
la Kapsel mit mehreren Zellen 2
lb Kapsel mit nur einer Zelle 10
2b Kapsel mehroderwenigerkugelig 3
2b Kapsel nicht kugelig 9
3a Zellen kokken-, selten stabchenformig 4
3b Zellen ellipsoidisch; in der Kapsel gewohnlich in Paaren angeordnet
2. S. geminata
4a Kapselmitmehralsl00Zellen;imDurchmesser0,7-l,8 mm
3. S. major
4b Kapsel mit weniger Zellen 5
5a Zellen gewohnlich zu 8 Paaren in Form von Diplokokken
4. S. conglomerata
5b Zellen nicht paarweise geordnet 6
6a Zellen 1,0-2,0 um grofi 7
6b Zellen sehrklein; selten einen Durchmesser von 1,0 um erreichend 8
7a Primarkapseln mit 2-8 Zellen; zoogloeale Formationen bildend, die aus bis
zu 90 Individuen zusammengesetzt sind; mit verschwommenen Kapseln.
Im Neuston 5. S. coronata
7b Primarkapseln mit mehr Zellen (bis 60). Sekundarkapseln zu einer Schleim-
masse vereinigt. Im Hypolimnion und auch im Epilimnion eutropher Seen
6. S. eusphaera
8a Primarkapseln gewohnlich 2, manchmal auch 4 Zellen enthaltend und
zoogloea-artige Gebilde formend, Kapseln in diesen nicht verschwommen.
Plankton-Art 7. S. arlbergensis
8b Kapseln gewohnlich 6-8 Zellen enthaltend, meist sessil an Wasserpflanzen
1. S. treubii
9a Kapsel zylindrisch, mit Ketten von 2-8 Zellen 8. S. lanceolata
9b Kapsel in Form einer rechteckigenTafel, mit 3—4 Zellen
9. S. rectangulata
10a Kapsel mehroderwenigerkugelig 11
10b Kapsel in Form eines Polygons 14
11a Kapselrand mehr oder weniger glatt 12
lib Kapselrand gezahnt; Zellen sehrklein, 0,2-0,5 um 10. S. anulata
12a Zellen mit Kapseln, unregelmafiige Aggregate bildend 13
12b Zellen mit Kapseln, Kettchen oder regelmafiige traubenformige Gebilde
formend, in denen die Individuen miteinanderdurch «Briicken» verbunden
sind U.S. solitaria
13a Aggregate sessil 12. S. monoica
13b Aggregate planktisch 13. S. botryoides
14a Kapsel mehr oder weniger regelmafiigviereckig 14. S. quadrata
14b Kapsel sechseckig 15. S. hexagonata
1. Siderocapsa treubii Molisch 1909 (Fig. 288)
Zellen in Form von Kokken. Gewohnlich eine Zoogloea-ariige Kolonie aus 6-8
Zellen mit einer Schleimkapsel bildend; nach Hardman und Henrici (1939) kann
eine Kolonie bis zu 30 Zelfen enthalten. Schleim mit Eisen- und Manganverbin-
dungen impragniert. Aufierrand der Schleimkapsel gut sichtbar; gewohnlich
rundlich oder ellipsoidisch verlangert. Morphologie des Organismus so auffal-
lend, daft er im Freiland verlafilich identifiziert werden kann. Zellen farblos; sie
lassen sich nur schwer mit den ublichen Farbstoffen farben, am besten noch mit
Schiffs-Reagens.
Organotropher, aerober Organismus, der als KohlenstoJjfcund Energiequelle
Scanned &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgrambler.
Siderocapsa • 467
organische Radikale organischer Verbindungen von Eisen und Mangan, beson-
ders Eisenhumate verwertet. Die Endprodukte dieser Oxydations-Reduktions-
Prozesse werden als Eisen- oder Manganoxide an der Oberflache der Kapseln, an
Wasserpflanzen, an denen sie meistens als Epiphyten auftreten, oder an submer-
sen Gegenstanden ausgeschieden. Unbeweglich.
Zellen im Durchschnitt 0,4-0,6 um grofi; Schleimkapseln 1,8-3,6 um grofl.
In Gewassern sehr verbreitet. Besonders zahlreich in Seen mit alkalischem,
hartem Wasser. In sauren, weichen Wassern nicht vorhanden. An Wurzeln und
Blattern von Wasserpflanzen besonders an Elodea, Nymphaea, Sagittaria, Salvi-
nia, usw. gefunden.
Pringsheim (1949) glaubte, dafi es sich um Gallertpolster anderer Organismen, die ebenfalls
mit Eisenverbindungen impragniert sind, handelt. Hardman und Henrici (1939) fanden eine
Reihe von Ubergangsformen zwischen Siderocapsa treubii und Siderocapsa major in den
Seen und Fliissen der Staaten Minnesota und Wisconsin (USA) und sind daherderMeinung,
dafi beide Arten als Siderocapsa treubii vereinigt werden sollten. Mangels bedeutenderer
Unterschiede in der Zellgrofie stellt Svorcova (1975b) auch Siderocapsa coronata hierher.
Naumann (1921) beschrieb zwei Sufiwasserformen, «chromophila» und ♦ chromophoba'.
Fig. 288. Siderocapsa treubii - verschiedene, mit Eisenverbindungen impra-
gnierte Kolonien (nach Molisch, 1909.-1340X). Fig. 289. Siderocapsa major-
verschiedene, stark impragnierte Kolonien (nach Molisch, 1909 und Rodina,
1958. - 1340X).
2. Siderocapsa geminata Skuja 1956 (Fig. 290)
Zellen ellipsoidisch, gleich nach der Teilung halbkugelig, oft in Paaren. Einzel-
zellen kommen nach der Teilung von Kolonien vor. Sie bilden eine abgerundete
Schleimkapsel, die zuerst homogen und farblos, spater gleichmafiig gelb oder
braun gefarbt ist; in alteren Kapseln sind schwacn angedickte konzentrische
Schichten vorhanden, wobeLdie Mitte hyalin bleibt. Protoplasma farblos,
homogen.
468 • Eisenbakterien - Siderocapsa
Zellen 0,5 x 0,5-0,8 um grofi, Schleimkapsel bis 5,0 um dick, ganze Kapsel
meistens 7,0-11,0 um breit.
Im Siifiwasserplankton. Im Hypolimnion und Epilimnion zur Zeit der Friih-
jahrs- und Herbstzirkulation der Seen Norrviken und Storacksen (Schweden)
gefunden. Svorcova (1975b) isolierte diese Art aus Mineralwassern von Karlovy
Vary und Zajecice sowie aus den Mineralwassern Ondrasovka und Bilinka
(CSSR).
Fig. 290. Siderocapsa geminata - kugelformige Schleimkapseln meistens Paare
von kokkenformigen Zellen umgebend (nach Skuja, 1956. - 1340X).
3. Siderocapsa major Molisch 1910 (Fig. 289)
Farblose Zellen in Form von Kokken oder kurzen Stabchen. Kolonien aus 100
oder mehr Zellen bestehend, eine gemeinsame braungefarbte Schleimkapsel
bildend. Siderocapsa treubii ahnlich, von der sie sich jedoch durch grofiere Zellen
und die nicht so scharf abgegrenzte Schleimkapsel unterscheidet.
Zellen 0,7 x 1,8 um grofi, Schleimkapsel meistens 2,0-4,5 um breit.
Sessil an der Unterseite submerser Blatter von Wasserpflanzen, aber auch frei
schwimmend am Wasserspiegel, besonders im Schaum stehender Gewasser.
Urspriinglich an der Wasseroberflache eines Altwassers der Vltava (Moldau) bei
Praha (CSSR) gemeinsam mit der Alge Spirogyra gefunden. Weitverbreitete
Art.
4. Siderocapsa conglomerata (Beger 1949) Svorcova 1975 (Fig. 291)
Siderosphaera conglomerata Beger 1949
Kleine Diplokokken, die in eine Primarkapsel eingeschlossen sind. Nach Simul-
tanteilung umgeben sich die Paare der Tochterzellen mit einer neuen Kapsel.
Durch eine solche Teilung entstehen 8 Zellpaare, die ein ballartiges Stadium
bilden, das in eine 8,0-10,0 um groften Schleimkapsel eingeschlossen ist, in der
Eisenverbindungen (Mangan bisher noch nicht festgestellt) abgelagert werden.
Die Schleimkapsel besteht aus mehreren Schichten, wobei die Eiseninkrustation
in der Nahe der Zellen am starksten ist, wahrend sie nach aufien hin abnimmt.
Die Aufienschicht ist beinahe transparent. Vermehrung durch gleichzeitige
Teilung der Diplokokken in zwei Zellpaare.
Durchmesser der Zellen 1,0-1,2 um. Kapsel im Durchschnitt 2,0 um breit. Das
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderocapsa • 469
komplizierte ballahnliche Stadium ist 8,0-10,0 um grofi. Im letzten Stadium
erreichen die Kolonien gewohnlich eine Grofie von 300-500 um.
An der Schlammoberflache von Suftwassersumpfen. Svorcova (1975b) fand sie
vereinzelt auch in den Mineralwassern von Bilinka, Zajecicka und in den Quellen
von Karlovy Vary (CSSR).
Fig. 291. Siderocapsa conglomerata - mehrschichtige sekundare Kapsel (nach
Svorcova, 1975. - 1340x).
5. Siderocapsa coronata Redinger 1931 (Fig. 292)
Zellen in Form von Kokken; sie bilden Kolonien, die in Kapseln eingeschlossen
sind. Kapsel anfangs homogen, spater mit undeutlicher Radialstruktur. Primare
farblose Kapseln mit 2-8 Zellen. Diese werden dann von einer sekundaren, gelb
bis braun gefarbten Kapsel umgeben, die aus bis zu 90 Primarkapseln zusam-
mengesetzt ist. Kapselmaterial durch Eisen- und Manganoxiden impragniert;
Kapseln von verschiedenartiger, unbestimmter Form. Morphologisch
Siderocapsa arlbergensis sehr ahnlich. Ohne eigene aktive Bewegung.
Kokken im Durchschnitt 1,0 um grofi; Sekundarkapseln konnen bis 10 cm im
Durchmesser erreichen.
Fig. 292. Siderocapsa coronata - verschiedene Gebilde sekundarer Kapseln (nach
Dorff, 1934, - 1340X). Fig. 293. Siderocapsa arlbergensis - Schleimkapseln mit
2-4 Zellen; in einigen Fallen bilden sie Zoog/oea-artige Anhaufungen (nach
Wawrik, 1956.- 1340X).
470 • Eisenbakterien - Siderocapsa
Im See und Teichwasser der Alpen und der umliegenden Gebieten sehr verbrei-
tet. Frei schwebend im Wasser oder an der Oberflache schwimmend.
Typischer Neustonorganismus. Im Lunzer Obersee (Osterreich) zur Zeit der
Schneeschmelze gefunden, wo er komplizierte, bis faustgrofie Formen bildete.
Ruttner (1937) gibt an, dafi das Vorkommen an die Sauerstoff-Schichtung
gebunden ist; meistens in einer Tiefe von 17-27 m, bei einem Sauerstoffgehalt
von 0,12-0,3 mg/1 vorkommend.
Die hochste Sauerstoffgehalt, bei dem dieser Organismus noch gefunden wurde,
betrug 4,66 mg/1. Svorcova (1975b) vereinigt diese Art mit der wenig unter-
schiedlichen Siderocapsa treubii.
6. Siderocapsa eusphaera Skuja 1948 (Fig. 294)
Primarkapsel mit 2-60 kokkenartigen Zellen von einer Sekundarkapsel umge-
ben, die grofie, in Schleimmassen eingebettete Kolonien bilden. Sekundarkap-
seln mit grofieren Mengen von Eisen- und Manganverbindungen in zwei bis drei
konzentrischen, gelb bis braun gefarbten Schicnten. Innenschicht immer dunk-
ler. Protoplasma hyalin, mit Gasvakuolen.
Zellen im Mittel 1,0-2,0 |im, Primarkapsel 10-20 \\xn, Sekundarkapsel bis
50 \xm grofi.
In den oberen Schichten von Siifiwasserseen, insbesondere dort, wo wenig
Sauerstoff vorhanden ist. Weit verbreitet. Oft im Hypolimnion und auch
Epilimnion mesotropher und eutropher Seen; Planktonorganismus. In den
schwedischen Seen Erken, Skarsjon und Amsjon gefunden.
Svorcova (1975b) vereinigt diese Art mit Siderocapsa major.
Fig. 294. Siderocapsa eusphaera - a Primarkapsel mit zwei Zellen, b mehr-
schichtige Kapsel mit einer grofieren Anzahl von Zellen, c einzelne Zellen mit
Gasvakuolen (nach Skuja, 1948. - 1700X).
7. Siderocapsa arlbergensis Wawrik 1956 (Fig. 293)
Zellen kugelig. Meistens 2, seltener 1 oder 4 Zellen von einer hellen Schleimkap-
sel umgeben, die gewohnlich unregelmafiig kugelig ist, eine kornige Struktur
und eine rauhe Oberflache aufweist. Nach Inkrustation durch Eisenoxide hell
bis dunkelbraun gefarbt, Manganoxide werden nicht gespeichert. Sowohl ein-
zeln als auch in zoogloealen, traubenformigen Gebilden, die aus mehr als 100
Kapseln zusammengesetzt sind, lebend. Diese Kapseln werden nie aufgelost,
wodurch sich diese Art von Siderocapsa coronata unterscheidet. Bewegung nicht
beobachtet. _
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderocapsa • 471
Einzelne Zellen 0,4—1,0 \\.m breit, Kapseln 6,0-15,0 \am im Durchmesser.
Als Planktonorganismus in Hochgebirgsmooren, besonders wahrend des Eis-
bruchs vorkommend und eine starke orange bis rotbraune Vegetationsfarbung
des Wassers hervorrufend. In Almtiimpeln des Arlbergsgebietes in der Umge-
bung von St. Christoph (2140 m), bei Arlesattel (2090 m) und im Albonapafi-
Tiimpel (2000 m) (Osterreich). Bildet braune Flecken auf brechenden Eis-
schollen.
8. Siderocapsa lanceolata Svorcova 1975 (Fig. 295)
Einzelne Zellen kugelig, aus 2-8 Zellen bestehende Ketten bildend, die in eine
gemeinsamen Kapsel eingeschlossen sind. Kapsel zylindrisch, durch Eisenver-
bindungen stark impragniert. Um diese Kapsel herum bildet sich eine Schleim-
hulle. Zellen im Mittel 0,3-0,5 \\xn grofi, Kapseln verschieden lang, gewohnlich
3,0-5,0 |im, ausnahmsweise bis 10,0 \nm und 1,0-3,0 |^m breit.
Vereinzelt in Mineralwassern von Vincentka, Ondrasovka, Bilinka (CSSR)
gefunden.
Fig. 295. Siderocapsa lanceolata - kurze Zellkettchen in verschieden gestaltete
Kapseln eingeschlossen (nach Svorcova, 1975. - 2500X). Fig. 296. Siderocapsa
rectangulata - rechteckige Kapsel 3—4 Zellen umgebend (nach Svorcova, 1975.
2500X).
9. Siderocapsa rectangulata Svorcova 1975 (Fig. 296)
Zellen in Form von Kokken, die zu je 3 bis 4 in den Ecken einer quadratischen,
tafelartigen, leicht bikonvexen Kapsel angeordnet sind; Kapsel von einem
Schleimlager umgeben.
Zellen 0,6—4,0 |im grofi, voneinander 3,4—5,0 \am entfernt.
In Mineralwassern von Vincentka, Zajecicka, Bilinka und in den Quellen von
Karlovy Vary (CSSR) gefunden.
472 ■ Eisenbaktenen - Siderocapsa
10. Siderocapsa anulata Kalbe, Keil et Thiele 1965 (Fig. 299)
Zellen kugelig, immer einzeln, in der Mitte eines kreisformigen Gallerthofes
liegend und von einem kreisformigen, ockergelben oder braunen Ring umgeben,
dessen Rand manchmal gezahmt, manchmal glatt ist. Mit Eisenverbindungen
inkrustiert. Zellumrisse nicht ganz deutlich, da sie durch den Schleim verwischt
werden. Ring von verschiedener Dicke, die von der Eisenoxidimpragnierung
abhangig ist. Zellen gut mit Gentiana-Violett, Methylenblau und Schiffs-Rea-
gens farbbar, wahrend der Ring Berliner Blau-Reaktion zeigt. Wahrscheinlich
organotropic ahnlich wie Siderocapsa treubii Eisenhumate verwertend, aerob.
Vermehrung durch Teilung, wobei eine Tochterzelle den Ring verlafit. Bewe-
gung nicht beobachtet.
Zellen im Durchmesser 0,2-0,5 um grofS. AufSendurchmesser des Rings 1,2-
1,9 um, Innendurchmesser 0,65-1,0 um.
b
299
Fig. 297. Siderocapsa solitana - Kettchen oder traubenformige Kapselanhaufun-
gen, die miteinander durch charakteristische «Briicken» verbunden sind (nach
Svorcova, 1975. - 2500X). Fig. 298 Siderocapsa monoka - a mehrschichtige
Kapsel mit einer einzigen kokkenartigen Zelle, b Kapselagglomeration (nach
Svorcova, 1975. - 2500X). Fig. 299. Siderocapsa anulata - a verschiedene
Ringformen, den Gallerthof der Zellen umgebend (2500X), b Detail eines
Exemplars (5000X) (nach Kalbe et al. 1965.).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderocapsa ■ 473
Im Plankton oder Tychoplankton von Siifiwasserseen, urspriinglich im Kumme-
rower See in Mecklenburg (DDR) gefunden.
11. Siderocapsa solitaria Svorcova 1975 (Fig. 297)
Zellen kugelig, mit eigener mehrschichtiger Kapsel, die mit Eisenoxid impra-
gniert ist. Zellen zu Ketten oder traubenformigen Gebilden vereinigt, in denen
sie durch deutliche «Briicken» miteinander verbunden sind, deren Beschaffen-
heit und Funktion bisher nicht bekannt sind.
Zellen 0,5-0,8 um grofi, Primarkapsel 1,2-1,5 um im Durchmesser. Die ganze
Kapsel erreicht bis zu 4,0 um.
Vereinzelt in den Mineralwassern Zajecicka und Vincentka (CSSR) gefunden.
12. Siderocapsa monoica Naumann 1921 (Fig. 298)
(non Siderocapsa monoeca Naumann 1921)
Einzelne Zellen in Form von Kokken oder ellipsoidisch, farblos. In Eisen- oder
manganhaltige gelbbraune Kapseln eingeschlossen. Jede Kapsel enthaltnur eine
Zelle. Bei alteren Zellen bildet sich ein hohler Zwischenraum zwischen der Zelle
und der Kapsel. Die Inkrustationen alterer Stadien aggregieren und fuhren zu
Eisen- und Mangananhaufungen an Wasserpflanzen (besonders Potamogeton
natans oder Sagittaria) und an anderen submersen Gegenstanden.
Einzelne Zellen im Durchschnitt 0,5-0,7 \im grofi.
Haufig in Fischteichen, Fliissen und Staubecken, Brunnen sowie in Siifiwasser-
seen. Mikroskopisch nachgewiesen (Svorcova 1975b) in den Mineralwassern von
Zajecicka, Vincentka, Bilinka und in den Quellen von Karlovy Vary (CSSR).
Urspriinglich an der Unterseite der Blatter von Potamogeton natans in Schweden
gefunden.
Drake (1965) bezweifelt die Giiltigkeit dieser Art. Svorcova (1975b) reiht hier auch die
folgende Siderocapsa botryoides ein, da der Unterschied unbedeutend ist.
13. Siderocapsa botryoides Beger 1949
Zellen kugelig oder ellipsoidisch, Kapseln bildend. In jungen Stadien einzeln
lebend, spater klumpen- oder knauelartige Kolonien bildend. Kolonien durch
Eisen- und Manganoxide inkrustiert.
Zellen im Mittel 0,6-0,8 \im, mit Kapsel 0,8-2,0 \im grofi; Kolonien ungefahr
3,0 \un grofi werdend.
In Brunnen und Wasserwerksanlagen vorkommend, sehr verbreitet. In Wasser-
werkssandfiltern gefunden.
14. Siderocapsa quadrata Svorcova 1975 (Fig. 300)
Zellen kugelig oder ellipsoidisch, von einer quadratischen Kapsel umgeben, die
im Profil bikonvex ist. Kapsel durch Eisenverbindungen inkrustiert, rostbraun
bis dunkelbraun gefarbt, aufien von hell gefarbtem Schleim umgeben.
Protoplasma mit konzentriertem Karbolfuchsin sattrot, Kapsel hellrot farbbar.
Durch die Farbung wird die Gestalt der Kapsel verandert.
Zellen 0,5-1,0 um grofi, die Seiten der quadratischen Kapsel 2,2-2,5 um und die
Diagonale 3,2-4,0 um lang, im Profil 1,0 um dick.
Bisher wurde keine Reinkultur erzielt. Im Mineralwasser des «Vh'dlo» und
«Mlynsky pramen» in Karlovy Vary gefunden, ferner in den Mineralwassern
Vincentka und Zajecicka (CSSR).
474 ■ Eisenbakterien - Naumanniella
300
301
Fig. 300. Siderocapsa quadrata - kugelformige Zellen eine quadratische Kapsel
bildend, die von der Seite gesehen bikonvex ist (nach Svorcova, 1975. - 4500X).
Fig. 301. Siderocapsa hexagonata - a mehrschichtige sechseckige Kapseln (vom
Profil gesehen bikonvex), b wabenformige Kapselkolonie (nach Svorcova,
1975.-4500X).
15. Siderocapsa hexagonata Svorcova 1975 (Fig. 301)
Zellen kugelig bis ellipsoidisch, von einer mehrschichtigen, regelmafiig sechsek-
kigen Kapsel umgeben, die im Profil bikonvex ist. Durch Eisenverbindungen
inkrustiert, hellrostbraun bis dunkelbraun gefarbt. Primarschicht starker, die
weiteren Schichten nach aufien zu weniger inkrustiert. Kapseln in Form einer
grofien Wabe oder einer unregelmafiigen Kette zu Kolonien verbunden. Proto-
plasma mit konzentrierter Fuchsin-Losung leuchtend rot farbbar, wahrend die
Kapsel nur hellrot wird. Bei Farbung mit gelbem Blutlaugensalz Berliner-Blau-
Reaktion verliert die Kapsel gewohnlich ihre typische Gestalt.
Zellen im Mittel 0,5-1,0 (im grofi. Kapseln diagonal 4,4-5,5 um, an den einzel-
nen Seiten 1,8-2,0 (im lang.
In Mineralwassern mit hohem Salzgehalt, wie z. B. im «Vn'dlo» und «Mlynsky
pramen» in Karlovy Vary, (CSSR) regelmafiig anzutreffen; gleichfalls in Bitter-
wasser «Zajecicka» (CSSR) gefunden.
2. Naumanniella Dorff 1934
Zellen ellipsoidisch oder stabchenformig mit abgerundeten Enden. Einzeln, in
Verbanden oder kurzen Ketten lebend. Stabchen gerade oder leicht gekriimmt,
oft in der Mitte biskuitartig eingeschnurt. Jede Zelle mit einer kleinen, feinen,
regelmafiig geformten Kapsel, deren Aufienschichten stark mit Eisen- und
Manganoxiden impragniert sind. Mit einem ausgepragten Aufienrand (Torus).
Falls mit Eisenverbindungen impragniert, ist die Kapsel goldgelb gefarbt, bei
Mangangehalt dunkel bis schwarz und undurchsichtig. Bildet keine typischen
grofien Schleimkapseln.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Naumanniella • 475
Die Zellteilung erfolgt durch Einschnurung und verlauft simultan mit der
Teilung der impragnierten Kapsel. In eisenhaltigen Gewassern; im Schlamm
oder an seiner Oberflache eine Art auch im Erdboden.
Typus generis: Naumanniella neustonica Dorff 1934
Wichtigste Literatur: Dorff 1934, Beger 1941, 1949, Bergey's Manual 1957,
1974, Ten Chak-Man 1968, 1969.
Bestimmungsschlttssel der Arten
la Zellen deutliche Stabchen, manchmal leicht gekriimmt oder eingeschnurt . 2
lb Zellen kugelig oder ellipsoidisch
2a Zellen immer einzeln
2b Zellen in Ketten
3a Zellen einschlieftlich Torus hochstens 2,0 \im lang
3b Zellen einschlieftlichTorus linger als 3,0 (im
4a Zellen einschlieftlich Torus hochstens 3,6 fimlang
4b Zellen einschlieftlich Torus langerals 4,0 (im
5a Zellen immer ellipsoidisch, 0,7-1,0 umbreit
5b Zellen kugelig oder ellipsoidisch, 2,0-2,5 (imbreit
5
3
2. N. catenata
3. N. pygmaea
4
. 4. N. minor
1. N. neustonica
. 5. N. elliptica
N. polymorpha
1. Naumanniella neustonica Dorff 1934 (Fig. 302)
Zellen kurz stabchenformig, gerade, immer einzeln; in einer Kapsel, deren
aufiere Schicht (Torus) durch Eisenverbindungen inkrustiert ist. Nie gekriimmt,
oft jedoch eingeschnurt. In der letzten Zeit ist es gelungen, den Organismus in
eisenzitralhaltigem Medium zu kultivieren, wo er einen goldgelben Oberfla-
chenfilm und wolckchenartiges Sediment aus Eisen(III)-Hydroxid bildete.
Einschliefilich Torus 1,8-3,3 x 4,9-10,0 (im grofi.
Grofkenteils im Neuston von Gewassern mit Schlamm, seiten an submersen
Pflanzen. Urspriinglich aus Eisenquellen bei Bad Freienwalde und Stolzenhagen
in der Mark Brandenburg (DDR) beschrieben, auch bei Brisbane (Australien)
gefunden.
2. Naumanniella catenata Beger 1941 (Fig. 304)
Stabchenformige Zellen, oft leicht bogig gekriimmt. Toruswande dick, mit
Eisenoxiden impragniert. Nach der Teilung entstehen Ketten aus 3 bis 12 Zellen.
Unbeweglich, rrei schwebend.
Zellen 0,4-0,5 x 4,6-5,2 (im; einschliefilich Torus 1,0-1,2 X 4,9-5,5 \im grofi.
Recht verbreitet; im Schlamm oder an seiner Oberflache in Gewassern mit
hoherem Eisengehalt. Im Aufwuchs auf untergetauchten Deckglasern in Brun-
nen in der Umgebung von Magdeburg (DDR) gefunden.
3. Naumanniella pygmaea Beger 1949
Kleine gerade Stabchen mit abgerundeten Enden. Auf Agar mit Erdextrakt
langsam wachsend. Vermehrung nach Bergey's Manual (1974) durch Knos-
pung.
Zellen einschliefilich Torus 1,0-2,0 um grofi.
Haufig vereinzelt in Wasserleitungsrohren und Brunnen vorkommend. Auch
auf Kolonien von Zoogloea filipendula sowie in tiefen Quellen gefunden.
4. Naumanniella minor Dorff 1934 (Fig. 303)
Zellen stabchenformig, einzeln lebend; sehr oft gekriimmt, eingeschnurt oder
schraubig gewunden.
476 ■ Eisenbakterien - Naumanniella
Fig. 302. Naumanniella neustonica - Zellen mit charakteristischem, durch
Eisenverbindungen impragniertem Torus (nach Dorff, 1934. - 2500X).
Fig. 303. Naumanniella minor - verschieden geformte Zellen mit Torus (nach
Dorff, 1934 und Beger, 1941. - 2500X). Fig. 304. Naumanniella catenata-
Zellkette mit charakteristischem Torus (nach Beger, 1941. - 2500X). Fig. 305.
Naumanniella polymorpha - einige Individuen im Knospungstadium (nach
Mikrophoto umgezeichnet - Ten Chak-Mun, 1969. - 2500 x).
Zellen mit Torus 1,2-1,5 x 3,1-3,6 um grofi.
Im Benthos, im Teichschlamm und in Mooren sowie auch am Grund von
Brunnen mit eisenhaltigem Wasser, selten an Wasserpflanzen. Urspriinglich in
einem kunstlichem Teich im Park von Sanssouci bei Potsdam (DDR) und in
einem Brunnen in Worms (BRD) gefunden.
Beger (1941) beschrieb eine etwas unterschiedliche Form aus einem Brunnen in
derUmgebungvon Magdeburg (DDR). Diese war einschliefllich Torus 1,4-1,6
X 2,5-2,6 um grofi, selten gekriimmt oder eingeschnurt. Sehr selten wurden
zwischen normalen Zellen Riesenzellen beobachtet, die 1,5 um breit und bis
10,0 um lang waren.
5. Naumanniella elliptica Beger 1949
Ellipsoidische Zellen mit ausgepragtem Torus.
Zellen einschliefilich Torus 2,0-2,5 X 3,0 um grofi.
In Wasserleitungsrohren und auch in Kolonien von Crenothrix polyspora. Weit
verbreitet auf Schlammoberflachen eisenhaltiger Gewasser; auch in tiefen Quel-
len gefunden.
6. Naumanniella polymorpha Ten Chak-Mun 1969 (Fig. 305)
Zellen je nach ihrem Entwicklungsstadium kugelig oder ellipsoidisch, einzeln
lebend, polymorph. Junge Zellen mit stark lichtbrechenden Kapseln, altere
Zellen von durch Manganverbindungen impragnierten Kapseln umgeben. Im-
pragnierung der Kapsel mit Manganverbindungen in Form konzentrischer
Kreise, die sich mit der Zeit vergrofiern. Torus ausgepragt. Nach Entfernung der
Manganverbindungen durch gesattigte Oxalsaurelosung sind die Zellen mit
Gentianaviolett gut farbbar.
Mixotroph, mikroaerophil, oxydiert nur Mangan-, nicht aber
Eisenverbindungen. Auf Medien mit Humin-Fulvat-Komplex oder auf mineralischen Medien
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderococcus ■ 477
mit Mangansulfat, werden punktformige, anfangs hellgelbe, spater dunkelbrau-
ne Kolonien bis zu 1 mm Durchmesser gebildet. Die Kolonien bestehen in der
Mitte aus ellipsoidischen Zellen mit ausgepragtem Torus, der stark mit Mangan
impragniert ist, wahrend an der Peripherie der Kolonien ellipsoidische Zellen
ohne Manganablagerungen vorkommen. Diese Zellen sind beweglich und tragen
zur Verbreitung bei. Wachsen nicht auf den iiblichen Medien mit organischen
Substraten.
Mit kompliziertem Entwicklungszyklus. Die Zellen vermehren sich hauptsach-
lich durch Knospung, wobei das Plasma zunachst kornig, und die Kapsel dicker
werden, bis schliefilich ein bis zwei Risse auftreten; in diesen erscheint allmahlich
ein Knospe. Die Knospen trennen sich entweder von der Mutterzelle und bilden
zoogloeale Verbande, die an ein Stadium von Metallogenium erinnern, oder sie
bleiben an den Zellen hangen. Wenn mehrere Knospen an einer Zelle entstehen,
bleiben sie gewohnlich auch nach ihrem Absterben mit ihr verbunden. Die
abgetrennten Knospen sind spharische Zellen, die sich allmahlich mit einer stark
lichtbrechenden Kapsel umgeben. Mit der Zeit werden sie mit
Manganverbindungen impragniert, so dafi sie ihre Lichtbrechung verlieren. Ihre Form wird
dann ellipsoidisch. Vermehrung jedoch auch durch Querteilung. Junge, nicht
mit Manganverbindungen impragnierte Zellen sind beweglich.
Zellen einschliefilich Torus 0,7-1,0 x 1,0-2,0 um grofi.
Urspriinglich aus Erdboden mit hohem Mangangehalt auf Sachalin (UdSSR)
beschrieben. Spater wurde festgestellt, dafi es sich um eine Art handelt, die in
Waldboden des Fernen Ostens weit verbreitet ist. Sie ist an der Bildung von
braunen, manganhaltigen Konkretionen im Boden beteiligt.
3. Siderococcus Dorff 1934
Zellen kugelig, verhaltnismafiig klein, mit fadenformigen Anhangseln; ohne
Gallerthulle. Einzeln lebend oder kleine bewegliche Mikrokolonien bildend, die
aus 6-15 Zellen in Form eines Maiskolbens zusammengesetzt sind. Manchmal
kontinuierliche Ketten, manchmal dagegen netzartige Strukturen hervorbrin-
gend. Zellen nie durch Eisenverbindungen inkrustiert. Diese werden aufierhalb
der Zelle im umgebenden Milieu abgeschieden, so dafi altere Mikrokolonien so
stark von Eisenoxiden bedeckt sein konnen, daft die Zellen kaum zu sehen sind.
Diese orangebraunen Ablagerungen enthalten nur Eisen, nie Mangan.
Bisher wurde diese Gattung nicht im Labor gezuchtet, sondern ist nur aus dem
Freiland bekannt. Vermehrung durch Knospung, wobei die Zelle anfangs eine
birnenartige Form bekommt. Wird die Knospe sehr grofi, daft so konnte man
irrtumlich glauben, daft es sich um seine Vermehrung durch Teilung handelt.
Vermehren sich die Zellen sehr rasch und haben geniigend Zeit sich von einander
zu trennen, so entstehen Kokkenketten, zottige Faden oder andere Gebilde.
Verlauft die Knospung auch in verschiedenen Ebenen, so entstehen zoogloeale
Anhaufungen.
Zellen beweglich, Geifieln bisher nicht gefunden. Zellbreite zwischen 0,2-
0,5 um.
Siifiwasserarten, die gewohnlich an der Schlammoberflache vorkommen.
Typus generis: Siderococcus limoniticus Dorff 1934
Wichtigste Literatur: Dorff 1934, Bergey's Manual 1957, 1974, Perfiliev und
Gabe 1961, 1964, Zavarzin 1972, Kutuzova 1974.
Bestimmungsschliissel der Arten
la Kokken nur0,2-0,5 umgrofi,strenglithotroph l.S. limoniticus
lb Kokken 0,4—1,0 um groK, immer organotropn 2. S. communis
478 • Eisenbakterien - Ochrobium
1. Siderococcus limoniticus Dorff 1934
Zellen in Form von Kokken, keine Kapseln bildend. Als streng lithotrophe
Organismen verwerten sie anorganische Eisenverbindungen und lagern die
Oxydationsprodukte aufierhalb der Zelle ab. Nach Kutuzov (1974) entstehen
kapselahnliche Gebilde, in denen die Ablagerung der Eisenverbindungen statt-
findet. Diese Zone ist bei jungen Individuen zunachst durchsichtig, spater
werden der zentrale und periphere Teil kompakt und undurchsichtig. Dadurch
wird das Studium des Organismus sehr erschwert.
Junge, 15 Tage alte Kolonien enthalten 0,1-0,5 \im grofie Zellen. In Aufwiichsen
mit starker Eiseninkrustation kommt es zur Bildung sehr kleiner Partikel, die
durch Zerfall der Zellen entstehen. Diese wachsen zu dunnen Faden aus, auf
denen sich weitere kokkoide Zellen bilden. Die verzweigten Faden stellen eine
Lebensform des Organismus dar. Oft legen sich solche Faden rund um die Zellen
fremder Organismen (Parasitismus?). Daneben treten dickere Faden auf, die im
Lichtmikroskop sichtbar sind. Diese sind wahrscheinlich infolge der Knospung
neuer Individuen aufien nicht glatt. In jungen Kulturen kommen auch Metallo-
genz«m-ahnliche Formen, d. h. kleine ovale Zellen und rosenkranzartige Ketten
vor. Aufierdem gibt Zavaran (1972) an, dafi sich 8-10 Zellen des Organismus zu
beweglichen Kolonien zusammenlagern, die aktiv iiber der Sedimentoberflache
schwimmen; Geifieln wurden jedoch bisher nicht nachgewiesen.
Zellen 0,2-0,5 urn im Durchmesser.
In Sumpfen und Seen sehr verbreitet; in Limonitlagern vorkommend. Urspriing-
lich bei Freienwalde (DDR) entdeckt.
Perfiliev und Gabe (1961, 1964) stellten mit Hilfe eines Peloskops die biogene
Grundlage ihres Vorkommens auf der Oberflache des Seeschlamms fest. Sie
bilden Mikrozonen im Bereich niedriger Sauerstoffkonzentrationen bei neutra-
len pH-Werten und sind sehr empfindlich gegen Anderungen des Schlammche-
mismus.
2. Siderococcus communis Dorff 1934
Zellen in Form von Kokken oder kurzen Stabchen, einzeln lebend oder Ketten
bildend. Ohne Kapseln. Eisenablagerung stets aufierhalb den Zellen.
Organotropic organische Eisenverbindungen werden verwertet. Wachst nicht in Was-
ser, das nur anorganische Eisenverbindungen enthalt.
Zellen 0,4-1,0 um grofi.
In Gewassern mit organischen Eisenverbindungen gefunden.
Unsichere Gattungen und Arten:
4. Ochrobium Perfiliev 1921
Zellen in Form kleiner zylindrischer Stabchen, manchmal auch kantig ellipso-
idisch. Jede einzelne Zelle ist von einem grofien gelb-braun gefarbten Torus in
Form eines Hufeisens umgeben, der stark durch Eisenoxide inkrustiert ist.
Zellen oft paarweise, wobei sie mit den offenen Seiten des Torus einander
gegenuber liegen. Aufierdem sind die Zellen in eine feine hyaline Schleimkapsel
eingeschlossen, die kleine Mengen von Eisenoxid enthalt. Manchmal entstehen
Mikrokolonien von 2-8 Zellen. Am Zellpol befindet sich eine kleine Vertiefung,
aus der zwei verschieden lange polare Geifieln austreten.
Vermehrung durch Quer- oder Langsteilung, wobei Tetraden entstehen. Wah-
rend der Teilung erfolgt auch eine simultane Torusteilung. Bewegliches Stadium
mit zwei Geifieln. In eisenhaltigen Gewassern weit verbreitet. Grofkenteils am
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sideromonas • 479
Grund oder in tiefen Wasserschichten vorkommend. Gewohnlich massenhaft
auftretend, so dafi das Wasser an solchen Stellen eine deutlich gelbbraune
Farbung aufweist. Urspriinglich in Teichen in der Umgebung von Leningrad
(UdSSR), spater in der Umgebung von Berlin in Brunnen gefunden.
Wichtigste Literatur: Perfiliev 1921, Naumann 1929, Beger 1949, Krasil'nikov
1949, Bergey's Manual 1957, 1974.
Eine einzige Art:
Ochrobium tectum Perfiliev 1921 (Fig. 306)
Sideroderma limneticum Naumann 1921
Mit den Merkmalen der Gattung.
Zellen einschliefilich Torus, 0,5-3,0 X 1,5-5,0 um lang, letztererist gewohnlich
0,5-10,0 um dick. Kolonien meistens 2,5-8,0 X 5,0-10,0 um grofi.
Rein aufierlich den Algen der Gattung Pteromonas ahnlich. Wahrscheinlich keine Bakte-
rien-, sondern eine Algenart. Schon Cholodnyj (1926) wies auf diese Tatsache hin und war
der Meinung, dafi sie zu den Flagellaten zu stellen ware. Ferner nahm er an, dafi der Torus
die aufiere Hiille des Protoplasma ist, in der Eisen abgelagert wird. Nach Naumann (1921)
mit der Gattung Sideroderma identisch.
Fig. 306. Ochrobium tectum - a verschiedene Ausbildung der meist 1 bis
8-zelligen Kolonien, b starker inkrustierte Dauerstadien (nach Skuja, 1956. -
1340X).
5. Sideromonas Cholodnyj 1922
Siderocystis Naumann 1921
Zellen in Form kleiner Kokken oder kurzer Stabchen. Jede Zelle einzeln mit
einer grofien, scharf begrenzten Kapsel. Durch Teilung der Zellen kann eine
grofiere Anzahl von Zellen in der Kapsel vorkommen, wo sie dann Ketten
angeordnet sein konnen. Altere Kapseln vereinigen sich und bilden grofie
Kolonien ohne ausgepragte Begrenzung. Die Kapseln sind mit Eisen- oder
Manganverbindungen impragniert und deshalb gelbbraun bis braun gefarbt.
Unter bestimmten Umstanden beweglich. Grofkenteils an Wasserpflanzen oder
476 ■ Eisenbakterien - Naumanniella
Fig. 302. Naumanniella neustonica - Zellen mit charakteristischem, durch
Eisenverbindungen impragniertem Torus (nach Dorff, 1934. - 2500X).
Fig. 303. Naumanniella minor - verschieden geformte Zellen mit Torus (nach
Dorff, 1934 und Beger, 1941. - 2500X). Fig. 304. Naumanniella catenata-
Zellkette mit charakteristischem Torus (nach Beger, 1941. - 2500X). Fig. 305.
Naumanniella polymorpha - einige Individuen im Knospungstadium (nach
Mikrophoto umgezeichnet - Ten Chak-Mun, 1969. - 2500 X).
Zellen mit Torus 1,2-1,5 X 3,1-3,6 um grofi.
Im Benthos, im Teichschlamm und in Mooren sowie auch am Grund von
Brunnen mit eisenhaltigem Wasser, selten an Wasserpflanzen. Urspriinglich in
einem kiinstlichem Teich im Park von Sanssouci bei Potsdam (DDR) und in
einem Brunnen in Worms (BRD) gefunden.
Beger (1941) beschrieb eine etwas unterschiedliche Form aus einem Brunnen in
der Umgebung von Magdeburg (DDR). Diese war einschliefilich Torus 1,4-1,6
X 2,5-2,6 um grofi, selten gekriimmt oder eingeschniirt. Sehr selten wurden
zwischen normalen Zellen Riesenzellen beobachtet, die 1,5 um breit und bis
10,0 um lang waren.
5. Naumanniella elliptica Beger 1949
Ellipsoidische Zellen mit ausgepragtem Torus.
Zellen einschliefilich Torus 2,0-2,5 X 3,0 um grofi.
In Wasserleitungsrohren und auch in Kolonien von Crenothrix polyspora. Weit
verbreitet auf Schlammoberflachen eisenhaltiger Gewasser; auch in tiefen Quel-
len gefunden.
6. Naumanniella polymorpha Ten Chak-Mun 1969 (Fig. 305)
Zellen je nach ihrem Entwicklungsstadium kugelig oder ellipsoidisch, einzeln
lebend, polymorph. Junge Zellen mit stark lichtbrechenden Kapseln, altere
Zellen von durch Manganverbindungen impragnierten Kapseln umgeben. Im-
pragnierung der Kapsel mit Manganverbindungen in Form konzentrischer
Kreise, die sich mit der Zeit vergrofiern. Torus ausgepragt. Nach Entfernung der
Manganverbindungen durch gesattigte Oxalsaurelosung sind die Zellen mit
Gentianaviolett gut farbbar.
Mixotroph, mikroaerophil, oxydiert nur Mangan-, nicht aber
Eisenverbindungen. Auf Medien mit Humin-Fulvat-Komplex oder auf mineralischen Medien
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderococcus ■ 477
mit Mangansulfat, werden punktformige, anfangs hellgelbe, spater dunkelbrau-
ne Kolonien bis zu 1 mm Durchmesser gebildet. Die Kolonien bestehen in der
Mitte aus ellipsoidischen Zellen mit ausgepragtem Torus, der stark mit Mangan
impragniert ist, wahrend an der Peripherie der Kolonien ellipsoidische Zellen
ohne Manganablagerungen vorkommen. Diese Zellen sind beweglich und tragen
zur Verbreitung bei. Wachsen nicht auf den iiblichen Medien mit organischen
Substraten.
Mit kompliziertem Entwicklungszyklus. Die Zellen vermehren sich hauptsach-
lich durch Knospung, wobei das Plasma zunachst kornig, und die Kapsel dicker
werden, bis schliefilich ein bis zwei Risse auftreten; in diesen erscheint allmahlich
ein Knospe. Die Knospen trennen sich entweder von der Mutterzelle und bilden
zoogloeale Verbande, die an ein Stadium von Metallogenium erinnern, oder sie
bleiben an den Zellen hangen. Wenn mehrere Knospen an einer Zelle entstehen,
bleiben sie gewohnlich auch nach ihrem Absterben mit ihr verbunden. Die
abgetrennten Knospen sind spharische Zellen, die sich allmahlich mit einer stark
lichtbrechenden Kapsel umgeben. Mit der Zeit werden sie mit
Manganverbindungen impragniert, so dafi sie ihre Lichtbrechung verlieren. Ihre Form wird
dann ellipsoidisch. Vermehrung jedoch auch durch Querteilung. Junge, nicht
mit Manganverbindungen impragnierte Zellen sind beweglich.
Zellen einschliefilich Torus 0,7-1,0 X 1,0-2,0 um grofi.
Urspriinglich aus Erdboden mit hohem Mangangehalt auf Sachalin (UdSSR)
beschrieben. Spater wurde festgestellt, dafi es sich um eine Art handek, die in
Waldboden des Fernen Ostens weit verbreitet ist. Sie ist an der Bildung von
braunen, manganhaltigen Konkretionen im Boden beteiligt.
3. Siderococcus Dorff 1934
Zellen kugelig, verhaltnismafiig klein, mit fadenformigen Anhangseln; ohne
Gallerthulle. Einzeln lebend oder kleine bewegliche Mikrokolonien bildend, die
aus 6-15 Zellen in Form eines Maiskolbens zusammengesetzt sind. Manchmal
kontinuierliche Ketten, manchmal dagegen netzartige Strukturen hervorbrin-
gend. Zellen nie durch Eisenverbindungen inkrustiert. Diese werden aufierhalb
der Zelle im umgebenden Milieu abgeschieden, so dafi altere Mikrokolonien so
stark von Eisenoxiden bedeckt sein konnen, da/5 die Zellen kaum zu sehen sind.
Diese orangebraunen Ablagerungen enthalten nur Eisen, nie Mangan.
Bisher wurde diese Gattung nicht im Labor geziichtet, sondern ist nur aus dem
Freiland bekannt. Vermehrung durch Knospung, wobei die Zelle anfangs eine
birnenartige Form bekommt. Wird die Knospe sehr grofi, dafi so konnte man
irrtiimlich glauben, dafi es sich um seine Vermehrung durch Teilung handelt.
Vermehren sich die Zellen sehr rasch und haben geniigend Zeit sich von einander
zu trennen, so entstehen Kokkenketten, zottige Faden oder andere Gebilde.
Verlauft die Knospung auch in verschiedenen Ebenen, so entstehen zoogloeale
Anhaufungen.
Zellen beweglich, Geifieln bisher nicht gefunden. Zellbreite zwischen 0,2-
0,5 um.
Sufiwasserarten, die gewohnlich an der Schlammoberflache vorkommen.
Typus generis: Siderococcus limoniticus Dorff 1934
Wichtigste Literatur: Dorff 1934, Bergey's Manual 1957, 1974, Perfiliev und
Gabe 1961, 1964, Zavarzin 1972, Kutuzova 1974.
Bestimmungsschliissel der Arten
la Kokkennur0,2-0,5 urngroft,strenglithotroph l.S.limoniticus
lb Kokken 0,4-1,0 umgroCimmerorganotroph 2. S. communis
480 • Eisenbakterien - Sideromonas
Fadenalgen (der Gattung Cladophora) festhaftend, wo sie gallertige, gelbe oder
rostbraune polsterformige Agglomerate bilden, die meistens Eisen(III)Hydro-
xid enthalten.
Wenig bekannte Organismen, deren weiteres Studium erforderlich ist.
Typus generis: Sideromonas confervarum Cholodnyj 1922
Wichtigste Literatur: Cholodnyj 1922, 1926, 1953, Naumann 1929, Beger
1957, Bergey's Manual 1957.
Bestimmungsschliissel der Arten
la Zellen in Form von Kokken oder sehr kurzen Stabchen, hochstens 1,0 [xm
lang. Kapseln an griinen Sufiwasseralgen festhaftend . . 1. S. confervarum
lb Zellen stabchenformig 2
2a Kurze Stabchen, hochstens 1,5 [imlang 2. S. major
2b Stabchen 2,5 \im lang oder langer 3
3a Stabchen ungefahr 2,5 urn lang, jede Zelle mit einer selbstandigen Kapsel . . .
3. S. vulgaris
3b Stabchen ungefahr 3 \im lang. In den Kapseln meistens zwei paarweise
angeordnete Zellen 4. S. duplex
1. Sideromonas confervarum Cholodnyj 1922 (Fig. 307)
Kokken oder kurze Stabchen, die zu Ketten vereinigt in einer Schleimmasse
(Kapsel) liegen. Die aus 4 bis 10 Zellen bestehenden Ketten werden nach
Auflosung der Eisenverbindungen mit Salzsaure und nach Farbung mit Gentia-
naviolett oder Karbolfuchsin sichtbar. Die Eisenverbindungen sind im Schleim
der Kapseln abgelagert. Die Kapseln haften an den Faden mancher
Sufiwasseralgen (z. B. Tribonema, Oedogonium, Mougeotia u. a.). Wahrscheinlich fakulta-
tiv autotroph. Unbeweglich.
Zellen 0,5-0,6 X 0,8-1,0 \im, Kapseln bis zu 100 \im grofi.
In stark eisenhaltigen Gewassern meist an fadenformigen Griinalgen oder Xan-
thophyceen, wo sie gallertartige, kissenformige, gelb oder rostbraun gefarbte
Aufwuchse bilden. Diese Gebilde wurden urspriinglich in der Algologie mit dem
Namen «Psichohormium» bezeichnet und ihre Entstehung durch Verschleimung
der Zellwand der Algen erklart. Die Zellen der Wirtsalge verandern sich ge-
wohnlich, ihr Chlorophyllgehalt wird grofier, sie sind dunkelgriin gefarbt und
enthalten mehr Reservestoffe. Manchmal vergrofiert sich auch ihr Volumen,
wodurch sie Akineten ahnlich werden. Auf Mougeotia sind diese Gebilde mehr
zylindrisch.
2. Sideromonas major (Naumann 1921) Beger 1957 (Fig. 308)
Siderothece major Naumann 1921, Siderothece minor Naumann 1921, Siderocy-
stis minor Naumann 1921
Zellen in Form von Stabchen. Jede Zelle mit einer grofien primaren Kapsel, die
sich spater auflost, wodurch eine Zoog/oea-artige Masse mit unregelmafiig
angeordneten Zellen entsteht. Die Eisenverbindungen werden in der primaren
Kapsel abgelagert. Zellen aerob und autotroph.
Stabchen 0,5-1,5 X 1,0-1,5 |xm grofi. Zoogloea-znige Gebilde erreichen
Grofien bis zu 10,0 [im.
In sumpfigen Graben, in Flufiwasser, Brunnen, Graben und Wasserleitungsroh-
ren, wo sie harte Inkrustationen bilden. Urspriinglich in der Gegend von
Aneboda (Schweden) als Ablagerungen auf untergetauchten Objekten im
Schlamm oder Flufiwasser gefunden.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sideromonas • 481
Fig. 307. Sideromonas confervarum - Algenfaden, auf dessen Oberflache sich
eine gallertige Kolonie befindet, die sowohl aus einzelnen Zellen als auch kurzen
Ketten zusammengesetzt ist {a nach Dorff, 1934; b nach Cholodnyj, 1926. -
1340X).
3. Sideromonas vulgaris (Naumann 1921) Beger 1957 (Fig. 309)
Siderocystis vulgaris Naumann 1921
Stabchen schlank, primare Kapseln bildend, die mit Eisenverbindungen impra-
gniert sind; spater losen sie sich auf, die Zellen verteilen unregelmSfiig in der
Schleimmasse. Altere Stadien bilden Zoogloea-anige Massen. Autotroph.
Zellen 0,5 X 2,5 \n,m grofi, Zoog/oe<*-artige Gebilde bis 7,5 |xm breit.
Als Uberziige an untergetauchten Objekten in Bachen und kleinen Fliissen.
Urspriinglicn als Filmbewuchs in Graben und Flufiwasser in der Gegend von
Aneboda gefunden (Schweden).
482 • Eisenbakterien - Sideromonas
Fig. 308. Sideromonas major - schematisiert - a eine urspriinglich als Siderothe-
ca major beschriebene Form, b als Siderotheca minor beschriebene Form, c als
Siderocystis minor beschriebene Form (nach Naumann, 1921. - 1340X).
Fig. 309. Sideromonas vulgaris - schematisiert (nach Naumann, 1921. - 1340X).
Fig. 310. Sideromonas duplex - schematisiert (nach Naumann, 1921. - 1340X).
Fig. 311. Sideronema globulifera - (nach Beger, 1951 und Schwers, 1908. -
1340X).
4. Sideromonas duplex (Naumann 1921) Beger 1957 (Fig. 310)
Siderocystis duplex Naumann 1921
Stabchen schlank, mit abgerundeten Enden, paarweise, manchmal auch einzeln
vorkommend. Von einer Kapsel umgeben, die an Zoog/oea-artige Gebilde
erinnert. Eisenverbindungen werden im Schleim der Kapseln abgelagert. Unbe-
weglich.
Zellen 0,5-1,5 X 3,0 [im grofi-
An untergetauchten Gegenstanden in Siimpfen, Graben und kleinen fliefienden
Gewassern.
Unterschiede zwischen dieser Art und Ferrihacterium duplex nur sehr gering. Es
ist moglich, dafi beide Arten identisch sind.
In der Gegend von Aneboda (Schweden) gefunden und von dort beschrieben.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Sideronema - Ferrihacterium • 483
6. Sideronema Beger 1941
Eine sehr wenig bekannte Gattung, deren weitere Untersuchung erforderlich ist.
Wichtigste Literatur: Beger 1941
Eine einzige Art:
Sideronema globulifera Beger 1941 (Fig. 311)
(non Sideronema globuliferum Beger 1941)
Zellen in Form von Kokken oder ovoid, kurze Ketten von 3-8 Zellen bildend,
die in eine dicke scheidenartige Schleimkapsel eingeschlossen sind, in der sie
mehr oder weniger voneinander entfernt liegen. Zellwand mit viel Eisenhydro-
xid und daher tief rostrot oder braun gefarbt. Kapsel praktisch ohne Eisenhydro-
xid und deshalb hell. Unbeweglich.
Zellen 4,8-5,0 X 6,5 \im grofi, Kapseln bis 1,6 \un dick.
Im Plankton eisenhaltiger Gewasser frei schwebend. Sehr verbreitete Art.
Urspriinglich auf submersen Deckglasern in 8-9 m tiefen Brunnen in der
Umgebung von Magdeburg (DDR) gefunden. Wurde schon friiher von Schwers
(1908) beschrieben, jedoch fur eine Form von Gallionella ferruginea gehalten.
7. Ferribacterium Brussoff 1916
Sideroderma Naumann 1921
Stabchen mit abgerundeten Enden, gewohnlich paarweise oder in kurzen Ketten
angeordnet, manchmal auch einzeln lebend. Gelegentlich beweglich, wahr-
scheinlich mit Hilfe polarer Geifieln. Meistens leben die Zellen in Schleimkap-
seln, die mit Eisenverbindungen impragniert sind. In eisen- und manganhaltigen
Gewassern. Auf der Wasseroberflache einen Film bildend.
Typus generis: Ferribacterium duplex Brussoff 1916
Wichtigste Literatur: Brussoff 1916, 1918, Neumann 1921, de Rossi 1927,
Skuja 1936, Bergey's Manual 1957, Hausler 1972, Svorcova 1975a, 1975b.
Bestimmungsschlussel der Arten
la Zellen ausgesprochen stabchenformig mit abgerundeten Enden 2
lb Zellen ellipsoidisch 4
2a Im Schleim der Kapseln nur Eisen- und Manganverbindungen vorhanden . 3
2b Im Schleim der Kapseln neben Eisen- und Manganverbindungen auch Kal-
ziumverbindungen vorkommend 2. F. calceum
3a Zellen schlank, nur 0,5 fimdick 3. F. rectangulare
3b Zellen mehr als 1,0 [im dick 1. F. duplex
4a Zellen bis 1,0 \un lang 4. F. dubium
4b Zellen 3,5 (im lang 5. F. gracilis
1. Ferribacterium duplex Brussoff 1916
Sideroderma duplex (Brussoff 1916) Naumann 1921, Bacterium duplex (Brussoff
1916), de Rossi 1927
Stabchen mit abgerundeten Enden, in Gallertkapseln, einzeln oder meistens
paarweise vorkommend. Manchmal kurze Ketten bildend. Ohne Sporen.
Gallertkapseln diinn, oft von Eisenverbindungen umgeben; Kapsel oft so diinn, dafi
es scheint, als ob das Eisen an der Zelloberflache abgelagert ware. Die biochemi-
schen Vorgange bei der Ablagerung der Eisenverbindungen sind nicht bekannt.
Cholodnyj (1926) nimmt an, dafi die physiologische Aktivitat des Organismus
484 • Eisenbakterien - Ferribacterium
hierbei keine Rolle spielt. Gramnegativ. Vermehrung durch Teilung. Unbeweg-
lich.
Zellen sowie die Gallertkapseln meistens 1,2 x 2,5-5,0 ^m grofi.
In Sedimenten eisenhaltiger Gewasser, in Leitungswasser oder eisenhaltigen
Quellen. Urspriinglich im Leitungswasser der Stadt Wroclav (Polen) gefunden.
Dorff (1934) stellt diese Art zu Ferribacterium rectangulare.
2. Ferribacterium calceum Brussoff 1918
Siderobacter calceum (Brussoff 1918) Naumann 1921, Bacillus calceus (Brussoff
1918) de Rossi 1927
Zellen stabchenformig, einzeln, zu zweit und zu dritt vorkommend; manchmal
in kurzen Ketten. Sporenbildung bekannt. Fur das Wachstum sind organische
Substanzen erforderlich. Zusammmen mit Eisenverbindungen werden auch
Kalziumsalze gespeichert. Eisen- und Manganverbindungen werden nur in den
Zellen abgelagert, die sich am Wasserspiegel befinden; in der Tiefe erfolgt keine
Eisenspeicherung. In jungen Kulturen haben die eisenspeichernden Zellformen
sehr regelmafiige Konturen, in alteren Kulturen hingegen ganz unregelmafiige.
Fortpflanzung durch Teilung. Beweglich.
Zellen 5,0-7,8 x 0,8 \xm grofi.
Siifiwasserart; urspriinglich in biologisch gereinigten stadtischen Abwassern
gefunden.
3. Ferribacterium rectangulare (Naumann 1921)
Beger 1957 (Fig. 312)
Sideroderma rectangulare Naumann 1921, Sideroderma tenue Naumann 1921
Zellen stabchenformig mit abgerundeten Enden, paarweise in Gallertkapseln.
Eisenverbindungen lagern sich an der Kapseloberflache ab. Die chemischen
Vorgange bei der Ablagerung dieser Stoffe sind nicht bekannt. Fortpflanzung
durch Teilung.
Zellen 3,0 X 0,5 \im grofi.
Siifiwasserart; in schlammhaltigen Graben und kleinen Wasserlaufen
vorkommend.
Beger (1957) stellt Sideroderma tenue zu Ferribacterium rectangulare.
312
313
Fig. 312. Ferribacterium rectangulare - a schematisiert (nach Naumann, 1921. -
1340x), b als Sideronema tenue beschriebene Form; grofieres Exemplar mit
starker Inkrustierung (nach Naumann, 1921. - 1340X). Fig. 313. Ferribacterium
gracilis - ovale Zellen unregelmafiige Ketten bildend, in Gallertkapsel mit
Eisenverbindungen eingeschlossen (nach Svorcova, 1975. - 1340X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderobacter • 485
4. Ferribacterium dubium (Skuja 1956) Hausler 1972 (Fig. 314)
Sideroderma dubium Skuja 1956
Zellen klein, kurz ellipsoidisch, einzeln, meist jedoch in Zweiergruppen, selten
in Tetraden oder in Gruppen von 8 Zellen lebend. Von einer Gallertkapsel
umgeben, die durch Eisenverbindungen gelb bis braun gefarbt ist. Die Mitte der
Kapsel bleibt hyalin. Oberflache der Kapsel uneben, hart. Kolonien oval.
Protoplasma hyalin, homogen oder mit feinen Granula. Fortpflanzung durch
Teilung. Zellen sowie Mikrokolonien unbeweglich.
Zellen ungefahr 0,4 X 0,5-1,0 \im, Kolonien 3,0-5,0 X 4,0-12,0 \im grofi.
Gallertkapsel gewohnlich 1,0-2,0 u, breit.
Im Siifiwasserplankton und -benthos. Skuja (1956) ordnete diese Art proviso-
risch in die Gattung Sideroderma ein.
Fig. 314. Ferribacterium dubium - Zellpaare in Kapseln eingeschlossen, die
unterschiedlich grofie Kolonie-Agglomerate bilden (nach Skuja, 1956.- 1340X).
5. Ferribacterium gracilis Svorcova 1975 (Fig. 313)
Stabchen oval mit abgerundeten Enden, meist unregelmafiige Ketten bildend, in
denen oft eine Zelle senkrecht zu den anderen orientiert ist. Zellen von einer
Gallertkapsel umgeben, in der Eisenverbindungen enthalten sind. Auf speziellen
Nahrboden werden strahlenartige, rostfarbene, rauhe Kolonien mit leicht ver-
tiefter Mitte gebildet.
Zellen 0,3-0,5 X 3,5 \im grofi.
In Mineralwassern mit hoherem Salzgehalt. In den Karlsbader Quellen und im
«Zajecicka»-Bitterwasser (CSSR) gefunden.
8. Siderobacter Naumann 1921
Zellen stabchenformig, mit abgerundeten Enden. Grofitenteils paarweise oder in
kurzen Ketten vorkommend; manchmal Kolonien bildend. Ohne Kapseln.
Eisen- und Manganverbindungen lagern sich an der Zelloberflache oder
eventual in der Zellwand ab. Es wurden bewegliche Stadien mit Geifieln beschrieben.
In neutralen oder alkalischen Gewassern vorkommend. Wenig bekannte Orga-
nismen, deren weiteres Studium notwendig ist.
Typus generis: Siderobacter linearis Naumann 1921
Wichtigste Literatur: Naumann 1921, Beger 1949
Bestimmungsschlussel der Arten
la Zellen scnmaler als 1,0 u.m an der Oberflache von Zoogloeen lebend 2
lb Zellen 1,0 \im breit oder breiter 3
Teil X. Addendum
Dieser Teil umfafit Organismen, die sich nach den gegenwartigen taxonomi-
schen Kriterien sehr schwierig einreihen lassen. Es handelt sich meistens um
ungenau oder unzureichend beschriebene, wenig bekannte Organismen oder um
Organismen mit unklarer oder unrichtiger taxonomischer Einordnung in die
betreffende Gattung. In manchen Fallen ist die Zugehorigkeit zur Klasse «Schi-
zomycetes» problematisch. Die meisten sind in Bergey's Manual (1957, 1974)
nicht angefiinrt; sie sind vornehmlich in verschiedenen limnologiscnen Werken
zu finden.
Gattungen unsicherer taxonomischer Stellung:
1. Blastococcus Ahrens et Moll 1970
Pleomorph, grampositiv. Zellen einzeln, beweglich, schwach gebogen; an Vi-
brionen erinnerna. Verschieden grofi. Mit einer Geifiel. Grofiere, stabchenfor-
mige bis ellipsoidische, unbewegliche Formen sind oft durch 1-4 Scheidewande
unterteilt; an den Scheidewanden nicht eingeschniirt. Eine Reihe von Individuen
tragt 1-6 knospende Tochterzellen, die die Gestalt von Vibrionen haben und an
verschiedenen Stellen der Mutterzellen festsitzen. Der Form nach sind sie mit
den einzeln vorkommenden Zellen identisch. Eine weiterer Zelltyp sind kokkoi-
de Zellen, die stark lichtbrechend, kompakte, dreidimensionale Aggregate bil-
den, die an Molekul-Modelle organischer Substanzen erinnern. Aggregate unbe-
weglich; auf ihren Knospen ebenfals vibrionenartige Tochterzellen. Mitunter
kommen kleine Kokken auch einzeln vor. Grofiere selbstandige Kokken sind
ohne sichtbare Einschniirung rechtwinklig oder radial durch Scheidewande
unterteilt. Vibrionenartige, Einzelzellen wachsen zu stabchenformigen Aggre-
gaten heran, diese sodann weiter zu Aggregaten von Kokken. Zwischen den
einzeln morphologischen Formen existieren alle Ubergange. Tochterzellen
(Knospen) entstehen massenhaft namentlich in jungen Kulturen. Aufier den
Tochterzellen besitzen alle Formen eine Schleimkapsel. Zytoplasma fein granu-
liert, Ektoplasma gewohnlich heller, mit einem rosfarbenen Pigment (offensicht-
lich ein Karotinoid).
Heterotroph, aerob und mikroaerophil. Oxidativ Sauren und Gas aus Glukose
und weiteren Kohlenhydraten bildend. Zersetzt keine Zellulose. Verwertet
Pepton als Kohlenstoff- und Stickstoffquelle. Gelatine wird nicht verfliissigt.
Fur das Wachstum ist eine Optimaltemperatur von 25 °C erforderlich. Bei
3 °C Wachstum sehr langsam, bei 40 °C begrenzt. Mit steigender Temperatur
verlauft die Entwicklung von beweglichen Zellen zu kokkenartigen Formen.
Braucht zum Wachstum 1% Salz, gedeiht jedoch auch im Siifiwasser. Maximale
Salzkonzentration 5%. In anorganischen Medien nicht wachsend. Auf Pepton
und Hefeextrakt enthaltendem Agar werden rosafarbene, kleine, glasige, mafiig
getrubte, kugelige Kolonien gebildet, die nach dreiwochiger Kultur dunkelrosa,
getriibt und nocnstens 1 mm grofi werden. Die glanzende Oberflache erinnert an
Organenschale. In fliissigen Medien ist die Triibung direkt proportional der
Menge von beweglichen Zellen; mehrzellige Aggregate bilden am Boden ein rosa
gefarbtes flockiges Sediment.
Bisher nur einmal in Meerwasser gefunden.
Wichtigste Literatur: Ahrens und Moll 1970.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Epicystopsis • 489
Eine einzige Art:
Blastococcus aggregatus Ahrens et Moll 1970 (Fig. 317)
Mit den Merkmalen der Gattung.
Bewegliche vibrioartige Zellen, gewohnlich 0,3-1,5 X 0,5-3,0 |xm grofi. Stab-
chenformige Zellen 1,2-1,5 X 1,5-3,0 |xm. Kokken gewohnlich 1,2-1,5 |xm im
Durchmesser, durch Scheidewande geteilte Kokken 2,0-2,5 |xm.
Aus Meerwasser mit 1,8% Salzgehalt von der Station Breitgrund (westliche
Ostsee) isoliert.
Systematische Stellung vollig ungeklart. Ahnelt den Gattungen Myxococcus
sowie Micrococcus oder Sarcina, auch Mycobacterium tetragenum.
Fie. 317. Blastococcus aggregatus - Entwicklungsgang schematisch. Schwarm-
zellen wachsen zu Stabchenformen heran; diese bilden durch Knospung neue
Schwarmzellen aus. Stabchenformen schwellen zu Kokkenformen an. Durch
Teilung in verschiedenen Ebenen entstehen vielzellige Kokkenaggregate (nach
Ahrens und Moll, 1970. - 1340X).
2. Epicystopsis Skuja 1956
Zellen kokkenformig oder in Form kurzer ovaler Stabchen. Kugelige oder
ellipsoidische Kolonien bildend, die mit einer diinnen, hyalinen, manchmal
schwach gelblichen Gallertkapsel umgeben sind. Die Gallerte zwischen den
Zellen kann gelegentlich schwach gefarbt sein.
Fortpflanzung durch Platzen der Gallerthiille der Kolonie, wodurch die
beweglichen kokkenartigen Zellen frei werden.
Die Kolonien und die in ihnen befindlichen Zellen sind unbeweglich. Nur in der
Vermehrungsperiode sind die Tochterzellen mit Hilfe einer Geifiel aktiv
beweglich.
Kolonien entstehen auf verschiedenen Planktonalgen, am haufigsten auf
Microcystis aeruginosa.
Wichtigste Literatur: Skuja 1956.
Eine einzige Art:
Epicystopsis synplanctica Skuja 1956 (Fig. 318)
Mit den Merkmalen der Gattung.
Kugelformige Kolonien 10,0-20,0 (xm, manchmal bis 50 (xm breit. Einzelne
Zellen 0,6-0,7 X 1,0 um grofi. Gallertkapsel 1,0 (xm dick.
Im See Norrviken (Schweden) gefunden.
Obwohl die systematische Stellung dieses Organismus unklar ist, ordnet ihn
Skuja (1956) in die Nahe der Gattung Zoogloea ein und empfiehlt, aus diesen
beiden Gattungen eine neue Familie Zoogloeaceae zu bilden.
486 ■ Eisenbakterien - Siderobacter
2a Zellen 0,5 umbreitoderschmaler 2. S. gracilis
3a Zellen durchschnittlich 1,0 [imbreit 1. S. linearis
3b Zellen breiter als 1,0 \im 4
4a Zellen paarweise, 1,5 \im im Durchmesser 4. S. duplex
4b Zellen 2,5 fim breit, harte, mikroskopisch sichtbare Sedimente bildend
5. S. latum
1. Siderobacter linearis Naumann 1921 (Fig. 315)
(non Siderobacter lineare Naumann 1921)
Zellen einzeln, stabchenformig, ohne Kapseln. Eisen wird an der Zelloberflache
abgelagert.
Zellen 1,0 x 5,0 \im, mit den eisenhaltigen Ablagerungen 1,2 x 7,0 \m\ grofi.
An untergetauchten Gegenstanden oder am Wasserspiegel stehender Gewasser
vorkommend.
II
315 316
Fig. 315. Siderobacter linearis - schematisiert (nach Naumann, 1921. - 2000X).
Fig. 316. Siderobacter duplex - schematisiert (nach Naumann, 1921. - 2000x).
2. Siderobacter gracilis Beger 1949
Zellen stabchenformig, meist frei und einzeln. Oft mit eisenhaltigen Inkrustatio-
nen bedeckt.
Zellen 0,4 X 3,0 \im, mit den Eiseninkrustationen 5,0-7,0 \im grofi.
Eisenhaltige Lager und dicke Ablagerungen in Brunnen, Sandfiltern u. a.
bildend. Oft auch an der Oberflache von Zoogloea filipendula gefunden.
Moglicherweise mit Siderobacter duplex identisch.
3. Siderobacter brevis Beger 1949
(non Siderobacter breve Beger 1949)
Zellen gewohnlich einzeln, Eisenlager bildend.
Zellen 0,8-1,0 x 3,0-4,0 \im grofi.
An der Oberflache von Zoogloea filipendula, oft auch auf Sandfiltern in Wasser-
werken.
4. Siderobacter duplex Naumann 1921 (Fig. 316)
Zellen stabchenformig, immer paarweise angeordnet.
Zellen ohne Inkrustationen 1,5 X 3,5 \im grofi.
Am Wasserspiegel von Siimpfen und kleinen Wasserlaufen.
Unsichere Art, deren weitere Untersuchungen erforderlich ist. Moglicherweise
mit Siderobacter gracilis identisch.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Siderobacter • 487
5. Siderobacter latum Beger 1949
(non Siderobacter latus Beger 1949)
Zellen gerade, manchmal mafiig gekrummt. Gewohnlich einzeln lebend, 2 5 x
6,0-15,0 |im grofi.
Eisen- und kalkhaltige Ablagerungen bildend, auch in kalten Gewassern und
tiefen Brunnen.
490 • Addendum - Gigantomonas
°0
Q> 0 0 00 £
Fig. 318. Epicystopsis synplantica - a Kolonie auf der Gallerthiille von
Microcystis aeruginosa festsitzend, b altere Kolonie bei der Entlassung von Schwarmern
(nachSkuja, 1956.- 1340X).
3. Gigantomonas Utermohl 1922
Zellen grofi, kurz, dick, zylindrisch, an beiden Enden abgerundet. Beweglich,
mit einer an lebenden Zellen schlecht sichtbaren polaren Geifiel. Protoplasma
hyalin, homogen bis grobkornig, oft mit zahlreichen Granula von Reservestof-
fen von nicht naher bestimmter Zusammensetzung. An einem Pol, gewohnlich
am geifieltragenden, ist das Plasma von der Zellwand zuriickgezogen, so dafi eine
konvex-konkave Hohlung (Vakuole?) entsteht. In grofieren Tiefen in Siifiwas-
serseen vorkommend. Systematische Stellung problematisch. Die Organismen
wurden nicht in Reinkulturen geziichtet; sie sind nur aus dem Freiland bekannt
und nur nach morphologischen Merkmalen beschrieben worden. Das Haupt-
merkmal - Protoplast von der Wand zuriickgezogen - kann, besonders bei der
Typusart, auch ein Artefakt oder die Reaktion auf eine Veranderung des
osmotischen Druckes sein.
Typus generis: Gigantomonas cucullata Utermohl 1922.
Wichtigste Literatur: Utermohl 1922, Koppe 1924, Vetter 1937, Huber -
Pestalozzi 1938, Skuja 1956, 1964.
Die Gattung umfafit nur zwei Arten:
1. Gigantomonas cucullata Utermohl 1922 (Fig. 319)
Zellen in Form machtiger, breiter Stabchen. Gerade oder leicht gebogen; am
begeifielten Ende oft leicht verjiingt, an den Polen abgerundet. Eine einzige
Geifiel, ohne spezielle Farbung schlecht sichtbar, ebenso lang oder langer als die
Zelle. Protoplasma gewohnlich farblos, schwach grau oder schwach graugrun,
mit zahlreichen feinen sowie auch grofieren Kornern, die vor allem im Vorderteil
oder in der Mitte der Zelle angehauft sind; durch optischen Kontrast erscheinen
die Korner schwach braun gefarbt. Plasma gewohnlich an einem Pol von der
Zellwand zuriickgezogen, so dafi ein Hohlraum ents^tt.
Scanned &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Gigantomonas • 491
Fortpflanzung durch Einschniirung in der Zellmitte. Bewegung mit Hilfe einer
polaren Geifiel sehr kraftig.
Zellen 4,0-6,0 |xm breit und bis 10,0-23,0 [im lang.
In grofieren Tiefen im Siifiwasserplankton, besonders in den Winter- oder
Friinjahrsmonaten in Waldtiimpeln vorkommend. Urspriinglich im Krummen
See (DDR) gefunden. Vetter (1937) beschreibt einen Fund im Schleimsee
(DDR); Skuja (1956) fand sie oft in den skandinavischen Seen.
Fig. 319. Gigantomonas cucculata - an einem Pol eines Exemplars ist das Plasma
zuriickgezogen, so dafi hier ein Hohlraum entsteht (nach Skuja, 1956. - 1340X).
Fig. 320. Gigantomonas capitata - am Apikalpol der Zelle ist eine grofie
Gasvakuole vorhanden, die die Zelle kopfig verbreitet (nach Skuja, 1964. -
1200X).
2. Gigantomonas capitata Skuja 1964 (Fig. 320)
Zellen zylindrisch, an beiden Enden abgerundet. Sehr haufig ist der Apikalteil
der Zelle gleichmafiig kopfig verbreitert. Basalteil gewohnlich mafiig verjiingt,
mit asymmetrisch abgerundetem Scheitel; dort mit einer Geifiel oder mit einem
Geifielbiindel, die schon an lebendem Material gut sichtbar sind. Geifiel kiirzer
als die Zelle. Blepharoblast seicht im Protoplasma gelagert.
Plasma verhaltnismafiig djfbf, farblos, fein eranuliert: mitunrer mir -.;»~i:-i.
492 • Addendum - Hyalosoris - Krassilnikov|
grofien Granula von Reservestoffen, die besonders an der Peripherie der Zelle
verteilt sind. Oben, unterhalb des Apikalscheitels befindet sich sehr haufig eine
grofie Gasvakuole (?), die diesen Teil der Zelle verbreitert. Vakuole meist
konvex-konkav, stark lichtbrechend, rotlich glanzend. Es kommen jedoch auch
Zellen ohne Vakuolen vor. Mitunter werden auch Zellen mit zwei symmetri-
schen Vakuolen gefunden. Bei der Vermehrung schniirt sich die Zelle in der
Mitte durch; es entstehen zwei etwa gleich grofie Tochterzellen. Verhaltnisma-
fiig schnell beweglich; um die Langsachse rotierend.
Zellen 1,7-2,0 [im breit und 4,0-12,0 urn lang.
Im Hypolimnion von Siifiwasserseen vorkommend. Bislang in den schwedi-
schen Seen in der Umgebung von Abisko und in Finnland gefunden und von dort
beschrieben.
4. Hyalosoris Skuja 1956
Zellen in Form von Kokken, vor der Teilung langlich werdend. Unregelmafiige,
mikroskopische, im Wasser frei schwebende und von einer gemeinsamen Gal-
lertkapsel umgebene Kolonien bildend. Junge Kolonien dicht, kugelformig oder
elliptisch; altere unregelmafiig mit runden Hohlungen oder netzartig gerormt.
Protoplasma farblos, grofie Korner und in der Zellmitte haufig eine Gasvakuole
enthaltend, die unscharf begrenzt und wenig deutlich ist. Teilungen in drei
zueinander senkrecht stehenden Ebenen. Fortpflanzung oft auch durch Zerfall
der Kolonie in zwei oder mehrere Fragmente. Nicht aktiv beweglich. Im
Hypolimnion von Siifiwasserseen vorkommend.
Wichtigste Literatur: Skuja 1956.
Eine einzige Art:
Hyalosoris lamprocystoides Skuja 1956 (Fig. 321).
Mit den Merkmalen der Gattung.
Kokkenformige Zellen im Durchmesser 1,0-1,5 um; Kolonien 20-150 umgrofi;
Gallerthiille der Kolonie gewohnlich 10,0 \im dick. Urspriinglich in 10-20 m
Tiefe im See Lushavet (Scnweden) gefunden. Morphologisch an Blaualgen der
Gattung Microcystis oder an purpurfarbene Schwefelbakterien der Gattung
Lamprocystis erinnernd.
Gorlenko und Lokk (1979) fanden einen ahnlichen Organismus, jedoch mit dem Charakter
einer Eisenbakterie im Vitina-See im siidostlichen Estland (UdSSR). Kokkenartige Zellen
mit einem Durchmesser von 1,5-2,0 um und einer zentralen Gasvakuole bilden eine
kugelige Kolonie mit sehr verschiedenem Durchmesser, von einer dicken Schleimkapsel
umgeben, manchmal intensiv mit Eisenverbindungen impragniert.
5. Krassilnikovia Kriss et Mickevic 1957
Faden ungegliedert; unverzweigt. Manchmal mit Scheide. Mehrere Dutzend bis
Hunderte von \im lang; oft zu strickartigen, aus mehreren hundert Faden
bestehenden Gebilden verflochten oder zu Spiralen, Schrauben oder Knaueln
aufgerollt. An einem Ende bildet der Faden eine Traube mehrerer Dutzend
kugelformiger, stark lichtbrechender Korperchen, die manchmal durch einen
diinnen Faden mit dem Hauptfaden verbunden sind. Weniger dichte Gebilde
sind doldenformig. Sie sind ebenso wie Bakteriensporen mit Malachitgriin gut
farbbar. Kulturen wurden bisher noch nicht erzielt.
Faden 0,4-0,5 urn breit; Faden mit Scheide 1,0-2,5 urn; kugelige Korperchen
0,5-2,0 [im im Durchmesser.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Krassilnikovia ■ 493
321
Fig. 321. Hyalosoris lamprocystoides - a verschiedene Ausbildung der Kolonien
(1000X), b einzelne Zellen, in denen Gasvakuolen sichtbar sind (1670x) (nach
Skuja, 1956).
Weit verbreitet in Meeren, besonders in grofieren Tiefen. Gefunden wurde diese
Art in Form von Uberzugen auf untergetauchten Objekttragern im Schwarzen
Meer, im Stillen Ozean, sowie im nordlichen Eismeer und am Nordpol. Perfiliev
und Gabe (1961) fanden einen ahnlichen Organismus in einer Tiefe von 1 m, im
Schlamm des Siifiwassersees Chepo-Jarvi (UdSSR).
494 • Addendum - Lampropedia
Systematische Stellung bisher vollig ungeklart. Zavarzin (1961) reiht ihn in die neue spezielle
Ordnung Calamobotryoeidales (Krassilnikoviales), Kriss und Mickevic (1957) in die Fami-
lie Krassilnikoviaceae ein. Nach Sorokin (1963) soil es sich uberhaupt nicht urn Mikroorga-
nismen handeln, sondern um ein Artefakt. Seiner Meinung nach handelt es sich urn
Colloblasten der Tentakel von Ctenophoren.
Typus generis: nicht angegeben.
Wichtigste Literatur: Kriss und Mickevic 1957, Kriss 1959, Perfiliev und Gabe
1961, Zavarzin 1961, Sorokin 1963.
Die Gattung enthalt nur zwei Arten:
1. Krassilnikovia capsulata Kriss et Mickevic 1957 (Fig. 322)
Faden in eine Scheide eingeschlossen.
2. Krassilnikovia incapsulata Kris et Mickevic 1957 (Fig. 323)
Faden ohne Scheide.
322 323
Fig. 322. Krassilnikovia capsulata - schematisiert (nach Zavarzin, 1961. -
4000x). Fig. 323. Krassilnikovia incapsulata - schematisiert (nach Zavarzin
1961.-4000X),
6. Lampropedia Schroeter 1886
Zellen kugelig, oval oder stabchenformig, vor der Teilung mafiig biskuitartig;
Paare, Tetraden oder regelmafiige, rechteckige, einschichtige, aus 4, 8, 16, 32, 64
usw. Zellen bestehende Tafelchen bildend. In kleinen Tafelchen sind die Zellen
eng aneinander gedrangt, so dafi es zu einem fast wiirfelformigen Gebilde
kommt. In grofieren Tafelchen sind die Zellen mehr kugelig; gewohnlich lassen
sich mehrere kleinere Vierer- und Achtergruppen unterscheiden, die aus 4X4
bzw. 8x8 usw. Zellen bestehen und die durch einen deutlichen Zwischenraum
voneinander getrennt sind. Elektronmikroskopisch wurde festgestellt (Murray
1963, Chapman et al. 1963), dafi die Kolonien in eine mehrschichtige Aufien-
Scanned &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@ramblet.
Lampropedia ■ 495
wand eingeschlossen sind. Einzelne Zellen sowie die Gruppen sind voneinander
und von der Aufienwand durch eine Schicht einer amorphen Substanz isoliert,
dessen chemische Zusammensetzung bisher unbekannt ist, die jedoch den
hydrophoben Charakter der Kolonien verursacht. Wenn unter gewissen Wachs-
tumsbedingungen dieser Stoff nicht erzeugt wird, entstehen keine Tafelchen; es
ist sodann schwierig den Organismus zu identifizieren. Form und Grofie der
Tafelchen hangen stark von aufieren Bedingungen ab. In nahrstoffreichem
Milieu kann eine zusammenhangende teppicnartige Schicht gebildet werden,
wogegen in einem niihrstoffarmen Milieu oder in alteren Kulturen kleine Zell-
gruppen vorkommen (Pringsheim 1966).
Protoplasma farblos oder infolge Lichtbrechung im Lichtmikroskop blaulich
erscheinend, feingranuliert; in der peripheren Schicht, Granulierung ein wenig
grober. Jede Zelle enthalt ein grofies, deutliches, stark lichtbrechendes Granu-
lum von Poly-f5-Hydroxybuttersaure. Im Tafelchen wechseln gewohnlich in
einer Reihe Zellen mit einem kleinen und einem grofien Granulum ab. In alten
Zellen oder Kulturen verkleinern sich die Granula. Bei geringer Temperatur
(16 °C) werden mehrere Granula in einer Zelle gebildet (Kuhn und Starr 1965),
in nahrstoff- oder phosphatreichem Milieu entstehen grofiere Granula; manch-
mal schwellen die Zellen infolgedessen an, so dafi es zu einer unregelmafiigen
Anordnung der Zellen kommt. Zellen ohne Pigmente, ohne Gasvakuolen und
Schwefeltropfchen. Ruhestadien werden nicht gebildet. Ohne Geifieln. Gram-
farbung negativ. Chemoorganotroph, streng aerob. Metabolismus respirativ.
Verwertet als Energie- und Kohlenstoffquelle iiberwiegend Zwischenprodukte
des Krebs-Zyklus; Alkohole, Kohlenhydrate, Fettsauren und ahnliche Verbin-
dungen konnen nicht verwertet werden. Hydrolysiert weder Fette noch Starke.
Als Stickstoffquelle werden einige Aminosauren, NHJ" benutzt. Kasein wird
nicht hydrolysiert, Gelatine nicht verfliissigt. Fur das Wachstum werden Vit-
amine, vor allem Biotin und Thiamin, Aneurin, Kobalamin benotigt. Optimal-
temperatur nach Kuhn und Starr (1965) bei 30 °C. Bei 20 °C ist das Wachstum
langsamer. Bei 39 °C stirbt der Organismus ab; Zellen dann grofi, unregelma-
fiig gestaltet und lysierend. Optimaler pH-Wert bei 7,0; der Organismus
toleriert die Spanne von 6,0-8,6. Vertragt 1% NaCl, jedoch nicht mehr 1,5%. _
Wachst auf Agarboden, sofern das Medium neutral ist und eine geniigend
feuchte Oberflache hat. Tafelchen wachsen dann in alle Richtungen; sobald die
Oberflache teilweise austrocknet, entsteht ein gefurchter hautiger Film mit
gekerbtem Rand. Typische Kolonien werden nicht gebildet. In fliissigen Nahr-
losungen heften sich die Tafelchen an den Wanden des Kulturgefafies an, wo sie
bis zu 3 cm iiber die Oberflache der Nahrlosung wachsen oder sich auch am
Boden oder an der Oberflachenhaut der Fliissigkeit ansetzen und eine faltige
Haut bilden. Zu einem diffusen Wachstum selbstandiger Zellen oder Zellpaare
kommt es nie.
Fortpflanzung nur bei neutraler oder mafiig alkalischer Reaktion des Mediums.
Vor der eigentlichen Zellteilung entsteht ein zweites Granulum von Poly-fj-
Hydroxybuttersaure; Zellen vor der Teilung mafiig in der Mitte verengt; sie
wachsen und teilen sich in zwei senkrecht zueinander stehenden Ebenen; das
Resultat ist die Bildung von Tafelchen, die aus Gruppen von je 4 Zellen
bestehen.
Zellen sowie Tafelchen meist unbeweglich. Pringsheim (1955,1966) beobachtete
bei einem Stamm eine zuckende, unterbrochene, unregelmafiig rotierende Bewe-
gung der Tafelchen in jungen sowie alten Kulturen, besonders in Nahrlosungen
mit noherem Nahrstoffgenalt. Durch Subkultur verlor der Stamm seine Beweg-
lichkeit. Puttlitzund Seley (1968) beschreiben die Bewegungnur bei der Teilung
von Tafelchen schnell wachsender Kulturen, wenn kleinere Zellgruppen sich von
der Muttergruppe entfeo^n.
496 • Addendum - Leukobium
Im Plankton eutropher Seen und Teiche; oft Uberziige an der Oberflache des
Schlammes oder auch am Wasserspiegel seichter Gewasser iiber dem Schlamm
bildend. Ferner in Siimpfen und verunreinigten stehenden Oberflachengewas-
sern. Durch die Struktur stark an Blaualgen der Gattung Merismopedia erin-
nernd; schon Kiitzing (1849) hielt sie daher fiir eine apochlorotische Form dieser
Gattung; Pringsheim (1966) neigte ebenfalls zu dieser Ansicht.
Wichtigste Literatur: Ehrenberg 1832, Kiitzing 1849, Schroeter 1886, Trevisan
in: de Toni und Trevisan 1889, Migula 1900, Kolkwitz 1909, Pringsheim
1955, 1966, Bergey's Manual 1957, 1974, Kuhn und Starr 1965, Chapman und
Salton 1962, Chapman, Murray und Salton 1963, Murray 1963, Pangborn und
Starr 1966, Puttlitz und Seley 1968.
Eine einzige Art:
Lampropedia hyalina (Ehrenberg 1832) Schroeter 1886 (Fig. 324)
Gonium hyalinum Ehrenberg 1832, Merismopedia hyalina (Ehrenberg 1832)
Kiitzing 1849, Sarcina hyalina (Ehrenberg 1832) Winter 1884, Pediococcus
hyalinus (Ehrenberg 1832) Trevisan 1889, Micrococcus hyalinus (Ehrenberg
1832) Migula 1900.
Mit den Merkmalen der Gattung.
In der alteren Literatur wird die Grofie der Zellen mit 2,0-2,5 X 2,5-3,8 (im
angegeben; in Bergey's Manual (1974) nur mit 1,0-1,5 X 1,0-2,5 urn. Die Grofie
der Tafelchen entspricht der Anzahl der in ihnen enthaltenen Individuen.
Urspriinglich in Siimpfen und faulendem organischem Material unterhalb des
Abwasserausflusses einer Zuckerraffinerie gefunden. Kolkwitz (1909) berichtet
iiber einen Fund in den Seen in der Umgebung von Berlin, deren Wasser durch
stadtische Abwasser verunreinigt war. Pringsheim (1955) isolierte diesen Orga-
nismus aus dem Abwasser der Milchfarm Madingley Road in Cambridge
(England). Oft in Gesellschaft von Bakterien der Gattungen Beggiatoa, Vitreos-
cilla, Sphaerotilus, Spirillum u. a. vorkommend.
Bergey's Manual (1974) reiht diesen Organismus in den Teil 11 (gramnegative
Kokken und Kokkobazillen) zwischen «Genera of uncertain affilation» ein.
§88888 m®mm®
0QOOOO :OQ©eo§§@
;§§©@
Fig. 324. Lampropedia hyalina - Teile von Tafelchen aus ovalen bis kurz
stabchenformigen Zellen zusammengesetzt (nach Skuja, 1956. - 1340X).
7. Leukobium Skuja 1948
Zellen einzeln, frei schwebend, meist kugelig, knapp vor der Teilung langlich.
Mit einer Geifiel. Protoplasma hyalin bis hellgrau, mitunter zart rosa. Peripherie
des Protoplasma kornig. Granula ziemlich grofi. Meistens im Hypolimnion von
Siifiwasserseen vorkommend.
Typus generis: Leukobium mikron Skuja 1948.
Seamed &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Leukobium • 497
Wichtigste Literatur: Skuja 1948, 1956.
Die Gattung umfafit nur zwei Arten:
1. Leukobium mikron Skuja 1948 (Fig. 325)
Zellen kokkenformig; nur vor der Teilung in Form eines oft ziemlich langlichen
Ellipsoids. Mit einer Geifiel, die 1,5 mal Tanger als die Zelle ist. Geifiel auch an
lebenden Zellen deutlich, besonders in Tusche-Emulsionen. Fortpflanzung
durch einfache Teilung. Bewegung schnell und geradlinig.
Zellen 1,5-2 um im Durchmesser.
Vereinzelt im Epilimnion, haufig in den unteren Schichten des Hypolimnions im
Siifiwasser vorkommend. Wahrscheinlich Wasser mit geringem H2S-Gehalt
bevorzugend (oligothiophil). Urspriinglich in den Seen Erken, Ubby-Langsjon,
Skarsjon und Amsjon (Schweden) gefunden.
326
Fig. 325. Leukobium mikron - einige Individuen mit Geifieln, einige im Tei-
lungsstadium (nach Skuja, 1956. -2000X). Fig. 326. Leukobium maior- grofie
ellipsoide Zellen mit grofiem zentralem Granulum (nach Skuja, 1956. - 1340X).
2. Leukobium maior Skuja 1956 (Fig. 326)
Zellen in Form grofier Ellipsoide oder kugelig. Mit einer polaren Geifiel, die
ebenso lang wie die Zelle ist. Protoplasma farblos oder hellgrau, fein gekornt.
Grofiere Korner in der Zellmitte konzentriert. Vermehrung durch Teilung.
Bewegung schnell, geradlinig, aber langsamer als Leukobium mikron.
Zellen 4,0-6,0 u\m lang und 3,0-5,0 (im breit.
Vor allem in den untersten Schichten des Hypolimnions von Siifiwasserseen
vorkommend. Oligothiophil. Beschrieben aus den Seen Hjalstaviken, Lushavet,
Mattsbosjon u. a. (Schweden).
8. Lineola Pringsheim 1950
Zellen lang, grofi, rigid; bewegliche, aus mehreren, moglicherweise zoenozyti-
schen Abschnitten bestehende Trichome mit peritricher Begeifielung bildend.
Bei spezieller Farbung werden Zelltrennwanae sichtbar. Einzelne Abschnitte
498 • Addendum - Lineola
miteinander fest verbunden; an der Verbindungsstelle konnen sie sich gelenkar-
tig biegen. Faden ohne Scheide und ohne Schleim. In frischen Isolaten Zellen
gramnegativ; Lineola longa nach Subkultur grampositiv. Faden manchmal ver-
zweigt. Seitliche Zweige gewohnlich aus einer Zelle oder kurzen Zellketten
bestehend; seltener konnen jedoch auch lange Zweige vorkommen, so dafi der
Hauptfaden schwierig zu erkennen ist. Fortpflanzung durch Querteilung mit
vorangehender Einschnurung. In einem fettsaurefreien Milieu erfolgt keine
Vermehrung.
In faulendem Pflanzenmaterial, auf Kuhmist, in Abwassern und verschmutzten
stehenden Gewassern vorkommend.
Typus generis: Lineola longa Pringsheim 1950.
Wichtigste Literatur: Pringsheim und Robinow 1947, Pringsheim 1950, 1957,
Jeynes 1956, Bennet und Canale-Parola 1965, Cyrus 1968.
Die Gattung umfafit nur zwei Arten:
1. Lineola longa Pringsheim 1950 (Fig. 327)
Bacillus macroides Bennet et Canale-Parola 1965
Rigide, verhaltnismafiig lange Stabchen, die lange, zarte, unregelmafiig ge-
kriimmte Faden verschiedener Lange bilden. Fadenlange von den Wachstumsbe-
dingungen abhangig; Faden im Freiland meist sehr lang. Sie bestehen gewohnlich
aus einer Kette von mehreren (4) getrennten Abschnitten, von denen vermutet
wird, dafi sie zoenozytisch strukturiert sind. Neueste Untersuchungen zeigten,
dafi bei spezieller Fixierung und Farbung bei diesen fadigen, «einzelligen»
Abschnitten einzelne, durch Querwande abgetrennte Segmente wahrnehmbar
sind. Faden weder in einer Scheide noch von Schleim umgeben. Form sehr
konstant, die sich auch bei Bewegung wenig andert. Mit peritricher Begeifielung.
Faden mitunter verzweigt. Hauptfaden gewohnlich wesentlich langer als die
Seitenzweige, die in der Regel aus 2-3 kurzen Abschnitten bestehen. Seitenzwei-
ge sitzen entweder an der Stelle der Einschnurung oder auch an den Wanden der
Abschnitte.
Unter giinstigen Bedingungen werden Endosporen in Form stark lichtbrechen-
der, terminal oder subterminal liegender, ovaler Korperchen gebildet. Mit
erhitzter 5,0%iger Losung von Malachitgriin und Merkurochrom oder Safranin
gut farbbar; die Sporen erscheinen griin, die Zellen rot gefarbt. Sporangien leicht
geschwollen. Die Zellen autolysieren, wenn die Sporen reif sind. Protoplasma
mit Korperchen gefullt, die positive Feulgen-Reaktion zeigen; wahrscheinlich
handelt es sich um DNS-haltige Granula. Protoplasma ebenso gut farbbar wie
das Plasma der iibrigen Bakterien. Grampositiv (Bennet und Canale-Parola
1965), nur bei frisch isoliertem Material gramnegativ (Pringsheim 1950).
Chemoorganotroph, offenbar mit respirativem Materialismus, streng aerob.
Glukose und andere Zuckerarten werden weder assimiliert noch oxydiert; als
Energie- und Kohlenstoffquelle werden vor allem Azetate und die iibrigen
Fettsauren mit C2-C5 aber unter Umstanden auch Aminosauren verwertet.
Starke wird nicht hydrolysiert. Als Stickstoffquelle dienen Aminosauren NH^,
jedoch kein NOj. Gelatine wird schwach verfliissigt, Kasein nicht hydrolysiert.
Fiir das Wachstum sind Thiamin, Guanin, Biotin erforderlich. Mangel an
anderen Vitaminen schadet nicht.
Zum Wachstum ist eine Temperatur zwischen 25—40 °C erforderlich, bei 10 °
und 44 ° wird das Wachstum eingestellt. Kolonien auf Agarboden flach oder
unregelmafiig, mit zerfransten Randern. Auf dunklem Hintergrund blaulich
weifi, mit seidigem Glanz; so fest zusammenhangend, dafi sich beim Uberimpfen
die ganze Kolonie von der Agaroberflache lost. Kolonig^o rigid, dafi bei
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mafl pahuteqwe@rambler.tu
Lineola • 499
Fig. 327. Lineola longa - a einzelne Faden (1000X), b Fadenverzweigung
(600 X), c an Stelle der unechten Fadenteilung (1000X) (nach Pringsheim, 1950).
Beruhrung mit einer Nadel diese steril bleibt. In fliissigen Nahrlosungen gedeiht
die Art am besten an der Oberflache, obwohl sie nach dem Uberimpfen zunachst
am Grund wachst. Unter dem Meniskus wird ein Ring gebildet, der spater
abreifit und als feine Triibung zu Boden sinkt. Bei schnellem Wachstum entsteht
eine homogene Triibung. Unter weniger giinstigen Kulturbedingungen bildet
der Organismus baumwollartige weifie Flocken.
Wahrend der Fortpflanzung beginnen sich die kurzen Faden (Abschnitte)
zunachst in der Mitte leicht einzuschniiren; die Einschnurung nimmt allmahlich
zu, wobei in beiden Fadenhalften neue Einschnurungen in nicht ganz regelmafii-
gen Intervallen entstehen. Im weiteren Verlauf der Teilung wird nach der
Einschnurung eine Zellwand gebildet und schliefilich teilt sich der Faden in zwei
Abschnitte. Faden peritrisch begeifielt, mit spezifischer Schwingbewegung. Sie
sind nur so lange beweglich^fcje das Wasser Sauerstoff enthalt. Nach seinem
500 • Addendum - Lineola
Verbrauch werden sie unbeweglich. Bewegungsaktivitat hangt mit der Fadenlan-
ge zusammen; lange Faden weniger beweglich als kurze. Verzweigte Faden
bewegen sich normal, sofern der seitliche Zweig kurz ist; ein langerer beeintrach-
tigt die Gleichmafiigkeit der Bewegung.
Faden 1,2-1,4 (X breit und sehr lang, bis 300 \im und dariiber. Junge Trichome
erreichen eine Lange von 50-60 (xm. Einzelne Abschnitte 10-15 (xm, gewohnlich
jedoch 25-40 (xm lang.
Auf Kuhmist und in Erdboden, die mit Kuhmist gediingt werden. Nach
Pringsheim (1954) soil der Organismus in den Exkrementen jeder Kuh vorhan-
den sein, die mit Grunfutter ernahrt wird. Ebenfalls in faulendem Pflanzenmate-
rial sowie auch haufig in Abwassern, vergesellschaftet mit polysaproben Flagel-
laten (Cyrus 1968). Urspriinglich in faulendem Pflanzenmaterial in stehendem
Wasser, das mit frischem Kuhmist verunreinigt war, Cambridge (England)
gefunden.
Pringsheim und Robinow (1947), spater Pringsheim (1950) stellten diesen Organismus in
eine neue selbstandige Gattung Lineola. Sie nehmen an, dafi er mit Vibrio longa Miiller
(1786) identisch sei. Umfangreiche Untersuchungen von Bennet und Canale-Parola(1965)
wiesen jedoch eindeutig auf die Zugehorigkeit zur Gattung Bacillus hin. Hier wird der
Organismus unter der alteren (unrichtigen) Bezeichnung gefiihrt, da sich dieser Name in der
limnologischen Literatur eingebiirgert hat.
2. Lineola articulata Pringsheim 1950 (Fig. 328)
Zellen in Form rigider, peritrichbegeifielter Stabchen, die lange bewegliche
Faden mit zoenozytischer, aus einer grofien Anzahl von Zellen bestehender
Struktur bilden. Auch 16-zellige Faden wurden gefunden. Diese Art ist durch
die Art der Biegung der Faden charakterisiert. An den Zellquerwanden konnen
sie sich gelenkartig biegen, wobei je zwei der Biegung benachbarte Zellen gerade
bleiben. Diese Gelenke sind sehr elastisch. Es wurden aber weder eine die
einzelnen Zellen verbindende Scheide noch Verbindungsfasern zwischen den
Zellen festgestellt. Es ist bisher unbekannt, wie die Zellen zusammengehalten;
bei der Bewegung trennen sie sich niemals. Faden oft verzweigt; seitliche Zweige
haften auf die gleiche Weise an der Hauptzelle, wie die Glieder des Hauptfadens
untereinander. Es werden hochstens zwei Hauptfaden gebildet. Sporen fehlen.
Gramnegativ.
Auf Agarboden entstehen Kolonien mit welligem bis flockigem Rand und
krauser Struktur. Perlmutterartig glanzend, opaleszent, nicht allzu koharent
und beim Umimpfen mittels einer Ose gut von der Agaroberflache abhebbar. In
fliissigen Medien Faden gleichmafiig im Medium verteilt, es entstehen keine
Fadenanhaufungen. Nur bei alten Kulturen wird Sediment gebildet. Fortpflan-
zung zunachst durch Verlangerung, dann durch Einschnurung der Zelle, die
allmahlich zur Bildung der Zellquerwand fiihrt und mit der endgiiltigen Abtren-
nung der Zellen endet. Zellteilung durch Anwesenheit von Fettsauren ausge-
lost.
Fortbewegung der Faden meist in gerader Rich rung, das Schlagen der Geifieln ist
gut synchronisiert. Bogenformig gekrummte Faden bewegen sich entweder in
einer kreisformig gekrummten Bahn oder mit der konvexen Seite nach vorn,
wobei sie sich nach einer gewissen Zeit strecken und dann in gerader Richtung
fortschwimmen. Vereinzelt kommen spiralig oder hufeisenformig gedrehte
Faden vor, die bei der Bewegung kontinuierlich die Richtung andern.
Zellen 1,4—1,6 X 30,0-50,0 (xm; manchmal bis 160 (xm lang.
In verschmutzten stehenden Gewassern oder Abwassern; in faulendem
Pflanzenmaterial. Die Art wurde aus einer Infusion und verwesendem
Pflanzenmaterial in New Forest (Siidengland) isoliert.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Perabacterium ■ 501
Fig. 328. Lineola articulata - a Fadenverzweigung, b Faden mit abgeschnurten
Zellen, c Zellen mit granuliertem Protoplasma d plasmolysierte Zellen, e Zellen
mit Geifieln (nach Pringsheim, 1950. - 1340X).
9. Perabacterium Coumartin 1957 (nomen provisorium)
Zellen stabchenformig, schwach gebogen, an beiden Enden deutlich geschwol-
len. Im Lauf der Teilung wird eine zwei- bis dreigliedrige Kette gebildet;
Bewegung zitternd. Protoplasma schwer farbbar. Der Organismus ist von einer
Scheide mit Eisenablagerungen umgeben, die ihn gegen Sterilisierung resistent
macht.
Chemolithotroph, anaerob; als Kohlenstoffquelle dienten FeC03 oder MnC03,
als Stickstoffquelle molekularer Luftstickstoff, NH| oder NOj. Der lithotro-
phe Charakter schwindet bei Anwesenheit von kohlenstoffhaltigen organischen
Stoffen mit der C-Gruppe CH200 oder CHOH. Fur optimales Wachstum sind
Eisen (H)-Salze, Feuchtigkeit und ein Substrat mit poroser Oberflache sowie
eine Temperatur zwischen 10 und 15 °C erforderlich. Barium hemmt das
Wachstum. Von Magnesiumsulfat und K2HP04 wird es hingegen schon in einer
l%igen Konzentration stimuliert. Widerstandsfahie gegen Sterilisierung. Uber-
lebt auch ein Erhitzen auf 120 °C und die Einwirkung von Athanol, Aether,
Phenol, organischen und anorganischen Sauren in einer 10%igen
Konzentration. Von feuchten, eisen- und lehmhaltigen Wanden der Tropfsteinhohlen in le
Lot und l'Arriege (Frankreich) isoliert.
Wichtigste Literatur: Coumartin 1957.
Eine einzige Art:
Perabacterium spelei Coumartin 1957 (nomen provisorium)
Mit den Merkmalen der Gattung.
Zellen 0,5 X 1,0-1,5 urn grofi.
Coumartin (1957) vermutet, dafi durch die Einwirkung dieses Organismus
502 • Addendum - Serpens - Steineckea
verschiedene eigenartige Muster in den Hohlen, in denen er in dicken Schichten
gefunden wurde, entstanden sind. Er bewirkt auch die Ausscheidung einer aus
Tartrat und Sukzinat bestehenden Substanz, der sog. «Mondmilch». Auch
aufierhalb von Tropfsteinhohlen in Ablagerungen aus verschiedenen geologi-
schen Zeiten gefunden. Offensichtlich ein Organismus, der in FeC03-reichem
Lehm Bedingungen fur dessen weitere Belebung schafft.
10. Serpens Hespell 1977
Ungewohnlich flexible, lange Stabchen. An beiden Polen 4-10 Geifielbiindel;
aufierdem sind sie in geringerer Anzahl liber die ganze Zelloberflache verteilt.
Geifieln werden leicht abgeworfen, darum manchmal nur polare Geifieln vor-
handen. Zellmembranen typisch fur gramnegative Bakterien. Keine Sporen
bildend. Kommen nur einzeln vor, nicht in Paaren oder Ketten. Keine Granula
von Poly-fS-Hydroxybuttersaure vorhanden.
Chemoorganotropher, aerober Organismus mit Respirationsmetabolismus,
wobei Sauerstoff der Endakzeptor der Elektronen ist. Wahrscheinlich vertragt er
auch mikroaerophile Bedingungen. Anaerob wachst er auch in Gegenwart von
Nitraten oder Sulfaten. Benotigt keine spezifische Wachstumsfaktoren, aber ein
Vitamingemisch oder Hefeextrakt stimulieren das Wachstum. Laktat diem als
einzige Kohlenstoff- und Energiequelle; begrenztes Wachstum erfolgt auch auf
Azetat oder a-Ketoglutarat; minimales oder kein Wachstum auf Fettsauren,
Alkoholen oder Karbohydraten. Als Stickstoffquelle dienen Kaseinhydrolysat,
Pepton, Hefeextrakt und Ammoniumionen. Weder Nitrate noch Nitrite konnen
assimiliert werden. Zum Wachstum ist eine Temperatur von 28-30 °C erforder-
lich; kein Wachstum bei 10 ° oder 40 °C.
Oberflachenkolonien auf Agarmedien sind cremefarbig, 3-6 (im breit, abgerun-
det, mit fadenformigem Rand.
Die Bewegungsart ist fur diesen Organismus charakteristisch: sie ist schrauben-
formig, rasch, schlangenartig bei extremer Flexibilitat. Die Migrationsgeschwin-
digkeit betragt 4 \im/St. in 0,5%igen Agar bei 30 °C. Wahrscheinlich positiv
chemotaktisch auf Laktat. Die Art der Bewegungskoordination und die Geifiel-
funktion ist nicht bekannt.
Vorkommen in den oberen Zentimetern der Sedimente eutropher Teiche bei
niedrigem Sauerstoffgehalt und Anwesenheit organischer Stoffe, die andere
fakultativ anaerobe Organismen zu Milch- und Essigsaure zersetzen. Im natiirli-
chen Milieu erfolgt eine betrachtliche Migration in der oberen Sedimentschicht.
Wichtigste Literatur: Hespell 1977.
Eine einzige Art:
Serpens flexibilis Hespell 1977.
Mit den Merkmalen der Gattung.
Zellen 0,3-0,4 X 8-12 \im grofi. Geifieln 10-30 \im lang. Im Hinblick auf seine
morphologischen und physiologischen Eigenschaften kann er zu keiner Gattung
beweglicher Bakterien gestellt werden.
11. Steineckea Koppe 1924
Zellen einzeln, grofi, lebhaft beweglich, kurz ellipsoidisch oder zylindrisch, an
beiden Polen kugelig gerundet. Wahrscheinlich mit Geifieln, die jedoch auch
nach Farbung mit Jodjodkalium oder Lofflerscher Losung nicht sichtbar
werden. Protoplasma kornig; mit einer grofien Zahl lichtbrechender, kugeliger
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thermus • 503
Korperchen. Brechungsindex verhaltnismafiig klein; ohne Schwefeltropfchen.
Zellwand einfach.
Fortpflanzung durch Querteilung. Im Plankton von Waldseen, in grofieren
Tiefen.
Wichtigste Literatur: Koppe 1924, Huber-Pestalozzi 1938.
Eine einzige Art:
Steineckea cylindrica Koppe 1924 (Fig. 329)
Mit den Merkmalen der Gattung.
Zellen 10,0-12,0 X 18,0-22,0 (im grofi.
Utermohl (1922) beschreibt ein Vorkommen in den Herbstmonaten im Kolksee
und Krummen See (DDR).
12. Thermus Brock et Freeze 1969
Gramnegative Stabchen, einzeln, paarweise oder in Ketten angeordnet. Sporen
werden nicht gebildet. Unbeweglich, ohne Geifieln. Polymorph. Junge Kultu-
ren bilden lange Faden; in alteren Kulturen fragmentieren die Faden in Stabchen.
In Abhangigkeit von den Kulturbedingungen produzieren sie auch Kokken und
Sphaeroplasten mit eigener Reproduktionsfahigkeit. Kokken entstehen durch
ungleichmafiige Teilung (Zerfall) der stabchenformigen Zellen. Sie sind weiter
teilungsfahig und konnen sich durch autolytische Zerstorung der Zellwand in
osmotisch sehr widerstandsfahige Sphaeroplasten umwandeln. Auch die direkte
Umwandlung von Stabchen zu Sphaeroplasten ist moglich. Diese sind grofie,
durchsichtige kugelige Gebilde, die aus einer exzentrisch liegenden dichten
inneren Kugel und einer aufieren Hiille besteht. Die aufiere Kugel entspricht der
gespannten aufieren Schicht der Zellwand, die jedoch das Aussehen einer
Membran verloren hat; die innere Kugel ist der eigentliche Protoplast.
Chemoorganotrophe, obligat bis streng thermophile Organismen. Optimale
Wachstumstemperatur 60-70 °C. Aerob bis mikroaerophil, manchmal auch
fakultativ anaerob. Die Fahigkeit zur Sphaeroplastenbildung ist eine Anpassung
des Organismus an mikroaerophile Bedingungen bei hohen Temperaturen una
hat grofie Bedeutung fur das Uberleben dieser Art (es ist kein Zeichen der
Degenerierung der Kultur): es erfolgt eine Vergrofierung der Oberflachenstruk-
turen, in denen sich die Atmungsenzyme befinden.
Kolonien durch Karotinoide gelb bis orange gefarbt. In Bergey's Manual (1974)
wird die Gattung unter die «Genera of uncertain affiliation* (Teil 7) einge-
ordnet.
Typus generis: Thermus aquatkus Brock et Freeze 1969.
Wichtigste Literatur: Brock und Freeze 1969, Brock und Edwards 1970, Freeze
und Brock 1970, Ramaley und Hixson 1970, Heinen 1971, Oshima und Imahori
1971, Ray et al. 1971a, 1971b, Yoshida und Oshima 1971, Yoshida et al. 1971,
Yoshizaki et al. 1971, Jackson et al. 1973, Saiki et al. 1972, Golovaceva 1973,
1976a, 1976b, 1977, Egorova et al. 1973, Loginova et al. 1973, 1975, 1978,
Oshima und Imahori 1974, Egorova und Loginova 1974, 1975, Loginova und
Egorova 1975, Golovaceva und Pivovarova 1977a, 1977b, Loginova und Bogda-
nova 1977, Loginova und Chrapcova 1977, Aleksandruskina und Egorova 1978,
Loginova et al. 1978.
Bestimmungsschlussel der Arten:
la Mit rotem Pigment; optimale Temperatur 50-55 °C 2. T. ruber
lb Mit gelbem bis orangenem Pigment, optimale Temperatur hoher als 65-
504 • Addendum - Thermus
2a Fiirdas Wachstum werden Aminosauren und Vitamine benotigt 3
2b Fiir das Wachstum werden weder Aminosauren noch Vitamine benotigt; mit
orangefarbenem Pigment; optimaleTemperatur70-72 °C
1. T. aquaticus
3a Mit gelbem Pigment, Gelatine wird nicht verflussigt 3. T. flavus
3b Mit gelborangefarbenem Pigment; Gelatine wird verflussigt
4. T. thermophilus
1. Thermus aquaticus Brock et Freeze 1969
Stabchen oder Faden. Stabchen einzeln oder Aggregate aus parallel gelagerten
Zellen oder Rosetten bildend. Keine Sporenbildung. Weerkamp und Heinen
(1972) geben jedoch an, dafi bei einigen Stammen Sporen entdeckt wurden. In
alten Kulturen lagern sich mehrere Zellen zu grofien kugeligen Gebilden zusam-
men. Diese bestehen aus einer Anhaufung von parallel an der Kugelperipherie
liegenden Stabchen. Aufierdem konnen sich unter bestimmten physiologischen
Wachstumsbedingungen Sphaeroplasten bilden. Zelloberflache mit Schleim be-
deckt.
Chemoorganotroph, obligat aerob, streng thermophil. Als Kohlenstoffquelle
werden Zucker und organische Sauren, als Stickstoffquelle Aminosauren und
NHJ verwertet, NOj hingegen nicht. Vitamine und Aminosauren sind fiir das
Wachstum nicht erforderlicn, obwohl ihre Anwesenheit das Wachstum be-
schleunigt. Hohe Konzentrationen organischer Stoffe inhibieren das Wachstum.
Optimaltemperatur 70-72 °C; Temperaturbereich 40-79 °C. Wachstumsfa-
hig auch bei hohen Temperaturen (80 °C), aber nur in Anwesenheit von
Sukzinaten oder Pyruvat als Kohlenstoffquelle (Loginova und Chrapcova 1977).
Optimaler pH-Wert 7,5-7,8, pH-Bereich 6,0-9,5. Kolonien kompakt, durch
Karotinoide orange gefarbt.
Zellen 0,5-0,8 X 5,0-10,0 u.m grofi; Faden 20-200 urn lang. Kugelige Aggregate
in alten Kulturen 10-20 ujn im Durchmesser.
Reichlich in Thermalquellen und Warmwasserleitungen vorkommend; auch aus
thermisch beeinflufiten Fliissen isoliert, wo hell orangefarbene, makroskopi-
sche, aus eingerollten Faden bestehende Buschel gebildet werden. Urspriinglich
aus verschiedenen Thermalquellen des Yellowstone National Parkes (USA) und
auch aus einer Thermalquelle in Kalifornien (USA) isoliert.
Ramaley und Hixson (1970) isolierten aus einem Bach bei Jordan Hall in dem Universitats-
grundstiick in Bloomington (Indiana, USA) einen pigmentfreien Stamm, der im
Temperaturbereich von 40-80 °C wachst und morphologisch und physiologisch identisch mit dem
Typenstamm ist. Unterscheidet sich nur durch das Fehlen des Pigments. Auch Golovaceva
(1976a, 1976b) isolierte einen Stamm ohne Pigment aus einer Kultur thermophilernitrifizie-
render Bakterien.
2. Thermus thermophilus (Yoshida et Oshima 1971)
Oshima et Imahori 1974
Flavobacterium thermophilum Yoshida et Oshima 1971
Lange Stabchen; einzeln oder paarweise vorkommend, manchmal kettenbil-
dend. Unter bestimmten Kulturbedingungen werden kugelige Sphaeroplasten
gebildet.
Chemoorganotrophe, streng aerobe und thermophile Organismen. Aus einigen
Sacchariden werden Sauren gebildet. Proteolytisch; Rinderalbuminserum oder
Milchkasein kann sowohl als einzige Kohlenstoff- als auch Stickstoffquelle
dienen. Zu optimalem Wachstum sind ein Vitamingemisch, Wachstumsfaktoren
und Mineralstoffe erforderlich. Die minimalen Nahrstoffaufforderungen sind
nicht bekannt. Optimaltemperatur 65-72 °C, Temperaturbereich 47-85 °C.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Thermus • 505
Bei 90 °C stirbt der grofite Teil der Zellen allmahlich ab; lebende Zellen
behalten jedoch ihre Stoffwechsel-Aktivitat. Bei 95 °C sterben sie schnell ab.
Kolonien abgerundet, 1 mm im Durchmesser, mit glatter, flacher Oberflache;
durch Karotinoide gelborange gefarbt. In fliissigen Medien einen Oberflachen-
film und manchmal auch flockige Sedimente bildend.
Zellen im Durchschnitt 0,5 X 3,0 urn grofi.
Aus einer Thermalquelle (80 °C) in Mine, Prefecture Shizouka (Japan) isoliert.
3. Thermus flavus Saiki et al. 1972
Einzelne Stabchen, manchmal zu Ketten vereinigt. Endosporen werden nicht
gebildet. Besitzen keine Geifieln, daher unbeweglich. Gramnegativ. Enthalten
ein gelbes Pigment, wahrschienlich ein Karotinoid.
Chemoorganotropher, obligat aerober Organismus mit Respirationsmetabolis-
mus. Aus Glukose, Fruktose, Manose und Xylose werden Sauren ohne Gas
produziert. Aus Galaktose, Arabinose, Saccharose, Laktose, Mannose, Dextrin,
Starke und Glyzerol entstehen weder Sauren noch Gas. Gelatine wird nicht
verflussigt. Wachst gut auf komplexen Medien. Fiir das Wachstum werden
einige Aminosauren und Vitamine benotigt; pH-Bereich 6,0-9,0, Optimum
7,0-7,5. Die optimale Temperatur betragt 70-75 CC; wachst im Bereich von 40-
81 °C. Die Kolonien auf festen Medien sind glatt, gelb bis braungelb gefarbt,
kompakt.
Einzelne Zellen 0,5-0,7 X 2,0-5,0 urn grofi. Aus heifien Quellen (IZU-Ataga-
wa), Prefecture Shizouka (Japan) isoliert.
4. Thermus ruber Loginova et al. 1975
Unbewegliche, eramnegative Stabchen, keine Sporen bildend. Polymorph. Zel-
lenlange vom Alter der Kultur abhangig. Am homogensten sind Kulturen von
16-24 Stunden mit verhaltnismafiig kurzen Stabchen. Jungere Kulturen
enthalten lange Faden. Ahnlich wie bei Thermus aquaticus werden vielzellige, kugelige
Gebilde und auch Sphaeroplasten gebildet. Kokken entstehen durch ungleich-
mafiige Zellteilung, was im Lichtmikroskop wie eine Knospung aussieht,
Kokken mit einer Schleimkapsel. Enthalten ein hellrotes (manchrnaforangefarbenes
Pigment (Karotinoid).
Chemoorganotropher, aerober, obligat thermophiler Organismus. Unter
bestimmten Umstanden auch fakultativ anaerob oder mikroaerob. Als
Kohlenstoff- und Energiequelle dienen verschiedene organische Sauren und Saccharide.
Am besten wird Laktin bei 55 °C verwertet, bei hoheren Temperaturen wahr-
scheinlich auch organische Sauren. Optimale Wachstumstemperatur 50-55 °C.
Maximaltemperatur 65 °C.
Einzelne Zellen 0,5-0,8 X 3,0-6,0 urn grofi. Junge Kulturen enthalten bis 40 urn
lange oder langere (manchmal bis 120 urn) Faden. Kugelige Gebilde 5-30 urn
breit. Kokkenartige Formationen 0,6-1,0 um.
Weit verbreitet in heifien Quellen. Aus dem Vulkankrater Uzon und aus heifien
Quellen in Niznaja Paratunka, Dolina Gejzerov, Esso, (Kamtschatka) isoliert,
sparer auch aus heifien Quellen in Tadjikistan Chodza-Obi-Garm und Thermal-
boden in Jagan-Tau, Ural (UdSSR) sowie aus Boden der Republik Togo
(Afrika). F B
Unsichere, ungeniigend beschriebene Arten:
Bacterium cyrusii Cyrus et Sladecek 1973 (Fig. 330).
Zellen in Form gerader, langer Stabchen; mit je einer Geifiel (oder wohl eher
einem vereinigten Geifielbundel) an den Polen. Protoplasma mehr oder weniger
kornig; mit kleinen Granula. Fortpflanzung durch Teilung.
506 ■ Addendum - Unsichere Arten
Fig. 329. Steineckea cylindrica - (nach Huber-Pestalozzi, 1938. - 1340X).
Fig. 330. Bacterium cyrusil:- (nach Cyrus 1969. - 1670X). Fig. 331. Streptobac-
terium zavisii - a makroskopische, gefranste Fadenagglomerate, in stark ver-
schmutztem Wasser auf Gegenstanden festsitzend (natiirliche Grofie), b Zellfa-
den ohne Scheide (1340x) (nach Cyrus, 1969). Fig. 332. Bacterium precipitation
- Stabchen, die typische Paare in «V»-Form bilden (nach Kalinenko, 1946. -
1670X).
Charakteristisch fiir diesen Organismus ist besonders seine Bewegung. Er
bewegt sich mit Hilfe der Geifieln auf kurze Entfernungen geradlinig in beide
Richtungen, wobei stets die hintere Geifiel aktiv ist und die vordere der Zelle
anliegt. Bei Anderung der Bewegung wechselt die Funktion der Geifieln. Neben
dieser Bewegungsweise ist auch eine zitternde Bewegung typisch.
Einzelne Zellen 1,0 x 7,0-14,0 u^m grofi.
In stark verschmutzten Gewassern, Abwassern, anaeroben Lagunen, haufig an
der Oberflache von organischen Partikeln oder im Wasser frei schwebend. Zeigt
anaerobes Milieu und Faulnisprozesse an.
Bacterium precipitatum Kalinenko 1946 (Fig. 332)
Unter Kulturbedingungen ein ziemlich variabler Organismus. Auf einem Nahr-
boden aus Peptonwasser-Eisen (Il)-Zitrat werden verhaltnismafiig lange Stab-
Scanned * Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.rn
Unsichere Arten • 507
chen gebildet; auf einem aus Meerwasser hergestellten Medium entstehen we-
sentlich kleinere, kokkenformige Zellen. Charakteristische Zellpare in V-Form
bildend. In Kulturen sowie in Freiland kommt es bei diesem Organismus zu
massenhafter Agglutination und damit zur Bildung von Flocken mit verschiede-
ner Zellenzahl. Zellen vereinigen sich zu grofieren spharischen oder scheibenfor-
migen Einheiten und bilden so typische, fiir diesen Organismus charakteristische
Mikrokonkretionen. Sie reifien mineralischen Detritus und besonders kolloide
Partikel von prazipitiertem Eisen und Mangan aus organischen Stoffen mit; der
Organismus Kann in Anwesenheit von NO^ aus organischen Stoffen Kalzium
freisetzen und vermag Kalzium ahnlich wie Eisen zu fallen. Die Radikale
organischer Stoffe werden als Kohlenstoffquelle verwertet. Auf mineralischen
Nahrboden werden Sauren aus Glukose, Mannitol und Glyzerol gebildet.
Gelatine wird nicht verfliissigt und Starke nicht hydrolysiert. Reduziert Nitrate
zu Nitriten.
Aus Grundsedimenten, unmittelbar aus mikroskopischen Konkretionen in den
arktischen Meeren isoliert. Verwertet hier die von sibirischen Fliissen einge-
schwemmten Huminstoffe. Durch seine Tatigkeit entstehen umfangreiche braun
gefarbte Lager mit hohem Eisen- und Mangangehalt. Mikrokonkretionen wur-
den auch unter Laboratoriumsbedingungen erzielt. Sie enthalten Eisenflocken
bis zu 40% ihres Gewichtes.
Streptobacterium zavisii Cyrus et Sladecek 1973 (Fig. 331).
Zellen von mittlerer Lange, stabchenformig, charakteristische Ketten in Form
langer, selbstandiger Faden bildend, in denen die einzelnen Zellen deutlich
sichtbar sind. In stark verschmutzten Gewassern werden fadige,
makroskopische, zottige Kolonien gebildet, die an Gegenstanden in fliefiendem Wasser
festsitzen. Einzelne Zellen an beiden Polen abgerundet, so dafi die Faden an den
Stellen der Zellquerwande deutlich eingeschnurt sind. Faden nicht gerade,
sondern unregelmafiig gebogen; ohne Scheide, wodurch sie sich leicht von den
Faden der Gattung Sphaerotilus unterscheiden lassen, denen sie sonst ziemlich
ahnlich sehen. Zellen keine Sporen bildend. Protoplasma farblos, fein granu-
liert.
Zellen bis 7,0 (xm lang und 2,0 urn breit.
Im anaeroben Milieu stark verschmutzter Gewasser und in Abwassern vorkom-
mend.
Organismen zweifelhafter Gattungszugehorigkeit:
Pseudomonas ariston Skuja 1956 (Fig. 333).
Zellen ziemlich grofi; ellipsoidisch oder zylindrisch-ellipsoidisch, gerade oder
leicht gekrummt, an den Enden abgerundet. Mit einer Geifiel an einem Pol, die
ungefahr gleich lang oder langer als die Zelle ist. Periplast zart, hyalinrProtoplas-
ma farblos, mehr oder weniger homogen mit feiner Granulation in der Zellmitte;
selten grobkornig. Oligothiophiler Organismus. Fortpflanzung durch Quertei-
lung. Mit Hilfe von GeiCeln stark beweglich.
Zellen 3,5-6,0 X 5,0-14,0 urn grofi.
In mittleren Tiefen von Sufiwasserseen vorkommend. Urspriinglich in den Seen
Honsan, Storacksen und Tjarnatjarn (Schweden) gefunden.
Systematische Stellung ziemlich problematisch. Die Einreihung von Skuja (1956)
in die Gattung Pseudomonas ist unbegriindet, da die Art nur an Hand morpholo-
gischer Merkmale beschrieben wurde. Auf5erdem entspricht sie vor allem durch
inre Ausmafie, nicht den charakteristischen Eigenscharten der iibrigen Angeho-
rigen der Gattung Pseudomonas-
508 • Addendum - Unsichere Arten
Fig. 333. Pseudomonas ariston - (nach Skuja, 1956. - 1340X).
Sarcina paludosa Schroeter 1886 (Fig. 335).
Einzelne Zellen kokkenformig; regelmafiig Pakete mit 8, 16, 32, sogar 64 Zellen
bildend. Mit stark lichtbrechendem Protoplasma. Fakultativ anaerob. Einzelzel-
len 2,0 (xm grofi.
Regelmafiig in stadtischen Abwassern und im Schlamm vorkommend. Am
haufigsten in Abwassern, die Zucker enthalten (Zucker- und Starkefabriken).
Oft auch in Belebtschlamm oder Tropfkorpern gefunden.
336
Fig. 335. Sarcina paludosa - (nach Liebmann, 1962 - 2000 x). Fig. 336.
Streptococcus margaritaceus - (nach Liebmann, 1962. - 2000X).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgrambler.
Unsichere Arten • 509
Sarcina tetras Skuja 1956 (Fig. 334).
Kokkenartige Zellen, am haufigsten kugelformige, ellipsoidische oder unregel-
mafiige Kolonien bildend, die in einer grofien nyalinen Schleimkapsel liegen.
Zellen innerhalb einer Kolonie tafel- oder paketformig angeordnet. An den
Randern der Kolonie kugelformig, regelmafiig oder durcn gegenseitigen Druck
wiirfelartig. Zellhaut diinn, hyalin. Protoplasma farblos, homogen oder mafiig
kornig. Zeilteilung in drei zueinander senkrechten Ebenen; Kolonien vermehren
sich durch Zerfall in mehrere Teile.
Zellen im Durchmesser 1,0-1,5 (xm. Kugelformige Kolonien samt
Schleimkapsel 20-60 (xm grofi.
Im Hypolimnion von Sufiwasserseen vorkommend, z. B. im See Norrviken in
0-10 m Tiefe, besonders im Fruhjahr; ferner in den Seen Tjarnatjarn, Lushavet,
Storacksen (Schweden).
334
Fig. 334. Sarcina tetras - kugelformige Zellen in einer grofien hyalinen
Scnlammkapsel eingeschlossen (nach Skuja, 1956. - 1340X).
510 • Addendum - Cyclobacteriales
Streptococcus margaritaceus Schroeter 1886 (Fig. 336)
Zellen grofi, unbeweglich, kokkenformig. Nach der Teilung bleiben die Zellen
beisammen, so dafi sie oft lange Ketten bilden. Fakultativ anaerob. Fortpflan-
zung durch Teilung.
Kokkenformige Zellen im Durchschnitt 1,5 pun grofi. Ketten ungefahr 30 \im
lane.
In der Regel zu bestimmten Zeiten in stadtischen Abwassern und Tropfkorpern
vorkommend. Manchmal in riesigen Mengen vorhanden. Ferner in faulenden
stehenden Gewassern, Sumpfen, Graben u. a.
Bislang sehr wenig untersuchte Ordnung:
Ordnung Cyclobacteriales Perfiliev 1960
Kurze Stabchen mit abgerundeten Enden, hoch organisierte, netzartige Mikro-
kolonien bildend, die sich koordiniert bewegen und sich auch sonst wie ein
einziger vielzelliger Organismus verhalten. Zellen wahrscheinlich durch Plas-
modesmen verbunden. Mikrokolonien durch ihre Struktur einer animalischen
Ernahrungsweise angepafit. Die Beute - gewohnlich eine fadige Bakterie - wird
mittels einer beweglichen, lassoartigen, aus einzelnen Zellen bestehenden
Schlinge eingefangen, in deren Evolution sich etwa drei Stufen verfolgen lassen. Der
einfachste Typ ist eine einfache Schlinge, die an die Zahl «8» erinnert und die sich
beim Fangen der Beute augenblicklich zuziehen kann. Bei der Gattung Cyclo-
bacter wird die Schlinge von einem mehrzelligen Faden gebildet, bei der Gattung
Teratobacter hingegen aus mehreren Dutzenden von Faden, die aus Tausenden
von Zellen bestehen, unter denen es bereits zu einer Differenzierung in der
Funktion kommt; manche Zellen dienen als Stiitze, andere absorbieren Nahr-
stoffe. Ein noch komplizierterer Typ sind die beweglichen spinnwebartigen
Netze, die bei den Gattungen Desmobacter, Streptobacter und Trigonohacter
vorkommen. Die Mikrokolonie enthalt einen klebrigen Schleim, von dem die
gefangene Beute eingeschlossen wird. Der hochst organisierte Typus stellt eine
einfache Analogie zum Korperbau der Coelenteraten dar. So bildet die
Mikrokolonie der Gattung Dictyobacter aus dem Zellnetz einen Beutel, in denen die Beute
aufgenommen wird und aus dem die Nahrungsreste auch wieder ausgestofien
werden.
Organismen dieser Ordnung wurden bisher nur im Freiland beobachtet und von
dort beschrieben; Reinkulturen konnten nicht erzielt werden. Physiologische
Eigenschaften daher noch unbekannt. Bei manchen Arten wird auch saprophyti-
sche, eventuell osmotische Ernahrungsweise vermutet. Fortpflanzungsweise
ebenfalls charakteristisch; Kolonien teilen sich durch Einschniirung in kleinere
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Cyclobacter • 511
Individuen, die sich weiterentwickeln und heranwachsen. Alle Gattungen dieser
taxonomischen Gruppe wurden mittels Kapillarpeloskop in der oberen
Schlammschicht von Siifiwasserseen oder Teichen entdeckt. Sie sind besonders
wichtig in der Geomikrobiologie als Indikatoren mikrozonaler Profile des
Schlamms, sowie als spezifische Antagonisten eisenhaltiger Bakterien.
Die Reprasentation dieser Ordnung zeigen die hochste Entwicklungsstufe der
Mikroorganismen die ausgehend, von der einzelligen Formen bis zu dieser
kolonialen Lebensweise funrte; nach Perfiliev und Gabe (1961) konnen sie als
Ubergangsform zwischen ein- und mehrzelligen prokaryotischen Organismen
betrachtet werden. Perfiliev (1960) reihte in diese Ordnung auch die Gattung
Lieskella (siehe Teil III, S. 292) ein, sowie den bislang sehr wenig erforschten
und daher unzureichend beschriebenen Trichobacter, bei dem ebenfalls Schlin-
genstrukturen gefunden wurden.
Die Ordnung umfafit 8 Gattungen mit bisher sehr wenig untersuchten
Organismen (einschhefilich der Gattung Lieskella). Nur bei zwei Gattungen wirdauch
die Art angefuhrt; bei den iibrigen wurde sie noch nicht bezeichnet; einige
Fachleute nehmen zur Beschreibung dieser Organismen eine zuriickhaltende
Stellung ein. In Bergey' Manual (1974) werden sie nicht erwahnt.
Wichtigste Literatur: Perfiliev 1954, 1960, Perfiliev und Gabe 1961, Aristov-
skaja 1963.
1. Cyclobacter Perfiliev 1960
Zellen farblos, zylindrisch bis stabchenformig mit mafiig abgerundeten Enden,
mehrzellige Kolonien mit aktiver koordinierter Bewegung bildend. Zellen ohne
Geifieln. Die Grundlage der Mikrokolonien bilden Faden, in denen die Zellen an
ihren Polen durch Plasmodesmen verbunden sind. In der Entwicklung der
Mikrokolonien sind 3 aktive Stadien zu beobachten; nach Perfiliev und Gabe
(1961) soil es noch ein viertes, ein Ruhestadium geben.
Das erste Stadium besteht aus beweglichen Faden, die an Blaualgen der Gattung
Phormidium erinnern. Diese konnen seitliche Schlingen bilden, die sich am
Faden entlang schieben konnen. Im zweiten Stadium werden bewegliche
Schlingen in Form von Ringen gebildet, die Perfiliev und Gabe (1961) als «Akran»
bezeichnen. Sie entstenen dadurch, dafi sich die Endschlingen mit energischer
Bewegung von den Faden losreifien; sie wachsen durch gleichzeitige Querteilung
der Zellen schnell heran, so dafi der Ring statt aus den urspriinglichen 4—6 Zellen
aus etwa 30 besteht. Der Ring dreht sich um seinen Mittelpunkt. Eine zweite
Form, die in diesem Stadium vorkommen kann, ist ein Ring mit einem mehr oder
weniger langen Auswuchs. Zellen in beiden Stadien grofi, zylindrisch mit
abgerundeten Enden. Im dritten Stadium werden netzartige Mikrokolonien
gebildet. Zunachst entstehen Schlingen an den freien Fadenenden. Mit steigen-
der Zahl von Zellen in den Endschlingen teilen sich diese in zwei Aste, deren
Enden sich wieder in zwei kleinere Schlingen umwandeln; haufig sich mehr oder
weniger langliche Schlingen oder solche, die an die Zahl «8» erinnern, bisweilen
auch kompliziertere Strukturen. So entsteht allmahlich ein Netz, von dem eine
Reihe von langen Seitenfaden mit einer grofieren Anzahl (6-10) beweglicher
Endschlingen ausgeht, was fur dieses Stadium besonders charakteristisch ist. Die
Mikrokolonie vermag sich durch pulsierende Bewegung auf einer festen Unterla-
ge voranzuschieben, wobei sich die «Akranen» biegen, drehen oder kriimmen
konnen.
Das erste Stadium hat eine vollig saprophytische Ernahrungsweise. Die Faden-
anhaufungen reagieren chemotaktisch auf organische, aus Schlammteilchen
diffundierende Stoffe, die sie umschliefien. Es kann angenommen werden, dafi
512 • Addendum - Cyclobacter
die Bildung von «Akranen» von gewissen Stoffen stimuliert wird. Im zweiten
Stadium iiberwiegt auch noch die saprophytische Ernahrungsweise, obwohl es
sich schon um einen Ubergang zu einer animalischen handelt, die fiir das dritte
Stadium spezifisch ist. Die Schlingen funktionieren hier wie ein Lasso; sie fangen
lebende, radenformige Bakterien ein, am haufigsten solche aus der Gattung
Leptothrix. Beim Ergreifen der Beute wird die Schlinge zugezogen, die Mikro-
kolonie umschliefit sie fest, so dafi das Ganze schliefilich wie ein geschlossener
Kokon aussieht.
In gut oxydierter Schlammschicht von Siifiwasserbecken und -seen vorkom-
mend. An die Anwesenheit von Fadenbakterien gebunden, die als Nahrung
dienen.
Eine einzige Art:
Cyclobacter constrictor Perfiliev et Gabe 1961 (Fig. 337).
Einzelne Zellen 1,4—1,6 x 4,5-7,0 (xm grofi.
Urspriinglich mittels Kapillarpeloskop im Schlamm der Seen Gabozero und
Uksozero in der Nahe von Petrozavodsk (Karelofinnische SSR) gefunden. Die
Entwicklung der einzelnen Stadien und das Eingreifen der Beute wurde in vivo
unmittelbar unter dem Mikroskop beobachtet. Aristovskaja (1963) beobachtete
ahnliche Organismen im Erdboden.
Fig. 337. Cyclobacter constrictor - einzelne Stadien schlingenartiger Bildungen-
a-b Bildung der Endschlingen, e-d Vergrofierung der Endschlingen und ihre
Umformung in longitudinale Achterschlingen, e wachsende Anzahl der
Schlingen (nach Perfiliev und Gabe, 1961. - 650 x).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgrambler.
Dictyobacter • 513
2. Dictyobacter Perfiliev 1954
Zellen farblos, stabchenformig, mit abgerundeten Enden, durch diinne Plasmo-
desmen miteinander verbunden; bewegliche, beutelartige Mikrokolonien in
Form eines sackartigen Netzes oder einer grobmaschigen Fischreuse bildend.
Die Wande der Kolonien bestehen aus einer Zellschicht; die Maschen des
«Netzes» sind mit transparentem, feinem, aber sehr festem Schleim ausgefullt.
Innerhalb der Kolonie befindet sich eine zentrale, mit Fliissigkeit gefiillt Hoh-
lung. Diese besitzt eine Offnung, die im Bedarfsfall weit geofrnet werden kann.
Durch Zusammenziehen der Rander kann sich diese Offnung in einen manchmal
ganz undeutlichen Spalt verwandeln. Die gesamte Kolonie besteht aus 100-200
Zellen.
Zellen im Schleim standig langsam beweglich, so dafi sich Form und Grofie der
Maschen im Netz kontinuierlich andern. Die Lage der Zellen zueinander ist vom
Verlauf der animalischen Nahrungsaufnahme abhangig. Kolonien fangen
lebende Bakterienzellen (speziell eisen- und schwefelhaltige Bakterien) in der inneren
Hohlung. Sie umgeben ihre Beute allmahlich mit dem Zellnetz, so dafi sie im
Innenraum vollkommen eingeschlossen wird. Dieser Vorgang zeigt Analogien
zur Nahrungsaufnahme von Amoben. Die Zellen in der Wand der Kolonien
treten allmahlich so zusammen, dafi die Maschen des «Netzes» eng geschlossen
sind. Die ganze Kolonie zieht sich um die Beute zusammen und rundet sich ab.
In den Innenraum scheiden die Zellen Exoenzyme (Proteasen) aus, die die
Verdauung der Beute einleiten. Wahrend dieser Zeit ist die Kolonie unbeweg-
lich. Nach der Verdauung werden die Nahrungsreste periodisch ausgestofien.
Aufier der animalischen Ernahrungsweise vermutet Perfiliev (1954) auch osmoti-
sche Ernahrung mit aus dem Schlamm diffundierenden organischen Stoffen
besonders dann, wenn die Kolonie keine lebende Nahrung erbeuten kann.
Fortpflanzung durch Durchschnurung der gesamten Mikrokolonie in zwei
Tochterkolonien, manchmal bereits in friihen Entwicklungsstadien.
Wie zahlreiche Beobachtungen zeigen, kommt der Organismus nicht allzu selten
in einer streng definierten, etwa 1 mm starken Mikrozone des Schlamms von
Siifiwasserseen vor, die unmittelbar der Schicht anliegt, in der die biologische
Oxydation von Eisen (Il)-Verbindungen durch Bakterien stattfindet. Gewohn-
lich in der Litoralzone. Hier bewegt sich die ganze Kolonie langsam und ergreift
vor allem Eisenbakterien; sie verhalt sich, wie ein vielzelliges organisiertes
Individuum.
Eine einzige Art:
Dictyobacter rapax Perfiliev 1954 (Fig. 338)
Mit den Merkmalen der Gattung.
Einzelne Zellen in der Kolonie 0,7-1,2 x 2,0-6,0 (xm grofi; Kolonien meist 10-
40 x 20-60 um.
Der Organismus wurde mittels Kapillarpeloskop entdeckt und ist sonst sehr
schwer zu beobachten. In den Teichen Kristatellevyj und Niznyj in der Nahe
von Petrodvorec bei Leningrad, der Karelischen Meerenge, in den Toksovseen
Chepo-Jarvi und Cajnoje (alles RFSSR) gefunden. Auch in den Seen Gabozero
und Uksozero (Karelofinnische SSR).
Innerhalb der Kolonie wurden oft Zellen der Gattungen Ochrobium, Leptothrix,
Gallionella gefunden, weniger haufig Algen der Gattungen Chlorella und Scene-
desmus, deren Chloroplasten einen verschiedenen Grad der Zersetzung zeigten.
Perfiliev (1954) beobachtete auch ein grofies, lebendes, purpurfarbenes, in der
Hohlung eingeschlossenes Spirillum, das sich linger als 90 Minuten vergeblich
bemiihte, den Schleim zwischen den Zellen in der Wand der Kolonie zu
druchbrechen.
Aristovskaja (1963) beobachtete ahnliche Organismen auch im Erdboden.
514 • Addendum - Trigonobacter
Fig. 338. Dictyobacter rapax - a simultane Teilung in zwei Tochterkolonien
durch Einschniirung - b das Ergreifen der Beute - grofie Bakterien aus der
Gattung Ackromatium (nach Perfiliev und Gabe, 1961. - 650x). Fig. 339.
Trigonobacter sp. - Struktur des aus diinnen Stabchen mit charakteristischen,
dreieckigen Maschen zusammengesetzten Netzes (nach Perfiliev und Gabe,
1961.-650X).
3. Trigonobacter Perfiliev 1960 (nomen provisorium)
(Fig. 339)
Bildet Mikrokolonien von verschiedenem Typus. Eine dieser Formen besteht
aus diinnen, stabchenformigen, 1,0-1,2 x 5,0-7,0 \im grofien Zellen, die zu
radialen, seesternformigen Gebilden zusammentreten und spharische Kolonien
bilden. Mikrokolonien auf fester Unterlage durch langsame Kriechbewegungen
aktiv beweglich.
Dieses Stadium kann sich in eine mafiig verzweigte Kette von zickzackformig
angeordneten Zellen spalten oder sich in ein in einer Ebene liegendes Netz
verwandeln, dessen Zellen so orientiert sind, dafi sie dreieckige «Schlingen»
bilden. An ihrer Peripherie ragen von den Knoten der dreieckigen Schlingen
einzelne Zellen oder Zellpaare wie Stacheln in verschiedene Richtungen hervor.
Nach Perfiliev sollen sie tatsachlich eine ahnliche Funktion wie Stacheln haben.
Die netzartige Anordnung ist die Grundform des Organism us. Im Peloskop lafit
sich unmittelbar beobachten, wie das schleimbedeckte Netz organische
Schlammpartikel erfassen und fest umschliefien kann. Bislaatwenig bekannter
Seamed &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Desmobacter - Streptobacter ■ 515
Organismus. Wahrscheinlich hat der Dimorphismus auch physiologische Be-
deutung.
Typus generis: nicht bestimmt.
4. Desmobacter Perfiliev 1960 (nomen provisorium)
Kolonien aus festen, schnurartigen, aus einer grofieren Anzahl von Zellen
bestehenden Faden. Diese bilden bandartige, sich zu Knaueln aufwickelnde
Biischel, mit denen sie die Beute umschliefien.
Typus generis: nicht bestimmt.
5. Streptobacter Perfiliev 1960 (nomen provisorium)
Bildet spinnwebartige Netze aus Zellfaden, die klebrigen Schleim ausscheiden.
Einzelne Faden bestehen aus Ketten von parallel liegenden Stabchenpaaren.
Fig. 340. Teratobacter sp. - a Kolonie mit Schlingen die Beute erfassend,
b Kolonie mit ihrer Schlinge Faden einer Schwefelbakterie aus der Gattung
Beggiatoa fangend (nach PerfJ^v und Gabe, 1961. - 850X).
516 • Addendum - Teratobacter
Einzelne Stabchenpaare sind in der Kette so orientiert, dafi die Ebenen der
Zellpaare senkrecht zueinander stehen.
Typus generis: nicht bestimmt.
2. Teratobacter Perfiliev 1960 (nomen provisorium) (Fig. 340)
Kolonien aus einer grofien Anzahl stabchenformiger Zellen mit abgerundeten
Enden bestehend. Die Fangschlingen bestehen aus Ketten von einigen Tausend
Zellfaden, die besonders lappenformige Auswuchse bilden, die sich zusammen-
rollen und krummen konnen; sie haben die Funktion sowohl von Fang- als auch
von Saugorganen. Hoher entwickelt als Cyclobacter. Entwicklungszyklus unbe-
kannt.
Typus generis: nicht bestimmt.
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgrambler.
Literaturverzeichnis
Aasen, A.J. und S. Liaaen-Jensen: Bacterial carotinoids. XXIII. The caroteno-
ids of Thiorhodace 6. Total synthesis of okenone and related compounds.
Acta. Chem. Scand. 21: 970-982 (1967).
Achenbach, H., Kohl, W., Reichenbach, H. und H. Kleinig: Zur Struktur des
Flexirubins.Tetrahedron Lett. 30: 2555-2556 (1974).
Adelmann, L.: Tuschekulturmethode und Teilungsvorgange bei Bakterien. Zbl.
f. Bact. Abt. I. Orig. 88: 401-417 (1922).
Agardh, C. A.: Aufzahlung einiger in Ostereichischen Landern gefunden neuen
Gattungen und Arten von Algen, nebst ihrer Diagnostik und beigefiigten
Bemerkungen. Lund, Flora (Bot. Ztg.) 10: 625-646 (1827).
Ahrens R. und G. Moll.: Ein neues knospendes Bakterium aus der Ostsee.
Arch. f. Mikrobiol. 70: 243-265 (1970).
Akashi, A.: Studies on the cellulose-decomposing bacteria in the rumen. Part
IV. About the bacteriological nature of the mesophilic and aerobic cellulose -
decomposing bacteria.J. agric. chem. Soc. Jap. 34: 278-285 (1960).
- Studies on the cellulose-decomposing bacteria in the rumen. V.J. agric. chem.
Soc. Jap. 34:285-289(1960).
- Studies on the cellulose-decomposing bacteria in the rumen. VI. J. agric.
chem. Soc. Jap. 34: 895-900 (1960).
Aleksandruskina, N. J., und L. A. Egorova: Nukleotidnyj sostav DNK termo-
fil'nych bakterij roda Thermus. Mikrobiologija 47: 250-252 (1978).
Aminuddin, M. und D. J. D.Nicholas: An AMP-independent Sulphite
Oxidase from Thiobacillus denitrificans: Purification and Properties. J. Gen.
Microbiol. 82: 103-113 (1974a).
Electron Transfer during Sulphide and Sulphite Oxidation in Thiobacillus
denitrificans. J. Gen. Microbiol. 82: 115-123 (1974b).
Anagnostidis, K.: Untersuchungen iiber die Salz- und Siifiwasser-Thiobio-
conosen (Sulphuretum) Griechenlands. Inst. Syst. Bot. u. Pflanzengeogr.
Univ. Thessaloniki, 10: 1-866 (1968).
Anagnostidis, K. und J. Overbeck: Methanoxidierer und hypolimnische
Scnwefelbacterien. Studien zur okologischen Bioconotik der Gewasser-Mi-
kroorganismen. Ber. Deutsch. Bot. Ges. 79: 163-174 (1966).
Anderson, I. I. W. und W. P. Hefferman: Isolation and characterization of
filterable marine bacteria. J. Bact. 90: 1713-1718 (1965).
Anderson, R. L. und E. J. Ordal: Cytophaga sttccinicans n. sp., a facultatively
anaerobic aquatic myxobacterium. J. Bact. 81: 130-138 (1961).
Anderson, R. L. und E. J. Ordal: C02-Dependant fermentation of Glucose by
Cytophaga sttccinicans. J. Bact. 81: 139-146 (1961).
Andres, A.: Di alcuni microorganismi, probabilmente nuovi, esistenti nel fango
termale di Bormio. Atti Congr. Natur. Ital. Soc. Sci. Nature.: 419-426
(1907).
Aragno, M. und Schlegel H. G.: Physiological Charakterization of the
Hydrogen Bacterium Aquaspirillum autotrophicum, Arch. Mikrobiol. 116,: 221-229
(1978a).
- Aquaspirillum autotrophicum, a new Spezies of Hydrogen-Oxidizing,
Facultatively Autotrophic Bacteria. Int. J. Syst.Bact. 28: 112-116 (1978b).
Aristovskaja, T. V.: Akkumuljacija zeleza pri razlozenii organo-mineral'nych
kompleksov gumusovych vescestv mikroorganizmani. DAN CCCP 136:
954-957(1961).
- O principach ekologiceskogo analiza v pocvennoj mikrobiologii. Pocvoved.
1: 7-16 (1962).
518 • Literaturverzeichnis
- O prirodnych formach suscestvovanija pocvennych bakterij. Mikrobiologija
32:663-667(1963).
- O razlozenii organo-mineral'nych soedinenij vpodzolistych pocvach; Pocvo-
ved. 1, (1963).
- O taksonomiceskom polozenii roda Selibena Arist. et Parink. Mikrobiologija
33: 929-934 (1964).
- Mikrobiologija podzolistych pocv. Nauka Moskva, Leningrad. 1965.
Aristovskaja, T. V. und O. M. Parinkina: Novye metodiceskie priemy izucenija
soobscestv pocvennych mikroorganizmov. Pocvovodenie 1: 20-28 (1961).
Novyj pocvennyj mikroorganizm Seliberia stellata n. gen. n. sp. Izv. Akad.
Nauk SSSR, Ser.biol. 1: (1963).
Asai, T.: Taxonomic studies on acetic acid bacteria and allied oxidative bacteria
isolated from fruits. A new clasification of the oxidative bacteria. J. agric.
chem. Soc. Jap. 11 : 499-513; 610-620; 674-708 (1935).
Asai, T., lizuka, H. und K. Komagata: The flagellation an taxonomy of genera
Gluconobacter und Acetobacter with reference to the existence of intermediate
strains. J. Gen. Microbiol. 10: 95-126 (1964).
Aso, K. und R. Yoshida: Application of the serum reaction in the classification
of Azotobacter. Proc. First Int. Congr. Soil Sci. (Washington), Comm: III. 1:
150-151. (1928).
Baas-Becking, L. G. M.: Studies on the sulphur bacteria. A. Bot. (London) 39:
613-650 (1925).
Babenzien, H. D.: 1965. (Zit.: Babenzien, H. D. und P. Hirsch, in Bergey's
Manual 1974).
- 1967. (Zit.: Babenzien, H. D. und P. Hirsch, in Bergey's Manual 1974).
Bacinskaja, A. A. und T. Kondrat'ev: Rasy Azotobacter chroococum Beij. i
Azotobacter incapsulate n. sp., vydelennye iz pocv Zavolzja. Sov. bot. : 94
(1941).
Bahr, H.: Zur Biologie von Sphaerotilus natans Kiitzing. Schweiz. Z. S. Hy-
drol. 15:285(1953).
Bahr, H. und W. Schwartz: Untersuchungen zur Okologie farbloser fadiger
Schwefelmikroben. Biol. Zbl. 75: 451-464 (1956).
Bachmann, Barbara J.: Studies on Cytophaga fermentans n. sp., a facultatively
anaerobic lower myxobacterium. J. Gen. Microbriol. 13 : 540-551 (1955).
Baillie, A., W. Hodgkiss und J. R. Norris: Flagellation of Azotobacter as
demonstrated by electron microscopy. J. Appl. Bact. 25: 116-119
(1962).
Balasova, V. V.: Nakopitel'naja kul'tura Gallionella filamenta n. sp.
Mikrobiologija 36: 646-650 (1967).
- Stroenie volokon «stebel'ka» laboratornoj kul'tury Gallionella filamenta.
Mikrobiologija 36 : 1050-1053 (1967).
- K taksonomii roda Gallionella. Mikrobiologija 37: 715-722. (1968).
- Ob otnosenii Gallionella k mikroplazmam. DAN SSSR 184: 1429-1432
(1969).
Balasova, V. V. und N. E. Cerni: Ul'trastruktura Gallionella filamenta.
Mikrobiologija 39: 348-351 (1970).
Balasova, V. V., U. Ja. Vedenina, G. E. Markosjan und T. A. Zavarzin: Lepto-
spirillumferrooxidans i osobennosti ee avtotrofnogo rosta. Mikrobiologija 43:
581-585 (1974).
Balickaja, R. M.: Razvitie zelenych serobakterij Chloropseudomonas ethylicum
pri raznych intensivnostjach sveta. Mikrobiologija 31: 961-965 (1962).
Balickaja, R. M. und E. N. Kondrat'eva: Vlijanie intezivnosti sveta na ispol'zo-
vanie C02 i organiceskich soedinenij pri fotosynteze Chloropseudomonas
ethylicum. Mikrobiologija 32 : 193-199 (1963). ^
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@ranibler.rn
Literaturverzeichnis • 519
Barooah, P. P. und Sen, A.: Nitrogen fixation by Beijerinckia in relation to
slime formation. Arch. f. Mikrobiol. 48: 381-385 (1964). -
Bauer, L.: Untersuchungen an Sphaeromyxa xanthochlora, n. sp. einer auf
Tropfkorpern vorkommenden Myxobakterienart. Arch. Hyg. Bact. 146:
392-400 (1962).
Bauld, J.: Algal-bacterial interactions in alkaline hot spring effluents. Ph. d.
dissertation, University of Wisconsin 1973.
Bauld, J. und T. D. Brock: Ecological Studies of Chloroflexis, a Gliding Photo-
synthetic Bacterium. Arch. Mikrobiol. 92: 267-284 (1973).
Algal excretion and bacterial assimilation in mats of alkaline hot spring
effluents. J. Phycol. 10: 101-106 (1974).
Bauld, J. und P. A. Tyler: Taxonomic implications of reproductive mechanisms
of Hyphomicrobiutn facies and Pedomicrobium facies of a pleomorphic
budding bacterium. Ant. v. Leeuwenh. 37: 417-424 (1971).
Bauld, J., P. J. Tyler und K. C. Marshall: Pleomorphy of a budding bacterium
on various carbon sources. Ant. v. Leeuwenh. 37: 409-416 (1971).
Bavendam, W.: Die farblosen und roten Schwefelbakterien des Sufi- und Salz-
wassers. Pflanzenforschung 2, Jena: 1-156 (1924).
Beaurepaire-Aragao, H. de und G. Vianna: Sobre un novo treponema encontra-
do em ulceras, Treponema minimum nov. spec. Brasil-Med. 27: 61-62 (1913).
Becker, B., E. M. Wortzel und J. H. Nelson: HI. Chemical composition of the
cell wall of Caryophanon latum. Nature (Lond.) 213: 300 (1967).
Becking, J. H.: Nitrogen-fixing bacteria of the genus Beijerinckia in South
Africans soils. Plant and Soil 11: 193-206 (1959).
- Species differences on molybdenum and vanadium requirements and
combined nitrogen utilization by Azotobacteriaceae. Plant and Soil 16: 171-201
(1962).
- Fixation of molekular nitrogen by an aerobic Vibrio or Spirillum. Ant. v.
Leeuwenh. 29: 326 (1963).
Beger, H.: Uber das Auftreten von Bakterienzoogloeen in Brunnenrohren.
Kleine Mitt. Ver. Wasser- u. Lufthyg. 4: 143-146 (1928).
- Leptothrix echinata, ein neues, vorwiegend Mangan fallendes Eisenbakte-
rium. Zbl. f. Bact. Abt. II. 92: 401-406 (1935).
- Die Eisenbakterien in Wasserversorgungsanlagen und ihre praktische Bedeu-
tung. Gas u. Wasserfach 80: 886-889 (1937).
- Naumaniella catenata und Sideronema globulifera, zwei neue Eisenbakterien.
Zbl. f. Bact. Abt. II. 103: 321-325 (1941).
- Beitrage zur Systematik und geographischen Verbreitung der Eisenbakterien.
Ber. Deutsch. Bot. Ges. 62: 7-13 (1944-1950).
- Uber Zoogloea filipendula Formen und einige neue Eisenbakterien. Zbl. f.
Bact. Abt. I., Orig. 154: 61-68 (1949).
- 1953. (in: H. Beger und G. Bringmann: 1953).
- Family II. Peloplocaceae Beger 1957 (In: Bergey's Manual 7th ed. 1957. 270-
272).
Beger, H. und G. Bringmann: Bisherige Anschauung uber die Morphologie von
Gallionella und neuere elektronenmikroskopische Befunde. Zbl. f. Bact. Abt.
II. 107: 305-318(1952).
Die Scheidenstruktur des Abwasserbakteriums Sphaerotilus und des Eisen-
bakteriums Sphaerotilus und des Eisenbakteriums Leptothrix im elektronen-
mikroskopischen Bilde und ihre Bedeutung fur die Systematik dieser Gattun-
gen. Zbl. f. Bact. Abt. II. 107: 318-334 (1953).
Behre, K.: Die Algenbesiedlung einiger Hafen in Bremerhaven und ihre Bezie-
hungen zur Verschmutzung dieser Gewasser. Veroff. Inst. f. Meeresf.
Bremerhaven 8: 192-249 (19Mk
520 • Literaturverzeichnis
Beijerinck, M. W.: Uber oligonitrophile Mikroben. Zbl. f. Bact. Abt. II. 7:
561-582 (1901).
- Anhaufungsversuche mit Ureumbakterien. Ureumspaltung durch Urease und
durch Katabolismus. Zbl. f. Bact. Abt. II. 7: 33-61 (1901).
- Sur les ferments lactiques de l'industrie. Arch. Neer. Sci. (Sect. 2) 6: 212-243
(1901).
- Sur des Microbes oligonitrophiles. Arch. Neer. Sci. (Sect. 2) 8: 190-217
(1903).
- Phenomenes de reduction produits par les microbes. Arch. Neer.Sci. (Sect. 2)
9: 131-157(1904).
- Uber ein Spirillum, welches freien Stickstoff binden kann? Zbl. f. Bact. Abt.
II. 63: 353-359 (1925).
Beljaev, C. C: Rasprostranenie gruppy Caulobacter v vodochraniliscach Volgo
- Dona. Mikrobiologija 36: 157-162. (1967).
Belousova, A. A.: Vlijanie nekotorych aminokislot na urozaj zelenych sero-
bakterij Chlorobium thiosulfatophilum. Mikrobiologija 37: 1010-1016
(1968).
Benecke, W.: Bau und Leben der Bakterien. B. G. Teubner, Leipzig I—XII,
1912.
Bennett, J. F. und E. Canale-Parola: The taxonomic status of Lineola longa.
Arch. Mikrobiol. 52: 197-205 (1965).
Berger, V.: Untersuchungen an Fusobakterien I. Systematik, Ziichtung,
Morphologic Zbl. f. Bact. Abt. I. 166: 484-497 (1956).
Bergey, D. H„ F. C. Harrison, R. S. Breed, B. W. Hammer und F. M.
Huntoon: Bergey's Manual of Determinative Bacteriology 1st. ed. The
Williams and Wilkins Co., Baltimore. 1923.
Bergey's Manual of Determinative Bacteriology 2nd. ed. The
Williams and Wilkins Co., Baltimore. 1925.
Bergey's Manual of Determinative Bacteriology. 3rd. ed. The
Williams and Wilkins Co., Baltimore. 1930.
Bergey, D. H., R. S. Breed, E. G. D. Murray und A. P. Hitchens: Bergey's
Manual of Determenative Bacteriology. 5th. ed. The Williams and Wilkins
Co., Baltimore. 1939.
Berkeley, M. J.: Introduction to Cryptogamic Botany. H. Bailliere, London
1857.
- Notices of the North American Fungi. Grevillea 3: 1-17, 49-64 (1874).
- Notices of the North American Fungi. Grevillea 3 : 97-112 (1875).
Berkeley, M.J. und B. Curtis: 1874. (In: M.J. Berkeley 1875).
- - 1875. (In: M.J. Berkeley, 1875).
Bersa, E.: Uber das Vorkommen von Kohlensaurem Kalk in einer Gruppe von
Schwefelbakterien. Akad. d. Wiss. Wien, Math.-nat. KL, Sitzungsber. Abt. I.
129:231-259 (1920).
Bernatova, V.: Occurence of Myxobacteria in Surface Water. Folia microbiolo-
gica22:468 (1977).
Bersa, E.: Neue kalkfuhrende Schwefelbakterien. Planta 2: 373-379 (1926).
Bicknell, A. K.: The morphology of Chlorobium limicola. J. Bact. 63: 645
(1952).
Billroth, T.: Untersuchungen uber die Vegetationsformen von Coccobacteria
septica. Georg Reiner, Berlin. 1874.
Biswas, K.: Studies on Indian iron-bacteria. Biol. gen. 13: 421—434 (1937).
Bland, J. A., J. T. Staley: Observations on the Biology of Thiothrix. Arch.
Microbiol. 117: 79-87 (1978).
Blinkov, G. N.: O solestojkom azotobaktere. Mikrobiologija 31: 880-883
(1962).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 521
Bloch, M.: Beitrag zur Untersuchung uber die Zoogloea ramigera (Itzigsohn)
auf Grund von Reinkulturen. Zbl. f. Bact. Abt. II. 48: 44-62 (1918).
Boatman, E. S. und H. C. Douglas: Fine structure of the photosynthetic
bacterium Rhodomicrobium vannielii. J. Biophys. Biochem. Cytol. 11: 469-
483 (1961).
Boer, Willemina E., J. W. M. de la Riviere, und Karin Schmidt: Some properties
of Achromatium oxaliferum. Ant. v. Leeuwenh. 37: 553-563 (1971).
Bogorov, L. V.: O svojstvach Thiocapsa roseopersicina, stamm BBS vydelenno-
go iz estuarija Belogo morja. Mikrobiologija 43: 326-332 (1974).
Bokor, R.: Mycococcus cytophagus n.s. 1929. Untersuchungen iiber aerobe,
bakterielle Cellulose-zersetzung mit besonderer Beriicksichtigung des Wald-
bodens. Arch. f. Mikrobiol. 1: 1-34 (1930).
Boltjanskaja, E. V.: Uslovija obrazovanija vyrostov na kletkach Azotobacter
chroococcum. Mikrobiologija 36: 100-105 (1967).
Bont, J. A. M., Staley, J. T. und Pangratz, H. S.: Isolation and description of a
non-motile, fusiform, stalked bacterium, a representative of a new genus.
Ant. v. Leeuwenh. 36: 397-407 (1970).
Bohlool, B. B.: Occurence of Sulfolobus acidocaldarius, an Extremely
Thermophilic Acidophilic Bacterium in New Zealand Hot Springs; Isolation and
Immunofluorescence Characterization. Arch. Mikrobiol. 106: 171-174
Borg, A. F.: Studies on myxobacteria associated with diseases in salmonid
fishes. Wildlife Dis. 8: 1-85 (1960).
Borall, R. und J. M. Larkin: Flectobacillus marinus (Raj) comb. nov. a Marine
Bacterium Previously Assigned to Microcyclus. Int. J. Syst.Bact. 28: 341-343
(1978).
Borzi, A.: Note allei morfologia e biologia delle alghe Ficocromacee. - Nuovo
Giorn. Bot. Italiano 10: 3 (1878).
Bosanquet, W. C.: Brief notes on the structure and development of Spirochaeta
anodontae Kes. Quart. J. Microbiol. 56: 387 (1911).
- Spirochaetes. Saunders. Philadelphia. 1911.
Bourrelly, P.: 1952. (Zit.: Wawrik, F.: 1952).
- Les sulfobacteries. Rev. algol. 1: 29 (1954).
Bowers, E. L., R. H. Weaver, E. A. Grula und O. F. Edwards: I. Studies and
identification of Caulobacter vibrioides Henrici and Johnson with emended •
description. J. Bact. 68: 194-200 (1954).
Bocher, T.: Studies on the sapropelic flora of the lake Flynders with special
reference to the Oscillatoriaceae. Kgl. Da. Vid. Selsk. Biol. Medd. 21: 1—46
(1949).
Bomeke, H.: Beitrage zur Physiologie nitrifizierender Bakterien. Arch. f.
Mikrobiol. 10: 385-445 (1939).
Brauss, F. W., W. Heyle und Heyle-Katzenberger: Beschreibung eines neuen
lytisch-aktiven Bakterienstammes. Arch. Hyg. 153: 457 (1969).
Brebisson, de: 1849. (In: F. T. Kutzing: 1849).
- 1853. (Zit.: H. Beger und G. Bringmann: 1952).
Breed, R. S.: 1948. (In: Bergey's Manual. 1948).
- Family II. Methanomonadaceae Breed. (In.: Bergey's Manual. 1957).
Breed, R. S., E. G. D. Murray und A. P. Hitchens: The outline classification
used in the Bergey's Manual of Determinative Bacteriology. Bact. Rev. 8:
255-260 (1944).
Bergey's Manual of Determinative Bacteriology 6th ed. The Williams and
Wilkins Co., Baltimore. 1948.
Breed, R. S., E. G. D. Murray und N. R. Smith: Bergey's Manual of
Determinative Bacteriology 7th ed. The Williams and Wilkins Co., Baltimore. 1957.
524 ■ Literaturverzeichnis
Biilow von, J. F. W. und J. Dobereiner: Potential for nitrogen fixation in
maize genotypes in Brazil. Proc. Nath. Acad. Sci. (USA) 72: 2389-2393
(1975).
Biisgen, M.: Kulturversuche mit Cladothrix dichotoma. Ber. Deutsch. Bot.
Ges., 12: 147-152(1894).
Biitschli, O.: Uber den Bau der Bakterien und verwandter Organismen. Vor-
trag. Leipzig. 1890.
Byckovskaja, A. L. und Skljar: Kislotovynoslivyj variant Azotobacter. Mikro-
biologija 28 : 335-342 (1959).
Bystricky, B.: Caulobacter - an unusual contaminant of preparations for the
electron microscope, (english. Translation). Biologia Bratislava 9: 566-569
(1954).
Canale-Parola, E., S. A. Rosenthal und D. G. Kupfer: Morphological and
physiological charakteristics of Spirillum gracile n. sp. Ant. v. Leeuwenh. 32:
113-124(1966).
Canale-Parola, E., S. C. Holt und Z. Udris: Isolation of free-living, anaerobic
spirochetes. Arch. f. Mikrobiol. 59: 41-48 (1967).
Canale-Parola, E., Z. Udris und M. Mandel: The classification of free-living
spirochetes. Arch. f. Mikrobiol. 63: 385-397 (1968).
Cantacuzene, J.: Sur un spirochete thermophile des eaux de Dax. C. R. Soc.
Biol. Paris 68: 75-78 (1910).
Caraway, B. U. und N. R. Krieg: Uncoordination and recoordination in
Spirillum volutans. Can. J. Microbiol. 18: 1749 (1972).
Carter, H. V.: Note on the occurrence of a minute blood-spirillum in an Indian
rat. Sci. Mem. med. Offrs. Army India 3: 45-48 (1888).
Castellani, A. und A. J. Chalmers: Manual of Tropical Medicine 3rd. ed.
William Wood and Co., New York. 1919.
Castenholz, R. W.: Thermophilic blue-green algae and the thermal
environment. Bact. Rev. 33 : 476-504 (1969).
- Ecology of blue-green algae in hot springs. In: N. G. Carr, B. A. Witton
(Eds.), The biology of blue-green algae. Blackwell, London 379-414 (1973a).
- The possible photosynthetic use of sulfide be the filamentous phototrophic
bacteria of hot springs. Limnol. Oceanogr. 18: 863-876 (1973b).
Cataldi, M. S.: Aislamiento de Leptothrix ochracea en medios solidos a partir de
cultivos liquidos. Folia biol. B. Aires : 337 (1937).
- Estudio fysiologico y systematico de algunas Chlamydobacteriales. Ph. D.
Thesis Univ. of Buenos Aires : 1-96 (1939).
- Aislamiento de Beggiatoa alba en cultivo puro. Rev. Inst. Bact. Dept. nad.
hig. B. Aires, 9: 393-423 (1940).
Cayton, H. R. und Preston, N. W.: Spirillum mancuniense n. sp. J. Gen.
Microbiol. 12: 519-525 (1955).
Certes, A.: Les parasites et les commenseaus de l'huitre. Bull. Soc. Zool. Franc.
7:374(1882).
Chan, E. C. S., P. Basavanand und Tiiu Liivak: The growth inhibition of
Azotobacter cbroococcum by Pseudomonas sp. Can. J. Microbiol. 16 (1970):
9-16.
Chapman, J. A. und M. R.J. Salton: 1962. (Zit.: Seeley in Bergey's Manual.
1974).
Chapman, J. A., R. G. E. Murray und M. R. J. Salton: The surface of Lampro-
pedia hyalma. Proc. Roy. Soc. B. 158, (1963): 498-513.
Chatton, E. und C. Perard: Schizophytes du coecum de cobaye. I. Oscillospira
guilliermondi n. g. n. sp. C. R. Soc. Biol. Paris 74: 1159-1162 (1913).
Chester, F. D.: A Manual of Determinative Bacteriology. The MacMillan Co.,
New York. 1901.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 525
Cholodnyj, N. G.: Uber Eisenbakterien und ihre Beziehungen zu den Algen.
Ber. Deutsch. Bot. Ges. 40: 326-346 (1922).
- Zur Morphologie der Eisenbakterien Gallionella und Spirophyllum. Ber.
Deutsch. Bot. Ges. 42: 35-44 (1924).
- Uber neue Eisenbakterienarten aus der Gattung Leptothrix Kiitz. Zbl. f. Bact.
Abt. II. 61: 292-298 (1924).
- Die Eisenbakterien. Verlag Gustav Fischer, Jena. 1926.
- New observations on iron bacteria. Mem. CI. Sci. phys. Acad. Ukr. 11: 239-
252 (1929).
- Zelezobakterii. Izdat. Ak. Nauk SSSR, Moskva. 1953.
Ciferri, R.: Reidentificazione di alcuni solfobatteri della «glea» termale di
Bormio. Atti 1st. bot. Univ. Pavia Ser. 5. 18: 209-214 (1960).
Clark-Walken: (Zit.: Bergey's Manual. 1974).
Claus, D.: Taxonomy of some highly pleomorphic bacteria. Spisy prirodoved.
fak. Univ. Brno, Ser. K 40: 254-257 (1967).
Claus, D., J. E. Bergendahl und M. Mandel: DNA base composition of Micro-
cyclus species and organisms of similar morphology. Arch. f. Mikrobiol. 63 :
26-28 (1968).
Coder, D. M. und M. P. Starr: 1978 (Zit. Gromov, Mamkaeva: Mikrobiologija
49: 165-166. (1980).
Cohen-Bazire, G.: Some observations on the organization of the
photosynthetic apparatus in purple and green bacteria. (In: H. Gest, A. San Pietro, L. P.
Vernon: Bacterial Photosynthesis. Antioch Press, Yellow Springs, Ohio. 89-
110 (1963).
Cohen-Bazire, G., N. Pfennig und R. Kunisawa: The fine structure of green
bacteriaj. Cell. Biol. 22: 207-225 (1964).
Cohen, G. A, und D. B. Johnstone: Extrazellular polysaccharides of
Azotobacter vmelandii. J. Bact. 88: 329-338 (1964).
- Capsular polysacharide of Azotobacter agilis. J. Bact. 88: 1695-1699
(1964).
Cohn, F.: Untersuchungen iiber die Entwicklungsgeschichte der mikroskopi-
schen Algen und Pilze. Nova Acta Acad. Caes. Leop.-Carol. Nat. Cur. 24:
1.01-256 (1854).
- Uber die Entstehung des Travertin in den Wasserfallen von Tivoli. Neues Jb.
Min. Geol. Palaeont. 580-610 (1864).
- Zwei neue Beggiatoen. Hedwigia4: 81-84 (1865).
- Uber den Brunnenfaden (Crenothrix polyspora) mit Bemerkungen iiber die
mikroskopische Analyse des Brunnenwassers. Beitr. Biol. Pfl. 1: 108-131
(1870).
- Untersuchungen iiber Bakterien. Beitr. Biol. Pfl. 1: 127-224 (1872).
- Untersuchungen iiber Bakterien II. Beitr. Biol. Pfl. 1: 141-207 (1875).
Cole, J. A. und D. E. Hughes: The metabolism of polyphosphates in Cbloro-
bium thiosulfatophilum. J. Gen. Microbiol. 38: 65-72 (1965).
Cole, J. A. und S. C. Rittenberg: A comparison of respiratory processes in
Spirillum volutans, Spirillum itersonii and Spirillum serpens. J. Gen.
Microbiol. 69:375-383 (1971).
Collier, W. A.: Cristispira helgolandica nov. spec, und ihre Fortpflanzung. Zbl.
f. Bact. Abt. I. 86: 132-134 (1921).
Collin, B.: Sur un ensemble de protistes parasites des batraciens (note prelimi-
naire). Arch. Zool. exp. gen. (Notes et Rev.) 51: 76 (1913).
Conn, H. J.: Taxonomic relationships of certain nonsporeforming rods in soil.
J. Bact. 36: 320-321 (1938).
Conti, S. F. und P. Hirsch: Biology of budding bacteria. III. Fine structure of
Rhodomicrobium and Hyphomicrobium. J. Bact. 89: 503-512 (1965).
526 • Literaturverzeichnis
Copeland, J. J.: Yellowstone thermal Myxophyceae. Ann. N. Y. Acid. Sci. 36:
1-232 (1936).
Copeland, H. F.: The classification of lower organisms. Pacific Books, Palo
Alto. Calif. 1956.
Corda, A. C. J.: Observations sur les animalcules microscopiques, qu'on
trouve aupres des eaux thermales de Carlsbad. Almanach de Carlsbad : 48
(1835).
- Pracht-Flora Europaischer Schimmelbildungen. Gerhard Fleischer, Leipzig.
1839.
Costerton, J. W. F., R. G. F. Murray und C. F. Robinow: Observations on
the motility and structure of Vitreoscilla. Can. J. Microbiol. 7: 329-339
(1961).
Coumartin, V.: Recherches sur une bacterie des argiles de cavernes et des
sediments ferrugineux. C. R. Acad. Sci. Paris 245: 1758-1760 (1957).
Crabtree, K. und E. McCoy.: Zoogloea ramigera Itzigsohn, identification and
description. Int. J. Syst. Bact. 17: 1-10 (1967).
-- (1974). (Zit.: Bergey's Manual 1974).
Crabtree, K., E. McCoy, W. C. Boyle und G. A. Rohlich: Isolation,
identification, and metabolic role of the sudanophilic granules of Zoogloea
ramigera. Appl. Microbiol. 13: 218-226 (1965).
Crabtree, K., W. Boyle, E. McCoy und G. A. Rohlich: A mechanism of floe
formation by Zoogloea ramigera. J. Wat. Poll. Contr. Fed. 38: 1968-1980
(1966).
Cwyk, W. M. und E. Canale-Parola: Treponema succinifaciens sp. nov., an
Anaerobic Spirochete from the Swine Intestine. Arch. Mikrobiol. 122 : 231-
239 (1979).
Cyrus, Z.: Vypracovani urcovaciho atlasu vodnfeh organismu se specialnim
zamerenfm na osi'dleni cistirenskych zaffzeni. Zav. zprava VUV. Praha. 1968.
Cyrus, Z. und V. Sladecek: Urcovaci atlas organismu z cistiren odpadnich vod.
VUV Praha-Podbaba, Prace a studie, 1973.
Czurda, V.: Uber eine neue autotrophe und thermophile Schwefelbakterien-
Gesellschaft. Zbl. f. Bakt. Abt. II. 92: 407 (1935).
Czurda, V. und E. Maresch: Beitrag zur Kenntnis der Athiorhodobakterien-
Gesellschaften. Arch. f. Mikrobiol. 8: 99-124 (1937).
Cerni, N. E., Z. V. Solov'eva, V. D. Fedorov und E. N. Kondrat'eva: Ul'tra-
structura kletok dvuch vidov purpurnych serobakterij. Mikrobiologiia 38:
479-484 (1969).
Cesnokov, V. A. und D. I. Saposnikov: The effect of the pH on development of
purple sulfur bacteria. Biochim. 1: 63-74 (1936).
The development of purple sulfur bacteria on organic acids. Biochim. 1 :
157-164(1936).
Dangeard, P. A.: Contribution a l'etude des bacteriacees vertes. Botaniste, 2.
ser. 151 (1890).
- Note sur deux bacteriacees vertes. Bull. Soc. Bot. France 56: 322 (1909).
Davis, H. S.: A new bacterial disease of freshwater fishes. Bull. U. S. Bur. Fish
38: 261-280(1922).
Davis, C. P., D. Cleven, J. Brown und E. Balish: Anaerobiospirillum a new
Genus of Spiral-Shaped Bacteria. Int. J. Syst. Bact. 26: 498-504 (1976).
Deflandre: 1937. (Zit.: Skuja: 1956).
Delap one, B.: Etude comparee de grands spirilles formant des spores:
Sporospirillum (Spirillum) proeclarum (Collin) n. g., Sporospirillum gyrini n. sp. et
Sporospirillum bisporum n. sp. A. Inst. Pasteur. (Paris) 107: 246-262 (1964).
Demoll, R. und H. Liebmann: Uber die Verteilung von Sphaerotilus natans im
Flufi. Schweiz Z. f. Hydrol. 14: 289-297 (1952).
Seamed &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgi
Literaturverzeichnis • 527
Derx, H. G.: Beijerinckia, a new genus of nitrogen-fixing bacteria occurring in
tropical soils. Koninkl. Nederl. Akad. Wetenschap. Proc. Sect. Sci. C. 53 :
140-147. (1950).
- Further researches on Beijerinckia. a. Bogoriensis 1: 1-11 (1950).
- Azotobacter insigne spec, nov., fixateur d'azote a flagellation polaire.
Koninkl. Nederl. Akad. Wetenschap. Proc. Sect. Sci. C. 54: 342-350 (1951).
- Sur les causes de la distribution geographique limitee des Beijerinckia. Riaos.
Comm. VI Int. Congr. Microbiol. (Rome) 3: 116-117 (1953).
Devide, von: Zwei neue farblose Schwefelbakterien. Thiogloea ruttneri n. g. n.
sp. und Thiogloea ragusina n. sp. Rev. Suis. d'Hydrol. 14: 446-455 (1952).
Dias, F. F. und J. V. Bhat: Microbiology of activated sludge. I. Dominant
bacteria. Appl. Microbiol. 12: 412-417 (1964).
Diedrich, D. L., C. F. Denny, T. Hashimoto und S. F. Conti: Facultatively
parasitic strain of Bdellovibrio bacteriovorus. J. Bact. 101: 989-996 (1970).
Dietrich, W. E. und J. Biggins: Respiratory mechanism in the Flexibacteriaceae
terminal oxidase system of Saprospira grandis and Vitreoscilla species. J. Bact.
105: 1083-1089(1971).
Dimitroff, V. T.: Spirochaetes in Baltimore market oysters. J. Bact. 12 : 135-177
(1926).
- Spirillum virginianum n. sp. J. Bact. 12: 19—49 (1926).
Dobell, C. C: On Cristispira veneris nov. sp. and the affinities and classification
of spirochaetes. Quart. J. Microbiol. 54: 507 (1910-1911).
- Researches on the spirochaets and related organisms. Arch. f. Protistenk. 26:
117-240(1912).
- Paraspirillum vejdovskii n. g. n. sp. a new bacterial form. Arch. f. Protistenk.
24: 97-108(1912).
Dobereiner, ].: Azotobacter paspali, sp. n. una bacteria fixadora de nitrogenio na
rizosfera de Paspalum. Pesqui. Agropec. Brasil. 1: 357-365 (1966).
Doetsch, R. N.: Notes on some structural features of Sphaerotilus natans. Arch,
f. Mikrobiol. 54: 46-55 (1966).
Dondero, N. C: Sphaerotilus, its nature and economic significance. Advanc.
appl. Microbiol. 3 : 77-107 (1961).
Dondero,N. C, R. A. Philipps und H. Heukelekian: Isolation and
preservation of cultures of Sphaerotilus. Appl. Microbiol. 9: 219-227 (1961).
Dorff, P.: Die Eisenorganismen. Pflanzenforschung, Jena 16: 1—62. (1934).
Douglas, H. C. und R. S. Wolfe: Motility of Rhodomicrobium vannieli.]. Bact.
78:597-599 (1959).
Dowson, E. J.: On the systematic position and generic names of the gram
negative bacterial plant pathogenes. Zbl. f. Bact. Abt. II. 100:177-193 (1939).
Dobereiner, J. und J. M. Day: Associative symbioses in tropical grases
characterization of microorganisms and dinitrogenfixing sites. In: Procedings of the
1st International Symposium on Nitrogen Fixation (W. E. Newton, C. J.
Nyman, Eds.). Washington State University Press 518-538 (1976).
Dobereiner, J. und A. P. Ruschel: Una nova especie de Beijerinckia. Rev. Biol
1:261-272 (1958).
Drake: 1965. (Zit.: Skuja H. in Bergey's Manual. 1974).
Drews, G. und P. Giesbrecht: Rhodopseudomonas viridis, nov. spec, ein neuiso-
liertes,obligatphototrophesBacterium.Arch.f.Mikrobiol.53 .-255-262 (1966).
Drews, G., H. Prauser und D. Uhlmann: Massenvorkommen von Synechococ-
cus plancticus nov. spec. Arch. f. Mikrobiol. 39: 101-115 (1961).
Dubinina, G. A.: O prinadleznosti Metallogenium k porjadku Mvcoplasmata-
les. DAN SSSR 184: 1433-1437 (1969).
- Inclusion of Metallogenium among the Mvcopiasmatales. Dokl. Akad. Xauk
(UdSSRj (Biol. Sci. Sect^84: 87-9C fl969;.
528 • Literaturverzeichnis
- Untersuchungen iiber die Morphologie von Metallogenium und die Beziehun-
een zu Mycoplasma. Z. f. Mikrobiol. 10: 309-320 (1970).
- 1974 (Zit.: G. A. Zavarzin in Bergey's Manual. 1974).
- Mechanizm okislenija dvuchvalentnogo zeleza i marganca zelezobakterijami,
razvivajuscimisja pri neutral'noj kislotnosti sredy. Mikrobiologija 47: 591—
599 (1978a).
- O funkcional'nom znacenii okislenija dvuchvalentnogo zeleza i marganca u
Leptothrix pseudoochraceae. Mikrobiologija 47: 783-789 (1978b).
- Biologija zelezobakterij i ich geoochimiceskaja dejatel'nost'. Dis. Inst,
mikrobiol. AN SSSR (1978c).
- Uspechi v izucenii presnovodnych bakterij. Uspechi mikrobiologii 13 : 117-
132(1978d).
Dubinina, G. A. und V. M. Gorlenko: Issledovanie mikroorganizmov krugo-
vorota marganca, zeleza i sery v meromikticeskom ozere Gek-gel.
Mikrobiologija 42: 918-924 (1973).
Novye nitcatye fotosintezirujuscie zelenye bakterii s gazovymi vakuoljami.
Mikrobiologija 44: 511-517 (1975).
Dubinina, G. A. und S. I. Kuznecov: The Ecological and Morphological
Characteristics of Microorganisms in Lesnaya Lamba (Karelia). Int. Rev. ges.
Hydrobiol. 61: 1-19 (1976).
Dubinina, G. A. und A. V. Zdanov: Recognition of the Iron Bacteria Siderocap-
sa as Arthrobacter and Description of Arthrobacter siderocapsulatus sp. nov.
Int. J. Syst. Bact. 25: 340-350 (1975).
Dugan, P. R. und D. G. Lundgreen: Isolation of the floe-forming organism
Zoogloea ramigera and its culture in complex and synthetic media. Appl.
Microbiol. 8: 357-361 (1960).
Duchow, E. und H. C. Douglas: Rhodomicrobium vannielii a new photohete-
rotrophic bacterium. J. Bact. 58: 409-416 (1949).
Dujardin, F.: Histoire naturelle des zoophytes. Paris. 1841.
Duysens, L. N. M.: Transfer of excitation energy in photosynthesis. Thesis.
Univ. Utrecht, Holland. 1952.
- The path of light energy in photosynthesis. In the photochemical apparatus.
Its structure function. Brookhaven Sympos. Biol. N. Y. 1959.
Dworkin, M.: Bilogy of the myxobacteria. A. Rev. Microbiol. 20: 75-106
(1966).
Dyar, M. T.: Isolation and cytological study of a free-living spirochaete. J. Bact.
54: 483-493 (1947).
Eckenfelder, W. W. Jr. und D.J. O'Connor: Biological Waste Treatment.
Pergamon Press. Oxford. 1961.
Edward, D. G. und E. A. Freundt: Proposal for Mollicutes as the name of the
class established for the Order Mycoplasmatales. Int. J. Syst. Bact. 17: 267-
268 (1967).
Egorova, A. A. und Z. P. Derjugina: O sporonosnoj termofil'noj tiobakterii
Thiobacillus thermophilica imschenetskii nov. sp. Mikrobiologija 32 : 439—446
(1963).
Egorova, L. A. und L. G. Loginova: Nesporoobrazujuscie bakterii gorjacich
istocnikov Kamcatki s optimal'noj temperaturoj rosta 70-75°.
Mikrobiologija 43 : 893-897(1974).
Infrakrasnye spektry ekstremal'no- i obligatno-termofil'nych bakterij roda
Thermus. Mikrobiologija 44: 1064-1067 (1975).
Egorova, L. A., I. N. Pozmogova und L. G. Loginova: EkstremaPno-termo-
fil'nyje bakterii gorjacich istocnikov Kamcatki. Dokl. Akad. Nauk SSSR 212:
747-750 (1973).
Ehrenberg, C. G.: Beitrage zur Kenntnis der Organization der Infusorien und
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.tu
Literaturverzeichnis • 529
ihrer geographischen Verbreitung besonders in Siberien. Phys. Abhandl. d. k.
Akad. Wiss. Berlin 38: (1832).
- Dritter Beitrag zur Erkenntnis grower Organisation in der Richtung des
Kleinsten Raumes. Phys. Abhandl. d. k. Akad. Wiss. Berlin: 145-336 (1833).
- 1836. In: Poggendorfs Ann. II. 8: 217 (1836).
- Vorlaufige Mittheilungen iiber das wirkliche Vorkommen fossiler Infusorien
und ihre grofle Verbreitung. Ann. Phys., Ser. 2. 8: 213-227 (1836).
- Die Infusionstierchen als vollkommene Organismen. L. Voss, Leipzig. 1838.
- Charakteristik von 274 neuen Arten von Infusorien. Ber. Bekannt. Verhandl.
Konigl. Preuss. Akad. Wiss. Berlin: 197-219 (1840).
Eidam, E.: Uber die Entwicklung des Sphaerotilus natans. Jahresber. d. Schle-
sisch. Gesell. f. vaterl. Kultur: 133 (1876).
- Uber die Entwicklung des Sphaerotilus natans Ktz., sowie iiber dessen
Verhaltnis zu Crenothrix und zu den Bacterien. Bot. Ztg. 37: 724-728 (1879).
Eikelboom, D. H.: Filamentous organisms observed in activated sludge. Water
Res. 9: 365-388(1975).
Eimhjellen, K. E.: Thiocapsa pfennigii sp. nov. a new species of the phototro-
phic sulfur bacteria. Arch. f. Mikrobiol. 73: 193-194 (1970).
Eimjellen, K. E., H. Steensland und J. Traetteberg: Thiococcus sp. nov. gen. n.,
its pigments and internal membrane system. Arch. f. Mikrobiol. 59: 82-92
Eisenberg, J.: Bakteriologische Diagnostik. Hilfstabellen zum Gebrauche beim
praktischen Arbeiten. Vol VII-XXX. 3. Aufl. Leopold Voss, Hamburg: 212
(1891).
Elazari-Volcani, B.: Genus XII. Halobacterium Elazoni-Volcani 1940. (In:
Bergey's Manual. 1957).
Eleftheriadis, D., A. Wenzel und R. Schweisfurth: Presence de microorganis-
mes oxydant le fer et le manganese dans des sources d'eaux minerales et
thermales en Grece et an Autriche. Proceedings Thermal-Waters 2, (1976).
Ellis, D.: A contribution to our knowledge of the tread-bacteria. 1. Leptothrix
ochracea (Kiitzing). 2. Gallionella ferruginea (Ehrenberg). 3. Spirophyllum
(Ellis). Zbl. f. Bact. Abt. II. 19: 502-518 (1907).
- A preliminary notice of five new species of iron-bacteria. Proc. Roy. Soc,
Edinb. 28:338-342(1908).
- I. Thioporphyra volutans (Ellis). A new genus of sulphur-bacteria. II. The
sulphur-bacteria as aids in the study of polluted waters. J. R. Tech- Coll.,
Glasg.: 165-177(1926).
- Studies of the sulphur bacteria. J. of Roy. Tech. Coll. 1929-1930.
- Sulphur bacteria. London, New York, Toronto. Longmanns, Green a Co.
1932.
Enderlein, G.: Ein neues Bakteriensystem auf vergleichend morphologischen
Grundlage. Sitz. Ber. Gesell. Natur.: 309-317 (1917).
- Bakterien-Cyclogenie Prolegomena zu Untersuchungen iiber Bau, ge-
schlechtliche una ungeschlechtlige Entwicklung der Bakterien. Walter de
Gruyter und C. Berlin und Leipzig. 1925.
Engel, H. und W. jr. Mevius: 1951. (Zit.: Zavarzin, G. A.: 1961).
Engelmann, Th. W.: Zur Biologie der Schizomyceten. Bot. Ztg. 40: 321-327;
337-341 (1882).
Engler, A.: Im Kieler Hafen in dem sogenannten «toten Grund» vorkommende
Pilzformen. Verhandl. bot. Ver. Brandenburg 24: 17-20 (1882).
- Uber die Pilz-Vegetation des weissen oder todten Grundes in der Kieler
Bucht. Vierter Bericht der Commission zur wissenschaftlichen Untersu-
chung der deutschen Meere in Kiel fiir 1877 bis 1881, Abt. I. : 187-193
(1883).
530 • Literaturverzeichnis
Engler, A. und K. Prantl: Die natiirlichen Pflanzenfamilien. W. Engelmann.
Leipzig. 1898.
Esmarch, E., von: Uber die Reinkultur eines Spirillum. Zbl. f. Bact. Abt. I. 8:
225-230 (1887).
Ert, M., van und J. T. Staley: Gas-vacuolated strains of Microcyclus aquaticus. J.
Bact. 108:236-240(1971).
Ewart, A. J.: On the evolution of oxygen from coloured bacteria. J. of Linn.
Soc. Bot. 33: 123-155(1897).
- Bacteria with assimilatory pigments found in the tropics. Ann. Bot., 11: 486
(1897).
Fair, G. M. und M. C. Whipple: The microscopy of drinking water. 1927.
Famintzin, A.: Eine neue Bacterienform: Nevskia ramosa. Bull. Acad. Imp.
Sci., St. Petersb., Ser. IV. 34: 484 (1892).
Fantham, H. B.: Some researches on the life-cycle of spirochaetes. Ann. Trop.
Med. Parasitol. 5: 479-496 (1911).
Faure-Fremiet, E. und Ch. Rouiller: Etude au microscope electronique d'une
bacterie sulfureuse Thiovulum majus Hinze. Exper. Cell. Res. 14: 29—46
(1958).
Faust, L. und R. S. Wolfe: Enrichment and cultivation of Beggiatoa alba. J.
Bact. 81: 99-106 (1961).
Fedorov, V. D.: Mezotrofnyj fotosintez, osuscestvljaemyj zelenymi serobakte-
rijami. Bjul. Mosk. inst. prir., odd. biol. 69: 158-159 (1964).
Fedorov, V. D. und A. A. Belousova: Vlijanie nekotorich organiceskich soedi-
nenij na rost Chlorobium tbiosulfatophilum v zavisimosti ot uslovij osvesceni-
ja i nalicija bikarbonata. Mikrobiologija 38: 589-597 (1969).
Feldmann, J.: La vegetation thio-thermale de la source de Monlay-Yakoub
(Maroc). Bull, de la Soc. d'Hist. Nat. de 1' Afrique du Nord. : 29-36 (1946).
Fiorini-Mazzanti, E.: Soure due nuove specie crittogamiche. Atti Accad. «Nuo-
viLincei» 27: 101-103 (1874).
Firsov, N. N., R. N. Ivanovskij und E. N. Kondrat'eva: Deistvie acetata na
okislenie serovodoroda i fotoassimiljaciju uglekisloty Ectothiorhodospira sha-
poshmkovii. Mikrobiologija 41: 953-958 (1972).
Fischer, A.: Untersuchungen uber Bakterien. Jb. Wiss. Bot. 27: 1-163 (1895).
Fischer, T.: Ein Fall von Stomatitis aus klinischem und bakteriologischem
Gesichtspunkt. Bacterium stomatofoetidum, ein aerober Faulnisserreger. Z.
Hyg. Infekt. Kr. 49: 329-355 (1905).
Fjerdingstad, E.: Clathrochloris marina n. sp. A new member of Chlorobacte-
ria. Rev. Algol, n. ser. 9: 25-27 (1967).
Fliigge, C.: Die Mikroorganismen. 3. Aufl. Leipzig Vogel. 1896.
Ford, W. W.: Text-book of Bacteriology. Saunders, Philadelphia. 1927.
Fott, B. und J. Komarek: Das Phytoplankton der Teiche im Teschner Schlesien.
Preslia32: 113-141 (1960).
Fox, D. L. und R. A. Lewin: A preliminary study of the carotenoids of some
flexibacteria. Can. J. Microbiol. 9: 753-768 (1963).
Francev, A. V.: 1959. (Zit.: Zavarzin, G. A.: 1961).
Frank, B.: Uber die Pilzsymbiose der Leguminosen. Ber. Deutsch. Bot. Ges. 7:
332-346 (1889).
Freeze, H. und T. D. Brock: Thermostable aldolase from Thermus aquaticus. J.
Bact. 101: 541-550 (1970).
Frenzel, J.: Neue oder wenig bekannte SufSwasserprotistenk. I. Modderula
hartwigii n. g. n. sp. Biol. Zbl. 17: 801-808 (1897).
Friedman, B. A. und P. R. Dugan: Identification of Zoogloea species and the
relationship to zoogloeal matrix and floe formation. J. Bact. 95: 1903-1909
(1968). -
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pamrtaqwe@rambler.
Literaturverzeichnis • 531
Friedman, B. A., P. R. Dugan, R. M. Pfister und C. C. Remsen: Fine structure
and composition of the zoogloeal matrix surrounding Zoogloea ramigera. J.
Bact. 96: 2144-2153 (1968).
Friedman, B. A., P. R. Dugan, R. M. Pfister und C. C. Remsen: Structure of
exocellular polymers and their relationship to bacterial flocculation. J. Bact.
98: 1328-1334 (1969).
Fuhrmann, F.: Vorlesungen uber technische Mykologie. G. Fischer, Jena. 1913.
Fuller, W. H. und A. G. Norman: Characteristics of some soil Cytophages. J.
Bact. 45: 565-572 (1943).
Cellulose decomposition by aerobic mesophilic bacteria from soil. I.
Isolation and description of organisms. J. Bact. 46: 273-280 (1943).
Gambarjan, M. E.: Novyj vid purpurnoj serobakterii Thiopedia sevani (n. sp.).
Mikrobiologija 31: 282-283 (1962).
Ganter, I. R. und W. Schwartz: Beitrage zur Biologie der Eisenmikroben. II.
Leptothrix crassa Choi. Schweiz. Z. Hydrol. 18: 171-192 (1956).
Garnjobst, L.: Cytophaga columnaris (Davis) in pure culture: a myxobacterium
pathogenic to fish. J. Bact. 49: 113-128 (1945).
Gaufin, A. R. und C. M. Tarzwell: Environmental changes in a polluted stream
during winter. Amer. Midi. Natur. 54: 78-88 (1955).
Geitler, L.: 1925. (In: Geitler L. und A. Pascher: Die Siiflwasserflora. Heft 12:
«Cyanophyceas», Jena. 1925).
- Uber Polyangiumparasiticum n. sp., eine submerse, parasitische Myxobacte-
riacee Arch. f. Protistenk. 50: 67-88 (1925).
- Beitrage zur Kenntnis der Flora ostholsteinischer Seen. Arch. f. Protistenk. :
52 (1925).
- 1932. (Zit.: H. Beger und G. Bringmann: 1953).
- Ein Hyp homierobium als Bewohner der Gallertmembran der Sufiwasser-
Rhodophycee Kyliniella. Arch. f. Mikrobiol. 51: 399-400 (1965).
- Chamaesiphonosira cymbellicola n. gen., n. sp. ein knospenbildendes Bakte-
rium und sein spezialisierter Epiphytismus. Arch. Mikroboil. 103: 231-236
(1975).
Geitler, L. und A. Pascher: 1925. (In: Geitler L. und A. Pascher: Die Siifiwas-
serflora. Heft 12: Cyanochloridinae - Chlorobacterriaceae, Jena. 1925).
Gibbons, N. E.: 1974. (In: Bergey's Manual. 1974).
Gibbons, N. E., R. G. E. Murray: Proposals concerning the higher taxa of
Bacteria. Int. J. Syst. Bact. 28: 1-6 (1978).
Gicklhorn, J.: Uber neue farblose Schwefelbakterien. Zbl. f. Bact. Abt. II. 50:
415-427 (1920).
- Zur Morphologie und Mikrochemie einer neuen Gruppe der Purpurbakte-
rien. Ber. Deutsch. Bot. Ges. 39: 312-319 (1921).
Gicklhorn, J.: 1937. (Zit.: H. Beger und G. Bringmann: 1953).
Giesberger, G.: Beitrage zur Kenntnis der Gattung Spirillum. Ehrb. Delft. 1936.
- Some observations on the culture, physiology and morphology of some
brown-red Rbodospirillum-species. Ant. v. Leeuwenh. 13: 135-148 (1947).
Giesbrecht, P. und G. Drews: Uber die Organisation und die makromolekulare
Architektur der Thylakoide «lebender» Bakterien. Arch. f. Mikrobiol. 54:
297-330 (1966).
Gieszczykiewicz, M.: Zagadniene systematikki w bakteriologii - Zur Frage
der Bakterien-Systematik. Bull. Acad. Pol. Sci. Ser. Sci. Biol. 1: 9-27
(1939).
Gietzen, J.: Untersuchungen uber marine Thiorhodaceen. Zbl. f. Bact. Abt. II.
83: 183-218(1931).
Gimesi, N.: Planktomyces bekefii Gim. nov. gen. et sp. Hydrobiol. Tanul-
manyok. Budapest. 1924. ^^
532 • Literaturverzeichnis
Gins, A. H.: Untersuchungen iiber die Spirillen der menschlichen Mundhohle.
Z. f. Hyg. Infekt. Kr. 124: 460 (1942).
Gloe, A. und N. Risch: Bacteriochlorophyll c„ a new Bacteriochlorophyll from
Chloroflexus aurantiacus. Arch. Mikrobiol. 118: 153-156 (1978).
Godnev, T. N. und G. G. Vinberg: O pigmentach «zelonoj bakterii». DAN
SSSR76: 909 (1951).
Gogotov, I. N. und N. A. Novikova: Vydelenie vodoroda rastuscimi kuPtura-
mi purpurnych serobakterij. Mikrobiologija 37: 19-25 (1968).
Golovaceva, R. S.: In: Sovremennye predstavlenija o termofilii mikroorganiz-
mov. «Nauka» M. 72: 84 (1973).
- Associirovanie Thermus spp. s termofil'nymi nitrificirujuscimi bakterijami.
Izv. Akad. Nauk. SSSR, Ser. biol. 5: 767-769 (1976a).
- Termofil'nye nitrificirujuscie bakterii gorjacich istocnikov. Mikrobiologija
45: 377-379 (1976b).
- Kompleksnye sfericeskie tela Thermus ruber. Mikrobiologija 46: 506-512
(1977)- . , . ,
- Prikreplenie kletok Sulfobacillus thermosulfidooxidans k poverchnosti sulfid-
nych mineralov. Mikrobiologija 48: 528-533 (1979a).
- Ul'trastrukturnaja organizacija kletok i spor Sulfobacillus
thermosulfidooxidans. Mikrobiologija 48: 681—688 (1979b).
- Osobennosti morfogeneza Sulfobacillus thermosulfidooxidans.
Mikrobiologija 48: 863-867 (1979c).
Golovaceva, R. S. und G. I. Karavajko: II Mezdunarodnyj simpozium «Rost
mikroorganizmov na Ci soedinenijach» Puscino, Tezisy dokl. : 110 (1977).
Sulfobacillus novyj rod termofil'nych sporoobrazujuscich bakterij.
Mikrobiologija 47: 815-822(1978).
Golovaceva, R. C. und T. A. Pivovarova: Kokkovidnye kletki i sferoplasty
kul'tur roda Thermus. Mikrobiologija 46: 695-702 (1977a).
- Povedenie sferoplastov v kulturach Thermus ruber. Mikrobiologija 46: 1019—
1027 (1977b).
Gonder, R.: Spirochaten aus dem Darmtraktus von Pinna: Spirochaete pinnae
nov. spec, und Spiroachaete hartmanni nov. spec. Zbl. f. Bact. Abt. I. Orig.
47:491-494 (1908).
- Spirochaetenstudien. Zool. Jb. Suppl. XV. 1: 485-514 (1912).
Gonder, R. und J. Gross: Zur Morphologie des Treponema icterogenes Uhlen-
huth und Fromme. Arch. f. Protistenk. 39: 62-82 (1919).
Gorlenko, V. M.: Novyj vid zelenych serobakterij. DAN SSSR 179: 1229-1231
(1968).
- Sporoobrazovanie u pockujuscejsja fotogeterotrofnoj bakterii.
Mikrobiologija 38: 126-134 (1969).
- A new phototrophic green sulfur bacterium - Prosthecochloris aestuarii nov.
gen. spec. Z. f. Mikrobiol. 10: 147-149 (1970).
- Fototrofnye koricnevye serobakterii Pelodictyon phaeum nov. sp.
Mikrobiologija 41: 370-371 (1972).
- Okislenie tiosulfata Amoebobacter roseus v temnote v mikroaerofiPnych
uslovijach. Mikrobiologija 43: 729-731 (1974).
- Charakteristika nitcatych fototrofnych bakterij iz presnych ozer.
Mikrobiologija 44 : 756-758 (1975).
Gorlenko, V. M. und S. I. Kuznecov: Vertikal'noe raspredelenie fotosinteziru-
juscich bakterij v ozere Kononner Marijskoi ASSR. Mikrobiologija 40: 746-
747(1971).
Gorlenko, V. M. und E. V. Lebedeva: Novye zelenye serobakterii s vyrostami.
Mikrobiologija 40: 1035-1039 (1971).
Gorlenko, V. M. und S. I. Lokk: Vertikal'noe raspredelenie i osobennosti
Scanned &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgrambler.
Literaturverzeichnis • 533
vidovogo sostava mikroorganizmov nekotorych stratificirovannych ozer
Estonii. Mikrobiologija 48 : 351-359 (1979).
Gorlenko, V. M. und T. N. Zilina: Izucenie tonkoj struktury zelenych
serobakterij stamma CK-413. Mikrobiologija 37: 1052-1056 (1968).
Gorlenko, V. M., E. N. Cebotarev una B. I. Kacalkin: Mikrobiologiceskie
processy okislenija serovodoroda v ozere Vejsovom (Slavjanskie ozera).
Mikrobiologija 43: 530-534 (1974).
Gorlenko, B. M., O. I. Keppen und A. N. Puckov: Morfologiceskaja differen-
ciacija u nesernych purpurnych bakterij. Mikrobiologija 45: 817-824
(1976).
Gorovic-Vlasova, L. M.: Opredelitel' bakterij. Snabtechizdat, Moskva. 1933.
Gossling, J. und W. E. C. Moore: Gemmiger formicilis n. gen. n. sp., an
Anaerobic Budding Bacterium from Intestines. Int. J. Syst. Bact. 25:202-207
Grasse, P. P.: Notes protistologiques. I. La Sporulation des Oscillospiracees.
II. Le genre Alysielta Langeron 1923. Arch. Zool. Exp. Gen. Notes. Rev. 62 :
25-34 (1924).
Gray, B. H.: Proposal to Place Chloropseudomonas and C. ethylica on the List
of Nomina Rejicienda Requests for an Opinion. Int. J. Syst. Bact. 27: 168
(1977).
Gray, B. H., C. F. Fowler, N. A. Nugent und R. C. Fuller: A reevaluation of
the presence of low midpont potential cytochrome 551,5 in the green photo-
synthetic bacterium Chloropseudomonas ethylica. Biochem. Bioph. Res.
Commun. 47: 322-327 (1972).
Gray, B. H., C. F. Fowler, N. A. Nugent, N. Rigopoulos und R. C. Fuller:
Reevalution of Chloropseudomonas ethylica strain K 2. Int. J. Syst. Bact. 23 :
256-264 (1973).
Graf, W.: Anaerobe Myxobakterien, neue Mikroben in der Menschlichen
Mundhohle. Arch f. Hyg. u. Bakt. 145: 405-459 (1961).
- Uber Wassermyxobakterien. Arch. f. Hyg. u. Bakt. 146: 114-115 (1962a).
- Die zytopathogenen Eigenschaften der anaeroben Myxobakterien. Arch. f.
Hyg. u. Bakt. 146: 481-491 (1962b).
- Die Pathogenitat anaerober Myxobakterien (Sphaerocytophaga) in Tierver-
such. Arch. f. Hyg. u. Bakt. 146: 492-500 (1962c).
- Bewegungsorganellen bei Myxobakterien. Arch. f. Hyg. u. Bakt. 149: 518—
526 (1965).
Graf, W., G. Perschmann: Uber eine neue Spezies von Vitreoscilla proteolytica
im Bodensee. Arch. f. Hyg. u. Bakt. 154: 128-137 (1970).
Graf, W. und P. Stiirzenhorecker: Bilogie und Vorkommen von aeroben
Wassermyxobakterien Sporocytophaga cauliformis im Bodensee. Arch. f. Hyg. u.
Bakt. 148: 79-96(1964).
- Uber die Okologie von Wassermyxobakterium (Sp. cauliformis) im
Bodensee. Arch. f. Hyg. u. Bakt. 149: 256-264 (1965a).
- Myxobakterientypenquotient als Eutrophierungsindikator bei Oberfla-
chengewassern. Arch. f. Hyg. u. Bakt. 149: 265-273 (1965b).
Graf, W. und D. Sukatsch: Wassermyxobakterien (Sporocytophaga cauliformis)
und ihr antibiotischer Wirkstoff. Arch. f. Hyg. u. Bakt. 149: 694-707 (1965c).
Green, Margaret und P. W. Willson: The utilization of nitrate nitrogen by the
Azotobacter. J. Gen. Microbiol. 9: 89-96 (1953).
Greenberg, E. P. und E. Canale-Parola: Spirochaeta halophila sp. n., a
Facultative Anaerobe from High-Salinity Pond. Arch. Mikrobiol. 110: 185-194
(1976).
Greville: 1889. (Zit.: Toni, J. B., de und V. Trevisan in: P. A. Saccardo: Sylloge
Fungorum 8: 923-1087 (1889).
jj-t - juiiciaturvcrzeicnnis
Griffith, J. W.: On Gallionella ferruginea (Ehrenb.). Ann. Mag. Nat. Hist.,
Ser. 2, 12: 438(1853).
Gromov, B. V.: Novaja bakterija roda Microcyclus. DAN SSSR 152: 733-734
(1963).
- Bakterii roda Caulobacter soputstvujuscie vodorosljam. Mikrobiologija 33:
298-305 (1964).
- Zgutikovanie Seliberia stellata Arist. et Parink. Vestn. LGU, 21, (1964).
Gromov, B. V., K. A. Mamkaeva: Elektronnomikroskopiceskoje izucenie pa-
razitizma bakterii Bdellovibrio chlorellavorus na kletkach zelonoj vodorosli
Chlorella vulgaris. Citologija 14: 256-260 (1972).
O novom rode Vampirovibrio dlja bakterii parazitirujuscej na chlorelle i
ranee otnesennoj k rodu Bdellovibrio. Mikrobiologija 49: 165-166 (1980).
Gromov, B. V., O. F. Ivanov, K. A. Mamkaeva und I. A. Avillov: Fleskibak-
terija lizirujuscaja sinezelenye vodorosli. Mikrobiologija 41 : 1074—1079
(1972).
Gross, J.: Cristispira nov. gen. Ein Beitrag zur Spirochatenfrage. Mitt. zool. Sta.
Neapel20: 41-93 (1910).
- Uber freilebende Spironemaceen. Mitt. zool. Sta. Neapel 20: 188-203 (1911).
- Uber Systematik, Struktur und Fortpflanzung der Spironemacea. Zbl. f. Bact.
Abt. I. 65: 83-98(1912).
Grula, E. A., R. H. Weaver und O. F. Edwards: Studies on a strain of
Caulobacter from water. II. Nutrition, with Implications for Cytology. J.
Bact. 68:201-206 (1954).
Guelin, A., P. Lepine, D. Lamblin und J. Sisman: Isolement d'un parasite
bacterien actif sur les germes Gram-positifs a partir d'echantillons d'eau
polluee. C. R. Acad. Sci. Paris. 266: 2508-2509 (1968).
Guillebeau, A.: Studien iiber Milchfehler und Euterentziindungen bei Rindern
und Ziegen. I. Uber Ursachen der Euterentziindung. Land. Jb. Schweiz. 4:
27-44 (1890).
Gusev, M. V., L. B. Senderova und K. M. Kondrat'eva: Otnosenie k molekul-
jarnomu kislorodu raznych vidov fotosintezirujuscich bakterij.
Mikrobiologija 38 : 787-792 (1969).
Vlijanie koncentracij kisloroda na rost i vyzivaemost'
fotosintezirujuscich bakterij. Mikrobiologija 39: 562-566 (1970).
Guseva, K. A.: O dvuch planktonnych mikroorganizmach, prinimajuscich
ucastie v krugovorote zeleza. Trudy biol. stan. Borok 2: 24 (1955).
Habib Ali, S. und J. L. Stokes: Stimulation of heterotrophic and autotrophic
growth of Sphaerotilus discophorus by manganous ions. Ant. v. Leeuwenh.
37: 519-528 (1971).
Hageage, G.J. und R. G. E. Murray: Random rotation among Vitreoscilla
species. J. Bact. 84: 1345-1346 (1962).
Hajdu, L., Observations on the bacterium species Planctomyces guttaeformis
Hortob. (Caulobacteriales). Arch. Hydrobiol. 74: 172-185 (1974).
Halfen, L. N., B. K. Pierson und G. W. Francis: Carotenoids of a gliding
organism containing bacteriochlorophylls. Arch. Mikrobiol. 82: 240-246
(1972).
Hama, T.: Studien iiber eine neue Rhodospirillum-An aus Yumoto bei Nikko.
J. Sci. Hiroshima Univ.. Ser. B., Div. 2, Bot. 1: 133-155 (1933).
- Nine species belonging to the order Thiobacteriales Buchanan found in
Hiroshima. J. Sci. Hiroshima Univ., Ser. B, Div. 2, 1: 157-163 (1933).
Hanert, H.: Untersuchungen zur Isolierung, Stoffwechselphysiologie und
Morphologie von Gallionella ferruginea Ehrenberg. Arch. f. Mikrobiol. 60:
348-376 (1968).
- Struktur und Wachstum von Gallionella ferruginea Ehrenberg am natiirlichen
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 535
Standort in den ersten 6 Std. der Entwicklung. Arch. f. Mikrobiol. 75 : 10-24
(1970).
Hanert, H.: Quantifizierung der Massenentwicklung des Eisenbakteriums
Gallionella ferruginea unter natiirlichen Bedingungen. Arch. Mikrobiol. 88:225-
243 (1973).
- Untersuchungen zur individuellen Entwicklungskinetik von Gallionella
ferruginea in statischer Mikrokultur. Arch. Mikrobiol. 96: 59-74 (1974).
Hansen, T. A., H. Gemerden: Sulfide Utilisation by Purple Nonsulfur
Bacteria. Arch. Mikrobiol. 86: 49-56 (1972).
Hansen, T. A. und H. Veldkamp: Rhodopseudomonas sulfidopbila, nov. spec,
a New Species of the Purple Nonsulfur Bacteria. Arch. Mikrobiol. 92 : 45-58
(1973).
Hanson, L. E., D. N. Tripatky, L. B. Evans und A. D. Alexander: An unusual
Leptospira, serotype illini (a new serotype). Int. J. Syst. Bact. 24: 355-357
(1974).
Hansgirg, A.: Mykologische und algologische Beitrage aus Bohmen. Ost. bot.
Z. 35: 113-119; 161-166(1885).
- Beitrage zur Kenntnis der Kellerbacterien, nebst Bemerkungen zur
Systematik der Spaltpilze (Bacteria). Ost. bot. Z. 38: 227-230; 263-267 (1888).
- Uber neue Siifiwasser- und Meeresalgen und Bacterien mit Bemerkungen zur
Systematik dieser Phycophyten und iiber den Einflufi des Lichtes auf Ortsbe-
wegungen des Bacilluspfeifferii Sitz. Ber. Boh. Gesell. Wiss. Natur. Math. K.
1, 1: 1-34 (1890).
- Uber die Bacteriaceen - Gattung Phragmidiothrix Engler und einige Lepto-
thrix Kiitzing - Arten. Bot. Zbl. 49: 314-315 (1891).
- Prodromus der Algenflora von Bohmen. Theil 2. Arch. Naturw. Landes
Forsch. Bohm. Bot. 8: 1-268 (1892).
Hanson, L. E.: 1965. In: Tripatky, Hanson: Am. J. Vet. Res. 33: 1723-1727
(1972).
Harder, E.: Iron-depositing bacteria and their geologic relations. U. S. Geolog.
Survey. Prof. Paper 113 (1919).
Harder, W., M. Attwood und J. R. Quayle: Methanol Assimilation by Hypho-
microbium sp., J. Gen. Microbiol. 78: 155-163 (1973).
Hardman, Y. und A. T. Henrici: Studies of freshwater bacteria. J. Bact. 37: 97-
104 (1939).
Harold, Ruth und R. Y. Stanier: The genera Leucothrix and Thiothrix. Bact.
Rev. 19: 49-64 (1955).
Hawkes, H. A.: The Ecology of Waste Water Treatment. Pergamon Press, The
MacMillan Co. New York. 1963.
Hausler, J.: Vyzkum biologickeho cisteni skrobarenskych odpadnich vod. Zav.
zprava VUV, Praha. 1968.
- Atlas mikrobu zijicich ve vodnim prostredi. Bulletin metodickeho strediska
chemickotechnologickych laboratofi. c. 17. Praha. 1972.
Heinen, W.: Growth Conditions and Temperature-Dependent Substrate
Specificity of Two Extremely Thermophilic Bacteria. Arch. Mikrobiol. 76: 2-17
Heinze, B.: Uber die Stickstoffassimilation durch niedere Organismen. Landw.
Jb. 35: 889-910(1906).
Henneberg, W.: Betrage zur Kenntnis der Essigbakterien. Zbl. f. Bact. Abt. II.,
3:223-231 (1897).
Henrici, A. T. und D. E. Johnson: Stalked bacteria, a new order of Schizomyce-
tes. J. Bact. 29:3-4 (1935).
Studies of freshwater bacteria. II. Stalked bacteria, a new order of Schizo-
mycetes. J. Bact. 30: 61-2111935).
536 • Literaturverzeichnis
Hespell, R. B.: Serpens flexibilis gen. et sp. nov., an Unusually Flexible Lactate-
Oxidizing Bacterium. Int. J. Syst. Bact. 27: 371-381 (1977).
Hespell, R. B. und E. Canale-Parola: Spirochaeta litoralis sp. n., a strictly
anaerobic marine spirochete. Arch. f. Mikrobiol. 74: 1-18 (1970).
- Carbohydrate Metabolism in Spirochaeta strenostrepta. J. Bact. 103 : 216-
226 (1970).
Heukelekian, H.: 1968. (Formal discussion zu: A. Pasveer: Investigation on the
Control of Filamentous Bulking. Fourth Int. Conf. Wat. Poll. Res., Prag.
1968).
Heynig, H.: Zur Kenntnis des Planktons mitteldeutscher Gewasser. Arch. f.
Protistenk. 105: 407-416 (1961).
- Einige Bemerkungen und Beobachtungen zur Gattung Planctomyces Gimesi,
1924 (Caulobacteriales). Arch. f. Protistenk. 122: 275-281 (1979).
Hieronymus: 1898. (In: O. Kirchner: Schizophyceae - in: A. Engler und
K. Prantl: Die natiirlichen Pflanzenfamilien. W. Engelmann. Leipzig 1898).
Hilger, F.: Etudes sur la systematique du genre Beijerinckia Derx. Ann. Inst.
Pasteur (Paris) 109: 406-423 (1965).
Hinze, G.: Thiophysa volutans, ein neues Schwefelbakterium. Ber. Deutsch.
Bot. Ges. 21: 309(1903).
- Beitrage zur Kenntnis der farblosen Schwefelbakterien. Ber. Deutsch. Bot.
Ges. 31: 189-202(1913).
Hirsch, P.: Photosynthetic bacterium growing under carbon monoxide. Nature
(Lond.) 217: 555-556 (1968).
- Gestielte und knospende Bakterien: Spezialisten fur C-l Stoffwechsel an
nahrstoffarmen Standorten. Mitt. int. Ver. Limnol., 14: 52-63 (1968).
- Biology of budding bacteria. IV. Epicellular deposition of iron by aquatic
budding bacteria. Arch. f. Mikrobiol. 60: 201-216 (1968).
- 1971. (In: Bergey's Manual 8th ed. 1974).
- Re-evaluation of Pasteuria ramosa Metchnikoff 1888, a bacterium pathogenic
for Daphnia species. Int. J. Bact. 22: 112-116 (1972).
- Two identical genera of budding and stalked bacteria: Planctomyces Gimesi
1924 and Blastocaulis Henrici and Johnson 1935. Int. J. Bact. 22: 107-111
(1972).
Hirsch, P. und S. F. Conti: Bilogy of budding bacteria. I. Enrichment, isolation
and morphology of Hyphomicrobium spp. Arch. f. Mikrobiol. 48 : 339-357
(1964).
Biology of budding bacteria. II. Growth and nutrition of Hyphomicrobium.
Arch. f. Mikrobiol. 48: 358-367 (1964).
Hirsch, P. und H. Pankratz: Study of bacterial populations in natural
environments by use of submerged electron microscope grids. Z. f. Mikrobiol. 10:
589-605 (1970).
Hirsch, P. und G. Rheinheimer: Biology of budding bacteria. V. Budding
bacteria in aquatic habitats: occurrence, enrichment and isolation. Arch. f.
Mikrobiol. 62: 289-309 (1968).
Hitchins, V. M. und H. L. Sadoff: Morphogenesis of Cysts in Azotobacter
vinelandii. J. Bact. 104: 492-498 (1970).
Hoare, D. S. und J. Gibson: Photoassimilation of acetate and the biosynthesis
of aminoacids by Chlorobium thiosulphatophilum. Biochem. J., 91: 546-559
(1964).
Hofsten, B. V., B. Berg und S. Beskow: Observations on bacteria occuring
together with Sporocytophaga in aerobic enrichment cultures on cellulose.
Arch. f. Mikrobiol. 79: 69-79 (1971).
Holden, M.: Loefflerella; glanders and melioidosis. (In: Gay: Agents of disease
and host resistance. Charles C. Thomas, Springfield, Illionois, 1935).
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwelgrambler.
Literaturverzeichnis • 537
Hollande, A. C: Presence d'un spirochetoide nouveau, Cristispirella caviae n.
g., n. sp. a membrane ondulante tres developee dans l'intenstin du cobaye. C.
R. Acad. Sci. Paris. 172: 1693-1696 (1921).
- La structure cytologique de Bacillus enterothrix camptospora Collin et de
Bacillospira (Spirillum) proeclarum Collin. C. R. Acad. Sci. Paris. 196: 1830—
1832 (1933).
Holt, J. G. und R. A. Lewin: Herpetosiphon aurantiacus gen. et sp. n., a new
filamentous, gliding organism. J. Bakt. 91: 311-323 (1966).
Holt, S. C. und E. Canale-Parola: Eine structure of Sp. stenostrepta a free living
anerobic spirochete. J. Bact. 96: 822-835 (1968).
Holt, S. C, S. F. Conti und R. C. Fuller: Photosynthetic apparatus in the green
bacterium Chloropseudomonas ethylicum. J. Bact. 91: 311-323 (1966).
Holt, S. C, H. G. Trtiper und B. J. Takacs: Fine structure of Ectothiorhodospi-
ra mobilis strain 8113.Thylakoids: Chemical fixation and freeze-etching
studies. Arch. f. Mikrobiol. 62: 111-128 (1968).
Hortobagyi, T.: Uj Planctomyces Rajok. Botaniki kozlemenyek 52: 111-119
(1965).
Houwink, A. L.: Caulobacter versus Bacillus spec. div. Nature 168: 654 (1951).
- Contamination of electron microscope preparations. Experientia 8: 385
(1952).
- A macromolecular mono-layer in the cell wall of Spirillum spec. Biochem.
Biophys. Acta 10: 360-366 (1953).
- Caulobacter, its morphogenesis, taxonomy and parasitism. Ant. v. Leeu-
wenh. 21: 49-64 (1955).
Houwink, A. L. und W., van Iterson: Electron microscopical observations on
bacterial cytology. II. A study on flagellation. Bioch. et biophys. acta 5: 10-
14 (1950).
Hovind-Hougen K.: Leptospiraceae a new Family to Include Leptospira Nogu-
chi 1917 and Leptonema gen. nov. Int. J. Syst. Bact. 29: 245-251 (1979).
Hoflich, K.: Kultur und Entwicklungsgeschichte der Cladothrix dichotoma
(Cohn). Osterr. Monatschr. Tierheilk. 25: 4-23; 49-64 (1901).
Hohnl, G.: Ein Beitrag zur Physiologie der Eisenbakterien. Vom Wasser 22:
176 (1955).
- Ernahrungs- und stoffwechselphysiologische Untersuchungen an Sph. natans.
Arch. f. Mikrobiol. 23: 207-250 (1955).
- Uber die Biologie der Abwasserpilze unter besonderer Beriicksichtigung der
Abwasser der Zellstoff- und Papierindustrie. Wochebl. f. Papierfabr. 84:564-
569 (1956).
Huber-Pestalozzi, G.: Das Phytoplankton des Siiftwassers. (In: A. Thiene-
mann: Die Binnengewasser, Band 16, Teil 1. Schweizerbart'sche Verlags-
buchhandlung, Stuttgart. 1938).
Hund, A. und O. Kandler: Zur Ernahrungsweise und Physiologie vom
Caulobacter. Arch. f. Mikrobiol. 25: 65-89 (1956).
Hurlbert, R. E. und J. Lascelles: Ribulose-diphosphate carboxylase in Thior-
hodaceae. J. Gen. Microbiol. 33: 445-458 (1963).
Hutchinson, H. B. und J. Clayton: On the decomposition of cellulose by an
aerobic organism (Spirochaeta cytophaga, n. sp.). J. agric. Sci., Camb. 9: 143—
173 (1919).
Huzel, C: Beitrag zur Kenntnis der mikroskopischen Pflanzenwelt der Rauhen
Wiese bei Bohmenkirche. Voroffentl. Wurth. Landstelle f. Naturschutz, 13.
Schwab. Hall. 1937.
Hiibener, H. J. und H. Reiter: Beitrage zur Atologie der Weilschen Krankheit.
Deut. Med. Wocheschr. 42: 1-2 (1916).
Hylemon, P. B„ J. S. jr. Wells, J. H. Bowdre, T. O. MacAdoo und N. R.
538 • Literaturverzeichnis
Krieg: Designation of Spirillum volutans Ehrenberg 1832 as type species of the
genus Spirillum Ehrenberg 1832 and designation of the neotype strain of S.
volutans. Int. J. Bact. 23: 20-27 (1973).
Hylemon, P. B., J. S. Wells, N. R. Krieg und H. W. Jannasch: The genus
Spirillum: A taxonomic study. Int. J. Bact. 23: 340-380 (1973).
Hynes, H. B. N.: The biology of polluted waters. University Press, Liverpool.
1960.
Imhoff, J. F. und H. G. Triiper: Ectothiorhodospira halochloris sp. nov. a New
Extremely Halophilic Phototrophic Bacterium Containing Bacteriochloro-
phyll b+. Arch. Mikrobiol 114: 115-121 (1977).
Imseneckaja, J. A.: Sravnitel'naja charakteristika kul'tur Azotobaktera. Avto-
ref. diss. Moskva 1950.
Imseneckij, A. A.: O filogenii Azotobacter chroococcum. Mikrobiologija 40:
459^67 (1946).
Imseneckij, A. A. und L. A. Kuzjurina: O bakteriotrofnych mikroorganiz-
mach. (K evoluciji chimicestva i parazitizma). Mikrobiologija 20: 3-12
(1951).
Imseneckij, A. A. und L. I. Solnceva: On aerobic cellulose-decomposing
bacteria. DAN SSSR, ser. Biol. 6: 1115-1172 (1936).
The symbiosis of cellulose-decomposing and nitrogen-fixing bacteria.
Mikrobiologija 9: 790-803 (1940).
Inada, R. und Y. Ido: A report on the discovery of the causal organism (a new
species of Spirochaeta) of Weil's disease. Tokyo med. News, 351-360; 1031—
1036 (1915).
Inada, R., Y. Ido, R. Hoki, R. Kaneko und H. Ito: The etiology, mode if
infection, and specific therapy of Weil's disease (Spirochaetosis icteroha-
emorrhagica). J. Exp. Med. 23: 377-^02 (1916).
Isacenko, B. L.: Issledovanija nad bakterijami Severnovo Ledovitovo Okeana.
Trudy Murmanskoj naucno-promislovoj ekspedicii 1906. Mag. dissertacija.
Petrograd. 1914.
- Mikrobiologiceskie issledovanija mad grjazevymi ozerami. Trudy geol. kom.
Nov. ser. 148: 1-154 (1927).
- 1927. (In: Jubilejnyj sbornik posvjascenyj I. P. Borodinu. Leningrad. Gos.
rusk. bot. ob-vo. 1929).
- Izbrannye trudy. Tomm I—II. Izdatelstvo Ak. Nauk. SSSR. 1951.
Iterson, W., van: Gallionella ferruginea Ehrenberg in a different light. Verh. K.
Akad. Wet. 52: 1-185 (1958).
Itzigsohn, H.: Quartscen. Uber Entwicklungsvorgange von Zoogloea, Oscilla-
ria, Synedra, Staurastrum, Spirotaenia und Chroolepus. Sitz.-Ber. d. Ges.
Nat. Fr. Berlin. Ser. Nov. 19: 30-31 (1867).
Ivanov, I. D., N. S. Demina und T. V. Gogoleva: Vlijanie ingibitorov cito-
chromnoj cepi perenosa elektronov na azotfiksaciju u fotosintezirujuscej
bakterii Chromatium minutissimum. Mikrobiologija 36: 8-12 (1967).
Ivanoskij, R. N., E. N. Krasil'nikova und E. N. Kondrat'eva: Okislenie sero-
vodoroda zelenymi bakterijami v zavisimosti ot prisutstvija organiceskich
soedinenij. Mikrobiologija 40: 783-789 (1971).
Jackson, D. D.: A new species of Crenothrix (C. manganifera). Trans. Amer.
Micro. Soc, 23: 31-39 (1902).
Jahn, E.: 1911. (In: Pilze I. Kryptogamenflora der Mark Brandenburg. 5: 187-
206(1911-1915).
- Die Polyangiden. Beitr. z. Bot. Protist., Leipzig. 1924.
Janke, A.: Allgemeine Technische Mikrobiologie. I. Teil: Die Mikroorganis-
men. T. Stenikopf. Dresden u. Leipzig. 1924.
Jannasch, H. W. und G. E. Jones: Bacterial population u^ea water as determi-
Scarmed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 539
ned by different methods of enumeration. Limnol. Oceanogr. 4: 128-139
(1959).
Caulobacter sp. in sea water. Limnol. Oceanogr. 5: 432—433 (1960).
Jarosch, R.: Lebensbeobachtungen an Bakteriengeiseln und ihre mogliche Be-
deutung fur die Interpretation der Dynamik endoplasmatischer Fibrillen.
Mikroskopie 25: 186-196 (1969).
Jeffers, E. E.: Myxobacters of a freshwater lake and its environs. Int. Bull. Bact.
Norn. Tax. 14: 115-136 (1964).
Jensen, H. L.: The Azotobacteriaceae. Bact. Rev. 18: 195-214 (1954).
- The magnesium requirements of Azotobacter and Beijerinckia. Acta. Agr.
Scand. 4:224-236 (1954).
- Azotobacter macrocytogenes n. sp. a nitrogen-fixing bacterium resistant to
acid reaction. Acta Agric. Scand. 5: 280-294 (1955).
Jensen, H. L., E. J. Petersen, P. K. De und R. Bhattacharya: A new nitrogen-
fixing bacterium: Derxia gummosa nov. gen., nov. spec. Arch. f. Mikrobiol.
36: 182-195 (1960).
Studies on the occurence of Azotobacter in Danish forest soils. Kli. Vet. og
Landbohojskole. 95-108 (1954).
Jeynes, M. H.: Soma observations on the morphology and taxonomy of Lineola
longa. J. Gen. Microbiol. 15: 10 (1956).
Johnsen, J. W. H.: A contribution to the biology of sewage disposal. J. econ.
Biol. London. 9: 105-164 (1914).
Johnson, A. H. und J. L. Stokes: Manganese oxidation by Sphaerotilus disco-
phorus. J. Bact. 91: 1543-1547 (1966).
Johnson, F. H. und R. F. Baker: The electron and light microscopy of Beggia-
toa. J. cell. comp. Physiol. 30: 131-146 (1947).
Johnson, P. W., J. McN. Sieburth, A. Sastry, C. R. Arnold und M. S. Dotty:
Leucothrix mucor infestation of benthic Crustacea, fish eggs, and tropical
algae. Limnol. oceanogr. 16: 962-969 (1971).
Johnson, R. M. and P. Weisrock: Hyphomicrobium indicum sp. nov. (Hypho-
microbiaceae Douglas). Int. J. Bact. 19: 295-307 (1969).
Johnstone, D. B. una J. R. Fishbein: Identification of Azotobacter species by
fluorescence and cell analysis. J. Gen. Microbiol. 14: 330-335 (1956).
Jones, M.: A peculiar microorganism showing rosette formation. Zbl. f. Bact.
Abt. II., 14:459-463 (1905).
Jones, G. E.: Caulobacter sp. in sea water. Limnol. and Oceanogr. 5: 432—433
(1960).
Jones, M.: A peculiar microorganism showing rosette formation. Zbl. f. Bact.,
Abt. II. 14:459-463(1904).
Jones, H. C. und J. M. Schmidt: Ultrastructural Study of Crossbands
Occurring in the Stalks of Caulobacter crescentus. J. Bact. 116: 466-470 (1973).
Joseph, R. und E. Canale-Parola: Axial fibrils of anaerobic spirochetes: Ultra-
structure and chemical characteristics. Arch. Mikrobiol. 81: 146-168 (1972).
Joshida, M. und T. Oshimia: The thermostable allosteric nature of fructose 1,6-
diphosphatase from an extreme thermophile. Bioch. Bioph. Res. Comm.45:
495-500 (1971).
Joshida, M., T. Oshima und K. Imahori: The thermostable allosteric enzyme:
phosphofructokinase from an extreme thermophile. Bioch. Bioph. Res.
Comm. 43: 36-39 (1971).
Joshizaki, F., T. Oshima und K. Imahori: Studies on phosphoglucomutase
from an extreme thermophile Flavobacterium thermophilum H 138.1.
Thermostability and other enzymatic properties. J. Bioch. 69: 1083-1089
(1971).
Kaffka, A.: Abbau von MjAanol, Athanol sowie Acetat und C-Assimilation
540 • Literaturverzeichnis
durch Hyphomicrobium vulgare Stutzer et Hartleb. Zbl. f. Bact. Abt. II. 115:
213-237 (1962).
Kalbe, L., R. Keil und M. Thiele: Licht und elektronenmikrospische Studien an
Arten von Leptothrix, Siderocapsa und Planctomyces. Arch. f. Protistenk.
108:29-40 (1965).
Kalinenko. V. O.: 1939 (Zit. Dubinina: Mikrobiologija 47, 1978).
- Novaja zelezobakterija r. Enisej. Mikrobiologija 14: 292 (1945).
- O zelezobakterijach v zelezistych vodach. Mikrobiologija 15 : 31—41 (1946).
- Rol' bakterij v formirovanii zelezomargancevych konkrecij. Mikrobiologija
15: 364-369 (1946).
- Proischozdenie zelezo-margancevnych konkrecij. Mikrobiologija 18: 528-
532 (1949).
- O stroenii Bacillus mycoides. Mikrobiologija 21: 171 (1952).
- Suscetvuet li chemosintez u zelezobakterij i u nitrificirujuscich bakterij.
Mikrobiologija 25 : 342-362 (1956).
Kandler, O., C. Zehender und O. Huber: Uber das Vorkommen von Caulo-
bacter sp. in destilliertem Wasser. Arch. Mikrobiol. 21: 57-59 (1954).
Kaplan, I. R.: Evidence of microbiological activity in some of the geothermal
regions of New Zealand. N. Z., J. Sci. and Technol. 37: 639 (1956).
Kauffmann, J. und P. Toussaint: Un nouveau germe fixateur de I'azote
atmospherique: Azotobachter lacticogenes. Rev. gen. Bot. 58: 553-561
(1951)-
Keil, F.: Beitrage zur Physiologie der farblosen Schwefelbakterien. Beitr. Biol.
Pflanz. 11:335-372(1912).
Kelly, M. T. und T. D. Brock: Warm-Water Strains of Leucothrix mucor. J.
Bact. 98: 1402-1403 (1969).
Physiological ecology of Leucothrix mucor. J. Gen. Microbiol. 59:153-162
(1969).
Keppen, O. I. und V. M. Gorlenko: Charakteristika novogo vida pockujus-
cichsjapurpurnych bakterij, soderzascich bakteriochlorofill b.
Mikrobiologija 44: 258-263 (1975).
Keppen., O. I., A. N. Nozevnikova und V. M. Gorlenko: Temnovoj metabo-
lizm Rhodopseudomonas sulfidophila. Mikrobiologija 45: 15-19 (1976).
Keysselitz, G.: Spirochaeta anodontae nov. spec. Arb. Gesund. Amt. Berl. 23:
566-567 (1906).
- Beschreibung von Spirochaeta anodontae n. sp. Kais. Ges-Amte 23: 566
(1906).
Kingma-Boltjes, T. Y.: Onderzoekingen over nitrificierende Bacterien. Proef-
schrift. Delft. 1934.
- Uber Hyphomicrobium vulgare Stutzer et Hartleb. Arch. f. Mikrobiol. 7:
188-205 (1936).
Kirchner, O.: 1878. (In: F. Cohn: Algen, Kryptogamen-Flora von Schlesien.
Teil2. 1878).
- Die Wurzelknollchen der Sojabohne. Beitr. Biol. Pfl. 7: 213-224 (1896).
- Schizophyceae. (In: A. Engler und K. Prantl: Die natiirlichen Pflanzenfami-
lien. W. Engelmann, Leipzig. 1898).
Klas, Z.: Zwei neue Schwefelbakterien Thiothrix voukii n. sp. et Thiothrix
longiarticulata n. sp. Arch. f. Protistenk. 88: 121-126 (1936).
- Uber den Formenkreis von Beggiatoa mirabilis. Arch. f. Mikrobiol. 18: 318
- Thiophysa gigantea, ein neues Thiobacterium der adriatischen Kuste. Bull.
Int. Acad. Jugosl. Zagreb 3: 5-13 (1951).
Klass, D. L., J.J. Jandolo und S.J. Knabel: Chem. Engng. Progr. Sympos.
Series 65: 72 (1969).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 541
Klemme, J. H.: Untersuchungen zur Photoautotrophie mit molekularem Was-
serstoff bei neuisolierten scnwefelfreien Purpurbakterien. Arch. f. Mikrobiol.
64:29-42 (1968).
Kluyver, A. J. und M. T. van den Bout: Notiz uber Azotobacter agilis Beije-
rinck. Arch. f. Mikrobiol. 7: 261-263 (1936).
Kluyver, A. J. und C. B. van Niel: Uber Bacillus funicularius n. sp., nebst
einigen Bemerkungen uber Gallionella ferruginea Ehrenberg. Planta, Arch.
wiss. Bot. 2: 507-527 (1926).
Prospects for a natural system of classification of bacteria. Zbl. f. Bact. Abt.
11.94:369-403 (1936).
(In: V. Czurda und E. Maresch: Beitrag zur Kenntnis der Athiorhodobak-
terien-Gesellschaften. Arch. f. Mikrobiol. 8: 99-124 (1937).
Kluyver, A. J. und W. J. van Reenen: Uber Azotobacter agilis Beijerinck. Arch.
f. Mikrobiol. 4: 280-300 (1933).
Knaysi, G.: Elements of bacterial cytology. Lomstock Publishing Co, Ithaca N.
J. 1951.
Knipovic, N. M.: Zur Hydrologie und Hydrobiologie des Schwarzen und des
Asowschen Meeres. Hydrobiol. und Hydrogr. 16: 81 (1926).
Knorr, M. und W. Graf: (In: W. Graf: 1962).
Kohlmiller, E. F. und H. Gest: A comparative study of the light and dark
fermentations of organic acids by Rhodospirillum rubrum. J. Bact. 61: 269-
282 (1951).
Koch, A. und H. Hosaeus: Uber einen neuen Froschlain der Zuckerfabriken.
Zbl. f. Bact. Abt. I., Orig. 16: 225-228 (1894).
Kolesko, O. J.: Strojenije junych kolonii azotobaktera. Mikrobiologija29:293-
295 (1960).
Kolk, Laura, A.: A comparision of the filamentous iron organismus Clonothrix
fusca Roze and Crenothrix polyspora Cohn. Amer. J. Bot. 25: 11-17
(1938).
Kolkwitz, R.: Uber die Planktonproduktion der Gewasser, erlautert an Oscilla-
toria agardhii Gom. Landwirtschaft. Jahrb. Erg.-Bd. 5 : 449-472 (1909).
- Die Beziehungen des Kleinplanktons zum Chemismus der Gewasser. Mitt,
kgl. Priifungst. Wass. u. Abwass. 14: 145 (1911).
- Biologie des Trinkwassers, Abwassers und der Vorfluter. Handb. Hyg.
Leipzig. Abt. 2. 2: 335-384 (1911).
- Uber die Schwefelbakterie Thioploca ingrica Wislouch. Ber. Deutsch. Bot.
Ges. 30:470-473 (1912).
- 1909. (In: Kryptogamenflora von Mark Brandenburg Band V., Heft 1. Verlag
von Gebriider Borntraeger. Leipzig. 1909-1915).
- Uber die Schwefelbakterienflora des Solgrabens von Arten. Ber. Deutsch.
Bot. Ges. 36, (1918).
- Pflanzenphysiologie. Verlag G. Fischer, Jena, 1935.
- Thionema vaginatum eine neue Schwefelbakterie. Ber. Deutsch. Bot. Ges.
56: 11-15 (1938).
Komarek, J.: Culture collections. (In: N. G. Carr, B. A. Whitton (Eds.), The
biology of blue green algae. 1973: 519-524).
Kondrat'eva, E. N.: O fiziologii sernych i nesernych purpurnych bakterij.
Mikrobiologija 23 : 719-741 (1954).
- Ispol'zovanie purpurnymi bakterijami organiceskich soedinenij v prisutstvii
sveta. Mikrobiologija. 25: 393-400 (1956).
- Zelenye serobakterii. Mikrobiologija 30: 346-363 (1961).
- Fotosintezirujuscie bakterii. Izd. Ad. Nauk SSSR, Moskva. 1963.
- Metobolizm ugleroda u zelenych fotosintezirujuscich bakterij. Nauc. dokl.
vys. sk. Biol, nauki 10: 77-94 (1967).
542 • Literaturverzeichnis
Kondrat'eva, E. N. und I. N. Gogotov: Vydelenie i potreblenije molekuljarno-
vo vodoroda Chloropseudomonas. Mikrobiologija 38: 938-944 (1969).
— Production of hydrogen by green photosynthetic bacteria
Chloropseudomonas. Nature 211: 83-84 (1969).
Kondrat'eva, E. N. und I. V. Malofeeva: K izuceniju karotinoidov purpurnych
serobakterij. Mikrobiologija 33: 758-762 (1964).
Kondrat'eva, E. N. und L. B. Rubin: 1970. (In: Fiziologija bol'novo i zdorovo-
go rastenia. Izd. MGU Moskva. 1970).
Kondrat'eva, E. N. und J. A. Trocenko: Fotometabolizm formiata u zelenych
serobakterij. DAN SSSR 185: 202-205 (1969).
Kondrat'eva, E. N., V. D. Fedorov und K. P. Gresnych: K izuceniju morfolo-
gii Chlorobium thiosulfatophilum. DAN SSSR 123: 365 (1958).
Kondrat'eva, E. N., E. N. Krasil'nikova und L. M. Novikova: Obrazovanie
polisacharidov zelenymi fotosintezirujuscimi bakterijami. Mikrobiologija 37:
417-424(1968).
Kondrat'eva, E. N., J. A. Trocenko und O. N. Voronina: Fiziologiceskie
osobennosti razlicnych stamov Chloropseudomonas. Izv. Ak. Nauk SSSR,
Ser. biol. 2: 218-225 (1968).
Kondrat'eva, E. N., E. N. Krasil'nikova, J. A. Trocenko und V. N. Gogotov:
O putjach ispolzovanija nekotorych soedinenij ugleroda zelenymi
bakterijami. Nauc. dokl. vys. sk. biol. nauki 13: 141 (1970).
Konopka, A. E., R. L. Moore und J. T. Staley: Taxonomy of Microcydus and
Other Nonmotile, Ringforming Bacteria. Int. Syst. Bact. 26 : 505-510 (1976).
Koppe, F.: Die Schlammflora der Ostholsteinischen Seen und des Bodensees.
Arch. f. Hydrobiol. 14: 619-672 (1922-1924).
Koprivik, B. und M. Vychodilova: Vyznam myxobakteril v hygiene, jejich
kultivace a identifikace. Acta hygienica, epidemiologica et microbiologica.
Ph'loha 9. (1977).
Kossaja, T. A.: O sostave okislov marganca v kulturach Metallogenium i
Leptothrix. Mikrobiologija 36: 1024-1029 (1967).
Kottel, R. H. und H. D. Raj: Pathways of Carbohydrate in Microcydus Species.
J. Bact. 113: 341-349 (1973).
Kowallik, U. und E. G. Pringsheim: The oxidation of hydrogen sulfide by
Beggiatoa. Amer. J. Bot. 53: 801-806 (1966).
Kran, G., F. W. Schlote und H. G. Schlegel: Cytologische Untersuchungen an
Chromatium okenii Perty. Naturwissenschaften 50: 728-730 (1963).
Krasil'nikov, N. A.: Opredelitel bakterij i aktinomycetov. Akad. Nauk. SSSR,
Moskva. 1949.
Krasil'nikov, N. A. und S. S. Beljaev: O rasprostranenii Caulobacter v
nekotorych pocvach. Mikrobiologija 36: 1083-1086 (1967).
Morfologija i razvitie Caulobacter. Mikrobiologija 39: 352-357 (1970).
Fiziologiceskie osobennosti bakterij roda Caulobacter. Mikrobiologija 40:
876-879(1971).
Razvitie Caulobacter v smesannych kulturach. Mikrobiologija 40: 1010—
1014(1971).
Krasil'nikov, N. A. und A. A. Uranov: Zizn' rastenij v sesti tomach. 1.
Vvedenie, bakterii i aktinomycety. Prosvescenije. Moskva. 1974.
Krasil'nikov, N. A., J. A. Chudjakova und V. I. Birjuzova: Zgutikovyj apparat
u azotobaktera v elektronnom mikroskope. Trudy inst. mikrobiol. 2: 44-50
(1952).
Krieg, N. R.: Taxonomic studies of Spirillum lipoferum. (In: Genetic
engineering for nitrogen fixation (A. Hollaender, ed.), London Plenum Press 463-
472 (1977a).
- Taxonomy of the root associated nitrogen fixer, Spirillum lipoferum. Int.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 543
Symposium on the Limitation and Potentials of Biological Nitrogen Fixation
in the Tropics, Brasilia. Brazil 1977b.
Krieg, N. R., J. P. Tomelty und J. S. Wells: Inhibition of flagellar coordination
in Spirillum volutans. J. Bact. 94: 1431-1436 (1967).
Kriss, A. E.: Morskaja mikrobiologija (glubomorskaja). Ak. Nauk SSSR,
Moskva. 1959.
Kriss, A. E. und I. N. Mickevic: Novyj klass mikroorganizmov, obitajuscich v
glubinach morej i okeanov. Usp. sov. biol. 44: 269-280 (1957).
Krul, J. M., P. Hirsch und J. T. Staley: Toxothrix trichogenes (Choi.) Beger et
Bringmann: the organism and its biology. Ant. v. Leeuwenh. 36: 409—420
(1970).
Kruse, W.: Systematik der Streptotrichen und Bakterien, (In: Fliigge, C: Die
Mikroorganismen. 3. Aufl. 2: 48-96, 185-526, 1896).
Krzemieniewska, H.: Le cycle evolutif de Spirochaeta cytophaga Hutchinson et
Clayton. Acta. Soc. Bot. Pol. 7: 507-519 (1930).
- Contribution a 1' etude du genre Cytophaga. Arch. f. Mikrobiol. 4: 394-408
(1933).
Kuenen, J. G. und H. Veldkamp: Isolation and properties of a chemolithotro-
phic sulfuroxidizing Spirillum sp. Ant. v. Leuwenh. 36: 186 (1970).
Some quantitative aspects of the incorporation of organic compounds by
two obligately chemolithotrophic sulfur bacteria. J. Gen. Microbiol. 69:
XVI. (1971).
Thiomicrospirapelophila, gen. n., sp. n. a new obligately chemolithotrophic
colourless sulfur bacterium. Ant. v. Leeuwenh. 38: 241 (1972).
Effects of Organic Compounds on Growth of Chemostat Cultures of
Thiomicrospira pelophila, Thiobadllus thioparus and Thiobadllus neapolita-
nus. Arch. Mikrobiol. 94: 173-190 (1973).
Kuhn, D. A.: 1974 (Zit.: Bergey's Manual. 1974).
Kuhn, D. A. und M. P. Starr: Clonal morphogenesis of Lampropedia hyalina.
Arch. f. Mikrobiol. 52: 360-376 (1965).
Kumar, R., A. K. Banerjee, J. H. Bowdre, L. J. McElroy und N. R. Krieg:
Isolation, charakterization, and taxonomy of Aquaspir'illum bengal sp. nov.
Int. J. Bact. 24: 453-458 (1974).
Kutscher: Spirillum undula minus und Spirilum undula majus. Zbl. f. Bact. Abt.
I. 18:614-616(1895).
- Die Vibrionen- und Spirillenflora derDiingerjauche. Z. f. Hyg. 20: 57 (1895).
Kutuzova, R. S.: Elektronno-mikroskopiceskoe izucenie ilovych obrastanij
zelezookisljajuscego kokka blizkogo Siderococcus limoniticus Dorff.
Mikrobiologija 43 : 285-288 (1974).
Kuznecov, S. I.: Izotopy v mikrobiologii. Izd. Ak. Nauk SSSR. 1955.
Kuznecov, S. I.: Mikroorganizmy gorjacich kljucej Kamcatki. Trudy Inst.
Mikrobiol. AN SSSR 4: 130 (1955).
Kiihlwein, H. und H. Reichenbach: Anreicherung und Isolierung von Myxo-
bacterien. Zbl. f. Bact. Abt. I., Supp. I. 57-80 (1966).
Kiitzing, F. T.: Beitrag zur Kenntnis iiber die Entstehung und Metamorphose
der niedern vegetabilischen Organismen, nebst einer systematischen Zusam-
menstellung der hierher gehorigen niedern Algenformen. Linnaea 8 : 335-387
(1833).
- Phycologia generalis oder Anatomie, Physiologie und Systemkunde der Tan-
ge. Leipzig. 1843.
- Phycologia germanica. Deutschlands Algen. 1845.
- Diagnosen und Bemerkungen zu neuen oder kritischen Algen. Bot. Ztg. 5:
22-25 (1847).
- Species Algarum. Lipsiae^^49.
544 • Literaturverzeichnis
Lackey, J. B. und E. W. Lackey: The habitat and description of a new genus of
sulphur bacterium. J. Gen. Microbiol. 26: 29-39 (1961).
Lackey, J. B. und Elsie Wattie: The biology of Sphaerotilus natans Kiitzing in
relation to bulking of activated sludge. Public Health Repts. (U. S.) 55: 975-
989 (1940).
- Studies of sewage purification XIII. The biology of Sphaerotilus natans
Kiitzing in relation to bulking of activated sludge. Sewage Wks. J. 12 :669-684
(1940).
Lafickaja, T. N. und L. V. Vasil'eva: Novyje treugol'nye bakterii. Mikrobiolo-
gija 45: 812-816 (1976).
Lagerheim, G., de: Notiz iiber phycochromhaltige Spirochaten. Ber. Deutsch.
Bot. Ges. 10: 364(1812).
Langeron, M.: Les Oscillariees parasites du tube digestif de 1'homme et des
animaux. Ann. Parasitol. hum. et comp., Paris 1: 75-89 (1923).
Lankester, E. R.: On a peachcoloured bacterium - Bacterium rubescens, n. s.
Quart. J. micr. Sci. 13: 408-425 (1873).
- Further observation on a peach- or red-coloured Bacterium - Bad. rubescens.
Quart. Journ. of Micr. Sc. 16 (1876).
- Note on Bact. rubescens and Clathrocystis roseopersicina. Quart. Journ. of
Micr. Sc. 16 (1876).
La Riviere, J. W. M.: (Zit.: J. M. W. La Riviere: in Bergey's Manual. 1974).
Larkin, J. M. und R. Borrall: Spirosomaceae a New Family to Contain the
Genera Spirosoma Migula 1894, Flectobacillus Larkin et al. 1977, and Runella
Larkin and Williams 1978. Int. J. Syst. Bact. 28: 595-596 (1978).
Larkin, J. M. und P. M. Williams: Runella slithhyformis gen. nov., sp. nov. a
Curved Nonflexible Pink Bacterium. Int. J. Syst. Bact. 28: 32-36 (1978).
Larkin, J. M., P. M. Williams und R. Taylor: Taxonomy of the Genus Microcy-
clus 0rskov 1928: Reintroduction and Emendation of the Genus Spirosoma
Migula 1894 and Proposal of a New Genus Flectobacillus. Int. J. Syst. Bact.
27: 147-156(1977).
Larsen, H.: On the morphology and general physiology of the green sulfur
bacteria. J. Bact. 64: 187-196 (1952).
- On the microbiology and biochemistry of the photosynthethic green sulfur
bacteria. Kgl. riorske rid. selskabs skr. 1: 1 (1953).
Larson, R. J. und J. L. Pate: Growth and Morphology of Asticcacaulis bipros-
thecum in Defined Media. Arch. Mikrobiol. 106: 147-157 (1975).
Lauterborn, R.: Zur Kenntnis der sapropelischen Flora. Allg. Bot. Z. 12 : 196—
197(1906).
- Eine neue Gattung der Schwefelbakterien (Thioploca schmidlei nov. gen., nov.
spec). Ber. Deutsch. Bot. Ges. 25: 238-242 (1907).
- Zur Kenntnis einiger sapropelischer Schizomyceten. Allg. Bot. Z. 19: 97-100
(1913).
- Die Sapropelische Lebewelt. Verhandl. Naturhist. - med. Ver. Heidelberg
13: 395-481 (1914-1917).
Lawrence, J. C: Filterability of the swarmers of Rhizobium and Azotobacter.
Nature (Lond.). 176: 1033-1034 (1955).
Layne, J. S. und E. J. Johnson: Natural factors involved in the induction of cyst
formation in Azotobacter. J. Bact. 87: 684-689 (1964).
Leadbetter, E. R.: Substitution of Methylomonas gen. nov. and Methylomona-
daceae fam. nov. for Methanomonas Orla Jensen and Methanomonadaceae
Breed. Request for an opinion. Int. J. Bact. 24 (1974).
Leadbetter, E. R., S. C. Holt und S. S. Socransky: Capnocytophaga: New
Genus of Gram-Negative Gliding Bacteria I: General Characteristics, Taxo-
nomic Considerations and Significance. Arch. Mikrobiol. 122: 9-16 (1979).
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 545
Lecianova, L.: Occurence and Significance of Myxobacteria in Waste Waters.
Folia microbiol. 22: 468 (1977).
- Myxobacterien im Wasser, ein neuer Indikator in der Hydromikrobiologie.
Wasser und Abwasser, Wien 21: 43-65 (1978).
- Einflufi okologischer Faktoren auf das Vorkommen von Myxobakterien im
Wasser. Sbornik III. Internationales hydromikrobiologisches Symposium,
Smolenice CSSR (in Press).
Lehmann, K. B. und R. O. Neumann: Atlas und Grundrifi der Bakteriologie
und Lehrbuch der speziellen bacteriologischen Diagnostik. Teil II. 1896.
Atlas und Grundrifi der Bakteriologie und Lehrbuch der speziellen bakte-
riologischen Diagnostik. 6. Aufl. 1920.
Bakteriologie insbesondere bakteriologische Diagnostik. II. Allgemeine
und spezielle Bakteriologie. 7. Aufl. 1927.
Leifson, E.: The flagellation and taxonomy of species of Acetobacter. Ant. v.
Leeuwenh. 20: 102-110 (1954).
- The bacterial flora of distilled and stored water. II. Caulobacter vibrioides
Henrici and Johnson in distilled water. Int. Bull. Bact. Nom. Tax. 12: 155—
159 (1962).
- The bacterial flora of distilled and stored water. III. New species of the genera
Corynebacterium, Flavobacterium, Spirillum and Pseuaomonas. Int. Bull.
Bact. Nom. Tax. 12: 161-170 (1962).
- Hyphomicrobium neptunium sp. n. Ant. v. Leeuwenh. 30: 249-256 (1964).
Leifson, E., B. J. Cosenza, R. Murchelano und R. C. Cleverdon: Motile
marine bacteria. I. Techniques, ecology, and general characteristics. J. Bact. 87:
652-666 (1964).
Levy, J., J. J. R. Campbell und T. H. Blackburn: Introductory microbiology.
John Willey and Sons. New York. 1973.
Lewin, R. A.: Leucothrix mucor. Biol. Bull. 117: 418 (1959).
- Saprospira grandis Gross; and suggestions for reclassifying helical, apochloro-
tic, gliding organisms. Can. J. Microbiol. 8: 555-563 (1962).
- Rodshaped particles in Saprospira. Nature (London) 198: 103-104 (1963).
- Isolation and some physiological Features of Saprospira thermalis. Can. J.
Microbiol. 11: 77-86.
- Freshwater species of Saprospira. Can. J. Microbiol. 11: 135-139 (1965).
- A classification of Flexibacteria. J. Gen. Microbiol. 58: 189-206 (1969).
- Flexithrix dorotheae gen. et sp. n. (Flexibacterales); and suggestions for
reclassifying sheathed bacteria. Can. J. Microbiol. 16: 511-515 (1970).
- New Herpetosiphon species (Flexibacterales). Can. J. Microbiol. 16: 517-520
(1970).
- Growth and nutrition of Saprospira grandis Gross (Flexibacterales). Can. J.
Microbiol. 18: 361-365 (1972).
- Flexibacter polymorph us, a new marine species. J. Gen. Microbiol. 82: 393-
403h (1974).
- Prochloron, type genus of the Prochlorophyta. Phycologia 16: 217
(1977)-
Lewin, R. A. und D. C. Lounsbery: Isolation, cultivation and characterization
of flexibacteria. J. Gen. Microbiol. 58: 145-170 (1969).
Lewin, R. A. und M. Mandel: Saprospira toviformis nov. spec. (Flexibacterales)
from a New Zealand sea shore. Can. J. Microbiol. 16: 507-510 (1970).
Lewis, I. M.: The genus Spirillum Ehbg. with special reference to cell inclusions
and the chromidial theory. J. Bact. 40: 271-285 (1940).
Ley, J., de: Comparative carbohydrate metabolism and a proposal for a phyloge-
netic relationship of the acetic acid bacteria. J. Gen. Microbiol. 24: 31-50
(1961).
548 • Literaturverzeichnis
Materassi, R., G. Florenzano, W. Balloni und F. Favilli: Su una nuova specie di
Beijerinckia (Beijerinckia venezuelae nov. sp.) isolata da terreni venezuelani.
Ann. Microbiol. 16: 201-215 (1966).
Matheron, R. und R. Baulaigue: Bacteries photosynthetiques sulfureuses
marines. Assimilation des substances organiques et minerales, et influence de la
teneur en chlorure de sodium du milieu de culture sur leur development. Arch,
f. Mikrobiol. 86: 291-304 (1972).
Matzuschita: Bakteriologische Diagnostik. G. Fischer Jena 1902.
Mayfield, D. C. und A. S. Kester: Physiological Studies on Vitreoscilla stercora-
ria. J. Bact. 112: 1052-1056 (1972).
McCurdy, H. D.: Studies on the taxonomy of the Myxobacterales. I. Record of
Canadian isolates and survey of methods. Can. J. Microbiol. 15: 1453-1461
(1969).
- Studies on the taxonomy of the Myxobacterales. II. Polyangium and the
demise of the Sporangiaceae. Int. J. Bact. 20: 283-296 (1970).
- 1974. (In: Bergey's Manual. 1974).
McKinney, R. E.: Biological flocculation. (In: Biological treatment of sewage
and industrial wastes, vol. 1. Rheinhold Publ. Co., New York. 1956).
Mechsner, K. L.: Physiologische und morphologische Untersuchungen an
Chlorobakterien. Arch. f. Mikrobiol. 26: 32-51 (1957).
Mecnikov, E.: Pasteuria ramosa un representant des bacteries a diversion longi-
tudinale. Ann. Inst. Pasteur (Paris) 2: 165-170 (1888).
- Uber die phagocytare Rolle der Tuberkelriesenzellen. Virchows. Arch. 113:
63-94 (1888).
Mejen, V. A.: Ocistka stocnoj zidkosti v trudach i vyrascivanie v nej ryby.
Moskva. 1932.
Mello, F., de.: Protozaires parasites de Pacheledra moesta Reeve. C. R. Soc.
Biol. Paris 84: 241-242 (1921).
Meneghini: (In: Fr. T. Kiitzing: Alg. exsicc. Nr. 16: (1833-1836). Zit.: W. Ba-
wendamm 1924).
Mesnil, F. und M. Caullery: Sur un organisme spirochetoide (Cristispira poly-
dorae n. sp.) de l'intestin d'une annelide polychete. C. R. Seances Soc. Biol.
Filiales 79: 1118-1121 (1916).
Mevius, W., Jr.: Beitrage zur Kenntnis von Hyphomicrobium vulgare Stutzer et
Hartleb. Arch. f. Mikrobiol. 19: 1-29 (1953).
Mez, C: Mikroskopische Wasseranalyse, Anleitung zur Untersuchung des
Wasser mit besonderer Beriicksichtigung von Trink- und Abwasser. 1898.
Migula, W.: Uber den Zellinhalt von Bacillus exaliticus Zopf. Arb. bakt. Inst.
Karlsruhe 1: 137-147 (1894a).
- Uber ein neues System der Bakterien. Arb. bakt. Inst., Karlsruhe 1: 235-238
(1894b).
- 1895. (In: A. Engler und K. Prantl: Die natiirlichen Pflanzenfamilien.
W. Engelmann. Leipzig. 1895).
- Uber Gallionella ferruginea Ehrenb. Ber. Deutsch. Bot. Ges. 15: 321-327
(1897a).
- System der Bakterien. Bd. I., Jena. 1897b.
- System der Bakterien. Bd. II., Jena. 1900a.
- Bakterienkunde fiir Landwirte. Berlin. 1900b.
Mikosovicova, L.: Metabolicka aktivita rodu Myxococcus vo vodnom biotope.
Sbornik c. 3., Komise mikrobiologie vody Ceskoslovenske spolecnosti mi-
krobiologicke pfi CSAV. (1979).
Mircink, T. G., K. M. Zapromentova und D. G. Zvjagincev: Griby - sputniki
bakterij, okisljajuscich marganec. Mikrobiologija 39: 379-383.
Miyoshi, M.: Studien iiber die Schwefelrosenbildung und die Schwefelbacterien
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 549
der Thermen von Yumoto bei Nikko. J. Coll. Sci. Imper. Univ. Tokyo 10:
143-173 (1897).
- Uber das massenhafte Vorkommen von Eisenbakterien in den Thermen von
Ikao. J. Coll. Sci. Imper. Univ. Tokyo 10: (1897).
Moir, R. J. und M. J. Masson: An illustrated sheme for the microscopic
identification of the rumen micro-organisms of sheep. J. Pathol. Bact. 64:
343-350 (1952).
Molisch, H.: Die Pflanzen in ihren Beziehungen zum Eisen. Jena. 1892.
- Zwei neue Purpurbakterien mit Schwebekorperchen. Bot. Ztg. 64: 223-232
(1906).
- Die Purpurbakterien nach neuen Untersuchungen. G. Fischer. Jena. 1907.
- Siderocapsa treubii Molisch, eine neue, weit verbreitete Eisenbakterie. Ann.
du Jard. Bot. Buitenzorg, 2. Ser. Suppl. 3: 29-33 (1909).
- Die Eisenbakterien. Venae G. Fischer, Jena. 1910.
- Neue farblose Schwefelbakterien. Zbl. f. Bact. Abt. II. 33: 55-62 (1912).
- Leuchtende Pflanzen. Eine physiologische Studie. Zweite vermehrte Auf-
gabe. Jena. 1912.
- Botanische Beobachtungen in Japan. VIII. Die Eisenorganismen in Japan. Sci.
Rev. Tohoka Imp. Univ. 4. Ser., Biol. 1: 135-168 (1925).
Monosov, E. Z. und N. L. Kudinova: Morfologija i cikl razvitija
Hyphomicrobium s vintoobraznoj prostekoj. Mikrobiologija 45: 806-807 (1976).
Moore und Hirsch, P.: 1972. (Zit.: P. Hirsch, in Bergey's Manual. 1974).
Moore, R. L. und J. T. Staley: Deoxyribonucleic acid Homology of Prostheco-
microbium and Ancalomicrobium Strains. Int. J. Syst. Bact. 26: 283-285
(1976).
Moquin: Amarantaceae. (In: Candolle, de und Alphonso: Prodromus Systema-
tis Naturalis Regni Vegetabilis. Sectio Posterior. 13: 231-424 (1849).
Mosser, J. L., A. G. Mosser und T. D. Brock: Population Ecology of Sulfolo-
bus acidocaldarius I. Temperature Strains. Arch. Mikrobiol. 97: 169-179
(1974).
Mosenceva, L. V. und E. N. Kondrat'eva: Obrazovanie chlorofillov purpurny-
mi i zelenymi bakterijami pri fotoaftotrofnom i fotogeterotrofnom razvitii.
Mikrobiologija 31: 199-202 (1962).
Mulder, E. G.: Iron bacteria, particularly of the Sphaerotilus-Leptothrix group,
and industrial problems. J. Appl. Bact. 27: 151-173 (1964).
Mulder, E. G., J. Antheunisse und W. H. J. Crombach: Microbial aspects of
pollution in the food and dairy industries. (In: G. Sykes and F. A. Skinner,
Microbial aspects of pollution. Soc. Appl. Bacteriol. Sym. Ser. 1.
1971).
Mulder, E. G., M. H. Deinema, W. L. Veen, van und L. P. T. M. Zevenhui-
zen: Polysacharides, lipids and poly-|3-hydroxybutyrate in microorganisms.
Recueil Trav. Chim. Pays - Bas 81: 797-809 (1962).
Mulder, E. G. und W. L. van Veen: The Sphaerotilus-Leptothrix group; VHIth
Intern. Congr. for Microbiol. Montreal. Abstr. B. 12. 7. 1962.
- The Sphaerotilus-Leptothrix group. Ant. v. Leeuwenh. 28:236-237 (1962).
- Investigations on the Sphaerotilus-Leptothrix group. Ant. v. Leeuwenh. 29
121-153 (1963).
-- 1964. Anreicherung von Organismen der Sphaerotilus-Leptothrix Gruppe
(In: Anreicherungskultur und Mutantenauslese. Symp. Gottingen 1964. Zbl.
f. Bact. Abt. I. Suppl. 1: 28-46 1965).
Murray, R. E. G.: Role of superficial structures in the characteristic
morphology of Lampropedia hyalina. Can. J. Microbiol. 2: 593-600 (1963).
- Microbial structure, as an aid to microbial classification and taxonomy. Spisy
Ph'rod. fak. Univ J. E. Purkyne, Brno, 43: 245-252 (1968).
550 ■ Literaturverzeichnis
Murray, R. E. G. und Douglas, H. C.: The reproductive mechanism of Rhodo-
microbium vanniellii and accompanying changes. J. Bact. 59: 157 (1950).
Miiller, O. F.: Vermium Terrestrium et Fluviatilium, seu Animalium Infuso-
riorum, Helminthicorum et Testaceorum, non Marionorum, succincta Histo-
ria. 1. (pt. 1), 1773.
- Animalcula Infusoria Fluviatilia et Marina, Quae Detexit, Systematice Des-
cripsit et Ad Vivum Delineari Curavit. 1786.
Miiller, M.: Verbreitung, Isolierung und Beschreibung neuer, knospender Bak-
terien aus Siifiwasserstandorten, sowie Untersuchungen iiber ihre Formen-
konstanz. Diss. Kiel (1977).
Miiller-Thurgau, H.: Bakterienblasen (Bacteriocysten). Zbl. f. Bact. Abt. II.
20: 353-400(1908).
Myers, J.: Studies on the Spirilleae. Methods of isolation and identification. J.
Bact. 40: (1940): 705-721.
Nadson, G. A.: K morfologii nizsich vodoroslej Chlorobium limicola Nads.,
zelenyj chlorofillonosnyi mikrob. Izv. imp. SPb., bot. sada 6: 190 (1906).
- Mikrobiologiceskie ocerfci. Chlorobium limicola Nads., zelenyj mikroorga-
nizs s nefunkcionirujuscim chlorofillom. Izv. im. SPb., bot. sada 12: 2-3
(1912).
- On sulfuric microorganisms of the Hapsal Bay. (Preliminary note). Izv. imp.
SPb., bot. sada 13: 106(1913).
- Uber die Schwefelbakterien: Thiophysa und Thiosphaerella. Z. f. Mikrobiol.,
St. Petersburg 1: 52-72 (1914).
Nadson, G. A. und N. Krasil'nikov: The structure and evolution oi Pontothrix
longissima Nadson and Krasil'nikov. (Chlamydothrix longissima Molisch, a
colorless alga of the group Schizophyceae). C. R. Acad. Sci. de URSS 10:243-
247 (1932).
Nadson, G. A. und S. M. Wislouch: La structure et la vie de la bacterie geante
Achromatium oxaliferum Schew. Bull. Princ. Jard. Botan., Republ. Russe 22:
1-37(1923).
Naegeli: 1849. (In: Kiitzing, F. T.: 1849).
Nakanishi, K.: Uber den Bau der Bakterien. Zbl. f. Bact. Abt. I. 30: 97-110;
193-201; 225-232 (1901).
Namsaraev, B. B.: Rost Methylosinus trichosporium stamm Z - 1442 na srede
Vittenbari. Mikrobiologija 42: 741-743 (1973a).
-Rost kult'ury Microcyclus na metanole. Mikrobiologija 42: 1108-1109
(1973b).
Namsaraev, B. B. und A. N. Nozevnikova: Avtotrofny rost Microcyclus aqua-
ticus na vodorode. Mikrobiologija 47: 389-392 (1978).
Namsaraev, B. B. und T. A. Zavarzin: Troficeskie svjazi v kul'ture okisljajuscij
metan. Mikrobiologija 41: 999-1006 (1972).
Namsaraev, B. B. und G. A. Zavarzin: Rost pockujuscejsja bakterii «Tetra-
edron» na odnouglerodnych soedinenijach. Mikrobiologija 43: 406-409
(1974).
Namsaraev, B. B., A. N. Nozevnikova und L. G. Loginova: Tezisy II. mezdu-
narodnogo simpoziuma «Rost mikroorganizmov na Q soedinenijach». Pus-
cino 59: (1977).
Naumann, E.: Untersuchungen iiber die Eisenorganismen Schwedens. I. Die
Erscheinungen der Sideroplastie in den Gewassern des Teichgebietes Anebo-
da. Kungl. Swensk. Vetensk. Handl. 62: 1-68 (1921).
- Uber den Begriff «Eisenorganismus». Ber. Deutsch. Bot. Ges. 46: 141
(1928).
- Die eisenspeichernden Bakterien. Kritische Ubersicht der bisher bekannten
Formen. Zbl. f. Bact. Abt. II. 78: 512-515 (1929).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 551
- Uber den Normaltypus von Sphaerotilus nutans Kiitzing und einige Modifika-
tion davon. Ber. Deutsch. Bot. Ges. 50: 558 (1932).
Nagler, K.: Eine neue Spirochete aus dem Siifiwasser. Zbl. f. Bact. Abt. I. Orig.
1: 445-447(1909).
Naveke, R.: Formiatoxydation und Kohlenstoff-Assimilation bei Hyphomicro-
bium vulgare Stutzer et Hartleb. Arch. f. Mikrobiol. 27: 375-399
(1957).
Naveke, R. und H. Engel.: Der Formiatabbau durch Hyphomicrobium vulgare
Stutzer et Hartleb. Arch. f. Mikrobiol. 21: 371-375 (1955).
Nesterov, A. I., I. N. Gogotov und E. N. Kondrat'eva: Znacenie intensivnosti
svete dlja ispolzovanja razlicnych soedinenij ugleroda fotosintezirijuscimi
bakterijami. Mikrobiologija 35: 193-199 (1966).
Neyra, C. A., J. Dobereiner, R. Lalande und R. Knowles: Dentrification by
N2-fixing Spirillum lipoferum. Can. J. Microbiol. 23: 300-305 (1977).
Nemec, P. und V. Bystricky: Kopulation bei Caulobacter. Biol, Z. 82: 595-600
(1963).
Niel, C. B., van: On the morphology and physiology of the purple and green
sulphur bacteria. Arch. f. Mikrobiol. 3: 1-112 (1931).
- The culture, general physiology, morphology and classification of the non-
sulfur purple and brown bacteria.Bact. Rev. 8: 1-118 (1944).
- 1948. (In: Bergey's Manual. 1948).
- 1957. (In: Bergey's Manual. 1957).
Nikitin, D. I.: Novyj pocvennyj mikroorganizm-Renobactervacuolatum gen.
et sp. n. DAN SSSR 198: 447 (1971).
Nikitin, D. I. und E S. Nikitina: 1978. (In: Processy samoociscenija okruzajus-
cej sredy i parazity bakterij (rod Bdellovibrio). «Nauka Moskva* 1978).
Noguchi, H.: Spirochaeta icterohaemorrhagiae in American wild rats and its
relation to the Japanese and European strains. J. exp. Med. 25: 755-763
(1917).
- The spirochetal flora of the normal male genitalia. J. exp. Med. 27: 667-678
(1918).
- Etiology of yellow fever II. Transmission experiments on yellow fever. J. exp.
Med. 29:565-584 (1919).
- Cristispira in North American shellfish. A note on a Spirillum found in oyster.
J. exp. Med. 34: 295 (1921).
- The Spirochaetes. 1928. (In: Jordan and Falk (Editors): The newer knowledge
of bacteriology and immunology. University of chicago Press, Chicago.
1928).
Novacek, F.: Actinothrix globulifera. Novy a kriticky druh celedi Chlamydo-
bacteriaceae - ad interim. Additamentum ad morphologiam oecologiamque
novae et incertae speciei et generis ordinis Trichobacteria. Sbornik Pfirodove-
deckeho klubu v Trebfci 2: 62-68 (1938).
Novikova, L. M.: Obrazovanie i potreblenie zapasnych produktov Ectothio-
rhodospira shaposhnikovii. Mikrobiologija 40: 28-33 (1971).
Nuttal, G. H. F.: 1849. (In: Moquin: 1849).
Oersted, A. S.: Beretning om en Exkursion tie Trindelen. Naturhist. Tidsskrift
3: 522 (1840-1841).
- De regionibus marinis, elementa topographiae historico naturalis freti
Oeresund. J. C. Scharling, Copenhagen. 1844.
Okon, Y., S. L. Albrecht und R. H. Burris: Factors affecting growth and
nitrogen fixation oi Spirillum lipoferum. J. Bact. 125: 1248-1254 (1976).
Okrend, H. und N. C. Dondero: Requirement of Sphaerotilus for cyanocoba-
lamin. J. Bact. 87: 286-292 (1964).
Okuda, A. und M. Bobayashi: P^^fciction of slime substance in mixed cultures
552 ■ Literaturverzeichnis
of Rhodopseudomonas capsulatus and Azotobactervinelandii. Nature (Lond.)
192: 1207-1208 (1961).
Olson, J. M.: Confused History of Chloropseudomonas ethylica 2 K. Int. J.
Syst. Bact. 28: 128-129 (1978).
Omelianski, V. L.: Uber eine neue Art farbloser Thiospirillen. Zbl. f. Bact.
Abt. II., 14: 769-772 (1905).
- Novyj bacil: Bacillus flagellatus Omel. Mikrobiologija 1: 24-27 (1914).
Oppenheimer, C. H.: The effect of marine bacteria on the development and
hatching of pelagic fish eggs, and the control of such bacteria by antibiotics.
Copeia 1: 43-49(1955).
Ordal, E. J. und J. J. Rucker: Pathogenic Myxobacteria. Proc. Soc. Exper. Biol.
Med. 56: 15-18 (1944).
Orla-Jensen, S.: Die Hauptlinien des natiirlichen Bakteriensystems. Zbl. f.
Bact. Abt. II. 22: 97-98; 305-346 (1909).
0rskov, J.: Beschreibung eines neuen Mikroben, Mycrocyclus aquaticus mit
eigentiimlicher Morphologie. Zbl. f. Bact. Abt. I. 107: 180-184 (1928).
Oshima, T. und K. Imahori: Isolation of an extreme thermophilic and
thermostabilities of its transfer ribonucleic acid and ribosomes. J. Gen. Appl.
Microbiol. 17: 513-517(1971).
Description of Thermus thermophilus comb, nov., a nonsporulating
thermophilic bacterium from a Japanese thermal spa. Int. J. Bact. 24: 102-112
(1974).
Ostertag, H.: Celluloseabbauende Mikroorganismen. Z. Hyg. Infekt. 133:
489-509(1952).
Osnickaja, L. K.: Novyj vid purpurnoj bakterii iz plastovych vod neftjanogo
mestorozdenija. {Rhodopseudomonas issatchenkoi n. sp.). Trudy inst. mikro-
biol. 3:5 (1954).
Osnickaja, L. K. und V. I. Cudina: Fotosintezirujuscie bakterii iz ozera Vanda
(Antarktida). Mikrobiologija 47: 131-137 (1978).
Palm, B. T.: Eine Eisenbakterie aus Westafrika. Svensk. Bot. Tidstr. 27: 360-
362 (1933).
Pammel, L. H.: Bacteriosis of rutabaga [Bacillus campestris n. sp.). Iowa State
coll. Agr. Exp. Sta. Bull. 27: 130-134 (1895).
Pangborn, J. und m. P. Starr: Ultrastructure of Lampropedia hyalina. J. Bact.
91:2025-2030(1966).
Panosjan, A. K.: Mikrobiologiceskaja charakteristika soloncakov Armjanskoj
SSR v svjazi s voprosom ich osvojenija. Izdat. Ak. Nauk Arm. SSR,
1948.
Panosjan: 1950. (Zit.: L. N. Rubencik: Mikrobiologija 28: 328-335 (1959).
Pascher, A.: 1925. (In: L. Geitler und A. Pascher: Die Siifiwasserflora.
Heft 12. Cyanophyccae. Jena. 1925).
Pashinger, H., J. Paschinger und H. Gaffron: Photochemical Disproportiona-
tion of Sulfur into Sulfide and Sulfate by Chlorobium limicola forma thiosulfa-
tophtlum. Arch. Mikrobiol. 96: 341-351 (1974).
Pasveer, A.: Investigation on the control of filamentous bulking. Fourth Int.
Conf. Wat. Poll. Res. Praha. 1968.
Pate, J. L. und E. J. Ordal: The fine structure of two unusual stalked bacteria. J.
Cell. Biol. 27: 133-150(1965).
Pate, J. L., J. S. Porter und T. L. Jordan: Asticcacaulis biprosthecum sp. nov.
Life cycle, morphology and cultural characteristics. Ant. v. Leeuwenh. 39:
569 (1973).
Pel's, A. D.: K gidrobiologii Karabugaza. Trudy Soljanoj labor. Izdat. Ak.
Nauk SSSR. 1936.
- O biologiceskoj zone sakskoj grjazi. Mikrobiologija 6: 1090-1100 (1937).
Seamed & Djvued by Pahuta Yuri, Katadag 2008, e-mail pahutaqwelgrambler.
Literaturverzeichnis - 553
Perfil'ev, B. V.: O chlorofillonosnom mikrobe Pelodyction clathratiforme iz
gruppy zelenych bakterij. Mikrobiologija 1: 195-198 (1914).
- K uceniju a simbioze Chlorochromatium aggregatum Lauterb. (Cbloronium
mirabile Buder) in Cylindrogloea bacterifera nov. gen., nov. sp.
Mikrobiologija 1:222-227(1914).
- To the knowledge of the microorganismus of the Nevsky bay. Bull. Inst,
hydrobiol. Leningr. 1: 84-96 (1921).
- K mikroflore sapropelja. Bull. Com. Etud. Saprop. 1: Petrohrad 41-129
(1923).
- Die Rolle der Mikroben in der Erzbildung. Verh. d. Int. Verein. f. theor. u.
angew. Limnol., Stuttgart 3: 330-359 (1925-1927).
- Novye dannye o roli mikrobov v rudoobrazovanii. Izv. geol. komit. 45:
(1926).
- K metodike izucenija ilovych otlozenij. Trudy Borod. biol. stancii. 5: (1927).
- Izucenie zailenii i absoljutnaja geochronologija. Izv. geogr. obsc. 84: 339-349
(1952).
- Novyj biologiceskij tip bakterij s chisnym sposobom pitanija. DAN SSSR 98 :
845-848 (1954).
- Teorija i technika protocnych mikrokultur bakterij. Izdat. LGU. 1959.
- Novyj porjadok chisnych bakterij s lovcimi snarjadami i ich filogenez. Izdat.
VBO Ak. Nauk SSSR, Leningrad. 1960.
- 1964. (Zit.: G. A. Zavarzin und P. Hirsch. in Bergey's Manual. 1974).
- 1965. (Zit.: S. Maier, in Bergey's Manual. 1974).
- O novom sero-zeleznom mikroorganizme Thiodendron latens i sposobach
ego vyrascivanija v elektivnych kul'turach. Izv. A. N. SSSR ser. biol. 2:181
(1969).
Perfil'ev, B. V. und D. R. Gabe: Kapilljarnyje metody izucenija mikroorganiz-
mov. Izdat. Ak. Nauk SSSR, Moskva-Leningrad. 1961.
Die Rolle der Mikroorganismen bei der Bildung von Eisen-Mangan-Erzen
in Seen. Moskau. 1964.
Perty, M.: Zur Kenntnis kleinster Lebensformen. Jent und Reinert, Bern 1852.
Peskov, M. A.: Cytology, karyology and cyle of development of new microbes.
DAN SSSR 25: 244 (1939).
Peskov, M. A.: Order Caryophanales Peshkoff. (In: Bergey's Manual. 1948).
Peskov, M. A. und B. I. Marek: Tonkoe stroenie bakterij Caryophanon latum i
Caryophanon tenue Peskoff. Mikrobiologija 41: 1064-1067 (1972).
Peskov, M. A., L. A. Lefcenko und A. S. Sarkova: Mechanizm obrazovanija i
ultratonkoe stroenie geteromorfnych form Caryophanon latum Peshkoff.
Mikrobiologija 35: 1069-1072 (1966).
Peskov, M. A., B. I. Marek und I. A. Sadrina: Izucenie v svetovom mikroskope
citologiceskich izmenenij trichomnoj bakterii Caryophanum latum Peshkoff
vyzvannych virulentnym fagom (S 1, CP 1). Mikrobiologija 41: 849-853
(1972).
Vnutrikletocnoje razvitie faga v trichomach Caryophanon latum i
Caryophanon tenue. Mikrobiologija 42: 107-111 (1973).
Peskov, M. A., V. I. Sechovcov und G. G. Zarikova: Morfologija mnogokle-
tocnych bakterij Caryophanon v processe rosta na agarizovannoj srede.
Mikrobiologija 47: 539-544 (1978).
Peskov, M. A., A. S. Tichonenko und B. I. Marek: Bakteriolofag protiv mno-
gokletocnoj bakterii Caryophanon tenue Peshkoff. Mikrobiologija 35: 684-
687 (1966).
Peskov, M. A., S. B. Stefanov, I. A. Sadrina und B. I. Marek: Bakteriofag
virulentnyj dlja Caryophanon sublatum Peshkoff. Mikrobiologija 36: 136—
139 (1967).
554 • Literaturverzeichnis
Petersen, E. J.: A new sappropelic microorganism (Conidiothrvx. sulphurea).
Dansk. Botan. Arkiv 4: 1-16. (1921).
- Serological investigations on Azotobacter and Beijerinckia. Arsskr. Kgl. Vet.
Landbojskole. Copenhagen. Denmark. 1959.
- Isolation and maintenance of myxobacteria. (In: J. R. Norris and D. W.
Ribbons, (Editors): Methods in Mikrobiology 3B. Academic Press London,
New York. 1969).
Petrova, E. A.: Morfologija sernych purpurnych bakterij iz roda Chromatium v
zavisimosti ot sostava sredy. Mikrobiologija 28: 814—818 (1959).
Pettit, A.: Contribution a l'etude des spirochetides. I. Morphologie, physiolo-
gie et chimiotherapie des spirochetides. II. Genres and es'peces de
spirochetides. III. Spirochaeta icterohemorragiae. Chez l'Auteur, Vanves (Seine).
1928.
Pfennig, N.: Beobachtungen iiber das Schwarmen von Chromatium okenii.
Arch. f. Mikrobiol. 42: 90-95 (1962).
- Anreicherungskulturen fur rote und griine Schwefelbakterien. Zbl. f. Bact.
Abt. I. Orig. Suppl. 1: 179-189; 503-504 (1965).
- 1966. (Zit.: H. H. Thiele: Arch. f. Mikrobiol. 60: 124-138 (1968).
- On the biology of two brown colored Chlorohium species. Intern. Congr.
Microbiol. 9th. Moscow. 156 Abst. (1966).
- Photosynthetic Bacteria. A. Rev. Microbiol. 21: 285-324 (1967).
- Chlorohium phaeobacteroides nov. spec, und C. phaeovibrioides nov. spec,
zwei Arten der griinen Schwefelbakterien. Arch. f. Mikrobiol. 63: 224-226
(1968).
- Rhodopseudomonas acidophila, sp. n., a new species of the budding purple
nonsulfur bacteria. J. Bact. 99: 597-602 (1969a).
- Rhodospirillum tenue sp.n., a new species of the purple nonsulfur bacteria. J.
Bact. 99: 619-620. (1969b).
- Dark Growth of Phototrophic Bacteria under Microaerophilic conditions. J.
Gen. Microbiol. 61: ii-iii (1970).
- Rhodopseudomonas globiformis sp. n., a New Species of the Rhodospiralla-
ceae. Arch. Mikrobiol. 100: 197-206 (1974).
- The phototrophic bacteria and their role in the sulfur cycle. Plant and Soil 43 :
1-16 (1975).
- Rhodocyclus purpureus gen. nov. and sp. nov., a Ring-Shaped Vitamin B12
Requiring Member of the Family Rhodospirallaceae. Int. J. Syst. Bact. 28:
283-288 (1978).
Pfennig, N. und H. Biebel: Desulforomonas acetoxidans gen. nov. ans sp. nov.,
a New Anaerobic, Sulfur-Reducing Acetate-Oxidizing Bacterium. Arch. f.
Mikrobiol. 110: 3-12. (1976).
Pfennig, N. und G. Cohen-Bazire: Some properties of the green bacterium
Pelodictyon dathratiforme. Arch. f. Mikrobiol. 59: 226-236 (1967).
Pfennig, N. und K. D. Lippert: Uber das Vitamin B)2-Bedurfnis phototropher
Schwefelbakterien. Arch. f. Mikrobiol. 55: 245-256 (1966).
Pfennig, N. und H. G. Triiper: Prosposal to declare Rhodopseudomonas palu-
stris and Chloropseudomonas ethylica as nomina conservanda. Int. J. Bact. 19:
153-154 (1969).
New nomenclaturae combinations in the phototrophic sulfur bacteria. Int.
J. Bact. 21: 11-14 (1971a).
Conservation of the family name Chromatiaceae Bavendam 1924 with te
type genus Chromatium Perty 1852. In. J. Bact. 21: 15-16 (1971b).
Higher taxa of the phototrophic bacteria. Int. J. Bact. 21: 17-18 (1971c).
Pfennig, N., M. C. Markham und S. Liaaen-Jensen: Carotenoids of Thiorho-
daceae. 8. Isolation and charakterization of a Thiothece.^unprocystis and
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis ■ 555
Thiodictyon strain and their carotenoid pigments. Arch. f. Mikrobiol. 62:
178-191 (1968).
Pierson, B. K. und R. W. Castenholz: Bacteriochlorophylls in Gliding
Filamentous Prokaryotes from Hot Springs. Nature New. Biol. 233: 25-27
(1971).
A Phototrophic Gliding Filamentous Bacterium of Hot Springs Chlorofle-
xus aurantiacus, gen. and sp. nov. Arch. Mikrobiol 100: 5-24 (1974a).
Studies of Pigments and Growth in Ckloroflexus aurantiacus, a
Phototrophic Filamentous Bacterium. Arch. Mikrobiol. 100: 283-305 (1974b).
Pierson, B. K. und H. M. Howard: Detection of bacteriochlorophyll-contain-
ing microorganisms by infrared fluorescence photomicrography. J. Gen.
Microbiol. 73: 359-363 (1972).
Pijper, A.: 1951. (In: G. Knaysi: 1951).
Pillot, J.: Thesis, University of Paris, France, 1965.
Pillot, J. und M. A. Ryter: Structure des spirochetes. I. Etude des Genres
Treponema, Borrelia et Leptospira au microscope electronique. Ann. Inst.
Pasteur, (Paris) 108: 791-804 (1965).
Pivovarova, T. A. und V. M. Gorlenko: Tonkoe stroenie Ckloroflexus
aurantiacus var. mesophilus (Nom. prov.) vyrossich na svetu v aerobnych i anarob-
nych uslovijach. Mikrobiologija 46: 329-334 (1977).
Poindexter, J. L.: Biological properties and classification of the Caulobacter
group. Bact. Rev. 28: 231-295 (1964).
Pongratz, E.: D'une bacterie pedicule isolee d'un pus de sinus. Schweiz. Z. allg.
Path. Bakt. 20: 593-608 (1957).
Ponomarev, A.: Biologiceskoe obsledovanie sernych kljucej i ozera Sernovod-
ska - Samarskogo. Uc. rap. Karanskogo inst. V. I. Lenina-Uljanova 89:
(1929).
Prave, P.: Untersuchungen iiber die Stoffwechselphysiologie des Eisenbakte-
riums Leptothrix ochracea Kiitzing. Arch. f. Mikrobiol. 27: 33-62
(1957).
Prave, P. und Rippel-Baldes, A.: Die Autotrophie von Lept. ochracea. Natur-
wiss. 43:23(1956).
Preobrazenskaja: Uber die Okologie und Biologie von Eisenbakterien. 1937.
(Zit.: H. Beger und G. Bringmann: 1953).
Pretorius, W. A.: A systematic study of genus Spirillum which occurs on
oxidation ponds, with a description of a news species. J. Gen. Microbiol. 32 :
403-408(1963).
Prevot, A. R.: Un anaerobie strict reduisant les nitrates en nitrites Eubaaerium
nitritogenes s. sp. C. R. Soc. Biol. Paris 134: 353-355 (1940).
Prevot, A. R.: Manuel de classification et de determination des bacteries anaero-
bies. Masson et Co., Paris. 1940.
- 1955. (In: J. Brisou: 1955).
- Manual for the classification and determination of the anaerobic bacteria. Lea
and Febiger Philadelphia. 1966.
Pribram, E.: A contribution to the classification of microorganisms. J. Bact. 18:
361-394 (1929).
- Klassifikation der Schizomyceten. F. Deuticke, Leipzig. 1933.
Pringsheim, E. G.: The relation between Bacteria and Myxophyceae. Bact. Rev.
13: 47-98(1949).
- Iron bacteria. Biol. Rev. 24 (1949): 200-245.
- The filamentous bacteria Sphaerotilus, Leptothrix, Cladothrix and their
relation to iron and manganese. Phil. Trans. Roy. Soc. London B. Biol. Sci. 233 :
453-482 (1949).
- The bacterial genus Lineola^Cen. Microbiol. 4: 198-209 (1950).
556 • Literaturverzeichnis
- The Vitreoscillaceae: a family of colorless, gliding, filamentous organisms. J.
Gen. Microbiol. 5: 124-149 (1951).
- Iron Organisms. Endeavour 11: 208 (1952).
- Taxonomy of green bacteria. Nature 172: 167-168 (1953).
- Die Stellung der griinen Bakterien im System der Organismen. Arch. f.
Mikrobiol. 19: 353-364 (1953).
- Lampropedia hyalina Schroeter 1886 and Vannielia aggregate n. g., n. sp.,
with remarks on natural and on organized colonies in bacteria. J. Gen.
Microbiol. 13:285 (1955).
- Observations on Leucothrix mucor and Leucothrix cohaerens nov. spec. Bact.
Rev. 21: 69-76 (1957).
- 1957. Vitreoscillaceae. (In: Bergey's Manual 7th ed. 1957).
- 1965. (In: Anreicherungskultur und Mutatenauslese. Zbl. f. Bact. Abt. I.,
suppl. 1. 1965).
- Der Polymorphismus von Lyngbya kuetzingii. Arch. f. Mikrobiol. 53 : 402-
412 (1966).
- Lampropedia hyalina Schroeter, eine apochlorotische Merismopedia (Cyano-
phyceae). Arch. f. Mikrobiol. 55: 200-208 (1966).
- Zur Kenntnis von Leucothrix, einer Gattung farbloser Cyanophyceen. Arch,
f. Mikrobiol. 55: 266-277 (1966).
- Die Mixotrophie von Beggiatoa. Arch. f. Mikrobiol. 59: 247-254 (1967).
Pringsheim, E. G. und C. F. Robinow: Observations on two very large
bacteria, Caryophanon latum Peshkoff and Lineola longa (nomen provisiorum). J.
Gen. Microbiol. 1: 267-278 (1947).
Pringsheim, E. G. und W. Wiessner: Minimum requirements for heterotrophic
growth, and reserve substance in Beggiatoa. Nature (Lond.). 197:102 (1963).
Provost, P. und K. N. Doetsch: An Appraisal of Caryophanum latum. J. Gen.
Microbiol. 28: 547-557 (1962).
Prowazek, S., von: Parasitische Protozoen aus Japan gesammelt von Herrn Dr.
Mine in Fukuoka. Arch. Schiffs-Trop. hyg. 14: 297-302 (1910).
Psenin, L. N.: Azotobacter miscellum nov. sp., obitajuscij v Cernom more.
Mikrobiologija 33: 684-691 (1964).
Puckova, N. N. und V. M. Gorlenko: Novye koricnevye chlorobakterii Pros-
thecochloris phaeoasteroidea nov. sp. Mikrobiologija 45: 655-660 (1976).
Puckova, N. N., V. M. Gorlenko und T. A. Pivovarova: Sravnitel'noe izucenie
stroenija vibrioidnych zelenych serobakterij. Mikrobiologija 44: 108-114
(1975).
Puttlitz und Seeley, H. W.: 1968. (Zit.: H. W. Seeley, Jr. in Bergey's Manual.
1974).
Quayle, J. R. und N. Pfennig: Utilization of Methanol by Rhodospirillaceae.
Arch. Mikrobiol. 102: 193-198 (1975).
Rabenhorst, L.: Die Algen Deutschlands. 1847.
- 1853. (Zit.: W. Zopf: 1879).
- Ein Notizblatt fur kryptogamische Studien. Hedwigia 2: 41-56 (1854).
- Flora Europaea algarum aquae dulcis et submarinae. Sect. II., Leipzig. 1865.
- Flora Europaea algarum aquae dulcis et submarinae. Sect. III., Leipzig, 1868.
Raj, H. D.: A new species Microcyclus flavus. Int. J. Bact. 20: 61-81 (1970).
- A New Species: Microcyclus marinus. Int. J. Syst. Bact. 26: 528-544 (1976).
Ralfs, J.:OnthebritishDiatomaceae. Ann. and. Mag. Nat. Hist. Ser. 1. 12:351
(1843).
Ramaley, R. F. und J. Hixson: Isolation of a nonpigmented, thermophilic
bacterium similar to Thermus aquaticus. J. Bact. 103: 527-528 (1970).
Rasmussen, C. J.: On the effect of silage juice in Danish streams. Int. Ver. Ther.
Angew. Limnol. Verh. 12: 819-822 (1955).
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 557
Ray, P. H., D. C. White und T. D. Brock: Effect of Temperature on the Fatty
Acid Composition of Thermus aquaticus. J. Bact. 106: 25-30 (1971a).
Effect of Growth Temperature on the Lipid Composition of Thermus
aquaticus. J. Bact. 108: 227-235 (1971b).
Raymond, J. C. und W. R. Sistrom: The isolation and preliminary
characterization of a halophilic photosynthetic bacterium. Arch. f. Mikrobiol. 59: 255-
268 (1967).
Ectothiorhodospira halophila: a new species of the genus Ectothiorhodospi-
ra. Arch. f. Mikrobiol. 69: 121-126 (1969).
Razumov, A. S.: 1935. (Zit.: A. S. Razumov 1961).
- 1948. (In: N. A. Krasil'nikov: Opredelitel bakterij i aktinemycetov. Akad.
Nauk SSSR. Moskva. 1949).
- Gallionella kljasmiensis sp. n., kak komponent bakterialnogo planktona.
Mikrobiologija 18: 442-446 (1949).
- K voprosu o chemosinteze u zelezobakterij. Mikrobiologija 26: 392-396
- Mikrobial'nye pokazateli saprobnosti vodoemov zagrjaznennych promyslen-
nymi stocnymi vodami. Mikrobiologija 30: 515-524 (1961a).
- Mikrobial'nye pokazateli saprobnosti vodoemov zagrjaznennych promyslen-
nymi stocnymi vodami. II. Mikrobiologija 30: 938-945 (1961b).
- Mikrobial'nye pokazateli saprobnosti vodoemov, zagrjaznennych promys-
lennymi stocnymi vodami. III. Mikrobiologija 30: 1088-1096 (1961c).
Redinger, K.: Siaerocapsa coronta Redinger, eine neue Eisenbakterie aus dem
Lunzer Obersee. Arch. f. Hydrobiol. (Plankt.) 22: 410-414 (1931).
Reichenbach, H.: Untersuchungen an Archangium violaceum. Ein Beitrag zur
Kenntnis der Myxobakterien. Arch. f. Mikrobiol. 52: 376-403 (1965).
- Rhapidosomen bei Myxobakterien. Arch. f. Mikrobiol. 50: 246-255 (1965).
- Nannocystis exedens gen. nov., spec, nov., a new Mycobacterium of the
family Sorangiaceae. Arch. f. Mikrobiol. 70: 119-138 (1970).
Reichenbach, H. und J. R. Golecki: The Fine Structure oi Herpetosiphon, and
Note on the Taxonomy of the Genus. Arch. Mikrobiol. 102: 281-291
(1975).
Reinsch, P. F.: Species ac genera nova Algarum aquae dulcis quae sunt inventa in
speciminibus in Expeditions Vener. transit, hieme 1874-1875 in insula Ker-
guelensi a el. Eaton cellectis. J. Linn. Soc. Bot. 15: 205-221 (1876).
Remsen, C. C, S. W. Watson, J. B. Watterbury und H. G. Triiper: Fine
Structure of Ectothiorhodospira mobilis Pelsh. J. Bact. 95: 2377-2392 (1968).
Rich, L.: Respiration studies on the organic nitrogen preferences of Zoogloea
ramigera. Appl. Microbiol. 3: 20-25 (1955).
Rippel-Baldes: Grundrifi der Mikrobiologie. 1947. (Zit.: H. Beger und
G. Bringmann: 1952).
Ris, H.: Ultrastructure and molecular organisation of genetic system. Can. J.
Genet. Cytol. 3: 95 (1961).
Rittenberg, B. T. und S. C. Rittenberg: The growth of Spirillum volutans
Ehrenberg in mixed and pure cultures. Arch. f. Mikrobiol. 42: 138-153
(1962).
Robbins, J., A. Herrey und M. E. Stebbins: Studies on Euglena and vitamin
B12. Science 112:455 (1950).
Rodina, A. G.: Razvitie zelezobakterij pri zelenom udobrenii rybovodnych
prudov. Mikrobiologija 12: 171-178 (1953).
- Vodnye spirilly, fikcirujuscie molekuljarnyj azot. Mikrobiologija 25:145-149
(1956).
- Serobakterii detrita ozer Priladozja. Mikrobiologija 32: 675-682 (1963).
Rohrer, E.: Schweiz. Z. Hydrol. 14: 348 (1952).
558 ■ Literaturverzeichnis
Romano, H. und P.J. Peloquin: Composition of the sheath of Spkaerotilus
nutans. J. Bact. 86: 252-258 (1963).
Romanova, A. K., I. Ja. Vedenina. K. A. Zykalova, Z. M. Ermolenko und
L. R. Semenova: Puti assimiljacii ugleroda pri metilotrofii Pseudomonas
gazotropha. Mikrobiologija 47: 617-623 (1978).
Rossi, de.: Microbiologia agraria e tecnica. Torino. 1927.
Roth, A. W.: Catalecta botanica quibus plantae novae et minus cognitae descri-
buntur et illustrantur. Lipsiae, fasc. 1-3. Catal. bot. 1 (1797).
Rouf, M. A. und J. L. Stokes: Morphology, nutrition and physiology of
Sphaerotilus discophorus. Arch. f. Mikrobiol. 49: 132-149 (1964).
Roy, A. B.: A new species of Azotobacter producing heavy slime and acid.
Nature. (Lond.) 182: 120-121 (1958).
Roy, A. B. und S. Sen: A new species of Derxia. Nature. (Lond.) 194: 604-605
(1962).
Roze, E.: Le Clonothrix, un nouveau type generique de Cyanophycees. J. Bot.
10: 325-330(1896).
Rubencik, L. I.: Zur aeroben Zellulosezersetzung auf den Rieselfeldem. Zbl. f.
Bact. Abt. II. 88: 186-193 (1933).
- K sistematike bakterij iz semejstva Azotobacteriaceae. Mikrobiologija 28 :
328-335 (1959).
Ruchhoft, C. und J. Watkins: Bacteriological isolation and study of the
filamentous organisms in the activated sludge. Sevage Works J. 1: 52 (1928).
Rullmann, W.: Die Eisenbakterien, Streptotrichen und Actinomyceten. (In:
Handbuch d. Tech. Mykologie, Jena, Bd. III. 1904-1906).
- Photogramme von Crenothrix polyspora Cohn. Zbl. f. Bact. Abt. II. 20: 97-
99 (1907).
- Uber Eisenbakterien. Zbl. f. Bact. Abt. II. 33: 277-289 (1912).
Ruttner, F.: Limnologische Studien an einigen Seen der Ostalpen. Arch. f.
Hydrobiol. 32: 167-319 (1937).
- Planktonstudien der Deutschen Limnologischen Sunda-Expedition. Arch. f.
Hydrobiol. Tropische Binnengewasser, Suppl. 10 1952.
Rullmann, W.: Uber ein Nitrosobakterium mit neuen Wuchsformen. Zbl. f.
Bact. Abt. II. 3: 228-231 (1897).
Ryter, A. und J. Pillot: Structure des spirochetes. II. Etude di genre Cristispira
au microscope optique et au microscope electronique. Ann. Inst. Pasteur
(Paris) 108: 552-562 (1965).
Sack, J.: Eine nitritbildende Bakterie. Zbl. f. Bact. Abt. II. 64: 32-37 (1925).
Saccardo, P. A.: Schizomycetaceae. Sylloge Fungorum 8: 923-1087 (1889).
Sakharoff, M. N.: Spirochaeta anserina et la septicemie des oies. Ann. Inst.
Pasteur (Paris) 5: 564-566 (1891).
Saiki, T., R. Kimura und K. Arima: Isolation and Characterization of Extremely
Thermophilic Bacteria from Hot Springs. Agric. Biol. Chem. 36: 2357 (1972).
Sail, T. und S. Mudd: A cytological study of Caryophanon latum. J. gen.
Microbiol. 12: 47-53 (1955).
Sambon, L.: Spiroschaudinnia. 1907. (In: Manson: Tropical Diseases, 4th ed.
Cassell, London, 1907).
Sampaio, M. J. A., L. Vasconcellos und J. Dobereiner: Indentification of three
groups within Spirillum lipoferum. Int. Symp. Env. Role of Nitrogen fixing
Bluegreen Algae and Asymbiotic Bacteria, Uppsala, Suecia (1976).
Sanzieva, E. U. und G. A. Zavarzin: Bakterija, okisljajuscaja okis' ugleroda.
DAN SSSR 196: 956-958 (1971).
Satoh, T., Y. Hoshino und H. Kitamura: Rhodopseudomonas sphaeroides
forma ssp. denitrificans, a Denitrifying Strain as a Subspecies of
Rhodopseudomonas sphaeroides. Arch. Mikrobiol. 108: 265-269 (1976).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 559
Savel'eva, N. D.: Metod kolicestvennogo uceta okisjajuscich margenec Lepto-
thrix. Mikrobiologija 34: 895-900 (1965).
Savel'eva, N. D. una A. N. Nozevnikova: Aftotrofnyj rost Seliberia carboxy-
dohydrogena pri okislenii vodoroda i okisi ugleroda. Mikrobiologija 41: 813—
817(1972).
Scardovi, V.: Un nuovo solfo-batterio fotosintetizzante: Rhodopseudomonas
vanniellii n. sp. Annali di Microbiologia 4: 77-102 (1950).
Scarr, M. P.: Production of polysaccharides by rod-shaped bacteria in sugar
factory and rafinery processes. Proc. Soc. Appl. Bact. 2: 100-104 (1949).
Scotten, H. L.: The isolation and study of pure cultures of Beggiatoa species.
Master's Thesis, Indiana Univ., Bloomington, Indiana USA. 1951.
Scotten, H. L. und J. L. Stokes: Isolation and properties of Beggiatoa. Arch. f.
Mikrobiol. 42: 353-368 (1962).
Sebald, M. M. und M. Veron: Teneur en bases de l'ADN et classification des
vibrions. Ann. Inst. Pasteur. 105: 897-910 (1963).
Seidler, R. J. und M. P. Starr: Isolation and characterization of
host-independent bdellovibrios. J. Bact. 100: 769-785 (1969).
Seidler, R. J., M. P. Starr und M. Mandel: Deoxyribonucleic acid
characterization of bdellovibrios. J. Bact. 100: 786-790 (1969).
Seidler, R. J., M. Mandel und J. N. Baptist: Molecular heterogeneity of the
bdellovibrios, evidence for two new species. J. Bact. 109: 209-217 (1972).
Setchel und Gardner: Univ. of Calif, publ. of Botany 6: 468 (1918). (Zit.:
H. Beger und G. Bringmann: 1953).
Skerman, V. B. D.: A guide to the identification of the genera of bacteria.
Baltimore, Wiliams and Wilkins. 1967.
Scherffel, A.: Aleologische Notizen. Ber. dtsch. Bot. Ges. 25: 228-232 (1907).
Shilo, M.: Morphological and physiological aspects of the interaction of Bdello-
vibrio with host bacteria. Curr. Top. Microbiol. Immunol. 50: 174-204
(1969).
Shilo, Miriam: Lysis of blue-green algae by Myxobacter. J. Bact. 104: 453—461
(1970).
Shmamine, T.: Uber die Reinziichtung der Spirochaeta pallida und der nadelfor-
migen Bakterien aus syphilitischem Material, mit besonderer Beriicksichti-
gung der Reinkultur von Spirochaeta dentium und des Bac. fusiformis aus der
Mundhohle. Zbl. f. Bact. Abt. I., Orig. 65: 311-337 (1912).
Shutter, J. und P. W. Wilson: Patterns of enzymatic adaptation in species of the
genus Azotobacter. J. Gen. Microbiol. 12: 446-454 (1955).
Schaudinn, F.: Korrespondenzen. Dsch. med. Wschr. 31: 1728 (1905).
Schaudinn, F. und E. Hoffmann: Vorlaufiger Bericht uber das Vorkommen von
Spirochaeten in syphilitischen Krankheitsprodukten und bei Papillomen.
Arb. Gesundh. Amt. Berl. 22: 528-534 (1905).
Scheer: 1934. (Zit.: H. Beger und.G. Bringmann: 1953).
Schellack, C: Studien zur Morfologie und Systematik der Spirochaeten aus
Muscheln. Kais. Ges. Amte. 30: 379 (1909).
Scherff, R. H., J. E. de Vay und T. W. Carroll: Ultrastructure of host parasitic
relationships involving reproduction of Bdellovibrio bacteriovorus in host
bacteria. Phytopathology 56: 627-632 (1966).
Scheuring, L.: Sphaerotilus natans, geloste und ungeloste Fragen. Wass. u.
Abwass. 2:39-51 (1957).
Schewiakoff, W.: Uber einen neuen bacterienahnlichen Organismus des Siifi-
wassers. Habilitationsschrift, Heidelberg, 1893.
Schikora, F.: Entwicklungs-Bedingungen einiger abwasserreinigenden Pilze,
insbes. Sphaerotilus fluitans, nov. spec, und Leptomitus lacteus Ag. Z. f.
Fischerei7: 1-28 (1899).^
560 • Literaturverzeichnis
Schlegel, H. G. und N. Pfennig: Die Anreicherungskultur einiger Schwefelpur-
purbakterien. Arch. f. Mikrobiol. 38: 1-39 (1961).
Schmid, G.: 1922. (In: H. Simons: Saprophytische Oscillatorien des Menschen
und der Tiere. Zbl. f. Bact. Abt. I., Orig. 88: 501-510 (1922).
Schmidle, W.: Neue Algen aus dem Gebiete des Oberheims. Beih. Bot. Cent.
10: 179-180(1901).
- Algen, insbesondere solche aus dem Plankton des Nyassa-Sees. Bot. J. Syst.
32: 63 (1903).
Schmidt, Karin: Die Carotinoide der Thiorhodaceae. II. Carotinoidzusammen-
setzung von Thiospirillum jenense Winogradsky und Chromatium vinosum
Winogradsky. Arch. f. Mikrobiol. 46: 127-137 (1963).
Schmidt, Karin und H. G. Triiper: Carotenoid composition in the genus Ecto-
thiorhodospira Pelsh. Arch. f. Mikrobiol. 80: 38-42 (1971).
Schmidt, Karin, N. Pfennig und S. Liaaen-Jensen: Carotenoids of
Thiorhodaceae. IV. The carotenoid composition of 25 pure isolates. Arch. f. Mikrobiol.
52: 132-146(1965).
Schmidt, J. M.: Stalk elongation in mutants of Caulobacter crescentus. J. Gen.
Microbiol. 52: 291-298 (1968).
- Prosthecate bacteria. Ann. Rev. Microbiol. 25: 93-110 (1971).
- Effect of Lysozyme on Crossbands in Stalks of Caulobacter crescentus. Arch.
f. Mikrobiol. 89: 33-40 (1973).
Schmidt, J. M. und R. Y. Stanier: Isolation and characterization of
bacteriophages actives against stalked bacteria. J. Gen. Microbiol. 39: 95-107 (1965).
Schmidt, J. M. und M. P. Starr: Morphotype V of the Blastocaulis-Planctomyces
Group of budding and appendaged bacteria: Planctomyces guttaeformis Hor-
tobagyi (sensu Hajdu). Current Microbiology 2: 195-200 (1979).
Schmidt, J. und F. Weis: Die Bakterien. Naturhistorische Grundlage fur das
bakteriologische Studium. Verlag von Gustav Fischer, Jena. 1902.
Schoenichen, W. und A. Kalberlah: 1900. (In: B. Eyferth's Einfachste Lebens-
formen, des Tier- und Pflanzenreiches. 3rd ed. B. Qoeritz, Braunschweig.
I-VII, 1900).
Schopf, J. M., E. G. Ehlers, D. V. Stiles und J. D. Birle: Fossil iron bacteria
preserved in pyrite. Proc. Amer. Phil. Soc. 109: 288-308 (1965).
Scnorler, B.: Beitrage zur Kenntnis der Eisenbakterien. Zbl. f. Bact. Abt. II. 12:
681-695 (1904).
Schorr, L.: Uber Leptothrix crassa. Zbl. f. Bact. Abt. II. 100: 146 (1939).
Schon, G.: Fructoseverwertung und Bacteriochlorophyllsynthese in anaeroben
Dunkel- und Lichtkulturen von Rhodospirillum rubrum. Arch. f. Mikrobiol.
63: 362-375 (1968).
- Der Einflufi der Reservestoffe auf den ATP-Spiegel in Zellen von
Rhodospirillum rubrum beim Ubergang von aerober zu anaerober Dunkelkultur. Arch. f.
Mikrobiol. 68: 40-50 (1969).
Schroeter, J.: 1885-1889. (In Cohn: Krypto gamen-Flora von Schlesien. 1889).
Schroder, M.: Die Assimilation der Luftstickstoffs durch einige Bakterien. Zbl.
f. Bact. Abt. II. 85: 177-212 (1932).
Schwers, H.: Le fer dans les eaux souterraines. Rev.d' Hyg. et de pol. san. 30:
100(1908).
- Megalothrix discophora, eine neue Eisenbakterie. Zbl. f. Bact. Abt. II. 3 : 273-
276 (1912).
Siegel, J. M.: The dark anaerobic metabolism of acetone and acetate by the
photosynthetic bacterium Rhodopseudomonas gelatinosa. J. Biol. Chem. 228:
41-47 (1957).
Simon, G. D. und D. White: Growth and Morphological Characteristics of a
Species of Flexibacter. Arch. f. Mikrobiol. 78: 1-16 (1971).
Seamed &. Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.
Literaturverzeichnis • 561
Simons, H.: Eine saprophytische Oscillarie im Darm des Meerschweinchens.
Zbl. f. Bact. Abt. II. 50: 356-368 (1920).
Sirevag, R. und J. G. Ormerod: Synthesis, Storage and Degradation of Polyglu-
cose in Chlorobium tbiosulfatophilum. Arch. f. Mikrobiol. Ill: 239-244
(1977).
Skalinskij, E. I. und E. N. Kondrat'eva: Novyj vid zelenych serobakterij. DAN
SSSR 138:456-457(1961).
Morfologija novogo vida zelenych serobakterij. DAN SSSR 139 (1961).
Skerman, V. B. D.: A guide to the identification of the genera of bacteria. The
Williams and Wilkins Co., Baltimore. 1959.
- A guide to the identification of the genera of bacteria 2nd ed. The Williams and
Wilkins Co., Baltimore. 1967.
Skerman, V. B. D., Galina Dementjeva und J. Barbara Carey: Intracellular
deposition of sulfur by Sphaerotilus natans. J. Bact. 73: 504-512 (1957).
Skerman, V. B. D., Galina Dementjeva und G. W. Skyring: Deposition of
sulphur from hydrogen sulfide by bacteria and yeast. Nature (Lond.) 179: 742
Skuja, H.: Taxonomie des Phytoplanktons einiger Seen in Uppland, Schweden.
Uppsala, A. B. Lundequistska Bokhandel. 1948.
- Taxonomische und biologische Studien viber das Phytoplankton schwedischer
Binnengewasser. A. B. L. Norblads Bokhandel, Uppsala, 1956.
- Die Pelonematacee *Desmanthos thiocrenophilum», ein Vertreter der apo-
chromatischen Blaualgen aus Schwefelquellen. Svensk. Bot. Tid. 52: 437-444
(1958).
- Grundziige der Algenflora und Algenvegetation der Fjeldgegenden um Abi-
sko in Scnwedisch-Lappland. Uppsala. 1964.
Smit, J.: Uber die Ursachen des Aufblahens von Belebtschlamm. Arch. f.
Mikrobiol. 5 : 550-560 (1934).
Smith, N. R.: Strain variation of Azotobacter and the utilization of carbon
compounds. J. Bact. 27: 54-55 (1934).
Smith, T. und M. S. Taylor: Some morphological and biochemical characters of
the spirilla {Vibrio fetus, n. sp.) associated with disease of the fetal membranes
in cattle. J. Exp. Med. 30: 299-311 (1919).
Snellen, J. E. und H. D. Raj: Morphogenesis and fine structure of Leucothrix
mucor and effect of calcium deficiency. J. Bact. 101: 240-249 (1970).
Sokolova, G. A.: Zelezobakterii ozera Glubokogo. Mikrobiologija28: 246-250
(1959).
- Jahreszeitliche Veranderung der Artzusammensetzung und der Anzahl der
Eisenbakterien und der Eisenkreislauf in der Trefsee. Trudy vsesoj. gidrobiol.
obsc. 11:5-11 (1961).
Sokolova-Dubinina, G. A. und Z. P. Derjugina: Izucenie processa obrazovani-
ja zelezo-margancevych konkrecij v ozere Punnus-Jarvi. Mikrobiologija 36:
1066-1076 (1967).
Vlijanije uslovij ozernoj sredy na mikrobiologiceskoe obrazovanie margan-
cevoj rudy. Mikrobiologija 37: 147-153 (1968).
Solov'eva, Z. V. und D. V. Fedorov: Izmenenija ul'tratonkogo stroenija
Chlorobium thiosulphatophilum v zavisimosti ot uslovii rosta. Mikrobiologija 39:
850-854 (1970).
Soriano, S.: Un nuevo orden de bacterias: Flexibacteriales. Ciencia e Invest.
(Buenos Aires) 1: 92-93 (1945).
- The Flexibacteriales and their systematic position. Ant. v. Leeuwenh. 12: 215
(1947).
Soriano, S. und I. A. Lewin: Gliding microbes: some taxonomie
reconsiderations. Ant. v. Leeuwenh. 31: 66-80 (1965).
562 ■ Literaturverzeichnis
Sorokin, N.: Eine neue Spirillum-Art. Zbl. f. Bact. Abt. I. 1: 465-466
(1887).
- Ob istinnoj prirode novogo klassa mikroorganizmov Krassilnikoviae (Kriss).
Mikrobiologija 32: 425-433 (1963).
Sperl, G. T. und D. S. Hoare: Denitrification with Methanol as Selective
Enrichment for Hyphomicrobium Species. J. Bact. 108: 733-736 (1971).
Staley, J. T.: Prosthecomicrobium and Ancalomicrobium: new prosthecate
freshwater bacteria. J. Bact. 95: 1921-1942 (1968).
Staley, J. T.: 1973. (Zit.: P. Hirsch in Bergey's Manual. 1974).
Stanier, R. Y.: Studies on the cytophages. J. Bact. 40: 619-636 (1940).
- A note on elasticotaxis in myxobacteria. J. Bact. 44: 405—412 (1942).
- The Cytophaga-group: a contribution to the biology of Myxobacteria. Bact.
Rev. 6: 142-196(1942).
- Studies on nonfruiting myxobacteria. I. Cytophaga johnsonae, n. sp., a
chitindecomposing myxobacterium. J. Bact. 53: 297-315 (1947).
- Myxobacterales Jahn, 1915. (In: Bergey's Manual. 1957).
Stanier, R. Y., R. Kunisawa, M. Mandel und G. Cohen-Bazire: Purification
and Properties of Unicellular Blue-Green Algae (Order Chroococcales).
Bacteriol. Rev. 35: 171-205 (1971).
Stanier, R. Y. und Koll. 1971. (Zit.: Bergey's Manual. 1974).
Stanier, R. Y., W. R. Sistrom, T. A. Hanzen, R. A. Whitton, R. W. Casten-
holz, N. Pfennig, V. N. Gorlenko, E. N. Kondrat'eva, K. E. Eimhjellen,
R. Whittenbury, R. L. Gherna und H. G. Triiper: Proposal to Place the
Nomenclature of the Cyanobacteria (Blue-Green Algae) under the Rules of
the International Code of Nomenclature of Bacteria. Int. J. Syst. Bact. 28:
335-336 (1978).
Stanley, P. M., R. L. Moor und J. T. Staley: Characterization of Two new
Isolates of Mushroom-Shaped Budding Bacteria. Int. J. Syst. Bact. 26: 522-
527 (1976).
Stapp, C. und I. Bortels: Mikrobiologische Untersuchungen iiber die Zerset-
zung von Waldstreu. Zbl. f. Bact. Abt. II. 90: 28-66 (1934).
Starkey, R. L. und P. K. De: A new species of Azotobacter. Soil. Sci. 47: 329-
342 (1939).
Starmach, K.: Flora sladkowodna Polski. Tom. 2. Cyanophyta - sinice, Glau-
cophyta - glaukofity. Panstwowe wydawnictwo naukowe. Warszawa 1966.
Starr, M. P. und N. L. Baigent: Parasitic interaction of Bdellovibrio bacterio-
vorus with other bacteria. J. Bact. 91: 2006-2017(1966).
Starr, M. P. und V. B. D. Skerman: Bacterial diversity: the natural history of
selected morphologically unusual bacteria. Ann. Rev. Microbiol. 19: 407—454
(1965).
Steed, P. D. M.: Simonsiellaceae fam. nov. with characterization of Simonsiella
crassa and Alysiella filiformis. J. Gen. Microbiol. 29: 615-624 (1962).
Stefanov, S. B. und D. I. Nikitin: Submicroscopic bodies in soil suspensions.
Mikrobiologija 34 : 261-264 (1965).
Stewart, W. D. P.: Liberation of extracellular nitrogen by two nitrogen-fixing
bluegreen algae. Nature 200: 1020-1021 (1963).
Stiebel, S. F.: Die Grundformen der Infusorien. Museum Senekenbergianum
1839.
- Die Grundformen der Infusorien. Frankfurt a. M. 1841.
Stiles, C. W. und C. A. Pfender: The generic name Spironema Vuillemin 1905
(not Meek, 1864, Mollusk) - Microspironema Stiles and Pfender 1905 of the
parasite syphilis. Amer. Med. 10: 936 (1905J.
Stimson, A. M.: Note on an organism found in Yellow-fever tissue. Publ.
Health. Rep. 22: 541 (1907). ^
Scanned & Djvued by Pahuta Yuri, Katadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis ■ 563
Stokes, J. L.: Studies on the filamentous sheathed iron bacterium Sphaerotilus
nutans. J. Bact. 67: 278-291 (1954).
Stokes, J. L. und A. H. Johnson: Growth factor requirements of two stains of
Sphaerotilus discophorus. Ant. v. Leeuwenh. 31: 175-180 (1965).
Stokes, J. L. und Margaret T. Powers: Stimulation of poly-f}-hydroxybutyrate
oxidation in Sphaerotilus discophorus by manganese and magnesium. Arch. f.
Mikrobiol. 59: 295-301 (1967).
Stolp, H. J.v und H. Petzold: Untersuchungen iiber einen obligat parasitischen
Mikroorganismus mit lytischer Aktivitat fur Pseudomonas-Bdkterien. Phyto-
pathol. Z. 45: 364-390 (1962).
Stolp, H. J. und M. P. Starr: Bdellovibrio bacteriovorus gen. et sp. n., a
predatory, ectoparasitic and bacteriolytic microorganism. Ant. v. Leeuwenh.
29: 217-248(1963).
Stove, J. L. und R. Y. Stanier: Cellular differentiation in stalked bacteria.
Nature 196: 1189-1192 (1962).
Strength, W.J. und Krieg, N. R.: Flagellar activity in an aquatic bacterium.
Can. J. Microbiol. 17: 1133-1137(1971).
Strength, W. J., D. Bilquis Isani, D. M. Linn, F. D. Williams, G. E. Wander-
molen, B. E. Laughon und N. R. Krieg: Isolation and Characterization of
Aquaspirillum fasciculus sp. nov., a Rod Shaped, Nitrogen Fixing Bacterium
Having Unusual Flagella. Int. J. Syst. Bact. 26: 253-268 (1976).
Strohl, W. R. und L. R. Tait: Cytophaga aquatilis sp. nov., a Facultative
Anaerobe Isolated from the Gills of Freshwater Fish. Int. J. Syst. Bact. 28:
293-303 (1978).
Strzeszewski, B.: Beitrage zur Kenntnis der Schwefelflora in der Umgebung von
Krakau. Bull. Int. Acad. Sci. Cracovie (Acad. Pol. Sci). Ser. B. Sci. Nat. I:
309-334 (1913).
Stutzer, A. und R. Hartleb: Untersuchungen iiber das in Alinit enthaltene
Bakterium. Zbl. f. Bact. Abt. II. 4: 31-39 (1898).
Untersuchungen iiber die bei der Bildung von Salpeter beobachteten Mi-
kroorganismen. Mitteil. d. landwirtsch. Inst. d. k. Univ. Breslau 1: 75-100;
197-232 (1899).
Suskina, N. N.: Azotobakter zasolenych pocv, evo raspredelenie i charakteristi-
ka. Vest. Mosk. Inst. 7: 105-119 (1948).
- Fiksacija azota i biologiceskie osobennosti azotobaktera vydelennovo iz
zasolivsichsja pocv Niznej Volgi. Vest. Mosk. Inst. 10: 195-209 (1948).
- Vest. M G U 7: 105 (1948); 10: 195 (1948). (Zit.: L.J. Rubencik 1959).
- Vest. M G U 6: 123 (1949). (Zit.: L. J. Rubencik 1959).
Swellengrebel, N. H.: Sur la cytologie comparee des spirochetes et des spirilles.
Ann. Inst. Pasteur 21: 581 (1907).
- Neuere Untersuchungen iiber die vergleichende Cytologie der Spirillen und
Spirochaeten. Zbl. f. Bact. 49: 529 (1909).
Szafer, W.: Zur Kenntnis der Schwefelflora in der Umgebung von Lemberg.
Bull. Int. Acad. Sci. Cracovie, Ser. B. 3: 161-162 (1911).
Saposnikov, V. N.: About the replacement of the sulfur by selenium in the
photoreduction of carbonic acid by purple sulfur bacteria. Mikrobiologija 6:
643-644 (1937).
Saposnikov, V. N., L. K. Osnickaja und V. I. Cudina: Ispolzovanie uksusnoj
ltisloty kak edinstvennogo istocnika ugleroda fotosintezirujuscej bakterii
Chromatium vinosum. Mirkrobiologija 29: 14-19 (1960).
Ucastie propionovoj kisloty v konstruktivnom obmene Chromatium
vinosum. Mikrobiologija 29: 164-169 (1960).
Ispolzovanie Chromatioum vinosum uksusnoj i propionovoj kislotu pri
sovmestnom ich prisutstvii v^srede. Mikrobiologija 29: 320-322 (1960).
564 • Literaturverzeichnis
Saposnikov, V. N., E. N. Kondrat'eva und V. D. Federov: K izuceniju zele-
nych serobakterij roda Chlorobium. Mikrobiologija 27: 530-535 (1958).
A new species of green sulphur bacteria. Nature (Lond.) 187: 167-168
(196°)-
Saposnikov, V. N., E. N. Kondrat'eva, E. N. Krasil'nikova, und A. A. Ra-
menskaja: Zelenye bakterii, ispolzujuscie organiceskije soedinenija. DAN
SSSR 129: 1424 (1959).
Sechovcov, V. P. und G. G. Zarikova: Citomorfologija lipidnych vkljucenij
Caryophanon pri ego roste na agarizovannoj srede. Mikrobiologija 47: 733-
738 (1978).
Siskina, V. N. und Ju. A. Trocenko: Svojstva novogo stamma Hyphomicro-
bium ispol'zujuscego odnouglerodnye soedinenija. Mikrobiologija 43 : 765-
770 (1974).
- Sturm, L. D. und S. I. Orlova: Serobakterii i ekologiceskie uslovija vodoema,
soputstvujuscie ich obil'nomu razvitiju. Trudy inst. mikrobiol. Ak. Nauk
SSSR 3: 176-178 (1954).
Svorcova, L.: Iron bacteria of the genus Siderocapsa in mineral waters. Z. f. Allg.
Mikrobiol. 15: 553-557 (1975).
- Kultivace a urcovani zelezitych bakterii. Kandidatska dis. price, VSCHT.
Praha. 1975.
Tauschel, H. D. und G. Drews: Thylakoidmorphogenese bei Rhodopseudomo-
nas palustris. Arch. f. Mikrobiol. 59: 381-404 (1968).
Taylor, V. I., P. Baumann, J. L. Reichert und R. D. Allen: Isolation,
Enumeration, and Host Range of Marine Bdellovibrios. Arch. f. Mikrobiol. 98 : 101—
114 (1974).
Tchan, Y. T.: Studies of N-fixing bacteria. III. Azotobacter beijerinckii (Lip-
man, 1903) var. acido-tolerans (Tchan, 1953). Proc. Linn. Soc. N. S. W. 78:
83-84 (1953a).
- Studies of N-fixing bacteria IV. Taxonomy of genus Azotobacter (Beijerinck
1901). Proc. Linn. Soc. N. S. W. 78: 85-89 (1953b).
- Studies of nitrogen-fixing bacteria. VI. A new species of nitrogen-fixing
bacteria. Proc. Linn. Soc. N. S. W. 82: 314-316 (1957).
Teichmann, E.: 1933. (Zit.: H. Beger und G. Bringmann: 1953).
- Vergleichende Untersuchungen iiber die Kultur und Morphologie einiger
Eisenorganismen. Diss. Praha. 1935.
Telegina, Z. I.: Nekotorie dannye o fiziologii butan-okisljajuscich mikroorga-
nizmov. Mikrobiologija 36: 67-73 (1967).
Ten Chak-Mun: Mikroorganizmy, okisljajuscie zelezo i marganec, v pocvach
juznoj casti Sachalina. Mikrobiologija 36: 337-344 (1967).
- O biologiceskoj prirode zelezo-margancevych korok pocvoobrazujuscich
porod v gornych pocvach Sachalina. Mikrobiologija 37: 749-753 (1968).
- Novyj pocvennyj mikroorganizm, okisljajuscij marganec. DAN SSSR 188:
679-699 (1969).
Terasaki, Y.: On two new species of Spirillum. Bot. Mag. Tokyo 74: 220-227
(1961).
- On Spirillum putridiconcbylium nov. sp. Bot. Mag. Tokyo 74: 79-85 (1961).
- On the isolation of Spirillum. Bull. Suzugamine Women's Coll. Nat. Sci. 10:
1-10 (1963).
- Studies on the genus Spirillum Ehrenberg. I. Morphological, physiological,
and biological characteristics of water spirilla. Bull. Suzugamine Women's
Coll. Nat. Sci. 16: 1-146 (1972).
- Studies on the genus Spirillum Ehrenberg. II. Comments on type and
reference strains of Spirillum and description of new species and subspecies. Bull.
Suzugamine Womes's Coll. Nat. Sci. 17: 1-71 (1973).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 565
- Transfer of Five Species and Two Subspecies of Spirillum to Other Genera
(Aquaspirillum and Oceanospirillum), with Emended Descriptions of the
Species and Subspecies. Int. J. Syst. Bact. 29: 130-144 (1979).
Thaxter, R.: The potato «scab». (In: R. Thaxter: Report of the mycologist.
Conn. Agr. Exp. Sta. Rept. : 81-95 (1890).
- Potato «scab». Ann. Rep. Conn. Agr. Esp. : 153-160 (1891).
- On the Myxobacteriaceae, a new order of Schizomycetes. Bot. Gaz. 17: 389-
406 (1892).
- A new order of Schizomycetes. Bot. Gaz. 18: 29-30 (1893).
Thiele, H. H.: Die Verwertung einfacher organische Substrate durch Thiorho-
daceae. Arch. f. Mikrobiol. 60: 124-138 (1968).
Thuret, M. G.: Essai de classification des Nostochineae. Ann. Sci. Nat. Bot. 6:
372-382 (1875).
Tieghem, P., van: Developpement du Spirillum amyliferum sp. nov. Bull. Soc.
Bot. France 26 : 65-68 (1879).
- Observations sur des Bacteriacees vertes, sur des Phycochromacees blanches
et sur les affinites de ces deux families. Bull. Soc. Bot. France 27: 174-179
(1880).
Tkacenko, N. I. und E. E. Drubljanec: Sphaerotilus dichotomus vozbuditel
vspuchanija aktivnogo ila aerotenkov. Mikrobiologija 28: 763-767 (1959).
Tkaceva, Z. G. und E. N. Kondrat'eva: Formiatdegidrogenaza i formiatgidro-
genliaza Chloropseudomonas ethylica. Mikrobiologija 40: 63-67 (1971).
Toni, J. B.. de und V. Trevisan: Schizomycetaceae Naegeli. (In: P. A. Saccardo:
SyllogevFungorum 8: 923-1087 (1889).
Tomina, Z. V. und V. N. Federov: Ul'tratonkoe stroenie zelenoj serobakterii
Chlorobium thiosulfatophilum. Mikrobiologija 36: 663-666 (1967).
Trevisan, V.: Prospetto della Flora Euganea. Padova. 1842.
- Prime linee d'introduzione alio die takterij italiani. R. C. Inst. Lombardo
(Ser. 2). 12: 133-151 (1879).
- 1889. (In: Toni et Trevisan 1889, in: P. A. Saccardo: Sylloge Fungorum 8:
923-1087 (1889).
Tripatky, D. N. und L. E. Hanson: Colonial and morphologic variations of
Leptospira Mini strain 3055. Am J. Vet. Res. 33 : 1723-1727 (1972).
Studies of Leptospira Mini strain 3055; Pathogenicity for different animals.
Am. J. Vet. Res. 34: 557-562 (1973a).
Studies of Leptospira Mini strain 3055; Immunological and serological
determinations. Am. J. Vet. Res. 34: 563-565 (1973b).
Trocenko, J. A.: Zelenye fotosintezirujuscie bakterii vydelennye iz sernogo
ozera. Mikrobiologija 35: 1087-1093 (1966).
Trocenko, J. A. und E. N. Kondrat'eva: O charaktere ispolzovanija nekoto-
rych spirtov zelenymi fotosintezirujuscimi bakterijami. DAN SSSR 178: 218
(1968).
Triiper, H. G.: Ectothiorhodospira mobilis Pelsh, a photosynthetic sulfur
bacterium depositing sulfur outside the cells. J. Bact. 95: 1910-1920 (1968).
- Higher Taxa of the Phototrophic Bacteria: Chloroflexaceae fam. nov., a
Family for the Gliding, Filamentous Phototrophic Green Bacteria. Int. J.
Syst. Bact. 26: 74-75(1976).
Triiper, H. G. und S. Genovese: Charakterizatiori of photosynthetic sulfur
bacteria causing red water in Lake Faro (Messina, Sicily). Limnol. Oceanogr.
13:225 (1968).
Triiper, H. G. und H. W. Jannasch: Chromatium buderi nov. spec, eine neue
Art der «grofien» Thiorhodaceae. Arch. f. Mikrobiol. 61: 363-372 (1968).
Triiper, H. G. und H. D. Peck: Formation of adenyl sulfate in photosynthetic
bacteria. Arch. f. Mikrobiol. 73: 125-142 (1970).
566 ■ Literaturverzeichnis
Triiper, H. G. und N. Pfennig: Sulphur metabolism in Thiorhodaceae. III.
Storage and turnover of thiosulfate sulphur in Thiocapsa floridana and Chro-
matium species. Ant. v. Leeuwenh. 32: 261-276 (1966).
— Family of phototrophic green sulfur bacteria: Chlorobiaceae Copeland, the
correct family name; rejection of Chlorobacterium Lauterborn; and the taxo-
nomic situation oftheconsortium-forming species.Int.J.Bact.21:8—10 (1971).
Trzilova, B. und L. Miklosovicova: Bedeutung und Vorkommen von Myxo-
bakterien im Wasser. SIL-Arbeitsgemeinschaft Donauforschung 16. Arbeits-
tagung, Bratislava. 17-23. IX. 1973.
Fysiologicka a biochemicka aktivita druhu Spprocytophaga cauliformis.
Sbor. 11. vyr, sjez. Cs. spol. mikrobiol. pfi CSAV Spindl. Mlyn- Bedrichov.
14.-16. V. 1974.
Tyler, P. A.: Hyphomicrobia and the exidation of manganese in aquatic
ecosystems. Ant. v. Leeuwenh. 36: 567-578 (1970).
Tyler, P. A. und K. C. Marshall: Pleomorphy in stalked, budding bacteria. J.
Bact. 93: 1132-1136 (1967).
Microbial oxidation of manganese in hydro-electric pipelines. Ant. v.
Leeuwenh. 33: 171-183 (1967).
— Form and function in manganese-oxidizing bacteria. Arch. f. Mikrobiol.
56: 344-353 (1967).
Ueda, K. S., S. Ishikawa, T. Itami und T. Asai: Studies on the aerobic mesophi-
lic cellulose-decomposing bacteria. Part. 5. I. Taxonomic study on genus
Sporocytophaga. J. agric. chem. Soc. Jap. 25 : 543-549 (1952).
Uffen, R. L. und R. S. Wolfe: Anaerobic growth of turtle nonsulfur bacteria
under dark conditions. J. Bact. 104: 426-472 (1970).
Uhlenhuth, P. und Fromme: Untersuchungen uber die Atiologie, Immunitat
and specifische Behandlung der Weilschen Krankheit (Icterus infectiosus). Z.
Immunitatsforsch. Exp. Ther. 25: 317-483 (1916).
Uhlenhuth, P. und M. Zuelzer: Zur Epidemiologic der Weilschen Krankheit,
zugleich ein Beitrag zur Frage der Freilebenden Spirochaten. Zbl. f. Bact. 85:
141 (1921).
Unz, R. F.: Neotype strain of Zoogloea ramigera Itzigsohn. Int. J. Bact. 21: 91-
99 (1971a).
Unz, R. F. und N. C. Dondero: The predominant bacteria in natural zoogloeal
colonies I. Isolation and identification. Can. J. Microbiol. 13 : 1671-1682
(1967)-
The predominant bacteria in natural zoogloeal colonies. II. Physiology anil
nutrition. Can. J. Microbiol. 13: 1683-1691 (1967b).
Uphof, J. C. T.: Zur Okologie der Schwefelbakterien in den Schwefelquellen
Mittelfloridas. Arch. f. Hydrobiol. (Plankt.) 18: 71-84 (1927).
Uspenskaja, V. E. und E. N. Kondrat'eva: Rost fotosintezirujuscich bakterij
Ectothiorhodospira shaposhnikovii v temnote v aerobnych uslovijach. Mikro-
biologija 41: 449-455 (1972).
Uspenskaja, V. E. und R. S. Sumarukova: Feofobridy zelenych bakterij. Mi-
krobiologija 35: 200-205 (1966).
Uspenskaja, V. E., E. I. Filipovic und T. D. Olovjanisnikova: Ucastie 5-ami-
nolevulinovoj kisloty v sinteze zelenymi bakterijami porfirinov, bakterioviri-
dina i vitamina B,2. Mikrobiologija 36: 3-7 (1967).
Utermohl, H.: Nannoplankton. 1922. (Zit.: F. Koppe 1924).
— Phaeobakterien. (Bakterien mit braunen Farbstoffen). Biol. Zbl. 43 : 605-610
(1924).
Utermohl, H. und F. Koppe: 1924. (In: F. Koppe 1924).
Vancura, V.: Detection or gibberellic acid in Azotobacter cultures. Nature
(Lond.) 192: 88-89(1961).
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 567
Vasil'eva, L. V., T. N. Lafickaja und B. B. Namsaraev: Novyj rod pockujus-
cichsja bakterij Angulomicrobium tetraedrale s radial'noj simetriej kletki.
Mikrobiologija 48: 1033-1039 (1979).
Vatter, A. E. und R. S. Wolfe: Electron microscopy of Gallionellafermginea. J.
Bact. 72: 248-252 (1956).
Vaucher, I.: Histoire des Conferves d'eau douce, contenant leurs differents
modes de reproduction, et la description de leurs principales especes. 1803.
Veen van, W. L.: Bacteriology of activated sludge, in particular the filamentous
bacteria. Ant. v. Leeuwenh. 39: 189-205 (1973).
Veen van, W. L., D. van der Kooij, E. C. W. A. Genze und A. W. van der Vlies:
The classification of a multicellular bacterium isolated from activated sludge.
J. Gen. Microbiol. 69: 10-11 (1971).
Investigations on the sheathed bacterium Haliscomenobacter hydrossis
gen. n.; sp. n. isolated from activated sludge. Ant. v. Leeuwenh. 39: 207-216
Veillon, A. und G. Repaci: Des infections secondaires dans la tuberculose
ulcereuse du poumon. Ann. Inst. Pasteur (Paris) 26: 300-312 (1912).
Veldkamp, H.: Isolation and characteristic or Treponema zuelzerae nov. spec,
an anaerobic, free-living spirochete. Ant. v. Leeuwenh. 26: 103-125 (1960).
- A Study of two marine agar-decomposing, facultatively anaerobic nyxobacte-
ria. J. Gen. Microbiol. 26: 331-342 (1961).
Vetter, H.: Limnologische Untersuchungen uber das Phytoplankton und seine
Beziehungen zur Ernahrung des Zooplanktons in Schleinsee bei Langenargen
am Bodensee. Int. Rev. ges. Hyd. 34 (1937).
Vinberg, G. G. und T. N. Sivko: Nekotorie nabljudenija nad «zelenoj bakte-
riej». Mikrobiologija 21: 139-145 (1952).
Vinogradskij, S.: Uber Schwefelbakterien. Bot. Ztg. 45: 489-508; 513-523; 529-
539; 545-559; 569-576; 585-594; 606-610 (1887).
- Beitrage zur Morphologie und Physiologie der Bakterien. Heft I. Zur
Morphologic und Physiologie der Schwefelbakterien. A. Felix. Leipzig.
1888.
- Uber Eisenbakterien. Bot. Ztg. 46: 261-270 (1888).
- Recherches physiologiques sur les sulfobacteries. Ann. Inst. Pasteur 3 : 49-60
(1889).
- Eisenbakterien als Anorgoxydanten. Zbl. f. Bact. Abt. II. 57: 1-21 (1922).
- Etudes sur la microbiologic du sol - Sur la degradation de la cellulose dans le
sol. Ann. Inst. Pasteur 43: 549-633 (1929).
- Etudes sur la microbiologic du sol et des eaux. Sur la morphologie et
Poecologie des Azotobacter. Ann. Inst. Pasteur 60: 351-400 (1938).
Vinzent, R.: Isolement et culture de spirilles et de spirochetes des eaux. C. R.
Soc. biol. (Paris) 95: 1472-1474 (1926).
Virieux, J.: Recherches sur YAchromatium oxatiferum. Ann. Scienc. nat. Ser. 9.
18:265-287(1913).
Vishniac, W. V. und M. Santer: The thiobacilli. Bact. Rev. 21: 195-213 (1957).
Vislouch, S. M.: A new sulfur-microorganism from the Neva, Thioploca ingrica
Wisl. Ruskij Vrac 10: 2102-2104 (1911).
- Spirillum kolkwitzii nov. sp. i. nekotorie sernie bakterii Molisha.
Mikrobiologija 1:42-51 (1914).
Vislouch, S. M. und O. Zacharias: Zur Kenntnis von Achromatium oxaliferum.
Biol. Zbl. 23: 542 (1913).
Vladimirova, M. G.: Izucenie avtotrofnych svojstv spirill, razvivajuscichsja v
vide plastinki na srede van Nilja. Mikrobiologija 29: 28-33 (1960).
- Izucenie geterotrofnych svojstv spirill, rastuscich v vide plastinki na srede van
Nilja. Mikrobiologija 29: 24^252 (1960).
568 • Literaturverzeichnis
Vouk, V.: Ein neues Eisenbakterium aus der Gattung Gallionella in den Ther-
malquellen von Bad Gastein. Arch. f. Mikrobiol. 36: 95-97 (1960).
Vuillemin, P.: Sur la denomination de l'agent presume de la syphilis. C. R.
Acad. Sci. Paris 140: 1567-1568 (1905).
Vychodilova, M. und B. Koprivik: Frekvence vyskytu myxobakterii v pod-
povrchovych vodach behem rocnich obdobi. Sbornik c. 2., Komise mikrobio-
logie vody Ceskoslovenske spolecnosti mikrobiologicke pfi CSAV, 1978.
Waitz, S. und J. B. Lackey: Morphological and biochemical studies on the
org'anismus Sphaerotilus nutans. Quart, J. Fla. Acad. Sci. 21: 4 (1959).
Walsh, F, und R. Mitchell: Differentiation between Gallionella and Metalloge-
nium. Arch. Mikrobiol. 90: 19-25 (1973).
Walter, M. R., J. Bauld und T. D. Brock: Siliceous algal and bacterial
stromatolites in hot springs and geyser effluents of Yellowstone National Park. Science
178:402-406(1972).
Warming, E.: Om nogle ved Denmarks kyster levende bakterier. Vidensk.
Medd. Naturhist. Foren. Kjobenhavn. 1875.
Watanabe, N.: On four new halophilic species of Spirillum. Bot. Mag. (Tokyo).
72:77-86(1959).
Watson, S.: Botany of California. John Wilson and Son. Univ. Press.
Cambridge, Mass. 2. 1880.
Wattie, Elsie: Cultural characteristics of zoogloea-forming bacteria isolated
from activated sludge and trickling filters. U. S. Pub. Health Rept. 57: 1519—
1533 (1943).
Wawrik, F.: Planctomyces - Studien. Syd. Ann. Mycol. 6: 443-452 (1952).
- Siderocapsa arlbergensis nova spec, eine Eisenbakterie aus dem Hochgebirgs-
Kleingewassern des Arlberggebietes. Oster. Bot. Z. 103 : 19—23 (1956).
- Neue Planktonerganismen aus den Waldviertler Fischteichen. Oster. Bot. Z.
103: 291-299 (1956).
Webster, D. A. und D. P. Hackett: The purification and properties of
cytochrome O from Vitreosalla. J. Biol. Chem. 241: 3308-3315 (1966).
Weckesser, J., G. Dreus und H. D. Tauschel: Zur Feinstruktur und Taxonomie
von Rhodopseudomonas gelatinosa. Arch. f. Mikrobiol. 65: 346-358 (1969).
Weerkamp, A. und W. Heinen: The Effect of Nutrients and Precursors on the
Fatty Acid Composition of Two Thermophilic Bacteria. Arch. f. Mikrobiol.
81: 350-360 (1972).
Weibel, E.: Untersuchungen iiber Vibrionen. Zbl. Bakt. Parasit. Inf. Hyg. Abt.
1.2:465-472 (1887a).
- Untersuchungen iiber Vibrionen. Zbl. Bakt. Parasit. Inf. Hyg. Abt. I. 4 : 225-
232 (1887b).
Weinberg, M., R. Nativelle und A. Prevot: Les Microbes Anaerobies. 1937.
Weisrock, W. P. und R. M. Johnson: Marine species of Hyphomicrobium. Bact.
Proc. G. 36:22(1966).
Wenyon, C. M.: Protozoology. Vol. 1 - Bailliere, Tindall and Cox, London
(1926). Vol. 2 - William Wood and Co; New York (1926).
West, G. S. und B. M. Griffiths: Hillhousia mirabilis, a giant sulphur
bacterium. Proc. Roy. Soc. London, Ser. B. 81: 398-405 (1909).
The lime-sulphur bacteria of the genus Hillhousia. Ann. Bot. Lond. 27: 83-
91 (1913).
West, W. und G. S. West: Notes on fresh water algae. J. Bot. Lond. 36: 330-
338 (1898).
- - 1904. (Zit.: H. Beger, und G. Bringmann, 1953).
The plankton of Irish Lakes. Trans. Roy. Irish Acad., sect. B. 33: (1906).
Whittenbury, R.: 1970. (In: R. Whittenbury, K. C. Phillips und J. F.
Wilkinson. 1970).
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 569
Whittenbury, R. und A. G. McLee: Rhodopseudomonas palustris and Rh.
viridis - photosynthetic budding bacteria. Arch. f. Mikrobiol. 59: 324-334
(1967).
Whittenbury, R. A. und J. M. Nicoll: A New, Mushroom Shaped Budding
Bacterium. J. Microbiol 66: 123-126 (1971).
Whittenbury, R., K. C. Philipps und J. F. Wilkinson: Enrichment isolation
and some properties of methane - utilizing bacteria. J. Gen. Microbiol. 61:
205-218 (1970).
Widdel, E. und N. Pfennig: A New Anaerobic Sporing Acetate Oxidizing,
Sulfate-Reducing Bacterium Desulfotomaculum (emend.) acetoxidans. Arch.
f. Mikrobiol. 112: 119-122 (1977).
Wille: 1913. (Zit.: H. Beger, und G. Bringmann, 1953).
- 1918. (Zit.: H. Beger und G. Bringmann, 1953).
Williams, M. A.: Chromatn patterns in Spirillum anulus. J. Gen. Microbiol. 21:
109-123 (1958).
- Some problems in the identification and classification of species of Spirillum.
I. Earlier taxonomy of the genus Spirillum. Int. Bull. Bact. Nom. Tax. 9: 35-
55.
- Some problems in the identification and classification of species of Spirillum.
II. Later taxonomy of the genus Spirillum. Int. Bull. Bact. Nom. Tax. 9: 137-
157(1959).
- Cell elongation and diversion on Spirillum anulus. J. Bact. 78: 374-377
(1959).
Williams, M. A. und S. C. Rittenberg: Microcyst formation and germination in
Spirillum lunatum. J. Gen. Microbiol. 15: 205-209 (1956).
A taxonomie study of the genus Spirillum Ehrenberg. Int. Bull. Bact. Nom.
Tax. 7:49-110(1957).
Winslow, C. E. A., J. Broadhurst, E. R. Buchanan, C. Krumwiede, L. A.
Rogers, Jr. und G. H. Smith.: The families and genera of the bacteria.
Preliminary report of the Committee of the Society of American
Bacteriologists on characterization and classification of bacterial types. J. Bact. 2 : 505-
566 (1917).
Winter, G.: Die Pilze Deutschlands, Oesterreichs und der Schweiz. I. Abt.
Schizomyceten, Saccharomyceten und Basidiomyceten. Rabenhorst's Kryp-
togamen-Flora 1: 1-924 (1884).
Wolbach, S. B. und C. A. L. Binger: The cultivation of a free living filterable
Spirochaeta elusa sp. n. A preliminary report. J. Med. Res. 30: 9-22 (1914a).
Notes en a filterable spirochaete from fresh water, Spirochaeta biflexa n. sp.
J. Med. Res. 30: 23-26 (1914b).
Wolfe, R. S.: Observations and studies of Crenothrix polyspora. J. Water Works
Ass. 52: 915-918 (I960).
Wright, J. H.: Report on the water supply of Philadelphia. Mem. nat. Acad. Sci.
7: 422-474 (1895).
Wuhrmann, K.: Beitrag zur Kenntnis der Physiologie von Schutzwasserorga-
nismen. Verhandl. Schweiz. naturforsch. Ges. 126: 142-143 (1946).
Wuhrmann, K. und S. Koestler: Uber den Vitaminbedarf des Abwasserbakte-
riums Sphaerotilus natans Kiitz. Verhandl. Schweiz. naturforsch. Ges. 130:
177-178 (1950).
Wurtz, A.: Champignons, bacteries et algues des eaux polluees. Extraits du
Bulletin francais de pisciculture. Conseil Superieur de la peche. Paris. 29:
5-25; 89-119(1957).
Yamagata, U. und A. Itano: Physiological study of Azotobacter chroococcum,
beijerinckii and vinelandii types. J. Bact. 8: 521-531 (1923).
Yasuzumi, G., T. Yamanaka, S. Morita, Y. Yamamoto und J. Yokoyama:
570 ■ Literaturverzeichnis
Metabolic chromosomes isolated from blood cell nuclei of various animals.
Experientia 8: 218-220 (1952).
Yoshida, M., T. Oshima und K. Imahori: The thermostable allosteric enzyme:
phosphofructokinase from an extreme thermophile. Biochem. Biophys. Res.
Comm. 43: 36-39(1971).
Zacharias, O.: Uber das Wegsterben der Zander im Grofien Eutiner See.
Deutsch. Fischerei-Ztg. 21: 538-539 (1898).
- Zur Kenntnis der niederen Flora und Fauna holsteinischer Meersumpfe.
Forschungsber. aus Biol. Stat. z. Plon 10: 223-289 (1903).
Zacharov, N. G. und E. F. Konstantinova: OcistitePnye prudy na Ljublinskich
poljach fil'tracii v 1919-1920 g. Trudy, sov. po ocistke stoc. vod. Vyp. 11.
Moskva. 1929.
Zachvataeva, N. V., I. V. Malofeeva und E. N. Kondrat'eva: Izucenie sposob-
nosti k azotfiksacii fotosintezirujuscich bakterij. Mikrobiologija 34: 761-766
(1970).
Zajceva, G. N., A. N. Belozerskij und T. M. Afanas'eva: Chimija azotobakte-
ra. VII. Izucenie polisacharidov trech vidov azotobaktera v zavisimosti ot
sostava sredy i istocnika azotistogo pitanija. Microbiologija 28 : 58-63 (1959).
Zavarzin, G. A.: Cikl razvitija i jadernyj apparat Hyphomicrobium vulgare
Stutz. et Hartleb. Mikrobiologija 29: 38-42 (1960).
Zavarzin, G. A.: Simbioticeskaja kultura novogo okisljajuscego marganec mi-
kroorganizma. Mikrobiologija 30: 393-395 (1961a).
- Pockujusciesja bakterii. Mikrobiologija 30: 952-975 (1961b).
- Stroenie Metallogenium. Mikrobiologija 32: 1020-1028. (1963).
- Metallogenium symbioticum. Z. Allg. Mikrobiol. 4: 390-395. (1964).
- Chemoavtotrofnye mikroorganizmy. Autoref. dis. inst. mikrobiol. Ak.
Nauk SSSR. 1965.
- Litotrofnye mikroorganizmy. Nauka, Moskva 1972.
Zavarzin, G. A. und V. V. Epichina: Simbioticeskij rost Metallogenium. DAN
SSSR 148:933-934 (1963).
Zavarzin, G. A. und T. N. Zilina: Miksobakterii v kulturach vodorodnych
bakterij. Mikrobiologija 40: 407-412 (1971).
Zavarzina, N. B.: Liticeskij agent v kulturach Chlorella pyrenoidosa Pringsh.
DAN SSSR 137: 435-437. (1961).
- Vlijanie antibiotikov na lizis kultur Chlorella pyrenoidosa Pringsh.
Mikrobiologija 31: 1002-1006(1962).
- Lizis kultur chlorellyvotsutstvie bakterij. Mikrobiologija 33 : 561-564 (1964).
Zettnow, E.: Kleine Beitrage zur Morphologie der Bakterien. Z. Hyg. Infekt.
85: 17-37(1918).
Zikes, H.: Vergleichende Untersuchungen uber Sphaerotilus natans (Kutzing)
und Cladothrix dichotoma (Cohn) auf Grund von Reinkukuren. Zbl. f. Bact.
Abt. II. 43: 529-552(1915).
Zobell, C. E.: The effect of solid surface upon bacterial activity. J. Bact. 46: 39-
56 (1943).
- Marine microbiology. (In: Chronica Botanica, Waltham, Mass. 1946).
Zobell, C. E. und Allen: Proc. Soc. exp. Biol, and Med 30: 1409 (1933). (Zit.:
Bergey's Manual 1957).
Zobell, C. E und H. C. Upham.: A list of marine bacteria including description
of sixty new species. Bull. Scripps Inst. Oceanogr. 5: 239-292 (1944).
Zopf, W.: Entwicklungsgeschichtliche Untersuchungen iiber Crenothrix poly-
spora, die Ursache der Berliner Wassercalamitat. J. Springer. Berlin. 1879.
- Zur Morphologie der Spaltpflanzen (Spaltpilze) und Spaltalgen. Leipzig 1882.
- Die Spaltpilze. Eduard Trewendt, Breslau. 1. Ausg. 1883; 2. Ausg. 1884;
3. Ausg. 1885.
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Literaturverzeichnis • 571
- Uber die Ursache der Rothfarbung eines neuen Wasserspaltpilzes aus der
Familie der Cladothricheen (Sphaerotilus roseus). Beitr. Physiol. Morphol. 1:
1-35 (1892).
Zuelzer, Margarete: Uber Spirochaeta plicatilis Ehrenberg und deren Verwandt-
schaftsbeziehungen. Archiv f. Protistenk. 24: 1-59 (1912).
- Biologische una systematische Spirochatenuntersuchungen. Zbl. f. Bakt.,
Abt. I., Orig. 85: 154-167 (1921).
- 1925. (In: Prowazek: Die Spirochaten. Handbuch der Pathogenen Protozoen.
Barth. Leipzig. 1925).
- Uber die Kultivierung mariner Spirochaeten mit einigen Bemerkungen zur
Ziichtung der Spirochaeta obermeieri. Zbl. f. Bact. Abt. I., Orig. 96 : 424-427
(1925).
- Zur Hydrobiologie der Spirochaeta icterogenes syn. biflexa in den Tropen.
Zbl. f. Bact. Abt. I., Orig. 105: 384-393 (1928).
Zuelzer, M. und Oba: Beitrag zur Kenntnis saprophytischer Spirochaten. Zbl.
f. Bact. Abt. I. 91: 95 (1923).
Zurukzoglu, S.: Die saprophytischen Spirochaten. (In: Kolle, Kraus und Uh-
lenhutn: Handbuch der pathogenen Mikroorganismen. Fischer. Jena. 1930).
Zvirbulis, E., und H. D. Hatt.: Status of the generic name Zoogloea and its
species. Int. J. Bact. 17: 11-21 (1967).
Zarova, T. V.: Vlijanie koncentracii ingredientov sredy na obrazovanie nitej u
Bacillus mycoides Fliigge. Mikrobiologija 35: 121-128 (1967).
Zdanov, A. V. und G. A. Dubinina: Arthrobacter siderocapsulatus, vydelennyj
iz ozernoj vody. Mikrobiologija 44: 714-719. (1975).
International code of nomenclature of bacteria. Int. Jour. System. Bacteriol. 16 :
459-490 (1966).
Namenverzeichnis
(Diekursiv gedruckten Namen sind Synonyma, fett wiedergegebene Seitenzahlen deuten
an, daiS dort die betreffenden Taxa ausfiihrlich behandelt sind).
Acetomonas Leifson 1954 430
ACHROMATIACEAE Massart 1901 216
Achromatium Schewiakoff 1893 217, 221
gigas Nadson 1913 217
mobile Lauterborn 1915 447
muelleri (Warming 1875) Migula 1900
451, 452
oxaliferura Schewiakoff 1893 216, 217,
223, 449
volutans (Hinze 1903) van Niel 1948 219
Achroonema Skuja 1948 202, 230
angustum (Koppe 1924) Skuja 1956 237
articulatum Skuja 1956 234
gotlandicum Skuja 1956 234
inaequale Skuja 1956 233
lentum Skuja 1956 233
macromeres Skuja 1956 234
profundum (Kirchner 1896) Skuia 1956
237
proteiforme Skuja 1956 237
simplex Skuja 1956 234
splendens Skuja 1948 236
spiroideum Skuja 1948 157, 231
splendens forma tenuior Skuja 1956 236,
237
sporogenum Skuja 1958 233
Actinothrix Novacek 1938 336
globulifera Novacek 1938 338, 339
Agrobacterium Conn 1942 440
radiobacter (Beijerinck et van Delden
1902') Conn 1942 440
Atysiella Langeron 1923 211, 213
filiformis (Schmid 1922) Langeron 1923
213
Amoebobacter Vinogradskij 1888, emend.
Pfennig et Triiper 1971 40, 67, 92
bacillosus Vinogradskij 1888 68, 77, 81
granula Vinogradskij 1888 61, 72
pendens (Molisch 1906) Pfennig et
Triiper 1971 69, 70, 72
roseus Vinogradskij 1888 63, 69, 72
Anaerobospiriflum Davis et al. 1976 411
succiniciproducens Davis et al. 1976 411
Ancalochloris Gorlenko et Lebedeva 1971
110
perfilievii Gorlenko et Lebedeva 1971
111
Ancalomicrobium Staley 1968 308, 321
adetum Staley 1968 308
Angulomicrobium Vasil'eva et al. 1979 353
tetraedrale Vasil'eva et al. 1979 353
Aphanothece clathratiformis Szafer 1911
102
luteola Schmidle 1901 103
parallela Szafer 1911 105
sulphurica Szafer 1911 106
Aquaspirillum Hylemon et al. 1973 386,
396, 453
aquaticum Hylemon et al. 1973 401
anulus (Williams et Rittenberg 1957)
Hylemon et al. 1973 403
autotrophicum Aragno et Schlegel 1978
407
bengal Kumar et al. 1974 399
delicatum (Leifson 1962) Hylemon et al.
1973 404
dispar Hylemon et al. 1973 401
fasciculum Strength et al. 1976 407
giesbergeri (Williams et Rittenberg 1957)
Hylemon et al. 1973 400, 403, 404, 406
gracile (Canale-Parola et al. 1966)
Hylemon et al. 1973 396, 399
itersonii (Giesberger 1936) Hylemon et
al. 1973 399
itersonii subsp. nipponicum (Terasaki
1973) Terasaki 1979 399, 400
metamorphum (Terasaki 1961) Hylemon
et al. 1973 406
peregrinum (Pretorius 1963) Hylemon et
al. 1973 401
peregrinum subsp. integrum (Terasaki
1973) Terasaki 1979 401
polymorphum (Williams et Rittenberg
1957) Hylemon et al. 1973 404
psychrophilicum (Terasaki 1973)
Terasaki 1979 406
putridiconchylium (Terasaki 1961)
Hylemon et al. 1973 399, 403
serpens (Muller 1786) Hylemon et al.
1973 395, 398, 403, 410
sinuosum (Williams et Rittenberg 1957)
Hylemon et al. 1973 400, 403, 406
ARCHANGIACEAE Jahn 1924 134
Archangium Jahn 1924 134
gephyrajahn 1924 134
violaceum (Kuhlwein et Gallwitz 1958)
Kiihlwein et Reichenbach 1964 132
Arthrobacter globiformis (Conn 1928)
Conn et Dimnick_1947 465
siderocapsulatus Zdanov et Dubinina
1975 465
Asticcacaulis Poindexter 1964 7, 8, 314,
321, 315
biprosthecum Pate et al. 1973 322
excentricus Poindexter 1964 322
Azomonas Vinogradskij 1938 431, 436
Scanned & Djvued by Pahuta Yuri, Kaiadag 2008, e-mail pahutaqwelgrambler.
Namenverzeichnis • 573
agilis (Beijerinck 1901), Vinogradskij
1938 435, 436, 437
insignis (Derx 1951) Baillie et al. 1962 438
macrocytogenes (Jensen 1955) Baillie et
al. 1962 438
Azospirillum Krieg 1977 412
brasiliense Krieg 1977 413
lipoferum (Beijerinck 1925) Krieg 1977
388, 413
Azotobacter Beijerinck 1901 387, 431, 436
acida Roy 1958 439
agile var. atypica Kluyver et van den Bout
1936 437, 438
agile var. jakutiae Krasil'nikov 1949 437,
438
agilis Beijerinck 1901 435, 437
araxii Panosjan 1950 432, 434
beijerinckii Lipman 1904 433, 434
beijerinckii acido-tolerans Tchan 1953
434
beijerinckii achromogenes Jensen et
Petersen 1954 434
fluorescens Krasil'nikov 1949 435, 436
falophilum Suskina 1945 432, 433
ilgardii Lipman 1909 433, 435
chroococcum Beijerinck 1901 432, 434,
435
indicum Starkey et De 1939 438, 439
insigne Derx 1951 438
lacticogenes Kaufmann et Toussaint 1951
439
macrocytogenes Jensen 1955 438
miscellum Psenin 1964 436
nigricans Krasil'nikov 1949 432, 434
paspali Dobereiner 1966 436
smyrnii Lipman et Burgess 1915 433,435
spirillum Beijerinck 1925 413
unicapsulare Bacinskaja et Kondrat'eva
1941 432, 433
vinelandii Lipman 1904 32, 412,435,437
vitreum Lohnis et Westermann 1909 435
woodstownii Lipman 1904 432, 433
AZOTOBACTERACEAE Pribram 1933
424, 430
Azotococcus Tchan 1953 436
agile var. atypica (Kluyver et van den
Bout 1936) Tchan 1953 437, 438
agilis (Beijerinck 1901) Tchan 1953 437
insigne (Derx 1951) Tchan 1953 438
Azotomonas Orla-Jensen 1909 431
Bacillospira proeclarum (Collin 1913) Hol-
lande 1933 414
Bacillus azotobacter Lohnis et Hanzawa
1914 432
calceus (Brussoff 1918) de Rossi 1927 484
chroococcus (Beijerinck 1901) Buchanan
1925 432
columnaris Davis 1922 148
flagellars Omeljanskij 1914 316, 317
macroides Bennet et Canale-Parola 1965
205, 206, 498
minor (Vinogradskij 1888) Trevisan 1889
49
minutissimus (Vinogradskij 1888)
Trevisan 1889 52
okenii (Ehrenberg 183 8) Trevisan 18 89 43
pedunculatus Scarr 1949 324
termo (Muller 1786) Trevisan 1889 429
w'nos«s(Ehrenbergl838)Trevisanl88951
virens van Tieghem 1880 120
virescens Dangeard 1909 120, 127
weissii (Petty 1852) Trevisan 1889 48
Bacterium bovista Molisch 1912 224, 443
Bacterium chlorinum Engelmann 1882 99,
120, 127
chlorophyllophorum Vinberg et Sivko
1952 118
cristalliferum Gicklhorn 1920 446
cyrusii Cyrus et Sladecek 1973 505
duplex (Brussoff 1916) de Rossi 1927 483
flagellatum (Omeljanskij 1914) Hou-
wink et van Iterson 1950 316
minus (Vinogradskij 1888) Trevisan 1889
49
minutissimum (Vinogradskij 1888)
Trevisan 1889 52
okenii (Ehrenberg 1838) Trevisan 1879 43
pediculatum Koch et Hosaeus 1894 324
precipitatum Kalinenko 1946 506
ramigerum (Itzigsohn 1867) Krasil'nikov
1949 427
retiformans Gicklhorn 1920 446
rubescens Lankester 1873 92
sulfuratum Warming 1875 43, 45, 73
termo (Muller 1786) Ehrenberg 1832 429
vinosum (Ehrenberg 1838) Trevisan 1889
51
viride van Tieghem 1880 120
weisii (Perty 1852) Trevisan 1889 48
zoogloeae ramigerae Bloch 1918 427
Bactoscilla Pringsheim 1949 210
flexibilis Pringsheim 1949 211
mobilis Pringsheim 1951 211
pseudo-termo Fischer 1895 429
Bdellovibrio Stolp et Starr 1963 409
bacteriovorus Stolp et Starr 1963 410
cblorellavorus Gromov et Mamkaeva
1972 411
stolpii Seidler et al. 1972 410
starrii Seidler et al. 1972 410
Beggiatoa Trevisan 1842 157, 171,180,192,
201, 209, 215, 223, 224, 241, 248, 367,
496
alba (Vaucher 1803) Trevisan 1845 150,
173, 182, 202, 205, 223, 224, 380
alba var. marina Cohn 1865 173
alba var. spiralis Hansgirg 1892 173
alba var. uniserialis Engler 1883 193
arachnoidea (Agardh 1827) Rabenhorst
1865 175, 177, 178, 182, 183,380
arachnoidea var. marina Hansgirg 1890
175
o/t ■ iNamenverzeichnis
arachnoidea var. uncinata Hansgirg 1888
175
arctoalpina Skuja 1964 177
foetida Fiorini-Mazzanti 1874 284
gigantea Klas 1937 178, 179
leptomitiformis (Meneghini 1842)
Trevisan 1842 150, 175, 178, 182, 183
major Vinogradskij 1888 175, 176
manna Molisch 1912 173, 174
maxima Uphof 1927 178
media Vinogradskij 1888 178
minima Vinogradskij 1888 175, 182
minima Warming 1875 382
minor Uphof 1927 175
mirabilis Cohn 1875, emend. Klas 1937
178, 180, 197, 202
mucor (Oersted 1844) Trevisan 1879 188
multiseptata Engler 1882 284
nivea Rabenhorst 1865 193
oerstedii Rabenhorst 1865 188
ochracea (Roth 1797) Breed 1948 259
pellucida Cohn 1865 175
punctata Trevisan 1842 173
raineriana Meneghini 1846 173
roseopersicinaZopf 1883 3, 38,60, 79, 91
uniguttata Koppe 1924 175
versatilis (Kiitzing 1843) Trevisan 1845
175
BEGGIATOACEAE Migula 1894 171
Beijerinckia Derx 1950 438
acida (Roy 1958) Petersen 1959 439
congensis Hilger 1965 439
derxiiTchan 1957 439
fluminensis Dobereiner et Ruschel 1958
439
indica (Starkey et De 1939) Derx 1950
438, 439
macrocytogenes (Jensen 1955) Rubencik
1959 438
mobilis Derx 1950 439
venezuelae Materassi et al. 1966 439
Blastobacter Zavarzin 1961 342, 346, 349
capsulatus Miiller 1977 352
denitrificans Miiller 1977 352
henricii Zavarzin 1961 341, 346, 350
viscosus Loginova et Trocenko 1979 352
Blastocaulis Henrici et Johnson 1935 301,
323, 336, 352
kljasmiensis (Razumov 1949) Zavarzin
1961 342
sphaerica Henrici et Johnson 1935 338,
339
Blastococcus Ahrens et Moll 1970 283, 488
aggregatus Ahrens et Moll 1970 489
Borrelia Schwellengrebel 1970 376
anserina (Sakharoff 1891) Bergey et al.
1925 373, 378
recurrentis (Lebert 1874) Bergey et al.
1925 373
Brachyarcus Skuja 1964 415
thiophilus Skuja 1964 416
Cacospira Enderlein 1917 376
Campylobacter Sebald et Veron 1963 408
fetus (Smith et Taylor 1919) Sebald et
Veron 1963 409
Capnocytophaga Leadbetter et al. 1979 169
gingivalis Leadbetter et al. 1979 169
ochracea Leadbetter et al. 1979 169
sputigena Leadbetter et al. 1979 169
Caryophanon Peskov 1939 186, 211, 212,
213,216
crassa (Schmid 1922) Peskov 1948 212
filiformis (Schmid 1922) Peskov 1948 213
latum Peskov 1939 215
muelleri (Schmid 1922) Peskov 1948 212
sublatum Peskov et al. 1967 215
tenue Peskov 1939 215
Caulobacter Henrici et Johnson 1935 1, 7,
8, 166, 312, 321, 322
bactericides Poindexter 1964 319
bacterioides «typ III» Poindexter 1964
319, 320
bacterioides «typ IV» Poindexter 1964
319, 320
bacterioides «typ V» Poindexter 1964
319, 321
crescentus Poindexter 1964 318
fusiformis Poindexter 1964 319
fusiformis «typ II» Poindexter 1964 319
halobacterioides Poindexter 1964 319
henrici Poindexter 1964 317
henrici var. aurantiacus Poindexter 1964
317, 318
intermedius Poindexter 1964 318
leidyi Poindexter 1964 318
maris Poindexter 1964 319
subvibrioides Poindexter 1964 317, 318,
319
subvibrioides var. albus Poindexter 1964
318
subvibrioides «typ I» Poindexter 1964
318
variabilis Poindexter 1964 319, 321
vibrioides Henrici et Johnson 1935 315,
316, 317, 318
vibrioides var. limonus Poindexter 1964
316, 317
Caulococcus Perfiliev 1959 359
manganifer Perfiliev 1964 359
Chamaesiphon hyalinus Scherffel 1907 362
Chamaesiphonosira Geitler 1975 361
cymbellicola Geitler 1975 362
hvalina (Scherffel 1907) Geitler 1975 362
Chlamydothrix Migula 1900 256, 287, 332
discophora (Schwers 1912) Naumann
1929 262
epiphytica (Migula 1895) Migula 1900
275
epiphytica (Hieronymus 1898) Naumann
1928 275
ferruginea (Ehrenberg 1838) Migula 1900
331
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Namenverzeichnis • 575
fluitans (Migula 1895) Migula 1900 251,
255
hyalina (Migula 1895) Migula 1900 289
longissima Molisch 1912 188, 190
ochracea (Roth 1797) Migula 1900 259
sideropous Molisch 1910 272
thermalis Molisch 1925 266
trichogenes (Cholodnyj 1924) Naumann
1925 289
Chlorobacterium Guillebeau 1890 425
Chlorobacterium symbioticum Lauterborn
1916 101, 125, 127
CHLOROBIACEAE Copeland 1956 93
CHLOROBIALES Gibbons et Murray
1978 15
CHLOROBINEAE Pfennig et Triiper
1971 92
Chlorobium Nadson 1906 16, 93, 94, 95,
99,101, 108, 111, 116, 118, 125, 127,128
ethylicum Saposnikov et al. 1959 119
chlorochromatii Mechsner 1957 99, 127
limicola Nadson 1906 96, 98, 99, 100,
105, 113, 115, 119, 120
limicola forma thiosulfatophilum (Larsen
1952) Pfennig et Triiper 1971 98
phaeobacteroides Pfennig 1967 99, 110,
130
phaeovibrioides Pfennig 1967 101
thiosulfatophilum Larsen 1952 97, 98, 99
vibrioforme Pel's 1936 96, 97, 98, 99
vibrioforme forma thiosulfatophilum
(Larsen 1952) Pfennig et Triiper 1971 98
CHLOROFLEXACEAE Triiper 1976 120
Chloroflexis Pierson et Castenholz 1971 121
Chloroflexus Pierson et Castenholz 1974
121
aurantiacus Pierson et Castenholz 1974
122
aurantiacus var. mesophilus Pivovarova
et Gorlenko 1977 122
Chlorochromatium aggregatum
Lauterborn 1906 99, 101, 120, 127, 129
aggregatum forma minor Geitler 1925
127
aggregatum forma typica Geitler 1925
127
glebulum Skuja 1956 128
Chloronema Dubinina et Gorlenko 1975
123
giganteum Dubinina et Gorlenko 1975
123
spiroideum Dubinina et Gorlenko 1975
124
Chloronium mirabile Buder 1914 127
Chloronostoc Pascher 1925 95, 113
abbreviatum Pascher 1925 97, 113
Chloroplana vacuolata Dubinina et Kuzne-
cov 1976 130
Chloropseudomonas Czurda et Maresch
1937 93,118
ethylica Saposnikov et al. 1960 119, 120
Chondrococcus columnaris (Davis 1922)
Ordal et Rucker 1944 148
Chondromyces Berkeley et Curtis 1874
138
crocatus Berkeley et Curtis 1874 138
CHROMATIACEAE Bavendamm 1924,
emend. Pfennig et Triiper 1971 38
Chromatiopsis Skuja 1948 46, 88
cinerea Skuja 1948 89
elektron Skuja 1948 88
maior Skuja 1956 88
Chromatium Perty 1852 33, 36, 40, 56, 58,
59, 64,66, 81, 88, 89,90
buderi Triiper et Jannasch 1968 47
cuculhferum Gicklhorn 1920 47, 48
densegranulatum Skuja 1948 43, 46, 88
fallax (Warming 1875) Kolwitz 1909 55,
450, 451, 452
gliscens (Ehrenberg 1838) Kolkwitz 1909
55
gobii Isacenko 1914 53
gracile Strzeszewski 1913 43, 51
linsbaueri Gicklhorn 1921 53, 54, 88
lipoferum (Beijerinck 1925) Bergey et al.
1930 413
minus Vinogradskij 1888 45, 49
minutissimum Vinogradskij 1888 45, 52
molischii (Bersa 1926) van Niel 1948 54
obovatum Skuja 1948 48, 49
okenii (Ehrenberg 1838) Perty 1852 3,43,
45, 46, 47, 49, 50, 51, 53, 54, 55, 65, 73,
91
okenii forma gracile Ellis 1932 51
okenii forma minus Ellis 1932 49
okenii forma minutissimum Ellis 1932 52
okenii forma weissei Ellis 1932 48
sphaeroides Hama 1933 58, 59
sulfuratum (Warming 1875) Isacenko
1927 43, 45
vanda Osnickaja et Cudina 1978 55
vinosum (Ehrenberg 1838) Vinogradskij
1888 50, 51, 53, 78
violaceum Bergey et al. 1923 50
violascens Perty 1852 50
warmingii (Cohn 1875) Migula 1900 47
warmingii forma minus Bavendamm
1924 47, 48
weissei (Perty 1852) van Niel 1948 45,48,
49, 50, 455
weissii Perty 1852 48
Chroobacter vantieghemi Pringsheim 1953
117
Cladothrix Cohn 1875 247, 253
dichotoma Cohn 1875 251, 253, 254, 274,
280
dichotoma forma major Biswas 1937 251,
254
dichotoma var. leptochaeteformis
Hansgirg 1888 251, 254
fluitans (Migula 1895) Razumov 1961
251, 255
576 ■ Namenverzeichnis
gracillima (West et West 1898) West et
West 1904 280
nutans (Kutzing 1833) Migula 1895 251
ochracea (Roth 1797) Chester 1901 259
reticularis Naumann 1921 262, 263
rosea (Zopf 1892) Razumov 1961 251,255
Clathrococcus roseopersicinus (Kutzing
1849) Schmidt et Weis 1902 79
Clathrocystis roseopersicina (Kutzing 1849)
Cohn 1875 73, 79
Clathrochloris Geitler 1925 93, 105
hypolimnica Skuja 1948 106, 107, 108
marina Fjerdingstad 1967 108
sulphurica (Szafer 1911) Geitler 1925
102, 106, 107, 108
Clonothrix Roze 1896 246, 277
ferruginea Molisch 1910 278, 280
fuscaRoze 1896 278,283
fusca Schorler 1904 253, 263, 278, 282
gracillima West et West 1898 280
putealis (Kirchner 1878) Beger 1953 278,
280
tenuis Kolkwitz 1909 278, 280
Coccoglia Billroth 1874 427
Cohnia roseopersicina (Kutzing 1849)
Winter 1884 79
Cohnidonum dichotomum Mez 1898 251,
254
Conferva ochracea Roth 1797 259
Conidiothrix ochracea (Roth 1797)Benecke
1912 259
sulphurea Peterson 1921 195
Crenothrix Cohn 1872 246, 250, 281
dichotoma Orla-Jensen 1909 278, 280,
282
foetida (Fiorini-Mazzanti 1874) Hans-
eirg 1891 284
fusca (Schorler 1904) Dorff 1934 278
kuhniana (Rabenhorst 1853) Zopf 1879
282, 284
manganifera Jackson 1902 282, 284
marina Hansgirg 1890 284
multiseptata (Engler 1882)Hansgirg 1891
284
ochracea (Roth 1797) Jackson 1902 259
polyspora Cohn 1872 254, 280, 282, 476
tenuis (Kolkwitz 1909) Dorf 1934 280
Cristispira Gross 1910 6, 363, 374
acuminata (Schellack 1909) Gonder 112
375
anodontae (Keysselitz 1906) Gross 1910
375
balbianii (Certes 1882) Gross 1910 375
cardii-papillosi (Schellack 1909) Ford
1927 375
chamae (Schellack 1909) Noguchi 1918
375
gastrochaenae (Schellack 1909) Ford 1927
375
hartmanni (Gonder 1908) Gross 1910
375, 376
helgolandica Collier 1921 375
interrogationis Gross 1910 375
limae (Schellack 1909) Gross 1910 375
mactrae (von Prowazek 1910) Ford 1927
375
mina Dimitroff 1926 375
modiolae (Schellack 1909) Gross 1910
375
ostreae (Schellack 1909) Noguchi 1918
375
pachelabrae de Mello 1921 376
parvula Dobell 1912 375
pectinis Gross 1910 375
pinnae (Gonder 1908) Gross 1910 375
polydorae Mesnil et Caullery 1916 375
pusilla (Schellack 1909) Gross 1910 376
saxicavae (Schellack 1909) Ford 1927 375
solenis (Fantham 1911) Kuhn 1974 375
spiculifera (Schellack 1909) Gross 1910
376
tapetos (Schellack 1909) Gross 1910 375
tenua Dimitroff 1926 375
veneris Dobell 1911 375
Cryptococcus roseus (Kutzing 1833)
Kutzing 1845 79
CYANOBACTERIALES Stanier 1978 15
Cyclobacter Perfiliev 1960 510, 511, 516
constrictor Perfiliev et Gabe 1961 512
CYCLOBACTERIALES Perfiliev 1960
510
Cylindrogloea bacterifera Perfiliev 1914
117, 125, 128
solitaria Skuja 1964 117
Cystobacter Schroeter 1886 134
fuscus Schroeter 1886 134
CYSTOBACTERACEAE Mc Curdy 1970
134
Cytophaga Vinogradskij 1929, emend.
Lewin 1969 33, 131,139,140, 141, 150, 164,
202, 211
albogilva Fuller et Norman 1943 145
anularis Stapp et Bortels 1934 141, 143
aquatilis Strohl et Tait 1978 145
aurantiaca Vinogradskij 1929 144, 152
columnaris (Davis 1922) Garnjobst 1945
148
crocea Stapp et Bortels 1934 141, 143
deprimata Fuller et Norman 1943 145
diffluens Stanier 1940 145
ellipsospora Imseneckij et Solnceva 1936
168
fermentans Bachmann 1955 145
flavicula Stapp et Bortels 1934 141, 143
globulosa Stapp et Bortels 1934 164
haloflava Kadota 1953 145
hutchinsonii Vinogradskij 1929 141, 144
hutchinsonii Imseneckij et Solnceva 1936
164
johnsonae Stanier 1947 141, 143, 152
johnsonae var. denitrificans Stanier 1947
143, 144
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Namenverzeichnis • 577
krzemieniewskae Stanier 1940 145
latercula Lewin 1969 145
lutea Vinogradskij 1929 141, 143
lytica Lewin 1969 145
myxococcoides Krzemieniewska 1933 164
psychrophila Borg 1960 152
rosea Kadota 1954 145
rubra Vinogradskij 1929 144
salmonicolor Veldkamp 1961 145
sensitiva Humm 1946 145
silvestris Stapp et Bortels 1934 141, 143
succinicans Anderson et Ordal 1961 148
tenuissima Vinogradskij 1929 145
CYTOPHAGACEAE Stanier 1940,
emend. Leadbetter 1974 139
CYTOPHAGALES Leadbetter 1974 138
Derxia Jensen et al. 1960 439
gummosa Jensen et al. 1960 440
indica Roy et Sen 1962 440
Desmanthos Skuja 1958 244
thiocrenophilum Skuja 1958 244
Desmobacter Perfiliev 1960 510, 515
Desulforomonas acetoxidans Pfennig et
Triiper 1969 120
Desulfovibrio gigas Le Gall 1963 412
Detoniella Trevisan 1889 256
ochracea (Roth 1797) Trevisan 1889 259
Dicrospirillum rubrum (von Esmarch 1887)
Enderlein 1925 20
rugula (Miiller 1786) Enderlein 1925 392
volutans (Ehrenberg 1832) Enderlein
1917 387
Dictyobacter Perfiliev 1954 510, 513
rapax Perfiliev 1954 513
Didymohelix Griffith 1853 325
ferruginea (Ehrenberg 1838) Griffith
1853 328, 331
Ectothiorhodospira Pel's 1936 38, 82
halochloris Imhoff et Triiper 1977 85
halophila Raymond et Sistrom 1969 84
mobilis Pel's 1936, emend. Triiper 1968
34, 67, 82, 83
shaposhnikovii Cerny et al. 1969 82, 84
Ehrenhergia Gieszczykiewicz 1939 364
plicatilis (Ehrenberg 1833)
Gieszczykiewicz 1939 366
Endosoma palleum Utermohl 1924 130
Entomospira Enderlein 1917 376
Epicystopsis Skuja 1956 489
synplanctica Skuja 1956 489
Erythroconis littoralis Oersted 1840 73
Ferribacterium Brussoff 1916 483
calceum Brussoff 1918 484
dubium (Skuja 1956) Hausler 1972 485
duplex Brussoff 1916 482, 483
gracilis Svorcova 1975 485
rectangulare (Naumann 1921) Beger 1957
484
Flavobacterium thermophilum Yoshida et
Oshima 1971 504
Flectobacillus Larkin et al. 1977 419, 422
major (Gromov 1963) Larkin et al. 1977
420
marinus (Raj 1976) Borral et Larkin 1978
421
Flexibacter Soriano 1945, emend. Lewin
1969 131, 146, 202
aggregans (Lewin 1969) Leadbetter 1974
150, 156
albuminosus Soriano 1945 153
aurantiacus (Borg 1960) Lewin 1969 144,
152, 170
aureus Soriano 1945 153
columnaris (Davis 1922) Leadbetter 1974
148
elegans Soriano 1945 152
flexilis Soriano 1945 147
flexilis var. algovorum Gromov et al.
1972 147
giganteus Soriano 1945 151, 155
litoralis (Fox et Lewin 1963) Lewin 1969
153
marinum (Pringsheim 1949) Fox et
Lewin 1963 153
polymorphus Lewin 1974 150
roseolus Lewin 1969 152
ruber (Fox et Lewin 1963) Lewin 1969
152
rubrum Fox et Lewin 1963 152
sancti Lewin 1969 152
succinicans (Anderson et Ordal 1961)
Leadbetter 1974 148
tractuosus (Lewin 1969) Leadbetter 1974
148
Flexithrix Lewin 1969 131, 156, 157, 159
dorothae Lewin 1969 150, 156
Flexoscilla Pringsheim 1951 211
mucronata Pringsheim 1951 211
Fusobacterium Knorr 1922 169
Gaillionella Ehrenberg 1836 325
ferruginea Ehrenberg 1836 328
Gaillonella ferruginea Ehrenberg 1838 328
Gallionella Ehrenberg 1836 7, 8, 10, 292,
325, 340, 343, 356, 513
corneola Dorff 1934 323
ferruginea Ehrenberg 1838 260, 294, 328,
332, 336, 483
ferruginea Ehrenberg 1838 sensu Ellis
1907 331
ferruginea Ehrenberg 1838 sensu Palm
1933 332
ferruginea forma lata Naumann 1921 330
ferruginea forma nodofolium Naumann
1921 330
ferruginea forma solenoidea Naumann
1921 331
ferruginea forma spirosoma Naumann
1921 331
ferruginea forma tenuis Naumann 1921
330
ferruginea forma trichoidea Naumann
1921 294
578 • Namenverzeichnis
ferrugineaiorttiatypicaNaumann 1921330
filamenta Balasova 1967 328, 331, 332
glomerata Naumann 1921 335
glomerata forma bacillaruz Naumann
1921 336
glomerata forma trichoidea Naumann
1921 294, 336
infurcata Beger 1937 335
kljasmiensis Razumov 1949 342
major Cholodnyj 1929 332
minor Cholodnyj 1924 332
pediculata (Koch et Hosaeus 1894) Kra-
sil'nikov 1949 324
planctonica Razumov 1948 in Krasil'ni-
kov 1949 342, 346
pyritica Schopp et al. 1965 328
ramosa (Famintzin 1892) Krasil'nikov
1949 324
reticulosa Butkevic 1928 335
scheminskyi Vouk 1960 335
sideropous (Molisch 1910) Naumann
1921 272
spirida Stiebel 1841 328
taeniata Enderlein 1925 330
tenuicaulis Skuja 1956 334
tortuosa Butkevic 1928 335
umbellata Beger 1949 332
Gemmiger Gossling et Moore 1975 360
formicilis Gossling et Moore 1975 361
Gigantomonas Utermohl 1922 490
capitata Skuja 1964 491
cucullata Utermohl 1922 490
Glaucospira Lagerheim 1892 383
agilissima Lagerheim 1892 383
tenuior Lagerheim 1892 383
Glaucothrix putealis Kirchner 1878 278,280
Gliacoccus Billroth 1874 427
Gloeosphaera Rabenhorst 1854 325
ferruginea Rabenhorst 1854 328, 330
GloeotUa Kutzing 1849 325
ferruginea (Ehrenberg 1838) Kutzing
1844 328
ferruginea (Ehrenberg 1838) Kutzing
1844 sensu Rabenhorst 1847 331
Gluconobacter Asai 1935, emend. Asai et
al. 1964 430
oxydans (Henneberg 1897) De Ley 1961
430
Gonium hyalinum Ehrenberg 1832 496
"Grune Bakterie» Zacharov et Konstantie-
va 1929 118
Haliscomenobacter van Veen et al. 1973 287
hydrossis van Veen et al. 1973 254, 289
HALOBACTERIACEAE Gibbons 1974
424, 441
Halobacterium Elazari-Volcani 1957 9,441
Herpetosiphon Holt et Lewin 1968,
emend. Lewin et Leadbetter 1974 121,
123, 131, 154,292
aurantiacus Holt et Lewin 1968 151,155,
208
cohaerens Lewin 1970 156
geysericola (Copeland 1936) Lewin 1969
155
giganteus (Soriano 1945) Reichenbach et
Golecki 1975 151, 155
nigricans Lewin 1970 156
persicus Lewin 1970 156
Hilhousia mirabilis West et Griffiths 1909
217
palustris West et Griffiths 1913 217
Hyalobotrys Skuja 1964 87
hypolimnicus Skuja 1964 87
Hyalosoris Skuja 1956 492
lamprocystoides Skuja 1956 492
Hygrocrocis nivea Kutzing 1843 193
vandellii Meneghini 1833 173
Hypheothrix kiihniana (Rabenhorst 1853)
Rabenhorst 1865 282, 284
Hyphomicrobium Stutzer et Hartleb 1898
7, 35, 36, 298, 299, 306, 352
indicum Johnson et Weisrock 1969 299,
304
indium Weisrock et Johnson 1966 304
manganoxidans Eleftheriadis et al. 1976
305
neptunium Leifson 1964 303, 305
polymorphum (Pongratz 1957) Zavarzin
1961 299
vulgare Stutzer et Hartleb 1898 301
Hyphomonas Pongratz 1957 298, 300, 304
polymorpha Pongratz 1957 299
Krassilnikovia Kriss et Mickevic 1957 492
capsulata Kriss et Mickevic 1957 494
incapsulata Kriss et Mickevic 1957 494
Kusnezovia Perfiliev 1959 360
polymorpha Perfiliev 1964 360
Lamprocystis Schroeter 1886 40, 68, 69, 78,
492
gelatinosa (Vinogradskij 1888) Migula
1900 58, 59
rosea (Miyoshi 1897) Migula 1900 77, 79
roseopersicina (Kutzing 1849) Schroeter
1886 3, 73, 79, 81,91, 92,380
rubra (Miyoshi 1897) Migula 1900 81
symbiotica Ponomarev 1929 81
violacea (Miyoshi 1897) Migula 1900 81
Lampropedia Schroeter 1886 8, 494
hyalina (Ehrenberg 1832) Schroeter 1886
9, 115,496
rosea (Vinogradskij 1888) de Toni et Tre-
visan 1889 73
Lankesteron roseopersicina (Zopf 1883)
Ellis 1932 91
rubescens (Lankester 1873) Ellis 1932 92
sulfuratum (Warming 1875) Ellis 1929
43, 45
Lauterbomiola minima Utermohl 1924
101, 130
Leptonema Hovind-Hougen 1979 364, 380
illini Hovind-Hougen 1979 381
Leptospira Noguchi 1917 364, 379
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Namenverzeichnis • 579
hiflexa (Wolbach et Binger 1914)
Noguchi 1918 380
hebdomadis (Ido et al. 1918) Noguchi
1919 373
icterogenes (Uhlenhuth et Fromme 1916)
Ford 1927 373, 380
icterohaemorrhagiae (Inada et al. 1916)
Noguchi 1917 380
icteroides Noguchi 1919 380
interrogans (Stimson 1907) Wenyon 1926
380
interrogans (Stimson 1907) Noguchi 1928
380
nodosa (Hubener et Reiter 1916) Ford
1927 380
pseudoicterogenes (Uhlenhuth et Zuelzer
1921) Noguchi 1928 380
LEPTOSPIRACEAE Hovind-Hougen
1979 378
Leptospirillum Markosjan 1972 411
ferrooxidans Markosjan 1972 412
Leptothrix Kutzing 1843 246, 256, 281,
294, 336, 512, 513
cholodnii Mulder et van Veen 1963 263,
264
crassa Cholodnyj 1924 251, 254, 260,
262, 263, 264, 280
cylindracea Skuja 1956 270
Sdindracea forma tenuis Skuja 1956 270
iscophora (Schwers 1912) Dorff 1934 2,
205, 251, 260, 262, 264, 268, 280
echinata Beger 1935 251, 260, 266, 268,
270, 275, 358
epiphytica (Hieronymus 1898) Dorff
1934 275
epiphytica (Migula 1895) Schoenichen et
Kalberlah 1900 254,275
ferruginea (Ehrenberg 1838) Lafar 1906 331
fluitans (Migula 1895) Schoenichen et
Kalberlah 1900 251, 255
hyalina (Migula 1895) Schoenichen et
Kalberlah 1900 289
issatschenkoi Kalinenko 1945 254, 263,
264, 277
kiihniana Rabenhorst 1853 282, 284
levissima Kalbe, Keil et Thiele 1965 266
longissima (Molisch 1912) Prevot 1955
188
lopholea Dorff 1934 254, 264, 268, 271,
274, 275
lopholea forma diminuta Beger 1953 264,
266
major Dorff 1934 274
meyerii Ellis 1908 262, 264
moscvaensis Kalinenko 1945 254, 276
ochracea (Roth 1797) Kutzing 1843 247,
251, 253, 254, 255, 259, 260, 261, 262,
263, 264, 266, 271, 274, 276, 280, 283,
327
pseudoochracea Mulder et van Veen 1963
260
parasitica Kutzing 1847 254, 260, 274
pseudovacuolata (Perfiliev 1925) Dorff
1934 123, 260, 266, 268 271, 275
pseudovacuolata var. subrecta Skuja 1956
268
punni Kalinenko 1949 277
sibirica Kalinenko 1946 254, 277
sideropous (Molisch 1910) Benecke 1912
253, 260, 265, 266, 272
skujae (Skuja 1948) Beger 1953 272
tenuissima Skuja 1948 272
tenuissima (Vinogradskij 1888) Hansgirg
1890 195
thermalis (Molisch 1925) Dorff 1934
266
thuretiana (Borzi 1878) Hansgirg 1888
286
trichogenes Cholodnyj 1924 289
volubilis Cholodnyj 1924 266, 268, 271,
275
wernadskyi Kalinenko 1949 277
winogradskii Cataldi 1939 272
Leptotrichia mucor (Oersted 1844) Trevisan
1889 188
ochracea (Roth 1797) Trevisan 1889 259
tenuis (Vinogradskij 1888) Trevisan 1889
193
tenuissima (Vinogradskij 1888) Trevisan
1889 195
thuretiana (Borzi 1878) Trevisan 1889
286
Leucothrix Oersted 1844 186, 192, 202,
203, 247, 254
cohaerens Pringsheim 1957 188, 190, 285
dissolvens Pringsheim 1966 188, 190
laqueus Pringsheim 1966 188, 190
mucor Oersted 1844 188, 190, 285
LEUCOTRICHACEAE Buchanan 1957
185
Leukobium Skuja 1948 496
maior Skuja 1956 497
mikron Skuja 1948 497
Lieskeella Perfiliev 1926 246, 292, 511
bifida Perfiliev 1926 293
bifilaris (Perfiliev 1926) Dorff 1934 293
Lineola Pringsheim 1950 497
articulata Pringsheim 1950 500
longa Pringsheim 1950 205, 206, 498
LiquQomonas Orla-Jensen 1909 425
Loefflerella Holden 1935 425
Lyngbya epiphytica Hieronymus 1898 275
ochracea (Roth 1797) Thuret 1875 259
Macromonas Utermohl et Koppe 1924 446,
452
bipunctata (Gicklhorn 1920) Utermohl et
Koppe 1924 449, 450
fusiformis Deflandre 1937 449
gicklhomii Skuja 1956 449
hyalina (Gicklhorn 1920) Utermohl et
Koppe 1924 55,450
rmnutissima Skuja 1956 55, 449,450, 451
580 • Namenverzeichnis
mobilis (Lauterborn 1915) Utermohl et
Koppe 1924 447, 450
thermalis (Andres 1907) Ciferri 1960 450
Mantegazzea rosea (Cohn 1875) Trevisan
1889 43,45
winogradskyi Trevisan 1889 43, 45
Megalothrix discophora Schweers 1912 262
Mellitangium Jahn 1924 134
boletus Jahn 1924 134
Melosira minutula Brebisson 1853 328
ochracea Ralfs 1843 328
Merismopedia hyalina (Ehrenberg 1832)
Kiitzing 1849 496
littoralis (Oersted 1840) Rabenhorst 1865
73
Metallogenium Perfiliev 1952 4, 300, 326,
327, 335, 354, 360, 477, 478
invisum Perfiliev 1952 356
personatum Perfiliev 1959 271, 356
symbioticum Zavarzin 1961 358
METHANOMONADACEAE Breed 195 7
440
Methanomonas Orla-Jensen 1909 440
Methylobacter Whittenbury et al. 1970 441
Methylococcus Leadbetter 1974 440
Methylocystis Whittenbury et al. 1970 441
METHYLOMONADACEAE Leadbetter
1974 424, 440
Methylomonas Leadbetter 1974 440
Methylosinus Whittenbury et al. 1970 440
sporium Whittenbury et al. 1970 423
trichosporium Whittenbury 1970 350
Micraloa rosea Kiitzing 1833 79
Microchloris Pringsheim 1953 93, 111
nadsonii Pringsheim 1953 111
Micrococcus hyalinus (Ehrenberg 1832) Mi-
gula 1900 496
ruber Migula 1895 91
Microcyclus 0rskov 1928, emend. Larkin
et al. 1977 34,419, 422,423
aquaticus 0rskov 1928 422
flavus Raj 1970 419
major Gromov 1963 420
marinus Raj 1976 421
2 238 Namsarajev et Zavarzin 1972 422,
423
Microhaloa rosea (Kiitzing 1833) Kiitzing
1843 79
Microscilla Pringsheim 1949 141, 146, 202
aggregans Lewin 1969 150
agilis Pringsheim 1951 154
arenaria Lewin 1969 145
flagellum (Pringsheim 1949) Pringsheim
1951 154
furvescens Lewin 1969 145
litoralis Fox et Lewin 1963 153
marina (Pringsheim 1949) Pringsheim
1951 153, 154
sericea Lewin 1969 145
tractuosa Lewin 1969 148
Microspira Schroeter 1866 417
larvalis Skuja 1956 417
vacillans Gicklhorn 1920 447
Microspironema Stiles et Pfender 1905 378
Microthrix parvicella van Veen 1973 295
Modderula hartwigi Frenzel 1897217
Monas cucullifera (Gicklhorn 1920) de
Rossi 1927 47, 48
fallax Warming 1875 55
gallionella Stiebel 1839 328
gliscens Ehrenberg 1838 55
gracilis Warming 1875 51
muelleri Warming 1875 451, 452
okenii Ehrenberg 1838 43
termo Miiller 1786 429
vinosa Ehrenberg 1838 51
warmingii Cohn 1875 47
Mycococcus cytophagus (Hutchinson et
Clayton 1919) Bokor 1930 144, 164
hutchinsonii (Imseneckij et Solnceva
1936) Imseneckij et Solnceva 1940 164
Mycogallionella glomerata Naumann 1921
294
Mycothrix abundans Naumann 1921 294
clonotrichoides Naumann 1921 294
MYXOBACTERALES Thaxter 1892,
emend. Stanier 1957 131
MYXOCOCCACEAE Jahn 1924 133
Myxococcus Thaxter 1892 133
fulvus (Cohn 1875) Jahn 1911 133
Nannocystis Reichenbach 1970 137
exedens Reichenbach 1970 137
Naumanniella Dorff 1934 474
catenata Beger 1941 475
elliptica Beger 1949 476
minor Dorff 1934 475
neustonica Dorff 1934 475
polymorpha Ten Chak-Mun 1969 476
pygmaea Beger 1949 475
Nephrococcus thermalis Andres 1907 450
Nevskia Famintzin 1892 7, 8, 323
pediculata (Koch et Hosaeus 1894) Hen-
rici et Johnson 1935 324
ramosa Famintzin 1892 324
Nitrosobacterium formae-novae Rullmann
1897 301
Nitrosospira briensis Vinogradskij et Vino-
gradskij 1933 412
Nodofolium Ellis 1908 325
ferruginea (Ehrenberg 1838) Ellis 1908
330
Nostocoida limicola van Veen 1973 294
Oceanospirillum Hylemon et al. 1973 386,
407
beijerinckii (Williams et Rittenberg 1957)
Hylemon et al. 1973 408
hiroshimense (Terasaki 1973) Terasaki
1979 408
japonicum (Watanabe 1959) Hylemon et
al. 1973 408
linum (Williams et Rittenberg 1957)
Hylemon et al. 1973 408
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Namenverzeichnis • 581
maris Hylemon et al. 1973 408
minutulum (Watanabe 1959) Hylemon et
al. 1973 408
multiglobuliferum (Terasaki 1973)
Terasaki 1979 408
pelagicum (Terasaki 1973) Terasaki 1979
408
pusillum (Terasaki 1973) Terasaki 1979
408
Ochrobium Perfiliev 1921 8, 478, 513
tectum Perfiliev 1921 479
Ophidomonas jenensis Ehrenberg 1838 65
sanquinea Ehrenberg 1840 64
Ophryothrix Borzi 1878 246, 285
curvata Skuja 1956 286
media Skuja 1964 287
thuretiana Borzi 1878 285, 286
Oscillaria versatilis Kiitzing 1843 175
caviae Simons 1920 216
Oscillatoria alba Vaucher 1803 173
angusta Koppe 1924 237
arachnoidea Agardh 1827 175
leptomitiformis Meneghini 1842 178
ochracea (Roth 1797) Greville 1889 259
profunda Kirchner 1896 237
Oscillospira Chatton et Perard 1913 211,
212, 215
guilliermondi Chatton et Perard 1913216
muelleri (Schmidt 1922) Krasil'nikov
1949 212
Palmella persicina Cohn 1864 79
Parachromatium Beijerinck 1903 431
Paraspirillum Dobell 1912 413
vejdovskii Dobell 1912 413
Pasteuria Mecnikov 1888, emend. Hirsch
1971 344, 346, 349
ramosa Mecnikov 1888, emend. Hirsch
1971 345
Pediococcus hyalinus (Ehrenberg 1832)
Trevisan 1889 496
roseus (Vinogradskij 1888) Trevisan 1889
73
Pediochloris parallela (Szafer 1911) Geitler
1925 105
Pedomicrobium Aristovskaja 1961 36, 300,
303, 305, 348
ferrugineum Aristovskaja 1961 306, 307,
308
manganicum Aristovskaja 1961 307
podsolicum Aristovskaja 1963 307
Pel ochromatium roseum Lauterborn 1913
101, 129
roseum var. minor Skuja 1956 129
roseoviridis Gorlenko et Kuznecov 1971
130
Pelodictyon Lauterborn 1913 93, 95, 101,
125, 127, 128, 130
aggregatum Perfiliev 1914 103, 104, 113,
129
clathratiforme (Szafer 1911) Lauterborn
1913 102, 104, 106
chlorinum (Lauterborn 1913)
Krasil'nikov 1949 112
lauterbomii Geitler 1925 102
luteolum (Schmidle 1901) Pfennig et Trii-
per 1971 103, 106, 113, 129, 130
parallelum (Szafer 1911) Perfiliev 1914
105, 130
phaeum Gorlenko 1972 104
Pelogloea Lauterborn 1913 95, 111
bacillifera Lauterborn 1916 104, 113
chlorina Lauterborn 1913 104, 112
Pelonema Lauterborn 1916 123, 226
aphane Skuja 1956 227
hyalina Koppe 1924 230
pseudovacuolatum Lauterborn 1916 227,
268
spirale Lauterborn 1916 160, 230
subtilissimum Skuja 1956 229
tenue Lauterborn 1916 227
PELONEMATACEAE Skuja 1956 225
Peloploca Lauterborn 1913 237
ferruginea Skuja 1956 241
fibrata Skuja 1956 238
pulchra Skuja 1956 241
taeniata Lauterborn 1913 238, 241
undulata Lauterborn 1913 238
Pelosigma Lauterborn 1913 414
cohnii (Warming 1875) Lauterborn 1913
415
palustre Lauterborn 1916 415
Pelosphaera Lauterborn 1906 116
rotans Lauterborn 1906 117
Perabacterium Coumartin 1957 501
spelei Coumartin 1957 501
Phaeospirillum Kluyver et van Niel 1936 19
Phormidium geysericola Copeland 1936
155
Phragmidiothrix Engler 1883 246, 284
multiseptata (Engler 1882) Engler 1883
190, 284
Phytomonas Bergey et al. 1923 425
Planctomyces Gimesi 1924 323, 336
bekefii Gimesi 1924 2, 338, 343, 350
condensatus Skuja 1964 341, 344, 345,
349
crassus Hortobagyi 1965 2, 338, 340, 343
ferrimorula Wawrik 1956 343
gracilis Hortobagyi 1965 343
futtaeformis Hortobagyi 1965 341, 350
ljasmiensis (Razumov 1949) Hirsch
1972 342, 346
stranskae Wawrik 1952 323,338,341,351
subulatus Wawrik 1952 338, 340
Planococcus roseus (Vinogradskij 1888)
Migula 1895 73
Planosarcina roseopersidna (Kiitzing 1849)
Migula 1900 79
violacea (Vinogradskij 1888) Migula 1895
56
Plectonema puteale (Kirchner 1878) Hans-
girg 1885 278, 280
582 • Namenverzeichnis
Pleurococcus roseopersicinus (Kiitzing 1849)
Rabenhorst 1868 79
POLYANGIACEAE Jahn 1924, emend.
Mc Curdy 1974 134
Polyangium Link 1809 1, 135
parasiticum Geitler 1925 1, 132, 135
vitellinum Link 1809 135
Pontothrix longissima (Molisch 1912) Nad-
son et Krasil'nikov 1932 188, 190
Proaainomyces cytophagus (Bokor 1930)
Krasil'nikov 1941 164
PROCHLORALES Lewin 1977 15
Promyxobacterium flavum Imseneckij et
Solnceva 1936 154
johnsonii (Stanier 1947) Krasil'nikov
1949 143
johnsonii var. denitrificans (Stanier 1947)
Krasil'nikov 1949 143, 144
lanceolatum Imseneckij et Solnceva 1936
154
Prosthecochloris Gorlenko 1970 108, 111
aestuarii Gorlenko 1970 109, 120
phaeoasteroides Puckova et Gorlenko
1976 110
Prosthecomicrobium Staley 1968 108, 309,
321
enhydrum Staley 1968 310
pneumaticum Staley 1968 310
Protococcus roseopersicinus Kiitzing 1849 79
PSEUDOMONADACEAE Winslow et
al. 1917 424
Pseudomonas Migula 1894 425, 428
aeruginosa (Schroeter 1872) Migula 1900
425
ariston Skuja 1956 507
bipunctata Gicklhorn 1920 449
flagellata (Omeljanskij 1914)
Krasil'nikov 1949 316
hyalina Gicklhorn 1920 450
molischii Bersa 1926 54
okenii (Ehrenberg 1838) Migula 1895 43
zoogloeae ramigerae (Bloch 1918) de
Rossi 1927 427
Pseudoromeria Cyrus et Sladecek 1973 416
cyrusiana Cyrus et Sladecek 1973 416
Pseudospira Dobell 1912 383
serpens Dobell 1912 383
Pseudospirillum uliginosum Zacharias 1903
64
Renohacter vacuolatum Nikitin 1971 422,
423
Rhabdochromatium Vinogradskij 1888 40,
41, 45, 47, 88
fusiforme Vinogradskij 1888 43, 45
gracile (Warming 1875) Migula 1900 51,
52, 78
linsbaueri Gicklhorn 1921 53, 54
minus Vinogradskij 1888 51, 52
roseum (Cohn 1875) Vinogradskij 1888
43, 45, 51, 54, 91
Rhabdomonas Cohn 1875 40, 41
gracilis (Warming 1875) Bergey et al.
1923 51
linsbaueri (Gicklhorn 1921) van Niel
1948 53, 54
rosea Cohn 1875 43, 45, 54
RHIZOBIACEAE Conn 1938 424, 440
Rhizobium Frank 1889 440
Rhodobacillus Molisch 1907 23
palustris Molisch 1907 24
Rhodohacterium capsulatum Molisch 1907
24,25
Rhodocapsa suspensa Molisch 1906 52, 77
Rhodococcus capsulatus Molisch 1907 29,30
minor Molisch 1907 29, 30
Rhodocyclus Pfennig 1978 34
purpureus Pfennig 1978 35
Rhodocystis gelatinosa Molisch 1907 32
Rhododictyon Orla-Jensen 1909 75
Rhodomicrobium Duchow et Douglas
1949 2, 35, 300, 304
vanniellii Duchow et Douglas 1949 36
Rhodomicrospira parva Molisch 1907 37
Rhodomonas Kluyver et van Niel 1936 23
palustris (Molisch 1907) Kluyver et van
Niel 1936 24
Rhodonostoc capsulatum Molisch 1907 31
Rhodopedia Skuja 1956 91
tetras Skuja 1956 61, 91
Rhodopolycoccus Orla-Jensen 1909 90
Rhodopseudomonas Kluyver et van Niel
1937 23, 37
Rhodopseudomonas sp. Kondrat'eva 1956
84
acidophila Pfennig 1969 23, 26
capsulata (Molisch 1907) van Niel 1944
28, 31, 435
gelatinosa (Molisch 1907) van Niel 1944
32
globiformis Pfennig 1974 31
issatschenkoi Osnickaja 1954 33
minor (Molisch 1907) Krasil'nikov 1949
29, 30
palustris (Molisch 1907) van Niel 1944
23, 24, 26, 27, 32, 83, 304
sphaeroides van Niel 1944 29
sphaeroides subsp. denitrificans Satoh et
al. 1976 29, 30
sulfoviridis Keppen et Gorlenko 1975 23,
28
sulphidophila Hansen et Veldkamp 1973
28
vannielii Scardovi 1950 33
viridis Drews et Giesbrecht 1966 23,
27
Rhodorrhagus capsulatus (Molisch 1907)
Bergey et al. 1925 29,30
minor (Molisch 1907) Bergey et al. 1925
29, 30
sphaeroides (van Niel 1944) Brisou 1955
29
Rhodosarcina Orla-Jensen 1909 60
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Namenverzeichnis • 583
Rhodosphaera capsulata (Molisch 1907)
Buchanan 1918 29, 30
minor (Molisch 1907) Bergey et al. 1923
29, 30
RHODOSPIRILLACEAE Pfennig et
Triiper 1971 17
RHODOSPIRILLALES Pfennig et Triiper
1971 15, 16
RHODOSPIRILLINEAE Pfennig et
Triiper 1971 17
Rhodospirillum Molisch 1907, emend, van
Niel 1944 19, 37, 67
fulvum van Niel 1944 22
giganteum Molisch 1907 20, 21
gracile Hama 1933 20, 21
longum Hama 1933 20, 21
molischianum Giesberger 1947 22
photometricum Molisch 1907 21, 22
rubrum (von Esmarch 1887) Molisch
1907 20, 22, 23, 67, 83
tenue Pfennig 1969 21, 22, 34
Rhodotece Molisch 1907 67, 68
conspicua Skuja 1956 69
nuda Skuja 1956 70, 72
pendens Molisch 1906 70, 72
Rhodothiosarcina Ellis 1932 60
rosea (Schroeter 1886) Ellis 1932 61
Rhodothiospirillum Ellis 1932 64
jenense (Ehrenberg 1838) Ellis 1932 65
Rhodovibrio parvus Molisch 1907 24, 26
Runella Larkin et Williams 1978 421
slithyformis Larkin et Williams 1978
421
Saprospira Gross 1911, emend. Lewin 1962
7, 131, 150, 156
albida (Kolkwitz 1909) Lewin 1962 161,
367
flammula Lewin 1965 161
flexuosa Dobell 1912 161
gigantea (Warming 1875) Soriano et
Lewin 1965 163
grandis Gross 1911 158, 161, 162
lepra Dimitroff 1926 163, 375
nana Gross 1911 161
plicatilis (Ehrenberg 1833) Lewin 1965
366
punctum Dimitroff 1926 162, 375
spiroidea (Skuja 1948) Lewin 1962 157,
231, 233
thermalis Lewin 1965 159, 230
toviformis Lewin et Mandel 1970 159,
161
Sarcina hyalina (Ehrenberg 1832) Winter
1884 496
Sarcina paludosa Schroeter 1886 508
rosacea Migula 1900 61
rosea Schroeter 1886 61
sulphurata Vinogradskij 1887 61
tetras Skuja 1956 509
Schmidlea luteola (Schmidle 1901) Lauter-
born 1913 103
Seliberia Aristovskaja et Parinkina 1963
327, 346
carboxydohydrogena Sanzieva et Zavar-
zin 1971 349
stellata Aristovskaja et Parinkina 1963
347
Serpens Hespell 1977 502
flexibilis Hespell 1977 502
Siderobacter Naumann 1921 485
brevis Beger 1949 486
calceum (Brussoff 1918) Naumann 1921
484
duplex Naumann 1921 486
gracilis Beger 1949 486
latum Beger 1949 487
linearis Naumann 1921 486
Siderocapsa Molisch 1909 465
anulata Kalbe, Keil et Thiele 1965 472
arlbergensis Wawrik 1956 469, 470
botryoides Beger 1949 473
conglomerata Svorcova 1975 468
coronata Redinger 1931 467, 469, 470
eusphaera Skuja 1948 470
geminata Skuja 1956 467
hexagonata Svorcova 1975 474
lanceolata Svorcova 1975 471
major Molisch 1910 467, 468, 470
monoica Naumann 1921 473
quadrata Svorcova 1975 473
rectangulata Svorcova 1975 471
solitaria Svorcova 1975 473
treubii Molisch 1909 266, 466, 468, 470,
472
SIDEROCAPSACEAE Pribram 1929 464
Siderococcus Dorff 1934 477
communis Dorff 1934 478
limoniticus Dorff 1934 478
Siderocystis Naumann 1921 479
duplex Naumann 1921 482
minor Naumann 1921 480
vulgaris Naumann 1921 481
Sideroderma Naumann 1921 483
dubium Skuja 1956 485
duplex (Brusoff 1916) Naumann 1921 483
limneticum Naumann 1921 479
rectangulare Naumann 1921 484
tenue Naumann 1921 484
Sideromonas Cholodnyj 1922 479
confervarum Cholodnyj 1922 480
duplex (Naumann 1921) Beger 1957 482
major-(Naumann 1921) Beger 1957 480
vulgaris (Naumann 1921) Beger 1957 481
Sideromyces glomerata Naumann 1929
292, 294, 336
Sideromyces glomerata forma trichoidea
Naumann 1929 294
Sideronema Beger 1941 483
J;lobulifera Beger 1941 483
erophacus Beger 1944 8, 322, 341
corneolus (Dorff 1934) Beger 1944 323
Siderosphaera conglomerata Beger 1949 468
584 • Namenverzeichnis
Siderothece major Naumann 1921 480
minor Naumann 1921 480
Simonsiella Schmid 1922 211, 212
crassa Schmid 1922 212
filiformis Schmid 1922 213
muelleri Schmid 1922 212
SIMONSIELLACEAE Steed 1962 211
Sorochloris Pascher 1925 95, 115
aggregata Pascher 1925 97, 116
Sphaerocytophaga Graf 1961 139, 169
filiformis Graf 1961 170
fusiformis Graf 1961 170
Sphaeromyxa Bauer 1962 139, 170
xanthochlora Bauer 1962 152, 168, 170
Sphaerothrix latens Perfiljev 1927 294, 330
Sphaerotilus Kiitzing 1833 184, 246, 247,
253, 256, 257, 258, 264, 268, 281, 292,
496, 507
catenulatus Schoph et al. 1965 251
dichotomus (Cohn 1875) Migula 1900
247, 250, 251, 253, 254, 278, 416
discophorus (Schwers 1912) Pringsheim
1949 251, 262, 263
discophorus forma arachnoides
Pringsheim 1949 263
discophorus forma eutrophica Pringsheim
1949 263
discophorus forma manganifera
Pringsheim 1949 263
discophorus forma ochraceoides
Pringsheim 1949 263
fluitans (Migula 1895) Schikora 1899251,
254, 255
glaucus Kiitzing 1849 251, 256
lacteus Kiitzing 1843 251, 256
natans Kiitzing 1833 186, 190, 205, 250,
251, 260, 262, 263, 264, 265, 266, 274,
275, 280, 289, 416
natans var. cladothrix Butcher 1932 251,
254
natans forma dichotoma Pringsheim 1949
251, 254
natans var. depauperatus Butcher 1932
251, 254
natans forma eutrophica Pringsheim 1949
251
natans forma fusca Pringsheim 1949 253,
278
natans forma ochracea (Roth 1797)
Pringsheim 1949 253, 255, 259, 260, 271,
274, 280
natans forma patens Pringsheim 1949
253, 278
natans var. prolifera Butcher 1932 254,
282, 284
natans forma roseus (Zopf 1892) Beger
1953 251, 255
natans forma sideropous (Molisch 1910)
Pringsheim 1949 272, 274
natans var. transiens Butcher 1932 251,
254
natans var. typica Butcher 1932 251
natans forma typica Pringsheim 1949
251
natans var. vulgaris Butcher 1932 251
ochraceus de Brebisson 1849 251, 256
ochraceus Pringsheim 1949 260
paludosus Smit 1934 251, 254, 255
reticularis (Naumann 1921) Cataldi 1939
262, 263
roseus Zopf 1892 251, 255
tenuis Beger 1935 251, 254, 255
thermalis Kiitzing 1843 251, 256
trichogenes (Cholodnyj 1924)
Pringsheim 1949 251, 289
SPIRILLACEAE Migula 1894 384
Spirillum Ehrenberg 1832 385, 396, 408,
496, 513
agilissimum Gicklhorn 1920 458
amyliferum van Tieghem 1897 387
anulus Williams et Rittenberg 1957 403
anodontae (Keysselitz 1906) Mace 1913
375
atlanticum Williams et Rittenberg 1957
408
azotocolligens Rodina 1956 387, 388
beijerinckii Williams et Rittenberg 1957
408
bipunctatum Molisch 1912 455
huccale (Steinberg 1862) Mace 1889 169,
170
camillae Cyrus et Sladecek 1973 388
coprophilum Migula 1900 389
crassum Terasaki 1961 389
curvatum Williams et Rittenberg 1957
408
delicatum Leifson 1962 404
ehrenbergi Matzuschita 1902 387
endoparagogicum Sorokin 1887 389
ferrugineum (Ehrenberg 1838) de Toni et
Trevisan 1889 328
flexible (Nagler 1909) Mace 1913 382
giesbergeri Williams et Rittenberg 1957
404
giganteum (Warming 1875) Trevisan
1889 163, 372
giganteum Migula 1900 391
gigas Certes 1882 391
gracile Canale-Parola et al 1966 399
graniferum Williams et Rittenberg 1957
403, 404, 405
granulatum Molisch 1912 454
halophilum Watanabe 1959 408
hiroshimense Terasaki 1979 408
ictersonii Giesberger 1936 399
ictersonii subsp. nipponicum Terasaki
1973 399, 400
ictersonii subsp. ictersonii Williams et
Rittenberg 1957 399, 400
ictersonii subsp. vulgatum Williams et
Rittenberg 1957 399, 400
japonicum Watanabe 1959 408
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Namenverzeichnis • 585
jenense (Ehrenberg 1938) Trevisan 1879
65
kolkwitzii Wislouch 1914 391, 393
kutscheri Migula 1900 391, 406
linum Williams et Rittenberg 1957 408
lipoferum Beijerinck 1925 388, 413
lunatum Williams et Rittenberg 1957 408
mancuniense Cayton et Preston 1955 392
maritimum Watanabe 1959 408
metamorphum Terasaki 1961 406
minor Carter 1888 386
minutulum Watanaba 1959 408
mobile Migula 1900 389, 392
multiglobuiiferum Terasaki 1979 408
ostrae Noguchi 1921 392
pelagicum Terasaki 1973 408
peregrinum Pretorius 1963 401
peregrinum subsp. integrum Terasaki
1973 401
plicatile (Ehrenberg 1833) Dujardin 1941
366
polymorphum Williams et Rittenberg
1957 404
portae Mantegazza sensu de Toni et
Trevisan 1889 366
proeclarum Collin 1913 414
psychrophilum Terasaki 1973 406
pusillum Terasaki 1979 408
putridiconchylium Terasaki 1961 403
rosenbergii Warming 1875 66
rubrum von Esmarch 1887 20
rufum Petty 1852 67
rugula (Miiller 1786) Winter 1884 392,
393
sanquineum (Ehrenberg 1840) Cohn
1875 64
serpens (Miiller 1786) Winter 1884 398
serpens var. azotum Williams et
Rittenberg 1957 398
serpens var. serpens Williams et
Rittenberg 1957 398
sinuosum Williams et Rittenberg 1957
400
sporiferum Migula 1900 393
subtilissimum Migula 1900 393
tenerrinum Lehmann et Neumann 1896
393
tenue Ehrenberg 1838 393
theophilii Cyrus et Sladecek 1973 394
undula (Miiller 1773) Ehrenberg 1832 67,
391, 395, 403, 458
undula minor Kutscher 1895 395
undula majus Kutscher 1895 391
violaceum Warming 1875 43, 45
virginianum Dimitroff 1926 393,395,403
volutans Ehrenberg 1832 8, 386, 387
No 1 Kutscher 1895 393
No 4 Kutscher 1895 163
Spirobacillus minimus (Warming 1875)
Lauterborn 1913 382
Spirochaeta Ehrenberg 1835 364, 378, 382
Spirochaeta Dujardin 1841 364
Spirochaeta agilis Adelmann 1922 372
anodontae Keysselitz 1906 375
aurantia Vinzent 1926 367
aurantia var. aurantia (Vinzent 1926)
Breznak et Canale-Parola 1975 367,
368
aurantia var. stricta Breznak et Canale-
Parola 1975 367, 368
biflexa Wollbach et Binger 1914 380
buccalis Steinberg 1862 372, 373
cytophaga Hutchinson et Clayton 1919
164
daxensis Cantacuzene 1910 372
elusa Wolbach et Binger 1914 372
eurystrepta Zuelzer 1912 366, 367
flexibilis Nagler 1909 382
fuleurans Dobell 1912 368, 369, 373
gaUinarum Stephens et Christopher 1905
373
gigantea Warming 1875 163, 372
graminea Zuelzer 1925 372
halophila Greenberg et Canale-Parola
1976 371
hebdomadis Ido et al. 1918 373
icterogenes Uhlenhuth et Fromme 1916
373, 380
icterogenes var. marina Zuelzer 1925 380
icterohaemorrhagica Lehmann et
Naumann 1920 380
icterohaemorrhagiae Inada et al. 1916 380
icterohaemorrhagiae japonica Inada et
Ido 1915 380
icteroides (Noguchi 1919) Lehmann et
Neumann 1927 380
interrogans Stimson 1907 380
litoralis Hespell et Canale-Parola 1970
370
marina Bergey et al. 1923 366, 367
minima Dobell 1912 373
nodosa Hubener et Reiter 1916 380
ostrae Schellack 1909 163
plicatilis Ehrenberg 1833 154, 157, 161,
366, 369, 373, 383
plicatilis var. eurystrepta Zuelzer 1912
366, 367
plicatilis var. marina Zuelzer 1912 366,
367
plicatilis var. plicatilis (Ehrenberg 1833)
Zuelzer 1912 366
portae Brisou 1955 366
pseudobuccalis Uhlenhuth et Zuelzer
1921 373
pseudogallinarum Uhlenhuth et Zuelzer
1921 373
pseudohebdomadis Zuelzer et Oba 1925
373
pseudoicterogenes Uhlenhuth et Zuelzer
1921 380
pseudoicterogenes var. aquatilis
Uhlenhuth et Zuelzer 1921 380
586 ■ Namenverzeichnis
pseudoicterobaemorrhagiae Vinzent 1926
380
pseudopallida Uhlenhuth et Zuelzer 1921
373
pseudorefringens Uhlenhuth et Zuelzer
1921 373
pusilla Schellack 1909 376
refringens Schaudinn et Hoffmann 1905
373
recurrentis (Lebert 1874) Castellani et
Chalmers 1910 373
spiculifera Schellack 1909 373
stenostrepta Zuelzer 1912 368, 370, 372
stenostrepta var. marina Zuelzer 1925
368, 369
sumatrana Zuelzer 1928 373
tapetos Schellack 1909 163
vivax (Dobell 1912) Zuelzer 1925 373
zuelzerae (Veldkamp 1960) Canale-Paro-
la et al. 1968 370
SPIROCHAETACEAE Schwellengrebel
1907 364
SPIROCHAETALES Buchanan 1917 363
Spirochaete Cohn 1872 364
ferruginea (Ehrenberg 1838) Hansgirg
1888 328
hartmanni Gonder 1908 376
plicatilis (Ehrenberg 1833) Cohn 1872
366
Spiromonas cohnii Warming 1875 415
Spironema Vuillemin 1905 378
Spironema Bergey et al. 1923 376
Spirophis Nagler 1909 381
flexibilis Bocher 1949 382
minima (Warming 1875) Lauterborn
1916 382
Spirophyllum Ellis 1907 325
ferrugineum (Ehrenberg 1838) Ellis 1907
330, 332
tenue Ellis 1908 330
infurcatum Beger 1937 335
Spiroschaudinnia Sambou 1907 376
Spirosoma Migula 1900, emend. Larkin et
al. 1977 34, 418, 422
Spirosoma Ellis 1908 325
/err«gj>jea(Ehrenbergl838)Ellisl908331
linguale (Eisenberg 1891) Migula 1894
419
solenoide Ellis 1908 331
tenue Ellis 1908 330
SPIROSOMACEAE Larkin et Borrall
1978 417
Spirothrix pseudovacuolata Perfiliev 1925
268
Spirulina albida Kolkwitz 1909 157, 161
ferruginea (Ehrenberg 1838) Kirchner
1878 328
plicatilis (Ehrenberg 1833) Cohn 1853
366
Sporocytophaga Stanier 1940 131, 139,163,
396
cauliformis Knorr et Graf 1962 166, 168,
170, 315
congregata Fuller et Norman 1943 168
congregata subsp. maroonicum Akashi
1960 168
ellipsospora (Imseneckij et Solnceva
1936) Stanier 1942 168
myxococcoides (Krzemieniewska 1933)
Stanier 1940 164, 168
myxococcoides a Akashi 1960 164, 166
myxococcoides ji Akashi 1960 164, 166
Sporoschaudinnia icterobaemorrhagiae
(Inada et al. 1916) Castellani et Chalmers
1919 380
Sporospirillum Delaporte 1964 414
proeclarum (Collin 1913) Delaporte 1964
414
Steineckea Koppe 1924 502
cylindrica Koppe 1924 503
Stella humosa Vasil'eva 1972 353
Stigmatella Berkeley et Curtis 1875 134
aurantiaca Berkeley et Curtis 1875 134
Streptobacter Perfiliev 1960 510, 515
Streptobacterium zavisii Cyrus et Sladecek
1973 507
Streptococcus margaritaceus Schroeter
1886 510
varians Ewart 1897 95, 96
Streptothrix Cohn 1875, emend. Migula
1895 287
epiphytica Migula 1895 275
fluitans Migula 1895 251, 255
hyalina Migula 1895 254, 289
Sulfobacillus Golovaceva et Karavajko 1978
461
thermosulfidooxidans (Golovaceva et
Karavajko 1977) Golovaceva et
Karavajko 1978 462
Sulfolobus Brock et al. 1972 442, 459
acidocaldarius Brock et al. 1972 460
Sulfomonas Orla-Jensen 1909 460
Sulfospirillum Kluyver et van Niel 1936 453
■winogradskyi (Omeljanskij 1905)
Kluyver et van Niel 1936 454
Synechococcus plancticus Drews et al. 1961
27
Taphrospira Skuja 1948 456, 458
elongata (Perfiliev 1923) Skuja 1948 456,
459
Teratobacter Perfiliev 1960 510, 516
Tetrachloris Pascher 1925 95, 113
diplococcus Pringsheim 1953 115
inconstans Pascher 1925 97, 114, 116
merismopediodes Skuja 1948 115
Thermus Brock et Freeze 1969 503
aquaticus Brock et Freeze 1969 463,
504, 505
flavus Saiki et al. 1972 505
ruber Loginova et al. 1975 505
thermophilus (Yoshida et Oshima 1971)
Oshima et Imahori 1974 504
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
Namenverzeichnis • 587
Thiobacillus Beijennck 1904 442, 460, 462
bovistus (Molisch 1912) Ellis 1932 443
coproliticus Lipman et Mc Lees 1940 461
denitrificans Beijerinck 1904 461
ferrooxidans Temple etColmer 1951 412,
460, 462
thermophilica imschenetskii Egorova et
Derjugina 1963 462
thioparus Beijerinck 1904 461
thermosulfidooxidans Golovaceva et
Karavajko 1977 462
unigutatum Perfiliev et Pels 1936 362
THIOBACTERIACEAE Janke 1924 442
Thiobacterium Janke 1924 443
bovista (Molisch 1912) Janke 1924 221,
443
cristalliferum (Gicklhorn 1920) Janke
1924 446
retiformans (Gicklhorn 1920) Janke 1924
446
Thiocapsa Vinogradskij 1888 56, 61, 72, 91
floridana Uphof 1927 62, 63
minima Isacenko 1929 62, 63
pfennigii Eimhjellen 1970 63
roseopersicina Vinogradskij 1888 62, 69
Thiococcus sp. Eimhjellen et al. 1967 63
Thiocystis Vinogradskij 1888 55, 61, 78, 91
gelatinosa (Vinogradskij 1888) Pfennig et
Triiper 1971 58
rufa Vinogradskij 1888 59
violacea Vinogradskij 1888 56, 59, 81
Thiodendron Lackey et Lackey 1961 443
Thiodendron Perfiliev et Gabe 1961 311
mucosum Lackey et Lackey 1961 443,444
latens Perfiliev et Gabe 1961 312
Thioderma Miyoshi 1897 78
roseum Miyoshi 1897 79
rubrum Miyoshi 1897 81
Thiodictyon Vinogradskij 1888 40, 68, 75
bacillosum (Vinogradskij 1888) Pfennig
et Triiper 1971 77, 81
elegans Vinogradskij 1888 52, 75
elegans forma magna Isacenko 1927 75
elegans forma minus Isacenko 1927 75
minus Isacenko 1914 75, 76
Thiogloea Devide 1952 221
bovista (Molisch 1912) Devide 1952 443
ragusina Devide 1952 221
ruttneri Devide 1952 216, 219, 221
Thiogloeobactron burmiense Andres 1907
454
Thiomicrospira Kuenen et Veldkamp 1972
461
pelophila Kuenen et Veldkamp 1972 461
Thionema Kolkwitz 1938 184
vaginatum Kolkwitz 1938 184
Thiopedia Vinogradskij 1888 56, 61, 68, 72,
91
elongata Rodina 1963 73, 75
rosea Vinogradskij 1888 73, 75
sevani Gambarjan 1962 73
Thiophysa Hinze 1903 217
gigantea Klas 1951 219, 221
macrophysa Nadson 1913 219, 220
minor Feldmann 1946 219, 221
volutans Hinze 1903 219
Thioploca Lauterborn 1907 180
ingrica Vislouch 1911 182
minima Koppe 1924 182
mixta Koppe 1924 182
schmidlei Lauterborn 1907 181
Thiopolycoccus Vinogradskij 1888 40, 90
Thiopolycoccus ruber Vinogradskij 188891
Thioporphyra Ellis 1926 86
volutans Ellis 1926 86
Thiorhodospirillum Fuhrmann 1913 64
Thiosarcina Vinogradskij 1888 56, 60, 91
rosea (Schroeter 1886) Vinogradskij 1888
61
Thiosiphon Klas 1936 224
adriaticum Klas 1936 224
THIOSIPHONACEAE Klas 1936 224
Thiosphaera Miyoshi 1897 55, 56
gelatinosa Miyoshi 1897 58, 59
Thiosphaerella amylifera Nadson 1913 219,
221
Thiosphaerion violaceum Miyoshi 1897 81
Thiospira Vislouch 1914 241, 453, 458, 459
agilis (Kolkwitz 1909) Bavendamm 1924
455, 457, 458
agilissima (Gicklhorn 1920) Bavendamm
1924 458
bipunctata (Molisch 1912) Vislouch 1914
455
dextrogyra Skuja 1956 455
dextrogyra var. leptosoma Skuja 1956 455
elongata Perfiliev 1923 459
propera Hama 1933 457
sulphurica Isacenko 1929 457
tenuis Skuja 1956 455
winogradskyi (Omeljanskij 1905)
Vislouch 1914 454, 455
Thiospirillopsis Uphof 1927 183
floridana Uphof 1927 184
Thiospirillum Vinogradskij 1888 64, 88,455
Thiospirillum Janke 1924 453
agile Kolkwitz 1909 457
agilissimum (Gicklhorn 1920) Ellis 1932
458
bipunctatum(Molisch\9\2)Ellis\9i2455
coccineum Hama 1933 66, 67
crassum Hama 1933 65, 66
granulatum (Molisch 1912) Bergey 1925
454
jenense (Ehrenberg 1838) Migula 1900
65, 66, 455
pistiense Czurda 1935 462
rosenbergii (Warming 1875) Migula 1900
66, 67
rufum (Perty 1852) Migula 1990 67, 83
sanquineum (Ehrenberg 1840)
Vinogradskij 1888 64, 66, 380
588 - Namenverzeichnis
violaceum (Warming 1875) Migula 1900
43, 45
winogradskyi Omeljanskij 1905 454
Thiothece Vinogradskij 1888 55, 56
gelatinosa Vinogradskij 1888 58
Thiothrix Vinogradskij 1888 174, 184, 190,
209, 254, 380
annulata Molisch 1912 198, 200
longiarticulata Klas 1936 198
marina Molisch 1912 195, 197
minutissima Uphof 1927 195
nivea (Rabenhorst 1865) Vinogradskij
1888 81, 193, 195, 199
tenuis Vinogradskij 1888 193, 195, 197
tenuissima Vinogradskij 1888 193, 195
torquis Rodina 1963 197
torquis forma minor Rodina 1963 197
undulata Rodina 1963 196
violacea Ellis 1932 201
voukii Klas 1936 197, 199
Thiovibrio vacillans (Gicklhorn 1920) Jan-
ke 1924 447
Thiovulum Hinze 1913 55, 451
majus Hinze 1913 451
minus Hinze 1913 451, 452
muelleri (Warming 1875) Lauterborn
1915 451, 452
spora Skuja 1964 453
Toxothrix Molisch 1925 246, 289, 327,
330
ferruginea Molisch 1925 289
gelatinosa Beger 1953 292, 294
trichogenes (Cholodnyj 1924) Beger 1953
251,289,292,294
Treponema Schaudinn 1905 369, 375, 378
buccale (Steinberg 1862) Schwellengrebel
1907 373
elusum (Wolbach et Binger 1914) Bergey
et al. 1923 372
icterogenes (Uhlenhuth et Fromme 1916)
Gonder et Gross 1919 380
ictero-haemorrhagica (Lehmann et
Neumann 1920) Brumpt 1920 380
icteroides (Noguchi 1919) Brumpt 1922
380
interrogans (Stimson 1907) Brumpt 1922
380
nodosum (Hubener et Reiter 1916)
Brumpt 1922 380
pallidum (Schaudinn et Hoffmann 1905)
Schaudinn 1905 370, 378
plicatilis (Ehrenberg 1833) Enderlein
1925 366
refringens (Schaudinn et Hoffmann 1905)
Castellani et Chalmers 1919 373
stenostrepta (Zuelzer 1912) Enderlein
1925 368
vivax Dobell 1912 373
zuelzerae Veldkamp 1960 370
Trigonobacter Perfiliev 1960 510, 514
Trichobacter Perfiliev 1960 511
Vampirovibrio Gromov et Mamkaeva 1972
410
chlorellavorus (Gromov et Mamkaeva
1972) Gromov et Mamkaeva 1980 411
Vannielia Pringsheim 1955 37
aggregata Pringsheim 1955 37
Vibrio Pacini 1854 417,421
aestuarii (van Delden 1904) Krasil'nikov
1949 400
canus Matzuschita 1902 389
hyos Ford 1927 392
itersonii (Giesberger 1936) Krasil'nikov
1949 399
linguale Eisenberg 1891 419
longa Miiller 1786 500
No 2 Kutscher 1895 389
No 3 Kutscher 1895 389,392
prolifer Ehrenberg 1838 395
rugula Miiller 1786 392
serpens Miiller 1786 398
spirillum Miiller 1786 387
subtilissimus (Migula 1900) Ford 1927
393
suis Ford 1927 389
undula Miiller 1773 395
Vitreoscilla Pringsheim 1949 202, 230, 249,
496
beggiatoides Pringsheim 1949 203, 206
catenula Pringsheim 1951 206, 207
conica Pringsheim 1951 208
filiformis Pringsheim 1951 205
flagellum Pringsheim 1949 154
major Pringsheim 1951 209
marina Pringsheim 1949 153
moniliformis Pringsheim 1951 205
paludosa Pringsheim 1951 206
proteolytica Graf et Perschmann 1970
155, 208
stercoraria Pringsheim 1951 207
stricta Pringsheim 1949 208
VITREOSCILLACEAE Pringsheim 1949
201
Winogradskya Trevisan 1889 426, 427
ramigera (Itzigsohn 1867) Trevisan 1889
427
Xanthomonas Dowson 1939 425
campestris (Pammel 1895) Dowson 1939
425
Zoogloea Itzigsohn 1867 8, 57, 81,241,426,
446, 489
carnea Kolkwitz 1911 427, 429
compacta Kolkwitz 1911 427, 429
filipendula Beger 1928 429, 475, 486
ramigera Itzigsohn 1867, emend. Bloch
1918 254, 380, 427,429,444
ramigera var. carnea Johnson 1914 427,429
ramigera var. compacta Johnson 1914
427, 429
ramigera var. uva Johnson 1914 427, 429
termo (Miiller 1786) Cohn 1854 429
uva Kolkwitz 1911 427,429
Seamed & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rarnbler.ru
Sufiwasserflora von Mitteleuropa
Begriindet von A. Pascher
Casper/Krausch
Pteridophyta und Anthophyta
2. Teil: Saururaceae bis Asteraceae
Band 24,1981. Etwa 500 S, 119 Tafeln mit
1695 Einzeldarstellungen,
Gzl. etwa DM 98-/etwa DM 89,-*
Casper/Krausch
Pteridophyta und Anthophyta
1. Teil: Lycopodiaceae bis Orchidaceae
Band 23,1980.403 S., 109 Tafeln, 1038 Figuren,
Gzl. DM 89-/DM 78,-*
Rieth
Xanthophyceae, 2. Teil
Band 4,1980. XIV, 147 S„ 61 Figuren,
Gzl. DM 68-/DM 61,-*
Ettl
Xanthophyceae, 1. Teil
Band 3,1978. XIV, 530 S., 636 Abbildungen,
Gzl. DM 98-/DM 89,-*
* Vorzugspreis fur Bezieher des Gesamtwerks
Gustav Fischer Verlag
Stuttgart • New York
Uhlmann Hydrobiologie
Ein Grundrifi fur Ingenieure und Naturwissenschaftler
2. Aufl, 1981. Etwa 352 S., kart. etwa DM 52 -
Walter Bekenntnisse eines Okologen
Erlebtes in acht Jahrzehnten und auf Forschungsreisen
in alien Erdteilen
2. Aufl., 1981. XII, 345 S, kart. DM 19-
Rheinheimer Mikrobiologie der Gewasser
3. Aufl., 1981.251 S., kart. DM36 -
Heller Gewasser- und
Pflanzenbehandlungsmittel IV
1981.136 S., kart. DM 28,50
Schwoerbel Methoden der Hydrobiologie -
Siifiwasserbiologie
2. Aufl., 1980. XII, 261 S., Tb. DM 19,80
Schwoerbel Einfuhrung in die Limnologie
4. Aufl., 1980. X, 196 S., Tb. DM 14,80
Ettl Grundrift der allgemeinen Algologie
1980. 549 S., Gzl. DM 70,-
Tischler Einfuhrung in die Okologie
2. Aufl., 1979. X, 306 S., kart. DM 32,-
Gustav Fischer Verlag
Stuttgart New York
Scanned & Djvued by Pahuta Yuri, Karadag 2008, e-mail pahutaqwe@rambler.ru
111
O
a.
o
'c
cu
n
CD
5
U)
co
s_
CD
>
i_
CD
SZ
O
CO
u.
•>
co
-I-'
l/J
3
o
CO
^
1—
o
C\l
h~
sz
o
to
»4—
<n
o
Q_
o
co
(f)
o
o
o
I
Q
c
CD
XI
CD
o>
c
a
c
CO
E
'CD
X
c
>- CD
<D .£
■a c
C <D
c
CD
c
o
>
m
c
TD
t_
<d
D
N
CD
enlo
E
CD
c
edi
2
(/>
c
,r
o
0)
N
0)
>
CD
o>
olo
CD
co
c
x:
o
(!)
e
CD
>
o
c
0)
iss
*
(0
sr
?
o
irts
5
CO
c
r;
o
ci>
N
(!)
>
a> a>
0)
co
fan
ii