Текст
6,941
9,0121821 10,811
бериллий Ковалевская Н
2,98976,
т\ /г 12 13
Mg
.... А1
12,011
УГЛЕР
14 гх
ХИМИЯ
28
PEMI-
19
39,0983
47,(
Си1
МЕДЬ
• 37
85,4673
Ag
ЕРЕБРО
55
85,39
69,723
АДМИЙ
56
87,62
88,90585
ИТТРИЙ
72,61
ГЕРМАН
32,90542
Au
КЛАСС37327
БАРИЙ
80
49
114,82
ЗОЛОТО
223,01
200,59
Для
самостоятельной
работы в школе и дома
Ковалевская Н.Б.
химия
в таблицах и схемах
8
КЛАСС
Для
самостоятельной
работы в школе и дома
Ковалевская Н.Б.
Химия. 8 класс. В таблицах и схемах
М.: "Издат-Школа XXI век", - 96 с.
Данное пособие содержит в наглядной форме все основные
разделы курса химии 8 класса. Пособие может быть использовано
при изучении, обобщении и повторении учебного материала, а
также может быть полезным в организации систематического
повторения при подготовке к выпускным или вступительным
экзаменам.
Настоящее пособие может дополнить любой учебник химии
для 8 класса.
ISBN 5-98031-024-Х
Перепечатка отдельных разделов и всего издания в уел ом запрещена.
Всякое коммерческое использование данного издания
возможно исключительно с ведома издателя.
Подписано в печать 09.01.2003 г
формат 60 х 90 1/16 тираж 5 000 экз. Заказ 5 19'
ООО "Издат-школа XXI век" 103012, Москва, ул. Новая ILiohuu
Отпечатано в ООО "Фирма Пандора 1"
107143, г. Москва, Открытое шоссе, д.28
ISBN 5-98031-024-Х
© "Издат-школа XXI век'
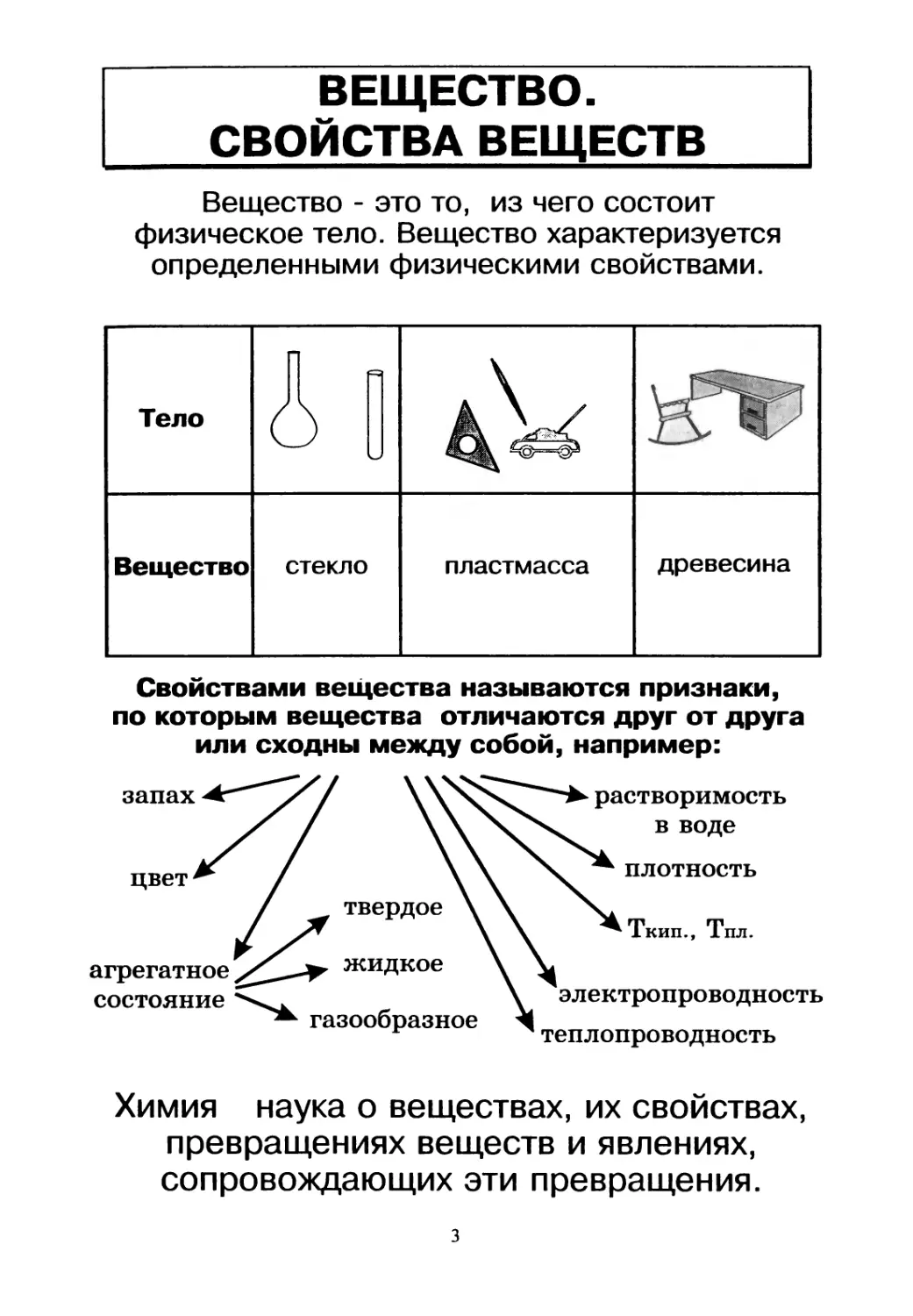
ВЕЩЕСТВО.
СВОЙСТВА ВЕЩЕСТВ
Вещество - это то, из чего состоит
физическое тело. Вещество характеризуется
определенными физическими свойствами.
Свойствами вещества называются признаки,
по которым вещества отличаются друг от друга
или сходны между собой, например:
Химия наука о веществах, их свойствах,
превращениях веществ и явлениях,
сопровождающих эти превращения.
3
МОЛЕКУЛЫ И АТОМЫ.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
Молекулы - это мельчайшие частицы данного вещества,
которые сохраняют его состав и химические свойства.
Атомы - это мельчайшие химически неделимые частицы
вещества.
Схема распада молекул воды и образования
молекул кислорода и водорода.
Молекула воды Атом кислорода Атомы водорода
Молекула кислорода
Атомы кислорода
Атомы водорода
Молекула водорода
Молекулы одного и того же вещества одинаковы.
Молекулы веществ при физических явлениях сохраняются,
при химических - распадаются. Атомы при химических
реакциях сохраняются, перегруппировываются,
образуя молекулы нрвых веществ.
Атомно-молекулярное учение. (М.В. Ломоносов)
Положения Поправки
1. Все вещества состоят из молекул, между которыми имеются промежутки. 2. Молекулы находятся в непрерывном движении. 3. Молекулы состоят из атомов. 4. Атомы характеризуются определенной массой и размерами. 5. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных из разных. Есть вещества немолекулярного строения. Исследования показали, что атомы делятся с помощью физических методов на более мелкие частицы.
4
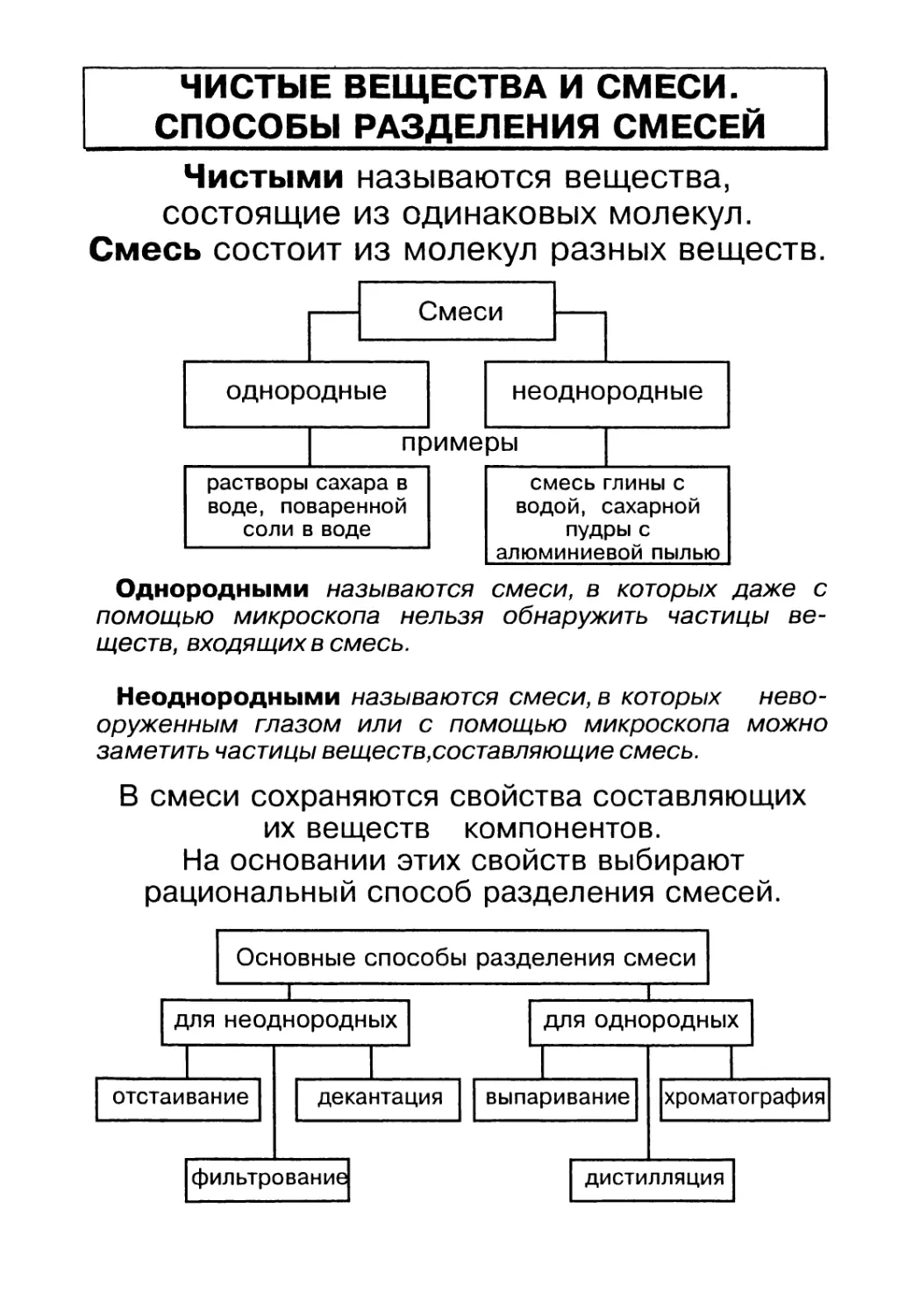
ЧИСТЫЕ ВЕЩЕСТВА И СМЕСИ.
СПОСОБЫ РАЗДЕЛЕНИЯ СМЕСЕЙ
Чистыми называются вещества,
состоящие из одинаковых молекул.
Смесь состоит из молекул разных веществ.
Однородными называются смеси, в которых даже с
помощью микроскопа нельзя обнаружить частицы ве-
ществ, входящих в смесь.
Неоднородными называются смеси, в которых нево-
оруженным глазом или с помощью микроскопа можно
заметить частицы веществ,составляющие смесь.
В смеси сохраняются свойства составляющих
их веществ компонентов.
На основании этих свойств выбирают
рациональный способ разделения смесей.
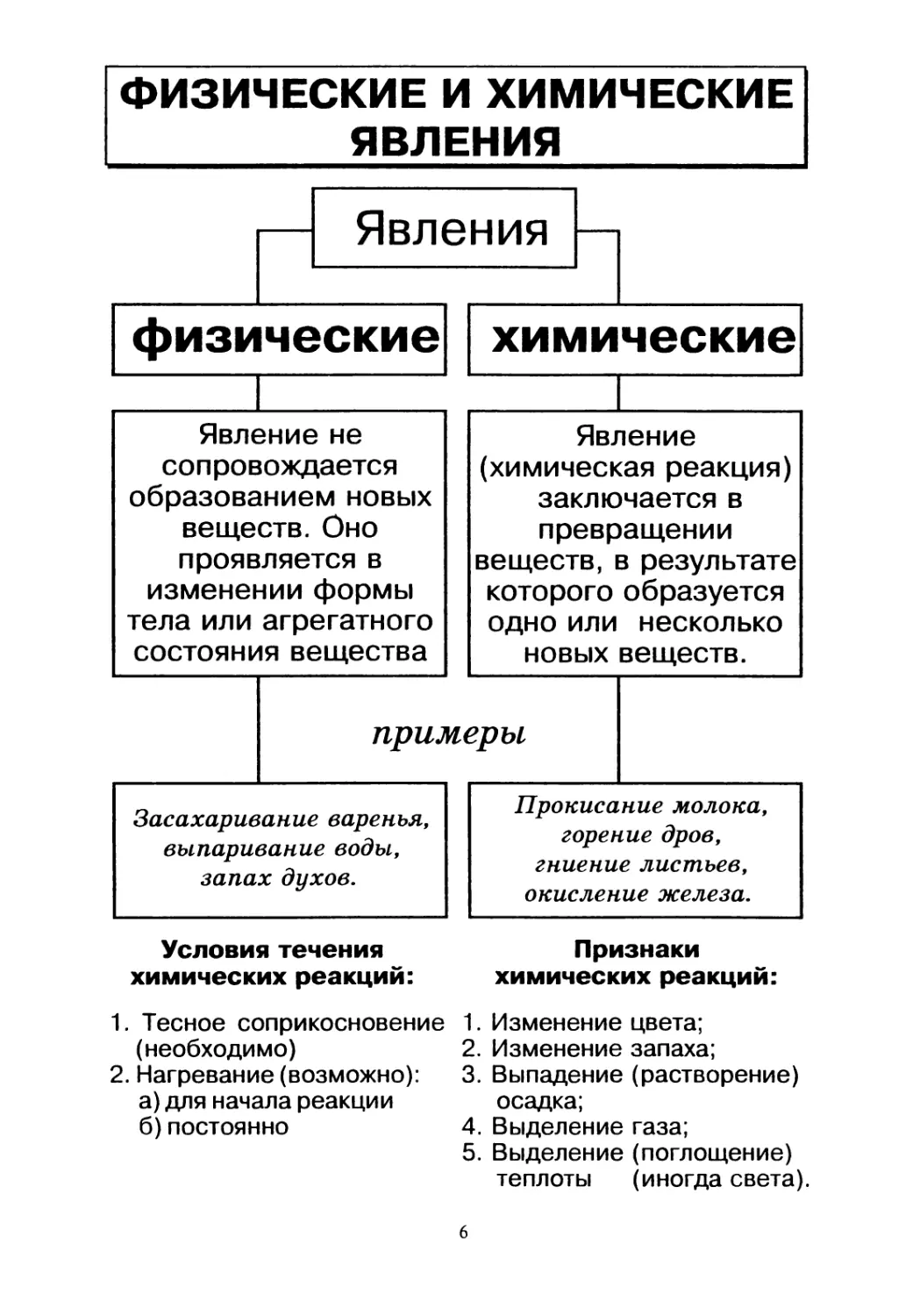
Условия течения
химических реакций:
1. Тесное соприкосновение
(необходимо)
2. Нагревание (возможно):
а) для начала реакции
б)постоянно
Признаки
химических реакций:
1. Изменение цвета;
2. Изменение запаха;
3. Выпадение (растворение)
осадка;
4. Выделение газа;
5. Выделение (поглощение)
теплоты (иногда света).
6
ХИМИЧЕСКИЙ ЭЛЕМЕНТ
Элемент (от лат. elementum стихия, первоначальное
вещество) составная часть сложного целого.
Советский энциклопедический словарь.
Элементарный. Начальный,
относящийся к основам чего-либо.
Ожегов С.И. Словарь русского языка.
Химический элемент составная часть вещества.
Роберт Бойль
Химический элемент это определенный вид атомов.
Джон Дальтон
Химический элемент - это вид атомов,
арактеризующийся определенным зарядом ядра,
строением электронных оболочек.
Число элементов ограничено, а их комбинации
дают все многообразие веществ.
В природе (на Земле) установлено существование
89 различных химических элементов.
Некоторые элементы получены искусственным путем
с использованием ядерных реакторов.
В настоящее время известно 110 хим. элементов.
"Вся сущность теоретического учения в химии лежит
в отвлеченном понятии об элементах. Найти их
свойства,определить причины их различия и сходства,
а потом, на основании этого, предугадать
свойства образуемых ими тел вот путь,
по которому идет эта наука...
Д.И.Менделеев
7
ХИМИЧЕСКИЕ СИМВОЛЫ
(ЗНАКИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ)
Алхимические
обозначения
Символы элементов и
соединений по Д. Дальтону
железо cf
воздух А
серебро О
вода V *=
огонь А
масло о°о£*
сера
свинец
земля V
стекло О—
водород ©
золото о
вода ©о
аммиак о®
о
серная кислота JgL Сто
метан СЖЗ
Современная химическая символика
разработана Й.Берцелиусом в 1814г.
Химический элемент обозначается
первой или первой и одной из последующих
букв латинского названия элемента.
Русское название Латинское название Символ Произно- шение
водород Hydrogenium H аш
калий Kalium К калий
медь Cuprum Cu купрум
углерод Carboneum C ЦЭ
кислород Oxygenium 0 о
сера Sulfur S эс
азот Nitrogenium N эн
хлор Chlorum Cl хлор
цинк Zincum Zn цинк
8
ЗНАКОМСТВО С СИМВОЛАМИ И
НАЗВАНИЯМИ ЭЛЕМЕНТОВ
I "Химические анаграммы"
Переставив буквы в каждом слове, надо получить
название химического элемента.
ЕЗЛЕОЖ
(без этого элемента вы не отрежете и куска хлеба)
елиКОДОР
(а без этого не проживете и десяти минут)
II "Крестики-нолики”
Зачеркните одной чертой в любом направлении
(по горизонтали, вертикали, диагонали)
три стоящих подряд химических элемента.
а) элементы-металлы б) элементы-неметаллы
К Са 0 CI Аи Нд
с N AI Си К Fe
Zn Ад Мд Si Р S
Al Н S N Си Ag
Р Si Na F Cl Mg
С Pb Cl Zn Hg 0
III Загадки
Если отбросить первую букву в моем названии,
я превращусь в напиток, если изменить первую
в другой химический элемент, а если
изменить третью букву - в церковь. Кто я?
IV Кроссворд
Заполните по
вертикали подходящие
пустые клетки русскими
названиями следующих
химических элементов:
P,Au,F,C,Cl,N,
Sn,Cr,Br,Ne,Rn
9
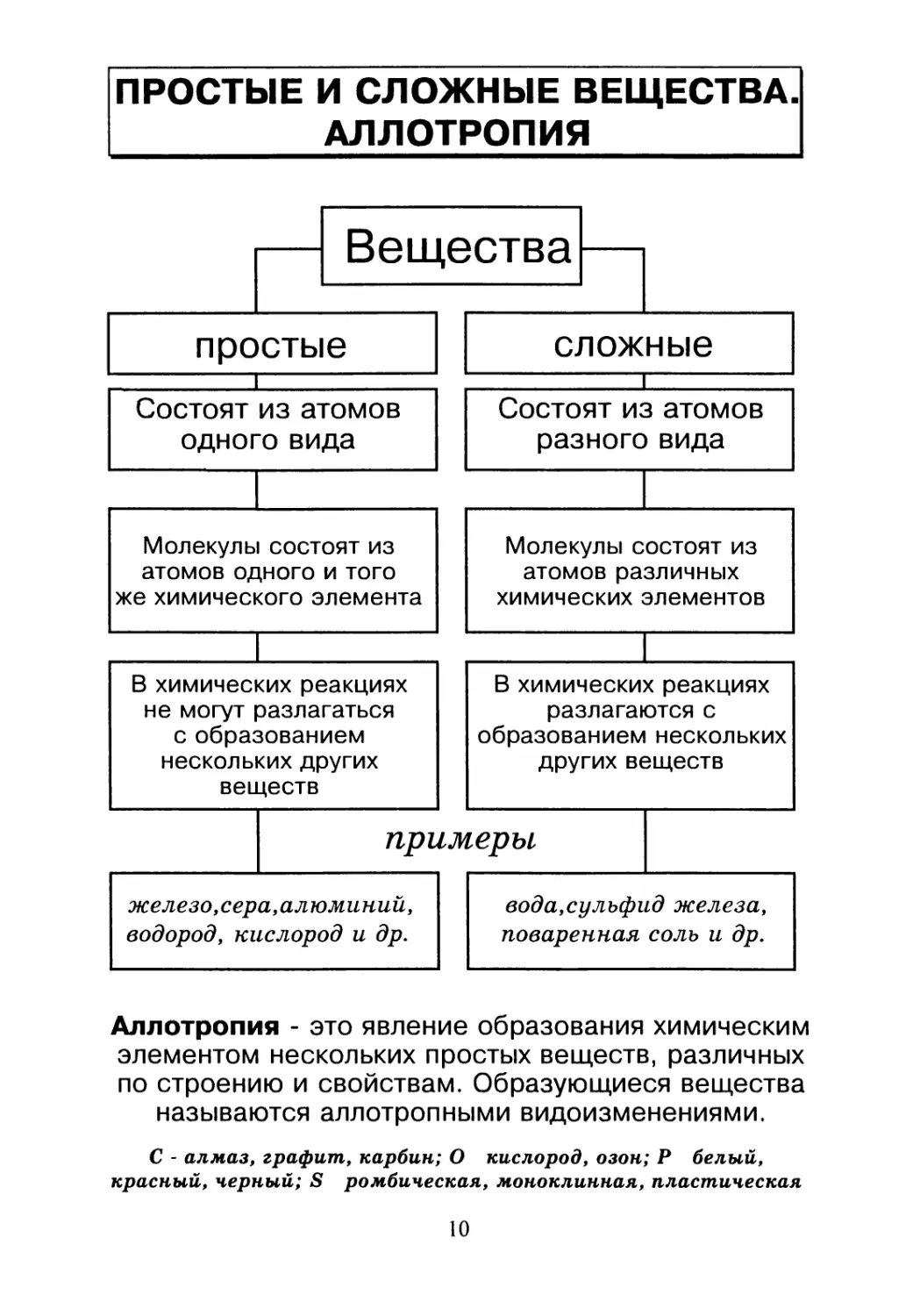
Аллотропия - это явление образования химическим
элементом нескольких простых веществ, различных
по строению и свойствам. Образующиеся вещества
называются аллотропными видоизменениями.
С - алмаз, графит, карбин; О кислород, озон; Р белый,
красный, черный; S ромбическая, моноклинная, пластическая
10
ХИМИЧЕСКИЕ ФОРМУЛЫ
Химическая формула - это условная
запись состава вещества посредством
химических знаков и индексов.
(Индекс - цифра, стоящая справа внизу от
символа. Обозначает число атомов в молекуле)
Химические формулы
символы
Н2О
со2
индексы
воды
углекислого
газа
Химическая формула показывает, атомы
каких элементов и в каких относительных
количествах соединены между собой.
Чтение формулы
Н2О — аш два о
С02
цэ о два
II
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
масса атома водорода равна
0,000 000 000 000 000 000 000 001 67г
Для выражения масс порядка атомных была
выбрана специальная единица массы,
названная атомной единицей массы (а.е.м.)
Атомная единица массы
представляет собой величину,
равную 1,66х1024г это 1/12
массы атома углерода,
обозначается а.е.м.
Относительная атомная масса
обозначается символом Аг
(индекс "г" relative -
"относительный").
Относительная атомная масса элемента есть
отношение массы атома данного элемента к 1/12
массы атома углерода. Это безразмерная величина.
Относительная атомная масса.
Аг(э)- т-О)
Аг(э)- та(с)
2.66-10'23 г
Аг(О)=----------тг =16 т(0)= 16 а.е.м.
0.166-10 г
Значение относительной атомной массы, и массы
атома, выраженной в а.е.м.,численно совпадают.
12
ОТНОСИТЕЛЬНАЯ
МОЛЕКУЛЯРНАЯ МАССА
Относительная молекулярная масса вещества
показывает, во сколько раз масса молекулы
данного вещества больше
1/12 массы атома углерода.
Обозначается символом Mr
(индекс "г" relative - "относительный").
гл т, Г
Мг-1/12та(с),г
m масса молекулы данного вещества
та(с) масса атома углерода
Mr = х Аг(Э)
Относительная молекулярная масса
вещества равна сумме относительных
атомных масс с учетом индексов.
Мг(НгО) = 2-Аг(Н) + 1 -Аг(О) =
= 2-1 + 1-16 = 18
Мг(СОг) = 1 -Аг(С) + 2-Аг(О) =
= 1-12 + 2-16 = 44
13
ЗАКОН ПОСТОЯНСТВА СОСТАВА
"От одного полюса Земли до другого соединения имеют
одинаковый состав и одинаковые свойства. Никакой
разницы нет между окисью железа Южного полуша рия
и Северного. Малахит из Сибири имеет тот же состав,
как и малахит из Испании. Во всем мире есть лишь одна
Ж.Л.Пру ст 1808 г.
СЕЛИТРА! = СЕЛИТРА:
ХаКОз
Каждое химически чистое вещество, независимо
от места нахождения и способа получения,
имеет один и тот же постоянный состав.
14
МАССОВЫЕ ОТНОШЕНИЯ
Атомы элементов соединяются, образуя
химическое соединение, только
в определенных массовых отношениях.
FeS сульфид железа
m(Fe) : m(S) = Ar(Fe) : Ar(S) =
= 56 : 32 = 7 : 4
Чтобы получить сульфид железа (FeS)
необходимо смешать порошки железа
и серы в массовых отношениях 7 4.
Если взятые количества исходных веществ
не соответствуют их соотношению в
химической формуле соединения,
одно из них остается в избытке.
Если взять 10 г железа и 4 г серы, то после
реакции останется 3 г железа, которые не
вступили в химическую реакцию.
15
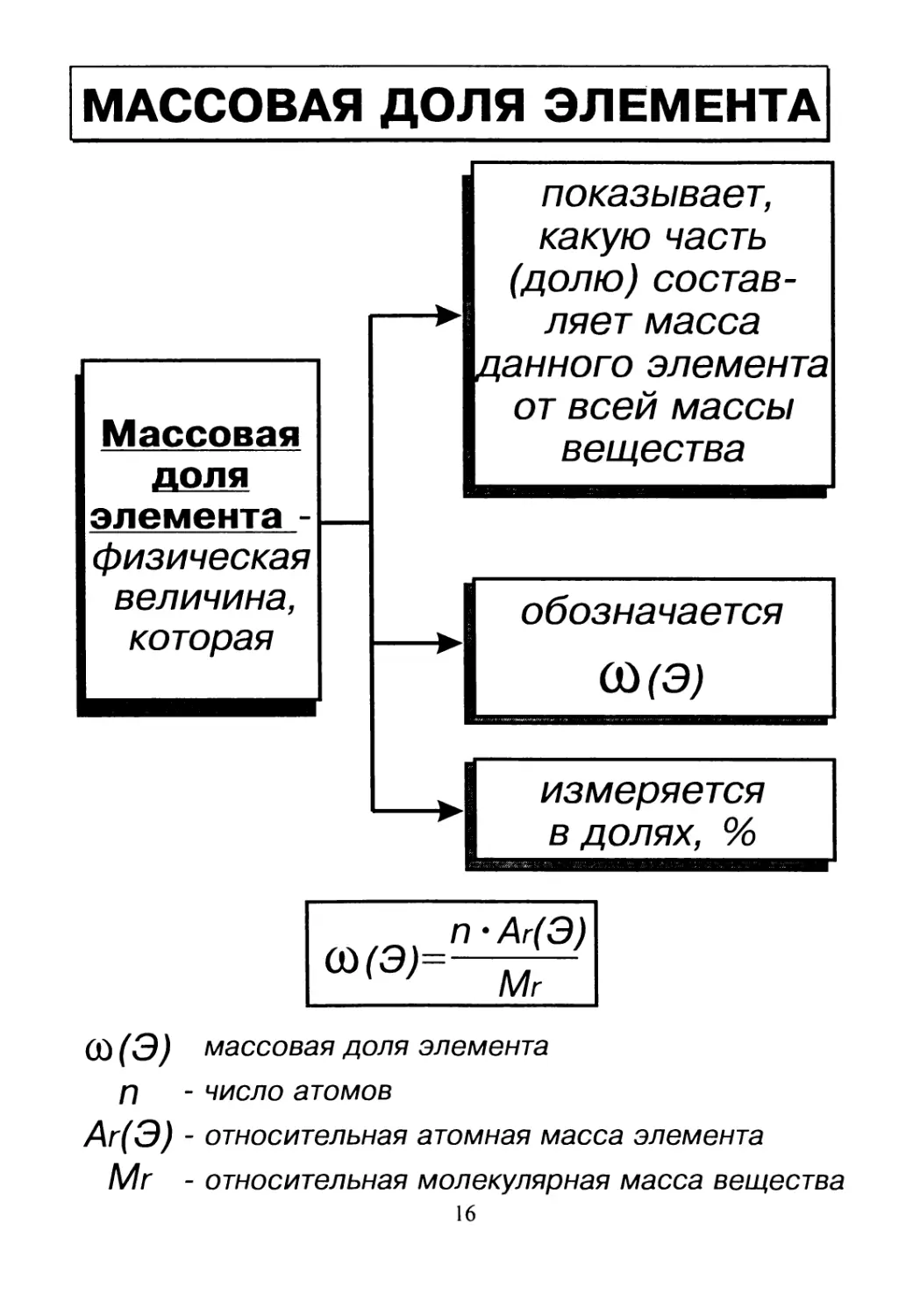
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА
—
Массовая
доля
элемента -
физическая
величина,
которая
показывает,
какую часть
(долю) состав-
ляет масса
данного элемента
от всей массы
вещества
обозначается
(£>(Э)
измеряется
в долях, %
(Л(Э) массовая доля элемента
П - число атомов
Аг(Э) - относительная атомная масса элемента
Mr - относительная молекулярная масса вещества
16
ВЫВОД ХИМИЧЕСКОЙ ФОРМУЛЫ ВЕЩЕСТВА
ПО ИЗВЕСТНОЙ МАССОВОЙ ДОЛЕ
Алгоритм решения Пример
1. Обозначить формулу соединения
с индексами (х, у, z).
AxByCz
2. Рассчитать отношение х:у:г
через массовые доли элемента
х-Аг(А) (Р(А)-Мг
Mr (AxByCz) v * * * * х Аг(А)
П(В)= у-лг(В) => асврмг
ш7 Mr (AxByCz ) у Аг (В)
ffi,C)= Z'Ar(C) (P(C)SMr
Ш(С7 Mr (AxByCz) z Ar (С)
v и ~ - ®(А) . ®(B) . ®(c)
Л у Ar(A) ' Ar(B) ' Ar(C)
3. Полученные цифры поделить или
умножить на одно и то же число для
получения целых чисел х, у, г.
4. Записать формулу.
Вывести химическую формулу питьевой
соды. Вещество содержит 27,38% Na,
1,19% Н, 14,29% С, и 57,14% О.
Решение:
1. Nax Ну Сz Ои
2. x у : г и =
= (P(Na). (Р(Н) . (Р(С) . (Р(О) =
Ar(Na): Аг(Н) : Аг(С) : Аг(О)
27,38 . 1,19 . 14,29 . 57,14
23 * 1 ‘ 12 ‘ 16
= 1,19 1,19 1,19 3,57
3. Поделить все полученные числа на
самое маленькое 1,19.
X у : 2 U = 1 1 1 3
4. Na Н С ОЗ формула питьевой соды
(Задачу целесообразно решать с
помощью микрокалькулятора)
ВАЛЕНТНОСТЬ
Валентность элемента - это способность его
атомов присоединять определенное число
атомов других химических элементов.
За единицу валентности принимают валентность
водорода. Валентность обозначается римскими
цифрами, записывается над символами элементов.
Валентность элемента можно
определить на основании его положения
в периодической системе элементов
Д.И.Менделеева:
Группы элементов
I II III IV V
11 12 13 14 15
Na Mg Al Si p
22,98 24,305 26,98 28,08 31,008
19
К
39,09
высшая валентность элемента, как правило,
равна номеру группы N;
I II III IV V (высшая)
Na Mg Al Si P
I III ( низшая )
К P
у элементов-неметаллов низшая
валентность определяется по формуле
р? N\,zde N номер группы.
18
СОСТАВЛЕНИЕ ХИМИЧЕСКИХ
ФОРМУЛ БИНАРНЫХ СОЕДИНЕНИЙ
(ПО ВАЛЕНТНОСТИ ЭЛЕМЕНТОВ)
Алгоритм решения Пример
1. Запишите символы элементов (согласно ряду электроотрицательности). А1 О
2. Запишите валентности элементов (по периодической системе). А1 О
3. Найдите наименьшее общее кратное (н.о.к.) между числовыми значениями валентности. [6] III II А1 О н.о.к.=6
4. Найдите отношение между атомами элементов (деля н.о.к. на соответствующую валентность). Полученные числа являются индексами. (6] III II А1 О 6 з = 2 _ „ „ 6 2=3 2 3
5. Запишите формулу вещества. Ah Оз
19
ХИМИЧЕСКОЕ УРАВНЕНИЕ
Химическим уравнением называют условную
запись химической реакции посредством
химических формул и математических знаков.
Оно показывает, какие вещества и в каких
количествах вступили и получились
в результате химической реакции.
электрический
ток
2Н20 = 02 + 2Н2
атом атом
кислорода водорода
В уравнениях химических реакций число
атомов каждого элемента слева и справа
от знака равенства должно быть одинаково.
20
ХИМИЧЕСКИЕ УРАВНЕНИЯ
Алгоритм составления химического уравнения Уравнение химической реакции между водородом и кислородом
1. Составить схему взаимодействия: слева записать формулы веществ, вступивших в реакцию,справа получившихся, соеденив их знаком ”+" 1. Н2 + О2 => Н2О В реакцию вступают 2 простых вещества,получается 1 сложное вещество.
2. Подобрать коэффициенты для каждого вещества так,чтобы число атомов каждого элемента в левой части было равно числу атомов этого элемента в правой части. 2. а) уравнять число атомов кисло- рода,поставив коэффициент 2 перед формулой воды. б) уравнять число атомов водо- рода,поставив коэффициент 2 перед формулой водорода. 2Нз + О2 => 2НзО
3. Проверить число атомов каждого элемента в левой и правой частях уравнения. Поставить знак равно ("= "). п(Н) = 2-2=4 п(0) = 1-2=2 2Н2 + О2 = 2НгО
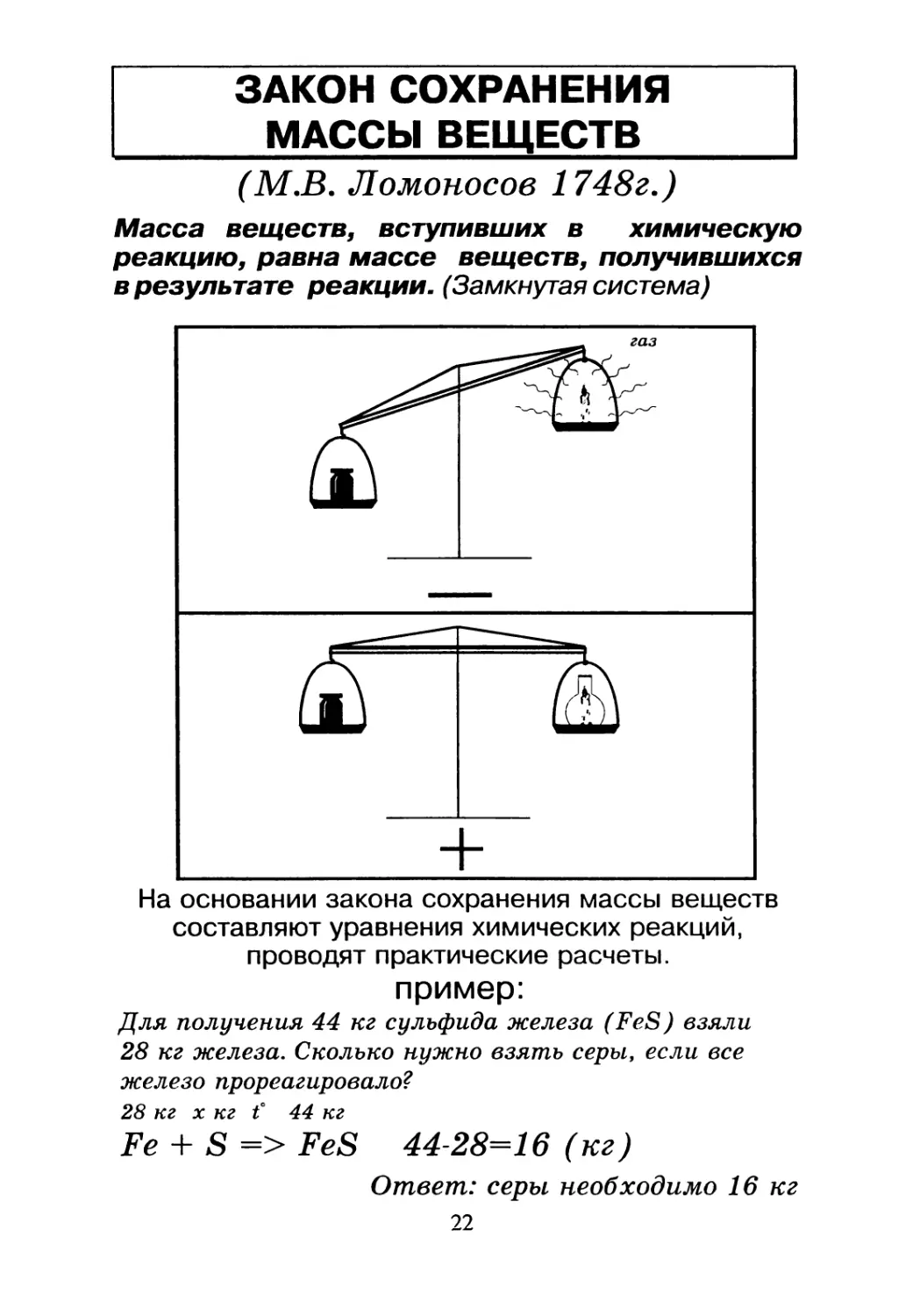
ЗАКОН СОХРАНЕНИЯ
_______МАССЫ ВЕЩЕСТВ___________
(М.В. Ломоносов 1748г.)
Масса веществ, вступивших в химическую
реакцию, равна массе веществ, получившихся
в результате реакции. (Замкнутая система)
На основании закона сохранения массы веществ
составляют уравнения химических реакций,
проводят практические расчеты.
пример:
Для получения 44 кг сульфида железа (FeS) взяли
28 кг железа. Сколько нужно взять серы, если все
железо прореагировало?
28 кг х кг t° 44 кг
Fe + S => FeS 44-28=16 (кг)
Ответ: серы, необходимо 16 кг
22
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИИ
X и м и ческиереакции | Г -> разложения реакция, в которой из одного сложного вещества получаются несколько простых или сложных веществ. пример: 2Н2О=2Н2^+О2^ ЭЛ. ток
соединения реакция,в результате которой из двух или нескольких простых ил и сложных веществ получается одно сложное вещество. пример: Ге + S => FeS
замещения реакция,протекающая между простым и сложным веществами, при которой атомы простого вещества замещают атомы одного из элементов сложного вещества f пример: СиО+Н2=Си+Н2О
обмена реакция, протекающая между сложными веществами, при которой они обмениваются составными частями. пример: ГегОз + 6НС1 = 2РеС1з + ЗН2О
23
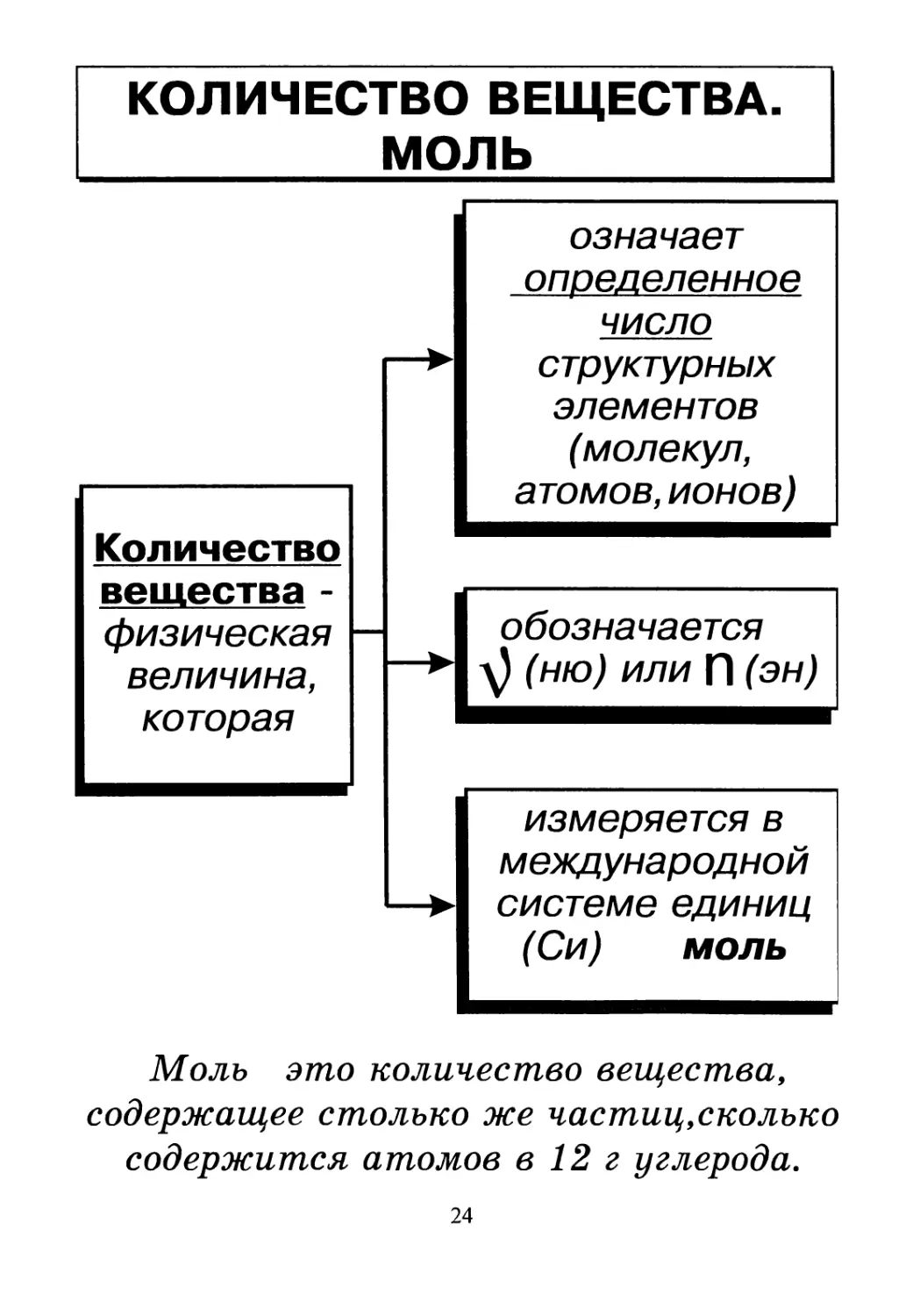
КОЛИЧЕСТВО ВЕЩЕСТВА.
МОЛЬ
означает
определенное
число
структурных
элементов
(молекул,
атомов, ионов)
Количество
вещества -
физическая
величина,
которая
обозначается
измеряется в
международной
системе единиц
(Си) моль
Моль это количество вещества,
содержащее столько же частиц,сколько
содержится атомов в 12 г углерода.
24
25
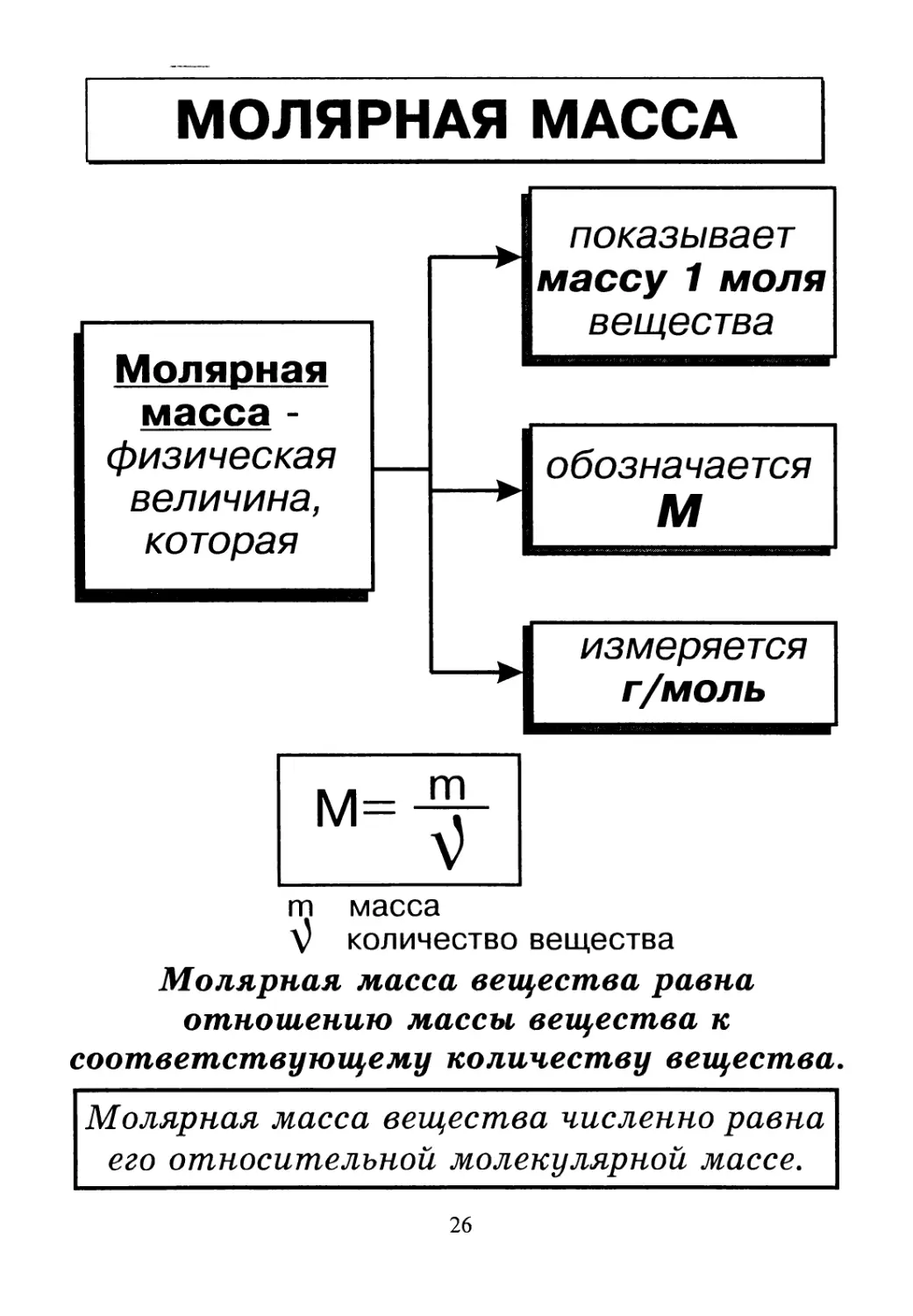
МОЛЯРНАЯ МАССА
m масса
\) количество вещества
Молярная масса вещества равна
отношению массы вещества к
соответствующему количеству вещества.
Молярная масса вещества численно равна
его относительной молекулярной массе.
26
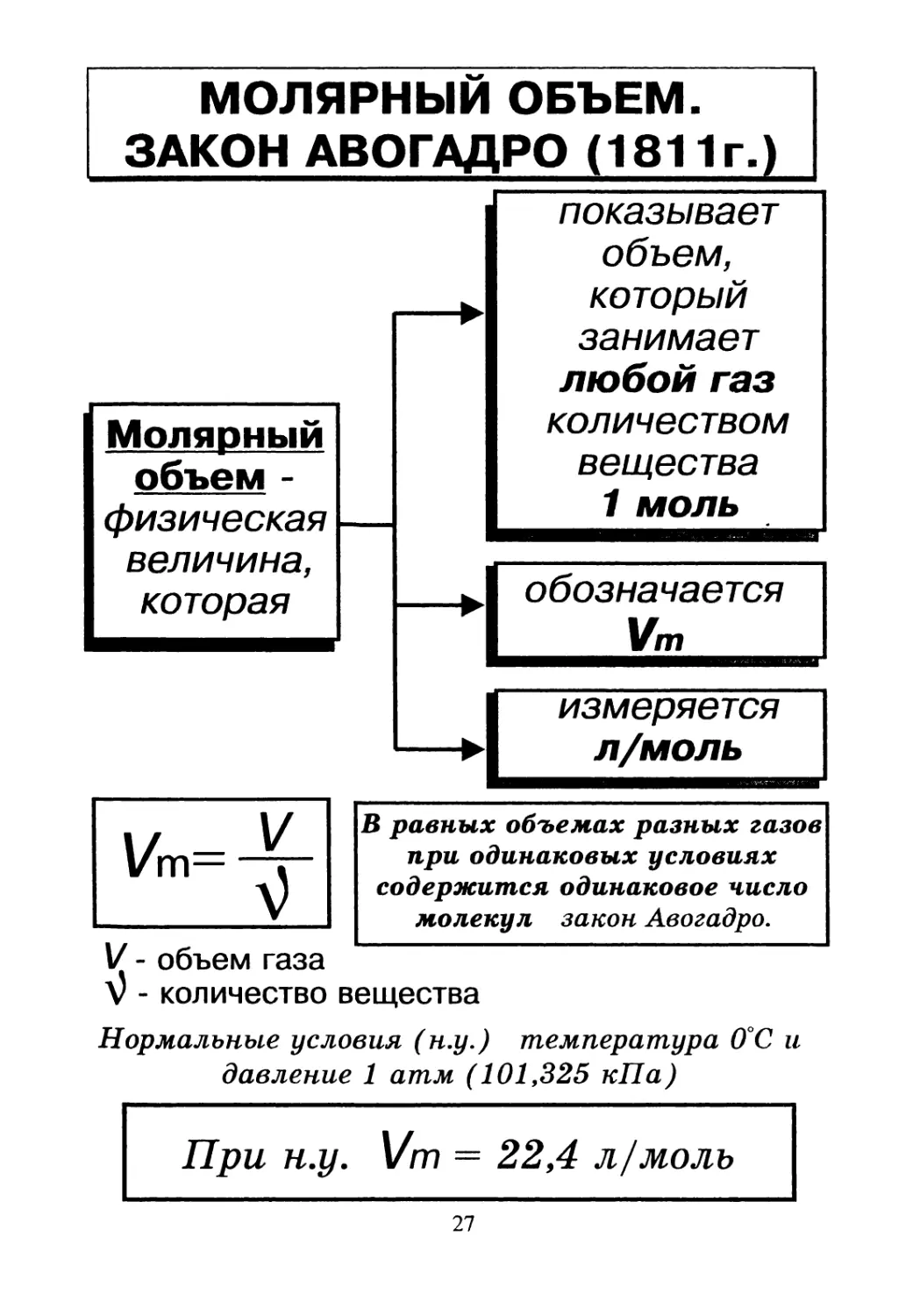
МОЛЯРНЫЙ ОБЪЕМ.
ЗАКОН АВОГАДРО (1811г.)
Молярный
объем -
физическая
величина,
которая
показывает
объем,
который
занимает
любой газ
количеством
вещества
1 моль
обозначается
Vm
измеряется
л/моль
l/m=
В равных объемах разных газов
при одинаковых условиях
содержится одинаковое число
молекул закон Авогадро.
вещества
V - объем газа
v - количество
Нормальные условия (н.у.) температура 0°С и
давление 1 атм (101,325 кПа)
При н.у. Vm — 22,4 л/моль
27
ОТНОСИТЕЛЬНАЯ
ПЛОТНОСТЬ ГАЗОВ
Относитель-
ная плотность
газов -
физическая
величина,
которая
показывает,
во сколько раз
1 моль одного
газа тяжелее
или легче 1 моля
другого газа
обозначается
D
безразмерная
величина
П м м
Uh“ М(н2) 2
=_м
возд 29
М молярная масса исследуемого вещества
М(нг) молярная масса водорода
29 средняя молекулярная масса воздуха
D(h2) плотность по водороду
Овозд -плотность по воздуху
28
РЕШЕНИЕ ЗАДАЧ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ
(с помощью пропорции)
Алгоритм решения Пример
1. Составить уравнение химической реакции. 2. В уравнении одной чертой подчеркнуть формулы веществ,массы (объемы) которых ука- заны в условии, двумя чертами формулы веществ,массы (объемы) которых требуется вычислить. 3. Что дано записать над формулами веществ. 4а. Под формулами записать: 1) количество вещества (\)),определяется по коэффициентам уравнения; 2) молярную массу (М), рассчитывается через Mr. 3) массу вещества (m) ,т=М- V 46. 1) количество вещества (\)); 2) молярный объем для газов при н.у. (Vm) Vm=22,4 л/моль 3) объем газа (V),V=Vm- 5. Составить пропорцию. 6. Решить пропорцию. 7. Записать ответ. Рассчитать, какой объем кислорода (н.у.) вступит в реакцию с оксидом серы (IV) массой 6,4 г. 2SO2 + Оз = 2SO3 6,4 г X л 2SO3 + Оз = 2SO3 \) = 2 моль \) = 1 моль М=64 г/молъ Ут=22,4 л/моль т=128 г '=22,4 л 6,4 = X 128 22,4 Х= 6,4.'2O2’4 = 1’12 W IZo ОТВЕТ: в реакцию вступит 1,12 л кислорода.
РЕШЕНИЕ ЗАДАЧ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ
(по количеству вещества)
Алгоритм решения Пример
1. Составить уравнение химической реакции. 2. В уравнении одной чертой подчеркнуть формулы веществ,массы (объемы) которых ука- заны в условии,двумя чертами формулы веществ,массы (объемы) которых требуется вычислить. 3. Что дано записать над формулами веществ. 4. Под формулами записать количество вещества (\)), определяется по коэффициентам уравнения. 5. Рассчитать,какое количество вещества (в молях) составляет масса (объем) вещества, указанного в условии задачи S (\) = Vm=22,4 л/моль) V m 6. По уравнению определить количество вещества (в молях) искомого вещества. 7. Определить объем (массу) искомого вещества 4 V=VVm (m= \)М) 8. Записать ответ. Рассчитать, какой объем кислорода (н.у.) вступит в реакцию с оксидом серы (IV) массой 6,4 г. 2SO2 + O2 = 2SO3 2SQ2 + О2 = 280з 6,4 г X л 2SO2 + 02 = 2SO3 \) = 2 моль \) = 1 моль 6,4 г п 1 —- =0,1 моль 64 г/моль 0,1 моль —> Y моль 2SO2 + 0^ = 280з 2 моль —> 1 моль Y = 0,05 моль 0,05 моль 22,4 л/моль=1,12 л Ответ: В реакцию вступит 1,12 л кислорода
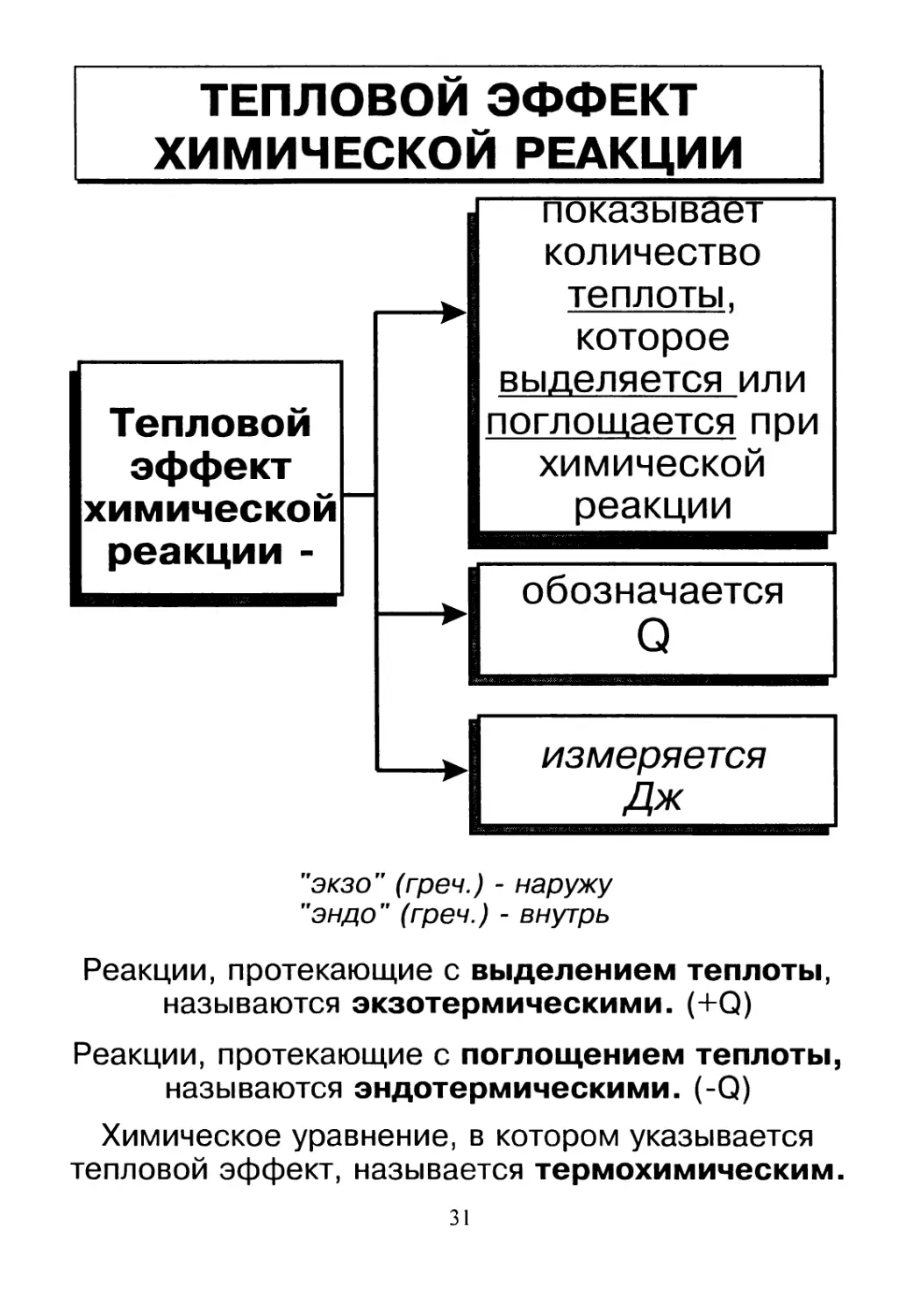
ТЕПЛОВОЙ ЭФФЕКТ
ХИМИЧЕСКОЙ РЕАКЦИИ
Тепловой
эффект
химической
реакции -
показывает
количество
теплоты,
которое
выделяется или
поглощается при
химической
реакции
обозначается
Q
измеряется
Дж
"экзо” (греч.) - наружу
"эндо” (греч.) - внутрь
Реакции, протекающие с выделением теплоты,
называются экзотермическими. (+Q)
Реакции, протекающие с поглощением теплоты,
называются эндотермическими. (-Q)
Химическое уравнение, в котором указывается
тепловой эффект, называется термохимическим.
31
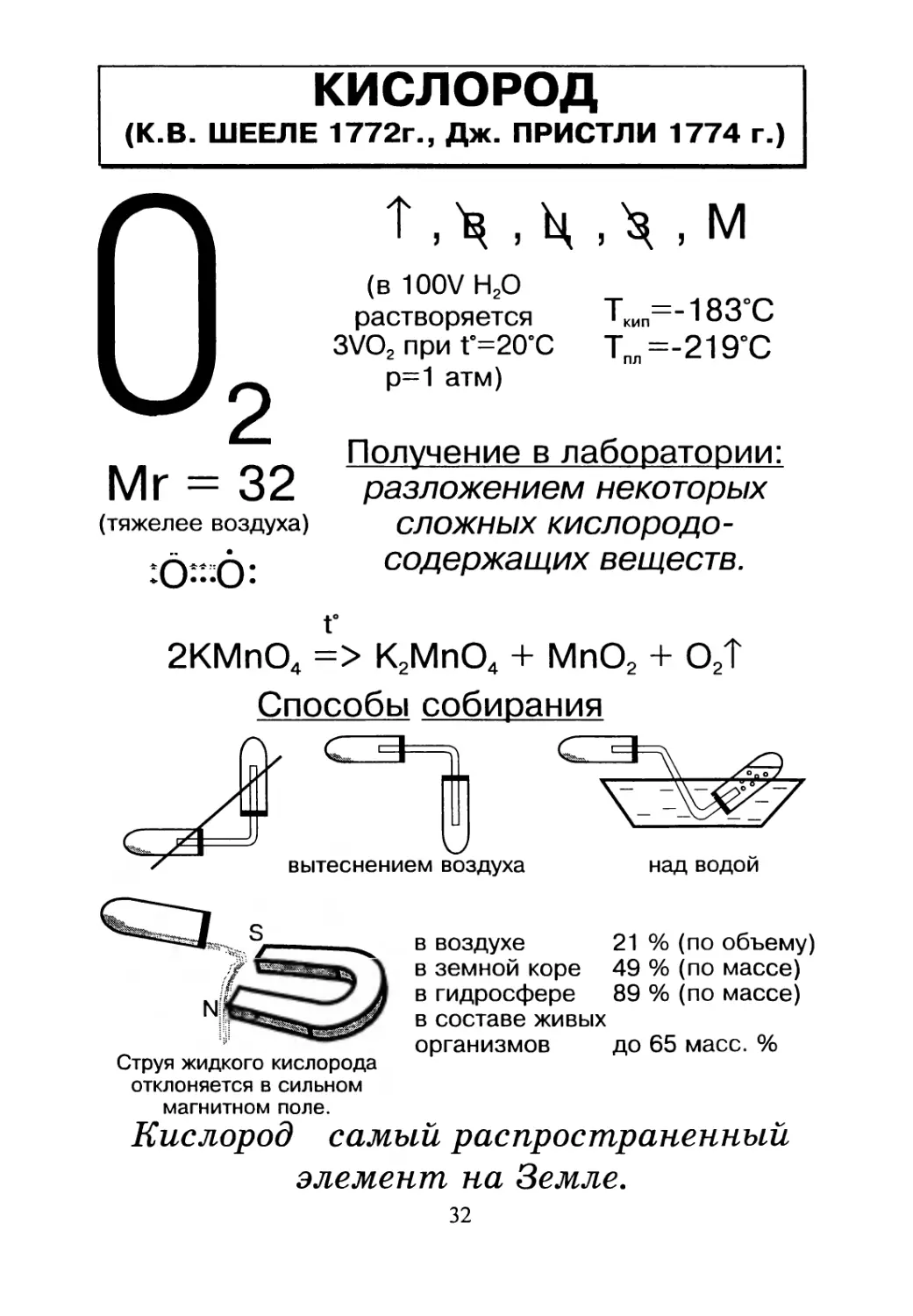
КИСЛОРОД
(К.В. ШЕЕЛЕ 1772г., Дж. ПРИСТЛИ 1774 г.)
Mr = 32
(тяжелее воздуха)
(в 100V Н20
растворяется
3VO2 при Г=20°С
р=1 атм)
ТКИП=-183°С
ТПЛ=-219°С
Получение в лаборатории:
разложением некоторых
сложных кислородо-
содержащих веществ.
г
2КМпО4 => К2МпО4 + МпО2 + 02Т
Способы собирания
в воздухе 21 % (по объему)
в земной коре 49 % (по массе)
в гидросфере 89 % (по массе)
в составе живых
организмов до 65 масс. %
Струя жидкого кислорода
отклоняется в сильном
магнитном поле.
Кислород самый распространенный
элемент на Земле.
32
КИСЛОРОД
ХИМИЧЕСКИЕ СВОЙСТВА
Взаимодействие веществ с кислородом
называется реакцией окисления.
Реагирует со всеми простыми веществами
кроме He,Ne,Ar,Au,Pt.
с неметаллами с металлами
S + 02 — S02 С ”1” 02 — С02 2Н2 + 02 = 2Н2О (взрыв) N2 + 02 = 2N0 (t*>1200'C) сгорают 2Мд + 02 = 2МдО 3Fe + 2О2 = Fe3O4 окисляются 2Cu + 02 = 2СиО
со сложными веществами
2H2S + ЗО2 = 2SO2 + 2Н2О сероводород СН4 + 2О2 = С02 + 2Н2О метан 4FeS2 + 1102 = 2Fe2O3 + 8SO2 £ с. с. и С. пирит
В реакциях со всеми веществами
(кроме фтора) всегда окислитель.
33
озон.
(Аллотропная модификация кислорода)
"ОЗОН” (греч.) -
пахнущий
т , з , ц , М
(голубой)
Неустойчив О3 = О2 + О
34
ВОЗДУХ
Воздух смесь газов.
(1774 г. А.Лавуазъе)
п О с т О я н н ы Е Азот Кислород Инертные газы (гелий Не, неон Ne, аргон Аг, криптон Кг, ксенон Хе) по объёму
78 % 21 % 0,94 %
п Е Р Е М Е Н Н ы Е Углекислый газ (СО2) Водяной пар (Н2О) 0,02 - 0,04 % до 3 %
С л У ч А Й Н Ы Е Оксиды азота (NO, NO2) Оксиды серы (SO2, SO3) Сероводород (H2S) * ПДК < 0,00001 %
ПДК (предельно допустимая концентрация) max количество
вещества в единице объёма, которое при длительном каждодневном
воздействии не оказывает отрицательного действия на организм
человека и не влияет на здоровье будущего потомства.
35
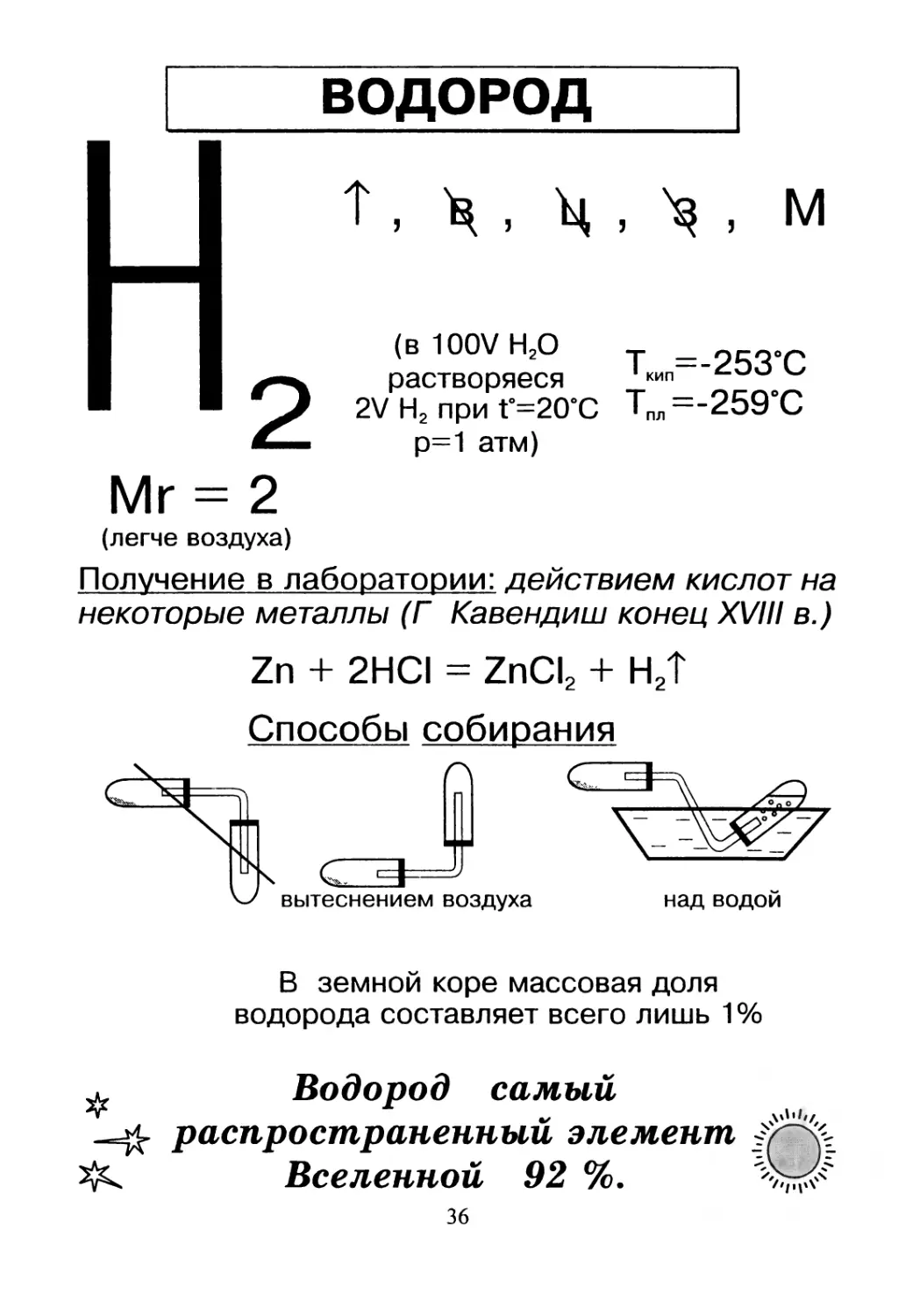
ВОДОРОД
т, X , X , X - М
(в 100V Н2О т =
растворяеся кип
2V Н2 при Г=20°С Тпл =-259°С
р=1 атм)
Mr = 2
(легче воздуха)
Получение в лаборатории: действием кислот на
некоторые металлы (Г Кавендиш конец XVIII в.)
Zn + 2HCI = ZnCI2 + Н2Т
Способы собирания
над водой
В земной коре массовая доля
водорода составляет всего лишь 1%
Водород самый
распространенный элемент
Вселенной 92 %.
36
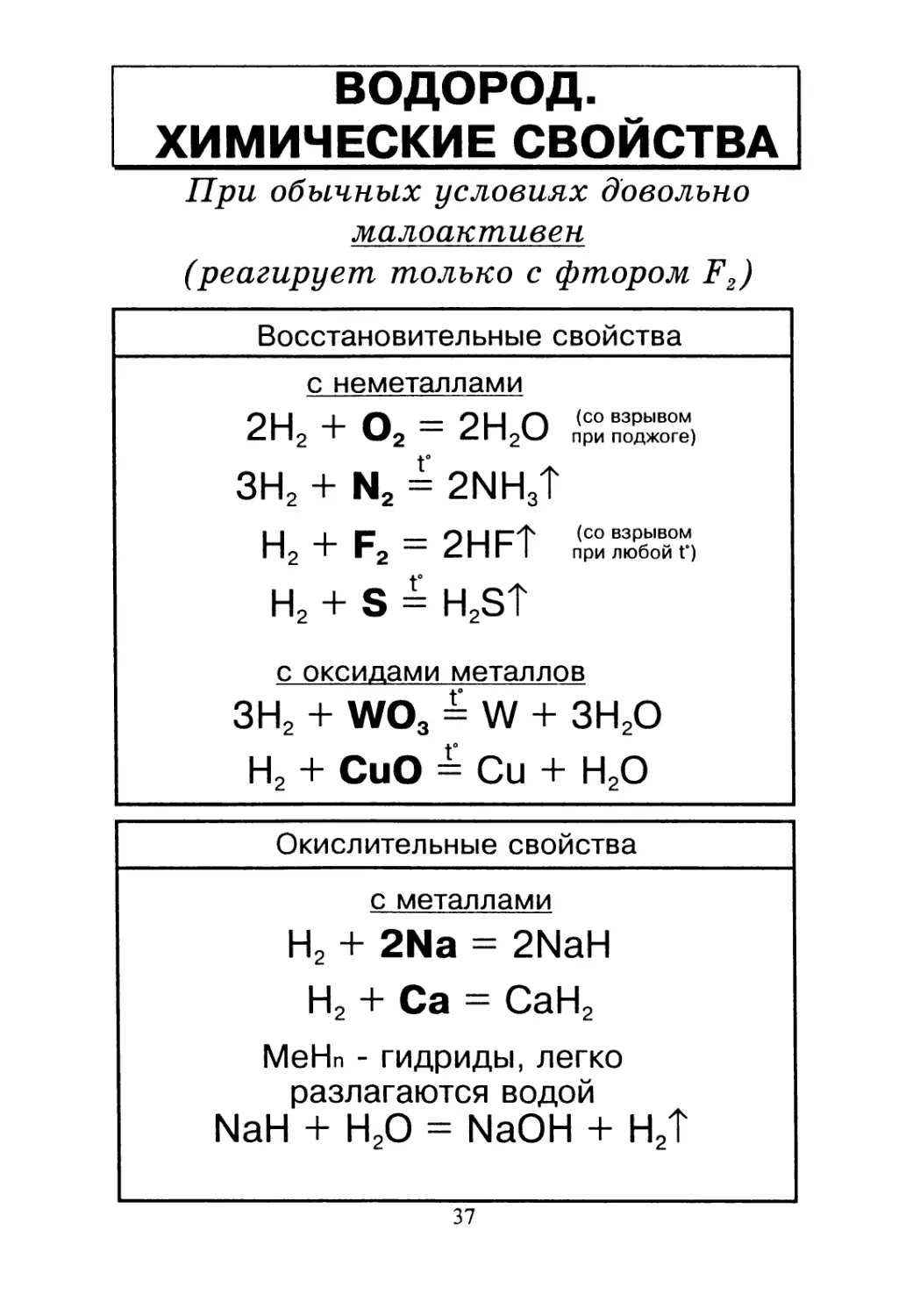
ВОДОРОД.
ХИМИЧЕСКИЕ СВОЙСТВА
При обычных условиях довольно
малоактивен
(реагирует только с фтором F2)
Восстановительные свойства
с неметаллами
Qii । Л _ Qll Q (со взрывом
^-П 2 * v#2 при поджоге)
ЗН2 + N2 = 2NH3?
HI г; О LI сф (со ВЗРЫВОМ
2 • >2 tnr I при любой Г)
Н2 + S = H2S?
с оксидами металлов
ЗН2 + W03 = W + ЗН2О
Н2 + СиО = Си + Н2О
Окислительные свойства
с металлами
Н2 + 2Na = 2NaH
Н2 + Са = СаН2
МеНп - гидриды, легко
разлагаются водой
NaH + Н20 = NaOH + Н2Т
37
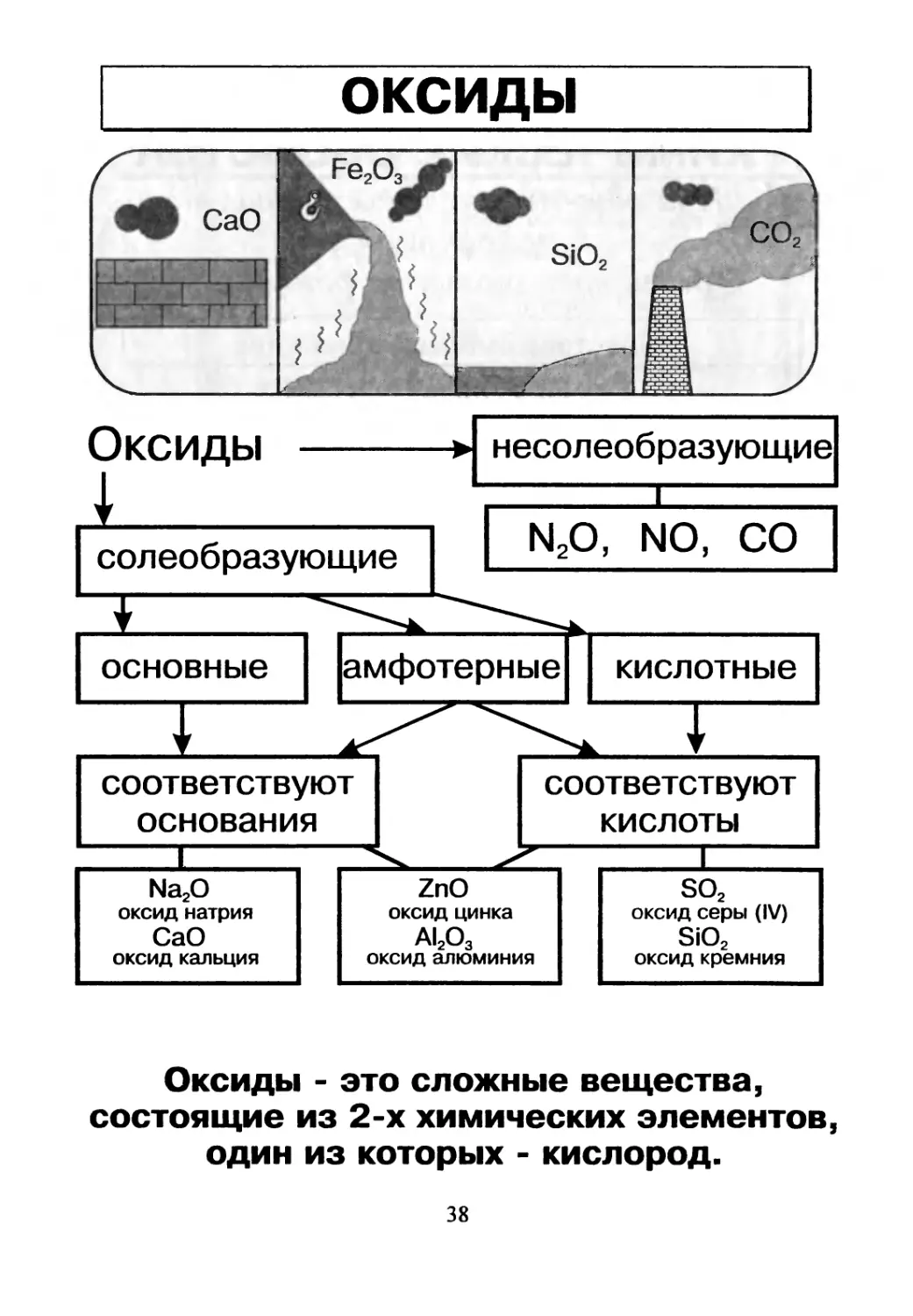
оксиды
Оксиды - это сложные вещества,
состоящие из 2-х химических элементов,
один из которых - кислород.
38
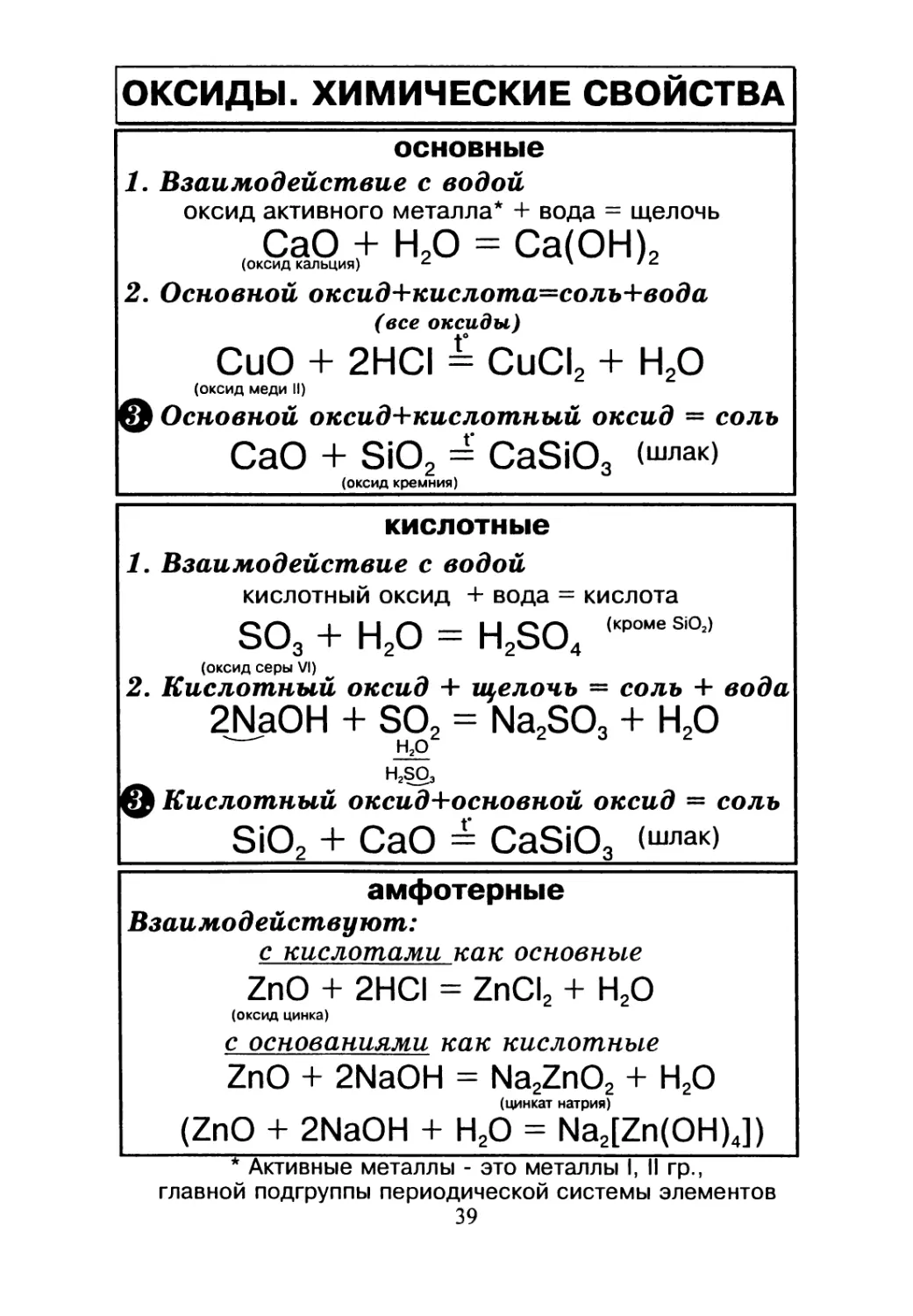
ОКСИДЫ. ХИМИЧЕСКИЕ СВОЙСТВА
основные
1. Взаимодействие с водой
оксид активного металла* + вода = щелочь
СаО + Н2О = Са(ОН)2
(оксид кальция) \
2. Основной оксид+кислота=соль+вода
(все оксиды)
CuO + 2HCI = СиС12 + Н2О
(оксид меди II)
© Основной оксид+кислотный оксид = соль
СаО + SiO2 = CaSiO3 (шлак)
о
(оксид кремния)
кислотные
1. Взаимодействие с водой
кислотный оксид + вода = кислота
S03 + Н2О = H2SO4 s'011
2. Кислотный оксид + щелочь = соль + вода
2JMaOH + S02 = Na2SO3 + Н20
Н2О
H^SO3
© Кислотный оксид+основной оксид = соль
SiO2 + СаО = CaSiO3 <шлак)
амфотерные
Взаимодействуют:
с кислотами как основные
ZnO + 2HCI = ZnCI2 + Н20
(оксид цинка)
с основаниями как кислотные
ZnO + 2NaOH = Na2ZnO2 + Н20
(цинкат натрия)
(ZnO + 2NaOH + Н20 = Na2[Zn(OH)4])
* Активные металлы - это металлы I, II гр.,
главной подгруппы периодической системы элементов
39
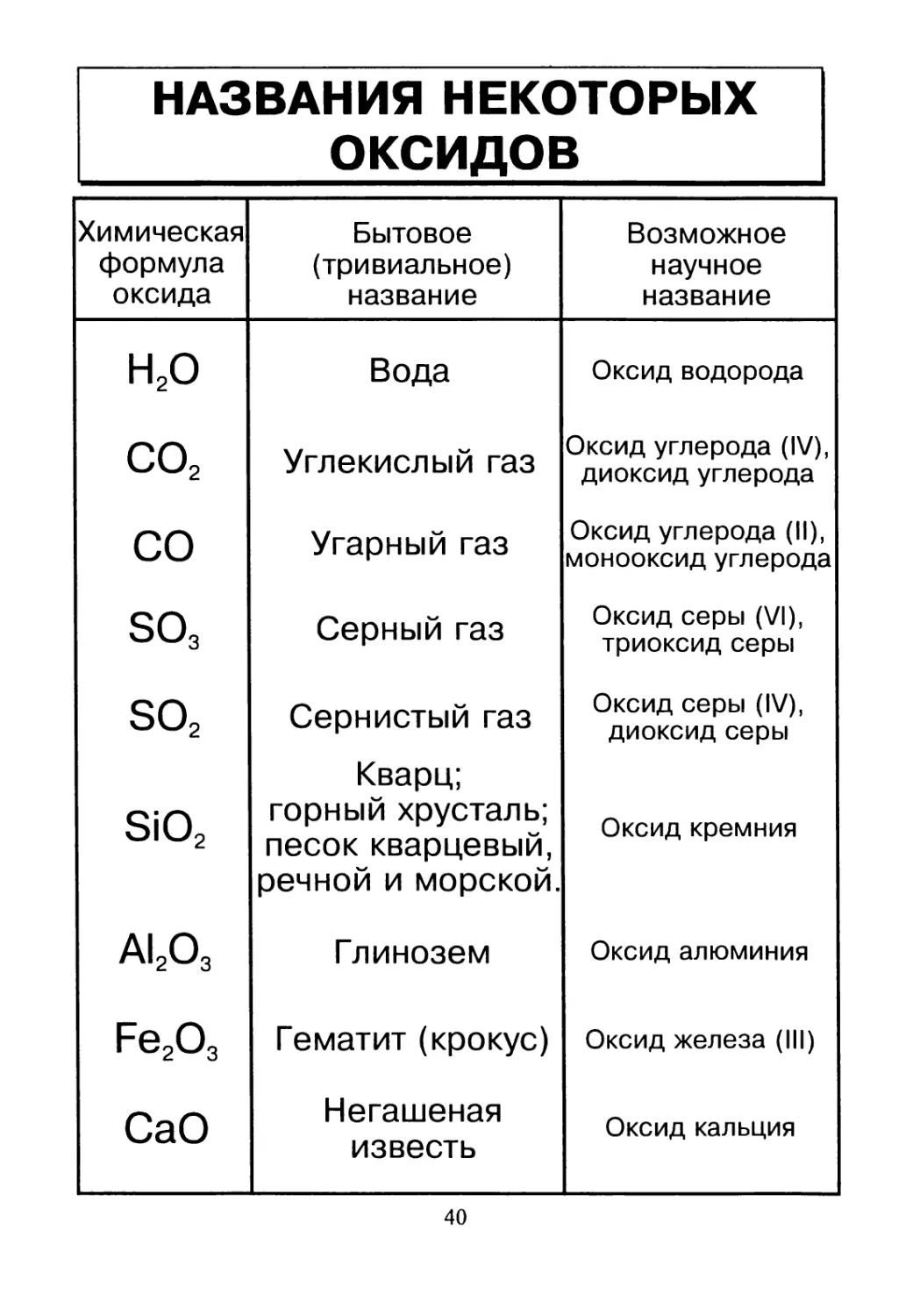
НАЗВАНИЯ НЕКОТОРЫХ
ОКСИДОВ
Химическая формула оксида Бытовое (тривиальное) название Возможное научное название
Н2О Вода Оксид водорода
со2 Углекислый газ Оксид углерода (IV), диоксид углерода
со Угарный газ Оксид углерода (II), монооксид углерода
so3 Серный газ Оксид серы (VI), триоксид серы
so2 Сернистый газ Оксид серы (IV), диоксид серы
SiO2 Кварц; горный хрусталь; песок кварцевый, речной и морской. Оксид кремния
AI2O3 Глинозем Оксид алюминия
Fe2O3 Гематит (крокус) Оксид железа (III)
CaO Негашеная известь Оксид кальция
40
КИСЛОТЫ. КЛАССИФИКАЦИЯ
HR
Кислоты - это сложные вещества, имеющие
в своем составе водород, способный
замещаться на металл, и кислотный остаток.
41
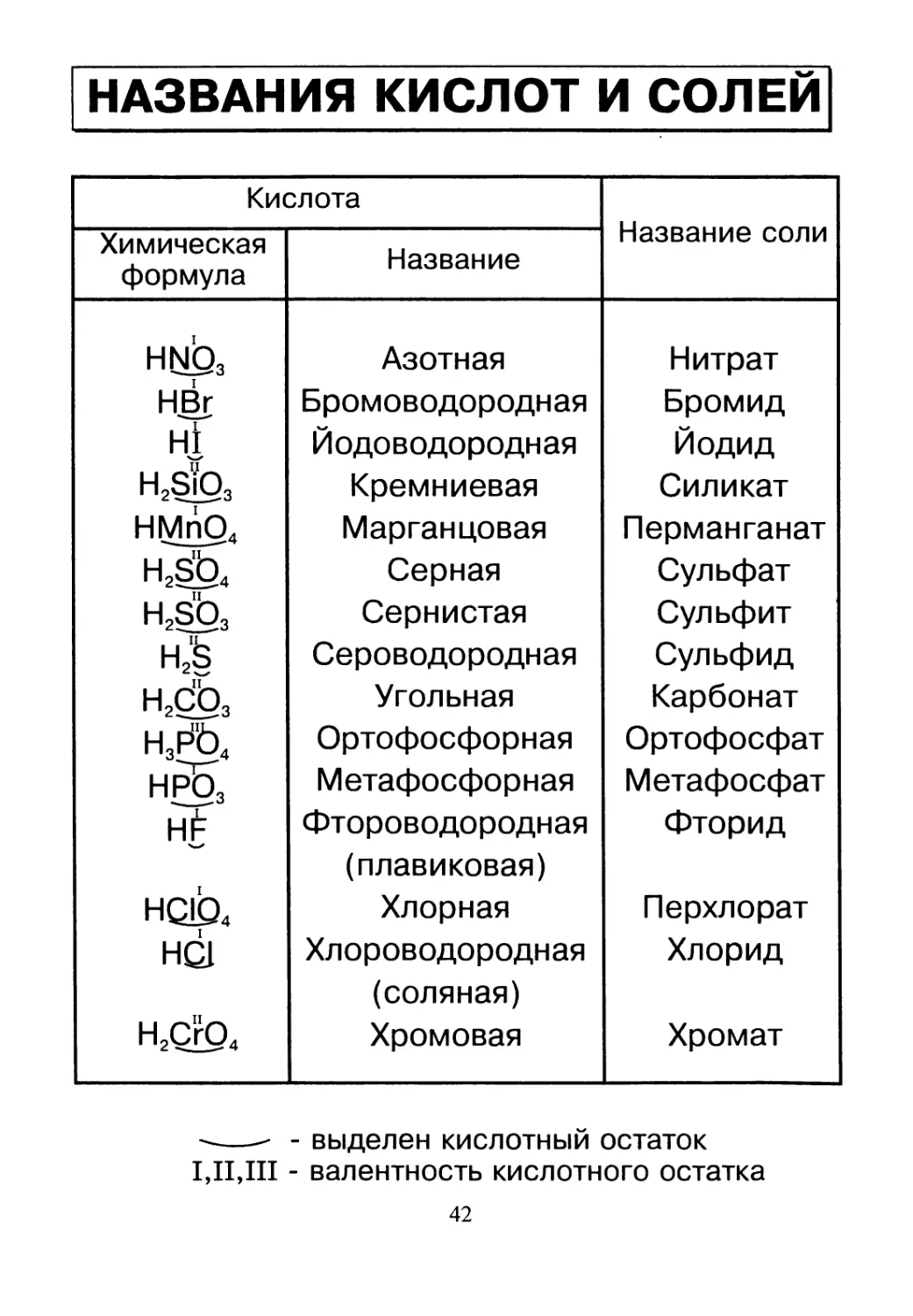
НАЗВАНИЯ КИСЛОТ И СОЛЕЙ
Кислота Название соли
Химическая формула Название
hno3 НВт Hi H2SiO3 НМпО4 Н2^Ь4 H2sb3 Н2§ H2db3 н3рЪ4 нрЬ3 н£ HQlb4 HQ1 H2CrO4 Азотная Бромоводородная Йодоводородная Кремниевая Марганцовая Серная Сернистая Сероводородная Угольная Ортофосфорная Метафосфо рная Фтороводородная (плавиковая) Хлорная Хлороводородная (соляная) Хромовая Нитрат Бромид Йодид Силикат Перманганат Сульфат Сульфит Сульфид Карбонат Ортофосфат Метафосфат Фторид Перхлорат Хлорид Хромат
----- - выделен кислотный остаток
I,II,III - валентность кислотного остатка
42
кислоты.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства
1. Действие на индикаторы
лакмус - красный
метилоранж - красный
2. Кислота + основание - соль + вода
пример: H2SO4 + 2NaOH = Na2SO4 + 2Н2О
3. Кислота + основной оксид = соль + вода
Г
пример: H2SO4 + CuO = CuSO4 + Н2О
4. Кислота + металл = соль + водород
(металлы, стоящие в ряду напряжений
до водорода, кислоты неокислители)
пример: • 2HCI + Zn = ZnCI2 + Н2Т
5. Кислота + соль = новая кислота + новая
соль (если образуется осадок^ или газТ)
пример: 2HCI + Na2CO3 = 2NaCI + Н2О + СО2?
H2SO4 +BaCI2 = BaSOj + 2HCI
Д Разрушают кожу, ткани, древесину.
ОСТОРОЖНО!
Нейтрализовать раствором соды,
смыть водой.
43
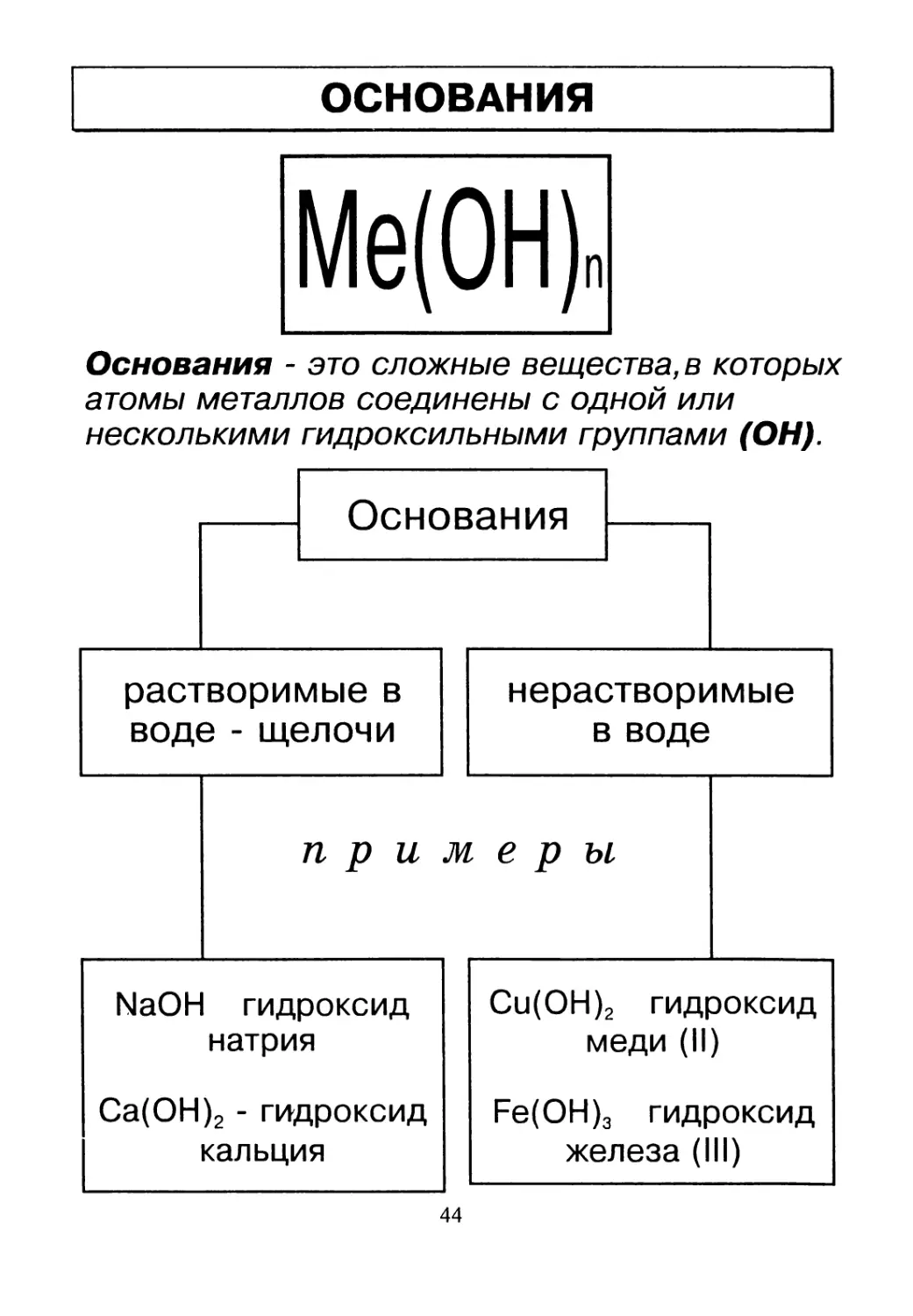
ОСНОВАНИЯ
Me(OH)n
Основания - это сложные вещества, в которых
атомы металлов соединены с одной или
несколькими гидроксильными группами (ОН).
44
ОСНОВАНИЯ.
ХИМИЧЕСКИЕ СВОЙСТВА
Щелочи
1. Действие на индикаторы:
лакмус синий
метилоранж желтый
фенолфталеин - малиновый
Q Основание + кислота = соль + вода
2NaOH + H2SO4 = Na2SO4 + 2Н2О
3. Щелочь+кислотный оксид = соль+вода
2NaOH + SiO2 = Na2SiO3 + Н2О
4. Щелочь + соль = н.основание + н.соль
(условие: образование осадка? или газа?)
Ва(ОН)2 + Na2SO4 = BaSO4? + 2NaOH
Нерастворимые основания
1. Действия на индикаторы нет.
Q Основание + кислота = соль + вода
Cu(OH)2 + H2SO4 = CuSO4 + 2Н2О
3. Разлагаются при нагревании
Cu(OH)2 = СиО + Н2О
Д Едкие вещества.
Разъедают кожу, ткани, бумагу.
Осторожно!
Смыть водой.
45
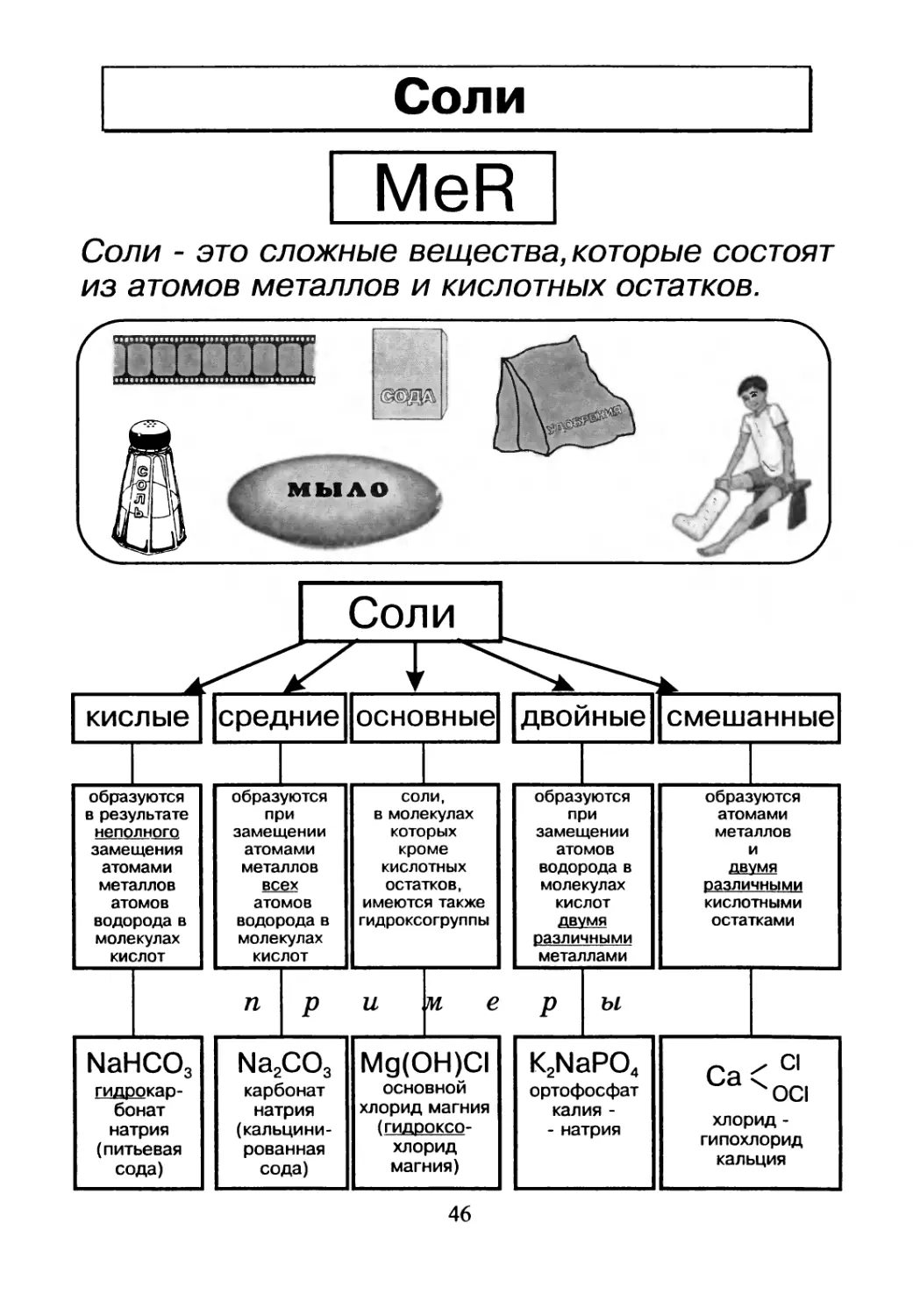
Соли
MeR
Соли - это сложные вещества, которые состоят
из атомов металлов и кислотных остатков.
Соли
кислые
образуются в результате неполного
замещения атомами металлов атомов водорода в молекулах кислот
NaHCO3 гидрокар- бонат натрия (питьевая сода)
средние основные
образуются при замещении атомами металлов всех атомов водорода в молекулах кислот соли, в молекулах которых кроме кислотных остатков, имеются также гидроксогруппы
п р U 7VL е
Na2CO3 карбонат натрия (кальцини- рованная сода) Mg(OH)CI ОСНОВНОЙ хлорид магния (гидро ксо- хлорид магния)
двойные смешанные
образуются при замещении атомов водорода в молекулах кислот двумя различными металлами образуются атомами металлов и двумя различными кислотными остатками
р Ы
K2NaPO4 ортофосфат калия - - натрия Са < С| ХОС1 хлорид - гипохлорид кальция
46
соли.
ХИМИЧЕСКИЕ СВОЙСТВА
Свойства
1. Соль + металл = н.соль + н.металл
(свободный металл должен быть активнее,
чем тот, который в соли)
CuSO4 + Fe = FeSO4 + Си
2. Соль + кислота = н.соль + н.кислота
(условие: образование осадка? или газа?)
HNO3
H2SO4, HCI, H2SO3, H2CO3, H2S, H2SiO3
W *
(каждая предыдущая кислота может
вытеснить из соли последующую)
Na2CO3 + 2HCI = 2NaCI + Н20 + СО2?
3. Соль + щелочь = н.соль + н.основание
(условие: образование осадка? или газа?)
CuSO4 + 2NaOH = Cu(OH)2? + Na2SO4
4. Соль + соль = н.соль + н.соль
(условие: обе соли растворимы в воде,
в результате реакции образуется осадок?)
NaCI + AgNO3 = AgCI? + NaNO3
5. Разложение при нагревании
(для некоторых)
СаСО3 = СаО + СО2
47
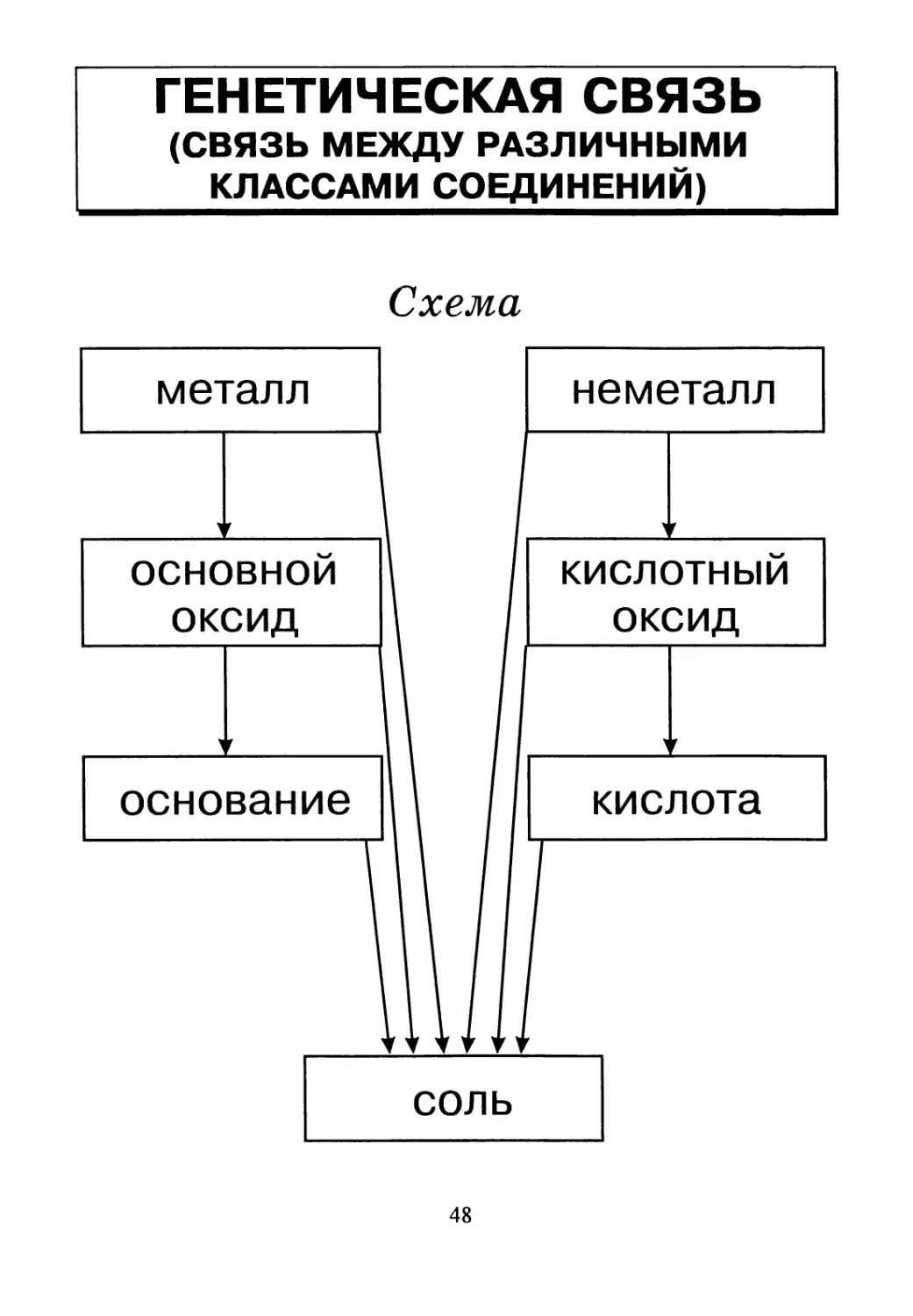
ГЕНЕТИЧЕСКАЯ СВЯЗЬ
(СВЯЗЬ МЕЖДУ РАЗЛИЧНЫМИ
КЛАССАМИ СОЕДИНЕНИЙ)
Схема
48
ВОДА
жидкость, Ч X
Twn= Ю0°С .
т _ Л'Т' (при Р=1а™)
’пл U
мах J) (при 4°С) = 1г/см3
Mr = 18
ЭТА Л О Н Ы
1. Температурная шкала Цельсия:
0° плавление льда, 100" - кипение воды
2. Единица массы:
массе 1 дм3 (л) воды приписано значение 1 килограмм.
Запасы воды на Земле:
в морях, океанах 1,4 млрд, км3
в ледниках (пресная) - 30 млн. км3
в реках, озерах 2 млн. км3
в атмосфере 14 тыс. км3
в живых организмах - 65 %
Единственное вещество в природе, которое
в земных условиях существует во всех трех
агрегатных состояниях^ жидком (вода),
твердом (лед), газообразном (пар).
49
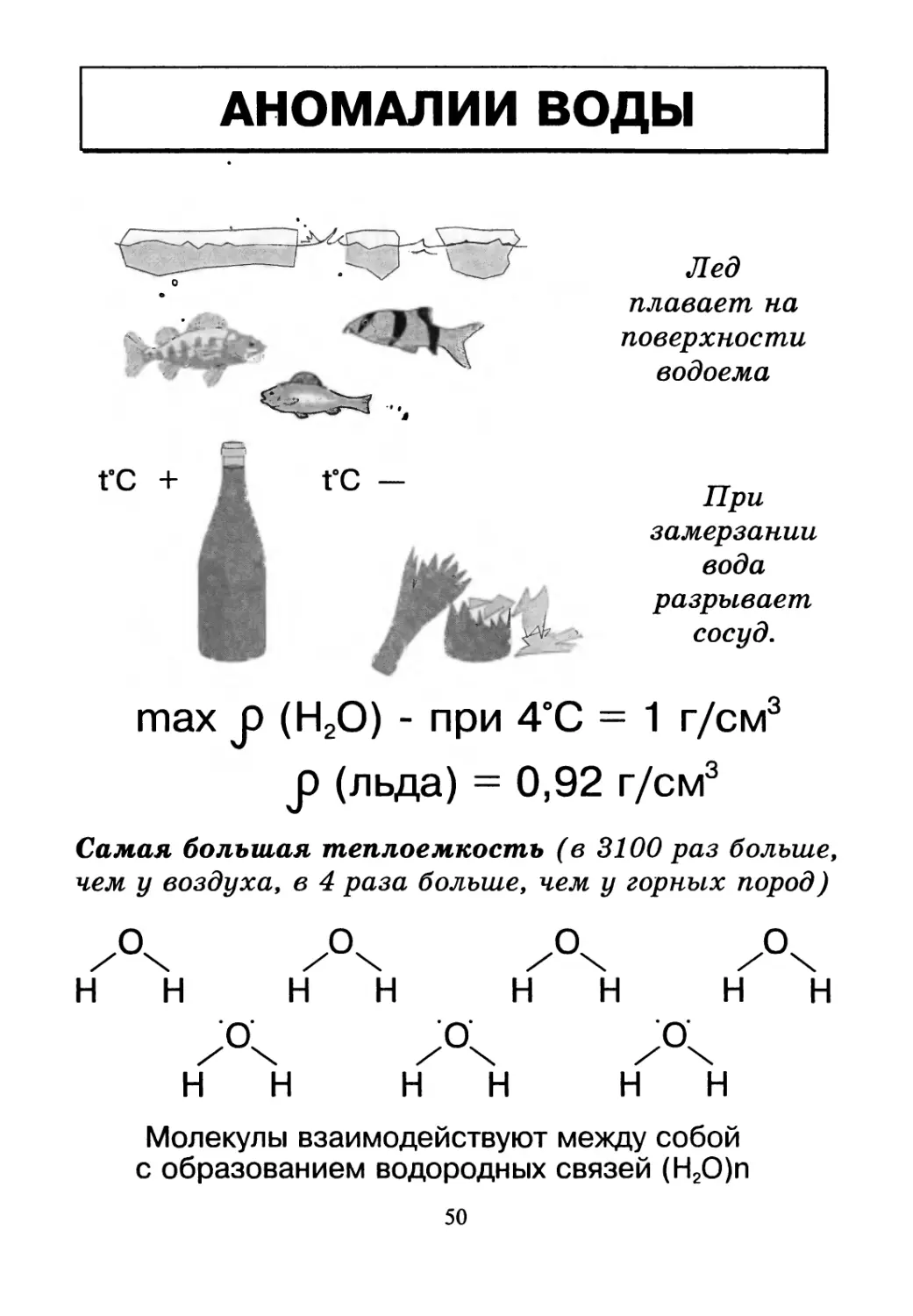
АНОМАЛИИ ВОДЫ
Лед
плавает на
поверхности
водоема
При
замерзании
вода
разрывает
сосуд.
max JD (Н2О) - при 4°С = 1 г/см3
J) (льда) = 0,92 г/см3
Самая большая теплоемкость (в 3100 раз больше,
чем у воздуха, в 4 раза больше, чем у горных пород)
Молекулы взаимодействуют между собой
с образованием водородных связей (Н2О)п
50
ВОДА-РАСТВОРИТЕЛЬ
Растворитель это вещество,
растворяющее * другие вещества.
В воде хорошо растворяются
многие газы, жидкие
и твердые вещества.
эссенция
Вода - универсальный растворитель.
* Процесс растворения сочетает в себе
физический процесс
(дробление до молекул) и химическое
взаимодействие компонентов.
51
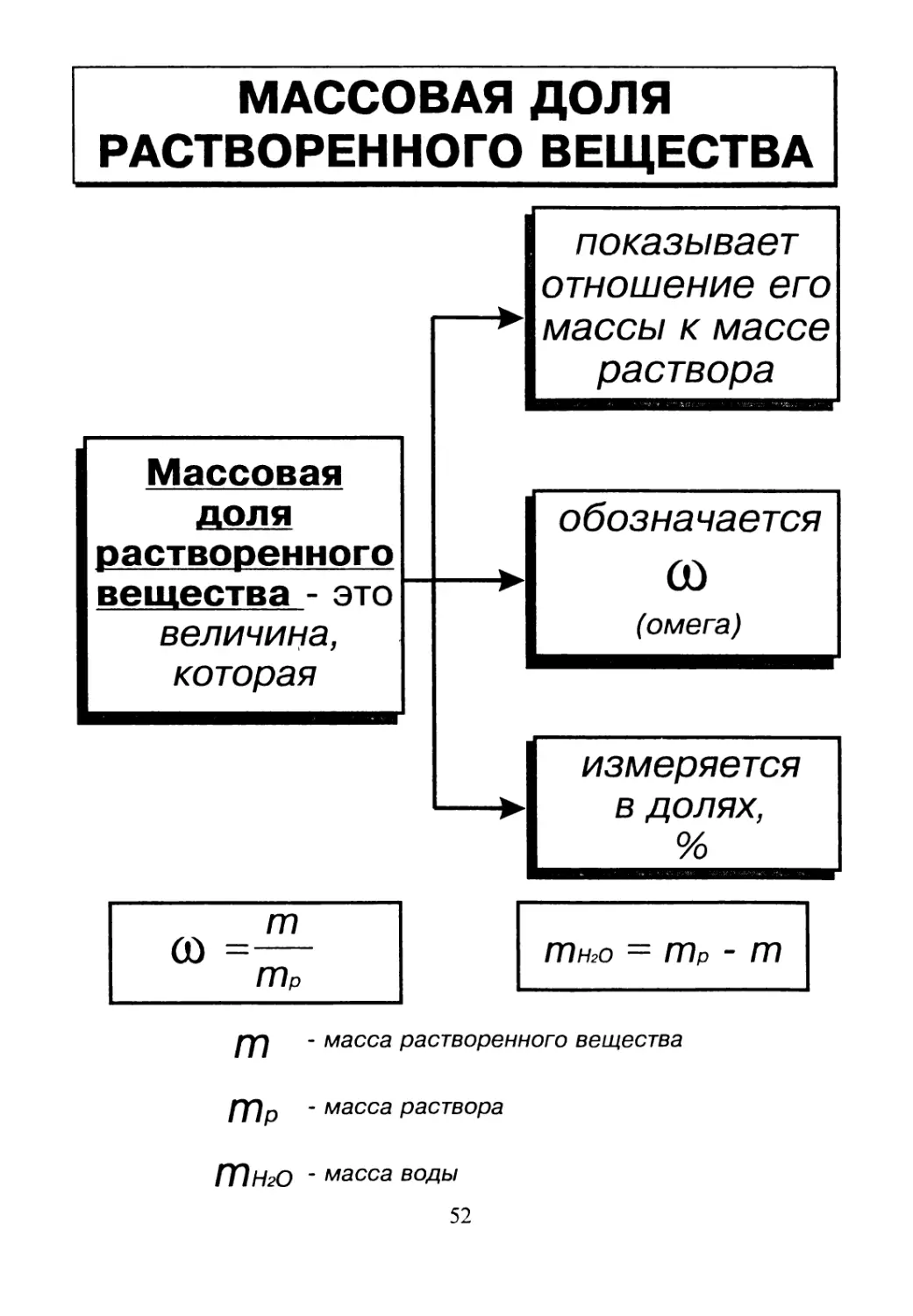
МАССОВАЯ ДОЛЯ
РАСТВОРЕННОГО ВЕЩЕСТВА
показывает
отношение его
массы к массе
раствора
Массовая
доля
растворенного
вещества - это
величина,
которая
обозначается
СО
(омега)
измеряется
в долях,
%
тнго = гпр - m
m
- масса растворенного вещества
тР
- масса раствора
171 ню - масса воды
52
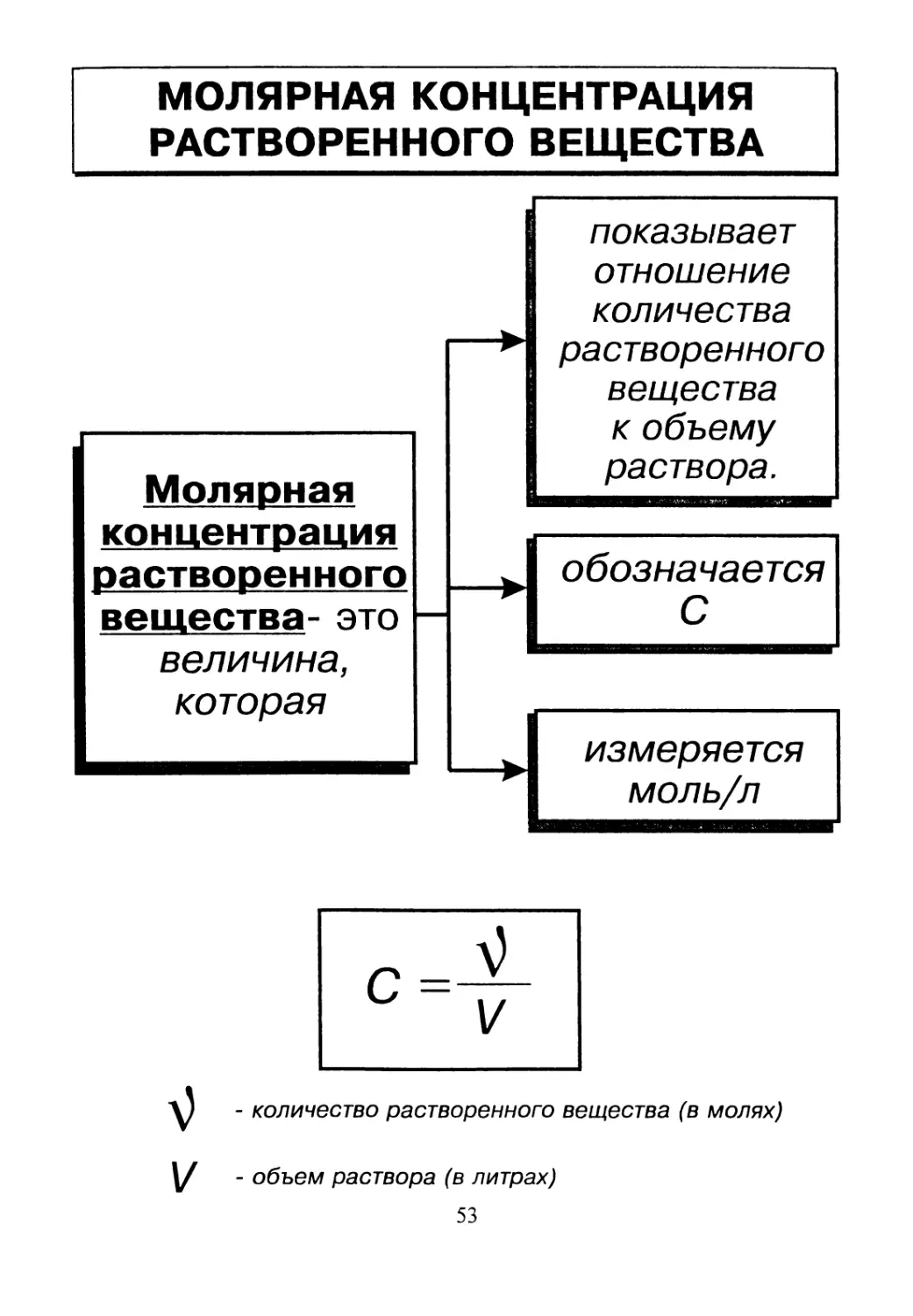
МОЛЯРНАЯ КОНЦЕНТРАЦИЯ
РАСТВОРЕННОГО ВЕЩЕСТВА
Молярная
концентрация
растворенного
вещества- это
величина,
которая
показывает
отношение
количества
растворенного
вещества
к объему
раствора.
обозначается
С
Ч измеряется
моль/л
- количество растворенного вещества (в молях)
- объем раствора (в литрах)
53
ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
с простыми веществами
1) с металлами:
активный металл* + вода = щелочь + водород
2Na + 2HiO = 2NaOH + Н2Т
металл средней активности** + вода =
оксид металла + водород.
Zn + Н2О = ZnO + Н2?
2) с галогенами: (продукты различны)
4F2 + ЗН2О = OF2 + 6HF + О2Т
С12 + Н2О = НС1О + НС1
со сложными веществами
1) с оксидами:
оксид активного металла + вода = щелочь
СаО + НгО = Са(ОН)2
кислотный оксид + вода = кислота (кроме SiO2)
SO3 + Н2О = H2SO4_________________
2) с солями: образование кристаллогидратов
CuSO4 + 5Н,О = CuSO4 • 5Н2О
бледно-голубой ярко-синий
3) с гидридами активных металлов:
гидрид металла + вода = щелочь + водород
КН + НгО = КОН + Н2
* активные металлы - стоящие в ряду напряжений
металлов до Mg включительно;
* * средней активности металлы - стоящие в ряду
напряжений металлов от Mg до РЬ.
54
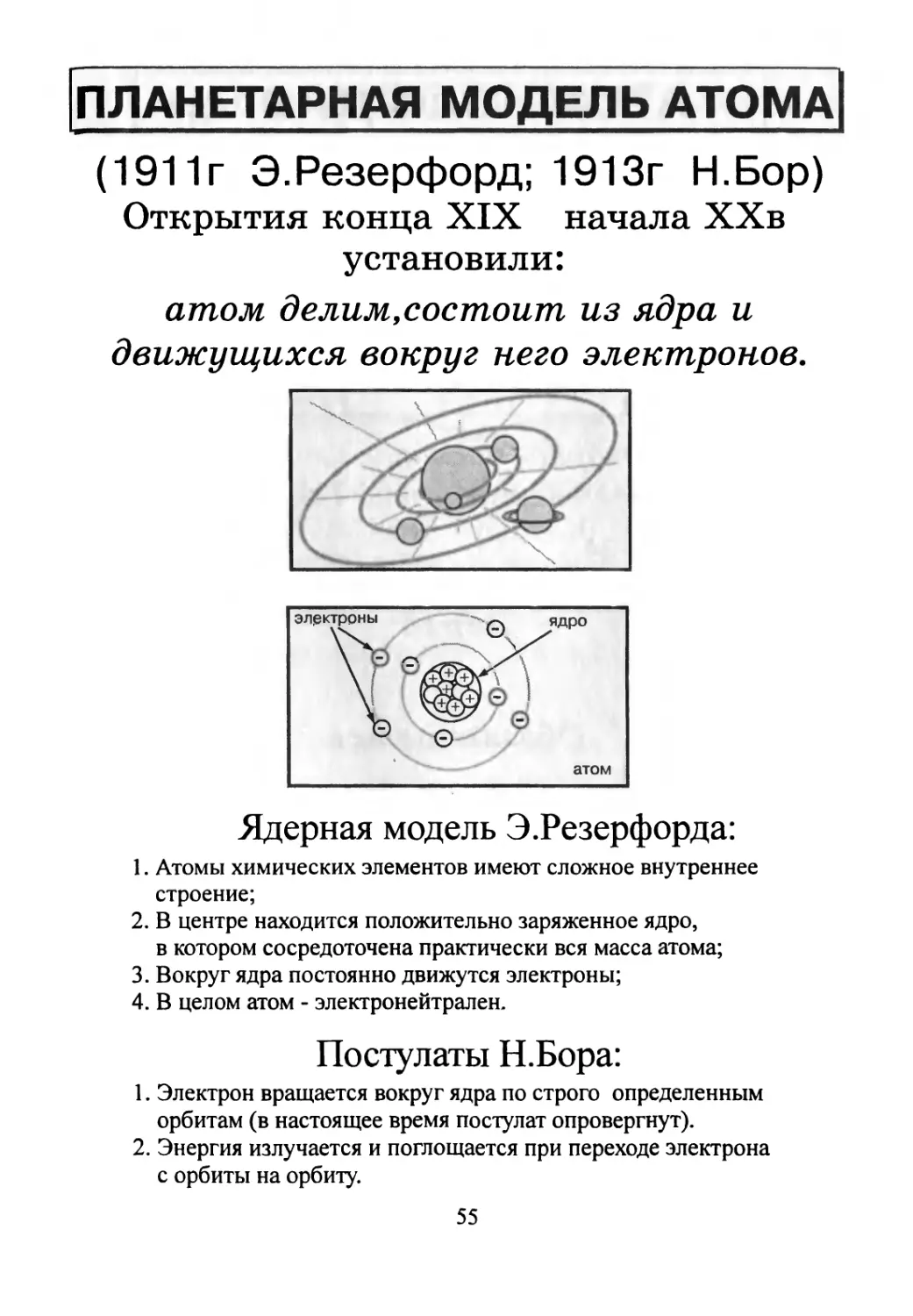
ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
(1911г Э.Резерфорд; 1913г Н.Бор)
Открытия конца XIX начала ХХв
установили:
атом делим,состоит из ядра и
движущихся вокруг него электронов.
Ядерная модель Э.Резерфорда:
1. Атомы химических элементов имеют сложное внутреннее
строение;
2. В центре находится положительно заряженное ядро,
в котором сосредоточена практически вся масса атома;
3. Вокруг ядра постоянно движутся электроны;
4. В целом атом - электронейтрален.
Постулаты Н.Бора:
1. Электрон вращается вокруг ядра по строго определенным
орбитам (в настоящее время постулат опровергнут).
2. Энергия излучается и поглощается при переходе электрона
с орбиты на орбиту.
55
АТОМНОЕ ЯДРО
(Протонно-нейтронная теория
Д.Иваненко, Е.Гапон 1932г.)
Ядро атомов имеет сложное строение.
Ядро состоит из протонов и нейтронов.
Оно заряжено положительно.
Протон Нейтрон
Элементарная частица, имеющая
массу приблизительно 1 а.е.м.
-24 -24
1,673-10 г 1,675-10 г
Заряд
+ 1 о
Обозначается
}р;5н jn
Число протонов в ядре атома элемента строго
определено (равно порядковому номеру элемента
в периодической системе Z) Число нейтронов в ядре
атома одного и того же элемента может быть
различным (равно А - Z, где А - относительная атомная
масса элемента, Z - порядковый номер)
Заряд ядра атома определяется зарядом протонов.
Масса ядра атома определяется суммой масс
протонов и нейтронов.
56
изотопы
Изотопы - это разновидности атомов одного
элемента, имеющие одинаковое число
протонов и различное число нейтронов
(различную массу ядра атома).
"изос" (греч.) - один, "топос" (греч.) - место
Занимающий одно место (клетку) в
периодической таблице элементов
Д. И .Менделеева.
Обозначение изотопов в природной смеси
углерод 12 ”С(б:р6>) 98,892 %
углерод 13 ;С(6'р7сп) 1,108%
Аг(С) = 12-0,98892 + 13-0,01108 = 12,011
(совпадает с Ar (С) в периодической таблице Д.И.Менделеева.)
Химические свойства изотопов
практически одинаковы.
57
ЭЛЕКТРОН
Стони 1891г. Электричество переносится
мельчайшими частицами, существующими в атомах
всех химических элементов. Он назвал эту частицу
"электрон " ("электрон " (греч.) - "янтарь ")
Через несколько лет Д.Томсон и Ж.Перрен
определили, что электроны несут отрицательный
заряд.
Д. Томсон определил скорость и массу электрона.
Электрон - отрицательно заряженная частица.
Его заряд численно равен, но
противоположен по знаку, заряду протона (-1)
Масса очень мала, приблизительно
равна 1/1840 а.е.м. (9,109* 10'28г)
обозначается е, ие
Число электронов в атоме равно числу
протонов. (Определяется по порядковому
номеру элемента в периодической системе
элементов - Z).
В 1924г. Луи де Бройль установил двойственную
природу электрона - волна и частица.
58
ДВИЖЕНИЕ ЭЛЕКТРОНА
В АТОМЕ
"Быть может, эти электроны
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом -
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет."
(В.Брюсов, 1922г.)
Движение электронов в атоме подчиняется законам
квантовой механики. Они не допускают наглядной
интерпритации.
С помощью приборов мы можем наблюдать не сам
электрон, а результат его взаимодействия с
веществом.
Особенности движения электронов в атоме
позволяют рассматривать каждый электрон
как микрооблако, не имеющее
четких внешних границ.
Пространство, в котором
движется электрон,
называют орбиталью.
Форма электронного
облака в атоме водорода
(0,053 нм = 5,3-10”м)
Вероятность нахождения
электрона в орбитали
характеризует
электронная плотность.
59
ФОРМЫ ЭЛЕКТРОННЫХ
_________ОРБИТАЛЕЙ______________
В зависимости от энергии электронные
облака отличаются размерами и формой.
Сферическая s-орбиталъ симмет-
рична относительно ядра и не
Ф имеет выделенного направления.
~ Гантелеобразные р-орбитали
расположены под прямым углом
друг к другу вдоль 3-х осей
S - орбиталь координат (х, у, z) -рх, ру, р„
Р - орбиталь
Электроны, которые
находятся на s-орбитали,
называют s-электронами,
на р-орбитали р-электронами.
Орбитали более сложных форм
обозначаются буквами d, f
60
ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА
Электронные облака с близкой энергией составляют
в атоме электронный слой (энергетический уровень).
Энергетический уровень характеризует энергию связи
электрона с ядром. Обозначается арабскими цифрами (1,
2, 3, 4...)
Электроны одного и того же энергетического уровня
могут различаться значениями энергии, образуя энер-
гетические подуровни. Обозначается буквами s, р, d, f.
Схема, иллюстрирующая энергетические уровни (а), подуровни(б),
орбитали(в).
Каждый уровень (кроме s) содержит несколько по разному
ориентированных в пространстве орбиталей. На схеме
обозначаются в виде квантовых ячеек.
свободная ячейки, заполненные
ячейка наполовину
Общее число орбиталей равно п2
Общее число электронов слоя 2п2
заполненная (п - НОМер СЛОЯ)
ячейка
61
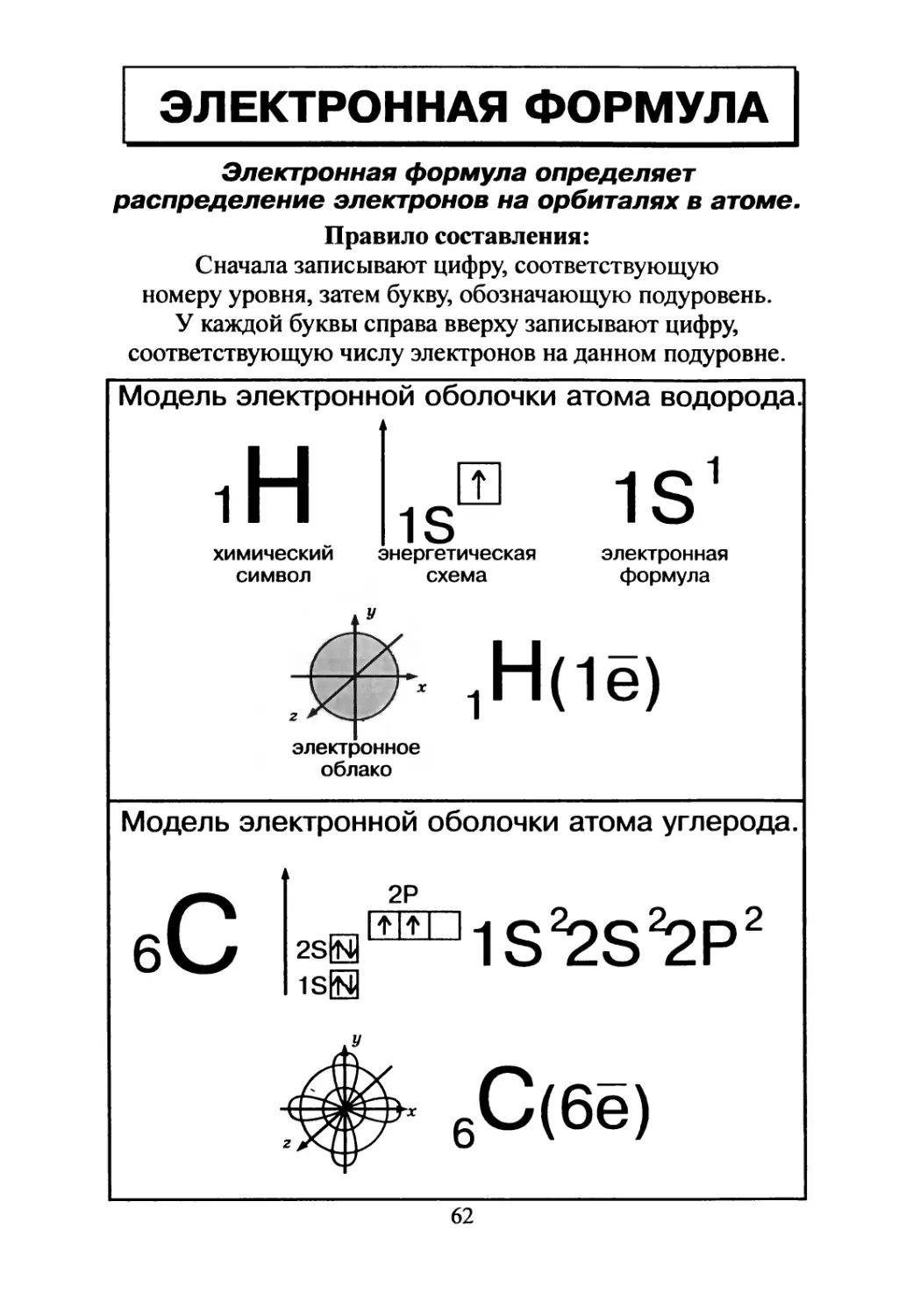
ЭЛЕКТРОННАЯ ФОРМУЛА
Электронная формула определяет
распределение электронов на орбиталях в атоме.
Правило составления:
Сначала записывают цифру, соответствующую
номеру уровня, затем букву, обозначающую подуровень.
У каждой буквы справа вверху записывают цифру,
соответствующую числу электронов на данном подуровне.
Модель электронной оболочки атома водорода.
1Н
химический
символ
t
1S
энергетическая
схема
электронная
формула
электронное
облако
Модель электронной оболочки атома углерода.
2Р
2
62
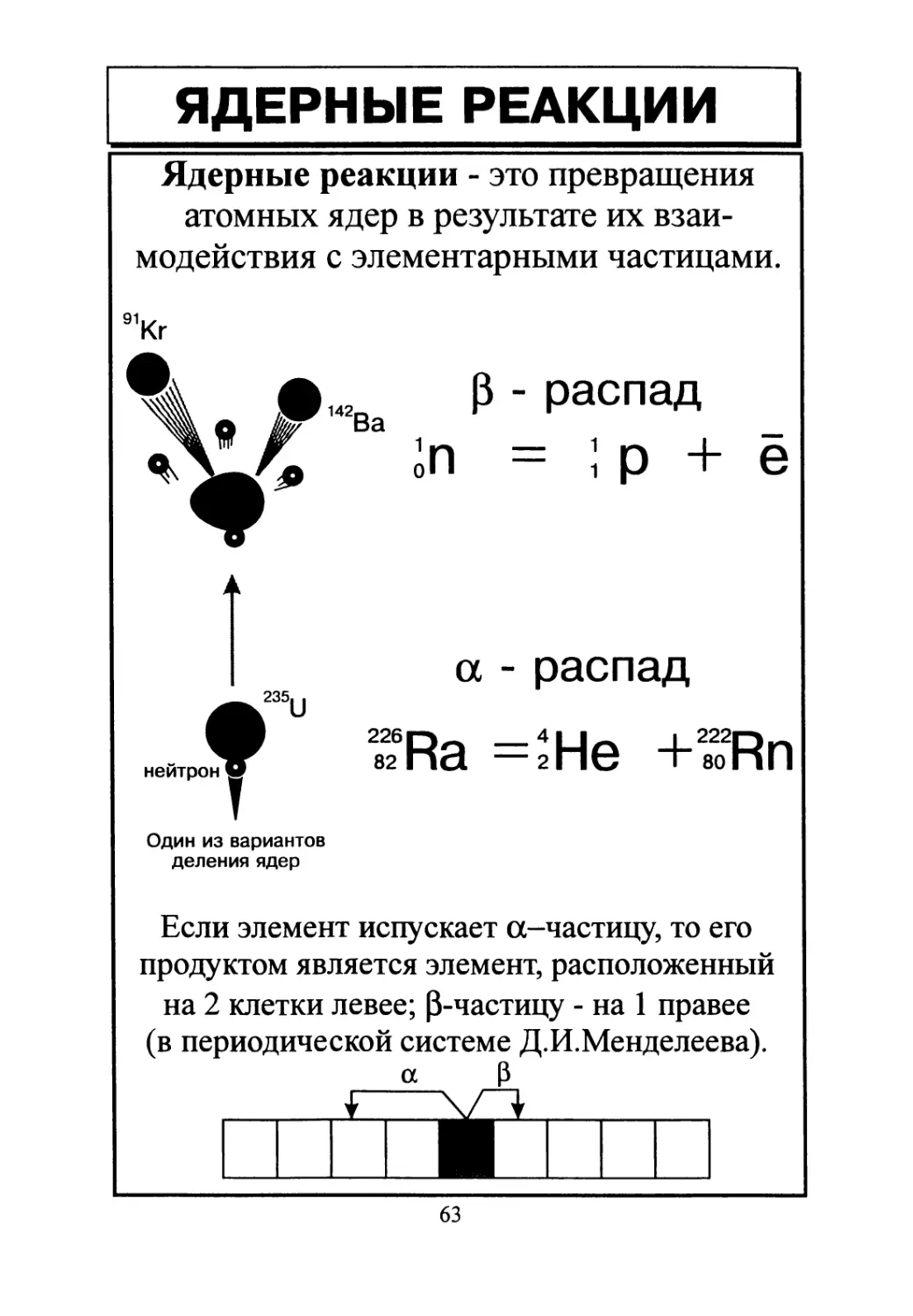
ЯДЕРНЫЕ РЕАКЦИИ
Ядерные реакции - это превращения
атомных ядер в результате их взаи-
модействия с элементарными частицами.
Один из вариантов
деления ядер
а - распад
ТгАа =2 Не +2802Rn
Если элемент испускает а-частицу, то его
продуктом является элемент, расположенный
на 2 клетки левее; 0-частицу - на 1 правее
(в периодической системе Д.И.Менделеева).
а Р
63
ПЕРИОДИЧЕСКИЙ ЗАКОН -
ФУНДАМЕНТ ВСЕЙ ХИМИИ.
(Д.И. МЕНДЕЛЕЕВ 1 марта 1869 г.)
Доменделеевские классификации элементов:
Мейер объединил сходные по свойствам элементы
(естественные семейства).
Ньюленде обнаружил повторяемость свойств
элементов через 7 элементов (закон октав).
Доберейер - выделил триады элементов.
"Свойства простых тел, а также формы и свойства
соединений элементов, находятся в периодической
зависимости от величины атомных весов элементов."
(Д. И. Менделеев)
Li 7 Be 9 В 11 с 12 N 14 О 16 F 19 Na 23 Mg 24 Al 27 Si 28 P 31 S 32 Cl 35.5 К 39 Ca 40
В основе классификации лежит
атомная масса элементов.
Сходные химические элементы
встречаются через определенные
интервалы, т.е.
повторяются периодически.
Современная формулировка закона:
"Свойства элементов, а также формы и
свойства их соединений,находятся в перио-
дической зависимости от величины заряда их
атомных ядер."
64
ПЕРИОДИЧЕСКАЯ СИСТЕМА
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Период - это горизонтальная последовательность
элементов по возрастанию порядкового номера от
первого s-элемента (n s1)
до шестого p-элемента (n s2 п р6).
Каждый период (кроме первого ) - это ряд,
который начинается щелочным металлом и
заканчивается галогеном и инертным газом.
Период обозначается арабской цифрой (от 1 до 7).
।-------Периоды-------------1
малые большие
(1 й, 2й, Зй) (4й, 5й, 6й, 7й незавершенный)
Группа это вертикальная последовательность
элементов по возрастанию порядкового номера,
обладающих однотипным электронным строением
и являющихся химическими аналогами.
Группа обозначается римской цифрой (от I до VIII).
Группы-----------1
побочные подгруппы
(Б - группы)
t
d - элементы
главные подгруппы
(А - подгруппы)
t
s и р - элементы
химический
номер элемента
относительная
атомная масса
Каждому химическому элементу отведено
строго определенное место, за каждым
закреплен свой порядковый номер.
65
ЧИСЛА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.
I. Z - порядковый номер элемента:
1) заряд ядра атома элемента
A <±1J> 13MI 2) число протонов ]р
13Ai 1з:р
3) число электронов ё
1з А! 13ё
4) ЧИСЛО нейтронов (Аг - относительная
атомная масса,
П — Д Г - 7 округленная до целого числа).
Аг (А1) = 26,981 = 27
оП — 27 - 13 = 14 AI 14;п 1 о
Формула состава атома
__________пАЦ 13!р; 14jn)13e_____________
II. № (номер) периода обозначает число
энергетических уровней *в атоме элемента.
13AI - 3 период_____________+ 13 )))
III. № группы:
1) число электронов на последнем слое.
13А1 - III группа + 13 )))
3
2) высшая валентность элемента в соединениях.
in
AI2S3
66
ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ ПО
ОСНОВНЫМ НАПРАВЛЕНИЯМ СИСТЕМЫ
горизонтальное направление
(слева направо по периоду)
Li Ве В С N О F
ООО О ООО
0,135 нм____________________________0,064 Hi^
(1нм = 10'9 м)
Увеличение заряда ядра (электронная оболочка атомов
сжимается), увеличение притяжения ё к ядру, увеличение
электроотрицательности, восстановительная способность
уменьшается, растет окислительная, переход от металлических
свойств через амфотерные к типичным неметаллам.
вертикальное направление
(сверху вниз по группе)
Na увеличение числа электронных уровней (радиуса атома)
'о' уменьшение притяжения е кядру
К увеличивается способность отдавать электроны
увеличивается восстановительная способность (ме-
— таллические свойства)
▼ уменьшается окислительная способность (неметалли-
ческие свойства)
диагональное направление
(из левого верхнего угла
к нижнему правому) - более короткое,
В С
объединяет
отчасти сходные
элементы.
67
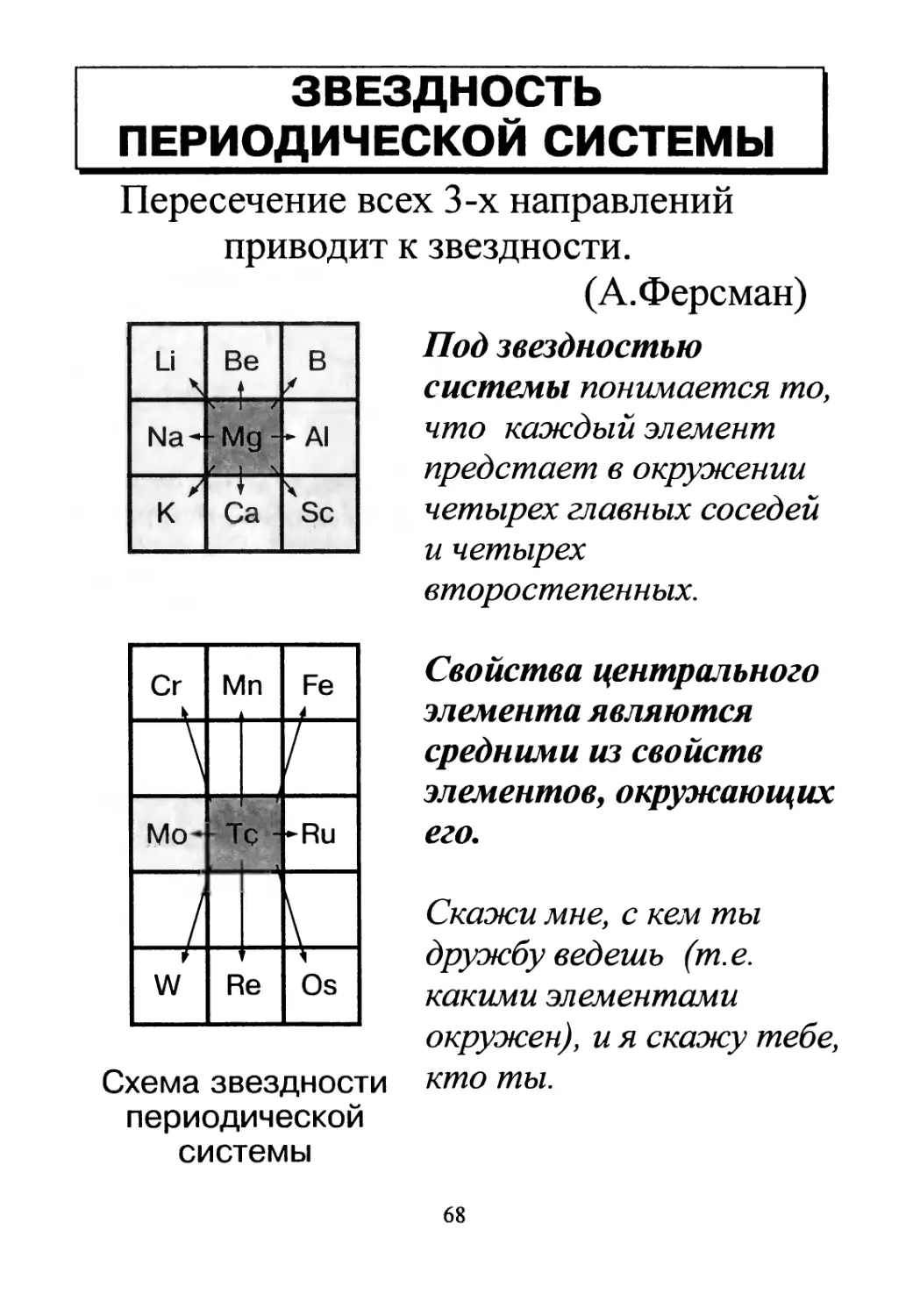
ЗВЕЗДНОСТЬ
ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Пересечение всех 3-х направлений
приводит к звездности.
(А.Ферсман)
U Be f В
Na* -Mg- г i х ► AI
К 1 Са Sc
Схема звездности
периодической
системы
Под звездностью
системы понимается то,
что каждый элемент
предстает в окружении
четырех главных соседей
и четырех
второстепенных.
Свойства центрального
элемента являются
средними из свойств
элементов, окружающих
его.
Скажи мне, с кем ты
дружбу ведешь (т.е.
какими элементами
окружен), и я скажу тебе,
кто ты.
68
ПЛАН ХАРАКТЕРИСТИКИ ХИМИЧЕСКОГО
ЭЛЕМЕНТА ПО ПЕРИОДИЧЕСКОЙ
СИСТЕМЕ Д,И, МЕНДЕЛЕЕВА
I. Положение элемента в периодической системе:
1) порядковый номер
2) период, ряд
3) группа, подгруппа
4) относительная атомная масса
II. Строение атома элемента:
1) заряд ядра атома
2) формула состава атома (количество \р ; ё )
3) количество энергетических уровней и размещение
на них электронов (ё)
4) формула электронной конфигурации (IS 2S...)
5) квантовые ячейки
6) число ё на последнем слое => металл или неметалл
III. Формулы соединений:
1) оксида
2) гидрооксида (кислоты или основания)
3) летучего водородного соединения (для неметаллов)
IV. Химический характер, его доказательство:
а) кислотный: кислотный оксид + щелочь = соль + вода
кислота + основание = соль + вода
б) основной: основной оксид + кислота = соль + вода
основание + кислота = соль + вода
в) амфотерный (а + б)
V. Сравнение с соседями:
а) по периоду б) по группе
(металл с неметаллами сравнивать нельзя)
69
"УКРЕПИТЕЛИ
ПЕРИОДИЧЕСКОГО ЗАКОНА"
Предсказано Менделеевым для экасилиция (1874г.) Найдено Винклером для германия (1886г.)
1. Относительная атомная масса 72. 2. Плотность 5,5. 3. Атомный объем 13. 4. Формула высшего оксида EsOz. 5. Плотность оксида 4,7. 6. Плавкий металл, улетучивающийся в сильном жару. 7. Оксид легко восстанавливается до металла. 8. Гидроксид - слабое основание. 9. Хлорид формулы EsCh - жид- кость с Ткип. 90°С и уд.вес =1,9. 10. Образует неустойчивое газо- образное соединение EsH4 (Ткип 160°С, уд. в.-0,96), но более стойкое, чем SnH4. 11 Образует металлоорганическое соединение Es(C2H5)4; Ткип 160°С, уд. в. 0,96. 1. Относительная атомная масса 72,6. 2. Плотность 5,35. 3. Атомный объем 13,4. 4. Формула высшего оксида GeOi. 5. Плотность оксида 4,7. 6. Плавится при 960°С, выше - улетучивается. 7. Оксид восстанавливается до металла. 8. Основные свойства гидроксида - слабые. 9. Хлорид GeCk - жидкость, Ткип. 86°С, уд.вес =1,88. 10. GeH4 - неустойчивый газ, но более стоек, чем SnH4. 11. Металлоорганическое соединение Ge(C2H5)4; Ткип 163,5°С, уд. вес 0,99.
Лекок-де-Буабодран (Франция 1875г.) открыл галлий (№31 Ga)
экаалюминий. "Я думаю, что нет необходимости настаивать на огромном
значении подтверждения теоретических выводов г. Менделеева."
Ларс Нильсон (Швеция, 1879г.) открыл скандий (№21 Sc) - экабор. "Нет
никакого сомнения, что в скандии открыт экабор. Мысли русского химика
подтверждаются самым наглядным образом."
Кл. Винклер (Германия, 1886г.) открыл германий (№32 Ge) - экасилиций.
"Вряд ли может существовать более яркое доказательство учения о
периодичности элементов... оно знаменует собой выдающееся расширение
химического поля зрения, гигантский шаг в области познания.”
70
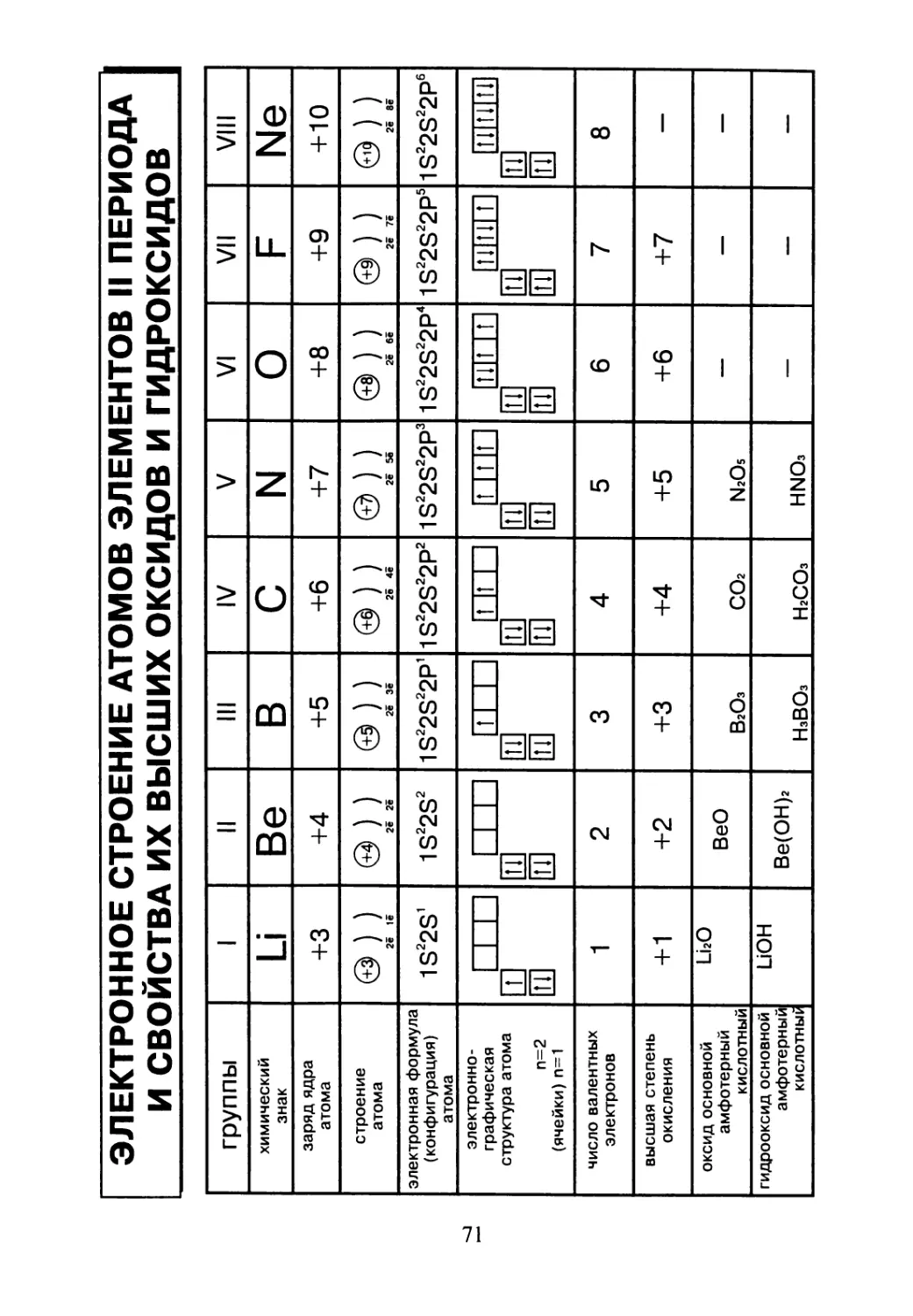
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ ЭЛЕМЕНТОВ II ПЕРИОДА
И СВОЙСТВА ИХ ВЫСШИХ ОКСИДОВ И ГИДРОКСИДОВ
группы I II III IV V VI VII VIII
химический знак Li Be в С N О F Ne
заряд ядра атома +3 +4 +5 +6 +7 +8 +9 +10
строение атома @) ) 2ё 1ё &)) 2ё 2ё ®)) 2ё Зё ®)) 2ё 4ё ® ) ) 2ё 5ё @) ) 2ё бё @ ) ) 2ё 7ё @) ) 2ё 8ё
электронная формула (конфигурация) атома 1S22S’ 1S22S2 1S22S22P1 1S22S22P2 1S22S22P3 1S22S22P4 1S22S22P5 1S22S22P6
электронно- графическая структура атома п=2 (ячейки) п=1 LLLI Ш И 1_Ш И ЕЛ ш_и ЕЛ ЕЛ ь_ш ЕЛ ЕЛ LUIlI ЕЛ ЕЛ ЮТ Тт| ЕЛ ЕЛ ШШШ ЕЛ ЕЛ ШИШИ ЕЛ ЕЛ
число валентных электронов 1 2 3 4 5 6 7 8
высшая степень окисления +1 +2 +3 +4 +5 +6 +7 —
оксид основной амфотерный кислотный LLO ВеО ВгОз со2 N2O5 — — —
гидрооксид основной амфотерный кислотны^ ион Ве(ОН)2 НзВОз НгСОз HNO3 — — —
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Свойства атомов данного элемента
оттягивать на себя электроны
от атомов других элементов в соединениях
называют электроотрицательностью.
Ряд электроотрицательности
Cs К Na Са Mg Al Si Н С Р S Br Cl N О F
ЭО возрастает
ЭО возрастает в периодах слева направо,
а в главных подгруппах снизу вверх.
При химических реакциях электроны
Г переходят или смещаются к атомам
элементов, обладающих
большей электроотрицательностью.
При составлении химических формул первым
записывается элемент с меньшей ЭО.
72
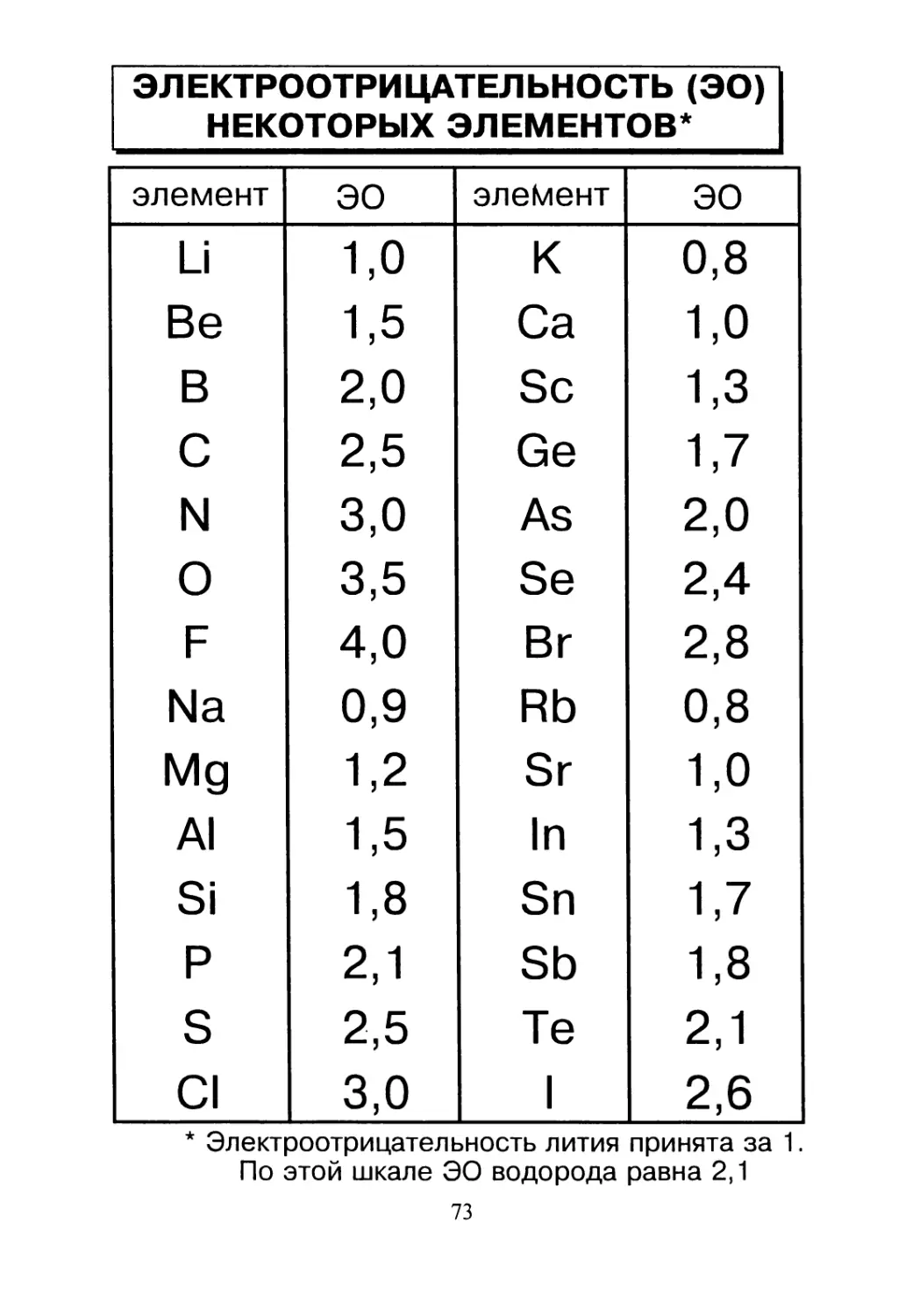
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ЭО)
НЕКОТОРЫХ ЭЛЕМЕНТОВ*
элемент ЭО элемент ЭО
Li 1,0 к 0,8
Be 1,5 Ca 1,0
В 2,0 Sc 1,3
С 2,5 Ge 1,7
N 3,0 As 2,0
О 3,5 Se 2,4
F 4,0 Br 2,8
Na 0,9 Rb 0,8
Mg 1,2 Sr 1,0
Al 1,5 In 1,3
Si 1,8 Sn 1,7
P 2,1 Sb 1,8
S 2,5 Te 2,1
Cl 3,0 I 2,6
* Электроотрицательность лития принята за 1.
По этой шкале ЭО водорода равна 2,1
73
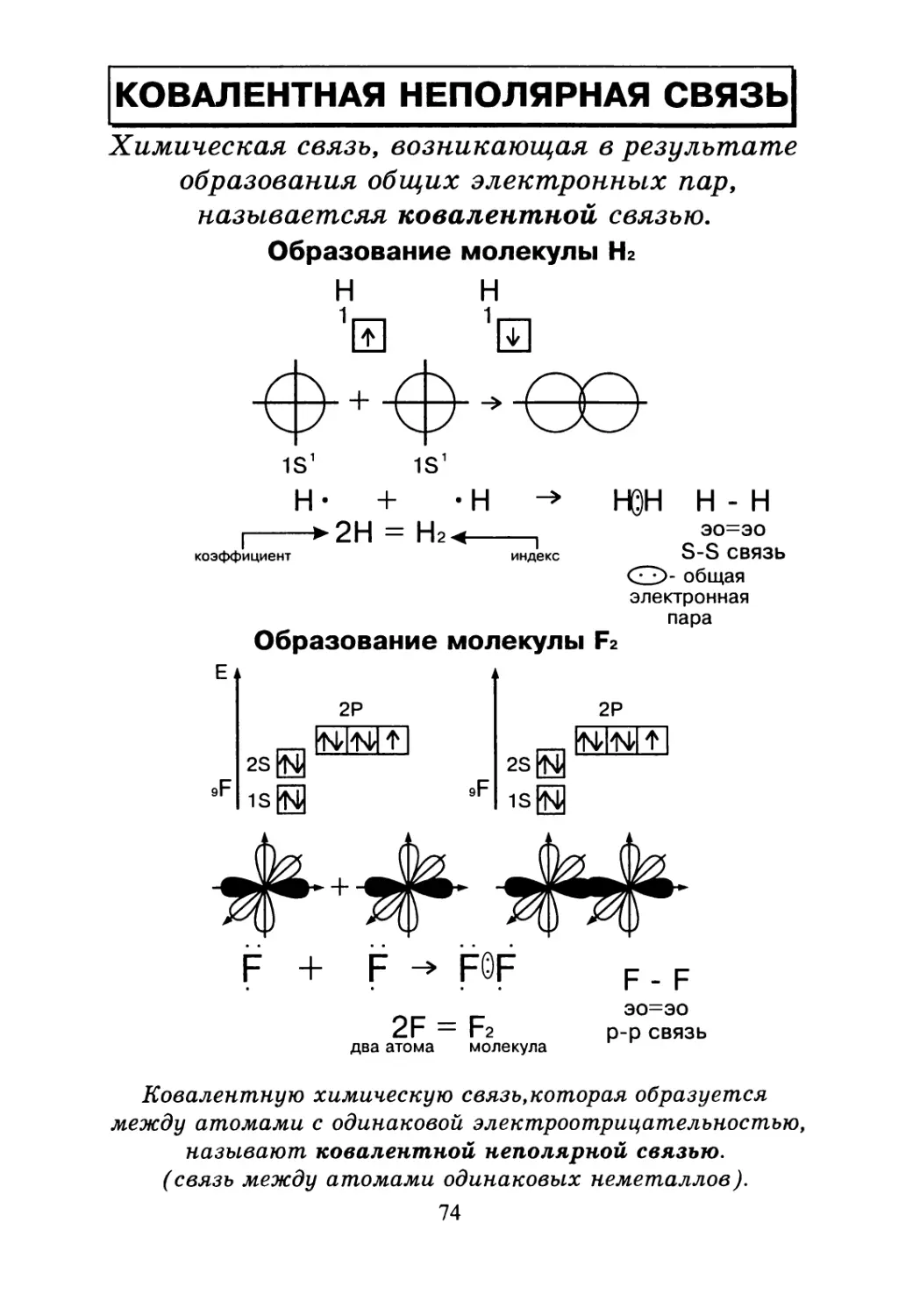
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ
Химическая связь, возникающая в результате
образования общих электронных пар,
называетсяя ковалентной связью.
Образование молекулы Hz
электронная
пара
Образование молекулы Fz
2Р
2Р
г-. miHiM
2S [ьу
1S0
2S0
1S0
Ковалентную химическую связь,которая образуется
между атомами с одинаковой электроотрицательностью,
называют ковалентной неполярной связью.
(связь между атомами одинаковых неметаллов).
74
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ
Химическая связь, образованная атомами,
электроотрицательность которых отличается
незначительно,называется
ковалентной полярной связью.
(связь между атомами различных неметаллов).
б- 5+ - частичные
заряды
s-p связь
О(сигма) - связь
С связь - это связь по линии,
соединяющей ядра атомов.
75
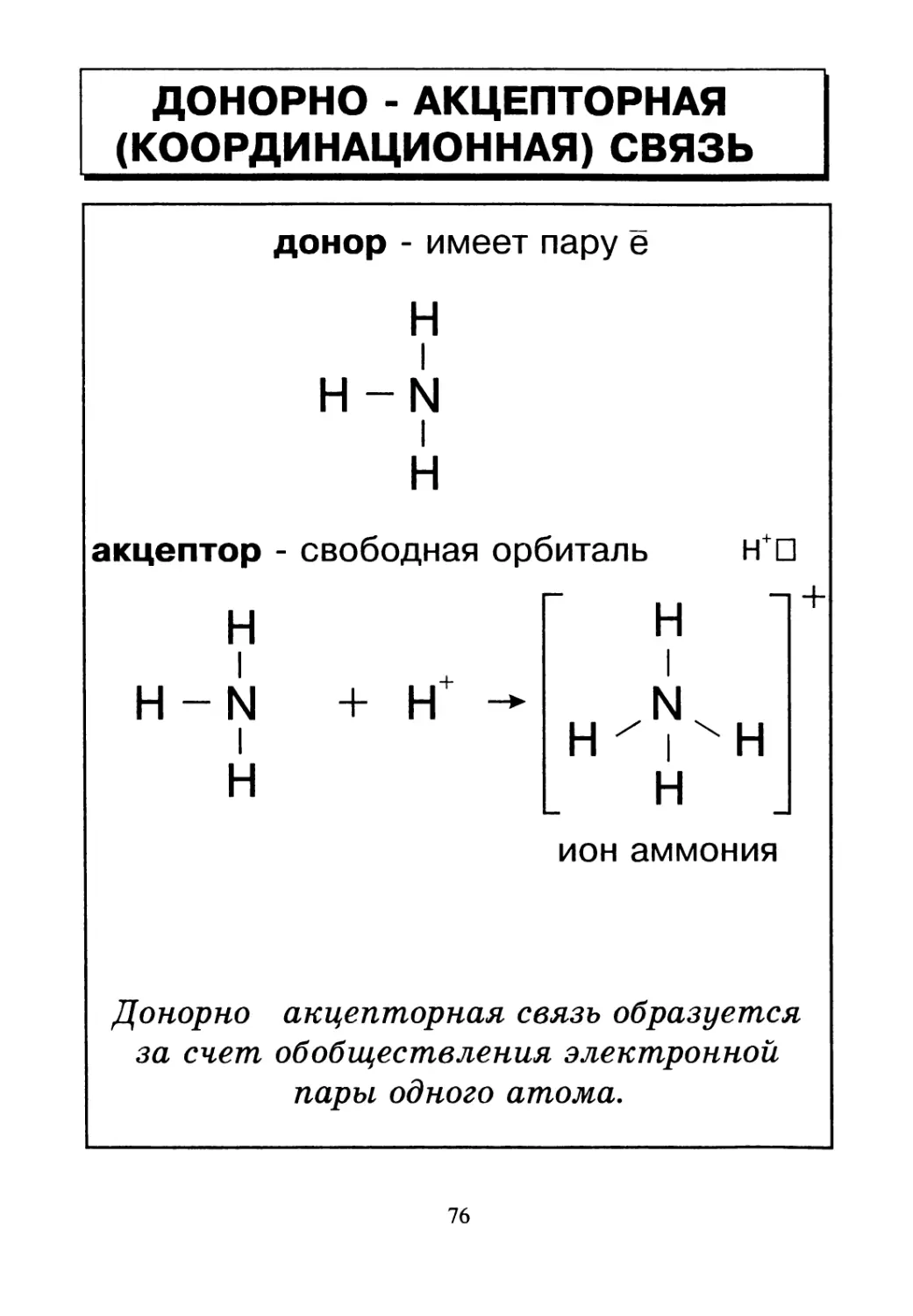
ДОНОРНО - АКЦЕПТОРНАЯ
(КООРДИНАЦИОННАЯ) СВЯЗЬ
донор - имеет пару е
Н
Н -N
I
н
акцептор - свободная орбиталь н*П
н
H-N
I
н
ион аммония
Донорно акцепторная связь образуется
за счет обобществления электронной
пары одного атома.
76
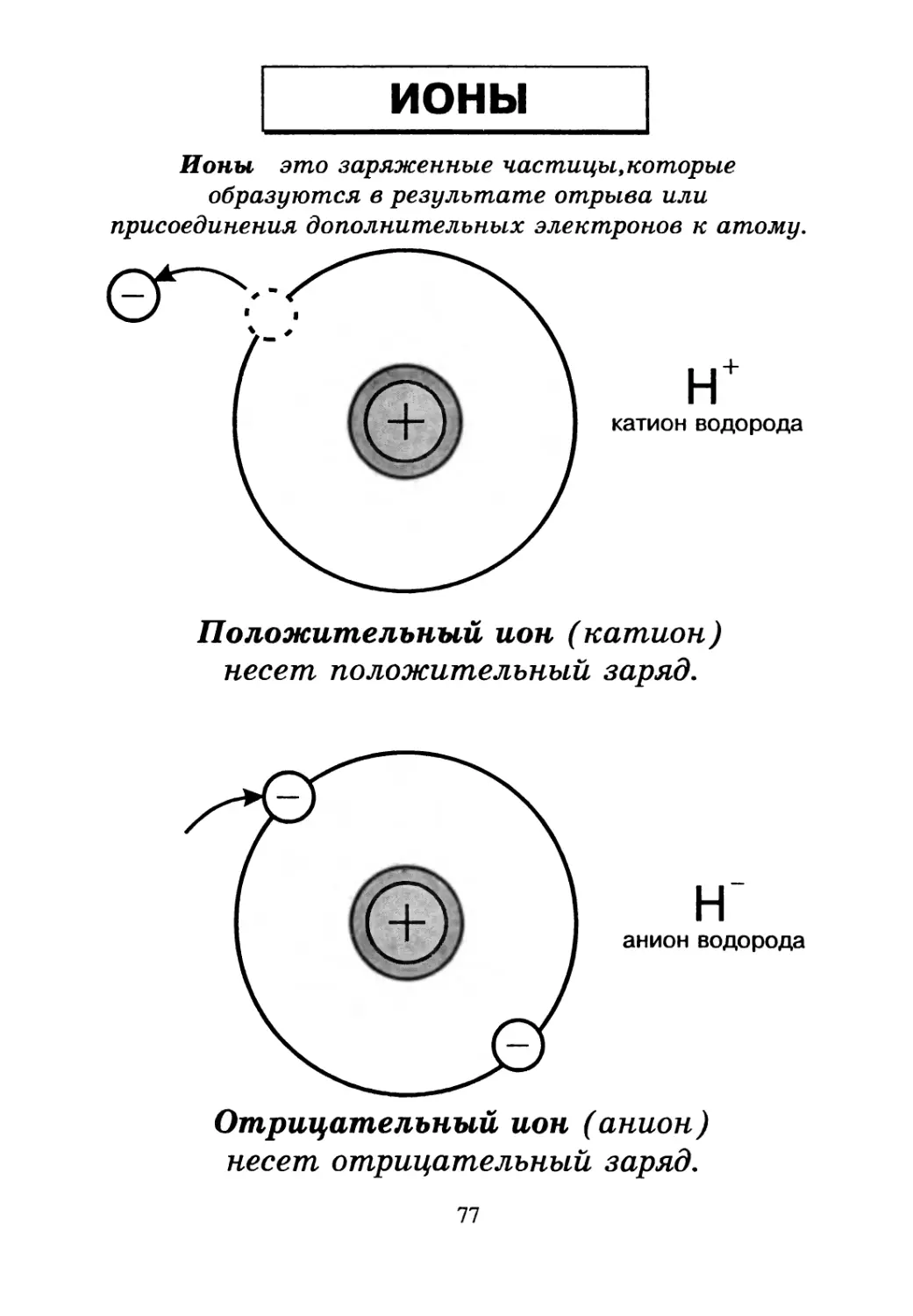
ионы
Ионы это заряженные частицы,которые
образуются в результате отрыва или
присоединения дополнительных электронов к атому.
Положительный ион (катион)
несет положительный заряд.
Отрицательный ион (анион)
несет отрицательный заряд.
77
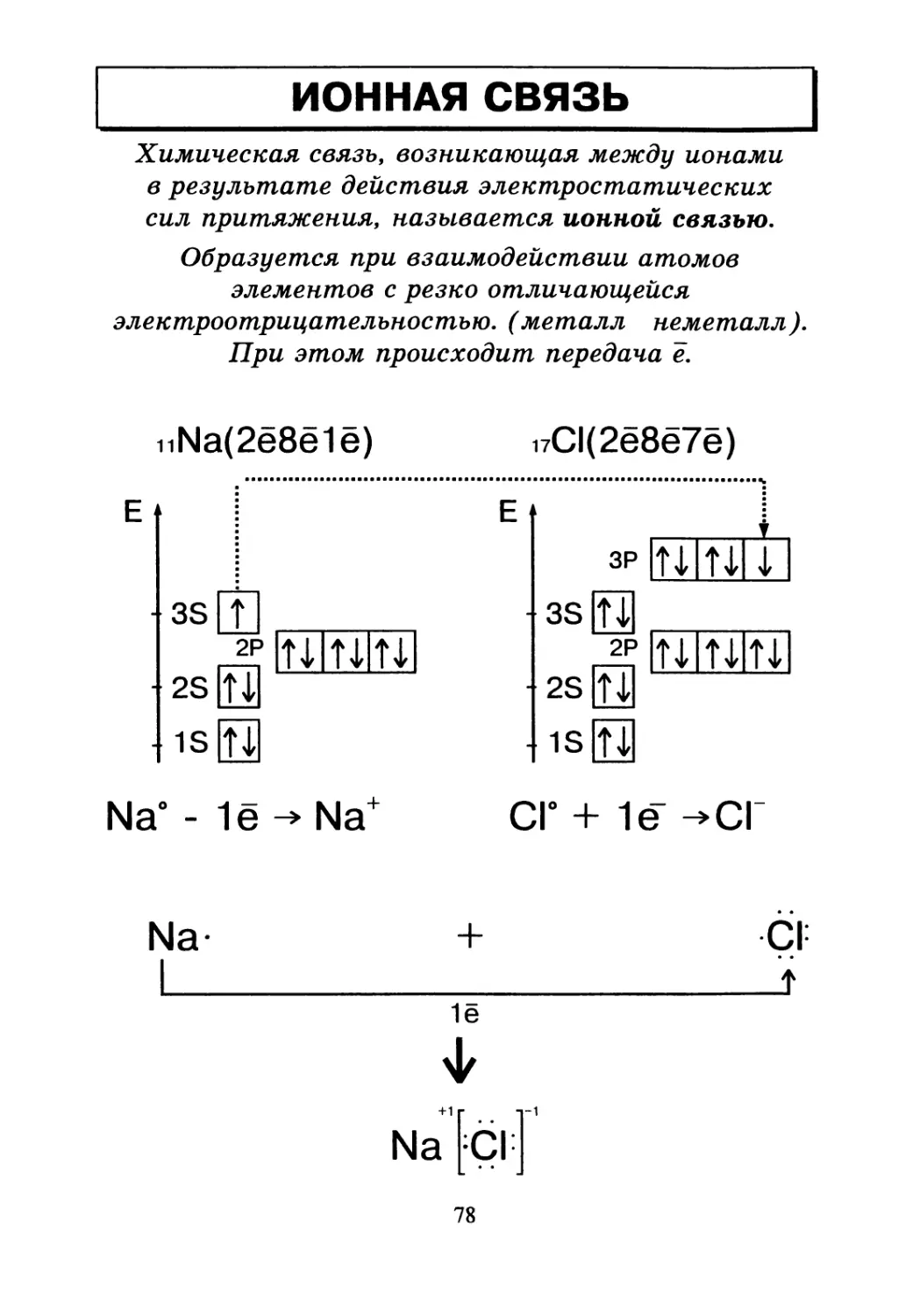
__________ИОННАЯ СВЯЗЬ_________________
Химическая связь, возникающая между ионами
в результате действия электростатических
сил притяжения, называется ионной связью.
Образуется при взаимодействии атомов
элементов с резко отличающейся
электроотрицательностью. (металл неметалл ).
При этом происходит передача ё.
nNa(2e8e1e)
17С1(2ё8ё7ё)
Е
- 3S t
л
2S[U
isR
Na° - 1ё Na+
Cl° + 1е ^СГ
Na-
Cl:
78
СТЕПЕНЬ ОКИСЛЕНИЯ
Степень окисления это условный заряд атома
в молекуле. Значение степени окисления
определяется числом электронов,смещенных от
атома данного элемента к атому другого элемента.
Степень окисления имеет знак "+” если ё
отданы и знак ' если ё присоединены.
Определение степени окисления
элемента по формуле:
1. Степень окисления, как у свободных атомов,
так и у атомов в соединениях с ковалентной
неполярной связью равна нулю.
Н2° ; О2° ; Na° ; S°
2. В бинарных соединениях: у правого - по
формуле | N-8|, где N - номер группы в
периодической системе элементов.
Степень окисления второго элемента
рассчитывается по формуле соединения.
Мп Г) Степень окисления кислорода равна 6 - 8 = -2
l\ld2kJ х _ степень окисления натрия
+ 1 -2
(-2)-1+х-2 = о х = +1 Na2O
+1 +6 -2
3. В сложных веществах (H2SO4)
Степень окисления водорода равна +1;
кислорода -2, серы - х
(+1) • 2 + х 1 +(-2)-4 = 0 х = +6
В соединениях сумма значений
степеней окисления равна нулю.
79
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
______________РЕАКЦИИ_______________
Реакции, идущие с изменением степени окисления
атомов, входящих в состав реагирующих веществ,
называются окислительно-восстановительными.
Процесс отдачи
электронов называется
окислением,
ло - л +п
Э - пе = Э
/
восстановитель
Процесс присоединения -
восстановлением
ЛО , _ -п
Э + пе — Э
Атомы или ионы,
которые в данной
реакции
присоединяют
электроны, являются
окислителями,
а которые
отдают электроны
восстановителями.
+1 -2
2Li2O
/
окислитель
4е
I---------->
4Li” + Ог =
восстановитель окислитель
(окисляется) (восстанавливается)
окисление взаимо-
степени -------------------—----------------►
.9 -9 -1 П 4-1 4-9 4-9 связанные
окисления u ~ 1_______г °
восстановление процессы
80
СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ
РЕАКЦИЙ (МЕТОД ЭЛЕКТРОННОГО БАЛАНСА)
Алгоритм составления уравнения Пример
1. Записать схему реакции 2. Определить степень окисления атомов до и после реакции. 3. Подчеркнуть знаки химических элементов,которые меняют степень окисления. 4. Составить электронные уравнения (показать процесс отдачи и присоединения электронов) 5. Сбалансировать заряды 6. Определить коэффициенты при окислителе и восстановителе 7. Подписать: процессы окисления восстановления; окислитель восстановитель. 8. Составить окончательное уравнение. Li + О2 => Li2O л +1-2 Ы1+О2 => L12O т . о т.+1 л процесс восстановитель — 1е => L1 4 окисления окислитель Ог° 4" 4б = > 20 1 пРоцесс vyz । i восстановления + 1 -2 4Li° + О20 = 2Li2O ОВР
XUMU4ECKUE УЛЫБК11
Попасть в кислоту для него неудача.
Но он перетерпит без вздохов, без плача.
Зато в щелочах у фенолфталеина
Начнется не жизнь, а сплошная малина.
От щелочи я желт, как в лихорадке,
Краснею от кислот, как от стыда.
Но я бросаюсь в воду без оглядки,
Да здравствует нейтральная среда.
В воде фиолетовым я становлюсь,
А в щелочь попасть я очень боюсь,
С испуга все время синею здесь я,
Краснеет в кислотах рубашка моя.
82
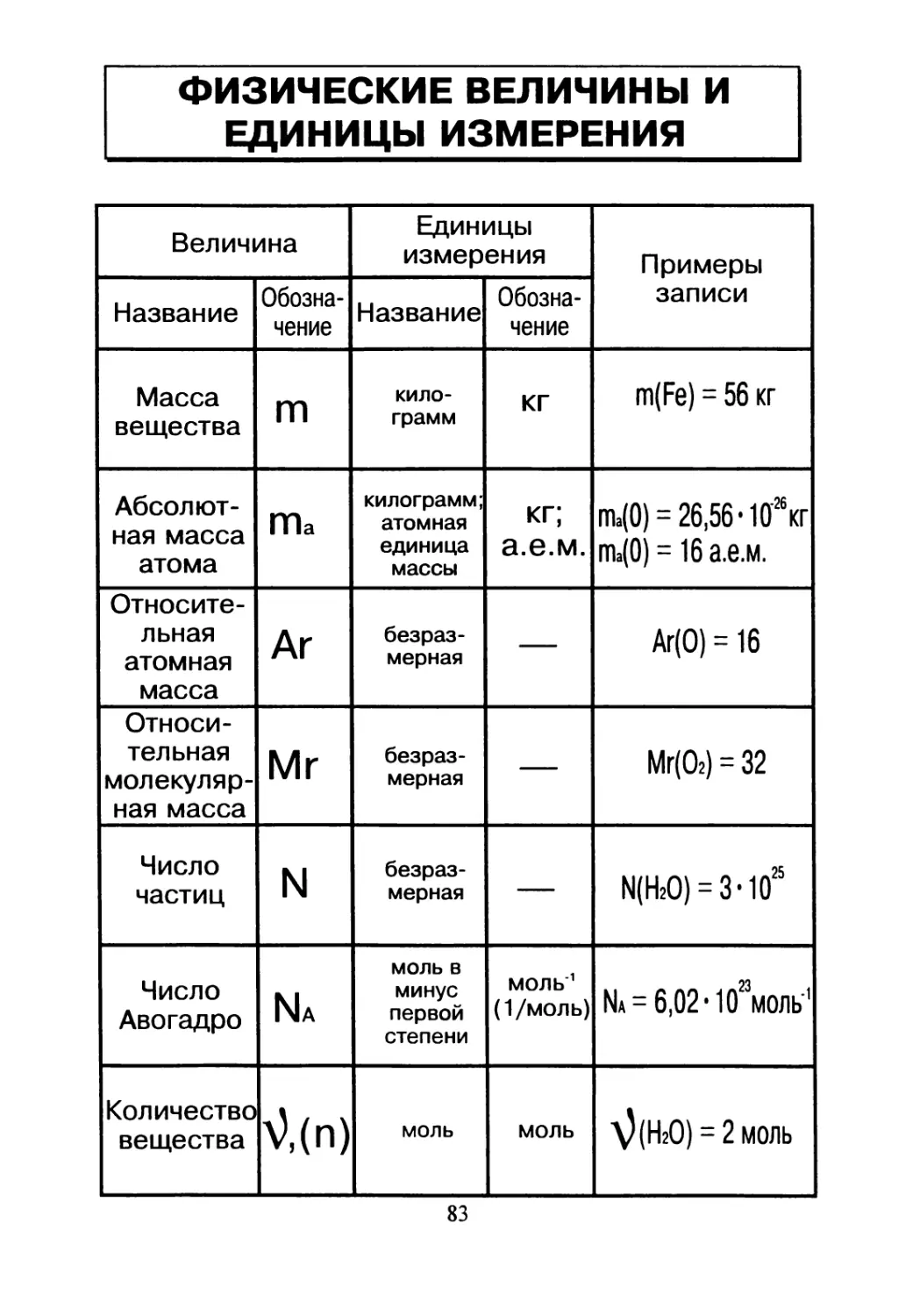
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ И
ЕДИНИЦЫ ИЗМЕРЕНИЯ
Величина Единицы измерения Примеры записи
Название Обозна- чение Название Обозна- чение
Масса вещества m кило- грамм кг m(Fe) = 56 кг
Абсолют- ная масса атома ma килограмм; атомная единица массы кг; а.е.м. та(0) = 26,56- Ю^кг та(0) = 16 а.е.м.
Относите- льная атомная масса Ar безраз- мерная — Аг(О) = 16
Относи- тельная молекуляр- ная масса Mr безраз- мерная — Мг(Ог) = 32
Число частиц N безраз- мерная — N(H2O) = з-ю25
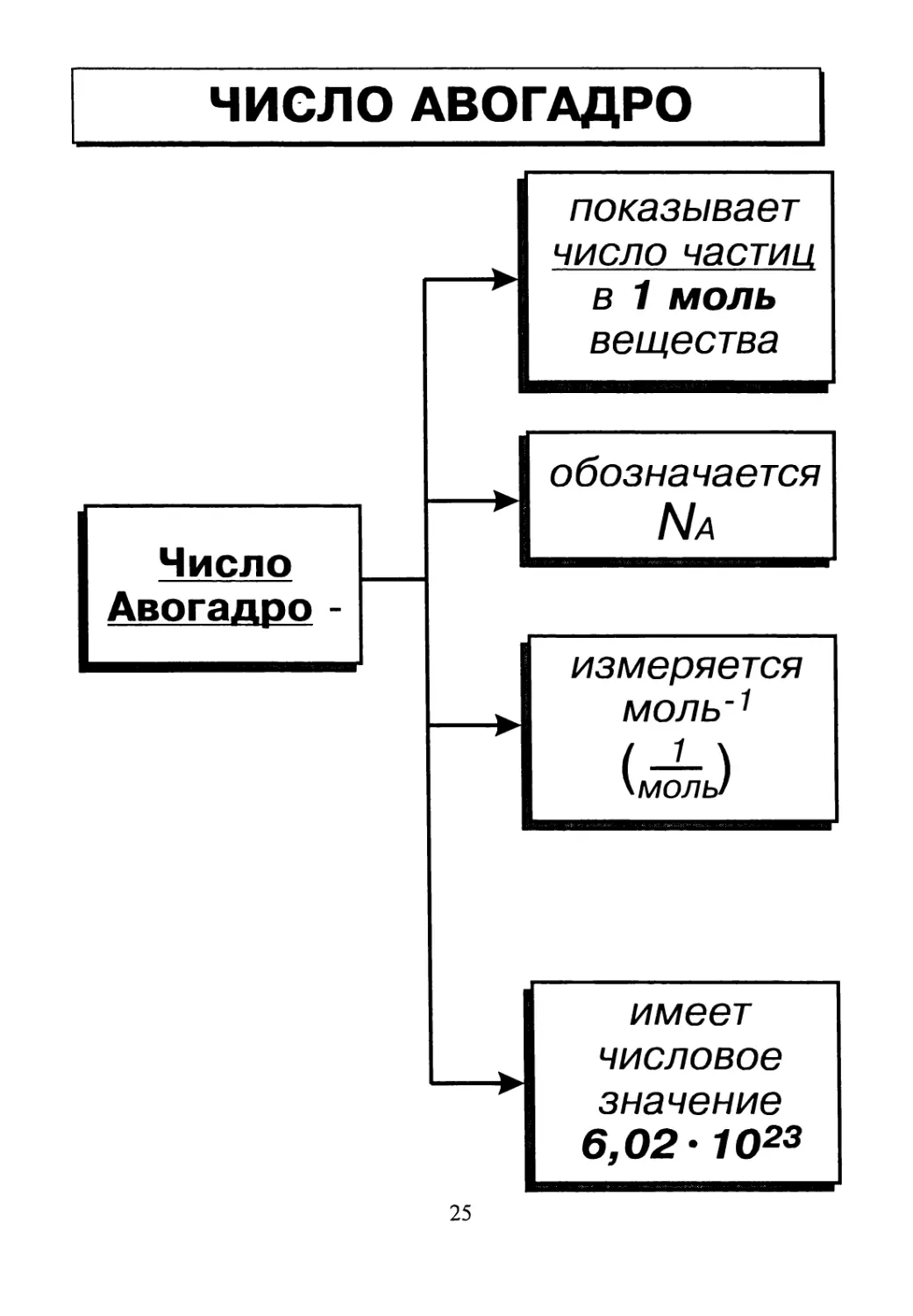
Число Авогадро Na моль в минус первой степени МОЛЬ’1 (1/моль) Na = 6,02-1 Осмоль'1
Количество вещества ^,(n) моль моль ^(НгО) = 2 моль
S3
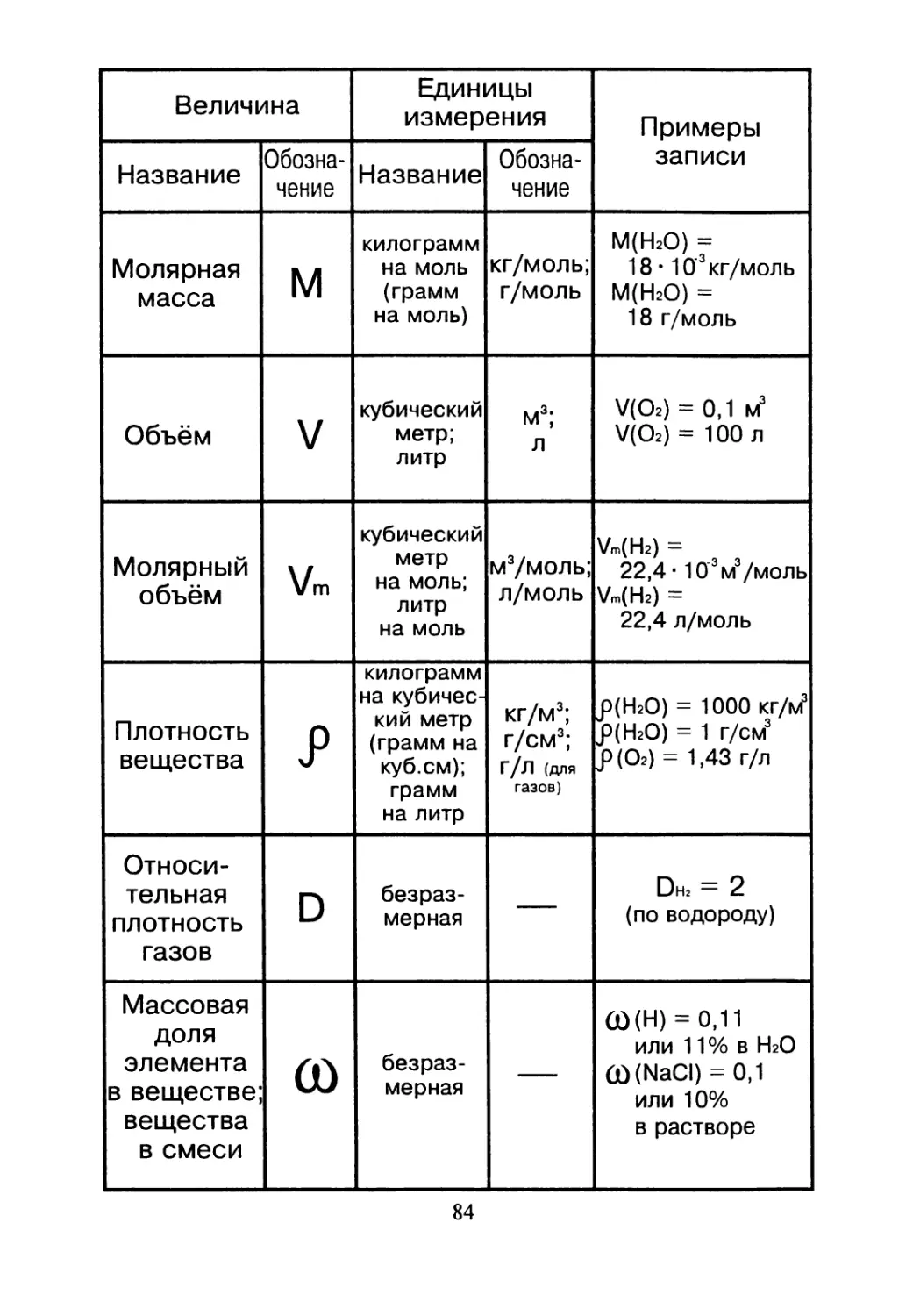
Величина Единицы измерения Примеры записи
Название Обозна- чение Название Обозна- чение
Молярная масса м килограмм на моль (грамм на моль) кг/моль; г/моль М(Н2О) = 18 • 10’3 кг/моль М(НгО) = 18 г/моль
Объём V кубический метр; литр м3; л V(O2) = 0,1 м3 V(O2) = 100 л
Молярный объём Vm кубический метр на моль; литр на моль м3/моль; л/моль Vm(H2) = 22,4 • 103м3/моль Vm(H2) = 22,4 л/моль
Плотность вещества килограмм на кубичес- кий метр (грамм на куб.см); грамм на литр кг/м3; г/см3; г/л (для газов) р(Н2О) = 1000 кг/h/ J>(H2O) = 1 г/см3 J)(O2) = 1,43 г/л
Относи- тельная плотность газов D безраз- мерная — Dh, = 2 (по водороду)
Массовая доля элемента в веществе; вещества в смеси CD безраз- мерная — 00(H) = 0,11 ИЛИ 1 1% В НгО 00(NaCI) = 0,1 или 10% в растворе
84
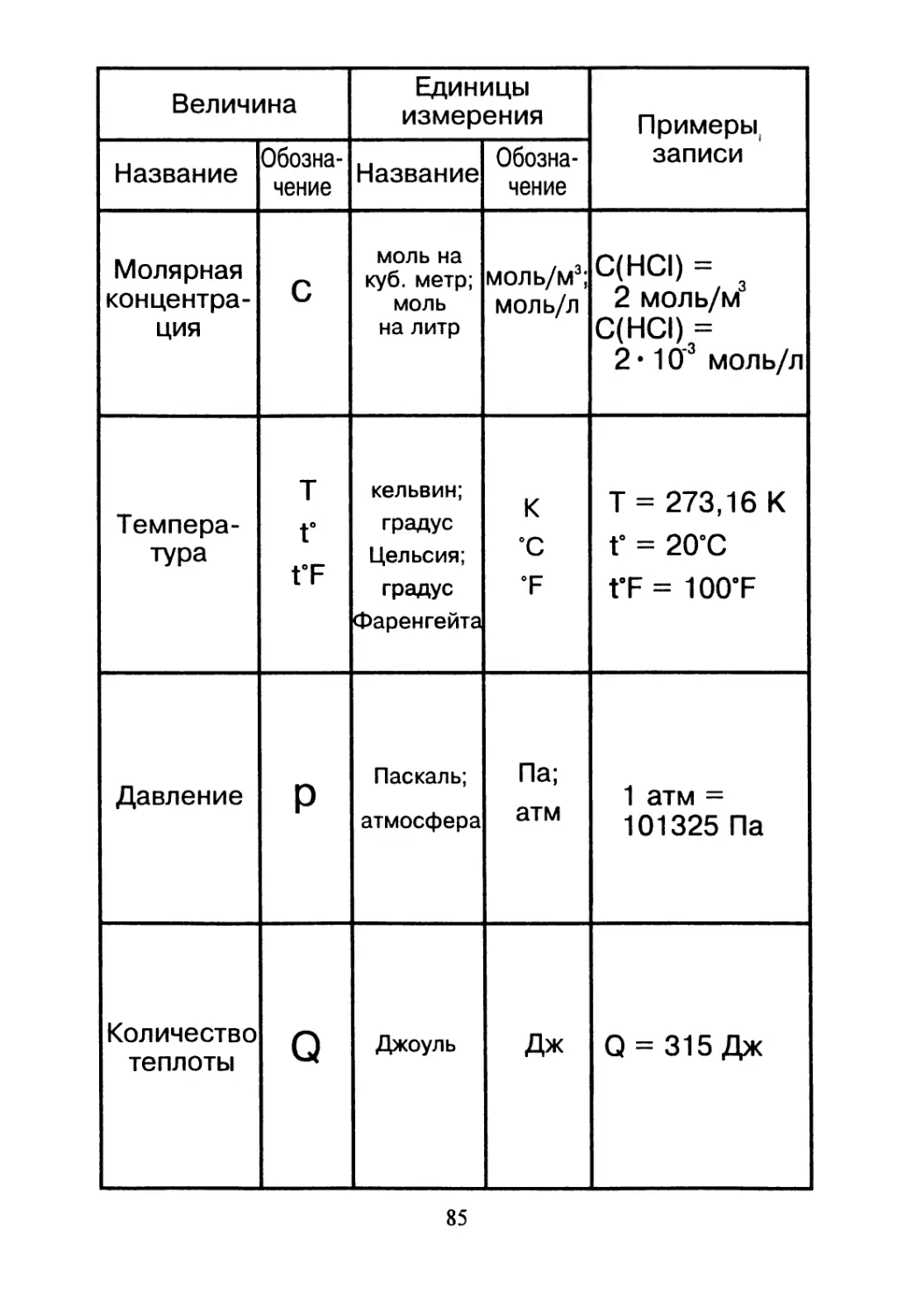
Величина Единицы измерения Примеры,
Название Обозна- чение Название Обозна- чение записи
Молярная концентра- ция С моль на куб. метр; моль на литр моль/м3; моль/л С(НС1) = 2 моль/м3 С(НС1) = 2 • 10’3 моль/л
Темпера- тура т г t’F кельвин; градус Цельсия; градус Фаренгейта -п 6 * Т = 273,16 К Г = 20’С t’F = 100’F
Давление Р Паскаль; атмосфера Па; атм 1 атм = 101325 Па
Количество теплоты Q Джоуль Дж Q = 315 Дж
85
РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ
Si Н С Р S Br Cl N О F
МЕТАЛЛЫ ---------------------------------------1
Электроотрицательность увеличивается
ЭЛЕКТРОХИМИЧЕСКИЙ
РЯД НАПРЯЖЕНИЙ
МЕТАЛЛОВ
К Са Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
86
Названия химических элементов с порядковыми номерами 104-109 рекомендованы
Комиссией ИЮПАК по неорганической номенклатуре в августе 1994г.
I ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА VII VIII Периодический закон открыт Д.И. МЕНДЕЛЕЕВЫМ в 1869 году
1 н 1 Хх 100794 ВОДОРОД (Н) 2 Не 4.002602 ГЕЛИЙ
и III IV V VI
2 Li литий Ве 4 9,012182 БЕРИЛЛИЙ 5 в 10,811 БОР 6 с 12,011 УГЛЕРОД n АЗОТ 8 О 15,9994 КИСЛОРОД 9 F 18.9984032 ФТОР 10 Ne 20,1797 НЕОН
3 Na 11 22,98976£ НАТРИЙ Mg 12 о 24,3050 МАГНИЙ 13 А1 26,981539 АЛЮМИНИЙ 14 Si 28,0855 КРЕМНИЙ 15 О 30,973762 ФОСФОР 16 S 32,066 СЕРА 17 С1 35,4527 ХЛОР 18 А Аг 39,948 АРГОН
4 К 19 Х 39,0983 КАЛИЙ Са 20 40,078 КАЛЬЦИЙ Sc 21 44,955910 СКАНДИЙ Ti 22 47,88 ТИТАН V 23 50,9415 ВАНАДИЙ Сг 24 1,9961 ХРОМ mixj: МАРГАНЕЦ Fe 26 ЖЕЛЕЗО Со 27 58,93320 КОБАЛЬТ Ni 28 58,69 НИКЕЛЬ
29 Си 83.546 МЕДЬ L zn цинк 31 .,723 Са ГАЛЛИЙ L Ge ГЕРМАНИЙ 33 А As 74,92159 МЫШЬЯК 34 Se 78,96 СЕЛЕН 35 Вт 79,904 БРОМ 1 Кг КРИПТОН
5 Rb 37 * 85,4678 РУБИДИЙ Sr J8 СТРОНЦИЙ Y 39 88,90585 ИТТРИЙ Zr 40 91,224 ЦИРКОНИЙ Nb 41 92.90638 НИОБИЙ Mo J МОЛИБДЕН Тс 43 97,9072 ТЕХНЕЦИЙ Ru 44 101,07 РУТЕНИЙ K^ksosso РОДИЙ Pd 46 106,42 ПАЛЛАДИЙ
47 Ag 107,8682 О СЕРЕБРО " Cd КАДМИЙ L in индий “ Sn олово 81 Sb СУРЬМА 52 Те 127,60 ТЕЛЛУР 53 I 126,90447 ЙОД Хе КСЕНОН
6 Cs 55 132,90543 ЦЕЗИЙ Ва 56 137,327 БАРИЙ La* 57 ЛАНТАН Hf J ГАФНИЙ Та 73 180,9479 ТАНТАЛ W 74 183,85 ВОЛЬФРАМ Re 75 186,207 РЕНИЙ Os 76 190,2 ОСМИЙ Ir J7 ИРИДИЙ Pt 78 195,08 ПЛАТИНА
79 Аи 196,96654 ЗОЛОТО 80 у у Hff 200,59 О РТУТЬ 81 Т1 204,3833 ТАЛЛИЙ 82 РЬ 207,2 СВИНЕЦ 83 Bi 208,98037 ВИСМУТ 84 Ро 208,9824 ПОЛОНИЙ 88 At 209,9871 АСТАТ 86 Rn 222,0176 РАДОН Относительные атомные массы приведены по международной таблице 1985 года
7 87 Fr 223.0197 ФРАНЦИЙ Ra 88 226,0254 РАДИЙ Ас** 89 227 0278 АКТИНИЙ оь 2 ДУБНИЙ л Z жолиотий Rf 106 263,118 РЕЗЕРФОРДИЙ Bh 107 БОРИЙ 262.12 ТТ 108 Нп ГАНИЙ (265] Mt 109 (266] МЕЙТНЕРИЙ
*ЛАНТАНОИДЫ
Се 58 140 115 ЦЕРИЙ Рг 59 140 90765 ПРАЗЕОДИМ Nd 60 144 24 НЕОДИМ Pm6’ 144 9127 ПРОМЕТИЙ Sm62 150 36 САМАРИЙ Ей 63|Gd 64 ЕВРОПИЙ ГАДОЛИНИЙ ТЬ 65 158.92534 ТЕРБИЙ Dy 66 « 162 50 ДИСПРОЗИЙ Но67 164.93032 ГОЛЬМИЙ Ег 68 167 26 ЭРБИЙ Тт69 168 93421 ТУЛИЙ Yb 70 173 04 ИТТЕРБИЙ Lu 71 174 967 ЛЮТЕЦИЙ
««АКТИНОИДЫ
Th 90 232.0381 ТОРИЙ Ра 91 231 0358 ПРОТАКТИНИЙ и 92 238 0269 УРАН Np 93 НЕПТУНИЙ Ри 94 244 0642 ПЛУТОНИЙ Am“|Cm“ АМЕРИЦИЙ |кЮРИЙ Вк 97 247.0703 БЕРКЛИЙ Cf 98 24 2 0587 КАЛИФОРНИЙ Es 99 252.083 ЭЙНШТЕЙНИЙ Fm’°° 257.0951 ФЕРМИЙ Md'01 258,10 МЕНДЕЛЕВИЙ No 102 259 1009 НОБЕЛИЙ Lr 103 260.105 ЛОУРЕНСИЙ
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
(ДЛИННАЯ ФОРМА)
00
00
Периоды) Г руппы элементов
IA IIA IIIB Семейства IVB VB VIB VIIB VIIIB IB IIB IIIA IVA VA VIA VILA VIIIA
1 (Н) 1 H 2 He
3 4 5 6 7 8 9 10
2 Li Be В c N 0 F Ne
11 12 13 14 15 16 17 18
3 Na Mg Al Si P s Cl Ar
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
4 К Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Те I Xe
55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
Г7 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118
7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Ku
s1 s2 dl f2 f /•* f5 Л Г f7dl fJ f10 fn f12 f13 f14 d2 d* d4 d5 dG d7 d8 dy d10 Pl P2 p‘ p* P3 p“
S d d p
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
(ПОЛУДЛИННАЯ ФОРМА)
оо
40
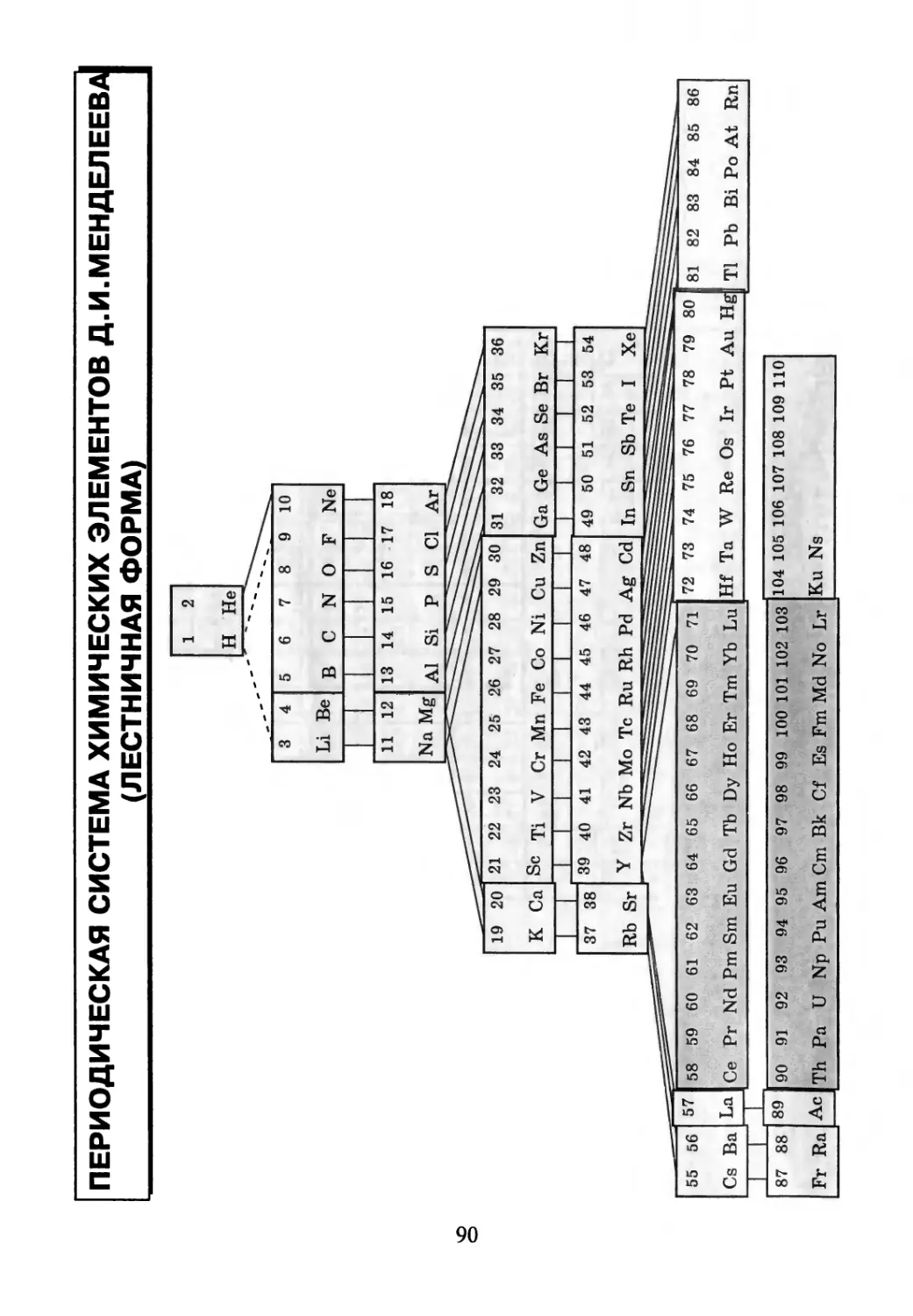
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
(ЛЕСТНИЧНАЯ ФОРМА)
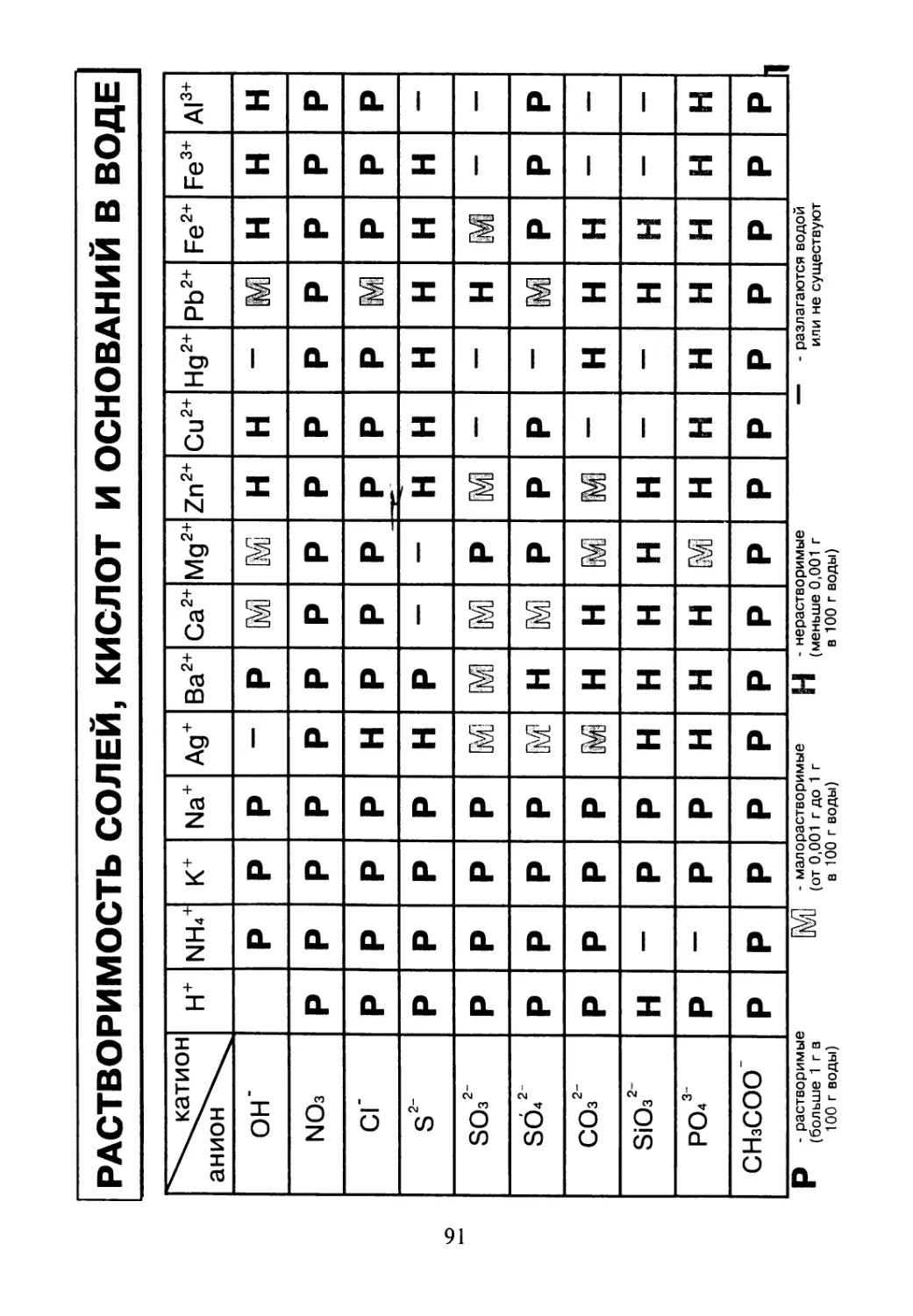
РАСТВОРИМОСТЬ СОЛЕЙ, КИСЛОТ И ОСНОВАНИЙ В ВОДЕ
"^^катион анион^^ н+ NHZ к+ Na+ Ад+ Ва2+ Са2+ Мд2+ Zn2+ Си2+ Нд2+ РЬ2+ Fe2+ Fe3+ Al3+
ОН’ Р р Р — Р [Mi М Н н — м н н н
NO3 р Р р Р р Р р Р Р р р р р р р
СГ р Р р Р н Р р Р_ Р р р м р р р
S2' р Р р Р н Р — — н н н н н н —
SO32’ р Р р Р М р М — — н м — —
SO42 р Р р Р м н М р р р — м р р р
СОз2’ р Р р Р м н н IM м — н н н — —
SiO32 н — р Р н н н н н — — н н — —
роЛ р — р Р н н н м н н н н н н н
СНзСОО’ р р р Р р р р р р р р р р р р
- растворимые FR/П ‘ малорастворимые L| - нерастворимые — - разлагаются водой
(больше 1 г в UwU (0Т о,ОО1 г до 1 г 8 (меньше 0,001 г или не существуют
100 г воды) в 100 г воды) в 100 г воды)
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
р - растворимо (больше 1 гв 100 г воды)
м - малорастворимо (от 0,001 до 1 г в 100 г воды)
J-J - нерастворимо (меньше 0,001 г в 100 г воды)
- газ - осадок
ц к - цвет - без цвета
в - вкус - без вкуса
3 - запах - без запаха
Met (Me) R - металл - радикал
max - максимальный
Z T°(t°) - математический знак суммы - температура
p J5 - давление - плотность
92
Литература
1. Ахметов Н.С., Кузнецова Л.Н. Неорганическая химия 7 - М.:
"Просвещение", 1983г.
2. Ахметов Н.С. Неорганическая химия - ч. 1,2. - М.: "Просве-
щенеи", 1990г.
3. Бердоносов С.С. Введение в неорганическую химию. - М.:
"МИРОС", 1995г.
4. Глинка Н.Л. Общая химия. - Л.: "Химия", 1984г.
5. Гроссе Э., Вайсмантель X. Химия для любознательных. - Л.:
"Химия", 1987г.
6. Гуревич А.Е., Исаев Д.А., Понтак Л.С. Физика и химия 5-6
класс-М.: "Просвещение", 1994г.
7. Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия 8 класс - М.:
"Дрофа", 1995г.
8. Кемпбел Дж. Современная общая химия - Т.1-3 - М.: "Мир",
1975г.
9. Колтун М. Мир химии - М.: "Детская литература", 1988г.
10. Кузменко Н.Е., Чуранов С.С. Общая неорганическая химия -
М.: "МГУ", 1977г.
11. Лидин Р.А., Молочко В.А. Химия для абитуриентов - М.:
"Химия" 1994 г.
12. Линсон И.А. Почему и как идут химические реакции - М.:
"Мирос", 1995г.
13. Манолов К. Великие химики ч.1,2 -М.: "Мир", 1985г.
14. Мартыненко Б.В. Кислоты и основания - М.: "Просвещение",
1988г.
15. Неорганическая химия. Энциклопедия школьника - М.: "Со-
ветская энциклопедия", 1985г.
16. Сатбалдина С.Т., Лидин Р.А Химия 8 класс - М.: "Просвеще-
ние", 1993г.
17. Стахеев А.Ю. Вся химия в 50-ти таблицах - М.: "МИРОС", 1993г.
18. Соловьев Ю.И, Трифонов Д.Н., Шамин А.Н. История химии - М.:
"Просвещение", 1984г.
19. Хомченко Г.П. Химия для поступающих в ВУЗы - М.: "Высшая
школа", 1985г.
93
Содержание
1. ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
1.1 Вещество. Свойства веществ..........................3
1.2 Молекулы и атомы. Атомно-молекулярное учение........4
1.3 Чистые вещества и смеси. Способы разделения смесей..5
1.4 Физические и химические явления.....................6
1.5 Химический элемент 7
1.6 Химические символы (Знаки химических элементов).....8
1.7 Знакомство с символами и названиями элементов.......9
1.8 Простые и сложные вещества. Аллотропия.............10
1.9 Химические формулы..................................11
2. КОЛИЧЕСТВЕННЫЕ ОТНОШЕНИЯ В ХИМИИ
2.1 Относительная атомная масса........................12
2.2 Относительная молекулярная масса...................13
2.3 Закон постоянства состава..........................14
2.4 Массовые отношения.................................15
2.5 Массовая доля элемента.............................16
2.6 Вывод химической формулы вещества по известной мас-
совой доле.............................................17
2.7 Валентность........................................18
2.8 Составление химических формул бинарных соединений (по
валентности элементов).................................19
2.9 Химическое уравнение...............................20
2.10 Химические уравнения (Алгоритм составления химическо-
го уравнения)..........................................21
2.11 Закон сохранения массы веществ....................22
2.12 Типы химических реакций...........................23
2.13 Количество вещества. Моль.........................24
2.14 Число Авогадро....................................25
2.15 Молярная масса....................................26
2.16 Молярный объем. Закон Авогадро....................27
2.17 Относительная плотность газов.....................28
2.18 Решение задач по химическим уравнениям............29
2.19 Тепловой эффект химической реакции................30
3. КИСЛОРОД
3.1 Кислород.............................................31
3.2 Кислород. Химические свойства......................32
3.3 Озон. (Аллотропная модификация кислорода) .........33
3.4 Воздух.............................................34
94
4. ВОДОРОД
4.1 Водород.............................................35
4.2 Водород. Химические свойства......................36
5. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
5.1 Оксиды............................................37
5.2 Оксиды. Химические свойства.......................38
5.3 Названия некоторых оксидов........................39
5.4 Кислоты. Классификация...........................40
5.5 Названия кислот и солей...........................41
5.6 Кислоты. Химические свойства......................42
5.7 Основания.........................................43
5.8 Основания. Химические свойства....................44
5.9 Соли..............................................45
5.10 Соли. Химические свойства.........................46
5.11 Генетическая связь. (Связь между различными классами
соединений)...........................................47
6. ВОДА. ВОДНЫЕ РАСТВОРЫ
6.1 Вода..............................................48
6.2 Аномалии воды.....................................49
6.3 Вода-растворитель.................................50
6.4 Массовая доля растворенного вещества.............51
6.5 Молярная концентрация растворенного вещества......52
6.6 Химические свойства воды..........................53
7. СТРОЕНИЕ АТОМА
7 1 Планетарная модель атома.........................54
7.2 Атомное ядро......................................55
7.3 Изотопы...........................................56
7.4 Электрон.........................................57
7.5 Движение электрона в атоме.......................58
7.6 Формы электронных орбиталей.......................59
7.7 Электронная оболочка атома.......................60
7.8 Электронная формула...............................61
7.9 Ядерные реакции..................................62
8. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
8.1 Периодический закон - фундамент всей химии 63
8.2 Периодическая система химических элементов
Д. И. Менделеева.................................... 64
8.3 Числа периодической системы химических элементов
Д. И. Менделеева......................................65
95
8.4 Изменение свойств элементов по основным направлениям
системы.................................................66
8.5 Звездность периодической системы....................67
8.6 План характеристики химических элементов по периодиче-
ской системе химических элементов Д.И.Менделеева........68
8.7 «Укрепители периодического закона»..................69
8.8 Электронное строение атомов элементов II периода и
свойства их высших оксидов и гидроксидов................70
9. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ. ОКИСЛИТЕЛЬНО-
ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
9.1 Электроотрицательность..............................71
9.2 Электроотрицательность некоторых элементов..........72
9.3 Ковалентная неполярная связь........................73
9.4 Ковалентная полярная связь..........................74
9.5 Донорно-акцепторная (координационная) связь.........75
9.6 Ионы................................................76
9.7 Ионная связь........................................77
9.8 Степень окисления.................................... 78
9.9 Окислительно-восстановительные реакции...............79
9.10 Составление уравнений окислительно-восстановительных
реакций (метод электронного балланса)...................80
10. ПРИЛОЖЕНИЕ
10.1 Химические улыбки..................................81
10.2 Физические величины. Единицы измерения.............82
10.3 Физические величины. Единицы измерения.............83
10.4 Физические величины. Единицы измерения.............84
10.5 Ряд электроотрицательности. Электрохимический ряд на-
пряжений металлов.......................................85
10.6 Периодическая система химических элементов
Д.И.Менделеева (короткая форма).........................86
10.7 Периодическая система химических элементов
Д.И.Менделеева (длинная форма)..........................87
10.8 Периодическая система химических элементов
Д.И.Менделеева (полудлинная форма)......................88
10.9 Периодическая система химических элементов
Д.И.Менделеева (лестничная форма) 89
10.10 Растворимость солей, кислот и оснований в воде....90
10.11 Условные обозначения..............................91
Литература..............................................93
96
По вопросам приобретения книг обращайтесь в магазины
г.Москвы и Московской области:
“Фегаро”
“Дом педагогической книги”, ул. Б.Дмитровка, 7/5
“Библио Глобус”, ул. Мясницкая, д.6
тел. 233-30-24
тел. 229-68-32
тел. 925-14-90 доб. 324
"Центральный Детский Мир", Театральный проезд, д.5
“Московский дом книги”, ул. Новый Арбат, д.8
“Молодая Гвардия”, ул. Б. Полянка, 28
"Дом книги Медведково”, Заревый пр., д.12
"Дом книги Сокольники”, ул. Русаковская, д.27
"Дом книги в Измайлово", Измайловская пл., д.2
"Дом книги в Орехово", Каширское шоссе, д.88/26, стр. 2
"Дом книги на Волоколамке", Волоколамское шоссе, д. 15/22
"Дом книги на Преображенке", Преображенский вал, 16-1
"М-Евроном-Ясенево"
тел. 926-21-85
тел. 203-82-42
тел. 238-00-32
тел. 478-54-79
тел. 264-81-21
тел. 165-92-56
тел.391-85-54
тел. 158-13-51
тел. 964-42-26
тел. 423-34-11
“Мир школьника”, 3-ий Митинский переулок, д. 1
“Мир школьника-Отрадное”, ул. Хачатуряна, д.20
тел. 754-00-66
тел. 907-68-34
“Мир школьника-Текстильщики”, ул. Шоссейная, стр.1
“Мир школьника-Лось”, ул. Е.Абакумова, д. 10
“Мир школьника-Нагатино”, ул. Нагатинская, д.20
“Мир школьника 2”, Измайловский бульвар, д.15, стр. 2
“Мир школьника 2”, Новокосино, ул. Салтыковская, д.27
"Родник-книга", ул. Судостроительная, д.29
“Тушино”, бульвар Яна Райниса, д.21
тел. 179-57-17
тел. 182-67-07
тел. 116-02-66
тел. 965-63-92
тел. 702-05-73
тел. 118-43-33
тел. 493-21-87
“Торговый дом “Альбатрос”, 9-ая Парковая ул., д.66-72
"Учколлектор №2", ул. ВелоЗаводская, д. 11/1
"Учколлектор педвузов №3", Лобнинская ул., д.9
“Шаг к пятерке”, ул. Красный Казанец, д.20
“Шаг к пятерке”, ул. Новомарьинская, д. 14/15
“Школьник-60", Ленинский проспект, 94/А
"Полезная книга", ул. Борисовские пруды, д. 18 корп. 1
"ПБОЮЛ Сугробов", Планерная, д.7, кор. 1
тел. 118-38-52
тел. 483-75-25
тел. 373-96-49
тел. 345-51-10
тел. 431-04-15
тел. 342-90-24
тел. 495-75-07
Книжная ярмарка, с-к “Олимпийский”, 5 этаж, 52 место
г.Зеленоград, “Алекс и К”, Панфиловский пр-т, к. 1106-В
г.Люберцы, “Дом книги”, Октябрьский просп, д. 151 /9
-------------------------------- Регионы России -
г.Волжский, Волгоградская обл.,
тел. 532-76-61
тел. 554-04-45
г.Воронеж, "Учитель"
г.Екатеринбург, ул. М.-Сибиряка, 137, оф. 1а. "Алис"
г.Новосибирск, "Сибирский дом книги",
г.Новосибирск, "Топ-книга", (опт)
г.Ростов-на-Дону, "Ростпединфо",
г.Санкт-Петербург, "Школьная книга",
г.Сургут, "Родник",
г.Тула, "Созидание",
г.Уфа, "Эдвис",
г.Челябинск, "Урал-Пресс",
тел. (8443) 29-79-20
тел. (0732) 55-15-39
тел. (3432) 55-10-06
тел. (3832) 26-62-39
тел. (3832) 36-10-28
тел. (863-2) 62-04-26
тел. (812) 585-21-72
тел. (3462) 31-05-02
тел. (0872) 25-56-93
тел. (3472) 25-52-01
тел. (3512) 63-58-13
E-mail: izdat@kor.ru
Наш сайт: www.book.kor.ru
оперативная полиграфия
asiNmrwifli
визитки, бланки, календарики,
пленки для презентаций, буклеты,
листовки, приглашения и многое др.