Автор: Бендолл Дж.
Теги: физиология сравнительная физиология энергетика механика биохимия биофизика очерк издательство мир мышечное сокращение химия мышц
Год: 1970
ИЗДАТЕЛЬСТВО
«МИP »
MUSCLES, MOLECULES AND MOVEMENT
AN ESSAY IN THE CONTRACTION OF MUSCLES
by
J. R. BENDALL
B. A. (Cantab), Sc. D. (Cantab)
Meat Research Institute, Langford, Bristol
HEINEMANN EDUCATIONAL BOOKS LTD: LONDON 1969
Дж. Бендолл
МЫШЦЫ, МОЛЕКУЛЫ И ДВИЖЕНИЕ
ОЧЕРК ПО МЫШЕЧНОМУ СОКРАЩЕНИЮ
Перевод с английского
Ю.А. ШАРОНОВА
Под редакцией и с предисловием чл.-корр. АН СССР Μ.В. ВОЛЬКЕНШТЕЙНА
ИЗДАТЕЛЬСТВО «МИР» МОСКВА 1970
УДК 612 + 577.3
В этой живо написанной книге простым и ясным языком на основе новейших данных рассказано о сложных и тонких вопросах физиологии, биохимии и биофизики мышечного сокращения. Отдельные главы посвящены мышечным белкам, их структуре и биохимии, саркоплазматическому ретикулуму, механике, энергетике и химии мышечного сокращения. Книга хорошо иллюстрирована многочисленными рисунками и микрофотографиями.
Предназначена для биологов и врачей всех специальностей, в том числе для студентов, а также для научных работников других специальностей, интересующихся проблемами биологии.
Редакция биологической литературы
Инд. 2-10-2 99—70
ПРЕДИСЛОВИЕ К РУССКОМУ ИЗДАНИЮ
Книга Дж. Бендолла — одного из крупнейших специалистов по биохимии мышцы — посвящена биохимии и биофизике мышечного сокращения. Это явление, в высшей степени важное для физиологии, биофизики и биологии в целом, уже давно служит предметом многочисленных и разнообразных исследований. Биофизика мышцы — одна из наиболее традиционных и детально разработанных областей биофизики. Однако процессы мышечного сокращения столь сложны, что очень многое еще остается неясным и требует дальнейшего изучения.
Книга Бендолла обладает рядом крупных достоинств. В ней с большой глубиной и ясностью, в лаконичной форме рассмотрен целый комплекс вопросов — как тех, которые разрабатываются уже давно, так и возникших в последнее время. Автор четко формулирует нерешенные проблемы и потому книга не только содержит ценную информацию, но и указывает направления дальнейших исследований. В то же время в ней почти исчерпывающим образом изложены уже установленные факты и научные концепции. Ничто в этой книге еще не устарело. При ее создании автор консультировался с крупнейшими учеными, занимающимися изучением мышцы, — Г. Хаксли, Джин Хансон, А. Хаксли, Р. Дэвисом, К. Обером и другими. Не будет преувеличением сказать, что в мировой научной литературе нет равноценной монографии, посвященной мышечному сокращению.
Однако следует отметить, что в книге отражено не все сделанное в области биофизики мышцы. Так, в ней не упомянуты важные экспериментальные работы, проведенные Г. Μ. Франком и его сотрудниками. Автор почти не затрагивает физической теории мышечного сокращения, лишь вскользь упоминая о первой работе А. Хаксли, в которой была предложена теоретическая модель сокращающегося саркомера и проведены соответствующие расчеты. Между тем в дальнейшем эта модель была существенно упрощена и усовершенствована В. И. Дещеревским, впервые получившим характеристическое уравнение А. Хилла из теоретических соображений. Та же модель А. Хаксли была детально проанализирована в серии теоретических работ Т. Хил-
6
Предисловие к русскому изданию
ла. Наконец, недавно автором этих строк была предложена молекулярная физическая теория мышечного сокращения, не только дающая теоретический вывод уравнения А. Хилла, но и раскрывающая молекулярный смысл фигурирующих в нем констант. Перечень этих работ, с которыми стоит познакомиться читателю, интересующемуся биофизикой мышцы, приложен ниже.
В книге Бендолла рассматриваются свойства лишь поперечнополосатых скелетных мышц позвоночных. Для биофизики не менее интересны быстро сокращающиеся мышцы насекомых, выполняющие своеобразные автоколебания. В последнее время они стали предметом содержательных исследований Прингла, Чаплена и других. Некоторые из этих работ также указаны в прилагаемом перечне.
Сказанное никак не умаляет ценности книги. Можно не сомневаться в том, что каждый интересующийся мышечным движением, т. е. механо-химическими свойствами биологических систем, прочтет ее и с пользой и с удовольствием.
Μ. Волъкенштейн
ЛИТЕРАТУРА
1. Вол ькен штейн Μ. В., Физика мышечного сокращения, УФН, 100, № 4 (1970).
2. Д е щ е р е в с к и й В. И., Биофизика, 13, 928 (1968); 15, 53 (1970).
3. Дещеревский В. И., Биофизика, 15, 53 (1970); Бурав- цев В. H., Дещеревский В. И., Биофизика, 15, 541 (1970).
4. Д е щ е р е в с к и й В. И., Кинетическая теория сокращения поперечнополосатых мышц, 1969. Депонирована в ВИНИТИ № 818-69 Деп.
5. HillT., Proc. Nat. Acad. Sei. U. S., 61, 98 (1968).
6. Hill T., White G, Proc. Nat. Acad. Sei. U. S., 61, 514, 889 (1968).
7. Волъкенштейн Μ. B., BBA, 180, 562 (1969); Молекулярная биология, 3, № 6 (1969).
8. P г i η g 1 е J., Insect flight, Cambridge, 1957. (Дж. Прингл, Полет насекомых, ИЛ, Μ., 1963.)
9. Pringle J., Progress in Biophys. and Mol. Biol., 17, 1 (1967).
10. Chaplain R., Biochem and Biophys. Res. Comm., 24, № 4, 526 (1966).
11. Chaplain R., Arch, of Biochem. and Biophys.. 121, 154 (1967).
12. C h a p 1 a i ri R. et al., Kibernetik, 5, № I, 2 (1968); 5, № 2, 61 (1968); 5, № 5, 177 (1969).
...потому
Дам беспокойного я спутника ему:
Как бес, дразня его, пусть возбуждает к делу!
Гёте, Фауст
ВВЕДЕНИЕ
Если читатель задумается о мышечном сокращении, он почти наверняка скорее представит себе движения балерины или штангиста, бег лошади или борзой собаки, нежели, скажем, биение сердца или медленные движения кишечника. Еще менее вероятно, что ему придет на ум отнести к тем же явлениям движение змеи, захлопывание раковины моллюска или хватательное движение щупалец актинии. Однако в основе всех этих действий, а также движений многих низших животных и растений лежат очень сходные, а иногда даже и более высокоорганизованные процессы. Даже у высших растений мы можем найти примеры искусных движений — такие, скажем, как у орхидеи-мухоловки, когда она хватает свою жертву, или у листьев мимозы, когда к ним прикасаются. У менее высокоразвитых организмов это волнообразные движения трипаносом сонной болезни, биение хвостов мириадов сперматозоидов при оплодотворении яйца или перемещения хромосом в процессе первого и всех последующих митозов этого яйца, которые и привели к тому, что возник читатель этой страницы [160].
У всех этих разнообразных явлений имеется одна общая черта — превращение химической энергии АТФ в механическую через посредство системы сокращающихся нитей. Другая черта, общая для многих явлений такого рода, — наличие двух параллельных рядов микронитей, состоящих из белков актина и миозина [57, 78, 130, 140, 160]. Специфическая система из нитей актина и миозина, скользящих относительно друг друга таким образом, что одни из них входят в промежутки между другими, характерна для всех поперечнополосатых скелетных мышц высших животных [56, 57, 80, 81]. Нас
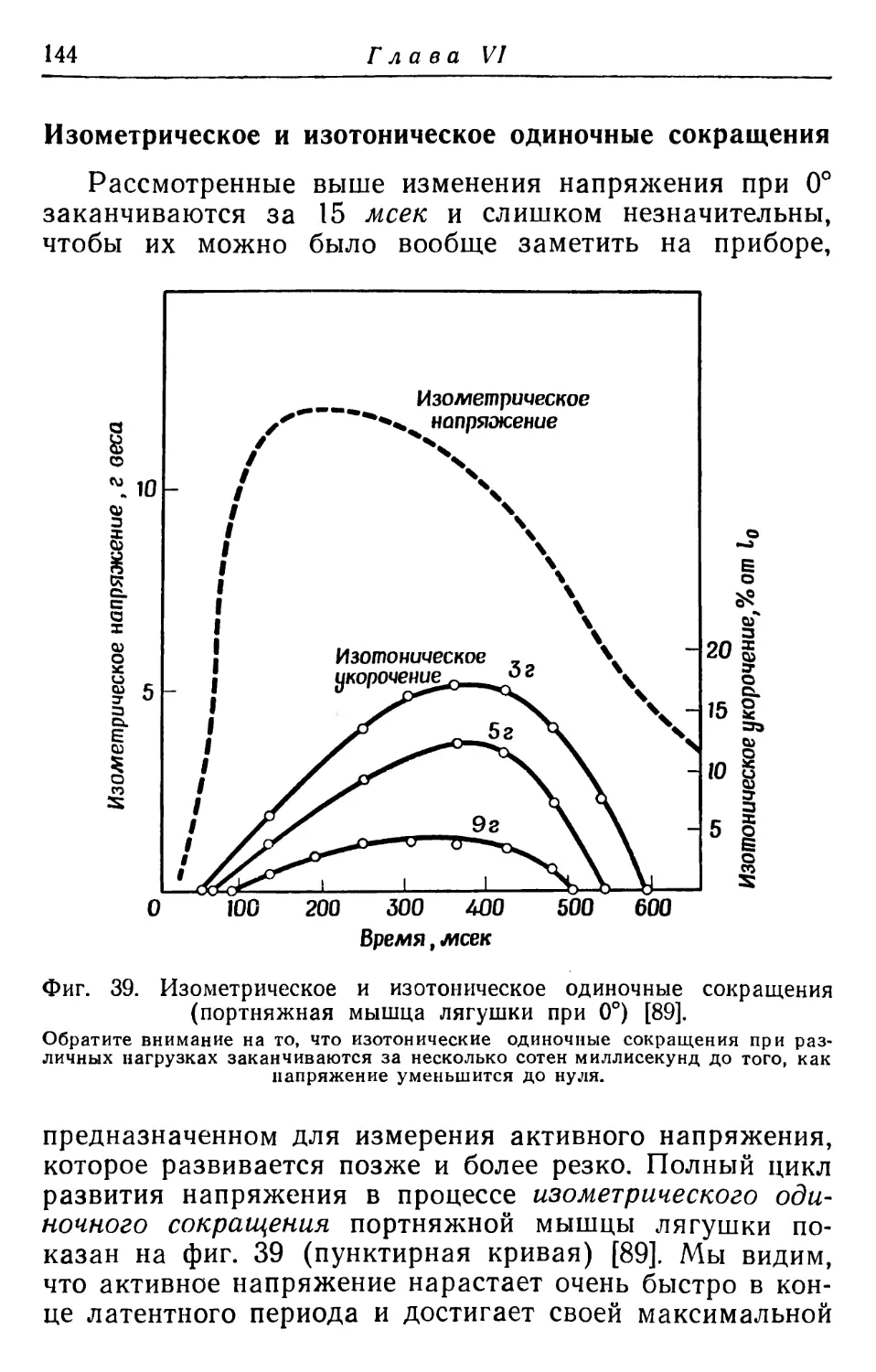
Фиг. 1. Схема одного участка длинной мышцы спины быка, показывающая направление волокон относительно позвоночника.
а — слой соединительной ткани; б — мышечные волокна; в — остистые отростки; г — поперечные отростки; д — позвонки; е — ребра (пронумерованы). Здесь и на фиг. 2—4 соединительная ткань изображена толстыми черными линиями.
Фиг. 2. Лучевой сгибатель быка до и после продольного разреза.
Обратите внимание на короткие волокна в плоскости сечения, идущие от вентральной поверхности мышцы к дорсальной. Длина самой мышцы 19 см.
Фиг. 3. Полусухожильная мышца кролика длиной 3,5 см до и после продольного разреза.
Введение
9
будет интересовать здесь в основном только этот тип мышц, ибо, как ни странно, такая высокоразвитая система преобразования энергии не только наиболее подробно изучена со всех точек зрения, но и дала гораздо более простые ответы на основные вопросы, связанные с движением, чем кажущиеся на первый взгляд менее сложными системы, которые мы находим в гладких мышцах или у примитивных одноклеточных и многоклеточных организмов [140].
Фиг. 4. Подостная мышца быка (типичная двуперистая мышца), разрезанная в продольном направлении.
Видны мышечные волокна, идущие от наружного слоя соединительной ткани к толстому внутреннему слою, который проходит по середине мышцы. Длина мышцы 39 см.
Система актин — миозин обладает почти уникальной для белков особенностью: ей присущи не только структурные свойства (в том смысле, что белковые нити тянутся от одного конца мышечного волокна до другого), но и ферментативные. Первичным источником энергии скольжения служит расщепление АТФ в активных центрах, расположенных в каждой молекуле миозина на одном из ее концов (этот конец называют «головой» молекулы) [46]; затем энергия, выделившаяся при расщеплении АТФ, преобразуется в движение посредством взаимодействия миозина с близко расположенными нитями актина [144, 145]. Таким образом, миозин работает как фермент (в мономерной или полимерной форме) и, кроме того, обладает способностью образовывать очень длинные, хорошо организованные нити путем агрегации
Фиг. 5. Поперечное сечение пучка мышечных волокон у поверхности мышцы.
C наружной стороны мышцы можно видеть эпимизиум (1), объединяющий воедино все пучки; отдельные пучки окружены перимизиумом (2), а волокна — эндомизиумом (3). Соединительная ткань состоит главным образом из коллагена и нескольких эластиновых волокон. Диаметр мышечных волокон около 50 мк.
Фиг. 6. Продольное сечение волокна скелетной мышцы.
Видна характерная картина поперечной исчерченности. Обратите внимание на окружающую волокно сарколемму, в которую как составная часть входит собственно плазмалемма. Под сарколеммой расположены многочисленные ядра (на схеме не показаны) длиной около 2 мк. Диаметр волокна 50 мк.
Введение
11
неферментных концов («хвостов») своих молекул по типу бок к боку, конец к концу. Актин же служит примером того, как очень маленькие глобулярные молекулы мономера, укладываясь одна подле другой наподобие бусинок, образуют длинные полимеры. Такая полимеризация актина служит еще одним доказательством вездесущности АТФ в природе, ибо она также сопровождается расщеплением АТФ; образующийся при этом АДФ (аденозиндифосфат) по окончании процесса полимеризации остается присоединенным к звеньям полимера [57, 143].
Фиг. 7. Поперечное сечение части мышечного волокна.
Видна внутренняя упаковка волокон. В нефиксированных волокнах упаковка гораздо плотнее, чем показано на схеме. Между фибриллами проходят поперечные трубочки саркоплазматического ретикулума (на препарате приведенного здесь типа они не видны). Диаметр фибрилл 1-1,5 мк.
Перейдем теперь сразу от субмикроскопического уровня молекулярной организации интактной скелетной мышцы к надмикроскопическому и рассмотрим механизм взаимодействия всех мышечных компонентов, посредством которого осуществляются сложные движения наших балерин, штангистов, лошадей и борзых — движения, сами по себе не более и не менее прекрасные, чем те молекулярные процессы, на которых они основаны.
На фиг. 1—7 приведены схемы, иллюстрирующие основные структурные особенности строения мышцы [58]. На фиг. 1—4 изображены мышцы различных типов. Первая из них (фиг. 1), длинная мышца спины, является самой длинной мышцей тела. Но волокна и пучки
12
Введение
волокон, из которых она построена, не простираются по всей ее длине, а прикреплены к остистым отросткам по* звонков и у таких животных, как бык, направлены вперед и вниз к поперечным отросткам и к боковым поверхностям ребер. Сверху и сбоку мышца покрыта толстой коллагеновой оболочкой, у которой начинаются многие волокна. Благодаря такой структуре длина отдельного волокна этой мышцы лишь ненамного превышает 12 см даже у этого очень крупного животного. Такую же структуру имеют и мышцы второго типа, называемые веретенообразными. В этих мышцах соединительная ткань часто покрывает непрерывным слоем всю поверхность мышцы от одного сухожилия до другого. Волокна могут присоединяться к сухожилиям под острым углом, благодаря чему они не должны быть очень длинными. Примерами таких мышц могут служить лучевой сгибатель быка (фиг. 2) и малая полусухожильная мышца кролика (фиг. 3). У мышц третьего типа, называемых двуперистыми (фиг. 4), возможна еще большая экономия длины волокон благодаря наличию внутреннего слоя коллагена, делящего мышцу на две части. Этот тип структуры особенно сильно выражен у многоперистых мышц (например, у большой дельтовидной мышцы верхней части спины), где внутренние слои коллагена делят мышцу на три и большее число частей. У мышц четвертого типа, примером которых может служить длинная полусухожильная мышца задней конечности быка, волокна простираются по всей длине мышцы (около 47 см), но они усилены большим числом параллельных эластиновых волокон.
Сократительные волокна мышцы оканчиваются обычно у соединительной ткани, которая на каждом конце непрерывно переходит в сухожилие и принимает на себя напряжение при сокращении. Эта соединительная ткань построена в основном из коллагена, волокна которого по своей прочности подобны стали и имеют очень небольшую податливость под напряжением. Примером может служить чрезвычайно прочное ахиллово сухожилие, которое в верхней своей части переходит в разветвляющиеся слои соединительной ткани, частично покрывающей икроножную и камбаловидную мышцы. От
Введение
13
этих слоев соединительной ткани, или фасций, отходят все более и более мелкие ответвления, проникающие в вещество мышцы и образующие сложную трехмерную систему, не прерывающую продольного хода волокон самой мышцы. Изобразить такую структуру на рисунке невозможно, но на поперечном сечении части мышцы (фиг. 5), видно, как сетка коллагена становится все более мелкой по мере ее проникновения между самими мышечными волокнами; последние обычно образуют первичные пучки из 20—40 волокон.
На фиг. 6 показана структура волокна в продольном разрезе, а на фиг. 7 — в поперечном. На фиг. 6 можно видеть характерную поперечную исчерченность, природу которой мы вскоре обсудим. Тонкие линии снаружи волокна (на обеих схемах) изображают истинную клеточную мембрану, или плазмалемму, которая, подобно мембранам всех других клеток, состоит из трех слоев и имеет толщину около 100 А. Диаметр самого волокна составляет от 20 до 80 мк (0,02—0,08 мм, или 200 000— 800000 А). Внутри волокна сразу под плазмалеммой примерно через каждые 5 мк по его длине расположены ядра (на схемах не показаны). Ядер много, так как длинное тонкое мышечное волокно развивается из мышечных трубочек, каждая из которых содержит в себе одно или несколько ядер; позднее ядра перемещаются и располагаются рядами непосредственно под мембраной. Каждое волокно образовано из множества (1000—2000 и более) мелких, также исчерченных фибрилл (фиг. 7) диаметром 1—2 мк, тянущихся от одного конца волокна до другого. Оболочка этих фибрилл имеет иную структуру. Это трубочки и пузырьки саркоплазматического ретикулума, который имеет непосредственное отношение к передаче нервного импульса в мышце. Мышца содержит также митохондрии длиной около 2 мк, расположенные рядами между фибриллами (ср. фиг. 27); в митохондриях протекают процессы окислительного фосфорилирования, необходимые для снабжения мышцы энергией.
На фото I видно, что сами фибриллы заполнены микронитями (так называются тонкие нити актина и толстые нити миозина), уложенными в небольшие участки,
14
Введение
или саркомеры [57, 58]. Это и объясняет характерную картину поперечной исчерченности: тонкие нити актина, образующие так называемые 1-диски, дают светлые полосы (видимые и в световом микроскопе), а нити миозина, в большей или в меньшей степени перекрывающиеся с актиновыми нитями и образующие А-диски,— более темные полосы. Размер более светлой Н-зоны в средней части A-полосы зависит от длины мышцы, т. е. от того, как далеко нити актина выдвинуты из промежутков между нитями миозина. Сами нити актина берут начало на Z-пластинках, которые отчетливо видны в виде тонких линий на большинстве фотографий, полученных с помощью светового микроскопа. Помимо актина эти пластинки содержат и другие белки. Наиболее важным из них является тропомиозин, который во многом напоминает миозин и, по-видимому, выходит из Z-пластинок в обоих направлениях между мономерами (молекулами) актина, имеющими структуру двойных спиралей [37, 51, 81].
Не требуется слишком большого воображения, чтобы представить себе, как нити этих двух типов, сохраняя свою первоначальную длину, скользят одна вдоль другой; это скольжение может происходить пассивно (при растяжении мышцы) или активно — за счет энергии расщепления АТФ (при сокращении). В последнем случае нити актина в каждом саркомере перемещаются по направлению к центру.
ЧАСТЬ ПЕРВАЯ
МЫШЕЧНЫЕ БЕЛКИ, ФИБРИЛЛЫ И ВОЛОКНА
ГЛАВА 1
СТРУКТУРА И ОРГАНИЗАЦИЯ СОКРАТИТЕЛЬНЫХ БЕЛКОВ
Миозин, актин и тропомиозин
Белки миозин и актин, непосредственно участвующие в сокращении поперечнополосатой мышцы, содержатся в мышечных фибриллах в виде нитей двух типов—толстых и тонких (фото VIII и IX и фиг. 8) [56, 57, 58, 81]. Большую плотность и характерную анизотропию A-дисков саркомеров мышцы определяют толстые нити, каждая из которых состоит из 180 или 360 продольно ориентированных молекул миозина. Гораздо менее плотные изотропные 1-диски образованы похожими на бусинки молекулами глобулярного белка актина, уложенными в виде двойных спиралей (молекулярный вес актина меньше, чем у миозина) [81, 121]. На каждый отрезок тонкой нити, соответствующий по длине половине саркомера, приходится 400 бусинок актина, т. е. на каждую цепь в двойной спирали приходится по 200 бусинок. Следовательно, в отдельной цепи, проходящей через Z-пластинку, имеется около 800 молекул актина (фиг. 10). Как следует из химических данных, для саркомеров высших позвоночных молярное отношение актина к миозину равно примерно 4: 1, а весовое 1 :2. Это означает, что в каждой толстой нити саркомера должно находиться по крайней мере 360 молекул миозина [58, 63, 83, 122].
Реальное существование нитей двух типов и вывод о том, что механизм мышечного сокращения и расслабления состоит в активном или пассивном скольжении
16
Глава 1
нитей одного типа в промежутках между нитями другого типа, доказываются не только электронно-микроскопическими снимками интактных саркомеров; интактные нити действительно были выделены из миофибрилл [81]. Из фото VIII и фиг. 8, А очевидно, что любой реагент, разрушающий связи между двумя типами нитей, должен приводить к полному разрушению саркомеров.
Фиг. 8. Схематическое изображение структуры актиновых (тонких) и миозиновых (толстых) нитей.
А — двойная суперспираль актина с шагом 350-400 Å (см. текст) и нить миозина, из которой выступают расположенные спиралью головы молекул (6 голов на виток спирали), образующие 6 рядов, параллельных оси нити [82]; Б — поперечное сечение, на котором видно, что напротив каждого ряда выступов расположена одна нить актина [82]; В — структура толстых нитей мышцы по последним рентгенографическим данным [83]. Обратите внимание на то, что в отличие от модели, построенной по электронно-микроскопическим данным (схема 8, А), на этой модели головы расположены попарно.
Практически это осуществляется путем гомогенизации небольшого кусочка мышцы вплоть до фибрилл. Затем фибриллы помещают в так называемую «расслабляющую» среду, содержащую ионы Mg, АТФ и ЭГТК1 (агент, способный образовывать с ионами Ca хелатные соединения). Дальнейшая гомогенизация в мягких условиях вызывает полное разрушение фибрилл до нитей актина и миозина. Электронные микрофотографии пре1 ЭГТК — этиленгликоль-бис(аминоэтиловый эфир)-N,N'-τeτpayκ∙ сусная кислота.
Структура и организация сократительных белков
17
паратов, получающихся после такой обработки, приведены на фото II—IV.
Перейдем теперь к молекулам, из которых построены нити (фото II и III). Молекула миозина длинная и тонкая, с утолщением на одном конце. Ее средняя длина около 1500 А, а ширина в стержнеобразной части около 20 А [81, 133]; утолщенный конец молекулы (ее «голова») имеет длину 200 А и ширину около 40 А. Следовательно, отношение осей для всей молекулы равно почти 100 и значительно превышает величину 25, получаемую в результате гидродинамических исследований в растворе.
Молекулы актина, в мономерной форме имеющие диаметр около 55 А, расположены подобно бусинкам в ожерелье из двух ниток, закрученных одна вокруг другой в виде суперспирали (фото IV и фиг. 8,Л). Мы пользуемся термином «суперспираль» во избежание путаницы с α-спиральной, а также двойной или тройной спиральной конфигурацией полипептидных цепей самих белков. Шаг этих двойных суперспиралей весьма постоянен, но его величину часто бывает трудно определить по одной фотографии. Если же изучить много фотографий, то можно видеть, что точки пересечения двух нитей находятся на расстоянии 340—420 А друг от друга; точная величина зависит от метода препарирования, но, по-видимому, не зависит от вида животного [57, 59, 112]. Для получения электронных микрофотографий препараты необходимо фиксировать, и при этом трудно избежать их сморщивания. Поэтому для подтверждения электронно-микроскопических данных нефиксированные препараты или живую мышцу исследовали методом дифракции рентгеновских лучей под малыми и средними углами [44, 59, 83, 112]. Однако и этот метод не позволяет сделать окончательные выводы, хотя большинство последних данных [83] указывает на величину около 360 А. Постоянство шага спирали не обязательно означает, что в одном витке должно быть целое число бусинок. Но если считать, что это число равно 13, то при диаметре мономера актина 55 А шаг спирали должен быть равен 710 А, откуда расстояние между точками пересечения нитей равно 355 А; эта величина находится
18
Г лава 1
в диапазоне значений, полученных на основании электронно-микроскопических исследований, и очень близка к той, которую дает метод дифракции рентгеновских лучей [59, 83].
Измерения осложняются тем, что при исследовании тонких естественных и искусственных нитей в электронном микроскопе в них часто наблюдаются поперечные полосы, находящиеся на расстоянии около 400 А друг от друга [35, 45]. Возможно, именно эта структура обусловливает появление меридионального рефлекса на рентгенограммах, соответствующего периоду около 385 А. Что это за структура, пока еще с достоверностью не известно, но большинство данных, полученных в последнее время, дает основание полагать, что это полосы тропомиозина, возможно, ассоциированного с недавно открытым белком тропонином, и что оба белка уложены в канавках спиралей актина. Так или иначе, мы можем с уверенностью утверждать, что тонкие нити образованы мономерами актина, расположенными в виде двойной суперспирали с шагом 710—740 А [44, 83].
Субструктура
Для первичной структуры миозина и тропомиозина характерно высокое содержание кислотных и основных аминокислотных остатков, благодаря чему заряд молекулы очень велик (табл. 1). В отличие от миозина молекула актина имеет ι небольшой заряд. Другая его отличительная особенность — значительное содержание пролина. В том месте полипептидной цепи, где находится эта иминокислота, молекула изгибается, что препятствует образованию данных спирализованных участков. Этого обстоятельства наряду с влиянием большого числа массивных неполярных боковых цепей достаточно для объяснения очень низкой степени спиральности актина, обнаруживаемой при измерении дисперсии оптического вращения. Действительно, представим себе, что пролин распределен по цепи равномерно; тогда на участке между двумя «пролиновыми изгибами» находилось бы примерно по 20 аминокислотных остатков. Эти участки имели бы вид более или менее вытянутых полипеп-
Структура и организация сократительных белков
19
тидных цепей, которые, изгибаясь, укладывались бы друг на друга таким образом, чтобы неполярные группы были внутри молекулы, а заряды — снаружи. В результате молекула имела бы сферическую форму. Ее структура в отсутствие заметного числа S—S-связей между остатками цистеина стабилизировалась бы взаимодействиями неполярных групп внутри молекулы, водородными связями между пептидными группами двух цепей, а также взаимодействиями между незаряженными полярными группами. Все это давало бы очень компактную структуру, внутрь которой не могла бы проникать вода. Если расстояние между соседними пептидными связями считать равным 3 А, то можно ожидать, что диаметр такой молекулы будет равен примерно 60 Ä, что не очень сильно отличается от величины 55 А, получаемой из данных электронной микроскопии [59].
Миозин, как мы видели, очень отличается от актина; в его молекулах имеются длинные вытянутые участки с высокой степенью спиральности, которые, по-видимому, простираются в хвостовой части молекулы почти на 1300 А [102, 103, 133]. Молекула тропомиозина имеет аналогичное строение, но она короче [97, 102]. Несомненно, что такие структуры образуются благодаря взаимодействиям большого числа отрицательно и положительно заряженных боковых групп, расположенных вдоль молекулы. Например, в хвостовой части молекулы миозина на каждый третий незаряженный остаток приходится положительно или отрицательно заряженная боковая группа. Интересно, что в этих молекулах почти отсутствуют нарушения линейности, обусловленные остатками пролина.
Существенной особенностью миозина, отличающей его от тропомиозина, является, конечно, утолщение в головной части молекулы. На фото II оно выглядит небольшим по сравнению с остальной частью молекулы, но именно здесь расположены ферментативные центры и центры связывания с актином и происходит преобразование химической энергии в механическую, когда молекулы расположены в определенном порядке в толстых нитях миофибрилл. Природа этих головных участков была частично раскрыта в результате многочисленных
Таблица 1
Аминокислотный состав 1) структурных белков и их молекулярные веса (97, 122, 146, 147]
Аминокислота
Миозин
Легкий меромиозин (фракция 1)
Тяжелый меромиозин
Тропомиозин
Актин
Кислые
Аспарагиновая
98,5
98,4
96,9
107
93,5
Глутаминовая
182
249
162
254
109
Свободные кислотные группы 2)
(174)
(219)
(153)
(284)
(114)
Основные
Лизин
107
112
102
128
50,2
Гистидин
18,5
24,9
16,5
6,6
20,1
Аргинин
49,8
71,2
40,2
49,1
48,6
Полярные незаряженные
Треонин
51
39,1
52
31,1
75,4
Серин
45,2
40,3
46
47,9
64,4
Тирозин
23,2
10,7
24,8
18,0
42,9
Цистеин-SH
10,2
4,7
8,7
7,8
11,9
Амидные группы
(107)
(128)
(106)
(77)
(89)
Неполярные
Глицин
46,4
21,3
59,1
14,4
74,6
Аланин
90,4
96,1
86,3
129
80,7
Валин
49,8
45,1
56,7
32,3
49,7
Изолейцин
48,7
46,3
52
35,9
73,2
Лейцин
93,9
114
86,3
114
68,8
Фенилаланин
33,6
4,7
42,5
4,1
31,3
Триптофан
~5,0
—
—
—
10,2
Метионин
26,6
22,5
30,7
19,1
43,5
Особая
Пролин
25,5
0
37,8
2,0
50,2
М.В × 10–3
510
120-162
320-360
56
47
Степень спиральности, %
58
~100
45-51
95
8
1) Цифры означают число остатков данной аминокислоты на 1000 аминокислотных остатков.
2) Число свободных кислотных групп равно сумме числа остатков глутаминовой и аспарагиновой кислот минус число амидных групп.
Структура и организация сократительных белков
21
и упорных исследований химиков, проведенных в последние пятнадцать лет. Вначале было показано, что трипсин более или менее специфично расщепляет молекулу миозина на две фракции — на так называемые легкий (ЛММ) и тяжелый (TMM) меромиозины. JIMM соответствует прямой хвостовой области, a TMM-областям головы и «шейки» молекулы миозина и обладает всеми ферментативными свойствами исходной молекулы [102, 146].
Легкая фракция (ЛММ) по своей структуре очень напоминает тропомиозин В. Многочисленные данные рентгеноструктурного анализа, полученные в последнее время, а также результаты исследования дисперсии оптического вращения свидетельствуют о том, что ЛММ состоит из двух идентичных полипептидных цепей, закрученных одна вокруг другой в слегка искаженной α-спиральной форме, в результате чего образуется так называемая «спирализованная спираль» [102, 103]. Возможно, однако, что эта структура представляет собой тройную спираль. В пользу этого предположения говорят данные по разрушению молекулы в 12 M мочевине или в 5 M гуанидине ∙ HCl [166]. Если это так, то возникают некоторые трудности в объяснении структуры головной части молекулы, которая также должна была бы состоять из трех полипептидных цепей. К обсуждению этого вопроса мы еще вернемся. Во всяком случае, не подлежит сомнению, что ЛММ имеет вытянутую структуру с высокой степенью спиральности. Он образует основу структуры толстых нитей A-дисков. По данным электронной микроскопии, его длина варьирует от 600 до 900 Â, что согласуется с результатами гидродинамических измерений [81, 133]. Тяжелая фракция (TMM) построена более сложно, чем легкая. К ней относятся не только области головы и шейки молекулы, но также и часть ее хвоста [102, 146]. Это следует как из физических измерений, так и из электронных микрофотографий, которые показывают, что цепи имеют разную длину в зависимости от того, в каком месте трипсин атаковал исходную молекулу. Очевидно, что он может действовать в различных точках на довольно длинном отрезке основных цепей. Длины цепей TMM
22
Глава I
варьируют по крайней мере от 500 до 700 А. Это составляет от трети до половины всей молекулы, в то время как длина утолщенной области головы равна примерно 200 А (фото II). Все эти данные приводят к вполне определенному выводу, заключающемуся в том, что TMM содержит гораздо меньше спиральных участков, чем ЛММ, и что большинство их расположено в области шейки и той части хвоста молекулы, которая остается присоединенной к TMM (ее длина около 400 А) [102]. Таким образом, возможно, что сама область головы вовсе не содержит спиралей или содержит их в небольшом количестве. Вероятнее всего, она имеет структуру, характерную для типичного глобулярного белка, такого, как актин. Это следует также из очень большого содержания пролина в TMM (см. табл. 1) [114].
Дальнейшее ферментативное действие трипсина на TiMM приводит к образованию так называемого субфрагмента 1 (TMM С-1), который обладает всеми ферментативными и актинсвязывающими свойствами исходной молекулы [114]. Под электронным микроскопом он выглядит как круглый объект, размеры которого меньше головы самого миозина [133]. Его молекулярный вес — от 120 000 до 180000 [122]; по самым последним данным он равен 129 000 [114]. Какую часть головы миозина мог бы составлять субфрагмент 1, зависит от того, какой молекулярный вес мы примем для всей головы. В настоящее время представляется наиболее вероятным, что эта часть составляет примерно половину. Основанием для такого заключения служат недавние электронномикроскопические исследования, в которых молекулы миозина «оттенялись» по методу, известному под названием «круговое напыление» [141а]. В этом методе при напылении золотом или платиной образец вращается, что обеспечивает гораздо большую четкость электронных микрофотографий.
Результаты ясно показывают, что, во-первых, молекула миозина имеет две головы, причем величина каждой из них хорошо согласуется с размерами молекул TMM C-1; во-вторых, эти головы могут лежать либо одна за другой в направлении длинной оси молекулы,
Структура и организация сократительных белков
23
либо рядом, свидетельствуя о значительной гибкости короткого участка, с помощью которого они присоединены к ЛММ. В-третьих, при дополнительном изучении продуктов переваривания папаином было найдено, что участок хвоста (субфрагмент 2), отщепляющийся вместе с головой, имеет вид стержня и содержит большую долю спиральных участков. Лучше всего эти результаты можно иллюстрировать с помощью схемы (фиг. 9), на которой приведены все известные веса различных субфрагментов, находящиеся в удовлетворительном согласии с их длинами. Схема показывает, что область хвоФиг. 9. Схема молекулы миозина, построенная на основании электронных микрофотографий, полученных методом кругового напыления [141а].
На самом деле длинная прямая часть молекулы, изображенная здесь двумя параллельными прямыми линиями, состоит из двух нитей, закрученных одна вокруг другой так, что образуется спирализованная спираль.
ста состоит из двойной спирали (или из спирализованной спирали) и каждая голова соединяется с хвостом через отдельную нить раскрученной спирали. Эти короткие участки между головами и хвостом состоят из одиночных полипептидных цепей, которые ввиду их гибкости вряд ли имеют целиком структуру α-спирали.
Итак, основные выводы, касающиеся сложной вторичной и третичной структуры сократительных белков, таковы. Миозин и тропомиозин В представляют собой длинные молекулы с отношением осей более 20. Они способны образовывать агрегаты длиной в 1 мк или больше (1 мк = 10000 Å) вследствие электростатических взаимодействий между их хвостами, располагающимися конец к концу и бок к боку. Актин является глобулярным белком гораздо меньшего молекулярного веса; его
24
Глава I
диаметр составляет всего около 55 А. Чистый актин в физиологических условиях агрегирует, образуя длинные спирали неопределенной длины, состоящие из двух скрученных нитей, напоминающих бусы. В самой мышце, однако, длина отдельной актиновой цепи лежит в пределах от 1 до 1,3 мк. Это заставляет думать, что в развивающейся мышце каким-то образом происходит автоматическое кодирование длины. Есть предположение, что определенную роль здесь играет тропомиозин, а возможно, и тропонин, однако пока еще это окончательно не доказано [51, 59, 102, 183].
Другие структурные белки миофибриллы
Говоря о возможности существования в миофибрилле других структурных белков, мы должны отчетливо представлять себе экспериментальный метод их получения и учитывать возможные загрязняющие примеси. Имеется три наиболее существенных источника загрязнений: 1) так называемые растворимые белки саркоплазматической жидкости, омывающей фибриллы и содержащей в себе множество ферментов, которые участвуют в гликолитическом цикле; 2) расположенные между фибриллами митохондрии, принимающие участие в использовании кислорода и в цикле окислительного фосфорилирования; 3) трубочки и пузырьки саркоплазматического ретикулума, пронизывающие сами фибриллы и передающие нервный импульс. Кроме того, возможны небольшие, но имеющие существенное значение примеси PHK рибосом и ДНК множества ядер, расположенных непосредственно под мембраной волокна, а также слоев соединительной ткани, окружающих волокна и их пучки.
Рассмотрим теперь, что произойдет, если эту сложную систему обработать концентрированным (0,5—1 М) солевым раствором, экстрагирующим миозин и актин. Экстракт будет содержать, во-первых, все саркоплазматические белки, во-вторых, фрагменты всех «твердых» систем, о которых мы говорили выше, и, наконец, некоторое количество ДНК и PHK в растворе. После этой обработки экстракт центрифугируют для очистки его от
Структура и организация сократительных белков
25
наиболее крупных нерастворимых частиц и затем осаждают миозин или актомиозин путем добавления воды до получения раствора соответствующей ионной силы. При таком осаждении выпадают, конечно, и нуклеиновые кислоты, примеси которых содержатся в большинстве растворов миозина. Более того, если не принимать особых мер предосторожности при переосаждении, то в осадок неизбежно попадают примеси небольших частиц саркоплазматического ретикулума и митохондрий. Ни одна из этих процедур не позволяет количественно экстрагировать сам актин; сообщалось, что осколки белков фигурируют в качестве примесей не только в препаратах актина и миозина, но и в остатке, получающемся после их частичной экстракции. Поэтому мы должны решать вопрос о наличии других сократительных компонентов с величайшей осторожностью и требовать наиболее сильных и убедительных аргументов в пользу существования новых веществ. Примерами таких компонентов, выделенных в прошлом и, как оказалось, не существующих в действительности, являются X- и Y-белки и «контрактин».
Несмотря на изложенные сомнения, надо признать, что существуют данные (основанные на результатах химических исследований и рассеянии рентгеновских лучей под малыми углами [20, 35, 83, 122]), свидетельствующие в пользу того, что в саркомерах помимо актина, миозина и тропомиозина содержится еще один или несколько структурных белков, хотя и в небольших количествах. Из них наиболее хорошо охарактеризованы, по- видимому, α-актинин и тропонин, которые во многих отношениях напоминают сам актин [35]. В частности, тропонин, как и актин, содержит очень много пролина и, следовательно (на основании тех же соображений, что и для актина), является скорее глобулярным, чем фибриллярным белком. Были высказаны предположения, что α-актинин вместе с тропомиозином находится в Z-пластинке, а тропонин связан с самими нитями актина и подобно тропомиозину уложен в канавках суперспиралей актина.
При добавлении неочищенного тропомиозина к очищенной системе актина и миозина ее АТФ-азная актив¬
Î6
Г лава I
ность становится чрезвычайно чувствительной к следам ионов кальция. Это отличительная черта интактных препаратов волокон и фибрилл. Чистый тропомиозин, даже если его SH-группы надежно защищены от окисления, такого действия не оказывает. Недавно было показано независимо, что примесью, сообщающей этой системе чувствительность к кальцию, является тропонин [20]. Выше мы пришли к выводу, что тропонин — глобулярный белок. Поэтому вероятнее всего, что его роль состоит в связывании длинных молекул тропомиозина друг с другом внутри спиралей актина. Действительно, окрашивание саркомеров антителами, меченными ферритином, показывает, что тропонин встречается в поперечных полосах примерно через каждые 400 А вдоль саркомера [35].
Было показано также, что IO5 г тропонина связывают 5 моль Ca2+, причем в присутствии 4 мМ Mg2+ константа связывания равна 6∙ IO5 ЛГ1 [35а]. Молекулярный вес тропонина, определенный из константы седиментации, равной 3S, близок к 80 000 [35а]. Следовательно, каждая молекула должна связывать 4 иона Ca. Зная величину молекулярного веса тропонина и его расположение вдоль нитей актина, можно заключить, что одна молекула тропонина приходится на 7 или 8 молекул актина, т. е. примерно на каждые две молекулы миозина. Таким образом, на каждую молекулу миозина приходится два иона Ca2+. Как мы увидим, это число очень важно, если рассматривать его в связи с известным активирующим действием ничтожных количеств кальция на нативную актомиозиновую систему, содержащую тропомиозин и тропонин. Необходимо отметить, что чистый тропомиозин сам по себе не способен связывать кальций в заметном количестве.
В дальнейшем мы будем иметь в виду, что тропомиозин содержится в нитях актина вместе с тропонином, но так как до сих пор здесь нет полной определенности, мы будем называть этот комплекс тропомиозиновым, тем самым оставляя в стороне детали его структуры.
Прежде чем закончить обсуждение структуры миофибрилл, мы должны упомянуть еще об одном белке —
Структура и организация сократительных белков
27
миофибриллине, который был недавно выделен [54]. Предположительно это так называемый S-белок. Первоначально полагали, что он соединяет друг с другом нити актина в середине каждой половины саркомера. Однако в таком случае для объяснения наблюдаемых свойств мышцы пришлось бы допустить, что этот белок обладает необычайной упругостью [58, 170].
Образование нитей актина (тонких нитей)
Явление агрегации глобулярных молекул (мономеров) актина, именуемого в этой форме G-актином, в длинные двойные суперспирали, называемые F-актином (см. фото IV и фиг. 8,Л)—одно из первых установленных свойств актина [143, 146]. Такая агрегация происходит в процессе получения, актина следующим образом. Прежде всего из размельченной мышцы удаляют миозин путем кратковременной экстракции при большой ионной силе. Затем следует обработка осадка ацетоном для удаления липидов. Высушенный остаток экстрагируют в воде, содержащей некоторое количество АТФ, который разрушает нити актина (все еще частично организованные в саркомеры, несмотря на отсутствие миозина) на отдельные бусинки G-актина, появляющиеся в экстракте. Для осуществления этого процесса необходимо присутствие АТФ. При увеличении ионной силы (Г/2) экстракта до 0,1 (для чего к нему добавляют KCl) раствор сразу же становится более вязким. Если исследовать его под электронным микроскопом, то в нем вновь обнаруживаются двойные спирали F-актина, но весьма переменной длины. Выдерживая растворы при 0°, с помощью этого метода можно получить F-актин, свободный от тропомиозина, но при случайном повышении температуры актин в той или иной степени загрязняется тропомиозином [33].
Химия G →F-πpeBpaιneHH∏ весьма своеобразна. Оно происходит по следующей схеме:
«(G-актин — АТФ) (F-актин — АДФ)П ÷ «Фн. (1.1)
В результате этой чисто стехиометрической реакции молекулы G-актина образуют цепочки, т. е. переходят
28
Г л а в a I
в F-форму, а связанный АТФ превращается в АДФ, также связанный. Поскольку при полимеризации система переходит из состояния хаотического распределения молекул к их упорядоченному расположению в суперспиралях, этот процесс сопровождается значительным уменьшением конфигурационной энтропии. Точная природа связи между мономерами актина неизвестна, но, по-видимому, связанный АДФ (всегда присутствующий в нативных нитях) в ней не участвует, так как при удалении его с помощью обработки ультразвуком структура не разрушается [5]. Агрегация здесь может происходить так же, как и у белка вируса табачной мозаики, т. е. путем удаления одной молекулы воды на 1 моль из так называемых «областей айсбергов» в молекуле белка и взаимодействия «дегидратированного» неполярного центра с такими же центрами соседних молекул [101]. Кроме того, сейчас установлено, что освобожденный от связанного нуклеотида G-актин может полимеризоваться в F-форму так же хорошо, как и обычный G-актин в присутствии АТФ [5].
Равновесие реакции (1.1) сильно сдвинуто вправо, и заметно сместить его в обратную сторону добавлением избытка Фн к системе F-актин — АДФ невозможно; другими словами, это превращение нельзя рассматривать как своего рода АТФ-ресинтезирующий механизм [143, 146]. Для того чтобы добиться обращения реакции, к раствору F-актина при низкой ионной силе нужно добавлять АТФ. Строго говоря, это реакция обмена, сопровождаемая большим увеличением конфигурационной энтропии. Путем введения радиоактивной метки в АДФ было показано, что реакция протекает по схеме
(F-актин — АДФ)n + nАТФ ↔ n(G-актин — АТФ) + nАДФ. (1.2)
Тот же метод позволил установить, что при сокращении миофибриллярной системы такого обмена не происходит (во всяком случае, в сколько-нибудь заметной степени). Однако при сверхсокращении искусственного актомиозина наблюдается заметный обмен связанного с актином АДФ на меченый АТФ, причем вновь присоединенный АТФ быстро дефосфорилируется до АДФ [146а]. Таким образом, хотя при естественном со-
Структура и организация сократительных белков
29
крашении некоторый обмен между F-актином и АТФ; возможно, и происходит, сомнительно, чтобы он протекал по схеме (1.2), тем более что ионная сила (0,15), при которой происходит сокращение, слишком велика для того, чтобы была возможна эта реакция.
Рассмотренные выше свойства актина свидетельствуют о том, что его биосинтез должен быть сравнительно простым. Необходимо только, чтобы он сошел с рибосомы [120] в виде полипептидной цепи. Затем она автоматически закручивается в G-форму и, находясь в среде, содержащей АТФ, быстро полимеризуется согласно уравнению (1.1) в упорядоченную структуру двойной суперспирали F-актин — АДФ. Мы должны предположить, однако, что при этом в нужный момент времени и в нужном месте появляется тропомиозин (возможно, вместе с тропонином и α-актинином), который выполняет функцию ядра F-актиновых нитей, контролируя их длину [7, 11].
Образование нитей миозина (толстых нитей)
Образование толстых нитей миозина, составляющих A-диски саркомеров, теперь также удается наблюдать in vitro [81, 93, 94]. Толстые нити образуются при более или менее быстром понижении ионной силы раствора миозина в 0,6 M KCl до 0,2. На первом этапе хвосты молекул, объединяясь попарно, образуют короткую нить с оголенным центральным стержнем, так что головы исходных молекул выступают на каждом его конце (фото V). В простейшей форме этот процесс продолжается путем добавления новых молекул на каждом конце нити до тех пор, пока ее максимальная длина не достигнет величины порядка 1,5 мк (см. то же фото) [81]. К этому времени структура действительно становится похожей на толстые нити, которые можно выделить непосредственно из миофибрилл (фото III). Эти нити также имеют голый центральный стержень длиной 1500—2000 А (0,15—0,2 мк), на обеих сторонах которого вплоть до самого конца нитей располагаются регулярные выступы голов миозина; концы нитей имеют конусообразную форму. Процесс образования такой очень
30
Г лава I
упорядоченной структуры весьма чувствителен к ионной силе и величине pH [93, 94]. Вне области физиологических значений Γ∕2 = 0,15—0,17 и pH 7,2—7,5 агрегация часто происходит нерегулярно, так что возникают разветвляющиеся структуры и очень длинные агрегаты.
Самое простое предположение относительно механизма агрегации состоит в том, что хвосты отдельных молекул миозина притягиваются друг к другу вследствие их большого электростатического заряда, в результате чего образуются ионные связи, очень стабильные при физиологических значениях ионной силы и pH. Однако трудно понять, почему при определенных условиях агрегация происходит так, что образуется голый центральный стержень, на концах которого молекулы ориентированы в противоположных направлениях [81]. Почему первая агрегация происходит способом хвост к хвосту, а все последующие — хвост к голове? Быть может, когда мы больше узнаем о структуре миозина, в особенности об аминокислотной последовательности в области хвоста молекулы, ответ на все эти вопросы появится сам собой.
Выше было сказано почти все, что можно сказать об организации молекул мышечных белков без подробного исследования деталей реальных фотографий А- и 1-дисков мышцы. Из этих фотографий ясно видно, что молекулы миозина могут агрегировать поляризованным способом, образуя толстые нити длиной до 1,5 мк, и что головы молекул через определенные расстояния выступают с обеих сторон голого центрального стержня, как и в толстых нитях, непосредственно выделенных из мышцы.
Организация миофибрилл
Единица структурной организации скелетных мышц высших млекопитающих — саркомер — в электронном микроскопе выглядит так, как это показано на фото VIII—X. На фото VIlI видны толстые миозиновые нити, из которых на одинаковом расстоянии друг от друга
Структура и организация сократительных белков
31
выступают головы молекул, образующие поперечные мостики, направленные к актину. Исключение состав’ ляет центральная область (М-полоса), где молекулы уложены хвост к хвосту. В центре этой полосы нити, видимо, толще, и возможно, что здесь имеются белки неизвестного строения, усиливающие связь между хвостами (фото IX). Более тонкие нити актина в случае частично растянутой мышцы проходят от Z-пластин- ки через 1-диск и дальше между миозиновыми нитями вплоть до области М-полосы каждой половины саркомера, где они кончаются. Как мы увидим, истинное место окончания актиновых нитей в A-диске зависит только от длины, при которой мышца фиксируется для приготовления среза. Большинство мышц в состоянии, предшествующем окоченению, можно сильно, растянуть так, что актиновые нити почти полностью вытягиваются из A-дисков. Напротив, в сверхсокращенном состоянии они могут проникать в промежутки между такими же нитями другой половины саркомера, пока Z-пластинки не начнут соприкасаться с концами миозиновых нитей и даже сжимать их [56—58].
На фото X (ср. фиг. 8,6) мы видим поперечное сечение фибриллы через ту область A-диска, где перекрываются нити актина и миозина. Фотография демонстрирует типичное гексагональное расположение нитей двух типов в этом хорошо организованном диске. Часть сечения проходит через 1-диск, где видны только менее регулярно расположенные нити актина. В части сечения, проходящей через область М-полосы, видно регулярное расположение нитей миозина, но нити актина отсутствуют. В области гексагонального расположения нитей шесть актиновых нитей окружают каждую миозиновую нить. Это означает, что каждая молекула актина окружена тремя молекулами миозина (ср. фиг. 8,Б).
Размеры нитей двух типов в большинстве поперечнополосатых мышц таковы: для актина длина проходящей через Z-пластинку нити от одного ее конца до другого равна 2,2 мк, а диаметр — около 80 А; для миозина эти размеры равны соответственно 1,5 мк и примерно 120 А [81, 119]. Головы молекул миозина выступают примерно на 100 А над поверхностью нити, образуя так
32
Г лава 1
называемые поперечные мостики, направленные к соседним актиновым нитям. Однако расстояние, которое им приходится перекрывать, меняется в зависимости от длины мышцы. Это будет ясно из дальнейшего, когда мы перейдем к рассмотрению расстояний между центрами нитей.
Теперь нужно выяснить, каким образом выступающие головы миозиновых молекул расположены относительно толстых нитей и окружающих их актиновых нитей (этого нельзя было установить при рассмотрении изолированных нитей миозина). Тщательное изучение многих электронных микрофотографий показывает, что расстояния между соседними головами, имеющими одинаковое направление, составляют примерно 400 А. Как следует из вида поперечного сечения, каждая толстая нить окружена шестью актиновыми. Отсюда естественно заключить, что по окружности нити расположено шесть рядов голов (это соответствует винтовой оси симметрии шестого порядка). Следовательно, каждая голова в ряду должна отстоять от ближайшей к ней голове в следующем ряду примерно на 70 А. Описанная структура изображена на фиг. 8, Л. Более поздние данные, полученные методом рассеяния рентгеновских лучей под малыми углами с использованием длинных камер для повышения точности измерений [83], действительно подтвердили, что по окружности нити расположено шесть рядов голов. Однако наличие очень сильного меридионального рефлекса третьего порядка, соответствующего межплоскостному расстоянию 143 А, несомненно, указывает на то, что винтовой оси симметрии шестого порядка нет и что, вероятнее всего, головы расположены попарно (на каждой стороне нити по одной голове) с интервалами 143 А, причем каждая пара повернута относительно соседней на 120° (фиг. 8, В). Точное расстояние между головами в любом ряду равно тогда 429 А, и каждая голова выступает на 135 А от центра нити. Поскольку в центральной части М-полосы (М-линия) молекулы уложены хвост к хвосту, а по обе стороны от нее — голова к хвосту, при переходе через M-линию полярность расположения голов меняется на
Структура и организация сократительных белков
33
обратную. Этому соответствует, как мы увидим, обратная полярность актиновых нитей в каждой половине саркомера [81, 121]. Заметим, что толстая нить содержит 30 выступающих голов в каждом из шести рядов, т. е. всего их 180.
На первый взгляд кажется, что очень просто построить нить из длинных молекул миозина по типу голова к хвосту, как мы это описали выше; но читатель может легко убедиться, насколько это трудно, если он попытается сделать нечто подобное из спичек, точно копируя пространственное расположение, показанное на фиг. 8, В. Очень скоро он окажется в затруднении даже при построении самого первого ряда молекул. C помощью антител, меченных флуоресцирующими красителями, действительно удалось показать, что геометрия миозиновой нити крайне сложна [121]. Для того чтобы получить правильное распределение голов на периферических участках саркомера, в поперечном сечении нити, проведенном через М-линию, где молекулы лежат хвост к хвосту, должны располагаться 12 плотно упакованных молекул миозина. В остальной части нити, кроме конусообразных концов, молекулы миозина также упакованы очень плотно. Кроме того, головы молекул миозина должны периодически выступать из глубины структуры. Поэтому область шейки должна быть очень гибкой, а хвост (или область легкого меромиозина) должен быть жестким, чтобы выдерживать продольные напряжения в саркомере при его сокращениях. Эти косвенные выводы о том, что шейка молекулы отличается своим строением от хвоста и имеет, по-видимому, неупорядоченную структуру, подтверждаются последними электронными микрофотографиями, о которых мы говорили выше. Из них следует, что молекулы миозина двуглавые, причем каждая голова прикреплена к двойной спирали хвоста одиночной гибкой полипептидной цепью [141а] (фиг. 9). Согласно этой новой модели, загадочные утолщения в области М-полосы, где молекулы уложены хвост к хвосту, создаются поперечными связями между самими молекулами миозина (возможно, при участии другого белка).
34
Г л а в a I
Стехиометрия актина и миозина в мышцах
Точная стехиометрия актина и миозина в саркомере до сих пор еще служит предметом споров. Из химических данных следует, что на долю миозина приходится примерно 54% веса всех структурных белков мышцы, а на долю актина — около 27%; остальное — это в основном тропомиозин (около 12%), тропонин и два акти- нина (около 7%). Эти цифры, конечно, неточны, поскольку ни один из существующих ныне методов не обеспечивает полной экстракции ни одного из этих белков; поэтому для оценки истинного содержания каждого из них приходится пользоваться обходными путями [58, 63, 83, 122]. Молекулярное отношение актина к миозину, как это видно из сказанного выше, не может превышать 4:1. Если же определить это отношение из длин толстых и тонких нитей мышцы и числа молекул, которые в них, по-видимому, содержатся, то получается гораздо большее значение, равное примерно 8,7: 1 (если считать, что две актиновые нити приходятся на одну миозиновую, причем нить актина содержит 1600 молекул, а миозина — около 180 выступающих голов). При таком отношении содержание актина должно составлять 54% всех структурных белков, что невозможно, если содержание миозина считать по-прежнему равным 50%. Единственный простой выход из этого затруднения состоит в том, чтобы считать каждую выступающую голову миозина двойной, т. е. содержащей не одну, а две молекулы миозина (ср. [83] и [121]). Вероятно, это не самое лучшее решение проблемы, ибо структура получается довольно неуклюжей, особенно если учесть, что каждая молекула миозина сама является двуглавой [141а], но при тех данных, которые имеются в нашем распоряжении, этот выход кажется единственно возможным.
Z-пластинка и полярность актина
Z-пластинка — это то место, где соединяются нити актина соседних саркомеров. Ее макроскопическая структура лучше всего видна на электронных микрофо¬
Структура и организация сократительных белков
35
тографиях нитей актина, выделенных из мышцы уже описанным нами способом, но все еще прикрепленных к Z-пластинке (фото IV) [81]. На фотографии видны нити соседних саркомеров, тесно спутанные друг с другом в Z-пластинке, но беспорядочно и свободно простирающиеся в обе стороны от нее. Для дальнейшего рассмотрения воспользуемся важным свойством актиновой и миозиновой систем: способностью молекул этих двух типов агрегировать с образованием сложных «молекул» актомиозина.
Когда из актина и миозина образуется актомиозин, молекулы миозина прикрепляются своими головами к бусинкам суперспирали (одна молекула миозина на две бусинки), а их длинные (1200 А) хвосты остаются свободными и располагаются в виде спирали вдоль длинной оси актомиозиновой нити (ср. фиг. 16), образуя сложные структуры, напоминающие веревочную лестницу; поэтому такие препараты не дают четких изображений на электронных микрофотографиях. Но если упростить молекулу миозина, отделив часть ее хвоста с помощью трипсина, и исследовать оставшуюся ее часть (тяжелый меромиозин), то молекулы располагаются гораздо более упорядоченно, с меньшей вероятностью агрегации бок к боку [81]. При этом получается картина, показанная на фото VII, где можно отчетливо видеть стреловидное расположение молекул тяжелого меромиозина вдоль спиралей актина, причем с одной стороны плотной Z-пластинки стрелы имеют одно направление, с другой противоположное. Из этого следует, что спирали актина имеют одну полярность по одну сторону пластинки и противоположную по другую ее сторону; очевидно, что это должно также относиться к актиновым нитям в каждой половине интактного саркомера. Полярность актина наряду с уже описанной полярностью миозина в каждом саркомере имеет важное значение для модели скользящих нитей, объясняющей сокращение.
Детали строения самой Z-пластинки все еще являются предметом дискуссии. Однако в настоящее время есть основания предполагать, что актиновые нити соседних саркомеров соединяются в пластинке друг с
36
Г лава 1
другом через посредство молекул, подобных тропомиозину, которые, начинаясь здесь, идут в обоих направлениях по канавкам актиновых суперспиралей. Сильным доводом в пользу этой идеи служит то, что кристаллы тропомиозина имеют в сечении почти квадратную решетку, в каждом узле которой пересекаются две нити. Размеры и углы этой решетки почти совпадают с размерами и углами в поперечных сечениях Z-пластинки [48, 81].
Модель скользящих нитей
Модель сокращения, основанная на скольжении нитей, является, по-видимому, наиболее существенным достижением в этой области за последнее десятилетие. Если в своих дальнейших рассуждениях мы примем эту модель за основу, то многие сложные проблемы, например вопросы энергетики, удастся решить довольно легко [56—58]. В этой главе мы не будем обсуждать биохимию сокращения, а также лежащий в его основе молекулярный механизм, так как будем говорить о них подробно в надлежащем месте, и опишем этот процесс лишь в самых общих чертах.
По-видимому, проще всего начать с обсуждения данных фазово-контрастной микроскопии (фиг. 10). Мы видим, во-первых, что при укорочении мышцы Z-пластинки смещаются в направлении к A-диску, в результате чего I-диск сужается. Все это происходит без изменения ширины A-диска. Когда мышца восстанавливает после сокращения свою первоначальную длину, 1-диск снова расширяется, но никакого изменения ширины А-диска при этом не происходит. Во-вторых, при удлинении покоящейся мышцы с каждой стороны от М-линии появляется зона меньшей плотности, ширина которой зависит от длины мышцы. Это так называемая Н-зона. В-третьих, при сокращении ненагруженной мышцы ее длина может уменьшиться до величины, составляющей 0,4 или менее от исходной. Такое сильное сокращение сопровождается вначале уменьшением ширины Н-зоны, затем увеличением плотности в области М-полосы, которое постепенно распространяется в зону A-диска, и,
Структура и организация сократительных белков
37
наконец, сразу же после исчезновения 1-диска, — появлением утолщения в области Z-пластинки, которое обычно называется узлом сокращения. И в-четвертых, мышца может переходить в состояние окоченения и становиться жесткой и нерастяжимой почти при любой
Фиг. 10. Схема, показывающая, как выглядят отдельные миофибриллы в световом микроскопе (при трех различных длинах саркомера).
Диаметр средней фибриллы при длине покоя (Z0) около 1 мк. Обратите внимание на зоны сжатия в области M-линии, образующиеся при укорочении саркомера до 1,5 мк (нижняя фибрилла). Здесь l0 = 2,2 мк.
длине — от самой большой до самой малой. Любая попытка растянуть мышцу силой приводит к ее разрыву (обычно в I-диске).
Следовательно, материал A-диска должен иметь более или менее жесткую и нерастяжимую структуру, а материал I-диска, как следует из электронных микро¬
38
Г лава I
фотографий, должен быть более гибким, но также нерастяжимым. Кроме того, для объяснения изменений плотности при сокращении мы должны предположить, что сокращение сопровождается заметным перемещением материала мышцы.
Фиг. И. Схема тонкой структуры саркомера мышцы быка в продольном и поперечном сечениях.
Видны миозиновые нити с выступающими головами и подобная бусам структура актина (см. текст). Для удобства отношение длины саркомера к его толщине уменьшено в 10 раз по сравнению с истинным. а — саркомеры при длине, близкой к длине покоя (l0 = 2,4 мк); б — саркомеры после растяжения до длины, равной l,3l0; в — саркомеры в состоянии сокращения до длины, равной 0,6l0. Заметьте, что на схеме головы миозиновых молекул наклонены в сторону Z-пластинок; в этом положении они способны развивать наибольшее тянущее усилие (ср. [31]).
Вернемся теперь к электронно-микроскопическим данным, приведенным на фото VIII и IX. На фиг. 11 эти фотографии воспроизведены в виде схемы, изображающей нить миозина и два из шести ее актиновых партнеров (выше и ниже ее) в каждой половине саркомера. Нити актина, подобные любым другим длинным белковым нитям, изображены в виде достаточно жестких нерастяжимых цепей, соединенных последовательно через Z-пластинку (также нерастяжимую) с нитями со¬
Структура и организация сократительных белков
39
седнего саркомера. Нить миозина изображена в виде жесткого и нерастяжимого стержня. Она примерно вдвое толще актиновой нити и вдоль нее располагаются выступающие головы молекул. У мышцы лягушки длина актиновых нитей в каждой половине саркомера равна 1 мк, а миозиновых—1,5 мк. У быка они несколько длиннее.
Если бы мы поместили нити актина и миозина, уложенные в таком порядке, как на фиг. И, в разбавленный солевой раствор, они сразу же образовали бы поперечные связи в результате соединения голов миозина с мономерами актина (конечно, если бы актиновые и миозиновые нити располагались достаточно близко друг к другу). Это могло бы произойти при любых длинах, показанных на схеме. Вся система замкнулась бы при этом от одного до другого конца каждого ряда и стала бы нерастяжимой. Такое состояние мы можем считать состоянием окоченения [14, 130].
Что же произойдет, если к этой системе добавить АТФ в присутствии ионов Mg? Это во многом зависит от дополнительных условий. При полном отсутствии ионов Ca (которые можно удалить, например, добавляя реагент, образующий с кальцием хелатные соединения) или в присутствии агентов, блокирующих SH-группы, АТФ-азные центры полностью ингибируются, и тогда Mg-АТФ действует в качестве пластификатора и препятствует образованию поперечных связей. В этих условиях актиновые нити можно протянуть вдоль миозиновых партнеров без всякого сопротивления; следовательно, при нагрузке вся система полностью развалилась бы на части. В интактной мышце этого не происходит благодаря наличию соединительной ткани и других параллельных структур, препятствующих такому распаду. Можно представить себе, что живая покоящаяся мышца находится именно в этом легко растяжимом состоянии, при котором сопротивление удлинению создают только упомянутые выше структуры. Такое состояние мы будем называть состоянием покоя. Заметим, что, говоря здесь о растяжимости, мы имеем в виду не какое-то изменение жесткости отдельных нитей, а лишь то, что они
40
Г л а в a I
могут свободно скользить относительно друг друга, сохраняя свою длину.
Если добавить теперь к такой гипотетической системе ничтожное количество ионов Ca, то это сразу же приведет к активации АТФ-азных центров миозина. Под действием АТФ-азы АТФ расщепляется, и головы начинают взаимодействовать с соседними мономерами актина. Освобождающаяся в этом процессе свободная энергия используется либо для развития напряжения в мышце, либо для ее укорочения и совершения работы. Во время укорочения мышцы отдельные нити не меняют своей длины, но просто скользят относительно друг друга (фиг. 11). Как происходит такое активное скольжение? Этого мы еще точно не знаем, но исследования живой мышцы методом рассеяния рентгеновских лучей под малыми углами показывают, что оно, несомненно, связано с движением голов миозина. Они совершают либо колебательные движения вперед и назад, толкая при этом своего актинового партнера к центру саркомера, либо тянут его благодаря незначительным сокращениям в области головы и шейки отдельных молекул [83]. Это состояние системы мы будем называть состоянием сокращения. Как мы увидим, и in vivo, и in vitro состояние сокращения может быть обращено. Для этого достаточно удалить ионы кальция при сохранении АТФ или какого-либо другого «пластифицирующего» поли- фосфатного соединения.
Изложенной гипотезе в настоящее время почти наверняка можно придать статут теории. Она справедлива для всех типов мышц, построенных из актиновых и миозиновых нитей, и дает изящное и убедительное объяснение всем процессам, наблюдаемым при сокращении, и в первую очередь развитию окоченения. Как мы уже говорили, состояние окоченения возникает в отсутствие АТФ и возможно при любой длине мышцы, при которой нити актина и миозина перекрываются.
Единственная нерешенная проблема — это так называемое остаточное напряжение мышцы, т. е. ее способность восстанавливать свою длину. Весьма вероятно, что восстановление длины осуществляется за счет пружиноподобных упругих элементов, окружающих отдельные
Структура и организация сократительных белков
41
фибриллы и волокна интактной мышцы [124]. Другая возможность состоит в том, что это является функцией гипотетического S-белка, который, как одно время считали, соединяет концы расположенных друг против друга актиновых нитей в каждом саркомере. Однако такой белок скорее не способствовал бы, а препятствовал восстановлению длины мышцы после ее удлинения (если только он не обладает необычайно высокой растяжимостью). Свидетельства в пользу существования такого белка носят лишь косвенный характер: из послеэкстрак- ционного остатка мышцы недавно был выделен «растяжимый» белок миофибриллин, который мог бы отвечать этим требованиям [54, 170].
Рентгенографические доказательства модели скользящих нитей
До сих пор мы рассматривали только микроскопические данные в пользу теории скользящих нитей. Сейчас, однако, получено много новых фактов методом рассеяния рентгеновских лучей под малыми углами. Очень существенно, что такие исследования можно проводить на живой сокращающейся мышце или на нефиксированных ее препаратах [43, 44, 82, 83].
Первый результат, к которому приводят эти работы, следует из давно установленного постоянства объема мышцы при ее сокращении. Такое постоянство означает, что диаметр (2г) любого микроскопического цилиндрика, мысленно выделенного в мышце, должен изменяться обратно пропорционально корню квадратному из ее длины (L), поскольку г ≈ YV∣nL , где V — постоянный объем. Поскольку такой микроцилиндр заполнен нитями актина и миозина, расстояние между их центрами также должно меняться обратно пропорционально корню квадратному из длины мышцы. Это полностью подтверждается сопоставлением расстояний между экваториальными рефлексами на рентгенограмме и длиной саркомера в живой мышце. Результаты рентгенографических исследований приведены на фиг. 12, где можно видеть, что расстояния между центрами актиновых и миознно-
42
Глава I
вых нитей линейно зависят от корня квадратного из длины саркомера (l8) (43, 112).
Из этих данных вытекает важное следствие для теории скольжения нитей: расстояние, на которое должны вытягиваться головы молекул миозина, чтобы достичь
Фиг. 12. Зависимость расстояний между центрами нитей миозин — миозин и актин — актин от корня квадратного из длины саркомера в фибрилле (√ls) по данным дифракции рентгеновских лучей [112].
соседней нити актина, должно довольно заметно увеличиваться при сокращении мышцы. Для интервала длин, приведенного на фиг. 12, это расстояние изменяется по меньшей мере на 70 А при изменении длины мышцы от максимального ее значения до минимального. Поскольку в покоящейся мышце сами головы отстоят от
Структура и организация сократительных белков
43
центра нити всего лишь примерно на 135 А, они должны быть гораздо более гибкими, чем это следует из электронно-микроскопических фотографий, для того чтобы могло произойти требуемое удлинение. Возможно, что именно гибкая шейка молекул помогает им удлиняться таким образом (фиг. 9).
Другое важное следствие из рентгенографических данных состоит в том, что длина самих основных цепей, по-видимому, не изменяется во время сокращения живой мышцы. C помощью специального приспособления в малоугловой рентгеновской установке, благодаря которому затвор камеры открывается лишь одновременно с сокращением мышцы, удалось снять несколько рентгенограмм сокращающейся мышцы лягушки [44, 83]. Основные рефлексы как в покое, так и при сокращении располагаются на меридиане или вблизи него. Это рефлексы, соответствующие межплоскостным расстояниям миозина 429 и 143 А (первое является основным периодом миозина, а второе соответствует третьему порядку отражения), а также рефлексы, соответствующие различным порядкам отражения для основного периода актина 360—370 А. Период 429 А — это расстояние между головами в любом отдельном ряду нити миозина, а расстояние 143 А — между головой в одном ряду и ее ближайшим соседом в следующем ряду. Период актина, равный примерно 360 А, — это расстояние между точками пересечения нитей двойной спирали актина, о чем шла речь выше (ср. фиг. 8, Д).
При сокращении мышцы ни один из рефлексов актина заметно не меняется, т. е. длина актиновых нитей остается при сокращении постоянной, что и следует из модели скользящих нитей. Что касается миозина, то период 143 А может удлиниться примерно на 1%, т. е. нить миозина слегка удлиняется, когда к ней прикладывается напряжение. Однако интенсивность соответствующего рефлекса уменьшается примерно до 66% ее значения в покоящейся мышце. Все это наряду со значительными изменениями немеридиональных рефлексов, которые в свою очередь возникают из-за спирального расположения поперечных мостиков, показывает, что сокращение сопровождается заметным перемещением
44
Глава I
голов миозиновых молекул. В основном, по-видимому, такие перемещения происходят по азимуту, т. е. голова молекулы миозина может поворачиваться, меняя свое направление на 60° относительно того, которое она имеет в покоящейся мышце. Фиг. 8, Б поможет читателю представить себе, как происходит такое движение.
При переходе в состояние окоченения происходят еще более сильные изменения интенсивности слоевых линий миозина, из которых следует, что головы миозина в этом случае могут прикрепляться к нитям актина во многих точках. Спиральность при этом нарушается настолько, что рефлексы, соответствующие межплоскостному расстоянию 429 Â, полностью исчезают, а вместо них появляются слоевые линии, которые можно отнести за счет спирали с периодом 360 или 380 А. В то же время период 143 А не меняется. Следовательно, положение скелета миозиновой нити в процессе сокращения или окоченения остается неизменным, а головы могут поворачиваться в поисках соответствующего актинового партнера, причем расстояния, на которые они смещаются, выходят за пределы тех значений, которые следуют из фиг. 8, Б и В. Тем не менее при сокращении с актином взаимодействует, по-видимому, относительно небольшое число голов миозина в любой данный момент времени, и это число, несомненно, меньше, чем при окоченении. В самом деле, из статистических соображений следует, что при быстром движении голова миозина вряд ли успеет найти соответствующего актинового партнера. Интересно, что на рентгенограмме покоящейся мышцы характерные периоды, повторяющиеся по длине отдельных миозиновых нитей, на протяжении почти всей ширины фибриллы совпадают, а при сокращении и окоченении это аккуратное расположение нарушается (особенно сильно в последнем случае) [83].
Изменения положения голов миозина отчетливо видны в летательных мышцах насекомых. В покое головы расположены под прямыми углами к оси нити, а при окоченении они образуют «стреловидную» структуру с остриями, направленными к Z-пластинке [130].
Структура и организация сократительных белков 45
Большой интерес, проявляемый к этим рентгенографическим исследованиям (особенно к наиболее точным из них [83]), обусловлен тем, что это единственный случай, когда рентгеноструктурный анализ позволил получить действительно новую существенную информацию об интактной живой системе. К сожалению, мы не можем обсудить здесь многие интереснейшие детали этих исследований и поэтому рекомендуем читателю обратиться к оригинальным работам [44, 83].
ГЛАВА II
БИОХИМИЯ СОКРАТИТЕЛЬНЫХ БЕЛКОВ
Миозин как фермент
В предыдущей главе мы познакомились с укладкой молекул миозина в толстых нитях саркомера; мы теперь знаем, что их длинные сильно заряженные хвосты, пере- крываясь, связывают нити друг с другом, а головы выступают из нитей, располагаясь упорядоченными рядами. Именно за счет движения этих голов — изгибов или, что более вероятно, миниатюрных циклов сокращения — нити актина подталкиваются или подтягиваются к центру саркомера при сокращении живой мышцы. Источником энергии для такого движения является изменение свободной энергии (—ΔF) при расщеплении АТФ в активных центрах миозина [31, 46].
Изучение миозина как такового дает информацию о реакции расщепления и об активном центре фермента в условиях, когда сократительная активность отсутствует. Однако к интерпретации этих данных следует подходить очень осторожно, ибо участие другого партнера — актина — в значительной степени изменяет механизм реакции; в первую очередь это касается влияния ионов металлов.
Реакция расщепления свойственна не только АТФ, но и ряду других нуклеозидтрифосфатов (НТФ), структурные формулы которых приведены на фиг. 13. Эту реакцию можно записать следующим образом:
(П.1)
где M означает миозин, НДФ — нуклеозиддифосфат и Фн— неорганический фосфат.
Разумеется, в этой схеме можно было бы привести еще несколько других стадий реакции, в частности ста¬
Биохимия сократительных белков
47
дии, включающие адсорбцию субстрата или продуктов на активных центрах. Отметим здесь, что продукты реакции ингибируют ее, причем НДФ является более силь-
Фиг. 13. Структурные формулы различных нуклеозидтрифосфатов (НТФ), встречающихся в мышце.
Все они, за исключением АТФ, присутствуют в малых или следовых количествах. Здесь не показан инозинтрифосфат (ИТФ), который представляет собой дезаминированное производное АТФ с OH-группой в положении 6 пуринового кольца.
ным ингибитором, чем Фн [10, 116]. Однако это не означает, что стадию (2) можно в какой-либо заметной степени обратить: поскольку она сопровождается большим по величине и отрицательным по знаку изменением
48
Глава II
свободной энергии (—∖F = 6— 10 ккал! моль), ее равновесие сильно смещено вправо [116, 125, 169].
По мере повышения pH до 7,4 фосфатная группировка НТФ приобретает все больший заряд и в конце концов переходит в полностью заряженную форму, показанную в левой части уравнения (II. 2). Окончательное распределение зарядов на продуктах реакции изображено в правой части уравнения. Таким образом, если расщепление происходит при физиологическом значении pH 7,4, то общее число отрицательных зарядов увеличивается на единицу. Это означает, что при такой реакции должен освободиться протон (чтобы компенсировать изменение заряда), т. е. pH должен понизиться [53]. Все эти изменения, происходящие при физиологическом значении pH, можно схематически записать следующим образом:
(11.2)
(отмеченный звездочкой кислород воды входит в состав образовавшегося неорганического фосфата Фн [98]).
При значениях pH, более низких, чем физиологические, отрицательный заряд на неорганическом фосфате постепенно уменьшается; поэтому при расщеплении освобождается меньше протонов и подкисление выражено слабее. Этот эффект всегда необходимо учитывать при измерениях изменений энтальпии (внутренней энергии), так как часть этих изменений обусловлена энтальпией нейтрализации освобожденных протонов (ср. гл. IX).
Уравнения (II. 1) и (II. 2) слишком упрощены и не дают полного представления даже о тех процессах, которые происходят при расщеплении АТФ миозином,
Фиг. 14. Зависимость удельной АТФ-азной активности миозина от концентрации активирующих ионов Ca(A) и от концентрации KCl
(S) [148].
А — трис-буфер, pH 7,6; 0,05 М KCl; [ATΦ] = 2,5∙10–3 М; температура 25°; Б — [Ca2+] ≈ 4∙10–3 М, остальные условия те же, что и в случае А. Концентрация KCl в системе приблизительно равна ионной силе.
50
Г лава 11
потому что эта реакция сильно зависит от ионной среды. Во-первых, она чрезвычайно чувствительна к природе двухвалентных катионов, которые могут находиться в системе, и, во-вторых, к общей ионной силе. Очень сомнительно, может ли вообще протекать реакция расщепления при полном отсутствии двухвалентных катионов, особенно Ca2+. На фиг. 14, А показана зависимость АТФ-азной активности от суммарной концентрации ионов Ca в условиях, когда концентрация АТФ остается неизменной и равна 2,5 мМ, а ионная сила (Г/2) обусловлена в основном ионами К, Cl и трис-буфера и равна примерно 0,1. Скорость расщепления максимальна, когда концентрация Ca2+ равна концентрации АТФ или немного превышает ее. Повышение концентрации Ca2h до значения, в 4 раза превышающего концентрацию АТФ4-, лишь слегка ингибирует реакцию, и даже ее увеличение в 40 раз уменьшает скорость расщепления лишь до величины, составляющей примерно половину максимальной скорости. При понижении концентрации Ca2+ скорость реакции уменьшается гораздо быстрее и в значительно большей степени (результаты взяты из работы [147], но см. также [117]).
Имеется много возможностей для объяснения такого действия Ca2+, однако прежде всего необходимо иметь в виду, что АТФ способен образовывать прочные хелатные соединения с этим ионом, причем константа связывания 1 равна примерно 2∙ IO3 M-1 [154]. Следовательно, справа от пика на фиг. 14 большая часть АТФ находится в форме Ca · АТФ2“, а слева от него появляется все больше и больше АТФ4-. Более того, сам миозин имеет большое сродство как к АТФ, так и к Ca2+, поэтому сразу трудно сказать, какое из этих веществ в действительности является субстратом активного центра. Наблюдаемые закономерности проще всего объяснить тем, что молекула миозина имеет два центра: один из них связывает АТФ4-, но не связывает его комплекс с Ca, а другой, расположенный близко от первого, связы1 Под константой связывания (К) подразумевается величина, обратная константе диссоциации К. Для простой реакции А + B^ 5^АВ она равна отношению [AB]∕[A] [В].
Биохимия сократительных белков
51
вает только Ca2+. И лишь взаимодействие связанного АТФ со связанным Ca приводит к расщеплению [117]. Когда свободного АТФ очень много, он будет вытеснять Ca2+ (область слева от пика), а при слишком большом содержании Ca2+ концентрация АТФ4- уменьшится ниже того предела, который необходим для насыщения АТФ- центров (область справа от пика). Учитывая наклон кривой в области справа от пика, можно сказать, что константа связывания АТФ с миозином гораздо больше, чем константа его связывания с Ca2+. Действительно, если взять за основу константу Михаэлиса Км (она примерно равна константе диссоциации) для реакции расщепления, то обратная ей величина, представляющая собой константу связывания АТФ с миозином, имеет значение порядка IO5 М~]. Это примерно в 50 раз больше константы связывания АТФ с Ca2+ [116, 117]. Аналогично результаты для области слева от пика можно объяснить, предположив, что константа связывания Ca2i с миозином имеет величину примерно такого же порядка, как и константа связывания Ca2+ с АТФ [169].
Другой важный двухвалентный катион, содержащийся в мышце, Mg2+, способен, по-видимому, лишь очень слабо активировать АТФ-азные центры хорошо очищенного миозина ([147] и личные наблюдения). Вероятно, это объясняется его размерами, которые либо вовсе не позволяют ему связываться с активным центром, либо настолько сильно искажают этот центр, что его взаимодействие со связанным АТФ4“, предполагавшееся нами в случае Ca2+, становится невозможным,. В литературе, однако, приводится много данных, согласно которым миозин имеет все же измеримую АТФ- азную активность в присутствии одних только ионов Mg, но она всегда очень мала и обусловлена, по-види- мому, примесями; такими примесями могут быть АТФ- аза системы саркоплазматического ретикулума или актин [138, 147, 149]. При добавлении к системе актина ситуация заметно меняется, так как Mg оказывает активирующее действие, особенно в присутствии небольших количеств Ca2+, и является необходимым участником 1
1 Другое объяснение см. в [168].
52
Глава II
реакции, в результате которой изменения свободной энергии превращаются в полезную работу, совершаемую актомиозиновой системой.
Влияние ионной силы на реакцию расщепления АТФ миозином показано на фиг. 14,5 [147], из которой видно, что увеличение ионной силы с 0,05 до 0,25 оказывает некоторое активирующее действие, но дальнейшее ее увеличение приводит к медленному, но нарастающему ингибированию реакции. Возможно, такой ход кривой обусловлен тем, что сначала по мере увеличения ионной силы до значения, соответствующего максимальной активности, крупные агрегаты молекул миозина разрушаются с образованием более коротких нитей (фото V), среди которых присутствует также некоторое количество димеров и тримеров, а в дальнейшем увеличение ионной силы приводит к образованию отдельных молекул и к новому понижению активности (при концентрации 1 M KCl она падает до величины, равной половине максимальной). Однако этот эффект ингибирования нельзя целиком объяснить простым диспергирующим влиянием ионной силы: как показывают последние данные, полученные методами ультрацентрифугирования и электронной микроскопии [93, 94], при значениях Г/2, превышающих 0,6, большая часть миозина уже находится в мономерной форме. Следовательно, при этих значениях Г/2 усиление ингибирующего действия должно быть, очевидно, обусловлено локальным распределением заряда в области активного центра. Между прочим, исследования на ультрацентрифуге и данные электронной микроскопии, на которые мы ссылались, дают вполне определенные доказательства того, что образование упорядоченных толстых нитей миозина путем агрегации мономеров бок к боку происходит только при физиологических условиях, т. е. вблизи pH 7,4 и при ионной силе, равной примерно 0,15. Эти более сложные толстые нити, несомненно, обладают меньшей АТФ-аз- ной активностью, чем более короткие и тонкие нити, обнаруживаемые при Г/2 = 0,25 [81, 93, 94]. Здесь можно было бы упомянуть и о других интересных эффектах, обусловленных ионами, например о действии Zn, Мп, Со, Sr, Ba и NH4 или об удивительном активирующем
Биохимия сократительных белков
53
влиянии этилендиаминтетраацетата (ЭДТА), образующего хелатные соединения с двухвалентными ионами, особенно в присутствии NHZ. Совместное действие этих агентов может увеличить АТФ-азную активность миозина настолько, что она заметно превысит активность, получаемую в присутствии только ионов Ca [146]1. Однако эти эффекты, хотя их изучение и полезно для понимания механизма расщепления и природы активного центра, имеют второстепенное значение. Более существенны вопросы о роли тиоловых (SH) групп миозина и оснований, входящих в состав НТФ, а также о влиянии pH на НТФ-азную активность.
Роль SH-групп миозина в реакции расщепления удалось объяснить, применив новый реагент [147], действующий более специфично, чем применявшиеся ранее n-хлормеркурибензоат и N-этилмалеимид [122, 149]. Этот реагент, 5-5,-дитио-бис(2-нитробензойная кислота), или ДТНБ, молекула которого построена симметрично, реагирует с SH-группами, сам расщепляясь при этом на две половины. Глубина реакции определяется по количеству образующегося окрашенного продукта. Из тридцати пяти-сорока SH-групп, содержащихся в молекуле миозина, ДТНБ взаимодействует лишь с девятью-десятью; остальные группы, очевидно, не могут взаимодействовать с такой большой молекулой из-за стерических препятствий. В результате связывания пяти SH-групп АТФ- азная активность миозина уменьшается вдвое; когда связано 7 групп, наступает полная инактивация. Таким образом, почти не остается сомнений, что эти группы находятся в области головы молекулы — возможно, в непосредственной близости от ее активного центра [147].
Однако наиболее интересным результатом этих исследований является различие в числе групп, связываемых в отсутствие и в присутствии Mg∙ATΦ2~, который сам, как мы видели, способен присоединяться без расщепления к активному центру миозина. Если сначала добавить к системе Mg∙ATΦ2~, то две SH-группы (в расчете на частицы с весом 250 000) становятся недоступными для ДТНБ. Это, очевидно, те группы, которые 1 См. также предыдущую сноску.
54
Глава II
непосредственно участвуют в связывании АТФ (или его комплексов с двухвалентным металлом) с активными центрами, находящимися на каждой из двух голов миозина. Можно думать, что это происходит путем образования водородной связи с пуриновой частью молекулы АТФ (ср. также сходные, но более ранние данные [142а]). Эти обстоятельства также подчеркивают важность сохранения неизменными SH-групп миозина в процессе его приготовления, для чего необходимо на каждой стадии использовать какой-либо восстанавливающий агент, например меркаптоэтанол, чтобы предотвратить окисление [122].
Скорость расщепления НТФ миозином существенно зависит от того, какое основание входит в состав НТФ [61, 146]. ИТФ, УТФ и ГТФ, содержащие ОН-группу в положении 6 пуринового кольца, расщепляются быстрее, чем АТФ и ЦТФ, у которых в этом положении находится NH2-rpyππa. ОН- и NH2-rpyπ∏bi способны образовывать водородные связи и поэтому почти наверняка принимают участие в присоединении субстрата. Подобно тому, что наблюдается для других характеристик реакции, порядок, в котором располагаются различные НТФ по скоростям их расщепления, полностью меняется на обратный, когда в системе помимо миозина присутствует и актин [61]. Причина этого пока неизвестна, хотя можно думать, что в присутствии актина в системе субстрат соединяется с ферментом в трех точках. Это означает, что относительный порядок сил ионных и водородных связей, участвующих в реакции, в присутствии актина может измениться.
Влияние pH на скорость расщепления миозином различных НТФ было изучено довольно подробно [6, 139]. Здесь мы рассмотрим лишь тот случай, когда расщепление АТФ катализируется ионами Ca. Кривая зависимости АТФ-азной активности миозина от pH для этого случая приведена на фиг. 15 (кривая /). На ней можно видеть два намечающихся максимума — один при pH < 6,0 и другой при pH > 9,5, а в области физиологических значений pH примерно от 7 до 7,5, как это ни странно, — широкий минимум. Очевидных доказательств того, что появление максимумов и минимума обусловле¬
Биохимия сократительных белков
55
но заряженными группами белка, у нас пока нет, хотя уменьшение активности в области pH от 6,0 до 7,5 можно объяснить удалением протона (H+) с имидазольной группы остатка гистидина (pK от 6,5 до 7,0), а довольно
Фиг. 15. Зависимость относительной АТФ-азной активности от pH среды.
Кривая I — для миозина в среде, содержащей 0,25 М KCl + 5,0∙10–3 М АТФ и Ca2+ [6, 139]; кривая II — для миофибрилл, активированных только Ca2+ (5,0∙10–3 М), ионная сила 0,12; [АТФ] = [Ca2+]; кривая III — для миофибрилл, активированных Mg2+ (5,0∙10–3 М) + Ca2+ (l∙10–4 М); [ATΦ] = 5∙10-3 М. Кривые II и III — собственные наблюдения автора.
резкое увеличение активности при pH > 8,0—депротонизацией феноксильных групп остатков тирозина или концевых аминогрупп остатков лизина (pK от 9,5 до 10,0).
В присутствии актина кривая зависимости активности от pH резко изменяется. Это иллюстрируется кривыми
56
Глава II
II и III на фиг. 15, полученными для миофибрилляр- ной системы. Кривая //, соответствующая тому случаю, когда единственным активирующим ионом является Ca2b, показывает, что в этих условиях активность почти не зависит от pH в области значений от 6,0 до 8,3. Если же основным двухвалентным ионом является Mg2+, а ион Ca присутствует лишь в ничтожных количествах, зависимость выражается S-образной кривой с минимальным значением активности при pH 6, максимальным при 8,5 и средней точкой примерно при 7,0 (кривая ///). Представляется весьма заманчивым объяснить такую зависимость также изменением заряда на имидазольной группе гистидила, поскольку вид кривой очень напоминает по форме кривую, описывающую отщепление протона от этой группы. И здесь активирующее действие актина таково, что он меняет ситуацию на обратную той, которая наблюдается для чистого миозина, так как теперь удаление одного протона от имидазола гистидила при слабощелочных pH активирует, а не ингибирует АТФ-азную активность. Не исключена возможность, что в области pH около 9,3 имеется еще один максимум активности (на фиг. 15 не показан). Нет никакого сомнения, что эта активированная ионами Ca и Mg миофиб- риллярная система наиболее точно воспроизводит явления, наблюдаемые при сокращении мышцы.
Модификация миозин-АТФ-азы актином
Реакция между миозином и актином, представляющая для нас непосредственный интерес, происходит в том случае, если актин находится в F-, или фибриллярной, форме, т. е. когда его мономеры образуют длинные двойные суперспирали, показанные на фиг. 8. При добавлении коллоидного раствора такого F-актина к миозину при больших ионных силах (Γ∕2≥0,3) вязкость раствора сразу же сильно увеличивается в результате образования сложных агрегатов актомиозина [144—146]. Эти агрегаты по виду несколько напоминают стреловидные структуры полимера из F-актина и Т-меромиозина, показанные на фото VII. Однако интактные молекулы миозина имеют гораздо более длинные хвосты, чем
Биохимия сократительных белков
57
Т-меромиозин, и это, очевидно, не дает им возможности присоединяться по одной на каждый мономер актина, как это происходит в случае Т-меромиозина. Таким образом, максимальное молярное отношение миозина к актину при их рекомбинации становится равным 1 :2, а не 1:1. Можно думать, что получающиеся сложные агрегаты F-актомиозина имеют вид, изображенный на фиг. 16. Длина их ничем не ограничена, и, следовательно, молекулярный вес сильно варьирует. У полимера, изображенного на фиг. 16, молекулярный вес должен
Фиг. 16. Возможная структура части актомиозиновой «молекулы» в растворе при оптимальном весовом отношении миозина к актину, равном 4:1.
Одна длинная двухголовая молекула миозина находится между каждой парой актиновых бусинок, образуя стреловидную спиральную структуру, которую можно видеть на фото VII. Размеры лишь приблизительные.
был бы равняться примерно 16 млн., поэтому совсем не удивительно, что «растворы» актомиозина имеют большую вязкость. Часто такие полимеры агрегируют и образуют сложные структуры типа веревочной лестницы [133]; возможно, что это происходит в результате объединения их хвостов.
Реакции в «растворе» при большой ионной силе
АТФ по-разному взаимодействует с растворами очищенного актомиозина при Г/2 = 0,6 в зависимости от того, какова природа двухвалентного катиона, содержащегося в системе. При добавлении Mg∙ATΦ2^ вязкость раствора внезапно и сильно изменяется, уменьшаясь до величины, значительно меньшей, чем аддитивная
58
Глава 11
вязкость двух компонент, и остается на этом уровне почти неограниченно долгое время [8, 143—146]. Mg · АТФ2" присоединяется к активному центру миозина, вызывая отталкивание прикрепленного к миозину актина за счет электростатических взаимодействий [127]; в результате полимерная структура полностью распадается на составные части. Так как Mg · АТФ2" не является эффективным субстратом миозин-АТФ-азы, при таком процессе не происходит сколько-нибудь заметного расщепления АТФ [147].
При замене Mg∙ATΦ2^ на Ca∙ATΦ2^ вязкость уменьшается гораздо медленнее и не столь значительно [8]. Этот процесс сопровождается сильным расщеплением АТФ, ибо Ca · АТФ2" является прекрасным субстратом миозина (фиг. 14). Следовательно, процесс расщепления заканчивается очень быстро, после чего вязкость сразу же возвращается к своему прежнему высокому значению, характерному для актомиозинового полимера [8, 146]. Таким обраом, Mg-АТФ2“· является гораздо лучшим «пластификатором» актомиозина, чем хелатный комплекс с Ca, вопреки тому, что Ca∙ATΦ2~ также должен был бы вызывать заметное электростатическое отталкивание. Следует отметить, что АТФ может действовать подобным образом (как пластификатор) только в виде хелатного соединения с двухвалентным катионом, а одновалентные катионы (в отсутствие двухвалентных) в этом смысле почти совсем неэффективны [8].
Актомиозиновый гель при физиологических значениях ионной силы
Хотя описанные эффекты происходят при условиях, очень далеких от физиологических, т. е. при высокой ионной силе, они имеют одну общую черту с эффектами, наблюдаемыми в актомиозиновых гелях и в более высокоорганизованной системе интактных миофибрилл, находящихся при физиологической ионной силе, равной примерно 0,15. Эта общая черта состоит в следующем: Mg ∙ ATΦ2~ действует как пластификатор актомиозиновых комплексов и разрушает их на составные части, кода условия таковы, что сам он не может расщепляться
Биохимия сократительных белков
59
в активном центре. К сожалению, именно здесь мы сталкиваемся с неприятным свойством этого геля при низкой ионной силе, которое только недавно было полностью изучено: его реакция с Mg∙ATΦ2~ зависит от способа приготовления системы.
Как гели актомиозина, экстрагированные непосредственно из мышцы, так и искусственный актомиозин, состоящий из актина со случайными примесями «тропомиозина», ведут себя «ортодоксально» по отношению к Mg-АТФ2-; иначе говоря, в присутствии только ионов Mg такой гель не будет ни расслаиваться, ни расщеплять АТФ [36, 37, 153]. Однако даже ничтожного (~ 1O^5Λ1) количества ионов Ca, содержащихся в реагентах и в стеклянной посуде, достаточно для того, чтобы вызвать быстрое расщепление АТФ. Это сопровождается очень сильным расслаиванием геля, которое было так изящно продемонстрировано Сцент-Дьёрдьи [144, 145] в его ранних исследованиях сократимости актомиозина. Для обеспечения максимального пластифицирующего действия Mg-АТФ2“ на естественные актомиозиновые гели и ингибирования АТФ-азы необходимо, чтобы все примесные ионы Ca были включены в хелатные соединения (предпочтительно с ЭГТК, которая связывает Ca2+ в 1000 раз эффективнее, чем Mg2+ [154]). Если посмотреть на это с другой стороны, то ионы Ca2+ необходимы для того, чтобы произошло расслаивание геля и расщепление АТФ в присутствии Mg · АТФ2-; однако естественная актомиозиновая система настолько чувствительна к этим ионам, что скорость расщепления достигает значения, равного половине максимальной, уже при очень низкой (3∙10^7 Л4) концентрации свободных ионов кальция [36, 37, 153, 154].
Можно ли утверждать, что Mg2+ также необходим для расслаивания геля? Конечно, можно, поскольку при наличии одного только Ca · АТФ2- (даже если концентрация его высока), эффект оказывается неполным, хотя расщепление АТФ все же происходит с большой скоростью [123, 153, 154]. Добавление ничтожного количества ионов Mg вызывает мгновенное и полное расслаивание геля. Для естественного актомиозина мы можем суммировать эти эффекты следующим образом:
60
Г лава Il
1) естественные актомиозиновые гели с примесью «тропомиозина» «пластифицируются» Mg · АТФ2', но не расщепляют его и не расслаиваются, 2) добавление ничтожного количества Ca2+ катализирует расщепление и расслаивание в присутствии Mg2+; 3) в отсутствие Mg2+ даже очень большое количество Ca2+ катализирует только расщепление, но не расслаивание; 4) для расслаивания ионы Mg так же необходимы, как и ионы Ca.
Обратимся теперь к свойствам искусственного актомиозина, приготовленного из очищенных актина и миозина. Гели из этих двух белков в одном отношении существенно отличаются от гелей из естественного актомиозина: они не требуют присутствия следов Ca2+, а способны расслаиваться и расщеплять АТФ в присутствии Mg2+; иными ословами, они теряют чувствительность к Ca [38, 115]. Однако, если в системе имеется только Ca · АТФ2", они расщепляют его так же хорошо, как и естественный актомиозин, и подобно последнему не расслаиваются. Следовательно, существенное различие между ними заключается только в их реакции с Mg · АТФ2', который в искусственном актомиозине не ингибирует расщепления АТФ и поэтому не может катализировать пластификацию. Хотя вопрос о природе фактора, обусловливающего чувствительность к Ca, утрачиваемую чистым актомиозином, находится еще в стадии исследования [122], представляется весьма вероятным, что этим фактором является тропомиозин вместе с тропонином [20, 38, 115]. В самом деле, было показано, что такой «тропомиозин» восстанавливает чувствительность актомиозина к Ca, если его готовить в присутствии какого- нибудь тиолового соединения или другого восстанавливающего агента, предотвращающего окисление SH-rpyπn белков [20, 115]. Как мы показали в предыдущей главе, сам тропомиозин, возможно, также включается в структуру Z-пластинки, начиная от которой он вместе с тропонином может распространяться в любом направлении по канавке двойной спирали актина.
В одной из возможных гипотез действие «тропомиозина» объясняется тем, что его присутствие внутри спиралей «естественного» актина приводит к отталкиванию Mg∙ ATΦ2^ или АТФ4-, присоединенных к миозиновому
Биохимия сократительных белков
61
партнеру, и тем самым мешает взаимодействию, приводящему к расщеплению АТФ и сокращению мышцы. Когда добавляется Ca2+, он связывается с отрицательно заряженными группами тропониновой части тропомиозинового комплекса, нейтрализует заряд и таким образом способствует взаимодействию между мономерами актина и комплексом субстрат — миозин [35а]. Иначе говоря, Ca2+ действует не как активатор в точном смысле слова, а как ингибитор ингибирования (путем взаимодействия с зарядом на тропомиозине). В сущности это означает возвращение к гипотезе, предложенной очень давно при открытии фактора Марша, хотя и с совершенно новым механизмом ([13], стр. 251). Кроме того, это восстанавливает Mg · АТФ2" или АТФ4- в правах истинных субстратов актин — миозин-АТФ-азы [10] в противоположность Ca · АТФ2", который расщепляется миозином без участия актинового партнера (ср. фиг. 14,Л). Эта гипотеза напоминает идею, выдвинутую Перри [122], с тем исключением, что место постулированного там гипотетического ESG-φaκτopa занимает «тропомиозин». Необходимое дополнение к этой концепции заключается, однако, в том, что «тропомиозин» должен обладать способностью связывать только Ca2+, но не Mg2+. Это важное обстоятельство было недавно установлено прямым экспериментом [35а].
Прежде чем закончить обсуждение искусственного актомиозина и вернуться к рассмотрению более упорядоченного расположения актиновых и миозиновых ни- тей в миофибриллах, следует повторить, что различные нуклеозидтрифосфаты, о которых мы упоминали в связи с чистым миозином, в этом случае дают совершенно противоположный эффект. Иначе говоря, НТФ с NH2-rpyπ- пой в положении 6 пуринового или пиримидинового кольца (АТФ, ЦТФ) расщепляются актомиозином быстрее, чем НТФ, у которых в этом положении находится ОН-группа (ИТФ, УТФ, ГТФ) [8]. Как мы уже говорили, это свидетельствует о том, что заместитель в положении 6 пуринового кольца является одним из партнеров в образовании важных связей между актином и миозином в процессе сокращения (другим партнером является трифосфатная группировка).
62
Глава II
АТФ-азная активность и сокращение миофибрилл
Для изучения АТФ-азной активности и сократительных свойств миофибрилл их можно готовить путем гомогенизации мышцы в слабых буферных растворах при pH 7,0 и ионной силе от 0,1 до 0,15. Препарат фибрилл из мышцы кролика получается особенно хорошим, если перед гомогенизацией мышца переходит в состояние окоченения (примерно через 20 час после смерти, при 10°). АТФ-азная активность таких миофибрилл идентична активности препаратов из мышцы в состоянии, предшествующем окоченению. Фибриллы можно отделить от соединительной ткани и интактных волокон дифференциальным центрифугированием гомогената при малой скорости [123] или просто фильтрованием [10]. Затем их тщательно промывают для удаления растворимых примесных белков. Такие фибриллы имеют диаметр 1—2 мк и длину 10—100 мк.
Описанная система имеет заметные преимущества перед гелями актомиозина не только потому, что нити актина и миозина лучше организованы в соответствии с их естественным расположением и пропорциями, но и потому, что ее чувствительность к кальцию сохраняется в течение нескольких дней. Следовательно, результаты наблюдений можно с большим основанием сопоставлять с сокращением in vivo.
Степень сокращения фибриллярной системы можно измерять в относительных величинах путем центрифугирования фибрилл примерно при 3000g и последующего измерения объема слоя фибрилл до и после добавления АТФ [109]. Пользуясь простым стробоскопическим эффектом, можно также следить за слоем фибрилл во время центрифугирования и определить таким образом скорости седиментации (фиг. 17). Значения этих скоростей можно затем сопоставить со скоростью расщепления АТФ или другого НТФ в аналогичных условиях. Этот метод позволяет определить средние размеры частицы фибриллы после сокращения. Успеть измерить эту величину во время самой фазы сокращения совершенно невозможно, потому что оно происходит так быстро, что успевает закончиться за время начального ускорения
Фиг. 17.
А. Изменение объема слоя фибрилл в зависимости от времени при их обработке в различных средах и последующем центрифугировании при 3000 g. Имидазольный буфер, pH 7,2; ионная сила 0,12; если добавлен АТФ, то его концентрация равна 4∙10–3 М; температура 20°. I — АТФ + 4∙10–3 М MgCl2 + столько же ЭГТК; II — контроль (без АТФ); III — АТФ как в случае I, но без MgCl2; (CaCl2] = 4∙10–3 М; IV — АТФ как в случае I; 4∙10–3 М MgCl2 + 0,4∙10–3 М CaCl2; V — ATΦ как
в случае I; 0,4∙10–3 М MgCl2 + 4∙10–3 М CaCl2. Б. АТФ-азная активность фибрилл при различных условиях, приведенных выше (наблюдения автора).
64
Глава Π
центрифуги. Самые большие скорости седиментации по- лучаются для сокращенных фибрилл, так как они плотнее, тогда как низкая скорость означает, что фибриллы перед началом центрифугирования были набухшими и если и были сокращены, то лишь незначительно. Такое различие в скоростях седиментации обусловлено выталкиванием осмотически связанной воды при сокращении фибрилл.
По своей реакции на двухвалентные ионы фибриллярная система очень напоминает естественные актомиозиновые гели. Если в нее добавить ЭГТК для хелатного связывания всех следов ионов Ca, то в присутствии только Mg∙ATΦ2^ она расщепляет АТФ, но скорость этого расщепления по крайне?! мере в 20 раз меньше, чем в присутствии следов Ca2+ (фиг. 17,5). В этих условиях фибриллы не сокращаются, а, наоборот, имеют тенденцию к набуханию, о чем можно судить по скорости и степени седиментации (фиг. 17, А, кривая /). В то же время добавление к фибриллам ионов Ca в концентрации примерно 0,4 мМ в присутствии 4 мМ Mg · АТФ2" приводит к их быстрому и интенсивному сокращению, о чем свидетельствует большая скорость и степень седиментации, причем в этом случае сокращение сопровождается максимальной АТФ-азной активностью (фиг. 17, А и Б, кривые IV; см. также [154]).
Если в среде находятся только ионы Ca, то они влияют на скорость седиментации значительно слабее, чем даже при очень низкой их концентрации в присутствии Mg · АТФ2“. Это можно видеть на фиг. 17, А, где кривая III соответствует случаю, когда Ca добавлен в виде Ca-АТФ2- при концентрации 4 мМ. Тем не менее АТФ-азная активность (кривая III на фиг. 17, Б) даже выше, чем для системы с Mg в присутствии ничтожных количеств ионов Ca (кривая IV). Возможно, что если перед добавлением Ca-АТФ2“ удалить все следы ионов Mg, то скорость седиментации будет еще ниже, но практически осуществить это трудно.
Таким образом, подобно системе актомиозинового геля, фибриллы реагируют на АТФ по-разному в зависимости то того, какой двухвалентный катион имеется в среде. В присутствии одного только Mg2+ они рас¬
Биохимия сократительных белков
65
щепляют АТФ очень медленно и не сокращаются, а скорее имеют тенденцию к набуханию. Добавление ничтожного количества ионов Ca (от 0,01 до 0,4 мМ) ведет к быстрому расщеплению и сильному и полному сокращению. Если же в среде содержатся только ионы Ca (даже в большой концентрации), то они либо вызывают незначительное сокращение, либо вообще его не вызывают, хотя в этом случае возможна очень большая скорость расщепления, вся энергия которого должна превращаться в тепло. Наконец, добавление ионов Mg (0,4 мМ) к системе, содержащей Ca, хотя и снижает несколько скорость расщепления, также немедленно катализирует максимальное сокращение (ср. фиг. 17, А и Б, кривые V).
Эти наблюдения дают прекрасную возможность представить себе, как может работать цикл сокращение — расслабление в живой мышце. Когда мышца находится в расслабленном состоянии, в ней, по-видимому, присутствуют только Mg ∙ATΦ2~, а все ионы Ca связаны в хелатные комплексы (какие именно, мы еще не знаем). Затем, когда возникает стимул для сокращения, ионы Ca освобождаются и концентрация свободного кальция возрастает примерно до 10^5M; при этом общее количество кальция должно несколько превышать то, которое необходимо для насыщения всех активных центров миозина (от 0,1 до 0,25 мг ионов Ca2+ на 1 а-мышцы). Это должно привести к быстрому расщеплению АТФ и, следовательно, к сокращению. Для расслабления мышцы необходимо, чтобы постулированная система, в которой Ca связан в хелатные комплексы, снова начала действовать на полную мощность и чтобы АТФ либо был полностью ресинтезирован из креатинфосфата, либо путем свободной диффузии доставлен к активным центрам из саркоплазмы. Вновь образованный Mg · АТФ2" ведет затем к ингибированию расщепления и полному расслаблению. Как мы увидим, в интактной мышце действительно существует такая система: это так называемый кальциевый насос, расположенный в трубочках саркоплазматического ретикулума, который обволакивает каждую фибриллу внутри волокна.
66
Г лава Il
Еще о действии Ca 2+ на фибриллы
Количественные аспекты активирующего действия Ca на фибриллярную АТФ-азу и сокращение очень важны для рассмотрения сокращения in vivo, так как они выявляют теоретические требования, предъявляемые к кальциевому насосу, о котором мы говорили выше, и дают ключ к пониманию природы реакции, протекающей в активных центрах миозина при сокращении. Как мы увидим, при этом наблюдается также еще одно интересное явление.
Типичные результаты действия Ca на миофибриллы кролика приведены на фиг. 18, Л (ср. [154]). Опыты выполнены при условиях, близких к тем, которые имеют место в живой мышце, т. е. при температуре 35°, ионной силе, немного меньшей 0,15, при pH ≈ 7,2 и при начальной концентрации Mg∙ATΦ2~, равной 4 мМ. Концентрация свободных ионов Ca2+ контролировалась в этом эксперименте с помощью Са-ЭГТК-буферов, действующих аналогично большинству обычных pH-буферов, за исключением того, что они контролируют именно концентрацию свободных ионов Ca [154].
Следует отметить, что в этих условиях абсолютное максимальное значение скорости расщепления в присутствии достаточного количества Ca2+ (≥10~5Λ4) весьма постоянно для разных образцов миофибрилл кролика и составляет примерно 2100 мкг-атом Фн, отщепляемых в минуту на 1 г белка. Максимальная скорость оборота составляет при этом примерно 36 моль расщепляемого АТФ на I моль миозина в 1 сек, или 1 моль АТФ на 1 моль миозина в 28 мсек (в предположении, что фибриллярный белок содержит 50% миозина, что соответствует концентрации ≈10~6 M в интактной свежей мышце).
Для свежих фибрилл кривая Са-активности имеет резко выраженную S-образную форму; при концентрациях Ca2+ ниже 1O^6Λ1 скорость расщепления очень быстро падает, достигая половины своего значения при 10~6>5Λ4. Однако, даже когда [Ca]2+ составляет всего 10~8Λf, фибриллы сохраняют небольшую остаточную АТФ-азную активность (5—10% максимальной).
Фиг. 18. Зависимость относительной АТФ-азной активности (V∕Vm) миофибрилл от концентрации Ca2+ в среде в присутствии 5∙10–3 М АТФ + MgCl2.
Условия те же, что и приведенные на фиг. 17, но температура 35°. Концентрацию Ca2+ контролировали с помощью Ca-ЭГТК-буферов. А. Кривая I — для фибрилл, выдержанных 6 дней в асептических условиях в кислороде при 20°; кривая II — для свежих фибрилл. Б. Те же данные, исправленные с учетом остаточной АТФ-азной активности (Vост)∙ существующей при исчезающе малой концентрации Ca2+, равной 10–8 М. По оси ординат отложено (V – Vост) ∕ (Vm – Vост). Светлые кружки — для свежих фибрилл, темные — для фибрилл, выдержанных 6 дней в O2 при 20° (наблюдения автора).
68
Биохимия сократительных белков
Происхождение этой активности еще неясно. Она гораздо выше, чем это необходимо для продукции энергии в покоящейся живой мышце, когда скорость расщепления составляет менее 0,1% максимальной скорости при сокращении. Об этой активности в различных условиях постоянно пишут и другие исследователи [154]. Возможно, что в интактной мышце она контролируется «растворимым» фактором, который, по сообщению Перри [122], ингибирует активированное магнием расщепление АТФ искусственным или десенсибилизированным актомиозином.
Остаточное расщепление, не активированное кальцием, интересно тем, что его скорость можно значительно увеличить, храня фибриллы в течение нескольких дней в асептических условиях в присутствии воздуха или кислорода. Фиг. 18, А показывает, что при хранении фибрилл в кислороде в течение 6 дней при 20° ([Ca]2+= 10^8Λi) скорость остаточного расщепления увеличивается примерно от 8 до 52% максимальной, хотя абсолютная величина последней остается неизменной. C помощью седиментационного теста, описанного выше, было показано, что выдержанные в таких условиях фибриллы наряду с их гораздо более высокой остаточной АТФ-азной активностью почти максимально сокращаются в присутствии одного только Mg · АТФ2-. В этом можно видеть аналогию с расслаиванием очищенного актомиозина в присутствии Mg · АТФ2“.
Утрата чувствительности к кальцию при хранении фибрилл действительно очень напоминает ситуацию с очищенным актомиозином [38]. В последнем случае, как мы говорили, утраченную чувствительность к кальцию можно было восстановить добавлением «тропомиозина», SH-группы которого были защищены во время приготовления каким-либо тиоловым реагентом, тогда как «тропомиозин», приготовленный обычным способом в присутствии воздуха, был неэффективен [33, 115]. Основываясь на этом, фибриллы выдерживали в азоте, добавляя или не добавляя к ним 5мМ меркаптоэтанол, и сравнивали их с фибриллами, хранившимися в кислороде. Результаты показаны на фиг. 19, где для различных условий приготовления приведены скорости рас¬
Г лава Il
69
щепления при [Ca]2+ = < 10–8 M (т. е. при концентрации Ca2+, близкой к нулю). Можно видеть, что низкая начальная скорость расщепления, характерная для этих условий, при выдерживании в O2 постепенно увеличивается, а в присутствии N2 не меняется (независимо от
Фиг. 19. Зависимость остаточной АТФ-азной активности, измеренной так, как указано на фиг. 18, от времени выдержки при 20° (наблюдения автора).
Концентрация примесных ионов Ca поддерживалась на уровне менее 10–8 М
посредством добавления 4 мМ ЭГТК. Результаты выражены в процентах от контрольной АТФ-азной активности в присутствии l∙10–4 М Ca2+. Светлые кружки — хранение в кислороде, темные кружки — хранение в азоте; треугольники — хранение в N2 в присутствии 5∙10–3 М меркаптоэтанола.
того, добавлен 5 мМ меркаптоэтанол или нет). Из этого следует, что: 1) окисление SH-групп является наиболее вероятной причиной утраты чувствительности к кальцию; 2) эти SH-группы, вероятно, расположены вдали от активного центра самого миозина, так как максимальная скорость расщепления Mg∙ATΦ2– в присутствии адекватного количества Ca2+ не меняется при хранении фибрилл; 3) рассматриваемые SH-группы, по-видимому,
70
Г лава Il
принадлежат «тропомиозину», который, как мы постулировали, лежит внутри двойных спиралей актина и определяет чувствительность системы к кальцию.
Сколько мест для Ca2+ имеется в активном центре?
Вопрос о числе ионов Ca, включенных в активный центр, когда в среде, где находятся свежие фибриллы, обладающие максимальной чувствительностью к кальцию, содержатся также ионы Mg, все еще полностью не решен. Исследования радиоактивного обмена Ca дали сомнительные результаты — что-то между одним и двумя ионами Ca на активный центр [154, 158], тогда как кинетика процесса совершенно ясно и недвусмысленно требует, чтобы это число было равно точно двум: кривая II на фиг. 18, А падает вниз слишком круто для случая присоединения только одного иона и, конечно, недостаточно круто для присоединения трех ионов. Результаты, приведенные на фиг. 18, Af точно описываются упрощенным кинетическим уравнением типа
V'm/Vx = l + K/[Ca2+]2x, (II.3)
где V'm — исправленная максимальная скорость, Vx — исправленная скорость при концентрации Ca2+, равной [Ca2+]χ (см. подпись под фиг. 18), а K — константа.
Из этой простой формы уравнения с необходимостью следует, что активный центр фермента насыщен субстратом. Здесь мы имеем именно этот случай, так как концентрация Mg∙ATΦ2– составляет 4 мМ, а константа Михаэлиса Km, определяющая степень насыщения, меньше 8∙10–5 М. Следовательно, член Km∕[ATΦ] в уравнении Михаэлиса — Ментен много меньше 0,02, и им можно пренебречь [10]. При тех условиях опыта, которые приведены на фиг. 18, А, численное значение константы в уравнении (П.З) равно 10–13 М2, откуда следует, что концентрация Ca2+, при которой скорость расщепления достигает половины максимальной, равна 10–6,5 М. Справедливость этого уравнения подтверждает фиг. 18, Б, где активность (V/Vm) исправлена с учетом остаточного расщепления, не активированного Ca. Светлые кружки соответствуют кривой I на фиг. 18, А для свежих фиб¬
Биохимия сократительных белков
71
рилл, у которых остаточная активность очень мала, а темные кружки — результатам, полученным через б дней хранения фибрилл в O2 при 20°, когда остаточная активность возрастает до 52% максимальной. Оба набора точек хорошо укладываются на теоретическую кривую, вычисленную из уравнения (II. 3). Вебер и Герц [154] получили аналогичную кривую, но с несколько иным положением средней точки — при 10^6>3 M Ca2+; вероятно, это обусловлено тем, что опыты проводили не при 37°, а при 25°.
Итак, совершенно ясно, что в случае активации кальцием свежих фибрилл в присутствии Mg-АТФ2" два иона Ca каким-то образом включены в активный центр или находятся вблизи него, тогда как для простого активированного кальцием расщепления АТФ самим миозином или фибриллами в отсутствие Mg2+ почти наверняка требуется только один ион Ca [117]. Несомненно, именно фибриллярная система, содержащая Mg и Ca, наилучшим образом отражает действительные процессы, происходящие в мышце, где истинными субстратами являются либо АТФ4-, либо Mg ∙ ATΦ4", a Ca2+, по-видимому, действует, присоединяясь к неспецифическим отрицательно заряженным группам «тропомиозина» внутри спиралей актина, нейтрализуя тем самым их ингибирующее действие. Если это так, то легко понять, почему столь большое влияние оказывает окисление SH-rpyππ этого «тропомиозина»: очевидно, оно должно приводить к очень сильному изменению формы молекул, что мешало бы им в дальнейшем играть их анти-АТФ-азную роль. Эта гипотеза могла бы объяснить также и загадочное постоянство максимальной АТФ-азной активности фибриллярной системы независимо от того, окислен тропомиозин или нет, т. е. нуждается ли система в ионах Ca или только в ионах Mg. Такое постоянство понятно, если истинным субстратом актин-миозинового комплекса является Mg ∙ ATΦ2^ или АТФ4". Если же в том случае, когда «тропомиозин» находится в восстановленном состоянии, субстратом является Ca · АТФ2", а затем при окислении белкового комплекса он неожиданно и непонятно заменяется на Mg ∙ATΦ2^, то такого постоянства наблюдаться не должно.
72
Глава il
Ранее мы видели, что для «активации» миофибрилл требуется, вероятнее всего, тропонин, связывающий Ca2+. Учитывая молярные отношения белков, в этом случае мы получили бы 2 связанных иона Ca на молекулу миозина, что вполне согласовалось бы с уравнением (II.3) (ср. [35а]). Отметим также, что связывается только Ca2+, а не Mg2+.
Влияние температуры
Если мы хотим связать данные об АТФ-азной активности миофибрилл с сокращением in vivo, мы обязательно должны учитывать влияние температуры, особенно если речь идет о сократительной активности мышц холоднокровных животных, которые были предметом столь многих работ по энергетике сокращения [И, 67]. Для наших целей достаточно рассмотреть влияние температуры при следующих стандартных условиях: [Mg∙ATΦ2-]≈ = 4 мМ; [Са2+]своб = 0,4 мМ\ имидазольный буфер (40 мМ), pH 7,2—7,6; ионная сила доведена с помощью KCl до 0,15 (для млекопитающих и птиц) или до 0,12 (для амфибий и рыб).
Результаты, полученные для различных видов животных, приведены на фиг. 20 и в табл. 2.
Из фиг. 20 видно, что кривые для теплокровных животных (млекопитающих и птиц) идут гораздо круче, чем для холоднокровных (щука, лягушка и черепаха); это означает, что у первой группы животных температура действует на АТФ-азную активность миофибрилл значительно сильнее, чем у второй. Можно отметить интересные различия и внутри групп: например, мышцы крупных млекопитающих при температуре тела около 37° расщепляют АТФ со скоростью, вдвое меньшей той, с которой действуют при этой температуре белые мышцы крысы и кролика. Что касается двух исследованных птиц, то цыпленок (грудная мышца) напоминает крысу и кролика, а голубь (та же мышца)—более крупных млекопитающих. На первый взгляд кажется, что, судя по этим результатам, белые мышцы (ножные мышцы крысы, спинные мышцы кролика и грудные мышцы цыпленка) являются «быстрыми», а красные мышцы
Фиг. 20. Зависимость относительной АТФ-азной активности от температуры для теплокровных (А) и холоднокровных (Б) животных.
Исследованные мышцы: различные ножные мышцы крысы, лягушки и черепахи; длинные мышцы спины кролика, свиньи, овцы и быка; грудные мышцы цыпленка и голубя. [АТФ] = [Mg2+] =4∙10–3 М; lg[Ca2+] = 3,7; pH 7,2-7,6; имидазольный буфер (ср. [11]).
Таблица 2
Энтальпия (∆H), энтропия (∆S) и свободная энергия (∆F) активации АТФ-азы миофибрилл для различных видов животных [11] (условия опыта см. на стр. 72).
Животное
Температура, oC
K' (константа скорости расщепления), число молей АТФ, расщепляемого в 1 сек, на 1 моль миозина
ΔH, ккал/моль
ΔS, единицы энтропии
ΔF, ккал/моль
Теплокровные
Крыса, кролик
0,6
0,14
28,2
+39,4
17,1
18,5
3,80
23,4
+24,1
16,2
35,0
35,30
Вол, свинья, овца
0,6
0,14
23,6
+23,5
17,0
18,5
2,20
21,6
+16,6
16,6
35,0
16,70
Цыпленок
0,6
0,13
29,0
+39,0
17,0
18,5
2,50
23,0
+20,0
16,8
35,0
29,60
Голубь
0,6
0,27
23,0
+23,0
17,0
18,5
2,30
20,0
+16,0
16,5
35,0
14,20
Холоднокровные
Черепаха
0,6
0,10
25,4
+29,0
17,2
18,5
1,70
14,4
–9,8
17,3
35,0
6,70
Лягушка
0,6
1,30
17,0
+4,8
15,8
1,5
16,70
14,0
–4,5
15.8
35,0
44,00
Щука
0,6
3,7
15,4
–0,9
15,7
18,5
22,0
12,7
–9,2
15,5
35,0
74,0
Биохимия сократительных белков
75
крупных млекопитающих и грудные мышцы голубя — «медленными». Но в действительности это совсем не так, поскольку как раз самые «медленные» из всех мышц — мышцы черепахи — почти не содержат миоглобина, окрашивающего мышцы высших животных в красный цвет.
Более вероятно, что АТФ-азная активность мышц различных животных определяется функциональной адаптацией мышц. Действительно, вполне возможно, что у низших организмов существовало некоторое ограниченное число типов миозина (изомиозины), отличающихся по удельной АТФ-азной активности, и из них в процессе эволюции в результате отбора возникли две главные группы — миозин холоднокровных животных и миозин теплокровных животных, — различающиеся по своей чувствительности к температуре [122]. Тогда все животные в пределах каждой группы должны были бы обладать генетической информацией, необходимой для образования различных изомиозинов, каждый из которых адаптирован к специфической мышечной функции. Чтобы пояснить это, рассмотрим растущего кролика. Если он рождается недоношенным, то у него при рождении имеется только «медленный» миозин, обладающий примерно той же активностью, что и миозин грудной мышцы взрослого голубя [122, 148]. Однако вскоре в большинстве «быстрых» белых мышц кролика образуется миозин с примерно вдвое большей активностью, тогда как АТФ-азная активность одной из немногих имеющихся у кролика «медленных» красных мышц — полусухожиль- ной — остается на том же уровне или становится даже ниже, чем при рождении в недоношенном состоянии. Например, АТФ-азная активность фибрилл из полусухо- жильной мышцы взрослого кролика составляет меньше 1A активности белых мышц — длинной мышцы спины или поясничной мышцы (ср. также [139]).
В ответ на высказанные нами соображения можно было бы возразить, что из двух компонентов актомиозинового комплекса мы рассматривали только миозин, тогда как актин также может играть роль в определении общей АТФ-азной активности фибрилл. Однако последнее маловероятно по двум причинам: во-первых, актины самых разных типов образуют с миозином кролика
76
Глава II
актомиозиновые комплексы, почти неразличимые по своей АТФ-азной активности; во-вторых, относительные скорости расщепления для миозинов, выделенных из животных различных видов, согласуются с соответствующими значениями для фибриллярных препаратов, где присутствует также и актин [11, 122, 139]. Следовательно, ясно, что миозины животных разных видов и изомиозины животных одного вида различаются группировками, лежащими вблизи от активного центра, тогда как ни в легком меромиозине, ни в актине заметных различий наблюдаться не должно, по крайней мере у позвоночных. Для специализированных миозинов, обнаруженных в гладких мышцах, и для миозинов низших животных, таких, как черви и моллюски, это обобщение, возможно, и не справедливо [140].
Для того чтобы выразить влияние температуры количественно, необходимо рассмотреть значения энергии или, точнее говоря, энтальпии активации, приведенные в табл. 2. В этой же таблице приведены также величины энтропии и свободной энергии активации. Эти параметры были вычислены из уравнения Эйринга для абсолютных скоростей реакций (см. [51]).
Вкратце, энтальпия активации представляет собой тот избыток внутренней энергии, который реагирующие молекулы должны приобрести путем столкновений для того, чтобы реакция началась; иными словами, это количество энергии, необходимое для перехода через «энергетический барьер». В сложном процессе мышечного сокращения, в котором участвуют по меньшей мере четыре «молекулы» — голова молекулы миозина, молекула АТФ, ион Ca2+ и мономер актина, — энергия активации распределена по нескольким степеням свободы, так как до начала реакции должен образоваться относительно высокоорганизованный комплекс. Образование такого комплекса означает увеличение упорядоченности, т. е. уменьшение энтропии, и поэтому можно ожидать, что обычно энтропия активации должна быть отрицательной. Это прямо противоположно данным для теплокровных животных, приведенным в табл. 2.
Свободная энергия активации является производной от двух других функций, и ее можно вычислить незави¬
Биохимия сократительных белков
77
симо. Именно эта функция определяет скорость реакции при данной температуре. Из таблицы видно, что во всех случаях она практически одинакова, и поэтому обсуждать ее мы больше не будем.
Наиболее существенно различаются между собой значения энтальпии и энтропии активации для теплокровных и для холоднокровных групп животных, тогда как внутри группы эти функции практически постоянны. В среднем энтальпия активации для теплокровной группы почти в 2 раза больше, чем для холоднокровной, а энтропия активации велика и положительна для первой группы и низка или отрицательна для второй.
Черепаха в температурном интервале от 0 до 18,5° является исключением из этого правила, так как значение энтальпии для нее приближается к значению, характерному для теплокровной группы, а энтропия, так же как в этой группе, положительна, а не отрицательна. Возможно, это получилось потому, что трудно измерить с достаточной точностью скорости расщепления (K, в табл. 2) при 0°, где они очень незначительны. Тем не менее с данными, приведенными здесь, согласуются и два других наблюдения на мышце черепахи: 1) для затухания активного напряжения после одиночного мышечного сокращения в живой мышце черепахи кажущаяся энтальпия активации в этом температурном интервале составляет 19 κκaΛ∣M0Λb, а энтропия равна +23 единицы [22]; 2) сравнение скорости выделения тепла во время тетануса при 0° для мышц черепахи и лягушки показывает, что последняя выделяет тепло в 12 раз сильнее, чем первая [72, 73]. Скорость выделения тепла зависит, в частности, от скорости той химической реакции, в результате которой выделяется тепло, а именно от расщепления АТФ; поэтому ее можно непосредственно сравнивать с относительными скоростями расщепления для соответствующих фибриллярных препаратов в табл. 2. И здесь снова отношение скоростей для лягушки и черепахи равно примерно 12. Следовательно, мы можем, по- видимому, считать данные для мышц черепахи при 0° вполне достоверными, так что она действительно является исключением среди холоднокровных животных.
78
Глава Π
В настоящее время не имеет особого смысла проводить дальнейшее обсуждение вопроса о том, какой смысл имеют приведенные в таблице положительные и отрицательные значения энтропий активации, поскольку имеющиеся у нас сведения о точном механизме расщепления АТФ недостаточны для того, чтобы мы были в состоянии судить о возможных причинах различий между группами (см., однако, [22, 51]). Стоит все же отметить одну особенность фибриллярных препаратов, свойственную также чистому актомиозину и миозину [116]: у всех трех АТФ-азных систем при активации ионами Ca в больших концентрациях в отсутствие ионов Mg значения энтальпии активации меньше тех, которые приведены в табл. 2. Среднее значение независимо от температуры составляет 10 ккал!моль. Более того, энтропия активации становится равной —11 единицам. Существенное различие между этим типом ионной системы и фибриллярной системой в ее физиологическом состоянии, где присутствуют ионы Mg и следы ионов Ca, состоит в том, что ни актомиозин, ни фибриллы не сокращаются в присутствии одних только ионов Ca. Отсюда следует, что именно превращение свободной энергии в движение и работу изменяет значения энтальпии и энтропии активации благодаря участию актина в одном случае и его пассивной роли в другом. В самом деле, если предположить, как мы это делали раньше, что ионы Ca активируют систему в присутствии Mg∙ATΦ2^, уничтожая ингибирующий эффект путем взаимодействия с заряженными группами «тропомиозина», выступающими из глубины актиновых спиралей, то появляется еще один путь к рассмотрению системы с точки зрения энтальпии и энтропии активации. Это позволяет легко объяснить различие этих величин в простой системе миозин — Ca · АТФ2“ и в гораздо более сложной системе актин — «тропомиозин» — миозин, с которой мы имеем дело в интактных фибриллах и живой мышце.
ГЛАВА III
МОДЕЛЬНЫЕ СИСТЕМЫ ВОЛОКОН
В предыдущей главе мы видели, как изолированный актомиозин и фибриллы, приготовленные путем гомогенизации мышцы, расщепляют АТФ при физиологических значениях ионной силы; в одних условиях это расщепление сопровождается расслоением геля или сокращением фибрилл, а в других возникает лишь незначительное сокращение или оно вообще не происходит и энергия расщепления переходит в тепло. Мы видели также, что если расщепление ингибируется, особенно в присутствии ионов Mg, то АТФ действует как пластификатор системы, что проявляется в набухании гелей или фибрилл. В такой системе, однако, сокращающее и расслабляющее действие АТФ можно продемонстрировать только качественно, так как для измерения работы, совершаемой такими короткими фибриллами или гелями, или напряжения, развиваемого ими в цикле сокращение — расслабление, к ним нужно приложить нагрузку, а сделать это не так-то просто.
Более близкое приближение к реальным условиям обеспечивают так называемые «модельные» системы волокон или актомиозиновых нитей. Здесь мы обсудим модель волокон, приготовленную путем обработки пучков свежих фибрилл водным раствором глицерина в течение нескольких дней при 0° [45]. Эта система имеет большие преимущества перед нитями актомиозина, так как в ней нити актина и миозина сохраняют свое естественное расположение, тогда как в искусственных нитях их порядок нарушен и они не развивают больших напряжений при добавлении АТФ [160]. В глицеринизи- рованных нитях интактной остается только структура нитей актина и миозина, а другие компоненты клетки, важные для метаболизма живой мышцы, разрушаются
80
Глава HJ
или удаляются. Например, большинство растворимых гликолитических ферментов вымывается в результате частичного разрушения полупроницаемой мембраны (плазмалеммы) волокон при обработке глицерином. Митохондрии, лежащие между фибриллами, и сакроплазма- тический ретикулум, окружающий каждую фибриллу, также очень сильно повреждаются и утрачивают свои свойства. Глицеринизированные волокна можно рассматривать, следовательно, только как организованную сократительную систему из актиновых и миозиновых нитей, проницаемую для двухвалентных катионов и АТФ и многих других крупных анионов.
Вопрос о диффузии
Хотя глицеринизированное волокно и становится проницаемым для крупных ионов, поступление внутрь волокна таких метаболитов, как АТФ, затруднено по следующим причинам: 1) АТФ может диффундировать в волокно только со скоростью, не превосходящей скорость его диффузии в воде; 2) по мере перемещения к центру волокна АТФ расщепляется на АТФ-азных активных центрах актиновых и миозиновых нитей следующих друг за другом фибрилл. Следовательно, если только скорость диффузии не превосходит максимальной скорости расщепления на этих центрах (или хотя бы не равна ей), концентрация АТФ на некоторой глубине внутри волокна упадет до нуля. Для идеальной системы эту глубину можно определить по уравнению диффузии Мейергофа — Шультца для цилиндрических волокон
r = (4cD/A)½, (III.1)
где г — предельная толщина внешнего кольца «активных» фибрилл, с — концентрация АТФ снаружи, D — коэффициент диффузии и А — максимальная скорость расщепления АТФ наиболее удаленными от центра фибриллами [Ш]. Таким образом, предельная толщина зависит от корня квадратного из концентрации АТФ, или, иначе, для одного волокна или пучка волокон заданной толщины предельная концентрация АТФ зависит от квадрата радиуса. Средний радиус отдельных глицери¬
Модельные системы волокон
81
низированных волокон равен примерно 60 мк, что в 40 раз больше радиуса фибрилл, рассмотренных в предыдущей главе.
К сожалению, в ранних экспериментах условия диффузии были далеки от идеальных, а именно из этих экспериментов мы и вынуждены черпать основную информацию о развитии напряжения и о совершении работы отдельными волокнами или пучками волокон. До недавнего времени не представляли себе, что ион Ca играет основную роль в АТФ-азной активности и сокращении так называемых «активированных магнием» систем фибрилл и волокон. Поэтому в большинстве опытов к волокнам добавляли только ионы Mg и АТФ, хотя на самом деле эти реагенты, как мы видели, не должны оказывать сокращающего действия, если они чистые. Однако, как это стало теперь ясно, применявшиеся реагенты всегда были более или менее сильно загрязнены кальцием, случайного присутствия которого было обычно вполне достаточно для стимуляции расщепления АТФ и сокращения [154]. Бесполезно искать еще какие-нибудь аргументы, поскольку мы можем только догадываться, при каких именно условиях проводились опыты. Поэтому мы будем рассматривать все ранние результаты как полуколичественные и относиться с осторожностью к основанным на них вычислениям предельной толщины и коэффициента диффузии. Точное значение коэффициента диффузии нам еще не известно, хотя имеются данные о том, что оно лежит в диапазоне 2∙ IO-8 — — 8∙ IO"8 cM2∣ceκ [60] (Боуэн [17] приводит гораздо большую величину).
Развитие напряжения
Развитие напряжения в отдельном глицеринизиро- ванном волокне можно измерить, прикрепив его к очень упругой проволоке [155]. В этих условиях длина волокна при его попытке к сокращению меняется очень мало, так что сокращение оказывается почти строго изометрическим. Для измерения небольших смещений проволоки световой пучок направляют на прикрепленное к ней маленькое зеркало и отраженный луч света фокусируют на
82
Глава III
длинную шкалу или на фотографическую бумагу на вращающемся барабане.
На фиг. 21 изображена зависимость напряжения, развиваемого отдельными волокнами поясничной мышцы кролика при добавлении АТФ, от общей концентрации АТФ. Ионная сила в этих опытах была равна
Фиг. 21. Влияние АТФ на напряжение, развиваемое отдельными глицеринизированными волокнами мышцы кролика [155, 159].
Для сравнения приведены значения измеренной автором АТФ-азной активности препарата из больших фрагментов волокна, содержащего очень мало фибрилл. [Mg2+] = 2∙10–3 М; ионная сила 0,10; температура 20°. Концентрация примесных ионов Ca2+, вероятно, пропорциональна [АТФ]. Значения напряжения и АТФ-азной активности отложены в % от максимума.
0,1-0,15; а концентрация ионов Mg 1-2∙10–3М. Следовательно, при общей концентрации АТФ более l∙10–3M концентрация свободного ATΦ4– будет увеличиваться. Этот свободный АТФ образует хелатные соединения со случайными примесными ионами Ca, а поскольку эти ионы необходимы для сокращения (см. фиг. 17, Д), можно ожидать, что с увеличением концентрации АТФ возникнут два противоположных эффекта: 1) по мере увеличения концентрации АТФ во внешней среде он стано¬
Модельные системы волокон
83
вится доступным для большего числа внутренних фибрилл и поэтому общая скорость его расщепления в волокне возрастает, в результате чего развивается все большее напряжение; 2) по мере того как концентрация АТФ все больше превышает концентрацию ионов Mg, увеличивается число ионов Ca, связанных с АТФ в хелатные комплексы, и это вслед за первым, «активирующим» эффектом увеличения концентрации АТФ приводит к ингибирующему эффекту. В конце концов ингибирование, усиливающееся также с увеличением ионной силы, обусловленным самим АТФ, становится преобладающим и скорость расщепления снова падает, а с ней и развивающееся напряжение. Как мы видим из графика, именно это и наблюдается на опыте, когда общая концентрация АТФ начинает превышать 20∙ 10^3 Μ.
Если учесть эти два противоположных эффекта, то станет ясно, что в ранних экспериментах либо вообще не получали максимальных значений напряжения, либо получали их очень редко. Обычно, по-видимому, максимальное значение напряжения лежало в интервале от 1 до 1,5 кг на 1 см2 поперечного сечения волокна, хотя приводятся и гораздо большие значения — около 4 кг!см2 (в этих опытах, вероятно, было больше случайных примесных ионов Ca [155]). Большее из приведенных значений напряжения близко к тому, которое получается для полностью стимулированной живой мышцы кролика. Следовательно, в предельном случае при идеальных условиях глицеринизированное волокно развивает, по-видимому, почти максимальное изометрическое напряжение при добавлении АТФ, если присутствуют также ионы Mg и следы ионов Ca. Многие из этих ранних экспериментов следовало бы повторить в свете новых количественных данных о действии ионов Ca.
Расщепление АТФ и развитие напряжения
В предыдущей главе было показано, что степень сокращения фибрилл тесно связана с активированной магнием и кальцием АТФ-азной активностью (фиг. 17). Но само по себе это еще не доказывает, что источником энергии сокращения является расщепление АТФ, так
84
Глава III
как не было проведено таких измерений, где эта энергия сравнивалась бы с производимой мышцей работой или с развиваемым напряжением. Более надежные основания для такого вывода дает модельная система волокон, для которой АТФ-азную активность фрагментов волокна можно измерить в условиях, аналогичных тем, которыми пользуются при изучении напряжения.
Из фиг. 21 (ср. также [155, 159]) можно видеть, что АТФ-азная активность фрагментов волокна достигает своего максимума при значительно меньших концентрациях АТФ, чем напряжение. Спад активности, обусловленный влиянием АТФ при концентрации выше оптимальной, также наступает раньше, чем спад напряжения. Это различие между фрагментами волокон и интактными фибриллами вызвано тем, что они имеют разную толщину, т. е. барьер для диффузии АТФ у них неодинаков (см. уравнение III. 1). Более короткие и несколько более тонкие фрагменты волокна по сравнению с интактными волокнами полностью насыщаются субстратом при более низких концентрациях АТФ. Поэтому и максимум кривой расщепления и спад ее лежат при меньших концентрациях АТФ, чем максимум и спад кривой напряжения. C учетом всего сказанного можно сделать вывод, что расщепление АТФ коррелирует с развитием напряжения примерно в такой же степени, как этого можно было бы ожидать. Следовательно, на основе этих экспериментов мы можем вполне уверенно заключить, что при тех специфических ионных условиях, о которых мы писали, источником энергии сократительной активности служит непосредственно процесс расщепления. Остается в силе также другой важный факт: агенты, снижающие АТФ-азную активность модельных волокон, уменьшают также и их способность развивать напряжение или мощность.
Изотоническое сокращение волокон и развитие мощности
Помимо изучения напряжения, которое способны развивать модельные волокна при постоянной длине (изометрические условия), важно знать также, какую мощность они будут развивать, укорачиваясь при постоян¬
Модельные системы волокон
85
ной нагрузке (изотонические условия). Для этой цели проще воспользоваться не отдельным волокном, а небольшим пучком волокон.
В первую очередь нужно определить мощность (работа в единицу времени), развиваемую при разных
Фиг. 22. Влияние АТФ на временную зависимость укорочения глицеринизированных пучков волокон из поясничной мышцы кролика. Результаты приведены в виде зависимости работы, производимой пучками под нагрузкой, от времени. [Mg2+] = 2∙10–3 М; ионная сила 0,12; имидазольный буфер, pH 7,2; температура 20°. Площадь поперечного сечения пучков, состоящих примерно из 20 волокон, равна 300×300 мк, длина 1,5 см; нагрузка на 1 см2 равна 1000 г; общее укорочение за 240 сек составляет 0,29 l0 и 0,48 l0 при 2∙10–3 и 11∙10–3 M АТФ соответственно (наблюдения автора).
концентрациях АТФ и постоянной нагрузке. Типичные экспериментальные кривые для двух концентраций АТФ приведены на фиг. 22, где по оси абсцисс отложено время, а по оси ординат — производимая работа. При обеих концентрациях волокна начинают сокращаться и производить работу вскоре (примерно через 0,6 сек) после
86
Глава III
того, как в систему добавляется АТФ. В первые две секунды после начала сокращения мощность возрастает очень быстро (на графике это не видно из-за выбранного масштаба), а затем по мере дальнейшего укорочения пучка волокон возрастание мощности снова замедляется. Повышение концентрации АТФ от 2∙10-3 до 11·10-3 M увеличивает первоначальную мощность почти в 4 раза.
Для того чтобы вычислить максимальную мощность, развиваемую в процессе совершения работы, для нашей цели достаточно определить наклоны кривых работа — время в точке, соответствующей 10 сек после добавления АТФ. Мощность определяется по формуле
Мощность (на 1 г волокон) = = ΔW∕Δt = –PΔl∕(M∙10 сек), (III. 2)
где W — производимая работа в г·см на 1 г волокон; P — нагрузка на пучок в граммах; –Δl — изменение длины в сантиметрах; M — исправленный вес волокон в граммах. Таким образом, размерность мощности — г·см на 1 г пучка в 1 сек.
Результаты ряда экспериментов при постоянной нагрузке и двух различных толщинах пучка приведены на фиг. 23. Следует отметить, что Боуэн [17] получил совершенно иные результаты, приводящие к диаметрально противоположным выводам. Читатель должен сделать свой выбор.
Кривые мощность — [АТФ] имеют несколько странных особенностей. В частности, очень интересно, что, хотя концентрация Mg2+ составляет всего 2∙10–3M, мощность продолжает увеличиваться даже тогда, когда [АТФ]общ приближается к очень высокому значению 24∙10–3Μ. В этой точке [ATΦ]своб должна равняться примерно 22∙10–3М. Можно думать, что такая концентрация вполне достаточна для того, чтобы связать в хелатные комплексы все примесные (но существенные) ионы Ca и тем самым ингибировать сокращение [154]. Однако совершенно ясно, что это не происходит и, следовательно, примесный Ca2+ вносится вместе с АТФ и его концентрация увеличивается пропорционально росту
Модельные системы волокон
87
[АТФ]. Это могло бы удовлетворительно объяснить отсутствие плато и следующего вслед за ним спада на кривой мощности, появления которых можно ожидать при самых больших концентрациях АТФ.
Фиг. 23. Мощность, развиваемая пучками волокон при разных концентрациях АТФ (условия те же, что и приведенные на фиг. 22). I — поперечное сечение пучков 200×200 мк2, нагрузка на 1 см2 равна 1200 г; II — поперечное сечение пучков 300×300 мк2, нагрузка на 1 см2 равна 700 г. Вертикальные штрихи — среднеквадратичная ошибка измерений; цифры в скобках — число опытов (наблюдения автора).
Другой интересной чертой является сравнительно быстрое увеличение мощности при возрастании [АТФ] от 0 до 5∙10–3Μ. Это, по-видимому, объясняется тем, что, во-первых, число активно сокращающихся волокон в пучке в этом интервале концентраций резко возрастает (согласно уравнению (III. 1)), а во-вторых, потому, что общая нагрузка на пучок поддерживается постоянной. Следовательно, при низкой концентрации АТФ, когда
88
Глава l∏
доля активных волокон также должна быть невелика, на эти волокна должна приходиться избыточная нагрузка. По мере увеличения [АТФ], а вместе с ней и доли активно сокращающихся волокон нагрузка постепенно приближается к оптимальной. Трудность в установлении оптимальной нагрузки является, конечно, одной из отрицательных сторон работы с системой, в которой число активно сокращающихся волокон на 1 см2 поперечного сечения не остается постоянным, а увеличивается с ростом концентрации субстрата из-за диффузии. На практике, однако, имеется очень широкий интервал нагрузок, при которых система может развить оптимальную мощность, так что самые большие трудности возникают только при очень низких концентрациях АТФ. В этом отношении утешителен во всяком случае тот факт, что экспериментальные кривые мощность— [АТФ] имеют одинаковую форму при двух различных толщинах пучка, что и предсказывает уравнение (III.1).
Попытка связать развиваемую мощность со скоростью расщепления АТФ также приводит к затруднению, так как из-за диффузии, особенно на первых этапах, невозможно оценить скорость расщепления АТФ, работая с пучками волокон: в процессе опыта не только АТФ диффундирует вовнутрь, но и те продукты, концентрация которых подлежит измерению (АДФ и Фн), диффундируют наружу, а это неизбежно приводит к большим ошибкам. К решению этого вопроса, однако, можно приблизиться иным путем, рассматривая теоретическую величину мощности, которую могут развивать фибриллы при 100%-ной эффективности, когда АТФ расщепляется ими с максимальной скоростью. При этом осложнения, обусловленные диффузией, отсутствуют. Максимальная скорость расщепления АТФ фибриллами при 20° составляет приблизительно 0,8∙10~6 молъ!сек на 1 г мышцы [10]. Приняв значение свободной энергии гидролиза АТФ равным примерно 10 ккал!молъ (≡≡≡ 427∙ IO6 г/см/моль при 100%-ной эффективности), получим, что максимально возможная величина развиваемой мощности равна 342 г -см/сек на 1 г мышцы. Максимальное значение мощности, полученное для бо¬
Модельные системы волокон
89
лее тонкого из двух пучков и приведенное на фиг. 23, равно 112 г· см/г!сек, что соответствует кажущейся механической эффективности 33% при концентрации АТФ, равной 24∙ 10“3 Μ. При этом, конечно, не учитывается то, что активной может быть лишь часть волокон в пучке; очевидно, что истинная эффективность активных волокон должна быть много выше. Даже в живых мышцах наибольшее значение механической эффективности, наблюдаемое в состоянии кратковременного тетануса, редко превышает 40%, так что искусственная модельная система в расчете на 1 г активных волокон эффективна в той же мере, что и живая система (а возможно, и в большей) [24,71].
Принимая во внимание сделанные нами выводы, можно сказать, что сейчас назрела необходимость повторить многие старые наблюдения на простой системе модельных волокон, полностью учитывая действие ионов Ca.
Процесс расслабления и ингибирование АТФ-азной активности
В опытах с изолированными фибриллами мы показали, что если все ионы Ca связаны в хелатные комплексы и, следовательно, расщепление АТФ ингибировано, то фибриллы не сокращаются более в присутствии АТФ, а имеют тенденцию к набуханию. Этот процесс мы уподобили расслаблению интактной мышцы. Процесс расслабления очень легко продемонстрировать на отдельных глицеринизированных волокнах или на пучках волокон, связывая Ca2+ в хелатные комплексы с помощью ЭДТК или ЭГТК [12, 152]. В опыте, результаты которого приведены на фиг. 24, к пучку волокон после вымывания глицерина в буферном растворе KCl сначала прикладывали нагрузку примерно 1000 г/см2. В этом случае волокна находятся в состоянии окоченения и имеют очень высокий модуль упругости, так что под нагрузкой они растягиваются всего примерно на 2% своей длины. При замене буферного раствора KCl на раствор 5 мМ Mg · АТФ2“ + 0,1 мМ CaCl2 наступает
90
Глава III
внезапное и быстрое сокращение, при котором мышца укорачивается примерно вдвое. При максимальном значении сокращения АТФ вымывают раствором KCl, и укорачивание волокон немедленно прекращается. Тест на упругость системы в таком состоянии (прикладывание дополнительной нагрузки примерно в 500 а/сти2) показы-
Фиг. 24. Искусственный цикл сокращения — расслабления в глицеринизированном пучке волокон (наблюдения автора).
Объяснения см. в тексте.
вает, что волокна снова переходят в состояние окоченения и более не растягиваются. Этот процесс мы объяснили тем, что при удалении АТФ между нитями актина и миозина в тех местах, где они перекрываются (фиг. 10), образуются электростатические связи. Очевидно, что это в равной мере может происходить как в укороченных волокнах, где имеется значительное перекрывание актина с миозином, так и при длине покоя, когда перекрывание гораздо меньше.
Модельные системы волокон
91
После снятия дополнительной нагрузки к укороченному пучку волокон, находящихся в состоянии окоченения, мы добавили раствор 5мМ Mg · АТФ2- + 2 мМ ЭГТК. Как мы видим, при этом быстро наступает расслабление и мышца сравнительно медленно восстанавливает первоначальную длину, которую она имела до первого добавления АТФ. Если теперь снова добавить достаточное количество Ca2+ (в виде CaCl2, конечная концентрация 2,1 лШ) для подавления хелатирующего действия ЭГТК, то волокно немедленно сократится вновь. Весь этот цикл (сокращение, окоченение, расслабление и новое сокращение) можно повторить на одном и том же пучке волокон несколько раз.
Вспомнив опыты с фибриллами, мы видим теперь, как расщепление АТФ связано с циклом сокращение — расслабление: в присутствии ионов Ca и Mg АТФ быстро расщепляется актомиозиновыми нитями и свободная энергия этого процесса используется для сокращения и развития мощности посредством скольжения нитей актина и миозина относительно друг друга. Вымывание АТФ приводит к состоянию окоченения, но при новом добавлении Mg · АТФ2“ в присутствии агента, хелатно связывающего кальций, АТФ-азная активность падает почти до нуля, так что Mg-АТФ2“ может теперь играть роль расслабляющего агента или пластификатора; иными словами, он препятствует образованию электростатических связей между нитями актина и миозина, которые могут, следовательно, свободно скользить относительно друг друга при наложении нагрузки.
Аналогичный искусственный цикл сокращение — расслабление можно продемонстрировать, конечно, и на отдельных волокнах, которые не производят работу, а развивают изометрическое напряжение [160]. На одном волокне можно продемонстрировать также и действие других ингибиторов АТФ-азы; из них наибольший для нас интерес представляют ингибиторы, блокирующие SH-группы, так как этот тип ингибирования совершенно отличен от того, который действует при удалении ионов Ca. В этом случае мы не просто удаляем активатор, а модифицируем ферментативные активные центры актиновых и миозиновых нитей. Для этой цели часто
92
Глава III
использовали сложный SH-реагент, называемый салир- ганом [159]. Если его добавить в концентрации 1 мМ к волокну, развивающему напряжение в присутствии АТФ, Mg2+ и Ca2+, то АТФ-азная активность и напряжение немедленно падают до нуля и волокно расслабляется. Это действие салиргана можно прекратить, добавив к системе 10 мМ раствор цистеина, который снова восстанавливает SH-группы ферментативного центра, в результате чего АТФ начинает опять расщепляться и вновь развивается напряжение. Поскольку салирган не оказывает расслабляющего действия в отсутствие АТФ, то эти эксперименты еще раз показывают, что Mg · АТФ2“ всегда действует в качестве расслабляющего агента независимо от того, ингибирована ли АТФ-азная активность актомиозиновой системы таким резким методом или более мягким способом, близким к физиологическому,— удалением из системы ионов Ca.
ИТФ как сокращающий и расслабляющий агент
Мы видели, что при физиологических значениях ионной силы актомиозин и фибриллы быстрее расщепляют нуклеотиды с NH2-rpyππoft в положении 6 пуринового кольца (например, АТФ), чем нуклеотиды, у которых в этом положении находится ОН-группа (например, ИТФ). Поэтому имеет смысл изучить влияние ИТФ на глицеринизированные волокна [12, 152]. Результаты типичного опыта, в котором для связывания ионов Ca вновь была применена ЭГТК, приведены на фиг. 25 (ср. фиг. 24). Из графика на вставке мы прежде всего видим, что пучку волокон требуется некоторое время для того, чтобы прореагировать с Mg · ИТФ2- и начать сокращаться. Запаздывание составляет в этом случае 8 сек, что почти в 10 раз больше, чем запаздывание при добавлении Mg · АТФ2-. Видно также, что и начальная мощность для ИТФ гораздо меньше, чем для АТФ (в среднем примерно в 5 раз).
Другое существенное различие между системами, содержащими ИТФ и АТФ, состоит в том, что связывание ионов Ca в хелатные комплексы с ЭГТК не оказывает на систему с ИТФ расслабляющего действия. Как вид¬
Модельные системы волокон
93
но из основного графика, пучок волокон продолжает медленно сокращаться в присутствии ЭГТК + Mg-ИТФ2“. Более того, добавление избытка ионов Ca, достаточного для подавления действия хелатирующего агента, оказывает на систему лишь незначительное ускоряющее действие (ср. [152]). Чтобы удостовериться, что эти эффекты не являются артефактами, к пучку волокон добавили, наконец, ЭГТК + Mg∙ATΦ2–, и это, как мы видим,
Фиг. 25. То же, что и на фиг. 24, но при введении ИТФ вместо АТФ (в той же концентрации).
На вставке приведены начальные участки кривых работа — время для 5∙10-3M АТФ и ИТФ (наблюдения автора).
привело к нормальному расслаблению. Отсюда следует, что при физиологических условиях ИТФ, вероятно, не является эффективным сокращающим агентом и совершенно не оказывает расслабляющего действия. Несомненно, однако, что, хотя мощность в присутствии ИТФ невелика, волокно может произвести почти то же самое общее количество работы и развить то же общее напряжение, что и в присутствии АТФ, но этот процесс будет происходить значительно медленнее.
94
Глава III
Как мы говорили, начальная мощность, развиваемая пучками волокон в присутствии ИТФ, примерно в 5 раз меньше мощности, развиваемой в присутствии АТФ, тогда как скорость расщепления ИТФ фибриллами равна по меньшей мере половине скорости расщепления АТФ [12]. Следовательно, механическая эффективность в присутствии ИТФ составляет 2∕s эффективности системы с АТФ. На этот факт, по-видимому, раньше не обращали внимания. Примечательно также, что связывание ионов Ca в хелатные комплексы хотя и уменьшает скорость расщепления ИТФ фибриллами, но лишь примерно вдвое, тогда как скорость расщепления АТФ уменьшается в 20 раз. Именно этим и объясняется неспособность ИТФ вызывать расслабление.
Длительная задержка начала сокращения системы в присутствии ИТФ до сих пор еще не объяснена. Возможно, она объясняется тем, что константа Михаэлиса для ИТФ гораздо больше, чем для АТФ [61]. Поэтому если лимитирующим фактором является диффузия, то для того, чтобы внутри пучка волокон установилась концентрация ИТФ, достаточная для насыщения ферментативных активных центров, требуется больше времени.
Другой загадочной особенностью расщепления ИТФ фибриллами является чрезвычайно низкая скорость этого расщепления, когда в качестве активирующего иона используется только Ca2+. При 35°, например, она составляет всего около 1∕i5 скорости расщепления Ca · АТФ2’.
Сокращаются ли волокна, если в системе присутствуют только АТФ и ионы Ca?
При рассмотрении фибриллярной системы мы видели, что Ca · АТФ2- в отсутствие других ионов не способен вызывать значительное сокращение, хотя он сильно расщепляется в ферментативных активных центрах (фиг. 17). В точности то же самое наблюдается и для нагруженных пучков волокон (фиг. 26). Здесь добавка одного только Ca-АТФ2- не вызывает никакого изменения длины, и волокна находятся, по-видимому, в состоя¬
Модельные системы волокон
95
нии окоченения, поскольку они не растягиваются даже при нагрузке 1500 г/см2. Добавление ионов Mg в концентрации 0,4 мМ вызывает, однако, немедленное укорочение волокон, которое сразу же прекращается, как
Фиг. 26. Кривая, показывающая, что добавление к пучкам глицеринизированных волокон только ионов Ca не вызывает сократительного эффекта, тогда как при добавлении ионов Mg они немедленно сокращаются.
[Ca∙ATP2-] = 4∙10-3 М; ионы Mg добавляются в виде MgCl2 до концентрации 4∙10-4 Μ. Остальные условия те же, что и приведенные на фиг. 22 (наблюдения автора).
только ионы Mg вымываются и вновь заменяются на Ca∙ATΦ2^. Этот ион не может стимулировать сокращение, даже если нагрузку на пучок волокон уменьшить в 5 раз. Отсюда следует, что, хотя в присутствии ионов кальция АТФ быстро расщепляется, он не может действовать как активатор сокращения при физиологических условиях. Для того чтобы сокращение возникло, необходимы также ионы Mg.
96
Глава III
Влияние старения на сокращение волокон
При изучении влияния старения на сократимостьгли- церинизированных волокон наблюдается два интересных эффекта: один относится к очень старым волокнам, другой— к очень свежим. Волокна, которые года два «старели» при —10° в 50%-ном водном растворе глицерина в присутствии воздуха, энергично сокращаются при добавлении Mg∙ATΦ2^. Но, как и старые фибриллы, они утрачивают чувствительность к ЭГТК и совсем не расслабляются при добавлении этого реагента в присутствии АТФ. Зачастую они даже продолжают медленно сокращаться. По аналогии с несвежей фибриллярной системой, где АТФ-азная активность лишь частично уменьшается при хелатном связывании ионов Ca (фиг. 18 и 19), кажется вероятным, что и здесь при длительном хранении происходит окисление некоторых специфических SH-групп комплекса актомиозин — тропомиозин— тропонин. Ясно, что эти группы участвуют не в сократительном процессе, а только в расслаблении, т. е. они обусловливают чувствительность системы к Ca [20, 115].
Почти полностью обратный эффект наблюдается для волокон, хранившихся в водном растворе глицерина день-два. Они не сокращаются при добавлении Mg-АТФ2", даже если содержание случайных примесных ионов Ca доходит до IO-5 Λ4, но добавление ионов в концентрации примерно 2∙10^4 M приводит к их быстрому и сильному сокращению. Эксперимент можно повторить, вымывая добавленные ионы Ca и начиная все сначала, но при каждом повторении волокна расслабляются все хуже. Этот эффект был замечен очень давно и некоторые его стороны в свое время были полностью поняты, но позднее об этом забыли [13, 19, 109]. Он ясно показывает, что в свежих волокнах содержится некий расслабляющий фактор, который при старении утрачивается и который подавляется при добавлении ионов Ca. Быть может, им является агент, хелатно связывающий Ca, или кальциевый насос? В следующей главе мы увидим, что это вполне возможно.
ГЛАВА IV
САРКОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ И РАССЛАБЛЕНИЕ IN VIVO
Введение
В последних двух главах была продемонстрирована необычайная чувствительность актиновых и миозиновых нитей естественных фибрилл к ионам Ca при физиологических условиях, т. е. при высокой концентрации АТФ и Mg2+; предполагается, что для такой чувствительности необходимо присутствие тропомиозина и тропонина внутри двойных спиралей актина. Мы пришли к заключению, что, исходя из этой способности ионов кальция при очень низкой их концентрации переводить систему из состояния покоя в состояние полной сократительной активности, т. е. от очень низкой АТФ-азной активности при покое к очень высокой, можно было бы объяснить связь возбуждения с сокращением в живой системе. Все, что было бы необходимо для этого, — это кальциевый насос, который в состоянии покоя поддерживал бы низкую концентрацию свободного Ca, и система для ингибирования этого насоса, позволяющая ионам Ca диффундировать к активным центрам фермента, когда к мышечной мембране через нерв и концевую двигательную пластинку приходит волна электрического возбуждения, или потенциал действия.
История открытия кальциевого насоса в живой мышце как части сложной системы поперечных и продольных трубочек и пузырьков, которая окружает каждую фибриллу и известна под названием саркоплазматического ретикулума, весьма своеобразна и полна самых неожиданных поворотов. В действительности, обсудив сначала влияние ионов Ca, а затем перейдя к кальциевому насосу, мы обратили историю вспять, так как механизм расслабляющего действия первого из найденных естественных факторов — так называемого фактора Марша [109] — считался совершенно иным [118], хотя
98
Глава IV
фактор Марша и состоял из фрагментов этого самого ретикулума. Такое неправильное представление было тогда, по-видимому, неизбежным, потому что этот фактор выделяли путем экстракции из мышечных гомоге- низатов при низкой ионной силе, и, следовательно, он содержал не только фрагменты ретикулума, но также и все ферменты анаэробного гликолиза; с некоторыми из них его и спутали. Такая интерпретация существовала до тех пор, пока с помощью высокоскоростных центрифуг не было показано, что суспензии фактора, ранее считавшиеся чистыми, содержат не только разрушенные митохондрии, но и фрагменты ретикулярных пузырьков [21, 128] (фото XV). Именно последние и обладают расслабляющей способностью.
Однако даже после того, как было показано, что расслабляющий фактор по своей природе является самостоятельным компонентом системы, еще несколько лет была неизвестна его способность перекачивать Ca, хотя уже было установлено, что низкие концентрации ионов Ca обращают его действие [39, 40, 62, 109, 156]. Для открытия кальциевого насоса требовалось достаточное развитие техники эксперимента, особенно разработка точных методов оценки содержания Ca и возможность использования радиоактивного кальция (Ca45). Более того, в течение более 50 лет гистологи, а равно и физиологи, изучающие мышцу, не обращали никакого внимания на сам саркоплазматический ретикулум, хотя он был открыт еще в начале века с помощью светового микроскопа [151] и описан очень подробно. Саркоплазматический ретикулум был заново открыт с помощью электронной микроскопии в самый разгар исследований по сокращению и АТФ-азной активности, которые мы обсуждали [126]. Это событие оказалось решающим, и поэтому мы сначала опишем структуру саркоплазматического ретикулума и лишь затем будем обсуждать его действие в качестве кальциевого насоса.
Саркоплазматический ретикулум
Структура саркоплазматического ретикулума в продольном сечении схематически изображена на фиг. 27 [131, 132]. Слева показана плазмалемма, или полупрони¬
Саркоплазматический ретикулум и расслабление 99
цаемая мембрана, мышечного волокна. Она состоит из трех слоев и имеет толщину порядка 100 А [120]. Подобно плазмалемме всех других клеток эта мембрана поддерживает тонкое осмотическое равновесие в мышечном волокне и выполняет также очень важную функцию пе-
Фиг. 27. Схематическое изображение структуры саркоплазматического ретикулума двух фибрилл из мышцы кролика.
В обеих фибриллах полностью изображен лишь один саркомер; слева — саркомер с интактным ретикулумом, справа — ретикулум частично удален, для того чтобы показать лежащие под ним миофибриллы. Можно видеть, что поперечные элементы ретикулума берут начало у плазмалеммы (II). Темные утолщения на концах продольных пузырьков — это концевые цистерны триад, расположенные в этом случае на границе A- и I-дисков; C — саркоплазма, M — митохондрии, О — основное вещество.
реноса вдоль волокна потенциала действия, поступающего через концевую двигательную пластинку [76, 95]. Но можно спросить, каким образом этот потенциал действия доходит до самых внутренних фибрилл внутри волокна, которые часто удалены от мембраны по меньшей мере на 25 мк (250 000 А). Ответ мы найдем, рассмотрев так называемую поперечную систему сарко¬
IOO
Глава IV
плазматического ретикулума. Как мы видим, она представляет собой впячивания самой плазмалеммы [49, 84], идущие внутрь в виде трубочек, обволакивающих каждую фибриллу на уровне места соединения А- и !-дисков у мышц млекопитающих и некоторых рыб и на уровне Z-пластинок у многих видов холоднокровных животных [126, 131] (см. также фото XI—XIV).
Хотя в большинстве работ, посвященных ретикулуму, эта поперечная сетка трубочек подробно не описывается, ясно, что она должна идти в поперечном направлении от фибриллы к фибрилле на одном и том же уровне в каждом саркомере. Насколько сложна эта сеть, можно частично представить себе с помощью фиг. 27. На этой схеме показаны только две самые наружные фибриллы волокна: одна из них с неповрежденным ретикулумом, а у другой он удален, чтобы показать, как эти разветвления располагаются по отношению к лежащим ниже нитям актина и миозина. В действительности большинство мышечных волокон содержит по меньшей мере 1000 фибрилл, и каждая из них должна быть связана с другими таким образом. Кроме того, в некоторых мышцах (например, в летательных мышцах птиц и насекомых) митохондрии, в которых протекают процессы окислительного метаболизма, упакованы в ряды между фибриллами, так что поперечные трубочки ретикулума должны пересекать их на своем пути внутрь волокна. Если еще добавить к этому, что на отрезке фибриллы длиной 1 см имеется около 4000 саркомеров, образующих поперечные связи со своими соседями, то можно видеть, что поперечные трубочки ретикулума достаточно многочисленны и их структура достаточно сложна, чтобы объяснить, почему поперечные полосы во всех фибриллах волокна прекрасно совпадают даже при очень сильном сокращении.
В заключение отметим, что поперечные связи с плаз- малеммой были впервые обнаружены посредством вымачивания интактных мышц или мышечных волокон в суспензиях очень мелких частиц ферритина. Эти частицы могут проникать в поперечные трубочки через поры в плазмалемме (фото XI—XlII) [49, 84]. Заметим, что в продольные пузырьки ферритин не проникает, откуда
Саркоплазматический ретикулум и расслабление
IOl
следует, что они непосредственно не соединены с поперечной системой.
Поперечная система состоит, вероятно, из очень тонких трубочек диаметром около 400 А; вообразить себе структуру продольных пузырьков гораздо труднее, хотя фото XI и XIV дают некоторое представление об их сложности. Фактически продольные пузырьки полностью окружают фибриллу, простираясь у млекопитающих и некоторых рыб от триад, где соединяются А- и 1-диски, в обоих направлениях вдоль фибриллы, а у многих холоднокровных животных (например, у лягушки) от одной Z-пластинки до другой (ср. фото XI—XIII с фото XIV) [49, 84, 131]. В первом случае эти пузырьки, оканчивающиеся в месте соединения А- и 1-дисков, образуют в этой области утолщения, которые контактируют с поперечными трубочками. Вся эта система известна под названием триады, потому что она состоит из двух таких утолщений, или концевых цистерн, расположенных по обе стороны от поперечной трубочки (см. фиг. 27, а также фото XIV). Именно через крошечный зазор между поперечными трубочками и концевыми цистернами триад должен проходить потенциал действия. Сейчас уместно задать вопрос, какие химические функции выполняет каждая часть этой системы.
Ионные насосы
Не стремясь пока к точному описанию потенциала действия, мы скажем лишь, что нервный импульс проходит по двигательному нерву к концевой двигательной пластинке мышечного волокна в виде волны деполяризации, или потенциала действия; под его влиянием из концевой пластинки освобождается ацетилхолин, что в свою очередь дает начало другому потенциалу действия, распространяющемуся вдоль мышечной мембраны [76, 95]. Во время этого процесса возникает локальное изменение полупроницаемости мембраны, в результате которого очень небольшое число ионов Na просачивается к мышечному или нервному волокну, а равное количество ионов К перемещается в обратном направлении. Очевидно, что, хотя обмен ионами, соответствующий одному стимулу, незначителен, должна существовать ка¬
102
Глава IV
кая-то система, способная восстанавливать status quo после серии стимулов и перекачивать ионы Na и К туда, где они первоначально находились. В последние годы натрий-калиевые насосы такого типа были очень тщательно исследованы, и оказалось, что они работают за счет свободной энергии расщепления АТФ, причем механизм их работы весьма сложен [120]. Поскольку число ионов, переносимых через мембрану во время восстановления в обратном направлении, незначительно, количество используемой в этом процессе АТФ также слишком мало, чтобы его можно было обнаружить среди тех огромных потоков энергии, которые возникают во время сокращения [76].
Как уже было сказано, поперечные трубочки ретикулума представляют собой на самом деле впячивания плазмалеммы; отсюда логически следует (хотя экспериментально это еще не доказано), что они также могут переносить потенциал действия внутрь волокна в виде волны деполяризации. Эта волна запускает импульс аналогичной формы через два зазора в триадной системе, т. е. тем самым в обоих направлениях вдоль каждой фибриллы. Однако в продольной передаче сигнала участвуют уже не Na+ и K+, a Ca2+ и, возможно, Mg2+ [39, 40, 62, 63]. Это мы знаем из оригинальных работ по изучению фактора Марша, который, как было показано, состоит из мелких фрагментов ретикулума. Они были отцентрифугированы при больших скоростях из казавшихся чистыми растворов, и осадок исследовался под электронным микроскопом [39, 40, 62]. Этот осадок состоит из тонких трубочек небольшой длины, а также из структур, которые можно считать частями продольных пузырьков и концевых цистерн триад (см. фото XIV и XV). Заметим, что только последние способны всасывать Ca2+ из среды, о чем свидетельствует их гораздо большая плотность на фото XV. Продольные пузырьки или, что более вероятно, концевые цистерны триад могут действительно достаточно эффективно работать как кальциевый насос, но они не обнаруживают никакой тенденции к перекачиванию ионов Na или К [63]. Как мы увидим, этот кальциевый насос также работает за счет свободной энергии гидролиза АТФ,
Саркоплазматический ретикулум и расслабление
103
АТФ и кальциевый насос
В отсутствие ионов Ca обычные препараты фактора Марша после их частичной очистки с помощью дифференциального центрифугирования расщепляют АТФ довольно медленно, но если к суспензии добавить даже очень незначительные количества Ca2+, то АТФ-азная активность резко возрастает [39, 40, 62, 156]. Применяя для определения содержания кальция в отцентрифугированном осадке радиоактивный Ca45, можно показать, что эта дополнительная АТФ-азная активность появляется вследствие накапливания Ca2+ во фрагментах ретикулума. Чтобы накопление Ca приблизилось к тому уровню, которого можно ожидать in vivo, необходимо, однако, добавить какое-либо вещество, которое будет осаждаться в пузырьках в виде соли Ca, диффундируя через более или менее проницаемую мембрану пузырьков [63, 156, 157]. Для этой цели обычно применяется оксалат, но вполне пригоден также фосфат. Можно показать, что по мере возрастания внутренней концентрации Ca2+ оба эти вещества накапливаются внутри пузырьков путем свободной диффузии и осаждаются там в виде своих кальциевых солей [40, 62, 63, 156, 157]. На этом основании было постулировано, что in vivo таким же образом может действовать неорганический фосфат, хотя прямых экспериментальных доказательств для этого нет [31]. В присутствии оксалата кальциевый насос способен накапливать Ca2+ внутри пузырьков в концентрации, превышающей наружную в 2000—3000 раз. И даже в отсутствие оксалата концентрация Ca в пузырьках может по меньшей мере в 500 раз превышать его уровень во внешней среде [40, 63, 157].
В первых работах по изучению насоса предполагалось, что внутри пузырька накапливается от 1 до 2 ионов Ca на одну расщепляемую молекулу АТФ [62, 63]. Однако более поздние исследования показали, что точное отношение — это 2 иона Ca на 1 молекулу АТФ независимо от наружной концентрации Ca [157]. Из фиг. 28, на которой показано соотношение между скоростью поглощения Ca и скоростью расщепления АТФ при различной наружной концентрации Ca, видно, что
104
Глава IV
экспериментальные точки достаточно хорошо ложатся на прямую, наклон которой соответствует 2 ионам Ca на 1 молекулу АТФ. Наружную концентрацию «свободного» Ca в большинстве описанных экспериментов поддержи-
Фиг. 28. Зависимость между АТФ-азной активностью суспензии из пузырьков саркоплазматического ретикулума и его способностью перекачивать и запасать ионы Ca [157].
Условия: ионная сила 0,1; температура 20°; Ca-ЭГТК-буфер; [АТФ] = 10∙10-6 Μ. Для поддержания [АТФ] на постоянном уровне добавлены креатинфосфат (2∙10-6 м) и креатинфосфаткиназа. Наклон прямой равен 2.
вали постоянной с помощью Ca-ЭГТК-буферов [157]. Как мы отмечали, эти буферы во всем аналогичны большинству обычных pH-буферов, кроме того, что вместо концентрации H+ они поддерживают постоянной концентрацию свободных ионов Ca. Сами пузырьки непроницаемы
Саркоплазматический ретикулум и расслабление
105
для ЭГТК, так что ее кальциевая соль не нарушает внутреннего равновесия Ca.
Поскольку АТФ также может хелатно связывать ионы Ca, можно было бы думать, что насос перекачивает эти ионы через мембрану пузырьков в виде хелатного соединения Ca ∙ATΦ. Но так как начальная скорость
Фиг. 29. Влияние наружной концентрации Ca2+ на скорость всасывания Ca2+ саркоплазматическими пузырьками [157].
Условия те же, что и приведенные на фиг. 28. Темные кружки — скорость всасывания пустыми пузырьками; светлые кружки — скорость всасывания пустыми пузырьками в присутствии оксалата.
переноса Ca не зависит от концентрации хелатного соединения (в достаточно широком интервале ее значений), механизм, несомненно, должен быть иным [157]. В то же время скорость всасывания сильно зависит от наружной концентрации ионов Ca, как это показано на фиг. 29, где последний параметр отложен по оси абсцисс в виде рСа (отрицательный логарифм концентрации Ca). Вспомнив, что скорость всасывания в свою очередь зависит от АТФ-азной активности (фиг. 28), мы можем сделать
106
Глава IV
вывод, что на первых стадиях, когда пузырьки пусты, последняя определяется только наружной концентрацией Ca. На фиг. 29 кривые имеют несколько разный наклон в зависимости от того, измеряется ли скорость всасывания в присутствии оксалата, т. е. при очень низкой внутренней концентрации Ca, или используются «пустые» пузырьки в отсутствие оксалата. Но если учесть все данные, то этому различию вряд ли следует придавать существенное значение.
В то время как скорость всасывания и скорость расщепления АТФ явно зависят от наружной концентрации Ca, концентрация АТФ не оказывает заметного влияния на эти процессы [157]. По крайней мере из имеющихся данных следует, что очень высокие скорости всасывания можно получить и при такой малой концентрации АТФ, как 10~6 Μ. Такие низкие концентрации АТФ редко встречаются в интактной мышце даже после ее перехода в состояние окоченения. Отсюда можно заключить, что кальциевый насос может действовать с полной мощностью при большинстве условий, которых можно ожидать in vivo [63].
Другие свойства насоса
Помимо потребности в ионах Ca насос, активируемый АТФ, нуждается, вероятно, и в ионах Mg. Однако в литературе, по-видимому, не содержится надежных данных о концентрациях Mg, необходимых при разных концентрациях АТФ [63]. В большинстве обсуждавшихся выше экспериментов (все они были проведены в одной лаборатории [157]) общая концентрация ионов Mg была равна 1 мМ или выше, т. е. на два или более порядка выше, чем наибольшая концентрация Ca во внешней среде. Но даже при такой огромной разнице в концентрациях кальциевый насос, по-видимому, не способен к активному переносу ионов Mg внутрь пузырьков. Таким образом, роль ионов Mg еще неясна, хотя возможно, что они просто служат для того, чтобы поддерживать в умеренных пределах концентрацию свободного АТФ4', хелатно связывая его избыток в виде Mg • АТФ2'. Конечно, in vivo общая концентрация ионов Mg соста¬
Саркоплазматический ретикулум и расслабление
107
вляет в большинстве мышц млекопитающих не менее 8 λ∕Λ4. Ионы Mn в этом смысле могут заменить ионы Mg. В отличие от Mg и Mn стронций может накапливаться в пузырьках почти в такой же степени, что и Ca [63, 157].
Существенная роль Mg для перекачивания Ca может быть продемонстрирована и в другом важном процессе — в фосфатном обмене, сопровождающем работу насоса. Но и здесь нет уверенности в том, что Mg играет активную роль, так как он опять-таки может быть заменен на Mn. Следовательно, действие обоих этих ионов сводится, вероятно, к тому, что они уменьшают уровень свободного ATΦ4-, который иначе мог бы превысить оптимальный.
Механизм фосфатного обмена, сопровождающего перекачивание ионов, может быть описан уравнениями типа (IV. I)
где НТФ обозначает АТФ, ГТФ, ИТФ или ЦТФ, a E — ферментативный активный центр [63, 103]. Согласно этой схеме, мы предполагаем, что k2 и k3 ненамного превосходят ⅛1, так что комплекс E ~ P может существовать конечное время и, следовательно, может реагировать с любым присутствующим НДФ с образованием соответствующего НТФ. Таким образом, если начать, скажем, с ИТФ, меченного радиоактивным фосфором в его концевой у-фосфатной группе, и затем добавить немеченый АДФ, то возникнет следующая реакция обмена (небольшую часть меченого АТФ можно изолировать хроматографией на бумаге):
(IV. 2)
при этом часть метки будет потеряна в результате распада комплекса
Ясно, что степень обмена зависит от природы использованного НДФ, которая определяет величину
108
Глава IV
константы скорости k2 в первом уравнении. Кроме того, не обязательно даже пользоваться различными HTΦ,τaκ как вместо немеченого АДФ можно добавить АДФ, меченный в концевой β-фосфатной группе, и в результате обмена с немеченым АТФ мы получим некоторое количество АТФ, меченного в β-фосфатной группе.
Помимо того что эта реакция обмена позволяет определить относительные константы скоростей для различных НТФ [105], представляют интерес следующие ее важные особенности: 1) она протекает только в присутствии ионов Ca и, следовательно, участвует в перекачивании кальция; 2) меченый неорганический фосфат не участвует в обмене, и, следовательно, реакция (IV, I, б) фактически необратима; 3) она представляет собой часть механизма перекачивания, так как может идти лишь через образование фосфорилированного промежуточного продукта, роль которого играет либо фосфорилированный фермент, либо какой-то носитель фосфатной группы.
Структурные особенности
Продольные пузырьки содержат значительное количество липидного материала, главным образом в виде фосфатидилхолинсодержащего и холинсодержащего плазмалогенов, а также некоторое количество фосфоинозитида и фосфатидилэтаноламина [110]. Эти липиды играют существенную роль в работе насоса, так как он полностью перестает действовать, если удалить их с помощью детергентов или фосфолипаз, хотя АТФ-аза при этом сохраняет свою активность [НО]. Способность к перекачиванию ионов можно восстановить, добавляя к системе лецитин и другие липиды. Эти эксперименты показывают, таким образом, что мембрана пузырьков, подобно другим плазматическим мембранам, состоит из липидных и белковых компонентов. При этом заряженные группы липидов покрыты монослоем белка, который выступает в водную среду, а боковые группы жирных кислот погружены внутрь структуры. Продолжать это описание и пытаться подробно изобразить структуру мембраны, вероятно, еще преждевременно; прекрасное
Саркоплазматический ретикулум и расслабление
109
общее описание других типов мембран приведено в книге Пауля [120].
Другим отличительным свойством мембраны продольных пузырьков (или, более вероятно, концевых цистерн), характерным для всех ферментов, использующих АТФ, является наличие нескольких SH-групп различного типа, часть которых, очевидно, находится в АТФ-азном центре и играет существенную роль в перекачивании ионов [64]. Общее число SH-групп составляет примерно 10 моль на IO5 г белка, причем 40% из них непосредственно принимают участие в перекачивании, которое прекращается, если блокировать эти группы N-этилмалеими- дом или салирганом (комплексное соединение остатка салициловой кислоты с ртутью). При дальнейшем блокировании пропорционально уменьшаются АТФ-азная активность, скорость всасывания Ca и концентрирующая способность, но способность к запасанию Ca, по-видимому, не нарушается до тех пор, пока не будет блокировано более 90% SH-групп. Иными словами, пузырьки будут удовлетворительно заполняться при небольших скоростях расщепления АТФ или всасывания Ca независимо от того, чем были вызваны такие малые скорости: низкой наружной концентрацией Ca или блокированием SH-групп. Добавление к системе АТФ до того, как к ней был добавлен SH-реагент, создает защиту против блокады SH-групп точно так же, как и в случае фибриллярной АТФ-азы (см. гл. II). Исходя из обсуждавшейся выше реакции обмена, можно ожидать, что АДФ также должен создавать защиту от SH-реагентов.
Используя краситель с высокой электронной плотностью, Hg-фенилазоферритин, можно обнаружить, что SH-группы, участвующие в транспорте Ca, располагаются на внешней поверхности мембран продольных пузырьков или концевых цистерн (фото XVI и XVII).
Кальциевый насос in vivo
Все результаты, которые мы только что обсуждали, были получены на фрагментах саркоплазматического ретикулума мышц кролика или лягушки. Активные фрагменты в этом случае почти наверняка представляют со¬
по
Глава IV
бой концевые цистерны триадной системы, расположенной в месте соединения А- и 1-дисков или у Z-пластинок. Можно спросить, каковы доказательства того, что кальциевый насос действительно работает в живой мышце. До самого последнего времени все такие доказательства основывались исключительно на результатах опытов по инъекции ионов Ca в живые волокна; концентрацию свободного Ca2+ контролировали при этом с помощью Са-ЭГТК-буферов [129]. Например, в гигантских мышечных волокнах краба Maia Squinado инъекция Ca- буфера в относительно больших концентрациях (рассчитанных так, чтобы окончательная концентрация свободных ионов Ca была порядка 5—10∙10^7 Λl) стимулировала полное сокращение примерно в течение 5 сек после инъекции. При уменьшении концентрации кальция до 10^7 M волокно переставало сокращаться [129]. Если сопоставить это с фиг. 17, то можно видеть, что эти данные хорошо согласуются с более подробно изученным влиянием [Ca2+] на АТФ-азную активность миофибрилл.
Наиболее интересная особенность таких опытов состоит в том, что подвергнутые инъекции волокна примерно через 20 сек после полного сокращения всегда начинают вновь расслабляться. Это показывает, что уровень свободного Ca2+ с помощью кальциевого насоса понижается от начального уровня примерно IO-6 M до значения более низкого, чем 10^7 Μ. На первый взгляд это соответствует перекачиванию не очень внушительного количества кальция, но следует помнить, что для такого понижения уровня свободных ионов Ca необходимо удалить гораздо большее количество Ca2+ из Са-ЭГТК-буфера, который сначала присутствует в концентрации примерно 3∙10^3 M1 а затем по мере понижения уровня Ca постепенно диссоциирует. В действительности для того, чтобы уровень свободных ионов кальция стал ниже 10^7 M1 необходимо удалить примерно l,7∙10^3 моль ионов кальция на 1 кг мышцы. Если мышечные волокна краба содержат приблизительно то же число триад, что и волокна кролика, то этот результат легко объяснить на основании исследований насоса in vitro, о которых мы говорили выше. Более прямое
Саркоплазматический ретикулум и расслабление
Ill
доказательство освобождения Ca2+ при стимуляции живой мышцы и его реабсорбции во время расслабления было получено недавно с помощью элегантного фотометрического метода, в котором индикатор кальция вводился непосредственно в мышцу (см. фиг. 38 и 47, а также [90]).
Распределение кальция в интактной мышце
Проблема распределения Ca в живых мышцах очень важна, так как из всего сказанного вытекает, что концентрация свободных ионов Ca в покоящейся мышце не может быть больше чем 10^7 Mf тогда как общее содержание Ca в большинстве мышц имеет порядок от 1 ∙ 10^3 до 2 ∙10~3 M [63]. Какая же часть этого кальция аккумулирована в саркоплазматическом ретикулуме, а какая связана с остальными структурами — главным образом актиновыми и миозиновыми нитями и митохондриями?
Актин содержит один очень прочно связанный ион Ca на молекулу (Μ. В. = 47 000), а миозин, по-видимому,— два иона, один из которых способен легко обмениваться на Ca45, а другой нет [7, 153]. Тропонин также может связывать Ca2+ в количестве примерно до 4 ионов на молекулу с Μ. В. = 80 000; этот Ca тоже способен легко обмениваться [20, 35а]. Миофибриллярные белки содержат примерно 27% актина, 54% миозина и 4% тропонина; их общее содержание на 1 г влажной мышцы составляет 0,12 г [57]. Отсюда получаются следующие молярные значения для количества Ca, связанного с этими компонентами (в расчете на 1 кг влажной мышцы): 7∙ IO-4, 2,6 ∙ IO"4 и 2,5∙ IO-4 M соответственно. Таким образом, общее содержание Ca составит примерно 1,2 ∙ IO-3 M0Λb∣κεf что близко к величине общего содержания Ca в мышце кролика. Из этого вытекает, что кальций либо вообще не связан с митохондриями и с другими специальными структурами, либо связан в очень незначительном количестве. Считается, что из Ca, связанного с основными структурами, всего около 0,40 ∙ IO"3 моль! кг могут легко обмениваться и, следовательно, легко удаляться при действии кальциевого насоса. Однако, по данным прямых измерений, максималь¬
112
Глава IV
ная емкость насоса составляет примерно 30∙ IO-3 моль на 1 кг мышцы. Это дает большой коэффициент надежности, по крайней мере в случае миофибрилл кролика, даже если учесть, что емкость измеряли в присутствии оксалата, который имеет тенденцию ее увеличивать [63].
Кальциевый насос в нескелетных и «медленных» мышцах
Распределение и детальная структура саркоплазматического ретикулума очень меняются от мышцы к мышце, но, как правило, чем быстрее сокращается мышца, тем более обширен ее ретикулум [63, 126, 131]. Можно ожидать, следовательно, что «медленные» мышцы (такие, как мышца сердца или еще более «медленные» мышцы кишечника и артерий) должны содержать относительно мало ретикулума. Это предположение оказывается правильным, и только сравнительно недавно удалось выделить активный препарат кальциевого насоса из сердечной мышцы [158], а во многих гладких мышцах его либо вообще нет, либо очень мало [63]. Поскольку мышцы последнего типа определенно не испытывают недостатка в Ca, было высказано предположение, что в них концентрация свободных ионов Ca контролируется не ретикулумом, а самой плазмалеммой. Иными словами, когда такая мышца находится в активном состоянии, перекачивание Ca2+ внутрь и наружу осуществляет вся мышечная клетка в целом [63]. Такой механизм может действовать, конечно, только в чрезвычайно «медленных» мышцах, поскольку он, безусловно, будет нарушать тонкое равновесие Na+∕K+ в плазмалемме, от которого зависит деполяризация и реполяризация «быстрых» скелетных мышц; кроме того, при таком механизме очень велик путь диффузионного переноса.
Возможные механизмы переноса кальция
Точный механизм переноса ионов через биологические мембраны еще не выяснен. Хотя и были постулированы более или менее сложные механизмы переноса, ни один из гипотетических носителей еще не удалось выделить. Как и для мембраны митохондрий, предпола¬
Саркоплазматический ретикулум и расслабление
113
гали, например, что перенос кальция через мембрану концевых цистерн осуществляется двумя носителями [157]; но хотя этот механизм и объясняет некоторые факты, в другие наблюдения он вносит полную путаницу. Таким образом, сейчас еще преждевременно слишком углубляться в этот предмет. Тем не менее надо сказать, что невольно возникает предубеждение против гипотезы, в которой предполагается наличие каких-то неидентифицированных веществ, когда с тем же успехом мог бы действовать и более простой механизм. Установлено, например, что при взаимодействии АТФ с АТФ-аз- ным активным центром миозина во время сокращения живой мышцы головы миозиновых молекул, выступающие из толстых нитей, изменяют свою форму. Именно эти изменения и приводят к активному скольжению актиновых и миозиновых нитей относительно друг друга в процессе сокращения, при котором совершается механическая работа или развивается напряжение [82,83]. Этот процесс должен сопровождаться переносом заметного количества Ca2+ и Mg2+ с одного активного центра на другой. Поэтому не столь уж фантастичным будет выглядеть предположение о том, что активные АТФ-аз- ные центры на поверхности или внутри мембраны ретикулярных пузырьков во время их АТФ-азной активности и перекачивания Ca также претерпевают аналогичные изменения формы, индуцированные АТФ, и что именно эти локальные изменения приводят к накоплению ионов Ca внутри пузырьков. Для этого процесса не требуется никакого носителя, а нужна только определенная степень гибкости белковых цепей в области активных АТФ-азных и Са-связывающих центров; в большей или меньшей степени изгибаясь внутрь или наружу, эти цепи могли бы переносить прикрепленный к ним ион Ca и освобождать его внутри мембраны всякий раз, когда молекула АТФ расщепляется. Это предположение могло бы объяснить также наблюдаемый фосфатный обмен между АТФ и АДФ. Из-за отсутствия места мы не можем больше вникать здесь в эту проблему, но заметим, что аналогичный механизм был недавно предложен для митохондрий [171].
114
Глава IV
Другой крайне важный вопрос, касающийся механизма перекачивания, это вопрос о его точной локализации. Происходит ли перекачивание вдоль всего продольного пузырька или оно локализовано в концевых цистернах в области триад? Удовлетворительного ответа на этот вопрос еще не получено, но из общих соображений следует, что наиболее вероятным местом для размещения насоса, а следовательно, и для освобождения Ca2+ при поступлении потенциала действия в область триад являются концевые цистерны [66]. Иначе было бы трудно объяснить, почему у «быстрых» мышц млекопитающих и рыб число триад и цистерн внутри саркомера удвоено за счет размещения их вблизи мест соединения А- и 1-дисков, а не вблизи Z-пластинок (фиг. 27 и фото XIII и XIV). В дальнейшем мы будем предполагать, что это действительно так, т. е. что насос располагается в концевых цистернах.
ЧАСТЬ ВТОРАЯ
ИНТАКТНАЯ МЫШЦА
ГЛАВА V
ПЕРЕДАЧА ДВИГАТЕЛЬНОГО ИМПУЛЬСА
В большинстве работ по сокращению живой мышцы, о которых мы будем здесь говорить, мышцу раздражали непосредственно, а не через ее нерв. Однако нам важно знать, как происходит передача двигательного импульса в живом организме, так как в этом процессе проявляется ряд общих существенных особенностей проводящих мембран. Для того чтобы представить себе механизм этого процесса, рассмотрим отдельную двигательную единицу, изображенную схематически на фиг. 30 [28, 29].
Рисунок показывает, что каждое волокно, идущее в составе двигательного нерва к соответствующей мышце, представляет собой длинный отросток (аксон) нервной клетки (мотонейрона), находящейся в переднем роге спинного мозга. В мышце волокно делится на мелкие ветви, каждая из которых образует несколько нервных окончаний, соприкасающихся с отдельным мышечным волокном, — это так называемая концевая пластинка. Одно нервное волокно часто дает начало 5—10 или большему числу таких ветвей. Вся группа концевых пластинок, принадлежащих одному волокну, называется двигательной единицей.
Сами двигательные единицы часто группируются в средней части иннервируемой ими мышцы (фото XVIII). Такое расположение, очевидно, наиболее удобно, так как импульс должен распространяться вдоль мышечного
116
Глава V
волокна с возможно большей скоростью, чтобы полностью его активировать. В большинстве мышц двигательные единицы соответствуют первичным мышечным пучкам, каждый из которых содержит от 20 до 60 мышечных волокон, разделенных перимизием.
Фиг. 30. Схематическое изображение мотонейрона и двигательной единицы.
Объяснение см. в тексте.
Содержимое аксона, или аксоплазма, одето мембраной, которая представляет собой непрерывное продолжение мембраны, окутывающей тело соответствующего мотонейрона с заключенным в нем ядром, и является проводящей структурой волокна. Эту трехслойную мембрану толщиной всего около 100 Å не следует путать с гораздо более толстым наружным защитным слоем, образованным шванновскими клетками.
Передача двигательного импульса
117
В примитивных немиелинизированных волокнах автономной нервной системы шванновские клетки выполняют лишь функцию простого защитного покрытия, обычно разомкнутого с одной стороны (фиг. 31). В миелинизированных двигательных нервных волокнах «произвольной» системы они образуют сложные концентрические кольца миелина, покрывающие волокно на всем его протяжении, кроме перехватов Ранвье. Таким образом, в
Фиг. 31. Поперечное сечение немиелинизированного нервного волокна (А) и продольное сечение миелинизированного волокна (Б) [76].
областях между перехватами такие волокна очень хорошо изолированы от внешней среды, тогда как в месте перехвата собственная мембрана нервного волокна оголена. Область между перехватами имеет длину от 1 до 2 мм; миелиновая оболочка, покрывающая эту область, образована одной шванновской клеткой; размер перехвата меньше 0,1 мм. Диаметр миелинизированного волокна обычно составляет от 1,0 до 20мк (0,001—O,O2λiλ0. У некоторых животных, например у кальмара, встречаются гигантские нервные волокна, диаметр которых достигает 1 мм, но они не миелинизированы и окружены сложной системой шванновских клеток. Исследования проведения импульса, о которых пойдет речь дальше, были выполнены в основном на нервах этого последнего типа (ср. [164]).
Фиг. 32. Схематическое изображение концевой пластинки [15, 27, 28].
А — ветвь нервного волокна и мелкие нервные окончания в мышечном волокне. Эти окончания окружены несколькими ядрами (на схеме не показаны), являющимися составной частью структуры концевой пластинки; Б — нервное окончание в своей „бороздке“ на мышечном волокне. В этом месте плазмалемма мышечного волокна образует соединительные складки; В — поперечное сечение нервного окончания. Обратите внимание на то, что аксоплазма находится в бороздке и дополнительно защищена с наружной стороны шванновской клеткой; Г — более детальное изображение соединительных складок плазмалеммы.
120
Глава V
В области концевой пластинки тонкие ветви нервного волокна, проникающие в бороздки, лишены миелиновой оболочки (фиг. 32) [15, 28, 95]. Существует два основных типа областей концевых пластинок: компактные «пластинчатые» (en plaque) и протяженные «гроздевидные» (en grappe). Первые характерны для «быстрых» фазических волокон, которые главным образом и описаны в этой книге, вторые — для «медленных» тонических волокон, также встречающихся во многих важнейших «быстрых» мышцах позвоночных [27]. На фиг. 32 показана концевая двигательная пластинка «пластинчатого» типа. Отметим, что ее нервные окончания имеют свою собственную трехслойную мембрану, находящуюся в непосредственном контакте с плазмалеммой иннервируемого ими мышечного волокна. В месте контакта плаз- малемма образует впячивание, направленное внутрь волокна. В аксоплазме нервного окончания находятся митохондрии, в которых протекают процессы окислительного фосфорилирования, являющиеся источником энергии; там же расположено множество других более мелких пузырьков, в которых, как предполагают, содержатся порции химического переносчика — ацетилхолина, выделяемого в тот момент, когда импульс достигает области концевой пластинки [15, 95].
Мембрана и потенциалы действия
Не считая разрывов в концевой двигательной пластинке и между поперечными и продольными трубочками саркоплазматического ретикулума (см. гл. IV), мембраны нервного и мышечного волокна непрерывны и настолько сходны по своей реакции на электрический импульс, что, описывая одну из них, мы описываем и другую. Единственное различие между ними состоит в величине постоянной времени, характеризующей скорость проведения импульса. В дальнейшем мы будем основываться главным образом на результатах, полученных для гигантских немиелинизированных нервных волокон кальмара и (значительно реже) более мелких миелинизированных волокон лягушки.
Передача двигательного импульса
121
В основе проведения импульса вдоль мембраны нервного и мышечного волокна лежит общее для всех живых клеток явление — наличие разности потенциалов между внутренним содержимым клетки и окружающей ее внешней средой [76]. Поэтому о покоящейся клетке говорят, что она поляризована', внутри она заряжена отрицательно, а снаружи — положительно. Как в животных, так и в растительных клетках эта разность потенциалов в подавляющем большинстве случаев обусловлена высокой концентрацией ионов калня и белка внутри клетки и ионов натрия и хлора снаружи, а также тем, что проницаемость покоящейся мембраны для K+ и C1“ примерно в 10 раз больше, чем для Na+. Таким образом, когда клетка находится в состоянии покоя, имеется тенденция к утечке из нее ионов К и более быстрому проникновению внутрь C1“, чем Na+. Этим и объясняется возникновение наблюдаемой разности потенциалов.
Покоящуюся мембрану можно рассматривать либо как С1“-электрод, либо как К+-электрод. Обычно принимается второй вариант. Как и для любого другого электрода, потенциал, который может генерироваться K+- электродом, определяется формулой Нернста
VK = (RT∕F)ln[K+]o∕[K+]i = = 58lg[K+]o∕[K+]i (при 20o), (V.1) где Vk — равновесный потенциал калия, равный разности потенциалов между наружной и внутренней частями электрода; R — газовая постоянная; T — абсолютная температура; F — число Фарадея; [K+]o — концентрация ионов калия снаружи, a [K+]i — внутри электрода.
Из данных, приведенных в табл. 3, мы находим, что если исходить только из отношения наружной концентрации K+ к внутренней, то потенциал покоя для аксона кальмара должен быть равным —74 мв (внутренняя сторона относительно наружной), а для мышечного волокна лягушки он будет гораздо выше, около -97 мв. Как показывает табл. 4, оба эти потенциала выше, чем наблюдаемые на опыте, что, возможно, связано с повреждением тканей при их выделении из организма [76]. Таким образом, мысль о том, что покоящаяся клеточная
122
Глава V
Таблица 3
Распределение электролитов с обеих сторон нервной и мышечной мембран [41]
Ткань
Внутренняя концентрация, мМ
Наружная концентрация, мМ
Отношение внутренней концентрации к наружной
Na
К
Cl
Na
К
Cl
Na
К
Cl
Нерв кальмара
49
410
40
440
22
560
1:9
19:1
1:14
Нерв каракатицы
43
360
—
450
17
540
1:10
21:1
—
Краб (ножной нерв)
52
410
26
510
12
540
1:10
34:1
1:21
Лягушка (портняжная мышца)
15
125
1,2
110
26
77
1:7
48:1
1:64
мембрана работает фактически как К+-электрод, в основном правильна. Чтобы убедиться в этом, вычислим, каким был бы потенциал при обратной ситуации, т. е. в том случае, если бы мембрана обладала большей проницаемостью для Na+, чем для K+. Расчет показывает, что для наблюдаемого на опыте потенциала покоя потенциал аксона кальмара был бы тогда равен +55 мв (внутренняя сторона относительно наружной) вместо —70 мв или около того. Как мы увидим, этот потенциал действительно имеет тот же знак и почти в точности ту же величину, что и максимальный потенциал, возникающий при деполяризации мембраны электрическим импульсом и распространении так называемого потенциала действия. Суммарное изменение потенциала составляет при этом +125 мв.
Для измерения потенциала покоя и потенциала действия в гигантском аксоне кальмара в отрезанный конец нерва предварительно вводят на 20—30 мм внутрь аксоплазмы тонкий стеклянный капилляр, наполненный насыщенным раствором KCl (фиг. 33, А) [76, 95]. Этот капилляр служит внутренним электродом; второй электрод— наружный (того же типа)—помещают на поверхности нерва. При работе с более мелкими нервными
Передача двигательного импульса
123
Таблица 4
Скорость проведения импульса в нервных и мышечных волокнах [41]
Ткань
Температура, oC
Диаметр волокна, мк
Скорость проведения импульса, м/ceκ
Наблюдаемое значение потенциала покоя
Наблюдаемое значение потенциала действия
Немиелинизированные волокна
Нерв краба
20
30
5
-62
+120
Гигантский аксон кальмара
20
500
25
-61
+89
Немиелинизированный нерв кошки
38
0,3-1,3
0,7-2,3
—
—
Мышечное волокно лягушки
20
60
1,6
-88
+120
Миелинизированные волокна
Миелинизированный нерв креветки
20
35
20
—
—
Лягушка (та же ткань)
24
3-16
6-32
-71
+116
Кошка (та же ткань)
38
2-20
10-100
—
—
волокнами для создания внутреннего электрода можно ввести в волокно тонкий капилляр (диаметр кончика около 1 мк) прямо через мембрану. В обоих случаях разность потенциалов, возникшая между внутренним и наружным электродами, подается в цепь усилителя и регистрируется на экране электроннолучевого осциллографа. Как только внутренний электрод вводится в клетку, он сразу же заряжается отрицательно по отношению к наружному электроду, и разность потенциалов между ними становится равной примерно —70 мв, т. е. величине, характерной для потенциала покоя. Отметим, что при дальнейшем обсуждении мы всегда будем определять мембранный потенциал как разность между внутренним и наружным потенциалами клетки или волокна.
124
Глава V
Рассмотрим теперь, что произойдет при раздражении нерва одиночным электрическим импульсом на некотором расстоянии от отводящих электродов (фиг. 33,А). После очень небольшой задержки, обусловленной тем,
Фиг. 33. Схема, показывающая способ записи потенциалов покоя и потенциалов действия в гигантских аксонах (А), и форма потенциала действия после одиночного раздражения аксона кальмара в морской воде при 16° (Б) [76].
что для прохождения импульса до регистрирующих электродов требуется некоторое время, разность потенциалов быстро достигает положительной величины 40—50 мв, а
Передача двигательного импульса
125
затем несколько медленнее возвращается к первоначальному значению потенциала покоя —70 мв или чуть меньше. Как видно из фиг. 33,5, при 16° весь процесс в нерве кальмара заканчивается примерно через 6 мсек. Этот процесс называется распространяющимся потенциалом действия, и его можно рассматривать как волну деполяризации — реполяризации, проходящую от точки раздражения в обоих направлениях вдоль нервного или мышечного волокна [76]. Чтобы пояснить, что понимают под распространением потенциала действия, рассмотрим гипотетическое длинное нервное волокно, в котором скорость проведения импульса составляет 25 м/сек. Если расположить одну пару отводящих электродов на расстоянии 2,5 см, а другую на расстоянии 25 см от точки раздражения и записать потенциалы действия, то оба они будут иметь одинаковую форму и высоту, но первый возникнет через 1 мсек после раздражения, а второй — через 10 мсек.
Механизм проведения импульса
Максимальное значение, которого достигает потенциал действия ( + 50 мв),— это величина того же порядка, что и потенциал, который возник бы, если бы мембрана вдруг стала локально проницаемой для ионов натрия и относительно непроницаемой для ионов калия ( + 55 мв). Иными словами, мембрана в активном состоянии ведет себя не как калиевый, а как натриевый электрод [76]. Предположим, что механизм генерирования потенциала действия именно таков. Тогда можно представить себе, что события развиваются так, как это изображено на фиг. 34. Невозбужденные участки мембраны заряжены отрицательно внутри и положительно снаружи. Но в месте расположения раздражающего электрода (катода) мы внезапно прикладываем извне отрицательный потенциал. При этом непосредственно под электродом заряд меняет свой знак, и мембрана сразу становится проницаемой для ионов Na, что приводит к возникновению новой локальной разности потенциалов в +55 мв (изнутри наружу).
126
Глава V
Эта локально деполяризованная область находится, конечно, в электрическом контакте с соседними областями с обеих сторон, так что в них также возникает ток, создаваемый потоком ионов Na внутрь по градиенту Фиг. 34. Механизм распространения потенциала действия в обоих направлениях от раздражающего электрода в немиелинизированном нервном волокне (А) и сальтаторное проведение в миелинизированном нервном волокне (Б) [76].
Обратите внимание на то, что во втором случае потенциал действия „перескакивает“ через изолированные области между перехватами, не вызывая в них никаких изменений ионного состава. Потенциал действия возникает в перехватах. Ток течет как внутри, так и снаружи области между перехватами, причем наружный ток проходит в омывающей волокно внеклеточной жидкости.
концентрации. Происходит в точности тот же самый процесс, что и на участке под электродом. Таким образом, в каждом направлении от точки раздражения распространяется потенциал действия в виде локального потока ионов натрия внутрь мембраны. Отметим, что пока
Передача двигательного импульса
127
существует этот направленный внутрь поток, мембрана временно непроницаема для ионов К.
Как можно объяснить нисходящую ветвь потенциала действия, т. е. волну деполяризации? Это сравнительно просто, ибо, как только натриевый ток начинает падать, проницаемость мембраны для ионов К восстанавливается. Затем, вследствие того что после прохождения
Фиг. 35. Изменение натриевой и калиевой проводимости нервного волокна при прохождении потенциала действия.
Форма потенциала действия показана пунктирной линией.
импульса проницаемость мембраны для ионов натрия сразу же уменьшается, на внутренней стороне мембраны образуется избыток положительного заряда. Это приводит к передвижению ионов К наружу и к уменьшению градиента концентрации этих ионов на величину, эквивалентную числу вошедших внутрь ионов Na. Таким образом, заряды нейтрализуются и мембрана реполяри- зуется. Этот так называемый калиевый ток нарастает гораздо медленнее, чем предшествующий ему натриевый ток, но, как видно из фиг. 35, со временем превышает его—возможно, благодаря небольшому потоку ионов Cl, возникающему во время прохождения потенциала
128
Глава V
действия; так или иначе, калиевый поток вскоре компенсируется, и потенциал покоя восстанавливается до своей первоначальной величины.
Ограниченный объем книги не позволяет описать здесь изящные опыты, с помощью которых была изучена зависимость токов натрия и калия от времени [77]. Достаточно сказать, что в них применялся метод фиксации напряжения, состоящий в том, что на потенциал покоя накладывается такое постоянное напряжение, чтобы создать желаемую разность потенциалов между внутренней и наружной поверхностями мембраны. Это позволяет определить, как изменяются во времени натриевая и калиевая проводимости после раздражения и при разных начальных потенциалах покоя. Соответствующие кривые при нормальном потенциале покоя, равном —70 мв, приведены на фиг. 35. Можно видеть гораздо более медленное возрастание калиевой проводимости, что и объясняет наблюдаемую форму потенциала действия. В этом случае количество ионов К, вышедших наружу, в точности сбалансировано числом ионов Na, вошедших внутрь (около 4,3 пмоль на 1 см2 мембраны).
Количественные и метаболические аспекты
Выше мы видели, что общее количество ионов Na и К, переносимых через мембрану в процессе прохождения одного потенциала действия в аксоне кальмара, равно всего около 4 пмоль на 1 см2 (1 пмоль = IO"12 г* ион). Общая концентрация как Na+, так и K+ по порядку величины составляет 400 мМ, или 4∙ IO11 пМ, а объем, соответствующий 1 см2 мембраны аксона кальмара (диаметр 0,05 см), равен примерно 0,00625 см3. Таким образом, в этом объеме имеется 2,5 ∙ IO6 пмоль ионов и, следовательно, при прохождении одного импульса переносится всего одна миллионная часть общего их числа. Это означает, что для восстановления status quo даже после прохождения большой серии импульсов требуются ничтожные количества метаболической энергии. По этой причине восстановление первоначальной концентрации ионов может без большого вреда происходить со значительной задержкой во времени [76].
Передача двигательного импульса
129
По сравнению с очень быстрым (хотя в количественном отношении и незначительным) переносом ионов через мембрану при прохождении импульса скорость потока калия и натрия в состоянии покоя очень низка (в нерве кальмара она составляет примерно 1Aooo величины скорости в процессе прохождения потенциала действия). Тем не менее для поддержания большой разницы в концентрациях ионов, которая существует в состоянии покоя, должен работать какой-то метаболический насос. И этот насос должен работать непрерывно в течение всей жизни организма, чтобы противодействовать неизбежному притоку Na и оттоку К, обусловленному отчасти очень медленной пассивной диффузией натрия, а отчасти действием несчетного числа импульсов. В большинстве нервных и мышечных клеток для этой цели существует натриевый насос, использующий энергию гидролиза АТФ для выноса ионов Na наружу против градиента концентрации. Источником «горючего» служат процессы окислительного фосфорилирования, протекающие в митохондриях. Калиевый насос здесь, по-видимому, не требуется, так как мембрана обладает высокой проницаемостью для K+. Действие натриевого насоса в состоянии покоя, а также непосредственно после прохождения серии импульсов было продемонстрировано в изящных опытах с применением изотопа Na24 [76, 95].
Независимость основных процессов, связанных с проведением импульса, от метаболизма и существования натриевого насоса выявилась не только при изучении потоков ионов, но и в прямых опытах по выдавливанию аксоплазмы из нерва кальмара [9]. Оказывается, что с помощью специального приспособления удается вытолкнуть аксоплазму из нерва, не повредив при этом мембрану. Затем можно показать, что полая часть нерва, погруженная в морскую воду, не способна проводить импульс, пока в нее не будет вдавлена аксоплазма из соседних сегментов или введен изотонический раствор ионов К. Аксоплазму можно полностью заменить искусственным внутренним содержимым, лишь бы только концентрации ионов К внутри и ионов Na снаружи поддерживались на нужном уровне; тип добавляемых анионов может быть практически произвольным. Такая система
130
Глава V
генерирует нормальные потенциалы действия и способна проводить их в течение многих часов. Более того, она имеет то огромное преимущество, что позволяет изучать, как влияют изменения внутренней концентрации Na и К на потенциал покоя и на потенциал действия. Проделав подобные опыты, можно видеть, как хорошо согласуются полученные результаты с предсказаниями уравнения Нернста (V. 1) в его простой форме; это означает, что мембрана действует как калиевый электрод в состоянии покоя и как натриевый электрод при возникновении потенциала действия.
Между прочим, опыты с выдавливанием аксоплазмы доказывают несостоятельность идеи, выдвигавшейся в старых учебниках гистологии, согласно которой внутри нервного волокна имеются еще более тонкие фибриллы. Совершенно ясно, что такие «фибриллы» являются артефактом техники фиксации. Эти опыты свидетельствуют также о том, что в распространении потенциала действия не может участвовать какой-либо химический переносчик, подобный ацетилхолину, ибо при обработке нерва такое вещество почти наверняка вышло бы из него вместе с аксоплазмой.
Скорость проведения импульса в нервных и мышечных волокнах
Процессы, лежащие в основе распространения потенциала действия в нервном и мышечном волокне, по существу одинаковы. Поэтому сами потенциалы действия и их длительности в обоих типах ткани сходны по величине. Однако скорость проведения импульса, как показывает табл. 3, очень сильно варьирует в разных волокнах. Прежде всего из таблицы следует, что при сравнимых величинах диаметра миелинизированные волокна проводят импульс значительно быстрее, чем немиелини- зированные. Это объясняется тем, что в миелинизированных волокнах проведение импульса носит не непрерывный, а прерывистый характер (так называемое саль- таторное проведение); иными словами, в таком волокне возбуждение «перескакивает» от одного перехвата к другому, минуя очень хорошо изолированную область между ними (см. фиг. 31, Б и 34,5). Если бы механизм
Передача двигательного импульса
131
проведения был иным, нервы млекопитающих, например, должны были бы иметь очень большую толщину, чтобы проводить импульсы с наблюдаемыми скоростями, так как скорость распространения импульса в миелинизированных волокнах пропорциональна диаметру волокна (в отличие от немиелинизированных, где она пропорциональна корню квадратному из диаметра).
Из табл. 3 видно также, что скорость проведения в мышце лягушки гораздо меньше, чем в иннервирующих ее миелинизированных двигательных нервах. Это различие объясняется тем, что мембрана мышечной клетки слабо изолирована и в этом смысле подобна мембране немиелинизированного волокна. Аналогичные различия имеются и в так называемом абсолютном рефрактерном периоде. Это тот короткий период сразу же после прохождения отдельного потенциала действия, когда нерв или мышца абсолютно не проводит импульса. Его длительность близка к длительности самого потенциала действия. За абсолютным рефрактерным периодом следует относительный рефрактерный период, в течение которого для генерирования потенциала действия сила раздражения должна быть выше обычного порогового значения [76, 95]. Следует заметить, что порог раздражения всегда ниже потенциала покоя и имеет величину порядка 10—20 мв. Логично предположить, что это тот потенциал, при котором индуцированный раздражением поток натрия внутрь точно уравновешивает поток K+ наружу. Теоретически этот потенциал должен быть равен примерно 19 мв.
Вопрос о скорости проведения импульса приводит нас к другой проблеме: что происходит в самой концевой двигательной пластинке, т. е. в месте первого разрыва мембраны, а также дальше, в месте соединения поперечных и продольных трубочек ретикулума внутри мышечного волокна, где имеется второй ее разрыв.
Передача через концевую двигательную пластинку
Явления, происходящие в концевой двигательной пластинке, когда потенциал действия проходит по мотонейрону и достигает нервного окончания, можно качественно описать следующим образом. Из маленьких пузырь¬
132
Глава V
ков, расположенных в нервном окончании, освобождается ацетилхолин, который диффундирует через крошечный зазор между нервным окончанием и мембраной концевой пластинки, находящейся в контакте с мышечной мембраной, и сразу же деполяризует эту мембрану (фиг. 32) [15, 95]. Почти одновременно с деполяризацией ацетилхолин очень быстро разрушается под действием холинэстеразы, находящейся в области концевой пластинки. Таким образом, эффект деполяризации продолжается не очень долго. Этот тип деполяризации отличается от деполяризации, происходящей в нервной и мышечной мембранах при их раздражении. Мембрана концевой пластинки становится проницаемой как для ионов Na, так и для ионов К, а не только для ионов Na, как это происходит с мембранами мышцы и нерва. Тем самым потенциал концевой пластинки (∏K∏) никогда не может превысить величину потенциала покоя. Тем не менее это изменение ПКП автоматически индуцирует такое же по величине локальное изменение потенциала мышечной мембраны, которая находится в контакте с ней. Это вполне достаточно, чтобы вызвать локальную деполяризацию и поток ионов Na внутрь. От этой области деполяризации мышечной мембраны начинает распространяться потенциал действия точно таким же образом, как он распространяется в нервных волокнах.
ПКП обладает рядом интересных количественных особенностей, которые мы не можем обсуждать здесь подробно из-за отсутствия места. Отметим лишь действие яда кураре, который каким-то образом блокирует передачу сигнала вдоль мышечной мембраны. Однако он не препятствует освобождению ацетилхолина в нервном окончании и, следовательно, развитию нормального ПКП, который медленно затухает в обоих направлениях вдоль мышечного волокна, не генерируя при этом распространяющегося потенциала действия [76, 95].
Передача импульса саркоплазматическим ретикулумом и инициирование одиночного сокращения мышцы
Явления, происходящие в нервных волокнах, концевых пластинках и мышечных мембранах, нам удавалось описывать количественно, в терминах электрических и
Передача двигательного импульса
133
химических величин. Но когда мы переходим к обсуждению вопросов, связанных с поперечной и продольной передачей импульса в самом мышечном волокне, такой возможности у нас больше нет, так как нет еще методов, позволяющих записывать изменения потенциала в поперечных трубочках и области триад саркоплазматического ретикулума (см. фиг. 27 и фото XV). Однако у нас есть достаточно надежные основания считать, что потенциал действия, передающийся в мышцы по поперечным впячиваниям плазмалеммы (либо в местах соединения А- и 1-дисков, как у млекопитающих, либо у Z-пластинок, как, например, у лягушек), имеет примерно такую же величину, как и исходный потенциал действия. Но распространяется он, вероятно, со значительно меньшей скоростью, так как диаметр трубочек очень мал. Начиная с этого момента мы не имеем точного представления о последовательности дальнейших событий, за исключением того, что в конечном счете происходит освобождение ионов Ca (по-видимому, из неких депо в концевых цистернах триад и в продольных пузырьках каждой фибриллы), их диффузия к активным центрам на актиновых и миозиновых нитях и непосредственное «взрывное» активирующее действие ионов СанаАТФ-аз- ные центры. Этот последний процесс инициирует движение голов миозиновых молекул и сокращение мышцы путем скольжения нитей двух типов относительно друг друга.
Доказательством передачи потенциала действия внутрь мышцы в поперечном направлении служит, во- первых, проделанный несколько лет назад классический опыт со строго локальным раздражением мышечной мембраны [85], и, во-вторых, полученные несколько позже данные о тонкой структуре ретикулума, особенно демонстрация (с помощью частиц ферритина) того факта, что между поперечными элементами и плазмалеммой нет разрыва (см. фото XI—XIV) [49, 84].
Упомянутый выше опыт с локальным раздражением, который необходимо посмотреть на киноленте, чтобы оценить его по достоинству, можно грубо изобразить так, как показано на фиг. 36. Микроэлектроды медленно движутся по поверхности одиночного мышечного волокна
134
Глава V
лягушки и в указанных стрелками местах через них пропускают очень слабый ток — настолько слабый, что он может возбудить лишь одну-две фибриллы под поверхностью волокна. Такое раздражение приводит только к локальному сокращению и лишь в том случае, если оно производится в точности над Z-пластинкой. В промежуточных положениях вообще ничего не происходит. Вспомним теперь, что в мышце лягушки Z-пластинка —
Фиг. 36. Схема, иллюстрирующая эффект раздражения отдельного мышечного волокна лягушки с помощью микроэлектродов, расположенных в разных местах вдоль саркомеров [85].
Обратите внимание, что раздражение дает эффект только в том случае, если оно наносится в месте расположения Z-пластинки (г). При этом укорачивается только тот саркомер, над которым находится микроэлектрод. Сокращение распространяется только на глубину нескольких фибрилл. Раздражение в области I-диска (а), A-диска (б) или в области соединения этих дисков (в) не вызывает никаких изменений.
это как раз то место, где поперечные трубочки ретикулума пронизывают волокно. Результаты этого эксперимента в сочетании с тем, что трубочки непрерывно переходят в наружную мембрану, убедительно доказывают, что рассмотренная возможность является единственным способом передачи импульса внутрь мышцы.
Этот наглядный опыт сразу вносит ясность в довольно долго обсуждавшийся вопрос о том, каким образом импульс может достаточно быстро доходить до центра толстого мышечного волокна (диаметром, скажем, 100 мк), чтобы обеспечить наблюдаемую скорость сокращения. Совершенно очевидно, что механизм, основанный на простой диффузии, исключается; но если импульс в действительности представляет собой распро¬
Передача двигательного импульса
135
страняющийся потенциал действия, то все трудности сразу же отпадают.
Согласно нашим представлениям о передаче импульса в мышцу, он поступает внутрь мышечного волокна в область триад. Каким образом импульс передается через зазор триадной системы — неизвестно. Один из возможных механизмов — это освобождение ацетилхолина, однако пока еще нет доказательств его участия в этом процессе. Конечно, на основании того, что мы знаем о процессах, происходящих в концевой двигательной пластинке и в других синаптических областях центральной и периферической нервной системы, естественно возникает мысль об участии какого-то химического посредника в области триадной системы. Мы также не знаем наверняка, где хранятся ионы кальция в интактной ретикулярной системе, хотя на основании исследований in vitro, рассмотренных в предыдущем разделе, у нас имеются достаточные основания считать, что сам кальциевый насос расположен в концевых цистернах триад [66]. Это не означает, однако, что продольные пузырьки саркоплазматического ретикулума, покрывающие всю поверхность каждой фибриллы, не способны хранить кальций, а говорит лишь о том, что они, возможно, активно его не аккумулируют.
Прямое доказательство освобождения Ca в тот момент, когда потенциал действия достигает, наконец, области расположения триад в фибриллах, было получено в элегантных опытах с применением фотометрической техники [90]. Метод заключается в том, что жабам скармливают мурексид и одновременно инъецируют диметилсульфоксид. Известно, что диметилсульфоксид повышает проницаемость мембран для крупных молекул и поэтому мурексид проникает в кровоток, а затем в саркоплазму. Так как мурексид, связывая ионы Ca, изменяет свой цвет, можно проследить, как эти ионы поступают в саркоплазму после нанесения раздражения; для этого нужно произвести фотометрическую регистрацию одновременно при двух длинах волн и затем проанализировать разностный спектр. Вид получаемых кривых показан на фиг. 38 и 47. Отметим две важные особенности этого процесса. Во-первых, освобождение
136
Глава V
кальция начинается спустя некоторое время после прохождения потенциала действия и вслед за этим сразу же происходит сокращение. Во-вторых, когда «волна» кальция уже, по-видимому, вновь полностью исчезнет, сокращение (в данном случае одиночное сокращение) едва достигает 2∕3 своей максимальной величины (фиг. 47). Во время сравнительно медленной фазы расслабления никаких дальнейших изменений не происходит.
Как объяснить такой поток кальция, который на первый взгляд кажется столь странным? Л1ожно предположить, что первая половина волны обусловлена быстрым поступлением Ca из кальциевого насоса, находящегося в концевых цистернах триад. Другими словами, под влиянием потенциала действия внезапно изменяется проницаемость мембраны концевых цистерн для Ca. Этот процесс аналогичен изменению проницаемости для натрия вдоль наружной плазмалеммы волокна при прохождении импульса.
Как было указано в гл. III, для активирования АТФ-азы, участвующей в сокращении, на один активный центр нитей миозина требуются два иона Ca. В таком случае для насыщения всех активных центров на 1 кг мышцы потребовалось бы около 2,4 ∙ IO-4 моль кальция. По-видимому, это как раз то общее количество Ca, которое освобождается концевыми цистернами триад в процессе одиночного сокращения мышцы. Внезапное поступление такого количества ионов Ca в саркоплазму легко объясняет способность мурексида связывать некоторое их количество и изменять свою окраску, прежде чем Ca2+ достигнет активных центров. Аналогичным образом, если константа связывания Ca2+ миозином или тропомиозином, скажем, на один порядок больше, чем константа связывания его мурексидом, то легко понять и вторую ниспадающую часть волны Ca2+, в течение которой Ca2+ как будто бы исчезает из саркоплазмы до того, как одиночное сокращение достигнет своей максимальной величины: это вызвано связыванием большей части Ca2+ активными центрами. Что касается обратного поступления Ca в концевые цистерны триад в фазе расслабления, то здесь, конечно, ситуация оказывается совершенно иной. Первый этап должен заключаться в
Передача двигательного импульса
137
реполяризации мембраны триад и в сильной активизации насоса, так как, хотя концентрация свободного Ca2+ в саркоплазме и не превышает значения 10^6 М, она все же достаточно велика, чтобы стимулировать перекачивание ионов (ср. фиг. 29). Поэтому ионы Ca медленно отщепляются от активных центров миозина и возвращаются обратно в концевые цистерны. Вследствие того что этот процесс, так же как и сам процесс расслабления, протекает сравнительно медленно, концентрация свободного Ca2+ в саркоплазме будет оставаться низкой и, по-видимому, недостаточной для того, чтобы обнаружить его с помощью мурексида. Этим и объясняется наблюдаемая форма волны Ca2+: вначале быстрое освобождение Ca2+, который частично связывается мурексидом, затем быстрое присоединение этого Ca2+ к активным центрам и, наконец, вновь перекачивание Ca2+ обратно в концевые цистерны триад при сохранении его низкой концентрации.
Хотя такое описание процесса активации вполне удовлетворительно в качественном отношении, оно оставляет желать много лучшего с точки зрения количественной схемы реакции. Основное затруднение — это механизм внезапного выделения Ca из триад. Следует ли объяснять его деполяризацией мембраны, т. е. точно так же, как возникновение потока натрия через плазмалем- му, или требуется какой-то иной механизм? Во всяком случае, на основании исследований in vitro мы можем быть уверены в одном: наблюдаемое явление нельзя объяснить простым ингибированием кальциевого насоса, так как выход Ca из фрагментов триад происходит при этом недостаточно быстро. Следовательно, в нашем распоряжении остается, по-видимому, только гипотеза деполяризации— реполяризации, и в этом случае необходимо знать разность потенциалов покоя в мембране концевых цистерн, которая обусловлена градиентом концентрации Ca между внутренней и наружной средой. Если этот градиент равен 500: 1, как это следует из данных in vitro, и мембрана умеренно проницаема для ионов Ca (по крайней мере когда насос работает при больших концентрациях АТФ), то потенциал внутренней стороны мембраны концевых цистерн относительно
138
Глава V
наружной должен быть равен +157 мв. Хотя этот потенциал очень высок, его знак верен по отношению к содержимому фибриллы. Однако мы не знаем, какие противоионы участвуют в этом процессе и какова природа аниона, необходимого для сбалансирования градиента Ca2+; скорее всего этим анионом является неорганический фосфат. Таким образом, необходимо ответить на два основных вопроса: 1) каков механизм передачи и освобождения Ca2+, когда на границу между поверхностями поперечных трубочек и концевых триад приходит потенциал действия, и 2) какова природа остальных анионов и катионов, участвующих в процессе перекачивания Ca2+ in vivo. Как мы видели раньше, несомненно требуются ионы Mg, а в качестве аниона всегда в достаточном количестве присутствует неорганический фосфат (~5∙ 10’3 M даже в покоящейся мышце [31, 63]).
ГЛАВА VI
МЕХАНИКА СОКРАЩЕНИЯ
В последней главе мы видели, как потенциал действия передается от концевой двигательной пластинки вдоль плазмалеммы мышечного волокна и затем проходит внутрь мышцы через поперечные трубочки capκo≠ плазматического ретикулума, где он активирует освобождение ионов Ca из концевых цистерн триад каждой фибриллы и, таким образом, инициирует расщепление АТФ и одиночное сокращение мышцы. Теперь мы подробно рассмотрим механические аспекты возникновения одиночного сокращения и покажем, как слияние одиночных сокращений приводит к тетанусу. C этой целью мышцу раздражают обычно не через ее нерв, а непосредственно путем расположения больших электродов на ее поверхности; такой метод исключает запаздывание при передаче импульса в концевой двигательной пластинке и, как правило, более удобен.
Отметим, что, говоря об изометрических условиях опыта, мы имеем в виду опыты, в которых длина мышцы фиксирована, так что, когда мышца сокращается в тех местах, где она укреплена, развивается напряжение, записываемое измерителем напряжения. Под изотоническими условиями понимают условия, в которых мышца имеет возможность укорачиваться под постоянной нагрузкой.
Экспериментальная установка
Существует много различных установок, позволяющих изучать одиночное сокращение. На фиг. 37 показана установка, применяемая наиболее широко. Она состоит из легкого дюралевого рычага 1, который может поворачиваться вокруг стержня 2. Мышцу прикрепляют к
140
Глава Vl
одному концу рычага с помощью легкой цепочки, прочно привязанной ниткой к сухожилию мышцы. Другой конец мышцы (на котором обычно сохраняют часть кости) привязывают к твердой опоре в ванне. Мышца располагается на раздражающих платиновых электродах (3),
Фиг. 37. Экспериментальная установка для исследования одиночного сокращения и тетануса, позволяющая измерять напряжение либо при изотоническом (A), либо при изометрическом (B) сокращении [89].
Объяснение см. в тексте.
причем отрицательные и положительные электроды чередуются.
При исследовании изотонических одиночных сокращений мышцу можно нагрузить в точке P, расположенной на рычаге с другой стороны от жестко прикрепленного стержня 2. Если, кроме того, необходимо записывать и напряжение, то в положении А или В с помощью цепочки прикрепляют датчик напряжений 4. В положении А датчик будет записывать изменение напряжения
Механика сокращения
141
при изотоническом одиночном сокращении, так как мышца тянет рычаг вниз и посредством этого ослабляет присоединенную к нему цепочку. Перемещая датчик вверх или вниз по жесткой опоре (на схеме не показана), его можно использовать и в качестве стопора, препятствуя таким образом чрезмерному растяжению покоящейся мышцы избыточным грузом Р. Если датчик находится в положении В, то можно записывать только изометрическое напряжение. Сила, развиваемая сокращающейся мышцей, действует непосредственно на датчик, не перемещая его, а генерируя в нем возрастающий электрический ток, который после усиления можно наблюдать на экране электроннолучевого осциллографа.
При изотоническом сокращении, когда нагрузка P поднимается благодаря сокращению мышцы, перемещение рычага записывается с помощью фотоэлемента 5, сигнал с которого также подается на электроннолучевой осциллограф. Фотоэлемент можно заменить датчиком специального типа, приспособленным для измерения больших перемещений. Наконец, для того чтобы при изотоническом сокращении ограничить его в тот момент, когда мышца достигает некоторой требуемой длины, или при изометрическом сокращении обеспечить нужную степень расслабления мышцы, можно применить ограничитель 6 (расположенный на том плече рычага, где находится мышца); он управляется электромагнитом 7, который срабатывает от импульса, подаваемого реле времени.
Ранняя стадия одиночного сокращения
C помощью соответствующей аппаратуры можно измерять электрические и механические изменения в мышце через 1—2 мсек после раздражения [135]. Для этого на экране электроннолучевого осциллографа делаются отметки времени с частотой 10 000 меток в секунду, а изменения напряжения регистрируются с помощью пьезоэлектрического датчика. Абсолютная скорость изменения в мышцах разного типа различна и зависит также от температуры. Здесь мы будем рассматривать только сокращения портняжной мышцы лягушки при 0°, так как
142
Глава VI
именно при этих условиях были выполнены также многочисленные измерения по энергетике сокращения. Мы собрали наблюдения различных авторов [90, 135] и там, где это было необходимо, внесли температурную поправку, считая, что температурный коэффициент (Q10°C) равен 3,0 [3, 67]. К сожалению, данных по осво-
Фиг. 38. График, показывающий изменения на ранних стадиях изометрического одиночного сокращения (портняжная мышца лягушки при 0° [90, 135, 137].
Объяснение см. в тексте.
бождению Ca в портняжной мышце лягушки пока еще нет, и соответствующая кривая на фиг. 38 была построена путем экстраполяции данных, полученных для более «медленных» мышц жабы (см. фиг. 47); таким образом, она отражает лишь общий характер этого процесса.
На фиг. 38 показаны изменения, происходящие на ранних стадиях изометрического одиночного сокращения,
Механика сокращения
143
а именно в течение и сразу же после так называемого латентного периода, т. е. до того, как мышца развивает какое-либо напряжение. Можно видеть, что потенциал действия возникает сразу же после раздражения; примерно за 1,5 мсек он достигает своего максимума и, прежде чем удается обнаружить какие-либо другие изменения, уменьшается более чем вдвое. Через 7 мсек после раздражения внезапно падает напряжение мышцы, через 11,5 мсек оно доходит до минимума, затем резко меняет знак и в следующие 3,5 мсек восстанавливается до своей первоначальной величины, после чего быстро растет, достигая величины, соответствующей полному изометрическому одиночному сокращению (на графике не показано). Падение напряжения на ранней стадии называется скрытым расслаблением [135, 136]. Оно совершенно незначительно по сравнению с полным изометрическим напряжением, составляя, вероятно, 1Aooo от него, поэтому для его обнаружения необходимы очень тонкие методы. Весьма вероятно, что оно совпадает с началом освобождения Ca из концевых цистерн триад, которое, судя по данным для мышц жабы, в мышце лягушки должно начинаться, по-видимому, примерно через 7 мсек и к концу латентного периода достигнуть 60— 70% своей максимальной величины.
Недавно скрытое расслабление было успешно объяснено как результат изменения длины в системе саркоплазматического ретикулума [137]. Триады и продольные пузырьки этой системы плотно обволакивают фибриллы и, по-видимому, составляют примерно 15% объема мышцы. Предполагается, что при прохождении потенциала действия они очень быстро теряют свои запасы кальция; поэтому можно ожидать, что одновременно значительно уменьшается их внутреннее осмотическое давление и, следовательно, из них выходит вода. Трубочки должны при этом растягиваться, и это растяжение могло бы объяснить незначительное уменьшение напряжения в период скрытого расслабления. Эту точку зрения подтверждает тот установленный в эксперименте факт, что растянутая мышца имеет более продолжительный латентный период, чем нерастянутая.
144
Глава Vl
Изометрическое и изотоническое одиночные сокращения
Рассмотренные выше изменения напряжения при 0° заканчиваются за 15 мсек и слишком незначительны, чтобы их можно было вообще заметить на приборе,
Фиг. 39. Изометрическое и изотоническое одиночные сокращения (портняжная мышца лягушки при 0°) [89].
Обратите внимание на то, что изотонические одиночные сокращения при различных нагрузках заканчиваются за несколько сотен миллисекунд до того, как напряжение уменьшится до нуля.
предназначенном для измерения активного напряжения, которое развивается позже и более резко. Полный цикл развития напряжения в процессе изометрического одиночного сокращения портняжной мышцы лягушки показан на фиг. 39 (пунктирная кривая) [89]. Мы видим, что активное напряжение нарастает очень быстро в конце латентного периода и достигает своей максимальной
Механика сокращения
145
величины примерно через 170 мсек после удара тока. Начиная с 200 мсек, оно снова уменьшается, сначала с возрастающей скоростью, а затем, примерно после 450 мсек, по кривой, близкой к экспоненте. Даже через 900 мсек в мышце еще сохраняется некоторое активное напряжение. Такая способность мышцы поддерживать напряжение может быть обусловлена только активными физическими и химическими процессами, происходящими внутри нее. Следовательно, в этом смысле уменьшение напряжения может служить мерой затухания этих процессов, или, другими словами, затухания так называемого активного состояния [68, 89].
Изотоническое одиночное сокращение резко отличается от изометрического. На фиг. 39 показаны изменения длины, наблюдающиеся в процессе серии изотонических одиночных сокращений одной и той же мышцы при различных нагрузках [89]. Прежде всего мы замечаем, что укорочение в процессе изотонического одиночного сокращения начинается только тогда, когда в мышце развивается достаточное напряжение, равное по величине напряжению нагрузки. В результате одиночное сокращение начинается тем позднее, чем больше нагрузка. Укорочение, а значит, и высота, на которую поднимается груз, вначале почти линейно зависят от времени, но они достигают своих максимальных значений тем раньше, чем больше груз. Например, при грузе 3 г максимум достигается примерно через 375 мсек, при грузе 5 г — через 340 мсек, при грузе 9 г — менее чем через 300 мсек. Затем наступает расслабление с возрастающей скоростью, причем, так же как и укорочение, оно завершается тем раньше, чем больше груз. Даже после того как мышца расслабится до первоначальной длины, в ней сохраняется остаточное напряжение даже при самом легком грузе (ср. кривую укорочения для груза Зге кривой для изометрического одиночного сокращения). Эти результаты показывают, как осторожно нужно интерпретировать данные по изотоническому одиночному сокращению, ибо очевидно, что прекращение изменения длины не может служить критерием потенциальной активности мышцы в этот момент. Фактически, исследование изотонического одиночного сокращения без
146
Глава VI
измерений напряжения не дает никакой информации о затухании активного состояния.
Развитие и спад напряжения в процессе изотонического одиночного сокращения можно измерять с помощью прибора, показанного на фиг. 37, если поместить датчик в положение А (описание метода см. в ра-
Фиг. 40. Развитие и спад напряжения при изотонических одиночных сокращениях, показанных на фиг. 39 [89].
Объяснение см. в тексте.
боте [89]). Результаты такого измерения показаны на фиг. 40, где для сравнения снова приведена кривая изометрического одиночного сокращения. Мы видим, что в начальной стадии изотонического одиночного сокращения напряжение развивается во времени так же, как при изометрическом одиночном сокращении. Мышца начинает укорачиваться, как только напряжение достигнет величины, равной весу груза, действующего на мышцу, а затем напряжение остается постоянным до тех пор, пока расслабление полностью не закончится.
Механика сокращения
147
Конечно, в фазе расслабления нагрузка медленно возвращает мышцу к ее первоначальной длине, зафиксированной ограничителем. Напряжение, измеренное в момент окончания расслабления (через 500—600 мсек), все еще равно весу груза, но далее оно начинает быстро уменьшаться, хотя ни в одном случае не достигает нуля даже через 900 мсек. Это время очень велико по сравнению с продолжительностью изотонического одиночного сокращения, и если бы мы судили об активности только по изменениям длины, то можно было бы думать, что в этот момент она уже давно закончилась (ср. фиг. 39).
Другой интересной особенностью кривых на фиг. 40 является зависимость их формы от нагрузки. Только при самой большой нагрузке временной ход спада напряжения в изотонических условиях совпадает (в самых общих чертах) со спадом напряжения при изометрическом сокращении. При двух других, меньших нагрузках, которым в начальной фазе одиночного сокращения соответствует значительно большая степень укорочения, различие кривых в фазе расслабления оказывается весьма заметным. Таким образом, чем меньше нагрузка и, следовательно, чем больше укорочение мышцы в процессе развития одиночного сокращения, тем скорее начинает падать напряжение в стадии расслабления. Это означает также более раннее затухание активного состояния, если судить о нем только по напряжению мышцы в данный момент времени.
Легче всего продемонстрировать влияние длины мышцы на падение напряжения, быстро освобождая мышцу от изометрических условий в разные моменты одиночного сокращения. Оказалось, что чем в большей степени мышца освобождена во время фазы расслабления, тем менее полно восстанавливается напряжение. Смысл этого феномена заключается в том, что во время расслабления мышца растрачивает свой химический «импульс» тем быстрее, чем больше она укорачивается. По-видимому, это либо отражает влияние длины мышцы на способность триад перекачивать Ca, либо просто означает изменение длины пути, который должен пройти кальций
148
Глава VI
за счет диффузии. Изменение любого из этих параметров должно было бы существенным образом влиять на продолжительность активного состояния, которое, несомненно, само по себе зависит от содержания свободного Ca внутри фибрилл.
Соотношение между силой и скоростью
Как видно из фиг. 39, при изотоническом одиночном сокращении мышца укорачивается тем медленнее, чем больше нагрузка. Если довести этот эффект до логического конца и увеличить нагрузку настолько, чтобы она была в точности равна тому полному изометрическому напряжению, которое мышца способна развить, то никакого внешнего укорочения, конечно, вовсе не произойдет. При другом предельном значении нагрузки — нулевом— скорость укорочения должна быть максимальной.
Как видно из кривой / фиг. 41, соотношение между нагрузкой (силой) и установившейся скоростью укорочения имеет вид типичной экспоненциальной зависимости. Оказалось, что экспериментальные данные удовлетворительно описываются двумя уравнениями: гиперболическим уравнением Хилла и экспоненциальным уравнением Обера. Оба они являются эмпирическими уравнениями в том смысле, что их константы нельзя легко выразить через какие-либо реальные параметры мышцы.
Характеристическое уравнение Хилла [67, 70, 71] имеет вид
υ = b(P0 - P)/(P + a),
или
P = (P0 + a)∣(υ/b + 1) - a,
(VI. 1)
где V — скорость укорочения; P — сила (нагрузка); Pq—максимальное изометрическое напряжение, которое может развивать мышца; b — константа, имеющая размерность скорости; а—константа, имеющая размерность силы.
Уравнение Обера [2, 3] имеет вид
P = A ехр (-υ/В) - Fi
V = В ln[A/(P + F)],
(VI. 2)
или
Механика сокращения
149
где Λ(=P0 + Γ) и В — константы, имеющие такую же размерность, как и параметры а и b в уравнении Хилла, a F представляет небольшую внутреннюю «фрикционную» силу, противодействующую укорочению.
Максимальная скорость, соответствующая условию P = O, равна bP0∣a из уравнения Хилла и В In A/F из
Фиг. 41. График, показывающий зависимость скорости укорочения от нагрузки (силы) на различных стадиях изотонического одиночного сокращения (так называемые кривые сила — скорость) [89].
Портняжная мышца лягушки при 0°. Кривая I — для фазы развития напряжения; кривые II-IV — для фазы расслабления (II — через 460 мсек, напряжение составляет 60% максимального; III — через 640 мсек, напряжение 30% максимального; IV — через 830 мсек, напряжение 8% максимального). Ср. фиг. 38-40.
уравнения Обера. Изометрическое напряжение P0 (когда оно неизвестно) определяется как разность A-F в уравнении Обера при условии υ = 0. Найти P0 из уравнения Хилла в явном виде нельзя: имеется лишь довольно сомнительная возможность оценки P0 путем совместного решения трех уравнений для наблюдаемых на опыте значений P и и. Аналогичным образом константу F в уравнении Обера можно найти только путем эмпирической подгонки кривых.
Все приведенные на фиг. 41 кривые были вычислены из уравнения Обера при F = 3 г, В = 1,7 см/сек, но при
150
Глава VI
разных значениях P0, изменяющихся от 44 до 3,5 г. Почему мы поступили таким образом, станет ясно из дальнейшего.
Кривая / соответствует изометрическому напряжению Po = 44 г и представляет собой кривую, которая должна быть получена из прямых изотонических данных, если измерять скорость и на начальном линейном участке соответствующих кривых укорочения при разных нагрузках. Кружочки отвечают экспериментальным данным [89], из которых были вычислены приведенные выше константы. То обстоятельство, что кружочки так хорошо ложатся на кривую, служит убедительным аргументом в пользу применимости уравнения Обера.
Остальные кривые на фиг. 41 приведены с целью показать, что теоретически должно произойти в процессе расслабления после одиночного изометрического сокращения, т. е. при падении напряжения (фиг. 39 и 40), если, изменив нагрузку, внезапно уменьшить напряжение мышцы. Нагрузку необходимо уменьшать в тот момент, когда падающее напряжение как раз достигнет значения, соответствующего пересечению кривой с осью абсцисс (Poi t)∙ За исключением небольших различий в абсолютных значениях скоростей, теоретические кривые почти точно воспроизводят экспериментальные данные [89]. Это свидетельствует о том, что уравнение Обера, а также, возможно, и уравнение Хилла применимы без какого-либо изменения входящих в них констант даже в процессе затухания активного состояния мышцы при ее расслаблении.
Приведенные кривые очень хорошо демонстрируют, что понимается под так называемым «активным» состоянием, а также показывают, что о нем нельзя судить по изменениям длины, происходящим при одиночном изотоническом сокращении под нагрузкой. Например, результаты, приведенные на фиг. 41, свидетельствуют о том, что мышца способна с заметной скоростью сокращаться даже через 830 мсек после удара тока, когда изометрическое напряжение уже упало настолько, что составляет менее 10% максимального значения. В то же время если бы мы полагались только на данные для изотонического одиночного сокращения, приведенные на
Механика сокращения
151
фиг. 39, то нам показалось бы, что даже при самой легкой нагрузке мышца уже полностью расслабилась через 600 мсек и, следовательно, все возможности для ее дальнейшего укорочения исчерпаны. И тем не менее, как мы видим, в мышце все еще имеется заметная активность. К понятию активного состояния мы еще вернемся при обсуждении тетануса.
Значения напряжения, приведенные на фиг. 39 и далее, относятся к мышце определенных размеров. Чтобы иметь возможность сравнивать результаты для разных мышц, удобно выразить напряжение как отношение PIqIМ, где I0 — длина мышцы в состоянии покоя, M — ее вес. Это исключает неопределенность данных, обусловленную различиями в площади поперечного сечения мышцы. При таком определении результаты приводятся как напряжение или нагрузка (г веса) на 1 см2 поперечного сечения. Для портняжной мышцы лягушки значения определенного таким образом напряжения могут варьировать от 1300 до 2100 г/см2\ величина напряжения зависит частично от свежести мышцы, а частично от неизвестных факторов, к которым, возможно, относится возраст животного. В хорошем приближении в качестве среднего значения можно взять величину 1500 г/см2 [3]. В равной степени полезной, хотя и безразмерной величиной является отношение P∣Pq, т. е. отношение нагрузки к изометрическому напряжению.
Упругие элементы, соединенные последовательно с сократительными
Прежде чем перейти к процессу слияния одиночных сокращений, приводящего к тетанусу, нужно рассмотреть упругие свойства сокращающейся мышцы, которые тесно связаны с ее структурой. Обратившись к модели скользящих нитей (фиг. 11), мы увидим, что, как только начинается сокращение, напряжение, развивающееся в мышечном веществе, должно поддерживаться рядами актиновых и миозиновых нитей и Z-пластинками. Едва ли возможно, что эти элементы обладают идеальной жесткостью. В особенности это относится к местам
152
Глава VI
соединения противоположно «поляризованных» актиновых нитей в Z-пластинках и к точкам контакта миозиновых голов с нитями актина, где развивается активное напряжение. Следовательно, в этих областях будет наблюдаться некоторая «податливость». Кроме того, концевые саркомеры каждой фибриллы внутри мышечного волокна должны быть каким-то образом связаны с соединительной тканью сухожилий, и это место также должно быть относительно слабым. Наконец, имеется очень незначительная «податливость» в самих сухожилиях.
Каждая из этих расположенных последовательно компонент дает свой вклад в величину, называемую последовательной упругостью; полный эффект от податливости отдельных элементов называется «последовательной податливостью». Зависимость этой величины от напряжения описана в работе Хилла [68]; следует отметить, что даже при очень большом напряжении в 3000 г/см2, которое получается при растяжении мышцы в условиях тетануса, податливость составляет менее 3% длины покоя. Это значение близко к величине податливости, наблюдаемой у мышцы в состоянии полного окоченения, когда головы многих миозиновых молекул жестко и постоянно прикреплены к мономерам актина в актиновых спиралях [14]. Очень важно не спутать эту очень небольшую податливость, характерную для сокращающейся мышцы, с гораздо большей «податливостью» покоящейся мышцы, которую можно сильно растянуть даже под действием очень легких грузов.
Помимо податливости, обусловленной самой мышцей и ее сухожилиями, в опытах с вырезанной мышцей появляется податливость, связанная с прикреплением мышцы к прибору. Ее можно свести к минимуму, прикрепив мышцу цепочкой. Этот тип податливости в большинстве существующих в настоящее время приборов не превышает 2% длины при максимальном напряжении. Следовательно, в современных установках общая последовательная податливость сокращающейся мышцы составляет величину порядка 5% (в некоторых более ранних экспериментах она была, вероятно, больше 8%).
Растяжение, обусловленное последовательной податливостью, достаточно велико для того, чтобы заметно
Механика сокращения
153
повлиять на результаты точных «изометрических» опытов, так как даже при наиболее благоприятных условиях сами сократительные элементы на ранней фазе сокращения должны укорачиваться на такую же величину, чтобы скомпенсировать податливость. Это основная причина различий в величинах напряжения при одиночном сокращении и при тетанусе. Этот эффект объясняет также очень быстрое начальное укорочение мышцы, происходящее сразу же после быстрого освобождения от изометрических условий в процессе одиночного сокращения [74, 89].
Слияние одиночных сокращений в тетанус
Из формы кривой изометрического одиночного сокращения (фиг. 39) очевидно, что при раздражении мышцы серией ударов, следующих с постоянной частотой, дальнейшие удары будут оказывать на нее разное действие в зависимости от того, на какой участок кривой напряжение — время они попадут. Например, когда портняжную мышцу лягушки при O0 раздражают с большой частотой (около 200 ударов в 1 сек), второй удар, отстоящий от первого на 5 мсек, будет приходиться на абсолютный рефрактерный период потенциала действия (он равен в данном случае 10 мсек) и не вызовет никакой дополнительной механической реакции. При низкой же частоте, равной 2 ударам в 1 сек, второй удар (через 500 мсек после первого) будет поступать тогда, когда фаза расслабления завершится на 2∕3. Мышца отреагирует следующим одиночным сокращением, которое в свою очередь прервется, не завершившись, третьим ударом, и т. д. В результате получается волнистая кривая (фиг. 42, кривая //), каждый горб которой соответствует удару [162].
Если частота раздражения не очень велика и не очень мала, то отдельные одиночные сокращения будут иметь все большую и большую тенденцию к слиянию. У портняжной мышцы при O0 полное слияние наступает при частоте примерно 15 ударов в 1 сек, т. е. когда удары поступают через каждые 67 мсек. В этих условиях напряжение первого одиночного сокращения развивается
154
Глава Vl
примерно до 70% своей максимальной величины. Эффект слияния проявляется в том, что активное напряжение увеличивается в 1,2—1,8 раза по сравнению с максимальным напряжением одиночного сокращения, т. е.
Фиг. 42. Слияние одиночных изометрических сокращений (тетанус) [68, 162].
Кривая I — одиночное сокращение; кривая II — два удара с интервалом через 500 мсек; кривая III — один удар через каждые 67 мсек (15 ударов в 1 сек; обратите внимание на равномерное развитие напряжения и его поддержание); кривая IV — влияние внезапного растяжения, произведенного в ранней стадии одиночного сокращения, на развитие напряжения. Мышца была растянута примерно на 5% от l0 в первые 50 мсек после удара.
составляет 1500-3000 г/см2 (фиг. 42, кривая III). Относительная величина напряжения одиночного сокращения по сравнению с напряжением тетануса варьирует в интервале 0,45-0,90 [162].
При слиянии одиночных сокращений в тетанус напряжение увеличивается потому, что последовательно
Механика сокращения
155
расположенные упругие элементы успевают растянуться под влиянием развивающегося напряжения до максимальной величины (в отличие от того, что происходит при кратковременном одиночном сокращении). Очевидно, что активное состояние полностью устанавливается к концу латентного периода (фиг. 38). Следовательно, если бы мышца к этому моменту могла стать совершенно неупругой, то напряжение могло бы резко возрасти до величины максимального напряжения тетануса с очень небольшим запаздыванием. Однако в действительности развивающееся напряжение вначале растягивает насколько возможно последовательные упругие элементы, увеличивая таким образом их потенциальную энергию. Вследствие этого увеличение напряжения на раннем этапе не может быть зарегистрировано полностью. Это подтверждают опыты, в которых мышцу в первые 50 мсек одиночного сокращения растягивают примерно на 5% от ∕0 [θ8]. В этом случае напряжение резко возрастает до максимального напряжения тетануса (кривая IV на фиг. 42). Другими словами, мы производим работу за мышцу, растягивая ее последовательно расположенные упругие компоненты как раз к тому моменту, когда она достигает состояния полной активности.
В этом смысле можно считать, что кривая IV лучше отражает активное состояние в процессе отдельного одиночного сокращения, чем простая кривая напряжения, особенно в фазе развития. Если воспользоваться таким критерием, то можно считать, что активное состояние начинает затухать уже примерно через 200 мсек после раздражения. Химическим процессом, лежащим в основе такого затухания, почти наверняка является удаление ионов Ca из активных центров актомиозинового комплекса под действием кальциевого насоса, расположенного в триадах саркоплазматического ретикулума (см. гл. IV).
Влияние длины мышцы на напряжение и скорость ускорения
В опытах, которые описывались до сих пор, развивающееся напряжение или изотоническое укорочение измеряли на мышцах, длина которых была близка к длине
156
Глава VI
расслабленной отрезанной мышцы или несколько превосходила ее. Существенно знать, что произойдет с этими двумя параметрами, если раздражение мышцы производить при гораздо больших или меньших длинах, и будут ли результаты соответствовать предсказаниям теории скользящих нитей.
Эксперименты такого типа наиболее удобно проводить на отдельных живых волокнах, так как в этом случае с помощью фазово-контрастной микроскопии можно измерить среднюю длину саркомера на отмеченном участке мышцы и, таким образом, непосредственно сопоставить длину саркомера с величиной развивающегося напряжения или со скоростью укорочения [52]. Опыт ставится следующим образом. Отсекают отдельное волокно, присоединенное к сухожилию на одном конце и к кости на другом, и монтируют его в горизонтальной плексигласовой ванне. Конец, присоединенный к кости, закрепляют жестко, а конец, присоединенный к сухожилию, соединяют с миниатюрным датчиком напряжения. В середине волокна к нему прикрепляют два маркера из золотой фольги. На них направляют луч света, который, отразившись, проходит через линзы микроскопа, а затем перпендикулярно оси волокна в двух направлениях — к системе слежения электроннолучевого осциллографа и к двум фотоэлементам. Импульсы от системы слежения и фотоэлементов подаются на вход сложного усилителя, а от него — на миниатюрный сервомотор, присоединенный к «костному» концу волокна. Благодаря такой системе имеется возможность с помощью подачи импульсов на сервомотор поддерживать расстояние между двумя золотыми листками равным заранее заданной величине, если изучается изометрическое напряжение, или приспособить устройство для слежения за изменениями длины, если изучается изотоническое сокращение [52].
В большинстве описываемых ниже опытов волокно помещали в оксигенированный рингеровский раствор при температуре 0—3° и раздражали его с частотой 20 ударов в 1 сек, вызывая изометрический тетанус; при этом длина саркомеров фиксировалась на заранее заданном уровне. На фиг. 43,/ (сплошная кривая) результаты для волокна из полусухожильной мышцы
Фиг. 43. I — влияние длины саркомера на напряжение, развиваемое отдельными мышечными волокнами (сплошная кривая [52] и точки [42]; пунктирной кривой представлены также результаты для интактной портняжной мышцы [3]); II — схема, показывающая перекрывание миозиновых (толстых) и актиновых (тонких) нитей при разной длине саркомеров [52].
158
Глава Vl
лягушки приведены в виде зависимости относительного напряжения изометрического тетануса от длины саркомера. Для этой мышцы точно известны общая длина актиновых нитей (от одного их конца до Z-пластинки и от Z-пластинки до другого конца) и длина миозиновых нитей (они равны соответственно 2,05 и 1,60 мк). Поэтому для данной длины саркомера можно показать расположение этих нитей относительно друг друга, как это сделано на фиг. 43, II.
Сравнивая фиг. 43, / и II, мы видим, что на кривой длина — напряжение имеются точки, соответствующие пяти критическим значениям длины саркомера: очень большой длине А (3,65 мк), когда развиваемое напряжение равно 0; длинам В и С, близким по величине к длине I0 в расслабленном состоянии, когда напряжение максимально; длине D, при которой начинается перекрывание актиновых нитей от каждой половины саркомера; длине В, при которой Z-пластинки каждой половины саркомера начинают контактировать с концами миозиновой нити, и, наконец, длине F, когда миозиновые нити начинают изгибаться под давлением Z-пластинок, сквозь которые они не могут пройти (развиваемое напряжение снова равно нулю).
Таким образом, очевидно, что перегибы на кривой длина — напряжение непосредственно связаны с критическими значениями длин саркомера при скольжении нитей относительно друг друга. Например, длина саркомера, равная 3,65 мк, настолько велика, что актиновые нити вряд ли контактируют с миозином и, следовательно, напряжение развиться не может. По мере того как саркомерам предоставляется возможность укорачиваться от этой длины до 2,25 мк, напряжение возрастает пропорционально длине саркомера вследствие увеличения числа миозиновых голов, способных прийти в соприкосновение с актином и, таким образом, развить активное напряжение. Дальнейшее укорочение до 2,0 мк не дает никакого эффекта, ибо теперь концы актиновых нитей перемещаются по центральной оголенной части миозиновых нитей, где голов нет (ср. фиг. 43, II). При укорочении саркомера от 2,0 до 1,65 мк напряжение медленно падает до величины, равной 0,85 максимума.
Механика сокращения
159
Это обусловлено в основном увеличивающимся перекрыванием актиновых нитей от каждого саркомера друг с другом, что препятствует образованию связей между миозином и актином. При 1,65 мк достигается критическое значение длины саркомера, при котором Z-пла- стинки как раз упираются в концы миозиновых нитей; начиная с этого значения длины саркомера, напряжение резко падает, так как увеличивается сжатие и изгибание миозиновых нитей. Наконец, при длине в 1,25 мк напряжение становится равным нулю. Эти изящные опыты дают нам самое убедительное из всех возможных подтверждений теории скользящих нитей, тем более что в отличие от более ранних работ в них точно контролировалась длина саркомера в процессе тетануса.
Примерно в то же время, когда были опубликованы рассмотренные выше результаты, в том же самом журнале появились аналогичные данные для полусухожиль- ных волокон лягушки, полученные в другой лаборатории Эдманом [42]. Точки на фиг. 43,/ взяты из этой более поздней работы, и, как можно видеть, они достаточно хорошо ложатся на рассмотренную кривую; небольшие различия, наблюдаемые между результатами двух серий опытов, можно объяснить тем, что в экспериментах Эдмана [42] длина саркомеров контролировалась менее точно. На графике приведены также некоторые результаты, относящиеся к изометрическому напряжению, развиваемому во время тетануса целой портняжной мышцей лягушки (пунктирная кривая) [3]. В этом случае длина саркомера не измерялась, но если допустить, что длине мышцы в расслабленном состоянии соответствует длина саркомера 2,0 мк, то кривая для всей мышцы удивительно хорошо согласуется с кривой для отдельных волокон.
Опыты на отдельных волокнах четко продемонстрировали, кроме того, независимость скорости укорочения при изотоническом одиночном сокращении под небольшой нагрузкой от начальной длины саркомера, если эта длина находится в интервале 2,6—1,65 мк. При меньших длинах, как мы видели, миозиновые нити все сильнее изгибаются из-за давления на них Z-пластинок, и это приводит к резкому уменьшению скорости укорочения.
160
Глава V!
Возникновение этой новой силы, сопротивляющейся укорочению при длинах менее 1,65 мк, означает, что ни измеряемое изометрическое напряжение, ни номинальная нагрузка, прикладываемая к мышце в процессе изотонических опытов, не отражают той истинной силы, какую сами сократительные элементы развивают в этом укороченном состоянии. При таких условиях как в уравнении Хилла, так и в уравнении Обера должна появиться какая-то новая сила, хотя пока еще и не ясно, постоянна ли она или зависит от длины [52].
Работа, производимая при одиночном сокращении и при тетанусе
Из предыдущего раздела очевидно, что производимая в процессе отдельного одиночного сокращения работа (= W = -P∆l) будет зависеть от нагрузки P далеко не линейно, поскольку как степень, так и скорость укорочения (v) сами зависят от нагрузки. Пользуясь уравнением Хилла (VI. 1) для зависимости между скоростью и нагрузкой, мы приходим к выводу, что в ранней фазе одиночного сокращения, когда υ практически постоянна (ср. фиг. 39), укорочение за время t равно υt, а произведенная работа равна Pυt, т. е.
W = Pυt = bPt(P0 - P)∕(P + a). (VI. 3)
Из этого уравнения следует, что зависимость W от P описывается типичной колоколообразной кривой с нулевыми значениями W при P = 0 и P = P0 и максимумом в точке P = √a(P0 + a) - a. «Константа» a, как оказалось, варьирует от 0,25 до 0,4 P0; отсюда следует, что W максимальна, когда P равно 0,31—0,35 от P0 или когда v равна 0,31-0,35 от υмакс. На фиг. 44 (сплошная кривая) приведена предсказываемая этим уравнением зависимость работы, производимой в единицу времени, от нагрузки.
Уравнением (VI.3) нельзя пользоваться для оценки всей работы, производимой при одиночном сокращении, так как оно справедливо в лучшем случае только в ранней линейной фазе укорочения. Особенно это относится
Механика сокращения
161
к случаю больших нагрузок. При одиночных сокращениях под большой нагрузкой скорость укорочения остается постоянной лишь в течение ограниченного промежутка времени, а затем более или менее резко падает до нуля; это видно, в частности, из кривой на фиг. 39, соответ-
Фиг. 44. Зависимость работы, совершаемой в процессе одиночного сокращения, от нагрузки на мышцу (P/P0).
Результаты для одиночных сокращений мышц лягушки и жабы при 0° показаны черными кружками [71]. Светлые кружки и проведенная по ним сплошная линия показывают работу в единицу времени, вычисленную теоретически по уравнению Хилла при отношении a/P0 = 0.3.
ствующей нагрузке 9 г (P∕P0 = 0,75), при которой скорость остается постоянной только в течение 200 мсек. В то же время для случая наименьшей нагрузки в 3 г (соответствующей 0,25 Р/Ро) скорость остается постоянной еще в течение дальнейших 100 мсек, т. е. всего 300 мсек. Таким образом, производимая работа сильно уменьшается при больших нагрузках. Это усугубляется тем обстоятельством, что по мере увеличения нагрузки развитие наблюдаемого укорочения также запаздывает все в большей и
162
Глава Vl
большей степени, так как необходимо некоторое время, для того чтобы сначала растянуть последовательные упругие компоненты. Легче всего показать суммарный эффект от действия всех этих факторов, построив зависимость всей работы, произведенной мышцей, от относительной нагрузки и затем сравнив ее с теоретической кривой для работы, которую мышца совершила бы в единицу времени при установившейся скорости, соответствующей уравнению Хилла. Такое построение произведено на фиг. 44, из которой видно, что при относительных нагрузках P/P0 < 0,40 соответствие оказывается вполне хорошим. При больших же нагрузках из-за влияния указанных выше факторов появляется расхождение, которое по мере возрастания нагрузки становится все больше и больше. Точно измерить внутреннюю работу, совершаемую мышцей при одиночном сокращении, для того чтобы растянуть свои последовательно расположенные упругие элементы, часто бывает довольно трудно. В то же время чем больше нагрузка, тем существеннее вклад этой работы (ср. [24]). Иногда можно оценить ее приблизительно, если точно известна податливость мышцы и тех элементов, с помощью которых она присоединяется к кости; имеется также косвенный способ ее вычисления по запаздыванию в начальной стадии укорочения [69]. По этой причине ни уравнение Хилла, ни уравнение Обера в их простой форме не могут дать точной величины общей работы, производимой под большими нагрузками.
Затруднения, связанные с оценкой суммарной внешней и внутренней работы, производимой мышцей, особенно при больших нагрузках, в значительной степени устраняются, если перейти от изучения одиночного сокращения к изучению тетануса. Это связано с тем, что в тетанусе время не играет столь существенной роли и ранние фазы сокращения теряют свою значимость. Например, портняжная мышца лягушки при нагрузке 0,6 P0 может совершить в процессе одиночного сокращения работу около 40 г • см на 1 г, а при тетанусе продолжительностью 1,3 сек ее работа равна почти 300 г • см. Фактически работа, которая может быть совершена в тетанусе, ограничена лишь тем, что мышца не способна укорачи¬
Механика сокращения
163
ваться до длины менее 0,6 /0 (см. фиг. 43,Б). Изучение тетануса имеет также то преимущество, что оно позволяет установить более точно максимальное значение мощности (поскольку скорость сохраняется постоянной в течение более длительного времени). В этом случае вполне применимы как уравнение Хилла, так и уравнение Обера.
Является ли расслабление активным процессом?
Исходя из гипотезы скользящих нитей, надо думать, что расслабление вряд ли является активным процессом в смысле активного проталкивания микронитей. В опытах с изолированными модельными системами волокон и их пучков, например, всегда необходимо приложить некоторую силу, чтобы растянуть мышцу в условиях, соответствующих расслаблению (или, что то же самое, ингибированию АТФ-азной активности). Однако часто наблюдается, что интактные мышцы, особенно мышцы млекопитающих (например, грудинно-нижнечелюстная мышца быка), спонтанно расслабляются после серии одиночных сокращений или после тетануса даже в том случае, если они положены на пластинку горизонтально. Именно благодаря наблюдениям такого типа в прошлом сложилось твердое мнение, что расслабление является активным процессом в упомянутом выше смысле.
Помимо данных для модельных систем, имеются два других типа доводов, свидетельствующих против идеи о том, что расслабление протекает «активно». Во-первых, мышцы, для которых в заметной степени наблюдается спонтанное расслабление, всегда содержат большое количество соединительных тканей. К ним относится, в частности, и грудинно-нижнечелюстная мышца, о которой говорилось выше. Она содержит 10% коллагена в расчете на сухой вес. В то же время, если портняжную мышцу лягушки, в которой соединительной ткани гораздо меньше, укоротить с помощью серии одиночных сокращений даже очень сильно, она будет вновь удлиняться только под действием силы, приложенной извне (хотя эта сила и не должна быть очень большой) [69, 71]. Однако даже эта мышца, если ее поместить в
164
Глава Vl
рингеровский раствор, стремится вытянуться под действием соединительной ткани. Это показывает, что «сила», вызывающая спонтанное расслабление, целиком обусловлена внефибриллярной соединительной тканью, которая скручивается в пружиноподобную структуру при активном укорочении мышцы и затем снова раскручивается, когда развитое сократительными нитями активное напряжение исчезает. Другим аргументом против активного участия сократительных нитей в расслаблении служат данные, полученные при изучении отдельных живых волокон. C волокна можно снять сарколемму и затем заставить его сократиться путем инъекции очень малого количества ионов Ca [124]. Такие волокна не способны расслабляться спонтанно, хотя их легко можно вытянуть снова до первоначальной длины, как только пройдет достаточно времени, для того чтобы саркоплазматический ретикулум смог выкачать все введенные ионы Ca2+.
Напряжение покоя
Помимо активного напряжения, развиваемого мышцей при раздражении, у нее имеется напряжение покоя (Pr), постепенно возрастающее по мере того, как ее растягивают до длины, большей Z0. Это напряжение покоя экспоненциально зависит от длины и определяется уравнением
Pr = kel/cl0
или
l∕l0 = с(lnPr - lnk).
(VI. 4)
Величины констант c и k в этом уравнении таковы, что напряжение покоя увеличивается примерно от нуля при l0 до значения, равного всего 3% полного активного изометрического напряжения, при l = 1,25l0 [69]. При больших длинах напряжение покоя быстро увеличивается и его зависимость от длины вскоре перестает описываться этим уравнением. При крайних условиях, т. е. при длине l = 1,65l0, когда актиновые нити выдвинуты настолько, что они уже почти не контактируют с миозиновыми, напряжение покоя возрастает в такой степени, что
Механика сокращения
165
оно превышает активное напряжение мышцы, развиваемое ею при l = l0, т. е. становится больше 1500 г/см2 или около того. Типичные кривые напряжение — растяжение для мышц лягушки и кролика приведены на фиг. 45. Увеличивающаяся сопротивляемость покоящейся мышцы
Фиг. 45. Зависимость напряжения покоя мышцы от ее относительной длины (l/l0).
I — портняжная мышца лягушки в состоянии покоя; II и III — поясничная мышца кролика в состоянии покоя и в состоянии окоченения ([69] и данные автора); IV — изменения pH при растяжении портняжной мышцы лягушки [32].
растяжению до больших длин обусловлена упругими элементами, расположенными параллельно сократительным нитям; сами нити, как мы видели, почти не оказывают сопротивления в состоянии покоя [69, 124].
Параллельные упругие элементы бывают двух типов: 1) элементы, расположенные внутри волокна (главным образом пузырьки саркоплазматического ретикулума). и 2) элементы тонких волокон соединительной ткани
166
Г лава VI
сарколеммы и более толстой соединительной ткани, окружающей пучки волокон (пери- и эпимизиум; фиг. 5). Путем осторожного отделения сарколеммы от живых волокон можно показать, что при длинах мышцы от Zo до 1,3 /о лишь очень небольшая часть напряжения покоя может быть обусловлена этой структурой и даже более крупной соединительной тканью. В этом интервале длин напряжение в основном должно приходиться, по-видимому, на трубочки саркоплазматического ретикулума, если только не предполагать, что действительно существует миофибриллин [54] или какой-то другой очень упругий белок, соединяющий концы актиновых нитей каждой половины саркомера. Такой связывающий белок, поскольку его так долго не удается обнаружить с помощью электронного микроскопа, должен был бы иметь крайне низкую плотность, очень близкую по величине к плотности резилина летательных мышц насекомых [170].
При длинах более 1,3 Z0 увеличение напряжения покоя объяснить нетрудно. Оно наверняка возникает главным образом благодаря сарколемме, а также коллагеновой соединительной ткани пери- и эпимизиума. Это доказывается тепловыми изменениями, происходящими при растяжении. При удлинении до 1,30 Z0 мышца обладает резиноподобной упругостью, поэтому при ее растяжении выделяется тепло, а когда ей предоставляется возможность пассивно укоротиться до прежней длины, она поглощает тепло. Такие тепловые эффекты обусловлены уменьшением конфигурационной энтропии (AS) при растяжении, которое приводит к освобождению тепла в количестве, равном —TAS. Другими словами, при растяжении упорядоченность молекул возрастает, а при снятии нагрузки — падает. При длинах более 1,3 Z0 тепловой эффект меняет свой знак и, наконец, начиная с длины, равной примерно 1,4 Z0, мышца при дальнейшем растяжении поглощает тепло. Эти изменения подобны небольшому термоупругому эффекту [165], обнаруженному при растяжении сокращающейся мышцы, и возникают, по- видимому, вследствие растяжения жесткой спиральной структуры белков типа коллагена.
Кривые напряжение—растяжение для покоящейся мышцы имеют две другие важные особенности: 1) при¬
Механика сокращения
167
ложение внешней нагрузки вначале приводит к быстрому растяжению мышцы, которое затем замедляется («ползучесть»), или если измеряется напряжение, то за быстрым первоначальным увеличением напряжения следует его уменьшение до некоторой постоянной величины; 2) на кривой, построенной при растяжении мышцы, каждой длине отвечают большие значения напряжения, чем на кривой, соответствующей обратному процессу укорочения мышцы (гистерезис). Для начального участка кривой напряжение — растяжение, когда основными элементами, деформирующимися под напряжением, являются, вероятно, нерегулярно расположенные продольные пузырьки и трубочки саркоплазматического ретикулума, обе эти особенности не кажутся неожиданными. Вязкость саркоплазматической жидкости, внутри которой должны скользить нити актина и миозина при их движении вперед и назад в процессе деформации, также должна давать свой вклад в эту так называемую «демпфированную» упругость.
Другое интересное явление — это возрастание pH при растяжении покоящейся мышцы [32]. Его можно измерить с помощью расположенных на поверхности мышцы стеклянных электродов. На фиг. 45 приведена соответствующая кривая для портняжной мышцы лягушки. Окончательно объяснить это явление пока еще не удалось, но возможно, что оно связано с растяжением саркоплазматического ретикулума, вследствие которого изменяется осмотическое давление, что приводит к перемещению воды и ионов.
ГЛАВА VII
ЭНЕРГЕТИКА СОКРАЩЕНИЯ
Предмет энергетики охватывает весь спектр изменений энергии в мышце, начиная от прихода потенциала действия к областям триад и выделения ионов Ca в саркоплазму и кончая расщеплением АТФ в активных центрах на актиновых и миозиновых нитях с последующим превращением выделяемой при этом химической энергии в работу или в напряжение. Для простоты мы рассмотрим только начальную активацию посредством освобождения Ca и конечный результат — совершение работы, развитие напряжения и выделение тепла. В следующей главе мы вернемся к тем затруднениям и спорным моментам, которые возникают при рассмотрении вопроса о превращениях энергии. Таким образом, наша основная задача заключается в том, чтобы установить связь между наблюдаемым выделением тепла и произведенной работой или развитым напряжением.
Когда мышца сокращается в изотонических условиях и совершает работу поднятия груза, одновременно освобождается определенное количество теплоты. Тепло выделяется также при сокращении в изометрических условиях, когда сократительные нити производят лишь ничтожную работу, необходимую для растяжения соединенных с ними последовательно упругих элементов (в том числе и элементов присоединения мышцы к записывающему рычагу). Даже после того, как эти упругие элементы полностью растянутся (при сохранении изометрических условий), актиновые нити продолжают непрерывно двигаться вперед и назад относительно активных миозиновых голов. Это движение было образно описано как своего рода дрожание [31]. В процессе такого дрожания то небольшое количество работы, которое производится мышцей в фазе укорочения каждого миниатюрного
Энергетика сокращения
169
цикла, компенсируется работой, совершаемой во время фазы удлинения, и, следовательно, оно не проявляется в общем энергетическом балансе.
На более поздней стадии — расслаблении после изотонического сокращения — груз опускается и мышца растягивается, по мере того как вследствие удаления ионов Ca затухает активное состояние. При изометрическом же сокращении удлинение в процессе расслабления является преимущественно внутренним процессом — растянутые упругие элементы укорачиваются и вновь растягивают расслабленные сократительные нити. В обоих случаях при расслаблении работа меняет знак: ее теперь совершает над мышцей опускающийся груз или укорачивающиеся упругие элементы. Эта «отрицательная» работа целиком рассеивается в виде тепла, небольшая часть которого выделяется при ударе груза о фиксатор, а остальная выделяется в самой мышце. Эта последняя, большая часть тепла может быть зарегистрирована термоэлемент том.
Первый закон термодинамики
Все эти превращения энергии подчиняются первому закону термодинамики, который гласит, что общая энергия системы и ее окружения должна оставаться постоянной. В ином виде этот закон может быть сформулирован следующим образом: всякий раз, когда исчезает некоторое количество одной формы энергии, должно производиться точно такое же количество другой формы энергии [51, 163]. Для наших целей первый закон можно выразить очень просто, так как мышца представляет собой систему, объем которой остается практически постоянным даже в активном состоянии, и поэтому ее внутренняя энергия по существу эквивалентна энтальпии или теплосодержанию. Мы будем обозначать внутреннюю энергию через Е, чтобы четко отличать ее от выделяемого тепла. Многие предпочитают обозначать ее через H, однако в данном контексте это привело бы лишь к путанице. Таким образом,
-ΔE = W - Q, (VII. 1)
170
Глава VlJ
где W— совершенная мышцей работа, а (—Q)—выделенное тепло.
В таком виде первый закон выражает тот факт, что, когда мышца совершает работу W, она выделяет тепло
— Qh теряет пропорциональное количество внутренней энергии. Заметим, что мы можем говорить лишь об изменениях внутренней энергии, а не об ее абсолютной величине, которая неизвестна, но очень велика. Другое понятие, которое можно ввести на этой стадии, это так называемая механическая эффективность, которая определяется отношением —W∣ΔE.
Природа одиночного сокращения и тетануса мышцы такова, что, имея в своем распоряжении усовершенствованную аппаратуру для тепловых измерений, можно разбить величину —Q на ряд компонент [71, 72]. Так, можно заметить очень быстрое выделение тепла на ранней стадии сокращения, когда еще отсутствуют какие- либо признаки развития напряжения или наблюдаемого укорочения [73, 74]. По-видимому, эта теплота появляется во время процесса активации, т. е. при освобождении ионов Ca из триад и последующем их присоединении к активным центрам актина и миозина. Эту теплоту мы будем называть здесь теплотой активации и обозначать через —Д'. Далее, по мере того как мышца начинает сокращаться и производить работу, происходит дальнейшее выделение тепла, ибо процесс превращения химической энергии в механическую не является идеальным. Эту теплоту мы будем называть теплотой сокращения
— Qc. Наконец, тепло будет выделяться в процессе расслабления, главным образом вследствие деградации работы; возможно, однако, что в результате химических реакций, обратных тем, которые происходят при сокращении, также возникают небольшие тепловые изменения. Эту последнюю, «химическую» часть теплоты расслабления, которую довольно трудно отделить от других частей, мы обозначим ± Qr (ее знак может быть положительным или отрицательным). Общий поток энергии в процессе сокращения можно, следовательно, записать в следующем виде:
-ΔE = -A' - Qc + W + Qr. (VII.2)
Энергетика сокращения
171
Отметим, что Qc всегда входит в это выражение со знаком минус, т. е. в фазе сокращения тепло всегда выделяется. Знак Qr, как мы заметили выше, к сожалению, еще не известен.
Из уравнения (VII.2) можно сделать следующий вывод: если при одиночном сокращении или тетанусе выделение тепла измеряется только во время фазы сокращения, то выделенное тепло равно —А'—Qc, а общий поток энергии равен —A'—Qc + W∖ если же измерять выделение тепла вплоть до окончания процесса расслабления при опускающемся грузе, то общее количество выделенного тепла примерно равно общему потоку энергии, т. е. сумме всех членов в правой части уравнения. Это происходит из-за того, что при опускании груза вся произведенная мышцей работа совершается вновь, но с обратным знаком и, таким образом, появляется в виде теплоты. Большая часть ее может быть зарегистрирована. При другом способе изучения расслабления груз, поднятый сокращающейся мышцей, задерживают наверху, так что он не может снова вытянуть мышцу. В этом случае произведенная мышцей работа не превращается в тепло, и поэтому часто кажется, что тепловые эффекты полностью прекращаются в конце фазы развития, хотя в это время иногда наблюдается небольшое поглощение тепла. Легко можно видеть, что и при этих условиях уравнение (VII.2) все еще приблизительно выполняется [24, 71, 163].
Крайне важно, чтобы читатель, прежде чем перейти к дальнейшему, понял основную особенность одиночного сокращения или кратковременного тетануса. Она состоит в том, что первичный процесс расщепления АТФ и более или менее быстрый ресинтез его из креатинфосфата (КФ) являются главными химическими процессами, обеспечивающими систему энергией в фазах сокращения и расслабления. Ресинтез АТФ и КФ при гликолитическом цикле в анаэробных условиях или при окислительном рефосфорилировании в аэробных условиях происходит гораздо позже, и теплота, выделяемая в тех или иных количествах в результате этих процессов, появляется через несколько сотен миллисекунд после завершения расслабления. Единственно, что необходимо
172
Глава VlI
для сократительных нитей непосредственно в фазе расслабления,— это присутствие достаточного количества АТФ, действующего как пластификатор.
Тепловые измерения
За многие годы методика тепловых измерений в мышце была настолько усовершенствована, что ее существенное улучшение вряд ли возможно, поскольку дальнейшее повышение точности ограничивают свойства самого материала. Для таких измерений применяют микротермоэлемент, помещаемый обычно между двумя мышцами, взятыми у одного и того же животного (фиг. 46) [70, 71]. Сам термоэлемент, сделанный примерно из 40 термопар константан — хромель, имеет толщину около 12 мк и защищен слоем слюды и бакелита общей толщиной 33 мк (фиг. 46, А). Он помещается внутри латунных фланцев в мышечной камере (вид с торца показан на фиг. 46, Б); все устройство в продольном разрезе изображено на фиг. 46, В. Мышцы помещают с обеих сторон прорези 1 и соединяют с цепью 5 и рычагом. Раздражающие электроды 6 расположены на концах камеры. Наиболее существенная особенность термоэлемента — наличие трех изолированных холостых термопар (9) на фиксированном конце мышцы и 20 холостых термопар (S) на ее конце, присоединенном к цепи. Благодаря этому при сокращении мышцы только те ее части могут попасть со стороны нити 4 в область измерительных термопар, которые находятся в тех же тепловых условиях, что и части, расположенные в центре. Если бы такие холостые термопары отсутствовали, то более нагретые части мышцы, перемещающиеся из области вне камеры, приходили бы в контакт с активными термопарами и создавали бы артефакты. Образованный термопарами ток записывается на специально приспособленном гальванометре и в конечном счете подается на электроннолучевой осциллограф. Дальнейшее усовершенствование методики заключается в том, что в цепь усилителя включают автоматическую дифференцирующую систему, позволяющую измерять не интегральную теплоту —Q, а скорость ее изменения —dQJdt. Дальнейшие детали устройства
Энергетика сокращения
173
аппаратуры описаны в работах Обера [3] и Хилла [70, 71]. Обычно мышцу перед началом измерений помещают на некоторое время в оксигенированный рингеровский
Фиг. 46. Термоэлемент для измерения выделяемого мышцей тепла [70, 71].
А — вид несмонтированного элемента с торца (а) и сбоку (б); Б — вид собранного элемента с торца (горячие спаи расположены в середине прорези 1); В — общий вид прибора с двумя мышцами 2, прикрепленными в точке 3 и соединенными нитью 4 и цепочкой 5 с записывающим рычагом; 6 — раздражающие электроды; Г — расположенная в прорези часть элемента в увеличенном масштабе; 7 — 42 изолированные термопары, защищенные справа (8) двадцатью и слева (9) тремя холостыми изолированными термопарами.
раствор. Затем основную массу этого раствора удаляют, и на мышце, находящейся в контакте с термоэлементом, остается лишь прилипшая поверхностная пленка раствора.
Большая часть тепловых измерений, о которых пойдет речь, была выполнена на портняжных мышцах
174
Глава VIl
лягушки весом около 0,08 г, длиной около 3,2 см и толщиной около 0,035 см. Осложнения, возникающие из-за наличия теплоизоляционных слоев на самой мышце, а также общие вопросы, связанные с тепловыми потерями и инерционностью гальванометра, подробно рассмотрены в работах Хилла [70, 71]. Само собой разумеется, что для всех кривых, обсуждаемых в этой книге, были сделаны соответствующие поправки и, таким образом, возможные ошибки, обусловленные артефактами, были сведены к минимуму. О требуемой точности измерений можно судить по тому, что суммарные температурные изменения при сокращении редко превышают 3∙ 10^3 0C.
Теплота, выделяющаяся на ранней стадии изометрического одиночного сокращения
Как мы видели, первым механическим изменением в мышце, возникающим под влиянием потенциала действия, является небольшой спад напряжения (так называемое скрытое расслабление), совпадающий по времени с переходом кальция из триад в саркоплазму. Большое количество тепловых измерений, выполненных на мышцах лягушки, жабы и черепахи, свидетельствует о том, что именно в конце периода скрытого расслабления наблюдается первое заметное выделение тепла, причем с большой скоростью [67, 71—73], и это происходит до развития какого-либо положительного напряжения. Ввиду трудности введения точной поправки на инерционность гальванометра и на запаздывание, обусловленное наличием тонкого изоляционного слоя снаружи мышцы, в течение первых 10—20 мсек одиночного сокращения невозможно точно определить момент, в который начинает выделяться тепло. Общие закономерности можно видеть из приведенных в табл. 5 результатов для ряда различных мышц. Первые тепловые изменения обнаруживаются во время фазы скрытого механического расслабления (когда она развилась примерно на 1∕3—1∕2), т. е. до начала развития положительного напряжения, и быстро достигают своей максимальной скорости. Еще до того, как можно обнаружить развитие положительного напряжения, скорость выделения тепла уже начи¬
Энергетика сокращения
175
нает уменьшаться и к тому времени, когда развивается напряжение, равное половине максимального, падает до величины, меньшей половины максимальной.
Таблица 5
Выделение тепла на ранней стадии одиночных изометрических сокращений при 0° [61, 71-73, 165]
Мышца
Теплота
Интервал времени до момента развития напряжения, мсек
интервал времени от момента раздражения до начала выделения тепла, мсек
начальная скорость, мкал/(г∙сек)
скорость при напряжении, равном половине максимального, мкал/(г∙сек)Портняжная (лягушка)
8-10
35,0
<10,0
23
Портняжная (жаба)
обычный рингеровский раствор [R]1)
15
17,0
<7,0
40
1,86∙[R]
27
17,0
—
70
2,28∙[R]
30
14,0
—
150
Подвздошно-берцовая (черепаха)
60
4,0
<1,0
90
1) [R] означает концентрацию солей в обычном рингеровском растворе.
На основании данных, приведенных в литературе [72, 90] для портняжной мышцы жабы, можно сопоставить количество выделившегося тепла с выделением ионов Ca в саркоплазму. После учета различий в температурах, при которых производились опыты, получаются результаты, показанные на фиг. 47. Можно видеть, что освобождение Ca, по-видимому, предшествует даже тепловым изменениям, хотя их наиболее быстрая фаза наблюдается гораздо раньше, чем достигается максимум на кривой для Ca. Ввиду неопределенности данных в первые миллисекунды после раздражения делать далеко идущие выводы из этих кривых не следует, но по крайней мере можно считать вероятным, что быстрое
176
Глава VlI
выделение тепла на ранней стадии непосредственно связано с процессом освобождения Ca. Мы вернемся к этому вопросу, когда будем более подробно рассматривать химические изменения в мышце.
Из табл. 5 можно видеть другую интересную особенность, связанную с выделением тепла на ранней стадии
Фиг. 47. Временная зависимость освобождения ионов Ca, выделения тепла и развития напряжения на очень ранних стадиях одиночного сокращения портняжной мышцы лягушки при 0° [72, 73, 90].
Максимальное напряжение равнялось 1200 г/см2, а количество выделенного тепла в пике одиночного сокращения — 3,0 мкал/г.
сокращения: повышение концентрации солей в омывающем мышцу рингеровском растворе приводит к тому, что выделение начинается позже и прогрессирует медленнее. Еще сильнее влияет это на развитие напряжения: оно не только начинается позже, но и достигает меньшей величины. Фактически при повышении концентрации солей в 2,8 раза по сравнению с обычной напряжение в портняжной мышце жабы не развивается вовсе, но тепло
Энергетика сокращения
177
на ранней стадии выделяется, по-видимому, в вполне нормальных количествах [73, 74].
Описанным выше методом можно оценить величину тех тепловых изменений на ранней стадии сокращения, которые мы приписали не химическим процессам в прямом смысле, а освобождению ионов Ca из триад. Для портняжной мышцы жабы они равны 0,6—0,8 мкал/г, тогда как общее количество тепла, выделяемое при нормальном изометрическом одиночном сокращении, составляет около 3 мкал/г. Аналогичные результаты получены гораздо менее прямыми методами [71]. Совсем недавно с помощью наложения двух одиночных сокращений было получено значение 1,2 мкал/г', однако для него наблюдается большое стандартное отклонение, и для многих отдельных измерений тепловые изменения лежат в интервале 0,8—0,9 мкал/г [50]. Следовательно, наилучшее среднее значение равно примерно 1,0 мкал/г.
Теплота, выделяющаяся на более поздних стадиях изометрического одиночного сокращения
Как мы видели из табл. 5 и фиг. 47, после ранних стадий сокращения скорость выделения тепла при изометрическом одиночном сокращении быстро уменьшается. На фиг. 48 показана величина тепловых изменений в процессе полного одиночного сокращения полуперепон- чатой мышцы жабы [71]. В данном случае дифференциальная кривая (—dQ∕dt) была вычислена через небольшие временные интервалы из интегральной кривой, которая приводится в той же работе [71].
Существенная особенность фиг. 48 состоит прежде всего в том, что скорость выделения тепла очень быстро уменьшается от начальной величины, равной около 19 мкал/сек/г (на графике не показано), до значения, примерно равного 1 мкал/сек/г, которого она достигает к тому времени, когда напряжение развивается до своей максимальной величины (через 1000 мсек после раздражения). За этой фазой следует плато, продолжающееся в течение 300 мсек, во время которого начинается расслабление. Однако через 1400 мсек, т. е. в то время когда расслабление в полном разгаре, наблюдается новый
Фиг. 48. Скорость выделения тепла (-dQ∕dt) при изометрическом одиночном сокращении полуперепончатой мышцы жабы при 0° [71].
А — зависимость -dQ/dt от времени. Для сравнения приведена кривая развития напряжения; Б — зависимость -dQ/dt от напряжения в фазе расслабления. Пунктирными линиями на обоих графиках изображены те скорости, которые наблюдались бы при идеальном одиночном сокращении, т. е. в отсутствие растяжения последовательно расположенных упругих компонент.
Энергетика сокращения
179
внезапный скачок скорости выделения тепла до нового максимума, а затем, по мере того как расслабление завершается, она постепенно падает до нуля. Этот скачок особенно хорошо виден на кривой зависимости —dQ∣dt от напряжения в фазе расслабления (фиг. 48, Б). Почти нет сомнений в том, что этот внезапный скачок обусловлен деградацией в тепло той внутренней работы, которую мышца затратила на растяжение последовательно расположенных упругих элементов и соединений с рычагом (см. уравнение VII.2). Иными словами, потенциальная энергия, запасенная упругими элементами в процессе сокращения мышцы, освобождается в виде тепла, когда они спонтанно укорачиваются во время расслабления вследствие того, что напряжение в них уменьшается. Следовательно, это выделившееся тепло не связано непосредственно с процессами метаболизма, а имеет целиком механическое происхождение.
Возвращаясь к концепции активного состояния, мы можем констатировать, что если принять во внимание «механический» скачок теплопродукции во время расслабления, то зависимость скорости выделения тепла от времени, изображенная на фиг. 48, А, может служить довольно хорошей мерой этого состояния. Это еще раз демонстрирует переходный характер полностью активного состояния в процессе одиночного сокращения (ср. с кривой IV на фиг. 42, где показаны механические изменения).
Изометрический тетанус
Мы уже видели из механических данных (фиг. 42 и далее), что изометрический тетанус очень сходен с изометрическим одиночным сокращением на его ранней стадии, однако позднее появляются различия, обусловленные влиянием временного фактора, который способствует развитию большего напряжения в случае тетануса. Другими словами, благодаря повторному раздражению активное состояние поддерживается на максимальном уровне. Следовательно, в обоих случаях выделение тепла на ранних стадиях должно было бы нарастать примерно одинаково быстро. В действительности так оно и
180
Глава Vll
происходит [3, 67]. Однако даже в этом случае, несмотря на непрерывное раздражение, выделение тепла очень сильно замедляется в течение нескольких первых секунд тетануса и для портняжной мышцы лягушки при 0° примерно через 7 сек наблюдается плато (для мышцы жабы это происходит примерно через 14 сек). В это время скорость выделения тепла имеет величину 3—4 мкал/сек, которую можно сравнить с начальным значением, превышающим 35 мкал/сек!г (ср. табл. 5 и работы [3, 165]). Для сопоставления с данными, относящимися к одиночному сокращению мышцы жабы, приведенными на фиг. 48, А, заметим, что установившаяся скорость тепловыделения при тетанусе мышцы жабы равна 1,5— 2 мкал/сек/г.
Уменьшение скорости выделения тепла можно описать следующим экспоненциальным уравнением Обера [3]:
-dQ/dt = hAexp(-αt) + hB, (VII. 3)
где a — константа, a hA и hB— «лабильная» и постоянная составляющие скорости выделения тепла.
Для портняжной мышцы лягушки при O0 типичные значения параметров hA и Iib равны соответственно 5,3 и 3,9 мкал/сек/г. Этим значениям отвечает начальная скорость, равная 9,2 мкал/сек/г (= hA + hB), т. е. величине, составляющей всего 1∕4 истинной начальной скорости. Константа a имеет величину порядка 0,74 ceκ~λ (l∕<z = = 1,35 сек).
Уравнение Обера, хотя оно и является эмпирическим в том смысле, что предсказываемая им начальная скорость слишком мала, пригодно для описания процесса выделения тепла при длительном тетанусе и дает возможность оценить влияние начальной длины мышцы на этот процесс.
Влияние длины мышцы на выделение тепла
Мы видели, что начальная длина мышцы заметно влияет на то напряжение, которое она может развить (фиг. 43). Максимальное напряжение развивается при длине саркомера 2,2 мк> когда актиновые нити каждой
Энергетика сокращения
181
половины саркомера почти соприкасаются в центре A-диска и, следовательно, контактируют с максимально возможным числом голов миозина. При больших длинах напряжение падает, так как все меньшее и меньшее количество актина находится в контакте с миозином. Наконец, при длине примерно 3,65 мк актин вытягивается
Фиг. 49. Влияние относительной длины мышцы (l∕l0) на напряжение (P0) и скорость выделения тепла (hA и hB) при длительном тетанусе портняжной мышцы лягушки при 0°.
Значения взяты из табл. XVI работы Обера [3].
настолько, что совсем не контактирует с миозином, и напряжение падает до нуля. Как видно из фиг. 49, для правой части кривой длина — напряжение постоянная составляющая скорости выделения тепла (hB) уменьшается так же, как напряжение, а «лабильная» составляющая (hA) изменяется гораздо медленнее [3].
При длинах, меньших l0, как hA, так и hB уменьшаются по мере убывания длины мышцы гораздо
182
Глава VII
медленнее, чем напряжение [3]. Именно при таких изменениях длины мышцы происходит все большее и большее перекрывание актиновых нитей противоположных половин саркомера, пока наконец A-диски не начнут сжиматься Z-пластинками [52]. Отношение hAlhB, соответствующее этой части графика, независимо от длины мышцы остается почти постоянным. Даже при таких небольших длинах, при которых напряжение падает до нуля, скорость выделения тепла все еще составляет более 50% максимальной.
Почему начальная длина мышцы влияет на скорость выделения тепла, в точности еще не выяснено. Можно думать, что постоянная составляющая скорости hB связана с поддержанием напряжения, т. е. появляется в результате взаимодействия актиновых и миозиновых нитей, поскольку при больших длинах, когда эти нити вытянуты настолько, что между ними нет контакта, она падает почти до нуля. Наоборот, при небольших значениях длина мышцы влияет на hB не так сильно, как на напряжение. Это, по-видимому, обусловлено тем, что при таких очень малых длинах взаимодействие между актином и миозином все еще может осуществляться и приводить к выделению теплоты, тогда как напряжение не может развиваться из-за того, что нити миозина оказывают механическое сопротивление их сжатию Z-пластинками. В связи с этим мы можем провести аналогию с расщеплением АТФ суспензиями миофибрилл, которое рассматривалось в гл. II. Через 1—2 сек после добавки АТФ фибриллы очень сильно сокращаются, и тем не менее они способны расщеплять АТФ с большой скоростью в течение длительного времени после того, как сокращение закончилось. Аналогия становится еще более реалистичной, если учесть, что при расщеплении АТФ миофибриллами лягушки при IO0 в течение первых 10 сек может выделиться около 1,7 мкал/сек на 1 г мышцы (при этом мы принимаем, что гидролиз 1 моль АТФ освобождает 10 ккал энергии; ср. табл. 2). Средняя скорость выделения теплоты за 10 сек в изометрическом тетанусе живой мышцы при очень небольших длинах равна 1,8 мкал!сек!г [3].
Энергетика сокращения
183
Альтернативная гипотеза, объясняющая причину появления постоянной составляющей скорости выделения тепла hB при тетанусе, заключается в том, что эта составляющая возникает в результате спорадического освобождения ионов Ca из триад и обратного процесса активного перекачивания этих ионов в противоположном направлении. Но если это действительно так, то очень трудно понять, почему длина мышцы должна так сильно влиять на Лв, особенно при значениях Z∕Z0, сильно отличающихся от единицы [134]. C другой стороны, эта гипотеза, основанная на действии насоса, могла бы объяснить влияние длины мышцы на «лабильную» составляющую скорости Лд, которое далеко не столь сильно. Можно было бы думать, что эта составляющая скорости, которая отражает истинную начальную скорость освобождения тепла, но не служит ее точной мерой, характеризует последействие процесса активации, который включает освобождение Ca из триад. Однако из-за отсутствия решающих экспериментов нет смысла продолжать обсуждение этого вопроса.
Изотонический тетанус и теплота укорочения
В только что описанных опытах по изометрическому сокращению величина укорочения не превышала 7% /0; это та незначительная величина, которая необходима для растяжения последовательных упругих элементов. Теплоту, специфическим образом связанную с этим укорочением, очень трудно заметить на фоне больших потоков энергии из других источников. Следовательно, для того чтобы установить, действительно ли при укорочении мышцы освобождается дополнительное количество теплоты, необходимо обратиться к опытам по изотоническому сокращению, где можно точно контролировать степень укорочения.
В опытах простейшего типа по изотоническому сокращению мышцу приводят в состояние тетануса и позволяют ей изометрически сокращаться в течение небольшого отрезка времени. Затем ее внезапно освобождают, так что она сокращается до некоторой заранее заданной длины [3, 67, 74]. Такие опыты показывают,
184
Глава VIl
что помимо «изометрического» тепла всегда выделяется некоторое дополнительное количество теплоты, причем временная зависимость освобождения этой «сверхтеплоты» очень сходна с временной зависимостью укорочения.
Фиг. 50. Тепловые эффекты в опытах с освобождением мышцы от изометрических ограничений при тетанусе.
P0 = 2000 г/см2; портняжная мышца лягушки при 0°. Мышца освобождалась через 0,4 сек после раздражения (показано стрелкой, направленной вверх). 1 — при нагрузке 0,05P0 = 100 г/см2; 2 — при нагрузке 0,50P0 = 1000 г/см2. Окончание укорочения показано стрелкой, направленной вниз. Вычислено по данным работы Хилла [67].
Результаты типичных опытов такого рода показаны на фиг. 50. В данном случае мышца находилась в состоянии тетануса в течение 400 мсек, а затем ей позволяли внезапно укоротиться от длины 1,1 Iq до 0,9 Z0, т. е. всего на 0,2 Z0. В опыте 1 к мышце прикладывалась малая нагрузка, равная 0,05 Pq (= 100 e∣CM2)i а в опыте 2 мышца
Энергетика сокращения
185
укорачивалась под нагрузкой в 10 раз большей (1000 г/см2). Несмотря на то что в первом опыте укорочение происходило гораздо быстрее, чем во втором, в обоих случаях оно сопровождалось выделением дополнительного к изометрическому количества тепла, изменяющегося во времени так же, как и укорочение. Однако, как только мышца укорачивалась до заранее заданной длины, наклон кривой, характеризующей выделение тепла, резко уменьшался и снова становился равным наклону, соответствующему изометрическим условиям. Другими словами, дополнительное выделение теплоты заканчивалось, как только прекращалось укорочение.
Удивительная особенность кривых на фиг. 50 состоит в том, что при сокращении под более тяжелой нагрузкой выделяется больше «сверхтеплоты» (кривая 2), чем при более легкой нагрузке (кривая /), хотя степень укорочения в обоих случаях была одинаковой. Зависимость этого эффекта от величины нагрузки можно приблизительно выразить следующим образом [67, 74]:
-Qs=-(⅛1p0±⅛2jp)A/, (VII. 4)
где (—Qs)—дополнительная теплота, освобождаемая при укорочении на величину А/ под нагрузкой P г/см2, a Pq- изометрическое напряжение, развиваемое мышцей.
Ввиду того что нагрузка определяет скорость, с которой мышца укорачивается [ср. уравнение Хилла (VLl) или уравнение Обера (VI.2)], количество дополнительной теплоты, приходящееся на 1 см укорочения, также зависит от его скорости. Оно мало при больших скоростях и быстро увеличивается по мере уменьшения скорости.
Константы ⅛1 и ⅛2 в уравнении (VII.4) безразмерны. Если добавочную теплоту выразить в мкал/г, то их средние значения равны 3,75 ∙ IO-3 и 4,2 ∙ IO-3. Вариабельность обеих констант составляет ±30%, поэтому в правой части уравнения (VII. 4) без существенной потери в точности можно написать ⅛(P0 + ^P), где среднее значение k равно 4-IO"3. Обсуждение этих величин, а также описание того, как были получены кривые, приведенные на фиг. 50, см. в работе Хилла [74].
186
Глава VII
Если мы хотим вычислить общую скорость выделения теплоты и энергии в ходе опыта описанного выше типа, то нужно прежде всего сложить скорость выделения тепла в изометрических условиях со скоростью дополнительного освобождения тепла при укорочении, вычисленной из уравнения (VII. 4). Это можно сделать, воспользовавшись уравнением Обера (VII. 3) для скорости освобождения теплоты при изометрическом тетанусе. Чтобы получить суммарную величину скорости освобождения энергии, к полученному результату нужно добавить скорость совершения работы, равную — Pdl∣dt. Общий результат имеет вид
-dE/dt = -dQs∕dt - dQi∕dt - Pdl∣dt =
= -[K(P0 + P) + P]dl/dt + hAexp(-αt) + hB, (VII.5)
где (-dQi∣dt) — скорость выделения тепла в изометрических условиях через время t после раздражения, а остальные обозначения имеют тот же смысл, что и в уравнениях (VII.4) (модифицированном) и (VII.3). Средние значения констант уже были приведены выше.
Результаты применения этого довольно неточного и в значительной степени эмпирического уравнения иллюстрируются фиг. 51, А и Б. На фиг. 51, Л приведены зависимости скоростей совершения работы и выделения общей энергии и теплоты, а также укорочения от относительной нагрузки на мышцу, а на фиг. 51, Б — зависимости скоростей выделения энергии и теплоты от скорости укорочения. Хотя форма этих кривых может существенно измениться, если для констант в уравнении (VII.4) взять крайние их значения, они дают хорошее представление о средних величинах скоростей, которых можно ожидать на ранних стадиях сокращения мышцы при ее укорочении от одной длины до другой. Из фиг. 51, Л видно, что зависимость скорости совершения работы (мощности) от нагрузки на мышцу имеет характерную колоколообразную форму, уже встречавшуюся нам раньше (ср. фиг. 44), а скорость укорочения уменьшается по экспоненте. Скорость выделения тепла также уменьшается экспоненциально от большого значения при нулевой нагрузке (т. е. при максимальной скорости укорочения) до
Фиг. 51. Зависимости скоростей выделения энергии от относительной нагрузки (А) и скорости укорочения (Б) при тетанусе.
Портняжная мышца лягушки при 0°. Кривые вычислены с помощью уравнений (VI.1) и (VII.5) и соответствуют начальным скоростям при t ≈ 0. I — скорость выделения суммарной энергии (-dE/dt); II — скорость выделения суммарной теплоты (-dQ/dt); III — скорость укорочения (-dl/dt); IV — скорость совершения работы (dW∕dt).
188
Глава VH
величины, втрое меньшей при нагрузке Po, которая соответствует изометрическим условиям. В то же время кривая энергии имеет форму, лишь слегка напоминающую колоколообразную; скорость достигает максимума, когда относительная нагрузка составляет 0,1—0,2 Po, а затем постепенно уменьшается до значения, равного 1A максимального при нагрузке P0-
Если построить зависимости скоростей выделения энергии и теплоты от скорости укорочения, как это сделано на фиг. 51, Б, то получатся следующие результаты. Обе величины (—dE/dt и — dQ/dt) начинают возрастать от некоторого конечного значения, отвечающего изометрическим условиям, т. е. нулевой скорости укорочения. Но —dE/dt быстро достигает максимума при скорости укорочения, равной 50—60% ее максимальной величины, а затем снова слегка уменьшается, пока скорость укорочения не достигнет максимума. Скорость же выделения тепла увеличивается непрерывно и на большей части кривой почти линейно. Форма кривой для энергии согласуется с гипотезой скользящих нитей, согласно которой актиновые нити перемещаются к центрам саркомеров за счет того, что их тянут или толкают движущиеся головы молекул миозина. При изометрических условиях движения голов напоминают дрожание [31]. Такое дрожание должно, по-видимому, ограничивать скорость основной химической реакции, т. е. реакции расщепления АТФ, происходящей в результате взаимодействия актина и миозина. В другом крайнем случае, при большой скорости укорочения, актиновые нити перемещаются вдоль цепочки миозиновых голов так быстро, что в каждый данный момент возможно лишь ограниченное число таких взаимодействий; в результате скорость освобождения энергии должна уменьшаться. При какой-то промежуточной скорости укорочения будет достигаться оптимум, т. е. максимальное число взаимодействий. Далее мы вернемся к этому важному вопросу.
Результаты опытов, в которых мышце после приведения ее в состояние тетануса дается возможность укорачиваться от одной длины до другой, можно суммировать следующим образом: когда мышца внезапно освобождается от изометрических ограничений, помимо изоме¬
Энергетика сокращения
189
трической теплоты выделяется дополнительная теплота, количество которой пропорционально укорочению (при постоянной нагрузке) или нагрузке (при постоянном укорочении). Этот закон заслуживает того, чтобы носить имя его первооткрывателя А. В. Хилла [70, 71, 74]. Аналогичные результаты были получены для одиночных сокращений, однако здесь ситуация осложняется малой продолжительностью сокращения; при большой нагрузке это ограничивает степень наблюдаемого укорочения, так как требуется некоторое время для того, чтобы сократительные элементы растянули последовательные упругие элементы (фиг. 39). Но при малых и средних нагрузках в течение ограниченной фазы одиночного сокращения тепло выделяется, по-видимому, в количестве, пропорциональном степени укорочения. Здесь имеется, однако, другое осложняющее обстоятельство, заключающееся в том, что освобождение тепла на ранней стадии активации не заканчивается полностью до того, как начнется укорочение, и, следовательно, его можно спутать с истинным теплом, выделяющимся при укорочении (если оно действительно выделяется). Кроме того, для всех опубликованных кривых характерна определенная тенденция к уменьшению скорости выделения тепла еще до того, как укорочение полностью завершится [71].
Здесь необходимо предупредить читателя о том, что, хотя выделение тепла при укорочении, казалось бы, совершенно четко обнаруживается в описанных нами опытах с изотоническим сокращением, этот факт еще остается спорным, особенно если рассматривать его в связи с той химической реакцией (расщеплением АТФ), в результате которой выделяется тепло. Как мы увидим в следующей главе, ни в одном из исследований расщепления АТФ в живой мышце не было показано, что существует химический эквивалент этой теплоты укорочения. Чтобы устранить это явное противоречие, было высказано предположение, что существует фаза поглощения тепла мышцей во время расслабления [29, 30, 31], но это не было четко показано экспериментально ни для изотонического тетануса, ни для изотонического одиночного сокращения. Как мы сейчас увидим, аналогичное противоречие возникает и между данными тепловых измере¬
190
Глава VII
ний, если сравнить измеряемые количества тепла, выделенного в сократительной фазе одиночного сокращения и во всем цикле сокращения и расслабления при опускающемся грузе.
Выделение энергии при изотонических одиночных сокращениях
Величина выделенной при одиночном сокращении энергии, представленной в виде суммы двух ее составляющих — теплоты и работы, сильно зависит от нагрузки на мышце, которая в свою очередь, как мы видели, определяет скорость укорочения.
Имеются, однако, существенные различия в форме экспериментальных кривых в зависимости от того, рассматривается ли весь цикл при опускающемся грузе или только фаза сокращения. Проще всего рассмотреть сначала весь цикл (фиг. 52, сплошные кривые). В этом случае вся выделенная в течение нескольких одиночных сокращений теплота регистрировалась инерционным термоэлементом. В соответствии с уравнением (VII.2) она представляет собой всю выделенную энергию, так как при расслаблении груз опускается в свое первоначальное положение [24]. Измерив работу, произведенную в фазе сокращения, и вычитая ее из суммарной энергии, можно найти теплоту (—Q), выделенную в результатах всех остальных процессов, кроме процесса деградации работы в тепло во время опускания груза при расслаблении. Кривые на фиг. 52 изображают зависимость этих трех параметров (— ΔB, Wf — Q) от величины относительной нагрузки (P∕P0) на мышце.
Мы видим, что кривая для работы (III, б) имеет типичную колоколообразную форму, такую же, как и кривая для работы, совершенной в процессе тетануса (фиг. 51). Точно такой же вид имеет и кривая для суммарной энергии (/, б), но она пересекается с осями координат не при нулевых, а при положительных значениях (при нулевой нагрузке —ΔB ≈ 2,5 мкал/г, а когда P = = Pq, —ΔE ≈ 3,1 мкал/г). Разность между суммарной энергией и работой дает величину —Q (II, б). Мы видим, что этот параметр почти не зависит от нагрузки, хотя кривая имеет в действительности слегка выраженную
Фиг. 52.
А — зависимость общего энергетического баланса от относительной нагрузки при одиночном сокращении. I — суммарная выделенная энергия, II — выделенная теплота, III — работа, произведенная мышцей. Сплошные кривые построены по усредненным данным, полученным в работе [24] для полного цикла одиночного сокращения портняжной мышцы лягушки при 0°, когда в фазе расслабления груз опускался. Пунктирные кривые взяты из работы [71]; они соответствуют только развивающейся фазе одиночных сокращений портняжной мышцы лягушки (светлые кружки) и полуперепончатой мышцы жабы (темные кружки); Б — зависимость работы, произведенной мышцей, от суммарной выделенной энергии (по результатам, приведенным на фиг. 52, А). Треугольники — для полного цикла при опускающемся грузе [24], темные кружки — только для развивающейся фазы одиночного сокращения [71]. Стрелки показывают, что относительная нагрузка увеличивалась от 0 до 0,30 (только развивающаяся фаза одиночного сокращения).
192
Глава VII
S-образную форму. Значения, соответствующие этой кривой, изменяются в пределах от ~2,5 до 3,1 мкал/г. Эти изменения, возможно, и имеют какой-то реальный смысл, однако требуется гораздо больше экспериментальных данных для того, чтобы доказать это, поскольку стандартная ошибка измерений сравнительно велика. Если считать величину —Q не зависящей от нагрузки, то среднее ее значение равно 2,9 мкал/г.
Из этой трудоемкой и тщательно контролируемой серии опытов для целого цикла [24] следует совершенно несомненный вывод: укорочение мышцы, равное по меньшей мере 35% Z0 при нулевой нагрузке и менее 5% при P = Pq, явно не сопровождалось выделением тепла (—-Q). Это особенно хорошо видно из данных для нулевой нагрузки, при которой количество выделенного тепла меньше, чем при остальных нагрузках, а степень укорочения больше. Таким образом, для величины энергии, освобождаемой при данных условиях, мы можем написать простое приближенное уравнение
-ΔE = const + kW = = 2,9 + 0,97W (в мкал/г на одиночное сокращение). (VII.6)
Перейдем теперь к обсуждению результатов более ранней серии опытов [71] для развивающейся фазы одиночных сокращений мышц лягушки и жабы. В свое время эта серия опытов была, несомненно, проведена с целью показать, что с укорочением мышцы всегда пропорционально увеличивается выделение тепла. В самом деле, приведенные на фиг. 52 экспериментальные кривые, по-видимому, действительно свидетельствуют о заметном влиянии степени укорочения, так как здесь количество выделившегося тепла —Q максимально при нулевой нагрузке, когда степень укорочения также максимальна, и постепенно уменьшается по мере увеличения нагрузки (кривая II, а). Более того, количество тепла, выделенного при нулевой нагрузке, на 1,7 мкал/г больше соответствующей величины для всего цикла, равней 2,5 мкал/г. Это большое различие в величине тепловых эффектов для двух типов опытов обусловливает, конечно, такое же раз¬
Энергетика сокращения
193
личие суммарной энергии —AE, зависимость которой для фазы сокращения (/, а) имеет гораздо менее ярко выраженную колоколообразную форму, чем в случае полного цикла (/,б). Заметим, что кривые для работы имеют в обоих случаях одинаковый колоколообразный вид. Причина различий в абсолютных величинах состоит, по-видимому, в том, что в опытах с полным циклом учитывалась внутренняя работа, произведенная мышцей над последовательно расположенными упругими элементами, тогда как при исследовании только фазы сокращения эта работа не учитывалась.
На фиг. 52,5 показан другой способ обнаружения различий между двумя типами опытов. На этом графике по оси ординат отложена произведенная мышцей работа, а по оси абсцисс — суммарная величина выделенной энергии. Мы видим, что значения, соответствующие полному циклу (треугольники), хорошо ложатся на одну прямую линию, как это и следовало ожидать на основании уравнения (VII.6). Проведенная прямая пересекает ось абсцисс в точке —AE ≈ 2,8 мкал/г. При больших величинах нагрузки (от 0,3 Pq до Pq) значения, отвечающие только фазе сокращения (точки), также хорошо укладываются на ту же прямую. Однако при меньших нагрузках (от 0 до 0,3 P0) точки расположены гораздо правее прямой и ложатся на другую кривую. Этот результат можно было бы интерпретировать следующим образом: когда степень укорочения больше той, которая отвечает нагрузке в 0,3 Pq, укорочение сопровождается выделением все более возрастающего количества дополнительной теплоты сверх той, которая наблюдается для полного цикла. Но этот вывод находится в явном противоречии с уравнением (VII.6) [165].
Имеется несколько возможностей объяснить различия между данными для фазы сокращения и для полного цикла при небольших нагрузках. Можно, например, предположить, что при расслаблении имеется фаза, в которой мышца поглощает тепло, в точности компенсирующее добавочную теплоту, выделяемую в фазе сокращения. Но, как мы уже отметили выше, экспериментально это еще не подтверждено. Могло бы даже оказаться, что при быстром укорочении мышцы в тепловые
194
Глава VlI
измерения вносилась большая экспериментальная ошибка, хотя в опытах обоих типов измерения тщательно контролировались специально для того, чтобы избежать таких ошибок. Какова бы ни была причина расхождений, оставлять без внимания возникающие трудности, по-видимому, нецелесообразно, даже несмотря на то, что химические данные, которые мы обсудим позднее, подтверждают результаты тепловых измерений, проведенных для полного цикла, и, следовательно, противоречат результатам более ранних измерений, касающихся только фазы сокращения. Если бы для подтверждения концепции, согласно которой укорочение сопровождается выделением дополнительного количества теплоты, мы должны были бы полагаться исключительно на результаты, полученные для изотонических одиночных сокращений, то можно было бы не обращать внимания на эти расхождения. Но мы уже видели, что данные о выделении такого тепла, получаемые в опытах, в которых мышце позволяют укоротиться до новой длины во время тетануса, даже гораздо более достоверны (фиг. 50 и уравнения (VII.4) и (VII.5)). Имеется, однако, одна лазейка: кривые, приведенные на фиг. 50 для опытов с освобождением мышцы, получены расчетным путем и, следовательно, являются весьма идеализированными. На практике часто бывает так, что дополнительное количество теплоты освобождается только в течение некоторой части процесса укорочения, а затем скорость выделения тепла уменьшается, и в итоге соответствующая кривая все больше и больше приближается к «изометрической» кривой. В результате к концу укорочения различия в количествах теплоты, выделенной в этих двух случаях, оказываются гораздо меньшими, чем это должно следовать из уравнения (VII.4).
Возвращаясь, наконец, к результатам опытов для полного цикла одиночного сокращения, мы можем сформулировать уравнение (VII. 6) следующим образом: энергия, выделенная за полный цикл одиночного сокращения при условии, что во время расслабления груз может опускаться, пропорциональна произведенной работе плюс некоторое постоянное количество теплоты, которая возникает в процессе превращения химической энергии
Энергетика сокращения
195
в работу. Исторически этот вывод возвращает нас далеко назад к работе Фенна [47], который его впервые сформулировал. Отметим, что Фенн изучал тогда изотонический тетанус, а не одиночное сокращение, так что этот закон, носящий его имя, может быть применен к обоим типам опытов. В таком случае расхождения, о которых мы говорили, можно наиболее отчетливо выявить, если сравнить закон Фенна с законом Хилла (стр. 189).
Эффективность сократительного процесса
Механическая эффективность, определяемая как отношение — W/ΔE (= W∕(W-Q)), — это единственная
Фиг. 53. Механическая эффективность (-W∕ΔE) для развивающейся фазы одиночных сокращений мышц лягушки и жабы (сплошная кривая и точки) и для полного цикла при опускающемся грузе для одиночных сокращений мышцы лягушки (пунктирная кривая) как функция P/P0.
Значения взяты из предыдущих графиков.
мера эффективности, которая имеется в нашем распоряжении, так как для того, чтобы оценить термодинамиче¬
196
Глава VlI
скую эффективность — W∣AE, необходимо знать изменения свободной энергии (—ΔF), а они еще не определены [163]. Из фиг. 52, А мы можем найти два ряда величин для —W/AE-. один — для полного цикла одиночного сокращения [24], и другой — для фазы сокращения [71]. Эти два ряда значений показаны на фиг. 53 соответственно пунктирной и сплошной линиями для интервала нагрузок от 0 до 0,6 Pq, в котором эффективность проходит через максимум. Далее она продолжает уменьшаться, достигая при P ≈ Pq нуля, если рассматривать только внешнюю работу, и несколько большей величины (не менее 8%), если в энергетическом балансе учитывать и внутреннюю работу. К сожалению, для промежуточного интервала нагрузок от 0,6 Pq до Pq имеется очень мало экспериментальных данных, и, кроме того, очень трудно оценить величину внутренней работы в этом интервале.
Вплоть до нагрузок 0,3 P∣Pq эффективность оказывается больше для полного цикла, чем для фазы сокращения. Это вполне естественно, поскольку в фазе сокращения при таких нагрузках выделяется больше теплоты, а работы производится примерно столько же, что и за весь цикл (фиг. 52,А). В обоих случаях максимум эффективности наблюдается при нагрузках от 0,3 до 0,45 Pq и составляет около 36%. При больших нагрузках эффективность для сократительной фазы одиночного сокращения имеет тенденцию уменьшаться быстрее, чем для полного цикла, возможно потому, что в первом случае при самых больших нагрузках опыты продолжались недостаточно долго, чтобы можно было зарегистрировать максимальную величину работы. Если воспользоваться эргометром и заставить мышцу работать с постоянной скоростью, то можно получить более высокие значения максимальной эффективности, чем 36% [71]. По-видимому, для мышц лягушки и жабы верхняя предельная величина эффективности составляет 45%. Однако для мышцы черепахи недавно были получены значения 75—80% [165].
ГЛАВА VIII
ХИМИЯ СОКРАЩЕНИЯ
На основании опытов in vitro, описанных в первой части книги, считалось само собой разумеющимся, что энергия сокращения непосредственно получается в результате расщепления АТФ. Теперь необходимо показать, что такое расщепление АТФ действительно происходит в живой сокращающейся мышце в количествах, достаточных для снабжения мышцы энергией. Практически это трудно показать главным образом из-за очень малого количества расщепляемого АТФ. Например, общее количество выделяемой энергии при одиночном сокращении и максимальной эффективности составляет 5 мкал на 1 г мышцы, и если считать, что общее изменение энергии равно 10 ккал на 1 моль АТФ, то это означало бы, что при одном одиночном сокращении расщепляется всего 0,5 мкмоль АТФ на 1 г мышцы. В портняжной мышце лягушки первоначальное содержание АТФ составляет около 3 мкмоль/г, но эта величина может меняться от мышцы к мышце по меньшей мере на ±0,3 мкмоль. Это вносит значительную ошибку, так как единственный возможный способ оценивать изменение энергии — это сравнение двух мышц одного и того же животного: контрольной мышцы и мышцы, подвергнутой раздражению [29].
Имеется еще одна дополнительная проблема: как остановить реакции в мышце по возможности более резко. Обычно для этого мышцу перед экстракцией хлорной или трихлоруксусной кислотой замораживают. В настоящее время это осуществляют путем погружения мышцы, находящейся в измерительном приборе, в сосуд с жидким фреоном (CCl2F2 ÷ CCl3F) при —180° (этот сосуд быстро подставляют снизу) [29, 86, 87]. Таким способом можно заморозить мышцу за 200 мсек, а в некоторых
198
Глава VIII
методах даже и за 50 мсек. Эта техника позволяет избежать одной из трудностей, присущих более старому методу замораживания мышцы прямо в жидком азоте, когда между мышцей и жидкостью образовывался слой пара, который, изолируя мышцу, препятствовал ее быстрому замораживанию.
Решив проблему быстрого замораживания химических процессов в мышце, мы должны рассмотреть теперь, какие реакции из всей цепи ресинтеза АТФ могут происходить в интервале времени перед замораживанием. К счастью, решить эту проблему не так трудно, как другие. Основная побочная реакция, происходящая с наибольшей скоростью, — это так называемая реакция Ломана (VIII.1,6), катализируемая креатинкиназой:
(VIII.1)
Первоначальное содержание КФ (креатинфосфата) составляет около 20 мкмоль/г, а максимальное его количество, распадающееся при длительной серии одиночных сокращений, редко превышает 5 мкмоль/г\ поэтому равновесие практически смещено вправо, хотя и не столь сильно, как это часто предполагают. Следовательно, количество КФ, разлагающегося при гидролизе, может служить хорошей мерой количества расщепляющегося АТФ при условии, что опыт продолжается достаточно долго, чтобы реакция успела пройти полностью, но не настолько долго, чтобы могли пройти другие побочные реакции. Оптимальное время составляет около 3 сек при O0 [88].
При одиночном сокращении можно следить за временной зависимостью реакции Ломана по тем изменениям pH, которые возникают в мышце [32]. Их можно измерить либо с помощью стеклянных микроэлектродов, располагаемых на поверхности мышц, либо путем введения в живую мышцу pH-индикатора, изменения окраски которого регистрируют фотометрически (ср. гл. IV). Эти методы основаны на изменении кислотности мышцы при расщеплении АТФ по уравнению (II.2) [53]. При физиологических значениях pH на 1 моль расщепляемой АТФ приходится 0,8—1,0 экв протонов. C другой стороны, реакция Ломана приводит к увеличению основ-
Химия сокращения
199
ности мышцы, соответствующему —1,0 же протонов на 1 моль КФ [32]. Если последняя реакция происходит не мгновенно, а более или менее запаздывает относительно начальной реакции расщепления (VIILl), то pH сначала будет падать, а затем снова повышаться до своего исходного значения. Именно это и происходит при сокращении: во время развивающейся фазы одиночного сокращения кислотность повышается за счет расщепления АТФ, а основность остается на прежнем уровне до тех пор, пока не начнется расслабление; тогда она начинает повышаться за счет реакции Ломана, и это повышение часто продолжается после окончания расслабления еще 100—200 мсек. Из этих данных, а также из результатов, полученных для серии перекрывающихся одиночных сокращений, когда «фаза основности» проявляется только во время последнего одиночного сокращения, очевидно, что реакция Ломана протекает медленнее, чем реакция расщепления [32]. Поэтому если критерием расщепления АТФ служит изменение содержания КФ или креатина, то при изучении сокращения очень важно, чтобы мышца перед ее замораживанием пришла в расслабленное состояние. К сожалению, из литературных данных совершенно не следует, что это условие всегда выполнялось.
Когда расслабление заканчивается, включаются реакции гликолитического цикла. Они начинаются фосфорилированием гликогена неорганическим фосфатом (Фн), освобождаемым в реакции (VIII. 1,а), и включают в числе других реакций дефосфорилирование одной молекулы АТФ на мономер глюкозы в гликогене по мере образования фруктозодифосфата. К счастью, большей части трудностей, связанных с этим циклом, можно избежать, отравив мышцу иодацетатом [23, 24, 104, 107], который блокирует гликолиз на стадии триозофосфатде- гидрогеназы. Это позволяет с большой точностью следить за процессом исчезновения КФ или за появлением эквивалентного количества свободного креатина после большой серии одиночных сокращений или длительного тетануса, причем имеется достаточная уверенность в том, что протекают только реакции (VIII. 1,а и б). C помощью такого метода можно установить связь между расщеплением КФ и выделением энергии при сокращении.
200
Глава Vlll
Вплоть до последнего времени было невозможно продвинуться дальше и оценить степень расщепления самого АТФ, пока не было показано, что фтординитробензол (ФДНБ) — реагент, широко применяемый в аминокислотном анализе концевых групп белка, — является до некоторой степени специфическим ядом для креатинки- назы. Таким способом можно ингибировать реакцию (VIII. 1,6), не нарушая слишком сильно работу сократительной машины [88, 100]. Удалось показать, что при одиночных сокращениях и тетанусах АТФ действительно расщепляется в количествах, соответствующих степени расщепления КФ в присутствии иодацетата в качестве ингибитора или количеству Фн, освобождаемого при кратковременных «неотравленных» сокращениях. Но даже и в этом случае возможна еще одна реакция, которая усложняет результаты, — это реакция с участием миокиназы:
2АДФ ↔ АТФ + АМФ. (VIII.2)
Реакция (VIII.2) в свою очередь приводит к дезаминированию АМФ, которое катализируется аденозинмоно- фосфатдезаминазой:
АМФ → Инозинмонофосфат + NH3. (VIII.3)
Обе эти реакции в значительной степени протекают и в портняжной и в прямой мышце живота лягушки, отравленных ФДНБ; поэтому при измерении —ΔATΦ на них необходимо делать поправку [29] (но эта поправка не требуется, когда об изменении количества АТФ судят по ΔΦh).
Итак, мы твердо знаем теперь, что АТФ расщепляется при сокращении и что эта реакция самым тесным образом связана с сократительным процессом.
Расщепление АТФ и КФ при кратковременных изометрических тетанусах
На фиг. 54 приведена временнёя зависимость расщепления АТФ и освобождения избыточного количества Фн в процессе кратковременного изометрического тетануса длительностью 1,5 сек для портняжной мышцы ля-
Химия сокращения
201
гушки, отравленной ФДНБ, при 0° [87]. На графике приведены также кривые развития напряжения и выделения тепла. Последнее было вычислено по уравнению Обера с использованием тех же констант, что и на фиг. 50 и в уравнении (VIII. 3), с поправкой на действие ФДНБ. Весьма примечательно, как хорошо ложатся
Фиг. 54. Расщепление АТФ (темные кружки) и образование Φн (светлые кружки) в процессе кратковременного изометрического тетануса портняжной мышцы лягушки при 0° [87].
Для ингибирования КФ-киназы мышцу отравляли ФДНБ. Вертикальные линии показывают величину среднеквадратичных ошибок химических оценок. Сплошная линия соответствует выделению тепла (-Q), вычисленному с помощью уравнения Обера (VII.2), в котором величина второй константы (hB) была предварительно уменьшена до 70% ее нормального значения, чтобы учесть влияние ФДНБ (см. [4]).
данные для -ΔATΦ на кривую, описывающую количество выделяемого тепла, если построить ее с учетом того, что установившаяся скорость выделения тепла мышцей, отравленной ФДНБ, составляет обычно лишь 70% скорости для необработанной мышцы [4]. Видно также, что степень расщепления АТФ (темные кружки) хорошо согласуется с количеством освобождающегося Фн (светлые кружки). Это показывает, что представления, изложенные в начале этой главы, справедливы.
202
Глава VIII
Для того чтобы грубо оценить энтальпию гидролиза АТФ, сравним количество освобождаемого тепла (—Q) с количеством расщепившегося АТФ (—ΔATΦ) в момент времени, соответствующий примерно середине тетануса (через 0,7 сек после раздражения). Они равны соответственно 4,70 мкал/г и 0,46 мкмоль/г, откуда энтальпия гидролиза (d5∕dATΦ) равна 10,2 ккал на 1 моль АТФ. Можно сравнить это значение с тем, которое было получено в ряде экспериментов при очень длительных тетанусах, продолжающихся от 20 до 60 сек [106, 107]. Здесь средняя скорость расщепления АТФ, оцененная в этом случае по расщеплению КФ, была гораздо более низкой в соответствии с более низкой скоростью выделения тепла при длительных тетанусах [ср. уравнение (VII. 2) и следующие]. В одной серии опытов она составляла 0,28, а в другой — 0,23 мкмоль/г/сек. Среднее значение для установившейся скорости выделения тепла (Zib) , согласно данным работы [3], равно 3,5 мкал/г/сек. Таким образом, для величины d5∕dATΦ получается гораздо меньшее значение, чем прежде, равное всего 7,3 ккал/молъ.
Влияние длины мышцы на скорость расщепления АТФ при изометрических тетанусах
Скорость расщепления АТФ, так же как и скорость выделения тепла (фиг. 49), зависит от длины мышцы. Это показано на фиг. 55, где приведены данные двух серий измерений, полученные разными исследователями [87, 134]. В первой серии (светлые кружки) длительность тетануса составляла 1,5 сек, а степень расщепления АТФ определяли по содержанию Фн [87]; во второй серии (темные кружки) продолжительность тетануса составляла 20 сек, а мерой химических изменений служила величина —ΔKΦ [134]. Кривые длина — напряжение для обеих серий опытов имели почти одинаковую форму, и их можно было совместить, введя для одной серии опытов поправочный множитель для относительной длины мышцы I/Iq, равный 0,1. На графике эти кривые показаны общей линией.
Химия сокращения
203
Из фиг. 55 можно видеть, что в случае тетануса длительностью 1,5 сек кривые напряжения и расщепления АТФ при уменьшении длины идут параллельно друг другу. Исключение наблюдается для отношения //Z0 = 0,5, при котором напряжение падает до нуля, а относительная степень расщепления АТФ все еще составляет 35%
Фиг. 55. Влияние длины мышцы на расщепление АТФ (измеряемое либо по ΔΦh, либо по -ΔKΦ) при тетанусе портняжной мышцы лягушки при 0°.
Сплошной линией показано развитие напряжения, а пунктирными — появление Фн (светлые кружки) [87] или расщепление КФ (темные кружки) [134]. Два дополнительных значения (крестик и квадратик), соответствующие длине 0,5 l/l0, взяты из работы [106]. Длину мышцы выбирали так, чтобы кривые напряжений, приводимые разными авторами, совпадали друг с другом.
максимума. C другой стороны, при более длительных тетанусах относительная степень расщепления АТФ при l/l0 < 1 всегда больше, чем относительное напряжение. Эти последние данные хорошо согласуются с падением стационарной скорости выделения тепла (Ав) при уменьшении длины мышцы (фиг. 49), а также с данными другого автора для l/l0 = 0,5 (на графике они показаны
204
Глава VIIl
крестиком и квадратиком) [106]. Мы уже высказывали ранее предположение, что причиной такого быстрого спада напряжения в левой части кривой является сжатие миозиновых нитей Z-пластинками (фиг. 43, Б). Хотя при таком сжатии имеется тенденция к уменьшению взаимодействия между миозином и актином, оно не исключается полностью, так что расщепление АТФ возможно и при самых малых длинах. Именно это отчетливо видно из фиг. 55.
При длинах мышцы, больших чем /о, также наблюдается быстрое уменьшение напряжения и степени расщепления АТФ, причем уменьшение степени расщепления по-прежнему хорошо согласуется с изменением стационарной скорости выделения тепла hB при тех же условиях (фиг. 49). Однако в обеих сериях опытов (фиг. 55) напряжение при длинах мышцы, больших Iq, очень быстро уменьшается; соответствующая кривая гораздо более симметрична, чем это обычно имеет место (фиг. 49). Поэтому полученные результаты не дают ясного ответа на вопрос о количественной связи между степенью расщепления АТФ и напряжением, хотя они ясно показывают, что расщепление АТФ связано с длиной мышцы, как этого и следовало ожидать из теории скользящих нитей, т. е. степень расщепления уменьшается, когда при увеличении длины мышцы актин выходит из контакта с миозином.
Расщепление КФ и АТФ
при изотонических одиночных сокращениях и тетанусе
Расщепление АТФ при изотонических одиночных сокращениях и тетанусе было исследовано главным образом тремя группами сотрудников, давших различную интерпретацию происходящему. Наиболее ранние исследования были выполнены на портняжных мышцах лягушки при 0o. В них мышцу подвергали либо серии одиночных сокращений, либо кратковременному тетанусу при различных нагрузках и определяли степень расщепления АТФ по количеству накапливающегося свободного креатина [ИЗ]. Все мышцы отравляли иодацетатом.
Химия сокращения
205
Полученные результаты со всей определенностью свидетельствуют о том, что при отдельном изотоническом тетанусе продолжительностью 400 мсек при O0 содержание свободного креатина (Kp) изменяется в соответствии с уравнением типа
ΔКр = A + k'W - k''Δl∕l0, (VIII. 4)
где А — константа, не зависящая от произведенной работы или скорости укорочения; величину 1∕k' можно определить как механо-химический эквивалент (dW∕dКр), а член k" представляет собой вклад укорочения per se в величину расходуемой энергии. Оказалось, что величина k" так сильно варьирует, что ее среднее статистическое значение очень близко к нулю. Отсюда был сделан вывод, что в уравнении для энергии отсутствует член, который был бы эквивалентен большой величине теплоты укорочения Хилла [ср. фиг. 50 и уравнение (VII.4)]. Если работу выразить в мкал/г, a ΔКр — в мкмоль/г, то константа k' оказывается равной 0,11 и для величины dW∕dКр (= -dW∕dКΦ = -dW∕dATΦ) получается значение 9 ккал/моль.
В трех других сериях опытов, в которых исследовались две мышцы (одна сокращалась изотонически, а другая изометрически), для величины -dW∕dKΦ, или dW∕dКр, получились значения, варьирующие от 7 до 11 ккал/моль. В этих случаях по-прежнему отсутствовал член, соответствующий теплоте укорочения. Ввиду того что тепловые измерения не проводились, полученные результаты не позволяют найти величину энтальпии расщепления КФ или АТФ [26, 106, 107].
К счастью, вторая группа исследователей провела ряд тщательно контролируемых опытов по изучению расщепления КФ совместно с тепловыми измерениями, результаты которых показаны на фиг. 52, А и Б [24]. Авторы сравнили значение суммарной выделенной энергии со степенью расщепления КФ и нашли величину энтальпии (dE/dKΦ) при трех разных условиях опыта. Для 30 одиночных сокращений при малой нагрузке, когда произведенная работа была невелика, но мышца очень сильно укорачивалась, энтальпия оказалась равной 9,16 ккал/моль. При увеличении нагрузки (серия из
206
Глава VIIl
25 одиночных сокращений), когда степень укорочения была средней, а произведенная работа большой, энтальпия была равна 10,43 ккал/моль. Для 30 изометрических одиночных сокращений под большой нагрузкой, когда
Фиг. 56. Разность между расщеплением КФ при изотоническом и при изометрическом одиночных сокращениях (изотоническое минус изометрическое) [24].
Для сравнения приведена кривая суммарной работы W, совершаемой мышцей. Перед началом опыта мышца была отравлена иодацетатом. Результаты приведены в зависимости от относительной нагрузки на мышцу (P∕P0). Вертикальные штрихи показывают величину среднеквадратичных ошибок при химических оценках. См. текст.
укорочения почти не было, а совершенная работа снова была небольшой, эта величина оказалась равной 9,58 ккал/моль. Проведенные позднее эксперименты дали более высокие значения энтальпии: 10,06 ккал/моль для тетанусов продолжительностью 10 сек\ 10,22 ккал/моль для тетанусов, длящихся 20 сек, и 11,94 ккал/моль для
Химия сокращения
207
изометрических одиночных сокращений [25]. Среднее значение изменения энтальпии, или внутренней энергии, для всех этих опытов равно 10,6 ккал/моль. В дальнейшем при определении величины изменений суммарной энергии по количеству расщепленного КФ или АТФ или наоборот мы будем пользоваться именно этим значением для энтальпии (см., однако, [24]).
В рассмотренных выше сериях опытов [24] сравнивались две мышцы, одна из которых сокращалась изотонически при разных нагрузках, а другая — изометрически, и измерялась разность между содержанием КФ в той и в другой в конце серии одиночных сокращений. Результаты показаны на фиг. 56.
Как видно из графика, при нулевой нагрузке и, следовательно, при нулевой работе разность между количествами расщепленного КФ при изотонических и изометрических условиях опыта отрицательна, т. е. в том случае, когда мышца укорачивается, но не совершает работы, на 1 г мышцы расщепляется на 0,08 мкмоль КФ меньше, чем в случае изометрического сокращения. Однако по мере увеличения нагрузки в изотонических условиях начинает расщепляться больше КФ, чем в изометрических, и это увеличение идет параллельно с увеличением совершаемой мышцей работы вплоть до нагрузки, равной 0,3 P∣Pq. При более высоких значениях нагрузки наблюдается обратная тенденция, т. е. количество расщепленного КФ уменьшается быстрее, чем совершаемая работа. Это означает, что в данном интервале нагрузок уже нет точной линейной зависимости между расщеплением КФ и совершаемой работой.
Из сопоставления фиг. 56 и 52 видно также, что отравленные мышцы совершают меньшую работу, чем неотравленные. Это могло бы хорошо объяснить низкое значение механо-химического эквивалента, получаемого в опытах с мышцами, отравленными иодацетатом (см. ниже), а также в опытах, в которых мышцы отравлялись ФДНБ (фиг. 57 и 58). Этим же можно было бы объяснить заметные различия между величинами констант в уравнении (VII. 6) и в «химическом» уравнении (VIII. 5) (которое необходимо умножить на множитель 10,6 для того, чтобы получить —AE).
208
Глава VIII
Если считать, что расщепление КФ действительно линейно зависит от работы для нагрузок менее 0,3 Р/Ро, то наклон прямой (-dW∕dKΦ), равный 4,65 ккал на 1 моль КФ, соответствует гораздо меньшему значению механо-химического эквивалента, чем те, которые были приведены выше (стр. 202 и 205). Авторы вычислили среднюю величину наклона для всех своих данных и получили значение, равное 6,00 ккал/моль.
Можно посмотреть на полученные результаты по- другому, вычислив абсолютное количество КФ, расщепившегося при одиночном сокращении. Это можно сделать, если прибавить к среднему количеству КФ, расщепившемуся при изометрическом одиночном сокращении (0,29 мкмоль/г), значения, показанные на фиг. 56 [26]. Полученные таким образом значения, которые показаны на фиг. 57 точками, мы обсудим позднее. При желании мы можем далее написать уравнение, связывающее количество расщепившегося КФ с совершенной работой для нагрузок от 0 до 0,3 P/P0:
-ΔКФ = 0,21 + 0,215W, (VIII. 5)
где величина -ΔKΦ выражена в мкмоль/г, a W — в мкал/г. Если учесть точки во всем интервале нагрузок от P/P0 = 0 до P/P0 = 1,0, то вторая константа уменьшится до 0,166, а первая увеличится до 0,235 [24]. Отметим, что в этом уравнении отсутствует член, соответствующий теплоте укорочения.
Теперь мы переходим к обсуждению серии опытов, выполненных третьей группой исследователей, результаты которых в какой-то степени отличаются от предыдущих [23, 86—88, 100]. Найденные значения количеств АТФ, расщепившегося в серии одиночных сокращений или при кратковременных тетанусах, показаны на фиг. 57 и 58. Авторы сравнивали сокращающуюся мышцу с покоящейся мышцей того же самого животного. После каждого одиночного сокращения или тетануса мышцы замораживались. Были получены почти одни и те же результаты независимо от того, измерялось ли непосредственно количество расщепившегося АТФ в мышцах, отравленных ФДНБ, или о расщеплении АТФ судили по количеству расщепившегося КФ
Химия сокращения
209
(когда мышцы были отравлены иодацетатом) или по появлению свободного Фн (в неотравленных мышцах). Поэтому на графиках различия в методах никак не отмечены. Можно заметить, что именно ученые этой школы впервые вполне определенно показали, что при со-
Фиг. 57. Зависимость между расщеплением АТФ или КФ и совершаемой работой при одиночном сокращении или кратковременном тетанусе прямой мышцы живота лягушки (данные, представленные светлыми кружками, взяты из работ [23, 86, 87, 100]).
Для сравнения приведены данные из фиг. 56 (изображены темными кружками), к которым предварительно была добавлена величина 0,29 мкмоль/г, соответствующая среднему количеству КФ, расщепляющемуся при изометрическом одиночном сокращении.
кращении мышцы действительно происходит расщепление самого АТФ, и таким образом успешно ответили на призыв к биохимикам доказать этот жизненно важный факт (ср. [67]).
Из фиг. 57 и 58 непосредственно следуют три вывода: 1) количество АТФ, расщепляющегося при сокращении прямой мышцы живота лягушки при 0° (фиг. 57), линейно зависит от произведенной работы
210
Глава VIIl
вплоть до ее значения, равного 1,8 мкал/г\ экстраполированная кривая проходит почти через начало координат; 2) довольно скудные данные для портняжной мышцы лягушки, приведенные на фиг. 58, очень сходны
Фиг. 58. Зависимость между расщеплением АТФ и совершаемой работой при одиночных сокращениях, а также при длительном и кратковременном тетанусах портняжной мышцы лягушки при 0° (мышца была отравлена ФДНБ).
Обратите внимание на низкий механо-химический эквивалент, равный 3,4-5,0 ккал/моль. Кривая I построена по данным, взятым из работы [100]; горизонтальные штрихи показывают среднеквадратичную ошибку для -ΔATΦ; кривая II получена из уравнения Обера (VII.3) (теплота укорочения не учитывалась); кривая III получена из уравнения Обера с учетом теплоты укорочения, которая была вычислена из уравнения Хилла (VII.4).
с результатами для прямой мышцы, но в обоих случаях получаются очень низкие значения механо-химического эквивалента (от 2,2 до 5,0 ккал на 1 моль АТФ); 3) эти результаты отличаются от только что рассмотренных (фиг. 56) тем, что для случая, когда работа не совершается, эти последние соответствуют количеству расщепляющегося АТФ, приблизительно равному
Химия сокращения
211
0,2 мкмоль^, тогда как в данном случае в тех же условиях АТФ почти не расщепляется. Однако при более высоких величинах работы оба ряда данных довольно хорошо согласуются друг с другом (светлые и темные кружки на фиг. 57).
Недавно те же авторы [30] заново провели тщательное исследование одиночных сокращений портняжной мышцы лягушки при слабых нагрузках, которое подтвердило, что в изотонических условиях, когда не совершается работа, расщепляется очень малое количество АТФ, несмотря на возможность сильного укорочения мышцы. Оказалось, что среднее количество расщепившегося АТФ при одиночном сокращении без нагрузки составляет 0,08 ± 0,0009 мкмолъ)г.
Для того чтобы подтвердить этот результат и показать, что выделение так называемой теплоты укорочения никоим образом нельзя объяснить расщеплением АТФ, была проведена дальнейшая серия опытов, в которых одна из пары мышц полностью сокращалась при нулевой нагрузке, а другая оставалась в изометрических условиях. Если бы теплоте укорочения соответствовало некоторое эквивалентное количество расщепившегося АТФ, то из уравнения (VII. 4) следовало бы, что свободно укорачивающиеся мышцы должны выделять 2,3 мкал избыточной теплоты, т. е. расщеплять на 0,22 мкмоль АТФ (на 1 г) больше, чем в изометрических условиях. В действительности результат оказался обратным: в свободно укорачивающихся мышцах расщепляется на 0,128 мкмоль АТФ меньше, чем в изометрических условиях. Это не очень сильно отличается от результатов, приведенных на фиг. 56, которые показывают, что при нулевой нагрузке расщепляется на 0,08 мкмоль АТФ меньше, чем в изометрических условиях. Если позволить мышце свободно укорачиваться, то количеству расщепляющегося АТФ при одиночном сокращении соответствовала бы величина 0,29—0,128 = = 0,162 мкмоль на 1 г. Данные о количестве расщепляющегося АТФ или КФ при сокращении без нагрузки приведены в табл. 6.
Отсутствие какого-либо эквивалента для теплоты укорочения косвенно подтверждается результатами,
212
Глава Vlll
Таблица 6
Расщепление АТФ в процессе изотонических одиночных сокращений мышцы лягушки без нагрузки (при 0o) 1)
Мышца
Вид животного
Расщепление КФ или АТФ, мкмоль/г
Источник данных
изотоническое минус изометрическое
изотоническое
Прямая мышца живота
Rana pipiens
—
0 ± 0,08
[29]
Портняжная
» »
-0,08 2) ± 0,007
0,21
[24]
Rana temporaria
—
0,08 ± 0,009
[30]
То же
-0,128 ± 0,035
0,162
[30]
1) Количество АТФ, расщепившегося при одиночном изометрическом сокращении, было принято равным 0,29 мкмоль/г; добавление этой величины к величинам, стоящим в третьем столбце, дает величины, выделенные курсивом в четвертом столбце [26].
2) Значение, полученное путем экстраполяции кривой на фиг. 56.
полученными для портняжной мышцы лягушки при длительных тетанусах (см. две верхние точки на фиг. 58) [100]. Эти точки отвечают тетанусам длительностью 2,5 и 4,9 сек соответственно, при которых мышца укорачивалась на 2,5 и 2,94 см при двух разных нагрузках. Если предположения, сделанные в предыдущей главе, правильны, то выделяемая в этих случаях теплота частично состоит из так называемой теплоты поддержания, которую можно вычислить с помощью уравнения Обера (VI 1.3), а частично — из дополнительной теплоты, связанной с укорочением, которую можно найти из уравнения Хилла (VII. 4). Воспользовавшись значениями констант уравнения Обера, исправленными для учета влияния ФДНБ, мы найдем, что теплота поддержания для тетануса продолжительностью 2,5 сек должна равняться 12,8 мкал/г. Добавив к этому значению величину измеренной работы, которая равна 6,3 мкал/г, получаем для суммарной энергии величину 19,1 мкал/г. При энтальпии расщепления, равной 10,6 ккал на 1 моль АТФ, для освобождения такого количества энергии необхо¬
Химия сокращения
213
димо расщепить 1,80 мкмоль АТФ на 1 г, а найденное на опыте значение равно 1,83 мкмоль/г. Аналогично для тетануса длительностью 4,9 сек вычисленная теплота поддержания должна равняться 20,3 мкал, совершенная работа равнялась 12,4 мкал и, таким образом, суммарная энергия от этих двух источников составляет 32,7 мкал, что эквивалентно расщеплению 3,1 мкмоль АТФ на 1 г мышцы. Экспериментальное значение равно 2,64 мкмоль/г. Если учесть теплоту укорочения, то получается эффект, показанный кривой III на фиг. 58. Эта теплота должна равняться 9,8 мкал в первом случае и 12,5 мкал во втором: соответственно для суммарной энергии получаем значения 30,1 и 48,7 мкал, эквивалентные расщеплению 2,84 и 4,6 мкмоль АТФ. Очевидно, что эти значения слишком велики и, несомненно, находятся за пределами ошибки опыта. Это еще раз свидетельствует об отсутствии каких бы то ни было доказательств расщепления АТФ, эквивалентного выделению дополнительной теплоты укорочения при тетанусе.
Сделанные выше выводы относительно химического эквивалента теплоты укорочения были подтверждены другим способом, а именно путем оценки изменений, происходящих с компонентами дыхательной цепи в митохондриях, особенно с восстановленным НАД, в результате расщепления АТФ при изотонических и изометрических одиночных сокращениях и тетанусах и при последующем ресинтезе АТФ из АДФ [91, 92]. Для очень тонких мышц, таких, как портняжные мышцы лягушки и жабы, имеется возможность проследить за этими изменениями спектрофотометрически с помощью двухлучевого прибора. Оказалось, что количество АДФ, образующегося при одиночных сокращениях или тетанусах, не зависит от степени укорочения мышцы [92]. Еще раз было также показано, что при свободном сокращении мышцы, когда она сильно укорачивается, расщепляется меньшее количество АТФ, чем когда мышцу раздражают в изометрических условиях. Вследствие того что при таком методе измерений мышца не повреждается, их можно повторять много раз на одном и том же образце. Этот метод — один из самых многообещающих для оценки суммарных изменений в мышце.
214
Глава VIII
Растяжение сокращающейся мышцы
Если во время изометрического тетануса мышцу немного растянуть, приложив к ней силу, то при достаточно медленном растяжении большая часть произведенной извне работы поглощается мышцей и не появляется вновь в виде теплоты. Точные энергетические соотношения в этом случае сложны, так как необходимо учитывать не только работу, произведенную упругими силами, но и так называемый термоупругий эффект. Поэтому здесь имеются некоторые расхождения [1, 75, 106]. На основании результатов оригинальной работы, выполненной несколько лет назад, автор высказал предположение, что поглощаемая во время растяжения работа расходуется на то, чтобы сдвинуть в обратном направлении какую- то химическую реакцию. В свете более поздних данных этой реакцией является, очевидно, реакция расщепления АТФ.
В некотором смысле попытки обнаружить ресинтез АТФ во время растяжения активной мышцы, по-види- мому, с самого начала обречены на провал, поскольку даже на первый взгляд ясно, что АДФ— важнейший продукт расщепления АТФ — может существовать в сокращающейся мышце лишь непродолжительное время, а потом он либо дефосфорилируется в реакции с участием креатинкиназы, либо вступает в реакцию дисму- тации, катализируемую миокиназой [уравнения (VIII. 1,6) и (VIII.2)]. Следовательно, в мышце фактически не содержится АДФ, который мог бы быть субстратом для прямой реакции ресинтеза АТФ, а если бы он даже и находился в мышце, то реакция должна была бы происходить слишком неправдоподобным образом — путем обращения реакции (VIII. 1,а).
Недавно были проведены две серии опытов, авторы которых преследовали указанную выше цель; и хотя эти опыты были неизбежно обречены на неудачу, с их помощью удалось показать по крайней мере, что при медленном сокращении мышцы расщепляется меньшее количество АТФ, чем при других условиях сокращения [88, 106]. При желании этот эффект экономии АТФ можно довести почти до предела, т. е. АТФ вообще не
Химия сокращения
215
будет расщепляться при растяжении [88]. Этот результат не столь поразителен, как это может показаться на первый взгляд, так как из него следует, что если гипотеза скользящих нитей верна, то сокращение является результатом превращения свободной энергии расщепления АТФ в движения миозиновых голов, которые затем тянут или толкают актиновые нити к центру каждого саркомера. Следовательно, можно было бы ожидать, что производимое растягивающей силой «оттаскивание» этих активных голов от их актиновых партнеров естественно должно было бы уменьшить взаимодействия, приводящие к расщеплению АТФ. Таким образом, эти трудоемкие опыты по растяжению подтверждают, по-види- мому, то, что мы уже знаем из множества других фактов: теория сокращения, основанная на гипотезе скользящих нитей, объясняет наиболее существенные особенности активной мышцы. Однако вопрос о том, что происходит с работой, поглощаемой во время медленного растяжения активной мышцы, остается еще открытым.
Выводы
Можно простить читателю, если он почувствует себя несколько озадаченным явно противоречивыми данными в области энергетики. Например, если читатель знаком с историей предмета, то он будет очень удивлен, обнаружив, что концепция о выделении избыточного количества тепла при укорочении мышцы, которая, казалось, была столь хорошо обоснована за предшествующие два- три десятилетия, недавно подверглась нескольким серьезным ударам со стороны как биохимиков, так и физиологов. Но на самом деле это всего лишь пример зигзагов истории, так как сама эта концепция заняла место более ранней гипотезы Фенна, остававшейся до самого последнего времени в тени, а затем попавшей вновь в центр внимания и оказавшейся применимой к полным циклам как одиночных сокращений, так и кратковременных тетанусов. Теперь очень уместно спростить: на какой же ряд данных следует полагаться? Ведь, по
216
Глава VIIl
утверждению авторов, оба они основаны на очень точных измерениях.
По-видимому, ответ на этот вопрос заключается в том, что и те и другие данные верны в своих собственных пределах. Так, представляется несомненным, что если мышца действительно укорачивается, то выделяется больше тепла, чем если она стационарно поддерживается в изометрических условиях. Это следует из закона Хилла и массы подтверждающих его экспериментальных фактов [2, 70, 71, 74]. C другой стороны, столь же несомненно, что если позволить мышце расслабляться при опускающемся грузе, то в общем энергетическом балансе отсутствует вклад теплоты, которая соответствовала бы укорочению, имевшему место в фазе сокращения; напротив, суммарная энергия всего цикла складывается в этом случае только из члена, отвечающего постоянному количеству теплоты, и члена, соответствующего произведенной работе (закон Фенна) [24, 25, 47]. Где-то между этими двумя наборами данных находятся результаты, полученные при условии, что положение прикрепленного к мышце груза фиксируется, как только начинается расслабление, так что мышца не вытягивается до своей начальной длины [71]. В этом случае расслабление часто оказывается термически нейтральным, хотя иногда на тепловых кривых можно наблюдать эффект, соответствующий поглощению небольшого количества тепла. Это означает, что в условиях, когда грузу не дают опускаться, в конце расслабления почти вся избыточная теплота, которая могла бы выделиться при укорочении, должна остаться в энергетическом балансе. На первый взгляд можно было бы полагать, что указанные выше расхождения между данными были обусловлены влиянием опускающегося груза, что могло приводить к автоматической компенсации избыточной теплоты укорочения путем поглощения равного количества теплоты при расслаблении. Однако, по-видимому, это не так, ибо маловероятно, чтобы такие большие тепловые изменения нельзя было обнаружить с помощью точных термоэлементов [165].
Независимо от того, каким методом оценивалось расщепление АТФ, химические данные согласуются между
Химия сокращения
217
собой и в той мере, в какой это позволяет довольно большая ошибка опыта, свидетельствуют о том, что АТФ расщепляется в соответствии с законом Фенна, а не с законом Хилла. Иначе говоря, количество расщепляющегося АТФ пропорционально совершенной работе плюс небольшая постоянная величина порядка 0,20 мкмоль/г на одиночное сокращение независимо от того, насколько укорачивается мышца в фазе сокращения. Даже в случае тетануса есть все основания считать, что расщепление избыточного количества АТФ обусловлено только совершаемой работой, но не укорочением per se. Конечно, при тетанусе постоянная составляющая выделяемого тепла увеличивается пропорционально продолжительности тетануса, т. е. пропорционально так называемой теплоте поддержания сокращения. Если сопоставить теплоту поддержания тетануса, даваемую интегральной формой уравнения Обера (VII. 3), с известной величиной энтальпии гидролиза АТФ, равной 10,6 ккал/моль, то приближенное уравнение для расщепляющегося при тетанусе количества АТФ (в мкмоль/г) можно записать в следующем виде:
— ΔАТФ = -ΔE∕10,6 = = {W + hA/α[1 - exp(-αt)] + hBt}/10,6. (VIII.6)
Это уравнение аналогично уравнению (VIII.5) для одиночного сокращения. Так же как и в уравнении (VIII.5), в нем отсутствуют члены, соответствующие теплоте укорочения. Насколько хорошо оно согласуется с экспериментальными данными, можно видеть из фиг. 58 (кривая II).
К сожалению, мы должны оставить эти проблемы в таком нерешенном состоянии, ибо совершенно очевидно, что их можно решить с помощью эксперимента, а не путем высказывания дальнейших гипотез, которые привели бы к еще большей путанице.
ГЛАВА IX
ВЗГЛЯД В ПРОШЛОЕ И БУДУЩЕЕ
В предыдущих восьми главах мы рассмотрели обширную область, вобравшую в себя данные множества различных наук, и путеводной нитью нам служили блестящие успехи современной цитологии. Придерживаясь этого главного направления, мы были вынуждены лишь поверхностно познакомиться со многими важными проблемами, имеющими первостепенное значение для полного понимания механизма сокращения. К ним относятся, например, детальная структура актина и миозина, природа активных центров, механизм реакции расщепления и теоретические основы самого сокращения. Сейчас мы вновь вернемся к некоторым из этих проблем, так как, по-видимому, именно их экспериментальное решение должно привести к дальнейшим успехам в области мышечного сокращения и именно на них можно было бы посоветовать сосредоточить свои усилия молодым биохимикам, работающим в этой области.
Имеются и другие проблемы, над которыми требуется дальнейшая кропотливая работа. Например, в области энергетики необходимо более подробно изучить важнейшую проблему, касающуюся выделения тепла в двух фазах цикла сокращения, а также выяснить нерешенный вопрос о существовании эндотермической фазы в процессе расслабления, в которой компенсировалась бы теплота укорочения, выделяемая при сокращении. В области химии остается неясной проблема механо-химического эквивалента, величина которого варьирует в широких пределах и обычно гораздо меньше теоретического значения 11,0 ккал/моль, получаемого из уравнения (VII. 6), если разделить его на величину энтальпии расщепления КФ.
Однако по сравнению с этими нерешенными проблемами, которые по существу связаны с методологическими
Взгляд в прошлое и будущее
219
трудностями, успехи, достигнутые молекулярной биологией и биохимией, несоизмеримо велики. Достаточно вспомнить изящную теорию скользящих нитей, замечательный по своей простоте механизм передачи импульсов в мышцу через саркоплазматический ретикулум или столь же блестящие открытия, которые привели к отождествлению триад ретикулума с кальциевым насосом и установили его связь с известными потребностями активных центров миозина и актина в ионах Ca. Мы видим, как далеко удалось продвинуться вперед примерно за десятилетний срок по сравнению с теми неясными и неопределенными позициями, на которых мы находились раньше, когда зыбучие пески неисследованных областей казались беспредельными.
Из этих открытий необходимо извлечь ряд важных уроков. В частности, они показывают, насколько необходимо концентрировать идеи и методы самых разных дисциплин в узловых точках научных проблем и уметь связывать между собой открытия, относящиеся к разным областям знания. Огорчительным примером отсутствия координации в нашей конкретной области явилась неспособность многих ученых осознать важность открытия АТФ-азной активности миозина, сделанного Энгельгардтом и Любимовой в 1939 г. [46], а позднее — нежелание переориентировать свое мышление на основе механизма скользящих нитей, открытого Хансон и Хаксли в 1953 г. [56, 80]. Такой консерватизм был (и до некоторой степени еще остается) серьезным тормозом для дальнейшего продвижения вперед, хотя, наконец, после многочисленных донкихотских сражений с ветряными мельницами сомневающимся все же стало ясно, что источником энергии сокращения действительно служит расщепление АТФ при взаимодействии актина с миозином. Более того, работы представителей школы Сцент- Дьёрдьи [143—145] и Вебера [160], выполненные между 1945 и 1953 гг., уже осветили все основные моменты мышечного сокращения. Исследования проводились на модельных системах волокон и фибрилл, структурные элементы которых были интактными. В этих ранних работах была решена даже проблема механизма расслабления, ибо в них было показано, что при ингибировании
220
Глава IX
АТФ-азной активности миозина АТФ перестает выполнять функцию сократительного агента и становится пластификатором системы актин — миозин [63, 155, 159, 160]. Тем более необходимо воздать должное этим пионерам- исследователям.
Имея в виду эти замечания, обратимся к некоторым белым пятнам на карте знания, где, вероятно, как раз и лежит золото, а быть может, и уран. C этой целью мы разделим обсуждение на две части: сначала перечислим нерешенные проблемы, а затем обсудим термодинамику и теорию сокращения.
А. Нерешенные проблемы
Субъединицы миозина. Вопрос о том, состоит ли миозин подобно многим другим белкам из субъединиц или нет, сам по себе имеет важное значение. Кроме того, решение этого вопроса существенно для выяснения механизма синтеза миозина, поскольку его молекулы, подобно молекулам тропоколлагена, имеют очень большую длину. Хотя несомненно установлено, что существуют полисомные системы, содержащие до семидесяти пяти рибосом [122], и что такие системы имеются в развивающейся мышце, особенно на той стадии, когда впервые можно различить нити миозина, невероятно, чтобы эти полисомы «за один заход» могли синтезировать всю молекулу с молекулярным весом 500 000 и длиной 1500 А, с сочлененными хвостом и головой. Прежде всего мы знаем, что область хвоста состоит, по-видимому, из двух полипептидных цепей, закрученных одна вокруг другой в спираль, и что эти цепи продолжаются в область головы молекулы, где их конформация становится менее упорядоченной. Более вероятно, что полисомная система строит нити спирали по очереди и что затем эти нити, как только они сходят с последней рибосомы, объединяются и закручиваются одна вокруг другой.
В соответствии с тем, что наблюдается для многих других белков, таких, как гемоглобин и миоглобин, можно думать, что отдельные рибосомы, участвующие в синтезе миозина, строят полипептидные цепочки с молекулярным весом около 16000, состоящие примерно
Взгляд в прошлое и будущее
221
из 140 аминокислотных остатков, последовательность которых в каждой субъединице является уникальной [16, 120]. Если это так, то каждую из двух или трех нитей молекулы миозина могли бы синтезировать от десяти до пятнадцати расположенных в ряд рибосом, которые затем соединяют субъединицы с молекулярным весом 16000 воедино с помощью пептидных связей. Последние в ряду рибосомы, на которых синтезируется область головы, должны читать генетический код, совершенно отличный от того, который читают первые рибосомы (их примерно восемь), участвующие в синтезе хвоста. Кроме того, именно «головными» рибосомами должны читаться различные коды для синтеза разных «изомиозинов», отличающихся по своей удельной АТФ-азной активности [122].
Обнаружены ли какие-либо субъединицы, которые могли бы соответствовать субъединицам такой гипотетической генетической схемы? Действительно, такие субъединицы имеются: под влиянием агентов, расщепляющих нековалентные связи, особенно тех, которые разрывают водородные связи (12 M мочевина или 5 M гуанидин ∙ HCl), и даже просто при повышении pH среды примерно до И миозин разрушается на крупные субъединицы с молекулярным весом от 160 000 до 260 000 и, кроме того, появляются меньшие фрагменты с весом от 20 000 до 40 000. Последние составляют 10— 20% общего веса миозина ([122], стр. 337). Однако у разных авторов имеются столь большие расхождения относительно точной величины молекулярного веса этих двух субъединиц, что существует множество разных возможностей построить из них исходную молекулу. Правда, эти возможности все же в какой-то мере ограничены и зависят от того, отдается ли предпочтение двух- или трехнитевой модели миозина. Как мы видели (фиг. 9), двухнитевая модель лучше согласуется с данными, полученными методом дисперсии оптического вращения, а также электронно-микроскопическими и гидродинамическими данными. В самом деле, как следует из электронно-микроскопических данных, молекула миозина имеет две головы, которые могут свободно и почти независимо поворачиваться одна относительно другой. Это
222
Г лава IX
само по себе накладывает дальнейшие ограничения на те возможные положения, которые могут быть заняты субъединицами, и делает почти невозможной модель, в которой меньшая субъединица соединяла бы две головы вместе. Если бы не это ограничение, такая возможность была бы очень заманчивой.
Если для меньшей субъединицы взять молекулярный вес, равный 25 000, и предположить, что на молекулу с молекулярным весом 500 000 приходится две такие субъединицы, то остальная часть молекулы должна была бы состоять из двух длинных цепей весом примерно 220 000 каждая, т. е. на меньшие субъединицы приходилось бы 10% общего веса. Все эти цифры находятся в пределах интервала значений, получаемого из опыта. Тогда можно бы предположить, что основное действие агента, разрывающего водородные связи (например, мочевины), заключается в разворачивании спи- рализованной спирали в хвостовых частях каждой цепи (область ЛММ), а возможно, и сильно закрученных полипептидных цепей в каждой из голов (TMM С-1). Это дало бы две очень длинные субъединицы с требуемым молекулярным весом 220 000.
Но куда поместить меньшие субъединицы? Была высказана мысль, что они могли бы присоединяться по бокам голов и удерживаться там с помощью водородных связей [122]. На первый взгляд эта гипотеза кажется надуманной, но она имеет следующие преимущества перед любой другой: 1) она объясняет, почему агенты типа мочевины вызывают диссоциацию малых субъединиц; 2) она позволяет избежать тех больших трудностей, с которыми сопряжено предположение о том, что эти единицы находятся где-то в главной цепи и служат связующим звеном, например, между хвостом и головами. Во-первых, такое расположение приводило бы к увеличению молекулярного веса больших субъединиц, а во-вторых, представляется невероятным, чтобы продольные водородные связи в главной цепи могли быть достаточно сильными, чтобы выдержать те напряжения, которые молекула испытывает при сокращении; 3) расположение малых субъединиц бок к боку могло бы способствовать сохранению компактной структуры голов.
Взгляд в прошлое и будущее
223
Например, если молекулярный вес каждой головы принять равным 120 000 (фиг. 9), то в полностью вытянутом состоянии их длина равнялась бы 3300 А, так что в нативном состоянии они должны иметь сильно свернутую конфигурацию. Высокое содержание в них пролина также свидетельствует об этом. Присоединение к головам малых субъединиц по типу бок к боку должно, очевидно, стабилизировать такую необычную структуру. Заметим, что TMM C-I содержит одну пролиновую «петлю» примерно на каждые 28 остатков. Следовательно, ширина молекулы в свернутом состоянии должна равняться около 84 А [114].
Концевые группы и группы, находящиеся вблизи активного центра миозина. Как для миозина, так и для актина N-концевая последовательность была определена лишь для небольшого участка цепи. Оба белка характеризуются редкой особенностью, заключающейся в том, что их N-концевые аминокислотные остатки, а именно аспартил в актине [1а] и серил в миозине [118а], ацетилированы. Это объясняет те трудности, которые встречались раньше при попытках идентифицировать N-koh- цевую группу в каждом из этих белков, и доказывает несостоятельность выдвигавшейся в свое время идеи, согласно которой две полипептидные цепи скелета миозина соединены посредством N-N'-концевых связей. Где расположена ацетил-Ы-концевая группа — в голове или в хвосте молекулы — пока еще неизвестно. В миозине ближайшая к N-концу последовательность аминокислот имеет вид ацетил-№сер-сер-асп-ала-асп, в актине — аце- тил-№асп-глу-тре-ала. Недавно было показано, что оба белка уникальны и в другом отношении: они содержат 3-метилгистидин [92а]. Эта аминокислота встречается в природе очень редко (и тем не менее, как было установлено ранее, она присутствует в крови млекопитающих). Ее содержание в актине равно 1 моль на 1 моль актина, а в миозине, по-видимому, 2 моль на 1 моль миозина, по одному аминокислотному остатку в каждом фрагменте TMM C-1, т. е. в каждой голове.
Исследования расположения групп вблизи активного центра миозина, так же как и изучение его аминокислотной последовательности, еще далеки от своего
224
Глава IX
завершения. Трудность здесь заключается в том, что для блокирования различных групп часто используются слишком большие молекулы. Есть основания думать, что многие такие реагенты влияют на форму молекулы миозина вблизи активного центра, не обязательно присоединяясь к нему самому, т. е. что они оказывают аллостерическое действие [122]. Это особенно вероятно в случае применения реагентов, блокирующих SH-группы, таких, как n-хлормеркурибензоат, который, как известно, вначале оказывает слабое активирующее действие на АТФ-азу, а затем ингибирует ее, по мере того как его концентрация, а следовательно, и число блокированных SH-групп увеличивается [122]. Однако в данном случае мы имеем убедительные доказательства того, что две специфические SH-группы (на 1∕2 моль) находятся в непосредственной близости от активного центра, так как добавляемый к миозину Mg • АТФ2- препятствует взаимодействию этих двух групп с SH-реагентом [142а, 147]. Вполне возможно, что молекула АТФ в действительности присоединяется к одной из этих групп путем образования водородной связи с NH2-rpyππoft ее пуринового основания, находящейся в положении 6, а к другой — путем образования аналогичной связи с одним из гидроксилов рибозы. При этом подразумевается, что каждая голова молекулы имеет отдельный активный центр, способный расщеплять молекулу АТФ.
C помощью специфического SH-реагента, 6πc-β-κap6∙ оксиэтилдисульфида, было показано также, что в присутствии актина еще одна SH-группа защищена от атаки [142а]. Это дает основания думать, что каждая из голов миозина имеет по две SH-группы, ориентированные так, что они способны присоединять АТФ, и еще одну SH-группу поблизости, которая взаимодействует с актином. Имеются и другие данные подобного типа, убедительно свидетельствующие о том, что центр связывания с актином отличается от АТФ-азного центра [122]. Большинство количественных данных подтверждает, что на каждую голову миозина (т. е. на молекулярный вес 250 000) приходится по одному центру каждого типа. Это важнейшее открытие имеет первостепенное значение для теории сокращения.
Взгляд в прошлое и будущее
225
Делались также попытки идентифицировать специфические остатки лизина и гистидина вблизи активного центра. Первый из них обнаруживался с помощью реакций тринитрофенилирования или гуанидирования [99, 122]. Но такое сильное воздействие, естественно, должно приводить к нарушению всей структуры в головной области молекулы, где имеется большое количество лизилов. Следовательно, ни один из эффектов ингибирования, наблюдающихся при такой обработке, нельзя считать убедительным доказательством того, что эта группа находится в активном центре. Для гистидила аргументы более убедительны [142]. На самом деле, хотя наблюдаемые факты сами по себе довольно неопределенны, можно полагать, что в активном центре находятся остатки не только гистидина и лизина, но и аргинина, поскольку все эти основные группы способствовали бы связыванию отрицательно заряженных трифосфатных группировок АТФ4' или Mg • АТФ2' независимо от того, какая из них служит истинным субстратом актомиозиновой АТФ-азы.
Этот аспект АТФ-азной активности относится к той области, где в скором времени можно ожидать появления новых волнующих результатов. Именно здесь должен быть найден ответ на самый узловой вопрос, касающийся преобразования энергии.
Механизм реакции. Механизм расщепления АТФ так сильно зависит от природы активного центра миозина, что сейчас еще преждевременно обсуждать его слишком широко. Часто высказывалось предположение, что первой ступенью реакции является образование какого-то фосфорилированного белка по мере расщепления АТФ на АДФ и Фн и что именно этот фосфорилированный белок взаимодействует с актином, вызывая движение [150, 160]. Основные доказательства существования такого промежуточного продукта получены из данных по обмену с HO18H [98]. Как мы видели, группа O18H меченой воды обнаруживается в появляющемся при расщеплении неорганическом фосфате, но не в АДФ (уравнение (II. 2)). Однако существенный вопрос заключается в том, появляется ли в Фн лишь один или несколько меченых атомов кислорода. Если верно
226
Глава IX
последнее, то должно происходить промежуточное фосфорилирование миозина, сопровождаемое отделением воды. Есть основания считать, что такой процесс происходит при очень медленном расщеплении АТФ миозином в присутствии ионов Mg, но не в присутствии Ca2+ [98]. Другие исследователи не смогли найти доказательств образования такой ковалентной фосфорильной связи [138].
В пользу образования фосфорилированного промежуточного продукта при реакции расщепления свидетельствуют также и результаты изучения относительных скоростей освобождения Фн и протонов [ср. уравнение (II.2)]. Например, если следить за изменением pH и освобождением Фн в системе, где скорость расщепления не слишком велика, скажем в миозине в присутствии Mg2+, то оказывается, что протоны всегда освобождаются быстрее, чем Фн [96, 149]. Отсюда делается вывод, что комплекс Фн — миозин диссоциирует достаточно медленно, чтобы его время жизни поддавалось измерению. Но не следует ли это из обычного определения ферментативной реакции, в котором предполагается, что комплекс фермент — продукт имеет определенное время жизни (ср. уравнение (II. 1))? И хотя на основе этих данных построена сложная теория [96, 149], нам не кажется, что более замедленное освобождение Фн обязательно подтверждает участие фосфорилированного промежуточного продукта в сократительном процесссе. Более того, по аналогии с окислительным фосфорилированием в митохондриях [171] такой фосфорилированный промежуточный продукт должен был бы снова реагировать с меченым АДФ и давать меченый АТФ. В действительности не удалось обнаружить такой обратной реакции, несмотря на повторные попытки доказать ее существование [63].
Другой вопрос первостепенной важности, имеющий отношение к механизму расщепления АТФ, касается роли двухвалентных катионов, Mg2+ и Ca2+. Как говорилось выше, ионы Ca активируют расщепление АТФ миозином как в отсутствие, так и в присутствии актина, то они не способны инициировать движение голов миозина и скольжение двух сортов нитей относительно друг друга,
Взгляд в прошлое и будущее
227
если не присутствуют также и ионы Mg. Помимо тех предположений, которые были сделаны ранее (гл. II) [31а], пока еще не было высказано ни одной удовлетворительной гипотезы, которая объясняла бы эти удивительные явления, хотя в последнее время появились некоторые правдоподобные объяснения [149, 168]. Безусловно, необходимо срочно взяться за решение этой проблемы. Однако один существенный вопрос, касающийся процесса связывания, а именно вопрос о структуре хелатных комплексов АТФ с Ca и Mg, наконец прояснился. Как было показано методом ядерного магнитного резонанса [28а], хелатные связи образуются с ОН-группами, присоединенными к двум концевым атомам фосфора в трифосфате, и ни в одной из них NH2-rpyππa пуринового кольца не участвует.
Б. Термодинамика и теория сокращения
Хотя мы еще не знаем точных значений трех важных параметров — изменений внутренней энергии (—ΔE), свободной энергии (—ΔF) и энтропии (—ΔS), — характеризующих химические реакции в мышце, полезно тем не менее рассмотреть термодинамические аспекты процесса сокращения, так как именно они определяют те пределы, в которых эти реакции могут протекать.
В гл. VlI и VIII мы рассмотрели первый закон термодинамики и продемонстрировали, как его можно применить к энергетике сокращения. Было показано, что выделяемая при сокращении энергия состоит из двух слагаемых: теплоты —Q и произведенной работы + W. По мере того как происходит сокращение, мы можем наблюдать и измерять только отношение этих двух параметров. Оба эти члена зависят от химических реакций, лежащих в основе процесса сокращения: от реакции расщепления АТФ, являющейся источником энергии сокращения, и от ломановской реакции ресинтеза, быстро следующей за первой. Так же как и в случае любой другой химической реакции, максимальная работа, которая может быть произведена в результате передачи энергии расщепления сократительным нитям,
228
Глава IX
определяется освобождаемой в процессе реакции свободной энергией -ΔF.
Свободная энергия. Величину свободной энергии -ΔF, освобождаемой в процессе какой-либо химической реакции, можно найти из изотерм Вант-Гоффа, если известна константа равновесия K реакции. (Заметим, что любое изменение свободной энергии, которое не «преобразуется» в работу, проявится в виде теплоты.)
В том случае, когда АТФ вновь образуется из АДФ и КФ, основные уравнения для реакции Ломана можно упрощенно записать в следующем виде1:
(а) K = [АТФ][Креатин]/[АДФ][КФ], (при равновесии)
(б) -ΔF0 = RTlnK,
(в) -ΔF = -ΔF0 - RTln[АТФ][Креатин]/[АДФ][КФ].
(для любой стадии реакции)
(IX.1)
Из уравнения (IX.1, в) видно, что истинное изменение свободной энергии (в расчете на 1 моль), сопровождающее развитие реакции от некоторой данной стадии до равновесного состояния, определяется изменением стандартной свободной энергии -ΔF0 (постоянная величина) и членом, зависящим от относительных концентраций реагентов и продуктов реакции на данной стадии. Очевидно, что, когда реакция достигает равновесия, второй член по определению должен быть равен по величине, но противоположен по знаку члену RTInК (= -ΔF0). Следовательно, дальнейшие изменения свободной энергии —AF невозможны, и реакция прекращается. На любой другой стадии второй, логарифмический член может быть либо отрицательным (отношение концентраций продуктов к концентрациям реагентов меньше 1,0), либо положительным (отношение больше 1,0). Этот член будет либо увеличивать, либо уменьшать фактически освобождаемую свободную энергию на величину, зависящую от значения -ΔF0, ко-
1 В полное уравнение должны входить также члены для Mg•АТФ2- и Mg•АДФ-.
Взгляд в прошлое и будущее
229
торое в свою очередь зависит от константы равновесия.
Мы можем подойти к изменению свободной энергии с другой стороны и считать, что второй член в правой части уравнения (IX. 1, в) представляет собой работу, затрачиваемую на то, чтобы сместить реакцию с данной ее стадии к равновесию. Следовательно, на это расходуется часть изменения стандартной свободной энергии —AFq1 остающаяся же часть может пойти на совершение внешней работы.
В физиологических условиях при 0° константа К реакции Ломана равна примерно 100. Этому значению соответствует величина —AFq1 равная 2,5 ккал/моль. В портняжной мышце лягушки в состоянии покоя концентрация АТФ составляет около ЗмМ, креатина — около 10 мМ и КФ — около 20 мМ. Если учесть величину K1 то это означает, что концентрация свободного АДФ не может превышать 1,5 ∙ IO*2 мМ.
Конечно, при одиночном сокращении или кратковременном тетанусе равновесное состояние сразу же нарушается, так как в результате расщепления АТФ его концентрация уменьшается примерно до 2,5 mM1 а концентрация АДФ возрастает приблизительно до 0,5 mM1 что приведет к смещению реакции Ломана вправо; но количество освобождаемой при этом свободной энергии зависит от того, начнется ли реакция сразу же, как только концентрация АДФ превысит равновесную величину в 1,5 ∙ IO*2/иМ, или она будет заметно запаздывать, так что сможет произойти накопление АДФ (как это следует из измерений pH в сокращающейся мышце [32, 91]). В первом случае условия, в которых протекает реакция, близки к равновесным, и потому, как видно из уравнения (IX. 1,в), свободной энергии будет освобождаться меньше, чем в случае запаздывания. В любом варианте освобождаемая свободная энергия деградирует в тепло, ибо невероятно, чтобы она могла превращаться в работу. И хотя величины энергий очень малы (максимум около 2 ккал/моль в случае длительного запаздывания), нет никаких оснований предполагать, как это часто делается, что реакция Ломана термически нейтральна.
230
Глава IX
Реакция расщепления АТФ (уравнение (VIII. l,a))— непосредственный источник свободной энергии, превращаемой в работу при сокращении мышцы, — коренным образом отличается от реакции Ломана; она представляет собой гидролитическую реакцию, для которой изотерма Вант-Гоффа имеет вид [АДФ][Фн]/[АТФ][Н2О]. Три первые величины очень малы (3 мМ или менее), а концентрация H2O в мышце высока (по меньшей мере 44 Л4), поэтому равновесие реакции расщепления очень сильно сдвинуто вправо, в сторону образования продуктов. Фактически в большей своей части реакция является псевдомономолекулярной, поэтому логарифмический член в правой части уравнения (IX. 1, в) велик, отрицателен и почти постоянен. Следовательно, величина (—ΔF) будет значительно превышать величину (—ΔF0). К сожалению, точного значения для (—ΔF) мы не знаем; значения, получаемые в опытах in vitro, неточны и лежат в пределах от 7 до 10,5 ккал!моль [125, 169].
Как мы увидим, неопределенность в величине —ΔF для реакции расщепления АТФ не позволяет точно оценить, насколько может изменяться энтропия в процессе реакции. Единственная надежная величина, которой мы располагаем, — общее изменение энергии, или энтальпии (—ΔE), в живой мышце, соответствующее сумме реакций расщепления и Ломана, — равна примерно 10,5 ккал!молъ [25]. Максимальный вклад реакции Ломана в эту величину составляет около 2 ккал!молъ, следовательно, на реакцию расщепления приходится около 8,5 ккал!молъ. Это значение находится в пределах интервала, приведенного выше для величины — ΔFy откуда следует, что изменения энтропии при расщеплении АТФ равны нулю или, во всяком случае, очень малы.
При количественной оценке изменений свободной энергии необходимо учесть то количество теплоты, которое выделяется при нейтрализации протонов, освобождаемых в процессе реакции расщепления и реакции Ломана. При расщеплении 1 моль АТФ в расчете на обе реакции поглощается от 0 до 0,2 экв. протонов. Однако в мышцах, отравленных ФДНБ, когда реакция Ломана ингибирована, при расщеплении освобождается от 0,8
Взгляд в прошлое и будущее
231
до 1,0 экв. протонов, и теплота, связанная с их нейтрализацией, может вносить существенный вклад в суммарные изменения энергии [125]. C другой стороны, теплота нейтрализации может в действительности как раз скомпенсировать ту теплоту, которая отсутствует из-за ингибирования реакции Ломана (максимум 2 ккал/моль). В результате в обоих случаях получаются почти одинаковые значения для —∆5,.
Энергия, или энтальпия, активации. В предыдущем разделе предполагалось, что реакция продолжается до тех пор, пока изменения свободной энергии (—ΔF) при образовании продукта из реагентов положительны. Однако такое предположение является слишком упрощенным. Оно справедливо лишь для немногочисленных спонтанных реакций, у которых так называемая энергия, или энтальпия, активации очень мала (примером спонтанной реакции может служить самовоспламенение белого фосфора на воздухе). Но в большинстве случаев молекулы вступают в реакцию лишь после того, как они приобретут дополнительную энергию сверх той, какую они имеют в основном состоянии. Эту дополнительную энергию и называют энергией, или энтальпией активации. Как известно из лабораторной практики, дополнительная энергия часто обеспечивается путем нагревания реагентов, так как оно увеличивает частоту соударений молекул, благодаря которым они и приобретают энергию, необходимую для вступления в реакцию. В живых системах ту же роль играют особые катализаторы, называемые ферментами. Функция всех ферментов заключается в том, чтобы сблизить реагирующие молекулы, т. е. увеличить упорядоченность их расположения и уменьшить конфигурационную энтропию. В результате такой новой упорядоченности в молекуле возникают дополнительные напряжения, которые в случае гидролитических реакций, в частности реакции расщепления АТФ, дестабилизируют молекулу субстрата и благодаря этому очень сильно уменьшают величину дополнительной энергии, необходимой для активации. В том случае, когда реакция расщепления АТФ катализируется актомиозином или фибриллами, ее энергия активации составляет около 20 ккал/моль. В отсутствие фермента
232
Глава IX
эта величина астрономически увеличивается, ибо известно, что при физиологических pH АТФ можно кипятить в разбавленных буферах в течение многих дней и никакого существенного расщепления не наблюдается. То же относится к реакции Ломана и к большинству реакций гликолитического цикла, катализируемых ферментами. Заметим, что величина изменения свободной энергии (—AF) реакции остается неизменной независимо от присутствия фермента.
Энтропия и второй и третий законы термодинамики. Перейдем теперь к области второго и третьего законов термодинамики. В краткой форме второй закон утверждает, что любая система стремится к состоянию наибольшего беспорядка. Мерой изменения степени упорядоченности, происходящего при химических и физических процессах, служит изменение энтропии AS. Положительная величина AS означает, что при таких процессах система становится менее упорядоченной, а отрицательная свидетельствует о том, что система стала более упорядоченной, или «кристалличной». Хорошим примером положительного изменения энтропии служит плавление кристалла, в результате которого неупорядоченность системы явно возрастает. Обратный процесс кристаллизации сопровождается отрицательными изменениями энтропии, т. е. уменьшением степени неупорядоченности (или увеличением упорядоченности) системы.
У ферментов и белков, которыми мы здесь интересуемся, упорядоченная структура «кристаллической решетки» в нативной молекуле поддерживается главным образом водородными связями внутри полипептидных цепей и между отдельными цепями и, кроме того, стабилизируется ионными взаимодействиями между противоположно заряженными боковыми группами, а также ван- дерваальсовыми силами между неполярными участками цепей. При существенном повышении температуры (обычно до 60° и выше) возросшая энергия теплового движения и колебательная энергия молекулы приводят к разрыву ряда водородных связей, в результате чего очень сложная вторичная и третичная структура разрушается и молекула переходит к более неупорядоченной, клубкообразной конформации. Хорошим примером слу-
Взгляд в прошлое и будущее
233
жит плавление длинных упорядоченных тройных спиралей коллагена. Для коллагеновых волокон млекопитающих оно наступает примерно при 61° и сопровождается очень быстрым сжатием, в процессе которого волокна в изометрических условиях способны развить напряжение до 10 кг/см2, а при изотонических условиях совершать большую работу. Сжатие связано с положительными изменениями энтропии, а работа совершается за счет освобождаемой свободной энергии (—ΔF>0).
Связь между изменениями энтропии и изменениями свободной и внутренней энергии должна быть найдена здесь интуитивно. Мы воспользуемся третьим законом термодинамики, или тепловой теоремой Нернста, которая утверждает, что по мере уменьшения температуры до абсолютного нуля система стремится к состоянию наибольшего порядка, т. е. состоянию с наименьшей энтропией. При этой температуре энтропия и внутренняя энергия идеальных систем стремятся к нулю; другими словами, системы становятся максимально упорядоченными. Из этого следует, что при повышении температуры энтропия системы, а вместе с нею и внутренняя энергия возрастают. Поэтому можно было бы предположить, что произведение изменений энтропии ΔS на абсолютную температуру Т, т. е. величина ΓΔS, имеет размерность энергии. Это действительно так: ΓΔS — тепловой член, т. е. он определяет, как изменяется теплота при изменении энтропии. В зависимости от того, является ли этот член положительным или отрицательным, теплота будет выделяться или поглощаться, а внутренняя энергия E соответственно уменьшаться или увеличиваться. Изменение внутренней энергии в результате какой-либо реакции мы можем записать в виде
-ΔE = -ΔF-TΔS = (IX.2)
= -Q + W (из первого закона, уравнение (VII.1)
Как уже отмечалось, величина -ΔF представляет собой максимальную работу, которая может быть получена в результате реакции; другими словами, это предельное значение работы W, которая может быть произведена системой. Найти систему, для которой -ΔF = W (т. е.
234
Глава IX
термодинамическая эффективность —W∕ΔF≈∖), очень трудно: в большинстве реальных систем некоторая часть освобождаемой свободной энергии деградирует в тепло. Поэтому механическая эффективность (—W∕ΔE) всегда меньше термодинамической.
Чтобы применить эти соображения к сократительной системе, необходимо знать величины хотя бы двух параметров в уравнении (IX. 2) для реакции Ломана и реакции расщепления АТФ. В настоящее время нельзя сказать, что мы располагаем достаточно точными данными, которые позволили бы нам не догадываться, а судить об истинном положении дел. Например, если величину —ΔF для реакции расщепления принять равной 7—10,5 ккал/моль [169], а для реакции Ломана — около 2 ккал/моль, то изменение свободной энергии для обеих реакций должно составлять 9—12,5 ккал/моль. Так как наблюдаемое на опыте изменение энтальпии составляет 10,5 ккал/моль, уравнение (IX. 2) дает для TΔS величину, находящуюся в пределах от —1,5 до 2,0 ккал/моль. Соответствующее изменение энтропии при 0° составляет от —5 до +7 энтропийных единиц. Отсюда следует, что изменения энтропии для этих реакций не могут существенно отличаться от нуля, т. е. для обеих реакций величина —AE почти совпадает с величиной —Af. Смысл этого вывода заключается в том, что выделяемая при сокращении теплота появляется в результате деградации свободной энергии, а не деградации энтропии.
Теории сокращения. Из всех процессов, которые должна учитывать любая теория сокращения, самым важным является процесс превращения энергии и связанное с ним движение голов миозиновых молекул, в результате которого мономеры актина подталкиваются или подтягиваются по направлению к центру A-диска. В настоящее время имеется только одна сколько-нибудь глубокая теория, принадлежащая Дэвису [31], в которой предпринята попытка решить эту проблему; правда, ей предшествовала блестящая работа Хаксли [85а], заслуживающая более тщательного изучения.
Основное предположение теории Дэвиса заключается в том, что в области активного центра миозина имеются короткие, довольно неупорядоченные участки полипеп-
Фиг. 59. Схема, иллюстрирующая теорию Дэвиса [31].
А — предполагаемая схема покоящейся молекулы миозина (голова молекулы вытянута и АТФ связан с активным центром); Б — голова молекулы миозина в сокращенном состоянии; оно наступает после образования связи между кальцием и АДФ актина и перехода полипептидной цепи в α-спиральную конформацию; В — другой вид концевого участка полипептидной цепи головы миозина в вытянутом неупорядоченном состоянии и в укороченной α-спиральной конформации.
236
Глава IX
тидной цепи, которые могут принимать две различные конфигурации (фиг. 59). В покоящейся мышце, когда ионы Ca отсутствуют, сохраняется хотя и беспорядочная, но вытянутая «змеевидная» форма полипептидной цепи, так как отрицательный заряд Mg • АТФ2", присоединенного к активному центру, отталкивается другим «фиксированным» отрицательным зарядом, расположенным где-то по соседству. Когда начинается активация, поступившие из триад ионы Ca присоединяются к связанному АТФ и образуют мостик между ним и АДФ, прикрепленным к актину. Это нейтрализует отрицательный заряд Mg • АТФ2“, в результате чего полипептидная цепочка, имевшая беспорядочную конформацию, может теперь укоротиться и частично перестроиться в а-спираль благодаря образованию водородных связей. Этот процесс сопровождается освобождением потенциальной энергии, которая была запасена вытянутой полипептидной цепочкой вследствие первоначального отталкивания зарядов (фиг. 59,А). Укорочение полипептидной цепи с образованием а-спирали приводит к двум эффектам. Во- первых, актин перемещается относительно голов миозина на один шаг; во-вторых, присоединенный АТФ перемещается в область гипотетического АТФ-азного активного центра, расположенного вблизи головы с одной из ее сторон. Заметим, что благодаря соответствующему расположению этого центра и наклону голов относительно остальной части миозиновой нити присоединенный актин при спирализации полипептидной цепи подтягивается в сторону М-линий.
Конечная стадия этой части цикла сокращения — расщепление АТФ в АТФ-азном центре и быстрая замена его новой молекулой Mg • АТФ2". Этот цикл может самопроизвольно повторяться до тех пор, пока присутствуют ионы Ca. Но когда они в процессе расслабления удаляются, присоединенная молекула Mg • АТФ2" снова отталкивается фиксированным отрицательным зарядом, а-спираль разрушается, так что полипептидная цепь опять принимает неупорядоченную конформацию и может перейти в вытянутое состояние. Схематически этот процесс изображен на фиг. 60, которая не требует объяснений.
Фиг. 60. Последовательные ступени реакции, приводящей к отдельному миниатюрному циклу сокращения голов миозиновой нити, в результате которого соединенный с этой нитью актин проталкивается примерно на 100 Å
(изображен также обратный процесс возвращения в первоначальное состояние) [31].
238
Глава IX
Дэвис приводит подробные вычисления, показывающие, что изменения свободной энергии и энтропии, которые должны быть связаны с описанным выше процессом, не противоречат тому, что нам уже известно об образовании а-спиралей в синтетических полипептидах. Каким образом в действительности освобождается АТФ и как он далее используется, не совсем ясно. Более того, автор, по-видимому, не учел освобождения энергии при действии АТФ-азы, если только он не предполагает, что эта энергия крайне мала( вследствие того что структура АТФ нарушается на более ранней стадии отталкивания зарядов) и ею можно пренебречь. Однако мы не хотим спорить о количественных оценках изменений энергии, происходящих в рамках гипотетической схемы такого типа, ибо очевидно, что если нет достоверных элементарных сведений даже об изменениях свободной энергии и энтропии при расщеплении АТФ такой простой системой, как миозин, то невозможно даже приблизительно оценить, каким изменениям могут подвергнуться эти параметры в процессах, предполагаемых схемой, показанной на фиг. 59.
Более существенный недостаток предлагаемого механизма заключается в том, что он: 1) не учитывает разделения центра, связывающего актин, и АТФ-азного центра в миозине и 2) не объясняет, как может образоваться Са-мостик, если к ATΦ4~ уже присоединен Mg2+. Что касается второго вопроса, то нетрудно было бы модифицировать теорию, предположив в соответствии со сказанным выше, что в присутствии тропомиозина и тропонина в спиралях актина роль Ca2+ заключается в том, чтобы нейтрализовать гипотетические отрицательные заряды на «тропонине» и таким образом дать возможность головам миозина с присоединенным к ним Mg • АТФ2" сблизиться с мономерами актиновой суперспирали. Вопрос о разделении центров более серьезен.
Нам представляется более приемлемой следующая альтернатива: 1) из-за отталкивания зарядов актин не может присоединиться к специфическому связывающему центру на миозине, когда с расположенным поблизости АТФ-азным центром связаны ионы Mg∙ATΦ2^ или АТФ4*; 2) как только ионы Ca нейтрализуют заряды на
Взгляд в прошлое и будущее
239
тропонине, актин сам может присоединиться к миозину. Это присоединение обязательно вызывает искажение структуры в головной области молекулы миозина и тем самым «запускает» расщепление АТФ в АТФ-азном центре (см. дальше) ; 3) для того чтобы привести систему в движение, в области головы должны произойти какие- то изменения структуры типа перехода клубок — спираль или наоборот, но эти изменения, как мы предполагаем, осуществляются за счет свободной энергии расщепления; 4) если в систему не поступают новые молекулы АТФ, она будет находиться в состоянии окоченения, при котором молекулы актина все еще остаются присоединенными к связывающим центрам миозина. Но как только запас Mg-АТФ2- пополнится, цикл может повториться, если Ca2+ все еще остается на своих местах на тропомиозине и нейтрализует его заряд. Такую модификацию можно было бы ввести в теорию без изменения ее основных предпосылок.
Какой бы привлекательной ни была эта теория, можно представить себе и другие механизмы превращения энергии в движение. Как мы видели, краеугольным камнем теории является переход от неупорядоченной конформации цепи в области головы миозина к a-спиральной. Именно в результате такого перехода актиновая нить перемещается на один шаг за каждый миниатюрный цикл сокращения. Другими словами, считается, что процесс сопровождается выигрышем в упорядоченности, т. е. потерей конфигурационной энтропии. При этом обязательно должна выделяться теплота, потому что член —TAS положителен. Процесс обратим, так что на следующей стадии цикла теплота вновь поглощается и т. д. В результате при изменениях энтропии теплота может и не выделяться. Все это так, но с тем же успехом можно было бы, по-видимому, посмотреть на происходящее с диаметрально противоположной точки зрения и заменить начальное отрицательное изменение энтропии на положительное по аналогии с другими белковыми системами.
Коллаген, сжимающийся при нагревании, служит хорошим примером системы, которая может развивать напряжение и совершать работу в результате разрушения
240
Глава IX
спирали, т. е. при увеличении степени неупорядоченности и возрастании энтропии. При нагревании примерно до 61° тройная спираль этого белка разрушается в результате того, что стабилизирующие ее водородные связи рвутся вследствие увеличения энергии теплового движения и энергии колебаний. При этом неполярные группы, спрятанные ранее внутри спирали, выходят наружу и имеют тенденцию к агрегации, подобно молекулам масла в воде. При нагревании коллагена из сухожилий быка (этот белок характеризуется большим числом поперечных связей) молекулы сжимаются с большой силой и развивают напряжение порядка 10 кг/см2 и более или (если они сжимаются в изотонических условиях) совершают большую работу. C точки зрения термодинамики в процессе изменения энтропии молекулы поглощают тепловую энергию —TAS1 и поэтому их внутренняя энергия E временно увеличивается. По мере того как они сжимаются и совершают работу или развивают напряжение, некоторая часть этой вновь приобретенной внутренней энергии снова теряется в виде свободной энергии —AF1 которая может превращаться в работу. Другими словами, эта система работает как энтропийная машина. Все эти изменения частично обратимы, так как с понижением температуры внутренняя энергия уменьшается, что создает условия для спонтанного образования некоторого количества новых тройных спиралей.
Применяя аналогичное рассуждение для мышцы, мы предполагаем, что самым первым изменением в процессе каждого миниатюрного цикла сокращения является разрушение спирального участка полипептидной цепи в области головы миозина и образование более беспорядочной, сильно свернутой конформации. Это должно было бы происходить после нейтрализации заряда ионами кальция, когда голова миозина временно соединяется с мономером актина посредством образования а) нековалентной связи между актином и центром его присоединения на миозине и б) по-видимому, ионной связи между Mg • АТФ2" или ATΦ4~, уже присоединенными к соответствующему месту на миозине, и аналогичным центром на актине. Далее необходимо предположить, что именно последняя связь служит причиной дестабилиза¬
Взгляд в прошлое и будущее
241
ции спирали, которая затем разрушается таким же образом, как и сжимающийся при нагревании коллаген. В процессе укорочения полипептидная цепочка тянет за собой АДФ-группировку АТФ, оставляя концевую фосфатную группу на актиновом партнере. Освобождаемая свободная энергия либо деградирует в теплоту, большая часть которой снова поглощается сокращающимся спиральным участком головы вследствие положительных изменений энтропии, либо поглощается непосредственно, так как внутренняя энергия E полипептидной цепи возрастает. В процессе сокращения вся вновь приобретенная внутренняя энергия или часть ее затем освобождается снова в виде свободной энергии —ΔF, которая идет на совершение внешней работы. Неиспользованная часть свободной энергии целиком выделяется в виде теплоты.
К концу процесса разрушения спирали внутренняя энергия укоротившейся полипептидной цепи вследствие освобождения свободной энергии уменьшится примерно до такой же величины, какой обладала первоначальная спираль, поэтому процесс образования новой спирали может происходить почти спонтанно и без больших изменений энергии. В результате, по мере того как из саркоплазмы поступают новые молекулы Mg∙ATΦ2~ или АТФ4“, головы снова вытягиваются и становятся готовыми к следующему циклу.
Преимущество такой схемы заключается, во-первых, в том, что она аналогична уже известному процессу и содержит минимальное число стадий, тогда как образование спирали из неупорядоченной цепи на той стадии сократительного цикла, которая сопровождается выделением энергии (как это предполагается в рассмотренной выше теории), — это нечто совершенно новое и сопряжено с некоторыми сомнительными энергетическими изменениями. Во-вторых, в этой схеме предлагается простой механизм превращения свободной энергии расщепления АТФ в работу с помощью энтропийной машины. В первой теории, наоборот, предполагаются отрицательные изменения энтропии, которые обязательно должны сопровождаться потерей энергии в виде тепла, так как величина —TAS положительна. Заметим, что обе теории строго применимы только для полного цикла. В них
242
Г лава IX
не учитывается теплота укорочения (хотя делались и обратные утверждения), так как изменения энтропии, благодаря которым эта теплота может выделиться, считаются обратимыми в каждый момент времени.
Независимо от того, какая из схем принимается, необходимо сделать предположение относительно возможного числа связей между актином и миозином при различных скоростях укорочения, которые в свою очередь зависят от нагрузки. Если, например, исходя из данных, приведенных на фиг. 43, сравнить степень перекрывания актиновых и миозиновых нитей с развиваемым напряжением, то можно видеть, что для того, чтобы мышца развила напряжение, соответствующее небольшой нагрузке, и начала поднимать груз, требуется очень небольшая степень перекрывания. В то же время для развития максимального изометрического напряжения перекрывание должно быть максимальным. Так как степень перекрывания непосредственно свидетельствует о потенциальных возможностях связывания голов миозина с актиновыми мономерами, очевидно, что при малых нагрузках и больших скоростях укорочения в любой данный момент образуется лишь небольшое число связей и это в свою очередь определяет количество расщепляемого АТФ и число миниатюрных циклов энтропийных изменений. C другой стороны, при очень больших нагрузках количество образованных связей близко к максимально возможному их числу, соответствующему изометрическим условиям; но в данном случае очень большая нагрузка настолько ограничивает скорость и степень укорочения, что это должно автоматически уменьшить скорость разрыва связей на конечной стадии каждого миниатюрного цикла и, таким образом, снова ограничить степень расщепления АТФ, от которого зависит разрыв связи.
Как мы видели в гл. VII и VIII, это как раз то, что наблюдается на опыте. При очень малых и очень больших нагрузках как выделяемая суммарная энергия, так и общее количество расщепляющегося АТФ при одиночном сокращении имеют гораздо меньшую величину, чем при промежуточных нагрузках, при которых может быть произведена также максимальная работа. Последнее объясняется тем, что при промежуточных нагрузках два
Взгляд в прошлое и будущее 243
противоположных эффекта, а именно увеличение числа образующихся связей и уменьшение вероятности их разрыва, как раз компенсируют друг друга. Эти предположения естественным образом возникают в теории скользящих нитей и не следуют ни из одной из теорий превращения энергии, которые здесь обсуждались. Ободряет, во всяком случае, то обстоятельство, что они могут быть введены в обе теории. Остается лишь подождать и посмотреть, позволит ли эксперимент сделать выбор между двумя противоположными точками зрения на предполагаемые энтропийные изменения и, таким образом, создать твердую основу для следующего шага вперед.
Притом клянусь, как честный Пэк, Что если мы вам угодили И злобных змей не разбудили, То лучше все пойдет потом. Давайте руку мне на том. Коль мы расстанемся друзьями, В долгу не буду перед вами.
Шекспир, Сон в летнюю ночь
Фото I. Электронная микрофотография продольного среза четырех фибрилл мышцы лягушки, показывающая расположение актиновых и миозиновых нитей.
Расстояние между Z-пластинками (на фото темные поперечные линии) около 2,5 мк. Вблизи Z-пластинок видны пузырьки саркоплазматического ретикулума.
Фото II. Электронные микрофотографии отдельных молекул миозина, полученные с помощью метода напыления.
Средняя длина молекул около 1500 Å. Видны глобулярные „головы“ и длинные „хвосты“.
Фото III. Препарат нитей миозина из поясничной мышцы кролика (негативное окрашивание).
Длина интактных нитей около 1,6 мк; на фото видны также разорванные нити. Поверхность нитей покрыта небольшими выступами — „головами“ миозиновых молекул.
Фото IV. Очищенный препарат F-актина, приготовленный непосредственно из мышцы, из которой предварительно был удален миозин.
Нити F-актина имеют структуру двойной спирали. Каждая из маленьких бусинок, или мономеров, актина имеет диаметр около 55 Å.
Фото V. Искусственно приготовленные толстые нити, полученные путем понижения ионной силы раствора миозина от 0,6 до 0,15.
Длина нитей варьирует, ее максимальная величина 1,4 мк. „Головы“ миозиновых молекул выступают по бокам всюду, кроме оголенной центральной области длиной около 1700 Å, где перекрываются хвосты молекул.
Фото VI (слева). I-диск из гомогенизированной мышцы.
Видно, как актиновые нити I-диска присоединены к Z-пластинке.
Фото VII (справа). Влияние обработки отдельного I-диска, показанного на фото VI, раствором тяжелого меромиозина.
Обратите внимание на стреловидные структуры в тех местах, где к каждому мономеру актина присоединилась молекула TMM. Отметьте также различное направление стрел с каждой стороны от Z-пластинки.
Фото VIII. Электронная микрофотография, показывающая тонкую структуру саркомера.
Обратите внимание на тонкие актиновые нити I-диска и на то, как они проходят между миозиновыми нитями A-диска вплоть до краев H-зоны. Заметьте также головы молекул миозина, выступающие из толстых нитей всюду, за исключением центральной части саркомера около утолщенной M-линии.
Фото IX. H-зона саркомера при большем увеличении; более детально видны головы молекул миозина и M-линия.
Фото X. Электронная микрофотография поперечного сечения трех фибрилл, на которой видна укладка нитей.
Обратите внимание на гексагональное расположение нитей актина вокруг нитей миозина в центральной фибрилле. Внизу показано сечение части фибриллы, приведенное в области I-диска, где можно видеть только актиновые нити. Вверху слева — сечение другой фибриллы, проведенное в области M-линии, где объединяются хвосты миозиновых молекул; поперечное сечение каждой нити имеет форму треугольника.
Фото XI. Саркоплазматический ретикулум портняжной мышцы лягушки после обработки ее ферритином.
Обратите внимание на маленькие темные частички ферритина в тех частях поперечных трубочек, которые проходят вблизи Z-пластинок, и на утолщенные пузырьки триад с каждой стороны от этих темных трубочек. Триады соединены с нерегулярно расположенными продольными пузырьками, проходящими вдоль сократимых нитей; в триадах видны гранулы гликогена.
Фото XII. Изображение области триад саркоплазматического ретикулума при большем увеличении.
Обратите внимание на то, что в этой мышце (портняжная мышца лягушки) структуры триад располагаются в области Z-пластинки. Отметьте также, что в этом случае ферритин проник только в центральные поперечные элементы триад (косой срез). В продольных элементах ферритин отсутствует.
Фото XIII. Поперечная трубочка на большем протяжении.
C каждой стороны от нее расположены продольные пузырьки. Обратите внимание, что поперечные трубочки проходят в области Z-пластинки.
Фото XIV. Косой срез через саркоплазматический ретикулум из мышцы стенки плавательного пузыря рыбы.
Поперечные трубочки выглядят как темные кружки, лежащие вблизи места соединения A- и I-дисков, а не в области Z-пластинки, как у лягушки. Отчетливо видны триады, с каждой стороны от которых параллельно миофибриллам отходят продольные пузырьки. Обратите внимание, что изображение очень похоже на схему мышцы млекопитающих (фиг. 27).
Фото XV. Препарат фрагментов саркоплазматического ретикулума из мышцы кролика после ее гомогенизации.
Фрагменты были обработаны Ca2 + , который проник в некоторые из них (темные частички).
Фото XVI. Фрагменты саркоплазматического ретикулума, обработанные вначале щелочью, а затем Hg-фенилазоферритином.
Обратите внимание, что SH-реагент присоединяется к частицам по их периферии. Во многих местах можно видеть трехслойную структуру мембраны. Изображенные на фото частицы скорее всего возникают из продольных утолщений триад и из пузырьков, показанных на фото XI и XIV.
Фото XVII. Пузырьки, обработанные, как и в предыдущем случае, «ферритином», но без предварительной обработки щелочью.
В этом случае вся поверхность оказывается покрытой „ферритиновыми“ гранулами, которые часто уложены рядами.
Фото XVIII. Двуглавая мышца плеча мыши, зажатая между предметными стеклами и затем обработанная иодацетилтиохолином для окрашивания холинэстеразы в областях концевых пластинок.
Обратите внимание, что концевые пластинки сгруппированы в центре мышцы в виде кольца.
ЛИТЕРАТУРА
1. Abbott В. С, Aubert X., Hill A. V, The absorption of work by a muscle stretched during contraction, Proc. R. Soc. B, 139, 86 (1951).
la. Alving R. E., Laki K∙, The N-terminal sequence of actin, Biochem, 5, 2597 (1966).
2. Aubert X, Le mécanisme contractile in vivo: aspects mécaniques et thermiques, J. Physiol. (Paris), 48, 105 (1956).
3. Aubert X, Le couplage énergétique de la contraction musculaire, Thèse d’agrégation, Université Catholique de Louvain, Bruxelles, Editions Arscia, 1956.
4. Aubert X, Tension and heat production of frog muscle teta- nized after intoxication with FDNB*, Pflügers Arch. ges. Physiol, 281, 13 (1964).
5. Barany Μ, Nagy B, Finkelmann F, Chrambach А, Studies on the removal of the bound nucleotide of actin, J. biol. Chem, 236, 2917 (1961); See also: Bârâny M, Tucci A. F, ConoverT. E, J. molec. biol, 19, 493 (1966).
6. Bârâny M, Gaetjens E, Bârâny K, Karp E, Comparative studies of rabbit cardiac and skeletal myosins, Arch. Bio- chem. Biophys, 106, 280 (1963).
7. Bârâny M, Finkelmann F, Therattil-Anthony T, Studies on the bound calcium of actin, Arch. Biochem. Biophys, 98, 28 (1962).
8. Baranyi E. H, Edman K. A. P, Palis A, The effect of ATP and metal ions on viscosity of solutions of actomyosin, 1961, quoted by D. M. Needham in Structure and Function of Muscle, vol. II, ed. G. H. Bourne, Academic Press, New York, pp. 67 and 96, 1960.
9. Baker P. F, Hodgkin A. L, Shaw T. I, Replacement of the protoplasm of a giant nerve fibre with artificial solutions, Nature, Lond, 190, 885 (1961).
10. B e n d a 11 J. R, A study of the kinetics of the fibrillar ATP-ase of rabbit skeletal muscle, Biochem. J, 81, 520 (1961).
11. Bendall J. R, The myofibrillar ATP-ase activity of various animals in relation to ionic strength and temperature: in Biochemistry of Muscular Contraction; ed. J. Gergely, Little Brown and Co, Boston, Mass, p. 87, 1964.
12. B e n d a 11 J. R, Relaxation of glycerol-treated muscle fibres by ethylenediamine tetraacetate, Arch. Biochem. Biophys, 73, 283 (1958).
Литература
245
13. Bendall J. R., Further observations on a factor effecting relaxation of ATP-shortened muscle-fibre models and the effect of Mg and Ca ions upon it, J. Physiol., 121, 232 (1953).
14. Bendall J. R., Post-mortem changes in muscle: in Structure and Function of Muscle, vol. Ill, ρ. 227 (1964).
15. Birks R., Huxley H. E., Katz B., The fine structure of the neuromuscular junction of the frog, J. Physiol., 150, 134 (1960).
16. Bishop J., Leahy J., Schweet R., Formation of the peptide chain of haemoglobin, Proc. Nat. Acad. Sei. U.S.A., 46, 1030 (1960).
17. BowenW. J., Glycerol-treated muscle as a model of contraction, in Biochemistry of Muscular Contraction, p. 441, 1964.
18. BoyerP. D., Oxygen exchange and oxidative phosphorylation studies as related to possible phosphorylations accompanying muscle contraction, Biochemistry of Muscle Contraction, ed. J. tion, in Biochemistry of Muscular Contraction, p. 441, 1964.
19. Bozler E., Evidence for an ATP-actomyosin complex in relaxed muscle and its response to Ca ions, Am. J. Physiol., 168, 760 (1953).
20. B r i g g s F. N., F u c h s F., The site of calcium-binding in the activation of myofibrillar contraction, Fed. Proc., 26, 598 (1967).
21. Briggs F. N., Portzehl H., The influence of relaxing factor on the pH dependence of the contraction of muscle models, Biochim. biophys. Acta, 24, 482 (1957).
22. Burge R. E., Elliot G. F., The thermal dependence of (i) the decay of the twitch and tetanic tension, and of (ii) elongation after stimulation, J. Physiol., 169, 86B (1963).
23. Cain D. F., I n f a n t e A. A., D a v i e s R. E., Chemistry of muscle contraction, Nature Lond., 196, 214 (1962).
24. Carlson F. D., Hardy D., Wilkie D. R., Total energy production and PC hydrolysis in the isotonic twitch, J. gen. Physiol., 46, 851 (1963); See also J. Physiol., 195, 157 (1968).
25. Carlson F. D., Hardy D., Wilkie D. R., Heat production and PC splitting in muscle, J. Physiol., 189, 209 (1967).
26. Carlson F. D., Siger A., The mechanochemistry of muscular contraction. I. The isometric twitch, J. gen. Physiol., 44, 33 (1960).
27. Couteaux R., The structure of the motor end-plate, in Symposium on Muscle, 1966 (Hungarian Acad, of Sciences, Budapest — in press), 1966.
28. Couteaux R., Motor end-plate structure, in Structure and Function of Muscle, vol. 1, 337—378 (1960).
28a. C о h n Μ., Hughes T. R., Jr., Nuclear magnetic resonance spectra of ADP and ATP. II. Effect of complexing with divalent metal ions, J. biol. Chem., 237, 176 (1962).
29. Davies R. E., The role of ATP in muscle contraction: in «Muscle», Symposium held at University of Alberta, Pergamon Press, London, pp. 49—69, 1965.
246
Литература
30. D a V i е s R. E., Kushmerick Μ. J., Larson R. E., ATP, activation and the heat of shortening of muscle, Nature, Lond., 214, 148 (1967).
31. Davies R. E., A molecular theory of muscle contraction, Nature, Lond., 199, 1068 (1963).
32. D i s t è c h e A., Contribution à Ietude des échanges d’ions hydrogène au cours du cycle de la contraction musculaire, Mémoires de !’Académie Royale de Belgique, Tome XXXII, 1960.
33. Drabikowski W., Gergely J., The effect of temperature of extraction and of tropomyosin on the viscosity of actin in Biochemistry of Muscle Contraction, p. 125, 1964.
34. Dydynska Μ., Wilkie D. R., The chemical and energetic properties of muscle poisoned with FDNB, J. Physiol., 184, 751 (1966).
35. Ebashi S., Kodama A., Native tropomyosin-like action of troponin on trypsin-treated myosin B (actomyosin), Jap. J. Bio- chem., 60, 733 (1966).
35a. Ebashi S., Ebashi F., Kodama A., Troponin as the Ca receptive protein in the contractile system, Jap. J. Biochem., 62, 137 (1967); See also Biochem. biophys. res. comm., 31, 647 (1967).
36. EbashiS., Calcium binding and relaxation in the actomyosin system, Jap. J. Biophem., 48, 150 (1960).
37. Ebashi S., Relaxation and removal of calcium by muscle particulate fraction, Jap. J. Biochem., 50, 77 (1961).
38. Ebashi S., Third component participating in the superprecipitation of natural actomyosin, Nature, Lond., 200, 1010 (1963).
39. E b a s h i F., E b a s h i S., Removal of calcium and relaxation in actomyosin systems, Nature, Lond., 194, 378 (1962).
40. Ebashi S., Lipmann F., ATP-Iinked concentration of Ca ions in a particulate fraction of rabbit muscle, J. Cell. Biol., 14, 389 (1962).
4L Eccles J. C., The ionic hypothesis and the active membrane, The neurological basis of mind, Clarendon Press, Oxford, p. 35, 1952.
42. E d m a n K. A. P., The relation between sarcomere length and active tension in isolated semitendinosus fibres of the frog, J. Physiol., 183, 407 (1966).
43. Elliott G. F., LowyJ., Worthington C. R., X-ray diffraction stydies of resting living muscle, J. molec. biol., 6, 295 (1963).
44. ElliottG. E., LowyJ., Millmann B. Μ., Low angle X-ray diffraction studies of living striated muscle during contraction, J. molec. biol., 25, 31 (1967).
45. Endo Μ., Nonomura Y., Masaki T., Ohtsuki I., Eba- shi S., Localisation of native tropomyosin in relation to striation patterns, Jap. J. Biochem., 60, 605 (1966).
46. Энгельгардт B. A., Любимова Μ. H., Myosin and adenosine triphosphatase, Nature, Lond., 144, 669 (1939).
47. FennW. 0., The relation between the work performed and the energy liberated in muscle contraction, J. Physiol., 58, 373 (1924).
Литература
247
48. Franzini-Armstrong С, Porter К. R., The Z-disc of skeletal muscle fibres, Zeit, für Zellforsch, 61, 661 (1964).
49. Franzini-Armstrong C, Porter K. R, Sarcolemmal invaginations and the T-system in fish skeletal muscle, Nature, Lond, 202, 355 (1964).
50. Gibbs C. L, Ricchinti N. V, MommaertsW. F. H. M, Activation heat in frog sartorius muscle, J. gen. Physiol, 49, 517 (1966).
51. Glasstone S, Theory of absolute reaction rates, Textbook of Physical Chemistry, 2nd edition, D. Van Nostrand and Co, Inc, New York, p. 1098 et seq, 1947.
52. Gordon A. M, Huxley A. F, Julian F. J, The variation in isometric tension with sarcomere length in vertebrate muscle fibres, J. Physiol, 184, 170 (1966).
53. Green I, Mommaerts W. F. H. M, Release of hydrogen ions during the splitting of ATP, J. biol. Chem, 202, 541 (1953).
54. G u b a F, H a r s a n y i V, Myofibrillin — a new structural protein, in Symposium on Muscle, 1966 (Hungarian Acad, of Sci., Budapest — in press) 1966.
55. H a n s о n J, L о w y J, Electron microscope studies of bacterial flagellae, J. molec. biol, 11, 293 (1965).
56. Hanson J, Huxley H. E, Sliding filament mechanism of muscle contraction, Symp. Soc. exp. Biol, 9, 228 (1955).
57. H a n s о n J, L о w y J, Molecular basis of contractility in muscle, Br. med. Bull, 21, 264 (1965).
58. Hanson J, Hyxley H. E, The molecular basis of contraction in cross-striated muscles, Structure and Function of Muscle vol. 1, pp. 183—225, 1960.
59. Hanson J, Axial period of actin filaments, Nature, Lond., 213, 353 (1967).
60. Hasselbach W, Die Diffusionskonstante des Adenosintriphosphats im Innerer der Muskelfaser. Z. Naturf, 7B, 334 (1952).
61. Hasselbach W, Die Wechselwirkung verschiedener Nukle- Osidtriphosphate mit Actomyosin im Gelzustand, Biochim. bio- phys. Acta, 20, 355 (1956).
62. Hasselbach W, Makinose M, Die Calciumpumpe der «Erschlaffungsgrana» des Muskels und ihre Abhängigkeit von der ATP-spaltung, Biochem. Z, 333, 518 (1961).
63. Hasselbach W, Relaxing factor and the relaxation of muscle, Prog. Biophys. molec. Biol, 14, 169 (1964).
64. Hasselbach Wτ, Seraydarian K., The role of sulphydryl groups in calcium transport through the sarcoplasmic membranes of skeletal muscle, Biochem. Z, 345, 159 (1966).
65. Hasselbach W, Elfrin G. L, Structural and chemical asymmetry of the Ca-transporting membranes of the Sarcotubular system as revealed by the E-M, J. Ultrastruct. Res, 17, 598 (1967).
66. Hasselbach W, Relaxation and the Sarcotubular calcium pump, Fed. Proc, 23, 909 (1964).
248
Литература
67. Hill A. V., A further challenge to biochemists, Biochem. Z, 345, 1 (1966).
68. Hill À. V., The «instantaneous» elasticity of active muscle, Proc. R. Soc. B., 141, 161 (1953).
69. Hill A. V., Thermoelasticity in muscle, Proc. R. Soc. B, 139, 464 (1952).
70. HillA. V., The heat of shortening and the dynamic constants of muscle, Proc. R. Soc. B, 126, 136 (1938).
71. HillA. V., The heat of activation and the heat of shortening
in a muscle twitch. Proc. R. Soc. B, 136, 195—254
(1949).
72. Hill A. V., The priority of the heat production in a muscle twitch, Proc. R. Soc. B, 148, 397 (1958).
73 Hill A. V., Does heat production precede mechanical response in muscular contraction? Proc. R. Soc. B, 137, 268 (1950).
74. Hill A. V., The effect of load on the heat of shortening of muscle, Proc. R. Soc. B, 159, 297 (1964).
75. Hill A. V., Howarth J. V., The reversal of chemical reactions in contracting muscle during an applied stretch, Proc. R. Soc. B, 151, 169 (1959).
76. Hodgkin A. L., Conduction of the Nervous Impulse, Liverpool Univ. Press, 1965. (Есть перевод первого издания: А. Ходжкин, Нервный импульс, изд-во «Мир», Μ., 1965.)
77. Hodgkin A. L., Huxley A. F., Potassium leakage from an active nerve fibre, J. Physiol., 106, 341 and 449 (1952).
78. Hofmann-Berling H., Geisselmodelle und ATP, Biochim. biophys. Acta, 16, 146 (1955).
79. Hotta K., Model for the myosin ATP-ase active site, Jap. J. Biochem, 50, 218 (1961).
80. Huxley H. E, Electron microscope studies on the organisation of filaments in striated muscle, Biochim. biophys. Acta, 12, 387 (1953).
81. Huxley H. E, Electron microscope studies of natural and synthetic protein filaments from striated muscle, J. molec. biol, 7, 281 (1963).
82. Huxley H. E, Brown W, Holmes K. C, Constancy of axial spacings in frog sartorius muscle during contraction, Nature, Lond, 206, 1358 (1965).
83. Huxley H. E, Brown W., X-ray diffraction studies of muscle, J. nιolec. biol, 30, 383 (1967).
84. HuxleyH. E, Evidence for continuity between the central elements of the triads and extracellular space in frog sartorius muscle, Nature, Lond, 202, 1067 (1964).
85. Huxley A. F, Taylor R. E, Local activation of striated muscle fibres, J. Physiol., 144, 426 (1958).
85a. Huxley A. F, A Theory of muscular contraction, Prog, in Biophys. and Biophys. Chem, 7, 255 (1957).
86. Infante A. A, Klaupiks D, Davies R. E, PC consumption during single working contractions of isolated muscle, Biochim. biophys. Acta, 94, 504 (1965).
Литература
249
87. I n f a n t e A. A., К 1 a u p i к s D., D a V i e s R. E., Length tension and metabolism during short isometric contractions of frog sartorius muscles, Biochim. biophys. Acta, 88, 215 (1964).
88. Infante A. A., Klaupiks D., Davies R. E., ATP changes in muscles doing negative work, Science, 144, 1577 (1964).
89. J e w e 11 B. R., W i 1 к i e D. R., Mechanical properties of relaxing muscle, J. Physiol., 152, 30 (1960).
90. Jobsis F. F., O’C о n n о r Μ. J., Calcium release and reabsorption in the sartorius muscle of the toad, Biochem. biophys. Res. Commun., 25, 246 (1966).
91. Jobsis F. F., Force, shortening and work in relation to chemical changes during contraction, in Symposium on Muscle (Hungarian Acad. Sci., Budapest — in press), 1966.
92. Jobsis F. F., Duffield J. C., Force, shortening and work in muscular contraction: relative contributions to overall energy utilization, Science, 156, 1388 (1967).
92a. J о h n s о n P., Harris C. I., Perry S. V., 3-methyl histidine in actin, Biochem. J., 105, 361 (1967).
93. Josephs R., Harrington W. F., Studies on the formation and physical chemical properties of synthetic myosin filaments, Biochemistry, 5, 3474 (1966).
94. Kammer B., Bell A. L., Myosin filamentogenesis: effects of pH and ionic concentration, J. molec. biol., 20, 391 (1966).
95. Katz B., Nerve, muscle and synapse, McGraw-Hill and Co. Inc., New York, 1966. (Б. Катц, Нерв, мышца и синапс, изд-во «Мир», Μ., 1968 )
96. Kitagawa S., Chiang К. K∙, Tonomura Y., Binding of p-nitrothiophenol to myosin A, Biochim. biophys. Acta, 82, 83 (1964).
97. Kominz D. R., Hough A., Symonds P., Laki K., The amino-acid composition of actin, myosin, tropomyosin and the meromyosins, Arch. Biochem. Biophys., 50, 148 (1954).
98. К о s h 1 a n d D. E., Jr., Levy H. Μ., Evidence for an intermediate in ATP hydrolysis by myosin, in Biochemistry of Muscle Contraction, ed. J. Gergely, Little Brown and Co., Boston, Mass., p. 87, 1964.
99. Rubo S., Tokura S., Tonomura Y., On the active site of myosin-A ATP-ase, J. biol. Chem., 235, 2835 (I960).
100. Kushmerick Μ. J., Minihan K∙, Davies R. E., Changes in free Pt and ATP in frog sartorius muscles during maximum work and rigor, Fed. Proc., 24, 2 (1965).
101. Lauffer Μ. A., Protein-protein interaction: endothermic poli- merisation and biological processes, Symposium on Foods, Proteins and their interactions, ed. H. W. Schultz, Avi Publishing Co. Inc., Westport, Conn., p. 87, 1964.
102. Lowey S., Goldstein L., Luck S., Isolation and characterization of a helical sub-unit from heavy meromyosin, Biochem. Z., 345, 248 (1966).
103. Lowey S., Cohen C., Studies on the structure of myosin, J. molec. biol., 4, 293 (1962).
104. Ludsgaard E., The energetics of anaerobic muscle contraction, Biochem. Z., 233, 322 (1930).
250
Литература
105. Makinose M, Die Nukleosidtriphosphat-Nucleosiddiphosphat- Transphosphorylase-Aktivität der Vesikel des Sarkoplasmatischen Reticulums, Biochem. Z, 345, 80 (1966).
106. Maréchal G, Le métabolisme de la phosphoryl-créatine et de l’adénosine triphosphate durant la contraction musculaire, Thèse d’agrégation, Bruxelles, Editions, Arscia S. A, 1964.
107. Maréchal G, Mommaerts W. F. H. M, The metabolism of phosphocreatine during an isometric tetanus in the frog sartorius muscle, Biochim. biophys. Acta, 70, 53 (1963).
108. Marechal G, Beckers-Bleukx G, ATP and PC breakdown in resting and stimulated muscles after treatment with EDNB, J. Physiol. (Paris), 57, 652 (1965).
109. Marsh B. B, The effects of ATP on the fibre volume of a muscle homogenate, Biochim. biophys. Acta, 9, 247 (1952).
HO. Martonosi A, Role of phospholipids in ATP-ase activity and Ca transport of fragmented sarcoplasmic reticulum, Fed. Proc, 23, 913 (1964).
111. Meyerhof O, Schultz W, Relation between lactic acid formation and O utilization in the contraction of muscle, Pflügers Arch. ges. Physiol, 217, 547 (1927).
112. Millmann B. M, Elliott G. F, Lowy J, X-ray diffraction studies, Nature, Lond, 213, 356 (1967).
113. Mommaerts W. F. H. M, Seraydarian K∙, Maréchal G, Work and chemical change in isotonic muscular contractions, Biochim. biophys. Acta, 57, 1 (1962).
114. Mueller H, Perry S. V, The degradation of heavy meromyosin by trypsin, Biochem. J, 85, 431 (1962); See also: Jones J. Μ., Perry S. V, Biological activity of Sub-fragment I, J. Biochem, 100, 120 (1966).
115. Mueller H, EGTA-sensitizing activity and molecular properties of tropomyosin prepared in presence of an SH-protecting agent, Biochem. Z, 345, 300 (1966).
116. Nanninga L. B, Mommaerts W. F. H. M, Formation of an enzyme-substrate complex between myosin and ATP, Proc. Nat. Acad. Sei. U. S. A, 46, 1166 (1960).
117. Nanninga L. B, Investigation of the effect of Ca ions on the splitting of ATP by myosin, Biochim. biophys. Acta, 36, 191 (1959).
118. Needham D. M, Biochemistry of muscular action, Structure and Function of Muscle, ed. G. H. Bourne, vol. II, Chapter II, 1960.
118a. Offer G. W, N-acetyl peptides from myosin, Biochim. biophys. Acta, 90, 193 (1966).
119. Page S, Sarcomere lengths in striated muscle, Proc. R. Soc. B, 160, 460 (1964). Private communication.
120. Paul J, Cell Biology, Heinemann and Co, London, pp. 35—47, 1965.
121. Pepe F, The myosin filament: structural organization from antibody staining observed in electron microscopy, J. molec. biol, 27, 203 (1967).
122. Perry S. V, The structure and interactions of myosin, Progress in Biophys, 17, 325 (1967); See also: Schaub M. E,
Литература
251
Hartshorne D. J, Perry S. V, Nature, Lond., 215, 635 (1967).
123. Perry S. V, Grey T. C, A study of the effects of substrate concentration and certain relaxing factors on the Mg-activated myofibrillar ATP-ase, Biochem. J, 64, 184 (1956).
124. Podolsky R. J, The maximum sarcomere length for contraction of isolated myofibrils, J. Physiol, 170, IlO (1964).
125. Podolsky R. J, Morales Μ. F, The enthalpy change of ATP hydrolysis, J. biol. Chem, 218, 945 (1958).
126. Porter K. R∙, Palade G. E, Studies on the endoplasmic reticulum. III. Its form and distribution in striated muscle cells, J. Biophys. Biochem. Cytol, 3, 269 (1957).
127. Portzehl H, Schramm G, Weber H. H, Actomyosin and its components, Z. Naturf, 5B, 61 (1950).
128. Portzehl H, Bewirkt das System Phosphokreatin — Phosphokinase die Erschlaffung des lebenden Muskels? Biochem. biophys. Acta, 24, 474 (1957).
129. Portzehl H, Caldwell P. C, Riiegg J. C, Calcium and the contraction of crab muscle fibres, Biochem. biophys. Acta, 79, 581 (1964).
130. PringleJ. W. S, The contractile mechanism of insect fibrillar muscle, Progress in Biophys, 17, 1 (1967); See also: Am. zool, 7, 465 (1967).
131. Revel J. P, The sarcoplasmic reticulum of fast-acting muscle, Biochemistry of Muscle Contraction, ed. J. Gergely, Little Brown and Co, Boston, Mass, p. 232, 1964.
132. Revel J. P, Fawcett D. W, The sarcoplasmic reticulum of a fast-acting fish muscle, J. Biophys. Biochem. Cytol, Vol. 10, No. 4, pt. 2 (suppt.) «The sarcoplasmic reticulum», p. 89 (1961).
133. Rice R. V, Brady A. C, Depue R. H, Kelly R. E, Morphology of individual macro-molecules and their ordered aggregates by electron microscopy, Biochem. Z, 345, 370 (1966).
134. Sandberg J. A, Carlson F. D, The length dependence of PC hydrolysis during an isometric tetanus, Biochem. Z, 345, 212 (1966).
135. Sandow A, Latency relaxation and a theory of muscular mechano-chernical coupling, Ann. N. Y. Acad. Sei, 47, 895 (1947).
136. Sandow A, Taylor S. R, Preiser H, Role of the action potential in excitation-contraction coupling, Fed. Proc, 24, 1116 (1965).
137. Sandow A, Excitation-contraction coupling in skeletal muscle, Pharmacol. Rev, 17, 265 (1965).
138. Sartorelli L, Fromm H. J, Benson R. W, В о y e r P. D, Direct and 18O-exchange measurements relevant to possible activated or phosphorylated states of myosin, 1966 (in press).
139. SeidelJ. C, Sreter F. A, Thomson Μ. M, Gergely J, Comparative studies of myofibrils, myosin and actomyosin from red and white rabbit skeletal muscle, Biochem. biophys. Res. Commun, 17, 662 (1964); See also: Gergely J, Pragay D, Scholz A. F, Seidel J. C, Sreter F. A, Thomp-
252
Литература
s о n Μ. Μ., in Molecular Biology of Muscular Contraction, Igaku Shoin Ltd. Tokyo, p. 145, 1965.
140. Shoenberg C. F., R ü e g g J. C., Needham D. Μ., Schirmer R. H., Nemetchek-Gansler H., A biochemical and electron microscope study of the contractile proteins in vertebrate smooth muscle, Biochem. Z., 345, 255 (1966).
141. Sisson S., The anatomy of the domestic animals, 2nd ed., W. B. Saunders and Co., Philadelphia, 1927.
141a. Slayter H. S., Lowey S., The sub-structure of the myosin molecule as visualised by the electron microscope, Proc. Nat. Acad. Sei. U. S. A., 58, 1611 (1967).
142. Stracher A., Evidence for histidine at the active site of myosin A, J. biol. Chem., 240, P. C. 958 (1965).
142a. S t r a c h e r A., Disulfide-Sulfhydryl interchange studies on myosin A, J. Biol. Chem., 239, 1118 (1964).
143. Straub F. B., G- and F-actin and effect of ATP, Studies from Inst. Med. Chem. Univ. Szeged. 2.3, quoted by A. Szent-Gyorgyi (q. v.), 1942.
144. Szent-Gyorgyi A., Studies on muscle, Acta Physiol. Scand., 9, Suppt. XXV (1945).
145. Szent-Gyorgyi A., Chemical physiology of contraction in body and heart muscle, Acad. Press Inc. N. Y., 1953.
146. Szent-Gyorgyi A. G., Proteins of the myofibril, Structure and Function of Muscle, vol. II, chapter I, ed. G. H. Bourne, Academic Press, New York, 1960.
146a. S z e n t - G y ö r g y i A. G., Prior G., Exchange of ADP bound to actin in superprecipitated actomyosin and contracted myofibrils, J. molec. biol., 15, 515 (1966).
147. Trayer J. C., Studies on myosin ATP-ase in developing muscle, Ph. D. Thesis, University of Birmingham, 1966.
148. Trayer I. P., Perry S. V., The myosin of developing skeletal muscle, Biochem. Z., 345, 87 (1966).
149. Tonomura Y., A molecular model for the interaction of myosin with ATP, in Molecular Biology of Muscular Contraction, ed S. Ebashi, F. Oosawa, T. Sekine and Y. Tonomura, Igaku- Shoin Ltd, Tokyo, p. 11, 1965.
150. Ulbrecht G., Ulbrecht Μ., Wustrow H. J., Biochim. biophys. Acta, 25, IlO (1957).
151. Veratti E., Investigations on the fine structure of striated muscle fibres, reprinted in J. Biophys. Biochem. Cytol., Vol. 10, No. 4, pt. 2 (suppt.), 1966, p. 1 (1902).
152. Watanabe S., Sleator W., EDTA relaxation of glycerol- treated fibres and the effects of Mg, Ca and Mn ions, Arch. Biochem. Biophys., 68, 81 (1957).
153. Weber A., Winicur S., The role of calcium in the superprecipitation of actomyosin, J. biol. Chem., 236, 3198 (1961).
154. Weber A., Herz R., The binding of calcium to actomyosin systems in relation to their biological activity, ibid, 238, 599 (1963).
155. Weber A., Weber H. H., Zur Thermodynamik der Kontraktion des Fasermodelle, Biochim. biophys. Acta, 7, 339 (1951).
Литература
253
156. Weber A, Herz R, Reiss I, On the mechanism of the relaxing effect of fragmented sarcoplasmic reticulum, J. gen. Physiol., 46, 679 (1963).
157. Weber A, Herz R, Reiss I, Study of the kinetics of Ca transport by isolated fragmented sarcoplasmic reticulum, Bio- chem. Z, 345, 329 (1966).
158. Weber A, Herz R, Reiss I, The regulation of myofibrillar activity by Ca, Proc. R. Soc. B, 160, 489 (1964).
159. Weber H. H, Portzehl H, The transference of the muscle energy in the contraction cycle, Prog. Biophys. and Biophys. Chem., 4, 91 (1954).
160. Weber H. H, Motility of Muscle and Cells, Harvard Univ. Press, Cambridge, Mass, 1958; See also: Young L. G, Nelson L, J. Exptl. Cell Res, 51, 34 (1958).
161. Wilkie D. R, Measurement of the series elastic component at various times during a single muscle twitch, J. Physiol, 134, 527 (1956).
162. Wilkie D. R, Tissues subserving movement and conduction, in Principles of Human Physiology by Starling and Lovatt Evans, 13th edition, J. and A. Churchill, London, pp. 794—843, 1962.
163. Wilkie D. R, Thermodynamics and the interpretation of biological heat measurements, Prog. Biophys. and Biophys. Chem, 10, 259—298 (1960).
164. Winton F. R, Bayliss L. E, Nerve, neuromuscular and synaptic transmission, and the central nervous system, Human Physiology, 5th edition, Churchill Ltd. London, 346—390, 1962.
165. Woledge R. C, Heat production and energy liberation in the early part of a muscular contraction, J. Physiol, 166,211 (1963); See also ibid, 197, 685 (1968).
166. Young M. D, Himmelfarb S, Harrington W. F, On the structural assembly of the polypeptide chains of heavy meromyosin, J. biol. Chem, 240, 2428 (1965).
167. Rees M. K., Young M, The structure and properties of G-actin, J. biol. Chem, 242, 4449 (1967).
168. Kiely B, Martinosi A, Kinetics and substrate binding of myosin ATP-ase, J. biol. Chem, 243, 2273 (1968).
169. Alberty R. A, Equilibrium hydrolysis of ATP and the binding constants of MgATP, CaATP, MgADP and CaADP, J. biol. Chem, 243, 1337 (1968).
170. McNeill P. A, Hoyle G, Evidence for superthin filaments in muscle, American Zoologist, 7, 483 et seq (1967).
171. Green D. E, Asai J, Harris R. A, Penniston J. T, Conforrnational basis of energy transformations in membrane systems, III, Arch. Biochem. and biophys, 125, 684 (1968).
172. Hill A. V, Trails and Trials in Physiology, Edward Arnold (Publishers) Ltd, London (1965).
ОГЛАВЛЕНИЕ
Предисловие к русскому изданию 5
Введение 7
ЧАСТЬ ПЕРВАЯ.
МЫШЕЧНЫЕ БЕЛКИ, ФИБРИЛЛЫ И ВОЛОКНА 15
Глава I. Структура и организация сократительных белков 15
Миозин, актин и тропомиозин 15
Субструктура 18
Другие структурные белки миофибриллы 24
Образование нитей актина (тонких нитей) 27
Образование нитей миозина (толстых нитей) 29
Организация миофибрилл 30
Стехиометрия актина и миозина в мышцах 34
Z-пластинка и полярность актина 34
Модель скользящих нитей 36
Рентгенографические доказательства модели скользящих нитей 41
Глава II. Биохимия сократительных белков 46
Миозин как фермент 46
Модификация миозин-АТФ-азы актином 56
Реакции в «растворе» при большой ионной силе 57
Актомиозиновый гель при физиологических значениях ионной силы 58
АТФ-азная активность и сокращение миофибрилл 62
Еще о действии Ca2+ на фибриллы 66
Сколько мест для Ca2+ имеется в активном центре? 70
Влияние температуры 72
Глава III. Модельные системы волокон 79
Вопрос о диффузии 80
Развитие напряжения 81
Расщепление АТФ и развитие напряжения 83
Изотоническое сокращение волокон и развитие мощности 84
Процесс расслабления и ингибирование АТФ-азной активности 89
ИТФ как сокращающий и расслабляющий агент 92
Оглавление
255
Сокращаются ли волокна, если в системе присутствуют только АТФ и ионы Ca? 94
Влияние старения на сокращение волокон 96
Глава IV. Саркоплазматический ретикулум и расслабление in vivo 97
Введение 97
Саркоплазматический ретикулум 98
Ионные насосы 101
АТФ и кальциевый насос 103
Другие свойства насоса 106
Структурные особенности 108
Кальциевый насос in vivo 109
Распределение кальция в интактной мышце 111
Кальциевый насос в нескелетных и «медленных» мышцах 112
Возможные механизмы переноса кальция 112
ЧАСТЬ ВТОРАЯ.
ИНТАКТНАЯ МЫШЦА 115
Глава V. Передача двигательного импульса 115
Мембрана и потенциалы действия 120
Механизм проведения импульса 125
Количественные и метаболические аспекты 128
Скорость проведения импульса в нервных и мышечных волокнах 130
Передача через концевую двигательную пластинку 131
Передача импульса саркоплазматическим ретикулумом и инициирование одиночного сокращения мышцы 132
Глава VI. Механика сокращения 139
Экспериментальная установка 139
Ранняя стадия одиночного сокращения 141
Изометрическое и изотоническое одиночные сокращения 144
Соотношение между силой и скоростью 148
Упругие элементы, соединенные последовательно с сократительными 151
Слияние одиночных сокращений в тетанус 153
Влияние длины мышцы на напряжение и скорость укорочения 155
Работа, производимая при одиночном сокращении и при тетанусе 160
Является ли расслабление активным процессом? 163
Напряжение покоя 164
Глава VII. Энергетика сокращения 168
Первый закон термодинамики 169
Тепловые измерения 172
Теплота, выделяющаяся на ранней стадии изометрического одиночного сокращения 174
256
Оглавление
Теплота, выделяющаяся на более поздних стадиях изометрического одиночного сокращения 177
Изометрический тетанус 179
Влияние длины мышцы на выделение тепла 180
Изотонический тетанус и теплота укорочения 183
Выделение энергии при изотонических одиночных сокращениях 190
Эффективность сократительного процесса 195
Глава VIII. Химия сокращения 197
Расщепление АТФ и КФ при кратковременных изометрических тетанусах 200
Влияние длины мышцы на скорость расщепления АТФ при изометрических тетанусах 202
Расщепление КФ и АТФ при изотонических одиночных сокращениях и тетанусе 204
Растяжение сокращающейся мышцы 214
Выводы 215
Глава IX. Взгляд в прошлое и будущее 218
А. Нерешенные проблемы 220
Б. Термодинамика и теория сокращения 227
Литература 244
Дж. Бендолл
МЫШЦЫ, МОЛЕКУЛЫ И ДВИЖЕНИЕ
Редактор А. Левина
Художник А. Купцов
Художественный редактор Ю. Максимов
Технический редактор И. Дeрва
Корректор И.С. Соколова
Сдано в производство 31/III 1970 г. Подписано к печати 9/IX 1970 г. Бумага тип. №1. Формат 84×1081∕32 = 4,19 бум. л. 14,07 усл. печ. л. Уч.-изд. л. 13,94 в т/ч 6 вклеек. Изд. № 4/5551. Цена 1 р. 21 к. Зак. 559.
ИЗДАТЕЛЬСТВО «МИР»
Москва, 1-й Рижский пер., 2.
Ордена Трудового Красного Знамени Ленинградская типография № 2 имени Евгении Соколовой Главполиграфпрома Комитета по печати при Совете Министров СССР. Измайловский проспект. 29.