Автор: Робустова Т.Г.
Теги: полость рта рот стоматология хирургия имплантация
ISBN: 5-225-04712-2
Год: 2003
Похожие
Текст
Т.Г.Робустова
ИММ ЗУБОВ
ХИРУРГИЧЕСКИЕ АСПЕКТЫ
Теч.: (095) 251-9670
250-9008
Саратовский государственный технический университет
Саратовский государственный медицинский университет
Научно-промышленная ассоциация «Плазма Поволжья»
ООО «Медицинская клиника Медстом»
Комплект имплантатов стоматологических с различными видами обработки
поверхности (пламенное напыление титана и гидроксиапатита, ультразвуков
травление, оксидирование и т.д.) и инструментов д\я их установки
КИСВТ-СГТУ-01
к семь основных типов (пластинчатых,
цилиндрических гладких, винтовых, цельных и
пустотелых и др.) и более 40 типоразмеров, что
дает возможность широкого выбора в
зависимости от клинической ситуации;
х высокие функциональные характеристики,
аналогичные системам Branemark, Sumisicon,
IMPLA GmbH, Leibinger, Alpha Bio, Friatec и
гораздо меньшая стоимость;
х индивидуальный подход к каждому клиенту;
х гарантия 18 месяцев;
х уровень приживляемости не мене^ 98%;
х гибкая система скидок в случае приобретения
более 10 имплантатов;
х доставка в любую точку России в сжатые сроки;
х расширение номенклатуры и улучшение качества
продукции за счет проведения научных
исследований и сотрудничества с крупнейшими
стоматологическими центрами России и
зарубежья;
х на базе кафедры хирургической стоматологии и
челюстно-лицевой хирургии с курсом
имплантологии (СГМУ) производится обучение
врачей-имплантологов с выдачей сертификатов
общероссийского образца.
я
НПА «Плазма Поволжья»:
410054, Россия, г. Саратов, а/я 3310
Тел./факс: (8452) 527-321, 527-822
Тел.; (8452) 566-265
Http://www.freeline.ru/plasimplant/
ООО «Медицинская клиника Медстом>
410031, Россия, г. Саратов.
ул. Некрасова, 54
Тел./факс: (8452) 23-83-83
Тел.: (8452) 26-72-04
Т.Г.Робустова
мтшия мов
ХИРУРГИЧЕСКИЕ АСПЕКТЫ
РУКОВОДСТВО ДЛЯ ВРАЧЕЙ
Москва
’’Медицина"
2003
УДК 616.314-089.843
ББК 56.6
Р58
Рецензент — М.А. Губин, доктор медицинских наук, профессор, за-
служенный врач РФ, зав. кафедрой хирургической стоматологии и че-
люстно-лицевой хирургии Воронежской государственной медицинской
академии.
Робустова Т.Г.
Р58 Имплантация зубов (хирургические аспекты). — М.: Медици-
на. 2003. — 560 с.: ил.
ISBN 5-225-04712-2
В руководстве представлены методики лечения адентии с помощью зубных
протезов, опирающихся на поставленные в кость челюсти имплантаты Рас-
смотрены специфические особенности оперативных вмешательств и психо-
логическое воздействие имплантации зубов на состояние здоровья пациента.
Для хирургов-стоматологов.
Robustova T.G.
Tooth implantation (surgical aspects): Guidelines for Practitioners. —
M.: Mcdicina, 2003. — 560 c.: ill.
ISBN 5-225-04712-2
Methods applicable to the treatment of adenlia by using the dentures resting on
the implants installed into the jaw bone are described in the*Guidelines. Specific fea-
tures of the surgical interventions as well as the psychological impact or tooth im-
plantation produced on the patient's health condition arc examined.
The Guidelines arc addressed to dental surgeons.
ББК 56.6
ISBN 5-225-04712-2
© Т.Г. Робустова, 2003
Все права автора защищены. Ли одна часть этого издания не может быть за
несена в память компьютера либо воспроизведена любым способом без предвари-
тельного письменного разрешения издателя.
ОГЛАВЛЕНИЕ
Предисловие.......................................................... 9
Глава 1. Введение в зубную имплантацию............................ 11
। 1, Краткая история развития зубной имплантации.................... 11
13' Материалы, используемые при зубной имплантации.................. 19
1.2.1. Металлы.................................................. 21
1.2.2. Аутогенные костные трансплантаты......................... 24
1.2.3. Аллогенная кость......................................... 25
1.2.4. Кссноткани.............................................
1.2.5. Сшггетическис кальций-фосфатные керамики................. 28
1.2.6. Комбинированные пластические материалы................. 31
1.2.7. Мембраны для направленной регенерации кости............ 34
1.2.8. Биоактивные агенты—факторы роста кости................. 37
1.3. Конструктивные особенности современных зубных имплантатов...... 38
1.3.1. Строение внутрикостных зубных имплантатов в форме корня зуба 39
1.3.2. Системы внутрикостных имплантатов в форме корня зуба (круглых) 49
1.3.3. Системы внутрикостных плоских имплантатов.................. 62
Список литературы..................................................... 69
Глава 2. Патоморфологнческне основы зубной имплантации .................
2.1. Морфологические особенности заживления костной раны................
Морфологические особенности контактной зоны кость—имплантат . . ..
Морфологические особенности приживления титановых имплантатов . .
Морфологические особенности приживления имплантатов с биокерами-
ческим покрытием...............................1....................
Морфологические особенности заживления слизистой оболочки и над-
костницы ...........................................................
Морфологические особенности приживления биоматериалов...............
2.6.1. ‘
2.6.2.
2.6.3.
2.6.4.
2.6.5.
2.2.
2.3.
2.4.
2.5.
2.6
2.6.6.
2.6.7. _____
Список литературы
Морфологические особенности приживления аутокости.....
Морфологические особенности приживления аллокости.....
Морфологические особенности приживления биокерамики ....
Морфологические особенности приживления ксенотканей...
Морфологические особенности приживления комбинированных
пластических материалов...............................
Морфологические особенности направленной регенерации кости
при помоши мембран....................................
Стимуляция роста кости................................
76
77
85
86
94
97
101
101
105
107
109
111
113
117
118
1 л а в а 3. Местная диагностика при зубной имплантации..............
3.1. Клиническое обследование больного...............................
3.1.1. Жалобы пациента и стоматологический анамнез..............
3.1.2. Внешний осмотр челюстно-лицевой области..................
3.1.3. Осмотр полости рта.......................................
3.1.4. Предварительный диагноз..................................
3.1.5. Инструментальные исследования липа, челюстей, зубов......
3 2. Рентгенографические исследования................................
3.2.1. Внутриротовая рентгенография.............................
3.2.2. Радиовизиографическос исследование зубов и костной ткани челю-
стей ...........................................................
3.2.3. Панорамная рентгенография................................
3.2.4. Томография...............................................
3.2.5. Цефалометрическая рентгенография лица....................
3.2.6. Рентгеновская компьютерная томография....................
3.2.7. Магнитно-резонансная томография..........................
3.2.8. Трехмерная визуализация лицевого черепа и мягких тканей липа
129
129
129
130
133
136
136
142
142
144
145
147
147
149
153
153
5
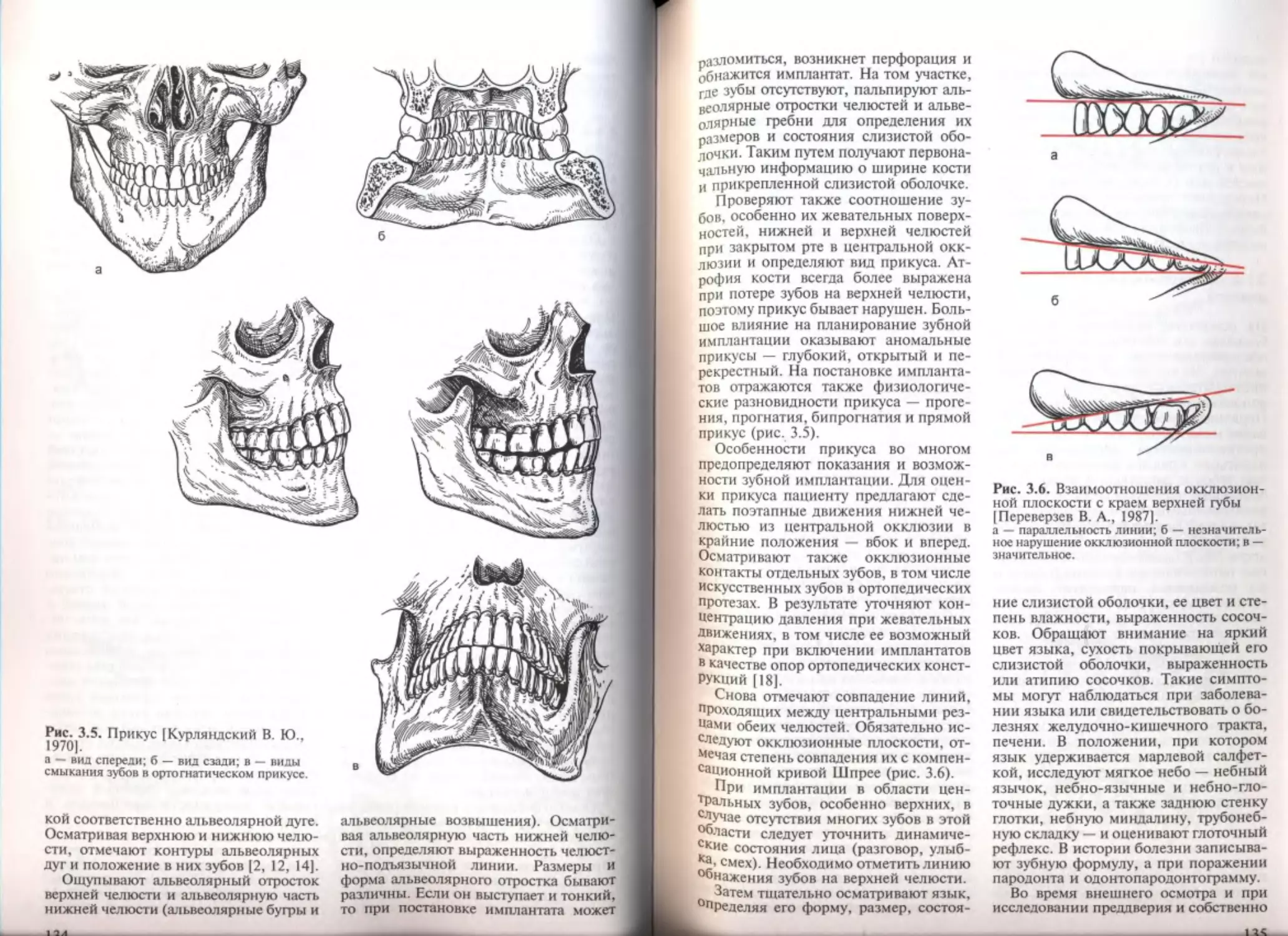
3,3. Обследование с использованием ортопедических методов........... 159
ЗА Атрофия и изменения кости........................................ 160
3.4.1. Атрофия кости при полной и частичной адентии............. 161
3.4.2. Анатомические изменения верхней челюсти при адентии..... 162
3.4.3. Анатомические изменения нижней челюсти при адентии...... 167
3.4.4. Классификация адентии и качества кости................... 171
3.4.4.1. Классификация полностью беззубых челюстей
по Misch и Judi........................................... 176
3.4.4.2. Классификация частично беззубых челюстей
по Misch и Judi........................................... 176
3.4.4.3. Классификация качества кости..................... 177
3.4.5. Планы обследования и лечения............................. 179
Список литературы................................................... 183
Глава 4. Оценка функционального состояния организма и подготовка к зубной
имплантации ........................................................... 189
4.1. Оценка сердечно-сосудистой системы............................
4.1.1. Нейроцнркуляторная дистония..............................
4.1.2. Гипертоническая болезнь..................................
4.1.3. Ишемическая болезнь сердца...............................
4.1.4. Некоронарныс заболевания сердца..........................
4.1.5. Инфекционные заболевания сердечно-сосудистой системы.....
4.2. Диффузные заболевания соединительной ткани....................
4.3. Оценка органов дыхания........................................
4.3.1. Острые и хронические воспалительные заболевания легких...
4.3.2. Бронхиальная астма ......................................
4.4. Опенка мочеполовой системы....................................
i l l. Болезни почек............................................
4 .4.2. Болезни половой системы.................................
4.5. Оценка эндокринной системы................................
4.5.1. Заболевания гипоталамо-гипофизарной системы..............
4.5.2. Заболевания щитовидной железы............................
4.5.3. Заболевания надпочечников ...............................
4.6. Опенка органов пищеварения....................................
4.6.1. Воспалительные заболевания органов пищеварения..........
4.6.2. Заболевания органов пищеварения, вызванные их анатомическими
особенностями...................................................
4.6.3. Заболевания, вызванные нарушением функций органов пищеваре-
ния ............................................................
4.6.4. Язвенная болезнь........................................
4.6.5. Болезни кишечника.......................................
4.6.6. Болезни печени, желчного пузыря и желчных путей.........
4.6.7. Болезни поджелудочной железы............................
4.7. Оценка кроветворной системы...............................
4.8. Оценка ЛОР-органов.............................
4.9. Оценка органа зрения..........................................
4.10. Оценка нервной системы........................................
4.11. Оценка психической сферы......................................
4.12. Оценка баланса витаминов и питания............................
4.13. Оценка состояния пациентов старшей возрастной группы..........
4.14. Оценка состояния пациентов с опухолями........................
4.15. Оценка результатов приема лекарственных препаратов............
4.16. Заболевания, возникающие на фоне дефектов и нарушений функций им-
мунной системы.......................................................
4.17. Лабораторные исследования.....................................
4.17.1. Клинический анализ крови................................
4.17.2. Анализ мочи.............................................
4.17.3. Иммунологические исследования ..........................
4.17.4. Биохимические исследования..............................
4.18. Правила оформления документов и информированного согласия пациента
на зубную имплантацию................................................
Список литературы...................................................
196
197
198
201
204
206
208
209
210
211
213
213
214
215
216
216
218
224
224
225
225
225
226
227
228
228
229
230
230
231
243
245
246
247
248
249
249
251
251
254
256
258
р лава 5. Общие принципы операций при зубной имплантации...........
> I. Организация работы при оперативных вмешательствах с целью зубной
имплантации.........................................................
5.1.1. Условия установления имплантатов........................
5.1.2. Стерилизация инструментов и материалов..................
5.1.3. Обеспечение стерильности в ходе операции................
5.1.4, Подготовка больного к операции..........................
5 2. Обезболивание при зубной имплантации......................
5.2.1. Премедикация............................................
5.2.2. Местная анестезия ......................................
5.2.3. Общее обезболивание.....................................
5.3. Особенности операций при зубной имплантации...................
5.3.1. Имплантация конструкций в форме корня зуба..............
5.3.2. Имплантация винтовых конструкций........................
5.3.3. Имплантация самонарезных винтовых конструкций...........
5.3.4. Имплантация винто-цилиндрических конструкций............
5.3.5. Имплантация цилиндрических конструкций..................
5.3.6. Одиоэтапная имплантация конструкций в форме корня зуба . . . .
5.3.7. Имплантация конструкций в форме корня зуба в бугор верхней
челюсти и крыловидный отросток клиновидной кости, скуловую
кость..........................................................
5.3.8. Имплантация винтовых и цилиндрических конструкций с титано-
вым и гидроксиапатитным покрытием..............................
5.4. Имплантация конструкций плоской формы.........................
5.4.1. Одноэтапная имплантация конструкций плоской формы.......
5.4.2. Имплантация конструкций плоской формы с гидроксиапатитным
264
264
264
265
267
269
270
271
273
278
279
280
294
319
320
320
327
329
334
334
336
покрытием......................................
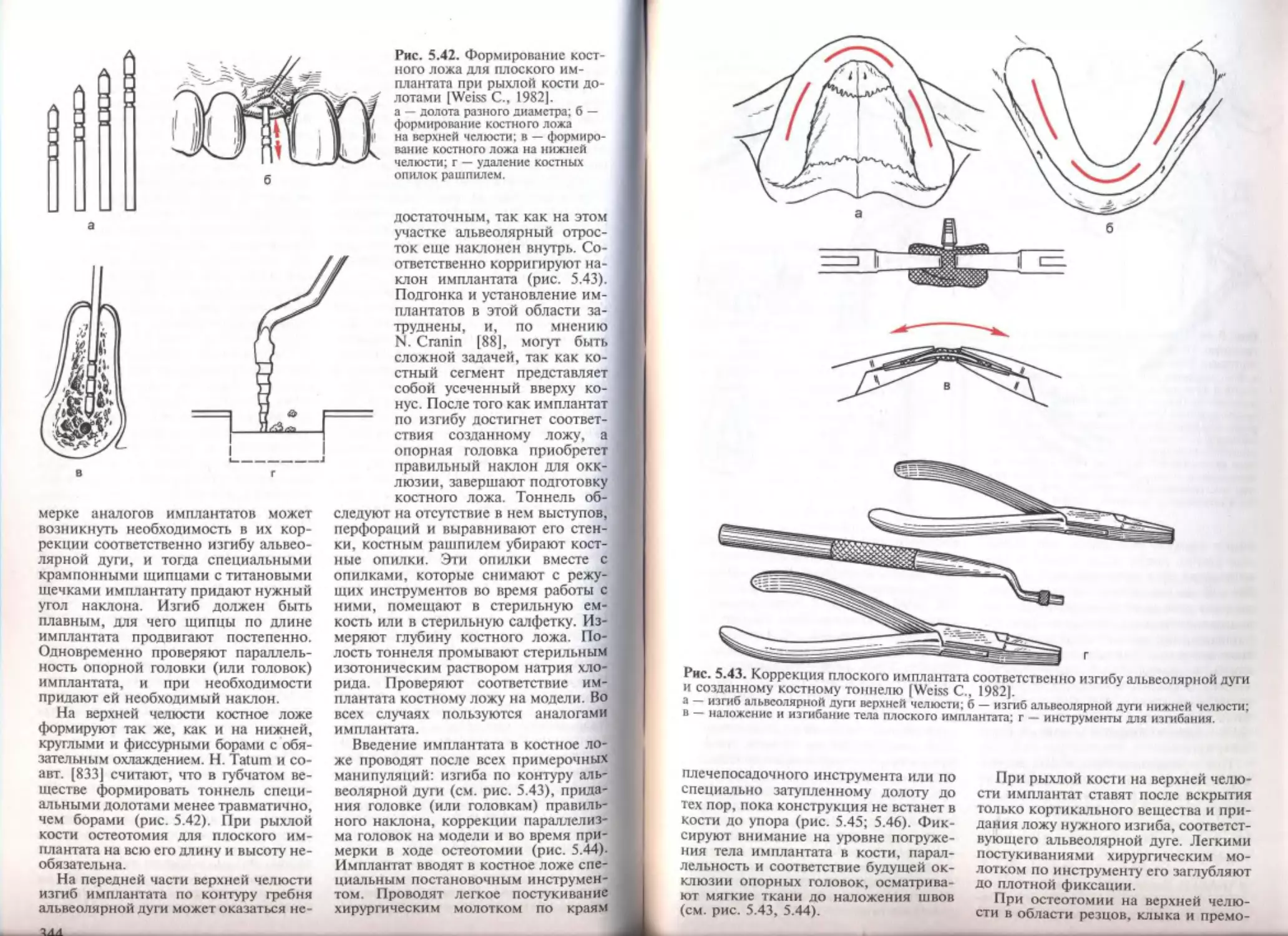
5.4.3. Двухэтапная имплантация конструкций плоской формы
5.4.4. Повторная имплантация конструкций плоской формы .
Имплантация конструкции "Ramus blade"................
Имплантация конструкции "Ramus frame"................
5.5.
5.6. ____________________________
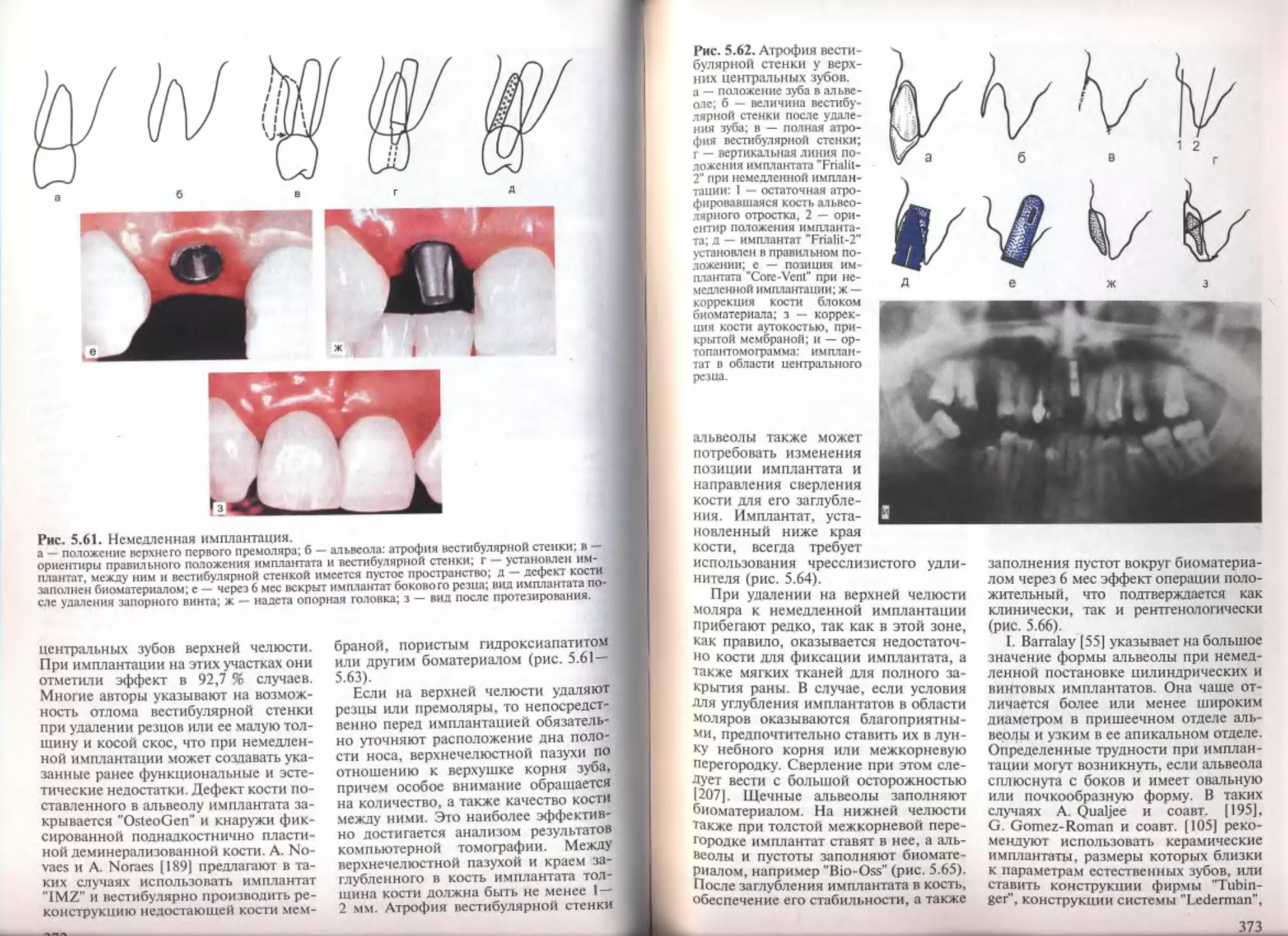
5.7. Немедленная имплантация конструкций в лунку удаленного зуба.
5.7.1. Обоснование немедленной имплантации, показания и противопо-
352
353
354
355
356
362
казания .................................................
5.7.2. Немедленная имплантация конструкций в форме корня зуба . . . .
5.7.3. Немедленная имплантация конструкций плоской формы.......
5.8. Отсроченная имплантация.......................................
5.8.1. Отсроченная имплантация конструкций в форме корня зуба . . . .
5.8.2. Отсроченная имплантация конструкций плоской формы.......
5.8.3. Временная имплантация...................................
5.9. Послеоперационное ведение больных.............................
Список литературы..................................................
362
366
378
382
382
384
385
386
396
Глава 6. Дополнительные операции при зубной имплантации.............
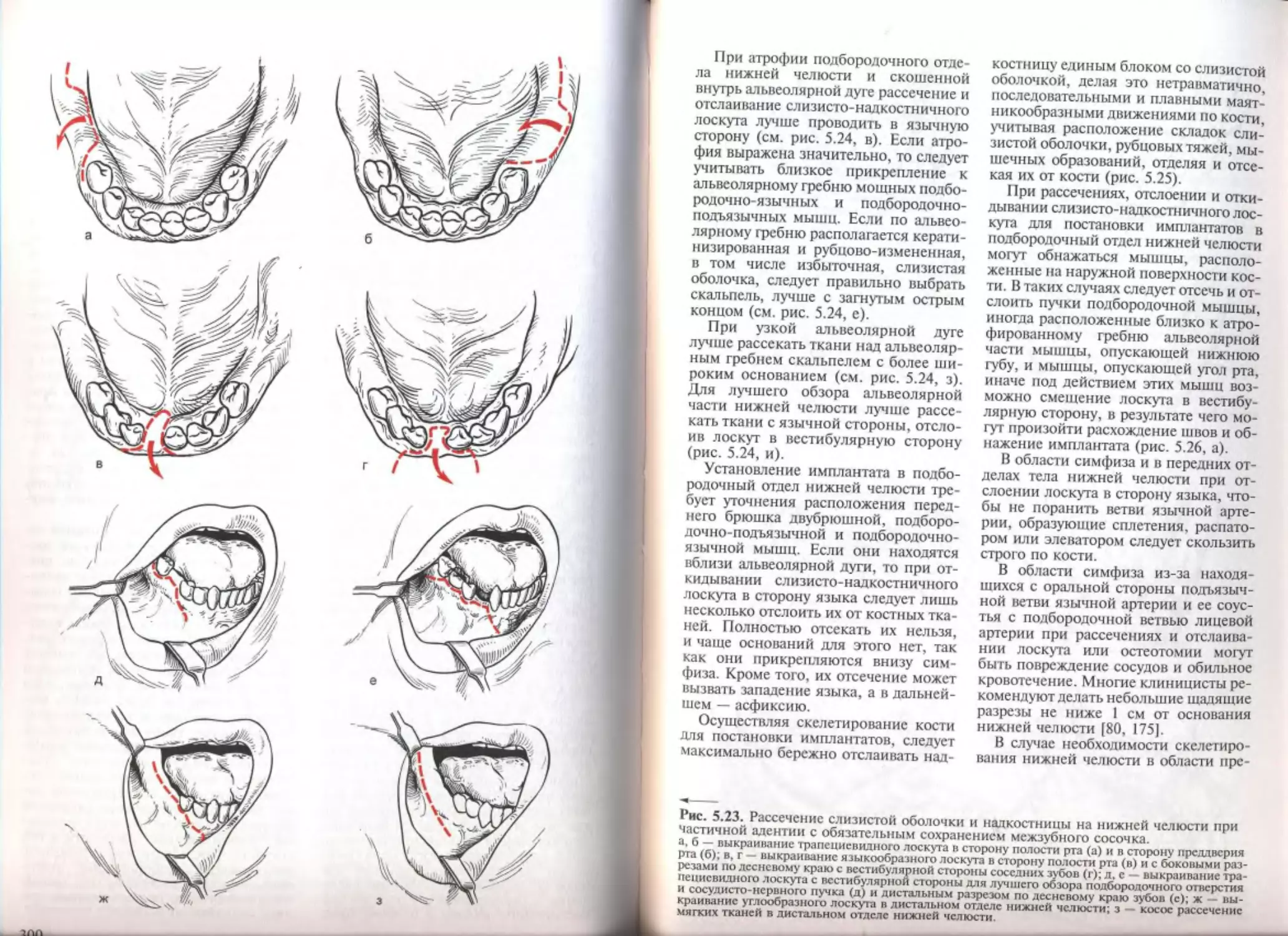
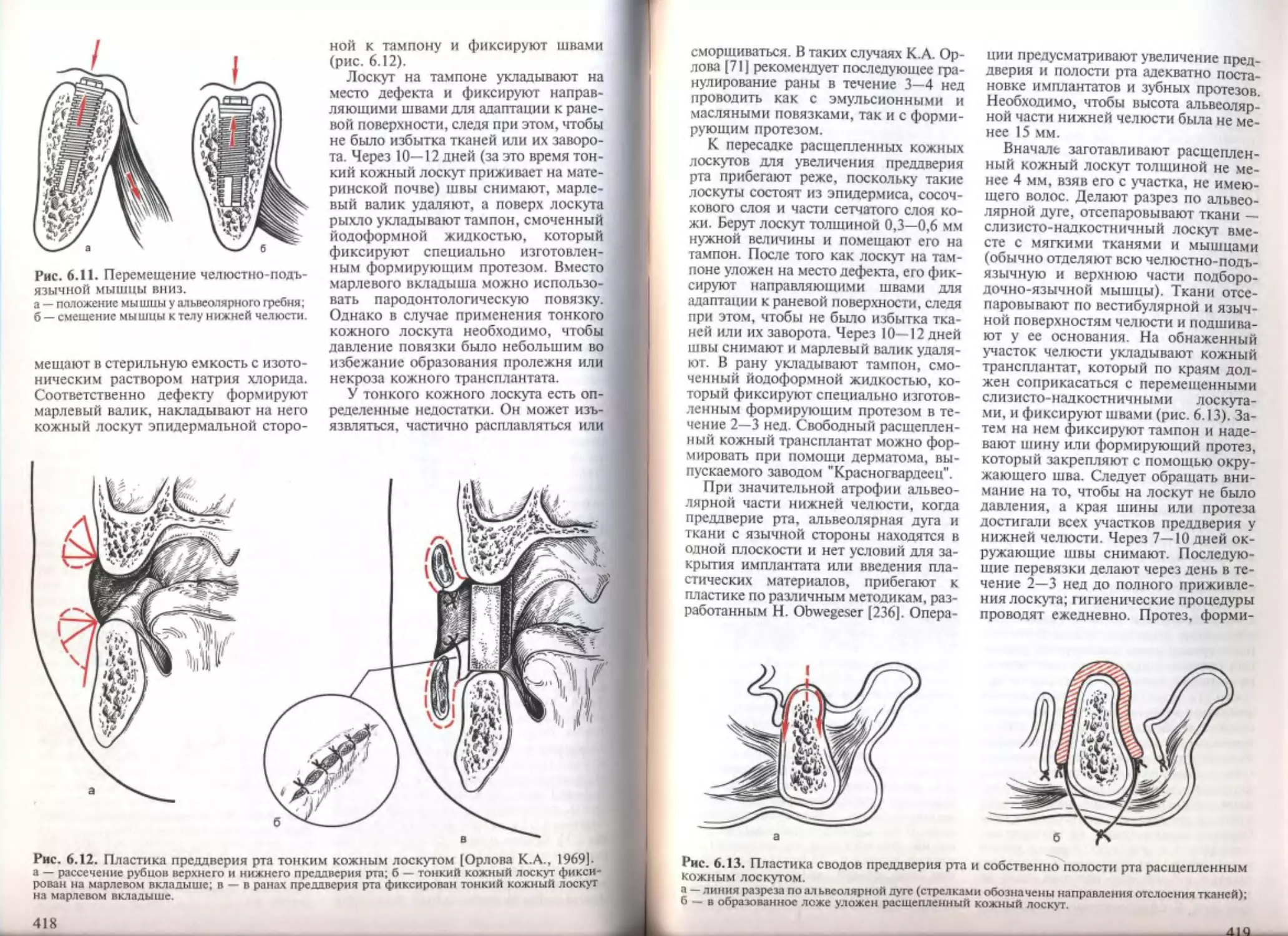
6.1. Дополнительные операции на мягких тканях полости рта...........
6.1.1. Адекватность мягких тканей при зубной имплантации........
6.1.2. Пластика уздечки губы и языка............................
6.1.3. Устранение рубцовых тяжей и складок слизистой оболочки пред-
дверия полости рта..............................................
6.1.4. Устранение дефекта слизистой оболочки местными тканями . ...
6.1.5. Пластика свободными слизистыми и кожными трансплантатами
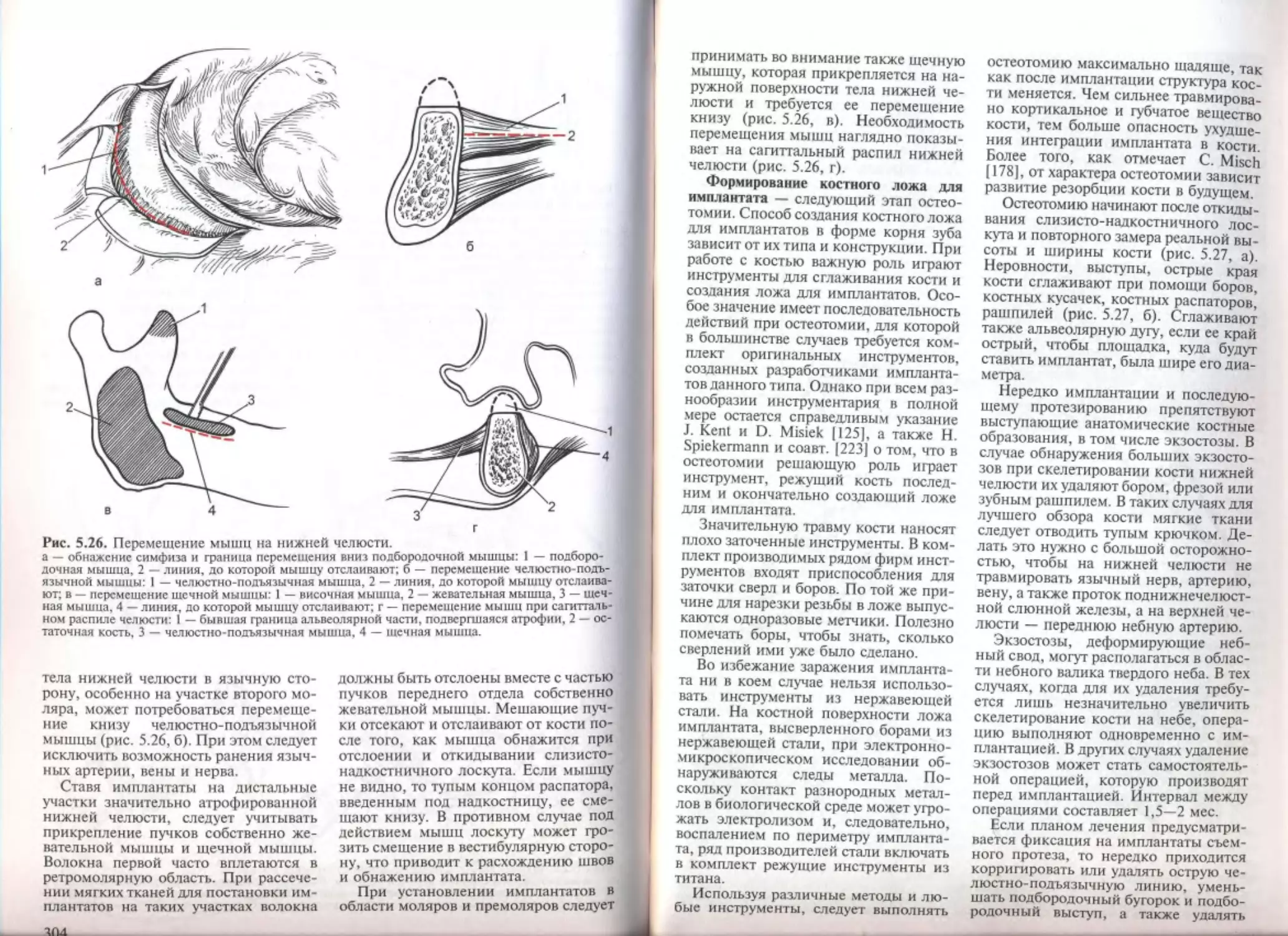
6 2. Дополнительные операции на костной ткани челюстей..............
6.2.1. Адекватность костных тканей.............................
6.2.2. Резекция костной ткани челюстей.........................
6.2.3. Костная пластика челюстей...............................
6.2.4. Пластика аутогенными костными трансплантатами...........
6.2.5. Пластика аллогенными костными трансплантатами...........
6.2.6. Пластика замешггелями кости на основе керамиков.........
6.2.7. Комбинированная пластика биоматсриалами.................
6.2.8. Направленная костная регенерация при помощи мембран.....
6.2.9. Стимуляция остеогенеза при дополнительных операциях.....
6.2.10. Пластика сегментов челюстей.............................
407
407
407
409
410
412
414
422
422
424
428
432
441
442
443
447
451
453
6.2.11. Пластика альвеолярного отростка верхней челюсти и альвеолярной
части нижней челюсти............................................... 468
6.2.12. Реконструкция верхней челюсти.............................. 478
6.2.13. Реконструкция нижней челюсти............................... 496
6J.14. Репозиция нижнего альвеолярного нерва....................... 497
Список литературы.................................................... 502
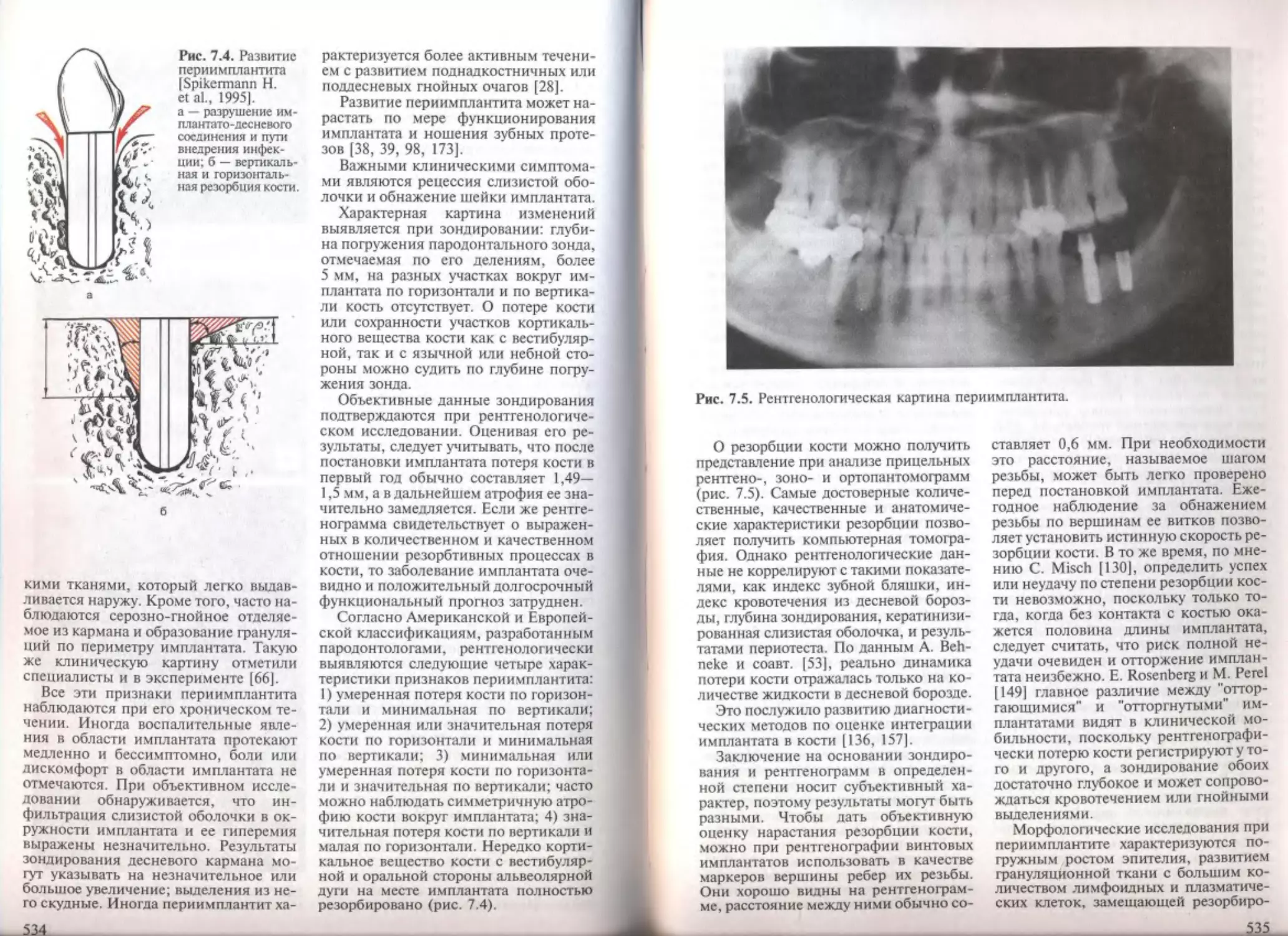
Глава 7. Осложнения зубной имплантации ....................... .
7.1. Общие осложнения во время операции.............................
1.2. Местные осложнения во время операции...........................
7.2.1. Перфорация или отлом кортикальной стенки кости...........
7.2.2. Вскрытие альвеолы соседнего зуба.........................
7.2.3. Перфорация верхнечелюстной пазухи........................
7.2.4. Проталкивание имплантата в верхнечелюстную пазуху........
7.2.5. Перфорация дна полости носа..............................
7.2.6. Перфорация канала нижней челюсти и повреждение нижнего
альвеолярного, подбородочного, язычного нервов..................
7.2.7. Кровотечение.............................................
7.3. Воспалительные осложнения при зубной имплантации...............
7.3.1. Ранние воспалительные осложнения.........................
7.3.2. Отдаленные воспалительные осложнения.....................
Список литературы...................................................
Заключение
515
515
515
516
516
517
519
519
520
522
524
524
527
545
554
ПРЕДИСЛОВИЕ
Одной из актуальных задач современ-
ной стоматологии является зубная им-
плантация. Применение внутрикост-
ных зубных имплантатов позволит ре-
шить многие вопросы при частичной и
полной утрате зубов, восстановить же-
вательную функцию и улучшить эсте-
тику лица.
В России попытки применить в ка-
честве зубных имплантатов пластмассу,
предпринятые в 50—60-е годы, закон-
чились неудачей, что привело к запрету
этого метода лечения. Только в 1987 г.
зубные имплантаты отечественного
производства были одобрены и начато
их серийное производство.
За рубежом в 60—80-е годы XX в.
был накоплен большой эксперимен-
тальный и клинический материм по
зубной имплантации. В 1978 г. этот ме-
тод лечения был одобрен FDI и ADI и
в 1987 г. рекомендован для широкой
стоматологической практики. Лечение
адентии с помощью зубных протезов,
опирающихся на поставленные в кость
челюсти имплантаты, становится
обычной практикой. Развитие зубной
имплантации расширило традицион-
ное представление о протезировании
как о лечении с хирургическими вме-
шательствами.
Предлагаемое читателю руководство
является итогом 20-летней научной и
практической работы профессора
Т.Г. Робустовой, а также ее учеников
и последователей — А.И. Ушакова,
Абу Асали Эяда, А.И. Сидельникова,
А.И. Жусева, Э.А. Базикяна, ИЛО. Гон-
чарова, И. В. Федорова, А.Р. Феха и
многих других педагогов и врачей Мо-
сковского государственного медико-
стоматологического университета.
В книге представлены основные
современные конструкции зубных
имплантатов и биоматериалы, разра-
ботанные отечественными и зару-
бежными специалистами, рассмотре-
ны их достоинства и недостатки, в том
числе в различных клинических ситуа-
циях.
Большое значение для успеха зубной
внутрикостной имплантации имеет
процесс их приживления в кости и об-
разование имплантатодесневого со-
единения Исходя из этого, изложены
основы патоморфоза кости при им-
плантации.
Представлены традиционные и но-
вые методы диагностики, позволяю-
щие расширить возможности лечения
с помощью внутрикостных зубных им-
плантатов. комплекс диагностических
средств для правильного планирования
лечения с точки зрения гармонии лица
и функции зубочелюстной системы.
Важной частью такого лечения явля-
ется имплантационная хирургия. Опе-
ративные вмешательства при зубной
имплантации имеют немало специфи-
ческих особенностей, что обусловлено
не только их значительным объемом и
анатомических! разнообразием челю-
стей. но и специальными приемами ос-
теотомии и манипуляциями на мягких
тканях и кости челюстей. При написа-
нии руководства автор стремилась осве-
тить как классические методы остеото-
мии. применяемые при установлении
внутрикостных зубных имплантатов, так
и методы более сложной имплантаци-
онной хирургии с использованием био-
материалов, что позволяет расширить
возможности этого метода лечения.
Хирургический этап лечения харак-
теризуется также сложными процесса-
ми приживления имплантатов, которые
во многом зависят от знания и учета об-
щего состояния здоровья пациента.
Кроме того, определенный риск и на-
несение травмы пациенту неизбежно
оказывают психологическое воздейст-
вие на него. Исходя из этого, на осно-
вании собственного опыта автора и ее
учеников, а также основных мировых
авторитетов в области зубной имплан-
тации даны рекомендации по оценке
функционального состояния организ-
ма, классификации имплантационной
хирургии по степеням сложности и
дифференцированному применению
методов подготовки к операции и по-
слеоперационного ведения пациентов.
Внутрикостная имплантация может
привести к развитию осложнений.
Представленные в данном руководстве
методы профилактики этих осложне-
ний и возможные ошибки позволят
врачам избежать их в своей практиче-
ской работе. Такой широкий круг во-
просов, связанных с оперативными
вмешательствами при зубной имплан-
тации, требует повышенного внима-
ния к ним. Именно эти вопросы рас-
сматриваются в данном руководстве.
Глава 1
ВВЕДЕНИЕ В ЗУБНУЮ ИМПЛАНТАЦИЮ
1.1. Краткая история развития
зубной имплантации
Зубная имплантация с древних времен
до XXI в. Издавна людей волновал во-
прос замены утраченных или плохих
зубов. Попытки вживления искусст-
венных зубов делались еще в глубокой
древности, о чем свидетельствуют им-
плантационные конструкции, найден-
ные при раскопках в Египте, Централь-
ной Америке, Китае и других странах.
При имплантации применялись камни,
в том числе драгоценные, благородные
металлы, слоновая кость и другие мате-
риалы. В Анатолии более 10 тыс. лет на-
зад обнаружен имплантат, поставлен-
ный в середине VI в. н.э. [65]. В музее
Тибоди Гарвардского университета
США демонстрируется череп человека
доколумбовой эпохи с имплантирован-
ными в нижнюю челюсть драгоценны-
ми камнями, а в музее Перу — череп че-
ловека эпохи инков с 32 имплантиро-
ванными зубами из кварца и аметиста
[67].
Ретротрансплантацию (репланта-
цию) и трансплантацию зубов как ме-
дицинскую проблему первым выдви-
нул в 1100 г. Spaniard Alabusasim [134].
Однако до XVII—XVIII вв. это не на-
ходило практического воплощения.
Основоположником современной сто-
матологии является Пьер Фошар
(1678—1761). В дальнейшем его учени-
ки продолжили изучение вопросов зу-
боврачевания, хирургической стомато-
логии и протезирования зубов. Это
предопределило появление в XVIII в.
отдельных попыток трансплантации
Донорских зубов от малообеспеченных
людей в Англии и ее колониях. Однако
широкое распространение таких ин-
фекционных заболеваний, как сифи-
лис и туберкулез, и возможность их пе-
редачи при трансплантации стали при-
чиной критики этого направления.
Научные основы аллотранспланта-
ции в зубоврачевании были заложены
только на рубеже XIX—XX вв. В этот
период появляются имплантаты в фор-
ме корня зуба, напоминающие древние
конструкции. Важным направлением
стали поиски приемлемых для имплан-
тации материалов. Так, J. Magillo в
1807 г. предложил имплантат из золота,
J. Edmuns и Н. Harris — фарфоровый
имплантат на платиновой основе,
J. Bonwell — имплантат в виде золотых
и иридиевых трубок, a I. Pedchelon —
серебряную капсулу в качестве имплан-
тата для фарфоровой коронки [67].
Можно отметить оригинальность
конструкции и методов постановки ка-
ждого предлагавшегося имплантата.
J. Magillo (1886) одноэтапно поставил
золотой имолантат в лунку после удале-
ния зуба, а на наддесневую часть при-
живленного имплантата — коронку.
Однако возникший после постановки
имплантата оптимизм вскоре сменился
разочарованием. Вокруг имплантата
началось воспаление и появилась зна-
чительная боль, поэтому имплантат
пришлось удалить. J. Edmuns и Н. Har-
ris (1886, 1887) создали имплантаты из
свинца с шероховатой поверхностью. В
них вставляли платиновые штифты, на
которых конструировали коронки.
Позднее данный метод усовершенст-
вовал R. Pajme (1901), использовав се-
ребро в качестве материала для внутри-
костного имплантата в виде трубки
[138]. Еще один шаг в развитии им-
плантации зубов сделал A. Hartmann
(1891): он винтами прикреплял протезы
к вживленным конструкциям. Заслу-
живает внимания разработанная S. Per-
ry (1888) и Н.Н. Знаменским (1891) ме-
тодика образования костного ложа для
введения имплантата. Большое значе-
ние для имплантации зубов имели ори-
гинальные экспериментальные и кли-
нические исследования, проведенные
Н.Н. Знаменским [26]. Однако вжив-
ленные собакам имплантаты из фар-
фора и каучука отторгались через 20—
35 дней. Так же безуспешно закончи-
лись имплантации в клинической
практике. Несмотря на неудачный вы-
бор материала и отрицательный исход
операций в эксперименте и клинике,
Н.Н. Знаменскому удалось проследить
патоморфоз при имплантации. Кроме
того, он первым сделал в апикальной
части своего имплантата сквозное от-
верстие для прорастания в него кости,
назвав такую конструкцию окончатой.
Эта идея нашла воплощение в боль-
шинстве современных конструкций
внутрикостных имплантатов.
Зубная имплантация в XX в. В начале
XX в. врачи-энтузиасты продолжали
разработку новых видов имплантатов.
Так, J. Schol (1905) предложил имплан-
таты из рифленого фарфора, а Е. Green-
field |91 ] в 1913 г. разработал платино-
вый имплантат в форме корзины, со-
единенный в надальвеолярной части
золотым каркасом (рис. 1.1). Такой
имплантат рекомендовался как для за-
мены одного отсутствующего зуба, так
и группы до 8 зубов. Е. Greenfield об-
ратил внимание на необходимость спе-
циальной техники создания костного
ложа и применил особые трепанаци-
онные боры.
К прообразам современного винто-
вого имплантата следует отнести конст-
рукции американских врачей R. Adams
Рис. 1.1. Имплантат Greenfield.
и A. Strock. Первый в 1937 г. изобрел
имплантат с винтовой нарезкой на по-
верхности [63], а второй в 1939 г. пред-
ложил имплантат из кобальта, хрома и
молибдена [136].
У имплантата, сконструированного
R. Adams, присутствовали все элемен-
ты сегодняшних цилиндрических кон-
струкций: гладкое основание, запор-
ный винт, ставившийся в тело имплан-
тата на период «ГО приживления, и
опорная головка с винтовой резьбой
для последующей фиксации протеза. В
зависимости от формы зубной дути и
прикуса после приживления имплан-
тата можно было придавать надальвео-
лярной части нужное направление как
по вертикали, так и по горизонтали.
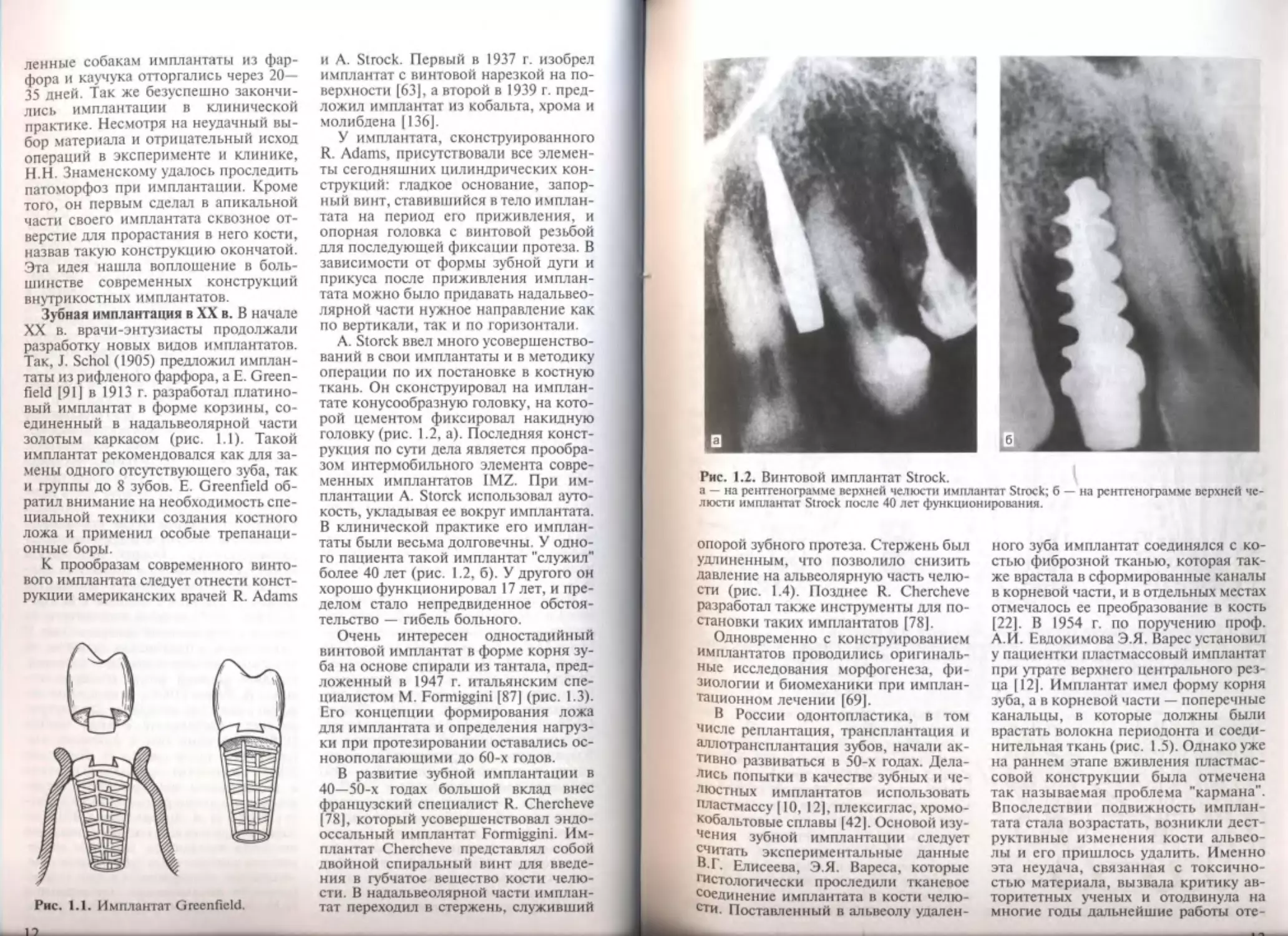
A. Storck ввел много усовершенство-
ваний в свои имплантаты и в методику
операции по их постановке в костную
ткань. Он сконструировал на имплан-
тате конусообразную головку, на кото-
рой цементом фиксировал накидную
головку (рис. 1.2, а). Последняя конст-
рукция по сути дела является прообра-
зом интермобильного элемента совре-
менных имплантатов IMZ. При им-
плантации A. Storck использовал ауто-
кость, укладывая ее вокруг имплантата.
В клинической практике его имплан-
таты были весьма долговечны. У одно-
го пациента такой имплантат "служил"
более 40 лет (рис. 1.2, б). У другого он
хорошо функционировал 17 лет, и пре-
делом стало непредвиденное обстоя-
тельство — гибель больного.
Очень интересен одностадийный
винтовой имплантат в форме корня зу-
ба на основе спирали из тантала, пред-
ложенный в 1947 г. итальянским спе-
циалистом М. Formiggini [87] (рис. 1.3).
Его концепции формирования ложа
для имплантата и определения нагруз-
ки при протезировании оставались ос-
новополагающими до 60-х годов.
В развитие зубной имплантации в
40—50-х годах большой вклад внес
французский специалист R. Chercheve
[78], который усовершенствовал эндо-
оссальный имплантат Formiggini. Им-
плантат Chercheve представлял собой
двойной спиральный винт для введе-
ния в губчатое вещество кости челю-
сти. В надальвеолярной части имплан-
тат переходил в стержень, служивший
13
Рис. 1.2. Винтовой имплантат Strock.
а — на рентгенограмме верхней челюсти имплантат Struck; б — на рентгенограмме верхней че-
люсти имплантат Strock после 40 лет функционирования.
опорой зубного протеза. Стержень был
удлиненным, что позволило снизить
давление на альвеолярную часть челю-
сти (рис. 1.4). Позднее R Chercheve
разработал также инструменты для по-
становки таких имплантатов [78].
Одновременно с конструированием
имплантатов проводились оригиналь-
ные исследования морфогенеза, фи-
зиологии и биомеханики при имплан-
тационном лечении [69].
В России одонтопластика, в том
числе реплантация, трансплантация и
аллотрансплантация зубов, начали ак-
тивно развиваться в 50-х годах. Дела-
лись попытки в качестве зубных и че-
люстных имплантатов использовать
пластмассу [10, 12], плексиглас, хромо-
кобальтовые сплавы [42]. Основой изу-
чения зубной имплантации следует
считать экспериментальные данные
В Г. Елисеева, Э.Я. Вареса, которые
гистологически проследили тканевое
соединение имплантата в кости челю-
сти. Поставленный в альвеолу удален-
ного зуба имплантат соединялся с ко-
стью фиброзной тканью, которая так-
же врастала в сформированные каналы
в корневой части, и в отдельных местах
отмечалось ее преобразование в кость
[22]. В 1954 г. по поручению проф.
А.И. Евдокимова Э.Я. Варес установил
у пациентки пластмассовый имплантат
при утрате верхнего центрального рез-
ца [12]. Имплантат имел форму корня
зуба, а в корневой части — поперечные
канальцы, в которые должны были
врастать волокна периодонта и соеди-
нительная ткань (рис. 1.5). Однако уже
на раннем этапе вживления пластмас-
совой конструкции была отмечена
так называемая проблема "кармана".
Впоследствии подвижность имплан-
тата стала возрастать, возникли дест-
руктивные изменения кости альвео-
лы и его пришлось удалить. Именно
эта неудача, связанная с токсично-
стью материала, вызвала критику ав-
торитетных ученых и отодвинула на
многие годы дальнейшие работы оте-
Рис. 1.3. Имплантат Formiggini.
Рис. 1.5. Имплантат Варсса (из дис. канд. мед. наук Э.Я.Вареса).
а—в — этапы имплантации; 1 — бор для формирования ложа под имплантат, 2 — коронка, фик-
сированная на супраструктуре имплантата. 3 — имплантат. 4 — отверстия в имплантате для про-
растания тканей периодонта.
Рис. 1.6. Имплантат Scialom.
чественных ученых в области им-
плантации зубов.
За рубежом в 60-х годах появилось
несколько новых интересных конст-
рукций. J. Lew [НО], считая, что винт
имплантата должен обладать свойства-
ми самореза, предложил соответствую-
щую конструкцию с квадратным
штифтом для его вворачивания.
J. Scialom [133] предложил трехно-
гую конструкцию из тантала, у которой
на уровне опорной головки крепилась
коронка (рис. 1.6).
S. Meglan и J. Lemons [84] сконст-
Рис. 1.7. Имплантат Linkow
"Ventplan".
руировали имплантат в виде
разжимающихся внутрикост-
ных штифтов, a S. Tramonte
[138] создал имплантат в виде
тонкого винта.
На основе имплантата
Chercheve L. Linkow в 1963 г.
разработал удачную конструк-
цию "Ventplan" [115]. Это был
полый винтовой имплантат с
резьбой и отверстиями на по-
верхности. Имплантат оказал-
ся еще более эффективным в
клинике, когда его стали изготавливать
из титана (рис. 1.7). По сути дела "Vent-
plan" явился прообразом современных
конструкций имплантатов, имеющих
форму корня зуба.
U. Paskialini [127] и G. Murratori [125]
разработали полую винтовую конст-
рукцию.
В середине 60-х годов новым на-
правлением в зубной имплантологии
стала разработка внутрикостных пло-
Рис. 1.8. Имплантаты Roberts,
а — ранний; б — якорный.
ских, или пластиночных, имплантатов.
Такую конструкцию в 1966 г. первыми
предложили R. Roberts и Н. Roberts, хо-
тя в литературе об этом не сообщалось
(рис. 1.8). Одновременно L. Linkow
[113] разработал и описал различные
варианты плоских имплантатов, кото-
рые вместе с зубами служили опорой
для мостовидных протезов (рис. 1.9).
Преимущество этих имплантатов за-
ключалось в возможности их поста-
новки при значительной атрофии кос-
ти и узком альвеолярном гребне. Боль-
шим прогрессом было создание разно-
образных конструкций для каждого
участка верхней и нижней челюстей в
различных клинических ситуациях.
В результате появились плоские им-
плантаты Bladevent, изготовленные из
титана и виталиума, имевшие на теле
сквозные отверстия разнообразной
формы, имплантаты с двумя головками
и разными размерами тела, в том числе
для беззубых челюстей. Были сконст-
руированы плоские предпазушные им-
плантаты оригинальных форм с одной
и двумя головками для верхней челю-
сти. Учитывая особенности строения
бугров верхней челюсти и ветви ниж-
ней челюсти, конструктор создал сер-
повидный и рамусный плоские им-
плантаты.
При конструировании имплантатов
L. Linkow учитывал величину кости
верхней и нижней челюстей, расстоя-
ние от нижнечелюстного канала, верх-
нечелюстной пазухи и полости носа.
Преимущество плоских имплантатов
он видел в том, что они могут занимать
правильное положение в кости челю-
стей, а их головкам можно придавать
требуемый угол соответственно поло-
жению коронки в артикуляции зубов.
Он считал возможным комплексное
применение плоских имплантатов
различных конструкций с разработан-
ным нм ранее имплантатом "Ventplan"
в форме корня зуба. Были также усо-
вершенствованы конструкции ’’Vent-
plan'' и предложены цилиндрические
имплантаты системы Linkow, в том
числе разборные конструкции и пово-
ротные опоры для создания паралле-
лизма.
Большим преимуществом плоских
имплантатов была возможность проте-
зировать пациента уже через 3—4 нед
после хирургического этапа. Это пред-
определило чрезвычайно широкое рас-
пространение плоских имплантатов в
70—80-х годах и разработку' их новых
видов. На рынке имплантатов появи-
лись такие системы, как "Startanius”
("Park Dental Research Corp."), "Ora-
tronics", "Calcitek”, "Steri-Oss", а в Рос-
сии - "ВНИИМТ", "Конмет" и др.
В России их продолжают широко при-
менять при лечении пациентов, а их
конструкции совершенствуются.
В нашей стране быстрое развитие
дентальной имплантации началось в
80-х годах прошлого столетия. Разра-
ботанные С.П. Чепулисом. А.С. Чер-
никисом, О.П. Суровым |62] и другими
специалистами плоские имплантаты в
1983 г. были переданы для клинических
испытаний в ЦНИИС (В.М. Безруков,
А.И. Матвеева, А.А. Кулаков и соавт.,
1987-1996) и в МГМСУ (Т.Г. Робусто-
ва, А.И. Ушаков и соавт., 1987—1996).
Полученные положительные результа-
ты и изучение клинико-теоретических
вопросов при использовании плоских
имплантатов нашли отражение в мето-
дических рекомендациях, составленных
В.М. Безруковым и соавт. [6], А.И. Мат-
веевой, А.А. Кулаковым [40], Т.Г. Ро-
бустовой и соавт. [55] и в диссертаци-
онных работах А.И. Матвеевой (39],
А.А. Кулакова [31], В.А. Вигдерович
[13], И.В. Балуды [5], Абу Асали Эяда
[1], А.И. Сидельникова [56], А.И. Жу-
сева [24], Р.Ш. Гветадзе [16] и др. Офи-
циальное утверждение плоских конст-
рукций, выпуск их ВНИИМТ, а также
монография О.Н. Сурова [57] способ-
ствовали внедрению плоских имплан-
татов в практику стоматологических
клиник нашей страны. На их основе
ряд новых конструкций разработали
Э.Г. Амрахов [2], В.В. Трофимов и
В.Ф. Дадыкина [60], В.Н. Лясников и
соавт. [37], А.И. Ушаков [61], С.Ю. Ива-
нов [27].
В 60-х годах в Европе и Америке
продолжалась разработка имплантатов
в форме корня зуба, как винтовых, так
и цилиндрических. Особенно успешно
эти работы велись в шведских лабора-
ториях Vital microscopy Университета
Лунда и Experimental Biology Универ-
ситета Гетеборга. В результате мн<
летних, не виданных ранее по глубине
и тщательности теоретических и экс-
периментальных исследований морфо-
генеза, биомеханики и других вопро-
сов применения зубных имплантатов
из чистого титана шведские ученые
P.-I. Branemark, G. Zarb, Т. Albrektsson
и др. разработали методику зубной им-
плантации, обеспечивающую их остео-
интеграцию. Была создана оптималь-
ная конструкция имплантата в форме
корня зуба для двухэтапной постанов-
ки его в кость челюсти (рис. 1.10). По-
сле многочисленных экспериментов на
животных в 1965 г. человеку был по-
ставлен первый внутрикостный им-
плантат для двухэтапного применения
Рис. 1.10. Имплантат Branemark.
с соблюдением всех условий, обеспе-
чивающих его остеоинтеграцию [74].
Многолетнее клиническое изучение
результатов использования таких им-
плантатов в клинической практике
(1965—1980) подтвердило успех им-
плантации в 95 % случаев на нижней и
в 91 % — на верхней челюсти. Костная
интеграция, описанная Р.-1. Brane-
mark, фактически открыла новую эру в
истории зубной имплантации [74]. По
мнению L. Linkow, стоматология дос-
тигла "золотого возраста" и для этой
медицинской специальности открытие
остеоинтеграции по своей значимости
вполне сравнимо с открытием в 1902 г.
местной анестезии [114].
Система имплантатов Branemark
была признана во всем мире, и фирма
"Nobelfarma" развернула их широкое
производство. Начиная с 80-х годов на
основе концепции имплантатов Brane-
mark появилось большое число модер-
низированных конструкций в форме
корня зуба, в том числе винтовых и ци-
линдрических, с плазменным титано-
вым и гидроксиапатитным напылени-
ем, а также с поверхностью, обрабо-
танной лазером. Эволюционировали
также опорные, надальвеолярные части
имплантатов для фиксации протезов.
В конструкциях появились амортиза-
ционные устройства, благодаря кото-
рым стало возможным использовать их
в протезах с естественными зубами. Бы-
ли разработаны и применялись в клини-
ческой практике имплантаты из керами-
ки — "Aluminium oxide ceramic" [Sand-
haus S., 1971; Schulte W., Heimke A.,
1976], "Biokeram" [Kawahara H. et al.,
1975]. Последними разработками стали
временные имплантаты, применяемые
одновременно с постоянными (рис.
1.11). Сообщения об успехах зубной
имплантации вызвали повышенный
спрос на имплантаты в форме корня
зуба, и производство их росло быстры-
ми темпами. К началу 90-х годов, т.е.
практически за 15 лет, на мировом
рынке появилось более 150 систем им-
плантатов в форме корня зуба различ-
ных конструкций и размеров. Однако,
по-видимому, не все они отвечали
строгим требованиям, поскольку Аме-
риканское управление по контролю за
производством продуктов питания и
медикаментов (FDA) в 1994 г. разре-
шило к применению в своей стране
только 50 из них.
В 80-х годах в СССР, ас 1991 г. в
России были созданы отечественные
имплантаты в форме корня зуба. Пер-
выми разработчиками отечественных
имплантатов в форме корня зуба стали
М.З. Миргазизови соавт. [41], В.Э. Гюн-
тер [19]. В.Э. Гюнтер и соавт. [20, 21],
В.И. Итин и соавт. [28]. В последую-
щие годы появились новые модифика-
ции, клиническое применение кото-
рых было положительно оценено мно-
гими авторами [44—46, 59].
С 1993 г. выпускаются также им-
плантаты системы "Контраст", кото-
рые имеют винтовые, в том числе са-
монарезные, конструкции как для од-
иоэтапной, так и двухэтапной опера-
ции [24а]. С 1996 г. начался выпуск им-
17
плантатов "Плазма Поволжья" [37].
Для рыхлой костной ткани был пред-
ложен имплантат с усиленной фикса-
цией Сурова—Массарского (ИВ-5),
С.Ю. Ивановым и соавт. [27], О.Б. Ку-
лаковым и соавт. |32] разработаны
оригинальные варианты винтовых им-
плантатов из циркония, а затем из ти-
тана.
К 1998 г. в России широкое приме-
нение получили плоские отечествен-
ные имплантаты "ВНИИМТ", "Кон-
мет", "АСИ-IM", в форме корня зуба —
"Контраст", а также имплантаты обеих
этих конструкции "Конмет" и "Плазма
Поволжья", "ЛИКо", "Дивадент".
Практически невозможно перечис-
лить всех тех исследователей и клини-
цистов-практиков, которые внесли
вклад в развитие зубной имплантации
в последние десятилетия XX в. Среди
них необходимо прежде всего назвать
пионеров современной зубной им-
плантации P.-I. Branemark и L. Linkow,
а также хотя бы назвать тех, о ком вы-
ше не упоминалось, но на работы ко-
торых немало ссылок в данной книге.
Это Н. Tatum, Ch. Babush, J. Hahn,
M. Block, J. Kent, Ch. Weiss, C. Misch,
H. Spiekermann, D. Buser, A. Cranin,
P. Ledennann, A. Kirsch, P. Worthing-
ton и многие другие исследователи,
клинический опыт которых позволил
поднять зубную имплантацию на но-
вую ступень и открыть новые перспек-
тивы.
В заключение краткого обзора исто-
Рис. 1.11. Временные и постоянные
имплантаты.
рии зубной имплантации можно
отметить, что в конструировании
зубных имплантатов отчетливо
прослеживаются определенные
этапы. До 40-х годов XX в. исто-
рия зубной имплантации была
связана с конструкциями в форме
корня зуба. Новым направлением
в те годы стали поднадкостнич-
ные зубные имплантаты, хотя ши-
рокого использования они не на-
шли. Первыми широкое распро-
странение получили созданные в
60-е годы плоские имплантаты.
Они доминировали до начала 80-х
годов, когда появилась возможность
проследить остеоинтеграцию и стал
известен имплантат в форме корня зу-
ба системы Branemark. С тех пор раз-
нообразные конструкции в форме кор-
ня зуба прочно удерживают лидерство
в зубной имплантации, хотя плоские и
поднадкостичные конструкции также
находят применение. Тем не менее
рост производства и использования
имплантатов в форме корня зуба стал
беспрецедентным. Уже к началу 90-х
годов за рубежом такие имплантаты
производили 43 фирмы и на рынке
имелось более 160 их конструкций.
Также быстро возрастало число паци-
ентов, получавших лечение с помощью
имплантатов. Только в США в 1990 г.
было поставлено около 20 000 плоских
имплантатов и 40 000 конструкций в
форме корня зуба. В той же стране в
1992 г., по некоторым оценкам, им-
плантатов всех конструкций было по-
ставлено около 300 000. По данным Ев-
ропейского рынка [151], к 2001 г. внут-
рикостные имплантаты составляли 98 %
от всех видов зубных конструкций, а
имплантаты в форме корня зуба — 95 %.
Одним из новых направлений в им-
плантологии является упрощение хи-
рургических действий при установле-
нии имплантатов и разработка времен-
ных конструкций — самонарезных
винтовых имплантатов и мини-и.м-
плантатов. Последние ставят как вре-
менные между основными импланта-
тами. Это позволяет на базе временных
самонарезных имплантатов конструи-
ровать зубные протезы, обеспечиваю-
шие как функциональный, так и эсте-
тический эффект до вскрытия посто-
янных конструкций (с.м. рис. 1.11).
Разработка новых имплантацион-
ных конструкций продолжается в на-
шей стране и за рубежом. Однако было
бы неправильно полагать, что бурный
пост числа пациентов, получающих ле-
чение адентии с помощью зубных им-
плантатов, связан только с совершен-
ствованием имплантационных конст-
рукций. В значительной степени кон-
тингент пациентов возрос и потому,
что в имплантационной хирургии с се-
редины 80-х годов прошлого столетия
усовершенствованы методы диагно-
стики [132] и прочное место заняли до-
полнительные операции, значительно
расширившие возможности постанов-
ки внутрикостных имплантатов боль-
ным, которым ранее в силу их анато-
мических или каких-либо патологиче-
ских особенностей сделать это было
невозможно. К дополнительным опе-
рациям относится прежде всего устра-
нение патологических последствий ре-
зорбции кости челюстей. Форму альве-
олярных гребней для зубной имплан-
тации хирурги-стоматологи исправля-
ют с помощью костной пластики; для
наращивания кости в местах постанов-
ки имплантатов и поднятия верхнече-
люстной пазухи используют различные
трансплантаты [103]. Местные дефек-
ты кости устраняют направленной ре-
генерацией с помощью мембран. Не-
обходимое для постановки импланта-
тов пространство в дистальных отделах
нижней челюсти создают путем лате-
ральной репозиции нижнего альвео-
лярного нерва [102].
Опыт зубной имплантации во всех
ее аспектах продолжает накапливаться
и критически оцениваться. В то же
время все более очевидно, что успех
имплантационного лечения связан с
Функциональным состоянием орга-
низма, учетом его особенностей и не-
обходимостью стимуляции защитных
Реакций для приживления импланта-
тов. От хирургов-стоматологов и спе-
циалистов ортопедической стоматоло-
гии теперь, как никогда раньше, требу-
ется прочное знание обшей терапии
для правильного отбора, предымплан-
тационной оценки, подготовки и лече-
ния больных.
1.2. Материалы, используемые
при зубной имплантации
Зубная имплантация связана с введе-
нием в ткани организма чужеродных
тел и с тканевой реакцией на их мате-
риал. Помимо реакции на сами им-
плантаты, проблему представляет так-
же реакция организма на биоматериа-
лы для дополнительных костно-пла-
стических операций, которые приме-
няются в виде порошков, гранул,
трансплантатов или мембран. Во всех
случаях главным условием успеха лече-
ния является приживление импланти-
руемого и трансплантируемого мате-
риала, поэтому к нему предъявляются
жесткие требования. Прежде всего он
не должен вызывать общей или мест-
ной реакции организма и не быть ток-
сичным, канцерогенным, аллерген-
ным и радиоактивным. При выборе
материала для зубной имплантации
или дополнительных операций следует
основываться на глубоком знании то-
го, как он будет действовать в биоло-
гической среде организма.
При изготовлении имплантатов ис-
пользуют три основные группы мате-
риалов: металлы, керамики и полиме-
ры. Приживление каждого материала
имеет особенности, которые детально
изучаются. Выводы и рекомендации
исследователей учитывают разработ-
чики и производители имплантатов и
биоматериалов. Реакция живых кост-
ных и мягких тканей на имплантируе-
мый материал была специально изуче-
на J. Osborn [126а], в результате чего по
биосовместимости он разделил их на
три группы: биотолерантные, био-
инертные и биоактивные. Для биото-
лерантных материалов (нержавеющие
стали, сплавы хрома, кобальта и мо-
либдена, а также последних с никелем)
как ответ на раздражающее действие
имплантата в контактирующей с тка-
нями зоне характерно возникновение в
кости дистанционного остеогенеза.
При этом кость от вживленного им-
плантата из этих материалов отделяет
Таблица 1.1. Характеристика видов совместимости
Вид совместимости Влияние материала на окружающую ткань Результат
Биотолерант-
ность (дистан-
ционный ос-
теогенез)
Биоинертность
(контактный
остеогенез)
Компоненты материала (ионы
и мономеры высвобождаются в
окружающую ткань)
Утечка из имплантата в окру-
жающую ткань ионов и других
элементов сопровождается
сильной и быстрой абсорбцией
молекул из жидкостей и тканей,
в результате чего поверхность
имплантата интимно соединя-
ется с окружающими тканями
Активация дифференциации клеток-
предшественников в остеобласты,
формирование богатого коллагеном
промежуточного слоя
Отсутствует биохимическое влияние
на клеточную дифференциацию и про-
лиферацию. Клетки не получают био-
химическую информацию о присутст-
вии имплантата. Отсутствуют реакции
энзимов. Имплантат изолирован от
иммунной системы хозяина, отсутст-
вуют реакции на чужеродное тело
Биоактивность
Отложение на поверхности им- Образуются соединения, схожие с ес-
плантата коллагена и гидрокси- тественной "склейкой”
апатита из окружающей среды
слой мягкой фиброзной ткани. При
благоприятных механических условиях
биоинертные материалы (алюминие-
вая керамика, керамики двуокиси цир-
кония, титан, тантал, ниобий, углерод)
создают контактный остеогенез, т.е.
прямое соединение этих материалов с
костной тканью. Костная интеграция
происходит благодаря тому, что по-
верхность таких материалов химически
инертна к окружающим тканям и тка-
невым жидкостям. Биоактивные мате-
риалы (кальций-фосфатная керамика,
стекло, стеклянные керамики) вызыва-
ют соединительный остеогенез, пред-
ставляющий собой определенный вид
прямого химического соединения им-
плантата с окружающей его костью за
счет присутствия свободного кальция
и фосфата на поверхности материала и
адекватности их взаимодействия с тка-
невыми компонентами кости [134].
Данные о влиянии видов совмести-
мости на ткани в 1990 г. были обобще-
ны G. Heimke [94| (табл. 1.1).
Успешное функционирование им-
плантатов в значительной степени зави-
сит от биомеханических свойств ново-
образованных тканей. G. Heimke обоб-
щил также биомеханические характери-
стики пяти типов тканей, образующих-
ся при имплантации разных материа-
лов. Характеристики этих свойств све-
дены в табл. 1.2.
Таблица 1.2. Биомеханические характеристики новообразованных тканей
Тип ткани Реакция Материалы
на сжатие на сдвиг на растяжение
Грунуляции: 0 0 0 Сталь, сплавы, полимеры рубец сосуды Остеоидная +0 0 Полиэтилен Хрящевая + 0 0 Акрилот Кость: при контакте +0 0 Сталь, титан, AljOj при соеди- Биостекло, стеклянная керамика, нении + + + плотный (спекшийся) апатит
Примечание. + — наличие реакции, 0 — отсутствие реакции.
Из таблицы видно, что из новых
тканевых образований силовое воздей-
ствие (сдавливание, сдвиг и растяже-
ние) лучше всего выдерживает кость.
Неблагоприятные результаты отмече-
ны в отношении грануляций (рубцов),
остеоидной и хрящевой ткани. По-
следняя из силовых нагрузок выдержи-
вает только сдавливание. Для успеха
имплантации у самих материалов, на-
ходящихся в тканях организма челове-
ка. не должны проявляться такие свой-
ства, как коррозия, эластичность, из-
нашиваемость и растворимость. Им-
плантируемые в ткани материалы
должны выдерживать давление, так
как в противном случае возникает раз-
дражение тканей, усиливаются про-
цессы резорбции в кости и нарушается
стабильность имплантата. Для зубных
имплантатов большое значение имеет
реакция материала на нагрузки. Одной
из характерных причин неудачной зуб-
ной имплантации является разлом
конструкции из-за неадекватной на-
грузки или за счет "усталости” материа-
ла. в том числе металла.
Важную роль в костной интеграции
имплантатов играют биохимические
свойства материала. Шведские и аме-
риканские исследователи при изуче-
нии биохимических свойств поверхно-
стности контактных зон биоматериа-
лов установили, что наиболее активно
и плотно кость соединяется с керами-
ками, в том числе с окисью алюминия,
гидроксиапатитом и трикальцийфос-
фатом (101, 103].
1.2.1. Металлы
В зубной имплантологии металлы на-
чали применять еще в начале прошло-
го века. Среди них наиболее часто ис-
пытывали и использовали на практике
золото, алюминий, серебро, бронзу,
железо, сталь, медь, цинк и никель как
отдельно, так и в комбинациях. Одна-
ко большинство этих материалов имеет
неадекватные механические характе-
ристики и вызывает патологические
Реакции тканей. Это предопределило
неудачи при использовании первых
имплантатов из металла.
На рубеже 30—40-х годов прошлого
века в общей хирургии стали приме-
нять достаточно прочные сплавы ко-
бальта и хрома. Кроме того, они более
совместимы с тканями. Эти материалы
получили название "металлы хирурги-
ческого класса". Самое широкое при-
менение нашла нержавеющая сталь. До
сих пор спицы Киршнера, мини-пла-
стины, аппараты для остеосинтеза ис-
пользуют в хирургической стоматоло-
гии. Однако для внутричелюстного вве-
дения в виде зубных имплантатов, ко-
торые, находясь внутри кости, помимо
разносторонних окклюзионных нагру-
зок, испытывают и особое влияние суб-
страта ротовой жидкости, ее клеточ-
ных, ферментативных, специфических
и других реакций, такие металлы не-
приемлемы. Непригодна для зубной
имплантации и нержавеющая сталь,
так как она вызывает коррозию, облада-
ет низкой прочностью и малой упруго-
стью при нагрузке зубными протезами.
При имплантации чистых металлов
и их сплавов многие исследователи от-
мечали развитие хронического воспа-
ления (63, 94]. Экспериментально бы-
ли установлены развитие грануляций
при имплантировании стали, образо-
вание рубца при вживлении сплавов
металлов (92]. Остеоидная ткань обра-
зовывалась при имплантации полиэти-
лена, а хрящевая — при имплантации
акрилота. Наблюдались патологиче-
ские иммунные клеточные реакции на
никель, содержащийся в нержавеющей
стали, что свидетельствует о контакт-
ной аллергической реакции живых
тканей на этот металл. Наилучшие по-
казатели отмечены у зубных импланта-
тов из сплава кобальта, хрома и нио-
бия. У них отмечено улучшение анти-
коррозийных свойств, механических
характеристик. Вместе с тем морфоло-
гические исследования показали, что
плотного соединения имплантацион-
ных конструкций из этих металлог* с
костью не происходит и между костью
и имплантатом образуется слой фиб-
розной ткани.
Дтя развития имплантации большое
значение имели исследования титана и
его сплавов. Еще в 30—40-х годах про-
шлого столетия было отмечено, что во-
круг титановых имплантатов кость рас-
тет быстрее, чем около конструкции из
сплава хрома и кобальта, и что сплавы
титана обладают антикоррозийными
свойствами и хорошей совместимо-
стью с тканями [110]. В конце 60-х —
начале 70-х годов титан и его сплавы
стали относить к приоритетным мате-
риалам для имплантационных конст-
рукций. В биологической среде эти ма-
териалы проявляют высокие антикор-
розийные свойства. Элгоированные
ионы титана значительно меньше, и
токсичность их существенно ниже, чем
у других металлов. За 40 лет не отмече-
но ни одного случая аллергической ре-
акции на титан [95], но D. Smith
зафиксировал ее на его сплавы. Для из-
готовления зубных имплантатов наи-
более часто применяют технически
чистый титан, сплавы титана, алюми-
ния и ванадия, сплавы титана, кобальта
и хрома (ВТ1-00, ВТ-0, соответствую-
щие зарубежным видам Grade 1, 2, и
ВТ5, BTg, соответствующие Grade 4, 5).
При зубной имплантации титан и
его сплавы соответствуют как химиче-
ским, так и механическим требовани-
ям. Их отличают высокая упругость,
которая выше, чем у кости, в 5 раз, и
низкая плотность, благодаря чему их
прочность выше, чем у других метал-
лов. Сплавы титана с алюминием и ва-
надием увеличивают прочность им-
плантационных конструкций [104]. Од-
нако при всех этих положительных ха-
рактеристиках у титана и его сплавов
остается низкое сопротивление на
сдвиг и износ, особенно в условиях тре-
ния. Не исключается также, что при
определенных условиях биологической
среды могут наблюдаться коррозия и
элюирование титана [140]. Установле-
но определенное значение пор на по-
верхности титановых имплантатов для
лучшего их “сцепления" с костью [71].
Большое значение в характеристике
титана и его сплавов имеет свойство
при введении в ткани образовывать на
поверхности имплантата окисный
слой, который повышает антикорро-
зийные свойства материала и благода-
ря стабильным и высокоплотным ок-
сидам обладает высокой вязкостью и
хорошей адгезией. Даже при возник-
новении царапин или других повреж-
дений поверхности титана происходит
восстановление окисной пленки [135,
137]. Однако окисная пленка может
разрушаться при избыточном влиянии
лекарственных препаратов, используе-
мых для профилактики кариеса, и ле-
карств, содержащих фториды [143].
Повышение устойчивости к корро-
зии титановых, алюминиевых и вана-
диевых материалов достигается также
их обработкой аргоном при температу-
ре накала и сварки [140].
Установлен международный стан-
дарт 5 марок титана в зависимости от
химического состава и прочности на
растяжение (табл. 1.3 и 1.4).
Из первого поколения медицинских
сплавов титана наибольшее распро-
странение получил BTg (по междуна-
родному стандарту Grade 5 Ti6A14v).
Благодаря присутствию фтора, бора и
ниобия такой сплав титана более про-
чен и пластичен. Однако многие авто-
ры считают, что его применение долж-
но быть ограничено из-за присутствия
Таблица 1.3. Химический состав титана
Элемент Пределы состава, % (макс.)
марка 1 марка 2 марка 3 марка 4А и 4В
Азот 0,03 0,03 0,05 0,05
Углерод 0,10 0,10 0,10 0,10
Водород 0,015’ 0,015* 0,015* 0,015*
Железо 0,20 0.30 0,30 0,50
Кислород 0,18 0,25 0,35 0,50
Т итак Остальное Остальное Остальное Остальное
*3а исключением заготовок, в которых максимальное содержание водорода должно состав-
лять 0,0100 %.
Т» 6 л и ца 1-4. Механические свойства гитана
Марка Состояние Предел проч- ности при рас- тяжении*, МПа/мин Предел теку- чести (0,2 % смешение*), МПа/мин Удли- не- ние** % Диаметр оправки для испытания на изгиб листа и полосы при
2 мм 3 мм
1 Обжиг 240 170 24 30 3 4 2 » 345 230 20 30 4 5 » 450 300 18 30 4 5 4А » 550 440 15 25 5 6 5 В Обработка вхолодном состоянии 680 520 10 18 6 7
♦Требования, предъявляемые к растяжению и текучести, относятся только к материалу, ис-
пытанному как паралелльно, так и перпендикулярно направлению прокатки.
•♦Калибр = 5,65VS0 или 50 мм, где So — первоначальная плотность поперечного сечения в
квадратных миллиметрах.
•»•/ — толшина листа или полосы.
ванадия или алюминия. Кроме того,
степень соединения его с тканями ни-
же. чем нелегированного титана. Вы-
зывает также большие опасения воз-
можность разломов имплантатов из
сплава ВТ6 при соприкосновении с ио-
нами хлора, содержащимися в ткане-
вых жидкостях.
Одним из лучших сплавов титана
считается сплав второго поколения Ti-
6А1-7НЬ. Он соответствует международ-
ному стандарту (Protasol-ЮО, Швейцар-
ский стандарт SN 056512, 1987 г.). На
Международной конференции по тита-
ну. проходившей в Сан-Диего (США) в
1972 г., были приняты и рекомендова-
ны к применению при зубной имплан-
тации р-сплавы, обладающие высокой
прочностью: Ti-15Mo-5Zr-3Al. Ti-Mo-
Zr, Ti-3o-Ta. Электронно-микроскопи-
ческое изучение соединения этого спла-
ва с костью показало адекватную сосу-
дистую реакцию и прочность его соеди-
нения с костью [124].
В последние 10 лет широко исполь-
зуется методика плазменного напыле-
ния нитрита титана или тонкого слоя
гидроксиапатита на поверхность тита-
новых имплантатов. Это позволило
Улучшить характеристику импланта-
°В: при сохранении их прочности
Улучшалось соединение с костью [82.
4, 100]. Экспериментальные исследо-
вания показали, что при покрытии
идроксиапатитом соединение им-
плантатов с костью более плотное и
происходит на ранних этапах [99]. Это
подтвердили сравнения титановых им-
плантатов с покрытием и без него при
нагрузках. Было установлено, что по-
крытие гидроксиапатитом в 5—8 раз
увеличивает прочность соединения с
костью, причем плотное соединение
наблюдается уже через 32 нед [116]. Од-
нако позже обнаружились некоторые
недостатки покрытия, в том числе его
способность со временем растворяться
в биологической среде организма. Кро-
ме того, с увеличением толщины по-
крытия снижается микротвердость,
оптимальной является пористость от
5 до 40 %, лучшим признан порошок
средней дисперсности — 70—100 мкм и
средняя дистанция напыления. Луч-
шая остеоинтеграция наблюдается у
имплантатов с двойным покрытием —
титаном и гидроксиапатитом [37].
Эксперименты с имплантатами, по-
крытыми гидроксиапатитом, получен-
ным от разных производителей, пока-
зали, что у всех физические характери-
стики (прочность сцепления с костью,
деградация, растворение и расщепле-
ние покрытия на титане и сплаве хрома
с кобальтом) оказались одинаковыми,
за исключением пористости. Однако in
vitro отмечено значительное отличие
процессов, проходивших в покрытиях
гидроксиапатитом различного произ-
водства. Какого-либо влияния мате-
риала имплантатов на такие различия
не отмечено. Исследователи относят
такие явления к разной пористости
гидроксиапатита, поскольку с увеличе-
нием плошали поверхности возрастает
разрушение фосфата кальция [37, 82].
В России разработаны имплантаты с
покрытием силиконом и ППВ*, стиму-
лирующих остеосинтез. Одной из про-
блем конструирования зубных им-
плантатов является устранение загряз-
нений тела конструкции. Попытки на-
пыления биологически чистых метал-
лов и биоматериалов, обработка источ-
никами высокой энергии — сверхмощ-
ными ионными пучками вызывают оп-
тимизм, но требуют высокого научного
обоснования.
Исследования по применению тита-
на и его сплавов для челюстных опера-
ций, в том числе при зубной импланта-
ции, в России начались в конце 70-х —
начале 80-х годов. В.Э. Гюнтер и соавт.
[19, 20, 211, И.В. Итин и соавт. [28J в
оригинальных исследованиях изучили
свойства никелид-титанового сплава,
который предложен в качестве мате-
риала для зубных имплантатов. При
разработке беспористых и пористых
сплавов с памятью формы на основе
никелида титана эти авторы установи-
ли высокую стабильность их физико-
химических свойств. Они могут приме-
няться в виде беспористых и пористых
материалов. Пористые сплавы характе-
ризуются плотным соединением с ко-
стью с прорастанием кости в глубь им-
плантата. Разработчики этого материа-
ла считают, что имплантаты из такого
сплава ведут себя в организме челове-
ка, как живые ткани. В.Н. Олесова [46|
отметила высокую стабильность их
физико-химических свойств, образо-
вание вокруг имплантатов из этого ма-
териала зрелой костной ткани и ее
прорастание внутрь пор имплантата.
На основе новой технологии
М.З. Миргазизов и соавт. [41 [ разрабо-
тали имплантаты из никелид-титана
методом спечения пористого материа-
ла на беспористой основе. В результате
самораспространяющегося высоко-
*ППВ — сополимер винилпирролидон с
метилметакрилатом, армированный капроно-
вым волокном и наполненный глюконатом
кальция (Ушаков А.И., 20011.
температурного синтеза порошков ме-
таллов (никелид тизана), а также мето-
дами механической, электроискровой
и химической обработки создавались
пористые никелид-титановые заготов-
ки для внутрикостных зубных имплан-
татов. После такой обработки имплан-
таты более устойчивы к коррозии.
Металлы на основе кобальта для
зубной имплантации обычно применя-
ют с добавлением молибдена, ванадия,
что повышает их прочность. Сплавы на
основе молибдена обладают высоким
пределом выносливости, резистентно-
стью к разлому и сопротивлением к из-
носу. Однако в отличие от технически
чистого титана, который, несмотря на
отсутствие активной реакции, соеди-
няется с костью, у хромокобальтовых
сплавов, полимеров, вызывающих пас-
сивную реакцию, плотного соедине-
ния с костью не бывает.
Такие же отрицательные свойства
имеет хромокобальтовый сплав для
зубных имплантатов, хотя первые дан-
ные о них в клинике были обнадежи-
вающими [15J.
В настоящее время обобщены ре-
зультаты исследований по применению
циркония в качестве материала для из-
готовления имплантатов [27, 32, 61).
1.2.2. Аутогенные костные
трансплантаты
Если перед зубной имплантацией или
в ходе ее необходимо восполнить не-
достаток кости или закрыть костный
дефект, то прибегают к пластике кост-
ными пластическими материалами.
Лучшим трансплантационным мате-
риалом являются костные трансплан-
таты самого пациента. Нередко планом
лечения предусмотрена постановка
имплантатов непосредственно в кост-
ные трансплантаты. Главный вопрос
заключается в приживлении ауто-
трансплантата в кости пациента.
Аутотрансплантаты берут из кости хо-
зяина: гребня подвздошной кости, реб-
ра, малой берцовой кости, а также фраг-
ментов верхней и нижней челюсти —
нижнечелюстного симфиза, ретромо-
лярной области и ветви; бугра верхней
челюсти, а также гиперостозов кости
Рис. 1.12. Аутогенный костный транс-
плантат ветви нижней челюсти.
(рис. 1.12). Большие преимущества ау-
тогенных трансплантатов перед други-
ми костными трансплантатами опреде-
ляются наличием у них жизнеспособ-
ных остеобластов и отсутствием чуже-
родных антигенных протеинов, а также
тем, что они имеют как остеокондук-
тивные, так и остеоиндуктивные ха-
рактеристики. Единственный их не-
достаток, если его можно так назвать,
заключается в дополнительной травме
при взятии трансплантата [101].
В первые недели после пересадки
аутогенного трансплантата в нем про-
исходит процесс адаптации клеток
кости, периоста, костного мозга с по-
следующей их реваскуляризацией. Во
второй фазе наблюдается стимуляция
клеток костного ложа, и они, диффе-
ренцируясь в остеобласты, создают ко-
стную матрицу. За счет костно-индук-
тивной деятельности клеток костного
ложа образуется новая кость, где пере-
саженный аутотрансплантат играет
Роль костного скелета. В дальнейшем
одновременно протекает резорбция
Кости и ее новообразование, что при-
водит к инкорпорации костного зранс-
плантата в хозяйское ложе.
Аутотрансплантаты могут быть взяты
из губчатого либо кортикального веще-
ства кости или быть комбинированны-
ми. Если они состоят из губчатого ве-
щества кости, то после пересадки в них
отмечается быстрая и более полноцен-
ная реваскуляризация. Между тем в ау-
тотрансплантатах, состоящих из корти-
кального вещества кости, эти процессы
происходят медленнее, и, кроме того,
значительная часть пересаженной кости
гибнет, а ее замещение новой костью
носит как бы ползучий характер [85].
1.2.3. Аллогенная кость
.Аллогенная кость — это костные ткани,
взятые от других людей посмертно. По
мнению Г.Н. Верченко [150], термин
"трансплантат" надо использовать по
отношению только к живым тканям.
Пластика аллогенными тканями ши-
роко распространена уже 30—35 лет.
Накоплен большой опыт применения
их различных видов как за рубежом
[73, 139], так и в России [4, 11, 52, 58].
Эти ткани могут быть лиофилизиро-
ванными, деминерализованными и ау-
толизованными или антигенно-экст-
раактивированными. Перед постанов-
кой их реконструируют разными мето-
дами, благодаря чему выраженность
тканевой иммунизации в них снижает-
ся [139]. При зубной имплантации
наибольшее применение находит вы-
пускаемая банками тканей лиофили-
зированная и деминерализованная
кость в виде блоков, фрагментов кор-
тикальных пластин, порошка, гранул
разной величины [148].
При пересадке в ткани аллогенной
кости происходит развитие кости от
костного ложа. Иначе говоря, аллоген-
ная кость, являясь остеокондуктивным
материалом, играет роль матрикса, хотя
многие исследователи признают за ним
и остеоиндуктивные свойства, потен-
циал которых зависит от метода обра-
ботки аллокости [139]. Процесс ремоду-
лирования аллокости идет параллельно
резорбции и путем постепенного заме-
щения новой костью оставшегося кар-
каса. Этот медленный процесс во
многом зависит от характера Переса-
Рис. 1.13. Аллогенные костные транс-
плантаты.
а — гребня подвздошной кости, ребра и других
костей скелета; б — "Dyna-Gran".
женного материала — метода его обра-
ботки (лиофилизированный, свежеза-
мороженный), типа (блок, стружка, по-
рошок) и состава (вид декальцифика-
ции) (рис. 1.13).
Лиофилизированная кость хорошо
поддается обработке, легко моделирует-
ся к участку кости и обеспечивает нуж-
ные анатомические контуры [52]. Вме-
сте с тем она очень чувствительна к ин-
фекции и дает хорошие результаты при
полном исключении воспалительного
осложнения [73]. В противном случае
аллокости нагнаиваются и отторгаются.
Особенно часто это происходит при
подсадке в заведомо инфицированные
ткани [3]. При зубной имплантации,
когда лиофилизированная кость так
или иначе может инфицироваться ауто-
инфекцией полости рта, она применя-
ется мало, хотя имеются отдельные со-
общения о хороших результатах ее ис-
пользования. Давая сравнительную
оценку’ различных видов аллокости,
К) А. Петрович и соавт. [51] считают бо-
лее перспективными формализованные
и частично деминерализованные, неже-
ли лиофилизированные трансплантаты.
Вместе с тем П.А. Железный и И.Г. Ту-
лупова [23] отметили, что в лиофилизи-
рованной кости процесс репаративного
остеогенеза протекает оптимально.
Замороженные кости в настоящее
время применяются мало. По данным
Н.А. Плотникова [52], они вызывают
наибольшее число осложнений. Более
того, возникает опасность иммунного
конфликта, при котором рассасывает-
ся не только пересаженная кость, но и
здоровые участки костной ткани по
краям ложа. Замороженную кость при-
меняют редко еще и потому, что вас-
куляризация ее идет медленно и воз-
можно инфицирование.
Формалинизированная кость имеет
определенное преимущество, так как
консервация в формалине снижает им-
муногенность в кости. По данным
Н.А. Плотникова [52, 53], формалини-
зированные трансплантаты эффектив-
но регенерируют только в 40 % случаев,
а по материалам Н.И. Локтева [36], еще
реже — в 18,7 % случаев. В развитых
странах Европы и Америки к настоя-
щему времени сформулированы две
правовые концепции взятия аллоко-
сти: согласие погибшего и его семьи на
изъятие тканей и презумпция согласия
без отрицательного мнения умершего
и его семьи. Такое правовое регулиро-
вание одобрено Всемирной организа-
цией здравоохранения в случае, если
изъятие тканей не валяется объектом
коммерческих сделок. По мнению
С.П. Миронова [150], в России еще нет
четких законодательных актов по рабо-
те тканевых банков и как следствие от-
сутствуют стандарты для изготовления
аллокостных материалов. Во всем мире
при применении аллокости и других
тканей от умерших людей существует
проблема инфицирования больных
ВИЧ, возбудителями гепатитов В и С и
другими малоизвестными вирусами
(Крейтцфельда—Якоба и др.). Совре-
менные методы обработки аллокости
пока не обеспечиваю! полной безопас-
ности. Несмотря на определенные труд-
ности, в настоящее время развиваются
экспериментальные и клинические ис-
следования по аллокости ым тканям с
насыщением их биологически активны-
ми составляющими — факторами роста,
гликозаминогликанами, морфогенети-
ческими белками. При зубной имплан-
тации применяют различные виды ал-
лотрансплантатов, но преимуществен-
но используется деминерализованная
облученная кость в виде блоков, фраг-
ментов кортикальных пластин, порош-
ка. гранул разной величины, выпускае-
мых банками тканей России, США и
Европы (рис. 1.13, б). Наиболее приме-
няемые при имплантации аллокостные
материалы — "DFDBA", "Dyna-Graft”,
"DBM" и '’ВМР5". В России после не-
которого перерыва аллокость выпускают
банки тканей ГУН ПИТО им. А Н. При-
орова, РНИИТО им. Р.Р. Вредена,
НИИ Новосибирска, Самары и др. Рос-
сийские банки тканей изготавливают
деминерализованный костный транс-
плантат (ДКТ), деминерализованный
костный матрикс (ДКМ), аллокость
оригинальной обработки (аллоплант),
костный деминерализованный транс-
плантат (перфоост), деминерализован-
ные кортикальные фрагменты кости
(ДКТ), депротеинизированную губча-
тую кость (ДГТ), замороженный кор-
тикальный трансплантат (ЗКТ), кост-
ные опилки и др. В стоматологии на-
ходит применение брефокость — кост-
ная ткань эмбрионов человека, чаще
5—7-месячных. При имплантации этот
материал еще мало изучен, а имею-
щийся опыт показывает низкую био-
механическую прочность и рассасыва-
ние подсаженных тканей*.
1-2.4. Ксеноткани
Материал, взятый от генетически раз-
личающихся организмов, представляет
‘Среди зарубежных банков и фирм наибо-
известны "Daytom Regional Tissue Bank",
"i e> m", "Osteo-Tech.", "Tissue Services Inc.",
» Rodent", "Rocky Mountain Tissue Bank",
Pacific Coast Tissue Bank" (США) и "Hess
/Hxhzintenchbox” (Германия). Из видов атло-
„TF” эти банки выпускают облученную кость
1™ °£гным мозгом ("Irradiated Allogenic Cancel-
us ), "Pacific Coast Tissue Bank” — разнооб-
разные облученные деминерализованные и
"^Деминерализованные кортикальные и губ-
собой ксеноткань. Основной состав-
ляющей ксенотрансплантатов являет-
ся коллаген. Это компонент соедини-
тельной ткани гетерочужеродных орга-
низмов — быков, коров. В организме
человека коллаген находится в сухожи-
лиях, хрящах, кости. Он активно уча-
ствует в процессах, происходящих в
соединительной ткани, в том числе в ее
механической, защитной и пластиче-
ской функциях. Клетки фибробласти-
ческого ряда синтезируют коллаген.
Благодаря этому свойству препараты
на основе коллагена имеют большую
перспективу для остеогенеза при зуб-
ной имплантации. Кроме того, колла-
геновые материалы хорошо коопериру-
ются с лекарственными веществами со-
судистого, противовоспалительного и
стимулирующего действия. Это позво-
ляет при пластике тканей создавать не-
обходимую кинетику лекарственных
веществ.
Известно более 20 типов коллагена.
Для кооперации с костью используется
коллаген 1, реже — коллаген V.
Коллагеновые материалы обладают
способностью резорбироваться в тка-
нях и стимулировать регенеративные
процессы, в том числе в кости. В то же
время они не имеют токсических и
канцерогенных свойств и слабоанти-
генны. Чаще всего используют ксе-
нотрансплантаты из бычьей кости,
прошедшей специальную обработку —
депротеинизацию, в результате чего
устраняется антигенное воздействие
ксенотрансплантата в тканях организ-
ма. После обработки ксенотрансплан-
таты становятся костными минерала-
ми, в кости могут поглощаться и рас-
сасываться, но при этом не обладают
остеоиндуктивными свойствами. В то
же время они являются остеокондук-
тивными агентами, и в результате их
действия в тканях и реакции тканей
происходит костное прорастание. Раз-
чатые кости ("Bone Graft"), деминерализован-
ную кортикальную кость ("Allograft ), демине-
рализованную кость в виде геля, порошка,
гранул, блоков ("Dcmbonc"), гель ("Antridox"),
деминерализованную кость в виде пластин,
порошка, гранул, блоков, "Human Allograft",
"Osleo Tech. Inc." — деминерализованную
кость ("DMIN"). Значительно реже эти банки
выпускают не минерализованную кость ("Life
Nem”, Т.М. Hess).
a
Рис. 1.14. Ксенотрансплантаты.
а — "Bio-Oss"; б — "Osteo-Graf"; в — “Pep-Gen Р-15".
витке кости идет от ложа ксенотранс-
плантата с депонированием костных
клеток на его поверхности. Сам ксе-
нотрансплантат в ходе костного про-
растания подвергается резорбции и ре-
конструкции с полной заменой его но-
вой костной тканью.
Высокую гистологическую оценку
такому трансплантационному материа-
лу дали J. Wagner и М. Perel [141]. О раз-
работке нехимического способа полу-
чения абсолютно анорганической ксе-
ногенной бычьей кости, при пересадке
которой сохраняются природные кост-
но-трофические свойства, сообщили
D. Callan и М. Rohrer [77]. Эти же ав-
торы трансплантировали полученный
материал двум пациентам во время
зубной имплантации и, судя по гисто-
логическим исследованиям, получили
положительный результат. Вместе с
тем в отдельных случаях остеогенез мо-
жет не происходить; образуется фиб-
розная соединительная ткань, что соз-
дает препятствие для остеоинтеграции
имплантата как в случае его постанов-
ки одновременно с пластикой ксено-
тканью, так и при последующей им-
плантации. Внушает оптимизм новый
материал для восстановления кости
"Биоимплантат”, прошедший клиниче-
ские испытания [150].
Используемые при зубной имплан-
тации зарубежные ксенотрансплантаты
"Bio-Oss" и "Osteo-Graf представляют
собой комбинированные материалы —
коронатный апатит с дефицитом каль-
ция, полученный из костей коровы
(рис. 1.14, а, б).
Из коллагена были синтезированы
15 аминокислот, составляющих пептид.
Последний вызывает активность праро-
дительских клеток — остеоцитов. Со-
единенный с частицами гидроксиапати-
та препарат стал испытываться фирмой
"Cera-med" в парадонтологии и имплан-
тологии. Предоставленный нам этой
фирмой для экспериментальных и кли-
нических испытаний "Pep-Gen Р-15”
(рис. 1.14, в) как изолированно, так и
в комбинации с ауто- и аллокостью ма-
териал способствовал образованию
полноценной кости в месте ее дефекта.
Наибольший клинический эффект этих
материалов получен нами при имплан-
тации, особенно немедленной. Эта же
фирма выпустила материал эмалевого
матричного протеина — “Emdogain",
являющийся стимулятором роста кос-
ти. При имплантации, особенно не-
медленной, он способствует раннему и
прочному образованию соединения
десна—имплантат. По нашему мне-
нию, это может сделать перспективной
раннюю нагрузку на имплантат.
1.2.5. Синтетические
кальций-фосфатные керамики
Минерализированные ткани человече-
ского организма состоят в основном из
разных видов гидроксиапатита, три-
калыгийфосфата и карбоната кальция.
Среди них гидроксиапатит выделяется
такими характеристиками, как упоря-
доченная структура кристаллов, иногда
аномальное их строение, способность
к обмену и изменчивость состава на
протяжении жизни. По мнению
В.К Леонтьева и соавт. |34], в основе
многих его свойств лежат два фактора —
развитие и деятельность в твердой фазе
под контролем внутренней и внешней
среды и синтез гидроксиапатита на ба-
зовых матрицах. Гидроксиапатит, имея
стабильную молекулярную структуру,
может формировать и сохранять мине-
рализованные ткани при разных кли-
нических ситуациях. Материалы на ос-
нове гидроксиапатита в медицине ис-
пользуются в виде плотной и пористой
керамики.
Имеющийся в организме человека
гидроксиапатит представляет биологи-
чески активное соединение кальция. Он
может иметь переменный состав, но по-
стоянные свойства. Обобщенная фор-
мула гидроксиапатита Саю(РО4)(ОН)2.
В его молекуле может быть от 8 до 12
ионов кальция, но иногда могут содер-
жаться гетероморфные замещения
Mg-, Sr2, Ba2, Н2О, а также ионами Н
и С1 и карбонатом. От этих взаимоот-
ношений зависят биологические свой-
ства гидроксиапатита. Гидроксиапатит
имеет стабильную молекулярную
структуру и, несмотря на переменный
состав, формирует и сохраняет мине-
рализированные ткани при разном со-
держании кальция. Это обусловливает
выделение кальцийдефицитного, сред-
него и кальцийизбыточного гидрокси-
апатита. Среди его свойств следует от-
метить такие, как стехиометричность,
кристалличность и пористость (47].
Считается, что гидроксиапатит орга-
низма человека представляет собой
минеральный скелет, который являет-
ся источником кальция и фосфата в
тканях. Однако имеются определенные
Различия между гидроксиапатитом ор-
ганизма человека и синтетическим.
Последний, являясь остеокондуктив-
йЫм, может участвовать в остеогенезе,
и от этого зависит его плотное соеди-
нение с костью.
Оба вида гидроксиапатита имеют
высокие механические, химические и
Физические свойства. В многочислен-
ных исследованиях гидроксиапатита и
керамик установлено, что для зубной
имплантации наиболее пригодны гли-
ноземные керамики — окись алюми-
ния, материалы из керамики на основе
кальция и фосфата. Как показало изу-
чение биохимических свойств поверх-
ности кости, находившейся в контакте
с этими материалами, они обеспечива-
ют наиболее активное и плотное со-
единение с ней [64, 108]. Алюминиевая
керамика характеризуется высокой со-
вместимостью с тканями в тех случаях,
когда глинозема в ней не менее 93,5 %.
Керамики, состоящие из кальция и
фосфата, относятся к группе биоактив-
ных материалов. Не имея остеогенных
свойств, они являются пластическим
материалом в виде матрицы для отло-
жения кости. Среди них наибольшее
распространение получили такие кера-
мики из кальция и фосфата, как три-
кальций-фосфат и гидроксиапатит.
Трикальций-фосфат относится к кри-
сталлическим керамикам (рис. 1.15).
Его называют обезвоженным вариан-
том гидроксиапатита. На западном
рынке высокую оценку имеет препарат
ТКФ "Cerasorb" (рис. 1.15, а). Порис-
тые гидроксиапатитные и трикальций-
фосфатные керамики имеют тенден-
цию непредсказуемо биосорбировать-
ся в костной ткани. Кроме того, они
хрупкие, плохо реагируют на силы на-
тяжения, скручивания или сгибания,
что не позволяет использовать их в ка-
честве материала непосредственно для
зубных имплантатов |99|, но эти кера-
мики способны формировать прямое
"сцепление" с костью. При этом снача-
ла в зоне соединения материала и кос-
ти образуется аморфное вещество, ко-
торое потом минерализуется.
Биосовместимость трехбазового
фосфата кальция — синтетического
гидроксиапатита — хорошо изучена.
Он не вызывает общей или местной
токсической реакции, воспалительных
явлений в тканях как инородное тело,
способствует функциональной инте-
грации с костью, не влияет на процес-
сы минерализации. Очень важно, что
гидроксиапатит создает прямую хими-
ческую связь с костью путем естест-
венных цементирующих механизмов
|98|. Не являясь естественным минера-
Рис. 1.15. Керамика.
а — трикальаий-фосфат — "Ccrasorb"; б — гра-
нулированные формы Тидроксиапола"; в —
искусственная гидроксиапатитная кость "1п-
tcrporc-200".
лом кости, по свойствам он близок к
нему. Как показали многолетние ис-
следования J. Jarcho (1976—1992), при
прямом соединении гидроксиапатита с
костью контактная зона может иметь
глубину от 50 до 2(М) нм. Она состоит из
биологических кристаллов гидрокси-
апатита, которые на расстоянии 10 нм
четко сгруппированы вокруг тела им-
плантата, что идентично строению
кальцифицированной кости. В составе
этой зоны отсутствуют коллагеновые
волокна, но она богата мукополисаха-
ридами. Из-за прочности указанной
зоны существует мнение о ее идентич-
ности с биологически природным це-
ментирующим веществом кости.
В зависимости от технологии
получения различают плотные и по-
ристые структуры гидроксиапатита.
Синтетический апатит в виде порошко-
вых форм может быть аморфным или
кристаллическим. Такой апатит полу-
чают путем синтеза в жидкофазной ре-
акции кальция и фосфата. В результате
создается материал с низкой кристал-
личностью, высокой сорбционной
способностью и химической мобиль-
ностью для тканей. При зубной им-
плантации применение нашли глав-
ным образом пористые гранулирован-
ные формы гидроксиапатита. Их широ-
ко применяют для напыления на тело
зубного имплантата, увеличения высо-
ты и ширины альвеолярного отростка,
закрытия дефекта кости, заполнения
ложа перед погружением в него им-
плантата. У синтетического гидрокси-
апатита призматическая форма имеет
длину 800 нм и диаметр 200 нм. Он об-
ладает поверхностной активностью,
что обусловливает его сорбционную ак-
тивность.
Плотные формы гидроксиапатита
состоят из кристаллов, которые могут
быть в виде керамических гранул, по-
ристых блоков и форм спеченного ма-
териала. Эти формы образуются при
нагревании гидроксиапатита до 800—
1000 ’С. Созданная таким путем кон-
денсационно-металлическая форма об-
ладает химической стабильностью в
тканях, дает остеогенный эффект и
способствует минерализации кости.
При имплантации плотного гидрокси-
апатита в ткани происходят прораста-
ние кости в блок спеченного материала
и ремоделирование кости вместе с ним.
Материал из непористой керамики об-
ладает слабой остеоинтегративной ак-
тивностью. Помешенная на область де-
фекта кости, она выполняет функцию
опорной матрицы. Для прорастания
кости оптимальным является размер
пор 100—200 мкм. Блок из плотного
гидроксиапатита в челюстно-лицевой
хирургии применяют для восполнения
дефектов костей лица.
Гидроксиапатиту свойственна био-
деградация, зависящая от его пористо-
сти и плотности. Пористые формы бо-
лее подвержены резорбции в тканях, у
плотных скорость резорбции меньше
[81]. Непористые формы в виде гранул
и порошка не стимулируют остеогенеза,
но условия взаимодействия в тканях
обеспечивают их адекватную реакцию
и хороший остеогенез. Среди них рас-
пространение имеет искусственная
кость на основе трикальций-фосфата,
гидроксиапатита — "CapSet", "Bii-
Роге™", "Bii-Fi™", "Bon-Apatite", "Bio-
Graft™", пористая p-трикальций-фос-
фатная керамика ("Peri-Oss"). Они
инертны и, заполняя пустоты в кости,
хорошо совмещаются с костной тка-
нью. В России по тем же показателям
хорошо себя зарекомендовал и широко
используется отечественный порошко-
вый и мелкодисперсный гидроксиапа-
тит под фирменным названием "ОС-
ТИМ-100" [50], а также гранулирован-
ный гидроксиапатит — "Гидроксиапол"
ТАП-85д", ТАП-85уд", "ГАП-99" с
диаметром гранул 0,25; 0,5; 1,0; 13,0 мм
[14, 33, 34. 47] (рис. 1.15, б).
В последние годы хорошим биоло-
гическим природным материалом для
имплантации являются кораллы, обла-
дающие макропористостью, и морские
водоросли, характеризующиеся мик-
Ропористостью. Аналогом такого мак-
ропористого биопластического мате-
риала является искусственная гидро-
ксиапатитная кость — "lnterpore-200"
< Interpore Inc.") (рис. 1.15, в).
"'•2.6. Комбинированные
пластические материалы
Комбинированные трансплантаты пред-
ставляют собой ту или иную комбина-
цию различных тканевых структур: ау-
тогенных трансплантатов и аллоген-
Ных костных тканей, гидроксиапатита
и ксенотканей, ксенотканей и синте-
тических пластических материалов. На
практике наиболее широко использу-
ют ауто- и аллокость. Их комбиниро-
ванное применение расширяет возмож-
ности восполнения кости с меньшей
травмой, связанной со взятием ауто-
трансплантата. Остеоиндуктивное дей-
ствие аутогенного трансплантата сти-
мулирует не только клетки костного
ложа, но и клетки аутотрансплантата.
Формирование кости может быть даже
более эффективным, чем при реконст-
руировании каждым из этих материалов.
При зубной имплантации применя-
ются также комбинации аутогенной
кости с гранулированным трикальций-
фосфатом или гидроксиапатитом. Экс-
периментальные исследования такой
комбинации дали хорошие результаты,
но при этом высказывалось мнение,
что кальций-фосфатные керамики
нужно использовать как наполнители,
но на их долю не должно приходиться
более 50 % [108]. Однако сравнитель-
ное экспериментальное изучение раз-
личных комбинаций, проведенное
С. Kobb и соавт. [80], показало, что ау-
тогенную кость и гидроксиапатит мож-
но брать в пропорции от 1:1 до 3:1. При
увеличении доли гидроксиапатита вы-
раженность костной интеграции
уменьшается. При зубной импланта-
ции используют также комбинацию ал-
логенной кости и синтетического гидр-
оксиапатита. Однако комбинация ал-
логенных трансплантатов с гидрокси-
апатитом по остеогенезу уступает
трансплантатам из аутогенной кости.
К комбинированным материалам от-
носятся биоситалы. Они содержат мик-
ро- и макроэлементы, гели природных
элементов — протеина, хондроитин-
сульфата, хитина и др. (рис. 1.16). Стек-
лянные керамики относятся к поли-
кристаллическим материалам. Они хо-
рошо адаптируются благодаря подавле-
нию локальной буферной реакции тка-
ней выделением ионов натрия в обмен
на ионы фосфата и водорода. При этом
образуется поверхностный слой фос-
фата кальция. Последний способен со-
единяться с костью, ее остеобластами и
коллагеновыми волокнами.
Отечественный стеклокристалличе-
ский материал биоситал, разработанный
Рис. 1.16. Биостекло "Perioglass".
в МГМСУ и Государственном НИИ
стекла, был апробирован на животных
и применен в клинике для восполне-
ния альвеол после удаления зубов. Ус-
тановлено, что в виде гранул и в ком-
бинации с коллагеном биоситал имеет
остеоиндуктивные свойства и может
быть использован как пластический
материал для замещения костных де-
фектов челюстей 129, 54]. Однако стек-
лянные керамики (непосредственно
биостекло) плохо выдерживают на-
грузки, поэтому использование их в
качестве материала для зубных им-
плантатов пока не получило распро-
странения (68].
С конца 80-х годов исследователи
активно разрабатывают различные
комбинированные материалы завод-
ского производства на основе
гидроксиапатита и трикальций-фосфа-
та, коллагена и других органических и
неорганических соединений. Такие
комбинированные материалы на осно-
ве гидроксиапатита и коллагена высо-
копрочны, эластичны и создают эф-
фективную костную индукцию. Неред-
ко комбинации пластических материа-
лов позволяют если не полностью уст-
ранить недостатки, присущие каждому
из компонентов в отдельности, то по
крайней мере уменьшить их число.
Кроме того, комбинация кальций-
фосфатного материала и коллагена мо-
жет использоваться для доставки в тка-
ни лекарственных веществ, клеток ко-
стного мозга, остеобластов, ростовых
факторов — морфогенетического белка,
трансформирующего факторы роста.
Из них наиболее хорошо себя зареко-
мендовали "Колапол", “Коллапан", "Os-
teotit", "Alloplast", "Natural Matrix",
"Chenograft", "Collagen”, "Bii-Plast™",
"Bii-Pore™", "OsteoGen".
В настоящее время на западном
рынке имеется большое разнообразие
комбинированных пластических мате-
риалов, предназначенных для зубной
имплантации*. Среди них широкое
применение нашли гидроксиапатитная
керамика из гранул на связке, ассими-
лирующихся в организме, гидрокси-
апатит в сетчатом футляре ("Реппа
Ringe”) (рис. 1.17, б). Для пластики ис-
пользуется "OsteoGen", состоящий из
спекшегося гидроксиапатита и деми-
нерализованной кортикальной кости
(рис. 1.17, в).
В России на основе кальций-фос-
фатной керамики и коллагена разрабо-
таны материалы Тапкол”, "Колапол",
"Коллапан" (8, 9, 14, 33, 34, 47] (рис.
1.17, г). В эти пластические материалы
активно прорастает костная ткань.
Происходит ее депонирование на по-
верхности минерала, а сами материалы
подвергаются резорбции. Разработан
биоактивный апатитовый композит
(БАК), состоящий из стекловидной
химически нейтральной матрицы Na-
Al-Si и гидроксиапатита. Матрица ма-
•Западныс фирмы выпускают кальций-
фосфатный костный материал Hacpet (произ-
водитель "Life Cell Corp.". США), варианты гид-
роксиапатита и трикальций-фосфата — Bii-
Pore™" “Bii-Fi™", "Bon-Apatite", "Bti-
Graft™ , "Peri-Oss” ("Bio Interfaces Inc.",
США); комбинации гидроксиапатита и три-
кальций-фосфата с деминерализованной ко;
стью или с коллагеном — Bio-Oss Collagen
(“Cera-Med". США); комбинация резорбируе-
мого гидроксиапатита с коллагеном "Ostco-
Gen" ("Impladent Ltd.", США); комбинация
трикальиий-фосфата с пластиком — "Bii-
Р1ая™“ ("Interfaces Inc.", США), деминерали-
зованная кость с биопластиком — "Bone-Ma-
trix™" ("International Tissue Scviccs Inc.", Ка-
нала), резорбированный коллаген — "Bio-
Tape” ("Vcrtrib und Bcratung", Германия), ком-
бинация синтетического гидроксиапатита,
деминерализованной кости и бычьего колла-
гена — "Osteomin” ("Bio-Interfaces Inc.",
США). Они придают трансплантату жесткость
и прочность и в то же время гибкость для луч-
шей подгонки к кости |25] (рис. 1.17, а).
Рис. 1.17. Комбинированные биомате-
риалы на основе гидроксиапатита и кол-
лагена.
а — резорбируемые коллагеновые нити с гра-
нулами гидроксиапатита; б — гидроксиапатит
в коллагеновом сетчатом футляре ('Реппа
Ringe"); в — "OsteoGen;" г — "колапол".
териала выполняет роль каркаса, между
перегородками которого равномерно
распределен гидроксиапатит до 60 %
по массе. Размеры пор составляют от
100 до 5000 нм [7].
Создан комбинированный препарат в
виде геля, состоящий из полиакрил-
амидного препарата гидроксиапола с
включением и без включения фермента
лизоцима [14, 16]. Разработан новый
отечественный материал "Тутопласт",
основанный на переработке, консерва-
ции и стерилизации тканей человече-
ского и животного происхождения (150].
Определенную перспективу представ-
ляют отечественные материалы, разра-
ботанные С.Ю. Ивановым и соавт.
12001): биоимплант, остеоматрикс и
био.матрикс. Биоимплант представляет
собой комбинацию коллагена 1 и 111
типа, гидроксиапатита и гликоамино-
гликанов. Изучение патоморфоза био-
импланта показало образование зрелой
кости через 3 мес. Остеоматрикс состо-
ит из тех же компонентов, но только
человеческих тканей. Биоматрикс, ос-
нованный на коллагене и гликоами-
ногликанах, выпускается в виде губки,
дисков, блоков, а также может исполь-
зоваться в виде мембраны (150]. Все
эти материалы относятся к остеокон-
дуктивным, создающим неорганиче-
ский матрикс. Обладая аллопластиче-
скими свойствами, пористый и непо-
ристый гидроксиапатит, биологически
активное стекло, сульфат кальция, ксе-
ноткани изолированно и в комбина-
ции используются при зубной имплан-
тации как заменители недостающей
кости.
1.2.7. Мембраны для направленной
регенерации кости
Мембраны используются для изоляции
костного дефекта от проникновения в
него в период регенерации нежела-
тельных видов клеток. Как в экспери-
ментах, так и в клинической практике
для мембран испытывали разные мате-
риалы, в том числе уже коммерчески
производившиеся — "Millipore filters",
"Biomembrane", "Dura mater" (США).
Испытывались также мембраны из по-
лимолочной кислоты, полигалактино-
вые пластины, губчатый политетра-
флюротилен, периост, коллагеновые
мембраны.
Мембраны могут быть нераствори-
мыми и растворимыми. Первой нерас-
творимой мембраной, примененной в
1982 г. для лечения дефекта кости че-
люсти, была используемая и в настоя-
щее время "Millipore filters" (126].
В настоящее время наиболее широ-
кое распространение имеют нераство-
римые мембраны e-PTFE ("Gore-Tex"),
материалом для которых служит мик-
ропористый политетрафлюорэтилен
"Tefflon" (рис. 1.18, а). Они специально
предназначены для обеспечения регене-
рации при лечении кости альвеолы. Ма-
териал таких мембран представляет со-
бой пленку с порами диаметром 200 нм.
Волокна материала имеют множество
переплетений с расположенными на
них узелками. У каждой мембраны две
микроструктуры. В ее центральной
части, которой непосредственно за-
крывается костный дефект, расстоя-
ния между узелками менее 8 мкм, что
делает ее обтурирующей, поэтому у
клеток лоскута мягкой ткани, закры-
вающего мембрану, нет возможности
проникнуть в костный дефект. Цен-
тральная часть по сравнению с пери-
ферийной менее гибкая, что позволяет
сохранять под ней необходимое про-
странство. Гибкость периферийной
части, накладываемой и прикрепляе-
мой за пределами костного дефекта,
обеспечивает плотность ее прилегания
к кости. Несмотря на то что в перифе-
рийной части мембраны расстояния
между узелками на пересечениях воло-
кон равны 25 мкм, т.е. в 3 раза больше,
чем в центральной части, она доста-
точно надежно обеспечивает защиту
костной регенерации. В пластине мем-
браны полимерные нити расположены
в продольном направлении. Этим как
бы создается молекулярная диагональ,
или однонаправленная ориентация,
вдоль которой материал становится
растяжимым. Благодаря этому мембра-
ны хорошо моделируются к костному
дефекту. Мембрана может быть тол-
стой — 0,250 мм (TG-250), средней
толщины — 0,200 мм (TG-200) и тон-
кой — 0,125 мм (TG-125). При зубной
имплантации чаще используют толстые
и средней толщины мембраны. По-
следние образцы таких мембран имеют
овальную форму и выпускаются грех
размеров. Нерастворимые мембраны
необходимо удалять через 6—8 нед.
Другими распросграненными ком-
мерческими образцами нерассасываю-
шихся мембран, которые к настоящему
времени применяются при зубной им-
плантации, стали "G-TAM", “TefGen-
FD™“ (США), "Frios®" (Германия) К
новому поколению мембраны e-PTFE
относится "Cytoplast GBR-200" (Кана-
да), которая для ее закрепления не тре-
бует специальных лоскутных операций.
На западном рынке, помимо перечис-
ленных, быстрыми темпами растет чис-
ло рассасывающихся мембран*.
Масштабные исследовательские ра-
боты проводятся с целью создания рас-
творимых мембран: испытаны и вне-
дрены покрытая коллагеном синтети-
ческая ультратонкая, полумикропорис-
тая силиконовая мембрана "Biomem-
brane” (66], материал "Vicril polyglactin-
910" — сетчатой структуры сополимер
гликолида и лактида в пропорции 9:1
(106, 117], мембрана "Gore-Resolut XT"
(рис. 1.18, б), периостальная и костная
мембраны, лиофилизированная твер-
дая мозговая оболочка [48, 89, 107].
Особенно много исследований про-
ведено с коллагеновыми мембранами,
некоторые из них уже применяются
(43, 79, 130, 131]. Мембраны обладают
хемотаксическими свойствами экзо-
*К рассасывающимся мембранам относят-
ся "Gore-Rcsolut XT" (США), "Epi Guide",
"Bio-Mend”, "Guidor" (США), "Atridox™",
"Alrisorb" (США), "Ethicon Vicril Membranen",
Vicril Membranen", "Bio Tide", GTR — "Guided
Tissue Regeneration" (Германия).
д
1.18. Мембраны.
а ~ нерастворимые "Gore-Tex"; б — растворимая "Gorc-Resolut XT”; в — коллагеновая "Пародонкол ;
г — титановая; д — биовинты и крепление их на мембране.
^нных коллагенов и, активизируя
Фибробласты, способны формировать
Фибриллярные структуры. Вместе с
^ем они могут неадекватно взаимодей-
ствовать с тканевыми ферментами, от-
чего вследствие нагноения успех при
их применении отмечался в среднем
только в 65 % случаев. Более эффек-
тинными оказались двухслойные кол-
лагеновые мембраны "Пародонкол", у
которых внутренний слой был обрабо-
тан фактором роста и фибрином [43].
Это активизировало образование кле-
ток соединительной ткани, и форми-
рование новой костной ткани при их
применении было отмечено уже в 95 %
случаев (рис. 1.18, в)*.
Несмотря на то что в большинстве
экспериментов с рассасывающимися
мембранами получены обнадеживаю-
щие результаты, всегда отмечалось, что
процент заполнения дефекта кости под
ними был меньше, чем под мембрана-
ми e-PTFE. Вопрос об их применении
при зубной имплантации все еще оста-
ется открытым не только потому, что
все эксперименты пока проводились
только с целью лечения пародонтита,
но главным образом из-за того, что все
известные и опробованные материалы
рассасываются в пределах 6—8 нед, то-
гда как для регенерации кости при са-
мых благоприятных условиях требует-
ся не менее 3 мес. Важнейшая пробле-
ма создания растворимых мембран для
использования при зубной импланта-
ции заключается в подборе материала с
адекватными сроками рассасывания.
Вместе с тем обнадеживающим
можно считать появившееся в конце
90-х годов сообщение о двухлетнем на-
блюдении за 25 пациентами, у которых
84 костных дефекта были замешены рас-
сасывающимися коллагеновыми мем-
бранами "Bio-Gide" и нерассасывающи-
мися e-PTFE. Сравнение оказалось не в
пользу последних. При использовании
мембран "Bio-Gide" костные дефекты
заполнялись новой костной тканью на
92 %, тогда как под мембранами
e-PTFE — только на 78 % [149].
К новым мембранам, разработан-
ным в последнее время, относится кост-
ная мембрана "Bio-Gran" (фирма "Ог-
tovita", США). В зубной имплантоло-
гии вместе с биоматериалами исполь-
зуют мембраны, армированные тита-
ном. Их преимущество неоспоримо
благодаря легкости придания нужной
формы (рис. 1.18, г). Последними раз-
*В России производятся коллагеновые
мембраны “Тахо-Комб", "Пародонкол" (фирма
"Полистом").
работками являются биовинты, крепя-
щие мембрану. Они рассасываются как
и мембрана (рис. 1.18, д).
Перспективным направлением в
развитии материаловедения зубной им-
плантации следует считать создание
искусственной кожи. Подобный мате-
риал, получивший название "Alloderm",
уже производится американской фир-
мой "LifeCell Corp.". Им можно вос-
полнять нехватку мягких тканей в тех
случаях, когда используют слизистые
или кожные трансплантаты (рис. 1.19, а).
Новым материалом для закрытия де-
фектов слизистой оболочки является
консервированный перикард “Pericar-
dium", применяемый в имплантологии
(рис. 1.19, б). Для соединения слизис-
тых оболочек эффективен клей "Epigli”.
Рис. 1.19. Восстановительные материалы
для слизистой оболочки.
а — искусственная кожа; б — перикард.
1 2.8. Биоактивные агенты —
факторы роста кости
Для зубной имплантации при допол-
нительных костно-восстановитель-
ных операциях применяют новые тех-
нологии, стимулирующие рост кости
|66]. Среди них следует выделить су-
персемью факторов роста TGF (табл.
I 5). Коммерческой формой отдель-
ных составляющих факторов роста яв-
ляется бычий морфогенетический
протеин — BMP. На основе его вы-
пускается новый материал в виде геля
"Emdogain".
Вместе с биокостными пластически-
ми материалами используют плазму
крови пациента, обогащенную тромбо-
цитами (PRP); 10 % раствор PRP в изо-
тоническом растворе натрия хлорида
(рис. 1.20, а) или в виде геля (рис. 1.20, б)
применяют при зубной имплантации и
дополнительных операциях для им-
плантации [151].
Материал на основе пептида из 15
аминокислот, наносимый на поверх-
ность частиц гидроксиапатита, назы-
ваемый "Pep-Gen Р-15", выпущен фир-
мой "Cera-Med". Он также оказывает
остеоиндуктивное действие, и его ши-
роко применяют при зубной имплан-
тации (см. рис. 1.14, в). При имплан-
тации стали применять отечественные
биоматериалы из полимеров, в том
числе "ППВ", представляющий собой
N-винилпирролидона метилметакрилат
марки "ППМ-Г. Он армирован специ-
ально модифицированным капроно-
Таблица 1.5. Основные составляющие суперсемьн TGF-Щ (скопировано с Ch. Babusch,
2000, по данным Catherine Chang, 1999)
TGF-fJ superfamily
GF'Pi Juhibin BA BMP-2 GDF1
cji-Pi Juhibin Bu BMP-3 GDF5
Juhibin Bc BMP-4 GDF8
GF-P, Juhibin B[j BMP-5 GDF9
(chicken) (Xenopus) BMP-6 (mouse)
GF-Pi a-Juhibin BMP-7 GDNF
(Xenopus) BMP-8/OP-2 BMP-9
BMP-10
BMP-12/GDF7 (mouse)
BMP-13/GDF6 (mouse)
Рис. 1.20. Остеоактивные агенты.
а — PRP-плазма, обогащенная тромбоцитами;
б — гель "Emdogain",
вым волокном и наполнен глюконатом
кальция. Также используется биомате-
риал на основе быстрополимеризую-
шихся мономеров — эфиров цианакри-
ловой кислоты — "МК-9М". Препара-
ты "ППВ-Г, "МК-9М” обладают анти-
бактериальным и остеорегенератив-
ным свойствами [61].
Sumitomo Bip/GDFIO
(mouse)
Dorsalin-1 (chicken)
Radar (zebrafish)
PC-8 (mouse)/OP-3 (mouse)
60A (Drosophila)
Dpp (Drosophila)
Vgl (Xenopus)
Univin (sea urchin)
Vgr-2/GDF3 (mouse)
Screw (Drosophila)
Nodal (mouse)
Mullcrian-inhibiting substance
1.3. Конструктивные
особенности современных
зубных имплантатов
рассмотрение конструкций современ-
ных зубных имплантатов требует не-
скольких предварительных замечаний.
Связано это с тем, что одновременно с
лавинообразным ростом публикаций
по различным аспектам зубной им-
плантации и большим объемом ин-
формации от производителей имплан-
татов, что является положительным
фактором, растет число терминов, от-
носящихся к имплантационным систе-
мам (и комплектующим их деталям)
для хирургического и ортопедического
этапов лечения. При создании новых
имплантатов разработчики и испытате-
ли нередко произвольно дают новые
названия как видам имплантатов, так и
их составным элементам. Анализ ино-
странной и отечественной литературы
по зубной имплантации свидетельству-
ет об отсутствии единообразия в назва-
ниях имплантатов и относящихся к
ним аббревиатурах. Нередко даже од-
нотипные системы имплантатов и их
комплектующие именуются по-разно-
му. Это неизбежно ведет к путанице.
Беспорядочность терминологии, ис-
пользуемой специалистами по зубной
имплантации, требует стандартизации
терминов. Это особенно необходимо
отечественным производителям стома-
тологических имплантатов. Потреб-
ность в этом ощущается и при подго-
товке врачей-стоматологов, и при пост-
дипломном обучении зубной имплан-
тации. В конструкциях имплантатов
могут быть специальные элементы для
работы врача-ортопеда в клинике и для
зубного техника, поэтому терминоло-
гия не должна отличаться от обозначе-
ний, общепринятых в ортопедической
стоматологии. Это же требование от-
носится к названиям медицинских ин-
струментов для остеотомии. Они долж-
ны соответствовать терминологии,
принятой в общей хирургии, хирурги-
ческой стоматологии и челюстно-ли-
цевой хирургии. Необходимы единые
названия этапных инструментов, ис-
пользуемых для постановки импланта-
тов разных систем. Их названия долж-
ны сообразовываться с хирургически-
ми действиями и этапами хирургиче-
ского лечения. При зубной импланта-
ции для обозначения анатомо-топо-
графических особенностей, патологи-
ческих процессов и болезней следует
пользоваться терминами в соответст-
вии с Международной анатомической
номенклатурой и Международной клас-
сификацией болезней (МК.Б-10).
Попытки стандартизации терминов
по имплантологии делали зарубежные
и отечественные авторы. Как показал
анализ американской медицинской ли-
тературы, большинство исследователей
предпочитают терминологию, разрабо-
танную С.Е. Misch и С.М. Misch [123].
В данной работе используется в основ-
ном терминология, относящаяся к хи-
рургической части зубной имплантации;
она максимально приближена к терми-
нологии, предложенной этими авторами.
От МКБ-10 сделано лишь отступление
общего характера. В соответствии с ней
имплантация относится к экспланта-
ции, но, поскольку во всем мире принят
термин "имплантация", он используется
и в данной работе. Кроме того, в данной
работе описаны не все виды внутрико-
стных имплантатов. Сознательно опу-
шена группа чрескостных и вводимых в
кость через канал зуба чреззубных кон-
струкций. В связи с этим далее речь
идет только о внутрикостных импланта-
тах, которые не связаны с лечением
природных зубов и используются для
реконструкции беззубых участков че-
люстей при частичной и полной аден-
тии.
В приводимом ниже обзоре совре-
менных зубных имплантатов внимание
в основном сосредоточено на тех их
конструктивных особенностях, кото-
рые влияют на приемы имплантацион-
ной хирургии. Ортопедический этап
лечения не рассматривается. Методика
оперативных вмешательств зависит не
только от вида выбранного имплантата,
но нередко также от его системы, т.е.
его производителя, рекомендациям ко-
торого необходимо следовать. Поэтому
хирургу, занимающемуся зубной им-
плантацией, необходимо знать общие
характеристики современных имплан-
татов и наиболее типичные тенденции
в их развитии.
1.3.1- Строение внутрикостных
зубных имплантатов
в форме корня зуба
Используемые для лечения частичной
и полной адентии внутрикостные им-
плантаты делятся на две группы — им-
плантаты в форме корня зуба и пло-
ские имплантаты* *. Среди тех и других
есть погружные и непогружные конст-
рукции (рис. 1.21). При использовании
погружных хирургическую часть лече-
ния проводят в два этапа. На первом
хирургическом этапе имплантат за-
глубляют в кость и мягкие ткани над
ним наглухо зашивают. На втором эта-
пе коронковую часть вскрывают, после
необходимых промежуточных проце-
дур фиксируют супраструктуру и про-
водят ортопедическое лечение. В слу-
чае применения непогружных конст-
рукций плоской и круглой формы опе-
ративное вмешательство производят в
один этап. В ходе его тело** имплантата
погружают в кость, но при зашивании
раны его надальвеолярная часть (голов-
ка, штифт)*** остается открытой, и к
ней после заживления раны крепят
элементы супраструктуры.
Имплантаты в форме корня зуба бы-
вают трех видов: винтовые, цилиндри-
ческие и комбинированные. Винтовые
имплантаты в свою очередь делятся на
стандартные (большинство зарубеж-
ных производителей употребляют та-
кой термин) и самонарезные.
При подготовке ложа**** для стан-
дартных имплантатов остеотомия вклю-
чает также нарезку в нем резьбы, по
которой затем имплантат вводят в
кость. Ложе для самонарезных им-
плантатов путем остеотомии готовят
’Термин "имплантаты в форме корня зуба"
был принят Специальной согласительной
конференцией, проходившей в США в 1988 г.,
как наиболее точно отражающий особенность
Их конструкции. Что касается термина "пло-
ские имплантаты", то многие отечественные
производители предпочитают ему термин
пластиночные".
”В отечественной литературе его также на-
зывают внутрикостным элементом, инфра-
структурой имплантата.
’’Другие названия — "трансслизистая
• "чресслизистый удлинитель".
”В отечественной рекламной литературе
встречается термин "опорное гнездо в костной
ткани".
Рис. 1.21. Имплантаты "Astra Tech." в
форме корня зуба.
а — погружные; б — непогружные.
без резьбы, которую имплантат нареза-
ет по мере его вворачивания в кость.
Цилиндрические имплантаты резьбы
на поверхности тела не имеют. Их вво-
дят в подготовленное костное ложе
легким давлением или слегка постуки-
вая по ним. Комбинированные им-
плантаты имеют на теле признаки как
винтовой, так и цилиндрической кон-
струкции, причем резьба у них только
на части тела. В зависимости от осо-
бенностей конструкции комбиниро-
ванные имплантаты вводят в костное
ложе, используя приемы давления и
завинчивания.
Тело имплантата. Основной частью
конструкции всех имплантатов являет-
ся их тело (рис. 1.22). Его хирургиче-
ским путем заглубляют в кость челю-
сти, и в таком положении оно остается
в течение всего периода функциониро-
вания конструкции. Без прочного сце-
пления тела имплантата с костью че-
люсти зубная имплантация успешной
быть не может.
У большинства имплантатов в фор-
ме корня зуба тело погружается в кость
полностью (см. рис. 1.21, а). Однако у
таких имплантатов, как "ITI", "Lider-
mann”, "Конмет” и некоторых других,
верхняя часть может выступать над по-
верхностью слизистой оболочки, по-
крывающей альвеолярную дугу (см.
рис. 1.21, б). Апикальная часть* им-
плантатов в форме корня зуба может
*В описаниях конструкций встречается
термин "нижняя часть имплантата* независи-
мо от постановки в нижнюю или верхнюю че-
люсть.
Рис. 1.22. Особенности строения тела имплантата и полировки шейки.
заканчиваться плоской площадкой или
иметь закругление. В большинстве слу-
чаев диаметр тела по всей длине им-
плантата одинаков, но некоторые вин-
товые и цилиндрические конструкции
могут быть сужены в апикальной части
("На-ТГ, "Frialit 1 и 2", "Steri-Oss", "Ra-
dix-Gimlet"). Классической формой
зубного имплантата является конст-
рукция Branemark (см. рис. 1.10).
На коронковой части тела* боль-
шинство имплантатов в форме корня
зуба имеют шейку** высотой 1—2 мм,
которая, как и все тело, заглубляется в
кость. Лишь у некоторых погружных
систем она выступает в мягкие ткани.
У непогружных имплантатов шейка то-
же обозначена и соответствует краю
кости и прилегающей части надкост-
ницы и слизистой оболочки. Шейка
сконструирована на случай ее обнаже-
ния из-за атрофии кости. Как правило,
на нее не наносят никакого покрытия
и хорошо полируют, чтобы при обна-
жении уменьшить канонизацию на ней
•В описаниях конструкций встречается
термин "верхняя часть имплантата" независи-
мо от постановки в нижнюю или верхнюю че-
люсть.
‘•Некоторые отечественные производители
называют шейку верхней частью внутрикост-
ного элемента, а иностранные — воротником
или манжетой.
ли
зубных бляшек, бактерий и облегчить
выполнение гигиенических процедур.
В то же время конструкция шейки воз-
действует на кость челюсти. Если ее
диаметр одинаков с диаметром им-
плантата, то ее высота влияет на атро-
фию кости: чем больше высота шейки,
тем меньше нагрузка на прилегающую
кость, в результате чего атрофия уси-
ливается [I47J. В связи с этим ряд сис-
тем имплантатов в форме корня зуба
имеют шейки в виде расширяющегося
в сторону ротовой полости конуса.
Этим увеличивается нагрузка на при-
легающую к ней кость, а диаметр шей-
ки, который в таких конструкциях бы-
вает больше диаметра имплантата и его
ложа, одновременно обеспечивает
плотную изоляцию ложа от ротовой
полости (см. рис. 1.22).
Конструкторы имплантатов всех
систем большое внимание уделяют во-
просам макро- и микроструктуры по-
верхности тела имплантатов (рис. 1.23,
I, II, III). Принимают меры для акти-
визации процесса остеоинтеграции,
усиления прочности соединения кости
с имплантатом, адекватного распреде-
ления окклюзионных нагрузок в кости.
Для успешного функционирования ос-
теоинтегрированного имплантата в
кости челюсти особо важную разь иг-
I
Рис. 1.23. Поверхность тела имплантата.
I — макроструктура: а — "Branemark", б — "Calcitck", в — "Stcri-Oss". г — "Osteo- Implant"; II —
микроструктура: а — “Branemark", б — “Calcitek". в — "Stcri-Oss"; г — "Osteo-Implant"; III — элек-
тронная микроскопия поверхности имплантата "Л И Ко".
рает адекватность передачи нагрузоч-
ных сил (111, 112]. К определяющим
факторам при этом относятся площадь
прямого контакта тела с костью и на-
правление передаваемых ей нагрузок:
чем больше площадь, тем значительнее
рассредоточение нагрузки на кость.
Первым и, пожалуй, самым простым
путем решения этой проблемы стало
максимальное увеличение геометриче-
ских размеров тела конструкции. Од-
нако, поскольку в каждом конкретном
случае анатомические особенности ус-
танавливают пределы допустимых раз-
меров имплантатов, в каждой системе
предусмотрены конструкции с телом
различной длины и диаметра. Разнооб-
разие конструктивных особенностей и
геометрических параметров неизбежно
ведет к увеличению числа предлагаемых
имплантатов. У некоторых систем их
число даже превышает 200. Например,
по данным каталогов и рекламных ма-
териалов, в 90-х годах прошлого столе-
тия имплантатов "Steri-Oss". различаю-
щихся по размерам и конструкции, вы-
пускалось 211, "Lifecore" — 131, "ЗГ —
125 единиц. Правда, в последние годы
во многих системах отмечается тенден-
ция к сокращению числа имплантатов,
как и специальных инструментов для
их постановки. Примером может слу-
жить "Replace™ Implant System" (фир-
ма "Steri-Oss")*.
При конструировании имплантатов
большое значение имеют способы аде-
кватной передачи кости нагрузочных
сил. Дело в том, что максимум прочно-
сти кость имеет тогда, когда на нее дей-
ствует компрессионная, давящая на-
грузка, направленная перпендикулярно
горизонтальному срезу окклюзии. При
растягивающей нагрузке прочность
кости снижается на 30 %, а при сдви-
гающей нагрузке — на 65 %. В связи с
этим сдвигающие силы для внутрико-
стных имплантатов считаются наибо-
лее опасными. В большой степени рас-
пределение нагрузочных сил зависит
от конструкции протеза (высота ко-
ронки, размер балки и т.д.). Опреде-
ленную роль играет также макрострук-
•В настоящее время фирма "Steri-Oss", как
и фирма "Nobelfarma". представляющая им-
плантаты Brancmark, вошла в американскую
компанию "Nobel Biocare".
Рис. 1.24. Виды резьбы винтового им-
плантата.
тура имплантата, в частности резьба у
винтовых конструкций (рис. 1.24).
Важной проблемой являются созда-
ние микроскопической блокировки
кости и имплантата, увеличение ее пло-
щади. У винтовых имплантатов это об-
легчается наличием резьбы. При оди-
наковых длине и высоте поверхность
винтовых имплантатов всегда больше
поверхности цилиндрических конст-
рукций (разница может даже превы-
шать 500 %). Конечно, многое зависит
от геометрии резьбы, в частности ее
шага от глубины канавок.
С точки зрения прочности механи-
ческого скрепления имплантата с ко-
стью наилучший эффект достигается
резьбой с треугольной формой канав-
ки. Однако прилагаемую компресси-
онную силу зубья такой резьбы, имея
наклон 45‘, трансформируют в сдви-
гающую, в 10 раз большую, чем у опор-
ной резьбы, у которой нижняя плос-
кость зубьев перпендикулярна оси им-
плантата. Опорная резьба также опти-
мальнее распределяет нагрузку. Имен-
но поэтому ее используют в имплантатах
"Micro-Vent” (фирма "Paragon”, ныне
объединенная с "Calcitek”), "Simplier",
"Maestro System” (фирма "BioHori-
zons"). Прогрессивным считают боль-
ших размеров резьбу в пришеечной
части имплантата, как, например, в
последних моделях "Replace".
В общей динамике развития конст-
рукции тела внутрикостных импланта-
тов в форме корня зуба отмечается по-
вышение внимания к макронеровно-
стям их поверхности, к ее пористости,
ячеистости, пазам, гнездам, прорезям
и другим особенностям [145]. Боль-
шинство исследователей полагают, что
такие конфигурации на макроуровне
создают механическую блокировку.
Особое внимание при этом уделяют
сквозным отверстиям в апикальной
части тела. У винтовых имплантатов их
делают все более удлиненными по вер-
тикали, чтобы в них собиралась кост-
ная стружка, которая играет большую
роль в процессе остеоинтеграции.
Общепризнанный способ увеличе-
ния площади контакта имплантата с
костью заключается в загрублении его
тела. Этого достигают путем создания
микронеровностей на его поверхности.
Особенно широко применяют покры-
тие тела имплантата гидроксиапатитом
или другим биоматериалом, напыле-
нием титана (рис. 1.25). Такую техно-
логию используют для всех внутрико-
стных имплантатов, хотя у винтовых
гидроксиапатитное покрытие чаще
всего наносят на двухэтапные, погруж-
ные конструкции. Считается обосно-
ванным классифицировать импланта-
ты с гидроксиапатитным покрытием
как биоинтегральные, поскольку ос-
Рис. 1.25. Виды покрытия тела имплан-
тата (титаном, гидроксиапатитом, био-
материалом).
теоинтеграция достигается не механи-
ческим путем, а биологическим сцеп-
лением кости с покрытием [100].
Существует несколько технологий
покрытия имплантатов гидроксиапати-
том. Это может быть сделано путем спе-
кания при температуре 1000— 3000 *С и
большом давлении или плазменного
напыления пористого гидроксиапати-
та. При использовании пористых форм
гидроксиапатита на титановых им-
плантатах имеются поры диаметром
100 мкм. Хотя это улучшает условия
для прорастания кости, оптимального
соединения не создается, так как для
него поры должны быть диаметром не
менее 150 мкм |96|. Помимо мини-
мального размера пор, должна быть
адекватной морфология пористости
покрытия. Его слой должен быть дос-
таточно большим, чтобы в него могла
прорасти кость, обеспечивающая фик-
сацию. Для этого на долю пор должно
приходиться 35—40 % поверхности,
контактирующей с костью [83]. Однако
значительно увеличивать количество
пор опасно, так как это может повлиять
на структуру врастающей кости [81].
Оптимальным вариантом покрытия
считается двухслойная поверхность,
дающая трехмерное механическое взаи-
мосцепление врастающей кости |71].
Благодаря напылению площадь по-
верхности тела возрастает в 6—7 раз,
отчего увеличиваются площадь кон-
такта имплантата с костью и прочность
их сцепления. Необходимо учитывать,
что приводимые в рекламных изданиях
цифры увеличения площади поверхно-
сти имплантатов, как и всех других
систем, не следует экстраполировать
на площадь их прямого контакта с ко-
стью [145]. Многое зависит от структу-
ры кости. Если при кости хорошего ка-
чества (D1) на прямой контакт с ней
может приходиться до 80 % поверхно-
сти имплантата, то с костью плохого
качества (D4) такой контакт возможен
только на 25 % площади поверхности
конструкции [119]. Надо принимать во
внимание тот факт, что напыление в
определенной степени уменьшает пре-
дел допустимых нагрузок на имплантат.
Имплантаты с пористой поверхностью
более подвержены "стрессу'' под влия-
нием функциональных нагрузок [76).
Эффективность биоактивных по-
крытий повышается при нанесении на
поверхность имплантатов гидрокси-
апатита сфокусированным излучением
импульсного лазера. Таким способом
создают более плотное прикрепление
покрытия к поверхности имплантата.
Чаше всего для этого используют экси-
мерный или СОз-лазер.
Создание лазером точечных участков
загрубления способствует прочному со-
единению с костью. Особую роль гид-
роксиапатитное покрытие тела играет в
цилиндрических имплантатах. Если у
винтовых имплантатов в механическом
сцеплении с костью костно-апатитная
связка является главным фактором
только в первые 4 нед после операции,
а затем эту роль берут на себя такие
конструктивные детали, как резьба,
прорези, отверстия и т.п., то у цилин-
дрических имплантатов покрытие ос-
тается главным фактором их сцепле-
ния с костью более длительное время.
Вместе с тем одним из недостатков
плазменных технологий напыления
гидроксиапатитного покрытия являет-
ся возможность его сколов при поста-
новке имплантата в кость челюстей.
С целью увеличения площади кон-
такта с костью используют также на-
пыление титановой плазмы на тело
имплантата. Технология включает ис-
пользование высоких температур и
большой скорости потока частиц тита-
на размером от 50 до 100 мкм, когда те-
ло имплантата покрывается за счет
плазменного напыления. В результате
создается затрубленная поверхность,
которая увеличивает площадь прямого
контакта тела имплантата с костью.
Требования, предъявляемые к имплан-
татам с титановым покрытием, те же,
что и в отношении имплантатов, по-
крытых гидроксиапатитом. Механиче-
ские и гистологические характеристи-
ки имплантатов с титановым напыле-
нием свидетельствуют об увеличении
площади их контакта с костью и хоро-
шем прорастании ее в глубь пор [129].
Образующееся соединение по своим
характеристикам лишь незначительно
уступает соединению с гидроксиапа-
титным покрытием.
Покрывать поверхность имплантата
можно и другим способом — навари-
ванием титановой пудры на его тело с
помощью обдувания песочной струей,
травления или лазерной обработки.
Такая технология препятствует попа-
данию частиц титана в ткани, обеспе-
чивает стерилизацию глубоких узур на
поверхности имплантата. Однако при
кислотном травлении с поверхности
имплантата удаляется пленка окислов,
что может отрицательно влиять на со-
единение с тканями.
Предпринимаются попытки увели-
чить стабильность имплантационной
конструкции путем прочного сцепле-
ния имплантата как с твердой, так и с
соединительной тканью, т.е. фактиче-
ски дополнить костную интеграцию
фиброзной. Одним из примеров рабо-
ты в этом направлении может служить
создание специалистами Тюбинген-
ского университета (Германия) им-
плантата, особенность тела которого
состоит в том, что на нем расположены
петли из титановой проволоки [75].
Другим примером может служить раз-
работка в последние годы прошлого
столетия винтовых имплантатов
"Maestro System" ("Biohorizons Implant
Systems Inc.", США). В их конструкции
для каждого из четырех типов кости
предусмотрены имплантаты не только
разных размеров, но и с неодинаковой
1 еометрией резьбы и с разными покры-
тиями их тела.
Отмеченными выше направлениями
работы по совершенствованию конст-
рукций тела внутрикостных импланта-
тов, конечно, не ограничиваются. Ис-
следования продолжаются во всех стра-
нах. В то же время совершенно очевид-
но, что создать универсальную и подхо-
дящую для всех ситуаций конструкцию
имплантата и его тела невозможно. Речь
может идти о совершенствовании кон-
струкции для решения какой-либо кон-
кретной проблемы. Главной задачей
всегда остается приспособление к био-
логическим и биомеханически.м усло-
виям приживления имплантатов [96].
Опорная головка. К важнейшим эле-
ментам всех систем погружных, а так-
же непогружных имплантатов в форме
корня зуба относятся их опорные го-
ловки*. Функционально опорные го-
•В отечественной рекламной литературе
встречается название “головка супраструктуры''.
ловки являются компонентом, связы-
вающим через мягкие ткани имплантат
с протезной конструкцией. На опор-
ной головке протез можно крепить
винтовой фиксацией, цементировани-
ем или соединением с абатменто.м для
фиксации съемного зубного протеза
|41, 57]. Высоту опорных головок под-
бирают с учетом толщины надкостни-
цы и слизистой оболочки. В отдельных
случаях из эстетических соображений,
чаше на передних участках челюстей,
коронку протеза можно ставить непо-
средственно на имплантат. Важная
особенность опорных головок заклю-
чается в том, что с их помощью в ходе
хирургического этапа лечения возмож-
на коррекция отклонения оси имплан-
тата от правильного окклюзионного
направления. Для этого опорные го-
ловки изготавливают не только прямы-
ми. которые часто именуют стандарт-
ными, но и с углами наклона 5’, 10’,
15’, 25’ и т.д. (рис. 1.26, а). После по-
становки на беззубых челюстях они
могут быть скреплены "балочными со-
единениями" для последующего проте-
зирования.
При использовании погружных им-
плантатов постановкой опорных голо-
вок фактически завершается хирурги-
ческий этап лечения. У ряда непогруж-
ных имплантатов их крепят на тело
еще до введения его в кость челюсти.
WWW
Рис. 1.26. Супраструктура для имплантатов.
а — геометрия опорных головок; б — опорные головки к основным системам имплантатов; в —
Дополнительные элементы супраструктуры.
Опорные головки всегда изготавли-
вают с предельно возможной степенью
полировки. Причина заключается в
том, что именно они являются глав-
ным объектом индивидуального ухода
за имплантатом, поскольку находятся в
постоянном контакте с полостью рта и
подвержены быстрой колонизации
бактерий. Однако эксперименты пока-
зали, что бороться с микроорганизма-
ми беспредельным улучшением поли-
ровки практически невозможно, по-
скольку полировка выше показателя
Ra = 0,2 мкм не отражается на степени
колонизации бактерий, которая оста-
ется постоянной [72].
Тщательно обрабатывают и плос-
кость опорной головки, прилегающую
к коронковой платформе имплантата.
Контакт здесь должен быть макси-
мально плотным не только для проч-
ности, но и для противодействия про-
никновению микроорганизмов к телу
имплантата. Оптимальный размер это-
го промежутка должен быть 2—4 мкм.
Каждая система имплантатов имеет
свои оригинальные опорные головки
(рис. 1.26, б).
Для некоторых систем имплантатов
предусмотрена возможность постанов-
ки пластмассовых опорных головок.
Как и металлические, их крепят к телу
имплантата винтами из титана. Благо-
даря своему материалу такие опорные
головки амортизируют нагрузочные
силы и предотвращают вращение [93].
Одной из таких типовых конструкций
является опорная головка UCLA, вы-
пускаемая как с внутренним шести-
гранным запорным винтом на кон-
тактирующей с имплантатом площад-
ке, так и с наружным шестигранником.
У отдельных систем имплантатов на
втором хирургическом этапе, т.е. при
вскрытии имплантата, предусмотрена
постановка временного элемента, ко-
торый выступает над слизистой обо-
лочкой и способствует образованию
эпителиального замка. Его обычно на-
зывают чресслизистым удлинителем*.
Фактически он выполняет задачу
опорной головки, так как к нему кре-
пят протезную супраструктуру.
‘Нередко этот элемент называют трансму-
козным удлинителем. Встречаются также дру-
гие названия.
Опорные головки, если они пред-
ставляют собой отдельный элемент,
ставят на имплантат только после за-
живления эпителия, т.е. на втором, по-
следнем, этапе имплантации, когда
имплантат остеоинтегрирован.
Дополнительные элементы конструк-
ции. На хирургических этапах вместо
опорной головки на тело имплантата
временно ставят дополнительные эле-
менты конструкции (рис. 1.26, в).
У всех погружных конструкций пер-
вый такой элемент — запорный винт,
который хирург ставит на имплантат
после его заглубления в кость. Времен-
ная функция запорного винта заклю-
чается в предохранении внутренней
полости имплантата от попадания в
нее тканевых структур в период остео-
интеграции. Нередко этот элемент на-
зывают санитарной заглушкой, вин-
том-заглушкой. Головка таких винтов
чаше всего плоская, чтобы она не за-
трудняла глухое зашивание тканей над
имплантатом. На втором хирургиче-
ском этапе лечения мягкие ткани над
запорным винтом вскрывают, удаляют
его и на это место ставят другой вспо-
могательный временный элемент —
винт заживления, край которого выхо-
дит в ротовую полость*. Винт заживле-
ния находится в имплантате до полной
эпителизации раны. Затем его заменя-
ют опорной головкой и начинают ор-
топедическое лечение. В последние го-
ды часто стали практиковать сразу по-
становку формирователя десны вместо
запорного винта при одноэтапной про-
цедуре как погружных, так и непо-
гружных имплантатов.
На хирургическом этапе лечения,
особенно при остеотомии, у многих
систем имплантатов предусмотрено
использование примерочных аналогов,
штифтов для проверки параллельности
осей имплантатов и ряда других допол-
нительных элементов с целью контро-
ля за ходом операций.
Запорные устройства. При функцио-
нировании имплантатов большую роль
играют резьбовые соединения
(рис. 1.27). Они позволяют врачу сни-
‘При описании конструкций винт зажив-
ления также может называться санитарным
винтом, заглушкой, санитарным запорным
винтом, формирователем десны.
мать протезы, осматривать мягкие тка-
ни у шейки имплантата, проводить ле-
чебные мероприятия, необходимые
при осложнениях — мукозите и пери-
имплантите. Кроме того, всегда имеет-
ся возможность коррекции протеза,
что исключено в тех случаях, когда
опорная головка имплантата соединя-
ется с ортопедической конструкцией
при помощи цементирования. В то же
8Ремя резьбовые соединения являются
слабым местом конструкции, так как
м°гут ослабевать и создавать неадек-
ватные нагрузки на тело имплантата.
Ьсли сила скрепления имплантата с
протезным базисом оказывается мень-
ше сил окклюзии, микродвижения в их
соединении неизбежны. В конечном
счете микродвижения приводят к на-
рушению целостности всего крепле-
ния. Особенно часто это наблюдается у
одиночных имплантатов, соединенных
Рис. 1.27. Виды запорных устройств
(а—г).
с естественными зубами [128].
Для укрепления резьбовых соеди-
нений можно использовать про-
тивовибрационные приспособле-
ния, механические запорные эле-
менты, меняющие шаг резьбы.
Уже у первых имплантатов
Branemark эта проблема полно-
стью проявила себя и при функ-
ционировании выразилась в ос-
лаблении золотых винтовых со-
единений и в элонгации (вытяги-
вании) винтов. Опасность заклю-
чалась в последующем расшаты-
вании всей протезной конструк-
ции. Небезынтересно в связи с
этим отметить, что ослабление
крепежных винтов особенно за-
метно сразу же после постановки
протезов. Как свидетельствуют
клинические наблюдения, уже
через 2 нед может требоваться до-
полнительная затяжка до 31 %
винтов [93]. На верхней челюсти
винты ослабевают в 2 раза чаще,
чем на нижней. Даже после не-
скольких корригирующих опера-
ций 13,6 % протезов на верхней
челюсти могут нуждаться в по-
вторении затягивания их винтов [70].
Хотя такие дополнительные манипуля-
ции создают немалые неудобства, ко-
нечный результат применения им-
плантатов Branemark всегда неизменно
высок. В то же время, по данным ис-
следования in vitro, благодаря доста-
точной гибкости и отсутствию жестко-
сти у винтовой системы соединений
есть и положительные качества. Вин-
товое соединение позволяет скреплять
имплантаты с природными зубами, и
при этом нагрузочные силы распреде-
ляются между ними почти одинаково
[70]. Тем не менее в конструкцию им-
плантатов Branemark были внесены не-
которые коррективы, в частности из-
менена конфигурация головки золото-
го винта для ее более плотного приле-
гания.
Для предупреждения негативных
явлений, связанных с ослаблением
резьбовых соединений, многие им-
плантаты имеют сложную систему ан-
тиротаиионных устройств, снабжены
двойными шестигранными замками-
стопорами. С этой же целью в протез-
ной конструкции рекомендуется
максимально уменьшать длину консо-
лей, в том числе балочных опор для
протеза.
Резьбовые соединения, которыми
все погружные имплантаты скрепля-
ются с опорными головками, таят в се-
бе еше одну опасность. Она связана с
невозможностью обеспечить идеально
плотное прилегание этих двух компо-
нентов друг к другу. Специальные ла-
бораторные эксперименты с бактерия-
ми Escherichia coli, размер которых
(1,1—1,5 мкм) соответствует среднему
размеру типичных для ротовой полос-
ти микроорганизмов, показали, что
практически невозможно полностью
избежать проникновения бактерий че-
рез резьбовые соединения [97]. Такое
проникновение, хотя и в разной степе-
ни, было обнаружено при использова-
нии всех 12 систем наиболее известных
имплантатов. Самое плотное соедине-
ние отмечено у конструкций с проме-
жуточной силиконовой шайбой. Хоро-
шими показателями характеризова-
лись соединения, имевшие увеличен-
ные площади благодаря конической
форме. Однако и в последнем случае
полностью остановить проникновение
микроорганизмов через их резьбовое
соединение не удалось даже путем
предварительного охлаждения опор-
ной головки перед ее скреплением с
телом имплантата. Больше всего мик-
роорганизмов проникало внутрь и на
поверхность тела имплантата через
резьбовые соединения многокомпо-
нентных конструкций опорных голо-
вок, особенно при использовании не-
зависимых соединительных винтов.
Все изложенное выше свидетельст-
вует о непрекращающихся исследова-
ниях и разработках с целью совершен-
ствования конструкций зубных им-
плантатов.
Несмотря на определенный про-
гресс, ряд вопросов взаимодействия
организма и имплантата остается нере-
шенным. К ним относятся проблемы
соединения имплантатов с природны-
ми зубами, развитие биоинтеграции и
стимуляции процессов роста кости,
предотвращение заболевания тканей
по периметру имплантатов, уменьше-
ние влияния зубных бляшек и разра-
ботка эффективных программ профи-
лактики инфекции.
Что касается врача-практика, то на-
личие множества систем имплантатов,
особенно в форме корня зуба, ставит
перед ним ряд проблем. Прежде всего
возникает вопрос о том, какой им-
плантат выбрать в данной ситуации.
Возможности для этого не всегда име-
ются не только в силу экономических
причин. Дело в том, что для каждой
системы имплантатов ее разработчики
рекомендуют определенные правила
постановки конструкций в кость. Эти
требования обоснованы, подтвержде-
ны клиническими наблюдениями, и
отклоняться от таких рекомендаций
весьма рискованно. Врачу далеко не
просто накопить одинаковый опыт
применения разных систем импланта-
тов. Естественно, в первую очередь он
ориентируется на те, с помощью кото-
рых им уже был получен хороший ре-
зультат лечения. Кроме того, переход
от одной системы имплантатов к дру-
гой всегда бывает связан с проблемой
инструментария. Это особенно отно-
сится к инструментам, необходимым
для остеотомии при использовании
винтовых имплантатов. Разработчики
для постановки имплантатов своей
системы в большинстве случаев преду-
сматривают специальные инструмен-
ты. Даже стандартная стоматологиче-
ская бормашина не всегда может быть
использована для зубной импланта-
ции, так как при угловом наконечнике
она должна обеспечивать работу с
уменьшенными в 10, 16 и даже 100 раз
скоростями вращения. Для постановки
каждого имплантата необходимы соот-
ветствующие его форме и размеру бо-
ры, сверла, метчики и другие насадки,
а также инструменты для контроля. К
сожалению, лишь несколько систем
имплантатов допускают пользование
инструментарием, разработанным для
других систем.
1.3.2. Системы внутрикостных
имплантатов в форме
корня зуба (круглых)
Имплантаты Branemark. Начало всем
используемым в настоящее время им-
плантатам в форме корня зуба положи-
ли имплантаты системы Branemark. Их
разработали в ходе многочисленных
экспериментов с разнообразными кон-
струкциями. Первая из них представ-
ляла собой комбинацию поднадко-
стичного и чрескостного имплантата,
но была отвергнута, так как вызывала
неконтролируемые реакции мягких
тканей. После испытаний почти 50
других видов имплантатов была выбра-
на внутрикостная конструкция в фор-
ме корня зуба. Первые имплантаты по-
ставлены пациентам в 1965 г. (74]. Сис-
тема имплантатов Branemark была при-
знана во всем мире, а фирма "Nobelfar-
ma” (в настоящее время "Nobel Bio-
care") стала их основным производите-
лем, распространившим эти импланта-
ты во всех странах. Проведенные в те-
чение I5 лет (1965—1980) наблюдения
свидетельствуют об успехе импланта-
ции при полной адентии в 95 % случаев
на нижней и в 91 % — на верхней че-
люсти (см. рис. 1.10). Нами первые им-
плантаты этой системы были установ-
лены в 1984 г., а всего до 2001 г. им-
плантация проведена 21 больному с 98 %
успехом при контрольном наблюдении
в течение 9—18 лет.
В последующие годы имплантаты
Branemark претерпели некоторые кон-
структивные изменения, расширившие
их универсальность. Тело всех имплан-
татов изготавливается из технически
чистого титана, на всей его поверхно-
сти имеется резьба. Сначала выпускали
только стандартные винтовые конст-
рукции, требующие предварительной
нарезки в костном ложе резьбы. Их
производство продолжается, хотя к на-
чалу 90-х годов появились и самонарез-
ные имплантаты Branemark, хорошо се-
бя зарекомендовавшие [88|. Стандарт-
ные имплантаты выпускаются трех
диаметров — 3,75; 4 и 5 мм, длиной от
7 до 20 мм. Самонарезные имплантаты
также производятся разной длины, но
имеют только один диаметр — 3,75 мм.
Как стандартные, так и самонарезные
имплантаты погружные, и хирургиче-
скую постановку их осуществляют в
два этапа.
Имплантаты Branemark состоят из
нескольких компонентов, скрепляе-
мых винтами. На тело имплантата
опорную головку крепят центральным
винтом из титана, который проходит
через шестигранный замок-стопор,
предотвращающий вращение головки.
Протезная конструкция опирается на
опорную головку золотым цилиндром,
устанавливаемым в протезе зубными
техниками. Цилиндр, а с ним и протез
крепят к внутренней резьбе централь-
ного винта опорной головки малым зо-
лотым винтом.
Вначале все опорные головки систе-
мы Branemark изготавливали только из
титана. Они могут быть стандартными
и тогда имеют цилиндрическую форму.
Длину стандартных головок выбирают
так, чтобы они на 1—2 мм выступали
над уровнем десны, поскольку при за-
живлении ткань десны способна раз-
растаться до такой степени, что полно-
стью закрывает опорную головку. Не
исключены случаи, когда из эстетиче-
ских соображений стандартные опор-
ные головки могут заглубляться; при
этом края поставленного на них про-
теза также заглубляются в десну.
Для особых ситуаций из эстетиче-
ских соображений выпусками головки
конической формы ("Esthetic Cone
Abutments") высотой 1; 2 и 3 мм. Их вы-
соту выбирают соответственно толщи-
не десны. Как и стандартные опорные
головки, их крепят к телу имплантата
центральным винтом. Для коррекции
окклюзии предусмотрены опорные го-
ловки "Esthetic Cone Abutment" с углом
наклона 17 и 30*. У них в отличие от ос-
тальных головок, имеющих шестигран-
ное отверстие для скрепления с телом
имплантата и предотвращения враще-
ния, такое отверстие имеет 12 граней,
что позволяет установить головки в
большем количестве положений.
Винт крепления к имплантату стан-
дартных и конических головок, назы-
ваемый центральным винтом, изготав-
ливают из титана и затягивают с силой
20 Ncm (Newton centimeters). Он имеет
внутреннюю резьбу, в которую ввора-
чивают малый золотой винт, скреп-
ляющий протез с опорной головкой.
Золотой винт затягивают с меньшей
силой (Ю Ncm). Конструкторы созна-
тельно сделали этот винт механически
самым слабым местом конструкции.
Неадекватное распределение окклюзи-
онных сил или плохая подгонка про-
тезной конструкции сказываются пре-
жде всего на нем: он ослабевает или
переламывается. В первом случае его
подтягивают, не снимая протеза, во
втором отворачивают опорную голов-
ку, из которой сломанный золотой
винт удаляется вне ротовой полости.
Изначально имплантаты системы
Branemark предназначались для опоры
протезов при полной адентии. Такая
система была выбрана P.-I. Branemark
и работавшими с ним исследователями
после многолетних экспериментов и
предназначалась почти исключительно
для лечения полной адентии с исполь-
зованием 4—6 имплантатов для опоры
на них полного протеза, заменявшего
12 зубов. Успех имплантации позволил
применять их и при частичной аден-
тии. Однако при дальнейших попытках
практиков применить имплантаты
Branemark для лечения частичной
адентии, особенно для протезирования
отдельных зубов, оказалось, что разли-
чия в биомеханических условиях соз-
дают значительные проблемы. Вскоре
в системе имплантатов Branemark по-
явилась новая опорная головка UCLA
из пластмассы, предназначенная спе-
циально для протезирования одиноч-
ных зубов. Она представляет собой мо-
дификацию стандартной многокомпо-
нентной головки, в которой два после-
довательно соединенных металлических
элемента заменены пластмассовым ци-
линдром, амортизирующим враща-
тельные нагрузки. Чтобы исключить
вращение супраструктурных элемен-
тов, одновременно с крепящими вин-
тами, обеспечивающими соединениям
плотность, использованы шестигран-
ное сочленение опорной головки с им-
плантатом и протезная конструкция с
опорной головкой [ПО].
В 90-х годах был разработан и после
клинических испытаний принят к ши-
рокому применению имплантат Brane-
mark "Nolum" с оригинальной опорной
головкой для замены одиночного зуба
(Core One Abutment) [100]. Крепление
опорной головки к такому имплантату
отличается от такового в других конст-
рукциях. Чтобы уменьшить опасность
вращения коронки, помимо винтового
скрепления с имплантатом, головку
ставят еще на цемент. Центральный
винт крепления делают не из титана, а
из золотого сплава и затягивают с при-
ложением большей силы (32 Ncm). Зо-
лотой сплав допускает такое затягива-
ние, которое осуществляют под элек-
тронным контролем. Имплантат от
вращения удерживается специальным
инструментом.
Почти одновременно с имплантатом
для замены одиночного зуба в системе
Branemark появился новый самонарез-
ной имплантат, сразу получивший хо-
рошую оценку [88].
Несмотря на то что в последние де-
сятилетия было создано немало удач-
ных модификаций имплантатов Brane-
mark, эти имплантаты остаются прове-
ренным временем авторитетом и клас-
сическим образцом современных внут-
рикостных конструкций.
Имплантаты "Steri-Oss". На основе
концепции Branemark разработаны
имплантаты "Steri-Oss" и их последние
образцы "Replace Implant System" и
"Replace Seleck" (рис. 1.28).
В настоящее время, как и импланта-
ты Branemark, они выпускаются компа-
нией "Nobel Biocare". Один из исследо-
вателей имплантатов "Steri-Oss" J. Hahn
разработал целую систему подготовки
к имплантации этими конструкциями.
Он применяет специальное устройство
Рис. 1.28. Имплантаты "Steri-Oss”.
для определения качества кости. Пер-
вое поколение цилиндрических и вин-
товых имплантатов имела диаметр 3,8;
4 5 и 5 мм и длину 8, 10, 12, 14, 16 и
18 мм. Поверхность имплантата была
покрыта гидроксиапатитом или тита-
ном. На теле имелись борозды (у ци-
линдрических) и отверстие у верхуш-
ки. Нами в 1990—1994 гг. у 26 больных
установлены 30 имплантатов "Steri-
Oss". Успех составил 96 % при 8 и 11 лет
контрольного наблюдения. Однако в
переднем отделе верхней челюсти сле-
дует менять их позицию или наращивать
кость с вестибулярной поверхности.
В последующих разработках — "Re-
place Implant System" имеются винто-
вые титановые, с гидроксиапатитным
и TPS-покрытием, диаметром 4,3; 5 и
6 мм и длиной 10, 13 и 16 мм. Соеди-
нение с супраструктурой осуществля-
ется шестигранным винтом. Большой
набор инструментов — боров, направ-
ляющих, формирующих сверл, поста-
новочных инструментов, как и сами
имплантаты, имеют цветовые обозна-
чения для большего удобства работы с
разными по диаметру и длине конст-
рукциями.
Последние виды винтовых имплан-
татов — "Replace Select™" имеют те же
характеристики — титановые, с
гидроксиапатитным и титановым по-
крытием. Их диаметр 3,5; 4,3; 5 и 6 мм,
длина 10, 13 и 16 мм. Новым в этих
конструкциях является наличие соеди-
нения с супраструктурой при помощи
как наружного шестигранника на ко-
ронковой части имплантата, так и
трехгранного винта, находящегося
внутри полой верхней части конструк-
ции. Нами и А.И. Ушаковым [61а] ус-
тановлено 510 имплантатов "Replace
Select". Успех при 5-летнем наблюде-
нии составил 94 %. J. Hahn рекомендует
0 переднюю часть нижней челюсти ста-
вить имплантаты размером 13—16 мм, в
Дистальную — 10 мм. На верхней че-
люсти также в переднем отделе этот ав-
тор рекомендует имплантаты размером
3 -16 мм, в дистальном отделе — 10—
'3 мм. J. Hahn (1995) при близости
нижнего альвеолярного нерва прово-
дил препаровку его из зоны восприни-
мающего имплантат ложа. Тоже самое
Делал с подбородочным нервом. Перед
зашиванием слизисто-надкостничных
лоскутов можно проводить реставра-
цию кости "Bio-Oss", "Osteo-Graf", де-
минерализованными опилками кости,
"Pep-Gen Р-15" и их комбинациями,
особенно при ее нехватке у шейки им-
плантата. Иногда это может потребо-
ваться при отломе вестибулярной стен-
ки кости. Вблизи верхнечелюстного
синуса на завершающем этапе автор
рекомендует работать остеотомом дли-
ной 2,7 мм.
Отойдя от общих правил, J. Hahn
использует не глухое зашивание раны,
а только вокруг опорных винтов, нами
также с успехом применялась одно-
этапная хирургическая процедура с ис-
пользованием биоматериалов. Это по-
зволило практиковать раннюю дозиро-
ванную нагрузку.
Опыт J. Hahn (1990-1995), К. Ва-
poo-Mohamed (1995), J. Rosenlicht
(1995) и др. показывает высокую эф-
фективность имплантатов "Steri-Oss”,
особенно с НА-покрытием. К. Вароо-
Mohamed (1995) установила меньшее
количество выделяемых бактерий и
лучшую гигиеническую пробу у ста-
бильных имплантатов "Steri-Oss".
J. Rosenlicht (1995) отмечает большие
преимущества этой системы из-за про-
стого и нетравматичного хирургиче-
ского вмешательства и сокращение
времени лечения.
Имплантаты системы "Astra Tech."
Имплантаты выпускаются концерном
"Astra Tech. Implants” и представляют
собой классическую винтовую конст-
рукцию из чистого титана, предназна-
ченную для двухэтапного лечения.
Длина имплантата от 8 до 19 мм, диа-
метр 3,5 или 4,9 мм, поверхность его
обработана титаном, что создает хоро-
шую остеоинтеграцию (см. рис. 1.21).
Особенность хирургических дейст-
вий заключается в работе только двумя
режущими инструментами — направ-
ляющим и формирующим сверлом и
не требует нарезания резьбы и зенков-
ки. Иначе говоря, имплантаты "Astra
Tech." являются самонарезными. По-
сле погружения тело закрывается за-
порным винтом, а на втором этапе в
имплантат ставится супраструктура:
формирователь десны, стандартный,
угловой или шариковый абатмент. Раз-
нообразна супраструктура как по дли-
не, так и по углам наклона конуса (20°,
30°, 45°). Это гарантирует плотное и
стерильное соединение имплантата и
супраструктуры, отсутствие микродви-
жений и микроутечки из полости рта в
десневую борозду. А.И. Ушаков и соавт.
[61а] установили более 300 импланта-
тов "Astra Tech." с успехом в 96 %.
Имплантаты "Контраст". Первыми
отечественными имплантатами в фор-
ме корня зуба были имплантаты систе-
мы "Контраст" [38] (рис. 1.29). Они
предназначены для лечения частичной
и полной адентии. Как имплантаты,
так и дополнительные модули к ним
изготавливают из титана. Их детали
подвергают электрохимической поли-
ровке, пассивируют и покрывают чис-
тым титаном. Отдельные модифика-
ции имеют на теле биореактивные по-
крытия на основе гидроксиапатита,
нанесенные плазменным напылением.
Выпускаются винтовые стандартные
и самонарезные имплантаты диаметром
3,5 и 4 мм, длиной 10, 13 и 16 мм. Вин-
товые имплантаты представлены разъ-
емными конструкциями для двухэтап-
ной постановки и неразъемными — для
постановки в один этап.
В двух моделях имплантатов для
обеспечения первоначальной стабиль-
ности и предохранения от вывинчива-
ния предусмотрены дополнительные
элементы. Имплантат ИВ-5 (конструк-
ции Сурова—Массарского) имеет спе-
циальный фиксирующий штифт, вво-
димый в костное ложе вдоль тела им-
плантата через направляющий канал
Рис. 1.29. Имплантаты "Контраст".
на его коронковом торце. В канал за-
остренный штифт рекомендуется заби-
вать специальным таппером, имею-
щим на конце углубление. Пробивая
резьбовые перегородки в костной тка-
ни, штифт проходит по канавке на теле
имплантата и плотно прижимает его к
стенке костного ложа, предотвращая
вращение и создавая надежный кон-
такт. Изготовители рекомендуют от-
верстие для штифта на коронковом
торце имплантата располагать на ме-
диальной или дистальной стороне.
У имплантата "ИВ-6" (имплантат
Массарского) на апикальной части име-
ется разрез вдоль оси тела. При завора-
чивании по его внутренней резьбе акси-
ально установленного винта апикаль-
ная часть тела раздвигается и, увеличи-
ваясь в диаметре, плотно прижимает его
к стенкам ложа. Такая конструкция дает
возможность не только контролировать
степень затягивания винта, но и при не-
обходимости в процессе операции отво-
рачивать его и удалять имплантат. Им-
плантаты "Контраст" установлены нами
у 31 больного при немедленной им-
плантации (56 имплантатов) и одиноч-
ные — у 12 человек. Успех немедленной
имплантации при 3-летнем контроль-
ном наблюдении отмечен в 96,5 %
случаев, при 6-летнем контроле — в
92,1 %.
Для снятия слепков с установлен-
ных имплантатов и изготовления мо-
делей челюстей выпускаются аналоги
имплантатов и переходные модули. В
комплект постановочных инструмен-
тов входит циркулярный нож для
вскрытия с помощью бормашины и
удаления мягкой ткани над местом по-
становки имплантата. Диаметр иссе-
каемого участка ткани должен точно
соответствовать диаметру имплантата.
Имплантаты "Плазма Поволжья",
КИСВТ-СГТУ-01. Имплантаты этой
системы больше известны по названию
выпускающей их НПА "Плазма Повол-
жья". Они разработаны В.Н. Ляснико-
вым и соавт. и разрешены к серийному
производству в 1996 г. В систему
КИСВТ-СГТУ-01 входят винтовые, са-
монарезные и цилиндрические им-
плантаты (рис. 1.30). Они изготовлены
из титана и могут быть цельными или
пустотелыми. Две модели цельных ци-
Рис. 1.30. Имплантаты "Плазма Повол-
жья".
Рис. 1.31. Имплантаты "Radix".
чиндров и одна модель самонарезного
имплантата имеют тело конической
Формы. У двух первых конусообразные
Шейки имеют угол наклона. Использо-
вание нами конусных имплантатов
Плазма Поволжья" при немедленной
Имплантации дало положительный ре-
зультат в 97 % случаев с 5-летним кон-
тролем их функционирования.
Выпускаются погружные конструк-
ции в форме зуба для двухэтапной им-
плантации и непогружные — для одно-
этапной постановки. Диаметр их тела
зависит от типа конструкции и может
составлять 3,2; 3,6 и 4,1 мм. Длина тела
от 8 до 13 мм. Шейка имплантатов мо-
жет быть цилиндрической и конусной
формы. Имплантаты выпускают с
плазменным напылением титана или
гидроксиапатита. Возможна также их
композиция. При напылении титана
толщина слоя покрытия составляет от
50 до 125 мкм, при гидроксиапатитном
покрытии — от 35 до 70 мкм.
Имплантаты "Конмет". Система
объединяет модели цельных винтовых
имплантатов, выполненных из техни-
чески чистого титана (стандарт США
ASTM F 67-89 Grade 4) и предназна-
ченных для одноэтапной операции.
Соединение инфра- и супраструктур
производят выше слизистой оболочки.
Винтовые имплантаты выпускаются
двух диаметров — 3,3 и 4 мм. Такой не-
большой диаметр позволяет проводить
имплантацию не только в нормальных
анатомических условиях, но и при уз-
ком альвеолярном гребне. Винтовые
имплантаты имеют длину 8, 10 и 12 мм.
Предусмотрен комплект разъемных и
неразъемных опорных головок, имею-
щих различные углы наклона, что по-
зволяет варьировать конструкции про-
теза. Опорные головки винтовых и
плоских имплантатов взаимозаменяе-
мы. Тело всех имплантатов системы
"Конмет" имеет плазменное напыле-
ние титана.
Имплантаты "Radix". Серийное про-
изводство имплантатов "Radix" начато в
1989 г. фирмой "Проекция" [48, 49]. В
систему входят внутрикостные имплан-
таты в форме корня зуба двух типов:
цилиндрические (пористые импланта-
ты Смирнова) и винтовые (серии "Ra-
dix Gimlet IISDM и I") (рис. 1.31)._
Цилиндрические имплантаты "Ra-
dix” погружные, предназначены для
двухэтапного лечения. Конструкция их
тела комбинированная и состоит из
двух участков. Апикальная и централь-
ная части имеют цилиндрическую фор-
му'. Тело выполнено из сферического
Рис. 1.32. Имплантаты "Дивадент".
порошка титана с частицами диамет-
ром 0,315—0,4 мм и обладает сквозной
пористостью. Диаметр пор 120—
180 мкм, что способствует прораста-
нию и формированию трабекулярной
сети не только на поверхности, но и
внутри пористой части имплантата.
Коронковая часть тела представляет
собой конус, выполненный из ком-
пактного титана. Внутри этой части
для установки опорной головки имеет-
ся коническое отверстие, переходящее
в резьбовой канал. Диаметр в торце ко-
ронковой части 5,05 мм. Общая длина
обеих частей тела составляет 12, 14 и
16 мм. Имплантаты комплектуются
тремя типами конусовидных головок.
Винтовые имплантаты системы "Radix
Gimlet 11S" погружные. Тело их кони-
ческой формы. Диаметр торца корон-
ковой части 3,9 мм. В торце имеется
внутренний конический резьбовой ка-
нал, заканчивающийся шестигранни-
ком, с помощью которого имплантово-
дом конструкцию завинчивают в кост-
ное ложе, а при необходимости — уда-
ляют. Длина тела имплантатов 8, 10, 12
и 15 мм. Имплантаты "Radix Gimlet
DM и 1" предназначены для одноэтап-
ного лечения.
Опорные головки изготавливают двух
типов — снабженные шейкой и без нее.
Головки с шейкой применяют при тол-
щине слизистой оболочки более 2 мм.
Имплантаты "Дивадент". Импланта-
ты "Дивадент" разработаны на основе
54
концепции "Branemark" специалистами
фирмы "Дива" [32] и рекомендованы
для применения Комитетом по новой
медицинской технике Минздрава РФ в
1998 г. Тело их изготавливают из цир-
кониевого сплава, основу которого со-
ставляет цирконий — элемент из под-
группы титана. Имплантаты винтовые,
предназначены для двухэтапного лече-
ния (рис. 1.32). Коронковая часть им-
плантата заканчивается конической
шейкой. Диаметр наружной резьбы на
теле имплантата 4 мм, длина тела 8,5;
10,5; 12,5 и 14 мм. Опорную головку
изготавливают в виде целого стержня с
десневым и коронковым отделами и
опорной площадкой под коронку.
Опорная головка сообщается с телом
имплантата посредством резьбового и
конусного соединения; последнее
обеспечивает эффект заклинивания.
Новые имплантаты "Дивадент" само-
нарезные, диаметром 4 и 5 мм.
Имплантаты "ЛИКо". Имплантаты
системы "ЛИКо" разработаны специа-
листами МГМСУ [27]. Они погружные
и предназначены для двухэтапного ле-
чения. Тело имплантатов "ЛИКо”
цельное и представляет собой винто-
вой цилиндр (рис. 1.33). Материалом
служит титан марки ВТ1-1 или цирко-
ний. Специального покрытия тело им-
плантата не имеет. С целью достиже-
ния однородности и микрорельефно-
сти поверхность тела обработана кон-
Рис. 1.33. Имплантаты "ЛИКо".
б
Рис. 1.34. Имплантаты фирмы "Friadent".
а - "1MZ"; б - "Frialit-2".
центрированными ионными потоками
энергии. Благодаря этому имплантаты
обладают повышенными биоинертно-
стью и биотолерантностью.
Диаметр тела имплантатов единый —
3,5 мм, длина может составлять 8, 10,
13 и 16 мм. Выпускаются прямые опор-
ные головки и с наклоном 15 *. У всех
головок единый диаметр — 4 мм, длина
наддесневой части от 4 до 6 мм, десне-
вой — от 2 до 4 мм.
Имплантаты ”IMZ”. До последнего
времени имплантаты "IMZ” были наи-
более распространенной в Европе сис-
темой внутрикостных имплантатов в
форме корня зуба. На них в конце про-
шлого столетия, по предварительным
оценкам, приходилось 85 % всех им-
плантатов, ставившихся пациентам в
Европе [146]. Имплантаты “IMZ” по-
Пэужные; их изготавливают из техниче-
ски чистого титана (рис. 1.34, а). Вы-
пускают имплантаты винтовые, ци-
линдрические и комбинированные с
резьбой только в апикальной части. У
всех имплантатов апикальный конец
тела закруглен, что способствует более
Равномерному распределению нагру-
зочных сил и защите костного ложа и
прилежащей кортикальной кости от
экстремальных нагрузок. В апикаль-
ной части имеются отверстия и канав-
ки для прорастания в них новой кост-
ной ткани. Последние 2 мм коронко-
вой части тела имплантата покрытия
Не имеют и тщательно отполированы.
Такая шейка обеспечивает удобство
при проведении индивидуальных ги-
гиенических процедур. Имплантаты
"IMZ" выпускают с плазменным тита-
новым или гидроксиапатитным напы-
лением на их тело.
Главная особенность имплантатов
системы "IMZ" заключается в конст-
рукции головки, которая амортизирует
силовые нагрузки, приближая функ-
циональные и динамические качества
имплантатов к таковым природных зу-
бов. Конструкция имеет два варианта.
В первом, раннем, варианте роль
чресслизистого удлинителя выполняла
титановая муфта, внутрь которой был
вставлен внутри мобильный элемент
(IME), изготовленный из полиоксиме-
тилена и выполнявший двойную функ-
цию. Во-первых, он, проходя сквозь
титановую муфту, служил винтом кре-
пления ее к имплантату, во-вторых,
при установке на него протезной кон-
струкции благодаря своей гибкости он
играл роль амортизатора силовых на-
грузок. Однако материал внутримо-
бильного элемента, успешно приме-
няющийся для искусственных сердеч-
ных клапанов и протезов суставов,
оказался недостаточно прочным для
выполнения двойной функции в кон-
струкции зубного имплантата. Наблю-
дались случаи деформации и разлома
пластического материала [ 105J.
Хотя возможность сравнительно не-
сложной замены внутримобильного
элемента не изменила общих хороших
долгосрочных результатов импланта-
ционного лечения, в начале 90-х годов
прошлого столетия был разработан
второй вариант конструкции, назван-
ный интермобильным соединителем.
После успешных 3-летних клиниче-
ских испытаний в Европе имплантаты
с интермобильным соединителем были
признаны и одобрены для применения
и в США. В новой конструкции пласт-
массовый элемент был фактически
превращен в муфту и перестал выпол-
нять функции соединительного винта,
тогда как задачу чресслизистого удли-
нителя стала выполнять не титановая
муфта, а стандартная титановая опор-
ная головка с резьбой для плотного и
жесткого соединения с коронковой ча-
стью имплантата. Головки выпускают
диаметром 3,3 и 4 мм. Устанавливае-
мые на них интермобильные элементы
универсальны, и их размер стандартен
для всех опорных головок. Конструк-
ция интермобильного соединителя
стала на 10 % более жесткой, чем кон-
струкция внутримобильного элемента
с чресслизистым удлинителем.
Амортизационный эффект у им-
плантатов "IMZ" очевиден, но в 2 раза
ниже того, что допускается периодон-
тальной связкой природных зубов.
Сравнительная оценка смешения в
зубном ряду природных премоляров и
поставленных на их область одиноч-
ных имплантатов "1MZ" показала, что
если имплантаты имели смещения от
30 до 40 мкм, то у природных зубов с
периодонтальной связкой отмечались
колебания до 100 мкм [118]. Тем не ме-
нее имплантаты "1MZ" клинически до-
казали свою долгосрочную эффектив-
ность благодаря способности рассре-
доточивать и смягчать нагрузки, а так-
же существенно снижать давление на
кость. Их рекомендуется применять в
отсутствие одного зуба, при включен-
ных, сочетанных, одно- и двусторон-
них концевых дефектах зубных рядов,
а также при полной адентии верхней и
нижней челюстей. Местным противо-
показанием к применению импланта-
тов "IMZ" может быть вертикальная и
горизонтальная атрофия альвеолярно-
го отростка верхней челюсти и альвео-
лярной части нижней челюсти.
В последнее десятилетие отношение
к имплантатам "IMZ" несколько изме-
нилось. Главная причина состоит в
том, что обе амортизационные конст-
рукции предусматривают ежегодную
замену пластмассовых компонентов.
Это в определенной степени стало
фактором снижения их популярности,
хотя сама идея приближения функцио-
нальных и динамических качеств им-
плантатов к таковым природных зубов
остается актуальной. В настоящее вре-
мя главная проблема заключается в ма-
териале амортизирующего компонента
конструкции. Поэтому в последних
разработках системы "IMZ" — "Kinetix
Lain" появились конструкции "Estetic
Lain", в которых амортизирующая сис-
тема не предусмотрена и замены не
требуется. По данным ряда авторов,
оба вида имплантатов "1MZ" дают хо-
рошие результаты [35].
Имплантаты "Friatec”. Имплантаты
"IMZ" выпускала фирма "Friatec".
Позднее специалистами этой фирмы
была разработана и стали выпускаться
имплантаты "Frialit-l", "Frialit-2". По-
следние получили высокую оценку и
стали применяться в Европе, позднее в
Америке, России. Последние разра-
ботки "Frialit" -2" представляют собой
цилиндрические и винтовые имплан-
таты из титана, имеющие конусовид-
ную форму с поперечными рельефны-
ми бороздами или сегментарной резь-
бой. Диаметр 3,8; 4,5 и 5,5 мм, длина
II, 13 и 15 мм. Имеются имплантаты
диаметром 6,5 мм и длиной 13 и 15 мм.
Тело имеет фриос-титановое и фриос-
гидроксиапатитное покрытие (рис.
1.34, б). Последней разработкой фир-
мы "Friatec" является винтовой им-
плантат "Frialoc", предназначенный
для немедленной имплантации. Доста-
точно подробно методика операций с
имплантатами "Frialit®-2" изложена
Ф.Ф. Лосевым [35].
Имплантаты "1ТГ ("Bonefit"). Им-
плантаты "IT1" были предложены в
1980 г. и свое название получили по
имени исследовательской группы Inter-
national Team for Oral Implantology, в
которую входили исследователи Берн-
ского университета и Института метал-
лургии Straumann. Можно считать, что
ими была создана первая конструкция
НПптППП
.<=57
_. 6 о
J й ° О
Д« 9-?
'Pt
м
^7 —ун 'j *4"-^^ У~~
Э О о Q
Рис. 1.35. Имплантаты "1ТГ ("Bonefit").
непогружных имплантатов в форме
корня зуба, основанная на принципах,
разработанных P.-I. Branemark. В по-
следующие годы их имплантаты под-
верглись нескольким модификациям,
благодаря чему стали более универсаль-
ными, но при этом все они остались не-
погружными, и хирургические манипу-
ляции с ними проводятся в один этап. В
этом их главное отличие от других со-
временных имплантатов (рис. 1.35).
Имплантаты "ПТ изготавливают из
технически чистого титана марки ISO
5832-11. Поверхность их тела независи-
мо от его конструкции имеет плазмен-
ное напыление титаном до предела
границы их погружения, всегда совпа-
дающей с краем кости. Толщина по-
крытия в среднем составляет 20 мкм.
Имплантаты "1ТГ делятся на две груп-
пы: неразъемные и состоящие из двух
частей. Первые уже при постановке
имеют прикрепленную опорную голов-
ку, которая выступает в ротовую по-
лость. Вторые, состоящие из двух час-
тей, вводятся в кость без опорной го-
ловки. Вместо нее при зашивании раны
ставят винт заживления. Диаметр его
головки может быть одинаковым с
Диаметром имплантата или ббльшим.
“ первом случае мягкие ткани после за-
живления оказываются слегка выше
плеча имплантата, тогда как более ши-
рокая головка, не допуская закрытия
имплантата мягкой тканью, предохра-
няет его от значительного погружения в
нее. Последующая постановка опорной
головки на имплантат не требует ка-
ких-либо оперативных вмешательств.
Если имплантат на 1—2 мм ниже края
кости челюсти, то предусмотрено при-
менение удлиняющих колпачков высо-
той 3—4 мм. Они улучшают эстетиче-
ские результаты в области между мяг-
кой тканью и будущей надальвеоляр-
ной частью зубного протеза.
В обеих группах имплантатов име-
ются винтовые и цилиндрические пус-
тотелые конструкции, а также цельно-
металлические винтовые имплантаты.
Погружаемое в кость челюсти тело всех
имплантатов имеет длину от 8 до 16 мм
у цельнометаллических и от 8 до 12 мм
у составных конструкций. Составные
конструкции отличаются тем, что име-
ют набор опорных головок с разными
углами для окклюзии. Для особых ана-
томических условий выпускают специ-
альные двухкомпонентные пустотелые
и цельнометаллические имплантаты с
заглублением тела только на 6 мм. У
них, как и у большинства двухком-
плектных имплантатов, форма опор-
ных головок конусообразная.
Выбор имплантатов "1ТГ зависит от
конкретных клинических ситуаций.
Производители рекомендуют пустоте-
лый цилиндрический имплантат диа-
метром 3,5 мм для участков с малым
количеством кости, особенно при оди-
ночном дефекте зуба. Цилиндриче-
ский пустотелый имплантат может слу-
жить опорой мостовидных протезов
жевательной группы зубов. При рых-
лой кости с выраженной атрофией луч-
ше использовать винтовой пустотелый
имплантат, так как он осуществляет на-
чальное сцепление с костью, а пустоте-
лая форма обеспечивает его последую-
щую стабильность. При достаточной
высоте кости и адекватном ее количе-
стве следует ставить винтовой пустоте-
лый имплантат длиной более 10 мм.
Такой же имплантат рекомендуется
для постановки на верхней челюсти
вблизи верхнечелюстной пазухи, в об-
ласти моляров.
Имплантаты "Endopore". Импланта-
ты системы "Endopore" разработаны в
Торонтском университете. Первое экс-
периментальное и клиническое приме-
нение их относится к 1983 г. Все они
погружные; материалом лля них слу-
жит титан (рис. 1.36). Их тело имеет
форму усеченного конуса. Это исклю-
чает образование большого напряже-
ния в зоне гребня челюсти, что нередко
наблюдается у винтовых и цилиндриче-
ских имплантатов. Кроме того, конусо-
образность имплантата при его поста-
новке позволяет до определенной сте-
пени маневрировать его положением
путем отклонения оси костного ложа от
соседних имплантатов, корней зубов
или элементов анатомической структу-
ры. Для предотвращения вращения и
ослабления винтового соединения на
коронковом торце тела имеется штыре-
вой шестигранник под шестигранное
гнездо на контактной поверхности эле-
ментов супраструктуры. Высота шести-
гранника 1,5 мм. Никаких отверстий
или прорезей на контактирующей с ко-
стью поверхности тела нет.
Рис. 1.36. Имплантат "Endopore".
Главная конструктивная особенность
имплантатов состоит в пористом по-
крытии всей их поверхности, за исклю-
чением полированной шейки высотой 1
или 2 мм. Пористость создается спека-
нием в вакууме сферических гранул ти-
танового сплава при высокой темпера-
туре. В результате образуется много-
слойное покрытие, в котором сферы
размером от 50 до 200 мкм точечно
скреплены между собой. Поскольку но-
вая кость прирастает к каждой сфере с
трех сторон, разработчики системы на-
звали такое покрытие трехмерным.
Пористая поверхность значительно
увеличивает площадь и прочность сце-
пления. По сравнению с винтовыми
имплантатами той же длины у имплан-
татов с пористой поверхностью пло-
щадь контакта с костью в 3 раза боль-
ше. Это позволило значительно умень-
шить длину имплантатов и, сохранив
прочность скрепления с костью и все
необходимые характеристики, расши-
рить возможности их применения при
недостаточных размерах кости.
Клинические наблюдения показали,
что при пористой поверхности тела
приживление имплантата ускоряется и
остеоинтеграция проходит в более ко-
роткие сроки (86]. Это позволяет пере-
ходить ко второму хирургическому эта-
пу при имплантации на передних уча-
стках нижней челюсти через 10 нед, а
на верхней челюсти и дистальных отде-
лах нижней челюсти — через 16 нед.
Остеоинтеграция протекает нормально
даже при микродвижениях имплантата
(до 28 мкм) (129]. В ходе остеоинтегра-
ции потеря кости за первый год состав-
ляет 0,44 мм, за второй — 0,17 мм, за
третий — 0,13 мм, что почти в 2 раза
меньше потери кости, которая считает-
ся нормой для винтовых и цилиндри-
ческих имплантатов. После третьего го-
да функционирования конических им-
плантатов с пористым покрытием по-
теря кости вокруг их коронковой части
не наблюдалась и ее граница оставалась
на уровне шейки имплантата (86].
Имплантаты выпускают длиной 7, 9
и 12 мм с коронковой частью диамет-
ром 4,1 мм, длиной 5 и 7 мм и диамет-
ром 5 мм и так называемые мини-им-
плантаты — длиной 9 мм и диаметром
3,5 мм.
Рис. 1.37. Оригинальные кругло-плоские имплантаты,
а — "Unipost System"; б — "Bicon".
Винты заживления, устанавливаемые
на втором этапе хирургического лече-
ния, могут быть одинакового (4,1 мм)
или большего (5,4 мм) диаметра по
сравнению с выбранным имплантатом.
На мини-имплантаты винты заживле-
ния ставят только увеличенного диа-
метра (4,7 мм). Для имплантатов "En-
dopore" предусмотрено несколько сис-
тем опорных головок, в том числе кон-
струкции с пластмассовыми амортиза-
торами. Стандартные опорные головки
металлические. Их выпускают одинако-
вого диаметра 3,5 мм, длиной 7 или
9 мм. На площадке контакта с имплан-
татом расположено шестигранное гнез-
до, в которое входит штыревой шести-
гранник тела имплантата. Скрепление с
имплантатом винтовое. Головки имеют
шейку высотой 1,5 или 3,5 мм. Высокой
шейке придают конусообразную форму.
Выпускают также опорные головки с
Углом наклона 15° и 25°. На стандартных
опорных головках протезную конструк-
цию закрепляют цементированием.
Имплантаты "Unipost System". Кон-
струкции разработаны Н. Tatum спе-
циально для постановки при реконст-
рукции верхней челюсти и поднятия
слизистой оболочки верхнечелюстной
пазухи (рис. 1.37, а). Они могут соче-
таться с имплантатами другой формы.
Остеотомию для их постановки прово-
дят как традиционным сверлением, так
и специальными долотами "Unipost sys-
tem". Имплантаты "Unipost system" на-
ми применялись только при реконст-
рукции верхней челюсти и поднятии
дна верхнечелюстной пазухи, так как
они имеют круглую форму и вытяну-
тые по сторонам ребра резьбы. Иными
словами, имея круглую форму, им-
плантаты вытянуты по горизонтали,
что позволяет использовать их при ма-
лой ширине кости альвеолярного отро-
стка и плохом качестве кости.
Имплантаты "Bicon” ("Shriicker")
представляют собой простую систему
винтовой конструкции и выраженны-
ми ребрами резьбы. Имеют длину 8, 11
и 14 мм и диаметр 3,5; 4 и 5 мм. Отли-
чаются простатой постановки, так как
требуют наметочного и формирующего
сверления и машинного или ручного
вворачивания. Производители реко-
мендуют перед постановкой импланта-
та проводить замер глубины, чтобы
шейка его была на 2 мм ниже края кос-
ти, а запорный винт — вровень с ней.
Простая конструкция, резкость ребер
винтовой нарезки позволяют приме-
нять имплантаты "Bicon" при рыхлой
кости, в самых сложных клинических
ситуациях, использовать минимальное
их число для фиксации съемных про-
тезов, особенно при значительной ат-
рофии кости (рис. 1.37, б).
Имплантаты "Maestro System”. Все
имплантаты этой системы винтовые,
изготавливаются из титана. Они по-
гружные и рассчитаны на двухэтапную
операцию (рис. 1.38). В системе четыре
группы имплантатов, каждая из кото-
рых предназначена для одной из четы-
Рис. 1.38. Им-
плантат "Maestro
System”.
рех категорий плотности кости соглас-
но классификации, разработанной
С. Misch и К. Judy [122]. Имплантаты
маркируют так же, как обозначают
кость в зависимости от ее качества.
Имплантаты DI и D2 предназначаются
для кости, адекватной с точки зрения
качества, тогда как имплантаты D3 и
D4 сконструированы под рыхлую, мяг-
кую кость. Главная особенность конст-
рукции каждой группы заключается в
увеличении площади контакта им-
плантата с костью по мере ухудшения
ее качества и в большем рассредоточе-
нии нагрузочных сил [121].
В меньшей степени это достигается
увеличением геометрических размеров
имплантатов [120].
Поскольку на площадь контакта,
помимо геометрических размеров, в
первую очередь влияют наличие и ха-
рактер покрытия, поверхность им-
плантатов "Maestro System" различная.
Имплантаты D1 и D2 специального
покрытия не имеют. Площадь их по-
верхности увеличивают загрублением,
путем обработки дутьем, причем для
предотвращения заражения использу-
ют частицы гидроксиапатита.
Имплантаты D3 имеют плазменное
напыление титаном. У имплантатов D4,
предназначенных для наиболее рыхлой
и пористой кости, покрытие гидрокси-
апатитное.
Площадь контакта с костью зависит
также от общей площади ребер винта
на теле имплантата. Она наиболее ве-
лика у имплантатов D4, поскольку шаг
резьбы у них наименьший, отчего ко-
личество ребер наибольшее.
Все имплантаты "Maestro System"
имеют только опорную резьбу, умень-
шающую перераспределение верти-
кальных сил окклюзии в боковые. Осо-
бое внимание этому вопросу уделено в
конструкции имплантатов Е)4лля рых-
лой кости. В них, чтобы распределить
на возможно большую площадь силы
нагрузки в коронковой части имплан-
тата, где они всегда максимальные,
применено постепенное увеличение
опорной поверхности ребер резьбы от
апикальной части имплантата к корон-
ковой. Для этого глубину канавок резь-
бы по мере их приближения к гребню
кости увеличивают.
Система "Maestro System" преду-
сматривает выбор имплантатов в зави-
симости не только от качества налич-
ном кости, но и от ее количества, т.е.
высоты и ширины. Выпускают им-
плантаты диаметром 3,5—4 и 5 мм,
длиной 9—13 мм. Для них предусмот-
рены различные конструкции опорных
головок и временных элементов супра-
структуры на период хирургических и
ортопедических манипуляций.
Первые сообщения о результатах
применения имплантатов "Maestro Sys-
tem" в клинической практике появи-
лись в последние годы прошлого столе-
тия [121]. Успех был достигнут в 98,9 %
случаев при постановке 364 импланта-
тов. Однако данных об отдаленных ре-
зультатах применения таких импланта-
нт еще нет.
Имплантаты "Sulzer Calcitek". Им-
плантаты "Calcitek Spline14’ Dental Im-
plant System" представляют собой тита-
новые цилиндрические имплантаты
диаметром 3,25; 4 и 5 мм и винтовые
диаметром 3,75 и 5 мм и длиной 8, 10,
13, 15, 18 мм, отдельные имеют гидро-
ксиапатитное и титановое плазменное
напыление. Среди винтовых имплан-
татов имеются также оригинальные с
механической и микротекстурной
алоевой титановой обработкой. Разно-
образие имплантатов и супраструктуры
позволяет применять их в разных кли-
нических ситуациях (рис. 1.39). Им-
плантаты "Calcitek” получили широкое
распространение в США и Европе. В
настоящее время фирма "Sulzer Medica"
стала владельцем фирмы "Paragon" и
выпускаемых имплантатов "Core-Vent".
Имплантаты "Core-Vent". Такие им-
плантаты выпускает фирма "Paragon",
ныне "Calcitek”. Их изготавливают из
титанового сплава (медицинский ти-
тан). Они представляют собой погруж-
ные конструкции в форме корня зуба
на основе концепции Branemark для
Двухэтапного лечения (рис. 1.40). Сис-
тема включает 4 вида имплантатов.
I- "Screw-Vent” — самонарезные винто-
вые имплантаты, поверхность тела
которых затрублена кислотным трав-
лением, плазменным напылением
титана или гидроксиапатита. По-
верхность шейки неоднородная. Ее
часть, прилегающая к телу имплан-
тата (2 мм), обработана горячим
дутьем для уменьшения резорбции
кости, коронковая часть (1 мм) —
кислотным травлением. Шейка ши-
рокая, гладкая, с высокой степенью
полировки. Имплантаты имеют дли-
ну 8, 10, 13 и 16 мм, диаметр тела 3,3;
3,75 и 4,7 мм. Выпускаются неразъ-
емные конструкции для одноэтап-
ной операции и погружные для
двухэтапного оперативного вмеша-
тельства. Предусмотрены разнопро-
фильные опорные головки.
2. "Bio-Vent" — цилиндрические пусто-
телые имплантаты. Вдоль тела, по-
крытого гидроксиапатитом, располо-
жены желобки, которые на апикаль-
ном конце заканчиваются круглыми
отверстиями. Апикальная часть тела
закруглена. Длина имплантатов 8,
10, 13 и 16 мм, диаметры тела и шей-
ки 3,4 и 4,5 мм.
3. "Complete Screw-Vent" — винтовые
имплантаты для одноэтапного и
двухэтапного лечения. Одноэтап-
ные, погружные имплантаты выпус-
каются неразъемной и разъемной
конструкции. Все двухэтапные им-
плантаты разъемные. Имеются ва-
рианты самонарезных винтовых им-
плантатов. У всех имплантатов в
апикальной части для сбора костной
стружки расположены сквозные
овальные отверстия, размер которых
возрастает с увеличением диаметра
тела. Апикальный конец импланта-
тов сделан плоским, чтобы исклю-
чить травму нижнего альвеолярного
нерва. Поверхность тела импланта-
тов может быть обработана плазмен-
ным напылением титана или
гидроксиапатита, кислотным трав-
лением или горячим дутьем раство-
римых субстанций (Soluble Blasting
Media). Длина имплантатов 8, 10, 13
и 16 мм, диаметр тела 4,3 и 5,3 мм.
4. "Micro-Vent” — винтовые пустоте-
лые имплантаты. На некоторых об-
разцах резьба на теле опорная. Фор-
ма тела — сужающийся к его апи-
кальному концу конус. Длина тела 8,
10, 13 и 16 мм, диаметр 3,25 мм. Им-
плантаты выпускаются с разными
видами покрытия тела.
Особое преимущество имплантатов
"Core-Vent" является их разнообразие,
что позволяло нам использовать их в
различных ситуациях. Однако малое
количество наблюдений — 12 пациен-
тов и 18 установленных конструкций с
10-летним 100 % отдаленным результа-
том требует дальнейшего опыта работы
с ними.
1.3.3. Системы внутрикостных
плоских имплантатов
Первые такие имплантаты почти одно-
временно были предложены в 1967 г.
Н. Roberts и R. Roberts, а также L. Lin-
kow [113]. Последний многие годы их
усовершенствовал и предложил разно-
образные формы для всех участков че-
люстей и разных качеств кости. Вы-
пуск их организовала фирма "Oratro-
nics". В последующие годы их конст-
рукцию многократно модифицировали,
внося важные усовершенствования.
R. Roberts в последующем также пред-
ложил новые конструкции плоских
имплантатов, в том числе рамусные
для узких альвеолярных отростков. На
тонкой листовой пластинке тела пло-
ских имплантатов для прорастания
кости делают большое количество про-
резей и отверстий, краям тела придают
фестончатую форму и разнообразную
конфигурацию с целью соответствия
анатомическим особенностям челю-
стей и конкретным клиническим си-
туациям (рис. 1.41). Улучшаются свой-
ства плоских имплантатов при обра-
ботке их тела сверхмощными ионными
пучками [17], напылением на тело
гидроксиапатита.
Благодаря пластиночной форме тела
они были специально предназначены
для одноэтапной постановки в узкую
альвеолярную дугу. В настоящее время
выпускаются также погружные пло-
ские имплантаты для двухэтапного ле-
чения. Тело плоских имплантатов мо-
жет иметь гидроксиапатитное покры-
Рис. 1.41. Плоские (пластиночные) имплантаты.
тне. Оно увеличивает площадь их кон-
такта с костью и, как и у цилиндриче-
ских конструкций, играет важную роль
р обеспечении стабильности в период
остеоинтеграции. Наблюдения показа-
ли также, что при использовании пло-
ских конструкций с покрытием для
двухэтапного лечения имеет место ос-
теоинтеграция, тогда как без такого по-
крытия вместо кости образуется фиб-
розная ткань [90].
Разрабатываются также плоские им-
плантаты не только с увеличенной пло-
щадью, но и с улучшенным распреде-
лением компрессионных сил. К одной
из таких конструкций относятся пло-
ские имплантаты ”Flexi-Cup”, у кото-
рых некоторые части тела можно не-
сколько отгибать в стороны, создавая
таким образом нечто похожее на плав-
ники рыбы. Разработчики утверждают,
что по сравнению с обычными имплан-
татами такая конструкция, названная
трехмерной, лучше распределяет ком-
прессионные силы и в 4 раза уменьша-
ет окклюзионную нагрузку, передавае-
мую на кость [142]. Это очень важно,
так как практически означает, что с
учетом нагрузки можно ставить им-
плантаты "Flexi-Cup” в 4 раза короче
обычных плоских имплантатов. Одна-
ко о практических результатах приме-
нения имплантатов "Flexi-Cup" сооб-
щений не было.
Конструктивно плоские погружные
имплантаты имеют такие же опорные
головки, как и имплантаты в форме
корня зуба. У непогружных плоских
имплантатов роль опорных головок иг-
рают выступающие из их плеч штифты,
количество которых зависит от величи-
ны нагрузки. Правда, существует важ-
ная разница между опорными головка-
ми имплантатов в форме корня зуба и
опорными головками и штифтами пло-
ских имплантатов. Диаметр последних
ограничивает пластинчатая конструк-
ция их тела, в связи с чем их диаметр
как минимум в 2 раза меньше диаметра
опорных головок имплантатов в форме
корня зуба. По этой причине площадь
их контакта с кортикальной костью
Фебня челюсти значительно уменьша-
ется, вследствие чего рассредоточение
в нем сил нагрузки ухудшается. Важно
отметить, что это происходит на тех
участках, где убыль кости после поста-
новки имплантата наблюдается в пер-
вую очередь [120].
Имплантаты Linkow. Имплантаты
предназначены в основном для одно-
этапного оперативного вмешательства.
Лишь отдельные конструкции системы
погружные и предусматривают две хи-
рургические процедуры. Тело имплан-
тата представляет собой плоскую режу-
щую вкладку с многочисленными про-
резями. Размеры и форма тела разно-
образны и соответствуют определен-
ным участкам верхней и нижней челю-
стей. Поверхность тела рифленая (см.
рис. 1.9). Соотношение площади по-
верхности тела, контактирующей с ко-
стью, и площади прорезей 3:1. Тело
может иметь одну или две опорные го-
ловки. Для остеотомии и постановки
имплантатов разработана серия инст-
рументов. Все конструкции и инстру-
менты автором запатентованы и послу-
жили основой для выпуска различны-
ми фирмами плоских имплантатов, по-
лучивших широкое распространение
во всем мире.
По данным клинических наблюде-
ний, проведенных L. Linkow, его пло-
ские конструкции на нижней челюсти
дали 90 % положительных результатов
при послеоперационном контроле в
течение 5 лет, 85,9 % — при 15- и 21-
летнем наблюдении. На верхней челю-
сти положительные результаты отме-
чены в 82,4 % случаев при 5-летнем на-
блюдении, в 75 % — при 15-летнем и
74,9 % — при наблюдениях в течение
21 года.
Имплантаты "Oratronics”. Фирма
"Oratronics" первой начала выпуск пло-
ских имплантатов из титана системы
Linkow. Позднее, когда Ch. Weiss
(1987) [144] разработал новые конст-
рукции плоских имплантатов, фирма
перешла на их выпуск. Оригиналь-
ность новой конструкции заключалась
в штамповке имплантатов из кристал-
лов титана, имевших форму грехмер-
ных призм (рис. 1.42). Такая микро-
структура поверхности (Tissue Tag) соз-
дает более плотный контакт с костью и
увеличивает его площадь. В результате
этого, по утверждению разработчиков
конструкции, поверхность имплантата
возрастает во много раз [144]. Благода-
Рис. 1.42. Штампованные призмы на им-
плантате "Oratronics".
Рис. 1.43. Имплантаты "Roberts”.
ря нитрогенно-азотному насыщению
имплантаты имеют также ионную за-
щиту.
Имплантаты "Oratronics" апробиро-
ваны в Гарвардском университете
(США) и получили высокую оценку.
Дальнейшие клинические наблюдения
показали, что конструкция из кристал-
лов титана и обработка ее поверхности
с помощью нитрогенно-азотной им-
прегнации обеспечивают имплантатам
хорошую стабильность в кости и сни-
жают функциональные нагрузки. Фир-
ма "Oratronics" производит также им-
плантаты для замены одного утрачен-
ного зуба. Однако некоторые исследо- |
ватели подвергают сомнению возмож-
ность их использования. Имплантаты
выпускаются как для одноэтапного,
так и для двухэтапного хирургического
лечения. В первом случае они имеют
цельную конструкцию, в втором —
разъемные. Для остеотомии L. Linkow
и фирма "Oratronics" разработали на-
бор периостальных элеваторов, борон
и дрелей и комплект постановочных
инструментов из титана. Разработан
также специальный инструмент для
"выщипывания” слизистой оболочки из
места опорной головки имплантата, а
для придания ей нужного утла наклона
используются специальные крампон-
ные щипцы с широкими щечками.
Любезно предоставленные Ch. Weiss
имплантаты "Oratronics" применяются
нами с 1992 г.; 10-летний контроль их
функционирования показал успех в
94 % случаев при стандартном хирур-
гическом вмешательстве и в 91 % —
при имплантации и пластике кости. Не
утратили своего значения плоские им-
плантаты "Roberts" (рис. 1.43).
Имплантаты "ВНИИМТ'. Имплан-
таты из титана ВТ-01 являются первы-
ми отечественными плоскими имплан-
татами [6, 40, 57, 62]. Они разработаны
и выпускаются ВНИИМТ. Клиниче-
ские испытания прошли в ЦНИИС
(проф. В.М. Безруков, проф. А.И. Мат-
веева, проф. А.А. Кулаков) и в М ГМСУ
(проф. Т.Г. Робустова, доц. А.И. Уша-
ков), получив хорошую оценку. В 1986 г.
приказом Минздрава СССР № 310 от
4.3 они утверждены для клинического
применения (рис. 1.44).
Рис. 1.44. Им-
плантат
"ВНИИМТ'.
Имплантат "ВНИИМТ" изготавли-
вается из сплава титана и представляет
собой конструкцию, близкую к ран-
ним вариантам имплантатов "Linkow”.
Он состоит из тела, шейки и опорной
головки. На теле имплантата первого
варианта имеются отверстия диамет-
ром 3 мм. В поперечном разрезе по
вертикали тело имеет форму усеченно-
го книзу под углом 45’ прямоугольника
толщиной 1,25 мм. Другие варианты
конструкции различаются количест-
вом опорных головок и длиной.
Позднее разработчики внести в кон-
струкцию имплантатов ряд изменений.
На теле был сделан воротничок, кото-
рый имеет полимерное покрытие и вор-
синки для наилучшей герметизации и
образования надежного замка. В даль-
нейшем был предложен вариант плос-
кого имплантата с двухслойным поли-
мерным покрытием тела [Ушаков А.И.,
1998]. Модернизация коснулась и по-
верхности имплантата [30), а также об-
работки мощными ионными пучками,
отчего интеграция с костью значитель-
но улучшилась [17J.
Имплантаты "ВНИИМТ" изготавли-
ваются 6 размеров. В ходе импланта-
ции предусмотрена возможность под-
гонки имплантата: изменение раз-
меров тела, шеек, головки или головок.
К имплантатам придаются аналоги,
твердосплавные боры разных раз-
меров.
Имплантаты “ВНИИМТ" нашли
широкое применение в клинической
практике. Итоги 13-летнего примене-
ния свидетельствуют об эффективно-
сти лечения в 94 % случаев при 5-лет-
нем контроле отдаленных результатов
[40, 55J.
В настоящее время А.А. Кулаковым
и В.И. Налапко (1999) на основании
клинических и математических иссле-
дований усовершенствованы импланта-
ты "ВНИИМТ1, что повысило их долго-
вечность при функционировании [30], а
А.И. Ушаков [61а] разработал двух-
слойное полимерное покрытие, обес-
печивающее лучшую интеграцию в
кости, особенно IV типа.
Плоские имплантаты "Плазма Повол-
жья”, "Конмет" и "Radix". НПА "Плаз-
ма Поволжья" производит несколько
моделей плоских одноэтапных им-
плантатов из титана [37]. У них много
конфигураций тела и разное число
опорных головок (от 1 до 3). Высота те-
ла плоских имплантатов от 13 до 18 мм,
длина — от 6 до 28 мм. Они отличаются
большой прочностью на изгиб и хоро-
шей адгезивностью (рис. 1.45). Их
клиническое применение дало хоро-
шие результаты [Робустова Т.Г. и др.,
1998].
Фирма "Конмет" выпускает не-
сколько моделей плоских имплантатов
с одной и двумя опорными головками.
Трансмукозная часть имеет высокий
уровень полирования. Тело импланта-
та характеризуется большим разнооб-
разием ширины и высоты, имеет тита-
новое плазменное напыление (рис.
1.46).
Высота тела всех моделей одинако-
ва — 7 мм. Длина тела может быть 12,
18 и 22 мм. У одной из моделей с раз-
мерами тела 7х 18 мм головка смешена
от центра. Опорные головки плоских
имплантатов взаимозаменяемы. Для
каждой модели плоских имплантатов
предусмотрен аналог.
Плоские имплантаты "Radix" отно-
сятся к серии "Blade" и предназначены
для одноэтапного оперативного вме-
шательства. Они являются модифика-
цией имплантатов "Blade-Vent" — ис-
торически первых плоских импланта-
тов, разработанных L. Linkow и нашед-
ших широкое применение в клиниче-
ской практике.
Плоские имплантаты ”Аси-1М". Из-
готовлены фирмой "МЕТТЭМ”. Суще-
ствует множество видов и форм, с од-
ной и двумя опорными головками. Те-
ло имеет разнообразную форму, адап-
тированную к различным участкам
верхней и нижней челюстей. Волни-
стая поверхность тела имеет прорези,
что создает макроблокировку имплан-
тата с костью и способность остеоин-
тегрироваться. Сравнительная оценка
65
Рис. 1.45. Имплантаты "Плазма Поволжья”.
имплантатов "Аси-1М” и "Oratronics"
показала, что прочность отечествен-
ной конструкции на 32 % больше, на
46 % у них увеличена усталостная
прочность, изгиб шейки на 19—26 %
снижает пиковые концентрации окк-
люзионных нагрузок. Особое преиму-
щество имплантатов ”Аси-1М" — их
экономичность.
Имплантаты выпускаются разбор-
ной и неразборной конструкции. Тело
имплантата гофрированное, имеет тол-
щину 1,2 мм и высоту 7 мм. Длина тела
может быть 18, 23 и 28 мм. Неразбор-
ные имплантаты первых двух размеров
выпускаются с центральными и сме-
шенными головками. У имплантатов
последнего размера две опорные го-
Рис. 1.46. Имплантат
"Конмет".
ловки. Разборные конструкции отли-
чаются тем, что их шейка переходит в
коническую резьбу, которая служит
модулем для установки съемных голо-
вок.
Разработка имплантатов в России и
странах СНГ продолжается, и многие
из них вполне конкурентны с зарубеж-
ными конструкциями. В последние 5—
10 лет за рубежом появился ряд новых
производителей имплантатов, среди
которых шведские фирмы "Premium
Dental Implant system", "Dyna" и "Den-
tatus”, французские "ONB”, "Biotech in-
ternational", "Sudimplant", "Victory'",
итальянские "Tocksystem", "Easy system
implant — TF1 system srl", финская "Os-
tix", израильская "Medical Implant sys-
tem".
Среди новых разработок обращает на
себя внимание винтовой имплантат с
боковым чрескостным креплением
("Euroteknica", Германия) (рис. 1.47) и
"Disimplant" ("Victory®", Франция),
предназначенные для немедленной
имплантации (рис. 1.48).
Многие западные фирмы ("Nobel
Biocare", "Steri-Oss", "М. Tabukasch",
"Frident" и др.) разработали импланта-
66
Рис. 1-47. Винтовой имплантат с чрескостным креплением.
я — установление чрсскостного крепления; б — вид имплантата в кости.
Рис. 1.48. Дисковый имплан-
тат ("Disimplant").
а — вид имплантата; б — уста-
новление чрескостного крепле-
ния; в — ортопантомограмма:
наложение дисковых импланта-
тов в кости верхней и нижней
челюсти.
S
Рис. 1.49. "Биодизайн-имплантат”.
ты для немедленной постановки в аль-
веолу удаленного зуба. Среди них "Био-
дизайн-имплантат", изготавливаемый
на основе сверхточных измерений по-
верхности удаленного корня (рис. 1.49).
Немецкая фирма "Friadent", помимо
"Frialit-2", вьшускает винтовые имплан-
таты "Frialoc , получившие признание
при немедленной имплантации в альве-
олы удаленных зубов. Фирма "Denta-
tus" разработала мини-имплантаты, от-
крывающие широкие перспективы для
сокращения сроков лечения. Аналогич-
ные мини-имплантаты стали выпускать
и другие фирмы — "Steri-Oss", "Imtex"
(рис. 1.50). Очень перспективна идея
P.-I. Branemark — лечение зубов за
один день, когда на беззубую нижнюю
челюсть в область симфиза ставятся
имплантаты со средним в центре, а в
съемный зубной протез вводится тита-
новая пластина с супраструктурой.
Таким образом, среди современных
имплантатов наиболее распространен-
ными являются конструкции в форме
корня зуба. Прослеживается тенден-
ция к совершенствованию импланта-
тов, и разрабатываются новые конст-
рукции. Это дает перспективу упро-
щать хирургическое вмешательство и
повышать остеоинтеграцию. Среди
них следует отметить новации имплан-
татов "Astra Tech.", "ITT, новые элемен-
ты сочленений у имплантатов компа-
ний "Slraumann", "Calcitek", "Paragon",
"Steri-Oss", "Плазма Поволжья". Про-
грессивно разрабатываются импланта-
ты для немедленной постановки в аль-
веолу удаленного зуба — компании
"Nobel Biocare", "Steri-Oss", "Strau-
mann", "Friadent". Лидируют в области
имплантации США, а в Европе наибо-
лее развита имплантология в Герма-
нии, Италии, Франции, Испании,
Швейцарии, Великобритании, Шве-
ции. Помимо непосредственно разви-
тых национальных систем импланта-
тов, во всех европейских странах веду-
щими остаются компании "Nobel Bio-
care", "Astra Tech.", "Straumann", "Fria-
dent", "Calcitek”, "Paragon".
В России развитие зубных импланта-]
тов началось лишь в 1986 г. и до 1993 г.
главенствовала только одна конструк-]
ция плоского имплантата "ВНИИМТ".
С пояапением конструкций в форме
корня зуба "Контраст", "Плазма По-
волжья” начали прогрессивно разви-
ваться как производство новых видов,
так и рынок их. Однако статистиче-1
ских данных нет. Вместе с тем развитие
новых технологий отечественных кон-
струкций, распространение зарубеж-
ных систем вселяют большой опти-
мизм в будущем развитии зубной им-
плантации.
Рис. 1.50. Мини-имплантаты.
1 — “Dentatus"; 2 — *Steri-Oss"; 3 — "Imtex'.
СПИСОК ЛИТЕРАТУРЫ
. дбу Асали Эяд. Клинико-лабораторное
обоснование применения импланта-
тов при концевых дефектах зубного
ряда нижней челюсти: Авторсф. дис.
... канд. мед. наук. — М.. 1992. — 26 с.
2 Амрахов Э.Г. Сравнительная экспери-
ментально-клиническая оценка отече-
ственных внутрикостных имплантатов:
Автореф. дис. ... канд. мед. наук. —
М„ 1986. - 20 с.
3 Архипов В.Д. и др. Остеопластика де-
фектов нижней челюсти ауто- и алло-
генными трансплантатами // Респуб.
сборн. научн. трудов "Конструктивные
и реконструктивные костно-пластиче-
ские операции в челюстно-лицевой
области". — М., 1985. — С. 43—46.
4. Бажанов Н.Н., Тер-Асатуров Г.П.
Применение формализованных гомо-
костей при костной пластике дефек-
тов нижней челюсти: Метод, реко-
мендации. — М., 1975. — 28 с.
5. бапАг И. В. Состояние тканей протез-
ного ложа у больных с концевыми де-
фектами зубных рядов при лечении с
использованием имплантатов: Авто-
реф. дис. ... канд. мед. наук. — М,,
1990. - 22 с.
6. Безруков В.М., Черникис Ф.С., Су-
ров О.Н., Матвеева А.И. Применение
имплантатов в стоматологии: Метод,
рекомендации. — М., 1987. — 35 с.
7. Белецкий Б.И. Химико-биологиче-
ские принципы получения остеопро-
водимого композита БАК-1000 для
челюстно-лицевой хирургии. Приме-
нение биокомпозиционных материа-
лов в челюстно-лицевой хирургии и
стоматологии. — М., 1997. — С. 6—7.
8- Верченко Г.Н. Влияние хитозановой
губки, содержащей рекомбинантный
основной фактор роста фибробластов
на заживление полноалойных ран.
Применение биокомпозитных мате-
риалов в челюстно-лицевой хирургии
и стоматологии. — М., 1997. — С. 13.
“ Берченко Г.Н. и др. Использование
пластических материалов на основе
гидроксиапатита в качестве матрицы
для формирования костной ткани.
Применение биокомпозитных мате-
риалов в челюстно-лицевой хирургии
и стоматологии. — М., 1997. — С. 14.
*«• Брахман Г.Б. Имплантат из пластмассы
.лля пластического восстановления
альвеолярного отростка нижней че-
люсти (клинико-экспериментальное
исследование) // Вопросы примене-
ния пластических масс в медицине. —
М.: Медгиз. 1956. - С. 133-140
11. Бригаднова Л.Л Отдаленные результаты
костно-пластического устранения де-
фектов нижней челюсти // Конструк-
тивные и реконструктивные костно-
пластические операции в челюстно-ли-
цевой области. — М., 1985. — С 71—
74.
12. Варес Э.Я. Реакция соединительной
ткани на поли.метилмстакрилат в ре-
акциях тканей амфодонта на имплан-
тацию искусственных зубов: Авто-
реф. дис. ... канд. мед. наук. — М ,
1955. - С. 26.
13. Вигдерович В.А. Прогнозирование ре-
зультатов хирургического этапа ден-
тальной имплантации: Автореф. дис.
... канд. мед. наук. — М., 1991. — 24 с.
14. Вояожин А.И и др. Клиническая апро-
бация препарата на основе гидрокси-
апатита в стоматологии // Новое в сто-
матологии — 1993. — № 3. — С. 29—
31.
15. Воробьев В.А. Восстановление конце-
вых дефектов зубного ряда нижней
челюсти мостовидным протезом с
дистальной опорой на имплантат из
серебряно-палладиевого сплава: Авто-
реф. дис. ... канд. мед. наук. — Омск,
1988. - 21 с.
16. Гветадзе Р.Ш. Комплексная оценка
отдаленных результатов дентальной
имплантации: Автореф. дис. ... канд.
мед. наук. — М., 1996. — 25 с.
17. Гончаров И.Ю. Клинико-лабораторное
обоснование и оптимизагшя примене-
ния отечественных пластиночных им-
плантатов в стоматологической практи-
ке. Авторсф. дис.... канд. мед. наук. —
М., 1999. - 25 с.
18. Григорян А.С. и др. Некоторые свойст-
ва композиционного материала на ос-
нове полиакриламидного геля и гид-
роксиапола для пластики костных де-
фектов Ц Применение биокомпози-
ционных материалов в челюстно-ли-
цевой хирургии и стоматологии. —
1997. - С. 15.
19. Гюнтер В.Э., Монасевич Л.А., Пас-
каль К). И. и др. Мартенситные превра-
щения и эффекты памяти формы в
сплавах на основе TiNi // Междуна-
родная конференция "ICOMAT-77". —
Киев, 1979. - С. 128-132.
20. Гюнтер В.Э. Исследования эффектов
памяти формы в сплавах на основе
TiNi: Авторсф. дис. ... канд. физ.-мат.
наук. — Томск, 1981. — 18 с.
21. Понтер В.Э., Итин В. И.. Монасе-
вич Л.А. и др. Физико-механические
критерии разработки материалов с
памятью формы для медицины. —
Известия вузов. Физика. — 1989. —
№ 3. - С. 97-100.
22. Елисеев В Г, Варэс Э.Я. Эксперимен-
тальные наблюдения по имплантации
искусственных зубов, корней из пласт-
массы // Стоматология. — 1956. —
№ 1. - С. 50.
23. Железный П.А., Тулупова И.Г. Аллоар-
топластика височно-нижнечелюстного
сустава. Заболевания височно-нижне-
челюстного сустава // Сборник науч-
ных трудов МОНИКИ. - М„ 1989. -
С. 73-78.
24. Жусев А.И. Микроциркуляторные на-
рушения слизистой оболочки полости
рта и их коррекция при эндооссаль-
ной имплантации: Автореф. дис. ...
канд. мед. наук. — М., 1995. — 22 с.
25. Заплешко Н.Н., Валожин А. И. и др.
Экспериметгтально-клиническое обос-
нование применения синтезированно-
го гидроксиапатита при лечении сто-
матологических заболеваний // Новое
в техническом обеспечении стоматоло-
гии. — Екатеринбург, 1992. — С. 121 —
123.
26. Знаменский НИ. Хирургическая кли-
ника и техника имплантации искусст-
венных зубов // Материалы IV Пиро-
говского съезда. — СПб., 1891. — 9 с.
27. Иванов С.Ю., Ломакин М.В. Разработ-
ка и опыт применения отечественных
остеоинтегрируемых стоматологиче-
ских имплантатов системы "ЛИКо" //
Современные проблемы имплантоло-
гии. — Саратов, 1998. — С. 23—24.
28. Итин В.И. и др. Электромеханическое
поведение сплавов на основе никелида
титана. — Эффекты памяти формы
сверхпластичности и их применение в
медицине // Матер. 1 Всесоюзной кон-
ференции. — Томск, 1989. — С. 181.
29. Копейкин В.Н. и др. Структура, свой-
ства синтетических материалов "био-
ситалла" и "биоситакола" в экспери-
менте // Новое в стоматологии. —
1995. - № 21. - С. 25-27.
30. Кулаков А.А., Налапко В.И. Клиниче-
ское и математическое обоснование
конструкций отечественных пластин-
чатых имплантатов. Материалы сим-
позиума "Проблемы эффективности
стоматологической имплантологии". —
М., 1999.
31. Кулаков А.А. Хирургические аспекты
реабилитации больных с дефектами
зубных рядов при использовании раз-
личных систем зубных имплантатов:
Автореф. дис. ... д-ра мед. наук. —
М.,1997. - 27 с.
32. Кулаков О. Б. и др. Использование вин-
товых конструкций имплантатов из
циркония в стоматологии // Новые
концепции в технологии, производстве I
и применении стоматологических им-
плантатов. — Саратов. 1996. — С. 29—1
30.
33. Курдюмов С.Г., Воложин А.И. и др.
Создание новых биосовместимых]
препаратов — "гидроксиапол", "кола-1
пол" // Сборник научн. работ III Все-
рос. нац. конгресса "Человек и лекар-
ства". - М., 1996. - С. 31-32.
34. Леонтьев В. К. и др. Применение но- i
вых препаратов "гидроксиапол" и "ко*
лапол” в клинике // Стоматология. —
1995. - № 5. - С. 69-71.
35. Лосев Ф.Ф. Экспериментально-кли-
ническое обоснование использова-
ния мателиалов для направленной ре-
генерации челюстной костной ткани
при ее атрофии и дефектах разной
этиологии: Автореф. дис. ... д-ра мед.
наук. — М., 2000. — 36 с.
36. Локтев Н И. Трансплантация костной
ткани // Стоматология. — 1997. — I
№ 1. - С. 95-101.
37. Лесников В.Н., Верещагина Л.А., Лепи-
лин А.В. и др. Внутрикостные стомато-
логические имплантаты. — Саратов,
1997. - 87 с.
38. Массарский А.С., Суров О.Н. Зубные |
винтовые имплантаты системы "Кон-
траст” Ц Новое в стоматологии. —
1993. — № 3. — С. 41-45.
39. Матвеева А. И. Комплексный метод
диагностики и прогнозирования в
дентальной имплантации: Автореф.
дис. ... д-ра мед. наук. — М., 1993. —
36 с.
40. Матвеева А. И. и др. Применение оте-
чественных имплантатов в клинике ор-
топедической стоматологии // Метод,
рекомендации. — М., 1991. — 20 с.
41. Миргазизов М.З., Гюнтер В.Э.,
Итин В.И. и др. Сверхэластичные им-
плантаты и конструкции из сплавов с
памятью формы в стоматологии. I
Квинтэссенция. — М„ Берлин. Чика-
го и др. — 1993. — 231 с.
42. Мудрый СП. Использование вживлен-
ных корней зубов с приспособлением
для фиксации протеза: Автореф. дис. ...
канд. мед. наук. — Киев, 1956. — 12 с.
43. Мустафаев М Ш. Экспериментальная
апробация и клиническое применение
биорезорбирусмых мембран в ком-
плексном лечении переломов костей
лицевого скелета и при рсконструк- ’
тивных операциях: Автореф. дис. —|
д-ра мед. наук. — М., 1998. — 37 с.
44. Олесова В.И. Биохимическое изучение
распределения напряжений вокруг по- |
ристых и беспористых механических <
зубных имплантатов с памятью формы
Ц Материалы Российской конфе-
ренции "Имплантаты с памятью фор-
мы" — Томск. — 1992. - № 1. -
С. 50-52.
45 Олесова В Н. Двухмоментная имплан-
тация титановых цилиндрических им-
плантатов как метод подготовки по-
лости рта к мостовидному протезиро-
ванию концевых дефектов нижней че-
люсти // Материалы II региональной
конференции. — Кемерово, 1988. —
С. 50-54.
46. Олесова В.Н. Комплексные методы
формирования протезного ложа с ис-
пользованием имплантатов в клини-
ке ортопедической стоматологии: Ав-
тореф. дис. ... д-ра мед. наук. — Омск,
1993. - 45 с.
47. Орловский В.Ю., Курдюмов С. Г., Слив-
ка О.И. Синтез, свойства и примене-
ние гидроксиапатита кальция // Сто-
матология. — 1996. — Т. 5, № 5. — С.
68-73.
48. Параскевич В.Л. Применение порис-
тых дентальных имплантатов из тита-
на (отдаленные результаты клиниче-
ских наблюдений) // Новое в стомато-
логии. - 1996. - № 2-3. - С. 54-58.
49. Параскевич В.Л. Сравнительная оценка
двух типов внутрикостных импланта-
тов для восстановления концевых де-
фектов зубных рядов верхней челюсти
// Новое в стоматологии. — 1997. —
№ 4. - С. 23-26.
50. Панкратов А.С. Лечение больных с
переломами нижней челюсти с ис-
пользованием ОСТИМ-ЮО (гидро-
ксиапатита ультравысокой дисперсно-
сти) как стимулятора остеогенеза: Ав-
тореф. дис. ... канд. мед. наук. — М.,
1995. - 19 с.
51. Петрович Ю.Л. и др. Минеральный
обмен в ортопедических аллотранс-
плантатах, консервированных различ-
ными способами после их подсадки в
дефект нижней челюсти // Стомато-
логия. - 1992. - № 2. - С. 26-28.
52. Плотников Н.А. Костная пластика
нижней челюсти. — М.: Медицина,
1979.- 271 с.
53. Плотников Н.А., Сысолятин П.Г, Без-
руков В.М. Успехи и нерешенные во-
просы пересадки консервированных
тканей в челюстно-лицевой хируру-
гии // Проблемы аллопластики в сто-
матологии. — М., 1974. — С. 7—9.
54. Ретинская М.В. Клинико-эксперимен-
тальное обоснование применения
биоситалла для имплантации в лунку
удаленных зубов при непосредствен-
ном протезированнии: Автореф. дне.
... канд. мед. наук. — М., 1997. — 18 с.
55. Робустова Т.Г., Ушаков А.И., Абу Ава-
ли Эяд и др. Клинические, математи-
ческие, иммунологические аспекты
зубной имплантации: Метод, указа-
ния. — М., 1987. — 26 с.
56. Сидельников А.И. Планирование опе-
рации имплантации с учетом антро-
пометрических параметров лица: Ав-
тореф. дис. ... канд. мед. наук. — М„
1992. - 20 с.
57. Суров О Н. Зубное протезирование на
имплантатах. — М.: Медицина, 1993. —
205 с.
58. Сысолятин П.Г. и др. Замещение де-
фектов нижней челюсти консервиро-
ванной аллокостью // Стоматология. —
1976. - № 1. - С. 67—69.
59. Тимерханов Ф.Е., Гарафутдинов Д.М.
и др. Экспериментально-клиническое
применение никелид-титановых им-
плантатов с пористой цервикальной
шейкой при атрофии альвеолярного
отростка верхней челюсти // Новое в
стоматологии. — 1995. — С. 17—18.
60. Трофимов В.В., Дадыкина В.Ф. Приме-
нение внутрикостного якорного им-
плантата в ортопедической стомато-
логии: Метод, рекомендации. — Ан-
гарск, 1989. — 36 с.
61. Ушаков А. И., Давыдов А.Б., Белых С.И.
Применение композиционного остео-
индуктивного материала ППВ при
операциях на альвеолярном отростке
челюстей. — Материалы 4-й Между-
народной конференции челюстно-ли-
цевой хирургии и хирургической сто-
матологии. — СПб., 1999. — С. 154.
61а. Ушаков А.И., Елизарова Н.О., Ушако-
ва Т.М. Стоматологическая импланта-
ция. Современное состояние проблемы.
// Международный медицинский жур-
нал IMJ. - 1998 — № 3. — С. 250—
252.
62. Чепулис СП., Суров ОН., Черникис А.С.
Применение металлических импланта-
тов в стоматологии: Метод, рекоменда-
ции. — Каунас, 1984. — 23 с.
63. Adams Р. Ancharing means for false
teeth. US Patent N 2112007, March 22,
1938.
64. Anneroih G. et al. Tissue integration of
Al2OvCeramic dental implants (Frialit):
A case report // Swed. Dent. J. — 1990. —
Vol. 14. - P. 63-70.
65. Atilla G. A rare find in Anatolia. A Tooth
implant mid-sixth century. — J. Oral.
Implantol. — Vol. 19. N 1. — P. 54—57.
66. Babusch Ch. The use of platelet richt
plasma with implant reconstructive pro-
cedures. — Buenos Aires, Argentina,
71
1999. Intemaiional College Oral Im-
plants, World Congress.
67. Batkin B. Implant dentistry: Historical
overview with current perspective // J.
Dent. Educ. - 1988. - Vol. 32. N 12. -
P. 683-685.
68. Bays B. The pathophysiology and anato-
my of edentulous bone loss. — In: R.
Fonseca. W. Davis (cds). — Reconstruc-
tive preprosthetic oral and maxillofacial
surgery. — Philadelphia: WB Saunders,
1986. - P. 1-17.
69. Berman N. The physiologic and mechan-
ic aspects of the implant technique and
its application to practical cases // Dent.
Dig. - 1952. - Vol. 8. - P. 342.
70. Binon P, Sutler F., Beaty K.. Brunski J.,
Gulbransen H., Weiner R. The role of
screws in implant system // Int. J. Oral
Maxillofac. Implants. — 1994. — Vol. 9
(Suppl.). — P. 48—63.
71. Bobin J., Pillar R., Cameron H., Wea-
therly G. The optimum pore size tor the
fixation of porous-surfaced metal im-
plants by the ingrowth of bone // Clin.
Orthop. Rel. Res. - 1980. - Vol. 150. -
P. 236.
72. Bollen C., Papaioanno W. Eldere J. et al.
The influence of abutment surface rough-
ness on plaque accumulation and peri-
implant mucositis // Clin. Oral Impl.
Res. - 1995. - Vol. 7. - P. 201-211.
73. Boyne P. Use of freeze-dried homoge-
nous bone grafts in the surgical position-
ing of teeth // J. Oral Surg. — 1957. —
Vol. 15. - P. 231.
74. Branemark P.-l., Zarb O., Albrektsson T.
Tissue-integrated prostheses. Osseointe-
gration in clinical dentistry. — Chicago,
London, Berlin: Quintessence, 1985 —
P. 29.
75. Brerne J., d'Hoedt B., Schulte W., Wade-
witz V. Contribution to the functional sur-
face structure of endosseous implants //
Int. J. Oral Maxillofac. Impl. — 1991. —
Vol. 6. - P. 37-41.
76. Brunski J. Biomaterials and biomcchanis
in dental implant design // Int. J. Oral
Maxillofac. Impl. — 1988. — Vol. 3. —
P. 85-87.
77. Callan D., Rohrer M. Use of bovine-de-
rived hydroxyapatite in the treatment of
edentulous ridge defects: a human clini-
cal and histologic report // J. Pcriodon-
tol. - 1993. - Vol. 64. - P. 575-582.
78. Chercheve R. Implantation technique //
Inform. Dent. — 1963. — Vol. 45. —
P. 439.
79. Chung K., Salkin I... Stein M.. Freedman
A. Clinical evaluation of a biodegradable
collagen membrane in guided tissue re-
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
92.
93.
generation // J. Periodontol. — 1990. —
Vol. 61. - P. 732-736.
Cobb C., Eick J., Barker B. et al. Resto-
ration of mandibular continuity defects
using combinations of hydroxyapatite
and autogenous bone: microscopic obser-
vations // J. Oral Maxillofac. Surg. —
1990. - Vol. 48. - P. 268-275.
Cook S., Thomas K., Dalton J. et al. Hy-
droxyapatite coaling of porous implants
improves bone ingrowth and interface at-
tachment strength // J. Biomed. Mater.
Res. - 1992. - Vol. 26. - P. 989.
Dalton J., Cook S. In vivo mechanical1
and histological characteristics of HA-
coated implants may vary with coating
vendor // J. Biomed. Mater. Res. —
1993. - P. 39-245.
de Groot, Geesink R., Clein C. , Serecian P.
Plasma sprayed coatings of hydroxyapa-
tite // J. Biomed. Mater. Res. — 1987. —
Vol. 24. - P. 1375.
Driskell T. History of implants // J. Cal-
if. Dent. Assoc. — 1987. — Vol. 15. — P.
17.
Ellis E. Biology of bone grafting // Se-
lected readings in oral and maxillofacial <
surgery. - 1991. - Vol. 2. - P. 1-28. I
Fleming A. The endopore dental implant
system: Implant treatment simpliftedcd //
J. Canadian Dental Association. —
1994. - Vol. 60, N 9. - P. 785-789.
Eormiggini M. Implant alloplastic endo-
mascellary con vita metalliche cave //
Associazione Europa Odonto-Stomato-
logica per gli implanti. Atti del Siinposio
degli Implanti Aliosplastici. — 1955. —
P. 195.
Friberg B., Grondahl K., Lekholm U. A
new self-tapping Branemark implant:
clinical and radiographic evaluation //
Int. J. Oral Maxillofac. Impl. — 1992. —
Vol. 4, N 1. - P. 80-85.
Garret S., Martin M., Edelberg J. Treat-
ment of periodontol furcation defect.
Coronally positioned flaps versus dura
mater in class II defects // J. Clin. Period-
ontol. - 1990 - Vol. 17. - P 179-185.
Golec T., Krauser J. long-tenn retro-
spective studies on hydroxyapatite-coated
endosteal and subperiosteal implants //
Dent. Clin. N. Amer. — 1992. —
Vol. 1. - P. 39-65.
Greenfield E. Implation of artifical crown
and Bridge abutament Dent Cosmos. —
1913. — Vol. 25. — P 467.
Gross U. el al. The ultrastructure of the
interface between a glass ceramic and
bone // J. Biomed. Mater. Res. — 1981.
- Vol. 15. - P. 291-305.
Haack J., Sakaguchi R.. Sun T, Coffey J.
Elongation and preload stress in dental
implant abutment screws // Int. J. Oral
Maxillofac. Impl. — 1995. — Vol. 10. —
I’ 29-536.
94. Heimke G. The aspects and modes of fix-
ation of bone replacements. — In: G.
Heimke (Ed.). — Osseo-integrated im-
plants. Basics, materials and joint re-
placements. — Vol. I. Boca Raton (Fl):
CRC Press. 1990. - P. 9-30.
95. Hohman I)., Legal H. Application of tita-
nium alloys for orthopedic surgery //
Proc, of the fifth World conference on ti-
tanium. - 1984. - Vol. 2. - P. 1365—
1372.
%. Hulben S., Cooke S., Klawitter J. et al.
Attachment of prosthescs to the muscu-
loskeletal system by tissue ingrowth and
mechanical interlocking // J. Biomed.
Mater. Res. Symp. — 1973. — Vol. 4. —
P. 1.
97. Jansen И, Conrads G., Richter E. Micro-
bial leakage and marginal fit of the im-
plant-abutment interface // Int. J. Oral
Maxillofac. Impl. — 1997. — Vol. 12. —
P. 527-540.
98. Jarcho M. Calcium phosphate ceramics
as hard tissue prosthetics // Clin. Orthop.
Rel. Res. - 1981. - Vol. 57. - P. 259.
99. Jarcho M. Retrospective analysis of hy-
droxyapatite development for oral im-
plant application // Dent. Clin. North
Amer. - 1992. - Vol. 36. - P. 19-26.
100. Jemt T, Lanely Ж, Harris D. et al. Os-
seointegrated Implants for single tooth
replacement: a 1-year report from a mul-
ticenter prospective study // Int. J. Oral
Maxillofac. Impl. - 1991. - Vol. 7. -
P. 29-36.
101. Jensen J., Sindet-Pedersen S. Autogenous
mandibular bone grafts and osscointc-
grate implants for reconstruction of the
severely atrophied maxilla: A preliminary
report // J. Oral Maxillofac. Surg. —
1991. - Vol. 49. - P. 1277-1287.
102. Jensen J.. Nock D. Inferior alveolar nerve
repositioning in conjunction with lace-
ment of osseointegrated implants: a case
report // Oral Surg. — 1987. — Vol. 63. —
P. 263.
• 03. Jenson O., Perkins S., van de Water F.
Nasal fossa and maxillary sinus grafting
of implants from a palatal approach //
J. Oral Maxillofac. Surg. — 1992. —
Vol. 50. - P. 15-418.
* 94. Kent J., Misiek D. Biomatcrials for crani-
al, facial, mandibular and TMJ recon-
struction. — In: R. Fonseca, R. Walker
(eds ). — Oral and maxillofacial trauma.
Philadelphia: W.B. Saunders, 1991. — P.
781-1026.
* 9-5. Kirsch A. The two phase implantation
method using IMZ intramobily cylinder
implant /I J. Oral Impl. — 1983. _______
Vol. 11, N 2. - P. 197-210.
106. Kon S., Ruben M., Bloom A. et al. Regen-
eration of periodontal ligament using re-
sorbable and non-resorbable membranes.
Clinical, histological and histometric
study in dogs I I Int. J. Periodont. Rcstor
Dent. - 1991. - Vol. 11. - P. 58-41.
107. Lekovic И, Kenney E., Garranza F,
Manignoni M. The use of autogenous pe-
riosteal grafts as barriers for the treat-
ment of class II furcation involvements
in lower molars // J. Periodontol. —
1991. - Vol. 62. - P. 775-780.
108. Lemons J., Bidez M. Endosteal implants
biomaterials and biomechanics. — In: R.
McKinny (Ed). — Endosteal implants. Bi-
omaterials and biomechanics. — St. Louis:
Mosby - Year Book, 1991. - P. 28-36.
109. Leventhal G. Titanium, a metal for surgery
// J. Bone J. Surg. - 1951, N 33A. -
P. 473.
110. Lew I. Progress in implant dentistry: an
evaluation // J. Amer. Dent. Assoc. —
1959. - Vol.59. - P. 478-492.
111. Lewis S., Beumer J., Peni G., Homburg W.
Single tooth implant supported restora-
tions // Int. J. Oral Maxillofac. Impl. —
1988. - Vol. 3. - P. 25-30.
112. Lindquist L.. Carlsson G., Glantz P Re-
habilitation of edentulous mandible with
a tissue-integrated fixed prosthesis //
Quintessence Int. — 1987. — Vol. 18. —
P. 89-96.
113. Linkow L. The Blade-vent — a new di-
mention in endosseous implants // Dent.
Cone. - 1968. - Vol. 11. - P. 3.
114. Linkow L. The pcss-fit anti-rotational
vent-plant cylinder implant // J. Oral
Impl. - 1995. - Vol. 21, N 1. - P. 40-
45.
115. Linkow L. Intra-osseous implants utilized
as fixed bridge abutments // J. Oral Im-
pl. Transpl. — 1964. — Vol. 10. — P. 17.
116 Lum L., Beime O., Cunis D. Histologic
evaluation of hydroxyapatite-coated ver-
sus uncoated titanium blade implants in
delayed and immediatelly loaded applica-
tions // Int. J. Oral Maxillofac. Impl. —
1991. - Vol. 6, N 4. - P. 456-462.
117. Magnusson L, Batich C., Collins B. New
attachment formation following con-
troled tissue regeneration using biode-
gradable membranes // J. Periodontol. —
1988. - Vol. 59. - P. 1-6.
118. Meriscke-Stem R. Oral tactile sensibility
recorded in overdenture wearers with im-
plants or natural roots: a compcrative
study. Part 2 // Int. J. Oral Maxillofac.
Impl. - 1994. - Vol. 9, N 1. - P. 63-
70.
119. Misch C. Density of bone: effect on
treatment plans, surgical approach, heal-
ing and progressive bone loading // Int.
J. Oral Maxillofac. Impl. — 1990. —
Vol. 6. - P. 23-31.
120. Misch C., Ridcz M. Occlusion and crestal
bone resorption: etiology and treatment
planning strategies for implants. — In: C.
McNeill (ed ). Science and practice of
occlusion. — Chicago: Quintessence,
1997. - P. 474-486.
121. Misch C., Hoar G., Beck G. et al. A bone
quality-based implant system: A prelimi-
nary report of stage I & stage II // Impl.
Dent. - 1998 - Vol. 7. - P. 35-42.
122. Misch C., Judy K. Classification of par-
tially edentulous arches for implant den-
tistry // Int. J. Oral Maxillofac. Impl. —
1987. _ Vol. 4 - P. 7-12.
123. Misch C.E, Misch CM. Generic termi-
nology for endosseous implant prostho-
donics I I J. Prosthet. Dent. — 1992. —
Vol. 68. - P. 809-812.
124. Murakami I. Scanning electron micro-
scopic study on bone and microvascula-
ture surrounding titanium implants //
J. Jpn. Prosthodont. Soc. — 1995. —
Vol. 39. - P. 123-124.
125. Muratory G. Personal system osseous im-
plants with screw-in surfaces // [Italian]
Dent. Cadm. (Milano). — 1964. —
Vol. 32. - P. 746.
126. Nyman S, Gottlow J., Kamng T., Lindhe J.
The regenerative potential of the perio-
dontal ligament: An experimental study
in the monkey // J. Clin. Periodonlol. —
1982. - Vol. 9. - P. 257-265.
126a. Osborn J., Kovacz E.. Kallenberger A.
H ydroxysapatitkeramik- Entwicklung eines
neucn Biowerkstffes und erste tierexperi-
mentellc Ergebnisse // Dtsch. Lahn-
deztl. - 1980. - Vol. 35. - P. 54.
127. Pasqualini U. Anathomic-pathologic re-
ports and clinico-surgical deductions
from 91 alloplastic implants in 28 experi-
mental animals [Italian] // Riv. Ital. Sto-
mat. - 1963. - Vol. 18. - P. 3.
128. Patterson E., Johns R. Theoretical analy-
sis of the fatigue life of fixture screws in
osseointegrated dental implants // Int. J.
Oral Maxillofac. Impl — 1992. —
Vol. 7. - P. 26-33.
129. Pilliar R., Lee J., Maniatopoulas C. Ob-
servations on the effect of movement on
the bone ingrowth into porous-surfaced
implants// Clin. Orthop. Rel. — 1986. —
Res. 208. - P. 108.
130. Pitaru S, Tai H., Soldinger M. et al. Col-
lagen membranes prevent the apical mi-
gration of epithelium during periodontal
wound healing // J. Periodont. Res. —
1987. - Vol. 22. - P. 331-333.
131. Pitaru S., Tai H., Soldinger M. et al. Par-
tial regeneration of periodontol tissues
using collagen barries. Initial observa-
tions in the canine // J. Periodontol. —
1968. - Vol. 59. - P. 380-386.
132. Probster L., Freesmeyer Ж Das Fem-
rontgenseitenbild in der praimplantolo-
gischen Diagnostik // Z. Zahnanztl.
Impl. - 1989. - N 5. - S. 55.
133. Scialom J. A new look at implants. A for-
tunate discovery: needle implants // Inf.
Dent. - 1962. - Vol. 44. - P. 737.
134. Spiekermann H., Donath K., Hassell T.
et al. Color Atlas of Dental Medicine
Implantology. — New York: Thieme,
1995. - P. 14, 59-76.
135. Steinemann S., Perren S. Titanium alloys
as metallic biomaterials / Proc, of the
fifth World conference on titanium. —
1984. - Vol. 2. - P. 1327-1334.
136. Strock A. Experimental work on a meth-
od for the replacement of missing teath
by direct implantation of a metal support
into the alveolus // Amer. J. Orthodont.
Oral Surg - 1939. - Vol. 25. -
P. 467-472.
137. Thompson-Neal D., Evans G., Meffert R.
Effects of prophilactic treatments on tita-
nium, sapphired and hydroxyapatite-coat-
ed implants: An SEM study // Int. J. Pa-
radont. - 1989. - Vol. 9. - P. 300-
301.
138. Tramone S. A further report on intraos-
seous implants with improved drive screw
// J. Oral Impl. Transpl Surg. — St.
Louis, 1965. - Vol. 11. - P. 35.
139. Urist M Bone transplants and implants. —
In: M. Urist. - Fundamental and clini-
cal bone physiology. — Philadelphia:
Lippincott, 1980. — P. 331.
140. Vargas E., Baier R., Meyer A. Reduced
corrosion of CP Ti and Ti-6A1-4V alloy
endosseous dental implants after glow-dis-
charge treatment: a preliminary report //
Int. J. Oral Maxillofac. Impl. — 1992. —
Vol 7, N 3. - P. 338-344.
141. Wagner J., Perel M. A resorbabie bone-
fill and its uses in implant procedures //
Dent. Implantol. Update. — 1992. —
VoL 3. - P. 89-93.
142. Valen M. The relationship between en-
dosteal implant design and function.
Maximum stress distribution with com-
puter-formed, three dimensional Flexi-
Cup blades // J. Oral Impl. — 1983. —
Vol. 11. - P. 49-71.
142a. Watzek G. Endoosseous Implants: Scin-
tifio and Clinacal Aspects. — Chicago:
Gunt. P.Co.. 1996 - P. 407.
143. Wang R., Fenton А. Применение тигана в
ортопедической стоматологии // Квинт-
эссенция. — 1997. — № 1. — С. 7—13.
144- If'eiss Ch. Tissue integration of dental
endosseous implants: Description and
comparative analysis of the fibro-osscous
integration and osseous integration systems
// J. Oral Impl. - 1986. - Vol. 12.
P. 169-214.
145. Wennerberg A., Albrektsson T, Andersson B.
Design and surface characteristics of 13
commercially available oral implant sys-
tems // Int. J. Oral Maxillofac. Impl. —
1993. - Vol. 8, N 6. - P. 622-633.
146. Worthington P. Current Implant usage //
J. Dent. Educ. — 1989. — Vol. 52,
N 12. - P. 692-695.
147. Yung Y., Han C., Lee К. A I year radio-
graphic evaluation of marginal bone
around dental implants // Int. J. Oral
Maxillofac. Impl. — 1996. — Vol. 11. —
P. 811-818.
148. Zaner D., Yukna R., Malinin T. Human
freeze-dries dura mater allografts as a
periodontal biological bondage // J. Per-
iodontol. — 1989. — Vol. 60. — P 617—
623.
149. Zitz/nann N., Naef R., Scharer P. Resorb-
able versus nonresorbable membranes in
combination with Bio-Oss for guided
bone regeneration // Int. J. Oral Maxil-
lofac. Impl. — 1997. — Vol. 12. — P
844-852.
150. Симпозиум по проблемам тканевых
банков с международным участием. —
М 2001. - С. 160.
151. 16" Annual Meeting Academia Os-
seointegration. March 22—24, 2001. —
Toronto, Canada.
152. The European Market Executive Summary
// ID. - 2001. - Vol. 10, N 1. - P. 5-8.
Глава 2
ПАТОМОРФОЛОГИЧЕСКИЕ ОСНОВЫ ЗУБНОЙ ИМПЛАНТАЦИИ*
Зубная имплантация вызывает естест-
венную реакцию живых тканей на чу-
жеродное тело. Эта реакция возможна
в чрезвычайно широких пределах — от
биологической совместимости и при-
живления до хронического воспаления
и отторжения. Во всех случаях имплан-
тация сопровождается определенными
морфологическими изменениями в
тканях челюсти, периосте и слизистой
оболочке полости рта. В то же время
химическая среда в живых тканях спо-
собна значительно влиять на характе-
ристики материала самого имплантата.
В принципе влияние биологической
среды и имплантата следует считать
взаимным.
С биологической точки зрения воз-
можны несколько вариантов прижив-
ления имплантата в кости. В каждом
случае между его поверхностью и ко-
стью образуется разный контактный
слой, который может быть образован
рубцовой, фиброзной, фиброкостной
или новой костной тканью.
Фиброзная ткань образуется при
травматичной остеотомии и прежде-
временной или чрезмерной нагрузке
на имплантат. Причина стойкости вновь
образованной фиброзной ткани в ее
медленной дифференцировке по срав-
нению с быстрой перестройкой кости.
Не имея адгезивных свойств, фиброз-
ная ткань создает вокруг имплантата
фиброзную капсулу, толщина которой
может быть различной. Многие годы
ученые полагали, что приживление
имплантата в полости рта происходит
за счет такого инкапсулирования фиб-
розной тканью, а образовавшаяся кол-
лагеновая ткань соединяет имплантат с
костью подобно прободающим (шар-
пеевским) волокнам и как бы натяги-
• Приношу глубокую благодарность докто-
Fy медицинских наук, профессору, лауреату’
осударственной премии В.П. Туманову за
ценные консультации при написании данной
главы.
76___________
вает кость, вызывая ее нормальную
функцию и непрерывный рост. Фиб-
розная интеграция была одним из
обоснований для применения плоских
имплантатов Linkow, Weiss. По этой
причине их поверхность специально
делали неровной; она имела изгибы и
отверстия, чтобы кость могла врасти в
эти детали конструкции [2, 150, 219].
Доминировавшее представление о
надежности соединения имплантатов с
помощью фиброзной ткани поколеба-
ли результаты морфологических иссле-
дований и многолетних экспериментов
Р.-1. Branemark, G. Zarb, Т. Albrektsson
и др. Их наблюдения и клинический
опыт показали, что фиброзная ткань
неспособна быть надежной опорой им-
плантата, так как при образовании ее
наблюдается ранняя эксфолиация, и
максимальный срок функционирова-
ния имплантата при такой опоре со-
ставляет 10 лет [65]. С таким категорич-
ным выводом не согласен L. Linkow.
Сконструированные им плоские им-
плантаты нередко успешно функцио-
нировали в течение 25 лет. По его мне-
нию, важно, чтобы контактный слой
фиброзной ткани был максимально
тонким (не более 125 мкм), и тогда им-
плантат можно считать остеоинтегри-
рованным [151]. Свидетельство о воз-
можности остеоинтеграции плоских
имплантатов получено также в экспе-
риментах, проведенных L. Lum [152]
на обезьянах, которым ставили пло-
ские имплангаты с гидроксиапатит-
ным покрытием для двухэтапного ле-
чения. Гистологически выявлено обра-
зование прямого костного контакта,
т.е. остеоинтеграция, даже при нагруз-
ке сразу после операции. Единствен-
ным условием развития остеоинтегра-
ции в таких случаях было шинирова-
ние имплантатов с соседним непод-
вижным зубом.
Отдельным видом приживления пло-
ских имплантатов Linkow и Weiss счи-
тают фиброкостную интеграцию, при
которой вместе с фиброзной тканью об-
разуется прямой костный контакт, глав-
ным образом благодаря прорастанию
новой костной ткани в отверстия на те-
ле имплантата. В этом случае в комби-
нации фиброзной ткани с костной на
долю последней, как считает L. Linkow,
должно приходиться до 22 % площади
опоры тела имплантата. Ch. Weiss [219]
полагает, что нормальную функцию
плоским имплантатам в зубных проте-
зах одинаково надежно обеспечивает
как костная, так и фиброкостная инте-
грация и характер соединения с костью
зависит от видов имплантатов: в одних
случаях, особенно при одноэтапном ле-
чении, может иметь место фиброкост-
ная, в других — чисто костная интегра-
ция. По мнению этого автора, при фиб-
рокостной интеграции опорный слой
благодаря упругости фиброзной ткани
приобретает свойства физиологическо-
го амортизатора, подобно волокнам пе-
риодонта, для прилагаемых сил жева-
ния [218]. Однако гистологическое
подтверждение образования вокруг им-
плантатов волокон с такой функцио-
нальной ориентацией не получено. По-
давляющая часть доказательств способ-
ности фиброзной ткани обеспечивать
плоским имплантатам должную опору
базируется главным образом на стати-
стических результатах имплантации, а
не на глубоких исследованиях морфо-
генеза. Как полагает J. Bruncky [61],
фиброинтеграция недостаточно изуче-
на для того, чтобы делать выводы.
М. Block и J. Kent [55] считают непра-
вильным проводить аналогию функцио-
нирования образованной при импланта-
ции фиброзной ткани с периодонтом.
Новым в морфогенезе зубной им-
плантации стало открытие возможно-
сти добиваться сращения кости с им-
плантатами при помощи плотной со-
единительной ткани или прямого со-
единения с костью. Архитектура и со-
став кости соответствовали ее нор-
мальному строению (рис. 2.1, I). Пер-
выми это наблюдали Р.-l. Вгапешагк и
соавт. [63, 64], Т. Albrektsson и соавт.
[36]. Открытие было сделано в ходе
экспериментов с имплантатами в форме
корня зуба из титана, его сплава и тан-
тала. Исследования, проводимые на без-
зубых собаках, показали стабильность
таких имплантатов с функционирую-
щими протезами в течение 10 лет без
каких-либо отрицательных явлений со
стороны как костной, так и мягкой
ткани. Более того, после завершения
клинического наблюдения попытки
удалить имплантаты натолкнулись на
большие трудности. Потребовалось
сильно повредить окружавшую их
кость, тогда как кость, находившаяся в
непосредственном контакте с поверх-
ностью имплантата, осталась неповре-
жденной. Это послужило основанием
для введения P.-I. Вгапешагк в научную
терминологию понятия "остеоинтегра-
ция", которое означает структурное и
функциональное соединение живой
кости с поверхностью несущего на-
грузку имплантата. Вывод этот осно-
вывался на полученном в ходе много-
летних экспериментов большом объе-
ме морфологических данных, которые
в дальнейшем были подтверждены и
клинически как достаточно точно от-
ражающие прочное соединение кости
с имплантатом (рис. 2.1, II).
2.1. Морфологические
особенности заживления
костной раны
Стадии заживления костной раны по-
сле постановки имплантатов соответ-
ствуют общим закономерностям ос-
теоинтеграции кости челюстей при их
переломах [53]. Однако в ходе изуче-
ния морфогенеза на эксперименталь-
ных моделях и в организме больного
было установлено, что приживление
зубных имплантатов может иметь оп-
ределенные особенности под влияни-
ем свойств их материала [103], качеств
кости, объема и специфики хирургиче-
ских манипуляций, особенно с костью,
а также под влиянием других факто-
ров. Процесс заживления костной ра-
ны при зубной имплантации проходит
три основные стадии: воспаления,
пролиферации и заживления. Эти ста-
дии могут сочетаться друг с другом, но
в каждый период одна из них домини-
рует (см. рис. 2.1, II).
Стадия воспаления начинается как от-
вет на оперативное вмешательство и на-
Рис. 2.1. Заживление кости.
I — состав кости при заживлении после им-
плантации: 1 — минеральное всшсство. 2 —
органическое вещество, 3 — вода |Babusch Ch.,
2001); II — биология остеоинтсгрании по Brane-
mark IBrancmark P.-I. et al., 1985).
a — соотношение размеров резьбы имплантата и костного ложа: I — плотный контакт между
имплантатом и костным ложем. 2 — гематома в замкнутой полости, образующейся между им-
плантатом и костью, 3 — кость, подвергшаяся неизбежной при остеотомии температурной и ме-
ханической травме, 4 — изначальная нетравмированная кость, 5 — имплантат; б — заживление
костной ткани: 6 —трансформация гематомы в костную ткань, 7 — реваскуляризация, де- и рс-
минерализация кости; в — прямой контакт новообразованной кости с поверхностью имплантата:
8 — реконструкция пограничной зоны кости под воздействием нагрузки; г — отсутствие остео-
интеграции и образование между костью и имплантатом нсминсрализованной соединительной
ткани: 9 — неминерализованная' соединительная ткань.
хождение в тканях чужеродного тела —
имплантата. Обычно стадия воспале-
ния продолжается до 10 дней, но ино-
гда бывает более длительной. Развитие
затяжной воспалительной реакции у
отдельных пациентов может быть отра-
жением индивидуального ответа тка-
ней на имплантат как на инородное те-
ло. На стадии воспаления в своем
единстве проявляются основные фено-
мены защитных реакций организма —
альтерация, экссудация и пролифера-
ция. Еще в 1985 г. P.-I. Branemark ус-
тановил, что введенный в костное ло-
же имплантат вступает в контакт с
клетками и внеклеточной жидкостью и
в ответ на повреждение тканей разви-
вается альтерация. Ес всегда следует
рассматривать как диалектическое
единство изменений, вызванных по-
вреждением клеточных структур, и за-
щитных ответных реакций клеток и
организма в целом |26|. Для альтера-
ции в зоне постановки имплантата
наиболее характерны разнообразные
биохимические и морфологические
изменения, протекающие главным об-
разом в виде местных сосудистых реак-
ций, некроза тканей в очаге пораже-
ния, а также реакции интегральных ре-
,1Яторных систем всего организма,
[равную роль в таких реакциях играют
вазоактивные и хемотаксические ве-
щества. Они обусловливают выражен-
ность воспаления, зависящую от кон-
центрации бактериальных гематтрак-
тантов, попадающих во внутреннюю
среду организма вместе с имплантатом.
Развивающаяся в ответ клеточная коо-
перация и доминирующая в этом про-
цессе роль макрофагов, активизация
системы комплемента влияют на сте-
пень дистрофии клеток, зону некроза и
высвобождение из погибших тканей
биологически активных веществ [28].
В силу этого во время альтерации на-
ступают дистрофические изменения
клеток и межклеточного вещества, ко-
торые ведут к быстрой адсорбции про-
теинов на поверхности имплантата. На
фоне адсорбции протеинов плазмы
крови происходит активизация и агре-
гация тромбоцитов, усиление коагуля-
ции каскадного характера, выделение
цитокинов, неспецифические и специ-
фические клеточные реакции и реак-
ции макрофагов. Однако установить
ранние проявления процессов экссуда-
ции и альтерации трудно, так как уже
в первые 5—7 дней могут доминиро-
вать репаративные процессы (185].
Быстрая адсорбция протеинов на по-
верхности имплантата ведет к освобож-
дению лизосомальных протео-, глико-
и липолитических ферментов. Они в
свою очередь разрушают мембраны
клеток на поверхности кости и межкле-
точные структуры (коллаген, протео-
гликаны и гликозаминогликаны) [141,
142]. Ферментативная деградация про-
теинов вызывает структурные измене-
ния, нарушение окислительно-восста-
новительных процессов. В результате
этого накапливаются кислые продукты
и жирные кислоты. Органические ки-
слоты подвергаются окислению.
Ферментативные процессы, веду-
щие к разрушению клеток и межуточ-
ного вещества, инициируют медиато-
ры воспаления. Одновременно возни-
кает тканевый ацидоз и повышается
осмотическое давление. Продукты, на-
капливающиеся в контактной зоне им-
плантат — кость, ведут к нарушениям
гомеостаза, изменению проницаемо-
сти сосудов. Именно эти изменения
свидетельствуют о переходе от одного
феномена защитной реакции — альте-
рации к другому, который характери-
зуется экссудацией и клеточной ин-
фильтрацией.
Под воздействием медиаторов вос-
паления, тканевого ацидоза и повыше-
ния осмотического давления в зоне по-
вреждения происходит раздражение
чувствительных нервов. Это вызывает
расширение артериол и развитие вос-
палительной артериальной гиперемии.
Ускоряется кровоток, увеличивается
артериальное давление в сосудах. Как
феномен защитной реакции экссуда-
ция выражается в нарушении гемоди-
намики. Воспалительная артериальная
гиперемия увеличивается. Нарушается
отток крови и лимфы.
Определенное влияние на этот про-
цесс оказывают серотонин и гистамин.
Замедление кровотока, усиление экс-
судации и увеличение внутритканевого
давления способствуют активизации и
агрегации тромбоцитов, что ведет к ло-
кальному тромбозу. Контакт элемен-
тов крови с инородным телом — им-
плантатом вызывает коагуляционные и
цитокинетические изменения в тка-
нях, что отчетливо наблюдалось при
сканирующей электронной микроско-
пии [164]. Коагуляция крови наиболее
выражена в тех местах, где остаются
пустые пространства между костью и
имплантатом. Там отмечается скопле-
ние застойного кинина как результат
нейромедиаторной вазодилатации и
расширения сосудов, а также их повы-
шенной проницаемости. Вследствие
набухания эндотелиальных клеток на-
рушается их сократительный аппарат и
они принимают круглую форму. Аци-
доз ведет к повышению гидрофильно-
сти тканевых коллоидов, главным об-
разом коллагеновых волокон, отчего
стенки мелких сосудов ослабляются и
кровоток в них замедляется. Это в
свою очередь обусловливает развитие
престаза и затем стаза; важную роль в
этих процессах играют как тромбооб-
разование, так и компрессия сосудов.
Замедленный кровоток и стаз вызыва-
ют нарушения свертывания крови, что,
с одной стороны, усиливает фибрино-
лиз, а с другой — активизирует систему
комплемента, вследствие чего плаз-
менные медиаторы воспаления регули-
руют защитные функции организма.
На воспалительной стадии прижив-
ления имплантата проявляется актива-
ция комплемента, в основном фрак-
ций С3 и С$, из которых последняя яв-
ляется сильнодействующим хемотак-
сическим фактором, опосредованно
стимулирующим секрецию протеоли-
тических ферментов нейтрофильных
лейкоцитов [176]. Фракции компле-
мента Су и С5 и значительная активи-
зация их при имплантации отражают
физиологическую ответную реакцию
системы комплемента на присутствие
имплантата, которая может быть как
положительной, так и отрицательной.
Многие исследователи видят в данной
реакции в одних случаях быстрое про-
явление неадекватной костной адапта-
ции, в других — возникновение адек-
ватной реакции через какое-то время,
связывая это с последовательностью
включения медиаторов в процесс вос-
паления [40, 125].
Экссудация и усиление отека в зоне
повреждения, как правило, развивают-
ся вследствие повышения проницаемо-
сти сосудов. Отек играет защитную
роль, но прогрессивно увеличивает
кровяное давление в венулах и осмоти-
ческое давление в околососудистых
тканях. Это влияет на адгезию лейко-
цитов к эндотелию и последующую ми-
грацию их в очаг повреждения. Мигра-
ция лейкоцитов происходит как через
межэндотелиальные щели, гак и через
цитоплазму самой эндотелиальной
клетки. Чем сильнее выражено воспа-
ление в области костного ложа и им-
плантата, тем выше скорость миграции
и число лейкоцитов. Одновременно
процесс миграции лейкоцитов в очаг
воспаления и их активная работа ведут
к сокращению срока их жизни и быст-
рой замене новыми. Движение лейко-
цитов при воспалении всегда имеет
четкую направленность в зону наибо-
лее поврежденных тканей. При им-
плантации они сосредоточиваются в
костно-мозговых пространствах, а так-
же между костью и поверхностью им-
плантата. Степень воспалительной ре-
акции при имплантации в значитель-
ной мере зависит от содержимого ней-
трофильных лейкоцитов — азурофиль-
хо_____
ных и специфических гранул. При бла-
гоприятном течении раневого процесса
уже на 3-й лень после постановки им-
плантата восстанавливается кровообра-
щение в зоне хирургического повреж-
дения тканей. Клетки костного мозга и
иммунные клетки, обнаруженные на
поверхности имплантатов, дают адек-
ватную воспалительную реакцию [187].
Метаболические изменения клеток
(фибробластов, остеобластов и др.)
приводят к относительной гипоксии.
Усиленное кислородное голодание
создается у краев раны. Состояние ги-
поксии в ране в комбинации с опреде-
ленными биологически активными ве-
ществами, такими как фактор роста
фибробластов и тромбоцитарный фак-
тор роста, стимулируют процесс ан-
гиогенеза. При этих процессах активи-
зируется гидролиз ферментов — колла-
генов и плазминогенов, что в свою
очередь способствует растворению ба-
зальных мембран сосудов. Последнее
стимулирует развитие кровеносных со-
судов, которые прогрессивно увеличи-
ваются.
Вначале воспалительные изменения
клеток носят неспецифический харак-
тер и проявляются в виде миграции
нейтрофильных лейкоцитов в зону по-
врежденной кости. Они активно фаго-
цитируют и переваривают остатки био-
логических веществ и клеток поражен-
ных тканей. Уменьшается количество
эозинофилов, которые также фагоци-
тируют, но уже вступая в контакт с
комплексами антиген—антитело. На-
правленная миграция нейтрофильных
лейкоцитов — хемотаксис — создает
миграцию из внутрисосудистого про-
странства во внесосудистое, и их фаго-
цитарная деятельность стимулирует
лимфообращение. Благодаря движе-
нию лимфы продукты нейтрофилов и
эозинофилов эвакуируются из очага
воспаления. Хемотаксис стимулирует
миграцию лейкоцитов, ведет к концен-
трации их в зоне воспаления, создавая
клеточный инфильтрат.
Демаркационная зона воспаления
проявляется формированием клеточно-
го вала [28]. Определенное влияние на
этот процесс оказывает ряд компонен-
тов плазмы крови (калликреин, актива-
тор плазминогена, фибринпептид В»
фракции комплемента) и клетки очага
воспаления, прежде всего макрофаги.
Если в очаге повреждения нет чуже-
родных антигенов, то возможно разви-
тие асептического воспаления. На сме-
ну скоплениям лейкоцитов приходят
измененные антигены и макрофаги,
которые заполняют зону повреждения
и активно ограничивают зону воспале-
ния. На 3—4-й день после операции
приходится пик миграции нейтро-
фильных лейкоцитов. Их фагоцитар-
ное действие сопровождается выбро-
сом в ткани лизосомальных гранул как
медиаторов воспаления, а также выхо-
дом последних во внешнюю среду при
разрушении фагоцитов. Нейтрофиль-
ные лейкоциты функционируют во
взаимодействии с другими клетками —
эозинофилами, лимфоцитами, моно-
цитами, лаброцитами.
В стадии воспаления первая, барьер-
ная, функция клеток сменяется специ-
фическими реакциями, в которых
главную роль играют лимфоциты и мо-
ноциты. Их действие начинается наб—
7-й день после постановки импланта-
та. Вначале специфические иммуноло-
гические реакции идут параллельно с
неспецифическими. Это выражается в
том, что в раневом очаге увеличивается
число Т- и В-клеток, Ts- и Тх-клеток, а
также макрофагов. Все клеточные по-
пуляции реагируют на специфические
антигенные субстанции, такие как ма-
териал зубной бляшки, представлен-
ный бактериями, и на резидентную
микрофлору, попавшую в очаг воспа-
ления в момент операции. Вступая в
реакции с микробными агентами, им-
мунокомпетентные клетки и макрофа-
ги выполняют регулирующую, воспа-
лительную, цитотоксическую функции.
Важную роль в воспалительных кле-
точных реакциях тканей на введенный
имплантат играют макрофаги. Они по-
являются на 5—6-й день после опера-
ции, образуясь из циркулирующих в
крови моноцитов. На отдельных участ-
ках поверхности имплантата, особенно
в местах неплотного контакта с костью,
располагается небольшое количество
макрофагов. Вместе с тем иногда на
этих участках сохраняется большое ко-
личество гигантских клеток. Сохране-
ние таких клеток, как клетки инород-
ных тел, может считаться отрицатель-
ным прогностическим признаком и
свидетельствует о неудачной импланта-
ции. Макрофаги в большинстве своем
проявляют фагоцитарную активность,
поглощая и переваривая различные
биологические частицы. В эксперимен-
тах на животных обнаружены фагоци-
тированные фрагменты титана, хрома,
молибдена, которые не вызвали ати-
пичных изменений клеток, тогда как
фагоцитированные частицы кобальта,
никеля и сплав кобальта с хромом спо-
собствовали значительным изменениям
клеток. Эти материалы также вызывали
воспалительный ответ иммунной систе-
мы и других медиаторов воспаления:
лизосомальных ферментов, простаглан-
динов, системы комплемента, лимфо-
кинеза [185] (схема 2.1).
В конечном счете реакцию макро-
фагов на имплантат можно считать ос-
новной функцией ткани [35].
В завершающей стадии воспаления
(стадии регенерации) может образо-
ваться ткань, мало отличающаяся от
исходной, или образоваться соедини-
тельная ткань более плотной структу-
ры. Этот процесс наиболее выражен в
кости, где происходит ее резорбция и
реконструкция как ответ на введение
имплантата и костная рецессия [166].
Происходящие при этом неспецифи-
ческие и специфические клеточные
реакции всегда связаны как между со-
бой, так и с лимфообращением и раз-
витием лимфокинезов. Это обусловли-
вает особенности иммунологической
реакции в процессе приживления им-
плантата. Реконструкция кости и при-
живление имплантата зависят от реак-
ции тромбоцитов, эндотелиальных
клеток, макрофагов и остеобластов. В
процессе заживления раны и форми-
рования кости основное значение име-
ют плазма крови (инсулиноподобный
фактор роста), остеобласты надкост-
ницы. Состояние последних во многом
зависит от содержания костных про-
теинов, определяющих костную ин-
дукцию и непосредственно реакцию
костных клеток и клеток костного моз-
га, что обусловливает те или иные осо-
бенности реконструкции кости. Клет-
ки костного мозга через гемопоэз регу-
лируют воспалительные неспецифиче-
Схема 2.1. Прямое и непрямое воздействие имплантата на макрофаги (Ray 'Г., 19Х6|
Прямое воздействие
Непрямое воздействие
Имплантат (металл)
Макрофаг
Антиген (имплантат)
В-лимфоцит
Фибробласт
Фиброгенез
\Ч Деградация
\ ферментов
Медиаторы
воспаления
Антитело
Т-лимфопит
Лимфокинез
Макрофаг
Восстановление
Комплекс анти-
ген-антитело +
+ комплемент
Деградация
ферментов:
кислых гидролаз,
нейтральных
\ протеаз
Хемотаксический
фактор
Медиаторы
воспаления
Восстановление
ские и иммунные реакции, оказывая
таким образом влияние на костную
индукцию. Отдельные металлы могут
нарушать этот процесс, приводя к ме-
таллодеструкци и.
Стадия пролиферации. Дифференци-
ровка клеток и восстановление трофи-
ки ткани свидетельствует о начале за-
живления костной раны. Стадия про-
лиферации может продолжаться до
6 нед, а первые изменения могут по-
явиться уже на 3—4-й день после опе-
рации. На стадии пролиферации про-
исходят репаративные регенерацион-
ные процессы, которые выражаются в
следующих клеточных реакциях: в но-
вообразовании сосудов, дифференци-
ровке и пролиферации клеток, произ-
водстве экстрацеллюлярного матрикса.
Эти изменения обнаруживаются в
большей степени на участке соедини-
тельной ткани, прилегающем к ино-
родному телу (имплантату). В этой зоне
продолжаются разнообразные клеточ-
ные изменения, проявляющиеся в виде
как неспецифических, так и специфи-
ческих реакций. Среди последних раз-
личают регулирование процессов адге-
зии, клеточную пролиферацию, обра-
зование новых сосудов, усиление син-
теза коллагена, регулирование костно-
го метаболизма и миграцию клеток в
разных районах очага воспаления [ 184J.
В разнообразных тканевых процес-
сах при приживлении имплантата ве-
лика роль региональных, в основном
поднижнечелюстных, лимфатических
узлов. Они обусловливают дифферен-
цировку клеток вообще и эпителиза-
цию раны в частности, в том числе
рост эпителия и его ороговение (эпи-
дермальный фактор роста). Большое
значение имеет также реакция крове-
творной системы, от которой зависит
активизация гомеостаза. Развитие и
анастомозирование сосудов ведет к
восстановлению локальной микроцир-
куляции и улучшению кислородного
обеспечения тканей. Затем происходит
последующее прогрессирование кро-
веносных сосудов, т.е. доставка тканям
питательных веществ и кислорода, что
необходимо для репаративной регене-
рации соединительной ткани. Одно-
временно эти процессы ведут к сниже-
нию секреции факторов роста и разви-
тию кровеносных сосудов.
Из репаративных процессов на ста-
пни пролиферации наблюдается ре-
конструкция незрелых элементов со-
единительной ткани. Формирование
молодой соединительной ткани прохо-
,11(Г несколько этапов: новообразова-
ние молодой грануляционной ткани,
формирование и перестройку рубцо-
воЙ ткани [29]. Отмечается последова-
тельная реорганизация тканей: образо-
вание специфических клеточных попу-
ляций, органического матрикса и его
минерализация.
В процессе остеоинтеграции глав-
ную роль в формировании костной
ткани играют остеобласты [83, 186J.
Стадия регенерации. Динамика раз-
вития в контактной зоне кость — им-
плантат сосудистых реакций, за кото-
рыми следует образование костного
вещества, доказана многими экспери-
ментальными исследованиями с при-
жизненным наблюдением за прижив-
лением имплантатов [33, 44, 63, 64].
Этот процесс, наблюдаемый уже в пер-
вую неделю после имплантации, дос-
тигает пика на 3—4-й нед. Стабилиза-
ция длится 6—8 нед. В последующие
недели и месяцы вокруг ненагружен-
ных имплантатов медленно происхо-
дят некоторая конденсация кости и
стабилизация ее кровеносной системы
[39]. В результате реорганизации тка-
ней образуется костная мозоль, со-
стоящая из волокнисто-хрящевой и
костной ткани. По мнению Т. Alberkts-
son [39], этот процесс подобен эндо-
хрящевому окостенению. Центры
образования кости располагаются в
секреторных матричных везикулах, ос-
вобождающихся от остеобластов. Па-
раллельно поверхности титанового им-
плантата формируются матрицы, бога-
тые ионами фосфата и кальция, фер-
ментами щелочной фосфатазы и фос-
фолипазы. Вблизи и непосредственно
на поверхности имплантата отмечают-
ся остеоциты. Кроме того, в этой же
т°не находятся участки неминерализо-
ванной кости [202, 203].
Улучшение трофики и доставка ки-
слорода стимулируют местную гемоди-
намику и циркуляцию крови, что спо-
собствует дальнейшей реконструкции
•Сости. Новообразованная кость, как
Правило, не дифференцирована, но
Постепенно она реконструируется [25].
На завершающем этапе происходит
минерализация новообразованной ко-
стной ткани. Минерализации кости
вокруг остеоинтегрированного им-
плантата всегда предшествует активи-
зация энергетических процессов, кото-
рая связана как с васкуляризацией, так
и с повышенным содержанием кисло-
рода в тканях. Минерализация кости
проявляется образованием основного
вещества с хондроитинсульфато.м и
синтезом коллагена при помощи гли-
козаминогликанов, с накоплением
кальция. Высвобождение неорганиче-
ского фосфата и выпадение фосфата
калия дает возможность формирова-
ния кости. В других случаях костная
минерализация может выражаться в
кальцификации хряща и образовании
незрелой кости или минерализации
пластинчатой кости. Кальцификация
хряща и образование крупнопетлистой
кости происходит через матричные ве-
зикулы, а в пластинчатой кости отло-
жение кристаллов выявляется в колла-
геновых волокнах и межуточном веще-
стве. В кристаллизации принимают
участие коллагены, фосфолипиды и их
фосфатная группа, в минерализации —
такие хилаты, как хондроитинсульфат,
кальцийсвязывающие белки — остео-
кальцин и костный протеин 2, карбо-
нат кальция [212].
Начавшийся еще в стадии пролифе-
рации процесс замены некротизиро-
ванной в результате остеотомии новой
костной тканью завершается на стадии
реконструкции. На этом этапе судьба
новообразованной кости во многом за-
висит от нагрузки на имплантат. В
многочисленных исследованиях рас-
крываются особенности патоморфоза
тканей при имплантации в зависимо-
сти от разных нагрузок, хотя плотный
контакт кости с имплантатом имеет
место как при нагрузке, так и в ее от-
сутствие и гистологически в том и дру-
гом случае кость по своей структуре
однотипна. Находящаяся в контакте с
имплантатом без нагрузки кость отли-
чается большим числом костномозго-
вых пространств и питательных кана-
лов губчатого вещества. Нагруженные
же имплантаты окружены более плот-
но сформированной костью. Только на
отдельных участках вблизи питатель-
Рис. 2.2. Морфология имплантации
[Spikermann Н. et al., 1995].
а — винтового имплантата Branemark;
б — плоского имплантата Linkow.
ных каналов кости обнаруживаются
бескостные зоны. Это подтверждено
гистологически и морфометрически в
экспериментах на обезьянах [178]. Од-
нако и у человека на удаленном винто-
вом имплантате, подвергавшемся на-
грузке в течение 7 лет, также отмечено
наличие компактной ламеллярной
кости с большим количеством костных
канальцев и остеонов. При морфомет-
рическом анализе удаленного имплан-
тата установлено, что 86,69 % его по-
верхности находилось в прямом кон-
такте с костью. Наиболее утолщенные
участки новообразованной компакт-
ной кости располагались на вершинах
витков резьбы. Минерализованную
кость от поверхности имплантата отде-
лял очень тонкий слой неминерализо-
ванного материала (рис. 2.2). Такой же
материал выявлен на границах остео-
идной ткани [179]. В отличие от таких
результатов наблюдения при экспери-
ментальном изучении костного мор-
фогенеза с имплантатами "1MZ" в пе-
риод от 2 до 24 нед обнаружено не за-
висящее от нагрузки постоянное уве-
84_______
личение плотного соединения кости с
поверхностью имплантата |140]. По
мнению многих авторов, последний
факт соответствует общим положени-
ям о реконструкции кости при зажив-
лении переломов челюсти [98, 99, 146].
В результате дифференцировки ме-
зенхимальных клеток в фибробласты и
остеобласты и цитогенеза из тромбо-
цитов, макрофагов и других клеток об-
разуются внеклеточные матрицы, со-
стоящие из коллагена, гликопротеи-
нов, гликолипидов, гликозаминогли-
канов и других ферментов. Незрелые
матрицы кости подвергаются реконст-
рукции, что вызвано резорбцией и де-
понированием кости. Реконструкция
незрелых матриц кости, связанных с
резорбцией и депонированием кости,
происходит в ответ на наличие в тканях
имплантата и на нагрузку, которую он
несет, а также на физиологическую ко-
стную рецессию. Такую резорбцию
кости ряд исследователей расценивают
как показатель приживления имплан-
тата [86]. Другие же в этом такого при-
знака не видят [91]. Тем не менее при
хорошей адаптации имплантата в ста-
щи регенерации костного ложа мезен-
химальные клетки на его поверхности
дифференцируются и заполняют уча-
стки поврежденной или неповрежден-
ной кости.
Одновременность процессов ре-
зорбции и оссификании во вновь об-
разованной композиционной ткани
выявил в эксперименте на животных
G. Wahl [216, 217]. При сцинтиграфии
было установлено непрерывное сни-
жение костного метаболизма, а через
12 нед после имплантации отмечено
развитие равновесия между резорбци-
ей и построением кости в контактной
зоне имплантат — кость. В результате
этих изменений происходило полное
костное ремоделирование и зона но-
вой незрелой кости интимно связыва-
лась с окружающей губчатой костью.
На завершающем этапе новообразо-
ванная костная ткань минерализова-
лась. Процесс минерализации кости
протекал со скоростью около 1 мм в су-
тки [1071.
2.2. Морфологические
особенности контактной зоны
кость—имплантат
Остеоинтеграция металлических им-
плантатов включает формирование
ацеллюлярного аморфного контактного
слоя между имплантатом и живой ко-
стью, т.е. между аллопластической по-
верхностью имплантата и минерализо-
ванной костной матрицей. Гетероген-
ность этого слоя может отражать мно-
г°ступенчатые стадии непрерывного
процесса ремоделирования ткани [178].
В экспериментах на крысах К. Murai и
соавт. [163], S. Hollister и соавт. [118]
показали, что у молодых особей обра-
зуется больше костной ткани, соедине-
ние имплантата с костью представляет
собой толстый аморфный слой; у
взрослых особей на поверхности им-
плантата отмечалась хорошо развитая
соединительная ткань. Варианты обра-
зованного контактного слоя, помимо
отражения его возраста, могут нести
Па себе отпечаток возраста всего орга-
низма.
На ультраструктурном уровне кон-
тактный слой отличается от минерали-
зованной костной матрицы или остео-
идной ткани [103]. Хотя биохимически
данный слой детально не изучен, гис-
тологические наблюдения in vivo и in
vitro показывают, что он богат протео-
гликанами и гликопротеинами [97,
195]. Это подтвердили результаты им-
мунологических проб. Наличие остео-
протеина и агНЗ-гликопротеина стало
свидетельством участия протеинов ос-
теобластной матрицы в образовании
контактного слоя. Считается, что это
зона, богатая гликопротеином бескол-
лагенной клеточной матрицы, напоми-
нающей линии костного цемента |94,
97, 175].
Поскольку некальцифицированный
район в контактной зоне связывают с
процессами деминерализации [97, 134,
135] или со сравнительной незрело-
стью контактного слоя, есть основание
предположить, что между формирую-
щейся костью и титаном, а также гид-
роксиапатитным покрытием имплан-
тата имеется органический контакт-
ный слой, частично образованный из
экстрацеллюлярного матрикса, соз-
данного остеобластами [94, 135]. Такой
контактный слой у имплантатов с гид-
роксиапатитным покрытием может
иметь одинаковую аморфную зону тол-
щиной от 200 до 1000 нм, отделяющую
поверхность имплантата от коллагено-
вой матрицы [97, 172]. Структурные
различия в композиции контактного
слоя титана и гидроксиапатитного по-
крытия можно объяснить наличием у
последнего сравнительно высокой ре-
активности.
К одним из главных феноменов об-
разования контактного слоя кость —
имплантат относится процесс неова-
скуляризации, который является важ-
нейшей детерминантой полного фор-
мирования кости после хирургических
манипуляций. Формирование новых
сосудов происходит от границ хирур-
гического вмешательства к телу им-
плантата внутри неплотной соедини-
тельной ткани, образующейся вначале
в микропромежутках его поверхности
[176]. Новые сосуды сохраняются и не
резорбируются в процессе костной ре-
генерации [222]. В то же время, если
условий для неоваскуляризации нет,
формирование кости может значитель-
но задержаться [ 155).
Важным вопросом остеоинтеграции
является быстрое формирование сет-
чатой кости после постановки имплан-
тата. Процесс минерализации требует
достаточного количества клеток и вы-
сокого уровня биосинтетической ак-
тивности для формирования протеи-
новой матрицы. В результате исследо-
ваний in vitro и in vivo установлено, что
грубые поверхности имплантатов спо-
собствуют созданию остеобластной
матрицы [154], клеточному делению
[56] и в некоторой степени изменению
фенотипа [43, 60, 156].
Определенную роль в клеточных
взаимодействиях на поверхности им-
плантатов играют макрофаги. Они
прикрепляются к имплантатам из ти-
тана как с покрытием из гидроксиапа-
тита, так и без такового [76, 105, 196).
В контексте остеоинтеграции вопросу
контроля одноядерных клеток при
формировании и ремоделировании
кости должного внимания еще не уде-
лялось, возможно, потому, что в ос-
новном исследователей интересует та
роль, которую играют макрофаги в ка-
честве промежуточного звена при об-
разовании фиброзной ткани [221].
Вопрос о завершении остеоинтегра-
ции сложный, точных и конкретных
критериев еще не выработано. Обяза-
тельным условием приживления им-
плантата является прикрепление к его
поверхности остеобластов или праро-
дительских костных клеток [147]. Про-
цесс остеоинтеграции развивается бы-
стрее всего в первые 12 нед после по-
становки имплантата [104, 121]. Имен-
но в этот период вместо "плетеной"
кости может образоваться соедини-
тельная ткань. На этом этапе процесс
остеоинтеграции идет быстрее у им-
плантатов с гидроксиапатитным по-
крытием, чем без такого покрытия.
Как показали эксперименты, прижив-
ление имплантата и его закрепление в
кости продолжаются 1 год [129], а у
людей — по крайней мере 3 года [223].
Формирование и реконструкция кости
служат как развитию, так и сохране-
нию остеоинтеграции [108]. О возмож-
ном состоянии контактного слоя через
7 лет функционирования имплантата
из титана может свидетельствовать
гистологический анализ, проведенный
после его удаления. Близко к его по-
верхности обнаружена компактная ла-
минарная кость со множеством кост-
ных канальцев и остеонов. Она оказа-
лась особенно утолщенной вокруг ре-
бер резьбы. При сильном увеличении
между костью и титаном наблюдался
небольшой полый промежуток. С по-
мощью гистохимической реакции уда-
лось обнаружить, что минерализован-
ная кость отделена от поверхности ме-
талла очень тонким слоем неминера-
лизованного, окрашенного в красный
цвет материала. Окраска была такой
же, как и у остеоидной ткани: тонких
пограничных слоев остеоидной ткани
и костных клеток (остеоциты). Даже
при удалении скомпрометированного
имплантата вследствие перелома опор-
ной головки обнаружено плотное со-
единение конструкции с костью. По-
следняя относилась к спонгиозному
типу, а также в отдельных биоптатах
отмечались дистрофические явления в
костных структурах [9]. Значительно
расходятся мнения о том, каким может
быть процент прямого контакта кости
с площадью имплантата при заверше-
нии остеоинтеграции, поскольку све-
дения о максимальных размерах кон-
такта противоречивы. В одних случаях
при гидроксиапатитном покрытии со-
общалось о 100 % контакте [95, 97], в
других экспериментах этот показатель
не превышал 65—85 % [48, 70,139, 180].
2.3. Морфологические
особенности приживления
титановых имплантатов
Течение процесса остеоинтеграции за-
висит от ряда факторов. Наиболее оче-
видно влияние на приживление и ха-
рактер тканевой интеграции имплан-
татов физических и химических
свойств их материалов [34, 187]. Раз-
ные материалы неодинаково влияют
на остеоинтеграцию. Если в первый
месяц такие различия еще не проявля-
ют себя полностью, то в последующие
недели воздействие материала на ос-
теоинтеграцию усиливается. Экспери-
ментируя in vivo на животных и вводя
в их костную ткань тантал и титан,
Р -1. Branemark и соавт. (65], Т. А1-
brektsson и соавт. (41] с помощью спе-
циально разработанной оптики наблю-
дали динамику изменений в тканях
микроваскулярной системы кровенос-
ного русла, ее структуры и функции.
В дальнейшем в экспериментах с
другими металлами и их сплавами бы-
ла подтверждена интеграция кости с
металлической поверхностью. Наибо-
лее адекватный остеогенез отмечен
при использовании титана (41,65, 209].
В частности, эксперименты показали,
что к технически чистому титану кость
прирастает гораздо прочнее, чем к
сплаву титана с алюминием и ванади-
ем. Кроме того, установлено, что час-
тицы технически чистого титана по
сравнению с кобальто-хромовыми час-
тицами вызывают значительно
большую активизацию воспалительных
посредников, участвующих в резорб-
ции кости [130]. Имплантаты из техни-
чески чистого титана полностью ин-
корпорируются в кость, и минерализи-
рованная ткань полностью конгруэнт-
на с микронеровностями на их поверх-
ности. Именно этот факт P.-I. Brane-
mark считал главным, предопределяю-
щим остеоинтеграцию при зубной им-
плантации (см. рис. 2.2, а). Аналогич-
ные данные получили М.З. Миргази-
зов, М.А. Меликян [18] у титановых
пористых имплантатов с эффектом па-
мяти формы.
Помимо материала, приживление
имплантатов зависит от особенностей
мест их постановки, включая количе-
ство и качество имеющейся там кости,
а также от пропорциональности их
опоры на кортикальную и губчатую
кость. Идеальные условия для поста-
новки имплантатов и адекватного мор-
фогенеза создаются при достаточном
количестве губчатого вещества и плот-
ной структуре кортикального вещества
кости (47]. От качества кости зависит
Не только первоначальная стабиль-
ность имплантата, но и непосредствен-
но регенерация кости. При одинако-
®°й стабильности новая костная ткань
Вокруг имплантата образуется быстрее
т°гда, когда площадь контакта костных
клеток с его поверхностью больше.
Вакную роль при этом играет порис-
тость кости, т.е. ее анатомическое
строение. Так, при гистологическом ис-
следовании имплантатов, удаленных в
одинаковые сроки после их приживле-
ния, отмечено, что при мелкоячеистой
губчатой кости на площадь ее контакта
с телом имплантата приходилось 74,5 %
и заполнение новой костной тканью
составило 18,4 %, тогда как у имплан-
татов, поставленных в крупноячеистую
губчатую кость, соответствующие по-
казатели составили 33,9 и 6 % [206].
Качество кости имеет прямую связь
с состоянием костного мозга. Уже при
первых исследованиях (63] реакции
тканей на зубной имплантат в костном
мозге отмечались морфологические
изменения, главным образом наруше-
ния гемодинамики под влиянием ме-
ханических или химических воздейст-
вий. Установлено, что микроваскуля-
ризация в костном мозге интимно свя-
зана с процессами приживления им-
плантата. Об этом свидетельствовали
изменения как в самом костном мозге,
так и в его лакунах. При последующих
экспериментах, проведенных по ори-
гинальной методике прижизненных
наблюдений за состоянием костного
мозга у мышей после введения им им-
плантата, помимо прямого контакта с
ним кости, обнаружены участки реге-
нерированного костного мозга. Неко-
торые клетки его имели морфологиче-
ские характеристики макрофагов и ги-
гантских .многоядерных клеток. Все
это свидетельствовало о прямом уча-
стии костного мозга в длительно про-
текающих процессах интеграции им-
плантата в кости [183].
Остеоинтеграция находится в прямой
зависимости от площади прямого кон-
такта кости с имплантатом [75]. Это
связано прежде всего с тем, что при
большей площади вероятность микро-
движений имплантата меньше и лучше
обеспечивается его плотное соединение
с костью. Высказывается мнение, что
на остеоинтеграцию могут влиять раз-
меры имплантата, его диаметр и длина.
Однако экспериментально это не под-
тверждено. При разных формах и раз-
мерах титановых имплантатов количе-
ство кортикальной кости в их контакт-
ной зоне было фактически одинако-
вым. Это позволило сделать вывод, что
геометрия титановых конструкций за-
метного влияния на остеоинтеграцию
не оказывает [32, 41].
В то же время в эксперименте уста-
новлено, что плошадь прямого контак-
та новой кости в значительной мере за-
висит от материала имплантата. Срав-
нение имплантатов из технически чис-
того тигана, виталлиума и сплава тита-
на с алюминием и ванадием показало,
что разница в контакте может быть
значительной — от 18,5 до 78 % по-
верхности имплантата. Следует учиты-
вать, что у одного и того же имплантата
плошадь прямого контакта в корти-
кальной и губчатой кости может быть
разной. Что касается влияния на при-
живление имплантатов топографии их
поверхности, то при исследованиях
оно отмечается неизменно. Это легко
прослеживается при остеоинтеграции
имплантатов с плазменным титановым
покрытием.
При лабораторных исследованиях
на клеточном уровне отмечено, что ос-
теобласты более чувствительны к изме-
нениям поверхности материала, чем
фибробласты [80, 81]. Также в лабора-
торных условиях in vivo установлено,
что топография поверхности имплан-
тата влияет на минерализацию 118, 79].
Проведенные in vivo исследования у
людей показали, что на полированных
поверхностях, хотя клетки прикрепля-
ются к ним активно, новой костной
ткани образуется меньше. Шерохова-
тость поверхности имплантата ускоря-
ет образование кости, так как способ-
ствует созданию остеобластной матри-
цы [154], клеточному делению [56] и до
некоторой степени изменению фено-
типа [43, 156, 207]. В связи с этим ак-
тивизируется процесс формирования
губчатой кости после постановки им-
плантата, который требует достаточно-
го количества клеток и высокой био-
синтетической активности для произ-
водства протеиновой матрицы, необ-
ходимой для минерализации. Однако
изучение клеточной пролиферации и
биосинтеза протеина в ходе лаборатор-
ных экспериментов in vitro свидетель-
ствует о том, что в таких искусствен-
ных условиях топография поверхности
материала большой митогенной роли в
остеогенезе не играет.
Для процесса остеоинтеграции
большое значение имеет также физи-
ко-химическая реакция поверхности
материала имплантата на культуру кле-
ток [7]. В лабораторных условиях уста-
новлено, например, что имплантация
ионов на поверхность платины или
сплава палладиума уменьшает клеточ-
ную активность и выраженность ток-
сических реакций [122, 123]. Имплан-
таты высвобождают ионы, которые мо-
гут влиять на дифференцировку клеток
в контактной зоне кость — имплантат
in vivo [123], но неизвестно, какие по-
следствия для клеток могут иметь ме-
сто при воздействии ионов на поверх-
ность имплантата.
На остеоинтеграции отражается так-
же возраст организма. В эксперименте
у молодых крыс при одинаковых усло-
виях формировалось больше новой кост-
ной ткани, чем у взрослых особей. У
молодых животных контакт с костью
был опосредован толстой аморфной зо-
ной, тогда как у взрослых особей на по-
верхности имплантатов обнаружена хо-
рошо развитая соединительная ткань
|121, 163].
Ускорять или замедлять остеоинте-
грацию могут различные физические
факторы. По данным сканирующей
микроскопии, обработка поверхности
цилиндрических имплантатов ультра-
фиолетовыми лучами и потоком разря-
дов радиочастоты ускоряет их прижив-
ление в период до 3 мес. В это время
происходит как образование новой
кости в пространстве между импланта-
том и стенками костного ложа, так и
замена ею некротизированной кости,
что подтверждают обычные морфоло-
гические и ультраструктурные иссле-
дования. Разницы в темпах оконча-
тельного заживления у обработанных и
необработанных имплантатов не обна-
ружено. Тем не менее высказывается
предположение, что обработка ультра-
фиолетовыми лучами и потоком разря-
дов радиочастоты может ускорять при-
живление имплантатов [34, 66]. Столь
же положительное влияние оказывает
гипербарическая оксигенация [168]. В
эксперименте при ее применении от-
мечено усиление синтеза коллагена,
активности остеобластов и остеокла-
стов. Также в эксперименте ускорение
костной интеграции выявлено при по-
крытии имплантатов зольно-гельным
титаном (TiOj) и предварительной об-
работке титановых имплантатов пере-
кисью водорода, что, как предполага-
ется, ускоряет гидролиз и делает по-
верхность имплантатов биоактивной.
Ускоряет остеогенез обработка титана
различными лазерами. Так, А.И. Воло-
шин и соавт. |7] установили значение
поверхности имплантата для его остео-
интеграции с костью. Остеоинтеграция
происходит более активно при обра-
ботке поверхности эксимерным и COj-
лазером. Губчатая кость развивается
быстрее у поверхности титановых им-
плантатов, обработанных лазером. Со-
единение его с костью бывает более
плотным. Характерно появление уже
через 15 дней большого числа остео-
бластов, а к 30-м суткам намечались
участки прямого контакта костных
трабекул с имплантатом. Спустя 60 сут
после имплантации вокруг конструк-
ции была видна костная пластина тол-
щиной 500—700 мкм. Некоторые ме-
дикаменты могут активизировать фор-
мирование фибробластов. В экспери-
менте наблюдалось более активное об-
разование их в контактирующей кости
у имплантатов, обработанных перед
постановкой 0,12 % раствором хлор-
гекседина [67].
На приживление имплантата отри-
цательно влияет радиационное воздей-
ствие. Прижизненное изучение сосу-
дистой реакции кроликов на титано-
вые имплантаты, установленные после
ионизирующего облучения, показало,
что радиация привела к повреждению
сосудов и усилению лейкоцитарной
инфильтрации. В капиллярах умень-
шался поток крови. Наибольшее раз-
рушение наблюдалось в капиллярах и
венулах, меньшее — в артериолах 1124).
Определенную тревогу у исследовате-
лей вызывало возможное влияние ти-
тана на общие функции организма, по-
скольку при заглублении имплантата в
костное ложе неизбежны трение его о
прилегающую кость и снятие с его по-
верхности микрочастиц металла. При
специальном экспериментальном ис-
следовании установлено, что вначале
эти частицы титана оставались на кон-
тактирующей с имплантатом поверхно-
сти кости, но через 5 мес там они не об-
наруживались и были зарегистрирова-
ны во внутренних органах. Больше все-
го микрочастиц титана оказалось в лег-
ких, значительно меньше — в почках и
печени. Был сделан вывод, что в силу
микронных размеров частиц их пере-
нос был клеточным и переносчиками
служили макрофаги. Однако, посколь-
ку титан нетоксичен и хорошо перено-
сится организмом, такие малые кон-
центрации его не угрожают внутрен-
ним органам [192].
Приживление имплантатов зависит
также от их биомеханической нагрузки
[143|. Высказывается мнение, что ха-
рактер морфологических изменений в
послеоперационном периоде обуслов-
ливается главным образом биомехани-
ческой стабильностью имплантатов,
которая в свою очередь зависит от ряда
факторов, в том числе от качества кос-
ти, конструкции имплантата, микро-
морфологии его поверхности, ее кон-
груэнтности с костным ложем [98]. Это
подтверждается результатами экспери-
ментальных [36] и клинических [65, 76]
исследований. Ранняя нагрузка подав-
ляет образование кости в зоне контак-
та имплантата с поверхностью костно-
го ложа. Кроме того, длительная ран-
няя нагрузка усиливает воспалитель-
ную реакцию в зоне костного ложа,
вызывая резорбцию кости и инкапсу-
ляцию самого имплантата [9].
На гуморальные и клеточные реак-
ции влияет температурное воздействие
во время формирования ложа имплан-
тата. С повышением температуры кос-
ти возрастает число гигантских клеток
инородных тел [115]. При температуре
выше 41 *С кровеносные сосуды, ток
крови, жировые клетки и костные бал-
ки начинают претерпевать значитель-
ные изменения, а нагрев до 52 *С при-
водит к перманентной остановке кро-
вотока и некрозу тканей. Эксперимен-
тально выявлено, что при работе в кос-
ти бором предельно безопасной явля-
ется температура до 47 ’С [102]. Этот
же предел температурного нагрева кос-
ти установлен с помощью электронно-
микроскопического исследования при
различных работах непосредственно на
имплантатах, в том числе при их элек-
трополировке 1194]. Обнаружено воз-
действие охлаждения при работе бора-
ми, которое может быть внутренним
(через бор) или внешним. Как показа-
ли эксперименты, под влиянием охла-
ждения остеопластическая резорбция
кости через 4 нед возрастает до 0,5 мм
в компактном веществе и до 0,18 мм в
губчатом, причем на гуморальные и
клеточные реакции внешнее охлажде-
ние влияет более адекватно, чем внут-
реннее. В то же время при остеотомии
в глубоких отделах кости внутреннее
охлаждение влияет на ткани более по-
ложительно. Однако через 8—12 нед
ремоделированная контактная зона
кости становится одинаковой незави-
симо от вида охлаждения [115].
Характер приживления имплантата
в значительной степени зависит от хи-
рургических действий при остеотомии
для его постановки: откидывания сли-
зисто-надкостничных лоскутов, мани-
пуляций с костью, слизистой оболоч-
кой и надкостницей [24]. Даже при ос-
торожных и щадящих действиях нельзя
избежать повреждения кости и на по-
верхности костного ложа всегда обра-
зуется слой омертвевшей кости. К по-
вреждению сосудов, помимо перегрева
кости, может привести излишнее трав-
мирование тканей при остеотомии за
счет трения и других механических
воздействий. Вызванное этим наруше-
ние кровоснабжения находящихся в
контакте с имплантатом тканей может
стать причиной его инкапсуляции или
отсутствия оссификации [38]. Кроме
того, практически невозможно добить-
ся идеального прилегания поверхности
имплантата к кости, вследствие чего
между костью и имплантатом неизбеж-
но образуются отдельные пустоты. Все
это сказывается на остеогенезе.
На заживлении костной ткани отра-
жается травматичность операции на
мягкой ткани, так как сохранение це-
лостности периоста и локального кро-
воснабжения обеспечивает хорошее
функционирование остеобластов. Од-
нако гистологические и морфометри-
ческие результаты экспериментов с не-
медленной имплантацией на живот-
ных показали, что на интеграцию в бо-
лее значительной степени, чем травма
мягкой ткани, влияет анатомическая
локализация вмешательства [174].
При всей очевидности разницы во
мнениях относительно того, что боль-
ше и что меньше влияет на конкретные
стороны динамики морфологических
изменений при внутрикостной зубной
имплантации, все исследователи счи-
тают, что характер сращения тканей с
имплантатом, хотя и в разной степени,
но всегда напрямую зависит от им-
плантируемого материала, формы и
конструкции имплантата, количества и
качества кости, хирургических мани-
пуляций при постановке имплантатов,
нагрузки в зубных протезах и гигиены
полости рта.
На остеоинтеграцию имплантатов
могут влиять ферменты, действующие в
первой стадии воспаления после остео-
томии. Лизосомальные протео-, глико-
и липолитические ферменты накапли-
ваются в молодых клетках кости и вне-
клеточном матриксе и регулируют фиб-
риллогенез, нейтрализуют действие ор-
ганических эфиров фосфорной кисло-
ты и способствуют минерализации. В
результате репаративной регенерации
возникает ткань, мало отличающаяся
от исходной, или за счет созревания со-
единительной ткани формируются бо-
лее плотные структуры. Наиболее ак-
тивно этот процесс выражен в кости,
где происходят резорбция и депониро-
вание, а также реконструкция как от-
вет на введение имплантата и костная
рецессия. Иначе говоря, имеет место
полная регенерация. Она может быть
идеальной, когда происходит плотное
сращение кости с имплантатом, и тогда
ее называют остеоинтеграцией. В дру-
гих случаях отмечается процесс рубце-
вания, при котором наступает фиброз-
ное срашение — фиброинтеграция.
Процесс, протекающий на этом этапе,
достаточно сложный и не статичный, а
динамичный [39]. Фиброинтеграция и
остеоинтеграция — это последователь-
ные фазы одного и того же процесса.
Его течение зависит от ряда клиниче-
ских факторов, т.е. от бального (в част-
ности, от защитных реакций его орга-
низма) и от физических и других фак-
торов, таких как сам имплантат.
В интеграции тканей и имплантата
важную роль играет дифференцировка
клеток. Непрерывно растут и диффе-
ренцируются остеобласты. Развитию
остеобластного фенотипа способствует
ряд факторов: понижающее регулиро-
вание пролиферации, биосинтез, орга-
низация коллагеновой внеклеточной
матрицы I типа и ее минерализация.
Добавление к изолированным остео-
бластам гормонов и факторов роста
кардинально нарушает процесс проли-
ферации и непосредственно экспрес-
сии генов. Изменения касаются прежде
всего способности клеток образовывать
остеоидную ткань, которая впоследст-
вии претерпевает структурную и функ-
циональную перестройку [223]. Если в
начале приживления воспалительная
реакция выражается в биохимических
процессах, то наступающая затем диф-
ференцировка клеток указывает на со-
единение имплантата и кости. В кон-
тактирующей с имплантатами кости
ткань характеризуется неоднородно-
стью процессов. При исследованиях в
одних препаратах красные клетки крови
располагались между поверхностью им-
плантата и слоем ткани, состоящей из
обызвествленной и декальцинирован-
ной кости и небольшой зоны с отдель-
ными вкраплениями титана и слоем
аморфного материала. В других же пре-
паратах определялась ткань, состоящая
из коллагеновых волокон, а рядом с
ней отдельные фрагменты титана и де-
кальцинированная кость. Слой аморф-
ного материала располагался между
коллагеновой тканью и имплантатом.
Контактному слою кость—имплантат
свойствен ряд функциональных черт:
I) молекулярной абсорбции; 2) клеточ-
ной адгезии; 3) адгезии минерализован-
ной матрицы у поверхности импланта-
та; 4) модуляции ремодулирования кос-
ти и таким путем сохранения кости на
поверхности имплантата; 5) контроля
остеокондуктивности; 6) контроля
Роста кристаллов; 7) модуляции пере-
дачи нагрузки от имплантата к кости
Хозяина.
Контактная зона имплантатов не
бывает однородной. Гистологический
анализ свидетельствует о наличии по
крайней мере трех типов морфологии
контактного слоя, к которым L. Linder
И соавт. [148], Т. Albrektsson и соавт.
[42] относят: 1)бесклеточную и аморф-
ную бесколлагеновую зону толщиной
около 500 нм; 2) зону аморфного мате-
риала толщиной 50 нм, отделяющую
имплантат от организованной коллаге-
новой матрицы; 3) рыхлую волокни-
стую ткань толщиной 500—600 нм, от-
деляющую поверхность имплантата от
коллагеновой матрицы. Такое морфо-
логическое строение контактного слоя
наблюдалось у имплантатов из разных
материалов, включая технически чис-
тый титан, нержавеющую сталь и
виталлий [148, 149].
При электронно-микроскопическом
изучении зоны контакта кости с им-
плантатом выявлены красные клетки
крови между поверхностью имплантата
и новой костной тканью — обызвеств-
ленной и декальцинированной костью.
В этой зоне обнаружены вкрапления
титана и небольшой слой аморфного
вещества. Большие частицы титана от-
мечались в коллагеновой ткани с участ-
ками декальцинированной кости. К
этим участкам прилегал слой аморф-
ного вещества толщиной 0,5 мкм [ 194].
Соединение клеток с имплантатами
происходит через посредство процес-
сов, происходящих на их поверхности.
Прямой контакт клеток с поверхно-
стью имплантатов, наблюдаемый in vi-
vo, служит показателем приживления
[187, 204]. Хотя при обычном микро-
скопическом изучении процесса на по-
верхности имплантатов отмечается но-
вая кость с остеоцитами, в большинст-
ве случаев свидетельств активности
процесса мало. Контакты клеток с им-
плантатом немногочисленны, как ог-
раничено и их взаимодействие [204]. В
таком взаимодействии важную роль
играют молекулы экстрацеллюлярного
матрикса, так как через них передают-
ся связанные с процессом остеоинте-
грации прямые и физиологические
сигналы из контактного слоя к приле-
гающим клеткам. На этом нередко
строится предположение о возможно-
сти путем изменения поверхности им-
плантата влиять на мезенхимальную
дифференцировку клеток в остеобла-
сты. Однако формирование кости на
поверхности имплантатов не может
полностью зависеть от прикрепления
остеобластов или им направляться.
При тщательном исследовании зажи-
вающей кости на поверхностях, по-
крытых гидроксиапатитом, не выявле-
но остеобластного или предклеточного
присоединения к поверхности титана
как обязательной ступени приживле-
ния [171]. По данным С. Clokie и
Н. Warshavski [83], а также L. Linder и
соавт. [148], остеоинтеграция представ-
ляет собой процесс постепенной мине-
рализации, направленный в сторону
поверхности имплантата, а не возни-
кающий на его поверхности. Активное
формирование кости происходит от
границ травмы, вызванной в кости опе-
ративным вмешательством, к поверх-
ности имплантата [83, 148]. Поскольку
развитие этого процесса во многом за-
висит от быстроты формирования гру-
боволокнистой кости, для образования
необходимой для минерализации про-
теиновой матрицы требуются достаточ-
ное количество клеток и высокий уро-
вень их активности. Как показали про-
веденные J. Martin и соавт. [154] и дру-
гими авторами исследования in vivo у
людей, загрубление поверхности им-
плантатов в этих целях способствует
созданию остеобластной матрицы [52],
клеточному делению (56] и в некоторой
степени изменению фенотипа [43, 156].
Несмотря на достаточно большой
объем лабораторных, эксперименталь-
ных и клинических исследований кон-
тактного слоя, многие вопросы его
строения, биохимической и динамиче-
ской природы еще не изучены.
При экспериментальном исследова-
нии композиционной морфологии
контакта недекальцинированной кос-
ти с 60 костно-интегрированными
плоскими и в форме корня зуба им-
плантатами, проведенном D. Stcflik и
соавт. (1997) |2О5] с помощью элек-
тронного микроскопа, установлено,
что после 2 лет функционирования
опорой имплантатам в одинаковой
степени служат как минерализован-
ные, так и неминерализованные ткани.
Большая часть поверхности импланта-
тов находилась в прямом контакте с
костью челюсти. Платно минерализо-
ванная коллагеновая волокнистая мат-
рица часто была отделена от имплан-
тата на 20—50 нм. Клеточный процесс
распространялся к имплантату прямо
из подлежащих костных клеток. Одна-
ко между теми же имплантатами и ко-
стью отмечались участки неминерали-
зованных костных матриц. На таких
участках с этими же матрицами взаи-
модействовали остеобласты и обнару-
живались впадины Хоушипа, содержав-
шие васкулярные элементы и гигант-
ские костные клетки (остеокласты).
У ряда имплантатов апикальный ко-
нец контактировал с фиброзно-жиро-
вой стромой. О том же свидетельствуют
эксперименты, в которых по периметру
имплантата на значительных участках
выявлялась минерализованная кость, (
плотно прикрепленная к металлу. На
других участках при электронно-мик-
роскопическом исследовании опреде-
лялись островки соединительной ткани
размером 2 нм, на которых были видны
остеобласты. Остеогенез развивался на
поверхности имплантата в направле-
нии участков тканей, богатых сосудами
(202]. Эти данные подтверждают плот-
ное соединение имплантатов со здоро-
вой минерализованной костью и даль-
нейший остеогенез независимо от их
конструкции, в том числе у плоских
имплантатов (см. рис. 2.2, б).
По-видимому, ремоделирование пред-
ставляет собой активный катаболиче-
ский с участием гигантских косгных
клеток (остеокластов) и метаболиче-
ский (остеобластов) процесс. Реакция
тканей, которые служат имплантапу
опорой, очевидно, является результатом
взаимосвязей остеобластов, остеоцитов
и остеокластов при наличии ангиогене-
за. Исследователи сдслачи вывод, что
реакция прилежащих к имплантату тка-
ней динамична и заключается во взаи-
модействии всех клеток и тканей по
всей длине тела имплантата [205].
Ряд исследователей считали, что
адекватный морфогенез происходит
только при одноэтапном оперативном
вмешательстве. Вместе с тем I. Eriksson
и соавт. (105] в эксперименте не отме-
тили разницы в остеогенезе при одно-
и двухстадийной постановке имплан-
татов. Природа контактной зоны меж-
ду аморфным слоем и поверхностью
имплантата до конца нс изучена. В
большой степени она зависит от мате-
риала имплантата, его бномолекуляр-
ного уровня, т.е. от молекулярной спо-
собности к поляризации, диэлектричс-
ской константы поверхности окисле-
ния. локальной микроструктуры, хи-
мической композиции поверхностного
окисления и других химических свя-
зей, В том числе ионных ковалентных.
Исходя из этого, различают слабое хи-
мическое соединение, прямое ионное
химическое соединение и комбиниро-
ванное. Если такие материалы, как ке-
рамики, дают плотное соединение, то
полимеры — слабое. Что касается тех-
нически чистого титана, то мнения о
характере его соединения расходятся.
Поданным некоторых исследователей,
прямое соединение титана и кости при
имплантации не всегда бывает про-
грессивным. К такому выводу, в част-
ности, пришли L. Cooper и соавт. [89],
которые с помощью электронной оп-
тики наблюдали остеобласты на тита-
новой и коллагеновой поверхностях
после их обработки и в разные сроки
инкубационного периода. При сравне-
нии коллагена I с чистым тиганом по
характеру соединения с тканями они
обнаружили, что прикрепление кост-
ных клеток к титану в 5—10 раз слабее.
По их мнению, есть основание пола-
гать, что в будущем позиции в отноше-
нии прямого соединения титана и кос-
ти могут быть пересмотрены.
Для понимания морфологических
процессов, происходящих в контакт-
ной зоне после постановки импланта-
тов, очень важны прижизненные ис-
следования. Непревзойденны по зна-
чимости наблюдения in vivo за костью
и мягкой тканью, проведенные С. Нат-
merle и соавт. [114]. Авторы ставили
Добровольцам в кость челюсти полые
имплантаты (трубки). В сроки 2; 7 и 12
нед через трубки-имплантаты брали
образцы тканей. В период до 12 нед по-
дучали только мягкую ткань, а после 12
нед начала отмечаться мягкая и кост-
ная ткань, степень минерализации ко-
торой в динамике увеличивалась.
Фиброинтеграция, возникающая у
плоских имплантатов, связывается
главным образом с ранней нагрузкой на
них. Высказывается мнение, что имен-
но по этой причине плоские импланта-
ты менее долговечны, чем имплантаты
в форме корня зуба [1, 65]. Тем не ме-
нее L. Linkow [151] продемонстрировал
Клиническую и рентгенологическую
стабильность плоского имплантата
функционировавшего в течение 19 лет*
Удалить его после поломки удалось
только путем выпиливания вместе с
блоком кости. Гистологическое иссле-
дование показало, что все поверхности
имплантата были покрыты костью.
Морфометрический контакт конструк-
ции и кости был отмечен на 46,4—
82,3 % их поверхности (см. рис. 2.2, в).
При зубной имплантации не только
ткани, но и сами плотно стоящие в
кости титановые имплантаты могут
претерпевать различные изменение и
большое значение в этих процессах
придается окисной пленке, которая
мгновенно образуется при контакте
титана с воздухом или физиологиче-
скими жидкостями. Количество окис-
ной пленки напрямую зависит от сте-
рильности имплантата, но, как показа-
ли электронно-микроскопические и
сканирующие исследования, на по-
верхности даже стерильных импланта-
тов имеются органические загрязнения
и разные химические элементы (131].
Взаимодействие с тканевыми жидко-
стями инертной окисной пленки, обра-
зующейся на поверхности титанового
имплантата, может привести к его раз-
рушению. Об этом свидетельствует зна-
чительное разрушение плазменного на-
пыления цилиндрических имплантатов
"1ТГ и "IMZ", удаленных из кости. Им-
плантаты "1Т1" теряют в кости 43 %,
имплантаты "1MZ" — 88 % плазменного
напыления. Процесс разрушения под-
тверждает обнаружение ионов титана в
прилегающих мягких и костных тканях
[153].
Приживление зубного имплантата
всегда сопровождается атрофией альве-
олярного гребня. По-видимому, это
связано главным образом с операцион-
ной травмой при установке имплантата.
При нормально протекающей остео-
интеграции в первый год функциони-
рования имплантата кость теряет от 0,5
до 1,5 мм высоты. Затем этот процесс
становится менее активным, и ежегод-
ная потеря кости не превышает 0,1 мм.
Повышенная нагрузка на имплантат и
развитие вокруг него воспалительных
явлений [34] могут значительно уси-
лить послеоперационную резорбцию
кости.
Приведенный выше краткий обзор
медицинской литературы свидетельст-
вует, что динамика морфологических
изменений при внутрикостной им-
плантации in vivo большинством ис-
следователей описана на основании
1ьтатов экспериментальных иссле-
дований на животных. Однако в по-
следние годы в таких исследованиях
обозначился новый этап. Опубликова-
ны данные о прижизненном изучении
морфогенеза при зубной имплантации
[114, 183], в том числе о микроцирку-
ляции в прилежащих к костям мягких
тканях [3, 12, 30]. Это дает основания
полагать, что уже в ближайшее время
можно ожидать новых теоретических и
практических рекомендаций, которые
будут способствовать прогрессу зубной
имплантации.
2.4. Морфологические
особенности
приживления имплантатов
с биокерамическим покрытием
Несколько иначе происходит остеоин-
теграция имплантатов, имеющих кера-
мическое покрытие. Эксперименты по-
казали, что, хотя все керамики усилива-
ют соединение с костью, у разных кера-
мик оно различное. При покрытии гид-
роксиапатитом прочность соединения
кости с титановым имплантатом воз-
растает в 5—8 раз [92, 93]. Гистологиче-
ски выявлена минерализация кости во-
круг имплантата, а в некоторых случа-
ях — тонкий слой волокнистой соеди-
нительной ткани, располагавшейся в
виде выступов к кости [54, 85, 86].
Еще более плотное соединение в
эксперименте отмечено у имплантатов
из плотной апатитовой керамики, по-
ставленных в лунки удаленных зубов с
глухим зашиванием слизистой оболоч-
ки и надкостницы. Изучение результа-
тов остеогенеза таких материалов пу-
тем электронной микроскопии показа-
ло образование двух разных типов со-
единения костной ткани с имплантата-
ми. Первый тип — интимное соедине-
ние с помощью кортикального или
губчатого вещества кости. Оно харак-
терно для мест плотного прилегания
тела имплантата к стенкам лунки. Ко-
стные пластинки врастают в микропа-
зы на его поверхности. Остеокласты,
способные разрушить имплантат, не
наблюдаются. На участках прилегания
губчатой кости костный мозг контак-
тирует с имплантатом, но обнаружива-
ются гигантские клетки инородных тел
с 10—20 ядрами. Такое соединение
можно классифицировать как анкилоз.
Второй тип соединения характерен
для участков неплотного прилегания
имплантатов к стенкам лунки. В таких
местах образуется пористый аморфный
слой толщиной до 1000 нм, в котором
не обнаруживаются ни клетки, ни во-
локна. Этот слой служит прочным ми-
нерализованным связующим материа-
лом, не вызывающим воспалительных]
явлений, хорошо совместимым с ко-
стью и недеградируюшим. Экспери-
ментаторы назвали его естественным
связующим костным цементом.
В местах контакта кости с имплан-
татами, независимо от наличия или от-
сутствия у них гидроксиапатитного по-
крытия, при экспериментах обнаружи-
вались участки аморфного материала.
Они были размером от 10 до 30 нм и
состояли из протеогликанов и гликоз-
аминогликанов. У имплантатов, по-
крытых гидроксиапатитом, его кри-
сталлы вытягивались через эту струк-
туру, соединяя кость с поверхностью
имплантата. У имплантатов без гидро-
ксиапатитного покрытия коллагено-
вые волокна и участки цитокинеза кос-
ти отделялись такой же аморфной тка-
нью. Коллагеновые волокна, подобно
прободающим, проходили сквозь эту
ткань и прикреплялись к поверхности
имплантата [68].
В ранних стадиях остеоинтеграция
гидроксиапатитного покрытия проис-
ходит быстрее и выражена больше, чем
у имплантатов без такого покрытия
[54, 207]. Считается, что в первые 4 нед
покрытие гидроксиапатитом служит
главным фактором механического
скрепления имплантата и кости (см.
рис. 2.2, б). Позднее все зависит от
конструкции. В цилиндрических им-
плантатах гидроксиапатит и в дальней-
шем обусловливает сцепление с ко-
стью и, следовательно, неподвижность
конструкции. В имплантатах же,
||Меюших на теле приспособления для
прорастания кости, значение гидро-
ксиапатита становится минимальным.
Вместе с тем у некоторых имплантатов
обнаруживается тонкий слой волокни-
стой соединительной ткани в виде вы-
ступов к кости 154, 86]. Кортикальное
вещество кости способно соединяться
с поверхностью имплантата более
плотно, тогда как губчатое вещество,
несмотря на покрытие имплантата
гидроксиапатитом, дает слабое соеди-
нение. Вместе с тем, хотя в отдаленные
сроки особой разницы в ходе самого
процесса образования кости у имплан-
татов с гидроксиапатитным покрытием
и без него в экспериментах не наблю-
дается, через 32 нед при гидроксиапа-
титом покрытии отмечается прямое и
плотное соединение с костью, тогда
как без покрытия в эти же сроки вме-
сто такого соединения обнаруживается
слой фиброзной ткани (85, 88].
При изучении в эксперименте ульт-
раструктуры и цитокинетической ха-
рактеристики клеток в области им-
плантатов, покрытых гидроксиапати-
том, и в прикрепленных мягких тканях
обнаружено скопление многоядерных
клеток около костных дефектов, где
расположен периодонт, а в области
гидроксиапатитного покрытия — обра-
зование новой кости. Вместе с тем
гидроксиапатит может рассасываться;
этот факт отмечался в 30 % экспери-
ментов |134]. Другие исследователи
при подсадке в ходе экспериментов
гранулированного гидроксиапатита ре-
зорбции его в кости не наблюдали [54].
Возможно, процессы резорбции зави-
сят от вещества кости — губчатого или
кортикального. На это, в частности,
Указывают результаты сканирующей
томографии титановых имплантатов в
вИде блоков, покрытых гидроксиапати-
том, подсаженных кроликам и порося-
там так, что часть их находилась в кор-
неальном веществе кости, а часть — в
Початом. Резорбция гидроксиапатита
происходила гораздо быстрее в костно-
мозговых пространствах. В местах, ог-
раниченных кортикальным веществом
кости, она почти отсутствовала [177].
На остеоинтеграцию определенным
образом влияет способ покрытия тела
имплантата биоматериалом. Более ак-
тивный морфогенез наблюдается у им-
плантатов с напылением гидроксиапа-
титного покрытия лазером как с обжи-
гом, так и без него. Морфологические
данные свидетельствуют о формирова-
нии в зоне контакта кости с импланта-
том трабекул, идущих вдоль его тела, с
большим количеством остеобластов и
остеоцитов. По направлению от кости
к имплантату отмечается рост костных
структур в виде пластинок с неболь-
шим количеством узких сосудистых
каналов или отдельных трабекул. На
отдельных участках наблюдается ин-
тимное соединение имплантата с ко-
стью в виде минерализованных пла-
стин костного матрикса [138].
Конструктивно покрытие импланта-
тов гидроксиапатитом может быть раз-
личным. Выпускаются имплантаты с
полным покрытием тела и шейки, с не-
полным покрытием, соприкасающим-
ся с хорошо отполированной шейкой.
Опыты на животных [62, 160] показа-
ли, что наличие или отсутствие поли-
рованного "воротничка" влияет на ре-
генерацию кости, но вместе с тем это
зависит от нагрузки. В имплантатах без
нагрузки построение кости отмечено
до края имплантата, а при нагрузке
кость формировалась только до уровня
гидроксиапатитного покрытия; в об-
ласти полированного воротничка она
не обнаружена [54].
При изучении процессов в кости
при имплантатах, покрытых гидрокси-
апатитом, установлена зависимость их
остеоинтеграции и стабильности от на-
грузки и воспаления вокруг импланта-
та. При наличии этих факторов неиз-
бежны развитие резорбтивных процес-
сов и потеря краевой части кости аль-
веолярного отростка верхней челюсти
и альвеолярной части нижней челю-
сти. Воспалительные явления по пери-
метру имплантата, покрытого гидро-
ксиапатитом, ускоряют процесс ре-
зорбции кости. В тех случаях, когда
слизистая оболочка вокруг шейки им-
плантата плотная, воспалительные
процессы замедляются [55].
К неожиданному выводу пришли в
результате исследований гидроксиапа-
титного покрытия A. Piattelli и соавт.
[180]. Экспериментируя на кроликах с
имплантатами фирмы "Sustain", они от-
мечали на одних участках прямой и
плотный контакт гидроксиапатитного
покрытия с костью, а на других — слой
неминерализованного материала между
костью и гидроксиапатитом, что позво-
лило сделать предположение о преуве-
личении органической связи соедине-
ния кости с гидроксиапатитом. Авторы
основывались и на том, что при лазер-
ном сканирующем микроскопическом
исследовании на многих участках кон-
такта кости с поверхностью имплантата
отмечалась флюоресценция.
Еще более жесткую позицию в отно-
шении покрытия имплантатов гидро-
ксиапатитом занимает Ph. Boyne [59].
Поскольку оно, как отмечено многими
исследователями, кондуктивно, у него
не может быть способности к активи-
зации остеоинтеграции. Основываясь
на результатах экспериментов с обезь-
янами, которым ставились разнообраз-
ные имплантаты с гидроксиапатитным
покрытием и без него, автор делает вы-
вод, что активизацией остеоинтегра-
ции и кондуктивностью характеризу-
ются только биоматериалы в форме
гранул, порошка или стружки. Именно
благодаря заполнению ими ложа для
имплантатов с гидроксиапатитным по-
крытием создается впечатление об ус-
корении образования новой кости [59].
Иного мнения придерживаются
S. Cook и соавт. [85, 86, 87]. За 32 нед
их наблюдений за такими имплантата-
ми каких-либо патологических изме-
нений в морфогенезе костной интегра-
ции не отмечено, в то время как у не-
покрытых гидроксиапатитом имплан-
татов наблюдалось образование тонкой
фиброзной ткани.
У имплантатов с гидроксиапатит-
ным покрытием контактный слой уни-
кален целостностью (единством, не-
прерывностью) фазы минерализации
формирующейся кости и гидроксиапа-
титного покрытия. Такое единство ми-
неральных фаз является, по-видимому,
основой "костной связи" [133, 170,
211]. Медленный процесс роста кри-
сталлов оказывается вовлеченным в
химическую связь гидроксиапатитной
поверхностью имплантата с минерали-
зованной матрицей |48]. В ускорении
процесса прямой минерализации на
гидроксиапатитных поверхностях мо-
жет выражаться реактивный феномен
покрытия. Остеокондуктивное поведе-
ние гидроксиапатита может быть свя-
зано с адгезивными свойствами про-
теина [138]. В одном эксперименте in
vivo более значительное формирование
кости у имплантата с гидроксиапатит-
ным покрытием по сравнению с по-
верхностью титана без покрытия по-
служило основанием для вывода о зна-
чительном потенциале остеокондук-
тивности у покрытия гидроксиапати-
том [77, 109, 200). Однако такое заклю-
чение еще требует подтверждения.
Помимо гидроксиапатита, хорошую
интеграцию с костью и адекватную'
биологическую совместимость обеспе-
чивает плотная алюмооксидная кера-
мика. В местах контакта имплантата с
костью образуются кристаллы гидро-
окиси апатита [82]. В зубной имплан-
тации его используют благодаря этим
качествам. Плотное соединение моле-
кул кремнезема и формирование кости
с плотной структурой при использова-
нии алюмооксидной керамики объяс-
няется образованием на поверхности
имплантата костного протеина, кото-
рый ограждает от гуморальных и кле-
точных реакций [157].
Приведенные выше данные о мор-
фогенезе приживления имплантатов
свидетельствуют, что процесс остеоин-
теграции при зубной имплантации в
эксперименте достаточно детально
описан и его динамика в целом изуче-
на. Тем не менее остается еще немало
вопросов, ответы на которые способст-
вовали бы дальнейшему совершенст-
вованию практики зубной импланта-
ции. Недостаточно точно и детально
изучено влияние техники хирургиче-
ских вмешательств на процесс остео-
интеграции. Знание реакции тканей на
те или иные хирургические приемы
могло бы содействовать успеху при по-
становке имплантатов различных ти-
пов и конструкций. Точно не известно,
как способствуют образованию новой
костной ткани или каким-либо обра-
зом влияют на него различные поверх-
ности имплантатов. Необходимо про-
должить изучение влияния различных
биоматериалов на образование новой
костной ткани.
Оптимальным результатом исследо-
ваний по всем этим и другим направ-
лениям могли бы быть не только по-
лезные практические рекомендации,
ио и создание стимуляторов остеогене-
за, т.е. средств прямого вмешательства
в процесс на клеточном и молекуляр-
ном уровне. Такие эксперименты по
ускорению остеогенеза зубных им-
плантатов уже проводятся. В частно-
сти, получены обнадеживающие ре-
зультаты при использовании с этой це-
лью бычьего морфогенетического про-
теина, плазмы крови, обогащенной
тромбоцитами, комбинации пептидов.
Под их воздействием более активно
формируется новая костная ткань. Та-
кая возможность терапевтического ин-
дуцирования новой кости представля-
ет определенную перспективу.
2.5. Морфологические
особенности заживления
слизистой оболочки
и надкостницы
Одновременно с процессами, происхо-
дящими при зубной имплантации в
кости, возникают изменения в слизи-
стой оболочке и надкостнице в зоне,
прилегающей к имплантату и создаю-
щей механический барьер между ним и
полостью рта. Даже при ранней нагруз-
ке под мукопериостом образуется за-
мыкательная пластинка [178].
Адаптация мягкой ткани неразрывно
связана с образованием новой кости.
Морфологическими исследованиями
установлено, что чем больше площадь
прикрепления новой костной ткани к
имплантату и ее минерализация, тем
адекватнее мягкотканное соединение
имплантата. Напротив, недостаточ-
ность слизисто-надкостичного замка
отрицательно влияет на плотное соеди-
нение имплантата с костью и может да-
*е отразиться на качестве новообразо-
ванной кости и ее минерализации [202].
Процессы и факторы заживления
мягких тканей. Сосудистые и
Клеточные р е а к ц и и. При зубной
имплантации на участках мягких тка-
ней, как и в кости, можно наблюдать
выраженное воспаление, увеличение
количества и концентрации сосудов.
При экспериментах отмечено увеличе-
ние количества капилляров с 33,5 до
1637,7 на 1 мм2 слизистой оболочки
лоскута соответственно участку остео-
томии [71]. Первоначальная сосудистая
реакция сменяется тромбоцитарной, а
также агрегацией, активизацией и кас-
кадом свертывания крови. Одновре-
менно начинают развиваться неспеци-
фические клеточные реакции, преиму-
щественно за счет нейтрофильных лей-
коцитов. Возникают также специфиче-
ские реакции в виде увеличения числа
лимфоцитов и макрофагов. Наблюдает-
ся цитокинез, играющий важную роль в
фазе заживления мягких тканей — пе-
риоста и слизистой оболочки соответ-
ственно костному сегменту, в который
погружен имплантат [162].
Воспалительные изменения в мяг-
ких тканях наблюдаются примерно 10
дней, затем наступает фаза пролифера-
ции. По сути она однотипна с теми из-
менениями, которые отмечались при
заживлении кости после постановки
имплантата. Наблюдаются процессы
неоваскуляризации, дифференциров-
ки, пролиферации и активизации кле-
ток с последующим образованием не-
зрелого коллагена, эластина и базовой
субстанции. В фазе активной пролифе-
рации эпителиальных и соединитель-
ных клеток начинается зажиатение
операционной раны. Процесс выража-
ется в миграции и пролиферации эпи-
телиальных клеток в течение первых
24—48 ч после операции [44]. Стиму-
лом к миграции клеток служит тормо-
жение и снижение локального уровня
ингибиторов роста кейлонов. Уже в
первые 23 ч после операции начинают-
ся закрытие раны и отграничение внут-
ренних отделов от полости рта. Эпите-
лиальное соединение по периметру им-
плантата образуется гемодесмосомами
подобно ткани периодонта [50] (рис.
2.3, а).
На стадии пролиферации слизистой
оболочки и надкостницы главную роль
играют фибробласты. Их пролифера-
ция и дифференциация возникают под
влиянием гипоксии и выделения цито-
кинов после изменений тромбоцитов и
макрофагов в предыдущей фазе воспа-
Рис. 2.3. Заживление мягких тканей по-
сле имплантации.
а — образование гсмодесмосомы (James R. et al.,
1974); б — гистология имплаитато-десневого
соединения у конструкции в форме корня зуба;
в — гистология имплантато-десневого соеди-
нения у конструкции плоской формы (Spie-
kermann Н. cl al.. 1995].
ления. Неоваскуляризация стимулиру-
ет пролиферацию фибробластов. В ре-
зультате этого образуются фибробла-
сты базовой субстанции, коллаген и
эластичные волокна. Базовая субстан-
ция состоит из протеогликанов и гли-
копротеинов [158]. Последние, явля-
ясь адгезивными микромолекулами,
взаимодействуют с клеточными эле-
ментами, внеклеточными матрицами и
стимулируют адгезивность, миграцию,
пролиферацию клеток, а также генное
регулирование. Протеогликаны, удер-
живая воду, образуют громоздкие гели,
заполняюшие внеклеточное простран-
ство. Концентрация одной из состав-
ных частей полигликанов, гиалуроно-
вой кислоты, понижается к 5-му дню
после операции, а содержание других
компонентов, наоборот, увеличивают-
ся. Это ведет к определенной коопера-
тивной работе всех элементов базовой
субстанции, что обусловливает разви-
тие коллагеновых структур и поддер-
жание клеточной функции. Среди них
коллаген и эластические волокна на-
блюдаются уже на 4—6-й день, тогда
как первые свидетельства образования
проколлагена обнаруживаются еШ®
раньше — на 2—4-й день после опера-
ции. Последующие его преобразова-
ния ведут к формированию коллагено-
вых фибрилл, которые, соединяясь,
образуют волокна. Одновременно из
фибробластов формируются эластич-
ные волокна, обладающие значитель-
ой упругостью и растяжимостью,
фибробласты, эпителиальные клетки,
.ейтрофилы и макрофаги секретируют
коллагеназы, расщепляющие колла-
жи В фазе заживления раны эти про-
цессы достигают пика на 16—17-й
лень Это обусловливает прочность
тканей. В тех же временных рамках
происходит эпителизация раны, кото-
рая обеспечивается ростом сосудов и
агрегацией протеинов [158, 159].
Высказывается мнение, что после-
дующие процессы в прилегающей к
имплантату слизистой оболочке зави-
сят от того, на сколько хирургических
этапов делится зубная имплантация.
При одноэтапной процедуре после фа-
зы заживления наблюдается хорошо
выраженная зона соединительной тка-
ни между надальвеолярной частью и
маргинальным отделом. У погружных
имплантатов Branemark соединитель-
ная ткань образуется после второго хи-
рургического этапа и отличается бо-
льшим количеством коллагеновых во-
локон во внутренней зоне и более рых-
лым, богатым сосудами наружным
слоем [71]. Сам же процесс адаптации
мягкой ткани и остеоинтеграции у по-
гружных и непогружных имплантатов
протекает, как показали эксперимен-
ты, практически одинаково. Однако
при гистологическом исследовании,
проведенном через 6 мес после поста-
новки имплантатов, обнаружены огра-
ниченная аккумуляция воспалитель-
ных клеток у погружных и постоянный
инфильтрат воспалительных клеток у
непогружных имплантатов. Исследо-
вания такого инфильтрата показали,
ито от гребня кости его отделяла зона
нормальной соединительной ткани
Шириной 0,8 мм. Потеря гребня кости
при эксперименте, отмеченная гисто-
логически и рентгенографически, со-
ставила около 2,4 мм. Высота слизи-
стой оболочки вокруг имплантатов ко-
лебалась от 3,5 до 3,9 мм. Сам костный
гребень располагался на 1,1—1,5 мм
внутрь от места присоединения опор-
ной головки и апикальной границы
стыкового эпителия, причем 2,1—
2>4 мм последнего были обращены к
Имплантату [105].
В третьей фазе, фазе окончательного
Заживления раны, в течение 3—9 нед
после операции происходит диффе-
ренциация депонированного коллаге-
на. При этом фибробласты заменяют
коллаген, повышая прочность ткани.
Образование эпителиаль-
ного соединения. В морфогенезе
мягких тканей при зубной импланта-
ции решающим является заживление
той части слизистой оболочки и надко-
стницы, которая имеет непосредствен-
ный контакт с имплантатом. Самым
важным считается образование замка
из соединительной ткани, отделяющего
внутреннюю среду раны от полости рта
[71]. Высказывается мнение, что обра-
зующаяся таким путем эпителиальная
и соединительная ткань аналогична
тканям десны и периоста у природных
зубов. Как показали ультраструктурные
исследования контактирующих с им-
плантатом мягких тканей, переходный
эпителий прикрепляется к поверхности
имплантата в виде тонкой пластинки,
состоящей из цепочек фибронектина
[158]. Ранее в этой зоне уже было отме-
чено наличие базальной пластины ге-
модесмосомы, подобной той, которую
имеют естественные зубы [111].
Аналогично участкам аморфного ве-
щества между имплантатом и костью у
мягких тканей имеется аморфный слой,
толщина которого составляет 20 мкм.
В то же время в ходе наблюдений за
приживлением имплантатов "Brane-
mark" лишь у 67 % из них отмечено вес-
тибулярно и у 51 % — орально образо-
вание соединительнотканного замка,
но нигде не выявлено гемодесмальное
соединение [127]. Последнее считается
возможным только при использовании
керамических имплантатов в связи с
наличием на их поверхности тонкого
слоя аморфного гликопротеина.
Развитие соединительной ткани про-
исходит по периметру имплантата [160].
Обнаружена разница в направлении
коллагеновых волокон у имплантатов
для одно- и двухэтапного применения
[68]. Если у первых, в том числе пло-
ских, имплантатов волокна идут гори-
зонтально, создавая подобие круговой
связки, то у погружных имплантатов в
форме корня зуба коллагеновые волок-
на имеют продольное направление, рас-
полагаясь вдоль их тела (рис. 2.3, б, в).
Однако во всех случаях строение и рас-
положение волокон вокруг имплантатов
отличаются от ориентации волокон пе-
риодонта у здоровых природных зубов,
амелобласты и эпителиальные клетки
которых имеют прикрепление к зубной
эмали и цементу толщиной 40 нм.
Внутрикостные имплантаты такого со-
единения не имеют.
У шейки имплантата ряд исследова-
телей наблюдали барьер в виде фиб-
розной ткани, причем часть волокон
отмечалась в зоне контакта имплантата
и кости [21, 52]. В других случаях при
постановке имплантатов с гидрокси-
апатитным покрытием обнаружено об-
разование коллагеновых волокон пер-
пендикулярно поверхности импланта-
тов с последующим образованием ос-
теоидной ткани [69, 136). Этому может
способствовать изменение поверхно-
сти имплантата. Так, у хорошо отполи-
рованной шейки образуется плотное
соединение, особенно в случае напы-
ления титана [193].
Обычно толщина соединения им-
плантата и мягкой ткани составляет
1 мм, что соизмеримо с природными
зубами. В то же время характер соеди-
нения с костями челюстей у импланта-
тов и природных зубов принципиально
разные, поэтому глубина карманов не
может быть ориентиром соединения.
По ней можно устанавливать лишь тол-
щину слизистой оболочки [199]. Тем не
менее возникшее соединение играет
роль замка и препятствует прорастанию
эпителия внутрь кости, предохраняя та-
ким образом десну от рецессии.
Ряд исследователей придерживаются
мнения, что характер тканого соедине-
ния зависит от типа имплантата. Одна-
ко исследования слизистого замка, об-
разованного вокруг тела имплантатов
"Branemark'', "Astra" и "IT!” для одно- и
двухэтапного лечения, показали, что
он состоял из компонентов эпители-
альной и соединительной ткани, его
размеры и композиция у всех систем
имплантатов были идентичными. Ко-
личество кортикальной кости в кон-
тактной зоне тоже было почти иден-
тичным [32, 220].
При изучении реакции мягких тка-
ней на различные материалы имплан-
татов проведены тщательные сравни-
тельные гистологические исследова-
ния здоровой слизистой оболочки,
прилегавшей к титановым импланта-
там Branemark и монокристалличес-
ким сапфировым имплантатам [45].
Для биопсии брали участки кератини-
зированного внешнего эпителия у им-
плантатов и внутреннего, некератини-
зированного. Оба вида эпителия имму-
нореактивны к цитокератину, который
использовался как иммуногистохими-
ческий маркер вместе с протеином S-
100, фактором VIII и KPI. Внутренний
эпителий имплантатов заканчивался
на стыковом эпителии и апикально
имел толщину всего в несколько кле-
точных слоев. Клетки, прилегавшие к
имплантатам, имели уплотненную ци-
топлазму, напоминавшую гемидесмо-
сому. В подлежащей соединительной
ткани, богатой фибробластами и кро-
веносными сосудами, иммунореактив-
ными к фактору VIII, пучки коллагена
располагались в разных направлениях.
Структуры нервов, иммунореактивные
к S-I00, чаще отмечались под внеш-
ним, чем под внутренним, эпителием
имплантата. Инфильтраты воспали-
тельных клеток (некоторые из них
KPI-позитивные) наблюдались в апи-
кальных частях внутреннего эпителия
имплантатов. Позитивные клетки Лан-
герганса S-100 отмечались главным об-
разом внутри наружного эпителия им-
плантатов. Качественных структурных
различий мягкой ткани, прилегавшей
ко всем исследованным имплантатам»
не обнаружено.
Большое значение соединения мяг-
кой ткани с имплантатом для успеха
имплантации требует повышенного
внимания к адекватности хирургиче-
ских манипуляций на мягкой ткани,
уходу за раной, нагрузке на имплантат
и гигиене полости рта. Разрушение
тканевого замка может привести к об-
разованию зубной бляшки и воспали-
тельным явлениям, способным вы-
звать осложнение — периимплантит,
который развивается как заболевание
пародонта. По этой причине рекомен-
дуется увеличивать количество мягкой
ткани у шейки имплантата, ставить
имплантаты на участки плотной слизи-
стой оболочки, использовать замени-
тели кости. Бесклеточный дермальный
матрикс ("Alioderm") стимулирует рост
коллагена, эластических волокон и
прорастание эпителия от материнской
1]0ЧВы. При необходимости рекомен-
дуется использовать направленную ре-
генерацию с помощью рассасываю-
щихся и нсрассасывающихся мембран.
2.6. Морфологические
особенности приживления
биоматериалов
В ходе зубной имплантации для повы-
шения интеграции имплантатов и их
стабильности при функционировании
все чаше стали прибегать к трансплан-
тации биоматериалов. Особое значе-
ние биоматериалы имеют в тех случа-
ях. когда имплантация невозможна
без увеличения ширины или высоты
кости челюсти либо во время опера-
ции возникают непредвиденные си-
туации и требуется закрыть дефект
кости. Биоматериалы способны сти-
мулировать процесс дифференциации
клеток — остеоиндукцию. Они могут
также служить матрицей для построе-
ния костных структур. На таких их
способностях при зубной импланта-
ции основано приживление ауто-, ал-
ло-, ксенопластических материалов и
керамик.
Трансплантацию можно проводить
Двумя путями: одновременно с им-
плантацией или последовательно, ко-
гда сперва проводится пластика кости,
а после приживления трансплантата —
имплантация. Виды трансплантатов
могут быть различными, но все они
Должны отвечать следующим требова-
ниям: не быть токсичными и канцеро-
генными, не препятствовать заживле-
нию тканей, быть совместимыми с тка-
нями пациента [71, 131, 201].
Возможность подбора наиболее аде-
кватного вида трансплантата значи-
тельно повышает эффект имплантации
1 Долговечность функционирования
Имплантируемых конструкций, осо-
бенно в сложных клинических ситуа-
циях. Однако если в отношении рекон-
струкции с помощью тканевых транс-
ЦДантатов и приживления зубных им-
плантатов из титана и его сплавов с
Различными покрытиями поверхности
морфогенез достаточно глубоко изу-
чен, то процессы комплексного взаи-
модействия биоматериалов с костью и
имплантатом еще только начинают ис-
следоваться, поэтому необходимы как
клинические наблюдения, так и теоре-
тическое обоснование, тем более что
механизмы остеогенеза костных транс-
плантатов и биопластических материа-
лов с имплантатами более сложные.
2.6.1. Морфологические особенности
приживления аутокости
При зубной имплантации наиболее
эффективно использование аутокости.
Чаше всего применяют кортикальное и
губчатое вещество кости, как в отдель-
ности, так и единым комплексом. Тра-
диционно аутотрансплантаты берут из
гребня большой берцовой кости или
ребра (цельный блок или только на-
ружную пластинку). В настоящее время
в челюстно-лицевой хирургии эти тра-
диционные методы стали уступать
место получению материала с участков
челюстей — бугра верхней челюсти,
подбородочного отдела, ретромоляр-
ной области нижней челюсти, черепа, а
также участков малой берцовой кости.
Можно использовать также кость из
близлежащих отделов челюстей, пре-
имущественно их кортикального веще-
ства. Мы с успехом использовали экзо-
стозы с челюстей. Однако материала с
челюстей для наращивания кости перед
имплантацией, как правило, недоста-
точно. Такую аутокость целесообразно
применять в тех случаях, когда не тре-
буется большого количества материала.
Чаще всего к таким трансплантатам
прибегают при немедленной импланта-
ции или закрытии небольшого дефекта.
Аутогенная кость имеет важные пре-
имущества перед другими транспланта-
тами, так как только в ней содержатся
жизнеспособные остеобласты и кост-
ные стволовые клетки и отсутствует от-
рицательное воздействие антигенных
протеинов. При использовании свобод-
ных аутотрансплантатов морфологиче-
ски установлено, что остеогенез проис-
ходит традиционно, аналогично зажив-
лению переломов. Большое значение
имеет тот факт, что кость постоянно
1Q1
способна к самообновлению. В этом
процессе участвуют костные клетки,
межуточное вещество, клетки эндоста и
периоста. В трех таких детерминантных
неделяшихся костных клетках — остео-
бластах, остеоцитах, остеокластах —
происходят взаимодействия, которые
стимулируют полустволовые и ство-
ловые клетки. Последние в свою оче-
редь вызывают самодифференцирова-
ние клеток и образование кости. Жиз-
неспособные остеобласты и стволовые
клетки создают стабильную реакцию
для репаративных процессов кости.
Пересаженные аутогенные транс-
плантаты приживаются в два этапа
[46]. В течение первых недель проис-
ходят пролиферация и дифференциа-
ция трансплантированных клеток с от-
ложением остеоидной ткани в транс-
плантированную кость. В образовании
остеоидной ткани участвуют эндоос-
сальные, периостальные клетки, ос-
теобласты, клетки костного мозга. Пи-
тание остеоидных тканей идет за счет
сосудистой сети воспринимающего ло-
жа. Иначе говоря, создается компози-
ционное костное губчатое вещество,
состоящее из вновь образованной ос-
теоидной ткани, которое окружает
трансплантированный материал. Мас-
са вновь образованной кости соответ-
ствует величине пересаженного ауто-
трансплантата, и плотность их иден-
тична. Развивающаяся неоваскуляри-
зация из окружающих тканей создает
стабильную сосудистую сеть в транс-
плантате.
На втором этапе изменения регист-
рируются уже на 2-й неделе после опе-
рации. Мезенхимальные клетки в ок-
ружающих аутотрансплантат тканях
дифференцируются в остеобласты и
образуют костную матрицу (остеоин-
дукция). Трансплантат служит как бы
скелетом для формирования кости. За
счет действия остеокластов и неова-
скуляризации продолжаются резорб-
ция и реконструкция кости с участием
остеобластов. По мнению Е. Ellies
[100], такую костную индукцию созда-
ет кислотно-нерастворимый гликопро-
теин, содержащийся в пересаженной
аутокости. I. Sampath и A. Reddy [190]
считают, что в этом процессе могут
участвовать и другие костно-матрич-
Рис. 2.4. Морфологическая картина при
трансплантации аутокости.
ные протеины. По более ранним дан-
ным J. Gray и М. Elves [ПО], в началь-,
ной продукции кости главную роль иг-
рают остеобласты и другие клетки ауто-
генных трансплантатов. В дальнейшем
как в воспринимающем ложе, так и в
самом аутогенном трансплантате про-
исходит окончательная реконструкция
кости и образуется новая костная ткань
с хорошо выраженной структурой. Мас-
са кости, произведенная транспланти-
рованными клетками, прямо пропор-
циональна плотности сохранившихся
остеобластов (рис. 2.4).
В остеогенезе аутотрансплантатов
важную роль играют особенности пе-
ресаживаемой кости. Структура новой
кости зависит от характера пересажен-
ного трансплантата, организации в
нем кортикального или губчатого ве-
щества, а также от их сочетаний при
пересадке блока кости [57, 72]. При ау-
тотрансплантации губчатой кости ре-
зультаты остеогенеза лучше, чем при
использовании кортикальной кости.
Применение цельного аутотрансплан-
тата значительно уступает постановке
кости блоками в виде щебенки или
стружки. Имеет значение также анато-
мическая принадлежность трансплан-
татов (ребро, гребень подвздошной
кости, кости симфиза, ретромолярной
области нижней челюсти, бугра верх-
ней челюсти, черепа). Наилучшие ре-
зультаты отмечаются при использова-
нии гребня подвздошной кости и реб-
ра. Столь же высоки свойства ауто-
грансплантатов, взятых с челюстей. По
102
мнению I. Eriksson и соавт. [103], они
даже менее подвержены атрофии.
В образовавшемся губчатом вещест-
ве наблюдается ранняя (первые 2 нед)
васкуляризация [116]. Размер и число
сосудов прогрессивно увеличиваются.
На трансплантате, как на костной мат-
рице. образуется новая кость. Как от-
мечено при рентгенологическом ис-
следовании, незрелая костная ткань
губчатого вещества, развившаяся в ре-
зультате репродукции остеобластов
трансплантата и воспринимающего его
ложа, достаточно плотная [101]. В про-
цессе реконструкции кости, костной
резорбции и депонирования костных
структур плотность тканей несколько
снижается. Однако костная резорбция
начинается только на 30—40-й день
после операции. Через 2 мес наблюда-
ются пик костного депонирования и
последующее ремоделирование кости.
После пересадки кортикальных кост-
ных трансплантатов их реконструкция
происходит гораздо медленнее, чем
губчатого вещества кости. Прижизнен-
ное микроскопическое исследование
аутотрансплантатов показало, что в ре-
конструкции кортикальных аутотранс-
плантатов вначале превалируют лити-
ческие, а затем остеогенные процессы
137].
В процессе реваскуляризации кро-
веносные сосуды врастают в корти-
кальное вещество и одновременно с
резорбцией кости образуются новые
слои костной ткани ("ползучее" заме-
щение). Эти слои соседствуют с омерт-
вевшими трансплантированными уча-
стками, но в дальнейшем полностью
замещают кортикальную кость и затем
Ремоделируются. Вначале новообразо-
ванная кость не бывает плотной, но
постепенно структура ее приближается
к нормальному строению кортикаль-
ного вещества [213].
Указанные выше особенности мор-
фогенеза аутотрансплантатов позволи-
ли применить аутокость при имплан-
тации [II, 162]. Это также подтвержде-
но нашими наблюдениями. Через 3 нед
После закрытия дефекта и заполнения
пустот в костной ткани в ходе немед-
ленной имплантации на рентгенограм-
ме вокруг имплантата можно было ви-
Деть мелкие кусочки кости и нежную
сеть остеоидных балок. Вокруг верхних
отделов имплантатов был слабовыра-
женный остеопороз — атрофия кост-
ной ткани. Через 1 мес на рентгено-
грамме отмечены увеличение сети ос-
теоидных балок, образование мости-
ков остеоидной ткани, рельеф костной
структуры мини-трансплантатов ста-
новится нечетким. При ремоделирова-
нии блока кости большей величины
остеоидные балки располагаются в на-
правлении аутотрансплантата к краю
имплантата. Через 1,5 мес остеоидная
ткань заполняла участок резорбции
кости по краю альвеолы или ложа им-
плантата и имела беспорядочное строе-
ние, но оставались заметными контуры
фрагментов аутотрансплантатов. Через
3 мес после имплантации на нижней и
через 4—4,5 мес на верхней челюсти на
рентгенограмме регистрировалось об-
разование компактной кости рыхлого
петлистого строения. Имплантат был
интимно связан с костью даже в тех
местах, где ранее имелись пустоты.
Новообразованная кость отличалась
более мелкими костномозговыми про-
странствами. Обнаруживались участки
слабообызвествленной кости. В конце
4-го месяца после вскрытия импланта-
та на нижней челюсти при микроско-
пическом исследовании ткани, взятой
над запорным винтом, выявлено обра-
зование костной ткани крупноячеисто-
го строения с широкими костномозго-
выми пространствами и низкой степе-
нью кальцификации ее трабекул. При
исследовании такого же фрагмента,
располагавшегося над запорным вин-
том на верхней челюсти и потому уда-
ленного позже 6 мес, в новообразован-
ной кости определялись отдельные бо-
лее крупные участки остеоидной ткани.
Через 6—8 мес имплантат распола-
гался в кости. Некоторые фрагменты
костного трансплантата имели вид от-
дельных островков, более интенсивно
насыщенных солями кальция. Через
12 мес вокруг имплантата отмечалась
плотная губчатая кость. Кальцифика-
ция ее была достаточно интенсивной,
строение — плотным. Костные балки
по краям имели четкое и последова-
тельное расположение, кость — мелко-
ячеистое строение и была кальцифи-
цирована. Костномозговые простран-
103
ства были узкими. По краям взятого
фрагмента на отдельных участках бес-
порядочно располагались костные бал-
ки. Вскрытие имплантата через 15 мес
и морфологическое исследование кос-
ти над запорным винтом показали, что
кость имела компактное строение, ко-
стные канальпы были узкими, костно-
мозговые пространства представляли
собой шелевидные образования, за-
полненные волокнистой соединитель-
ной тканью. На одних участках кости
остеоциты не имели ядра, на других
кость была представлена молодой тка-
нью плотного строения. Поверхност-
ный слой кости имел такое же строе-
ние, как плотная кость, причем четко
определялась зона склероза на замыка-
тельной поверхности, прилегающей к
периосту.
У 2 пациентов пожилого возраста
(старше 65 лет) в динамике наблюде-
ний немедленная имплантация с ауто-
пластикой мелкими частицами корти-
кально-губчатой кости закончилась не-
полным образованием костной ткани
по всему периметру имплантата. Оста-
вались только отдельные участки кости
крупнопетлистого строения. По срав-
нению с окружающей костью на этих
участках регистрировалась сниженная
кальцификация. Последующее дина-
мическое наблюдение свидетельство-
вало о медленной перестройке костной
ткани. Такой остеогенез мы связывали
как с возрастом пациентов, так и с на-
грузкой на имплантат (Робустова Т.Г.,
Попова И.В., 2000].
У 3 других пациентов (у одного при
резекции верхушки корня и у 2 при
цистэктомии с резекцией верхушек
двух верхних резцов) была проведена
эндодонтоэндооссальная имплантация
с заполнением костной полости ауто-
костью в виде измельченных частиц.
Изучение рентгенограмм после опера-
ции по восстановлению кости показа-
ло, что уже к концу 4-й недели у всех
больных снизилась прозрачность пато-
логического деструктивного очага и
кусочков аутокости. Наблюдались так-
же отдельные остеоидные балки, иду-
щие от периферии к центру. Через
3 мес очаг почти полностью был запол-
нен костью. На рентгенограммах были
хорошо видны толстые костные трабе-
кулы, появились участки их обызвест-
вления. Через 6 мес очаг во всех случа-
ях был заполнен нормально организо-
ванной костью губчатого строения с
узкими костномозговыми пространст-
вами. Обызвествление наиболее четко
проявлялось по периферии очага. На
центральных участках оно было выра-
жено меньше. Через 1 год очаг был за-
полнен мелкопетлистой костью.
По нашим данным, реконструкция
кортикальных трансплантатов из кор-
тикальной кости, особенно пластин
кости, происходит медленно. Более
стабильный и ранний остеогенез имеет
место при трансплантации губчатой
кости или ее комбинации с кортикаль-1
ной костью в виде небольших блоков,
стружки. Наблюдение за аутотранс-
плантатами большей величины, в кото-
рые, как и на участок альвеолы, были
поставлены имплантаты, показало, что
процессы рассасывания трансплантата, I
перестройки кости и интеграции ее с
имплантатом протекали медленнее. Че-
рез год аутотрансплантат полностью
еше не рассасывался и трансплантат на-
ходился в плотном костном регенерате,
вокруг которого располагались единич-
ные кальцифицированные фрагменты
аутотрансплантата.
Как показали наши наблюдения,!
при пластике накладными кортикаль-I
но-губчатыми аутотрансплантатами
после 1 года их функционирования с
имплантатом потеря альвеолярной кос-
ти составила 1,49 мм, а в последующие
годы — 0,1 мм. Это соответствовало па-
раметрам обычной потери кости при
имплантации без трансплантации [34].
Если в результате значительной не-
хватки кости челюсти постановка им-
плантатов невозможна и требуется
пластика аутокостью, приходится от-
кладывать имплантацию до полной ре-
конструкции кости. Для ускорения ре-
модуляции гти хорошие результаты
дает пересадка блоков аутокости на со-
судистой ножке [106].
Морфологически в пересаженных в
верхнюю челюсть аутотрансплантатах
обнаружено формирование поверхно-
стного слоя волокнистой фиброзной
ткани разной величины [58]. Такую
фиброзную ткань, созданную постав-
ленными в трансплантат имплантата-
MlJt назвали псевдопериодонтом. Учи-
тывая это, рекомендуется на втором
этапе, т.е. при постановке имплантата в
костный трансплантат, иссекать фиб-
розную ткань и тем самым способство-
вать долговечности имплантата [210].
Приведенные выше данные свиде-
тельствуют о том, что пластика ауто-
трансплантатами при зубной импланта-
ции может служить эффективным мето-
дом улучшения остеогенеза вокруг им-
плантатов, способствовать созданию
плотного соединения их с костью |11].
Поэтапное лечение, включающее вна-
чале трансплантацию, а затем имплан-
тацию, ведет к образованию адекватной
кости для опоры всей конструкции.
2.6.2. Морфологические особенности
приживления аллокости
При создании в челюстях условий для
постановки имплантатов имеет значе-
ние также аллотрансплантация. В разра-
ботке аллопластики для устранения де-
фектов челюстей большое участие при-
нимали отечественные клиницисты —
М.А. Плотников. Н.Н. Бажанов,
А.А. Никитин, П.Г. Сысолятин и зару-
бежные ученые Р. Boyne, М. Urist,
R. McKinney. Предложенные ими ме-
тодики широко используются в хирур-
гической стоматологии. Основное дос-
тоинство аллогенных костных транс-
плантатов заключается в том, что почти
при всех методах их обработки уничто-
жается большинство антигенных час-
тиц, в связи с чем значительно снижа-
ются иммунные свойства тканей. При
имплантации пластику аллогенной ко-
стью осуществляют одновременно с
постановкой имплантатов или перед
ней, когда имплантацию производят
Через 6—12 мес после трансплантации.
В отечественной стоматологии наи-
более широко применяют. .’Twyfr'y/jaifr-
Рованные и формализированные ал-
лотрансплантаты. При эксперименталь-
ных исследованиях, касавшихся воспол-
нения дефектов челюстей лиофилизи-
рованной костью, НА. Плотников [27],
Г И. Лаврищева и Г.А. Оноприенко [17]
Установили, что трансформация опти-
мально происходит в компактной кос-
ти, так как в ней не возникает имму-
нологическая реакция [21]. При ал-
лотрансплантации губчатой костью за
счет костного мозга развивается ткане-
вая несовместимость между донорской
и материнской костями, что ведет к от-
торжению подсаженной кости. Через
6 мес после аллотрансплантации кор-
тикальной кости, заготовленной по
методике Лаврищевой, костное веще-
ство трансплантата полностью замеща-
ется новообразованной костной тка-
нью. Сохраняются небольшие участки
старой остеоидной костной ткани ал-
лотрансплантата. Хорошо восстанавли-
вается кровоснабжение кости. В даль-
нейшем происходят окончательная за-
мена аллотрансплантата новообразо-
ванной костью, ремоделирование и
нормализация костной структуры. Ме-
сто соединения аллотрансплантата с
костью материнского ложа неразличи-
мо или едва различимо (рис. 2.5, а),
особенно у деминерализованного ко-
стного матрикса (рис. 2.5, б).
При пластике аллогенными транс-
плантатами следует учитывать состав
кости (кальцифицированная, декальци-
фипированная, поверхностно кальци-
фицированная) [212]. Аллокость, не
подвергшаяся декальцинации, имеет бо-
лее низкие остеоиндуктивные свойства.
Неминерализованные трансплантаты
отличаются значительной атрофией
кости, что препятствует полноценному
восполнению дефекта. У деминерализо-
ванных трансплантатов остеоиндуктив-
ные качества выражены более значи-
тельно, и они лучше обеспечивают вос-
становление кости. Считается, что наи-
более остеокондуктивны специально
очищенные деминерализованные
трансплантаты, так как антигенность их
еще более низка. В настоящее время за-
рубежные клиницисты пластику ал-
лотрансплантатами при зубной имплан-
тации с целью наращивания кости и за-
крыкМм кичпыл дсЛрскюп гца/извцдм i
преимущественно деминерализованной
костью [137]. Вместе с тем описаны слу-
чаи, когда остеогенез наблюдался при
использовании неминерализованных
аллотрансплантатов. При поднятии дна
верхнечелюстной пазухи получали кость
плотного строения [198].
Применяя деминерализованные кор-
тикальные аллотрансплантаты и кост-
Рис. 2.5. Морфологическая картина при
трансплантации аллокости.
а — деминерализованной кости; б — деминера-
лизованного костного матрикса "Dyna-Graft’.
ные опилки для увеличения ширины и
высоты альвеолярной дуги перед им-
плантацией, мы наблюдали обычную
картину остеогенеза. Непосредственно
к зубной имплантации после костной
пластики приступали через 4 мес на
нижней и 6—8 мес, а иногда и более —
на верхней челюсти. При создании ло-
жа для имплантата брали фрагмент ре-
конструированной кости. Микроско-
пически в фрагментах ремоделирован-
ных кортикальных пластинок кости
определялись костная ткань плотного
строения в глубоких слоях и еше не
сформировавшаяся остеоидная струк-
тура с участками хрящевых прослоек,
перемежающихся с участками оссифи-
кации. в поверхностных отделах челю-
стей. В эти же сроки при использова-
нии опилок аллокости отмечалась бо-
лее однородная костная структура с
эндохряшевой оссификацией.
Мы подтвердили также, что наибо-
лее адекватный остеогенез обеспечива-
ют деминерализованные кортикаль-
ные пластинки или порошок. При ис-
пользовании порошка кость восста-
навливалась значительно быстрее. Ме-
зенхимальные клетки вначале диффе-
ренцировались в незрелые хрящевые
клетки — хондробласты. Последние об-
разовывали хрящевую матрицу, кото-
рая в дальнейшем подвергалась окон-
чательной оссификании. В ходе наблю-
дений отмечался нормальный костный
генез мелких частиц деминерализован-
ного костного порошка. Созданная
ими кость имела большую плошадь, чем
та, которую формировали крупные час-
тицы. Нами отмечено также, что при-
живлению деминерализованных пла-
стин кортикальной кости дефекта спо-
собствуют их плотная фиксация и дос-
таточное кровоснабжение восприни-
мающего ложа. При исследовании кос-
ти через 10—12 мес после ее пластики
перед постановкой имплантата выяв-
лялась костная ткань четко выражен-
ного трабекулярного строения.
Используя деминерализованные кор-
тикальные пластинки для поднятия дна
верхнечелюстной пазухи, мы отметили, ।
что образование кости шло медленнее.
Через 12 мес удаленная при создании
ложа имплантата ткань была представ-
лена хрящом с отдельными участками
оссификации. По рентгенологическим
данным, остеогенез ткани вокруг им-
плантатов завершался через 18—20 мес.
Таким образом, изучение морфоге-
неза аллокости показало, что в ранних
стадиях ее пересадки основную роль в
морфогенезе играют ткани восприни-
мающего ложа, так как аллокость ив
содержит жизнеспособных клеток. Со-
суды прорастают к трансплантату, и
неоваскуляризация происходит одно-
временно с остеопластическими про-
цессами, в которых важную роль игра-
ют гигантские клетки. Формируется
соединительная ткань, в дальнейшем
преобразующаяся в остеоидную. Одно-
временно протекающие процессы ат-
рофии и костной индукции в ал-
лотрансплантате обусловливают мед-
ленное депонирование и реконструк-
цию кости. "Ползучее" замещение кости
аллотрансплантата происходит так же,
как аутогенной кости, но медленнее и
во многом зависит от характера предва-
рительной обработки трансплантата и
его вида (блок, порошок, стружка и др.).
Для восстановления дефектов челю-
стей применяют брефокость, состоя-
щую из костной ткани эмбрионов че-
ловека. Эта ткань имеет низкие им-
мунные свойства, и реконструкция
кости из нее происходит быстрее. Эм-
брионопластические ткани характери-
зуются активной остеоиндукцией. Од-
нако достаточно убедительных данных
о морфогенезе брефокости при зубной
имплантации не имеется.
2.6.3. Морфологические особенности
приживления биокерамики
При зубной имплантации материалы
на основе фосфатов и кальция исполь-
зуют не только для покрытия тела кон-
струкции, но и с целью восполнения
кости и повышения остеоинтеграции.
Наиболее широко применяют такие
керамики, как гидроксиапатит и три-
кальций-фосфат. Трикальций-фосфат
не проявляет остеоиндуктивности и не
стимулирует образование кости, но,
обладая костной проводимостью,
обеспечивает образование матрицы
Для отложения кости. При контакте с
костью керамики из кальция и фосфа-
та на основе образующейся матрицы
может сформироваться прямое соеди-
нение с ней (рис. 2.6) [13, 15, 22].
С помощью гранулированной кера-
мики кость наращивают чаще всего за
мес до имплантации. Эксперимен-
тальные исследования свидетельствуют
°б эффективности остеоинтеграции
Имплантатов в тех случаях, когда их ста-
вят спустя 3 мес после увеличения вы-
соты или ширины кости челюсти гид-
роксиапатитом [59]. Однако А. А. Ники-
тин и соавт. (1996) [20] отмечали обра-
зование плотной новой кости и
Интеграцию с ней имплантата при его
Постановке с одновременным наращи-
Рнс. 2.6. Морфологическая картина при
трансплантации трикальций-фосфатной
керамики "Cerasorb".
ванием альвеолярного отростка и под-
нятием дна верхнечелюстной пазухи
гидроксиапатитом.
При электронно-микроскопическом
исследовании тканей из костного очага
с имплантированным гидроксиапати-
том, проведенном М. Jarcho [126, 128]
на 6—10-й день, отмечены наличие ме-
зенхимальных клеток со слабой диф-
ференциацией цитоплазмы и умеренно
выраженное развитие коллагеновых
структур [128]. Среди них располага-
лись скопления ретикулярных клеток в
виде узких канальцев, заполненных
тонковолокнистым содержимым. Во-
круг гранул гидроксиапатита появля-
лись пролиферативные структуры, об-
разовывавшие сеть. Цитоплазма кол-
лагенобразуюших клеток была насы-
щена гранулами эндопластического
материала. На периферии от гранул
располагались более крупные скопле-
ния этого материала с тонковолокни-
стым содержимым. Гиалоплазма имела
вид узких слабоосмиофильных просло-
ек, в которых наблюдались усиление
фибриллопродуцирующих процессов и
активная перестройка волокнистых
структур, вновь образованных с помо-
щью коллагенобластов. Через 2 нед во-
круг гранул образовывалась соедини-
тельная ткань, в последующем преоб-
разовавшаяся в костную. Имелись так-
же участки атрофии мелких гранул
гидроксиапатита, что усиливало ин-
капсуляцию всей массы введенного
биоматериала. На этом участке вновь
построенная кость имела нежный ри-
сунок, костномозговые пространства
________________________________Ш7
Рис. 2.7. Морфологическая картина при
трансплантации гидроксиапатита.
были широкими. Через 6 нед наблюда-
лись зоны неравномерной оссифика-
ции, где более плотные участки пере-
межались с рыхлой костью. Постепен-
но оссификация нарастала, кость за-
полняла все поле вокруг имплантата.
Плотность костного рисунка увеличи-
валась, отмечалось напластование друг
на друга костных балок. Через 6 мес
рисунок кости приближался к нор-
мальному (рис. 2.7).
Практическое применение нами оте-
чественного пористого гидроксиапа-
тита — гидроксиапола для восполне-
ния дефектов кости, в том числе перед
имплантацией, показало, что в течение
5—12 мес образуется костная ткань,
имеющая плотное пластиночное строе-
ние с толстыми костными балками. По
краю кости строение ткани было ком-
плексным. При вскрытии этой ткани на
нижней челюсти через 6 мес и создании
костного ложа для имплантата выяви-
лась неоднородность костной структу-
ры. На дне альвеолы она была менее
плотной, и имплантат входил в нее, не-
сколько пружиня. Вместе с тем у при-
шеечной части имплантата кость была
очень плотной, и остеотомия требовала
длительной работы режущими инстру-
ментами. По данным морфологическо-
го исследования, образовавшаяся кость
отличалась плотным строением и зна-
чительной оссификацией.
При обычной и немедленной им-
плантации рентгенофото.метрически ус-
тановлено, что закрытие дефекта кости
гидроксиаполом обеспечивает интегра-
цию имплантата с костью. Отмечено об-
разование костных балок вокруг гранул
гидроксиапола. При вскрытии участка
кости через 6 мес, перед началом вто-
рого этапа имплантации, обнаружена
плотная кость, взятие которой требова-
ло усилий. Ее гистологическое строение
было представлено костно-цементной
субстанцией со значительной минера-
лизацией ткани. В местах, где были взя-
ты ремоделированный гидроксиапол и
соседняя кость, отмечено интимное со-
единение их между собой. Прилежащая
кость имела мелкопетлистую структуру,
была значительно минерализована, ко-
стномозговые пространства имели вид
узких щелей и были заполнены грубой
соединительной тканью с малым коли-
чеством сосудов. В последующие 6—
12 мес гранулы становились менее
рентгеноконтрастными. Образовавшая-
ся крупнопетлистая кость постепенно
уплотнялась. Через год в ней отдель-
ными плотными вкраплениями выде-
лялись гранулы биоматериала.
При применении гидроксиапола пе-
ред имплантацией дтя остеогенеза наи-
более оптимальным оказалось исполь-
зование крупных гранул материала,
смешанных с кровью, которыми рыхло
заполнялась альвеола. Сгусток с грану-
лами плотно удерживался колаполом,
который устанавливали поверх гидро-
ксиапола и подшив&ли к надкостнице
устья альвеолы, после чего прикрывали
слизистым лоскутом. Через 6 мес при
рентгенофотометрии была хорошо вид-
на плотная замыкательная пластинка,
под которой располагалась кость плот-
ного строения, с четким рисунком ба-
лок, иногда напластовывавшихся друг
на друта. Формирование ложа при по-
становке имплантата на реконструиро-
ванный участок кости не представляло
трудностей. Микроскопически при ис-
следовании новообразованной кости в
зоне кость — гидроксиапатит выявлены
одонтобласты и фибробласты, а также
слой коллагеновых волокон, который
непосредственно прилегал к биомате-
риалу. По периферии от него распола-
гались фибро- и хондробласты. В связи
с тем что кость была взята in vivo только
над запорным винтом, определить
аморфный слой не удалось.
J. Kent и D. Misiek (137) при рекон-
структивных операциях в процессе им-
плантации на челюстях отмечали зна-
lOft
цительную плотность сцепления гид-
роксиапатита и кости, но обращали
нНимание на сохранность контакти-
рующей поверхности. По их данным,
зона сцепления имела толщину от 50
до 200 нм и была представлена мине-
рализованным аморфным веществом,
в котором не было коллагеновых фиб-
рилл. А.С. Панкратов [23], используя
ОСТИМ-100, также обнаружил зону
неструктурированного аморфного ве-
щества на границе кости и биомате-
риала. Тем не менее, поданным М. Jar-
cho [128], керамики из кальция и фос-
фата при контакте с костью могут фор-
мировать прямое соединение с ней.
Все исследователи указывают на высо-
кую минерализацию тканей в этой зо-
не и значительное содержание мукопо-
лисахаридов. Однако многие отмечают
хрупкость образованного костного ма-
териала, который, по их мнению, при
имплантации плохо выдерживает на-
грузки. Однако постановка Н. Tatum
имплантатов в реконструированные ал-
лопластические материалы и их успеш-
ное функционирование свидетельству-
ют о прямо противоположном [208].
Таким образом, во всех исследова-
ниях вновь образованной кости и со-
седней с ней ткани при пластике кера-
микой наблюдалось плотное соедине-
ние титановой поверхности и новооб-
разованной кости. Вместе с тем ис-
пользование гранулированного гидро-
ксиапатита для наращивания кости пе-
ред зубной имплантацией связано с
определенными трудностями при фор-
мировании контура будущей кости.
Чтобы облегчить задачу, предложено
закладывать гранулы гидроксиапатита
н коллагеновые тубы, что обеспечивало
Успех в 95 % случаев. Однако, кроме
формирования контура будущей кос-
ти, возникают и другие сложности. В
частности, оказалось, что пористые
Формы гидроксиапатита и трикаль-
Иий-фосфата могут биосорбироваться,
что до известной степени ограничивает
их изолированное применение.
Плотные керамики еще не нашли
применения в зубной имплантации и в
основном используются в виде им-
плантатов, имитирующих элементы ли-
цевого скелета. Однако работы в этом
направлении продолжаются. Прове-
денные на беспородных собаках экспе-
рименты с целью восполнения альвеолы
удаленных зубов плотной керамикой
позволили М. Jarcho [127] через 6 мес
при микрорадиоангиографии отметить
нормальную структуру кости. Крово-
снабжение близлежащей к трансплан-
тату кости было нормальным, крово-
ток в костных канальцах равномер-
ным. Остеопороз не обнаружен. Взять
кость единым блоком с поставленным
трансплантатом не удалось. При ис-
следовании его контакта с костью вы-
явлена их интимная связь. Костная
ткань, прилегавшая к керамическому
трансплантату, была плотной и харак-
теризовалась четким расположением
клеточных балок. При электронно-
микроскопическом исследовании уча-
стка тканей в контактной зоне транс-
плантат — кость обнаружен тонкий и
прочный минерализованный слой, ко-
торый как бы цементировал его с ко-
стью [126]. Многие исследователи вы-
сказывают предположение, что плот-
ный керамический материал, входя во
взаимодействие с жидкими компонен-
тами тканей на месте контакта транс-
плантата с костью, образует остаточные
продукты и тканевые структуры.
Эксперименты проводились и с им-
плантатами из плотной гидроксиапа-
титной керамики. Как подтверждено
электронно-микроскопическими ис-
следованиями, образуется более интим-
ное соединение их с костью. Аморф-
ный слой между новообразованной ко-
стью и керамикой не превышает
60 мкм. В то же время Т. Ichikawa и со-
авт. [120] выявили резорбцию кости
после постановки имплантатов из
гидроксиапатита, в основном из-за на-
грузки. В ненагруженных имплантатах
из гидроксиапатита отмечался прирост
кости по альвеолярной дуге, тогда как в
имплантатах, подвергавшихся нагруз-
ке, происходила атрофия новой кости.
2.6.4. Морфологические особенности
приживления ксенотканей
В качестве пластических материалов
при зубной имплантации используют
также ксенотрансплантаты, которые
берут от генетически других организ-
Рис. 2.8. Морфологическая картина при
трансплантации "Osteo-Graf’.
Рис. 2.9. Морфологическая картина при
трансплантации "Bio-Oss".
мов — коров, быков, свиней. При зуб-
ной имплантации такие трансплантаты
используют в комбинации с керамика-
ми для предварительного наращивания
кости, закрытия кости во время им-
плантации, коррекции взаимоотноше-
ний имплантата и кости, особенно при
ее нехватке, а также для заполнения
пустот при немедленной имплантации.
Несмотря на то что ксенотранспланта-
ты имеют антигенные свойства, специ-
альная обработка позволяет снизить
этот потенциал, поэтому они фактиче-
ски действуют как биорассасываюшие-
ся остеокондуктивные пластические
материалы. Кроме того, большинство
современных ксенотрансплантатов де-
протеинизировано и деорганизировано,
в связи с чем не оказывает антигенного
действия. К тому же они хорошо по-
глощаются костными минералами 174].
При трансплантации ксеноматериапа
происходит его рассасывание, которое
вызывает костную индукцию, начинаю-
щуюся в тканях воспринимающего ло-
жа. На поверхности ксенотканей обра-
зовавшаяся кость под воздействием ос-
теобластов и остеокластов, с одной сто-
роны, резорбирует трансплантат, с дру-
гой — способствует замене его фиброз-
ной соединительной тканью и ее после-
дующему преобразованию в остеоид-
ную, а затем в костную ткань. Это под-
тверждается морфологическими наблю-
дениями, которые показали, что ис-
пользуемые в настоящее время ксе-
нотрансплантаты из костей коровы
("Bio-Oss”, "Osteo-Graf) резорбируются
остеокластами и заменяются новой ко-
стью [132, 215] (рис. 2.8; 2.9). По-види-
мому, трансплантируемый материал
действует как минеральная матрица,
вызывая продукцию кости и заполне-
ние ею своего каркаса. В отдельных слу-
чаях может наблюдаться образование
только фиброзной ткани [181|.
Использование нами при зубной
имплантации материала "Osteo-Graf
для восполнения дефектов кости, в том
числе при отломе стенки лунки, и для
изоляции от верхнечелюстной пазухи
дало хорошие результаты. Взятая через
6 мес над запорным винтом имплантата
кость имела пластинчатое строение; за-
мыкательная пластина кости по верх-
нему краю была представлена плотной
кортикальной костью. Иногда выявля-
лась упругая волокнистая ткань, при
микроскопическом исследовании ее
обнаруживалось строение незрелой ос-
теоидной ткани по периферии и круп-
нопетлистое костное строение в глубо-
ко лежащих участках.
Несмотря на обнадеживающие ре-
зультаты образования кости при пла-
стике ксенотканями, для имплантации
этот материал может быть использован
лишь при небольшой нехватке костной
ткани. Кроме того, нагрузка на им-
плантат может привести к потере обра-
зовавшейся костной ткани. Вызывает
опасение и возможность формирова-
ния хрящевой или фиброзной ткани.
Все эти нерешенные вопросы морфо-
генеза ксенотрансплантатов свиде-
тельствуют о необходимости дальней-
щих исследований с целью примене-
ния этого материала для зубной им-
плантации.
2.6.5. Морфологические особенности
приживления комбинированных
пластических материалов
В последнее время в клинической прак-
тике доказана перспективность исполь-
зования комбинированных трансплан-
татов. Наибольшее распространение
получили комбинации аутогенных и ал-
логенных трансплантатов, которые до-
полняют друг друга. В первой фазе ау-
тотрансплантат вызывает активное об-
разование кости, а во второй аллодеми-
нерализованный трансплантат увеличи-
вает объем новой костной ткани [144].
Основу комбинации обычно состав-
ляют аллогенные трансплантаты, к ко-
торым добавляют аутогенную кость. В
других случаях фрагмент аутогенной
кости обкладывают измельченной ал-
логенной костью. Эффект такой ком-
бинации достигается тем, что аллоген-
ный трансплантат представляет собой
структурную опору и действует как
стимулятор протеина на костные клет-
ки аутогенной кости костного ложа. В
результате образуется полноценная ко-
стная ткань. Сравнительные исследо-
вания показали, что применение этих
материалов в комбинации дает лучшие
результаты, чем использование каждо-
го из них в отдельности [100].
Аутогенная кость применяется так-
же в комбинации с керамикой. В экс-
перименте на кроликах через 6 нед
комбинированное применение ауто-
генной кости с гидроксиапатитом да-
вало образование еще незрелой кости
Ml, 145]. Этот срок соответствует об-
разованию костной матрицы при пла-
стике только аутокостью и значительно
Уступает срокам реорганизации три-
кальций-фосфата или гидроксиапати-
та. В комбинации аутокости и гидро-
ксиапатита последний играет роль на-
полнителя. В эксперименте на обезья-
нах установлена зависимость остеоин-
4уктивных процессов от соотношения
й комбинации кости и гидроксиапатита,
Характеристики биоматериала и ауто-
Кости [84]. Оптимальным признано со-
отношение 1:1. Наиболее остеоиндук-
тивен трансплантат из губчатого ве-
ществ кости. Меньше подвергается ат-
рофии и не склонно к уменьшению
объема при трансплантации корти-
кальное вещество кости. Эксперимен-
ты показали, что с увеличением доли
аллопластика снижаются остеоиндук-
тивные свойства, и образовавшаяся
ткань структурно несовершенна. Для
комбинации с аутокостью более эф-
фективен трикальций-фосфат 1145].
Для применения при пластике на
челюсти испытывались также раалич-
ные комбинации аллопластических
материалов и аллокости. Однако ре-
зультаты как в эксперименте, так и в
клинической практике значительно
уступали таковым при комбинации с
аутокостью 1198].
В настоящее время известно множе-
ство комбинаций ксенотрансплантатов
и аллопластике в. Их морфогенез осно-
ван на остеокондуктивном свойстве
этих материалов вызывать прорастание
кости в их пористую структуру. Кость
растет от периферии к центру, замещая
трансплантат и одновременно улучшая
его механические свойства.
В последние годы за рубежом стали
применять препарат "OsteoGen", кото-
рый состоит из неспекшегося гидро-
ксиапатита и аллопластика(вариантом
является комбинация гидроксиапатита
с деминерализованной кортикальной
костью). Он обладает также остеоин-
дуктивными свойствами и успешно
применяется для восстановления кости
челюстей при ее атрофии, обеспечивая
хорошее соединение с материнской ко-
стью и активное восполнение дефектов
кости с хорошо выраженной костной
структурой (рис. 2.10) [214]. Отмечен
адекватный остеогенез при комбина-
ции "OsteoGen” с ауто- и аллокостью.
Морфогенез такой комбинации имеет
преимущество, состоящее в том, что
остеоиндуктивные свойства аутокости
увеличивают активность прародитель-
ских костных клеток костного ложа,
вследствие чего усиливается остеогенез
и восполнение кости.
На комбинации коллагена и гидро-
ксиапатита основаны новые отечест-
венные материалы с органическими
наполнителями, такие как "Коллапан"
Рис. 2.10. Морфологическая картина при
трансплантации "OsteoGen".
Рис. 2.11. Морфологическая картина при
трансплантации "Колапола".
[4, 5], "Колапол" (КП 1, КП2. КПЗ) [I,
13, 14], "БАК-1000" |4|.
При использовании "Коллапана",
представляющего собой композит из
гидроксиапатита, коллагена и антибио-
тика, отмечено, что в сроки от 4 до 16
мес формируется остеоидный матрикс,
постепенно превращающийся в пла-
стинчатую зрелую кость, в которой на-
ходятся остатки резорбируемого гид-
роксиапатитсодержашего материала
]5]. По данным оптической и скани-
рующей электронной микроскопии и
морфологических исследований, по-
ристая структура и минерально-хими-
ческий состав обеспечивают полную
инфильтрацию тканевой жидкостью с
последующим образованием костной
ткани как на поверхности, так и внутри
материала (рис. 2.11).
Результаты использования нами в
клинической практике "Коллапана" и
"Колапола" (КП,2,3) для изоляции вер-
хушки имплантата от дна верхнечелю-
стной пазухи, закрытия дефекта кости,
заполнения пустот при немедленной
имплантации дали хорошие результа-
ты. Оцененное с помощью фоторент-
генометрии и компьютерной томогра-
фии ремоделирование материалов под-
тверждает патогистологические дан-
ные, полученные отечественными раз-
работчиками. Через 6 мес после поста-
новки материал трансформировался в
крупнопетлистую кость с несколько
хаотичным расположением костных ба-
лок и отдельными вкраплениями гидро-
ксиапатита, а через 12—15 мес обнару-
живалась плотная, мелкопетлистая
кость с выраженной оссификацией и
отдельными бледными контурами гра-
нул биоматериала.
При исследовании в эксперименте
композиционного материала на основе
полиакриламидного геля и гидрокси-
апола А.И. Воложин и соавт. [8] отме-
тили образование кости с полной ре-
зорбцией композиционного материала.
Они наблюдали повышение активно-
сти ряда основных ферментов крови
как показатель антиоксидантной защи-
ты организма на введение гелевой ком-
позиции в кость. Активность фермен-
тов падала на 7-е сутки после опера-
ции, тогда как концентрация продуктов
перекисного окисления липидов воз-
растала. Это свидетельствует о том, что
в послеоперационный период данный
материал оказывает противовоспали-
тельное и корригирующее действие на
микроциркуляцию. Добавление к мате-
риалу лизоцима снижало выражен-
ность воспалительной реакции.
В последнее время за рубежом из
материалов для пластики при зубной
имплантации наибольшее распростра-
нение получили такие биоматерилы,
как "lnterpore-200", "Perioglass", "Os-
teomin". "Interpore-200" представляет
собой нерастворимое производное ко-
раллового карбоната. Материал имеет
поры диаметром 200 мкм, и 60 % его
массы приходится на пустоты. Будучи
помешенным в ткани, "lnterpore-200"
проявляет остсокондуктивные свойст-
ва и вызывает прорастание ткани в
Рис. 2.12. Морфологическая картина при
трансплантации "lnterpore-200".
Рис. 2.13. Морфологическая картина при
трансплантации "Osteomin".
Рис. 2.14. Морфологическая картина при
трансплантации "Emdogain".
Рис. 2.15. Морфологическая картина при
трансплантации "Pcrioglass".
свою пористую структуру. Динамика
остеогенеза при этом заключается во
врастании соединительной ткани с
большим количеством сосудов в ходе
сложных клеточных взаимодействий и
дифференцировки клеток, в результате
чего происходит остеобластическое
преобразование кости. Через 12 мес
формируется костная ткань, прони-
кающая в глубь трансплантата на 5—
6 мм. Таким образом создается плот-
ный, с хорошими компрессионными
свойствами материал, соединенный с
материнской костью (рис. 2.12). Высо-
кая дифференциация клеток и образо-
вание зрелой кости через 6 мес отме-
чены при использовании "Osteomin"
(рис. 2.13). Образование кости, восста-
новление цемента зуба и периодон-
тальной связки отмечены при лечении
пародонтита с использованием "Ет-
dogain". Этот препарат имеет перспек-
тиву для закрытия дефектов кости у
имплантатов (рис. 2.14). Как в экспе-
рименте, так и в клинике установлены
остеоиндуктивные свойства у биостек-
ла, в том числе отечественного мате-
риала "Биоситал" (рис. 2.15).
2.6.6. Морфологические особенности
направленной регенерации кости
при помощи мембран
При использовании мембран актив-
ный морфогенез обеспечивается их
плотным прикреплением к краям ко-
стного дефекта и созданием под ними
замкнутого пространства, в котором
располагается кровяной сгусток. Реге-
нерация кости при использовании не-
рассасывающихся и рассасывающихся
мембран происходит по принципу ре-
организации кровяного сгустка после
удаления зуба. В созданных таким об-
разом условиях созревающая грануля-
ционая ткань становится богатой кол-
лагеновыми структурами, в которые от
кости врастает остеоидная ткань. Акти-
визация прорастания кости начинается
от краев костного дефекта. Остеогенез
происходит без участия микробных,
клеточных и гуморальных факторов по-
лости рта. От реорганизации кровяного
сгустка в фиброзную, остеоидную и ко-
стную ткань, а также от прорастания
эпителия предохраняет организованная
пористая микроструктура мембраны. В
течение 30 дней процесс образования
костной ткани протекает параллельно
остеокластической резорбции кости,
которая постепенно стихает.
Большинство исследователей счита-
ют, что главное достоинство мембран
заключается в создании барьера против
проникновения в зону раны эпители-
альной ткани, бактерий и в ее гермети-
зации [182]. Это препятствует проник-
новению в закрытое мембраной про-
странство инфекции, благодаря чему в
нем могут свободно мигрировать ос-
теоциты.
Новообразованная ткань заполняет
все пространство под мембраной. Вна-
чале у нее отмечается только петлистое
строение и пространства между трабе-
кулами представляют собой волокни-
стую соединительную ткань. У краев
костного дефекта в костномозговых
пространствах наблюдаются умеренное
полнокровие и отек. Происходит пре-
образование волокнистой соедини-
тельной ткани в остеоидную. Дальней-
шая перестройка новообразованной
кости выражается в образовании губ-
чатой структуры кости по периферии
дефекта и компактной кости по пери-
метру прилежащей мембраны. При
этом замыкательная пластинка хорошо
просматривается. После удаления не-
рассасываюшейся мембраны реорга-
низация продолжается, одновременно
кость обызвествляется. По периферии
скапливаются остеобласты, продолжа-
ется новообразование кости, тогда как в
центре кость принимает все более плот-
ное строение, костномозговые про-
странства сужаются до узких щелей.
Гистологические исследования ос-
теогенеза с помощью мембраны пока-
зали, что его динамика одинакова с ес-
тественным развитием и ростом кости,
но с помощью мембраны этот процесс
идет быстрее, хотя через 4 мес он еще
не заканчивается [191]. По мнению
D. Baser и соавт. [72], для окончатель-
ного созревания кости требуется не
менее 9 мес.
Большая выраженность процессов
остеокластического рассасывания и
более медленное образование кости
отмечены в рассасывающихся мембра-
нах. В то же время в них более выра-
жены процессы экссудации и после-
дующие клеточные реакции. Этим
объясняется повышенная опасность
скопления экссудата, перфорации ос-
татков мембраны и развитие мукозита
с выходом содержимого наружу. Про-
цессы экссудации могут более плавно
переходить в стадию пролиферации с
последующей дифференцировкой кле-
ток, образованием фиброзной, остео-
идной и костной ткани. Воспалитель-
ные явления более выражены на участ-
ках кости по краю дефекта, но число
остеобластов постепенно нарастает, и
кость образуется как на периферии,
так и изнутри остеоидной ткани. Про-
цесс кальцификации, возникающий
позднее, зависит от окончательного
растворения тканевой основы мембра-
ны и наиболее четко выражен на пери-
ферии, ближе к материнской костЯа
Медленнее процесс кальцификации
протекает в глубине новообразованных
тканей.
При рассасывании мембран из поли-
молочной и полигликолевой кислоты
регенеративный этап (формирования
кости) останавливается, продолжаются
ремодуляция и созревание (достижение
полного развития) новообразованной
костной ткани [6]. Сохранение же не-
растворимых мембран до второго хи-
рургического этапа способствует про-
должению формирования кости, кото-
рое, как показали клинические наблю-
дения, может продолжаться даже через
9 мес [197]. После второго хирургиче-
ского этапа вместо классической кости
может начаться формирование кости с
иррегулярным и трабекулярным внеш-
ним строением (рис. 2.16).
Рис. 2.16. Образование кости под мем-
браной "e-PTFE" у имплантата.
Хотя мембрана влияет на заполнение
дефекта новой костной тканью, непо-
средственно в регенерации кости она
не участвует. В связи с этим проводи-
лись обширные исследования с целью
активизации реорганизации кровяного
сгустка и функции костеобразующих
клеток. Применение в данном экспе-
рименте деминерализованной кости
позволило повысить заполнение де-
фекта под мембраной до 75 %. Однако,
по данным гистологических исследова-
ний, при пластике деминерализован-
ной костью потенциал остеогенеза сла-
бый. В матрице отмечается всего 8,3 %
кортикальной кости [208]. Очевидно, в
силу этих обстоятельств без таких кост-
ных добавок дефект под мембраной за-
полнялся новой костью больше (80 %).
Тем не менее эксперименты, проведен-
ные в нескольких зарубежных меди-
цинских центрах, показали, что кост-
ная регенерация при дефектах кости в
пределах 4 мм развивается быстрее, ес-
ли под мембрану ставят био.материал
190]. В другом эксперименте заполне-
ние под мембраной крупного верти-
кального дефекта диаметром 5 мм де-
минерализованной лиофилизирован-
ной костью эффекта не дало. За 4 мес
не произошло ни замены, ни созрева-
ния деминерализованной кости [73].
В эксперименте предпринимались
также попытки повысить потенциал
остеогенеза с помощью гидроксиапа-
тита [112]. Деградация его гранул под
мембраной способствует процессу де-
понирования новой кости [49]. Чем
М’еныце их плотность, тем больше они
на костную интеграцию [167].
Если же гранулы подвижны, то вокруг
них образуется фиброзная ткань. Что
касается количественного показателя
образования новой костной ткани, то
гидроксиапатит не влияет на него.
Эксперименты показали, что если де-
фект заполнен гидроксиапатитом, то
как при наличии мембраны, так и без
нее регенерируется одинаковый объем
новой кости. Использование же мем-
браны без заполнения дефекта биома-
териалом не улучшает образование но-
вой кости, и дефект заполняется так
же, как без мембраны, или улучшение
оказывается незначительным [189].
При заполнении костного дефекта
гидроксиапатитом отдельные исследо-
ватели в эксперименте отмечали вос-
палительные явления и гигантские
клетки чужеродных тел. Такое воспа-
ление носило хронический характер, в
нем участвовали лимфоциты, макро-
фаги и .многоядерные клетки [189].
Воспалительный процесс завершался
фиброзом с участием макрофагов. По-
следние, будучи неспособными фаго-
цитировать имплантированные грану-
лы гидроксиапатита, трансформирова-
лись в фагоциты, генерировавшие кол-
лагеновые волокна, и происходила ин-
капсуляция материала [173|. Ремоде-
лирование гидроксиапатита всегда со-
провождалось наличием макрофагов,
гигантских клеток и лимфоцитов. Все
исследователи отмечали это как в экс-
перименте на животных, так и в клини-
ческой практике. Высказывается мне-
ние, что в процессе биодеградации гид-
роксиапатита и его непрерывной заме-
ны новой костной тканью происходит
фагоцитоз [169]. Другие исследователи
полагают, что в динамическом процес-
се депозита и резорбции кости, если
имеет место инфильтрация макрофага-
ми и многоядерными гигантскими
клетками, под воздействием остеокла-
стов одновременно происходит ре-
зорбция гидроксиапатита и кости [74].
Адекватный остеогенез с заполнени-
ем 95 % объема костного дефекта отме-
чается только при использовании не-
рассасывающейся мембраны "e-PTFE"
("Gore-Tex") с аутогенной костью. Та-
кой результат объясняют тем, что ауто-
кость благодаря большому количеству
остеобластов в ней способствует обра-
зованию новой кости, заполняющей
дефект, улучшает ее перестройку и
структуру, а мембрана в этом процессе
играет роль защитного барьера [182].
Гистологически определено, что при
пластике аутокостью под мембраной
потенциал остогенеза самый большой
и матрица на 61 % состоит из корти-
кальной кости.
Такой же положительный эффект
отмечен при использовании аутоген-
ной кости с рассасывающимися мем-
бранами. Применение в ходе зубной
имплантации полилактицидных и по-
лиглюкоцидных резорбируемых мем-
бран с аутокостью привело к стабиль-
ному и полному остеогенезу в 93,38 %
случаев. Это подтвердило мнение, что
без применения аутокости процесс ре-
организации кровяного сгустка и
функция костеобразующих клеток
оказывались недостаточными для по-
строения костной ткани под мембра-
ной. Иные результаты костной инте-
грации получили W. Becker и соавт.
(51] в эксперименте на собаках с тита-
новыми имплантатами и мембранами.
Дефекты, имевшие под мембраной ау-
тогенную кость, заполнялись новооб-
разованной костной тканью на 95 %, а
деминерализированную — на 75 %.
При использовании только одной мем-
браны без костных добавок новая
кость заполняла дефект на 80 %. Гис-
тологически остеогенез наиболее вы-
ражен при пластике аутокостью, когда
матрица на 61 % состоит из кортикаль-
ной кости. При использовании мем-
бран на кортикальную кость в матри-
цах приходилось 70,2 %, а 29,8 % со-
ставляла грубоволокнистая кость. Са-
мый слабый потенциал остеогенеза от-
мечен при пластике деминерализиро-
ванной костью, когда в матрице име-
лось всего 8,3 % кортикальной кости.
Обнадеживающие результаты полу-
чены при использовании отечествен-
ных гидроксиапатитсодержащих мем-
бран. Они состоят из плотной части,
содержащей коллагеновую ткань, и
губчатого слоя, состоящего из рыхлого
коллагена и гидроксиапатита [7, 10,
19]. В эксперименте при травме лица
уже на 15—20-й день отмечалось скоп-
ление в о коло костных отломках мак-
рофагов и лейкоцитов крови. Сосуды в
зоне травмы были представлены ка-
пиллярами, имевшими связь с сохра-
нившимися сосудами периоста. Увели-
чение количества элементов под мем-
браной, в периосте и костномозговых
пространствах вело к началу регенера-
ционного остеогенеза, характеризовав-
шегося появлением костных балочек с
оксифильным основным веществом, а
вокруг них — остеобластов. По краям
отломков кости располагались остео-
класты, различавшиеся формой и раз-
мерами, а также количеством ядер в
цитоплазме. Активно, с формировани-
ем лакун, происходила остеокластиче-
ская резорбция кости в костных отлом-
ках и клетках остеонов. Между кост-
ными отломками образовывалась сеть
тонких коллагеновых волокон. По
мнению М.Ш. Мустафаева [19], эта
ткань напоминала рыхлую соедини-
тельную ткань с большим содержани-
ем капилляров.
На 30-е сутки заживления костной
ткани отмечалось значительное ново-
образование грубоволокнистой кости,
прораставшей в зону травмы. Актив-
ный процесс костеобразования разви-
вался в направлении как от надкостни-
цы, так и из глубины зоны травмы от
сохранившихся отломков. Активизи-
ровались остеобласты, заполняя собой
пространства между костными отлом-
ками и формируя непосредственно на
них молодое костное вещество. Мем-
брана служила своеобразной матрицей
для образующихся балочек и имела вид
оксифильной пластинки, напоминаю-
щей по окраске основное вещество мо-
лодых костных балочек. Новообразо-
ванная кость у поврежденной кости и
кость в мембране имели вид единого
целого. На 60-е сутки большая часть
дефекта была заполнена костным реге-
нератом, в котором нарастали процес-
сы минерализации и дальнейшей пере-
стройки с формированием пластиноч-
ной кости.
В эксперименте и клинической
практике отмечена зависимость фор-
мирования новой кости под мембра-
ной от анатомической локализации
костного дефекта. При вертикальном
дефекте наблюдаются активное фор-
мирование новой костной ткани и ре-
оссификация [6, 78, 119, 131, 161]. При
горизонтальном дефекте формирова-
ния кости в эксперименте не обнару-
жено [ИЗ]. На морфогенез под мем-
браной определенное влияние оказы-
вают некоторые внешние факторы, в
частности специальные шпильки или
винты, которыми фиксируют мембра-
ны. R Caudvill и R. Meffert [78] отме-
тили, что металлическая фиксация
мембран лимитирует рост кости в при-
шеечной части имплантата.
Мембраны применяют не только с
целью закрытия дефектов кости в ходе
имплантации, но и для предваритель-
ного наращивания кости биоматериа-
лами. В частности, при таких операци-
ях широко и успешно используют мем-
браны ‘‘Gore-Tex", "Парадонкол".
В последние годы развитие биомате-
риалов, в том числе мембран, продол-
жается. На рынке тканей появились
костные мембраны [117], отечествен-
ные коллагеновые мембраны, титано-
вые мембраны. Определенную пер-
спективу для замещения и восстанов-
ления мягких тканей у имплантатов и
над костными тканями имеют такие
аллогенные материалы, как аллокожа
("Alloderm"), перикард и другие пла-
стические материалы.
2.6.7. Стимуляция роста кости
К новому направлению в реконструк-
тивной пластике челюстей для зубной
имплантации относится поиск остео-
индуктивных имплантационных мате-
риалов. Среди них надо выделить ис-
следования по культивированию кост-
ных клеток и последующей их пересад-
ке. Многие ученые с оптимизмом оце-
нивают эту методику, считая ее пер-
спективной для повышения эффектив-
ности зубной имплантации.
Одним из этапов на пути к достиже-
нию этой цели можно считать экспе-
римент, проведенный группой япон-
ских ученых [165]. Из свода черепа мы-
1цей ими были взяты остеобластные
клетки, которые в культуральной среде
за 21 день образовали тонкую пленку,
Легко поддававшуюся манипуляциям.
Изолированная пленка была транс-
плантирована в мышечную ткань мы-
*Пи, где она образовывала коллаген, ос-
Теокальций и алкамин-фосфат, что
подтвердило остеоиндуктивные свой-
ства имплантируемого материала. В
результате был сделан вывод о возмож-
ности культивированием остеобластов
in vitro создавать остеоиндукгивный
имплантируемый материал, который
может прогрессивно влиять на остеоге-
нез кости и имплантата. В.П. Туманов
и соавт. [39] провели динамическую
морфофункциональную оценку куль-
тур фибробластов и установили наибо-
лее оптимальные сроки — 3-и сутки
культивирования — для изготовления
трансплантатов. Именно в этот период
фибробласты имели веретеновидную
или звездчатую форму. В культурах
клеток отмечалось накопление гликоз-
аминогликанов, гликопротеидов и
протеогликанов. С помощью иммуно-
перекисного метода устанавливали вы-
сокий уровень накопления фибронек-
тина в протоплазме клеток. Клетки
культуры формировали богатый экст-
рацеллюлярный матрикс. В межкле-
точном пространстве отмечались раз-
розненные дезориентированные кол-
лагеновые волокна. Трансплантаты из
культур фибробластов с успехом ис-
пользованы для восстановления кости
при заболеваниях пародонта. Это мо-
жет также иметь перспективу для зуб-
ной имплантации.
Перспективным для остеогенеза яв-
ляется применение хитозановых губок,
содержащих рекомбинантный основ-
ной фактор роста фибробластов. Их
экспериментальное изучение показа-
ло, что они способны активизировать
сосудистые и клеточные реакции при
репаративных процессах в кости [5].
Феномен остеоиндукции, впервые
описанный М. Urist в 1965 г. [21], на-
шел новое развитие в современных тех-
нологиях роста кости, которые стали
применяться при зубной имплантации.
Главным источником факторов роста
кости является большая семья ее со-
ставляющих (TGF-p Superfamily). Од-
ним из них является бычий морфогене-
тический протеин (BMP). BMP — экс-
трацеллюлярная молекула, которая
воспроизводит морфогенез, присущий
циклу развития кости; 30—40 % BMP
являются аминокислотами, соответст-
вующими основным видам TGF-p. Под
влиянием ВМР происходит активация
хемотаксиса, подавляется активность
остеокластических процессов в кости,
восстанавливается кровоснабжение и
увеличивается количество остеобласт-
ных клеток, происходит регуляция кос-
теобразующих клеток, увеличивается
синтез костных матриц. BMP регулиру-
ет функцию различных типов коллаге-
на и непосредственно усиливает синтез
коллагена 1 типа. Все эти многофактор-
ные и взаимосвязанные процессы ведут
к построению кости и ее перестройке
[105, 153а]. По периметру имплантата
под влиянием BMP более активно фор-
мируется новая костная ткань [188].
Новым шагом в решении проблемы
роста кости является применение
плазмы крови пациента, обогащенная
тромбоцитами. Освобожденная от кле-
ток красной и белой крови плазма,
обогащенная тромбоцитами (PRP),
также входит в качестве составляющей
в большую семью тромбоцитарных
факторов роста (TGF). Из этой корпо-
рации имеют значение трансформи-
рующий фактор роста р( (TGF-pj),
трансформирующий фактор роста ]}?
(TGF-P2) и инсулиноподобный фактор
роста (IGF) (см. табл. 1.5).
PRP способствует образованию ме-
зенхимальных клеток, усилению их хе-
мотаксиса и остеогенеза. Восстановле-
ние кровоснабжения ведет к актива-
ции остеобластных клеток и построе-
нию костной матрицы с последующим
ремоделированием новообразованной
кости. Таким образом, установлено,
что под влиянием PRP происходит уси-
ление роста новых тканей, прежде все-
го остеоиндуктивных клеточных эле-
ментов. R. Marx и соавт. [153а] указы-
вают на увеличение кости в 2 - Ю4 раз
под влиянием PRP. Авторы подчерки-
вают, что свойства PRP являются ауто-
генными, нетоксичными и неиммуно-
подавляющими. Одновременно уста-
новлено, что под влиянием PRP про-
исходит не только усиление и ускоре-
ние роста кости, но и улучшение ее ка-
чества. Во всех исследованных образ-
цах новообразованная ткань представ-
ляла собой более зрелую и плотную
кость, чем в группах сравнения без
PRP.
Гистологическое исследование PRP с
аутогенным, ксеногенным и синтетиче-
ским материалом, проведенное Н. Ey-
mer, F. Preusse 1105], показало, что до-
бавление фактора роста PRP вело через
8—12 нед к развитию неорганизован-
ной кости без гаверсовой системы.
В процессе последующей перестройки
кость превращалась в кортикальную с
хорошо выраженной гаверсовой систе-
мой.
PRP перспективна для новых откры-
тий в области остеогенеза. Новые тех-
нологии с применением плазмы крови,
обогащенной тромбоцитами, позволя-
ют отказаться от пересадки костного
мозга, уменьшить дополнительную;
травму при взятии аутокости, повысить
остеоинтеграцию зубных имплантатов
и эффективность костно-восстанови-
тельных операций в имплантологии.
Стимуляция остеогенеза возникает
под влиянием "Pep-Gen Р-15", который
также является остеоиндуктивным мате-
риалом. "Pep-Gen Р-15" стимулирует
остеобластные клетки, прародитель-
ские остеоциты, ведет к более активно-
му росту костной матрицы, ремодели-
рованию кости и ее минерализации. 1
Возможность стимуляции увеличе-
ния количества и качества кости под
влиянием биоактивных агентов — фак-
торов роста кости имеет большую пер-
спективу. Вместе с тем остается много
неясных положений в остеогенезе, гак
как процесс построения кости являет-
ся детерминированной реакцией орга-
низма и его ускорение ранее считалось
достаточно проблематичным.
Продолжение морфологических ис-
следований при зубной имплантации
позволит внедрять наиболее эффек-
тивные материалы и повысить долго-
вечность их функционирования.
СПИСОК ЛИТЕРАТУРЫ
1. Аюмирзоев Ф.А. Экспериментально-
клиническое обоснование примене-
ния препаратов группы колапол при
одонтогенных кистах и сложном уда-
лении зубов у детей в условиях поли-
клиники: Автореф. дис. ... канд. мед.
наук. — М., 1998. — 16 с.
2. Ачрахов Э.Г. Сравнительная экспери-
ментально-клиническая оценка отече-
ственных внутрикостных имплантатов:
Автореф. дис. ... канд. мед. наук. — М.,
1986. — 20 с.
118
з.
4
5.
6.
7.
8.
9.
Ю.
И.
12.
Базуда ИВ. Состояние тканей протез-
ного ложа у больных с концевыми де-
фектами зубных рядов при лечении с
использованием имплантатов: Авто-
рсф. дис. ... канд. мед. наук. — М.,
1990. - 22 с.
Белецкий Б.И., Власова Е.Б., Ники-
тин А.А. и др. Химико-биологические
принципы получения остсопроводи-
мого композита БАК-1 000 для челю-
стно-лицевой хирургии // Примене-
ние биокомпозинионных материалов
в челюстно-лицевой хирургии и сто-
матологии. — М„ 1997. — С. 6—7.
Верченко Г.Н., Уразгальдеев З.И., Бу-
дыгин В.Н. и др. Использование пла-
стических материалов на основе гид-
роксиапатита в качестве матрицы
для формирования костной ткани //
Проблемы аллопластики в стоматоло-
гии. — М., 1974. — С. 14.
Венц Б. Разработка рассасывающихся
мембран для регенерации кости //
Клиническая стоматология. — 1998. —
№ 3. - С. 38-43.
Воложин А.И., Лиханов З.Б., Докто-
ров А.А. и др. Особенности построе-
ния костной ткани у поверхности им-
плантата с покрытием гидроксиапати-
та, напыленными эксимерным и СО;
лазером // Стоматология. — 1996. —
№ 6. - С. 3-7.
Воложин А.И., Нидаль Аль Ахмар, Гри-
горьян А.С. и др. Некоторые свойства
композиционного материала на осно-
ве полиамидного геля и гидроксиапо-
ла для пластики костных дефектов //
Биокомпозиционные материалы в че-
люстно-лицевой хирургии и стомато-
логии. - М.. 1997. - С. 15.
Григорян А.С., Кулаков А.А. Анализ
гистоморфологических характери-
стик тканевого материала, полученно-
го при хирургическом удалении зуб-
ных имплантатов // Стоматология. —
1977. - № 7. - С. 30-34.
Дианова Е.Ю. Экспериментальное
изучение отечественных биодегради-
рующих мембран для направленной
регенерации костной ткани: Авто-
реф. дис. ... канд. мед. наук. — М.,
1998. - 17 с.
Дудко А.С. Клинико-эксперименталь-
ное обоснование применения новой
кости и зубных имплантатов: Авто-
реф. дис. ... канд. мед. наук. —
Минск, 1993.
Жусев А.И., Робустова Т.Г., Уша-
ков А.И. Микроциркуляция в слизи-
стой оболочке при эндоосальной им-
плантации // Казанский вестник сто-
матологии. — Казань, 1996. — 133 с.
13. Заплешко Н.Н., Воложин А.Н. и др.
Экспериментально-клиническое обос-
нование применения синтезированно-
го гидроксиапатита при лечении сто-
матологических заболеваний // Новое
в техническом обеспечении стоматоло-
гии. — Екатеринбург, 1992. — С. 121 —
123.
14. Ибрагимов Т.И. Комплексное лечение
пародонтита с применением имплан-
тационных материалов: Автореф. дис.
... канд. мед. наук. — М., 1993. — 23 ci
15. Каширина О.А. Применение биоген-
ного композиционного материала на
хирургическом этапе дентальной им-
плантации: Автореф. дис. ... канд.
мед. наук. — М., 1994. — 25 с.
16. Кулаков А.А. Хирургические аспекты
реабилитации больных с дефектами
зубных рядов при использовании раз-
личных систем зубных имплантатов:
Автореф. дис.... д-ра мед. наук. — М.,
1997. - 27 с.
17. Лаврищева Г.И., Оноприенко ГА. Мор-
фологические и клинические аспек-
ты репаративной регенерации опор-
ных органов и тканей. — М.: Меди-
цина, 1996. — 206 с.
18. Миргазизов М.З., Меликян М.А. Осо-
бенности тканевой интеграции порис-
тых и беспористых имплантатов на ос-
нове титана и его сплавов с памятью
формы И Проблемы стоматологии и
нейростоматологии. — 1999. — № 2. —
С. 41-43.
19. Мустафаев М.Ш. Экспериментальная
апробация и клиническое примене-
ние биорезорбируемых мембран в
комплексном лечении переломов кос-
тей лицевой скелета и при реконструк-
тивных операциях: Автореф. дис. ...
д-ра мед. наук. — М., 1998. — 37 с.
20. Никитин А.А., Пьянзин В.И., Курдю-
мов С.Г. Клиническое применение ос-
теопластических материалов при ат-
рофии альвеолярных отростков челю-
стей. Тезисы докладов 4-й Междуна-
родной конференции "Современные
проблемы имплантологии". — Сара-
тов, 1998. - С. 118-119.
21. Олесова В.Н. и др. Клинико-морфоло-
гическая характеристика слизистой
оболочки полости рта вокруг внутри-
костных имплантатов. Новые методы
диагностики, лечения и профилакти-
ки заболеваний. — Новосибирск. —
1992. - С. 124.
22. Паникаровский В.В., Григорьян А.С.,
Каширина О.А. и др. Эксперименталь-
ное исследование композиции, вклю-
чающей гидроксиапатит и комплекс
коллагена с силимином для непосред-
ственной имплантации // Новое в
техническом обеспечении стоматоло-
гии. — Екатеринбург. — 1992. —
С. 115-118.
23. Панкратов А.С. Лечение больных с
переломами нижней челюсти с ис-
пользованием ОСТИ М-100 (гидро-
ксиапатита ультравысокой дисперсно-
сти) как стимулятора репаративного
остеогенеза: Автореф. дис. ... канд.
мед. наук. — М.. 1995. — 19 с.
24. Параскевич В.Х. Реакция костной тка-
ни на препарирование ложа под ци-
линдрические имплантаты в стомато-
логии: Автореф. дис. ... канд. мед. на-
ук. — Минск, 1991. — 25 с.
25. Пальцев М.А., Иванов А.А. Воспале-
ние, заживление, восстановление. В
кн.: М.А. Пальцева, Н.М. Аничкова.
Патологическая анатомия. — М.: Ме-
дицина, 1999. — С. 140—179.
26. Пауков В. С., Кауфман О. Я. Морфоло-
гия воспаления. Стадии воспаления //
Воспаление / Под рсд. В.В. Серова,
В.С. Паукова. — М.: Медицина,
1995. - С. 176-199.
27. Плотников Н.А. Сравнительная оцен-
ка патоморфологичсских исследова-
ний лиофилизированного и аутоген-
ного костных трансплантатов. "При-
менение лиофилизированных кост-
ных гомотканей в восстановительной
челюстно-лицевой хирургии". — М.:
Медицина, 1979. — С. 66—71.
28. Серов В. В., Пауков В.С. Воспале-
ние. — М.: Медицина, 1995. — С. 630.
29. Туманов В.П., Серов Г.Г., Рунова В.П.
Цитологическая характеристика куль-
туры фибробластов человека и опти-
мальные условия приготовления транс-
плантатов для клиники Ц Новости
клинической цитологии России. —
1997. - № 1. - С. 34-36.
30. Шарин А.Н. Адаптационно-компенса-
ционные изменения в структурных
элементах зубо-челюстной системы
при частичной адентии и способы их
устранения: Автореф. дис.... д-ра мед.
наук. — М., 2000. — 44 с.
31. Ясенчук С.М. Изменение репаратив-
ной регенерации кости при использо-
вании кости и полусинтетического гид-
роксиапатита: Автореф. дис. ... канд.
мед. наук. — М., 1995. — 20 с.
32. Abrahamsson /., Bergtundh Т., Wenn-
strom J., l.indhe J. The periimplant hard
and soft tissues at different implant sys-
tems // Clin. Oral. Impl. Res. — 1996. —
Vol. 7. - P. 212-217.
33. Adell R., Lekholm U., Rockier B., Brane -
mark P.-I. et al. Marginal tissue reactions
at osseointegrated titanium fixtures. I.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
A 3-year longitudinal prospective study //
J. Oral Maxillofac. Surg. — 1986. —
Vol. 15. - P. 39.
Adell R., Eriksson B., Lekholm U., Brane-
mark P.-L, Jemt T. A long-term follow-
up study of osseointegrated implants in
the treatment of totally edentulous jaw //
Int. J. Oral Maxillofac. Impl. — 1990. —
Vol. 5. - P. 347-359.
Albrektsson T., Albrektsson B. Microcir-
culation in grafted bone. A chamber tech-
nique for vital microscopy of rabbit bone
transplants // Acta. OrthoP. Scand. —
1978. - Vol. 49. - P. 1-7.
Albrektsson T., Branemark P.-L, Lind-
strom J. Osscointegrerade benimplantafl
undersokning av interfacezonen // Ab-
stract. Hygiea. — 1980. — N 89. — S.
386.
Albrektsson T. Repair of bone glafts //
Scand. J. Plast. Rcconstr. Surg. — 1980. —
Vol. 14. - P. 1-12.
Albrektsson T. et al. Osseointegrated tita-
nium implants. Requirements for en-
suring a long-lasting, direct bone anchor-
age in man // Acta. OrthoP. Scand. —
1981. - Vol. 52. - P. 155.
Albrektsson T. Direct bone anchorage of
dental implants // J. Prosthet. Dent. —
1983. - Vol. 50. - P. 255.
Albrektsson T., Zarb G., Worthington P.,
Eriksson A. The long-term efficacy of
currently used dental implants: a review
and proposed criteria of success // Int. J.
Oral Maxillofac. Impl. — 1986. —
Vol. 1. - P. 11-25.
Albrektsson T, Gottlander M., Johansson C.
et al. Interface reactions to implant ma-
terials. Vortrag AG I der DGZMK. —
Berlin, 1992.
Albrektsson T, Hansson C„ Sennerby L.
Biological aspects of implant dentistry: Os-
seointegration // Periodontology 2000. —
1994. - Vol. 2. - P. 58-73.
Anselme K., Lane! B, Gentil C. et al One
organotypic culture method: A model for
cytocompatibility testing of biomaterials
// Cells Mater. - 1994. — Vol. 4. -
P. 113-123.
Apse P., Ellen R., Overall C., Zarb G.
Microflora and crcvicular fluid colla-
genase activity in the osseointegrated
dental implant sulcus: A comparison of
sites in edentulous and partially edentu-
lous patients // J. Periodont. Res. —
1989. - Vol. 24. - P. 96-105.
Arvidson K., Fartash B., HiHiges M., Kan-
dell P. Histological characteristics of
peri-implant mucosa around Branemark
and single-crisial sapphire implants H
Clin. Oral Impl. Res. — 1996. — Vol. 7. —
P. 1-10.
46. Axhausen Hz The osteogenctic phases of
regeneration of bone. A historical and
experimental study // J. Bone J. Surg. —
1956. - Vol. 35A. - P. 593-601.
47. Habbush C. Surgical atlas of dental im-
plant techniques. — Philadelphia: Saun-
ders, 1980.
48. Bagambisa F., Joos U., Schilli W. The in-
teraction of osseogenic cells with hy-
droxyapatite implant materials in vitro
and in vivo // Int. J. Oral Maxillofac.
Impl. - 1990. - Vol. 5. - P. 217-226.
49. Bagambisa F., Joos U., Schelli W. Mech-
anisms and structure of the bone between
bone and hydroxuapatite ceramics // Bi-
omed. Mater. Res.—1993. — Vol. 27. —
P. 1047-1055.
50. Bauman G., Rapley J., Hallmon И<, Mills
M. The peri-implant sulcus // Int. J.
Oral Maxillofac. Impl. — 1993. —
Vol. 8, N 3. - P. 264-272.
51. Becker W., Schenk R., Higuchi K. et al.
Variationes in bone regeneration adjacent
to implants augmented with barrier mem-
branes alone or with demineralizcd-freez-
dried bone or autologous grafts: A study in
Dogs // Int. J. Oral Maxillofac. Impl. —
1995. - Vol. 10. - P. 143-154.
52. Berglundh R, Lindhe J., Ericsson I. et al.
The soft tissue barrier at implants and
teeth // Clin. Oral Implant. Res. —
1991. - Vol. 2. - P. 81-90.
53. Berman N. The physiologic and mechan-
ic aspects of the implant technique and
its application to practical cases // Dent.
Dig. - 1952. - Vol. 8. - P. 342.
54. Block M., Kent J., Kay J. Evaluation of
hydroxyapatite-coated titanium dental
implants in dogs // J. Oral Maxillofac.
Surg. - 1987. - Vol. 45. - P. 601-607.
55. Block M., Kent J. Factors associated with
soft- and hard tissue compromise of en-
dosseous implants // J. Oral Maxillofac.
Surg. - 1993. - Vol. 48 - P. 1153-
1160.
56. Boyan B., Schwarz Z., Dean D., Hambier-
ton J. Response of bone and cartilage cells
to biomaterials in vivo and in vitro // J.
Oral Maxillofac. Impl. — 1993. —
Vol. 19. - P. 116-122.
57. Boyne Ph. Treatment of extravasation
cysts with freeze-dried homogenous bone
grafts // J. Oral Maxillofac. Surg. —
1956. - Vol. 14. - P. 206.
58. Boyne Ph., Cole M., Stringer D., Shafqu-
at J. A technique for osseous regenera-
tion of difficicnt edentulous maxillary
ridges // J. Oral Maxillofac. Surg. —
1985. - Vol. 43. - P. 87-91.
59. Boyne Ph. Hydroxyapatite coatings on
dental implants (bone response to
hydroxyapatite) // J. Oral Maxillofac.
Impl. - 1994. - Vol. 20, N 3 -
P. 227-231.
60. Brook /., Craig G., Lamb D. In vitro in-
teraction between primary bone organ
cultures, glass-ionomer cements and hy-
droxyapatite/tricalcium phosphate ce-
ramics U Biomaterials. — 1991 _
Vol. 12. - P. 179-186.
61. Brunski J. Biomaterials and biomecha-
nics in Dental implant design // Int. J.
Oral Maxillofac. Impl. — 1988 —
Vol. 3. - P. 85-97.
62. Bowman A., Gammage D., Meffert R. A
comparison of the soft and osseous tissue
responses of loaded and unloaded
IMZ implants // Int. J. Periodont. Rest
Dent. — 1990. - Vol. 4. — P. 6.
63. Branemark P.-L, Hansson B., Adell R. et
al. Osseointegrated implants in the treat-
ment of the edentulous jaw: experience
from a 10-year period. Stockholm:
Almqvist & Wiksell, 1977.
64. Branemark P.-L, Albrektsson T. Titanium
implants permanently penetrating human
skin // Scand J. Plast. Reconstr. Surg. —
1982. - Vol. 16. - P. 17.
65. Branemark P.-I., Zarb G., Albrektsson T.
Tissue-integrated prostheses. Osseointe-
gration in clinical dentistry. — Chicago-
London—Berlin: Quintessence, 1985. —
P. 29.
66. Budd T., Bielat K., Meenaghan M.,
Schaaf N. Microscopic observation of the
bone-implant interface of surface-treat-
ed titanium implants // Int. J. Oral Ma-
xillofac. Impl. — 1991. — Vol. 6. —
P. 253-258.
67. Burchard Ж, Cobb C., Drisko C. Effects
of chlorhexidinc and stannous fluoride
on fibroblast attachment to different im-
plant surfaces // Int. J. Oral Maxillofac.
Impl. - 1991. - Vol. 6, N 4. -
P. 418-426.
68. Buser D., Warrer K. Karring T. Forma-
tion of a periodontal ligament around ti-
tanium implants // J. Periodontol. —
1990. - Vol. 61. - P. 597.
69. Buser D., Weber H., Lang N. Tissue inte-
gration of non-submerged implants. I year
results of a prospective study with 100
ITI hollow-cylinder and hollow-srew im-
plants // Clin. Oral Impl. Res. — 1990. —
Vol. 1. - P. 33-40.
70. Buser D., Schenk R., Steinemann S. et al.
Influence of surface characteristics on
bone integration of titanium implants. A
istomorphometric study in miniature pigs
I I J. Biomed. Mater. Res. — 1991. —
Vol. 25. - P 889-902.
71. Buser D., Weber H., Donath K. et al. Soft
tissue reactions to none submerged un-
loaded titanium implants in beagle dogs //
J. Periodontol. — 1992. — Vol. 63. —
P. 226-236.
72. Buser D.. Dula K., Belser U. et al. Local-
ized ridge augmentation using guided 83.
bone regeneration. II. Surgical procedure
in the mandible // Int. J. Periodont.
Rest Dent. - 1995. - Vol. 15. -
P. 11-29.
73. Caplanis N., Sigurdsson T, Rohrer M.
Effect of allogeneic, freeze-dried, dem- 84.
ineralized bone matrix on guided bone
regeneration in supra-alveolar peri-im-
plant defects in dogs // Int. J. Oral Max-
illofac. Impl. - 1997. - Vol. 12. -
P. 634-642.
74. Callan D., Rohrer M. Use of bovine-de- 85.
rived hydroxyapatite in the treatment of
edentulous ridge defects: a human clini-
cal and histologic report // J. Periodon-
tol. - 1993. - Vol. 64. - P. 575-582.
75. Cardona M., Simmons R., Kaplan S.
TNF and IL-1 generation by human 86.
monoytes in response to biomaterials //
J. Biomed. Mater. Res. — 1992. —
Vol. 26. - P. 851-859.
76. Carlsson G., Haraldson T. Functional re-
sponse. In: P.-I. Branemark, G. Zarb, T.
Albrektsson. — Tissue integrated pros- 87.
theses: osscointcgration in clinical den-
tistry. — Berlin: Quinlesscnz, 1985. —
P. 155-163.
77. Carisson L., Regner L., Johansson C. et
al. Bone response to hydroxyapatite 88.
coated and commercially pure titanium
implants in the human arthritic knee //
J. OrthoP. Res. - 1994. - Vol. 12. -
P. 274-285. 89.
78. Caudill R., Meffert R. Histologic analysis
of the osseointegration of endosseous im-
plants in simulated extraction sockets
with or without e-PTFE barriers. Part 1.
Preliminary findings // Int. J. Periodont.
Restor. Dent. — 1991. — Vol. 11. —
P. 207-215. 90.
79. Chehroudi B., Ratkay J., Brunette D. The
role of implant surface geometry on min-
eralization in vivo and in vitro: A trans-
mission and scanning electron micro-
scopic study // Cells Mater. — 1992. —
Vol. 2. - P. 89-104.
80. Cheung H., Haak M. Growth of osteob- 91.
lasts on pourous calcium phosphate ce-
ramic: An in vivo model for biocompati-
bility study // Biomatcrials. — 1989. —
Vol. 10. - P. 63-67. 92.
81. Clarke E., Hickman J. An investigation
into the correlation between potential of
metals and their behavior in biological
fluids // J. Bone J. Surg. — 1953. — Vol.
35B. - P. 467
82. Clark A.E. et al. The influence of surface 93.
chemistry on implant interface histology:
A theoretical basis for implant material
selection // J. Biomcd. Mat. Res. —.
1976. - Vol. 10. - P. 161-174.
Clokie C., Warshawsky H. Morphologic
and radioautographic studies of bone for-
mation in relation to titanium implants
using rat tibia as a model // Int. J. Oral
Maxillofac. Impl. - 1995. - Vol. 10. -
P. 155-165.
Cobb C., Eick J., Barker B. et al. Resto-
ration of mandibular continuity defects
using combinations of hydroxyapatite
and autogenous bone: microscopic obser-
vations // J. Oral Maxillofac. Surg. —
1990. - Vol. 48. - P. 268-275.
Cook S., Kay J., Thomas K. et al. Varia-
bles affecting the interface strength and
histology of hydroxyapatite coated im-
plant surfaces // Trans. 12th Ann. Mee-
ting Soc. Biomaterials. — Minneapolis,
Minnesota, 1986.
Cook S., Kay J., Thomas K., Jarcho M.
Interface mechanics and histology of ti-
tanium and hydroxyapatite coated titani-
um for dental implant application // Int.
J. Oral Maxillofac. Impl. — 1987. —
Vol. 2. - P. 15-22.
Cook S., Kay J., Thomas K.. Jarcho M.
Hydroxyapatite coated porous titanium
for use as an prthopedic histologic at-
tachment system // Clin. OrthoP. Rel.
Res. - 1988. - P. 225-230.
Cook S. Evaluation of a hydroxyapatite
(HA) resorbable suture implant for alveo-
lar ridge augmentation // J. Oral Impl. —
1994. - Vol. 20. N 4. - P. 292-298.
Cooper L, Handelman B., McCormack S.,
Guckes A. Binding of murine osteoblastic
cells to titanium disks and collagen 1
gels: implications for alternative interpre-
tations of osseointegration // Int. J. Oral
Maxillofac. Impl. — 1993. — Vol. 8,
N 3. - P. 264-272.
Dahlin C., Lekholm U., Becker Ж et al.
Treatment of fenestration and dehiscence
bone defects around oral implants using
the guided tissue regeneration technique:
a prospective multicenter study // Int. J.
Oral Maxillofac. Impl. — 1995. —
Vol. 10, N 3. - P. 312-318.
Dao T., Anderson J., Zarb G. Is oste-
oporosis a risk factor for osseointegration
of dental implants // Int. J. Oral Maxil-
lofac Impl. - 1993. - Vol. 8. - P. 137.
Dhert H., Klain C„ Wolke J. et al. A me-
chanical investigation of fluorapatite,
magnesiumwhitlockite, and hydroxyapa-
tite plasma-sprayed coatings in goats //
J. Biomed. Mater. Res. — 1991. — Vol.
25. - P. 1183—1200.
Dhert Ж, Clain C., Jansen J. et al. A his-
tological and histomorphometrieal inves-
tigation of fluorapatite, magnesiumwhit-
lockite, and hydroxyapatite plasma -
sprayed coatings in goats // J. Biomcd.
Mater. Res. — 1993. — Vol. 27. —
P. 127-138.
94. de Bruijin J., van Blitterawijk C., Davies J.
Initial bone matrix formation at the hy-
droxyapatite inteface in vivo // J. Bi-
omed. Mater. Res. — 1995. — Vol. 29. —
P. 89-99.
95. de Lange G., Donath K. Intrface between
bone tissue and implants of solid hy-
droxyapatite or hydroxyapatite-coated ti-
tanium implants // Biomaterials. —
1989. - Vol. 10. - P. 121-125.
96. de Lange G., de Putter C., de Wijs F. His-
tological and ultrastnictural appearance
of the hydroxyapatite-bone interface //
J. Biomed. Mater. Res. — 1990. —
Vol. 24. - P. 829-845.
97. de Lange G., de Putter C. Structure of the
bone interface to dental implants in vivo
I/ J. Oral Maxillofac. Impl. — 1993. —
Vol. 19. - P. 123-135.
98. Donath K., Kirsch A. Welche Bedeutung
hat die primare Stabilisation von Implan-
taten fur die ossare Integration wahrend
der Einhcilphasc // Z. Zahnarztl. Impl. —
1986. - Vol 2. - P. 1-11.
99. Donath К., I Mass M., Gunzl H. The hys-
topathology of different foreign-body re-
actions in oral soft tissue and bone tissue
I I Virchows. Arch. Abt. — 1992. — Vol.
A 420. - P. 131.
100. Ellies E. Biology of bone grafting // Se-
lected readings in oral and maxillofacial
surgery. — 1991. — Vol. 2. — P. 1—28.
101. Enneking W. Immunologic aspects of
bone formation in isografts of bone //
Acta. Orthop. Scand. — 1975. —
Vol. 46. - P. 549.
102. Ericsson R., Albrektsson T. Temperature
threshold levels for heat-induced bone
tissue injury: A vital-microscopic study in
the rabbit // J. Oral Maxillofac. Surg. —
1983. - Vol. 50. - P. 101-107.
ЮЗ. Ericsson /., Johansson B.. Rosengren A. et
al Ultrastnictural investigation and anal-
ysis of the interface of retrieved metal
implants. — In: J. Davies (cd). — The
bone-biomaterial interface. — Toronto:
University of Toronto Press. 1991. —
P. 425-437.
104. Ericsson L, Johansson C., Bystedt H., Nor-
ton M. A histomorphometric evaluation
of bone-to-implant contact on machine-
prepared and roughened titanium dental
implants // Clin. Oral Impl. Res. —
1994 - Vol. 5. - P. 202-206.
105. Ericsson I., Nilner K., Klinge B.,
Glantz P- Radiographical and histological
characteristics of submerged and nonsub-
merged titanium implants // Clin. Oral
Impl. Res. — 1996. — Vol. 7. — P. 2—20.
105a.Eymer H., Preusse F. Platelet-Rich Plas-
ma. Erste klinische Bcobachtangen mit
autologen wachstumsfaktoren zur Ver-
besserung augmerhativer Verfahren mit
autologom, xenogenem so wie. Syntehe-
tischem Knochener Satz material // J.
Implantologie. — 1999. — N 4 —
P. 399-405.
106. Frodel J., Funk G., Capper D. et al. Os-
seointegrated implants: A comparative
study of bone thickness in four vascular-
ized bone flaps // Plast. Reconstr. Surg —
1993. - Vol. 92. - P. 449.
107. Frost H. Mechanical determinants of
bone remodelling // Metab. Bone Dis. —
1982. - Vol. 4. - P. 217.
108. Garetto L., Chen J., Roberts И7 Remode-
ling dynamics of bone supporting rigidly
fixed titanium implants: A histomorpho-
metric comparison in four species in-
cluding humans // Implant. Dent. —
1995. - Vol. 4. - P. 235-243.
109. Gottlander M. et al. A histomorphometric
study of unthreaded hydroxyapatite-coat-
ed and titanium-coated implants in rabbit
bone // Int. J. Oral Maxillofac. Impl. —
1992. - Vol. 7. - P. 485-490.
110. Gray J., Elves M. Early osteogenesis in
compact bone isografts; A quantitative
study of contributions of different graft
cells // Calcif. Tissue Int. — 1979. —
Vol. 29. - P. 225-237.
111. Gould T, Brunette D., Westbury L. The at-
tachment mechanism of epithelial cells to
titanium in vitro // J. Pcriodont. Res. —
1981. - Vol. 16. - P. 611-616.
112. Gorfredsen K., Warren K., Hjoreting-
Hansen T. et al. Effect of membranes and
hydroxylapatite on healing in bone de-
fects around titanium implants // Clin.
Oral Impl. Res. - 1991. - P. 172.
113. Grunder U., Hurzeler M., Schupbach P.,
Strub J. Treatment of ligature-induced
peri-implantitis using guided tissue re-
generation: a clinical and histolologic
study in the beagle dogs // Int. J. Oral
Maxillofac. Impl. — 1993. — Vol. 4. —
P. 282-293.
114. Hammerle C., Schmid J., Olah A., Lang N.
A novel model system for the study of ex-
perimental guided bone formation in hu-
mans // Clin. Oral Impl. Res. — 1996. —
Vol. 7. - P. 38-47.
115. Haider R., Watzek G., Plenk H. Effects of
drill cooling and bone stuture on IMZ
implant fixation // Int. J. Oral Maxillofac.
Impl. - 1993. - Vol. 8. - P. 83-91.
116. Hammack B., Enneking W. Comporativc
vascularization of autogenous and ho-
mogenous bone transplants // J. Bone J.
Surg. - I960. - Vol. 42A. - P. 811.
117. Haniseh O, Tatakis N., Boskovic M. et
al. Bone formation and reosseointegra-
tion in peri-implantitis defects following
surgical implatation of rhBMP-2 // Int.
J. Oral Maxillofac. Impl. — 1997. —
Vol. 12. - P. 604-610.
118. Hollister S., Guildberg R., Kuelske C. et
al. Relative effects of wound healing and
mechanical stimulus on early bone re-
sponse to porous-coated implants //
Orthop. Res. — 1996. — Vol. 14. —
P. 654-662.
119. Hurzeler M, Quinones C., Morrison E.,
Caffesse R. Treatment of peri-implantitis
using guided bone regeneration and bon-
egrafts, alone or in combination in bea-
gle dogs. Pan I: Clinical findings and
histologic observations // Int. J. Oral
Impl. - 1995. - Vol. 10. - P. 474-
484.
120. Ichikawa T., Miyamoto M., Horisaka Y.,
Horiuchi M. Radiolografic analysis of a
two-piece apatite implant: Part II. Pre-
liminary report of 2-ycar observation //
Int. J. Oral Maxillofac. Impl. — 1994. —
Vol. 9. N 2. - P. 214-222.
121. Inadome T., Hayashi K., Nakashima Y. et
al. Comparison of bone-implant interface
share strength of hydroxyapatite- coated
and alumina-coated metal implants //
J. Biomcd. Mater. Res. — 1995. — Vol.
29. - P. 19-24.
122. hakura Y., Kosugi A., Sudo H. et al. De-
velopment of a new system for evaluatinf
the biocompatibility of implant materials
using an osteogenic cell line (MC3T3-E1)
// J. Biomed. Mater. Res. — 1988. —
Vol. 22. - P. 613-622.
123. Itakura Y., Tajima T., Ohoke K. et al.
Osteocompatibility of platium-plated tita-
nium assessed in vitro // Biomatcrials. —
1989. - Vol. 10. - P. 489-492.
124. Jacobsson M., Nannmark U.. Turesson /.
Acute Microvascular reactions to ioniz-
ing irradiation in bone-anchored titani-
um implants: a vital microscopic study //
Ini. J. Oral Maxillofac. Impl. — 1987. —
Vol 2, N 4. - P. 193-199.
125. James R. Periodontal considerations in
implant dentistry // J. Prosthet. Dent. —
1973. - Vol. 30. — P. 202.
126. Jarcho M., Jasty V., Gummer K. et al.
Electron microscopic study of a bone-
hydroxyapatite implant interface. Trans-
actions of the 4lh Annual Meeting of the
Society of Biomaterials, San Antonio,
1978. - P. 112.
127. Jarcho M. Calcium phosphate ceramics
as hard tissue prosthetics // Clin.
Orthop. — 1981. — P. 157-259.
128. Jarcho M. Retrospective analysis of hy-
droxyapatite development for oral im-
plant application // Dent. Clin. North
Amer. - 1992. - Vol. 36. - P. 19-26.
129. Johansson C., Albrektsson T. Integration
of screw implants in the rabbit: A I year
follow-up of removal torque of titanium
implants // Int. J. Oral Maxillofac
Impl. - 1987. - Vol. 2. - P. 69-75.
130. Johansson C., Han Ch., Wennerberg A.,
Albrektsson T. A quantitative comparison
of machined commercially pure titanium
and titanium-alluminum-vanadium im-
plants in rabitt bone // Int. J. Oral Max-
illofac. Impl. — 1998. — Vol. 13. —
P. 315-321.
131. Jovanovic S., Kenney E., Carranza F.,
Donath K. The regenerative potential of
plaque-induced peri-implant bone de-
fects treated by a submerged membrane
technique: An experimental study // Int.
J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 13-18.
132. Karring T, Nyman S., Lindhe J. Healing
following implantation of periodontitis
affected roots into bone tissue // J. clin.
Periodontol. — 1980. — Vol. 7. —
P. 96-105.
133. Kato K., Aoki H., Tabata T, Ogiso M.
Biocompatibility of apatite ceramics in
andibles // Biomatcr. Med. Devices Artif.
Organs. - 1979. - Vol. 7. - P. 91-297.
134. Kawaguchi H., Ogawa T., Shirakawa M.
et al. Ultrastructural and ultracytochemi-
cal characteristics of multinucleated cells
after hydroxyapatite implantation into rat
periodontal tissue I I J. Periodont. Res. —
1992. - Vol. 27. - P. 48-54.
135. Kawaguchi H., McKee M., Okamoto H.,
Nanci A. Immunocytochemical and lec-
tin-gold characterization of the interface
between alveolar bone and implanted hy-
droxvapatite in the rate // Cells Materi-
als. - 1993. - Vol. 3. - P. 337-358.
136. Kent J., Block M., Finger I. et al. Biointe-
grated hydroxyapatite-coated dental im-
plants: five-year clinical observation // T
Amer. Dent. Ass. — 1990. — Vol. 121. —
P. 138-144.
137. Kent J., Misiek D. Biomaterials for crani-
al, facial, mandibular and TMJ recon-
struction. — In: R. Fonseca, R. Walker
(eds). — Oral and maxillofacial trauma. —
Philadelphia: W.B. Saunders, 1991. ~~
P. 781-1026.
138. Klein C., de Groot K., van Kamp G. Acti-
vation of complement C3 by different
calcium phosphate powders // Biomate-
rials. — 1983. — Vol. 4. — P. 181 — 184.
139. Kohn M., Cooper E., Ferracane J., H'aite
D. Comarative study of hydroxyapatite
and titanium dental implants in dogs //
J. Oral Maxillofac. Surg. — 1990. —
Vol. 48. - P. 1265-1273.
140. Kraut R.. Dootson J., McCullen A. Bio-
mechanical analysis of osteointegration of
IMZ implants in goat mandibles and max-
illae // Int. J. Oral Maxillofac. Impl. —
1993. - N 2. - P. 7-11.
141. Last K., Cawood J., Howell R., Embry G.
Monitoring of Tfbingen endosseous den-
tal implants by glycosaminoglycans anal-
ysis of gingival crevicular fluid // Int. J.
Oral Maxillofac. Impl. — 1991. —
Vol. 6. - P. 42-49.
142. Last K., Smith S., Pender N. Monitoring
of IMZ titanium endosseous dental im-
plants by glycosaminoglycan analysis of
peri-implant sulcus fluid // Int. J. Oral
Maxillofac. Impl. — 1995. — Vol. 10,
N 1. - P. 58-65.
143. Lekholm U., Ericsson L, Adell S., Slots J.
The condition of the soft tissues at tooth
and fixture abutments supporting fixed
bridges. A microbiological and histological
study // J. clin. Periodontol. — 1986. —
Vol. 13. - P. 558-562.
144. Lekovic V., Kenney E., Garranza F.,
Manignoni M. The use of autogenous pe-
riosteal grafts as barriers for the treat-
ment of class II furcation involvements
in lower molars // J. Periodontol. —
1991. _ Vol. 62. - P. 775-780.
145. Lemons J., Ballard J., Culpepper M., Nie-
mann K. Porous tricalcium phosphate ce-
ramic for segmental lessions (abstract) //
First World Biomaterials Congress. —
Baden (Austria), 1980.
146. Lemons J., Bidez M. Endosteal implants
biomaterials and biomechanics. — In: R.
McKinny (Ed). — Endosteal implants.
Biomaterials and biomechanics. — St.
Louis: Mosby-Year Book, 1991. —
P. 28-36.
•47. Lian J., Stein G. The development stages
of osteoblast growth and differentiation
exibit selective responses of genes to
growth factors (TGF beta 1) and har-
mones (vitamin D and glucocorticoids) //
J. Oral Maxillofac. Impl. — 1993. —
Vol. 19, N 2. - P. 95-105.
•48. Linder L. Osseointegralion of metallic
implants. I. Light microscopy in the rab-
bit // Actra. Orthop. Scand. — 1989. —
, Vol. 60. - P. 129-134.
•49. Linder L., Obrant K.. Boivin G. Os-
seointegration of metallic implants. II.
Transmition electron microscopy in the
rabit U Acta. Onhop. Scand. — 1989. —
Vol. 60. - P. 135-139.
*50. Linkow L. Intra-osseous implants utilized
xs fixed bridge abutments // J. Oral Im-
pl. Transpl. - 1964. - Vol. 10. - P. 17.
151. Linkow L., Giauque F., Ghalili R., Ghali-
li M. Levels of osseointegralion of blade-
plate-form implants. — 1993. — P. 21 —
31.
152. Lum L., Beime 0., Curtis D. Histologic
evaluation of hydroxyapatite-coated ver-
sus uncoated titanium blade implants in
delayed and immediatelly loaded applica-
tions // Int. J. Oral Maxillofac. Impl. —
1991. - Vol. 6, N 4. - P. 456-462.
153. Luthy H., Strub J., Scharer J. Analysis of
plasma flame-sprayed coatings on endos-
seous oral titanium implants exfoliated in
man: preliminary results // J. Oral Max-
illofac. Impl. - 1987. - Vol. 2, N 4. -
P. 197-202.
153a.Afarx R., Carleon E., Eichstadt et al.
Platelet-richt plasma. Gowth factor en-
hancement for bone graft // Oral Surg.,
Oral Med., Oral Pathol., Oral Radiol.
Ended. - 1998. - Vol. 85. - P. 638 -
646.
154. Manin J., Schwartz Z, Hummen T.,
Schraub D. et al. Effect of titanium sur-
face roughness on proliferation, differen-
tiation and protein synthesis of human
osteoblast-like sells (MG63) // J. Bi-
omed. Mater. Res. — 1995. — Vol. 29 —
P. 389-401.
155. Matsuda T. Histological investigation of
improvement of jaw-bone structure for
application hydroxyapatite dental implant
// J. Stomatol. Soc. Japan. — 1989. —
Vol. 56. - P. 289-313.
156. Matsuda T., Davies J. The in vitro re-
sponse of osteoblasts to bioactivc glass //
Biomaterials. — 1987. — Vol. 8. —
P. 275-284.
157. Mayo J., Oenling K.. Andieu S. Bacterial
biofilm: A soure of contamination in
dental air-water syringes // Clin. Prev.
Dent. - 1990. - Vol. 12. - P. 13-20.
158. McKinney R.. Steflik D., Koth D. Evi-
dence for a junctional epithelial attach-
ment to ceramic denial implants: A
transmission electron microscopic study
// J. Periodontol. — 1985. — Vol. 56. —
P. 579-591.
159. McKinney R. et al. The biological tissue
response to denial implants. — In: R.
McKinney (ed). — Endosteal dental im-
plants. — St. Louis: Mosby-year book.
1991.
160. Meffen R. How to treat ailing and failing
implants? // Impl. Dent. — 1992. —
Vol. 1. - P. 23.
161. Meffen R. Treatment of failing dental
implants // Curr. Opin. Dent. — 1992.
- Vol. 2. - P. 109-114.
162. Misch C. Contemporary implant dentist-
ry. — St. Louis (MO): Mosbv-Ycar
Book, 1993.
163. Murai К., Takeshita F., Ayukawa Y. et al.
Light and electron microscopic studies of
bone-titanium interface in the tibia of
young and mature rats // J. Biomed.
Mater. Res. - 1996. - Vol. 30. -
P. 523-533.
164. Murakami I. Scanning electron micro-
scopic study on bone and microvascula-
ture surrounding titanium implants //
J. Jpn. Prosthodont. Soc. — 1995. —
Vol. 39. - P. 123-124.
165. Nagahara K., Mouri K.. Kanematsu N.,
Meenaghan M. An in vivo evaluation of
an osteoinductive implantable material
produced by osteoblastic cells in vitro //
Int. J. Oral Maxillofac. Impl. — 1994. —
Vol. 9, N 1. - P. 41-48.
166. Naji A., Harmand M. Study of the effect
of the surface slate on the cytocompati-
bility of Co-Cr alloy using human ostej-
blasts and fibroblasts // J. Biomed.
Mater. Res. — 1990. — Vol. 24. —
P. 861-971.
167. Neo M., Nakamura T., Ohtsuki C. et al.
Apatite formation on three kinds of bio-
active materials at an early stage in vivo:
A comparison study by transmission
electronic microscopy // J. Biomed.
Mater. Res. - 1993. - Vol 27. -
P. 999-1006.
168. Nilsson P., Albrektsson T, Granstrom G.,
Rockert H. The effect of hyperbaric oxy-
gen treatment on bone regeneration: an
experimental study using the bone har-
vest chamber in the rabbit // Int. J. Oral
Maxillofac. Impl. — 1988. — Vol. 3. —
P. 43-48.
169. Ogilvie A., Frank R., Gineste M. et al.
The biocompatibility of hydroxyapatite
implanted in the human periodontum //
J. Periodont. Res. - 1987. - Vol. 22. -
P. 270-283.
170. Ogiso M.. Tabata T, Ichijo T, Borgese D.
Bone calcificationon the hydroxyapatite
dental implant and the bone-hydroxyapa-
tite interface // Long Term Eff. Med. Im-
plants. - 1992. - Vol. 2. - P. 137-148.
171. Ogiso M., Yamashita Y, Tabata T. et al.
The delay method: A new surgical tech-
nique for enhancing the bone-binding
capability of HAP implants to bone sur-
rounding implant cavity preparations //
J. Biomcd. Mater. Res. — 1994. —
Vol. 28. - P. 805-812.
172. Orr R., de Rruijn J., Davies J. Scanning
electron microscopy of the bone inter-
face with titanium allov and hydroxyapa-
tite // Cells Materials. — Vol. 1992. —
Vol. 2. - P. 241-251.
173. Park J., Lakes R. Tissue response to im-
plants / In: J. Park, R. Lakes (cds). —
Biomaterials: An introduction. 2 ed. —
New York: Plenum Press, 1992. —
P. 123-224.
174. Parr G., Steflik D., Sisk A. Histomorpho-
metric and histologic observations of
bone healing around immediate implants
in dogs // Int. J. Oral Maxillofac. Impl. —
1993. - Vol. 8, N 5. - P. 534-540.
175. Passi P, Terrible Wiel Marin И, Paren-
ti A., Miotti A. Ultrastruclural findings on
the interface between hydroxyapatite and
oral tissues // Quintessence Int. —
1991. - Vol. 22. - P. 193-197.
176. Perala D., Chapman R., Gelfand D.
Compliment activation by dental im-
plants// Int. J. Oral Maxillofac. Impl. —
1991. - Vol. 6. - P. 136-141.
177. Piattelli A., CordioH G., Trisi P. et al.
Light and confocal laser scanning micro-
scopic evaluation of hydrxyapatite resorb-
tion patterns in medullary and cortical
bone // Int. J. Oral Maxillofac. Impl. —
1993. - Vol. 8, N 3. - P. 309-315.
178. Piattelli A., Ruggeri A., Franchi M.
An histologic and histomorphometric
study of bone reactions to unloaded and
loaded non- submerged single implants
in monkevs: A pilot study // J. Oral
Impl. - 1993. - Vol. 19, N 4. -
P. 314-320.
179. Piattelli A., Trisi P., Romasco N.,
Eman ue Hi M. Histologic analysis of a
screw implant retrieved from man: Influ-
ence of early loading and primary stabili-
ty // J. Oral Impl. - 1993. - Vol. 19,
N 4. - P. 303-306.
180. Piattelli A., Piattelli M., Romasco N., Tri-
si P. Histochemical and laser scanning
microscopy characterization of the hy-
droxyapatite-bone interface: an experi-
mental study in rabbits // Int. J. Oral
Maxillofac. Impl. — 1994. — Vol. 9,
N 2. - P. 163-168.
181. Piecuch J. et al. Compressive strength of
implanted porous rcplamineform implants
// J. Biomed. Mater. Res. — 1984. —
Vol. 18. - P. 39-45.
182. Quinones C., Caton J., Mota L. et al.
Evaluation of a synthetic biodegradable
barrier to facilitate guided tissue regener-
ation // J. Dent. Res. — 1990. —
Vol. 69. - P. 13-35.
183. Raha! M., Branemark P.-L, Osmond D.
Response of bone marrow to titanium
implants: osseointegration and the estab-
lishment of a bone marrow-titanium in-
terface in mice // Int. J. Oral Maxillofac.
Impl. — 1993. — Vol. 8, N 5. —
P. 573-579.
184. Ray T. Tire machrophuge response to
implants materials — with special re-
fcence to the used in orthopedics //
CRC Crit. Rev. Biocompat. — 1986. —
Vol. 2. - P. 97.
185. Rigdon R. Tissue reaction for tissue ma-
terials // Crit. Rev. Food Sci. Nutr. —
1975. - Vol. 7. - P. 435.
186. Roberts W., Smith R.K., Zilberman Y. et
al. Osseous adaptation to continuous
loading of rigid endosseous implants //
Amer. J. Orthod. — 1984. — Vol. I. —
P. 95-111.
187. Rosengren F, Johansson B., Thomsen P.,
Ericson L. Immunohistochemical studies
on the disruption of albumin, fibrinogen,
IgG and collagen around PTE and titani-
um implants // Biomaterials. — 1996. —
Vol. 17. - P. 1779-1786.
188. Rutherford R., Sampath T, Rueger D.,
Taylor T. Use of bovine osteogenic pro-
tein to promote rapid osseointegration of
endosseous dental implants // Int. J. Oral
Maxillofac. Impl. - 1992. - Vol. 7,
N 3. - P. 297-301.
189. Salata L., Craig G., Brook I. Bone heal-
ing following the use of hydroxyapatite or
ionomeric bone substitutes alone or
combined with a guided bone regenera-
tion techique: An animal study // Int. J.
Oral Maxillofac. Impl. — 1998. —
Vol. 13. - P. 44-51.
190. Sampath I.., Reddy A. Dissociation ex-
traction and reconstitution of extracellu-
lar matrix components involved in local
bone differentiation // Proc. Natl. Acad.
Sci. USA. - 1981. - Vol. 78. -
P. 7599-7603.
191. Schenk R.. Buser D., Hardwick W., Dahl-
in C. Healing pattern of bone regenera-
tion in membrane-protected defects: a
histologic study in the canine mandible //
Int. J. Oral Maxillofac. Impl. — 1994. —
Vol. 9, N 1. - P. 13-29.
192. Schliephake H., Reiss G., Urban R. et al.
Metal release from titanium fixtures dur-
ing placement in the mandible: an exper-
imental study Ц Int. J. Oral Maxillofac.
Impl. - 1993. - Vol. 8. - P. 502-511.
'93. Schroeder A. et al. The reactions of bone
connective tissue and epithelium to en-
dosteal implants with titanium sprayed
surfaces // J. Oral Maxillofac. Surg. —
1981. - Vol. 9. - P. 15-25.
'94. Sennerby L., Ericsson L., Thompsen P.,
lekholm U., Astrand P. Structure of the
bone titanium interface in retrieved clinical
oral implants // Clin. Oral Impl. Res. —
1991. - Vol. 2. - P. 103-111.
'95. Sennerby L., Thomsen P., Ericsson L.
Early tissue to titanium implants in rab-
bit cortical bone. Part I. Light micro-
scopic observations // J. Mater. Sci.
Mater Med. — 1993. — Vol. 4 —
P. 240-250.
196. Sennerby L., Thomsen P.. Ericson L. Ear-
ly response to titanium implants inserted
in rabbit cortical bone. Pan II. Ul-
trastructural observations // J. Mater.
Sci. Mater. Med. — 1993. — Vol. 4 —
P. 494-502.
197. Simian M., Dahlin C., Trisi P., Piattelli A.
Qualitative and quantitative comparison
study on different filling materials used in
bone regeneration: A controlled clinical
study // Int. J. Pcriodot. Rest. Dent. —
Vol. 14. - P. 199-215.
198. Smiler D., Johnson P., Lozada J. et al. Si-
nus lift grafts and endosseous implants.
Treatment of the atrophic posterior maxil-
la // Dent. Clin. Nonh. Amer. — 1992. —
Vol. 36. - P. 151-186.
199. Smith D., Zarb G. Criteria for success for
osseointegrated endosseous implants // J.
Prosth. Dent. - 1989. - Vol. 62. -
P. 567.
200. Soballe K., Hansen E., Brackstedt-Ras-
mussen H. et al. Hydroxyapatite coating
converts fibrous tissue to bone around
loaded implants // J. Bone J. Surg. —
1992. - Vol. 75. - P. 270-278.
201. Spector M., Cease C., Tong-Li X. The lo-
cal tissue response to biomaterials //
Crit. Rev. Biocompat. — 1989.
202. Steflik D., Sisk A., Parr G. et al. Experi-
mental studies of the implant-tissue in-
terface // J. Oral Maxillofac. Impl. —
1993. - Vol. 19, N 2. - P. 90-94.
203. Steflik D., Parr G., Sisk A. et al. Osteob-
last activity at the dental implant-bone
interface. Transmission electron micro-
scopic and high voltage electron micro-
scopic observationes // J. Periodontol. —
1994. - Vol. 65. - P. 404-413.
204. Steflic D., Sisk A., Parr G. et al. Trans-
mission electron and high-voltage elec-
tron microscopy of osteocyte processes
extending to the dental implant surface //
J. Biomed. Mater. Res. — 1994. — Vol.
28. - P. 1095-1107.
205. Steflik D., Corpe R., Lake F. et al. Com-
posite morphology of the bone and asso-
ciated support-tissue interfaces to os-
seointegrated dental implants: ТЕМ and
HVEM analyses // Int. J. Oral Maxillo-
fac. Impl. — 1997. — Vol. 12. —
P. 443—450.
206. Takeshita F., Ayukawa Y, Suetsugu T. et
al. Histologic investigation of hollow im-
plants retrieved for psychological rea-
sons // Oral Surg., Oral Med., Oral
Pathol., Oral Radiol. Endod. — 1996. —
Vol. 82. - P. 379-385.
207. Takuma M., Harada S., Takashima F. et
al. Experimental study on the function
adaptation to aluminum oxide hydroxya-
patite and titanium implants Ц J. Osaka
Univ. Dent. Sch. - 1987. - Vol. 27. -
P. 111-121.
208. Tatum H„ Lebowitz M., Borger R. Restora-
tion of the atrophic, edentulous mandible
// J. Oral Maxillofac. I mpl. — 1994. —
Vol. 20, N 2. - P. 124-134.
209. Tetsch P., Ackermann K. Konsensus-
Konferenz zur implantologie 18.10.1989
in Mainz // Z. Zahnarztl. Impl. —
1990. - N 6. - S. 5.
210. Tidwell J., BHjdorp P., Stoelinga P. et al.
Composite grafting of the maxillary sinus
for placement of endosteal implants. A
preliminary report of 48 patients // J.
Oral Maxillofac. Surg. — 1992. —
Vol. 21. - P. 204-209.
211. Tracy B., Doremus R. Direct electron mi-
croscopy studies of the bone-hydroxyap-
atite interface // Biomed. Mater. Res. —
1984. - Vol. 18. - P. 719-726.
212. Urist M. Bone transplants and implants.
In: M, Urist. — Fundamental and clini-
cal bone physiology. — Philadelphia:
Lippincott, 1980. — P. 331.
213. Urist M. Isolation and characterization of
bone morphogcnic protein / From E. El-
lis. — Biology of bone grafting // Select-
ed readings in oral and maxillofacial sur-
gery. - 1991. - Vol. 2. - P. 1-28.
214. Valen M. The significance of percursores
in your bone augmentation material.
Proceedings of the 44th annual meeting
and symposium. — Boston, 1995. —
Oct. 26-29. - P. 41.
215. IKrgner J., Perel M. A resorbable bone
fill and its uses in implant procedures //
Dent. Impl. Update. - 1992. - Vol. 3. -
P. 89-93.
216. Wahl G. Postoperative knochenst-
offwechselaktivitaten und ihre bedeutung
bei der belastung von implantaten // Z.
Zahnarztl. Impl. — 1986. — N 2. —
S. 140.
217. Wahl G. Implantateinhcilung im kiefer-
bereich und moglichkeiten szintigra-
phischer kontrollen. — Berlin: Quintes-
senz, 1989.
218. Weiss Ch. Tissue integration of dental
endosseous implants: Description and
comparative analysis of the fibro-osseous
integration and osseous integration sys-
tems // Oral Impl. — 1986. — Vol. 12. —
P. 169-214
219. Ife/ss Ch. Fibro-osteal and osteal inte-
gration: A comparative analysis of blade
and fixture type dental implants support-
ed by cliical trials // J. Dent. Educ. —
1988. - Vol. 52, N 12. - P. 706-711.
220. Wennstrom J., Lindhe J. Role of attached
gingiva for maintenance of periodontal
health. Healing following excisional and
grafting procedures in dogs // J. Clin.
Periodontal. — 1983. — Vol. 10. —
P. 206.
221. Wennerberg A., Albrektsson T., l-ausmaaj.
Torque and histomorphometric evalua-
tion of commercial pure titanium screws
blasted with 25- and 75-mm-sized parti-
cles of AkOj // J. Biomed. Mater. Res. —
1996. - Vol. 30. - P. 251-260.
222. Winer H., Albkretsson T. Wound healing
in the bone chamber Neovascularizaion
during transition from repair to the regen-
erative phase in the rabbit tribial cortex //
J. Oral Maxillofac. Impl. — 1988. —
Vol. 3. - P. 99-107.
223. Yamanaka E., Tjellstrom A., Jacobsson
M., Albrektsson T. Long-term observa-
tions on removal torque of directly bone-
anchored implants in man. — In: N.
Yanagihara, j. Suzuki (eds). — Trans-
plants and implants in Otologi II. —
Amsterdam: Kugler, 1992. — P. 245—
250.
224. Zian J., Steing J. The devertoment stages
of osteoblast growth and differentiation
exibit selective responses of genes to
drowth factors (TGF beta 1) and par-
moncs (vitamin D and glucocorticoids) //
J. Oral Maxillofac. Impl. — 1993. —
Vol. 19, N 2. - P. 19-105.1
Глава 3
МЕСТНАЯ ДИАГНОСТИКА ПРИ ЗУБНОЙ ИМПЛАНТАЦИИ
Диагностика при зубной имплантации
проводится с целью определения воз-
можности и условий для хирургиче-
ского и ортопедического лечения. Ме-
тоды диагностики включают основные
диагностические приемы, принятые в
стоматологии, в том числе в хирурги-
ческой и ортопедической [Курлянд-
ский В.Ю., 1975; Копейкин В.Н., 1993;
Робустова Т.Г., Стародубцев В.С., 1996],
а также специальные методы, разрабо-
танные для диагностики и планирова-
ния лечения с зубной имплантацией и
протезированием с опорой на имплан-
таты [Суров О.Н., 1993; Безруков В.М.,
Робустова Т.Г., 2000; Linkow L., 1971;
Lekholm U., Zarb G., 1985; Misch C.,
1993; Spikermann H. et al., 1995]. По-
скольку для постановки зубных им-
плантатов требуются оперативные
вмешательства различного и часто зна-
чительного объема, прежде всего опре-
деляют показания к имплантации и ус-
ловия в челюстях для ее проведения.
Если вопрос о целесообразности и не-
обходимости имплантации решен по-
ложительно, должно быть оценено об-
щее функциональное состояние орга-
низма пациента. На основании анализа
и результатов местной диагностики со-
ставляют план лечения. О состоянии зу-
бочелюстной системы судят, руковод-
ствуясь принятыми классификациями
полностью и частично беззубых челю-
стей, а также качества кости.
Местные методы клинической, ин-
струментальной и специальной диа-
гностики при зубной имплантации
Представляют собой ряд последова-
тельных и усложняющихся исследо-
ваний.
К диагностическим исследованиям
первого порядка относятся изучение и
инструментальные исследования зубо-
челюстной системы для определения
показаний и противопоказаний к зуб-
ной имплантации. Анатомические и
физиологические особенности обос-
новывают выбор способа опоры зуб-
ных протезов на имплантатах.
Диагностические исследования вто-
рого порядка заключаются в углублен-
ной клинической и рентгенологиче-
ской оценке челюстей для постановки
имплантатов, определении их функ-
ций в зубных протезах с учетом окклю-
зионных взаимоотношений всей зубо-
челюстной системы, а также эстетики
лица в целом. Конечным результатом
являются выбор мест постановки им-
плантатов, их конструкции, размеров и
определение адекватной методики хи-
рургических вмешательств и ортопеди-
ческого лечения.
3.1. Клиническое обследование
больного
3.1.1. Жалобы пациента
и стоматологический анамнез
Важнейшей частью предоперационно-
го обследования пациента является бе-
седа с ним хирурга. В ходе ее выясняют
жалобы на патологические явления в
полости рта и устанавливают анамнез
заболеваний зубов и слизистой обо-
лочки. Несмотря на желание пациента
иметь протезы на зубных имплантатах
и положительную мотивацию этого,
всегда уточняют возможную связь мест-
ных жалоб с общими заболеваниями и
системной патологией. Особое внима-
ние обращаются на жалобы, связанные
с нарушениями слюноотделения, боле-
выми ощущениями при открывании
рта и жевании, кровоточивостью де-
сен, нарушением чувствительности
слизистой оболочки полости рта и др.
Беседуя, врач уточняет анамнез забо-
леваний зубов и слизистой оболочки
полости рта, выясняет, какое лечение
проходил пациент и каковы были ре-
зультаты. Следует учитывать причину
потери зубов и то, как проходило их
удаление, возникшие осложнения и их
последствия.
3.1.2. Внешний осмотр челюстно-
лицевой области
Внешний осмотр челюстно-лицевой
области начинают с осмотра лица ан-
фас и в профиль, определяют положе-
ние головы, отмечают ее конфигура-
цию, симметричность правой и левой
половин, соотношение между верх-
ним, средним и особенно нижним от-
делами лица, в том числе выступание
или западение челюстей по отноше-
нию друг к другу. В.А. Переверзев [19],
А.И. Сидельников [28] считают необ-
ходимым исследовать антро.метриче-
ские периметры лица. Исследования
можно проводить на лице пациента, по
фотографиям больного и телерентге-
нограммам. Основными размерами го-
ловы и лица являются ширина, высота,
длина и глубина. Определяют высоту
лица: морфологическую и физиологи-
ческую. Форма лица, ее ширина и дли-
на зубных рядов взаимосвязаны. Меж-
ду широтным и высотными параметра-
ми лица установлены корреляционные
связи, на основании чего с большой
степенью достоверности можно судить
о реальных размерах челюстей. Это по-
зволяет получить более достоверную
информацию для планирования зуб-
ной имплантации независимо от про-
екционных искажений при рентгено-
логическом исследовании. Оценивают
подвижность мимической мускулату-
ры, симметричность движений мышц с
обеих сторон лица, выразительные
способности во время разговора, сте-
пень и характер обнажения зубов при
разговоре и улыбке, линию улыбки.
Определяют соотношение видимой
части зубов при разговоре и улыбке,
фиксируют чистоту речи [2]. Обращают
внимание на цвет кожных покровов и
красной каймы губ, углов губ, их сим-
метричность, наличие трещин, а также
на цвет слизистой оболочки. Необхо-
димо отмечать выраженность естест-
венных складок лица — носогубных и
подбородочной, морщин, состояние
ротовой щели, симметричности губ, их
выворота или западения. Регистриру.
ют уменьшение размера нижней трети
лица и связь этого с потерей зубов или
нарушением прикуса.
Для зубной имплантации важную
роль играет установление изменений
конфигурации лица: значительная вы-
раженность естественных складок ли-
ца, западение ротовой щели или из-
лишняя складчитость губ, диспропор-
ция в соотношении челюстей. Эстети-
ческие недостатки устраняют или
уменьшают путем правильного выбора
имплантационных систем и их адек-
ватного применения. Однако выявлен-
ные изменения могут носить и ано-
мальный характер как в зубочелюстной
системе, так и во всем лицевом и моз-
говом черепе. Анализ пропорций лица
и разного рода отклонения учитывают
при составлении плана лечения с ис-
пользованием имплантатов [59] (рис.
3.1).
При пальпации можно судить о со-
стоянии мягких тканей, тургоре кожи и
выраженности консистенции подкож-
ной жировой клетчатки. Путем глубо-
кой пальпации определяют костные
контуры лицевого черепа, главным об-
разом в местах соединения костей, же-
вательные и мимические мышцы,
слюнные железы — околоушные и под-
нижнечелюстные. Оценивают чувстви-
тельность выхода периферических вет-
вей тройничного нерва в точках Валле
(надглазничный, подглазничный и
подбородочный нервы), а также нару-
шение чувствительности кожи лица
(анестезия, парестезия, гиперестезия).
При каких-либо нарушениях функций
тройничного нерва определяют так-
тильную, болевую и температурную
чувствительность. У пожилых пациен-
тов изменения в периферических вет-
вях нерва могут быть связаны как с со-
судистыми изменениями, так и с суже-
нием костных каналов, в которых они
находятся. Неврологические симпто-
мы должны быть оценены с позиций
стоматоневрологии, с учетом цели
предстоящего лечения с постановкой
имплантата и его функционирования в
дальнейшем.
Пальпаторно исследуют височно-
нижнечелюстной сустав — головку
мыщелкового отростка и сочленений
130
Рис. 3.1. Анатомо-клиническая классификация лица,
а, б, в — анфас; г, д, е — профиль.
ее с суставной впадиной, определяют
объем движений нижней челюсти при
открывании и закрывании рта и в сто-
роны. При этом отмечают, нет ли хру-
ста в височно-нижнечелюстных суста-
вах и симметричны ли движения ниж-
ней челюсти. Наличие болезненности
суставной головки нижней челюсти,
Усиление болей или нарушение движе-
ний при открывании и закрывании
Рта, хруст могут указывать на заболева-
ние височно-нижнечелюстного суста-
на Такие симптомы, с одной стороны,
требуют обследования на заболевания
°порно-двигательного аппарата, а с
Другой — могут быть связаны с потерей
зубов, нарушением прикуса. После
кинического обследования пациента
Изменения в височно-нижнечелюст-
ном суставе должны быть подвергнуты
Диализу с точки зрения функции сус-
тава при ортопедическом лечении с
Помощью имплантатов.
Осматривают и пальпируют жева-
тельные мышцы (собственно жева-
тельная и височная), оценивают функ-
ционирование внутренней и наружной
крыловидных мышц при их движениях
в стороны. Исследуют также мимиче-
ские мышцы, в том числе поднимаю-
щие верхнюю и нижнюю губу, щечную
мышцу. Особое значение это обследо-
вание имеет в случае отсутствия зубов
и атрофии челюстей. Для зубной им-
плантации важное значение имеет
улыбка и особенности обнажения зу-
бов при ней. При этом необходимо от-
метить величину и форму зубов, соот-
ветствие их форме лица. Определяю-
щим является ширина рта в покое и ее
изменение при улыбке (рис. 3.2), а так-
же симметрия улыбки (рис. 3.3). При
улыбке происходит обнажение перед-
них зубов, что необходимо учитывать,
особенно при имплантации в переднем
отделе челюстей. Определяют основ-
131
Рис. 3.2. Влияние ширины рта на улыбку
[Переверзев В. А., 1987].
а — ширина рта в покос; б — ширина рта при
улыбке.
Рис. 3.4. Наружное измерение лица.
ные размеры лицевого черепа, опреде-
ляющие гармонию лица (рис. 3.4).
Пальпируют регионарные лимфати-
ческие узлы: поднижнечелюстные, под-
подбородочные и остальные шейные, а
также околоушные, губные, шечные и
др. Бимануально прощупывают глубо-
кие ухчы в поднижнечелюстной, под-
подбородочной и щечной областях, а
также околоушные и поднижнечелю-
стные слюнные железы.
Увеличение лицевых и шейных лим-
фатических ухтов может быть реакцией
на воспалительные заболевания, в том
числе в челюстно-лицевой области, а
также симптомокомплексом ВИЧ-ин-
фекции.
Следует обращать внимание сухость
кожи и видимых слизистых оболочек,
увеличение слюнных желез, заеды в уг-
лах рта. При таких симптомах необхо-
димо дополнительное обследование с
целью выявления заболеваний слюн-
ных желез, болезней кожи, опорно-
двигательного аппарата, сердечно-со-
Рис. 3.3. Симметрия улыбки
[Переверзев В. А.. 1987].
а — симметричная; б — асиммет-
ричная.
судистой системы, а также уточнения
снедений о приеме лекарств по поводу
какого-либо заболевания.
3.1.3. Осмотр полости рта
После осмотра лица переходят к обсле-
дованию полости рта. Осмотр начина-
ют с ротовой щели. Определяют форму
губ. ивет слизистой оболочки, наличие
складок в области углов рта, трещин.
Отмечают степень открывания рта и
отсутствие болезненности при движе-
нии нижней челюсти, а также совпаде-
ние или смещение центральной линии
по вертикали при смыкании зубов.
При осмотре преддверия полости рта
определяют цвет слизистой оболочки и
ее увлажненность. Визуально и паль-
паторно устанавливают глубину свода
преддверия рта, состояние прикреп-
ленной и свободной слизистой оболоч-
ки, выраженность уздечек верхней и
нижней губы, наличие складок слизи-
стой оболочки и мышечных тяжей, а
также уровень прикрепления к кости
ряда мимических и жевательных
мышц. Все это важно потому, что в не-
которых случаях перед имплантацией
приходится прибегать к предваритель-
ному хирургическому вмешательству —
пластике уздечек, губ, языка, рассече-
нию слизистых и мышечных тяжей, от-
сечению пучков, перемещению низко-
или высокоприкрепленных мышц,
поднимающих верхнюю и опускающих
нижнюю губу, подбородочных, челю-
стно-подъязычных, особенно в случае
значительной атрофии челюстей. От-
тягивая щеку шпателем, обращают
внимание на возможное наличие на ее
поверхности отпечатков зубов. Бима-
нуально ощупывают жевательную
мышцу и ее передний край. Особое
внимание уделяют выводным отвер-
стиям околоушных слюнных желез и
выделению из них слюны, ее количе-
ству и консистенции.
Осмотр собственно полости рта про-
водят при хорошем ее освещении сто-
матологическим зеркалом, желательно
с вмонтированной в него лампочкой.
Отмечают состояние слизистой обо-
лочки, выраженность уздечки языка,
Подъязычных складок и сосочков. При
оттянутом шпателем языке в сторону
наблюдают выделение слюны из прото-
ка поднижнечелюстной слюнной желе-
зы справа, а затем и слева. На небе ос-
матривают резцовый сосочек, небные
ости и борозды, оценивают цвет, ув-
лажненность слизистой оболочки в об-
ласти небных отростков верхней челю-
сти, а также особенности их соедине-
ния, в частности выраженность торуса.
Одновременно уточняют концентра-
цию давления при жевательных движе-
ниях, в том числе возможный характер
давления при включении имплантатов
для опоры будущих ортопедических
конструкций.
Слизистую оболочку десен исследу-
ют с вестибулярной и оральной сторо-
ны. При этом определяют ее цвет, ана-
томическое состояние десневых же-
лобков, клинического десневого и па-
родонтального карманов. Отмечают
наличие зубной бляшки, зубного кам-
ня и состояние гигиены полости рта.
При помощи зубного зонда уточняют
глубину пародонтального кармана со
всех сторон зуба, отмечают наличие
поддесневого и наддесневого зубного
камня. Руками или пинцетом опреде-
ляют подвижность зубов, которая име-
ет большое диагностическое значение
для планирования зубной импланта-
ции. При необходимости пациент дол-
жен быть осмотрен терапевтом или па-
родонтологом. Следует углубленно
оценить пародонтологический статус,
определить пародонтальный индекс и
потребность в лечении. Все зубы об-
следуют зондом с целью обнаружения
кариозных полостей и некариозных
дефектов эмали, а также качества стоя-
ния пломб. Тщательно оценивают дис-
топию при наклоне отдельных зубов
или их групп, уточняя такие возмож-
ные причины этих явлений, как забо-
левания пародонта, нарушения прику-
са и т.д. О реакции периодонта можно
судить при перкутировании по режу-
щему краю резцов и клыков и жева-
тельной поверхности премоляров и
моляров.
Если у пациентов имеются искусст-
венные коронки, мостовидные проте-
зы и другие ортопедические конструк-
ции, то обращают внимание на приле-
гание их к зубу, отношение с межзуб-
ными сосочками и слизистой оболоч-
Рис. 3.5. Прикус [Курляндский В. Ю.,
а — вид спереди; б — вид сзади; в — виды
смыкания зубов в ортогнатическом прикусе.
кой соответственно альвеолярной дуге.
Осматривая верхнюю и нижнюю челю-
сти, отмечают контуры альвеолярных
дуг и положение в них зубов [2, 12, 14].
Ощупывают альвеолярный отросток
верхней челюсти и альвеолярную часть
нижней челюсти (альвеолярные бугры и
альвеолярные возвышения). Осматри-
вая альвеолярную часть нижней челю-
сти, определяют выраженность челюст-
но-подъязычной линии. Размеры и
форма альвеолярного отростка бывают
различны. Если он выступает и тонкий,
то при постановке имплантата может
разломиться, возникнет перфорация и
обнажится имплантат. На том участке,
где зубы отсутствуют, пальпируют аль-
веолярные отростки челюстей и альве-
олярные гребни для определения их
размеров и состояния слизистой обо-
дочки. Таким путем получают первона-
чальную информацию о ширине кости
л прикрепленной слизистой оболочке.
Проверяют также соотношение зу-
бов, особенно их жевательных поверх-
ностей, нижней и верхней челюстей
при закрытом рте в центральной окк-
люзии и определяют вид прикуса. Ат-
рофия кости всегда более выражена
при потере зубов на верхней челюсти,
поэтому прикус бывает нарушен. Боль-
шое влияние на планирование зубной
имплантации оказывают аномальные
прикусы — глубокий, открытый и пе-
рекрестный. На постановке импланта-
тов отражаются также физиологиче-
ские разновидности прикуса — проге-
ния, прогнатия, бипрогнатия и прямой
прикус (рис. 3.5).
Особенности прикуса во многом
предопределяют показания и возмож-
ности зубной имплантации. Для оцен-
ки прикуса пациенту предлагают сде-
лать поэтапные движения нижней че-
люстью из центральной окклюзии в
крайние положения — вбок и вперед.
Осматривают также окклюзионные
контакты отдельных зубов, в том числе
искусственных зубов в ортопедических
протезах. В результате уточняют кон-
центрацию давления при жевательных
Движениях, в том числе ее возможный
характер при включении имплантатов
в качестве опор ортопедических конст-
рукций [18].
Снова отмечают совпадение линий,
проходящих между центральными рез-
цами обеих челюстей. Обязательно ис-
следуют окклюзионные плоскости, от-
вечая степень совпадения их с компен-
сационной кривой Шпрее (рис. 3.6).
При имплантации в области цен-
тРальных зубов, особенно верхних, в
случае отсутствия многих зубов в этой
области следует уточнить динамиче-
ские состояния лица (разговор, улыб-
*а. смех). Необходимо отметить линию
Обнажения зубов на верхней челюсти.
Затем тщательно осматривают язык.
Определяя его форму, размер, состоя-
Рис. 3.6. Взаимоотношения окклюзион-
ной плоскости с краем верхней губы
[Переверзев В. А., 1987).
а — параллельность линии; б — незначитель-
ное нарушение окклюзионной плоскости; в —
значительное.
ние слизистой оболочки, ее цвет и сте-
пень влажности, выраженность сосоч-
ков. Обращают внимание на яркий
цвет языка, сухость покрывающей его
слизистой оболочки, выраженность
или атипию сосочков. Такие симпто-
мы могут наблюдаться при заболева-
нии языка или свидетельствовать о бо-
лезнях желудочно-кишечного тракта,
печени. В положении, при котором
язык удерживается марлевой салфет-
кой, исследуют мягкое небо — небный
язычок, небно-язычные и небно-гло-
точные дужки, а также заднюю стенку
глотки, небную миндалину, трубонеб-
ную складку — и оценивают глоточный
рефлекс. В истории болезни записыва-
ют зубную формулу, а при поражении
пародонта и одонтопародонтограмму.
Во время внешнего осмотра и при
исследовании преддверия и собственно
полости рта ориентировочно оценива-
ют функциональные и эстетические
нарушения, получают предваритель-
ную информацию о количестве кости и
конфигурации альвеолярных отрост-
ков. состоянии слизистой оболочки, а
также функции мимических, жеватель-
ных и других мышц, отходящих от че-
люстей или прикрепляющихся к ним.
Определяют состояние височно-ниж-
нечелюстных суставов и окклюзионные
взаимоотношения зубов верхней и
нижней челюсти.
3.1.4. Предварительный
диагноз
На основании результатов беседы с
больным, его осмотра и клинического
обследования ставят предварительный
диагноз. На его основе устанавливают
предварительные показания и проти-
вопоказания к зубной имплантации.
Первоначальное клиническое обследо-
вание может обнаружить убедительные
противопоказания дентальной им-
плантации в связи с наличием кариоз-
ных зубов и заболеваний периодонта,
болезнями пародонта (особенно гене-
рализованными формами пародонто-
за), плохой гигиеной полости рта, по-
ражениями слизистой оболочки по-
лости рта. В одних случаях обнаружен-
ные патологические явления (кариес и
его осложнения, пародонтит, низкая
гигиена полости рта) оказываются от-
носительными противопоказаниями к
имплантации и могут быть сняты по-
сле санации полости рта [25]. В других
случаях они остаются абсолютными,
как, например, при генерализованном
пародонтозе, заболеваниях слизистой
оболочки полости рта или при патоло-
гическом прикусе [31]. Следует иметь в
виду, что отдельные отклонения от
нормы, такие как патологический при-
кус и нарушения жевательной муску-
латуры, могут быть корригированы в
ходе предымплантационного лечения.
В первом случае проводят коррекцию
окклюзии, во втором — лечение мио-
артропатии. Вместе с тем бруксизм
(скрежетание зубами во сне), который
не поддается лечению, является абсо-
лютным противопоказанием к им-
плантации [68, 117].
При зубной имплантации необходи-
мо принимать во внимание продолжаю-
щийся в юношеском возрасте рост кос-
тей. Молодым людям нельзя ставить
имплантаты, пока не закончится рост
кости [91,94, 105]. D. Dausch-Neumann
[ 581 считает, что у девушек зубную им-
плантацию можно производить при их
приближении к 20-летнему возрасту,]
а у молодых людей — в возрасте от
20 лет.
Зубная имплантация считается пока-
занной только в отсутствие стоматоло-1
гических заболеваний, при санирован-
ной полости рта, ортогнатическом при-
кусе или благоприятных ситуациях в
случаях других разновидностей физио-
логического прикуса и обязательно —
при хорошей гигиене полости рта.
3.1.5. Инструментальные
исследования лица,
челюстей, зубов
Если прямые противопоказания отсут-
ствуют, то врач приступает к дальней-
шему обследованию, задачей которого
является определение следующих мо-
ментов: 1) влияние и эффективность
имплантатов на функцию жевания и
эстетику зубочелюстной системы, эс-
тетику лица в целом; 2) определение
количества и качества кости для им-
плантации; 3) количество, позиция и
ориентация имплантатов.
Проводят изучение лица анфас и в
профиль при различных его состояни-
ях — покое, разговоре, улыбке. Боль-
шое значение следует придавать линии
улыбки, особенно при имплантации в
области центральных зубов. Однако
только описательный метод, фотоста-
тическое исследование моделей челю-
стей, ориентированных к взаимопер-
пендикулярным плоскостям головы,
не позволяют полноценно диагности-
ровать патологию и планировать зуб-
ную имплантацию. Исследование мяг-
ких тканей лица: степень их развития,
рельеф, форма, активность мимиче-
ских и жевательных мышц, эластич-
ность кожи и количество подкожной
жировой клетчатки, отражает как ин-
дивидуальные особенности,так и эсте-
тические нарушения, связанные с ут-
ратой зубов, атрофией кости, возрас-
тными изменениями.
Днтрометрические исследования лица
для зубной имплантации. Потеря зубов,
индивидуальные особенности строе-
ния челюстей и всего лицевого черепа
может создавать деформации зубоче-
люстной системы. По данным Нацио-
нального института здоровья США, у
35 % населения имеются аномалии и де-
формации лицевого черепа, поэтому
при обследовании необходимо устано-
вить размеры лица анфас и в профиль,
сравнивая симметричные участки. Уста-
навливают анатомо-клиническую клас-
сификацию лица и фиксируют его тип:
удлиненный, средний, укороченный
(см. рис. 3.1). Отмечают размеры ана-
томических образований средней зоны
лица — глазницы, верхней челюсти,
скуловых костей. Большое значение
имеют изменения верхней челюсти в
связи с утратой зубов. Исследуют ниж-
нюю зону лица — нижнюю челюсть, в
том числе при адентии. Нижняя че-
люсть содержит значительное количе-
ство губчатого вещества. Его качество,
расположение создают лучшие условия
для имплантации, нежели плоская
кость — верхняя челюсть. Отмечают
положение и смыкание верхней и ниж-
ней губ и при этом степень обнажения
зубов (рис. 3.7). Важное значение име-
ют ширина рта и обнажение слизистой
оболочки альвеолярного отростка при
разговоре или улыбке (рис. 3.8) и сим-
метрия последней (см. рис. 3.3). Изме-
рения проводят на основании фикси-
рования общепринятых антропомет-
рических точек, по которым определя-
ют лицевые параметры.
Зубная имплантация ставит своей
Целью восстановление не только функ-
ции и эстетики зубочелюстной систе-
мы, но и достижение гармонии лица.
Поэтому при планировании зубной
Имплантации необходимо определять
параметры лица. Измерение парамет-
ров лица производится по правилам
антропометрии [19] (рис. 3.9). Наи-
большее значение имеют бигониаль-
ная ширина, высота верхней и нижней
челюсти по средней линии.
Симметричность и пространствен-
ное положение частей лица следует со-
Рис. 3.7. Степень обнажения зубов
Исверзев В. А., 1987).
степень; б — III степень; в — IV степень;
г — видны нижние зубы.
Рис. 3.8. Типы обнажения зубов в про-
филь (Переверзев В. А., 1987].
а, б — гармоничное обнажение зубов; в — об-
нажение альвеолярного отростка.
1
Рис. 3.9. Антропометрическое исследование лицевого скелета.
а — измерительные приборы: 1 — остеометр, 2 — линейка, 3 — циркуль; б, в — размеры
лица анфас; г, л — размеры лица анфас и в профиль на черепе: 1 — наибольшая скуловая
ширина, 2 — морфологическая высота лица, 3 — ширина основания лица, 4 — высота ветви
нижней челюсти, 5 — высота верхней челюсти по средней линии, 6 — высота нижней че-
люсти по средней линии.
измерять с ориентировочными плос-
костями головы (рис. 3.10).
Антрометрические параметры лице-
вого черепа в соответствии с высотой,
шириной трех ее частей — верхней,
средней и нижней позволяют доста-
точно точно установить тип строения
лица анфас и в профиль. В последую-
щем следует проводить сравнительную
характеристику антрометрических па-
раметров пациента и его телерентгено-
грамм. Вместе с тем для достоверности
необходимо проводить не только ли-
нейные замеры, но и угловые, а также
установить особенности наклона осно-
вания черепа по отношению к гори-
Рис. 3.10. Плоскости головы
[Курляндский В. Ю., 1970].
а — краниометрическая; б — ухоглазничная
и фронтальная; в — сагиттальная.
зонтали. Это позволяет определить вы-
соту средней зоны лица, тип строения
нижней челюсти, высотные, широтные
характеристики альвеолярного отрост-
ка и тела верхней челюсти, тела и ветви
нижней челюсти, окклюзионную плос-
кость (см. рис. 3.4). Для зубной им-
плантации среди всех антрометриче-
®ких исследований наибольшую ин-
формацию дают высотные характери-
стики верхней и нижней челюстей по
средней линии и бигониальная шири-
на их. При физиологическом прикусе
Нижняя челюсть имеет три типа строе-
ния, часто почти с прямым гениаль-
ным углом и бигониальным размером
°коло 11 см. Величины ширины ветви
и высоты тела, уравновешенные с раз-
мерами альвеолярной части и зубов,
создают параллелизм с краем нижней
челюсти, совпадение оси резцов с ее
базисом. При втором типе строения
нижней челюсти тело имело нормаль-
ное строение с тупым гениальным уг-
лом и бигониальным размером около
7 см. Третий тип характеризуется длин-
ной ветвью, нормальным или коротким
телом, гениальный угол острый, биго-
ниальный размер около 7 см. Наилуч-
шие условия, эстетический и функ-
циональный успех зубной импланта-
ции отмечен у пациентов с показате-
лем высоты верхней челюсти 14 мм,
нижней челюсти 32,5 мм, бигоииаль-
Рис. 3.11. Зависи-
мость ширины
центральных зубов
от ширины рта
[Переверзев В. А.,
1987].
а — нормальная ве-
личина зубов; б —
узкие зубы; в — ши-
рокие зубы.
ной ширины от
95 мм. Это созда-
ет лучшие усло-
вия для создания
в гармонии лица.
В прямой кор-
релятивной взаи-
мосвязи с показателями основных па-
раметров мягких и костных тканей ли-
ца находятся окклюзионные взаимоот-
ношения при ортогнатическом прику-
се. Однако потеря зубов, атрофия кос-
ти, возрастные изменения наиболее
выражены в характеристике мягких тка-
ней — изменении формы, образовании
складок, морщин, борозд. Последние
связаны со снижением упругости мяг-
ких тканей, разной характеристикой
морщин, особенностями мышечного
тонуса.
Антропометрические параметры ли-
ца у мужчин превосходят таковые у
женщин. Различия в линейных пара-
метрах лица у мужчин и женщин со-
ставляют больше 1,5—10 мм. Однако
следует иметь в виду, что при измере-
нии лица высотные и широтные кра-
ниометрические параметры могут да-
вать на 1,3—3 мм больше истинных,
так как в зону измерений попадают
мягкие ткани. Вместе с тем высота аль-
веолярного отростка верхней челюсти
у мужчин и женщин не имеет сущест-
венных различий и зависит от особен-
ностей строения верхнечелюстной
пазухи. Широтные и высотные пара-
метры лица коррелируют между собой
При исследовании полости рта так-
же проводят измерение зубов, альвео-
лярного отростка верхней челюсти и
альвеолярной части нижней челюсти.
Измеряют ширину, высоту коронок
зубов, в том числе в зоне имплантоло-
гического интереса, фиксируют ме-
диодистальный диаметр — у режущего
экватора, толщину коронки между
наиболее выпуклыми пунктами на вес-
тибулярной и оральной поверхностях.
Ширину, высоту и толщину следует
измерять у шести верхних и нижних
центральных зубов (рис. 3.11).
Определяют высоту и ширину альвео-
лярного отростка верхней челюсти и
альвеолярной части нижней челюсти, а
также состояние прикрепленной и сво-
бодной слизистой оболочки. Кость из-
меряют специальной линейкой, остео-
метром, циркулем [28] (рис. 3.12, а, б).
Замеры от наружной вестибулярной
точки можно делать штангенциркулем.
По вертикали высоту кости определяют
клинически, а затем полученные дан-
ные переносятся на рентгенограмму.
Ширину кости альвеолярной дуги сле-
дует замерять в нескольких точках, так
как ее толщина и внутренняя архитек-
тура на разных участках верхней и ниж-
ней челюсти различны [42J. Одновре-
менно отмечают степень обнажения
зубов, что имеет принципиальное зна-
чение при имплантации в области
центральных зубов (см. рис. 3.7; 3.8).
Определяют ширину зубной дуги —
у центральных и боковых резцов, клы-
ков, премоляров и моляров, высоту
преддверия рта и степень резцового
перекрытия.
Оценку клинического состояния
альвеолярного отростка верхней челю-
сти, альвеолярной части нижней челю-
сти и зубов дополняют замерами тол-
щины слизистой оболочки. Это позво-
ляет реально судить не только о мягких
тканях, но и о ширине имеющейся
кости (рис. 3.12, б).
После обезболивания при помоши
иглы или специального инструмента
определяется как толщина слизисто-
надкостничного покрова, так и размер
кости от наружной поверхности корти-
кального слоя [117]. Некоторые авторы
рекомендуют для определения толщи-
ны слизистой оболочки и надкостницы
использовать резонансную томогра-
фию [5, 84, 137]. Однако проведенное
G. Mailath и соавт. [97] на трупах срав-
нение результатов замеров толщины
слизистой оболочки традиционным
зондированием с данными резонанс-
Рис. 3.12. Измерения в полости рта.
а — определение высоты и ширины альвео-
лярного отростка с помощью линейки; б. в —
определение толщины слизистой оболочки
циркулем и иглой.
ной томографии не выявило каких-ли-
бо существенных рахличий.
Необходимо, чтобы после постанов-
ки имплантата оставалось не менее 1 —
2 мм костной ткани до дна полости носа,
верхнечелюстной пазухи, канала ниж-
ней челюсти, 3—4 мм до ментального
отверстия.
В.А. Переверзев [19] отмечает 4 сте-
пени обнажения зубов: 1) коронки верх-
них Центральных резцов обнажаются в
Пределах режущего края или нижней
трети; 2) обнажение зубов в средней
трети; 3) обнажение зубов в верхней
трети; 4) обнажение альвеолярного от-
Ростка верхней челюсти. Для имплан-
тации наиболее благоприятны 1 и 11
степень, а для красоты улыбки — II и
*** степень обнажения верхних цен-
тральных резцов (см. рис. 3.7).
Рекомендуется обратить внимание на
отношение верхнего зубного ряда к
Краю нижней губы, равномерность об-
нажения верхних зубов от одного угла
рта к другому. Для эстетики протезиро-
вания имеет значение отношение ши-
рины основания носа к ширине дуги
верхних зубов. У женщин оно меньше и
соответствует буграм клыков, у мужчин
расположено на границе клыка и пер-
вого премоляра [19]. Для уточнения ли-
нии улыбки и степени обнажения верх-
них зубов необходимо фиксировать
внимание на величине губы (высокая
или короткая) (см. рис. 3.11).
В.А. Переверзев [19J считает эти па-
раметры несущественными, однако от
величины губы и окклюзионной по-
верхности при сомкнутых челюстях за-
висит уровень обнажения зубов при
движении. Если окклюзионная плос-
кость соответствует разрезу губ, то аль-
веолярный отросток не будет обна-
жаться; если она ниже или выше, то
обнажение неизбежно. Рекомендуется
осмотреть соотношение челюстей в
141
профиль и расположение углов накло-
на верхней губы, лицевого угла и угла
наклона одного из сохранившихся
верхних резцов или альвеолярного от-
ростка. Оптимальным является угол
95’. Вместе с тем тупой угол внутри или
кнаружи никогда не создает адекват-
ной эстетики при протезировании и,
следовательно, должен устанавливать-
ся при постановке имплантатов. Опре-
деляют прикус, поскольку кандидата-
ми на имплантацию могут быть только
пациенты с разновидностями ортодон-
тического прикуса (см. рис. 3.5). В дру-
гих случаях имплантация возможна, но
только после ортопедического или ор-
тодонтического лечения.
A. Schroeder и соавт. [Ill], F. Sutter
и соавт. [120] считают, что для имплан-
татов в форме корня зуба минимальная
ширина альвеолярного гребня равна
4,5—5 мм, а высота — не менее 8 мм,
тогда как для имплантатов плоской
формы эти же предельные параметры
ширины и высоты составляют 3 мм и
4—6 мм, а С. Misch [104] допускает воз-
можность ставить плоские имплантаты
при ширине 2,5 мм. С учетом получен-
ных данных рассчитывают число им-
плантатов, определяют расстояния ме-
жду ними и до природных зубов.
L. Ohmell и соавт. 1106] считают, что
между имплантатами должно быть не
менее 3—4 мм, а до природного зуба —
1,25 мм. При постановке в лунку зуба
одиночного имплантата расстояние до
соседних зубов по обе стороны должно
быть по меньшей мере 6,5 мм, чтобы
была возможность поставить имплан-
тат диаметром 4 мм. При этом у им-
плантата не должно быть никакого
контакта с периодонтом соседних зу-
бов [106].
3.2. Рентгенографические
исследования
Важное значение в предымплантаци-
онной диагностике имеют рентгеноло-
гические исследования, которые обя-
зательны для всех пациентов и прово-
дятся при постановке всех типов им-
плантатов независимо от их количест-
ва. В имплантологии чаще пользуются
142
аналоговыми рентгеновскими изобра-
жениями: внутриротовой, панорам-
ной, окклюзионной и цефалометриче-
ской рентгенографией. Цифровые изо-
бражения получают на основе компью-
терной томографии, отображения маг-
нитного резонанса и интерактивной
компьютерной томографии.
3.2.1. Внутриротовая
рентгенография
Внутриротовые рентгенограммы до-
полняют клинические результаты ос-
мотра зубов и участков кости, где от-
сутствуют зубы. Такие рентгенограм-
мы дают возможность анализировать
тени зубов, качество пломбирования
их каналов и полостей, состояние
краевого и апикального периодонта,
межальвеолярных перегородок и кост-
ной ткани в области отсутствующих зу-
бов [6, 20, 21, 67]. По периапикальным
снимкам можно уточнять размер и ме-
стоположение резцового канала, сле-
дить за состоянием кости после поста-
новки имплантата. При этом, как ука-
зывает R. Kraut [89], всегда следует
учитывать, что у внутриротовых рент-
геновских снимков неизбежны угло-
вые искажения изображения и по ним
невозможно определить реальную вы-
соту альвеолярного отростка верхней
челюсти или альвеолярной части ниж-
ней челюсти. Очень важно также мне-
ние Н.А. Рабухиной [20], Н.А. Рабухи-
ной и А.П. Аржанцева [21], которые
предупреждают о необходимости осто-
рожного отношения к количественным
и пространственным показателям, ха-
рактеризующем зубы и окружающие их
ткани, полученные на основании внут-
риротовых снимков. Многие авторы об-
ращают внимание на большую дозу об-
лучения при получении рентгеновских
снимков всех зубов и рекомендуют
больше пользоваться ортопантомо-
графией и косой рентгенографией че-
люстей [21, 64, 108].
Несмотря на такие отрицательны6
моменты внутриротовых снимков, при
имплантации они необходимы, осо-
бенно для уточнения качества кости 8
месте постановки имплантата (рис-
3.13, а, б). Корректируют искажения с
Рис. 3.13. Прицельная
рентгенография.
а — рентгенограмма цен-
трального резца с перело-
мом корня; б — рентгено-
грамма после удаления зуба
и установления имплантата;
в — рентгенограмма альве-
олярного сегмента с расчет-
ной миллиметровой сеткой.
Помощью специальных расчетных се-
То«, каждое деление которых состав-
ляет на 1 мм (рис. 3.13, в). Сделанные
с такой сеткой снимки четко отражают
Искажения. Расчетным путем удается
п°лучить более реальную картину кос-
Окклюзионные снимки являются раз-
новидностью внутриротовой рентгено-
графии. Их делают в дополнение к дру-
гим методам рентгенографии. Они по-
зволяют определить толщину верхней и
нижней челюсти, размер кортикальной
кости с вестибулярной и оральной сто-
рон. Наибольшую информацию окк-
люзионные снимки дают о симфизе
нижней челюсти. Их недостатки такие
же, как и внутриротовых снимков [21].
143
АН
Рис. 3.14. Визиографическое исследова-
ние.
а — сравнительные рентгенологическое и ви-
зиографическос изображения имплантата; б —
цветная и структурная визиография установ-
ленных имплантатов; в — комплексная цвет-
ная, объемная и структурная визиография
кости и установленных имплантатов.
3.2.2. Радиовизиографическое
исследование зубов
и костной ткани челюстей
Диагностика перед зубной импланта-
цией может включать радиовизиогра-
фию. Это удобно при контроле эндо-
донтического лечения, этапов остеото-
мии для создания ложа имплантата,
его глубины, параллельности. Изобра-
жение регистрируется на электронной
матрице и по волоконной оптике пере-
дается в компьютер, где происходит
обработка полученных данных. Они
получают отражение на экране мони-
тора. Сравнительное рентгенологиче-
ское и визиографическое исследова-
ния дают более реалистическую карти-
ну зоны имплантологического интере-
са и всей зубочелюстной системы для
планирования лечения с точки зрения
как функции, так и эстетики (рис. 3.14,
а). Большими достоинствами радиови-
зиографии являются возможность по-
лучения увеличенного и цветного изо-
бражения, повышения его контрастно-
сти, а также вывод при помощи прин-
тера на бумагу. При имплантации не
только при диагностике, но и в момент
установления имплантата, а также по-
сле операции может быть быстро полу-
чена необходимая информация. Одна-
ко если на экране все диагностические
и оперативные детали хорошо про-
сматриваются, то регистрация полу-
ченных данных на бумаге значительно
ниже по качеству и уступает прицель-
ным рентгенограммам. Последнее по-
коление визиографов фирмы "Си-
менс", "Трофи" позволяет обращать
негативное изображение в позитивное,
объемное и цветное, измерять линей-
ные и угловые величины, значительно
увеличивать и панорамировать объект
исследования и получать не только
черно-белые и цифровые, но и цвет-
ные изображения (рис. 3.14, б, в). При
имплантационной хирургии можно
видеть срез кости с поставленным бо-
ром. другими этапными сверлами ДЛЯ
имплантации, глубиномером и фикси-
ровать последний этап — установление
конструкции в кости. Срез кости опре- I
деляет структуру кости, взаимоотно- I
шение зубои.мплантационного сегмен-
та по отношению к соседним зубам. 1
бухтам верхнечелюстной пазухи, кана-
лу нижней челюсти, подбородочному
отверстию. Подключение видеокаме-
ры к визиографу дает еще более пол-
ную информацию о зоне имплантоло-
гического интереса и состоянии и осо-
бенностях мягких и костных тканей.
Во время диагностики благодаря
снижению лучевой нагрузки радиови-
зиографическая аппаратура располага-
ется в диагностических кабинетах,
предоперационной комнате по прави-
лам, предусмотренным для этих иссле-
дований. В операционном блоке аппа-
рат устанавливают в специальной за-
щитной кабине, обеспечивающей
безопасность пациента и врача.
3.2.3. Панорамная рентгенография
Наиболее часто при зубной импланта-
ции применяются панорамные сним-
ки, в том числе прямые, боковые и зо-
нограммы. Прямые панорамные рент-
генограммы дают хороший обзор аль-
веолярного отростка, зубов, периодон-
та, межальвеолярных гребней. Четко
выявляются костная структура кости,
видны альвеолярные бухты верхнече-
люстной пазухи, канал нижней челю-
сти, подбородочное отверствие. По
прямым и боковым панорамным
снимкам определяют такие важные д ля
имплантации параметры, как адекват-
ная длина имплантата и его необходи-
мый наклон. Более детально картина
челюстей отображается на боковых
снимках, они дают меньше искажений.
Для обзорного рентгенологического
исследования используется панорам-
ная зонография или ортопантомогра-
Фия. Она предоставляет больше ин-
формации о дистальной половине ли-
цевого черепа. Все эти исследования
Рекомендуется стандартизировать и
проводить их в процессе имплантации
120, 21]. При этом рекомендуется про-
изводить все снимки при одном и том
*е положении пациента и обрабаты-
вать их одинаково.
Ортопантомограмма предоставляет
возможность с большей точностью оп-
ределить высоту кости и ее качество,
особенности дна верхнечелюстной па-
зухи и полости носа на верхней челю-
сти, положение подбородочных отвер-
стий и нижнечелюстных каналов на
нижней челюсти, а также особенности
обеих альвеолярных дуг (рис. 3.15, а).
Аналогичная ортопантомограмма с
маркировочными шариками опреде-
ленного размера, опирающимися на
слизистую оболочку альвеолярной ду-
ги и вмонтированными в шаблоны, по-
зволяет судить об окклюзионной плос-
кости и реальной высоте кости [116,
117] (рис. 3.15, 6). S. Dharmar [59] счи-
тает, что панорамное исследование
нижней челюсти при постановке им-
плантатов в 91 % случаев позволяет оп-
ределить правильное расположение
как мандибулярного канала, так и мен-
тального отверстия. Вместе с тем с по-
мощью ортопантомограм.мы невоз-
можно получить реальные данные о
ширине альвеолярного отростка верх-
ней челюсти или альвеолярной части
нижней челюсти, а также о размерах и
форме верхнечелюстных пазух, истин-
ное отношение альвеолярных бухт к
верхушкам корней зубов, прилежащих
к ним. Поэтому дополнительно прихо-
дится делать и исследовать прямые и
боковые панорамные снимки. По ним
определяют окклюзионные взаимоот-
ношения между альвеолярными дуга-
ми челюстей и получают сравнитель-
ные с ортопантомограммой данные.
Это имеет особое значение для нижней
челюсти, особенно при выраженных
атрофических процессах в ней |134].
Нередко требуется цефалометрическая
радиография [64].
В то же время панорамные снимки
не лишены недостатков, по ним невоз-
можно представить полную картину
состояния кости, так как они не поз-
воляют установить ширину альвеоляр-
ных отростков и альвеолярных дуг, что
имеет решающее значение для выбора
плоской или круглой формы имплан-
тата, а для последнего ширина опреде-
ляет и выбор диаметра имплантата. На
ортопантомограммах видны только ме-
зиальная и дистальная стороны кости
и имплантатов, тогда как дефекты тка-
ней возможны вокруг всей поверхно-
сти конструкций.
Искажения на панорамных снимках
часто создают впечатление более бла-
гоприятных условий для внутрикост-
ной имплантации, чем реально суше-
Рис. 3.15. Панорамная рентгенография (Spikermann Н.. 1995].
а — ортопантомограмма с диагностическими шаблонами; б — панорамные прямая и боковая
рентгенограммы с диагностическими шаблонами.
ствующие. Это особенно проявляется
при клинически выраженной атрофии
верхней челюсти. Отмечая ограничен-
ное значение панорамных рентгено-
грамм при зубной имплантации,
Н. Spiekermann [116], L. Probster и
W. Freesmeyr [109] также указывают,
что они дают информацию лишь о сре-
динных участках обеих челюстей, при-
чем наиболее часто искажаются пара-
метры расположения канала нижней
челюсти и подбородочного отверстия.
146
Более реальные панорамные сним-
ки можно получать на комплексных
рентгенодиагностических установках
с интероральными, панорамными
и цифровыми приставками при ИХ
функционировании как единого
целого, дополняя друг друга. Можно
получать наиболее достоверные пока-
затели зубочелюстной системы
для планирования имплантации *’
костезамещающих операций для неб
(рис. 3.15, в).
Рис. Л. 15. Продолжение.
в — комплексное исследование панорамных внутриротовых снимков на компьютере.
3.2.4. Томография
В последние годы при зубной имплан-
тации стала широко применяться то-
мография. У нее есть ряд преимуществ
перед обычной рентгенографией, так
как она дает точную информацию о
количестве кости [72, 90J. Томографию
для зубной имплантации также необ-
ходимо делать с маркировочными ша-
риками и диагностическим протезом
из прозрачной акриловой массы. То-
мография, сделанная с маркировочны-
ми шариками, расположенными в мес-
тах предполагаемой постановки им-
плантатов, позволит увидеть простран-
ственное состояние кости и оценить
правильность предполагаемого лече-
ния [ 113]. Важным является и умень-
шение дозы облучения при диагности-
ке Однако для выбора мест постанов-
ки имплантата приходится делать не-
сколько снимков, чтобы правильно
определить наиболее подходящий уча-
сток остеотомии для постановки им-
плантата. Понятно, что успех такого
Исследования может быть обеспечен
олько совместной работой стоматоло-
п со специалистом, осуществляющим
томографию. Однако необходимость
“Ыбора из многочисленных ориенти-
ровочных мест возможной постановки
имплантата и получения большего
числа томограмм этих участков кости
обусловливает увеличение лучевой на-
грузки.
3.2.5. Цефалометрическая
рентгенография лица
В предымплантационной диагностике
для планирования имплантации и кор-
рекции гармонии лица может потребо-
ваться проведение телерентгенографии.
Выявление нарушений по показаниям
телерентгенограмм позволит более чет-
ко прогнозировать успех хирургическо-
го и ортопедического этапов лечения
(рис. 3.16).
Как правило, в ортодонтии, челюст-
но-лицевой хирургии пользуются иссле-
дованиями угловых и линейных пара-
метров лицевого черепа. В норме харак-
терна симметричность правой и левой
половины черепа на рентгенограмме в
прямой проекции. При ортогнатиче-
ском прикусе угол между центральными
резцами составляет по боковым сним-
кам 130—140", наклон зубов по отноше-
нию к верхней челюсти равен 70 ± 5", к
нижней 85—90 ± 5* [21[. Строение че-
147
Рис. 3.16. Цефалометрическая рентгенограмма.
репа браки- и долихоцефалического
типа меняется как по длине, так и по
высоте, но гармоничность сохраняет-
ся. Угол между франкфуртской гори-
зонталью и продолжением длинной
оси центральных верхних резцов дол-
жен составлять около 65", угол между
МТ и центральными нижними резца-
ми равен 90 ± 5°, угол между франк-
фуртской горизонталью и MTj — 25’
(углы Tweed) [21J.
На боковых снимках следует опре-
делить профиль. Его правильные про-
порции соответствуют расположению
нижних резцов на 2 мм впереди и по-
зади лицевой плоскости N—Ро.
Положение и форма основания чере-
па влияют на ориентацию нижней че-
люсти. Изогнутое основание нижней
челюсти кажется всегда укороченным
или удлиненным, что зависит от поло-
жения суставной впадины. Для нормы
характерно положение плоскости SPP и
МТ под одинаковым углом по отноше-
нию к горизонтальной линии.
Средняя зона лица определяется ве-
личиной угла NTSp n. post, нижняя зо-
на лица — величиной угла Sp. n. post.
Go Gn.
Однако, как указывают Н.А. Рабухи-
на и А.П. Аржанцев [21], анализ только
угловых и линейных параметров чере-
148
па, неточные выбор анатомически,
ориентиров и статистическая обработ-
ка краниометрических показателей мо-
гут привести к ошибкам. Поэтому для
суждения о взаимоотношениях лицево-
го черепа, в том числе альвеолярных
отростков челюстей, с мозговым чере-
пом, а также окклюзионных соотноше-
ниях зубов нужно проводить исследо-
вания в вертикальном, трансверсаль-
ном и сагиттальном направлениях.
Патология костного скелета по теле-
рентгенограммам характеризуются из-
менениями как размеров (высотных и
широтных) альвеолярных отростков
челюстей, так и структуры кортикаль-
ного и губчатого вещества кости. Ди
зубной имплантации наиболее ценны
боковые изображения, так как они де*
монстрируют геометрию альвеолярных
отростков и определяют ориентир®"
вочные места установления импланта-
тов и протезов на них для достижения
гармонии лица.
Телерентгенологические исследова-
ния дают целостное представление ®
пропорциях лица и его гармонии и вы-
являют нарушения взаимоотношении
зубных рядов, челюстей, их дефекты **
деформации, что необходимо для пла-
нирования имплантационной хирургии
Данные анализа телерентгенограМ
счедует сопоставлять с клиническими
показателями антропометрическими
параметрами лицевого черепа.
Телерентгенограммы целесообраз-
но делать и исследовать в специализи-
рованных центрах с хорошо организо-
ванной рентгенологической службой.
В прямой корреляционной взаимо-
связи с основными параметрами мяг-
кИх и костных тканей лица находятся
окклюзионные взаимоотношения при
ортогнатическом прикусе. Однако по-
теря зубов, атрофия кости, возрастные
изменения больше всего отражаются
на характеристике мягких тканей: из-
менение формы, образование складок,
морщин, борозд. Последние связаны
со снижением упругости мягких тка-
ней. разной характеристикой морщин,
особенностями мышечного тонуса.
При использовании имплантатов не
всегда можно добиться единого эф-
фекта эстетики и функции, особенно
при выраженных возрастных измене-
ниях мягких тканей лица и атрофии
кости челюстей. Клинические иссле-
дования мягких и костных тканей, ана-
лиз телерентгенограмм и математиче-
ская обработка полученных данных у
каждого больного — трудоемкий про-
цесс. Их следует использовать при вы-
раженных изменениях мягких тканей и
атрофии челюстей. В отдельных случа-
ях эти данные могут не дать целостного
представления о лице и зубочелюстной
системе для планирования лечения с
использованием имплантатов.
3.2.6. Рентгеновская компьютерная
томография
В последние годы для диагностики при
зубной имплантации большинство спе-
L 3.17. Рентгеновские компьютерные томограммы.
1 ЛИ
Рис. 3.18. PKT верхней и нижней челюЛ
стей для планирования зубной имплан-
тации.
а—г — верхней челюсти; д — нижней.
циалистов предпочитают рентгеновскую
компьютерную томографию (РКТ), ко-
торая дает точные изображения в трех
измерениях (5, 11, 35, 62, 76]. При этом
она, во-первых, регистрирует объем-
ные и математические данные о кости,
изображения она дает 1:1. Во-вторых,
она определяет топографию нижнече-
люстных каналов и подбородочных от-
верстий. В-третьих, компьютерная то-
мография устанавливает расположение
верхнечелюстных пазух, особенности
их строения, толщину и качество кости
(рис. 3.17; 3.18).
Ряд исследователей считают, что толь-
ко компьютерная томография способна
дать объективные данные для планирО-1
вания предхирургического и последую*!
щего ортопедического лечения с помо-
щью зубных имплантатов [135, 121].
М. Shimara и соавт. [113] с успехом
использовали для изучения формы
верхней и нижней челюсти особую
программу компьютерной томографий
(мягкую). Авторы считают, что она ДЗ'
ет достаточную информацию для пла- ]
нирования имплантации.
Особое диагностическое значение
компьютерная томография приобрета-J
ет при имплантации у беззубых паиИ-|
ентов. С ее помощью не только полУ'
чают точную информацию о высоте,]
Рис. 3.19. Планирование имплантации на верхней челюсти по РКТ.
ширине и форме альвеолярного отрост-
ка верхней челюсти и альвеолярной
части нижней челюсти, но также, ис-
пользуя специальные приспособления,
создают ориентиры адекватной окклю-
зионной плоскости и определяют наи-
более оптимальные места постановки
имплантатов. Как исследователи, так и
практики подчеркивают особое значе-
ние компьютерной томографии для бо-
лее точного определения и замеров на-
личной кости в щечно-язычной и губ-
но-небной плоскостях. Благодаря этим
возможностям врач перед имплантаци-
ей получает данные о размерах костной
структуры в трех плоскостях и соответ-
ственно им выбирает наиболее адекват-
ный вид имплантата и его размеры.
Компьютерная томография особенно
показана при лечении с помощью
сложных имплантационных конструк-
ций и биоматериалов, например в дис-
тальных отделах нижней челюсти, под-
нятия дна верхнечелюстной пазухи,
пластики альвеолярного отростка верх-
йей челюсти и альвеолярной части ниж-
йей челюсти и т.д. Наиболее часто РКТ
необходима для планирования имплан-
тации при атрофии альвеолярного от-
ростка верхней челюсти, близости верх-
нечелюстной пазухи (рис. 3.19), атро-
фии нижней челюсти, особенно дис-
тальных ее отделов (рис. 3.20). По дан-
ным компьютерной томографии можно
вначале создавать анатомические моде-
ли челюстей, что позволяет проводить
имплантацию в сложных условиях, в
том числе с использованием костно-ре-
конструктивных операций. Как указы-
вают М. Schwartz и соавт. [121], создать
модель можно также по снимкам, сде-
ланным в трех проекциях с интервалами
от 1 до 2 мм. Вместе с тем Н. Tatum и
М. Lebowitz [124], исходя из своей прак-
тики постановки рамусного имплантата,
считают, что точность измерений с по-
мощью обычной рентгенографии быва-
ет выше, чем на модели, созданной с
помощью компьютерной томографии.
Большие возможности компьютер-
ная томография имеет для определе-
ния качества кости. Если при обычной
рентгенографии плотность кортикаль-
ной кости может исказить истинное
строение губчатого вещества, то компь-
ютерная томография дает более досто-
верную информацию. С ее помощью
нам, в частности, неоднократно удава-
лось получать перед имплантацией точ-
ные данные о строении губчатого веще-
ства, толщине кортикальных пласти-
нок вообще и в области дна верхнече-
люстной пазухи, в частности, точно оп-
ределять ход канала нижней челюсти.
Полученные с помощью компьютер-
ной томографии данные рекомендуется
вводить в классификацию Lekholm и
Zarb, а также Misch и Judi, Misch.
151
Рис. 3.20. Планирование имплантации на нижней челюсти.
а — по РКТ у подбородочного отверстия и над каналом нижней челюсти; б — по томограммам
в дистальном отделе.
3.2.7. Магнитно-резонансная
томография
Магнитно-резонансная томография
(МРТ) — один из самых перспектив-
ных и быстро совершенствующихся
методов диагностики в современной
челюстно-лицевой хирургии.
МРТ не связана с лучевым воздейст-
вием, но является дорогостоящим ис-
следованием.
Опираясь на последние достижения
электроники, криогенной техники и
новейшие информационные техноло-
гии, МРТ позволяет за несколько минут
получить изображения, сравнимые по
качеству с гистологическими срезами, а
для получения высококачественных
диагностических изображений продол-
жительность обследования пациента
можно уменьшить до нескольких се-
кунд. При этом врач получает возмож-
ность не только снизить степень выра-
женности структурных и патологиче-
ских изменений, но и оценить физико-
химические, патофизиологические про-
цессы в исследуемых тканях в целом
или его отдельных структурах, прово-
дить функциональные исследования.
МИГ строится по данным излучения
радиоволн ядрами водорода (протона-
ми), содержащимися в тканях тела сра-
зу же после получения ими энергии от
радиоволнового сигнала от объекта ис-
следования. Таким образом, контраст-
ность тканей на МРТ отражает особен-
ности "внутренних", ядерных структур
вещества, и она зависит от ряда таких
факторов, как строение вещества, взаи-
модействие между молекулами, молеку-
лярное движение (диффузия, кровоток)
и т.п., что позволяет не только диффе-
ренцировать на изображении патоло-
гически измененные и здоровые тка-
ин, но и наблюдать отражение функ-
циональной деятельности отдельных
структур.
В сложных случаях при планирова-
нии МРТ дает информацию о мягких
тианях лица и полости рта: по серии
т°нких срезов строят трехмерную мо-
дель исследуемой области, выделяют
Сосудистую сеть и даже отдельные
Нервные стволы. Такая информация
оказывает неоценимую помощь при
Имплантации, особенно при сочетании
ее с реконструктивной челюстно-лице-
вой хирургией.
МРТ малоинформативна при иссле-
довании костной ткани, плотных тка-
невых структур, больше данных полу-
чают при исследовании мышц, слюн-
ных желез, языка, лимфатических уз-
лов. Высокий сигнал МРТ дает жиро-
вая ткань, жидкости, костный мозг и
клетчатка челюстно-лицевой области.
Цветовая текстура дополняет цифро-
вые и объемные изображения зоны ин-
тереса. При зубной имплантации как
отдельный метод МРТ не представляет
большой перспективы. Вместе с РКТ
особенно при предымплантационной
пластике костных и мягких тканей, а
также при этих операциях одновремен-
но с имплантацией они предопределя-
ют правильное планирование и благо-
приятный исход операций.
За рубежом и в России в последние
годы с успехом стали применять интер-
активную компьютерную томографию
[83, 85] и магнитно-резонансное ис-
следование [84, 137]. Однако широкое
применение этих методов пока ограни-
чено прежде всего из-за их дороговиз-
ны. К ним прибегают главным образом
в случае определенных анатомических
трудностей при постановке импланта-
тов на нижней челюсти и при частич-
ной или полной адентии на верхней
челюсти, особенно в случаях пневма-
тического типа верхнечелюстной пазу-
хи [84, 137].
3.2.8. Трехмерная визуализация
лицевого черепа и мягких тканей
лица
Комплексное применение рентгенов-
ской компьютерной и магнитно-резо-
нансной томографии позволяет создать
трехмерное пространственное пред-
ставление о тканях лица, что имеет важ-
ное значение для планирования зубной
имплантации. РКТ и МРТ дают циф-
ровые изображения, в том числе цвето-
вое отображение магнитного резонан-
са, и позволяют осуществлять интерак-
тивную компьютерную томографию.
Построение трехмерных графиче-
ских моделей различных органов чело-
веческого тела основано на получении
через минимальные интервалы рентге-
новских компьютерных и магнитно-
резонансных томограмм, позволяю-
щих создавать текстурную сегмента-
цию и трехмерную реконструкцию ор-
ганов. Это получило диагностическую
значимость благодаря возможным "по-
летам" в различных полостях человече-
ского тела с возможностью осмотра
внутренних поверхностей сердца,
крупных сосудов, бронхов, желудка,
внутреннего уха [109а]. Изучение ана-
томо-топографических особенностей
верхнечелюстных пазух в норме и при
патологии по трехмерным изображе-
ниям РКТ позволило диагностировать
опухоли в ней и определять хирургиче-
скую тактику и объем вмешательства
[36]. В развитие объемного простран-
ственного изучения лицевого черепа и
прилегающих снаружи и изнутри мяг-
ких тканей нами разработана методика
применения трехмерной визуализации
лица по РКТ для планирования зубной
имплантации [Робустова Т.Г. и др.,
2001]. РКТ осуществлялась на компь-
ютерном томографе фирмы "Филипс" в
формате 3.0, МРТ — на электронно-
магнитном устройстве с текстурной и
цветовой сегментацией с использова-
нием программы 3D Doctor. Определе-
ние пространственных координат во
время остеотомии для постановки им-
плантата производилось дистанцион-
но. Анализ полученных результатов ус-
тановил форму, массу и цвет верхней и
нижней челюстей. Экспертная тек-
стурная сегментация позволяла полу-
чить целостное представление как в
целом о лице и зубочелюстной систе-
ме, гак и о зоне интереса хирурга для
зубной имплантации (рис. 3.21).
Комплексное использование РКТ и
МКТ позволило нам в процессе пре-
дымплантационной диагностики вы-
делять контуры и математические зна-
чения вначале костных образований,
затем — мягких тканей. В процессе
сбора и редактирования полученные
данные позволяли создавать трехмер-
ную модель челюстей каждого больного.
Она давала четкие и визуальные изо-
Рис. 3.21. Послойная визуализация тканей лица по РКТ и МРТ.
Рис. 3.22. Разрешающая способность
трехмерной визуализации по РКТ.
а — морфометрия верхней челюсти по томо-
граммам и трехмерным образам; б — послой-
ная визуализация тканей: в — виртуальный
разрез тканей на заданную глубину.
Сражения индивидуальных особенно-
стей лица и его тканей и предоставляла
в°зможность видеть их как снаружи и
Послойно, так и изнутри (рис. 3.22, а,
в). Цветовое текстурное оформление
тканей позволяло оценить количество
и качество их. Для зубной импланта-
Нии дополнительно нами выделялись
такие объекты, как дно верхнечелюст-
ной пазухи и ее бухты, дно носа, канал
Нижней челюсти, подбородочное от-
верстие, величины кортикального и
губчатого вещества костей, особенно-
сти их строения. Математические рас-
четы для определения мест постановки
имплантата, расстояния от соседних
зубов, взаимосвязи остаточной кости с
вестибулярной и оральной кортикаль-
ными пластинками, толщины ее у дна
полости носа, позволяло правильно
моделировать имплантационную хи-
рургию в трехмерных образах и ис-
пользовать эти данные для обз^ктини-
зании вмешательства (рис. 3.23).
Рис. 3.23. Математические величины по
РКТ.
Текстурное и цветовое оформление
трехмерных моделей или их отдельных
объектов придавало большую реали-
стичность получаемым образам и по-
зволяло объективно планировать зуб-
ную имплантацию.
Определенное значение для буду-
щей имплантации имело обнаружение
атрофии кости. По РКГ можно было
судить об объемных математических
характеристиках резорбции кости и
степени истончения кортикальной
пластинки челюстей, количестве кост-
ных трабекул. Физиологическая гор-
мональная атрофия кости у людей по-
жилого возраста, женщин, пациентов
после утраты зубов при комплексной
оценке данных РКТ и МРТ характери-
зовалось различными изменениями
костной структуры, количества крас-
ного костного мозга, увеличением жи-
рового мозга.
Текстура костных тканей по РКТ и
МРТ позволяла определять количест-
венное содержание в губчатом вещест-
ве клеточных и неклеточных компо-
нентов. Неклеточные элементы были
представлены в виде волокон, отлича-
лись скрученностью по оси вправо и
влево, располагались под разными уг-
лами по отношению друг к другу. Ус-
танавливалась степень минерализации
волокон, образующих трабекулы. Ма-
тематические показатели строения
трабекул в губчатом веществе отражали
тип строения кости — мелкопетли-
стый, среднепетлистый и крупнопет-
листый. Это имеет решающее значение
для выбора имплантата и его размеров.
В губчатом веществе кости опреде-
лялись остеоны в виде многослойных
трубок. Текстура их указывала на раз-
ную степень прочности. Атрофия кости
характеризовалась истончением корти-
кальной пластинки, увеличением кост-
номозговых пространств при одновре-
менном увеличении жирового и умень-
шении красного костного мозга, на-
блюдалась потеря костных трабекул.
Покрывающие кость мягкие ткани
имели различные характеристики как
по толщине, так и соотношениям сли-
зистой оболочки, подслизистой ткани,
надкостницы.
В неподвижной слизистой оболочке,
покрывающей альвеолярный отросток,
после удаления зубов можно было оп-
ределить степень атрофических про-
цессов, их локализацию с вестибуляр-
ной и оральной стороны. В отдельных
случаях наблюдалась трансформация
тканей, особенно подслизистого слоя,
что вело к патологической подвижно-
сти их и исчезновению границы между
прикрепленной и свободной слизи-
стой оболочкой. Видны были слизи-
стые и мышечные тяжи, приближаю-
щиеся к альвеолярному отростку. Это
имеет важное значение для рассечения
и отслаивания слизисто-надкостнич-
ных лоскутов, перемещения мыши,
рассечения слизистых тяжей [109а].
Мягкие ткани, покрывающие альве-
олярный отросток после удаления зу-
бов, атрофируются и истончаются
больше с вестибулярной стороны, а с
небной стороны выражено уплотнение
слизистой оболочки и подслизистого
слоя. Трансформация подслизистого
слоя часто ведет к подвижности тка-
ней, когда исчезает граница между
прикрепленной и свободной слизи-
стой оболочкой.
Атрофия альвеолярного отростка
после потери зубов обусловливает раз-
личные нарушения строения альвео-
лярной дуги в виде лезвия ножа, косой
скат вестибулярной стенки, нарушение
окклюзионных взаимоотношений.
Пневматический и средний тип
строения верхнечелюстной пазухи при
текстурном и цветовом оформлении
трехмерных моделей имеет строение
неправильной усеченной пирамиды, а
каждая из ее стенок — неправильной
трапеции. Диагонали трапеции делят
ее на четыре частично совместимых
треугольника. В альвеолярный отрос-
ток верхней челюсти изнутри вдаются
альвеолярные бухты, разделенные от-
дельными перегородками. Дно альвео-
лярной бухты, как правило, различно
расположено по отношению ко дну по-
лости носа: на одном уровне, выше и
ниже его. Полость пазухи может рас-
пространяться на альвеолярный отрос-
ток кпереди от первого премоляра и
кзади от второго моляра. При пневма-
тическом типе строения верхней челю-
сти верхушки корней зубов-премоля-
ров, первого и второго моляра может
отделять только тонкая кортикальная
пластинка и слизистая оболочка, по-
крывающая верхнечелюстную пазуху.
Нами отмечены случаи, когда корни
этих зубов вдавались внутрь пазухи. В
области твердого неба дно верхнечелю-
стной пазухи вдается в него, образуя
небные бухты.
Величина пазухи при пневматиче-
ском типе варьировала по высоте от 2,3
до 4,3 см, по ширине — от 1,9 до 3 см
и по объему — от 4,2 до 20,5 см3. Верх-
нечелюстные пазухи, как правило, бы-
ли несимметричны, объем левой пазу-
хи был больше объема правой. Линей-
ные размеры и объем у мужчин были
больше, чем у женщин.
При потере зубов в области премо-
ляров и моляров величина кости до дна
пазухи преимущественно уменьшалась
До 0,5—0,7 мм. Отмечены индивидуаль-
ные варианты наиболее тонких стенок
верхнечелюстной пазухи: в области ла-
теральной, передней и медиальной сте-
нок. Это имеет важное значение для
выбора оперативных доступов при
поднятии дна верхнечелюстной пазухи
и реконструкции верхней челюсти с
Поднятием ее дна.
При расположении дистальной стен-
ки верхнечелюстной пазухи у верхнего
второго моляра атрофические процессы
в кости делают опасной эту зону для им-
плантации в связи с близким располо-
жением внутренней челюстной артерии,
Крыловидного венозного сплетения.
В развитии компьютерной графики
Для зубной имплантации новым подхо-
дом является эндоскопия пазухи через
естественное отверстие в полости носа
(рис. 3.24). Этот метод определяет эн-
дохирургический оперативный подход
к поднятию дна пазухи и реконструк-
ции челюсти, а также обеспечивает на-
вигационного контроля при вмеша-
тельстве на мониторе компьютера.
Исследования по РКТ и МКТ ниж-
ней челюсти также позволяют судить
об объемных величинах кости, ее ха-
рактеристиках. Еще в большей степе-
ни, чем на верхней, на нижней челю-
сти ее строение во многом зависит от
ориентации трабекул, прочности ос-
теонтов.
Исследование нижней челюсти по-
сле удаления зубов показало, что атро-
фия кости более выражена с оральной
стороны. В области симфиза у отдель-
ных больных атрофия создает плоскую
поверхность, в других случаях плоский
скат атрофированной кости заканчи-
вается острым альвеолярным краем.
Избыточная мягкая ткань часто может
не иметь костной опоры. Вместе с тем
при клиническом исследовании на ос-
новании оценки деталей хорошо в та-
ких случаях определялась мнимая дос-
таточность костных тканей по ширине
и высоте. Цветное тонирование тканей
дает четкую ориентацию мест отхожде-
ния и прикрепления мышц, а также
определяет анатомические особенно-
сти подбородочного бугорка, челюст-
но-подъязычной и костной линий.
Для имплантации важно расположе-
ние канала нижней челюсти и подбо-
родочного отверстия, в том числе их
взаимоотношение с корнями зубов —
премоляров и моляров. РКТ и МКТ
показали отсутствие канала нижней
челюсти в области тела в 25 % случаев
и значительную вариабельность поло-
жения подбородочного отверстия. От-
деление ветвей от нижнего альвеоляр-
ного нерва происходило в толше ниж-
ней челюсти. При наличии канала его
положение было высоким, низким и
промежуточным. Самая нижняя точка
нами отмечена у первого моляра. Ат-
рофия кости вела к смещению канала
в язычную сторону. Установлена зави-
симость расположения канала от ана-
томических особенностей лицевого
черепа. При высокой альвеолярной
157
Рис. 3.24. Эндоскопическое исследова-
ние верхнечелюстной пазухи.
а — вхождение в средний носовой ход; б —
ориентир естественного отверстия в верхнече-
люстную пазуху; в — отверстие пазухи; г — эн-
доскопическое освещение пазухи.
части канал нижней челюсти располо-
жен низко; при ее малой величине ка-
нал и расположенный в нем сосудисто-
нервный ствол находятся вблизи кор-
ней. В случае атрофии кости при отсут-
ствии зубов канал приближен к корти-
кальной пластинке кости по ходу аль-
веолярной дуги. В единичных случаях
нижний луночковый нерв отмечен на
158
поверхности остаточной кости нижней
челюсти.
Таким образом, трехмерное модели-
рование зубочелюстной системы по-
зволяет не только диагностировать па-
тологический процесс, но и опреде-
лить оптимальную позицию импланта-
та, обеспечивающую окклюзионную
нагрузку.
Общепринятые методы диагностики
позволяют решит такие задачи, как ве-
рификация патологического процесса,
определение качества и количества
кости, позиция имплантата или им-
плантатов и прогнозирование его
функцию как опор зубного протеза.
Однако решение этих задач на основе
клинических, двухмерных рентгеноло-
гических исследований и оценки моде-
лей бывает недостаточным. Моделиро-
вание имплантации на трехмерных мо-
делях позволяет более достоверно ви-
зуализировать обследуемый образ в
объемном виде, а построенные матема-
тически точные анатомические модели
зубочелюстной системы использовать
для виртуального хирургического и ор-
топедического этапов зубной имплан-
тации.
3.3. Обследование
с использованием
ортопедических методов
Врач-ортопед более детально исследу-
ет стоматологический статус пациента
с точки зрения этапов предстоящего
ортопедического лечения и вместе с
хирургом проводит исследование мо-
делей челюстей.
При обследовании пациента врач-
ортопед обращает внимание на сле-
дующие моменты:
• определение характера межчелюст-
ных соотношений и прикуса, нали-
чие функциональных нарушений и
дисгармонии. Учитывается то, как
эти отклонения могут отразиться на
будущем протезировании зубов на
имплантатах [15, 33, 36, 37. 53, 60,
90, 98, 104, 104а];
• оценку жевательной системы, в том
числе с использованием лаборатор-
ных и функциональных методов, для
решения вопроса о возможном влия-
нии этих факторов на функциониро-
вание имплантатов в будущих зубных
протезах [7, 18, 19, 40, 51, 54, 103];
• уточнение состояния и функции ви-
сочно-нижнечелюстных суставов и
возможного влияния их на имплан-
таты и зубные протезы с опорой на
них [63. 97];
• исследование моделей челюстей, в
том числе в артикуляторе, с приме-
нением акриловой каппы для пла-
нирования мест постановки им-
плантатов, углов их наклона, а также
использование аналогов, выбранных
для отработки четкого плана хирур-
гических манипуляций при поста-
новке имплантатов и последующего
ортопедического лечения 115, 32, 44
60, 90, 91, 93, 117].
Комплексная оценка этих данных
позволяет определить условия для им-
плантации (рис. 3.25, а). В отдельных
случаях удается выявить скрытые нару-
шения жевательной функции. На этом
этапе еще раз может быть поставлен
вопрос о целесообразности и возмож-
ности зубной имплантации у данного
пациента. По данным РКТ можно так-
же моделировать места установления
имплантатов и ортопедическое лече-
ние (рис. 3.25, б)
После описанного выше обследова-
ния ставится заключительный диагноз.
Первичные клинико-рентгенологиче-
ские исследования позволяют оценить
состояние зубочелюстной системы,
подтвердить необходимость постанов-
ки имплантатов для устранения функ-
циональных и эстетических наруше-
ний, определить количество, качество
и конфигурацию кости, в которую
предполагается поставить имплантаты.
На основании всех этих данных и
результатов дополнительного обследо-
вания методами ортопедической сто-
матологии с оценкой моделей челю-
стей в артикуляторе врач-ортопед дает
окончательное заключение о показа-
ниях к конструированию зубных про-
тезов с опорой на имплантат или им-
плантаты, уточняет необходимое число
имплантатов в зависимости от будущей
функциональной нагрузки. Одновре-
менно врач-ортопед вместе с хирур-
гом-стоматологом решает вопрос о не-
обходимости имплантации и предлага-
ет альтернативные методы ортопедиче-
ского лечения. С. Drago [59а] считает,
что для каждой клинической ситуации
должен быть набор обязательных и до-
полнительных исследований и опреде-
лена зона интереса для хирургии. С ус-
ложнением условий для постановки
159
имплантата последовательно должен
увеличиваться объем исследований,
главным образом рентгенологических.
Обычно на основании клинических и
рентгенологических данных и опенки
моделей челюстей решается вопрос о
месте постановки имплантатов и опре-
деляется план ортопедического лече-
ния.
3.4. Атрофия и изменения кости
Перед хирургическим этапом имплан-
тации оценивают количество, качество
и конфигурацию кости, чтобы пра-
вильно выбрать имплантаты и их коли-
чество. Для этого учитывают анатоми-
ческие особенности челюстей и про-
цессы, возникающие в костной ткани
при потере зуба или зубов. После уда-
ления зуба или зубов неизбежны остео-
кластическая резорбция кости, атро-
фия губчатого и кортикального вещест-
ва кости. Строение челюстей во многом
зависит от антропологических особен-
ностей черепа индивидуума [19, 28J.
Следует иметь в виду, что с возрас-
том происходят уплотнение губчатого
вешества и потеря ориентации кост-
ных балок, усугубляющиеся с потерей
зубов.
3.4.1. Атрофия кости при полной
и частичной адентии
Основные сложности при зубной им-
плантации возникают у пациентов с
атрофированными альвеолярными от-
ростками. В перспективе можно ожи-
дать, что такая проблема не только не
потеряет актуальности, но станет более
острой, если учесть, что срок жизни
людей постепенно увеличивается и не-
обходимость в лечении с использова-
нием имплантатов возрастает [47, 66].
Строение губчатого вещества кости
неоднородно. Оно может быть мелко-,
средне- и крупнопетлистого типа [9].
Как показали исследования Ю.М.
Аникина и ЛЛ. Колесникова [1], кость
челюстей состоит из клеточных и не-
клеточных компонентов. Последние
представлены в виде волокон, отлича-
ются скрученностью по оси вправо и
влево. В зависимости от функции кос-
ти волокна ориентируются и занимают
определенное положение под разными
углами по отношению друг к другу и
линиям напряжения. При нагрузке
кость находится в состоянии растяги-
вающегося напряжения и характеризу-
ется большой сопротивляемостью к де-
формации. Минерализованные волок-
на образуют трабекулы, которые также
представляют собой одну из ступеней
организации неклеточного вещества,
составляя губчатое вещество кости.
Под влиянием нагрузки, ее силы, ско-
рости и времени действия возникает
разрушение трабекул по типу "зеленой
веточки”. Важное значение в кости
имеет костный мозг, который действу-
ет как гидравлический фактор. Иначе
говоря, волокна придают кости упру-
гость, кристаллы — твердость, костный
мозг обеспечивает рассеивание и по-
глощение энергии. Следующей ступе-
нью организации костного вещества
является остеон, представленный в ви-
де многослойной трубки. На разных
Уровнях остеонов также по спирали
Располагаются остеоциты. Остеоны
разных костей имеют разную степень
Прочности, обеспечивающую нор-
мальное функционирование в услови-
ях естественных нагрузок и напряже-
ний. Все эти особенности строения че-
люстных костей имеют большее значе-
ние для постановки в кость импланта-
тов и выбора оптимальной нагрузки на
них в зубных протезах [31]. Исследова-
ния отечественных авторов указывают
на важность установления индивиду-
альных особенностей строения челю-
стных костей и их механических
свойств [1, 4, 8, 9, 18].
Как показали исследования, прове-
денные D. Atwood [76], С. Bassetti и со-
авт. (48], при атрофических процессах
в кости происходят уменьшение крас-
ного и разрастание желтого костного
мозга. Снижение потенциальных не-
специфических и специфических воз-
можностей красного костного мозга
при атрофических процессах в челю-
стях ведет к нарушениям адаптацион-
ных и компенсаторных возможностей
кости [1], что может отражаться на ос-
теоинтеграции имплантата, адаптации
его к нагрузке, а также способствует
развитию осложнений при импланта-
ции. Т. Teylor и соавт. [185] свидетель-
ствуют о частых осложнениях при им-
плантации в кость VI класса. Атрофия
кости происходит особенно быстро в
первые 3 мес после удаления зуба. В
этот период быстрее уменьшается вес-
тибулярная стенка альвеол, причем
скорость резорбции кости на верхней
челюсти в 3—4 раза выше, чем на ниж-
ней ] 127]. Считается, что степень вы-
раженности атрофических процессов в
кости после удаления зубов связана с
нарушением сосудистой системы и пи-
танием. Это в разной степени отража-
ется на качестве кости [ПО].
При внутрикостной имплантации
следует учитывать остеопороз, связан-
ный с возрастом [47,49, 57]. Типичным
признаком остеопороза является атро-
фия, которая ведет к истончению кор-
тикальной пластинки и увеличению
пространства для костного мозга при
одновременной потере костных трабе-
кул [83]. Уменьшается также красный
костный мозг при одновременном уве-
личении жирового мозга [48, 73, 127].
Физиологические, гормонально обу-
словленные нарушения плотности
кости у разных лиц рахтичны. Однако
у женщин, особенно после менопаузы,
эти процессы бывают более выражены
и развиваются быстрее, чем у мужчин.
Высказывается мнение, что у ножи-
лых пациентов важно выяснить нали-
чие в анамнезе переломов трубчатых
костей и в таких случаях выделять их в
группу риска для имплантации (119].
Однако Р. Kondell и соавт. [79], Т. Dao
и соавт. (57] не согласны с таким мне-
нием. a G. Wakley и D. Baylink (130] во-
обще не считают возможным прово-
дить аналогию изменений в челюстях с
изменениями в других костях организ-
ма. Вместе с тем нельзя не согласиться
с позицией R. Bays [50], который счи-
тает, что на атрофические процессы
кости влияет ряд факторов, в том числе
пол, расовая принадлежность, возраст,
системные заболевания, питание, при-
ем лекарств, состояние полости рта и
зубов, а также предшествовавшее но-
шение зубных протезов.
Кроме того, после удаления зубов
происходят изменения покрывающих
кость мягких тканей — слизистой обо-
лочки и надкостницы. Резорбция кости
сопровождается атрофией прикреплен-
ной десны, хотя в десне, по наблюдени-
ям Р. Tetsch (1991) [126], процесс про-
текает значительно медленнее, чем в
кости (10:0,6). У некоторых пациентов
резорбция десны может вызвать необ-
ходимость оперативного вмешательства
перед имплантацией [132]. В тканях
прикрепленной десны могут иметь ме-
сто такие изменения, как истончение,
склерозирование и кератинизация [56].
3.4.2. Анатомические изменения
верхней челюсти при адентии
Верхняя челюсть представляет собой
парную кость сложного строения. Она
имеет тело и три отростка — альвеоляр-
ный, небный и вестибулярный. Вместе
с другими костями лицевого черепа
верхняя челюсть образует верхнечелю-
стные пазухи и носовую полость. На
альвеолярном отростке имеются альве-
олы, которые дают опору зубам. Нахо-
дящиеся в альвеолах зубы расположены
под разными углами, а отросток имеет
вид арки, состоящей преимущественно
из губчатого вещества кости, а слой кор-
тикального вещества очень тонкий, вес-
тибулярная его часть особенно тонкая
по сравнению с небной (рис. 3.26, а).
На скелетной архитектуре верхней
челюсти отражается реакция кости на
силы жевания. По мнению Н. Hoff-
mann [75], альвеолярный отросток с
небной дутой опирается на небный от-
росток, вестибулярный отросток и
сошник. А.Т. Бусыгин [4] при изуче-
нии макро- и микроструктуры челюсти
придавал большое значение горизон-
тальным и вертикальным контрфосам,
воспринимающим жевательное давле-
ние. Горизонтальный контрфос пред-
ставлен небным отростком, вертикаль-
ным контрфосом является лобный от-
росток, медиальным и латеральным —
внутренняя и наружная стенки верхне-
челюстной пазухи и сошник. Именно в
этих анатомических частях кость наи-
более плотная и способна восприни-
мать силы жевания (рис. 3.26, б, в).
Р. Mercier и R. Lafontant [98] указыва-
ют, что на костную морфологию влия-
ют силы жевания, передаваемые через
периодонт. В.Ю. Курляндский [14] от-
метил напряжение в кости верхней че-
люсти при нагрузке и показал на моде-
ли фотоупругости возможность пере-
мещения ее в зависимости от функ-
ционирования разных групп зубов.
R. Bays [50] отмечает, что при рекон-
структивной предпротезной хирургии
альвеолярного отростка верхней челю-
сти следует учитывать степень атрофии
и факторы, ее усугубляющие. Среди
них он выделяет возраст, пол, расовую
принадлежность, системные заболева-
ния, статус питания, прием лекарств и
предшествовавшее протезирование.
Вместе с тем В.А. Переверзев [19],
G. Throckmorton и соавт. [128] при ат-
рофических процессах придают боль-
шое значение типу строения костей
мозгового и лицевого черепа, связывая
это с особенностями небного свода, ви-
дом прикуса и соответственно с переда-
чей различных компрессионных сил на
альвеолярный отросток верхней челю-
сти. На основании антропометрических
исследований авторы выделяют людей с
долихоцефалическим типом лица и
всегда высоким небным сводом, соче-
тающимся с высоким альвеолярным
отростком верхней челюсти, а у инди-
видуумов с брахицсфалическим лицом
и мелким небным сводом отмечают
значительно меньшую высоту альвео-
лярного отростка. При потере зубов
Рис. 3.26. Контрфосы верхней челюсти
[Курляндский В. Ю., 1970].
а — строение верхней челюсти; 6 — контрфо-
сы анфас; в — в профиль.
компрессионное давление увеличивает-
ся, и при малой величине альвеолярно-
го отростка атрофия кости усиливается.
Как уже упоминалось, при удалении
зубов альвеолярный отросток подвер-
гается атрофии, что влияет на ширину
альвеолярной дуги и отражается на
окклюзионных взаимоотношениях с
антагонирующими зубами нижней че-
люсти. J. Stover [119] считает, что атро-
фия альвеолярной части верхней челю-
сти наиболее выражена с вестибуляр-
ной стороны.
Вестибулярная стенка альвеолярно-
го отростка верхней челюсти получает
значительную нагрузку за счет сил на-
пряжения от периодонта центральных
зубов, в то время как небная часть вос-
принимает минимальную нагрузку. В
тех случаях, когда отсутствуют жева-
тельные зубы, вестибулярная часть
альвеолярного отростка получает из-
лишнее компрессионное давление, что
и обусловливает ее атрофию. При по-
тере верхних центральных зубов (рез-
цов и клыка) атрофические процессы в
альвеолярном отростке особенно акти-
визируются, захватывая вестибуляр-
ную часть альвеол. На передних участ-
ках верхней челюсти по горизонтали
атрофия почти в 2 раза более выраже-
на, чем по вертикали (70]. При этом
небная поверхность остается выпук-
лой, а вестибулярная становится пло-
ской. Этим обусловлено строение аль-
веолярной дуги в виде лезвия ножа. Та-
кая атрофия кости переднего отдела
верхней челюсти создает вогнутый ли-
цевой профиль и способствует выдви-
жению нижней челюсти.
Рис. 3.27. Строение верхнечелюстной пазухи.
а — верхнечелюстная пазуха пневматического типа; б — строение стенок и размеры углов верх-
нечелюстной пазухи в виде усеченной пирамиды.
Если верхние резцы наклонены в
сторону преддверия рта, как и их анта-
гонисты на нижней челюсти, то моля-
ры верхней челюсти, имея наклон так-
же вестибулярно на 5—10*, не гармо-
нируют с антагонистами на нижней че-
люсти. которые наклонены в язычную
сторону. При атрофии эти антагони-
стические взаимоотношения зубных
дуг еще больше нарастают. Именно эти
межчелюстные взаимоотношения сле-
дует учитывать при внутрикостной им-
плантации [55]. При имплантации не-
соответствие альвеолярных дуг челю-
стей требует выравнивания поверхно-
сти кости, что позволит определить
место и число имплантатов и выбрать
оптимальную конструкцию зубного
протеза. Это приобретает особую важ-
ность, когда вследствие окклюзионных
нарушений возникают заболевания па-
родонта.
Резцы верхних зубов чаще наклоне-
ны в вестибулярную сторону, что соз-
дает резцовое перекрытие. Это создает
опасность функциональной перегрузки
имплантатов, поставленных в дисталь-
ных отделах как верхней, так и нижней
челюсти. Если дистальные зубы отсут-
ствуют, то компрессионное давление
на центральные зубы верхней челюсти
увеличивается и ведет к еще большей
атрофии кости альвеол. При отсутствии
зубов на этом участке челюсти альвео-
лярный гребень оказывается смещен-
ным к небу, резко атрофирован. Одно-
временно меняется внешний вид лица
и западает верхняя губа, так как значи-
тельно потеряна ее костная поддержка.
В случае аналогичных изменений и на
нижней челюсти развивается вогнутый
лицевой профиль.
Иногда атрофия альвеолярного от-
ростка может достигать передней неб-
ной ости.
Атрофия альвеолярного отростка
верхней челюсти ведет к нарушению
ряда анатомических образований: сосу-
дисто-нервный пучок, выходящий из
резцового отверстия, может сместиться
к гребню альвеолярного отростка, а
мышцы: щечная, поднимающая верх-
нюю губу, верхнюю губу и крыло носа,
угол рта, большая и малая скуловые,
могут занять положение, близкое к аль-
веолярному гребню. Если в передней
части верхней челюсти размеры альве-
олярного отростка хорошо видны и
могут быть замерены, то в дистальных
отделах альвеолярный отросток подвер-
гается всегда большей резорбции и ори-
ентиры его установить трудно [61]. 'Эго
также осложняется при пневматиче-
ском типе верхнечелюстной пазухи, ко-
торая уменьшает размер оставшейся
кости. В связи с этим долгосрочный
прогноз при имплантации на верхней
челюсти всегда хуже, чем на нижней.
Имплантация в таких условиях часто
невозможна без реконструкции верхней
челюсти. Главная причина заключается
в невозможности точно определить ко-
личество и качество кости верхней че-
люсти. С возрастом содержание мине-
ралов в кости уменьшается; этот '"фи-
зиологический" процесс более заметен
у женщин. Так, если после достижения
50 лет он наблюдался у 1—2 % мужчин,
то в первые годы после менопаузы — у
5 % женщин. Губчатая кость становит-
ся тоньше, а компактный слой кости
делается пористым и его объем умень-
шается, хотя контур всей кости (коли-
чество) обычно не меняется [117].
В теле верхней челюсти располагает-
ся пазуха. У взрослых она является са-
мой большой околоносовой пазухой.
По данным Л.И. Свержевского [27],
средний объем пазухи составляет
12,1 см3, наибольший — 18,6 см3, наи-
меньший — 2,8 см3, а по А.С. Иванову
110], величина его находится в пределах
от 12 до 15 см3, ширина равна 25 мм,
высота — 33 мм, переднезаднее рас-
стояние — 34 мм. Самая низкая точка
расположена соответственно первому
моляру. Анализ результатов анатомиче-
ских исследований позволил Л.И. Свер-
жевскому [27] и Б.Б. Брандсбургу [3]
выделить три типа пазух в зависимости
от степени их пневматизации: пневма-
тический, склеротический и промежу-
точный. При пневматическом типе раз-
меры пазухи относительно велики,
стенки тонкие, дно часто глубоко вда-
ется в альвеолярный отросток, образуя
бухты. При этом корни зубов (больших
и малых коренных) отделены от дна
верхнечелюстной пазухи лишь очень
тонкой костной пластинкой или кон-
тактируют непосредственно со слизи-
стой оболочкой. Склеротический тип
верхних пазух характеризуется малым
объемом и выраженной толщиной кос-
ти (от 1 до 10 мм и более). Считается,
что чаше встречается пневматический
тип верхнечелюстных пазух [17, 26].
Исследование пневматического типа
строения верхнечелюстной пазухи по
Данным РКТ, эндоскопии и последую-
щей морфометрии показало особенно-
сти ее стенок и возможности оператив-
ных доступов при зубной имплантации
(рис. 3.27, а). Сечение верхнечелюст-
ной пазухи в аксиальной плоскости
представляет собой трапецию, диагона-
ли которой делят се на четыре частично
совпадающих треугольника. Именно
на основании такой математической
концепции обоснован эндоскопиче-
ский доступ к пазухе и ее дну (рис.
3.27, б). Именно в таких случаях наи-
более вероятны распространение ин-
фекции и перфорация ее дна при им-
плантации [23].
Описаны три типа соотношения дна
верхнечелюстной пазухи с корнями
верхних зубов. При первом типе (в 19 %
случаев) корни зубов верхней челюсти
располагаются около дна или проника-
ют в пазуху, при втором (47 % случаев)
верхушки верхних зубов не доходят до
дна верхнечелюстной пазухи, а толщи-
на костной стенки при этом составляет
от 1 до 13 мм. Третий (комбинирован-
ный) тип встречается в 34 % случаев
[38].
Азьвеолярная бухта пазухи в 42 %
случаев опускается ниже носового хода
(иногда до 11 мм), в 17,9 % — распо-
лагается выше него и в 39,3 % — нахо-
дится на одном уровне с ним [27].
Антропометрические исследования
показали, что наибольшим является
расстояние между дном верхнечелюст-
ной пазухи и верхушками корней пер-
вого малого коренного зуба, в среднем
равное 7,4 мм. Наименьшее расстоя-
ние — от первого коренного зуба до па-
зухи, средняя величина костной ткани
у шечных корней составляет 2,05—2,02
мм, у небного корня — 2,02 мм [10].
Верхнечелюстная пазуха сообщается
с полостью носа через отверстие и в
норме может постоянно опорожнять-
ся, оставаясь здоровой. Величина от-
верстия от 3,5 до 6 мм в ширину и вы-
соту. Однако оно может сужаться
вследствие воспалительных и аллерги-
ческих явлений в слизистой оболочке,
выстилающей полость носа и саму па-
зуху. При имплантации необходимо
иметь в виду возможность перфорации
пазухи и попадания туда костных опи-
лок, которые могут провоцировать
воспаление [8. 34]. Следует учитывать
возрастные изменения верхнечелюст-
ной пазухи. При изучении возрастных
особенностей ее строения установле-
но, что в возрасте от 31 года до 40 лет
возникают признаки инволютивных
изменений стенок пазухи, проявляю-
щиеся остеопорозом губчатого вещест-
ва под ее дном. В возрасте до 60 лет на-
блюдается истончение костных стенок,
позже атрофия стенок верхнечелюст-
ных пазух нарастает [34].
По мере потери зубов верхнечелюст-
ная пазуха сближается с альвеолярным
отростком верхней челюсти и их может
разделять только тонкая пластинка
кости. В дистальном отделе альвеоляр-
ного отростка после удаления моляров
пространство зубной альвеолы может
соединяться с пазухой [95]. По мнению
W. Lili и соавт. [95], этим создаются
трудные условия для зубной импланта-
ции и нередко от нее приходится отка-
зываться или предварительно подни-
мать дно пазухи био.материалами.
Дистальный отдел верхней челюсти
имеет анатомические особенности: во-
первых, близость внутренней челюст-
ной артерии и возможность ее травми-
рования при имплантации, особенно
при атрофии дистального отдела альве-
олярного отростка, во-вторых, близкое
расположение крыловидного венозно-
го сплетения у бугра верхней челюсти.
При атрофии кости расстояние между
артерией, венозным сплетением и аль-
веолярным отростком сокращается,
тем более при постановке на этом уча-
стке имплантата [75].
Возможность поставить имплантат в
дистальный отдел верхней челюсти дает
крыловидная зона, причем необходимо
достичь латеральной пластинки крыло-
видного отростка. Однако при введении
имплантата в бугор верхней челюсти
всегда есть опасность повреждения дис-
тальнонижнего отдела пазухи. Поста-
новка имплантата в эту зону сопряжена
с углублением апикального его отдела
в крылонебную ямку, что создает опас-
ность кровотечения из верхнечелюст-
ной артерии или ее ветвей — задней
верхней альвеолярной артерии, под-
глазничной артерии, нисходящей неб-
ной артерии, а также петли крыловид-
ного венозного сплетения. Лигировать
эти сосуды достаточно трудно, а в
сложных ситуациях может потребо-
ваться лигирование сонной артерии.
Если атрофия дистального отдела верх-
ней челюсти небольшая, то условия для
постановки имплантата длиной от 15 до
20 мм благоприятны. В случае выражен-
ности атрофических процессов в альве-
олярном отростке верхней челюсти
расстояние между ним и дном пазухи
уменьшается и следует иметь в виду
как анатомические особенности кры-
ловидной зоны, так и изменения, воз-
никшие с утратой зубов. Имеется мне-
ние, что при входе имплантата через
бугор верхней челюсти в крыловидную
ямку и возникшее кровотечение не
опасно, так как оно больше связано с
повреждением мышцы и вполне кон-
тролируемо [75].
Отсутствие зубов на верхней челю-
сти ведет к изменениям слизистой
оболочки, покрывающей атрофиро-
ванный альвеолярный отросток верх-
ней челюсти. Обычно слизистая обо-
лочка с оральной стороны и на небе
уплотняется, а с вестибулярной, на-
оборот, истончается. По альвеолярной
дуге трансформация тканей и особен-
но подслизистого слоя ведет к избытку
слизистой оболочки, часто отличаю-
щейся неподвижностью. Отмечены па-
тологическая подвижность слизистой
и подслизистой ткани с вестибулярной
стороны, а также неподвижность и от-
сутствие подслизистого слоя — с неб-
ной [43]. При атрофии альвеолярного
отростка верхней челюсти граница ме-
жду прикрепленной и свободной сли-
зистой оболочкой исчезает и нередко
слизистые и мышечные тяжи прибли-
жаются к гребню альвеолярной дуги.
Нередко слизисто-надкостничный
покров на верхней челюсти создает
клиническое благополучие альвеоляр-
ного отростка для постановки имплан-
тата. При рассечении он часто оказы-
вается свободным, мягким и не имею-
щим опоры на кость. Глубокие слои
надкостницы при этом фиброзно из-
менены, а кость порозная.
Большое значение для постановки
имплантатов на верхней челюсти име-
ют особенности иннервации и крово-
снабжения. Ветви подглазничного нер-
ва, образуя переднее и среднее верхне-
челюстные сплетения, малую "гусиную
лапку” и заднее верхнечелюстное спле-
тение, осуществляют иннервацию кос-
ти, зубов и слизистой оболочки с вес-
тибулярной стороны. Резцовый и пе-
редний небный нервы иннервируют
слизистую оболочку и надкостницу с
оральной стороны. Вместе с нервами
располагаются сосуды, среди которых
верхняя альвеолярная артерия имеет
большое значение для кровоснабже-
ния губчатого вещества кости, а перед-
няя небная и подглазничная артерии
осуществляют кровоснабжение слизи-
стых оболочек с вестибулярной и неб-
ной сторон, а также неба |16].
Анатомические различия верхней и
нижней челюстей отражаются на им-
плантации. Из-за широких про-
странств губчатого вещества и более
тонких кортикальных пластин площадь
непосредственного контакта импланта-
та с костью на верхней челюсти всегда
на 30—40 % меньше, чем на нижней.
При одинаковой ситуации на верхней
челюсти приходится ставить большее
число имплантатов, чем на нижней.
3.4.3. Анатомические изменения
нижней челюсти при адентии
Нижняя челюсть также относится к
костям лица. Она представляет собой
кость в виде арки, соединенную по
средней линии в виде подбородочного
симфиза. Нижняя челюсть состоит из
тела и ветви. Альвеолярная часть тела
нижней челюсти включает в себя аль-
веолярную дугу, зубные альвеолы, меж-
корневые перегородки и альвеолярные
возвышения. Наклон альвеолярной
части нижней челюсти может быть как
в вестибулярную, так и в оральную сто-
роны. В альвеолярной части нижней
челюсти в зубных альвеолах находятся
зубы. Нижняя челюсть отличается зна-
чительными индивидуальными разли-
чиями формы (13, 16, 65], поэтому не-
обходим тщательный подбор вида и
размеров имплантатов (87, 88].
Строение нижней челюсти во мно-
гом зависит от ориентации трабекул,
прочности остеонов, на что алияет
функция нагрузки и напряжения всего
органа в жевательной системе (рис.
3.28). Поданным Л.В. Кузнецовой (13],
Ю.М. Аникина, Л Л. Колесникова [1],
особое место в архитектонике нижней
челюсти занимает ее угол. Обычно он
имеет величину в пределах 110—130‘.
Углы отклонений ветвей от вертикали
представляют собой углы ’’твердого" со-
противления, а угол наклона альвео-
лярной части нижней челюсти состав-
а
б
^ис. 3.28. Строение нижней челюсти.
я — расположение губчатого вещества при узкой и длинной нижней челюсти; б — при широкой
И короткой (по С.С. Михайлову).
ляет около 50’, что соответствует углам
"эластического, мягкого” сопротивле-
ния. Подбородочное возвышение у че-
ловека как опора передних зубов вы-
полняет биомеханическую амортиза-
ционную функцию.
Для определения будущих нагрузок
на имплантаты имеет значение измере-
ние отдельных параметров нижней че-
люсти и определение взаимоотноше-
ний между ветвями и базисом, особен-
но альвеолярной и базальной зубными
дугами (см. рис. 3.28, б). Следует иметь
в виду, что преимущественно альвео-
лярная дуга в области вершины арки
нижней челюсти выступает вперед, а
дистальные участки занимают медиаль-
ное положение, что ведет к отклоне-
нию дуги на 10—15’ в медиальном и
дистальном положении. Зубные же ду-
ги усугубляют отклонения альвеоляр-
ной дуги еще на 10’, но имеют отдель-
ные участки без отклонений, чаше в
области первого моляра [2].
В области первого моляра самая
высокая микротвердость кости. Воз-
можно, это связано с тем, что он пер-
вым прорезывается во временном и по-
стоянном прикусе, обусловливает его
влияние при формировании окклюзии.
Немаловажное значение имеет откло-
нение оси зубов от срединной линии
челюстного сегмента. Для выбора мест
постановки имплантатов нужны также
параметры соотношения высот коро-
нок и длин корней у различных зубов
нижней челюсти, как и характеристики
кости в местах их отсутствия.
На нижней челюсти процессы атро-
фии обусловлены теми же факторами,
что и на верхней, т.е. удалением зубов,
мышечными нагрузками, возрастом,
полом, формами строения лица, об-
щим и местным статусом здоровья па-
циента и ношением зубных протезов.
Атрофия альвеолярной части ниж-
ней челюсти происходит главным обра-
зом за счет губчатого вещества (см. рис.
3.28, а). Удаление зуба или зубов вызы-
вает атрофию кости. В первые 3 мес
этот процесс идет интенсивно, а затем
замедляется, особенно после 6 мес. Ре-
моделирование и атрофия кости закан-
чиваются через 1—2 года после удале-
ния зубов [8]. Наиболее интенсивно
процесс атрофии кости протекает с
язычной стороны, кроме участков мо-
ляров [31]. Средняя скорость атрофии
кости после удаления зубов на нижней
челюсти составляет около 0,2 мм в год,
т.е. в 3—4 раза выше, чем на верхней
челюсти [122]. На разных сторонах
нижней челюсти скорость атрофии раз-
лична [71]. При имплантации пробле-
мы могут создавать не только индиви-
дуальные особенности строения ниж-
ней челюсти, но в немалой степени и
специфика атрофии при адентии.
После удаления зубов вначале атро-
фируется язычная сторона альвеоляр-
ной части, в связи с чем альвеолярный
гребень часто приобретает форму лез-
вия ножа. В дальнейшем вследствие ат-
рофии кости снижается высота альвео-
лярной части гребня и он становиться
более плоским. В области симфиза не-
редко образуется плоская поверхность с
острым альвеолярным краем, представ-
ленным мягкой тканью. Анатомические
образования в местах отхождения под-
бородочно-язычной и подбородочно-
подъязычной мыши могут пальпиро-
ваться у самого края атрофированной
кости и выступать вверх [66].
В подбородочном отделе нижней че-
люсти атрофия выражена гораздо мень-
ше, чем в боковых отделах ее тела, по-
скольку центральные зубы оказывают-
ся более долговечными и удаляют их
позднее других. Кроме того, от области
симфиза берут начало мощные мышцы
передней группы, опускающие ниж-
нюю челюсть. Но могут наблюдаться и
такие клинические ситуации, когда на
плоской поверхности центрального от-
дела нижней челюсти располагается
острый край альвеолярной дуги. В дру-
гих случаях у края альвеолярной дуги
могут находиться подбородочный вы-
ступ и отходящие от области симфиза
подбородочно-язычные и подбородоч-
но-подъязычные мышцы и снаружи
близко располагаться подбородочная
мышца. Это делает достаточно сложным
рассечение слизистой оболочки для ос-
теотомии и постановку имплантатов.
Кроме того, в области симфиза ниж-
ней челюсти в этой области с оральной
стороны находятся сосуды, в том числе
подъязычная ветвь язычной артерии,
которая образует соустья с подподбо-
родочной ветвью лицевой артерии, и
анастомозы с более мелкими сосудами
мышц передней группы, отходящими
от этого участка кости.
В дистальном отделе нижней челю-
сти, где зубы отсутствуют наиболее
часто, кость может быть различной как
по форме, так и по качеству. Большое
значение имеет тяга медиальной кры-
ловидной мышцы. Необходимо паль-
паторно обследовать ретромолярную
область и остаточную альвеолярную
часть кости, определить ширину альве-
олярной дуги, выраженность челюст-
но-подъязычной линии и близость че-
люстно-подъязычной мышцы к альве-
олярной дуге. Если альвеолярная часть
атрофирована и узкая, то при поста-
новке имплантата она может перфори-
роваться или отламывается язычная
стенка. Кроме того, в такой ситуации
всегда есть опасность повредить языч-
ный нерв. Об этом свидетельствуют па-
тологоанатомические исследования, в
ходе которых у 17,6 % трупов нерв был
обнаружен под слизистой оболочкой
на уровне альвеолярной части и выше
его, а у 62 % — непосредственно при-
легал к кости [82|.
Большое значение для постановки
имплантатов на уровне ветви и альвео-
лярной части нижней челюсти соответ-
ственно молярам и второму премоляру
имеет расположение нижнечелюстного
канала и заключенного в нем сосуди-
сто-нервного пучка с нижним луночко-
вым нервом (рис. 3.29). При их травми-
ровании могут развиться такие ослож-
нения, как кровотечение и поврежде-
ние нерва. Кроме того, перфорация
нижнего луночкового нерва может по-
влиять на приживление имплантата и
его будущую функцию в ортопедиче-
ских конструкциях зубных протезов.
Нижнечелюстной канал имеет диа-
метр от 2 до 2,4 мм. Нерв от отверстия
нижней челюсти илет вниз и горизон-
тально, часто вблизи корней моляров,
особенно приближаясь к третьему
большому коренному зубу. Перед под-
бородочным отверстием он поднима-
ется кверху. По горизонтали в области
ветви и угла нижней челюсти нижне-
челюстной канал и одноименный нерв
расположены ближе к язычной поверх-
ности кортикального вещества кости.
В области тела он пересекает кость на-
Рис. 3.29. Анатомия нижнего альвеоляр-
ного нерва.
а — расположение в канале нижней челюсти;
б — выход через подбородочное отверстие.
искосок и находится ближе к латераль-
ной поверхности кортикального веще-
ства кости. Отмечено, что от нижнего
третьего моляра нерв идет латеральнее
альвеол второго и первого моляров, а
также второго премоляра (41]. Ближе
всего нижнечелюстной канал распола-
гается на участке первых моляров [129].
Установлена значительная вариабель-
ность положения канала нижней челю-
сти и подбородочного отверстия (30].
Еще Е. Oliver 1107] установил, что у
66 % взрослых людей нижний луноч-
ковый нерв идет от нижнечелюстного
отверстия в нижнечелюстном канале к
подбородочному отверстию, где раз-
ветвляется на ветви — подбородочные
и резцовые. У остальных 34 % автор от-
метил отсутствие нижнечелюстного
канала и отделение ветвей в области
моляров и далее в челюсти к премоля-
рам, клыкам и резцам. У 40 % людей
отсутствовал нижнечелюстной канал и
в толще челюсти обнаружены нервные
сплетения, иннервирующие зубы ниж-
ней челюсти и слизистую оболочку
десны с вестибулярной стороны.
Если у расположения нижнего луноч-
кового нерва по отношению к верхуш-
кам зубов отмечается определенная за-
кономерность, то, как видно на верти-
кальных срезах, положение нижнече-
люстного канала может быть разнооб-
разным и его квалифицируют как вы-
сокое. низкое и промежуточное [107).
Среднее расстояние от нижней части
канала до края основания нижней че-
люсти составляет 5,9 ± 2,2 мм. Его
крайняя точка при этом находится на
расстоянии не более 6 мм от подборо-
дочного отверстия, самая нижняя точ-
ка — около первого моляра 1100, 129].
При атрофии альвеолярной части
нижней челюсти происходит смеше-
ние нижнего альвеолярного нерва в
язычную сторону. Значительная атро-
фия кости альвеолярной части может
привести к такому обнажению нерва и
смешению подбородочного отверстия,
что они окажутся на поверхности аль-
веолярной дуги. Такая ситуация делает
имплантацию невозможной без пред-
варительной пластики альвеолярного
отростка, репозиции нерва и других до-
полнительных манипуляций [29].
Отмечено, что при высокой альвео-
лярной части нижней челюсти нижне-
челюстной канал расположен низко,
вдали от верхушек корней зубов. При
малой величине альвеолярной части
канал и нижний луночковый нерв рас-
полагаются вблизи корней (30, 86, 136].
На рентгенограмме канал иногда накла-
дывается на корни моляров, а при ком-
пьютерном исследовании выявляется
его расположение на уровне корней зу-
бов с вестибулярной стороны [86]. С
помощью поперечной томографии ус-
тановлено, что почти у половины боль-
ных (даже в 61 % случаев) нижний лу-
ночковый нерв с вестибулярной сторо-
ны кости располагается на уровне рети-
нированного нижнего зуба мудрости
[99, 100, 123]. Особые трудности пред-
ставляет постановка имплантатов в
дистальный отдел нижней челюсти.
Как правило, необходим рентгенологи-
ческий контроль [74, 118]. При поста-
новке имплантатов в дистальный отдел
тела нижней челюсти клинические из-
мерения приходится дополнять не толь-
ко рентгенографией в различной проек-
ции [74], рентгенотомографией [133],
но и компьютерной томографией, хотя
даже такое всестороннее обследование
не может застраховать от ошибки [117].
Ряд клиницистов рекомендуют перед
зубной имплантацией производить
транспозицию нерва [41, 77].
Вопросу расположения передней
петли медиально к ментальному нейро-
васкулярному тяжу уделяли внимание
многие клиницисты и исследователи
[30, 45. 101, 124].
Мнения о достаточности кости для
постановки имплантатов на участке
подбородочного отверстия нижней че-
люсти различны. Р. Worthington [135]
считает, что при расстоянии от края аль-
веолярного гребня до нижнего края ос-
нования беззубой челюсти 7 мм ставить
имплантаты можно. Однако Р. Tetsch
[126] полагает, что это расстояние
должно быть не менее 12 мм, так как
иначе нельзя обеспечить стабильность
имплантатов длиной 11 мм.
Значительную атрофию альвеоляр-
ной части нижней челюсти предотвра-
щают мышцы, прикрепляющиеся к
ней и отходящие от нее. Процесс опус-
кания и поднимания нижней челюсти
позволяет сохранять кортикальное ве-
щество кости, и если возникают про-
цессы резорбции, то преимущественно
в губчатом веществе.
Неблагоприятным клиническим сим-
птомом для имплантации считается су-
жение края альвеолярной части ниж-
ней челюсти, если он принимает вид
лезвия. Постановка имплантатов в та-
ких случаях затруднена без уплощения
края альвеолярной дуги, что возможно
только при достаточной высоте кости.
В противном случае постановка им-
плантатов бывает невозможна. Вместе
с тем при остеотомии нежелательна
лишняя травма кости. В такой ситуа-
ции часто приходится прибегать к
предварительной пластике с использо-
ванием ауто- или аллотрансплантатов,
а также новых биоматериалов [81]. По-
теря зубов в области моляров может
привести к трансформации нижнече-
люстного канала и нижнего луночко-
вого нерва, и они могут перемешаться
больше в язычную сторону. Это обу-
словливает другие взаимоотношения
между альвеолярной дугой и каналом
[99].
Рис. 3.30. Классификация
адентии по Kennedi.
а — I класс; б — II класс; в —
III класс; г — IV класс.
Значительная пробле-
ма при имплантации мо-
жет возникнуть в случае
выраженной атрофии
альвеолярной части ниж-
ней челюсти, соответст-
вующей первому моляру
и премолярам. В данной
ситуации подбородоч-
ный нерв может оказать-
ся на поверхности кости.
При диффузной атрофии
кости в области моляров
и премоляров ситуация
может усугубиться и весь
нижний луночковый нерв может ока-
заться свободно лежащим на поверх-
ности кости. В таких случаях нельзя
ставить имплантаты, и приходится ре-
шать вопрос об изоляции нерва и пла-
стике кости, чтобы имплантация стала
возможной.
3.4.4. Классификации адентии
и качества кости
Атрофия кости челюстей тесно связана
с нарушением метаболизма в костных
структурах. L. Halets и соавт. [72] вы-
явили изменения не только радиогра-
фически, но и с помощью эндокрин-
ных и гистоморфометрических тестов.
Из классификации зубной адентии
была принята классификация, предло-
женная в 1928 г. J. Kennedi [80] (рис.
3.30). Согласно ей, при частичной
адентии все дефекты зубных рядов де-
лятся на четыре класса и подклассы в
зависимости от локализации дефекта
зубного ряда.
Класс I характеризуется двухступен-
чатыми концевыми дефектами зубов, в
оставшемся зубном ряду могут быть
все естественные зубы или иметься де-
фекты.
Для II класса типичен односторон-
ний концевой дефект зубов, в осталь-
ной части зубной ряд может быть не-
прерывным или иметь дефект.
—I
Класс III отличается потерей зубов в
виде включенного дефекта.
Класс IV характеризуется потерей
зубов на фронтальном участке зубного
ряда в виде включенного дефекта.
Классы I, II и III делятся на под-
классы.
В ходе развития стоматологии оказа-
лось недостаточным классифицировать
дефекты зубного ряда только по их ло-
кализации. В связи с появлением новых
методов лечения адентии потребова-
лось дифференцировать характер и сте-
пень поражения кости челюсти. Тем не
менее классификация Kennedi до сих
пор является основой всех диагностиче-
ских признаков дефектов зубного ряда.
В случае атрофии верхней челюсти
при зубной имплантации пользуются
также классификацией G. Fallschussel
[63]. Согласно этой классификации,
различают: класс 0 — беззубый альве-
олярный отросток; класс I — широкий,
высокий альвеолярный отросток;
класс II — узкий и высокий альвеоляр-
ный отросток; класс III — острый вы-
сокий альвеолярный отросток; класс
IV — широкий альвеолярный отросток
с уменьшенной высотой; класс V —
полностью атрофированный альвео-
лярный отросток (рис. 3.31).
Дополнением к классификации
Kennedi [80] стала классификация ат-
рофии нижней челюсти, предложенная
D. Atwood [46]. В ней состояние альве-
Рис. 3.31. Классификация адентии верх-
ней челюсти по Fallschusscl’s.
Рис. 3.32. Классификации атрофии ниж-
ней челюсти по Atwood.
а
Рис. 3.33. Классификации атрофии и качества кости.
а — атрофии челюстей по Lekholm и Zarb: А — хорошо выраженные альвеолярный отросток
верхней челюсти и альвеолярная часть нижней челюсти, В — умеренная атрофия кости, С — пол-<
ная атрофия кости, D, Е — атрофия остаточной кости. Линия обозначает границу между аль-
веолярным отростком верхней челюсти и ее телом, альвеолярной частью нижней челюсти и се
телом; б — качества кости по Lekholm и Zarb: 1 — однородная компактная кость, 2 — толстый
кортикальный слой и плотная губчатая кость. 3 — тонкий слой кортикальной кости и плотная
губчатая кость, 4 — тонкий слой кортикальной кости и рыхлая губчатая кость.
олы делилось на 6 классов. В 1 класс
входила альвеола с естественным зубом,
во II — альвеола непосредственно после
удаления зуба, в III—VI — собственно
атрофия альвеолы. Kill классу отнесе-
ны высокие альвеолярные отростки, к
IV — высокие и узкие, к V — закруглен-
ные и плоские, к VI — отростки вогну-
тые и плоские. Другими словами, в этой
классификации классы отражают фак-
тически ступени нарастания атрофии
альвеолярного отростка (рис. 3.32).
Классификацию беззубой нижней
челюсти в 1974 г. предложили Е. Wical
и D.C. Swoope [134]. Классификацию
беззубой нижней челюсти разработали
также J. Cawood и R. Howell [52], клас-
сификацию как нижней, так и верхней
челюсти для соответствующей тактики
имплантации, — U. Lekholm и G. Zarb
[93] (рис. 3.33, а).
Значительные различия атрофиро-
ванных челюстей, неизбежно отра-
жающиеся на специфике зубной им-
плантации, способствовали системати-
зации патологических процессов с по-
мощью классификаций. Предлагались
классификации адентии на обеих че-
люстях, только на нижней или верхней
челюсти. Классифицировались также
кости челюстей, степени атрофии и ка-
чество кости [4].
При зубной имплантации, когда на
верхней челюсти наблюдается частич-
ная адентия, пользуются классифика-
цией Kennedi с дополнениями Lekholm
И Zarb [93], Misch и Judi [10].
U. Lekholm и G. Zarb (1985) предла-
гают оценивать степень атрофии и ка-
чество кости. При полной адентии
верхней и нижней челюстей авторы раз-
личают следующие степени атрофии.
А. Фактически атрофированные аль-
веолярный отросток верхней челю-
сти или альвеолярная часть ниж-
ней челюсти.
В. Незначительная атрофия альвео-
лярного отростка или альвеоляр-
ной части.
С. Нарастающая атрофия альвеоляр-
ного отростка или альвеолярной
части.
t>. Начальная атрофия тела челюсти.
Е. Глубокая атрофия тела челюсти
(см. рис. 3.33, а).
Рис. 3.34. Классификация атрофии че-
люстей по Misch и Judi.
а — при беззубых челюстях.
Класс 1
Класс 2
>15 мм >15 мм
-5 мм -5 мм
>10 мм
Рис. 3.34. Продолжение,
б — при частичной адентии.
Класс 3
Класс 4
Рис. 3.34. Продолжение.
В соответствии с этой классифика-
цией по качеству кости оценивают
кортикальное и губчатое вещество че-
люстей (рис. 3.33, б). Авторы различа-
ют 4 класса качества кости.
Класс I — челюсть состоит почти
исключительно из гомогенного (од-
нородного) компактного вещества
кости.
Класс II — толстый слой компактно-
го вещества кости окружает толстый
слой губчатого вещества с хорошо
выраженным трабекулярным строе-
нием.
Класс Ill — тонкий слой кортикаль-
ной кости окружает губчатое веще-
ство с хорошо выраженным трабеку-
лярным строением.
Класс IV — тонкий слой кортикаль-
ной кости окружает рыхлое губчатое
вещество.
Класс I — это самая плотная, а IV —
самая рыхлая кость. Различая плот-
ность кости 4 степеней, авторы альве-
олярные гребни классифицируют по
формам А, В, С, D и Е и диагностиру-
ют их по цефаюметрическим рентге-
новским снимкам.
В настоящее время наибольшее при-
менение имеет классификация Misch и
Judi, специально ориентированная на
зубную имплантацию и внесшая до-
полнения в диагностические критерии
Kennedi. В ней каждый класс деления
по Kennedi дополнен подгруппами А,
В, С и D.
По этой классификации при частич-
ной адентии следует различать 4 груп-
пы, а при полной адентии нижней че-
люсти — еще пятую группу. Классифи-
кация основана на определении трех
основных параметров кости: высоты,
ширины и медиодистальной длины ее
тела. Эти параметры применимы как к
круглым — винтовым и цилиндриче-
ским, так и к плоским имплантатам.
Авторы классификации различают
полностью беззубую и частично беззу-
бую челюсть (рис. 3.34).
3.4.4.1. Классификация полностью
беззубых челюстей по Misch и Judi
Авторы выделяют 4 группы: А, В, С, D
(рис. 3.34, а).
Группа А: количество кости доста-
точное для постановки имплантатов в
нижнюю и верхнюю челюсти, но даже
при таких благоприятных условиях на
нижней челюсти имплантаты обычно
ставятся только между подбородочны-
ми отверстиями. Пациентам показаны
съемные протезы или дистальный кон-
сольный мостовидный протез.
Группа В: кость менее объемная. Как
на нижней, так и на верхней челюсти
можно ставить винтовые и цилиндри-
ческие имплантаты, но меньших разме-
ров. Однако прогноз может быть менее
благоприятным в зависимости от каче-
ства кости. Число опорных головок
следует увеличивать для создания боль-
шей площади около контактной зоны
по периметру имплантата, что улучша-
ет распределение нагрузки.
Группа С: наличная кость беззубой
нижней челюсти позволяет ставить на
участке между подбородочными отвер-
стиями короткие винтовые и цилинд-
рические имплантаты. В отдельных
случаях может возникнуть необходи-
мость в перемещении нижнего альвео-
лярного нерва. Если пациент выражает
удовлетворение первоначальной си-
туацией, то постановка внутрикостных
зубных имплантатов маловероятна. В
таких исключительных случаях может
потребоваться наращивание гребня
или поднятие дна верхнечелюстной
пазухи.
Группа D: альвеолярная часть и уча-
стки базальной кости нижней челюсти
атрофированы. В любом случае поста-
новка внутрикостных зубных имплан-
татов противопоказана. Протезирова-
ние на имплантатах возможно только
после пластики нижней челюсти и на-
ращивания кости.
3.4.4.2. Классификация частично
беззубых челюстей по Misch и Judi
Авторы различают 4 класса. Классы
делятся на группы А, В. С и D (рис.
3.34, б).
Классы 1 и 2, группа А: пациенты
классов имеют природные зубы на пе-
редних участках зубного ряда. У них
достаточное количество кости для мос-
товидных протезов при включенных и
концевых дефектах зубного ряда. Воз-
можна постановка мостов как с опорой
на зуб и имплантаты, так и на один им-
плантат. Число имплантатов зависит от
числа отсутствующих зубов и зубов-ан-
тагонистов.
Класс 2, группа В: у пациентов этой
группы количество кости несколько
уменьшено, но ее еще достаточно для
постановки винтовых и цилиндриче-
ских имплантатов небольших разме-
ров. В отдельных случаях для распре-
деления нагрузки показана постановка
более одного имплантата. Можно ста-
вить также плоские имплантаты, так
как их используют при меньших коли-
чествах кости.
Класс 2, группа С: у пациентов этой
категории количества кости недоста-
точно для постановки цилиндрических
и винтовых имплантатов. В последние
годы таким пациентам имплантаты
ставили после операции по поднятию
дна пазухи на верхней челюсти или по-
сле перемещения альвеолярного нерва
на нижней челюсти. В настоящее вре-
мя проводится научная оценка резуль-
татов этих операций.
Класс 2, группа D: наблюдается глу-
бокая атрофия кости. Показано ноше-
ние обычных съемных протезов. При
таком лечении иногда возникают за-
труднения (например, парестезия) из-
за высокого расположения нижнече-
люстного канала. В тех случаях, когда
существует опасность перелома ниж-
ней челюсти, ее альвеолярную часть
наращивают биоматериалами.
Классы 3 и 4 делят на группы А, В,
С и D.
Классы 3 и 4, группа А: у пациентов
отсутствуют одиночные зубы или груп-
пы зубов, но кости достаточно для по-
становки винтовых, цилиндрических и
плоских имплантатов. Число необхо-
димых имплантатов зависит от протя-
женности беззубого участка и типа
планируемого протеза. Протез может
опираться только на имплантаты или
на зубы и имплантаты.
Классы 3 и 4, группа В: у пациентов
весьма большие беззубые участки, но
кости все еще достаточно, чтобы ставить
имплантаты для опоры на них несъем-
ных мостовидных протезов. Некоторые
врачи в таких случаях предпочитают ис-
пользовать плоские имплантаты.
Классы 3 и 4, группа С: у пациентов
протяженные беззубые участки. Коли-
чества кости недостаточно для поста-
новки эндооссальных имплантатов. В
некоторых случаях можно прибегнуть к
пластике верхней челюсти с поднятием
дна пазухи или перемещению нижнего
альвеолярного нерва. В ситуациях клас-
са 4 можно использовать только корот-
кие винтовые и цилиндрические им-
плантаты, но делать это следует с боль-
шой осторожностью из-за функцио-
нальных и эстетических ограничений.
Классы 3 и 4, группа D: чрезвычайно
сильная атрофия кости исключает по-
становку внутрикостных имплантатов.
Показано лечение с помощью частич-
но съемного зубного протеза. В тех
случаях, когда существует опасность
перелома нижней челюсти, можно по-
пытаться стабилизировать кость путем
ее наращивания трансплантатом.
3.4.4.3. Классификация качества
кости
Большое значение для стабильности
имплантата в кости имеет ее качество.
Исходная или возрастная недостаточ-
ность остеобластов вызывает атрофию
кости. В результате этого уменьшается
слой кортикального вещества и снижа-
ется плотность трабекул губчатого ве-
щества кости. Трансформация красного
костного мозга в желтый делает кость
рыхлой, кровоснабжение ее снижается
[48, 73, 127J. Возрастное гормональное
изменение кости и ее остеопороз, более
выраженный у женщин, также приво-
дят к снижению плотности костных
трабекул и значительной атрофии [48J.
По рентгеновским снимкам оценить
качество кости можно только ориенти-
ровочно. Различная способность рент-
геновских лучей фиксировать костные
структуры, ''жесткость" и "мягкость"
рентгеновских снимков и плотность
кортикального вещества, заслоняюще-
го губчатое вещество, не дают реально-
го представления о качестве кости.
Наиболее достоверно качество кос-
ти может быть оценено по РКТ, а так-
же хирургом при оперативном вмеша-
тельстве и визуальном осмотре, но да-
леко не всегда после получения таким
Рис. 3.35. Классификация качества кос-
ти по Misch.
а — толстая компактная кость D1; б — толстая
кость D2 (оптимальное сочетание толстого
кортикального и губчатого вещества); в — пре-
имущественно трабекулярная кость D3; г —
полностью трабекулярная кость D4.
образом новой информации врач име-
ет возможность изменить план опера-
ции. Максимальная точность диагно-
стирования состояния кости непосред-
ственно перед имплантацией играет
важнейшую роль при выборе опти-
мальной методики оперативного вме-
шательства. Решению этой сложной
задачи способствуют дополнения, ко-
торые были сделаны С. Misch [102] к
приведенной выше классификации и
которые содержат наиболее типичные
характеристики кости и классифици-
руют ее качество (рис. 3.35).
Классификация качества кости no Misch.
Оцениваемая зона и характеристика
качества
D1 — толстая компактная кость. Перед-
ний участок атрофированной без-
зубой нижней челюсти.
Достоинства; хорошая начальная
стабильность имплантатов; боль-
шая площадь контакта имплантата
с костью; возможность использова-
ния коротких имплантатов.
АЗЯ._________________
Недостатки: слабое кровоснабже-
ние (увеличено время заживления);
часто небольшая высота кости (со-
отношение имплантата и корон-
ки); трудности при подготовке ло-
жа (перегрев кости).
D2 — толстая кость с пористым ком-
пактным веществом и выражен-
ным губчатым веществом трабеку-
лярного строения. Передний и
дистальный участки нижней челю-
сти, передний участок верхней че-
люсти (небная сторона).
Достоинства: хорошая начальная
стабильность; хорошее кровоснаб-
жение и возможность благоприят-
ного заживления; несложная под-
готовка ложа.
Недостатки: не имеются.
D3 — тонкая кость с пористым компакт-
ным веществом и губчатым веще-
ством рыхлой структуры. Передние
и дистальные участки верхней че-
люсти. Дистальные участки ниж-
ней челюсти. Ситуация после кост-
ной пластики кости класса D2.
Достоинства: хорошее кровоснаб-
жение.
Недостатки: трудности с подготов-
кой ложа (расширение); необходи-
мость оптимально использовать на-
личную кость; уменьшенная пло-
щадь контактной зоны имплантата
с костью (необходимость увеличе-
ния числа имплантатов).
D4 — рыхлое, тонкое компактное веще-
ство кости. Бугристость верхней
челюсти, условия после костной
пластики.
Достоинства: не имеются.
Недостатки: подготовка ложа за-
труднена (может отсутствовать на-
чальная стабильность); необходи-
мость оптимально использовать на-
личную кость; уменьшенная пло-
щадь контактной зоны имплантата
с костью (необходимость увеличе-
ния числа имплантатов).
При альвеолярной кости, относя-
щейся к классам DI—D4, С.Е. Misch
[102] рекомендует увеличивать нагруз-
ку на кость постепенно, поскольку она
способна к функциональной адапта-
ции, если не будет перегружена.
С. Misch [102], М. Сухарев [33] счи-
тают, что кость обладает высокими
функциональными возможностями, в
том числе способностью адаптироваться
к разным повреждениям и нагрузкам.
Они вызывают в ней перестройку и ре-
моделирование, но кость остается фи-
зиологичной, если при этом отсутству-
ет излишняя перегрузка. На основании
плотности кости можно математиче-
ски моделировать оптимальную на-
грузку: зубной протез — имплантат —
кость (22]. Этапность лечения при им-
плантации обеспечивает адаптацию
кости. Желаемых результатов для раз-
ных классов кости всегда можно дос-
тичь правильным дозированием нагру-
зок на кость: шалящей остеотомией,
нетравматнчной постановкой имплан-
татов, обеспечением их первичной ста-
бильности в кости и адекватной на-
грузкой после второго хирургического
этапа в качестве опор зубных протезов.
Так, С. Misch [102, 104] при импланта-
ции на кости IV класса рекомендует
изменять нагрузку с интервалом 4 нед.
Согласно оценке характеристик ко-
стных структур верхней и нижней че-
люстей для постановки имплантатов
по классификациям Lekholm и Zarb,
наиболее благоприятной для имплан-
тации является класс В при качестве
кости 11 класса. Резорбция кости клас-
са D и Е при качестве кости от I до IV
класса на верхней челюсти и резорбции
кости класса В и качестве кости I клас-
са на нижней челюсти считаются не-
благоприятными. Н. Spikermann [116],
К. Misch [102] рекомендуют при поста-
новке имплантата использовать четыре
классификационных признака качест-
ва кости и в зависимости от этого да-
вать дозированные нагрузки и коррек-
тировать их. Автор считает, что кость
обладает большими функциональными
возможностями и если ее постепенно и
Дозированно нагружать, то даже не
очень прогрессивные характеристики
хости могут оптимально измениться.
Правда, при использовании рекоменда-
ций С. Misch потребуется больше вре-
мени для ортопедического лечения и
при данных дозированных нагрузках —
Для завершения ортопедического лече-
ния [ЮЗ].
В отсутствие общих и местных про-
тивопоказаний имплантация может
быть альтернативным и более эффек-
тивным методом лечения. При полной
Длентии на верхней или нижней, а так-
же на обеих челюстях частичная аден-
тия с концевым дефектом зубного ряда
или множественное отсутствие зубов
также может быть показанием к зубной
имплантации. Конечно, при потере од-
ного зуба имплантация позволит опти-
мально устранить функциональные и
эстетические нарушения.
Таким образом, на основании кли-
нических, рентгенологических данных
и оценки моделей челюстей проводится
математическое моделирование для
постановки имплантатов и составляется
план ортопедического лечения с опо-
рой на них. Это определяет тактику хи-
рургического лечения. Операции могут
быть разной степени сложности. В од-
них случаях требуется постановка 1—2
имплантатов (I степени сложности), в
других — от 2 до 4 имплантатов, что
требует большего количества отдель-
ных операций и соответственно боль-
шего времени (II степень сложности),
в-третьих — более 3 имплантатов в
трудных анатомических условиях или с
пластикой мягкой ткани и кости (III
степень сложности), в-четвертых — бо-
лее 5 имплантатов с пластикой челю-
стей ауто- или аллотрансплантатами,
другими биоматериалами и их комби-
нациями (IV степень сложности).
Клинические и лабораторные дан-
ные определяют тактику хирургическо-
го лечения и степень его сложности.
Для решения этих вопросов следует
оценить функциональное состояние
организма и в зависимости от общего
состояния пациента установить показа-
ния и противопоказания к операциям.
3.4.5. Планы обследования
и лечения
I. План обследования и варианты
зубной имплантации на верхней че-
люсти в области центральных зубов
1. Определение задач зубной им-
плантации для гармонии лица
и функции жевания.
2. Наружное измерение сегмента
адентии.
3. Определение линии улыбки и
обнажения верхних централь-
ных зубов.
179
4. Измерение размеров альвео-
лярного отростка.
5. Измерение толщины слизистой
оболочки, высоты свода пред-
дверия рта, состояния уздечки
верхней губы, уточнение мест
прикрепления мимических
мышц к альвеолярному отрост-
ку при атрофии кости.
6. Прицельная рентгенография
участка адентии и соседних зу-
бов.
7. Панорамная рентгенография.
8. Исследование моделей челюс-
тей в артикуляторе.
9. Антропометрические исследо-
вания.
10. Окклюзионная рентгенография.
11. Анализ величин альвеолярного
отростка, окклюзии, определе-
ние количества и мест установ-
ления имплантатов, изготовле-
ние акриловой каппы.
В сложных случаях:
12. Цефалометрическая рентгено-
графия.
13. РКТ.
14. Эндоскопия полости носа.
Варианты лечения:
1) имплантация;
2) имплантация с поднятием дна по-
лости носа биоматериалом;
3) имплантация с одновременным
наращиванием кости в накладку;
4) остеотомия и расщепление кости с
одновременной или отсроченной
установкой имплантата;
5) поднадкостничное введение био-
материала с отсроченной имплан-
тацией;
6) наращивание кости биоматериа-
лом и имплантация через 6 мес;
7) реконструкция переднего отдела
верхней челюсти биоматериалом
и установление имплантатов че-
рез 6— 12 мес.
II. План обследования и варианты
зубной имплантации на верхней че-
люсти в области премоляров
1. Определение задач зубной им-
плантации для гармонии лица.
2. Определение ширины рта.
3. Определение степени обнаже-
ния зубов при улыбке, разго-
воре.
4. Антропометрические исследо-
вания, наружное измерение
верхней челюсти.
5. Измерение размеров альвео-
лярного отростка.
6. Измерение толщины слизистой
оболочки, высоты свода пред-
дверия рта, уточнение мест при-
крепления мимических мышц,
наличия мышечных и слизистых
тяжей.
7. Прицельные и панорамные
снимки.
8. РКТ.
9. Анализ величин альвеолярного
отростка, окклюзии, определе-
ние числа и мест установления
имплантата, изготовление ак-
риловой каппы.
В сложных случаях:
10. Цефалометрическая рентгено-
графия.
Варианты лечения:
I) имплантация;
2) имплантация с одновременным
наращиванием кости биоматериалами;
3) имплантация с одновременным
поднятием дна верхнечелюстной пазухи;
4) наращивание кости биоматериа-
лом, имплантация через 6 мес;
5) поднятие дна верхнечелюстной
пазухи через латеральную стенку био-
материалом с одновременной имплан-
тацией;
6) поднятие дна верхнечелюстной па-
зухи через латеральную стенку биомате-
риалом с имплантацией через 6 мес;
7)эндоскопическое поднятие дна
верхнечелюстной пазухи биоматериа-
лом с одновременной имплантацией.
III. План обследования и варианты
зубной имплантации на верхней че-
люсти в области моляров
1. Антропометрическое исследо-
вание лица.
2. Измерение размеров альвео-
лярного отростка.
3. Измерение толщины слизистой
оболочки, высоты свода, уточ-
нение наличия мышечных и
слизистых тяжей.
4. Прицельные, панорамные сним-
ки (боковые, зонограммы, орто-
пантомограмма), томография.
5. РКТ.
б. Анализ величин альвеолярного
отростка и окклюзии, опреде-
ление количества и мест поста-
новки имплантатов, изготовле-
ние акриловой каппы.
В сложных случаях:
7. Эндоскопия верхнечелюстной
пазухи.
Варианты лечения:
1) имплантация;
2) имплантация с одновременным на-
ращиванием кости по ширине и высоте;
3) имплантация с одновременным
поднятием дна верхнечелюстной пазухи;
4) костная пластика и имплантация
через 6— 12 мес;
5) поднятие дна верхнечелюстной па-
зухи через латеральную стенку и транс-
плантация биоматериала под пазуху с
одновременной или отсроченной им-
плантацией;
6) эндоскопическая реконструкция
верхней челюсти биоматериалом с од-
новременной имплантацией;
7) эндоскопическая реконструкция
верхней челюсти биоматериалом с им-
плантацией через 6 мес.
IV. План обследования и реконструк-
ции верхней челюсти и зубной им-
плантации
1. Определение задач реконструк-
ции и имплантации для гармо-
нии лица.
2. Определение линии улыбки и
обнажения центральных зубов:
ширины рта в покое, при улыб-
ке; симметрии улыбки, степень
обнажения зубов при улыбке,
разговоре.
3. Антропометрическое исследо-
вание лицевого черепа.
4. Определение плоскостей лица.
5. Наружное измерение верхней
челюсти.
6. Наружное измерение нижней
челюсти.
7. Измерение размеров альвео-
лярного отростка верхней че-
люсти и альвеолярной части
нижней челюсти.
8. Измерение толщины слизистой
оболочки, высоты сводов пред-
дверия рта, уточнение наличия
слизистых, мышечных тяжей у
верхней и нижней челюстей.
9. Определение: окклюзионной
плоскости соответственно верх-
ним зубам и их соотношение с
краем верхней губы; определе-
ние окклюзионной плоскости
для гармонии лица.
10. Панорамные (прямые, боко-
вые, зонограммы, ортопан-
томограмма) и прицельные
снимки.
11. Цефалометрическая рентгено-
графия.
12. РКТ.
13. РКТ и МРТ.
14. Трехмерная компьютерная гра-
фика для планирования лече-
ния на верхней челюсти.
15. Измерение альвеолярного от-
ростка верхней челюсти на
модели, изготовление акрило-
вой каппы.
16. Анализ увеличения высоты,
ширины альвеолярного отрост-
ка и тела верхней челюсти, пла-
нирование костной пластики с
поднятием дна верхнечелюст-
ной пазухи, определение числа
и мест установления импланта-
тов, этапности операции.
Варианты лечения:
1) накладная трансплантация био-
материала с одновременным установ-
лением имплантатов;
2) накладная трансплантация биома-
териала с установлением имплантатов
через 6—12 мес;
3) поднадкостничное введение био-
материала с одновременной или отсро-
ченной имплантацией;
4) остеотомия по нижнему типу с
вставной трансплантацией биоматериа-
ла и имплантацией через 6—12 мес.
V. План обследования и зубной им-
плантации на нижней челюсти в об-
ласти центральных зубов и первого
премоляра
1. Определение задач зубной им-
плантации для гармонии лица.
антропометрические исследо-
вания.
2. Определение линии улыбки и
обнажения нижних централь-
ных зубов.
3. Прицельная рентгенограмма
участка адентии и соседних зу-
бов, окклюзионная рентгеногра-
фия.
4. Панорамная рентгенография
(центральная, зонограмма, ор-
топантомограмма).
5. Наружное измерение размеров
альвеолярной части нижней че-
люсти и в полости рта.
6. Измерение толщины слизистой
оболочки, высоты свода пред-
дверия рта, состояние уздечки
нижней губы, уточнение при-
крепления мышц по наружной
и внутренней поверхности ниж-
ней челюсти.
7. Анализ величин альвеолярной
части нижней челюсти и окк-
люзии, определение количества
и мест постановки импланта-
тов, изготовление акриловой
каппы.
В сложных случаях:
8. Цефалометрическая рентгено-
графия и РКТ.
Варианты лечения:
1) имплантация;
2) имплантация и наращивание кос-
ти биоматериалом по высоте, ширине с
одновременной имплантацией;
3) наращивание кости биоматериа-
лом с имплантацией через 3—4 мес;
4) остеотомия челюстного сегмента с
транспозицией кости кнаружи и внутрь,
помещение биоматериала в образовав-
шееся пространство и установление
имплантата;
5) остеотомия челюстного сегмента и
транспозиция вестибулярной стенки,
заполнение образовавшегося простран-
ства биоматериалом и установление
имплантата;
6) то же, что и в п. 4 и 5, но с ус-
тановлением имплантата через 3—
4 мес;
7) дистракция кости и отсроченное
установление имплантата.
VI. План обследования и варианты
зубной имплантации на нижней че-
люсти в области первого, второго
премоляра и моляров
1. Определение задач зубной им-
плантации для гармонии лица,
антропометрические исследо-
вания.
2. Прицельная рентгенограмма
участка адентии и соседних зу-
бов, при необходимости с мил-
лиметровой сеткой, окклюзи-
онная рентгенограмма.
3. Панорамная рентгенография
(боковая зонограмма, ортопан-
томограмма, в том числе с мар-
кировочными элементами), то-
мография.
4 РКТ.
5. Измерение размеров альвео-
лярной части нижней челюсти.
6. Измерение толщины слизистой
оболочки, высоты нижнего сво-
да преддверия рта, уточнение
прикрепления мышц по наруж-
ной и внутренней поверхности
нижней челюсти, наличия мы-
шечных и слизистых тяжей.
7. Анализ величин альвеолярной
части нижней челюсти и окк-
люзии, определение количества
и мест постановки имплантата,
изготовление акриловой каппы.
Варианты лечения:
1) имплантация;
2) имплантация с одновременным
наращиванием кости биоматериалом;
3) наращивание кости с импланта-
цией через 3—4 мес;
4) остеотомия для расщепления кос-
ти, заполнения образовавшегося про-
странства биоматериалом и установле-
ния имплангата;
5) остеотомия и транспозиция вес-
тибулярной стенки, введение в образо-
вавшееся пространство биоматериала
и установление имплантата;
6) то же, что и в п. 4 и 5, но с отсро-
ченным установлением имплантата;
7) дистракция кости с отсроченным
установлением имплантата;
8) транспозиция остеотомирован-
ных участков кости с одновременной
или отсроченной имплантацией и ре-
позицией нижнего альвеолярного нер-
ва, перемешен нем ментального отвер-
стия и одноименного нерва, изоляцией
их биоматериалом от имплантата.
VII. План обследования и варианты ре-
конструкции атрофированной ниж-
ней челюсти и зубной имплантации
1. Задачи реконструкции и им-
плантации для гармонии лица.
2. Определение ширины рта, ли-
нии улыбки, степени обнаже-
ния нижних зубов при улыбке,
разговоре.
3. Антропометрическое исследо-
вание лицевого черепа.
4. Определение плоскостей лица.
5. Наружное измерение нижней
челюсти.
6. Измерение размеров альвеоляр-
ной части нижней челюсти и
соотношения с верхней челю-
стью, окклюзионных взаимоот-
ношений челюстей.
7. Измерение толщины слизистой
оболочки, высоты нижнего сво-
да преддверия рта, уточнение
наличия слизистых, мышечных
тяжей, прикрепления мышц по
наружной и внутренней поверх-
ности нижней челюсти.
8. Определение окклюзионной
плоскости для гармонии лица.
9. Панорамные снимки (прямые,
боковые, зонограммы, ортопан-
томограмма, в том числе с мар-
кировочными элементами).
10. Цефалометрическая рентгено-
графия.
II. РКТ.
12. РКТ и МРТ.
13. Трехмерная компьютерная гра-
фика для планирования лече-
ния на нижней челюсти.
14. Измерение альвеолярной части
нижней челюсти по модели, из-
готовление акриловой каппы.
15. Анализ по ортопедической мо-
дели, РКТ и МРТ величин уве-
личения высоты, ширины аль-
веолярной части нижней челю-
сти, репозиции нижнего альве-
олярного нерва, этапности опе-
раций, числа и мест постанов-
ки имплантатов.
Варианты лечения:
1) накладная пластика биоматериа-
лом со стороны основания нижней че-
люсти;
2) накладная пластика биоматериа-
лом со стороны альвеолярного гребня;
3) поднадкостичное введение био-
материала по альвеолярной дуге;
4) пластика п. 1, 2, 3 с одновремен-
ной или отсроченной имплантацией;
5) пластика п. 1, 2, 3 с транспозици-
ей нижнего альвеолярного и подборо-
дочного нервов.
СПИСОК ЛИТЕРАТУРЫ
1. Аникин Ю.М., Колесников Л.Л. По-
строение и свойства костных струк-
тур. - М., 1993. - 127 с.
2. Боровский Е.В., Копейкин В.Н., Коле-
сов А.А. и др. Обследование стоматоло-
гических больных // Стоматология. —
М.: Медицина, 1990. — С. 18—53.
3. Брандсбург Б.Б. Хирургические мето-
ды лечения заболеваний челюстей (с
данными типовой анатомии). — Харь-
ков, 1931. - С. 6-13, 48-53.
4. Бусыгин А.Т. Структура челюстных
костей взрослого человека в норме и
при некоторых патологических со-
стояниях: Автореф. дис. ... д-ра мед.
наук. — М., 1963. — 18 с.
5. Воробьев Ю.И., Лесняк В.Н. Компью-
терная томография в диагностике забо-
леваний челюстно-лицевой области //
Стоматология. — 1988. — № 2. —
С. 89-92.
6. Воробьев Ю.И. Рентгенография зубов
и челюстей. — М.: Медицина, 1989. —
168 с.
7. Гветадзе Р.Ш., Матвеева А. И. Диаг-
ностика и прогнозирование функцио-
нального состояния тканей протезно-
го ложа в дентальной имплантации //
Пробл. стоматол. и нейростоматол. —
М.: Медицина, 1999. — № 2. — С.
38-41.
8. Гинзбург К). Б. Возрастная морфология
альвеолярных отростков: Дис. ... канд.
мед. наук. — М., 1954. — 160 с.
9. Дойников АН Особенности анатоми-
ческого и микроскопического строе-
ния нижней челюсти человека: Дис. ...
канд. мед. наук. — М., 1951. — 160 с.
10. Иванов А.С. Особенности расположе-
ния верхушек корней многокоренных
зубов в альвеолярном отростке верх-
ней челюсти И Арх. анат. — 1976. —
Т. LXX. вып. 4. - С. 11-16.
11. Иванов С.Ю., Климов Б.А., Лома-
кин М В. и др. Использование рентге-
новской компьютерной томографии в
планировании стоматологической им-
плантации И Современные проблемы
имплантологии. — Саратов, 1998. —
С. 48-49.
12. Копейкин В.Н., Миргазизов М.З., Боль-
шаков Г.М. и др. Руководство по орто-
педической стоматологии / Под ред.
В.Н. Копейкина. — М.: Медицина,
1993. - 711 с.
13. Кузнецова Л.В. Об индивидуальных
различиях формы нижней челюсти че-
ловека // Вопросы стоматологической
анатомии. — Вып. 1. — М., 1969. —
С. 139-145.
14. Курляндский В.Ю. Ортопедическая сто-
матология. — М.: Медицина, 1977. —
670 с.
15. Матвеева А.И., Иванов А.Г, Гветад-
зе Р.Ш., Гаврюшин С. С. Сравнитель-
ное клинико-рентгенологическое ис-
следование состояния опорных тка-
ней протезных конструкций, фикси-
рованных на имплантатах Core-Vent и
IMZ // Пробил, стоматол. и нейростома-
тол. — М.: Медицина, 1999. — № 2. —
С. 16-18.
16. Михайлов С.С., Колесников Л.Л. Ана-
томические основы топографии ли-
ца. — М.: Медицина, 1976. — С. 215.
17. Овчинников Ю.М. Оториноларинголо-
гия. — М.: Медицина, 1995. — 285 с.
18. Олесова В.Н., Осипов А.В. Новые ас-
пекты в оценке результатов математи-
ческого анализа напряженно-дефор-
мированного состояния системы про-
тез—кость—имплантат // Пробл. сто-
матол. и нейростоматол. — М.: Меди-
цина, 1999. — № 2. — С. 18—23.
19. Переверзев В.А. Медицинская эстети-
ка, — Волгоград, 1987. — 238 с.
20. Рабухина Н.А. Общие принципы ин-
терпретации рентгенограмм // Рент-
генодиагностика заболеваний челюст-
но-лицевой области // Под ред. Н.А.
Рабухиной, Н.М. Чупрыниной. — М.:
Медицина, 1993. — С. 71—87.
21. Рабухина Н А., Аржанцев А.П. Руково-
дство по рентгенодиагностике челю-
стно-лицевой области. — М.: МАА.
1999. - С. 451.
22. Робустова Г.Г., Ушаков А.И, Абу Асали
Эяд и др. Клинические, математиче-
ские, иммунологические аспекты зуб-
ной имплантации: Методические ука-
зания. — М., 1987. — 26 с.
23. Робустова Т.Г., Фех А.Р., Гокоева А.А.
Взаимосвязь параметров мягких тка-
ней лица, антропометрических пока-
зателей лицевого скелета и трехмер-
ной компьютерной и резонансной то-
мографии для зубной имплантации //
Вестник российской стоматологии. —
2000. -№ 4. - С. 20-25.
24. Робустова Т.Г., Стародубцев В.С. Об-
следование хирургического стомато-
логического больного // Хирургиче-
ская стоматология. — М.: Медицина,
1996. - С. 21-34.
25. Робустова Т.Г., Безруков В.М. Зубная
и челюстно-лицевая имплантация //
Руководство по хирургической стома-
тологии и челюстно-лицевая хирур-
гии. - 2000. - Т. 2. - С. 1040-1072,
26. Романов Н.А. Лечение больных одон-
тогенным перфоративным гаймори-
том с применением остеопластиче-
ских материалов: Автореф. дис. ...
канд. мед. наук. — М., 1998. — 20 с.
27. Свержевский Л.И. Аномалии гайморо-
вых пазух // Ежемесячн. ушн., горл, и
нос. бол. — 1910. — Т. 5. — С. 86.
28. Сидельников А. И. Планирование опе-
рации имплантации с учетом антро-
пометрических параметров лица: Ав-
тореф. дис. ... канд. мед. наук. — М.:
1992. - 20 с.
29. Смирнов В.Г., Кузнецова Л.В. Индиви-
дуальная изменчивость формы и по-
ложения нижнечелюстного и подбо-
родочного отверстий // Стоматоло-
гия. — 1969. — № 1. — С. 54—57.
30. Смирнов В.Г, Кузнецова Л.В. О возрас-
тных особенностях формы и размеров
нижней челюсти // Вопр. стоматол.
анатомии. — 1969. — Вып. 1. —
С. 145-152.
31. Соловьев М.М., Трезубов В.Н., Алехова
Т.М. и др. Уточнение показаний и
противопоказаний к применению
внутрикостных имплантатов при про-
тезировании полости рта // Пробл.
стоматол. и нейростоматол. — 1999. —
№ 2. - С. 45-47.
32. Суров ОН. Протезирование на им-
плантатах. — М.: Медицина, 1993. —
С. 205.
33. Сухарев М.Ф. Экспериментально-кли-
ническое обоснование конструкций
на имплантатах: Автореф. дис. ...
канд. мед. наук. — СПб., 1996. — 24 с.
34. Танфильев Д.Е. Возрастные особенно-
сти гайморовых пазух. — Л.: Медини-
на, 1964. - С. 26.
35. Темерханов Ф.Т., Гарафутдинов Д.М.,
Архаров С.Л. Компьютерно-томогра-
фическое и клиническое обоснование
применения эндооссальных никелид-
титановых дентальных имплантатов //
Стоматология — 1997. — № 1. —
С. 34-36.
36. Фех А.Р. Эндохирургические техноло-
гии и компьютерная графика в диаг-
ностике и лечении доброкачествен-
ных новообразований верхнечелюст-
ных пазух: Дис. ... канд. мед. наук. —
М., 2000. - С. 118.
37. Шхарц А.Д. Биомеханика и окклюзия
зубов. — М: Мединина. — 203 с.
38. Шнейдер А.Л. О топографоанатомиче-
ском соотношении зубов верхней че-
люсти к гайморовой и носовым по-
лостям И Стоматологический сбор-
ник, посвященный Е.М. Гофунгу. —
Харьков. 1936. — С. 17.
39. Abrahams J.J. The role of diagnostic im-
aging in dental implantology // Radiol.
Clin. N. Amer. — 1993. — Vol. 31. — P.
163-180.
40. Albrektsson T, Gott lander M., Johansson
C. et al. Interface reactions to implant
materials. — Berlin: Vortrag AG I der
DGZMK, 1992. - 12 s.
41. Alling C. Lateral repositioning of the in-
ferior alveolar neurovascular bundle // J.
Oral Surg. - 1977. - Vol. 35. - P. 419.
42. Anderson L., Karri ng T, Mackenzie I.
Oral mucous membrane // Human Oral
Embryology and Histology / Eds. I.A.
Mjor, 0. Fcjcrskov. — Copenhagen:
Munksgaard, 1986. — P. 203—242.
43. Anderson L.C., Kosinski T.F., Mentag P.J.
A review of the intraosseous course of
the nerves of the mandible // J. Oral Im-
plant. - 1991. - Vol. 17. - P. 394.
44 Andersson B., Odman P., Lidvall AM. et al.
Single tooth restorations supported by os-
seointegrated implants // Int. J. Oral Ma-
xillofac. Impl. — 1995. — Vol. 10(6). —
P. 702-711.
45. Arzouman M., Otis L., Kipnis C., Levi-
ne D. Observations of the anterior loop
in the inferior alveolar canal // Int. J.
Oral maxillofac. Impl. — 1993. — Vol. 8,
N 3. - P. 295-300.
46. Atwood D. Reduction of residual ridges.
A major oral disease entily // J. Prosth.
Dent. - 1971. - Vol. 25. - P. 266.
47. Balogh K, Molnar L., Schranz D., Hus-
zar G. Geroslomatologie. — Leipzig:
Barth. 1962. - P. 214.
48. Bassetti C., Remagen Ж, Spiessl B. His-
tologic-morphometric investigations into
cadaver mandibles. The bony structure as
a site for an implant prosthesis // Con-
cepts in maxillofacial bone surgery / Ed.
B. Spiess. — Berlin: Springer, 1976. —
P. 150-155.
49. Baxter J.C., Fattore L.D. Osteoporosis
and osseointegralion of implants Ц J.
Prosthodont. — 1993. — Vol. 2. —
P. 120-125.
50. Bays R. The pathophysiology and anatomy
of edentulous bone loss / Reconstructive
preprosthetic oral and vaxillofacial sur-
gery / Eds. R. Fonseca, W. Davis. —
Philadelphia: WB Saunders, 1986 —
P. 1-17.
51. Beime O.R. Osscointegrated implant sys-
tems // Principles of Oral and Maxillofa-
cial Surgery / Eds. L.J. Peterson, A.T. In-
dresano, R D. Marciani, S.M. Roser. —
Philadelphia: IB. Lippincott, 1992. — P
1133.
52. Cawood J., Howell R. A classification of
the edentulous jaws // J. Oral Maxillofac
Surg. - 1988. - Vol. 17. - P. 232-236.
53. Cibirka R.M., Razzoog ME., Lang В R.,
Slohler C.S. Determining the force ab-
sorption quotient for restorative materials
used in implant occlusal surfaces // J.
Prosthct. Dent. — 1992. — Vol. 67. —
P. 361-364.
54. Clarke E., Hickman J. An investigation in-
to the correlation between potential of
metals and their behavior in biological
fluids // J. Bone J. Surg. — 1953. —
Vol. 35B. - P. 467.
55. Cranin A., Klein M., Simon S. Color atlas
of oral implantology. — Stuttgart: Thieme
Medical Publishers Inc., 1993. — P. 342.
56. Dahlin C., Linde A., Goelow J., Nyman S.
Healing of bone defects by guided tissue
regeneration // Plast. Reconstr. Surg. —
1988. - Vol. 81. - P. 672-676.
57. Dao T., Anderson J., Zarb G. Is oste-
oporosis a risk factor for osseointegralion
of dental implants? // Int. J. Oral Maxil-
lofac. Impl. - 1993. - Vol. 8. - P. 137.
58. Dausch-Neumann D. Kieferorthopadie //
Swenzer N. Zahn-Mund-Kiefer-
Heilkunde. — Bd. 5. — Stuttgart:
Thieme, 1987. - S. 114.
59. Dharmar S. Locating the mandibular ca-
nal in panoramic radiographs // Int. J.
Oral Maxillofac. Impl. — 1997. —
Vol. 12. - P. 113-117.
59a. Drago A. Implant restorations: A step by
step. — Implant Innovations Inc. — Tex-
as, 1997. - P. 219.
60. Eckert S.E., Laney Ж.Л. Patient evalua-
tion and prosthodontic treatment plan-
ning for osscointegrated implants //
Dent. Clin. North Amer. — 1989. —
Vol. 33. - P. 599-618.
61. Ellis E. The nature of vertical maxillary
deformities: Implications for surgical in-
tervention // J. Oral Maxillofac. Surg. —
1985. - Vol 43. - P. 756.
62. Engelman M., Sorensen J., Moy P. Opti-
mum placement of osscointegrated im-
plants // J. Prosthct. Dent. — 1988. —
Vol. 59. — P. 467.
63. Fallschusser G. Zahnaurztliche implan-
tologie. — Berlin: Quintessenz, 1986. —
S. 203.
64. Fernandes R.J., Azarbal M., Ismail Y.H.
A cephalometric tomographic technique
to visualize the buccolingual and vertical
dimensions of the mandible // J. Pros-
thet. Dent. — 1987. — Vol. 58. — P
466-470.
65. Gabriel A. C. Some anatomical features of
the mandible // J. Anat. — 1958. —
Vol. 92. - P. 580.
66. Geering A., Kundert M. Total- und Hy-
bridprothetik / 2. Auf). Farbatlanten der
Zahnmedizin. — Bd. 2. — Stuttgart:
Thieme, 1992. — S. 81.
67. Goaz P.W., White S.C. Oral radiology:
principles and interpretation. — St Louis:
Mosby, 1992. - 316 p.
68. Graf H. Bruxism // Dent. Clin. N.
Amer. - 1969. - Vol. 13. - P. 659-665.
69. Grondahl K, Ekestubbe A., Grondahl H.G.
Technical considerations for intraoral ra-
diography in postoperative examination //
Nobel Biocare Global Forum. — 1996. —
Vol. 10(3). - P. 10-11.
70. Gruber H.. Solar P., Ulm C. Anatomie
und atrophicbedingte Ver(ndcrungen der
Kicfcrknochen. Endossale Implantatc in
der oralen Chirurgie. Ed. G. Watzck. —
Berlin: Quintessenz, 1993. — S. 29—60.
71. Harle F. Atlas der proprothetischcn Op-
erationcn. — Munchen: Hanser, 1989. —
P. 212.
72. Habets L., Bras J., Borgmeyer-Hoelen
A.M. et al. Mandibular atrophy and met-
abolic bone loss, endocrinology, radiolo-
gy and histomorphometry // J. Oral
Maxillofac. Surg. - 1988. - Vol. 17. -
P. 208.
73. Harris Ж, Heaney R. Skeletal renewal
and metabolic bone disease // New Engl.
J. - 1969. - Vol. 280. - P. 193-303.
74. Hendrick R.T., Dove SB., Peters D.D. et
al. Radiographic determination of canal
length: direct digital radiography versus
conventional radiography // J. Endo-
dont. - 1994. - Vol. 20(7). - P. 320-
326.
75. Hoffman K. Preoperative Considerations
Maxilla Endoosseus Implants for Maxillo-
facial Reconstruction. — Philadelphia —
London: Saunders Co., 1995. — P. 103—
113.
76. Jeffcoat M, Jeffcoat R.L., Reddy M.S,
Beriand L. Planning interactive implant
treatment with 3D computed tomogra-
phy // J. Amer. Dent. Assoc. — 1991. —
Vol. 122 - P 40—44.
77. Jensen J., Nock D. Inferior alveolar nerve
repositioning in conjunction with place-
ment of osseointegrated implants: a case
report // Oral Surg. — 1987. — Vol. 63. —
P. 263
78. Jensen O. Site classification for the os-
seointegrated implant // J. Prost het.
Dent. - 1989. - Vol. 61. - P. 228-
234.
79. Kondell P., Nordenram A., Land! H. Tita-
nium implants in the treatment of eden-
tulousness: influence of patient's age on
prognosis // Gerodontics. — 1988. —
Vol. 4. - P. 280.
80. Kennedy E. Partially denture construc-
tion. — Brooklyn — N.Y., 1928. — 124 p.
81. Kent J., Misiek D. Biomaterials for cranial,
facial, mandibular and TMJ rcconstruc- i
tion // Oral and maxillofacial trauma /
Eds. R. Fonseca, R. Walker. — Philadel-
phia: W.B. Saunders, 1991. — P. 781—
1026.
82. Kiesselbach J.E., Chamberlain J.G. Clini-
cal and anatomic observations on the re-
lationship of the lingual nerve to the
mandibular third molar region // J. Oral
Maxillofac. Surg. — 1984. — Vol. 42. —
P. 565.
83. Kircos L.T. Implant imaging in perspec-
tive with a focus on interactive computed
tomography and electronic surgery //
Int. Cong. Oral Implant. — 1995, March
15-16.
84. Kircos L.T. Magnetic resonance imaging
of the mandible utilizing a double scout
techniques for preprosthetic imaging //
J. Magnetic Res. Med. — 1993. —
Vol. W. - P. 24-30.
85. Kircos L.T. Quantitative implant imaging
with a focus on interactive computed to-
mography: successful implants cases /
Are they possible? For how long? — Lo-
ma Linda University, 1994.
86. Klinge B., Petersson A., Maly P. Location
of the mandibular canal: Comparison of
macroscopic findings, conventional radi-
ography, and computer tomography //
Int. J. Oral Maxillofac. Impl. — 1989. —
Vol. 4. - P. 327-332.
87. Kraut R.A. Selecting the precise implant
site // J. Amer. Dent. Assoc. — 1991. —
Vol. 122. - P. 59-60.
88. Kraut R.A. Utilization of 3D/dental soft-
ware for precise implant site selection:
Clinical reports // Impl. Dent. — 1992. ~~
Vol 1. - P. 134.
89. Kraut R.A Radiologic Planing for dental
Implants. Endoosseus Implant for Maxil-
lofacial Reconstruction. — Philadel-
phia-London: W.B. Sanders, 1995. —!
P. 113-134
90. Laney Ж Selecting edentulous patients
for tissue-integrated prostheses // Int. J-
oral maxillofac. implants. — 1986. —
Vo). 1. - P. 131.
91. Ledermann P., Hassell T, Hefti A. Os-
seointegrated dental implants as alterna-
tive therapy to bridge construction or or-
thodontics in young patients: seven years
of clinical experience // Pediat. Dent. —
1993. - Vol. 15. -P. 327.
92. Lee C.Y.S. Three dimensional CT im the
evaluation of placement for dental im-
plants I I Hawaii Dent. J. — 1996. —
P. 26-20.
93. Lekholm U., Zarb G.A. Patient selection
and preparation // Tissue-Integrated
Prostheses Osseointegration in Clinical
Dentistry. / Eds. P.l. Branemark et al —
Chicago: Quintessence Publishing.
1985. - P. 199-210.
94. Lekholm U. The use of osseointegrated
implants in growing jaws // Int. J. Oral
Maxillofac. Impl. - 1993. - Vol. 8. -
P. 243.
95. Lili W., Velikogne Ж, Plenk H. et al. Der
Einfluss von Bohrerdesign und primarer
Passgenauigkeil des implantatbettes auf
die Knocheme Einheilung von IMZ-im-
plantaten // Z. Stomatol. — 1992. —
N 289. - S. 192.
96. Linkow L. Oral Implantology — Princi-
ples and Pitfalls // Dent. Survey. —
1971. - P. 161-166.
97. Mailath G., Ulm C., Ertl U. et al. Soft-
tissue thickness of the edentulous maxilla
// Int. J. Oral Maxillofactor//J. Sonog-
raphie imaging of the. — 1991. — Vol. 6,
N 1. - P. 70-74.
97a. Maher W.P. Topographic, microscopic,
radigraphic and computerized morpho-
metric studies of the human, adult eden-
tate mandible for oral implantologists //
Clin. Anat. - 1991. - Vol. 4. - P. 327-
340.
98. Mercier P., Lafontant R. Residual alveo-
lar ridge atrophy: Classification and in-
fluence of facial morphology // J. Pros-
thet. Dent. - 1979. - Vol. 43. - P. 90.
99. Miller C.S., Nummikoski P.V., Barnett
DA. et al. Cross-sectional tomography. A
diagnostic technique for determining the
buccolingual relationship of impacted
mandibular third molar and the inferior
alveolar neurovascular bundle // Oral
Surg. Oral Med. Oral Pathol. — 1990. —
Vol. 70. - P. 791.
100. Miller J.A. Studies on the location of the
lingula, mandibular foramen and mental
foramen // Anat. Rec. — 1953. —
Vol. 115. - P. 349
101. Misch C., Crawford E. Predictable mandib-
ular nerve location. A clinical zone of safe-
ty // Int. J. Oral Maxillofac. Implant. —
1990. - Vol. 7. — P. 37-40.
102. Misch C., Judy K. Classification of par-
tially edentulous arches for implant den-
tistry // Int. J. Oral Maxillofac. Implan-
tol. - 1987. - Vol. 4. - P. 7-12.
103. Misch C.E., Bidez M.W. Implant protect-
ed occlusion, a biomechanical rationale /
/ Compent. Cont. Educ. Dent. — 1994 —
Vol. 15(11). - P 1330-1344.
104. Misch C.E. Early crcstal bone loss etiolo-
gy and its cffecton tretment planing for
implants // Post Graduate Dent. —
1995. - Vol. 2. - P. 3-17.
104a.Norton M. Dental Implant Quintcssense
Co. — London—Berlin. 1996. — P. 148.
105. Odman J., Grondahl K., Lekholm U.,
Thilander B. The effect of osseointegrated
implants on the dental-alveolar develop-
ment: a clinical and radiographic study in
growing pigs // Europ. J. Orthodont. —
1991. - Vol. 13. - P. 279.
106. Ohmell L., Palmquist J., Branemark P.-L
Single tooth replacement // Worthington
P., Branemark P.-I. Advanced Os-
seointegration Surgery. — Berlin: Quin-
tessenz, 1992. — P. 211.
107. Olivier E. The inferior dental canal and
its nerve in the adult // Brit. E>ent. J. —
1928. - Vol. 49. - P. 356.
108. Petrikowski C.G., Pharoah M.J., Schmitt
A. Presurgical radiographic assessment
for implants // J. Prosthet. Dent. —
1989. - Vol. 61. - P. 59-64.
109. Probster L., Freesmeyer W. Das Fem-
rontgenseitenbild in der praimplantolo-
gischen Diagnostik Ц Z. Zahnartztl.
Impl. - 1989. - N 5. - S. 55.
109a.Robb R. Three-Dimensional biomedical
imaging principles and practice. — New-
York: YCN publishers Inc., 1995. - P. 27.
110. Rothman S., Chaftez N., Rhodes M.L. et
al. CT in the preoperative assessment of
the mandible and maxilla for endosseous
implant surgery // Radiology. — 1998. —
Vol. 168. - P. 171.
111. Schroeder A., Maeglin B., Sutter E,
Das LT. Hohlzylinderimplantat Type F
zur Prothescnretention beim zahnlosen
Kiefer // Schweiz. Monatschr. Zahn-
heilk. - 1983. - N. 93. - S. 720-733.
112. Schwarz M., Rothman S., Rhodes M.,
Chafetz N. Computer tomography: Part
I. Preoperative assessment of the mandi-
ble for endosseous implant surgery // Int.
J. Oral Maxillofac. Impl. — 1987. — Vol.
2. - P. 137.
113. Shimura M., Babbush C.A., Majima H. et
al. Presurgical evaluation of/for dental
implants using a reformatting program of
computed tomography: Maxilla/mandi-
ble shape pattern analysis (MSPA) // Int.
J. Oral Maxillofac. Impl. — 1990. — Vol.
5. - P. 175.
114. Shimura M.. Babbush C.A., Majima H. et
al. Presurgical evaluation for dental im-
plants using a reformatting program of
computed tomography: Maxilla/mandi-
blc shape pattern analysis (MSPA) // Int.
J. Oral Maxillofac. Impl. — 1990. —
Vol. 5. - P. 175-181.
115. Smith J.P., Borrow J.W. Reformatted CT
imaging for implant planning // J. Oral
Maxillofac. Surg. — 1991. — Vol. 3. —
P. 805-825.
116. Spiekermann H. Implantatprothetik //
Voss R., Meiners H. — Fortschritte der
zahnarztlichen prothetik und Wcrkst-
offkundc. — Bd 3. — Munchen: Hanser,
1987. - S. 279.
117. Spiekermann H., Donath K., Hassell T. et
al. Color Atlas of Dental Medicine. Im-
plantology. — N.Y.: Thieme, 1995. —
P. 59-76.
118. Stella J.P., Tharanon W. A precise radio-
graphic method to determine the loca-
tion of the inferior alveolar canal in the
posterior edentulous mandible: Implica-
tions for dental implants: Part 1. Tech-
nique // Int. J. Oral Maxillofac. Impl. —
1990. - Vol. 5. - P. 15-22.
119. Stover J. Preoparative Considerations.
Anatomic Consideration. Ensoosseus
Implants for Maxillofacial Reconstruc-
tion. — Philadelphia—London: Sanders
Co., 1995. - P. 93-103.
120. Sutler F., Schroeder A., Buser D. The new
concept of I.T.I. hollow-cylinder and
hollow-screw implants. Part I. Engineer-
ing and design // Int. J. Oral Maxillofac.
Impl. - 1988. - Vol. 3. - P. 161-172.
121. .SVwt- M.S., Rothman S.L.G., Rhodes M.L.
et al. Computed tomography. Part I Pr-
eoperative assessment of the mandible
for endosseous implant surgery // Int. J.
Oral Maxillofac. Impl. — 1987. —
Vol. 2. - P. 137-141.
122. Tallaghren A. The continuing reduction
of the residual alveolar ridgem in complete
dentures weares // J. Prosth. Dent. —
1972. - Vol. 27. - P. 120.
123. Tammisalo T, Happonen R.-P., Tarnmis-
alo E.H Stereographic assessment of
mandibular canal in relation to the roots
of impacted lower third molar using mul-
ti projedtion narrow beam radiography //
J. Oral Maxillofac. Surg. — 1992. —
Vol. 21. — P. 85.
124. Tatum O., Lebowitz M. Anatomic consid-
eration for dental implants // J. Oral Im-
pl. _ 199]. _ Vol. 17. - P. 16-21.
125. Taylor T. Fixed implant rehabilitation for
the edentulous maxilla Ц Int. J. Oral
Maxillofac. Impl. — 1991. — Vol. 6. —
P. 329.
126. Tetsch P. Enossale implantationen in der
zahnheilkunde. — Munchen: Hanser,
1991. - S. 485.
127. Thedens E., Lippert H. Bezahnung und
kompaktadichle der kieferknochen //
Dtsch. Zahnarztl. Z. — 1973. — N 28. —
S. 56.
128. Throckmorton G.S., Finn R., Bell W. Bio-
mechanics of differences in lower facial
height // Amer. J. Orthod. — 1980. —
Vol. 77. - P. 410-420.
129. Ulm C., Pechmann U., Lili W. et al.
Anatomische untereuchungen an der at-
rophen mandibula. Teii 2. Das foramen
mentale und der canalis mentalis // Z.
Stomatol. - 1990. - N 87. - S. 7.
130. Wakley G., Baylink D. Systemic influ-
ences on the bone response to dental and
arthopedic implants // J. Oral Impl. —
1988. - Vol. 14. - P. 285.
131. Watson R., Davis D., Forman G., Coward |
T. Considerations in design and fabrica-
tion of maxillary implant-supported ]
prosthescs // Int. J. Prosthodont. —J
1991. - Vol. 4. - P. 232.
132. Watzek G. Endossale implantate in der
oralcn chirurgie. — Berlin: Quintessenz,
1993. - S. 392
133. Weingart D., Duker J. Rontgentomjgra-
phische technik zur darstellung des atro- '
phierten alveolarfortsatzes vor endossaler
implantation // Z. Zahnarztl. Impl. — 1
1991. - N 7. - S. 271.
134. Wical K., Swoope D. Studies of residual
ridge resorption. Part 1: Use of panoram-
ic radiographs for classification of man-
dibular resorption // J. Prosth. Dent. —
1974. - Vol. 32. - P. 7.
135. Worthington P. Clinical aspects of severe
mandibular atrophy // Worthington P.,
Branemark P —I. Advanced osseointe-
gration surgery. — Berlin: Quintessenz,!
1992. - P
136. Yosue N., Brooks S.L. The appearance of
mental foramina on panoramic and peri-
apical radiographs: II Experimental eval-
uation // Oral Surg. Oral Med. Oral
Pathol. - 1989. - Vol. 68. - P. 488-
492.
137. Zabalegui J., Gil J.A., Zabalegui B. Mag-
netic resonance imaging as an adjunctive
deagnostic aid in patient selection for en-
dosseous implants: preliminary study //
Int. J. Oral Maxillofac. Impl. — 1991. —
Vol. 5. - P. 283-288.
Глава 4
ОЦЕНКА ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ОРГАНИЗМА
И ПОДГОТОВКА К ЗУБНОЙ ИМПЛАНТАЦИИ
Зубная имплантация заключается в про-
велении оперативных вмешательств. Их
допустимый объем у каждого пациента
зависит прежде всего от функциональ-
ного состояния организма [48]. Перед
зубной имплантацией его следует оце-
нивать по общим правилам, принятым
в хирургической стоматологии [37, 92].
Однако, поскольку зубная импланта-
ция проводится не по жизненным по-
казаниям, сопоставлять отрицательное
влияние операции на общее здоровье
пациента необходимо с максимальной
точностью [5, 36,128]. Это приобретает
особое значение в связи с увеличением
числа случаев внезапной смерти во
время имплантации [80].
Как показала практика, в США поч-
ти 80 % пациентов, обратившихся по
поводу имплантации, страдали хрони-
ческими заболеваниями. Из них почти
у 50 % людей старше 65 лет наблюда-
лись заболевания опорно-двигательно-
го аппарата, у 39 % было повышено ар-
териальное давление и 27 % имели
другие проблемы с сердечно-сосуди-
стой системой [113, 114, 117]. В России
также отмечается рост числа пациен-
тов с диабетом, остеопорозом, патоло-
гическими иммунологическими реак-
циями [35]. Все это может создавать
риск при зубной имплантации, ухуд-
шать общий прогноз комплексного ле-
чения и увеличивать длительность реа-
билитационного периода.
Первым и важным этапом для хи-
рурга-стоматолога является анкетиро-
вание больного с выяснением сопутст-
вующей патологии и общего физиче-
ского состояния организма на момент
осмотра. Обращают внимание на те
медицинские данные, которые могут
повлиять на показания к имплантации
и в дальнейшем на приживление им-
плантата. Физическое состояние паци-
ента заключается в оценке имеющихся
У него симптомов. Затем анализируют
результаты лабораторного исследова-
ния, включающего неоднократный кли-
нический анализ крови и оценку коа-
гуляционных свойств крови. На треть-
ем этапе сопоставляют стоматологиче-
ский статус с результатами лаборатор-
ных исследований и оценки функцио-
нального состояния организма и
имеющейся соматической патологии,
что позволяет установить показания к
зубной имплантации [104].
Оценка состояния пациента перед
операцией имплантации имеет важное
значение с точки зрения хирургиче-
ских противопоказаний, дальнейшего
протезирования и гигиены полости
рта. Потребность в зубной импланта-
ции увеличивается с возрастом, в ре-
зультате чего большее количество па-
циентов пожилого возраста обращают-
ся к стоматологам.
Начальные сведения о функцио-
нальном состоянии организма канди-
дата на имплантацию врач-стоматолог
обычно получает при беседе с ним,
тщательно и педантично собирая
анамнез и устанавливая возможные
факторы риска. В ходе беседы выясня-
ют жалобы, относящиеся к общим за-
болеваниям. Среди них врач различает
основные и второстепенные и профес-
сионально оценивает их. Пациент мо-
жет жаловаться на боли и другие сим-
птомы заболеваний полости рта или
челюстно-лицевой области, других ор-
ганов и систем организма. К моменту
общего обследования пациент должен
быть санирован и поэтому не ощущать
болей в зубах и тканях пародонта. В
случаях, когда пациент предъявляет
жалобы на сухость в полости рта, боли
в языке, на участках выхода перифери-
ческих ветвей тройничного нерва, ви-
сочно-нижнечелюстном суставе, при
глотании, следует установить связь
этих симптомов с заболеваниями сер-
дечно-сосудистой, эндокринной, нерв-
______ ______________1Я9
ной систем, желудочно-кишечного
тракта. При навязчивости с фиксирова-
нием отдельных жалоб необходим бо-
лее глубокий анализ нервно-психиче-
ского состояния пациента, адекватно-
сти и мотивации лечения, связанного с
имплантационной хирургией и дли-
тельными сроками ортопедической
реабилитации |7|.
Опрашивая больного, уточняют осо-
бенности его роста и развития. Необ-
ходимо получить сведения о здоровье
родителей, условиях труда, быта, отдыха
пациента, занятиях физической куль-
турой. Особое внимание должно быть
обрашено на вредные привычки — ку-
рение, употребление алкоголя, ле-
карств, наркотиков. Все эти сведения
позволяют получить правильное общее
представление о физическом и нравст-
венном здоровье пациента. Курение, в
частности, может значительно ухуд-
шить прогноз имплантации [42, 51, 85,
129J. С. Bain и Р. Моу [52] специально
изучали приживаемость имплантатов в
связи с курением. Ими проанализиро-
ваны результаты лечения 540 пациен-
тов с 2194 имплантатами, за которыми
проводили динамическое наблюдение
в течение 6 лет. В целом во всей группе
неудачи отмечены в 5,92 % случаев (у
11,28 % курящих и 4,7 % некурящих).
Таким образом, при имплантации у ку-
рящих пациентов степень риска значи-
тельно (в 2,4 раза) выше. Более катего-
рично можно утверждать, что у людей,
злоупотребляющих наркотиками и ал-
коголем, имплантация невозможна
[86, 102J.
Собирая анамнез, необходимо отме-
тить наследственные болезни и в даль-
нейшем учитывать генетические фак-
торы. Так, при наличии у близких род-
ственников аллергических, аутоим-
мунных, иммунопролиферативных бо-
лезней, а также злокачественных ново-
образований, психических болезней в
нескольких поколениях должно быть
предметом обследования больного со-
ответствующими специалистами. Врача
должно насторожить наличие у больно-
го наследственных болезней и синдро-
мов, которые, как правило, сочетаются
с дефектами иммунитета. Кроме того,
при наследственных болезнях и син-
дромах могут быть поражены как че-
люстно-лицевая область, так и внут-
ренние органы и системы организма
[6, II, 50, 130]. Часто именно такие
преморбидные факторы анамнеза за-
ставляют отказывать пациенту в зуб-
ной имплантации или проводить спе-
циальную подготовку. В других случа-
ях предположения об отягощенной на-
следственности могут быть отвергнуты
в ходе специального углубленного об-
следования.
При анализе анамнеза жизни канди-
дата на имплантацию, характера сис-
темных и других заболеваний большую
помощь может оказать вопросник, ко-
торый дают пациенту до начала беседы
с ним (форма № 1). Данные о перене-
сенных или имеющихся заболеваниях
служат определенными ориентирами
при беседе с кандидатом на импланта-
цию, помогают систематизировать по-
лученные сведения. Они могут быть
соотнесены с разработанными нами в
1987 г. показаниями и противопоказа-
ниями к зубной имплантации с учетом
сопутствующей патологии [2, 33, 35], а
также с практическими рекомендация-
ми по диагностике ряда общих заболе-
ваний, подготовке пациентов к опера-
ции в поликлинических условиях и
оказанию помощи при неотложных со-
стояниях [26, 42, 92].
Разработанный нами вопросник со-
ответствует международным требовани-
ям к оценке функционального состоя-
ния пациента, необходимого для прове-
дения зубной имплантации. Оценка
функционального состояния организ-
ма перед зубной имплантацией с уче-
том классификации заболеваний по
этиологии и патогенезу и результатов
лабораторных исследований дает воз-
можность дифференцированно опре-
делить показания и противопоказания
к зубной имплантации, ее объем и
план лечения.
Форма № 1
Карта обследования пациента для оценки функционального состояния организма
Перенесенные и имеющиеся заболевания
(со слов пациента)
Фамилия, имя. отчество______________________________________________
Пол Рост Масса тела Возраст
Обведите кружком свой ответ и подчеркните симптом или заболевание. Во-
просы имеют непосредственное отношение к состоянию Вашей полости рта
и определяют возможность имплантации, особенности подготовки к ней и ее
проведения.
1. Имеются ли у Вас жалобы на состояние своего здоровья? Да, нет
2. Чем Вы болели в последний год?___________________________________
3. Когда Вы проходили медицинский осмотр в последний раз?
4. Находитесь ли Вы сейчас под наблюдением врача?
Если да, то по поводу чего? Да, нет
5. Поликлиника и врачи, у которых Вы наблюдаетесь
6. Были ли у Вас тяжелые заболевания или операции?
Если да, то какие? Да, нет
7. Госпитализировались ли Вы в последние 5 лет?
Если да, то по поводу какого заболевания? Да, нет
Есть ли у Вас сейчас или было когда-нибудь одно из перечисленных ниже
заболеваний?
/. Сердечно-сосудистая система
СС1. Нейроциркуляторная дистония Да, нет
СС2. Гипертоническая болезнь Да, нет
ССЗ. Гипертонические кризы Да, нет
СС4. Ишемическая болезнь Да, нет
СС5. Стенокардия Да, нет
СС6. Инфаркт миокарда Да, нет
СС7. Сердечная астма Да, нет
СС8. Нарушения сердечного ритма и проводимости Да, нет
СС9. Инфекционные болезни сердца Да, нет
СС10. Пороки сердца Да. нет
ССП. Операции на сердце Да. нет
СС12. Есть ли у Вас одышка при ходьбе, отек ног _ Да, нет
//. Ревматические заболевания
РБ1. Страдаете ли Вы диффузными заболеваниями соединительной
ткани Да, нет
РБ2. Ревматизм Да, нет
РБЗ. Полиартриты Да, нет
РБ4. Воспалительные дегенеративные заболевания позвоночника Да, нет
РБ5. Болезни соединительной ткани Да, нет
РБ6. Системная красная волчанка Да, нет
РБ7. Системная склеродермия Да, нет
РБ8. Системные васкулиты Да, нет
III. Дыхательная система
ДС1. Часто ли Вы простужаетесь? Бывают ли после этого осложнения
на бронхи, легкие? Да, нет
ДС2. Как часто возникает кашель, в том числе с мокротой Да, нет
ДСЗ. Бывают ли у Вас одышка, боли в груди? Да, нет
ДС4. Страдаете ли Вы эмфиземой, бронхоэктатической болезнью.
бронхиальной астмой? Да, нет
Прсик>.1жение
IV. Болезни почек
БП1. Есть ли у Вас или были заболевания почек? Да, нет
БП2. Есть ли боли в нижнем отделе спины или при мочеиспускании? Да. нет
БПЗ. Бывают ли задержка мочи, отеки лица и ног? Да. нет
БП4. Болели ли Вы острыми инфекционными заболеваниями. Да, нет
после которых отмечались нарушения функции почек?
БП5. Исследовали ли Вы мочу, были ли в ней какие-либо изменения? Да, нет
V. Половая система
Есть ли у Вас или были следующие заболевания:
ПС1. Г оноррея Да. нет
ПС2. Сифилис Да. нет
ПСЗ. Хламидиоз Да, нет
ПС4. В ИЧ -и нфекция Да, нет
Женщины
ПС5. Есть ли у Вас воспалительные заболевания матки, яичников Да. нет
ПС6. Как протекают у Вас менструации? Да. нет
ПС7. Сколько времени нет менструаций? Да. нет
ПС8. Вы беременны или кормите грудью? Да, нет
ПС9. Принимаете ли Вы внутрь контрацептивы Да, нет
пли гормональные препараты?
Мужчины
ПСП. Не страдаете ли Вы воспалительными заболеваниями Да, нет
предстательной железы или мочевыводящих путей?
VI. Эндокринные болезни
ЭБ1. Есть ли у Вас заболевания щитовидной железы? Да, нет
ЭБ2. Отмечаете ли Вы частый пульс, чувство жара, потливость, Да. нет
раздражительность?
ЭБЗ. Болеете ли Вы диабетом? Да, нет
ЭБ4. Болел ли диабетом кто-либо в семье? Да. нет
ЭБ5. Мочитесь ли Вы более 6 раз в день? Да, нет
ЭБ6. Часто ли Вы испытываете жажду, сухость языка? Да. нет
ЭБ7. Не было ли у Вас переломов костей Да. нет
ЭБ8. Нет ли у Вас заболеваний пародонта и нс наблюдается ли Да, нет
кровотечение из десен при чистке зубов?
VII. Система пищеварения
Есть ли у Вас или когда-либо были следующие заболевания:
СП1. Желудка, двенадцатиперстной кишки, язвенная болезнь Да. нет
СП2. Эзофагиты или другие заболевания пищевода Да. нет
СПЗ Энтерит, гастрит, глистные или лямблевые инвазии Да. нет
СП4 СП5. Заболевания печени, желчного пузыря Были ли у Вас операции на желудке, двенадцатиперстной кишке. Да, нет
желчном пузыре? Да, нет
СПб. Наблюдались ли у Вас тошнота, рвота кровью, темный Да. нет
или с примесью крови кал, поносы или запоры?
СП7. Каков Ваш рацион питания, достаточно ли витаминов в пище, Да, нет
наблюдаются ли изменения в полости рта?
СП8. Употребляете ли Вы алкогольные напитки? Да, нет
VIII. Болезни системы крови
БСК1. Да. нет
Продолжение
БСК2. Болел ли кто-нибудь в семье заболеваниями крови? Да, нет
БСКЗ. Образуются ли у Вас гематомы после легких ушибов? Да, нет
БСК4. Были ли у Вас обильные кровотечения после операций, удаления зубов, травм? Да. нет
БСК5. Делали ли Вам переливание крови? Да, нет
БСК6. Обнаруживались ли изменения при исследовании крови? Да, нет
IX. Болезни уха, горла, носа
БУГН1. Есть ли у Вас заболевания уха, горла, носа? Да. нет
БУГН2. Как часто Вы болеете ОРВИ? Да, нет
X. Болезни органов зрения
Б031. Есть ли у Вас заболевания глаз? Да, нет
БО32. Как менялось с возрастом зрение, какие очки носите? Да, нет
БОЗЗ. Есть ли у Вас глаукома? Да, нет
XI. Болезни нервной системы
БНС1. Страдаете ли Вы заболеваниями нервной системы? Да, нет
БНС2. Наблюдаетесь ли Вы у невропатолога? Да, нет
БНСЗ. Бывают ли у Вас боли в области лица? Да, нет
БНС4. Бывают ли у Вас судорожные припадки? Да, нет
БНС5. Отмечались ли у Вас или у родственников наследственные болезни нервной системы? Да, нет
БНС6. Бывают ли у Вас головная боль, тошнота, рвота? Да, нет
БНС7. Были ли у Вас гипертонические кризы с неврологическими нарушениями? Да, нет
БНС8. Что Вы ждете от предстоящего лечения, насколько оно Вас тре нож ит? Да, нет
XII. Психическая сфера пациента
ПСП1. Не страдаете ли Вы психическими заболеваниями? Да, нет
ПСП2. Не страдают ли Ваши близкие родственники психическими заболеваниями? Да, нет
ПСПЗ. Состояли ли Вы в детстве на учете у психиатра? Да, нет
ПСП4. Наблюдались ли у Вас нарушение функций речи, сна, приема пищи, энурез, острые реакции на стресс? Да. нет
ПСП5. Не страдаете ли Вы алкоголизмом, токсикоманией, наркоманией? _ Да, нет
ПСП6. Не наблюдаются ли у Вас сексуальные отклонения? Да, нет
XIII. Опухоли
О1. Есть ли у Вас или когда-либо были опухоли или злокачественные новообразования? Да, нет
02. Проводили ли Вам химиотерапию или облучение? Да, нет
03. Были ли злокачественные новообразования у близких родственников, в том числе в нескольких поколениях? Да, нет
XIV. Прием лекарств
Л1. Укажите, какие лекарства Вы принимаете: а) антибиотики, сульфаниламидные, нитрофурановые препараты Да, нет
б) обезболивающие препараты Да. нет
в) антикоагулянты Да, нет
г) лекарства для снижения артериального давления Да. нет
д) сердечные лекарственные средства Да, нет
е) транквилизаторы Да. нет
Продолжение
ж) наркотические средства Да, нет
э) другие Да, нет
Л2. Отмечается ли у Вас аллергия или неблагоприятные реакции на:
а) местную анестезию Да, нет
б) антибиотики, сульфаниламидные препараты Да, нет
в) барбитураты, успокоительные, снотворные Да, нет
г) ацетилсалициловую кислоту Да, нет
д) кодеин, наркотики Да, нет
е) другие лекарственные препараты Да, нет
Есть ли у Вас
а) профессиональные вредности_____________________________. Да, нет
б) вредные привычки Да, нет
Есть ли у Вас какие-либо заболевания или медицинские проблемы, которые не
были упомянуты выше и о которых, как Вы полагаете, следует нам сообщить?
Решая вопрос об имплантации, сле-
дует особенно тщательно изучить дан-
ные обследования пациента общими
специалистами и сопоставить характер
сопутствующих заболеваний с риском
операции — постановки имплантата,
предусмотреть проявления общей реак-
тивности организма, которые могут от-
рицательно повлиять на обезболивание
и ход операции [108], приживление им-
плантата и последующее функциони-
рование его в зубных протезах [39].
С целью адекватного подхода к опе-
рации по оценке функционального со-
стояния организма нами разработана
классификация сложности операций
при зубной имплантации (табл. 4.1)
[38].
Сложность и объем вмешательств
при зубной имплантации зависят преж-
де всего от анатомических условий для
постановки имплантатов, в первую
очередь от достаточности и адекватно-
сти качества кости. Особую роль при
этом играют анатомические изменения,
связанные с возрастом, здоровьем па-
циента или другими факторами. На ос-
нове накопленного опыта и анализа
большого объема информации предла-
гается различать четыре степени слож-
ности имплантационных вмешательств:
I степень сложности хирур-
гических манипуляций — постановка
одного имплантата плоской формы
или одного-двух имплантатов в форме
корня зуба. Эта степень сложности не
имеет риска, но следует учитывать
психоэмоциональное состояние паци-
ента. Операция может быть сопряжена
с такими осложнениями, как повреж-
дение кости, кровотечение, поврежде-
ние ветвей тройничного нерва или
перфорация стенки верхнечелюстной
пазухи, носовой полости, перфорация
или отлом стенки костного ложа им-
плантата.
II степень сложности — по-
становка двух-трех имплантатов пло-
ской формы или трех-четырех имплан-
татов в форме корня зуба. Операция
этой степени сложности сопряжена с
теми же осложнениями, что и при I
степени. Оперативное вмешательство
продолжается от 40 мин до 2 ч.
111 степень сложности — по-
становка более четырех имплантатов в
трудных анатомических условиях или с
пластикой мягких тканей, аутопласти-
кой костными и слизистыми гранс-
плантатами из полости рта и челюстей
или с использованием аллопластиче-
ских материалов для реконструкции
альвеолярных отростков, поднятие дна
верхнечелюстной пазухи, репозиция
нижнего луночкового нерва. Вмеша-
тельство 111 степени более сложное с
точки зрения как техники хирургиче-
ских манипуляций, так и их объема.
Операция может быть сопряжена с те-
ми же осложнениями, что и при 1 и П
степени сложности, а также с возмож-
ностью повреждения артерий, вен и их
сплетений. Продолжительность опера-
ции от 2 до 3 ч.
IVстепень сложности — по-
становка более пяти имплантатов с
пластикой челюстей ауто- или ал-
лотрансплантатами. Имплантацию IV
степени сложности производят в ста-
ционаре, иногда в поликлинике с
дневным стационаром. Она представ-
ляет собой многоэтапную операцию с
использованием гребня подвздошной
кости, ребра, фрагментов малой берцо-
вой или лучевой кости, а также свобод-
ных слизистых и кожных транспланта-
тов и их комбинаций с аллопластиче-
скими материалами, реконструкцию
верхней челюсти с поднятием дна па-
зухи, реконструкцию нижней челюсти
с репозицией нижнего альвеолярного
нерва. При выполнении хирургических
приемов можно использовать микро-
сосудистую технику. Продолжитель-
ность операции 3—4 ч и более.
На основании результатов опроса,
выяснения анамнеза заболевания и
анамнеза жизни, данных опросника, а
Таблица 4.1. Степени сложности хирургических вмешательств при зубной имплантации
Сте- пень слож- ности Доста- точ- ность кости Количество имплантатов Время опера- ции Возможные дополнительные операции Возможные осложнения
I
Плоских — I, До
круглых — 40 мин
1-2
Нет или закрытие неболь-
шого дефекта кости биома-
териалом
Повреждение зубов;
повреждение кости;
кровотечение; повре-
ждение ветвей трой-
ничного нерва; пер-
форация верхнече-
люстной пазухи; пер-
форация носовой по-
лости; перфорация
(отлом) стенки кост-
ного ложа; развитие
послеоперационного
воспаления
II
III
IV
Плоских —
2-3,
круглых —
3-4
Плоских и
круглых — 4
и более в
трудных ана-
томических
условиях
От 40
мин до
2ч
От 2
до 3 ч
Более 5 им-
плантатов с
пластикой
костных и
мягких тка-
ней, установ-
ление рамоч-
ного имплан-
тата, 2 и более
поднадкост-
ничных им-
плантатов
3-4 ч
и бо-
лее
Нет или закрытие неболь-
шого дефекта кости биома-
териалом, в том числе мем-
браной
Наращивание тканей челю-
стей при помощи местных
трансплантатов, биомате-
риалов для реконструкции
альвеолярных отростков;
поднятие дна верхнечелю-
стной пазухи; репозиция
нижнего луночкового нерва
Многоэтапные операции
для наращивания кости и
устранения костных дефек-
тов: использование ауто-
трансплантатов костей ске-
лета; использование слизи-
стых и кожных трансплан-
татов: реконструкция верх-
ней челюсти с поднятием
верхнечелюстной пазухи;
реконструкция нижней че-
люсти, в том числе с репо-
зицией нижнего луночко-
вого нерва
Те же
Тс же, а также повре-
ждение сосудов арте-
риального типа, вен,
их сплетений
Те же, что при I—III
степенях сложности,
а также повреждение
стволов II и III вет-
вей тройничного
нерва, ветвей лице-
вого нерва, перелом
нижней челюсти
также местного осмотра и знакомства с
лабораторными показателями хирург-
стоматолог оценивает функциональ-
ное состояние больного и решает во-
прос о необходимости дополнитель-
ных клинических и лабораторных ис-
следований (49, 121].
Определяют телосложение, массу
тела и рост пациента. Обращают вни-
мание на температуру тела, психоэмо-
циональное повеление. Повышение
температуры тела может быть связано с
началом воспалительного заболевания
или отражать скрытые эндокринные
расстройства, нарушения психическо-
го состояния. Если масса тела превы-
шает норму, то следует исключить на-
рушения обмена и ожирение, эндок-
ринные расстройства и заболевания
сердечно-сосудистой системы [133].
Важным признаком здоровья канди-
дата на имплантацию являются нор-
мальные показатели пульса и артери-
ального давления. Врача всегда должны
настораживать повышение артериаль-
ного давления (верхнее выше 140 мм
рт.ст., нижнее выше 100 мм рт.ст.)*; та-
хикардия (более 80 в минуту), бради-
кардия (менее 60 в минуту), а также
пульс слабого наполнения и напряже-
ния, аритмичный. В случае повыше-
ния артериального давления, наруше-
ния пульса и других изменений необ-
ходимо более детальное обследование
пациента специалистом. При опросе и
осмотре больного обращают внимание
на частоту дыхания (в норме от 16 до 18
дыхательных движений в минуту), тип
его, наличие кашля, одышки. При ка-
жущемся здоровье важно установить
симптомы, относящиеся к заболевани-
ям сердечно-сосудистой и дыхатель-
ной систем.
Осмотр кожи лица, слизистых обо-
лочек полости рта, глаз, носа позволя-
ет выявить отдельные симптомы бо-
лезней пищеварительной системы, эн-
докринных расстройств, дефицита ви-
таминов и других заболеваний. Отме-
чают также наличие петехий, кровоиз-
•Согласно рекомендациям экспертов ВОЗ
и Международного общества по гипертонии,
критериями артериальной гипертензии явля-
ется систолическое АД 140 мм рт.ст. и выше и
диастолическое АД 90 мм рт.ст. и выше |145).
лияний, гематом, которые могут быть
также симптомами заболеваний крови.
Большое значение имеет исследова-
ние регионарных лимфатических уз-
лов, увеличение которых может указы-
вать на скрытые очаги инфекции в по-
лости рта, носоглотке, верхнечелюст-
ной или других околоносовых пазухах,
в других органах, а также неблагополу-
чие в системе кроветворных органов. В
случае обнаружения лимфаденопатии
вместе с лихорадкой и другими сим-
птомами требуются дополнительный
опрос и обследования пациента на
ВИЧ-инфекцию.
4.1. Оценка сердечно-сосудистой
системы
В общей массе болезней патология сер-
дечно-сосудистой системы является
наиболее частой и, по данным ВОЗ,
имеет повсеместное распространение,
считается болезнью XX в. С. Misch
[ 12I] отметил, что в США 20 % взрос-
лого населения страдает гипертонией.
Вместе с тем, если судить по публика-
циям в американской литературе, более
чем у половины больных с гипертонией
она не диагностирована 1113]. По дан-
ным американских кардиологов, у
1,3 % пациентов старше 30 лет и у 10 %
старше 40 лет установлен перенесен-
ный ранее, но не диагностированный
инфаркт миокарда [124]. В России так-
же отмечена определенная зависимость
числа больных гипертонией от возрас-
та, питания, физической активности, а
также психоэмоциональных факторов.
Таким образом, при зубной импланта-
ции очень трудно определить степень
риска. Во многом риск зависит от сте-
пени сложности имплантационной хи-
рургии.
Измерение АД является необходи-
мым исследованием не только для им-
плантации. АД — это показатель со-
стояния артериальной системы орга-
низма. Его характеристиками являются
максимальное, или систолическое, и
минимальное, или диастолическое,
давление. Артериальное давление за-
висит от функционального состояния
сердца, объема циркулирующей крови,
ее вязкости, состояния кровеносных
сосудов (особенно артерий небольшо-
го калибра) и частоты сердечных сокра-
щений. Существуют прямые и косвен-
ные методы определения артериального
давления. Стоматологу необходимо и
достаточно использовать косвенный
метод (измерение по Riva-Rocci).
Артериальная гипертензия — пато-
логическое повышение систолического
и/или диастолического артериального
давления. Артериальная гипертензия,
обусловленная артериосклерозом, со-
ставляет приблизительно 40 % заболе-
ваний сердечно-сосудистой системы.
По данным С. Misch [113|, в США по-
ловина случаев артериальной гипер-
тензии остаются невыявленными.
Также должен быть исследован пульс.
В норме пульс в состоянии покоя колеб-
лется от 60 до 90 в минуту. Изменение
частоты пульса менее 60 ударов в ми-
нуту или более 110 ударов в минуту яв-
ляется основанием для более глубокого
обследования пациента. Кроме того,
надо отметить ритм пульса. Наиболь-
шую тревогу вызывают больные с рит-
мичным, но неровным пульсом и арит-
мичным пульсом, свидетельствующим
о преждевременных желудочковых со-
кращениях сердца. Это может быть свя-
зано с физическим истощением, эмо-
циональным напряжением, чрезмерным
курением, злоупотреблением кофе, а
также рядом болезней сердца. Также
требует внимания слабая пульсовая
волна, характеризующая напряжение
пульса. Эти пациенты перед импланта-
цией должны быть обследованы кар-
диологом.
4.1.1. Нейроциркуляторная дистония
Нейроциркуляторная дистония пред-
ставляет собой функциональное невро-
генное заболевание системы кровооб-
ращения. Поскольку возможны неди-
агностированные формы гипотензии,
следует обращать внимание на пациен-
тов с приступами головной боли, осо-
бенно по утрам, головокружениями,
быстрой утомляемостью, легкой возбу-
димостью, в том числе изменениями
Показателей гемодинамики и появле-
нием одышки при физической ншруз-
Ке, а также общей функциональной
слабостью [27]. Основными симптома-
ми являются лабильность и снижение
артериального давления. При хирурги-
ческом лечении И.А. Шугайлов и со-
авт. [47] включают таких пациентов в
группу риска. Нейроциркуляторной
дистонией гипотонического типа стра-
дает около 20 % населения [Вейн А.М.
и др., 1996]. Эта патология отмечена у
7,8 % стоматологических больных [1].
В патогенезе этой формы нейроцирку-
ляторной дистонии главными являют-
ся психогенные факторы, под влияни-
ем которых нарушаются психовегета-
тивные функции и происходит разба-
лансирование вегетативной нервной
системы. Вследствие этого возникает
гиперфункция парасимпатических от-
делов, отчего повышается риск разви-
тия обморока или коллапса. При об-
следовании таких пациентов рекомен-
дуется фиксировать внимание на
стрессовых ситуациях в жизни, на-
клонности к обморокам, реакции на
смену погоды, непереносимости жары,
холода, духоты, а также на страхе перед
лечением. При нейроциркуляторной
дистонии гипотонического типа необ-
ходимо учитывать такие вегетативные
симптомы, как низкое артериальное
давление, брадикардия, слабость, голо-
вокружение, тошнота, повышенное по-
тоотделение, красный и белый дермо-
графизм, наличие бледного носогубно-
го треугольника при гиперемии лица,
похолодание конечностей [13]. Им-
плантация может быть проведена по-
сле заключения специалистов, и требу-
ет предварительной медикаментозной
стабилизации артериального давления,
а перед операцией — введения холино-
литических препаратов: 0,1 % раствора
атропина сульфата или 0,1 % раствора
метацина сульфата в количестве до
I мл. Е.В. Зорян и соавт. [13] рекомен-
дуют выполнять операцию на операци-
онном столе или лежа в кресле. Опера-
ции I и 11 степени сложности проводят
в поликлинике, 111 степени сложности —
в стационаре или в поликлинике с днев-
ным стационаром, IV степени — только
в стационаре. В ходе операции необхо-
димо контролировать АД. после опера-
ции рекомендовать больному медлен-
но вставать и лучше на 15—20 мин по-
местить его на топчан в предопераии-
онной и только под контролем пульса
и АД переводить в вертикальное поло-
жение. При нейроциркуляторной дис-
тонии следует учитывать психоэмо-
циональное состояние пациента. При
сочетании низкого давления с астено-
невротическим или тревожно-депрес-
сивным синдромом рекомендуется
проводить предоперационную подго-
товку в зависимости от диагностиче-
ских психиатрических тестов, в том
числе за 4—6 дней до операции назна-
чить транквилизаторы, в других случа-
ях их назначают за 40 мин до операции
или на ночь и утром. Выбор обезболи-
вания определяется продолжительно-
стью вмешательства. После операции
больного отпускают только с сопрово-
ждающим.
4.1.2. Гипертоническая болезнь
При гипертензии следует уточнить
время появления первых симптомов
болезни, ее стадию, а также то, нахо-
дится ли пациент под постоянным на-
блюдением специалиста, какие лекар-
ства принимает и как они действуют.
L. Goldman и соавт. [81] разработали
индексы сердечно-сосудистых заболе-
ваний. Различают 9 категорий, на ос-
новании которых многие специалисты
США разрабатывают подход к имплан-
тационной хирургии. Эти категории
коррелируют с предложенными нами 4
степенями риска.
По классификации ВОЗ [145] разли-
чают следующие формы гипертониче-
ской болезни: I — мягкая (АД систоли-
ческое 140—180 мм рт.ст., диастоличе-
ское 90—105 мм рт.ст., отсутствуют объ-
ективные признаки поражений сердца,
мозга, почек); II — умеренная (АД сис-
толическое 180—210 мм рт.ст., диасто-
лическое 105—120 мм рт.ст. и наличие
по меньшей мере одного из следующих
признаков поражения: гипертрофия
левого желудочка сердца; генерализо-
ванное или фокальное сужение артерий
сетчатки глаза; микроальбуминурия;
протеинурия и/или артериосклероти-
ческое поражение аорты и крупных со-
судов); III — тяжелая (АД систоличе-
ское >210 мм рт.ст. и диастолическое
> 120 мм рт.ст.; наличие симптомов и
признаков поражения органов-мише-
ней: сердце — стенокардия, инфаркт
миокарда, сердечная недостаточность;
головной мозг — инсульт, преходящие
нарушения мозгового кровообраще-
ния, гипертоническая энцефалопатия,
сосудистая деменция: сетчатка глаза —
кровоизлияния и экссудаты с отеком
соска зрительного нерва или без него;
почки — содержание креатинина в
плазме крови выше 2 мг/дл, почечная
недостаточность; сосуды — расслаи-
вающая аневризма аорты, симптомы
окклюзирующего поражения артерий).
Гипертоническая болезнь опасна во
время стоматологических операций и в
том числе при зубной имплантации из-
за факторов риска развития осложне-
ний. Их условно разделяют на две груп-
пы: 1-я — гипертензивные, связанные
непосредственно с перегрузкой сердеч-
но-сосудистой системы и давлением,
2-я — атеросклеротическая, т.е. свя-
занная с ускоренным развитием атеро-
склеротических поражений аорты и ее
крупных ветвей на фоне повышенного
АД [40].
В случаях гипертензивных осложне-
ний может развиться тяжелая форма,
которая ведет к быстро прогрессирую-
щей или злокачественной фазе артери-
альной гипертензии, геморрагическо-
му инсульту, застойной сердечной не-
достаточности, нефросклерозу и рас-
слаивающей аневризме аорты. Атеро-
склеротическими осложнениями явля-
ются ишемическая болезнь сердца,
аритмии, атеротромботический ин-
сульт и облитерирующий атеросклероз
сосудов нижней конечности, внезап-
ная смерть.
Исходя из этого у пациента с гипер-
тонической болезнью важно выяснить
поражение сердца и непосредственно
выявленную методом электрокардио-
графии гипертрофию левого желудоч-
ка. Даже у пациентов без клинических
симптомов болезни увеличение левого
желудочка является основанием для
диагностики II стадии заболевания, и
риск развития осложнений у них в 30
раз выше, чем у больных с нормальной
массой левого желудочка [40]. Также У
бальных с гипертонической болезнью
средней тяжести надо выяснить со-
стояние почек, так как при ней разви-
вается почечная недостаточность; при
подозрении на нее следует уточнить
два наиболее информативных показа-
теля — клубочковую гиперфильтрацию
(более 130 мл/мин) и микроальбуми-
нурию (мочевая экскреция альбуминов
не превышает 20—200 мкг в 1 мин).
В то же время L. Goldman и соавт.
[81] считают, что при зубной импланта-
ции мягкая гипертензия не создает уг-
розы для жизни. Вместе с тем у отдель-
ных пациентов высокое давление может
не сопровождаться выраженными сим-
птомами, что не настораживает врача
[16]. Помимо этого, следует иметь в ви-
ду, что по поводу зубной имплантации
часто обращаются пациенты с неуста-
новленными или нелечеными формами
гипертонической болезни, поэтому
следует обращать внимание на пациен-
тов, у которых часто отмечаются голов-
ная боль, головокружения, тошнота,
рвота, мелькание перед глазами [27].
Для диагностики гипертонической
болезни разработан алгоритм действий
врача-стоматолога [42]. Дополнитель-
но к заполненному пациентом вопрос-
нику необходимо измерить АД. анали-
зировать характер пульса, а также вы-
яснить наличие головной боли, голо-
вокружения, мелькания перед глазами,
тошноты, шума в ушах, болей в сердце.
Внимание должно быть обращено на
рвоту при ухудшении самочувствия и
указанных выше симптомах, особенно
при головной боли. Необходимо уста-
новить, бывают ли гипертонические
кризы и сколько они длятся? Бывают
ли после криза тяжесть в голове, голо-
вокружение, парестезия, стенокардия,
приступы сердечной астмы? Необхо-
димо также уточнить, какие лекарст-
венные препараты принимал пациент
и как они действовали.
Пациент с гипертензией должен
быть обследован специалистом, кото-
рый дает разрешение на проведение
зубной имплантации. В зависимости
от особенностей течения гипертониче-
ской болезни перед операцией должна
быть проведена адекватная кардиоген-
ная терапия, иначе всегда существует
Риск возникновения во время опера-
ции гипертонического криза, инфарк-
та миокарда, острой сердечной недос-
таточности, а также поражение мозга,
почек, глаз.
При гипертонической болезни мяг-
кой формы можно производить им-
плантационные вмешательства всех
степеней сложности. Однако следует
учитывать, что при гипертонической
болезни эмоциональное состояние па-
циента перед операцией может спро-
воцировать подъем артериального дав-
ления, поэтому необходимы гипотен-
зивная и седативная подготовка перед
зубной имплантацией и надежное
обезболивание. Рекомендуется преме-
дикация транквилизаторами бензодиа-
зепинового ряда. Обезболивание 1 сте-
пени сложности проводят с использо-
ванием 3 % мепивикаина или 4 % рас-
твора прилокаина без вазоконстрикто-
ра, II и III степени сложности — 1—2 %
раствора ультракаина ДС с вазоконст-
риктором (1:200 000). Существуют раз-
ные точки зрения по поводу снижения
АД перед операцией. С. Misch [121]
считает, что непосредственно перед
операцией снижать артериальное дав-
ление не следует. Он считает предель-
но допустимым для проведения опера-
ции артериальное давление 140/90 мм
рт.ст. Вместе с тем Е.В. Зорян [19] ре-
комендует отрегулировать уровень
кровяного давления. Иностранные ав-
торы считают, что при вмешательствах
I степени сложности можно ограни-
читься премедикацией и адекватной
анестезией. При операциях II и 111 сте-
пени сложности предварительно про-
водят гипотензивную терапию и назна-
чают седативные средства. При психо-
патологических реакциях дозы препа-
ратов можно увеличить, ввести антиде-
прессанты, нейролептики и за 30 мин
до операции — внутривенно седуксен.
При вмешательствах IV степени слож-
ности, производимых в стационаре,
предоперационную подготовку назнача-
ет кардиолог или анестезиолог в зависи-
мости от объема и длительности пред-
стоящей операции |2, 48, 60, 93, 121].
Если у пациента гипертоническая бо-
лезнь II стадии (умеренная форма), то
зубную имплантацию I и II степени
сложности производят после седатив-
ной подготовки, а при III степени слож-
ности — после такой же подготовки в
условиях стационара. Седативные сред-
ства (транквилизаторы бензодиазипи-
нового ряда, антигистаминные препа-
раты) назначают за 3—5 дней до опе-
рации.
Во время операции при умеренной
гипертензии не следует опасаться повы-
шения давления до 110/160 мм рт.ст.
Это может быть вызвано волнением
больного перед операцией [82). В таких
случаях осложнения можно предотвра-
тить седативной подготовкой.
При местном обезболивании следу-
ет применять препараты с содержани-
ем адреналина 1:200 000, например
ультракаин ДС, или не добавлять вазо-
прессорные препараты к анестетикам.
При зубной имплантации I и II степе-
ни сложности у пациентов с гиперто-
нической болезнью из местных анесте-
тиков предпочтительно применять 3 %
раствор мепивакаина или 4 % раствор
прилокаина. При операции III степени
сложности рекомендуется применять
1—2 % раствор лидокаина или ксило-
каина. Необходима аспирационная
проба, чтобы анестетик не попал в со-
судистое русло, особенно при провод-
никовой анестезии. Во время операции
нужно тщательно проводить местную
анестезию. Лучше сочетать проводни-
ковую анестезию с инфильтрацион-
ной. Если при длительном вмешатель-
стве у больного появляются болезнен-
ные ощущения, то обезболивание надо
повторить. В операционной для этих
пациентов должна быть предусмотрена
вентиляционная поддержка [81, 83,
122].
При тяжелой форме гипертониче-
ской болезни имплантационное вме-
шательство не показано, хотя С. Misch
[121) у больных этой категории наблю-
дал положительные результаты при
простых операциях.
При склеротической гипертензии с
утратой трудоспособности и быстро
прогрессирующих формах болезни,
особенно у пациентов молодого и сред-
него возраста, Ю.К. Токмачев и соавт.
[42] рекомендуют сопоставлять риск
операции с функциональной необхо-
димостью в ней. Можно с достаточным
основанием утверждать, что при этих
формах гипертонии имплантация про-
тивопоказана.
Гипертонический криз. У пациентов с
умеренной и тяжелой формой гиперто-
нической болезни (САД > 159 мм рт. ст..
ДАД > 179 мм рт.ст.) заболевание мо-
жет осложняться гипертоническим
кризом. Считается, что лица с таким
повышением систолического и диасто-
лического артериального давления от-
носятся к группе риска в отношении
гипертонического криза. В то же время
без премедикации и при нормальном
давлении страх перед операцией может
привести к развитию гипертоническо-
го криза. У отдельных больных повы-
шение артериального давления и ги-
пертонический криз могут возникнуть
после анестезии смесью анестетика с
адреналином.
При гипертоническом кризе может
развиться приступ стенокардии или
возникнуть инфаркт миокарда, острое
нарушение мозгового кровообращения
или нарушение функций других орга-
нов [53, 54].
Особое опасение вызывает быстро
прогрессирующее течение гипертони-
ческой болезни (тяжелая форма) с час-
тыми кризами [122]. Это свидетельст-
вует о дисфункции диэнцефальных
структур и снижении адаптационных
резервов центральной нервной систе-
мы. Во время криза могут развиваться
нейровегетативные нарушения с повы-
шением тонуса симпатико-адреналовой
системы. У таких пациентов следует
оценивать тип гипертонического криза
[42]. Кризы I типа более легкие и крат-
ковременные, чаще наблюдаются в ран-
них стадиях гипертонической болезни и
развиваются на фоне хорошего само-
чувствия. Такие кризы могут длиться от
нескольких минут до нескольких часов.
С разрешения кардиолога при легких
гипертонических кризах показания к
зубной имплантации такие же, как при
гипертонической болезни II стадии.
Операцию проводят под комбиниро-
ванным обезболиванием — премедика-
ция и анестезия амидными анестетика-
ми с минимальным содержанием вазо-
констриктора.
В случае развития гипертонического
криза во время операции следует успо-
коить больного, придать ему полуле-
жачее положение и отложить проведе-
ние операции на 30—60 мин. Больному
дают какой-либо транквилизирующий
препарат (элениум, седуксен, тазспам,
триоксазин, нозепам), а также препа-
200
раты валерианы, корвалол, валокор-
дин, настойку пустырника, применяют
в таблетках либо вводят подкожно или
внутримышечно гемитон или его ана-
логи — клофелин, клонил ин, катапре-
сан. Хорошее действие оказывает вве-
дение внутривенно или внутримышеч-
но 1—2 мл 1 % раствора дибазола. Че-
рез 20—30 мин состояние стабилизиру-
ется и операцию можно продолжать. В
случаях развития тяжелого гипертони-
ческого криза операция должна быть
отложена или прекращена. Врач-сто-
матолог продолжает оказывать экс-
тренную помощь пациенту, дает под
язык фенигидин, коринфар, капотен,
кордафлекс. При оказании помощи
контролируют самочувствие больного,
измеряют артериальное давление и, ес-
ли состояние стабилизируется, то че-
рез 20—30 мин завершают операцию. В
случае ухудшения состояния больного
ему внутримышечно или очень мед-
ленно внутривенно вводят 0,2—0,75 мл
5 % раствора ганглиоблокатора пента-
мина. При внутривенной инъекции в
качестве растворителя используют
20 мл изотонического раствора натрия
хлорида или 5 % раствор глюкозы.
Кризы 11 типа более тяжелые и могут
длиться от нескольких часов до 5 сут.
Они характерны для более поздних
стадий гипертонической болезни и со-
провождаются признаками церебраль-
ных расстройств: тяжестью в голове,
головокружением, парестезиями [122].
К указанным симптомам могут при-
соединяться приступы стенокардии и
сердечной астмы. Такая клиническая
картина болезни сопровождается
подъемом как систолического, так и
диастолического артериального давле-
ния. Вопросы о возможности выпол-
нения и объеме операции, подготовке
к ней решают задолго до имплантации.
В таких случаях с разрешения кардио-
лога после подготовки имплантацию 1
степени сложности можно проводить в
поликлинике, II степени сложности —
в стационаре. Перед операцией прово-
дят премедикацию препаратами сиба-
Зона и адекватную местную анестезию
Ультракаином, лидокаином, мепива-
каином с малой концентрацией вазо-
констриктора. Прогрессирующее тече-
ние гипертонической болезни (111 ста-
дия) с гипертоническими кризами яв-
ляется противопоказанием к зубной
имплантации.
4.1.3. Ишемическая болезнь сердца
Ишемическая болезнь сердца — рас-
пространенное заболевание, особенно
среди лиц пожилого возраста. При по-
ражении коронарных сосудов сердца
любое оперативное вмешательство мо-
жет создать риск развития стенокар-
дии, инфаркта миокарда, сердечной
астмы |22|. Вопрос об имплантацион-
ной хирургии следует решать диффе-
ренцированно.
Опрашивая пациента, необходимо
иметь в виду скрытые заболевания со-
судов сердца. Пациенты с ишемиче-
ской болезнью сердца часто не обра-
щаются к врачу, и у 23 % из них она
протекает безболезненно [27]. Наш
опыт показывает, что невнимание к се-
бе больных, с одной стороны, и неред-
ко примитивность кардиологического
обследования и заключений, получае-
мых от специалистов, — с другой, по-
вышают ответственность хирурга-сто-
матолога за возможность непредвиден-
ных осложнений во время операции.
Следует помнить о факторах риска раз-
вития ишемической болезни сердца, к
которым относятся гиперхолестерине-
мия, особенно наследственно обуслов-
ленная, нарушения обмена (диабет, ги-
пергликемия), артериальные гипертен-
зии, курение, гиподинамия, ожирение,
чрезмерная эмоциональность пациен-
та, а также их сочетания. Более тща-
тельный опрос пациентов и обнаруже-
ние таких симптомов, как стенокардия,
тахикардия, одышка, нарушения сер-
дечного ритма, приступы острой боли
сжимающего или давящего характера в
области сердца, за грудиной, приступы
головокружения, позволяют диагно-
стировать ишемическую болезнь серд-
ца, осложненную сердечной астмой, и
направить пациента для дополнитель-
ного обследования, определения воз-
можности зубной имплантации и соот-
ветствующей подготовки к ней [22].
Провокационным моментом для при-
ступа ИБС может быть страх перед
операцией или реакция на вазоконст-
риктор в обезболивающем растворе.
Если боли в сердце возникают не-
сколько раз в день, то в имплантации
следует отказать до проведения кар-
диологом более тщательного обследо-
вания и выполнения лечебных реко-
мендаций, в том числе по объему зуб-
ной имплантации. При частоте при-
ступов не более одного раза в день с
разрешения кардиолога после премеди-
кации можно производить импланта-
цию I степени сложности. В тех случа-
ях, когда приступы стенокардии наблю-
даются один раз в месяц, в подготови-
тельном предымплантационном перио-
де следует применять седативные ле-
карственные средства, что позволит
сделать такие приступы более редкими
и произвести вмешательство I и II сте-
пени сложности. При разрешении кар-
диолога оперативные вмешательства
III степени сложности у больных этой
категории выполняют только в стацио-
наре.
При даче кардиологом разрешения
на имплантацию у пациентов с ишеми-
ческой болезнью сердца, с легкой сте-
пенью нарушений психоэмоциональ-
ного состояния стабильности кровооб-
ращения достигают использованием
при премедикации седуксена с барал-
гином, антигистаминным препаратом
(супрастин, диазолин). У больных ише-
мической болезнью, в том числе пере-
несших инфаркт миокарда, помимо
указанной выше седативной подготов-
ки транквилизаторами бензодиазепи-
нового ряда, перед оперативным вме-
шательством с профилактической це-
лью применяют валидол, нитроглице-
рин, нитросорбит под язык, вводят
внутримышечно I—2 мл 2 % раствора
но-шпы. У этих больных нежелательно
снижение диастолического давления,
так как перфузия миокарда левого же-
лудочка происходит в фазу диастолы.
При анестезии к раствору анестетика
нужно добавлять адреналин в кон-
центрации 1:200 000 и ниже. Перед
вмешательством и во время него целе-
сообразна ингаляция кислорода. Во
время операции должны быть преду-
смотрены меры профилактики присту-
па стенокардии.
Стенокардия — клинический сим-
птом ишемической болезни сердца.
Различают стабильную и нестабиль-
ную стенокардию. Если пациент отве-
тил утвердительно на вопрос о нали-
чии у него стенокардии, то следует
уточнить, когда был последний при-
ступ и не возникают ли боли в сердце
при подъеме в гору, быстрой ходьбе,
волнении. Следует также уточнить, ка-
кие лекарства принимает пациент и
как их переносит. В стоматологиче-
ской клинической практике при пла-
новой операции очень важно выявле-
ние скрытых поражений коронарной
артерии. В связи с этим больные стено-
кардией должны быть обследованы
кардиологом, иначе риск во время и
после операции остается значитель-
ным. Если стабильная стенокардия (42]
не создает особой угрозы во время опе-
рации, то нестабильная требует особой
осторожности, так как при ней всегда
повышается риск инфаркта миокарда.
Имплантационная хирургия у таких
пациентов или не показана, или про-
водится в объеме вмешательств I—II
степени сложности в госпитальных ус-
ловиях.
Зарубежные специалисты считают,
что у пациентов, не подвергавшихся
операции с коронарным шунтирова-
нием, такой риск больше, чем после
такого лечения. Это связано главным
образом с тем, что, как правило, со-
стояние неоперированных пациентов
недостаточно изучено кардиологом
[78]. Во всех случаях стабильной стено-
кардии, даже при разрешении кардио-
лога и несмотря на подготовку пациен-
та к имплантации, должна быть преду-
смотрена профилактика приступа сте-
нокардии во время операции.
Если приступ был давно и больной
получал адекватную антиангиальную
терапию, то при разрешении кардиоло-
га можно производить имплантацию 1
и II степени сложности. Пациенту сле-
дует провести премедикацию, за 10—
15 мин до операции профилактически
дать нитроглицерин или впрыснуть в
рот на область щеки спрей "Нитро-
Поль'1, "Нитроминт", "Изокет", "Изо-
мак”. Обезболивание проводят 1—2 %
раствором ультракаина, септонеста,
лидокаина с низкой концентрацией
адреналина (1:200 000 и ниже). Обяза-
тельно проведение аспирационной
пробы во избежание внутрисосудисто-
го введения препарата. Операцию луч-
ше проводить в положении больного
сидя в стоматологическом кресле. Опе-
рацию III степени сложности выпол-
няют после кардиологического лече-
ния и только в условиях стационара. В
случае развития приступа стенокардии
во время имплантации операцию пре-
кращают, создают больному покой,
обеспечивают приток свежего воздуха,
кислородную поддержку. В виде ка-
пель или таблетки дают валидол или
валокордин, корвалол, капли Вотчала.
Если в течение 5—10 мин приступ сте-
нокардии не устраняется, то назначают
нитроглицерин, нитросорбит. Если со-
стояние не стабилизируется, то эти
препараты применяют сублингвально.
Альтернативой этих препаратов могут
быть нифедипин, кордафлекс, корин-
фар, адалат, кордафен в дозе 1 таблетка
под язык. Если приступ купировался,
то закрепить его результаты можно па-
рентеральным введением 2 мл 2 % рас-
твора папаверина, 2 мл 50 % раствора
анальгина и 1 мл 1 % раствора димед-
рола на изотоническом растворе на-
трия хлорида или 5 % растворе глюко-
зы или сделать инъекцию трамала, тра-
мадола, баралгина. Если операция не
была начата, то ее отменяют. В случае
развития приступа во время импланта-
ции ее завершают после купирования
приступа, но выполняют в ограничен-
ном объеме (I степень сложности). По-
становку других имплантатов отклады-
вают. Если приступ не снимается, то
лечение продолжают до приезда брига-
ды скорой помощи.
Инфаркт миокарда. Тактика имплан-
тационной хирургии после инфаркта
миокарда зависит от тяжести пораже-
ния и времени, прошедшего после
окончательной реабилитации. Необхо-
димо учитывать клинические особен-
ности инфаркта миокарда и индивиду-
альные особенности реабилитационно-
го периода. Пациенты, перенесшие ин-
фаркт миокарда, должны быть обследо-
ваны кардиологом, от которого необ-
ходимо получить разрешение на опера-
цию [127].
Среди ''здоровых" кандидатов на опе-
рацию у 1,3 % в возрасте старше 30 лет
и у 10 % старше 40 лет при обследова-
нии перед имплантацией обнаружива-
ется недиагностированный инфаркт
миокарда (81, 82, 83].
По данным И.В. Мартынова и
А.Л. Господаренко [27], у 30 % паци-
ентов, перенесших инфаркт миокарда,
через 3 мес сохраняется опасность по-
вторного инфаркта, а у 15 % он может
возникнуть через 6 мес. Общая тактика
хирургического лечения после ин-
фаркта миокарда предусматривает воз-
можность плановых стоматологиче-
ских операций через 6 мес, хотя риск
повторного инфаркта возможен в 30 %
случаев [124]. Зубную имплантацию
рекомендуется производить не ранее
чем через год. У всех перенесших ин-
фаркт миокарда допустима зубная им-
плантация 1 степени сложности. Седа-
тивная подготовка, анестетики и дру-
гие рекомендации по местному обезбо-
ливанию аналогичны таковым при сте-
нокардии. В отдельных случаях по за-
рубежному опыту проводят хирургию
П степени сложности в условиях ста-
ционара, лучше под общим обезболи-
ванием. У таких пациентов С. Misch
[113, 114] рекомендует имплантацион-
ную хирургию дробить и во время ка-
ждой операции ставить не более 1—2
имплантатов. После тяжелого инфарк-
та миокарда и развившихся функцио-
нальных проблем имплантационное
вмешательство не показано.
Сердечная астма. Заболевание раз-
вивается у пациентов, страдающих сте-
нокардией, перенесших инфаркт мио-
карда. У больного этими заболевания-
ми следует уточнить, не возникают ли
у него приступы нарастающей одыш-
ки, затрудненного дыхания, переходя-
щего в удушье, или надсадный кашель
с затрудненным вдохом. Утвердитель-
ные ответы на эти вопросы убедитель-
но свидетельствуют о наличии сердеч-
ной астмы. Как правило, у пациентов с
сердечной астмой наблюдается сердеч-
ная недостаточность II и III степени, и
имплантация им противопоказана.
В стоматологической клинической
практике при имплантации очень важ-
но выявить скрытые поражения коро-
нарной артерии. Пациенты со стено-
кардией после инфаркта миокарда, сер-
дечной астмой должны быть обследова-
ны кардиологом, иначе риск во время и
после операции остается значительным.
Следует помнить, что во время имплан-
тации сердечная астма всегда может
вызвать неотложное состояние, поэто-
му требуется соизмерять необходи-
мость имплантационного лечения со
степенью риска. На наш взгляд, при
разрешении кардиолога и предопера-
ционной подготовке можно проводить
только зубную имплантацию I степени
сложности. Премедикацию и обезбо-
ливание проводят так же, как у боль-
ных стенокардией.
Недостаточность кровообращения.
Как осложнение органических болез-
ней сердца, а также других органов и
систем может развиваться недостаточ-
ность кровообращения (сердечная или
сосудистая). Особенно опасна недоста-
точность кровообращения у пациентов,
которые не лечатся у общих специали-
стов и не находятся под их наблюдени-
ем [104J. Зубная имплантация может
вызывать у них острую недостаточность
в виде сердечной астмы, отека легких,
коллапса, кардиогенного шока, пред-
ставляющих непосредственную угрозу
для жизни больных. При наличии таких
начальных симптомов, как одышка, та-
хикардия, слабое дыхание, цианоз ви-
димых слизистых оболочек, головокру-
жение и др., стоматолог обязан напра-
вить пациента для обследования к спе-
циалисту. Должна быть согласована
необходимость хирургического лече-
ния с имплантацией. После заключе-
ния кардиолога решают вопрос об объ-
еме имплантации и разрабатывают
план подготовки к операции. Объем
имплантационной хирургии не должен
превышать 1 степени сложности. Лече-
ние проводится в стационаре под на-
блюдением кардиолога. Показана се-
дативная подготовка транквилизатора-
ми бензодиазепинового ряда. Анесте-
зию проводят препаратами артикаино-
вого ряда — ультракаин, септонест,
альфакаин с содержанием адреналина
1:200 000 и ниже или анестетики с до-
бавлением вазопрессина и фелипрес-
сина, при этом расход лекарств не дол-
жен превышать 1,8 мл. Во всех случаях
сердечной недостаточности больной
должен быть предупрежден, что остео-
томия для постановки имплантата мо-
жет у него осложниться некротиче-
ским процессом.
4.1.4. Некоронарные заболевания
сердца
К таким заболеваниям относятся мио-
кардиты, кардиомиопатии, дистрофия
миокарда. Вопрос об имплантацион-
ном вмешательстве решается в зависи-
мости от генеза болезни (инфекцион-
ный, аллергический) и степени сердеч-
ной недостаточности. Этими фактора-
ми обусловливаются возможность зуб-
ной имплантации и объем оперативных
вмешательств (I, II, III или IV степени
сложности).
При получении от больного сведе-
ний о наличии таких заболеваний, как
миокардиты, кардиомиопатии, дис-
трофии миокарда, имплантация не по-
казана до получения результатов об-
следования и заключения кардиолога.
Таким пациентам имплантация может
быть разрешена после адекватного ле-
чения и в случае отсутствия в течение
года субъективных симптомов заболе-
вания, а также при нормализации ЭКГ
как в покое, так и при велоэргомегри-
ческой нагрузке. Кроме того, необхо-
димо быть уверенным в том, что ин-
фекционный фактор заболевания лик-
видирован.
При обследовании пациентов следует
диагностировать скрытые формы бо-
лезней, которые проявляются в виде
одышки при физической нагрузке,
отека конечностей и пароксизмальной
ночной одышки. Планируя импланта-
цию, следует учитывать прием пациен-
том глюкокортикоидов, гепарина.
Пациентам с некоронарными забо-
леваниями сердца (миокардиты, кар-
диомиопатии, дистрофия миокарда)
перед имплантацией показаны седа-
тивная подготовка и кардиогенная те-
рапия в зависимости от степени сер-
дечной недостаточности. При обезбо-
ливании рекомендуется проводниковая
анестезия с небольшим расходом ане-
стетика и максимально малой концен-
трацией вазоконстриктора (1:200 000 и
ниже). Вводя анестетик, обязательно
ставят аспирационную пробу во избе-
жание попадания анестезирующего рас-
твора в сосудистое русло.
Во время операции недиагностируе-
мое состояние сердечной астмы может
возникнуть в виде одышки с ощущени-
ем удушья, надсадного кашля, цианоза
лица и набухания видимых вен шеи,
учащенного дыхания, тахикардии. В
таких случаях операцию следует пре-
кратить и срочно начать ингаляцию ки-
слорода. Одновременно подкожно вво-
дят препарат из числа наркотических
анальгетиков (промедол, омнопон или
морфин) и 0,5 мл 0,1 % раствора атро-
пина, сердечные средства (кордиамин,
сердечные гликозиды) в дозе 2—4 мл.
Если приступ сердечной астмы сопро-
вождается высоким давлением, то до
приезда бригады скорой помощи вво-
дят внутримышечно 2—4 мл 2 % рас-
твора но-шпы, 6—8 мл 0,5 % раствора
диабазола в 10—15 мл изотонического
раствора натрия хлорида. Если же ар-
териальное давление снижено, то эти
препараты противопоказаны и вводят
0,05 % раствор строфантина (0,3—
0,5 мл) или 0,06 % раствор коргликона
(0,5—1 мл) с изотоническим раствором
натрия хлорида (20 мл). Последующие
лечебные мероприятия осуществляет
бригада скорой помощи. Независимо
от стабилизации состояния пациента
операцию не завершают. Пациент дол-
жен быть госпитализирован.
Нарушения сердечного ритма и про-
водимости. Как следствие атеросклеро-
за, перенесенного инфаркта миокарда,
миокардита, миокардиодистрофии и
кардиомиопатии, а также как проявле-
ния заболеваний пищеварительной,
дыхательной и других систем развива-
ются нарушения сердечного ритма и
его проводимости. Кроме того, они мо-
гут наблюдаться при диабете, в том
числе скрытом, тиреотоксикозе, поро-
ках сердца. Нарушения сердечного рит-
ма и проводимости не являются само-
стоятельной формой заболевания, а
лишь отражают синдром функциональ-
ных нарушений [28). Обследуя больно-
го перед зубной имплантацией, следует
Учитывать аритмию пульса, наличие
экстрасистол, а также указания больно-
го на выявление общими клинициста-
ми суправентрикулярной экстрасисто-
лии, желудочковой аритмии, наруше-
ния внутрижелудочковой проводимо-
сти. антриовентрикулярной блокады и
синдрома слабости синусового узла.
Решая вопрос о зубной импланта-
ми, к этим заболеваниям нужно под-
ходить дифференцированно. Пациен-
тов с нарушениями сердечного ритма и
проводимости следует относить к груп-
пе риска, особенно при экстрасистоли-
ческой и суправентрикулярной арит-
мии. Именно у них во время операции
могут возникнуть пик аритмии и пре-
дынфарктное состояние. Таким паци-
ентам необходима консультация спе-
циалиста, получение от него разреше-
ния на операцию. Исходя из патогене-
за аритмии, проводят подготовку к
оперативному вмешательству. Показа-
на только имплантация I и II степени
сложности.
Следует иметь в виду, что многие
больные с хроническими формами
аритмий и блокад их не ощущают и у
них не наблюдается недостаточность
кровообращения. У молодых и здоро-
вых пациентов нарушение ритма сер-
дечных сокращений в виде экстрасис-
толии может появиться впервые и ча-
ще носит неврогенный характер, свя-
занный с предстоящей имплантацией.
В отсутствие порока сердца в таких
случаях необходима только седативная
подготовка к операции.
Абсолютным противопоказанием к
имплантации является сердечный
ритм более 100 в минуту при постоян-
ной мерцательной аритмии. При сину-
совой тахикардии или брадикардии
при постоянной форме артериовен-
трикулярной блокады имплантация
также не показана. Для профилактики
ошибок при такой сердечной патоло-
гии рекомендуется выяснить, ощущает
ли больной наличие перебоев или "за-
мирания” сердца. При утвердительном
ответе необходимо уточнить характер
аритмии и сосчитать пульс на сонной
артерии. Если пульс 100—110 в минуту,
аритмичный, экстрасистолы частые
или же, наоборот, пульс реже 60 в ми-
нуту, то имплантацию проводить не
следует даже при разрешении кардио-
лога. В отсутствие аритмии, при пульсе
80—100 в минуту шли экстрасистолии
1—2 раза в минуту больного можно го-
товить к имплантации I и II степени
сложности.
Иногда экстрасистолию можно
фиксировать непосредственно перед
имплантацией или во время операции.
Если экстрасистолы редкие и быстро
устраняются приемом 20—30 капель
валокордина, то это не является пре-
пятствием к имплантации I и II степе-
ни сложности. Однако следует иметь в
виду, что во время операции симптомы
аритмии могут проявиться в виде об-
морока, коллапса.
Пароксизмальная тахикардия, выра-
жающаяся в нарушении ритма сердца с
учащением сердечных сокращений до
120 в минуту с неправильной последо-
вательностью (тахиаритмическая арит-
мия), наблюдается у людей с органиче-
скими заболеваниями сердца. В таких
случаях необходимы всестороннее об-
следование у кардиолога и решение с
ним вопроса о возможности импланта-
ции и подготовки к ней. У пациентов с
пароксизмальной тахикардией без на-
рушения функций сердечно-сосуди-
стой системы, в том числе по данным
электрокардиографии, можно произ-
водить имплантацию I и II степени
сложности.
При нарушениях сердечного ритма
и проводимости необходимы консуль-
тация кардиолога и получение от него
разрешения на операцию. При им-
плантационном вмешательстве I и II
степени сложности осуществляют се-
дативную подготовку транквилизато-
рами бензодиазепинового ряда. Обез-
боливание проводят в основном про-
водниковое с малым расходом анесте-
тика (лучше лидокаина), без вазокон-
стриктора или при малой его концен-
трации. Е.В. Зорян и соавт. [19] реко-
мендуют использовать 3 % раствор ме-
пивакаина и 4 % раствор прилокаина
без вазоконстриктора с максимальной
дозой препарата 1,8 мл.
Если мерцательная аритмия наблю-
дается у пациентов с пороками сердца,
кардиосклерозом, после инфаркта
миокарда, особенно недиагностиро-
ванного, или при тиреотоксикозе, то с
разрешения специалистов им может
быть выполнена имплантация I степе-
ни сложности.
Пациентам с полной атриовентри-
кулярной блокадой даже в случае по-
лучения ими от кардиолога разреше-
ния на имплантацию операция нс ре-
комендуется, так как эта патология
входит в группу риска внезапной оста-
новки сердечной деятельности.
4.1.5. Инфекционные заболевания
сердечно-сосудистой системы
К инфекционным болезням сердца от-
носятся эндокардиты, перикардиты,
воспалительные поражения клапанных
структур, пристеночного эндокарда,
эндотелия магистральных сосудов. Они
возникают в результате бактериальной
инфекции [17]. Очень часто причина-
ми их служат заболевания зубов и сли-
зистой оболочки полости рта. Отмече-
на корреляция между эндокардитом и
числом удаленных зубов [104]. При за-
болеваниях зубов, пародонта в 6 раз
возрастает количество бактерий в по-
лости рта и опасность инфекционного
поражения сердца [57, 64]. Эндокардит
может развиться и у беззубого пациен-
та вследствие стоматогенной инфек-
ции при травме слизистой оболочки
зубным протезом [111]. Наличие ак-
тивного воспалительного процесса в
сердце является абсолютным противо-
показанием к зубной имплантации
[69]. Если острые воспаления легко
диагностируются общими клинициста-.
ми, то в практике хирургической сто-'
матологии существует опасность нали-1
чия у больного недиагностированных
подострых и затяжных форм эндокар-1
дита, хронического перикардита. Оп-
рашивая больного, следует уточнить
связь заболевания сердца с гнойными
заболеваниями кожи и внутренних ор-
ганов, с субфебрильной температурой
тела, наличием в анамнезе удалений
зубов или других стоматологических
вмешательств, инвазивных исследова-
ний сосудов и сердца |54].
Формы инфекционных заболеваний,
при которых проводилось лечение, сле-
дует оценивать с точки зрения возник-
ших стойких функциональных наруше-
ний сердечно-сосудистой системы и в
зависимости от сделанных выводов ре-
шать вопрос о зубной имплантации.
С. Misch [121] считает возможным
производить имплантацию, назначая
профилактически антибиотики, одна-
ко обращает внимание на то, что после
лечения по поводу инфекционного эн-
докардита нередки анафилактические
реакции на антибактериальные препа-
раты [91].
Больным, перенесшим эндокардит
или перикардит без функциональных
нарушений, можно производить зуб-
ную имплантацию после полного рег-
ресса воспалительного процесса и за-
вершения реабилитационного перио-
да. Показано оперативное вмешатель-
ство I и II степени сложности. При на-
личии же функциональных нарушений
имплантация не показана или возмож-
на (только 1 степени сложности) после
лечения у кардиолога.
Перед операцией проводят поддер-
живающую сердечно-сосудистую тера-
пию, в том числе сердечными гликози-
дами. При ревматических пороках
сердца A. Dajani [70, 711 рекомендует
проводить перед имплантацией мас-
сивный профилактический курс анти-
биотикотерапии. Перед имплантацией
обязательно назначают антибактери-
альную терапию: амоксилин в дозе 3 г
внутрь за 1 ч до операции и 1,5 г спустя
6 ч после первого приема. Пациентам с
аллергией к амоксилину, пенициллину
назначают 800 мг эритромицина внутрь
за 2 ч до операции и половину этой до-
зы спустя 6 ч. В качестве альтернатив-
ного препарата можно применять
клиндомицин внутрь в лозе 300 мг за 1 ч
до операции и 150 мг через 6 ч после
первого приема [66]. Перед операцией
и во время нее обязательна кислород-
ная поддержка. Пациентам с указан-
ными заболеваниями сердечно-сосу-
дистой системы для наилучшей седа-
тивной подготовки и контроля в по-
слеоперационном периоде назначают
снотворные на ночь. Оперативное вме-
шательство, особенно II степени слож-
ности, предпочтительно производить в
стационаре. Осуществляют проводни-
ковую анестезию с малым, но доста-
точным для обезболивания количест-
вом анестетика с низкой концентраци-
ей вазоконстриктора. Обязательна
подготовка, в том числе в день опера-
Нии, седативными и антигистаминны-
ми препаратами. Продолжительность
пребывания пациента в стационаре 2—
Дня. Это необходимо для контроля за
состоянием пациента, наложения по-
вязок и временных протезов, контроля
33 их фиксацией.
Пороки сердца. После инфекцион-
ных заболеваний сердца могут сформи-
роваться пороки его клапанов. Этиоло-
гическим фактором инфекционного
эндокардита являются многие микро-
бы, преобладающими — стрептококки
и стафилококки, а воротами инфекции
чаще бывают одонтогенные очаги. По-
роки сердца могут сформироваться так-
же как врожденная патология. При та-
ких пороках, а также врожденных ано-
малиях и деформациях клапанов, от-
верстий, перегородок между камерами
сердца или отходящих от него сосудов,
нарушающих гемодинамику, больные,
обратившиеся по поводу зубной им-
плантации, должны быть внимательно
обследованы общими специалистами.
В таких случаях при зубной импланта-
ции необходима дифференцированная
тактика в зависимости от клинической
картины болезни и степени недоста-
точности кровообращения.
Рекомендуется учитывать класси-
фикационные формы пороков серд-
ца, предложенные В. И. Маколкиным
(1986). Пациентов с пороками сердца
надо относить к группе риска, так как
во время имплантации у них может
развиться острая или хроническая де-
компенсация кровообращения. Как
указывают A. Dajani и соавт. [70], у па-
циентов с давними пороками сердца
кардиальный резерв ограничен. Вместе
с тем многие из них не находятся под
диспансерным наблюдением по пово-
ду порока сердца, поэтому случайное
обнаружение шума в сердце, измене-
ния сердечных тонов, а также указание
больных на появление одышки при
физических нагрузках, отеков на но-
гах, нарушений ритма, болей в области
сердца может свидетельствовать о не-
диагностированном пороке сердца.
При оценке общего и местного статуса
врач должен внимательно отнестись к
цианозу губ больного, цианозу и изме-
нениям пальцев рук по типу барабан-
ных палочек, стойкому повышению
артериального давления, иногда кро-
вохарканью, мерцательной аритмии,
что может указывать на порок сердца.
Наличие таких симптомов заставляет
направлять пациентов к специалистам
для обследования и решения вопроса о
возможности имплантации. В случае,
когда пациент оперирован по поводу
пороков сердца и имеет искусственные
сердечные клапаны, при имплантации
всегда присутствует риск повторного
развития эндокардита. Если в анамнезе
имеются указания на повторные обо-
стрения воспалительного процесса в
сердце, то риск рецидива увеличивает-
ся на 25 %. Даже после того, как тера-
певт даст разрешение на зубную им-
плантацию, перед операцией следует
проводить профилактику антибиоти-
ками, поддерживающую терапию сер-
дечными гликозидами. Таким боль-
ным показана имплантация I и II сте-
пени сложности с предварительной се-
дативной подготовкой. Для анестезии
предпочтительны препараты артри-
каинового ряда с низким содержанием
вазоконстри кторов.
4.2. Диффузные заболевания
соединительной ткани
Диффузные заболевания соединитель-
ной ткани объединяют разнообразные
по происхождению заболевания сис-
темного, реже локального характера,
проявляющиеся в первую очередь в об-
ласти суставов. Согласно классифика-
ции болезней соединительной ткани
(1985), к ним следует относить ревма-
тизм, ревматоидный, ювенильный, ре-
активный, микрокристаллический арт-
рит, в том числе подагру, диффузные
болезни соединительной ткани, сис-
темные васкулиты, болезнь Бехтерева,
спондилоартриты, деформирующий
остеоартроз, другие болезни суставов и
артропатии внесуставных мягких тка-
ней, костей, остеохондропатии и арт-
ропатии. Отличительной особенностью
болезней являются воспалительные
или дегенеративные изменения соеди-
нительнотканных структур. В патоге-
незе этих заболеваний главное место
занимают нарушения иммунитета, па-
тологические аутоиммунные и имму-
нокомплексные реакции [30]. Диффуз-
ные заболевания соединительной ткани
относятся к заболеваниям, имеющим
наследственную предрасположенность,
что повышает требования к оценке се-
мейных заболеваний. Развивающиеся в
результате воспаления изменения со-
судов, клеток, межклеточного матрик-
са соединительной ткани создают в
кости челюстей неблагоприятные ус-
ловия для приживления имплантата и
его последующего функционирования.
Аутоиммунные заболевания (сустав-
ной ревматизм, системная красная вол-
чанка, склеродермия) мы оцениваем
как противопоказания к имплантации.
J. Hipp и соавт. [92] высказали мнение,
что пациенты с такими заболеваниями
являются плохими кандидатами для
имплантации, поскольку у них повы-
шена опасность развития коагуляцион-
ных, иммунодепрессивных и регенера-
тивных процессов, а также воспали-
тельных осложнений. При зубной им-
плантации у этих пациентов степень
риска связана не только с самим забо-
леванием, но и с приемом лекарств, в
том числе гормонов [70].
Кроме того, глубокие нарушения
иммунитета при ревматических болез-
нях и срыв толерантности по отноше-
нию к собственным клеткам и их
компонентам — аутоантигенам вызы-
вает стойкие аутоиммунные и гиперре-
активные реакции, гиперчувствитель-
ность замедленного типа, когда нару-
шаются морфология соединительной
ткани и реакции отторжения, в том
числе имплантата.
Ревматизм. 5>го заболевание наибо-
лее распространено и представляет со-
бой поражение соединительной ткани
с преимущественными изменениями в
сердечно-сосудистой системе. Если ак-
тивные формы ревматизма диагности-
руются достаточно хорошо, то первич-
но- и вторично-латентные болезни мо-
гут протекать бессимптомно, иногда
распознаваться при случайном обнару-
жении порока сердца [30]. Следует об-
ращать внимание на пациентов моло-
дого возраста с нарушениями функций
сердечно-сосудистой системы, особен-
но с сердечной недостаточностью, бо-
лями в суставах, их припухлостью и на-
рушением функции. Нередко симпто-
мами ревматоидного артрита бывают
симметричное поражение межфалан-
говых и других суставов, васкулиты и
ревматоидные узелки — в одних случа-
ях, деформация суставов с искривле-
ниями пальцев — в других, дермато-
миозит, синюшная окраска кожи "
в третьих. Вопрос об имплантации ре-
шают в зависимости от степени ревма-
тических поражений и эффекта ле-
чения.
Системная красная волчанка, сис-
темная склеродермия, системные васку-
литы занимают особое место среди
диффузных заболеваний соединитель-
ной ткани. В их патогенезе ведущую
роль играют иммунопатологические
процессы, в связи с чем результаты ос-
теотомии и имплантации в целом не-
предсказуемы. Мы полагаем, что зуб-
ная имплантация таким пациентам не
показана. В случае скрытых и нелече-
ных форм заболеваний стоматолог дол-
жен при обследовании обращать вни-
мание на кожные высыпания, пораже-
ния суставов, частую лихорадку, поли-
невриты, которые характеризуют сис-
темную красную волчанку. По харак-
терным поражениям кожи (отек, энду-
рация и атрофия) можно заподозрить
системную склеродермию. При ней для
лица типичны маскообразное и ами-
мичное выражение, истончение носа и
ушей, сужение ротовой щели с образо-
ванием "кисетообразных” морщин, не-
полное смыкание век, а также синдром
Шегрена — ксерофтальмии, ксеросто-
мии, увеличение слюнных желез.
Системные васкулиты представляют
собой тяжелые заболевания стенок со-
судов, которые имеют характерные
неврологические проявления, поража-
ют сердце, почки и могут быть диагно-
стированы только специалистами. Ука-
зание пациента на такие заболевания
делает имплантацию невозможной.
Нераспознанные формы системных
васкулитов могут характеризоваться
похуданием, болями в суставах, обшей
слабостью, явлениями нефропатии с
гранзиторной гипертонией, в других
случаях множественными моно- и по-
линевритами или абдоминальными
синдромами в виде гастрита, энтерита,
колита. При диагностике таких заболе-
ваний рекомендуются предваритель-
ное исследование почек, свертываю-
щей системы крови и оценка других ге-
матологических показателей.
При ревматических заболеваниях
обследование должен проводить спе-
циалист, но независимо от его заклю-
чения о возможности имплантации
этих лиц следует относить к группе
риска. Мы отказываем таким пациен-
там в операции. Зарубежные специали-
сты считают возможным проводить им-
плантацию только у больных ревматиз-
мом, прошедших полный курс лечения.
В таких случаях возможна импланта-
ция 1 и II степени сложности. Перед
операцией проводят курс антибактери-
альной терапии, который продолжают
и в послеоперационном периоде. При
обезболивании следует учитывать воз-
можность аллергических реакций на
местные анестетики. Для их профилак-
тики при медикаментозной подготовке
используют антигистаминные препа-
раты и увеличивают дозы транквилиза-
торов бензодиазепинового ряда. Обез-
боливание проводят препаратами арт-
рикаинового ряда с содержанием адре-
налина 1:200 000 с обязательной аспи-
рационной пробой. Отдельным паци-
ентам оперативное хирургическое вме-
шательство целесообразно выполнять
под общей анестезией.
Для остеотомии при имплантации у
таких пациентов большое значение
имеет бактериемия в полости рта. Реко-
мендуются орошение ее раствором
хлоргексидина и минимальное рассече-
ние тканей, чтобы предотвратить про-
никновение бактерий в костные струк-
туры. В таких случаях пациенты долж-
ны быть предупреждены о возможности
осложнений и неприживления имплан-
тата [115]. Кроме того, у пациентов с
ревматизмом наблюдается плохая им-
мунологическая защита. Следователь-
но, у них необходимо контролировать
показатели крови и иммунного статуса
(анемия, лейкопения, тромбоцитопе-
ния и лимфоцитоз). Пациентам, нахо-
дящимся на лечении по поводу ревма-
тизма и принимающим гормональные
препараты (кортикостероиды), средства
цитотоксической направленности и ан-
тибиотики, зубная имплантация абсо-
лютно противопоказана.
4.3. Оценка органов дыхания
Для положительного исхода импланта-
ционной хирургии большое значение
имеет состояние дыхательной систе-
мы. Патология органовдыхания вклю-
чает большое число острых респира-
торных заболеваний, острые и хрони-
I
Э1Ш
ческне пневмонии и бронхиты, аллер-
гические и хронические неспецифиче-
ские заболевания легких, бронхиаль-
ную астму, эмфизему легких и бронхо-
эктатическую болезнь [14, 15J. Подход
к оценке состояния легочной системы
перед имплантацией такой же, как при
сердечно-сосудистых болезнях. Разре-
шение на операцию дают терапевт,
кардиолог или пульмонолог.
При обследовании необходимо под-
робно расспросить пациента, не стра-
дает ли он легочными заболеваниями,
и выявить такие факторы риска, как
курение, ожирение, рецидивирующие
воспалительные заболевания дыхатель-
ных путей, легочная недостаточность.
Особенно внимательно нужно обследо-
вать пациентов старше 60 лет. Врача
должны насторожить такие симптомы,
как кашель с мокротой, нарастающая
одышка, боли в груди, одутловатость
лица, цианоз кожи и видимых слизи-
стых оболочек. Кроме того, столь ха-
рактерные клинические симптомы,
как утолщение концевых фаланг паль-
цев, бочкообразная форма груди, судо-
рожное, свистящее или стридорозное
дыхание, должны быть основанием для
специального обследования у пульмо-
нолога или общего терапевта [58]. Вме-
сте с тем легочная недостаточность
возможна в пожилом возрасте, при
ожирении, болезнях сердечно-сосуди-
стой системы. В свою очередь острые и
хронические заболевания легких могут
вести к правожелудочковой недоста-
точности сердца.
4.3.1. Острые и хронические
воспалительные заболевания
легких
Острые и хронические воспаления
бронхов и легких представляют собой
иммунопатологический инфекцион-
ный синдром и являются противопо-
казанием к зубной имплантации. Толь-
ко после полного истечения и в отсут-
ствие клинико-лабораторных показа-
телей воспаления можно снова обсуж-
дать вопрос о зубной имплантации.
Однако плохими кандидатами для им-
плантации являются пациенты с часты-
ми респираторными заболеваниями ды-
210
хательных путей. Только после оконча-
тельной санации очагов инфекции и оз-
доровительных лечебных мероприятий
под контролем пульмонологического
обследования, исследований крови и
иммунограмм мы через 6—12 мес после
последнего заболевания легких можно
обсуждать вопрос об имплантации.
Имплантацию I и II степени сложно-
сти производят в поликлинике, III
степени — в стационаре или поликли-
нике с дневным стационаром.
Хронические неспецифические за-
болевания легких составляют группу
наиболее сложных заболеваний орга-
нов дыхания. Это хронические брон-
хиты, хронические пневмонии, эмфи-
зема легких, бронхоэктатическая бо-
лезнь. По данным ВОЗ, хронические
обструктивные заболевания легких по
частоте занимают второе место после
сердечно-сосудистой патологии, осо-
бенно у жителей США и североевро-
пейских стран. Чаще они наблюдаются
у мужчин старше 40 лет, особенно у ку-
рильщиков. Важную роль играет вто-
ричная инфекция, усугубляющая тече-
ние болезни [59].
При хронических обструктивных
поражениях легких пациенты должны
пройти обследование и лечение у спе-
циалистов. Имплантация возможна I—
II степени сложности после стабилиза-
ции процесса и при поражении легкой
степени. Производить ее рекомендует-
ся в условиях стационара или в поли-
клинике с дневным стационаром. Под-
готовка, обезболивание такие же, как
описано выше. С. Misch [114] отмечал
положительные результаты при зубной
имплантации средней (II) степени
сложности в поликлинике и даже про-
водил в стационаре операции III—IV
степени сложности. Мы полагаем, что
объем хирургического лечения оконча-
тельно определяет терапевт, но воз-
можна имплантация только 1 или П
степени сложности.
За 7—10 дней до имплантации целе-
сообразно назначать больным настойку
термопсиса, теофедрин, эуфиллин и
проводить подготовку седативными И
антигистаминными препаратами. Опе-
рацию лучше проводить в стоматологи-
ческом кресле под углом 45‘. Премеди-
кацию осуществлять транквилизатора-
ми бензодиазепинового ряда и бронхо-
литиками. Из них очень эффективны
беротек и сальбутамол в виде аэрозоль-
ных ингаляций. Назначение снотвор-
ных барбитурового ряда, опиатов, фен-
танила и дроперидола не показано. Для
обезболивания наиболее целесообраз-
но использовать ультракаин DC, сеп-
танест, содержание адреналина долж-
но быть 1:200 000 и ниже. Нельзя при-
менять двустороннюю проводниковую
анестезию 119]. Перед операцией реко-
мендуется ввести внутривенно 5—10 мл
2,4 % раствора эуфиллина. Во время
операции целесообразна ингаляция
кислорода (2 л/мин). Для профилактики
дыхательной недостаточности обязате-
лен проводимый анестезиологом кон-
троль за состоянием пациента.
Тщательное проведение местной
анестезии лидокаином, ксилокаином с
добавлением адреналина в обычной
дозе и исключение болевых раздражи-
телей во время вмешательства позво-
ляют обеспечить устойчивое состояние
системы дыхания.
4.3.2. Бронхиальная астма
При любых стоматологических вмеша-
тельствах, включая зубную импланта-
цию, группой риска являются пациен-
ты с бронхиальной астмой. Различают
инфекционно-аллергическую и атопи-
ческую формы заболевания. Инфекци-
онно-аллергическая форма бронхиаль-
ной астмы возникает обычно при вос-
палительных заболеваниях носоглот-
ки, бронхов и других очагов инфици-
рования и аллергизации. Атопическая
форма чаще наблюдается при повы-
шенной чувствительности к аллерге-
нам неинфекционной природы. Эта
форма может быть также наследствен-
но обусловленной или возникать у
больных с другими заболеваниями ал-
лергического генеза (14].
Приступы бронхиальной астмы из-
меняют реактивность организма. Су-
жение бронхов вследствие спазмов
’Ладкой мускулатуры, отека слизистой
оболочки и накопления вязкого секре-
та приводит к нарушению легочной
вентиляции. В результате жизненная
емкость легких резко снижается, а объ-
ем остаточного воздуха возрастает, что
сопровождается артериальной гипок-
семией. За счет спазма гладкой муску-
латуры бронхиального дерева увели-
ченное артериальное давление и ги-
поксия вызывают рефлекторный спазм
артериол малого круга и повышение
давления в системе легочной артерии.
В этих условиях работа правого желу-
дочка сердца затруднена и может на-
ступить его перегрузка [14].
Встречаются больные с недиагно-
стированными формами бронхиаль-
ной астмы. Всегда следует уточнять, не
наблюдаются ли у них приступы за-
трудненного дыхания и кашля, одыш-
ки или признаков бронхоспазма —
удушья. При выявлении таких симпто-
мов пациент должен быть обследован
терапевтом, от которого необходимо
получить разрешение на операцию с
указанием условий проведения (в по-
ликлинике или стационаре), а также ее
допустимого объема.
Особенно серьезное внимание сле-
дует уделять тем пациентам, у которых
бронхиальная астма развивается на
фоне выраженной сердечно-сосуди-
стой патологии, а также лицам пожи-
лого возраста [78]. Кроме того, боль-
ные бронхиальной астмой часто дли-
тельно принимают кортикостероиды.
Все эти симптомы следует считать не-
благоприятными факторами для об-
щих и местных иммунологических ре-
акций, поэтому пациентам с этими ле-
гочными заболеваниями необходимо
отказывать в зубной имплантации. Кро-
ме того, у пациентов с бронхиальной ас-
тмой, которая служит одним из прояв-
лений иммунопатологического синдро-
ма, снижен иммунитет, отчего возника-
ют неблагоприятные тканевые реакции,
влияющие на приживление имплантата.
По этой причине больным бронхиаль-
ной астмой зубная имплантация проти-
вопоказана. Однако С. Misch [ 119] счи-
тает возможной зубную имплантацию
при бронхиальной астме, но только при
тщательном обследовании больного и
при условии, что в случае приступа
бронхиальной астмы во время опера-
ции врач сумеет оказать необходимую
помощь. Перед имплантацией больной
не должен долго ждать операции, необ-
ходимо устранить все возможные стрес-
совые ситуации, все назначенные ле-
карственные препараты должны быть
приняты и при необходимости дозы их
увеличены 1119]. Премедикацию осу-
ществляют успокаивающими средства-
ми бензодиазепинового ряда и анти-
гистаминными препаратами. Имплан-
тацию проводят только под местным
обезболиванием. Выбор анестетика осу-
ществляют в зависимости от переноси-
мости препарата. Если в анамнезе име-
ется аллергия на парагруппу, то следует
использовать местные анестетики, не
содержащие парабен как стабилизатор,
такие как ультракаин DC, септонест с
адреналином в концентрации 1:200 000
и ниже. Если у пациента имеется по-
вышенная чувствительность к сульфи-
там, не следует применять анестетики
с вазоконстрикторами, так как в каче-
стве консерванта сосудосуживающего
средства он содержит бисульфит нат-
рия [19]. После имплантации как обез-
боливающее не назначают ацетилсали-
циловую кислоту, морфин, индомета-
цин, так как они провоцируют брон-
хоспазм.
Во время оперативного вмешатель-
ства врач может столкнуться с присту-
пом недиагностированной бронхиаль-
ной астмы. Начальными клинически-
ми признаками являются сухой ка-
шель, затрудненный и удлиненный вы-
дох, одышка. Кожа покрывается по-
том, увеличивается частота дыханий,
усиливается цианоз лица. Если при-
ступ не купировать, он может перейти
в астматический статус в виде состоя-
ния тяжелой асфиксии. При оказании
экстренной помощи такому больному
внутрь или под язык дают нзодрин
(0,005 г), эфедрин (0,025 г), алупент
(0,02 г), эуфиллин (0,15 г), а также таб-
летку нитроглицерина. Если этими
средствами не удается купировать при-
ступ, то подкожно вводят 0,5— 1 мл 5 %
раствора эфедрина или такие препара-
ты, как беротек, вентолин, сальбута-
мол. При затянувшемся приступе при-
меняют адреномиметики (адреналин,
эфедрин, алупент) и холинолитики
(атропин, платифиллин). Эуфиллин
(аминофиллин, диафиллин, синто-
филлин) вводят внутривенно очень
медленно по 5—10 мл 2,4 % раствора в
сочетании с 5—10 мл 0,5 % раствора
глюкозы. Через носовой катетер или
маску проводят ингаляцию увлажнен-
ного кислорода до полного прекраще-
ния приступа.
На фоне выраженной сердечно-со-
судистой патологии у отдельных боль-
ных, особенно у лиц пожилого возрас-
та, тяжесть приступа бронхиальной ас-
тмы может усугубиться при наличии
сердечной астмы. При оказании помо-
щи, помимо упомянутых лекарствен-
ных препаратов, следует вводить сер-
дечные глюкозиды (0,5—0,75 мл 0,06 %
раствора коргликона или 0,3—0,5 мл
0,05 % раствора строфантина в 20 мл
40 % раствора глюкозы внутривенно).
В случае быстрого купирования при-
ступа бронхиальной астмы операцию I
и II степени сложности продолжают в
полном объеме, III степени — завер-
шают начатые манипуляции с очеред-
ным имплантатом. При тяжелом, затя-
нувшимся приступе бронхиальной ас-
тмы во всех случаях сердечной астмы
операцию прекращают. Отдельным
больным может потребоваться специа-
лизированная скорая помощь.
В то же время пациентам, у которых
бронхиальная астма развивается на
фоне выраженной сердечно-сосуди-
стой патологии, лицам пожилого воз-
раста и больным, длительно леченным
кортикостероидами, необходимо отка-
зывать в зубной имплантации.
Больные с эмфиземой, бронхоэкта-
тической болезнью также являются
плохими кандидатами для зубной им-
плантации, поскольку у них иммуно-
логический статус значительно нару-
шен и условия для приживления и
функционирования имплантатов в
зубных протезах могут быть неадекват-
ными. У таких пациентов может раз-
виться дыхательная недостаточность,
что представляет угрозу во время опе-
рации. Такой риск во время операции
возникает также у больных с нераспо-
знанными хроническими легочными
заболеваниями. Пациенты с хрониче-
скими обструктивными заболевания-
ми легких должны пройти длительное
лечение у специалистов. Имплантация
может быть произведена при стабили-
зации процесса и легкой степени пора-
жений. С. Misch (119] рекомендует
осуществлять ее в условиях стациона-
ра. Вопрос о степени сложности хирур-
гического имплантационного лечения
решает обший специалист. Можно ре-
комендовать только операцию I и II
степени сложности. Подготовку, обез-
боливание осуществляют при хрониче-
ском заболевании легких.
Во время имплантационного вмеша-
тельства у больных с хроническими за-
болеваниями легких может возникнуть
аллергическая реакция в виде бронхо-
спазма, отека Квинке, а также анафи-
лактического шока. Иногда такая ре-
акция может возникать на введенный
анестезирующий раствор или на запах
лекарств в операционной. В случае
развития аллергической реакции сле-
дует немедленно прекратить операцию
и начать оказание срочной помощи в
зависимости от типа реакции и тяже-
сти состояния пациента [15]. Проводят
интенсивную терапию с целью выведе-
ния больного из состояния острой сер-
дечно-сосудистой недостаточности.
Одновременно принимают меры по
борьбе с бронхоспазмом. Подкожно
или внутримышечно вводят 0,5—1 мл
0,1 % раствора адреналина, а если со-
стояние связано с реакцией на анесте-
зию, то 0,3—0,5 мл этого препарата
вводят в депо анестетика. Начинают
внутривенное введение препаратов:
капельно вводят 2—3 мл 0,2 % раство-
ра норадреналина в 250 мл 5 % раство-
ра глюкозы или изотонического рас-
твора натрия хлорида, 60—120 мг пред-
низолона или 125 - 250 мг гидрокорти-
зона, а также по показаниям строфан-
тин или коргликон. При бронхоспазме
на фоне нормального артериального
Давления вводят эуфиллин. В случае
снижения артериального давления по-
казана подкожная инъекция эфедрина.
Природа таких заболеваний легких,
как эмфизема, бронхоэктатическая бо-
лезнь, делает пациентов с этой патоло-
гией плохими кандидатами для зубной
Имплантации, поскольку их иммуно-
логический статус значительно нару-
жен и условия для приживления и
Функционирования имплантатов в
3Убных протезах могут быть неадекват-
ными. В связи с этим пациентам с эм-
физемой легких и бронхоэктатической
болезнью зубная имплантация нами не
Рекоме ндустся.
4.4. Оценка мочеполовой
системы
4.4.1. Болезни почек
Общий подход к болезням почек с точ-
ки зрения показаний и противопоказа-
ний к зубной имплантации заключает-
ся прежде всего в том, что при воспа-
лительном процессе операция проти-
вопоказана. Кроме того, ряд заболева-
ний почек связан с иммунной недоста-
точностью аллергической или аутоим-
мунной природы. Хронический гломе-
рулонефрит, пиелонефрит являются
противопоказанием к зубной имплан-
тации. Зубная имплантация не показа-
на также пациентам с нефротическим
синдромом, хронической почечной не-
достаточностью. В США все больше
людей с недостаточностью почек и
весьма часто после пересадки почки
обращаются по поводу зубной имплан-
тации. У таких пациентов нарушение
водно-электролитного и белкового об-
мена, функций свертывающей системы
крови всегда увеличивает риск ослож-
нений во время операции. Часто у них
развиваются послеоперационные ос-
ложнения, а в связи с нарушением им-
мунитета затруднены приживление и
функционирование имплантата [115].
При подозрении на заболевания по-
чек с исходом в хроническую почеч-
ную недостаточность наиболее про-
стым исследованием является анализ
крови. На заболевание указывают по-
вышение уровня креатинина и мочеви-
ны. Следует иметь в виду также другие
болезни органов и систем, при кото-
рых почки вовлекаются в воспалитель-
ный процесс вторично [120].
По мнению J. Neary [124], зубная им-
плантация возможна при компенсиро-
ванных формах почечной недостаточно-
сти, если водно-электролитный баланс
стабилен, плотность мочи нормальная и
уровень креатинина в сыворотке крови
не превышает 0,13 ммоль/л. Пациенты с
такими показателями обычно еще не ну-
ждаются в диачизе. По мнению автора,
имплантацию можно производить да-
же у больных, находящихся на долго-
временном диализе, если функция по-
чек стабильна. Операцию рекомендует-
ся выполнять на следующий день после
диализа.
При планировании зубной имплан-
тации у пациентов, перенесших транс-
плантацию почки, следует учитывать
прием ими кортикостероидов. Именно
такие моменты создают наибольшую
опасность послеоперационных ослож-
нений и могут влиять как на заживле-
ние раны, так и на приживление и
функционирование имплантатов. Сле-
дует отметить, что системные диффуз-
ные болезни соединительной ткани,
болезни обмена веществ с преимуще-
ственным поражением почек всегда
являются противопоказаниями к зуб-
ной имплантации.
С учетом сказанного выше при ком-
пенсированных формах почечной не-
достаточности зубную имплантацию I
степени сложности производят в тех
случаях, когда отсутствует воспалитель-
ный компонент болезни. При легкой и
средней тяжести хронической почечной
недостаточности самое простое им-
плантационное вмешательство (I сте-
пень сложности) возможно в хорошо
контролируемых клинических ситуаци-
ях. С. Misch считает возможным им-
плантацию даже после лечения гемо-
диализом и рекомендует оперировать
больных на следующий день после него.
При легкой и средней тяжести по-
чечной недостаточности пациенты
должны быть обследованы общим спе-
циалистом или нефрологом. Опреде-
ляют артериальное давление и статут
сердечно-сосудистой системы, уровень
креатинина, азота и мочевины в крови,
электролитный баланс. По рекоменда-
ции нефролога осуществляют подго-
товку к операции. Для улучшения ко-
стного зажиаления необходима норма-
лизация сывороточного кальция. Пе-
ред имплантацией рекомендуется по
согласованию с нефрологом снизить
дозы лекарственных препаратов, экс-
кретируемых почками.
Для достижения седативного, гип-
нотического и вазодепрессорного эф-
фекта перед имплантацией назначают
лекарственные препараты. Использу-
ют седуксен, дроперидол, атропин, а
также индивидуально в терапевтиче-
ских дозах фентанил, промедол. Ане-
стезия должна быть достаточной и
обеспечиваться обычными анестетика-
ми с адреналином. Перед операцией
следует знать время кровотечения, так
как при заболеваниях почек возможно
нарушение гомеостаза, а в дальнейшем
обязателен контроль коагулограммы
[121]. При остеотомии на нижней че-
люсти для постановки имплантата у
основания должно остаться не менее
3—4 мм кости, так как у таких больных
всегда имеется опасность перелома.
4.3.2. Болезни половой системы
При воспалительных гинекологических
заболеваниях имплантация не показана
до санации. Не следует также произво-
дить имплантацию во время беремен-
ности и кормления ребенка грудью.
При подготовке и планировании опера-
ции учитывают прием контрацептивов
и гормональных препаратов.
При решении вопроса о зубной им-
плантации у женшин стоматолога дол-
жен насторожить климактерический
синдром. Необходимо отметить случаи
нарушений нервно-психического со-
стояния у женшин в климактериче-
ском периоде (депрессии, психозы и
др.). Особенно тщательно должна быть
оформлена юридическая документа-
ция по проведению имплантации и
рассмотрены альтернативные методы
лечения.
При опросе женщины в возрасте от
45 до 55 лет нужно получить детальные
сведения о наличии приливов, чувства
жара, головокружения, тахикардии,
нарушениях психоэмоционального со-
стояния. Если эти симптомы сочета-
ются с отсутствием менструаций более
года, то следует направить пациентку
на обследование к эндокринологу' и ги-
некологу, определить содержание гона-
дотропинов в крови и моче. Кроме то-
го, необходимо специальное исследо-
вание состояния костей для исключе-
ния остеопороза. Потеря кости у жен-
щин особенно прогрессирует в пост-
менструальном периоде, а также при
удалении яичников (135].
Таким образом, состояние женщин
в климактерическом периоде должно
быть оценено как с точки зрения тяже-
сти климактерического синдрома, так
и состояния костей для зубной им-
плантации. Период климакса на пике
невротических пароксизмальных реак-
ций является противопоказанием к им-
плантации. Через год после прекраще-
ния менструаций имплантация может
быть произведена, если нет тенденции
к остеопорозу костей, в том числе че-
люстей. Подготовка и обезболивание
обычные с учетом степени сложности
имплантационной хирургии.
Мужчинам имплантация противо-
показана при воспалительных заболе-
ваниях мочевыводящих путей. Вопрос
об операции решают после лечения.
4.5. Оценка эндокринной
системы
Нейроэндокринная система коорди-
нирует и регулирует деятельность всех
органов и систем, обеспечивая адапта-
ционные, компенсаторные реакции ор-
ганизма на различные факторы внеш-
ней и внутренней среды. Главное дей-
ствие этой системы — обеспечение ус-
тойчивого гомеостаза для поддержания
деятельности органов и систем орга-
низма. Гормоны, секретируемые орга-
нами и тканями эндокринной системы,
оказывают гормональное, изо-, пара-,
ауто- и нейрокринное, а также нейро-
эндокринное действие. Гормоны могут
быть белковыми, стероидными и про-
изводными аминокислот. Ни одна
функция в организме не осуществляет-
ся без гормонов. Они играют важную
роль в процессах пролиферации. По-
скольку это главное и конечное звено
приживления зубных имплантатов, на
хирургическом этапе имплантации эн-
докринной системе следует уделять
большое внимание.
Изменение функций эндокринных
Желез происходит под влиянием повы-
шения или снижения секреции гормона
Железой, нарушения транспорта гор-
мона от места его образования до ор-
гана или ткани, процессов взаимодей-
ствия гормона с рецептором и постре-
ле пторных механизмов [3]. Большин-
ство заболеваний эндокринной систе-
мы развивается при врожденных де-
фектах иммунной системы или врож-
денной, а также приобретенной им-
мунной недостаточности. Аутоиммун-
ные механизмы патогенеза болезней
предопределяют неблагоприятные ре-
акции тканей на приживление и функ-
ционирование имплантата [70].
При большинстве заболеваний эн-
докринной системы зубная импланта-
ция противопоказана. Нередко по по-
воду имплантации обращаются паци-
енты с недиагностированными форма-
ми заболеваний эндокринной систе-
мы. Надо обращать внимание на боль-
ных, легко раздражающихся на приеме
у врача, легко утомляющихся, не пере-
носящих холода и жары, с сухостью ко-
жи, осиплостью голоса, тремором рук,
тахикардией, повышением температу-
ры тела. Пациентов с таким статусом
следует направлять для обследования к
эндокринологу, который оценивает
возможность имплантации и разраба-
тывает план подготовки к ней [101].
J. Neary [124] считает, что даже мини-
мальное оперативное вмешательство
может вызвать у таких пациентов криз,
например тиреотоксический шок.
Вместе с тем, по данным зарубеж-
ных авторов, при ряде заболеваний им-
плантация может быть проведена при
компенсированных формах пораже-
ний и соответствующей подготовке па-
циента эндокринологом. При заболе-
ваниях эндокринной системы объем и
продолжительность зубной импланта-
ции нужно планировать строго инди-
видуально [118]. Иностранные и отече-
ственные авторы указывают на опреде-
ленные успехи зубной имплантации
при сахарном диабете, тиреотоксикозе.
Среди эндокринных болезней, ока-
зывающих влияние на зубную имплан-
тацию, значительное место занимают
заболевания гипоталамо-гипофизар-
ной системы, щитовидной и околощи-
товидных желез, надпочечников, а так-
же сахарный диабет. При предопера-
ционном обследовании больного сле-
дует также обращать внимание на из-
менения, обусловленные секрецией
желудочно-кишечных гормонов, ожи-
рение и нарушения, связанные с кли-
мактерическим периодом (104].
4.5.1. Заболевания гипоталамо-
гипофизарной системы
К болезням гипоталамо-гипофизарной
системы относятся акромегалия, гипо-
физарный нанизм, синдром гипопи-
туитаризма, болезнь Иценко—Кушин-
га, несахарный диабет.
Акромегалия связана с избыточной
секрецией гормона роста за счет аде-
номы гипофиза. При обследовании па-
циента на предмет имплантации следу-
ет обратить внимание на увеличение
ушей, носа, языка, губ, надбровных
дуг, а также кистей рук. Эти проявле-
ния сочетаются с повышением внутри-
черепного давления, кардиомиопати-
ей, дыхательной недостаточностью,
активизацией основного обмена. Па-
циенты с акромегалией являются пло-
хими кандидатами для зубной имплан-
тации. Имплантат может не прижить
вследствие как изменений костной
ткани, так и повышения уровня орга-
нического фосфора в сыворотке крови
и кальцийурии.
Гипофизарный нанизм относится к
болезням задержки роста, что связано
со снижением секреции гормона роста.
Заболевание часто бывает семейным и
наследственным пороком.
Обследуя пациента, гипофизарный
нанизм достаточно легко выявить, так
как задержка роста составляет 30 %
нормы [3]. Пациентов карликового
роста, с маленьким лицом, имеющим
ранние морщины, с тонкой и нежной
кожей и плохо развитой мышечной
системой можно считать страдающими
гипофизарным нанизмом. Таким боль-
ным зубная имплантация не показана,
поскольку у них кости челюстей очень
тонкие, кортикальное вещество также
истончено. Часто продолжающаяся
структурная перестройка костей, в том
числе челюстных, может предопреде-
лять неудачу имплантации.
Противопоказаниями к зубной им-
плантации являются и другие заболе-
вания гипоталамо-гипофизарной сис-
темы: синдром гипопитуитаризма, бо-
лезнь Ипенко Кушинга, несахарный
диабет. Однако в зарубежной литерату-
ре имеются сведения о возможности
зубной имплантации при болезни
Иценко—Кушинга и ряде других забо-
леваний гипоталамо-гипофизарной сис-
темы 1118]. При таких заболеваниях им-
плантацию рекомендуется производить
в условиях стационара. Обязательна
тщательная подготовка, включающая
предоперационную коррекцию приема
лекарственных препаратов, в том числе
стероидных гормонов [121, 124].
4.5.2. Заболевания щитовидной
железы
В эту группу болезней входят диффуз-
ный токсический зоб, тиреотоксиче-
ская аденома, многоузелковый токси-
ческий зоб, подострый тиреоидит, ау-
тоиммунный тиреоидит и гипертиреоз.
Диффузный токсический зоб. Забо-
левание характеризуется увеличением
щитовидной железы, тремором многих
мышц тела, тахикардией и нарушения-
ми функций половых желез у мужчин,
глазными симптомами, нарушениями
деятельности сердечно-сосудистой сис-
темы. При нелеченом диффузном ток-
сическом зобе и во время его лечения
зубная имплантация не показана, по-
скольку в этот период усиливается ос-
теопороз костей, в том числе челюстей,
и снижается иммунитет. Кроме того,
любое оперативное вмешательство, осо-
бенно если к анестетику добавлен адреа
калин, может спровоцировать стресс у
таких пациентов [19, 94, 106, 116].
Среди эндокринных заболеваний
следует выделить тиреотоксикоз, кото-
рый характеризуется повышением
функции щитовидной железы. Гормон
этой железы тироксин оказывает влия-
ние на белковый обмен, и его токсиче-
ское действие ведет к нарушению дея-
тельности сердечно-сосудистой и цен-
тральной нервной систем, печени.
При обследовании перед импланта-
цией следует обращать внимание на
пациентов с повышенной возбудимо-
стью, раздражительностью, тремором
рук и дрожанием всего тела. Наличие
при объективном исследовании тахи-
кардии также может ориентировать на
тиреотоксикоз. При осмотре полости
рта такие симптомы, как жжение сли-
зистой оболочки полости рта, сниже-
ние вкусовой чувствительности, нали-
чие стоматита, также могут указывать
на это заболевание.
Анамнез болезни пациента и диаг-
ноз тиреотоксикоза должны быть под-
креплены заключением эндокриноло-
га. В зависимости от степени тиреоток-
сикоза следует решать вопрос о воз-
можности имплантации и характере
специальной подготовки.
Отечественные авторы не распола-
гают опытом зубной имплантации у
пациентов с заболеваниями щитовид-
ной железы. В связи с этим при плано-
вых операциях приходится ограничи-
ваться уменьшением степени риска.
Зарубежный опыт показывает, что па-
циентам с заболеваниями щитовидной
железы, которым специалистами раз-
решена имплантация, может быть ре-
комендована операция I и 11 степени
сложности. В зависимости от характера
заболевания операции II степени слож-
ности лучше проводить в условиях ста-
ционара или в поликлинике с дневным
стационаром, где до, во время вмеша-
тельства и после него будет продолжен
адекватный контроль за больным.
Зарубежный опыт показывает, что
при токсическом зобе 1 и 11 степени,
когда лечение в течение года дало кли-
ническую и лабораторную стабилиза-
цию процесса, можно производить им-
плантацию [121]. При токсическом зо-
бе 111 и IV степени, если в результате
лечения наступает только частичное
улучшение, имплантация противопо-
казана [121]. После удаления щитовид-
ной железы по поводу тиреотоксикоза
111 и IV степени можно вновь обсудить
с эндокринологом вопрос о зубной им-
плантации и решать его в зависимости
от общего статуса пациента.
Вместе с тем при легком тиреоток-
сикозе специальная подготовка к опе-
рации не обязательна, а седативную
проводят по общим правилам, исполь-
зуя транквилизаторы бензодиазепино-
вого ряда. При заболевании средней
тяжести следует готовить пациента к
операции согласно указаниям эндок-
ринолога. Можно применять йод в
микродозах в течение 6—8 дней, мер-
казолин, витамины С, В], В6, В]2, РР,
глюкокортикоидные препараты и ин-
сулин, липокаин по 0,3 г 2 раза в сутки,
метионин по 1 г 3 раза в сутки, 40 %
раствор глюкозы с инсулином [68]. Эти
лекарственные препараты корригиру-
ют функцию надпочечников, инсуляр-
ного аппарата поджелудочной железы
и печени. Назначают также транквили-
заторы и ганглиоблокаторы — резер-
пин по 0,1 мг 3 раза в сутки или гексо-
ний, гигроний, пентамин и сердечные
глюкозиды. Назначение всех лекарст-
венных препаратов и контроль за их
эффектавностью должен проводить те-
рапевт или эндокринолог. Вместе с тем
установлено, что пациенты с тиреоток-
сикозом чувствительны к наркотикам,
седативным средствам, адреналину и
другим вазоконстрикторам и риск со-
судистых реакций вплоть до коллапса у
них достаточно велик [121]. При обез-
боливании применяют анестетики баз
вазоконстриктора, в крайнем случае в
качестве сосудосуживающего средства
используют норадреналин или фели-
прессин.
Результат имплантационных опера-
ций у пациентов с тиреотоксикозом за-
висит от выполнения лечебных реко-
мендаций эндокринолога и соблюде-
ния графика приема лекарств во время
операции.
Несмотря на все меры предосторож-
ности, во время операции внезапно
может возникнуть тиреотоксический
шок, причиной которого может стать
стресс. Шок начинается с появления
жара, тахикардии, обильного потоот-
деления, резкого возбуждения и спу-
танности сознания. В такой ситуации
следует увеличить дозу седативных
препаратов, наркотических и антигис-
таминных средств, атропина (0,5—
1 мг). Обязателен контроль гемодина-
мики, а при необходимости — кардио-
генная терапия и кислородная под-
держка [68, 121].
Тиреотоксическая аденома — это ги-
пертиреоидное состояние, обусловлен-
ное избыточной функцией автономной
аденомы щитовидной железы. Сим-
птомы болезни аналогичны таковым
при диффузном токсическом шоке, но
офтальмопатия не наблюдается. Вме-
сте с тем более выражены нарушения
функций сердечно-сосудистой систе-
мы и миопатия, поэтому имплантация
не показана. Только после эндокрино-
логического лечения и получения по-
ложительных результатов функцио-
нального обследования пациентов
можно обсуждать вопрос о возможно-
сти зубной имплантации. Объем им-
плантационной хирургии определяет
эндокринолог. Седативная подготовка,
обезболивание проводят так же, как
при диффузном зобе.
Аутоиммунный тиреоидит относится
к заболеваниям, при которых под
влиянием аутоантител происходят де-
струкция шитовидной железы и заме-
щение ее соединительной тканью. Бо-
лезнь проявляется в атрофической и
гипертрофической формах. В наиболее
типичных случаях она характеризуется
симметричным узловатым увеличени-
ем железы, явлениями гипертиреоза,
нарушениями функций сердечно-сосу-
дистой системы. Будучи аутоиммун-
ным процессом, заболевание всегда
сочетается с нарушением иммунитета,
поэтому приживление и нормальное
функционирование имплантатов весь-
ма проблематичны. После излечения и
разрешения специалистом зубной им-
плантации перед операцией необходи-
мо уточнить результаты лечения глюко-
кортикоидными препаратами и опреде-
лить титр антитиреоидных антител в
крови [101]. Показана имплантация I—
II степени сложности. Необходима под-
готовка к операции. Премедикацию
проводят седативными, антигистамин-
ными препаратами. При обезболива-
нии используют анестетик без вазо-
констриктора.
Гипотиреоз — гипофункция щито-
видной железы. Заболевание может раз-
виваться при аномалии развития щито-
видной железы, эндемическом зобе,
кретинизме, подостром тиреоидите, ау-
тоиммунном тиреоидите, а также после
медикаментозного или хирургического
лечения. Клинические проявления бо-
лезни разнообразны (нарушения функ-
ций центральной нервной, эндокрин-
ной, сердечно-сосудистой, пищевари-
тельной и других систем).
При обследовании пациентов на
предмет зубной имплантации следует
внимательно отнестись к таким фак-
там, как операция на шитовидной же-
лезе и длительность лечения по поводу
ее заболевания. При обнаружении отека
слизистой оболочки полости рта, уве-
личении губ и языка, сухости во рту
следует исключить гипотиреоидоз и
направить пациента к эндокринологу.
Если диагноз гипотиреоза подтвержда-
ется специалистом, то имплантация не
показана.
Заболевания паращитовидных желез —
первичный и вторичный гиперпарати-
реоз. Первичный гиперпаратиреоз от-
носится к болезням нарушения фос-
форно-кальциевого обмена. Легкие
поражения могут протекать бессим-
птомно. Поражения средней тяжести
чаше всего выявляются в почках,
тяжелые — в костях, почках, желудоч-
но-кишечном факте. Первые и наибо-
лее яркие симптомы гиперпаратиреоза
костей отмечаются в области челюстей.
Наблюдаются истончение кортикаль-
ной кости, убыль губчатого вещества,
прогрессирующее поражение пародон-
та. Учитывая поражение челюстей и
артериальные гипертензии с частыми
кризами, таким больным не следует
производить зубную имплантацию.
4.5.3. Заболевания надпочечников
Заболевания надпочечников относятся
к патологии эндокринной системы.
Среди них перед зубной имплантацией
следует фиксировать болезнь Аддисо-
на, синдром Конна, врожденную ги-
перплазию коры надпочечников [109].
Болезнь .Аддисона. Проявлением пер-
вичной хронической недостаточности
коры надпочечников служит болезнь
Аддисона, которая характеризуется де-
струкцией функциональной ткани ко-
ры надпочечников и снижением секре-
ции кортикостероидов. Часто процесс
развивается на фоне аутоиммунных за-
болеваний, туберкулезной инфекции,
амилоидоза внутренних органов. Пре-
морбидные признаки скрытых нару-
шений функции надпочечников в виде
утомляемости, снижения массы тела,
гиперпигментации кожи и слизистых
оболочек должны насторожить стома-
толога [101]. Пациента необходимо на-
править к эндокринологу для обследо-
вания. Нужно обращать внимание на
гиперпигментацию кожи лица и слизи-
стой оболочки полости рта. Особенно
ярко это проявляется на губах, деснах,
слизистой оболочке щек. Заболевания
аутоиммунной природы в сочетании с
недостаточностью коры надпочечни-
ков приводят к снижению иммуноло-
гической реактивности организма
[109]. Прогностически исход зубной
имплантации неблагоприятный, в силу
чего при болезни Аддисона она проти-
вопоказана.
Синдром Конна — первичный альдо-
стеронизм, связанный с гиперсекреци-
ей альдостерона, который возникает
вследствие аденомы коры надпочечни-
ков. Головная боль, стойкая артери-
альная гипертензия, мышечная сла-
бость, легочная недостаточность явля-
ются наиболее характерными симпто-
мами синдрома Конна. Результаты
стоматологического обследования и
выявление отечности слизистой обо-
лочки полости рта, губ, бати в жева-
тельных и мимических мышцах, паре-
стезия ветвей тройничного нерва по-
могают врачу сориентироваться и на-
править пациента к эндокринологу.
При синдроме Конна имплантация
противопоказана.
Врожденная гиперплазия коры над-
почечников. Клинически забатевание
проявляется нарушением секреции
кортикостероидов. Это связано с вро-
жденным дефектом ферментов, ответ-
ственных за биосинтез кортикостерои-
дов. Дефекты представляют собой тя-
желые или средней тяжести пораже-
ния. Пациенты, указавшие на наличие
в детстве названных поражений, долж-
ны быть обследованы специалистом.
При нарушениях функций коры над-
почечников зубная имплантация не
показана. Вместе с тем опыт зарубеж-
ных имплантологов свидетельствует о
такой возможности.
При нарушении функции надпочеч-
ников зубная имплантация возможна с
Дифференцированной предымпланта-
Пионной подготовкой. Несмотря на оп-
ределенную категоричность общих под-
ходов к неургентным операциям на че-
Дюстях при недостаточности надпочеч-
ников, С. Misch и Р. Мооге [118] счита-
ет, что имплантация может быть вы-
полнена при компенсированных фор-
мах этой патологии, которые могут соз-
давать небольшой или умеренный риск
"о время и после вмешательства. При
выраженной недостаточности надпо-
чечников возможно оперативное вме-
шательство только 1 степени сложности.
Видимо, опыт С. Misch и Р. Мооге [118]
можно использовать только тогда, ко-
гда пациенты постоянно находятся под
наблюдением эндокринолога или неф-
ролога и результаты лечения кортико-
стероидами контролируются лабора-
торно. Устанавливая показания к им-
плантации у пациентов с недостаточно-
стью надпочечников, следует помнить о
возможности осложнений. Во всех слу-
чаях стоматолог должен учитывать до-
зы лекарственных препаратов, которые
пациент принимает в связи с недоста-
точностью надпочечников. Обычно в
таких случаях назначают стероидную
терапию. Если объем предстоящего
вмешательства небольшой, I—II степе-
ни сложности, то оперировать можно в
поликлинических условиях. В таких
случаях за день до операции и на дру-
гой день после нее следует удвоить
обычную для пациента дневную дозу
гидрокортизона. Имплантацию значи-
тельного объема следует проводить в
стационаре при дозированном введе-
нии гидрокортизона до и после опера-
ции. У таких пациентов операция дает
хорошие результаты и компенсация
функции надпочечников бывает ста-
бильной. Авторы обращают внимание
на необходимость седативной подготов-
ки с использованием малых транквили-
заторов и антигистаминных препаратов
[115, 121]. Для местного обезболивания
предпочтителен мепивакаин, ультрака-
ин, лидокаин с минимальным добавле-
нием катехоламинов или применение
вазопрессина, фелипрессина.
Имплантационная хирургия I степе-
ни сложности требует введения 100 мг
гидрокортизона внутримышечно или
внутривенно непосредственно перед
операцией. Пациентам, принимающим
стероиды, следует удвоить обычную су-
точную дозу за день до операции, в день
ее проведения и в течение суток после
нее. Больным с почечной недостаточ-
ностью, которым не показана терапия
гидрокортизоном, рекомендуется за
день до операции и в день ее выполне-
ния принимать этот препарат в дозе
60 мг в сутки, в течение 2 дней после
операции — по 40 мг и в последующие
3 дня — по 20 мг.
При операции 11 степени сложности
за 20 мин до ее начала внутривенно
вводят 100 мг пирокортизона. В тече-
ние следующих за операцией суток этот
препарат вводят каждые 6 ч по 50 мг, а
в последующие 3—5 дней — с такими
же интервалами в дозе 25 мг. Если в
послеоперационном периоде наблюда-
ются температурная реакция и сниже-
ние артериального давления, то дозу
гидрокортизона нужно увеличить. Од-
нако F. McCarthy [109] считает, что,
несмотря на получение от общих спе-
циалистов разрешения на импланта-
цию, во время операции полностью не
исключен риск осложнений, связан-
ных с нарушением функции надпочеч-
ников. Часто недостаточность надпо-
чечников может не выявляться до тех
пор, пока их функция не нарушится на
90 %. Таким больным имплантацию
производят в стационаре.
Вместе с тем недостаточность надпо-
чечников, не отмеченная пациентом и
не учтенная лечащим врачом, при им-
плантации может вызвать опасный для
жизни шок. Спровоцировать его разви-
тие может эмоциональное перенапря-
жение пациента во время операции.
Шок начинается с болей в животе и
тошноты, падения артериального дав-
ления. При таких осложнениях прово-
дят реанимационные мероприятия,
внутривенно вводят гидрокортизон.
С. Misch [121] считает, что результа-
ты пред- и послеоперационной лекар-
ственной терапии при местной ста-
бильности имплантата через 3 мес по-
сле операции и отсутствие периим-
плантита в дальнейшем убедительно
свидетельствуют об эффективности
операции у этих пациентов.
Сахарный диабет представляет со-
бой синдром хронической гиперглике-
мии и глюкозурии. Он является эндок-
ринно-обменным заболеванием, при
котором развивается абсолютная или
относительная инсулиновая недоста-
точность, приводящая к нарушениям
углеводного, белкового, жирового об-
мена и глубокой дезорганизации внут-
риклеточного метаболизма [3, 67, 87,
123]. Клиническая картина сахарного
диабета разнообразна. Болезнь может
развиваться самостоятельно или быть
симптомом других эндокринных забо-
леваний. Согласно рекомендациям ВОЗ
(1980), различают инсулиновый диа-
бет, инсулиннезависимый диабет, са-
харный диабет на почве недостаточно-
сти питания, вторичный диабет при
эндокринных заболеваниях, болезнях
поджелудочной железы и др. Сахарный
диабет протекает в легкой, средней тя-
жести и тяжелой форме и может быть
компенсированным, субкомпенсиро-
ванным и декомпенсированным.
В зубной имплантологии большинст-
во исследователей придерживаются
мнения о том, что при диабете поста-
новка имплантатов противопоказана
|35, 136]. Высказывается опасение, что
пациенты с сахарным диабетом являют-
ся группой риска при оперативных
вмешательствах в полости рта, так как
всегда имеется угроза общих осложне-
ний — комы [118, 1211.
По мнению!. Neary [124], пациенты
с диабетом подвергаются риску' не
только в ходе операции, но и в процес-
се приживления имплантата. Послед-
нее обусловлено нарушением микро-
циркуляции и хемотаксиса в зоне им-
плантат-кость, повышенной обсеме-
ненностью операционного поля ана-
эробными бактериями, а также тен-
денцией к нагноению. Кроме того, со-
стояние пациента с диабетом усугубля-
ется стрессом из-за операции, что уси-
ливает гормональные нарушения. Экс-
периментальные данные свидетельст-
вуют о возможности имплантации при
диабете. В этом убеждают и первые
клинические наблюдения авторов при
постановке имплантатов таким паци-
ентам [121].
J. Neary [124] указывает на возмож-
ность зубной имплантации при нетя-
желых формах диабета. Однако автор
предупреждает, что пациенты с сахар-
ным диабетом должны быть хорошо
подготовлены к остеотомии для поста-
новки зубного имплантата.
Поданным S. Sones и соавт. [135], в
современных условиях диабет "помо-
лодел": в большом проценте случаев
заболевание развивается в 10—30 лет,
причем в последние годы эта тенден-
ция прогрессирует. Кроме того, в хи-
рургической стоматологии нельзя ис-
ключать асимпто.мных, недиагностиро-
ванных случаев сахарного диабета. В
США, например, среди кандидатов на
зубную имплантацию с сахарным диа-
бетом у 5 % болезнь была диагности-
рована в связи с их обращением к сто-
матологам (117]. Кандидаты на им-
плантацию с избыточной массой тела,
со значительным слоем подкожной
жировой клетчатки в верхней полови-
не туловища (на лице, шее, плечевом
поясе, груди), а также те, у кого часто
возникают обострения гнойных забо-
леваний, должны быть направлены для
обследования к терапевту и эндокри-
нологу.
Пациенты с диабетом склонны к
развитию макро- и микроангиопатии с
нарушением функции почек, повыше-
нием артериального давления и тахи-
кардией. Нередко у них бывают при-
ступы стенокардии и развивается ин-
фаркт миокарда. При диабете, в том
числе при недиагностированных фор-
мах заболевания, такие моменты необ-
ходимо уточнить. Особенно тщательно
следует устанавливать местные показа-
ния к имплантации, поскольку альтер-
нативное ортопедическое лечение не-
эффективно.
Иногда из-за волнений на приеме
при обследовании у пациента может
развиться гипогликемия и он впадает в
кому (внезапный обморок). После ока-
зания срочной помощи и выведения
его из коматозного состояния рекомен-
дуется уточнить, принимал ли он перед
операцией пищу, антидиабетические
препараты, а затем направить его к эн-
докринологу. Если эндокринологдиаг-
ностирует легкую форму диабета и раз-
решает имплантацию, то можно вы-
полнить оперативное вмешательство I
степени сложности в условиях поли-
клиники и строго индивидуально II
степени сложности — в стационаре или
поликлинике с дневным стационаром.
В том и другом случае операции долж-
ны предшествовать тщательная подго-
товка и профилактика гипергликемии.
Седативную подготовку' и обычный курс
антидиабетического лечения с контро-
лем содержания глюкозы в крови и мо-
че рекомендуется проводить до насту-
пления ночи перед операцией. В день
выполнения вмешательства больной
Должен принять внутрь только утрен-
нюю дозу. Инъекции инсулина следует
Продолжать и только в день операции
снизить обычную дозу на */2 или 1/з-
Обязателен легкий завтрак или введе-
ние раствора, содержащего глюкозу. Во
время операции рекомендуется поддер-
живать глюкозу на уровне 5,5—
11 ммоль/л.
По данным Т.Г. Робустовой и
В.С. Стародубцева [37], плановые сто-
матологические операции у больных
сахарным диабетом следует выполнять
в условиях стационара после консуль-
тации с эндокринологом и корриги-
рующей терапии. Авторы использовали
простой инсулин и поддерживали уме-
ренную гипергликемию. Наиболее аде-
кватным было снижение уровня глю-
козы в крови до 6,66—7,77 м.моль/л.
Если он был выше 8,32 ммоль/л, то
вводили 10 ЕД инсулина на каждые
лишние 2,77 ммоль/л глюкозы каждые
8 ч. При содержании глюкозы в моче
свыше 2 % вводили 20 ЕД инсулина,
при 1—2 % — 15 ЕД, при 0,5—1 % —
10 ЕД каждые 4—8 ч. За 1 — 1,5 ч до опе-
рации больному внутривенно вводили
концентрированный раствор глюкозы
(1 г глюкозы на I ЕД инсулина).
Учитывая, что у больных диабетом
повышена чувствительность к нарко-
тическим лекарственным веществам и
ганглиоблокаторам, угнетающим ды-
хание, перед операцией лучше назна-
чать антигистаминные средства, атро-
пин и промедол в половинной дозе.
Операции проводят под местной про-
водниковой и инфильтрационной ане-
стезией с адреналином (не более
1:100 000), что обеспечивало хорошее
выключение ветвей тройничного нерва
и его мелких рецепторов [37]. Е.В. Зо-
рян и соавт. [19] при хирургии у боль-
ных сахарным диабетом рекомендуют
использовать местноанестезирующие
средства без вазоконстриктора или со-
держащие такие сосудосуживающие
вещества, как вазопрессин или фили-
прессин. Такое ведение больных диа-
бетом может быть экстраполировано
на зубную имплантацию I—II степени
сложности.
Более сложная ситуация в ходе им-
плантационной хирургии может воз-
никнуть при нарушении приема диабе-
тических препаратов и пищи, при
стрессовой ситуации, связанной с вол-
нением пациента. В таких случаях раз-
вивается коматозное состояние или
обморок. У отдельных больных этому
могут предшествовать усиление жаж-
да, полиурия, тошнота, иногда рвота,
резкая слабость. Характерны бледность
и сухость кожных покровов и слизи-
стых оболочек, расслабление мышц,
глубокое дыхание (в выдыхаемом воз-
духе запах ацетона), тахикардия, сни-
жение артериального давления.
При глубокой диабетической коме к
указанным симптомам присоединяет-
ся коллапс и сердечная недостаточ-
ность, а иногда картина острого живо-
та. В таких случаях следует прекратить
операцию и оказать пациенту срочную
помощь. Ему вводят необходимое ко-
личество инсулина (40—50 ЕД внутри-
венно и 40—50 ЕД подкожно) и раство-
ры электролитов (1,5—3 л раствора на-
трия хлорида в сочетании с раствором
калия хлорида внутривенно). После оп-
ределения уровня глюкозы в крови вво-
дят лекарственные препараты — глю-
козу, сердечные гликозиды, инсулин,
солевые растворы. Во всех случаях диа-
бетической комы больной должен быть
немедленно госпитализирован в реа-
нимационное отделение.
Вместе с тем следует иметь в виду,
что пациенты, принимающие стероид-
ные препараты при диабете, тирео-
токсикозе, более восприимчивы к ин-
фекции [88, 128]. В таких случаях все-
гда существует опасность неприживле-
ния имплантата [136], поэтому в по-
слеоперационном периоде проводят
более массивную антибактериальную
терапию.
У женщин нарушения функций эн-
докринной системы и диабет могут на-
блюдаться в климактерическом перио-
де. Таких пациенток следует готовить к
зубной имплантация с учетом их пси-
хоэмоционального состояния. Особое
внимание при этом обращают на седа-
тивную подготовку и местную анесте-
зию, чтобы обеспечить безболезнен-
ность операции.
Болезни костей. При заболеваниях
эндокринной системы часто наблюда-
ется поражение костей, что отражается
на результатах зубной имплантации [3,
50, 130, 132]. В организме человека
около 99 % кальция содержится в кос-
тях и зубах и на метаболизм кальция
непосредственно влияет его содержа-
ние. В норме в юношеском возрасте
масса кости увеличивается и к 30—40
годам достигает пика. Этот процесс бо-
лее выражен у мужчин и значительно
меньше — у женщин. С возрастом ко-
личество кости уменьшается. У жен-
щин в первые 3—10 лет после менопау-
зы происходит максимальная потеря
кости. К 80 годам потеря кости у жен-
щин составляет 40 %, у мужчин —
27 %. Остеопороз всегда более выражен
у худых пациентов, чаше в возрасте
старше 60 лет, при низком содержании
кальция в пище и у курильщиков [97].
Костная ткань челюстей активно
реагирует на системные нарушения
кости, связанные с кальцием [36, 125].
Важную роль в регулировании обмена
кальция в организме человека играет
паратиреоидный гормон. Кроме того,
на содержание внеклеточного кальция
влияют витамин D, простагландины,
лимфоциты (через остеокластные ак-
тивные факторы), инсулин, глюкокор-
тикоиды, эстрогены. Особенно велико
значение простагландинов при остео-
интеграции имплантата в кости, по-
скольку он, действуя как локальный
фактор, может вызвать остеолизис кос-
ти, гиперкальциемию и костную атро-
фию вокруг имплантата [73].
В отсутствие эстрогена остеопороз
усиливается. Все виды остеопороза^
проявляются и в других костях скелета.
Снижение количества эстрогенов, вы-
званное различными причинами (вто-
ричная аменорея, овариэктомия, по-
стменструальный период), проявляет-
ся уменьшением минеральной насы-
щенности костей. По данным эхогра-
фии, в костной ткани челюстей снижа-
ется скорость распространения ультра-
звука [Хохлова Е.Ю., 1995]. В области
челюстей остеопороз более значитель-
но поражает губчатое вещество кости И
в меньшей мере — кортикальное. Кор-
тикальное вещество уменьшается, и
пластинка его кости становится тонь-
ше. Масса губчатого вещества умень-
шается более значительно, кость ста-
новится более рыхлой, усиливается ее
минерализация [100].
У пациентов с остеопорозом атро-
фия кости происходит как при нали-
чии зубов, так и в отсутствие их. У жен-
щин, которые в возрасте 50 лет имели
все зубы, к 60 годам при остеопорозе
оставалось только 44 % зубов. Между
тем пациентки такого же возраста, не
страдающие остеопорозом, за указан-
ный период теряли только 15 % зубов.
Это обстоятельство следует иметь в ви-
ду при имплантации в беззубую че-
люсть, когда остеопорозом поражена
преимущественно губчатая кость и
опорой имплантата может служить
только кортикальная пластина [ 140|.
Немаловажное значение для им-
плантации при остеопорозе имеют за-
болевания пародонта [20, 84, 88]. От-
мечена прямая корреляция болезней
пародонта и остеопороза челюстей.
Частота и тяжесть поражения пародон-
та у больных с остеопорозом выше.
Кроме того, поражение пародонта мо-
жет быть симптомом одного из идио-
патических общих заболеваний, при
которых развивается прогрессирую-
щий лизис тканей пародонта. Следует
обращать внимание на такие симпто-
мы, как: 1) разрушение всех тканей па-
родонта, в том числе кости челюстей с
выпадением зубов в короткие сроки
(2—4 года); 2) быстрое образование па-
родонтального кармана с гноетечени-
ем и дистопия зубов; 3) быстрый и
прогрессирующий остеолизис с пол-
ным растворением кости [20].
Указание на такие процессы в челю-
стных костях, как эозинофильная гра-
нулема, болезнь Легера—Зиве, син-
дром Папийона—Лефевра, всегда не-
благоприятно для зубной импланта-
ции. При обнаружении остеопороза
имплантация не показана, так как при
остеотомии есть опасность перелома
челюстей [89]. Кроме того, при расса-
сывании костного вещества могут соз-
даться неблагоприятные условия для
остеоинтеграции имплантата, а во вре-
мя его функционирования убыль кост-
ной ткани за счет остеопороза и самой
операции может привести к тому, что
количество кости вокруг поставленной
конструкции будет неадекватным.
Стоматолог должен уточнить анамнез
и клинические симптомы остеопороза,
з затем направить больного к специа-
листу' для обследования и лечения.
Наиболее современными методами
оценки состояния костей являются ден-
ситометрическое исследование (опреде-
ление плотности кости), одно- и двух-
фотонная адсорбциометрия, количест-
венная компьютерная томография,
ультразвуковая остеодентоситометрия'
Выявление нормы, остеопении (сниже-
ние массы костной ткани), остеопороза
или тяжелого остеопороза позволяет
установить показания к имплантации.
Кроме того, диагностическим тестом
является определение уровня остео-
кальцина в сыворотке крови, кальция и
фосфора в крови и моче.
Л.Б. Лазебник [23] считает, что у па-
циентов, склонных к остеопорозу, сле-
дует проводить профилактику даль-
нейшей потери кости (лечебная физ-
культура, сбалансированное питание с
адекватным количеством кальция,
особенно в виде добавок в пишу его
таблетированных форм). Нормальное
потребление кальция должно состав-
лять 800 мг в сутки. У женщин в пост-
менструальный период поддержание
уровня кальция обеспечивается посту-
плением его в количестве 1500 мг в су-
тки. Вместе с тем С. Misch [121] указы-
вает, что в США среднее потребление
кальция составляет 450—550 мг. Мы не
смогли отметить восстановление кости
после рекомендуемого лечения. По-
видимому, в приведенных публикаци-
ях речь идет только о создании устой-
чивого равновесия кальция в кости и
профилактике дальнейшей атрофии
кости [105, 140].
С целью выявления остеопороза при
стоматологическом обследовании сле-
дует обращать внимание на лиц с не-
однократными переломами костей, ху-
дых и астеничных, принимающих экс-
трогенные гормональные препараты,
женщин в постменструальном перио-
де, лиц пожилого возраста, пациентов
с заболеваниями пародонта [89].
При зубной имплантации необходи-
мо учитывать и другие заболевания кос-
тей: остеомаляцию (размягчение кос-
тей), костную болезнь Педжета, гипер-
трофическую остеоартропатию, кото-
рые также должны входить в группу
риска при зубной имплантации. В слу-
чае обнаружения остеомаляции необхо-
димо исключить такие факторы, как де-
фицит витамина D, особенно у вегета-
рианцев, недостаточное ультрафиоле-
товое облучение пациентов пожилого
возраста, заболевания тонкой кишки,
печени, операции на них, нарушаю-
щие всасывание витамина D, недоста-
ток в организме неорганического фос-
фора вследствие заболеваний почек,
системных заболеваний соединитель-
ной ткани — синдрома Шегрена, мие-
ломной болезни [134, 135). При рент-
генологическом и лабораторном выяв-
лении остеомаляции имплантацион-
ная хирургия не показана. По мнению
Е. Salvati (1984), грубые изменения
губчатой кости и периостальное утол-
щение кортикальной пластины препят-
ствуют адекватному восприятию и по-
следующему функционированию им-
плантата, что делает имплантацию
противопоказанной.
Костная болезнь Педжета также яв-
ляется противопоказанием к импланта-
ции. Несмотря на то что деформация
челюстей, как указывает D.McGonsar
[ПО], создает большие трудности для
ношения протезов, перспектив для при-
живления имплантата мало из-за пато-
логической перестройки кости. Кроме
того, имплантация может спровоциро-
вать развитие остеосаркомы [1211. Та-
ким образом, при обнаружении остео-
пороза или других поражений костей
имплантация не показана, поскольку
при остеотомии есть опасность перело-
ма [61]. Кроме того, рассасывание кост-
ного вещества может создавать неблаго-
приятные условия для остеоинтеграции
имплантата, а во время его функциони-
рования в связи с остеопорозом коли-
чество кости вокруг поставленной кон-
струкции еше более убывает.
Нарушение секреции желудочно-ки-
шечных гормонов. К заболеваниям, свя-
занным с нарушением секреции желу-
дочно-кишечных гормонов, относятся
гастринома, глюкагонома, соматоста-
тинома, синдром Вернера—Моррисо-
на и др. Эндокринные клетки желудоч-
но-кишечного тракта вызывают нару-
шения функции гормонов APUD-сис-
темы, в том числе в виде образования
гастроинтестинальных эндокринных
опухолей. При этих заболеваниях зуб-
ная имплантация не показана в связи
как с общими нарушениями и бласто-
матозным ростом опухолей, так и с та-
кими симптомами в стоматологическом
статусе, как хейлит, стоматит, глоссит.
4.6. Оценка органов пищеварения
При зубной имплантации необходимо
учитывать состояние пищеварительной
системы. Среди болезней органов пи-
щеварения следует различать воспали-
тельные заболевания пищевода, желуд-
ка, двенадцатиперстной, тонкой и тол-
стой кишки, печени, желчного пузыря
и желчных путей, поджелудочной же-
лезы, а также заболевания, связанные с
нарушением анатомии и функции этих
органов. Больным с такими воспали-
тельными заболеваниями, как эзофа-
гит, язва пищевода, хронический гаст-
рит, дуоденит, хронический энтерит,
хронический колит, хронический гепа-
тит, хронический панкреатит, необхо-
дима длительная терапия, осуществ-
ляемая гастроэнтерологом. Импланта-
ция может быть произведена после из-
лечения и реабилитации.
Пациентам с врожденными наруше-
ниями функций органов пищеварения
показаны специальные исследования.
Принципиальных противопоказаний к
имплантации нет, но лишь при усло-
вии восстановления функции и отсут-
ствия других пороков развития.
Аллергические заболевания желу-
дочно-кишечного тракта (аллергиче-
ские энтеропатии, иммунодефицитные
поражения кишечника и др.) являются
противопоказанием к имплантации.
4.6.1. Воспалительные
заболевания органов пищеварения
Такие болезни являются противопока-
занием к зубной имплантации. Необхо-
димы лечение и полная реабилитация.
После выздоровления пациента можно
вернуться к рассмотрению вопроса о
зубной имплантации. Заболевания, вы-
званные нарушениями анатомии и
функции органов пищеварения, долж-
ны быть оценены специалистом. После
обследования решают вопрос о воз-
можности зубной имплантации. Ряд
заболеваний создают порочный круг в
организме, когда вовлеченными в за-
болевание могут быть несколько орга-
нов и систем, что однозначно является
противопоказанием к зубной имплан-
тации.
Эзофагиты и пептические язвы так-
же являются воспалительными заболе-
ваниями пищевода, при которых им-
плантация показана только после вы-
здоровления.
4.6.2. Заболевания органов
пищеварения, вызванные
их анатомическими особенностями
Ахалазия кардии. Это и подобные за-
болевания представляют определен-
ную опасность во время операций в
полости рта, в том числе при зубной
имплантации. При нарушении глота-
ния, рвоте, скоплении пищи в пище-
воде операция может осложниться по-
паданием содержимого пищевода в
дыхательные пути, развитием удушья,
сильным приступом кашля. Таким
больным можно производить имплан-
тацию I и II степени сложности с уче-
том возможности указанных осложне-
ний. Время операции максимально со-
кращается.
Эзофагоспазм, выражающийся в на-
рушении перистальтики и спастиче-
ском сокращении пищевода, не явля-
ется противопоказанием к зубной им-
плантации. Однако пациенты с такими
заболеваниями, как правило, склонны
к психоэмоциональным стрессам, вол-
нению, переживанию. Вопрос о зубной
имплантации и подготовке к ней сле-
дует решать с учетом психоэмоцио-
нального состояния пациента.
Дивертикул пищевода, представляю-
щий собой выпячивание его стенки, не
является противопоказанием к зубной
имплантации. Однако следует пом-
нить, что при дивертикуле пищевода
возможны и другие патологические из-
менения органов пищеварения, поэто-
му пациент должен быть обследован
специалистом.
4.6.3. Заболевания, вызванные
нарушением функций органов
пищеварения
Функциональные расстройства желудка.
Нарушения секреторной и двигатель-
ной функций желудка должны быть
оценены специалистом. Лечение сле-
дует проводить в зависимости от формы
поражения. Восстановление нормаль-
ной деятельности желудка позволяет
положительно решать вопрос о зубной
имплантации. Следует отметить, что у
таких пациентов заболевание может
быть связано с вредными привычками;
курением, злоупотреблением алкого-
лем, кофе. Кроме того, у этих больных
нередко наблюдается лабильность пси-
хики. Все эти факторы должны быть
оценены перед зубной имплантацией.
Хронический гастрит. Этим терми-
ном обозначают различные по этиоло-
гии и патогенезу заболевания. При ре-
шении вопроса о возможности зубной
имплантации основными критериями
являются результаты лечения, длитель-
ная ремиссия, а также отсутствие дис-
пепсических явлений. Следует иметь в
виду, что больные гастритом часто
имеют вредные привычки (курение,
прием алкоголя), что неблагоприятно
для имплантации. Нередко хрониче-
ский гастрит сочетается с другими за-
болеваниями желудочно-кишечного
тракта.
Хронический дуоденит — воспаление
со структурной перестройкой слизи-
стой оболочки двенадцатиперстной
кишки. Подход к этому заболеванию с
точки зрения возможности зубной им-
плантации аналогичен таковому при
хроническом гастрите. Кроме того, эти
болезни часто сочетаются с другими бо-
лезнями желудочно-кишечного тракта.
Особую осторожность при решении
вопроса об имплантации следует про-
являть при указаниях в анамнезе на
кровотечения из двенадцатиперстной
кишки [21].
4.6.4. Язвенная болезнь
Язвенная болезнь желудка представля-
ет собой циклически протекающее за-
болевание с образованием язв в период
обострения. Для решения вопроса о
зубной имплантации следует учиты-
вать особенности этиологии язвенной
болезни, а именно наследственную
предрасположенность, нервно-психи-
ческие, алиментарные факторы, вред-
ные привычки и инфекцию. В случаях
недиагностированных форм язвенной
болезни при опросе пациентов в сто-
матологической клинике следует обра-
37S
щать внимание на боли, особенно по-
сле еды, диспепсические явления, из-
жогу- Особенно важно выявить такие
симптомы, как кровотечение, кровавая
рвота, черная окраска кала. В этих слу-
чаях пациента нужно направлять для
обследования к общим специалистам.
С учетом устранения причинных фак-
торов, результатов лечения и диспан-
серного наблюдения специалист реша-
ет вопрос о возможности зубной им-
плантации.
Эрозии желудка и двенадцатиперст-
ной кишки, являющиеся поверхност-
ными дефектами слизистой оболочки
желудка и двенадцатиперстной кишки,
характеризуются острым и хрониче-
ским течением. Они могут развиваться
в результате приема лекарств, алкоголя,
а также при других заболеваниях желу-
дочно-кишечного тракта. Определен-
ное значение в развитии эрозий имеет
воспалительный компонент. Острые
эрозии должны быть излечены, а при-
чины, вызвавшие их, устранены. Про-
изводить имплантацию затем можно
только в отсутствие воспаления. Хро-
нические эрозии часто сочетаются с
другими заболеваниями желудочно-
кишечного тракта. Решать вопрос о
зубной имплантации следует при ком-
плексной оценке болезней.
Симптоматические гастродуоденаль-
ные язвы представляют собой язвен-
ный дефект в желудке или двенадцати-
перстной кишке, возникший вследст-
вие стресса, воздействия лекарствен-
ных препаратов, а также как проявле-
ние других заболеваний внутренних
органов и эндокринной системы.
Симптоматические язвы принципи-
ально отличаются от язвенной болезни
как по этиологии и патогенезу, так и
по клинической картине. Характерные
боли, изжога, тошнота, желудочные
кровотечения возникают при приеме
лекарств, особенно ацетилсалицило-
вой кислоты, кортикостероидов, или в
стрессовой ситуации и сочетаются с
симптомами других заболеваний внут-
ренних органов [21J. Вопрос об им-
плантации при симптоматических яз-
вах можно обсуждать только после из-
лечения язвы и обязательно с учетом
других заболеваний.
Болезни оперированного желудка. В
практике врача-стоматолога могут на-
блюдаться случаи, когда в анамнезе
имеются указания на операцию на же-
лудке и двенадцатиперстной кишке, а
также отмечаются симптомы наруше-
ния их функций. Среди этих болезней
следует выделить постваготомические
синдромы, например дисфагию, по-
скольку в таких случаях повышена
опасность рвоты во время операции.
4.6.5. Болезни кишечника
Среди заболеваний кишечника разли-
чают болезни тонкой и толстой кишки.
При зубной имплантации следует
иметь в виду прежде всего процессы,
связанные с инфекцией (хронический
энтерит и колит, глистные и лямблие-
вые инвазии), болезни аллергической
природы (аллергические энтеропатии),
а также иммунодефициты. При всех
этих поражениях имплантация не по-
казана. При легких и средней тяжести
воспалительных заболеваниях после
лечения можно вернуться к вопросу об
имплантации, в других случаях эта
операция больным противопоказана.
Следует учитывать, что у пациентов с
заболеваниями тонкой кишки могут
возникать поражения, связанные с
ВИЧ-инфекцией. Больных с хрониче-
ской диареей, лихорадкой, снижением
массы тела нужно обследовать на
ВИЧ-инфекцию.
При болезнях органов пищеварения
подготовку пациентов проводят седа-
тивными средствами. Выбор препара-
тов и их количество определяет психо-
эмоциональный статус пациента. Опе-
рацию выполняют только натощак.
Предварительно определяют прогром-
биновое время. Оперативное вмеша-
тельство I степени сложности осущест-
вляют в поликлинике, II и III степени —
в стационаре или в поликлинике с
дневным стационаром. Во время опе-
рации и после нее обязателен контроль
гомеостаза. Выбор анестетиков доста-
точно широкий, но концентрация со-
судосуживающих средств в растворе
должна составлять 1:100 000. После
операции может потребоваться под-
кожное введение витамина К или внут-
ривенное введение 10 мл 10 % раствора
кальция хлорида.
4.6.6. Болезни печени, желчного
пузыря и желчных путей
Заболевания печени, желчного пузы-
ря, желчных путей различны по этио-
логии и патогенезу.
Заболевания печени чаше бывают
вирусной, алкогольной или лекарст-
венной этиологии [46]. Зубная им-
плантация при них не показана, что
обусловлено как наличием активного
воспаления в организме, так и значи-
тельным нарушением иммунитета [64,
65]. К вопросу об операции можно вер-
нуться после наблюдения у специали-
ста, излечения или стабилизации про-
цесса.
Особое внимание следует уделять
пациентам с заболеваниями печени. В
90 % случаев наблюдаются вирусные,
алкогольные и лекарственные гепати-
ты [46]. При вирусном гепатите необ-
ходимо уточнить возможность нарко-
мании, гомосексуальных отношений,
что должно быть основанием для отка-
за от имплантации. Аутоиммунный
хронический активный гепатит и алко-
гольный цирроз печени также являют-
ся противопоказанием к имплантации.
Не следует планировать имплантацию
у больных лекарственным гепатитом.
При доброкачественных пигментных
гепатозах и ферментопатических ги-
пербилирубинемиях после лечения у
специалистов имплантация может
быть произведена.
После вирусных, а иногда и алко-
гольных гепатитов часто развивается
хронический гепатит. У таких больных
замедлено заживление тканей, повы-
шена опасность осложнений, а в слу-
чае рецидива воспаления вирусной
природы велика опасность развития
Цирроза печени. Кроме того, как пра-
вило, их лечат кортикостероидами. Все
это служит основанием для отказа от
имплантации. Не показана импланта-
ция также больным холециститом, осо-
бенно в активной форме, и с проявле-
ниями постхолецистэктомических син-
дромов. При хороших результатах реа-
билитации после медикаментозного
или хирургического лечения холеци-
стита имплантацию можно выполнять
в том случае, когда общий специалист
Дает разрешение.
Обследуя пациентов на предмет им-
плантации, нужно помнить о недиа-
гностированных хронических формах
этих заболеваний. Такие процессы
всегда имеют вирусную этиологию или
же связаны со неупотреблением алко-
голем [75]. При решении вопроса о
зубной имплантации в случаях бес-
симптомных и недиагностированных
форм хронического гепатита следует
обращать внимание на желтушное ок-
рашивание кожи, склер, слизистых
оболочек, телеангиэктазии кожи в ви-
де сосудистых звездочек, а также на
наличие в анамнезе носовых кровоте-
чений. Кроме того, при высоком ин-
дексе прогромбинового комплекса,
увеличении времени кровотечения
нужно исключить не только болезни
кроветворной системы, но и хрониче-
ский гепатит.
Оценка болезней печени должна
быть дифференцированной. В допол-
нение к клиническому обследованию
необходимо определять протромбино-
вое время. Пациентов с небольшими
отклонениями этого показателя от
нормы можно относить к группе мало-
го риска и производить им импланта-
цию I—III степени сложности. При не-
значительном увеличении протромби-
нового времени и умеренном повыше-
нии уровня билирубина в крови паци-
ента следует включать в группу средне-
го риска и направлять к специалисту.
Если последний дает разрешение, то
производят операцию I степени слож-
ности под контролем гомеостаза. Та-
ким пациентам имплантационная хи-
рургия II и Ill степени сложности мо-
жет проводиться только в условиях
стационара [114]. При большом про-
тромбиновом времени (в 1,5 раза боль-
ше нормы) и тромбоцитопении паци-
енты входят в группу большого риска и
имплантация им противопоказана.
Операцию не следует производить так-
же пациентам, злоупотребляющим ал-
коголем, особенно при поражении пе-
чени [Американская академия зубной
имплантации, 1978].
Седативная подготовка и обезболи-
вание обычные. Во время имплантации
должны быть предусмотрены все меры
профилактики вирусной инфекции
(двойные перчатки, очки, утилизация
227
использованного материала, специаль-
ная обработка инструментов).
Циррозы печени. При этих заболева-
ниях зубная имплантация противопо-
казана. Поражения печени чаше всего
являются следствием вирусного гепа-
тита В или хронической интоксикации
алкоголем [75]. Глубокие нарушения
иммунитета снижают эффективность
зубной имплантации, а во время опе-
рации возникает опасность несверты-
вания крови.
Холециститы (острые и хрониче-
ские) представляют собой группу забо-
леваний, чаше развивающихся на фоне
желчнокаменной болезни. Если холе-
цистит острый или наблюдается обост-
рение хронического заболевания, то
производить зубную имплантацию не
следует. Хронический процесс должен
быть оценен с точки зрения выражен-
ности воспаления и состояния имму-
нитета. При латентных формах желч-
нокаменной болезни, протекающей
без обострений, а также хороших по-
казателях деятельности других систем
организма и иммунитета возможна
зубная имплантация I—III степени
сложности. Премедикация и обезболи-
вание стандартные.
4.6.7. Болезни поджелудочной
железы
Такие заболевания как острый и хро-
нический панкреатит являются проти-
вопоказанием к зубной имплантации,
особенно в случаях интоксикации ал-
коголем, тяжелых проявлений желчно-
каменной болезни и других заболева-
ний желчного пузыря.
Из болезней поджелудочной железы
часто встречаются хронические пора-
жения ее (алкогольный панкреатит по
частоте занимает одно из первых мест).
Другие, как правило, связаны с другими
заболеваниями желудочно-кишечного
тракта, преимущественно с болезнями
желчного пузыря. Обнаружение в анам-
незе хронического панкреатита должно
быть основанием для более детального
обследования, главным образом общим
специалистом. У таких пациентов обна-
руживают ряд заболеваний, что не по-
зволяет делать имплантацию.
4.7. Оценка кроветворной
системы
Болезни системы крови относятся к
иммунопролиферативному синдрому и
признаны абсолютным противопока-
занием к зубной имплантации. Среди
гемобластозов принято рахтичать ост-
рые лейкозы, миело- и лимфопроли-
феративные опухоли, лимфомы, лейке-
моидные реакции, гистиоцитозы, мие-
лоднспластические синдромы, депрес-
сии гемопоэза, железодефицитные ане-
мии, пернициозные анемии, наследст-
венные гемолитические анемии, ди-
эритропоэтические анемии, порфирии,
метгемоглобинемии, геморрагические
диатезы [44, 45]. Именно эти заболева-
ния создают угрозу кровотечения во
время и после операции.
При обследовании пациентов важно
установить состояние кроветворной
системы, особенно ее недиагностиро-
ванных заболеваний.
Если в беседе с пациентом выявляют
имеющиеся у него гематологические
проблемы, реакции на переливание
крови, исследуют кровь. Внимательно
следует отнестись к легкому развитию
гематом при ушибах, отмстить наличие
кровотечений из носа, после удаления
зуба, а у женшин — также длительное
время менструации. В таких случаях
можно установить недиагностирован-
ные болезни кроветворной системы.
Опрашивая больного, уточняют семей-
ный анамнез (наличие кровотечений
или гематологических проблем у близ-
ких родственников). Что касается ле-
карственных препаратов, то следует
выяснить, принимал ли пациент аце-
тилсалициловую кислоту, нестероид-
ные противовоспалительные средства,
гепарин, по поводу каких заболеваний
они были назначены и какова длитель-
ность лечения ими. В таких случаях У
пациентов и с другими заболеваниями
могут возникать гематологические
проблемы, особенно в период коагуля-
цнонной терапии [139]. Все это должно
быть учтено при планировании зубной
имплантации.
Осматривая пациента, надо отметить
цвет конъюнктивы, слизистой оболоч-
ки полости рта, вил ногтевого ложа и ее
побледнение, цвет кожи, наличие на
ней петехиальной сыпи, телеангиэкта-
зий или кровоизлияний, что может ука-
зывать на скрытые нарушения в крове-
творной системе. Следует оценить ос-
новные лабораторные тесты — гемо-
грамму, время кровотечения и протром-
биновый индекс. При подозрении на
гематологическое заболевание больной
должен быть обследован у гематолога.
Согласно общему правилу, при бо-
лезнях системы крови имплантация
противопоказана. Операции на челю-
стях наиболее опасны при гемобласто-
зах — лейкозах и гематосаркомах, мие-
лопролиферативных и лимфопролифе-
ративных опухолях, лимфомах, миело-
диспластических синдромах, приобре-
тенных и наследственных гемолитиче-
ских анемиях. В случае язвенно-некро-
тических поражений слизистой обо-
лочки, увеличения лимфатических уз-
лов нужно обследовать больного на
острый или хронический лейкоз и дру-
гие перечисленные выше заболевания
кроветворной системы.
Зубная имплантация не показана
также при изменениях реактивного ха-
рактера в крови и органах кроветворе-
ния, развивающихся при рахтичных за-
болеваниях. Среди гематологических
заболеваний, относящихся к этой груп-
пе, наиболее часто встречаются инфек-
ционный мононуклеоз, инфекционный
лимфоцитоз, псевдобластные, миело-
идные и лимфоцитарные реакции. Од-
нако после адекватной терапии основ-
ного заболевания и при стабильных
показателях крови возможна имплан-
тация I, а иногда и 11 степени сложно-
сти. Такие поражения, как полиците-
мия, особенно при длительности бо-
лезни 5—10 лет, являются противопо-
казанием к имплантации.
Среди болезней кроветворной сис-
темы отдельную группу составляют де-
прессии гемопоэза, различные виды
анемий, геморрагические диатезы. По
мнению N. Coker и Р. Milner [65J, при
апластических анемиях, агранулоцито-
зе может быть проведена зубная им-
плантация небольшого объема (I сте-
пени сложности). При железодефи-
Питной пернициозной анемии им-
плантация возможна, но только после
Лечения основного заболевания и кор-
рекции нарушений кроветворной сис-
темы. Дефицит гемоглобина перед
операцией корригируют в тех случаях,
когда при анемиях его содержание ме-
нее 14 % у мужчин и менее 12,5 % у
женщин [116].
В ходе предоперационной подготов-
ки таких больных проводят лечение
антибактериальными препаратами, ис-
ключают прием ацетилсалициловой
кислоты, гепарина и других антикоагу-
лянтных средств. Премедикацию на-
значают согласно данным психоэмо-
ционального статуса. Обезболивание
проводят с достаточной концентраци-
ей вазоконстриктора в анестетике. В
послеоперационном периоде продол-
жают терапию антибиотиками и с це-
лью профилактики вторичного инфи-
цирования следят за гигиеной полости
рта [99].
Западные клиницисты предупреж-
дают о возможности кровотечения у
таких пациентов во время операции,
послеоперационного отека значитель-
ной выраженности и воспаления. При
анемии губчатая кость становится рых-
лой и теряет более 40 % массы, что от-
рицательно сказывается на начальной
стабильности имплантата [76].
4.8. Оценка ЛОР-органов
Для предстоящей имплантации необ-
ходимо знать, имеются ли очаги ин-
фекции в полости носа, околоносовых
пазухах, ушах, глотке, гортани, по-
скольку воспалительные процессы в
близлежащих к полости рта органах
могут осложнить как саму операцию,
так и приживление имплантата [120].
Особенно тщательно нужно обследо-
вать верхнечелюстную пазуху [141]. В
случае обнаружения очагов инфекции
в ЛОР-органах имплантация может
быть произведена только после их са-
нации [90].
При обследовании полости рта необ-
ходимо определить взаимоотношение
мягкого неба, миндалин, тонус мышц.
При увеличении миндалин и язычка
мягкого неба следует уточнить наличие
храпа и апноэ во время сна. Симптомы
храпа и сонного апноэ сопоставляют с
состоянием сердечно-сосудистой сис-
темы и мозгового кровообращения и
при необходимости консультируют па-
циента у сонолога.
4.9. Оценка органа зрения
При наличии таких заболеваний, как
глаукома, сосудистые нарушения с из-
менениями глазного дна и резкой по-
терей зрения, необходимы консульта-
ция офтальмолога и его разрешение на
операцию. Воспалительные заболева-
ния глаз и их придатков инфекцион-
ной, аллергической природы являются
противопоказанием к зубной имплан-
тации. После лечения воспалительного
процесса и устранения аллергического
состояния возможна имплантация I—
III степени сложности. В случае глау-
комы следует корригировать лекарст-
венную терапию, чтобы во время опе-
рации исключить повышение внутри-
глазного давления и развитие острого
приступа болезни. В комплекс препа-
ратов для подготовки к операции не
следует включать атропин и другие М-
холиноблокаторы [19]. Не рекоменду-
ется вместе с раствором анестетика
вводить препараты группы катехол-
аминов. Имплантацию предпочтитель-
нее проводить, используя в качестве
анестезии 3 % мепивакаина или 4 %
раствор прилокаина с вазопрессином
или фелипрессином.
4.10. Оценка нервной системы
При сосудистых заболеваниях голов-
ного мозга решение о возможности
имплантации и ее объеме принимают
после обследования и заключения нев-
ропатолога. В число противопоказаний
к зубной имплантации входят неврал-
гии и невропатии тройничного, языко-
глоточного, позвоночного нервов, по-
ражения лицевого нерва различной
этиологии, инфекции и интоксикации
нервной системы.
Следует иметь в виду, что пораже-
ния нервной системы часто возникают
вследствие соматических заболеваний,
преимущественно эндокринной систе-
мы. В таких случаях вопрос об имплан-
тации, се объеме и подготовке к опе-
рации решают невропатолог и эндо-
кринолог.
Ряд заболеваний нервной системы
связан с генетическими дефектами —
хромосомными синдромами и другими
наследственными болезнями. Пациен-
ты с такими заболеваниями являются
плохими кандидатами для импланта-
ции, поэтому перед операцией целесо-
образно получить заключение невро-
патолога и генетика.
Перед зубной имплантацией, осо-
бенно у пожилых пациентов, следует
проводить профилактику острых нев-
рологических состояний, которые мо-
гут возникнуть во время операции. Па-
циентам этой группы риска с целью
анестезии следует вводить растворы
малой концентрации без катехолами-
нов, исключать попадание анестетика
в сосуды. Наиболее тяжелыми наруше-
ниями мозгового кровообращения яв-
ляются гипертонический криз и ин-
сульт мозга. Симптомами острого ги-
пертонического криза и инсульта мо-
гут быть резкая головная боль, голово-
кружение, тошнота, рвота, сонливость
или психомоторное возбуждение, со-
порозное состояние, иногда потеря
сознания. Возможны также очаговые
неврологические симптомы: преходя-
щие парестезии, парезы, нарушение
зрения, дискоординация движений. В
таких случаях операцию следует пре-
кратить, начать введение спазмолити-
ческих и гипотензивных препаратов
под контролем артериапьного давле-
ния и пульса. Возможность продолже-
ния и завершения операции определя-
ет общий специалист в зависимости от
эффекта экстренной помощи.
Сосудистая патология мозга может
проявляться в виде зрительных и глаз-
ных двигательных рефлексов, вестибу-
лярных нарушений, причем отдельные
нарушения могут возникать за счет
особенностей статики и динамики го-
ловы и шеи при манипуляциях в стома-
тологическом кресле, когда при запро-
кидывании головы, наклонах и поворо-
тах ее происходит компрессия позво-
ночных артерий, а также подключич-
ных, сонных артерий [Верещагин Н.В.,
1997]. Для предупреждения развития
сосудистых нарушений во время им-
плантации следует расспросить паци-
ента о таких симптомах при повороте
головы, ее запрокидывании. В одних
случаях следует провести обследование
у невропатолога, в других — контроли-
ровать положение головы в стоматоло-
гическом кресле и иммобилизировать
шею на период вмешательства.
У пациента следует уточнить, не бы-
вает ли у него припадков, которые мо-
гут быть связаны с эпилепсией. В таких
случаях заключение о необходимости
имплантации, ее объеме и подготовке
решает специалист.
В случае, если в анамнезе у пациента
имеется указание на эпилептические
припадки, он должен получить разре-
шение невропатолога на имплантацию,
а также указания относительно реко-
мендуемого объема операции и усло-
вий ее проведения (поликлинические
или стационарные). Имплантацию I
степени сложности проводят в поли-
клинике, II степени сложности — в ста-
ционаре или поликлиническом днев-
ном стационаре. Операции III степени
сложности должны быть тщательно
"выверены" как с точки зрения причин,
клиники эпилепсии, так и необходимо-
сти имплантационной хирургии.
С. Misch [121] считает, что при ле-
ченой эпилепсии, когда в течение не-
скольких лет не было припадков, им-
плантационная хирургия I и II степени
сложности может проводиться в усло-
виях поликлиники и III степени слож-
ности — в стационаре. Пациентов с
припадками 1 раз в месяц, по мнению
этого автора, следует относить к группе
повышенного риска и операции им
противопоказаны или делаются только
по жизненным показаниям. Обследова-
ние пациентов с эпилепсией перед пла-
новыми имплантационными вмеша-
тельствами, оценка характера эпилеп-
сии (наличие генерализованных или
очаговых припадков) имеет особое зна-
чение для оценки личности больного и
правильной мотивации предстоящего
лечения. Следует иметь в виду, что у
больных эпилепсией наступает сниже-
ние памяти, приобретаются эпилепти-
ческие черты характера, в том числе де-
прадация личности.
В ходе оперативного вмешательства
У пациентов могут возникать судорож-
ные припадки (эпилепсия). В припад-
ке пациент теряет сознание, начина-
ются судороги клонико-тонического
характера, появляется тахикардия. В
таких ситуациях очень важно исклю-
чить аспирацию крови, хирургическо-
го материала. Принимаются все меры
для скорейшего выведения его из при-
падка. Если приступ кратковременный
и объем имплантационной хирургии
небольшой, то операцию можно за-
кончить после медикаментозной под-
готовки больного седативными средст-
вами и проведения надежной местной
анестезии, предпочтительно препара-
тами группы артикаина. В комплексе
хирургического инструментария всегда
должен быть роторасширитель для
профилактики прнкусывания языка во
время припадка. При длительном при-
падке отмечаются стойкое нарушение
гемодинамики, плохое общее самочув-
ствие и неадекватность сознания. В
этих случаях операцию прекращают и,
вызвав бригаду скорой помощи, боль-
ного госпитализируют.
Больным с нарушением мозгового
кровообращения, частыми церебраль-
ными кризами, после инсульта им-
плантация не показана.
Пациенты без органических измене-
ний мозга, но страдающие заболева-
ниями вегетососудистого характера,
также подлежат обследованию у невро-
патолога, который должен дать разре-
шение на имплантационную хирургию.
4.11. Оценка психической сферы
Для успешного хирургического лечения
важное значение имеют оценка психо-
эмоционального состояния пациента и
выявление его изменений. Для этого
следует оценить внешний вид пациен-
та, его ответы при выяснении жалоб и
сборе анамнеза, сведения о перенесен-
ных заболеваниях, отметить поведение
при осмотре челюстно-лицевой облас-
ти и полости рта. Важно установить,
что ждет пациент от лечения, нет ли
рассогласования между реальным со-
стоянием полости рта с точки зрения
функции и эстетики и ожидаемым ре-
зультатом операций с использованием
имплантатов. Необходимо обращать
внимание на личностные особенности
пациентов: повышенную возбудимость,
эмоциональность, склонность к теат-
ральности, повышенную мнительность.
У пациента должен быть в норме меха-
низм психологической зашиты, предот-
вращающий отрицательные моменты,
связанные с этапными хирургически-
ми манипуляциями при имплантации,
и длительными сроками лечения, в том
числе на ортопедическом этапе.
Согласно извлечения из Междуна-
родной статистической классифика-
ции болезней, травм и причин смерти
(10-й пересмотр, Женева, 1997], следу-
ет различать психические расстройства
и расстройства поведения (FOO— F99):
1. Психозы: а) психотические нару-
шения вследствие органических пора-
жений головного мозга; б) другие пси-
хозы (шизофренические, аффектив-
ные, параноидные состояния и другие
неорганические психозы) (FOO—F09,
F20-F29).
2. Невротические расстройства, пси-
хопатии и другие психические рас-
стройства непсихотического характера:
а) невротические расстройства, рас-
стройства личности, половые извраще-
ния и нарушения, хронический алкого-
лизм, наркомания и токсикомания,
злоупотребление лекарственными сред-
ствами. Нарушение физиологических
функций психогенной этиологии, спе-
цифические симптомы и синдромы
(заикание, тик, специфические нару-
шения сна, питания, энурез и др.), ост-
рые реакции на стресс (F10, F19, F93).
3. Умственная отсталость (F70 —
F79). Если психозы и умственная от-
сталость всегда являются противопо-
казанием к лечению с хирургическими
и ортопедическими этапами зубной
имплантации, то невротические рас-
стройства, психопатии и психические
нарушения непсихотического генеза
требуют специальных исследований,
консультаций психиатра, определения
возможности имплантационной хи-
рургии и ее объема.
А.Ф. Бизяев [8] среди психоэмоцио-
нальных реакций выделяет астениче-
скую, депрессивную, тревожную, ипо-
хондрическую, истерическую и считает
необходимой подготовку больных к
стоматологическим операциям. Асге-
ноневротическая реакция проявляется
ааа_____________________________
вегетативной лабильностью, головной
болью, повышенной утомляемостью,
раздражительностью, слехливостью.
Тревожно-депрессивная реакция ха-
рактеризуется подавленным настрое-
нием, больной насторожен, не уверен в
успехе лечения, немногословен. Про-
явления реакции выражаются в беспо-
койстве, волнении, страхе, плохом сне,
учашении пульса. Пациент опасается
неудачного исхода операции. При ипо-
хондрической реакции больной предъ-
являет много жалоб, детализирует их,
охотно соглашается на различные об-
следования. У таких больных большое
количество жалоб не соответствует па-
тологическим изменениям стоматоло-
гического статуса. Нередко у таких па-
циентов наблюдаются истерические ре-
акции, которые имеют такие вегетатив-
ные проявления, как "комок в горле",
нехватка воздуха, тремор пальцев рук,
появление красных пятен на коже лица
и шеи. Чаше истерические реакции на-
блюдаются у женщин.
При легкой форме вышеуказанных
реакций симптомы непостоянны и
существенных изменений в поведе-
нии пациента не наблюдается. Уме-
ренные формы реакций бывают по-
стоянными и выраженными. Для вы-
раженной формы реакций характер-
ны не только клиническая картина
тех или иных психоэмоциональных
расстройств, но и плохое контролиро-
вание поступков.
М.Г. Панин, Л.М. Берденштейн [31]
считают необходимым при восстано-
вительных операциях в челюстно-ли-
цевой области и сложном челюстно-
лицевом протезировании оценивать
психоэмоциональное состояние и вы-
деляют астеноневротический, тревож-
но-депрессивный, ипохондрический и
психоорганический синдромы; ими
разработаны дифференцированные
программы подготовки к операциям.
Однако в этих случаях, помимо кон-
ституционного состояния психической
сферы, на больных с дефектами и де-
формациями липа оказывает влияние
наличие врожденного или приобретен-
ного дефекта, усугубляющего наруше-
ния психики [31]. Поэтому предложен-
ная подготовка к восстановительным
операциям не может быть экстраполи-
рована на зубную имплантацию, хотя
следует учитывать, что функциональ-
ные и эстетические дефекты зубочелю-
стной системы также могут вести к из-
менениям психического состояния па-
циента.
Анализ стоматологической литера-
туры показывает, что внимание клини-
цистов преимущественно привлечено
к оценке психического статуса боль-
ных с дефектами и деформациями че-
люстно-лицевой области, когда врож-
денный порок или приобретенный де-
фект уже явились причиной травмы
психической сферы [31]. Друтие спе-
циалисты-стоматологи исследовали
адаптацию пациентов к процедурам,
связанным с протезированием, и пред-
ложили врачебную тактику с учетом
психического статуса больного. Вместе
с тем лечение с использованием внут-
рикостных имплантатов связано с
этапными хирургическими вмешатель-
ствами, длительными сроками ортопе-
дического лечения, что tpe6yeT оценки
и учета психической сферы пациента,
его правильного понимания и адапта-
ции лечебных процедур. Это приобре-
тает особую актуальность при имплан-
тационном лечении, так как его эф-
фективность в значительной степени
зависит от учета врачом индивидуаль-
ных особенностей больного, его пси-
хического статуса и психической инди-
видуальности.
При оценке функционального со-
стояния организма стоматологу бывает
трудно определить психическую "нор-
му”. На основании оценки лишь одной
грани — поведения пациента врач-сто-
матолог не может с достаточным осно-
ванием судить о нормальной или пато-
логической психической деятельности
человека. Вместе с тем привлекать во
всех случаях психиатра или психонев-
ролога стоматологу невозможно, а
иногда и неэтично. Имеющиеся у па-
циента или возникшие психические
нарушения усугубляются при неудач-
ном лечении методами терапевтиче-
ской и ортопедической стоматологии.
Возможность избавиться от комплекса
нарушений функции, эстетики метода-
ми протезирования с опорой зубных
протезов на имплантаты заставляет па-
циентов обращаться в стоматологиче-
ские лечебные учреждения для прове-
дения такого лечения.
Обычно для правильного отбора па-
циентов для имплантации в зависимо-
сти от психоэмоционального состоя-
ния врач выделяет пациентов, которые
имеют убедительную мотивировку не-
обходимости операции, готовы к мно-
гоэтапному и иногда длительному ле-
чению. Они знают о тех неудобствах,
которые им придется перенести до по-
лучения окончательного положитель-
ного результата. Характерно, что они
всегда доверяют врачу. Эта группа па-
циентов наиболее благоприятна в ка-
честве кандидата для имплантации.
Следует тщательно обследовать па-
циентов, которые все нарушения в их
зубочелюстной системе связывают с
"плохими" врачами. Они часто меняют
врачей, ходят по поводу имплантации
в различные лечебные учреждения.
Необходимо обращать внимание на
больных, которые преувеличивают
имеющиеся у них эстетический и функ-
циональный дефекты. Отказ в зубной
имплантации при отсутствии показа-
ний к ней вызывает у них нежелатель-
ную реакцию, они обращаются с жало-
бами в вышестоящие инстанции. На-
рушение психического состояния у ря-
да пациентов можно определить по по-
ведению при осмотре: они болтливы,
перебивают врача, у них наблюдается
фиксирование взгляда в одной точке
или, напротив, бегающий взгляд.
Следует воздержаться от импланта-
ции у пациентов, у которых выявлено
нарушение психоэмоционального со-
стояния, связанное со стрессом из-за
несчастья дома, трудностей на работе.
Всегда следует обращать внимание на
поведенческие характеристики боль-
ных: грубость с персоналом, больны-
ми, раздражительность, недовольство.
Вместе с тем наряду с общими соци-
альными факторами и соматическими
нарушениями организма у человека мо-
гут возникать пограничные расстрой-
ства психической сферы — неврозы, па-
тологическое развитие личности, крае-
вые психопатии.
Пациенты с такими психическими
нарушениями на основании рекламы,
информации о новых методах протези-
рования зубов с использованием им-
плантатов часто обращаются за таким
лечением, не представляя его возмож-
ностей, длительных сроков реабилита-
ции и не предвидя окончательных ре-
зультатов и риска развития осложне-
ний.
Специалистам, занимающимся та-
ким лечением, необходимо оценить
психоэмоциональное состояние, пока-
зания к лечению, возможность устра-
нения эстетических и функциональ-
ных нарушений другими, менее трав-
матичными и длительными по времени
методами лечения.
Для оценки психического статуса
рекомендуется пользоваться традици-
онным клиническим методом, состоя-
щим из подробной беседы с больным,
а иногда и с родственниками, исследо-
вания стоматологического статуса и
показаний к лечению с использовани-
ем имплантатов, а также знакомство с
медицинской документацией, в том
числе с результатами диагностических
исследований. На основании этих дан-
ных можно составить первое представ-
ление о личности пациента. Больные с
выявленными нарушениями психиче-
ского состояния подлежат дальнейше-
му исследованию.
Первые заключения стоматолога о
нарушениях в психической сфере под-
тверждают или отвергают комплекс-
ной оценкой тестов. Оценивая психи-
ческое состояние пациента и планируя
имплантацию, врач должен решить
следующие вопросы:
1) какие нарушения функции и эсте-
тики могут быть устранены при лече-
нии;
2) соответствие психического со-
стояния больного и объема, времени
лечения;
3) какой характер психологической
подготовки требуется на этапах лече-
ния.
В стоматологической практике сто-
матологу не всегда удается получить
квалифицированное заключение пси-
хиатра, а иногда направление к психи-
атру невозможно перед имплантацией
по этическим причинам. Поэтому при
предымплантационном обследовании
пациента стоматологу необходимо во
время беседы уточнить основные пато-
генетические моменты, при которых
проявляются психические болезни:
1) генетическую предрасположен-
ность к психическим заболеваниям;
2) нарушения функции мозга, кото-
рые развиваются при всех психических
заболеваниях;
3) особенности личности (застенчи-
вость, открытость, стремление к риску
и новизне или осторожность);
4) способность противостоять стрес-
совым воздействиям [2, 7].
При расспросе больного особое
внимание следует обращать на такие
проявления, как депрессия, тревож-
ность, стрессовое состояние. При об-
следовании перед имплантацией необ-
ходимо выяснить: 1) почему пациент
обратился по поводу имплантации зу-
бов, какое лечение для улучшения
функции и эстетики зубочелюстной
системы он проводил ранее; 2) при бе-
седе с пациентом необходимо создать
доверительные отношения с ним, про-
водить ее в спокойной, уютной обста-
новке; 3) оценить интеллект, уровень
сознания, контактность больного, от-
ношение к беседе (охотно отвечает на
вопросы, безразличен, насторожен, по-
дозрителен, агрессивен), особенности
речи (громкость, эмоциональная окра-
ска), настроение (спокойное, мрачное,
подавленное, унылое, печальное, тре-
вожное, испуг, безразличие, раздра-
женность, беспокойство), отношение
больного к своему состоянию (отсутст-
вие критики всегда типично для пси-
хического заболевания); 4) обращать
внимание на тип телосложения (гипер-
стенический, астенический), как одет
больной (если пациент одет неопрят-
но, можно предположить депрессию),
нет ли у него видимых физических не-
достатков, в том числе в челюстно-ли-
цевой области; 5) фиксировать двига-
тельную сферу: позу, походку, гипер-
кинезы, выражение лица (напряжен-
ное, испуганное, печальное), особен-
ности поведения (неусидчивость, ма-
нерность). Астеноневротический син-
дром относится к пограничной патоло-
гии, диагностика его проявлений осно-
вывается на фиксации ряда признаков
анамнеза больного, наследственности
и объективной, комплексной оценке
ряда специальных тестов. Среди выде-
ляемых психопатологических синдро-
мов больные с астеноневротическими
нарушениями в зависимости от резуль-
татов специальных тестов могут после
соответствующей подготовки лечиться
с использованием имплантатов.
Особенно плохими кандидатами для
имплантационной хирургии являются
лица с тревожными и депрессивными
психоэмоциональными реакциями.
Несмотря на медикаментозную подго-
товку к операции, они и в раннем, и в
позднем послеоперационном периоде
часто предъявляют необоснованные
жалобы.
В случаях выявления психооргани-
ческого синдрома зубная имплантация
таким пациентам не показана.
Среди нарушений психической сис-
темы особое внимание следует обра-
щать на так называемую проблему дис-
тимии (МКБ-10, F.34.1) и дистимиче-
ских расстройств (ДСМ1У; 300,4), ко-
торые относятся к устойчивым (хрони-
ческим) расстройствам настроения [2].
Эту патологию относят также к погра-
ничным психическим расстройствам
[7, 30|. Они чаще встречаются у жен-
щин. Симптомами, характеризующи-
ми дистимию, являются потеря энергии,
снижение активности и настроения,
пониженная самооценка, снижение
уровня интересов, пессимизм. Также
перед положительным решением о
зубной имплантации следует обращать
внимание на больных с тревожными
состояниями. Они характеризуются
широким диапазоном невротических
расстройств — депрессией, неврасте-
нией. расстройством дневного сна. Не-
редко эти симптомы сочетаются с ве-
гетососудистой дистонией,гипертони-
ческой болезнью, эндокринными бо-
лезнями. В настоящее время установле-
на связь тревожных состояний с норад-
ренергической системой мозга. Все это
имеет принципиальное значение как
при отборе пациента для зубной им-
плантации, так и для определения объ-
ема операции, премедикации и местно-
го обезболивания при вмешательстве.
При решении вопроса о лечении с
использованием имплантатов для фик-
сации зубных протезов должна быть
проведена оценка личностных свойств
пациента. В случаях пограничных пси-
хических состояний важно рассмотре-
ние альтернативных методов лечения и
обоснование необходимости и пер-
спективности протезирования зубов на
имплантатах. Последнее должно быть
четко взаимосвязано с психологиче-
скими личностными оценками паци-
ента, основанными как на его индиви-
дуальных особенностях, так и персо-
нальной опенке.
Диагностика психического состоя-
ния перед имплантацией по тестам,
проводимым стоматологом, позволит
правильно отобрать пациентов для
применения этого метода лечения,
провести дифференцированную подго
товку к операции или операциям, этап-
ным ортопедическим лечебным меро-
приятиям и получить высокий эффект
комплексной терапии с точки зрения
не только жевательной функции и эс-
тетики, но и устранения вторичной
невротизации.
Перед операцией рекомендуется
применять комплекс эксперименталь-
но-психологических методов, позво-
ляющих уточнить личностные характе-
ристики, самооценку пациента, моти-
вацию его на лечение с использовани-
ем протезирования на имплантатах.
Эти методы оценки психопатологиче-
ских реакций у пациента представляют
комплекс унифицированной диагно-
стики психического состояния боль-
ных (М3 СССР, 1990). Среди них нами
комплексно применялись: опросник
личностных особенностей, тест само-
оценки Дембо—Рубинштейна—Блехе-
ра, тест тревоги Тейлора, личностный
опросник Леонарда—Шмишека, метод
незаконченных предложений, шкала
депрессии Гамильтона, тест личност-
ных свойств пациента Айзенка, тест
для оценки социального и профессио-
нального функционирования, шкала
общего клинического впечатления.
Исследование самооценки по мето-
дике Дембо—Рубинштейна— Блехера
позволяло пациенту определить свое
состояние по отдельным шкалам —
оценки здоровья, умственного разви-
тия, характера, состояния счастья, на-
строения, внешности. Методика про-
ста и может быть легко освоена паци-
ентом. Нами давалась больному инет-
Тест Дембо—Рубинштейна—Блехера
рукния по заполнению графика на вер-
тикальной линии, верхний полюс ко-
торой отражает состояние полного
счастья, а нижний соответствует со-
стоянию несчастья. Пациент обознача-
ет свое видение состояния личного
счастья или несчастья. Аналогичные
пометки он делает на шкале здоровья
или нездоровья, удовлетворения своим
умственным развитием или неудовле-
творения им, характера, настроения,
внешности. После заполнения паци-
ентом графиков с ним проводят беседу
и уточняют, почему поставлены те или
иные обозначения счастья, несчастья,
здоровья, нездоровья, настроения и
т.д. Оценив результаты теста Дембо—
Рубинштейна—Блехера в 8, 9, 10 бал-
лов, можно положительно подтвердить
возможность зубной имплантации;
при 6, 7 баллах следует индивидуально
решать вопрос об отмене имплантаци-
онной хирургии или седативной подго-
товке к операции.
Наиболее демонстративным для ха-
рактеристики психического состояния
является тест Дембо—Рубинштейна-
Блехера, а при выявленной депрес-
сии — шкала Гамильтона. Такие ха-
рактеристики больных по тесту Дем-
бо—Рубинштейна—Блехера перед им-
плантацией, как характер, настроение,
оценка счастья, внешности, здоровья,
ума, позволяли дать оценку в баллах: от
1 до 3 баллов — низкая оценка, от 4 до
6 баллов — средняя оценка, от 7 до 10
баллов — высокая оценка. Среднюю
оценку, связанную с эстетическим и
функциональным дефектом зубочелю-
стной системы, в основном за счет та-
ких характеристик, как внешность,
счастье и настроение, дают большин-
ству пациентов, обследуемых перед
имплантацией. Низкая оценка теста
Дембо—Рубинштейна—Блехера требу-
ет специального обследования больных
у психоневролога с целью выявления
патологических психовегетативных
синдромов. Высокая оценка наблюда-
лась у отдельных пациентов, которые
хорошо ориентированы в методах ле-
чения, в том числе зубной импланта-
ции, и имеют большую волю, настрое-
ние для такого лечения и считают его
наиболее адекватным.
Для определения степени тревоги
пациенту дается опросник Тейлора и
инструкция к нему. Больной отклады-
вает карточки, с положениями которых
он согласен, в одну сторону, а с утвер-
ждениями, с которыми не согласен, —
в другую. Подсчет ответов, каждый из
которых оценивается в 1 балл, дает
суммарную оценку уровня тревожно-
сти: 30 баллов свидетельствует о высо-
ком уровне тревожности, от 20 до 14
баллов — о среднем уровне, до 13 бал-
лов — о норме. При 13 баллах, которые
коррелировали с оценкой "норма" дру-
гих тестов, подготовку к имплантации
проводили по обшим правилам, при
14—20 баллах вопрос об операции ре-
шали индивидуально, но если решали
положительно, то за 1—2 нед назнача-
ли предоперационную фармакотера-
пию. Однако вопросник Тейлора до-
полняется определением откровенно-
сти каждого пациента по ’’шкале лжи"
в баллах от 0 до 5. В последующем мы
отказались от метода Тейлора, хотя он
позволяет не только определить сте-
пень тревожности, но и установить
конституциональную предрасполо-
женность к тревожности.
Для оценки личностных особенно-
стей пациента заполняли карту Леон-
гарда—Шмишека. По результатам тес-
та выделяют 10 типов: 1-й — гипертим-
ная личность, склонная к повышенно-
му настроению в сочетании с оптимиз-
мом и высокой активностью; 2-й —
"застревающие" личности, которые
склонны к бредовым (паранойяльным)
реакциям; 3-й — эмоционально-ла-
бильные личности; 4-й — педантичные
личности с преобладанием повышен-
ной ригидности, инертности и малой
подвижности психических и нервных
процессов, неспособные к вытеснению
травмирующих факторов; 5-й — тре-
вожные личности с преобладанием в
характере тревожности, боямивости,
робости, пугливости, склонности к
страхам; 6-й — циклотимные лично-
сти, у которых отмечается смена на-
строения; 7-й — демонстративные
личности, характеризующиеся истери-
ческими чертами характера и обладаю-
щие повышенной способностью к вы-
теснению отрицательных факторов;
8-й — возбудимые личности, склонные
к повышенной импульсивности, реак-
тивности, но с ослаблением контроля
над влечением и побуждением; 9-й —
конституционально-субдепрессивные
личности, характеризующиеся часты-
ми расстройствами настроения, сни-
женным фоном настроения в сочета-
нии с оптимизмом и высокой активно-
стью; 10-й — экзальтированные лич-
ности, склонные к аффективной эк-
зальтации, легко переходящие от со-
стояния восторга к состоянию печали.
С одной стороны, методика диагности-
ки психического статуса по опросник)'
Леонгарда—Шмишека позволяет опре-
делить такие патологические состоя-
ния, как психопатия истерического
круга (демонстративные личности),
ананкастическая психопатия (педан-
тичные личности), паранойяльная пси-
хопатия (застревающие личности), эпи-
лептоидная психопатия (возбудимые
личности). С другой стороны, осталь-
ные типы личности относятся к осо-
бенностям темперамента пациента,
глубине эффективных реакций.
Очень удобно, что больной заполня-
ет вопросник, который врач расшиф-
ровывает по каждому из личностных
типов акцентуации и оценивает в бал-
лах: 24 балла — это максимальный по-
казатель для каждого типа, и если по-
казатель более 14 баллов, то можно
считать его объективным критерием
типа личностной акцентуации. Вместе
с тем оценка личностной характери-
стики пациента не давала объективно-
го подхода к выделению психических
расстройств и не всегда коррелировала
с результатами других тестов.
Метод незаконченных предложений
Гамильтона в разных вариантах широ-
ко используется как в психиатрии, так
и в хирургической стоматологии (30].
Быстрое заполнение незаконченных
предложений может при анализе вы-
явить скрытые мысли и переживания
больного: ипохондрию, мнительность.
Хотя методика незаконченных предло-
жений проста для применения в кли-
нической практике, она включает ряд
неприятных и интимных вопросов, ко-
торые вызывали неприятие у пациен-
тов, поэтому в дальнейшем для реше-
ния вопроса об имплантации мы отка-
зались от нее.
Исследовали личностные свойства
пациента по опроснику Айзенка, в ко-
тором имеется три шкалы — достовер-
ность, экстраверсивность и невротич-
ность. Очень важно выявить субъек-
тов, склонных к невротичности, кото-
рые входят в группу риска невротичс-
ского срыва. Согласно опроснику Ай-
зенка, пациент отвечает на 57 вопро-
сов, среди которых 24 — по шкале экс-
травертивности, 24 — по шкале нейро-
тизма и 9 — по шкале лжи. Очень важ-
но, чтобы больной быстро отвечал на
вопросы, не обдумывая, что позволяет
установить его первую реакцию на за-
данный вопрос. Тест Айзенка позволя-
ет установить личностные свойства, но
не отражает степень умственных спо-
собностей. Если у пациента сумма по-
казателей по шкале лжи 4—5 баллов, то
это отражает приспособление его к да-
че гак называемых хороших ответов и
демонстративности поведения. В то же
время быстрота реакции пациента на
вопросы может отражать уровень ин-
теллекта. Результаты тестирования па-
циента по опроснику Айзенка оцени-
вают следующим образом: наивысшая
оценка — 24 балла; балл выше 12 отра-
жает шкалу экстравертивное™, а 12
баллов соответствуют шкале интравер-
тивности. Баллы, отражающие экстра-
и интравертивность, являются тестом
личностных особенностей пациента;
12 баллов и ниже соответствуют раз-
ным степеням невротичности, когда
возможно возникновение невротиче-
ского срыва. Диагностика "невротиз-
ма" отражает эмоционально-психоло-
гическую устойчивость или неустойчи-
вость, стабильность или нестабиль-
ность. Вместе с тем обследование по
опроснику Айзенка — процесс трудо-
емкий, и в дальнейшем мы отказались
от него, отдавая предпочтение другим
тестам, наиболее информативным.
У пациентов с выявленным симто-
мом трево™, депрессивным синдромом
отмечали степень выраженности де-
прессии по шкале Гамильтона.
ШКАЛА ДЕПРЕССИИ
ГАМИЛЬТОНА
1. Депрессивное настроение
(подавленность, безнадежность, беспомощ-
ность, малоненность)
О — отсутствие;
1 — выражение указанного чувства только
при прямом вопросе;
2 — высказывается в жалобах спонтанно;
ДЛЯ____________________________
3 — определяется не вербальным выраже-
нием, а посредством наблюдения: ми-
мика, поза, голос, плаксивость;
4-выражаются ФАКТИЧЕСКИ ТОЛЬКО
эти чувства, как спонтанными выска-
зываниями, так и невербально.
2. Чувство вины
О — отсутствует;
1 —самоуничижение;
2 — идеи виновности или мучительные раз-
мышления о прошлых ошибках или
грехах;
3 — настоящее заболевание расценивается
как наказание; бредовые идеи виновно-
сти;
4—вербальные галлюцинации обвиняю-
щего и осуждающего содержания и/или
зрительные галлюцинации угрожающе-
го действия.
3. Суицидальные намерения
О — отсутствуют;
1 — чувство, что жить не стоит;
2 — желание смерти или какие-либо мысли
о возможности собственной смерти;
3 — суицидальные высказывания или жесты;
4—суицидальные попытки (любая серьез-
ная попытка оценивается как "4").
4. Ранняя бессонница
О — отсутствие затруднений при засыпании;
1 —жалобы на эпизодические затруднения
при засыпании (более чем на '/j 4)l
2 — жалобы на невозможность заснуть каж-
дую ночь.
5. Средняя бессонница
О — отсутствует;
1 —жалобы на беспокойный сон в течение
всей ночи;
2 — многократные пробуждения в течение
ночи — любое покидание постели оце-
нивается как "2" (исключая физиологи-
ческие потребности).
6. Поздняя бессонница
О — отсутствует;
1 — раннее пробуждение утром с последую-
щим повторным засыпанием;
2 — окончательное раннее утреннее пробу-
ждение.
7. Работоспособность и активность
О — отсутствие трудностей;
1 — мысли и ощущение недееспособности,
чувство усталости и слабости, связанное
с деятельностью: работа или хобби;
2 — утрата интереса к деятельности: работе,
хобби — или выраженная непосредст-
венно в жалобах или опосредованно че-
рез апатичность и нерешительность
(чувство потребности в дополнитель-
ном усилии для приступления к работе
или проявления активности);
3 — уменьшение реального времени прояв-
ления активности или снижения про-
дуктивности;
4 — прекращение работы вследствие на-
стоящего заболевания.
8. Заторможенность (замедленность мыш-
ления и речи, нарушение способности кон-
центрировать внимание, снижение мотор-
ной активности)
О — нормальная речь и мышление;
1 —легкая заторможенность в беседе;
2 — заметная заторможенность в беседе;
3 — выраженные затруднения при проведе-
нии опроса;
4 — полный ступор.
9. Возбуждение
О — отсутствие;
1 —беспокойство;
2 — беспокойные движения руками, тереб-
ление волос и пр.;
3 — подвижность, неусидчивость;
4 — постоянное перебирание руками, обку-
сывание ногтей, выдергивание волос,
покусывание губ.
10. Психическая тревога
0 — отсутствие;
1 —субъективное напряжение и раздражи-
тельность;
2 — беспокойство по незначительным по-
водам;
3 — тревога, выражающаяся в выражении
лица и в речи;
4 — страх, выражаемый и без расспроса.
11. Соматическая тревога
0 — отсутствие;
1 — слабая;
2 — средняя;
3 — сильная;
4 — крайне сильная.
Физиологические проявления тревоги:
— гасгроинтеральные — сухость во рту,
метеоризм, диспепсия, диарея, спаз-
мы, отрыжка;
— сердечно-сосудистые — сердцебие-
ние, головные боли;
— дыхательные — гипервентиляция,
одышка;
— учащенное мочеиспускание;
— повышенное потоотделение
12. Желудочно-кишечные соматические сим-
птомы
0 — отсутствие;
1 —утрата аппетита, но с приемом пищи
без сильного принуждения; чувство тя-
жести в животе;
2 — прием пищи только с упорным прину-
ждением; потребность в слабительных
средствах или препаратах для купирова-
ния гастроинтестинальные симптомов.
13. Общие соматические симптомы
0 — отсутствие;
I — тяжесть в конечностях, спине или голо-
ве; боли в спине, голове, мышечные бо-
ли; чувство утраты энергии и упадка сил;
2 — любые резко выраженные симптомы.
14. Генитальные симптомы
0 — отсутствие;
I — слабовыраженные;
2 — сильновыраженные симптомы:
— утрата либидо;
— менструальные.
15. Ипохондрия
0 — отсутствие;
1 — поглощенность собой (телесно);
2 — чрезмерная озабоченность здоровьем;
3 — частые жалобы, просьбы о помощи и пр.;
4 — ипохондрический бред.
16. Уменьшение массы тела (оценивается
либо пункт А, либо Б)
А — по данным анамнеза:
0 — отсутствие уменьшения массы тела;
1 — вероятное уменьшение массы тела в
связи с настоящим заболеванием;
2 — явная (со слов пациента) потеря в весе;
3 — не поддающаяся оценке;
Б —если изменения в массе тела имеют ме-
сто еженедельно и регистрируются в
настоящее время;
0 — уменьшение массы тела менее 0,5 кг в
неделю;
1 —более 0,5 кг в неделю;
2 — более 1 кг в неделю;
3 — не поддающаяся оценке.
17. Критичность отношения к болезни
0 — осознание, что болен депрессией или
каким-либо заболеванием;
1 — осознание болезненности состояния,
но отнесение этого за счет плохой пи-
щи, климата, переутомления на работе,
вирусной инфекции, потребности в от-
дыхе и пр.;
2 — полное отсутствие сознания болезни.
18. Суточные колебания состояния
2 — вечером;
1 —утром;
О — состояние нс меняется.
Б. Если колебания имеются, уточнить их
выраженность:
2 — выраженные;
1 —слабые;
0 —состояние нс меняется.
19. Деперсонализация и дереализация (чув-
ство нереальности мира, нигилистические
идеи)
4 — полностью охватывают сознание боль-
ного;
3 —сильно выражены;
2 —умеренно выражены;
I —слабо выражены;
О — отсутствуют.
20. Бредовые (параноидальные, персеку-
торные) расстройства
3 — бредовые идеи отношения и преследо-
вания;
2 — идеи отношения;
I —повышенная подозрительность;
0 — отсутствуют.
21. Обсессивно-компульсивные расстрой-
ства
2 — сильно выражены;
1 — слабо выражены;
О — отсутствуют.
В шкале депрессии Гамильтона 21
пункт, и общая сумма баллов 8 или
меньше рассматривается как показа-
тель ремиссии. Именно эти параметры
считались оптимальными для сложно-
го челюстного протезирования у боль-
ных с дефектами челюстно-лицевой
области. Для решения вопроса об им-
плантационной хирургии мы считаем
оптимальным количество баллов 6 и
меньше, в других случаях необходимо
предлагать альтернативные методы ле-
чения, а при количестве баллов более
10 должны проводиться только неот-
ложные стоматологические процедуры
(лечение зубов, протезирование).
По данным Ю.А. Александровского
12], Л.М. Берденштейна (7], целесооб-
разно определение уровня социально-
го и профессионального функциони-
рования (Social and Occapational Func-
tioning Assesment Scale). При примене-
нии этого теста для оценки "здоровье —
болезнь" при решении вопроса об им-
плантации нами приняты наиболее оп-
тимальными оценки 100-80 баллов
как высокий уровень функционирова-
ния пациента. Других результатов на-
ми не получено, так как все пациенты
обследовались по этому тесту, будучи
уже обследованными перед импланта-
цией и готовыми к ней.
ШКАЛА ДЛЯ ОЦЕНКИ СОЦИАЛЬНОГО
И ПРОФЕССИОНАЛЬНОГО
ФУНКЦИОНИРОВАНИЯ(SOFAS)
100—91 Максимальное функционирование
в широком спектре деятельности
90—81 Хорошее функционирование во всех
сферах, эффективное как в профес-
сиональном, так и в социальном
плане.
80—71 Не более чем легкое расстройство
социального и профессионального
(школьное) функционирования, т.е.
редкие конфликты с окружающими,
периодическое отставание в школе.
70—61 Социальное или профессиональное
(школьное) функционирование со-
провождается некоторыми сложно-
стями, но в целом остается нормаль-
ным. сохраняются значимые меж-
личностные контакты.
60—51 Социальное или профессиональное
(школьное) функционирование уме-
ренно затруднено, т.е. друзей мало,
конфликты с одноклассниками или
сослуживцами.
50—41 Серьезное расстройство социального
или профессионального (школьного)
функционирования, т.е. друзей нет,
не в состоянии заниматься профес-
сиональной деятельностью.
40—31 Резко выраженные расстройства в
нескольких сферах, включая работу
или школу и семейные отношения,
т.е. взрослый в состоянии депрес-
сии избегает бывших друзей, не за-
мечает членов семьи и нс способен
работать; ребенок часто бьет более
младших по возрасту, дома ведет се-
бя вызывающе, отстает в школе.
30—21 Неспособность к функционирова-
нию ни в одной сфере, т.е остается в
постели по целым дням; не сущест-
вует ни работы, ни дома, ни друзей.
20—11 Время от времени не соблюдает да-
же элементарную личную гигиену:
не способен функционировать само-
стоятельно.
10—1 Полная потеря способности соблю-
дать даже элементарную личнуто ги-
гиену. Не способен функциониро-
вать, не причиняя при этом вреда
себе или окружающим, или же не
имея значительной поддержки со
стороны, т.е. без ухода сестры или
наблюдения врача.
0 Сведения не верны.
Учитывая длительность лечения с
использованием зубных имплантатов,
у пациента .могут отмечаться смена на-
строения и депрессия. В связи с ожи-
данием результата, тревогой по поводу
приживления имплантата может по-
требоваться фармакологическая кор-
рекция. Этого могут требовать и разви-
вающиеся осложнения имплантацион-
ной хирургии, например повреждение
периферических ветвей тройничного
нерва, плохая адаптация временных
протезов, трудности общения с людь-
ми из-за эстетических и функциональ-
ных нарушений в период от установле-
ния имплантата до ортопедической
реабилитации. В таких случаях для
поддержания адекватного психическо-
го состояния и назначения фармакоте-
рапевтических препаратов целесооб-
разно проведение теста с использова-
нием "Шкалы общего клинического
впечатления". Если улучшение состоя-
ния пациента между этапами имплан-
тации оценивается 1—2 баллами, то
пик дистимии пройден.
Комплексная оценка психоэмоцио-
нального состояния позволяет связать
результаты исследований с имеющи-
мися у пациента заболеваниями, диа-
гностировать нормальные и патологи-
ческие реакции и на основе этого под-
твердить возможность имплантацион-
ной хирургии и подготовки к ней или
констатировать нецелесообразность та-
кого лечения у конкретных пациентов.
Пациент, имея инструкцию по каж-
дому методу и ответив на все вопросы
по каждому тесту, может приступить к
собеседованию с врачом, который дол-
жен комплексно оценить результаты
указанных исследований. Вместе с тем
наш опыт показывает, что это целесо-
образно делать после отбора кандидата
на имплантацию по местным и общим
параметрам статуса здоровья пациента.
В отличие от данных М.Г. Панина и
соавт. [31], установленных у пациентов
с челюстно-лицевыми деформациями,
нами отмечено, что функциональные и
эстетические дефекты у пациентов,
связанные с дефектами зубных рядов,
беззубыми челюстями, и желание при-
бегнуть к имплантационному лечению
обусловливают более высокую органи-
зованность и стабильность психиче-
ского состояния. В то же время среди
обращающихся за лечением с исполь-
зованием зубных имплантатов доста-
точно много лиц, имеющих психасте-
нические и астенические акцентиро-
ванные черты характера, ипохондриче-
ские и психоорганические синдромы, а
также психозы в анамнезе. Анализ ре-
зультатов комплексной оценки психи-
ческого статуса пациентов показал, что
у 8 % из них отмечался астеноневроти-
ческий синдром, у 24 % — тревожно-
депрессивный, тогда как у остальных
68 % психический статус был стабиль-
ным, отмечалась полная готовность к
операции и последующему ортопедиче-
скому лечению. Обращаясь за лечени-
ем, пациенты с нарушениями психиче-
ского состояния не ориентированы в
его особенностях, верят в него, как в па-
нацею, но не готовы пройти обследова-
ние, провести санацию полости рта и
адекватно воспринять этапность лече-
ния и его длительные сроки. В таких
случаях на первых этапах обследования
мы отказывали этим пациентам в им-
плантации, особенно в случаях их не-
адекватной реакции на предоперацион-
ное обследование, оценку общего здо-
ровья и подготовку зубов к операции.
При предоперационном обследова-
нии пациентов, имеющих показания и
высокую психологическую мотива-
цию, мы использовали вначале ком-
плексную тестовую оценку и в зависи-
мости от ее результатов в дальнейшем
определяли тактику медикаментозной
подготовки и предоперационной пре-
медикации.
По данным FDA, ADA, Американ-
ской академии зубной имплантации,
большинство судебных исков, предъяв-
ляемых после зубной имплантации и
протезирования, поступает именно от
больных этой категории, а также от лиц,
страдающих психическими заболева-
ниями. Необходимо добиваться сопри-
частности пациента к операции, осо-
бенно восстановительной, правильной
оценки им всех "за" и "против", готов-
ности его к тому, что после операции
возможны неблагоприятные явления.
, Как и любое оперативное вмеша-
тельство, зубная имплантация наруша-
ет психическое равновесие. Подготов-
ка пациента к зубной имплантации по-
зволяет снизить психоэмоциональное
напряжение и выраженность вегета-
тивных реакций организма [7]. Меди-
каментозную подготовку пациентов в
нормальном психоэмоциональном со-
стоянии проводят традиционно.
Наблюдения за пациентами перед
началом имплантации свидетельствуют
о том, что все они без исключения про-
являют адекватное отношение к зубной
имплантации. Более того, нарушение
функции и требований эстетики, неэф-
фективность предшествовавшей тра-
диционной терапии, часто неодно-
кратной, укрепляют их готовность к ле-
чению с помощью имплантатов. При
четких показаниях к зубной импланта-
ции и документальном юридическом
оформлении согласия пациента на ле-
чение (знакомство с этапами хирурги-
ческих и ортопедических мероприятий,
сроками их проведения, а также сооб-
щение о возможности осложнений)
производят операцию с учетом их воз-
раста, сопутствующих заболеваний и
объема предстоящего оперативного
вмешательства.
Фармакотерапия как предымпланта-
ционная подготовка у наших пациен-
тов предполагает назначение стомато-
логом транквилизаторов, седативных и
активизирующих препаратов расти-
тельного происхождения. Психотроп-
ные средства назначались только пси-
хиатром. У пациентов с пограничными
психическими состояниями легкой
степени выраженности эффективно
применение (как вместе, так и по от-
дельности) седативных и активизирую-
щих средств растительного происхож-
дения, витаминных комплексов, сти-
муляторов фагоцитоза.
В ходе подготовки пациентов к им-
плантации или проявления астенонев-
ротического и тревожно-депрессивного
синдромов в соответствии с рекоменда-
циями психиатра или психоневролога,
нашим пациентам назначали антиде-
прессанты. Не следует прерывать курс,
контролировать его указанными выше
тестами. При расстройстве сна допол-
нительно назначали снотворные сред-
ства. У пациентов с колебаниями на-
строения показаны препараты нормо-
тимического действия. При этом обяза-
телен контроль функции шитовидной
железы, содержания электролитов, мо-
чевины, азота, креатинина, а также со-
став лейкоцитарной формулы.
Пациентам с астеноневротическим
синдромом проводят подготовку в за-
висимости от их состояния, используя
седативные и активизирующие средст-
ва; больным с тревожно-депрессивным
синдромом легкой степени назначают
антидепрессанты и нейролептики со-
гласно рекомендациям психиатра.
У пациентов с патологическими
психоэмоциональными реакциями
прежде всего должны быть точно уста-
новлены показания к зубной имплан-
тации. При умеренно и резко выра-
женных формах психоэмоциональных
реакций имплантацию производят
только после лечения и разрешения
психиатра. В случае неэффективности
альтернативного лечения, в том числе
более простых предпротезных опера-
тивных вмешательств, премедикацию
назначают с учетом типа и степени
психоэмоциональных расстройств.
Пациентам с ипохондрической ре-
акцией зубная имплантация противо-
показана, так как методы их предопе-
рационной подготовки еще не разра-
ботаны. Главная сложность заключает-
ся в трудности общения с ними, невы-
полнении ими рекомендаций по об-
следованию и подготовке полости рта
к операции.
Противопоказанием к зубной им-
плантации могут быть также неадек-
ватные поведенческие характеристики
и установление на основании ком-
плексного обследования по тестам ис-
терического синдрома. Для таких па-
циентов характерно непонимание оп-
ределенных требований к лечению с
применением имплантатов, отсутствие
четкой воли и желания пройти дли-
тельное лечение.
Больные, у которых при сборе анам-
неза были заподозрены органические
нарушения центральной нервной сис-
темы, должны пройти обследование
психического статуса по соответствую-
щим тестам, а также получить у психи-
атров заключение о возможности опе-
рации. В литературе данных о зубной
имплантации у таких пациентов нет.
В ходе предоперационного лечения
контролируют его эффективность по
"шкале общего клинического впечат-
ления”.
242
ШКАЛА ОБЩЕГО КЛИНИЧЕСКОГО
ВПЕЧАТЛЕНИЯ (CGI)
Пункты 2 и 3 могут быть пропущены при
первичной оценке (отметить "не оценива-
ется")
1. Тяжесть заболевания
Указать общее впечатление о тяжести пси-
хического заболевания
О — не оценивается;
1 — норма, не болен;
2 — на грани психического расстройства;
3 —слабая степень тяжести;
4 —средняя степень тяжести;
5 — значительно болен;
6 — тяжело болен;
7 — крайне тяжелое заболевание.
2. Общее улучшение
Оценить, есть ли улучшение в состоянии в
результате приема препарата; насколько
сильно изменилось состояние в сравнении с
состоянием при поступлении.
О — не оценивается;
1 —очень выраженное улучшение;
2 — выраженное улучшение;
3 — минимальное улучшение;
4 — нет изменений;
5 — минимальное ухудшение;
6 — намного хуже;
7 —очень сильное ухудшение.
3. Индекс эффективности
Оценка выставляется только на основании
эффективности препарата.
Выберите показатель, наиболее точно соот-
ветствующий степени терапевтического эф-
фекта и побочных явлений.
3.7. Терапевтический эффект
О — не оценивается;
1 —значительный: выраженное улучшение;
полное или почти полное исчезновение
симптоматики;
2—средний: явное улучшение; частичная
редукция симптоматики;
3 — минимальный: слабое улучшение, нс из-
меняющее сколько-нибудь значительно
состояние больного;
4 — отсутствие изменений или ухудшение.
3-2. Побочные эффекты
О — Не оценивается;
1 —отсутствуют;
2 — не вызывают значительного нарушения
деятельности больного;
3 — значительное нарушение деятельности;
4 — перевешивают терапевтические эф-
фекты.
При положительной динамике со-
стояния пациента и результатов кон-
тролирующего теста проводится хи-
рургия I и II степени сложности, III
степени — в 2—3 этапа. При малой эф-
фективности лечения от имплантации
отказываются, при других погранич-
ных психических нарушениях имплан-
тация не показана.
4.12. Оценка баланса витаминов
и питания
В приживлении имплантатов важную
роль играют витамины. В то же время
у обращающихся за стоматологической
помощью пациентов часто наблюдают-
ся различные формы витаминной не-
достаточности. В ее течении различают
три стадии: прегиповитаминоза, гипо-
витаминоза и авитаминоза [12]. Эти
стадии могут быть экзогенными (пи-
щевыми) и эндогенными, связанными
с болезнями органов кровообращения,
соединительной ткани. Для диагности-
ки витаминной недостаточности при
подготовке больных к зубной имплан-
тации большое значение имеют анам-
нез и выяснение таких моментов, как
возраст, питание, профессиональные
вредности, сопутствующие заболева-
ния. Характерными симптомами не-
достаточности витаминов являются
ксеростомия, ксерофтальмия, кератоз
кожи и ее шелушение. При осмотре
больного следует обращать внимание
на ангулярный стоматит, поражения
слизистой оболочки рта.
Пациентов, указавших на резкое
ухудшение зрения, конъюнктивит, а
также страдающих ксерофтальмией,
гиперкератозами кожи, необходимо
обследовать на недостаточность ви-
тамина А. В одних случаях эта недос-
таточность может быть связана с хро-
ническими заболеваниями кишечни-
ка, печени, эндокринных желез, в дру-
гих — может быть экзогенной приро-
ды. Если содержание витамина А ме-
нее 100 мкг/л, то необходимо более де-
тальное обследование пациентов спе-
циалистами [104].
При дефиците витамина В| (тиамин)
на первый план выступают симптомы
нарушения функций сердечно-сосуди-
стой и нервной систем. В таких случаях
вопрос об имплантации следует решать
комплексно, в том числе путем кардио-
логической подготовки и коррекции
витаминной недостаточности.
Дефицит витамина В2 можно пред-
полагать, если при осмотре больного
отмечаются ангулярный стоматит, глос-
сит, поражения слизистой оболочки
рта, глаз, кожи.
При диагностике недостаточности
никотиновой кислоты (витамин РР, В5)
следует обращать внимание на эритему
кожи (в первую очередь вокруг губ, но-
са, на щеках, лбу, шее), гиперемию сли-
зистой оболочки полости рта, пародон-
тит, глоссит. Отметив такие же прояв-
ления в полости рта в сочетании с себо-
рейным дерматитом и конъюнктиви-
том, пациента необходимо обследовать
на дефицит витамина В^.
Глоссит в сочетании с невралгиями
и диспепсическими расстройствами,
макроцитарной анемией заставляет
предполагать недостаточность витами-
на В|2- Это особенно важно при обсле-
довании лиц пожилого возраста, стра-
дающих гипертонической болезнью.
Дефицит витамина В|2 может свиде-
тельствовать также о наличии недиаг-
ностированной опухоли.
Недостаточность витамина D суще-
ственно влияет на заживление костной
ткани при зубной имплантации, так
как этот витамин повышает адсорбцию
кальция и фосфата. Главным отрица-
тельным фактором при этом является
остеомаляция кости, которая ведет к
уменьшению количества губчатого и
кортикального вещества, порозу и спо-
собствует прогрессированию болезней
пародонта. Причинами недостаточно-
сти витамина D в организме нередко
являются нехватка его в пище и малое
количество солнечного света [131]. Осо-
бенно часто витаминная недостаточ-
ность наблюдается улиц пожилого воз-
раста, в том числе у вегетарианцев. Та-
кая же патология может иметь место
при диспепсических явлениях у паци-
ентов, принимающих противосудо-
рожные лекарственные препараты.
При таких клинических симптомах
следует определить содержание вита-
мина D. Коррекцию его недостаточно-
сти проводят общие специалисты. Од-
нако даже при получении от них разре-
шения на имплантацию приживление
имплантатов может быть проблематич-
ным.
Дефицит аскорбиновой кислоты
при пародонтите с выраженной крово-
точивостью десен проявляется ухудше-
нием общего самочувствия и приводит
к угнетению Т-системы иммунитета,
что может повлиять на интеграцию им-
плантата с костью и стать причиной
воспалительных осложнений. Если та-
кие симптомы подтверждаются лабо-
раторными исследованиями мочи, то
следует заподозрить дефицит аскорби-
новой кислоты и перед зубной им-
плантацией направить больного на
специальное лечение.
Таким образом, проявления недоста-
точности витаминов В|, В2, В3, В(,, В12,
С и D должны быть оценены общим
специалистом и подтверждены лабора-
торно. Вопрос о возможности зубной
имплантации решают с учетом этиоло-
гии и патогенеза витаминной недоста-
точности. Учитывая тяжесть сопутст-
вующей патологии, специалист может
отказать в разрешении на импланта-
цию. Иногда целесообразно отложить
имплантацию на 6—12 мес с целью ле-
чения основных заболеваний и кор-
рекции витаминной недостаточности.
Для успеха зубной имплантации,
кроме достаточного количества вита-
минов, большое значение имеет пра-
вильное питание. Особую роль в диете
играют аминокислоты. В случае неаде-
кватного обмена ферментов и амино-
кислот как строительного материала
тканей течение раневого процесса на-
рушается. При подготовке к импланта-
ции, помимо сведений о заболеваниях
и рутинных лабораторных исследова-
ний, может понадобиться определение
биохимических показателей крови, 8
том числе сывороточного альбумина.
Уровень его значительно ниже нормы
следует считать относительным протИ'
вопоказанием к зубной имплантации-
В таком случае пациенту рекомендует-
ся перед имплантацией сбалансиро-
вать питание, в котором должны пре-
обладать продукты, содержащие каль-
ций. фосфор, аминокислоты [112].
т,| ।
Среди пациентов, обращающихся
по поводу зубной имплантации, встре-
чаются лица с алиментарной дистро-
фией. Она может быть связана с али-
ментарным истощением за счет низкой
калорийности пищи. Как правило, это
наблюдается у женщин, следящих за
массой своего тела или стремящихся ее
снизить нерациональным и несбалан-
сированным питанием, снижением ко-
личества витаминов в пите.
Перед имплантацией следует обра-
щать внимание также на пациентов с
признаками ожирения. По мнению
М.И. Балаболкина [3], при накоплении
жира в организме и увеличении массы
зела на 20 % и более по сравнению со
средними нормальными величинами
необходима медицинская оценка, осо-
бенно перед операцией. Избыточная
масса тела может обусловить развитие
гипертонической болезни, сахарного
диабета, холелитиаза и др. Среди фак-
торов ожирения одним из ведущих яв-
ляется питание. От морфологических
изменений жировой ткани зависят па-
тогенез ожирения, его степень (I сте-
пень — до 30 % от нормы, II степень —
до 50 %, 111 степень — более 50 %). Не-
зависимо от степени ожирения следует
установить его характер. Ожирение
может быть первичным, связанным с
алиментарно-конституциональными
или генетическими синдромами, и
вторичным, которое наблюдается при
гипоталамо-гипофизарных нарушени-
ях, эндокринных заболеваниях и нару-
шениях центрального генеза (травмы
черепа, заболевания оболочек мозга,
сосудистые внутричерепные расстрой-
ства).
При алиментарно-конституциональ-
ном или генетическом ожирении 1 сте-
пени противопоказаний к импланта-
Нии нет. Однако режим питания за 1—
2 мес должен быть изменен. Рекомен-
дуются диета с пониженным содержа-
нием жиров и углеводов, но полноцен-
ная по содержанию белков и витами-
нов (субкалорийная диета — 1600—
1800 ккал в день, прием поливитами-
нов), а также повышение физической
активности пациента.
Ожирение II и 111 степени, особенно
У больных эндокринными заболевания-
ми, является противопоказанием к им-
плантации. Специальное обследование
таких пациентов проводит эндокри-
нолог.
4.13. Оценка состояния
пациентов старшей
возрастной группы
Поскольку большинство кандидатов
на зубную имплантацию, как правило,
старше 60 лет, при предварительном их
обследовании следует учитывать воз-
растное снижение компенсаторных и
;шаптационных реакций организма и
проводить профилактику их срывов во
время оперативного вмешательства.
Многие из пожилых пациентов могут
не иметь точных сведений о состоянии
здоровья, поэтому важно выявить за-
болевания, которые могут создать риск
во время операции [76J, в том числе за-
болевания компенсированного харак-
тера и недиагностированные болезни.
Большинство специалистов, занимаю-
щихся имплантацией, считают, что да-
же здоровых людей пожилого возраста
следует относить к группе риска с забо-
леваниями средней тяжести. Несмотря
на индивидуальную высокую сохран-
ность сердечно-сосудистой системы, в
пожилом возрасте всегда отмечаются
атеросклеротические изменения коро-
нарных, мозговых и почечных сосудов,
может развиться скрытая функциональ-
ная недостаточность кровообращения и
дыхательной функции, снижен метабо-
лизм. В связи с этим имеет значение не
только правильная оценка симптомов
этих заболеваний, лабораторных тестов
и состояния иммунитета, но и профи-
лактика возможных осложнений во
время оперативного вмешательства и
после него. Важно, чтобы перед им-
плантацией состояние здоровья паци-
ента было оценено общим специали-
стом, четко определены показания и
противопоказания к операции.
У пациентов старшей возрастной
группы, в том числе у страдающих ка-
кими-либо хроническими заболева-
ниями сердечно-сосудистой системы,
эмоциональный фактор в связи с пред-
стоящей операцией может спровоци-
ровать нарушение сердечного ритма и
проводимости. Только кардиолог мо-
жег определить, возможна ли зубная
имплантация, и разработать план под-
готовки к ней. По данным Ю.К. Ток-
мачева и соавт. [42], при постоянной
форме мерцательной аритмии, корри-
гированной сердечными глюкозидами
и антиаритмическими препаратами,
возможны небольшие по объему амбу-
латорные оперативные вмешательства,
в том числе зубная имплантация. У та-
ких пациентов может быть произведе-
на операция I и II степени сложности.
Следует учитывать нарушение обме-
на в костях скелета с возрастом. Часто
возникающий остеопороз ведет к нару-
шению минерального обмена. У людей
старше 60—70 лет скорость обмена
кальция между костью и сывороткой
уменьшается. Снижается выражен-
ность периостальной реакции и соот-
ветственно нарушается образование
костной мозоли. Одновременно сни-
жается активность остеогенеза губча-
того вещества кости. Таким образом, у
пожилых людей возможности для при-
живления имплантата значительно
меньше, чем у молодых. Вместе с тем
клинические наблюдения свидетельст-
вуют о достаточно высоком проценте
приживления и функционирования
имплантатов у пожилых пациентов. В
таких случаях очень важно правильно
определить время начальной нагрузки
на имплантат [60].
Кроме того, пожилым пациентам
всегда приходится производить более
сложные оперативные вмешательства —
имплантацию с предпротезной хирур-
гией, остеопластикой и другими до-
полнительными операциями. Это
предопределяет индивидуальную под-
готовку к каждой операции, выбор
премедикации, обезболивания и по-
слеоперационное ведение больного
1106, 143].
J. Diokovic и J. Hedley-White [74]
считают имплантационные хирургиче-
ские вмешательства возможными в
возрасте до 80 лет. Свое мнение они
обосновывают тем, что нередко на-
блюдаются хорошая индивидуальная
сохранность основных систем жизне-
обеспечения и высокая мотивация на
хирургическое лечение, которое зна-
чительно улучшает зубную эстетику и
повышает жевательную эффектив-
ность.
Во всех случаях пациенты старшей
возрастной группы должны быть под-
готовлены к зубной имплантации за
несколько дней до операции. Им на-
значают внутрь триоксазин по 0,3 г 3—
4 раза в сутки, седуксен в дозе 0,005 г
и элениум по 0,01 г 2 раза в сутки. На-
кануне операции больной должен при-
нять снотворное. При местной анесте-
зии дозу адренолитиков уменьшают
наполовину [41].
4.14. Оценка состояния
пациентов с опухолями
Доброкачественные опухоли и опухо-
леподобные поражения после их адек-
ватного лечения не являются противо-
показанием к зубной имплантации. Ее
производят в полном объеме в зависи-
мости от функционального состояния
пациента.
При злокачественных новообразо-
ваниях нередко после операций и лу-
чевого лечения имплантация является
единственной возможностью обеспе-
чить функцию жевания.
Однако злокачественные новообра-
зования, особенно рак слизистых обо-
лочек, всегда вызывают иммунодефи-
цит. Лучевая терапия, проводившаяся
по поводу злокачественных опухолей,
ведет к токсическому поражению кле-
ток; происходят распад протеина,
инактивация ферментативных систем,
нарушаются протоплазменные кол-
лоиды и деструктурируются нуклеопро-
теины. Степень поражения клеток под
влиянием радиационного облучения
зависит от обшей дозы и порядка воз-
действия. При дозе ниже 48 Гр (I Гр ®
= 100 рад) осложнения наблюдаются
редко. В случае превышения дозы коли-
чество их значительно увеличивается,,
достигая критического уровня при лу-
чевом воздействии в дозе выше 65 Гр-
Чем дольше время получения доз облу-
чения, тем больше возможность адаптя-'
ции клеток. При коротком времени лу-
чевого воздействия усиливается токси-
ческая реакция клеток и снижается воз-
можность для их восстановления [104].
Под влиянием радиационных воз-
действий снижаются васкуляризация и
остеобластическая функция костной
ткани. При введении имплантата в об-
лученную кость всегда имеется опас-
ность развития ранних или поздних ос-
ложнений, а главное — неприживле-
ния конструкции.
Возможность имплантации у паци-
ентов, подвергшихся лучевой терапии,
определяет онколог. Принципиальное
значение имеет выявление дефицита
белой и красной крови, что обычно яв-
ляется противопоказанием к имплан-
тации. Тем не менее пациентам, пере-
несшим лучевое лечение по поводу
злокачественных новообразований и
не имеющим, кроме имплантации,
альтернативы для улучшения функции
и эстетики челюстно-лицевой области,
такое лечение необходимо. Имеется
немало сообщений об интеграции зуб-
ных имплантатов в облученной кости
при правильном выборе имплантата,
места его постановки и спланирован-
ной терапии после операции. Р. Wor-
thington и P.J. Branemark [142], L. Fran-
zen и соавт. [79], P.J. Branemark и со-
авт. [56], A. Komisar [98], считая в та-
ких случаях зубную имплантацию воз-
можной, отмечают, что, как правило,
приходится выполнять более сложные
оперативные вмешательства, соответ-
ствующие, по нашей оценке, III и IV
степени сложности.
При постановке имплантатов онко-
логическим пациентам необходимо
учитывать общую дозу облучения и
срок, прошедший после лучевой тера-
пии. Оптимальным сроком считается
1—2 года. Предварительно рекоменду-
ется провести гипербарическую окси-
генацию для улучшения приживления
имплантатов. Имплантаты следует ста-
вить на участки челюстей с более плот-
ным корковым и толстым слоем губча-
того вещества кости [107]. Остеотомия
при имплантации должна быть макси-
мально щадящей, поскольку травми-
рование облученной кости может при-
вести к ее некрозу. Премедикацию и
обезболивание назначают индивиду-
ально согласно общему состоянию
больного и степени сложности им-
плантационной хирургии.
4.15. Оценка результатов приема
лекарственных препаратов
Перед имплантацией необходимо вы-
яснить, какие лекарства принимает па-
циент, и при подготовке к операции
сбалансировать их прием. Среди ле-
карственных веществ, которые могут
принимать пациенты по поводу сопут-
ствующих заболеваний, особую осто-
рожность надо проявлять к кортико-
стероидам [95, 104]. Лечение стероида-
ми угнетает формирование соедини-
тельной и эпителиальной ткани, сни-
жая иммунитет и подавляя клеточные
реакции. По поводу заболевания, при
котором назначают кортикостероиды,
и возможности имплантации в связи с
таким лечением необходимо заключе-
ние общего специалиста. В случае, ес-
ли разрешение на зубную импланта-
цию получено, следует определить до-
зы стероидов для приема до операции,
в ходе и после нее.
Требует коррекции прием антикоа-
гулянтных препаратов, в том числе
ацетилсалициловой кислоты, посколь-
ку в таких случаях во время операции
возрастает риск кровотечения [55, 62].
За сутки до операции следует прекра-
тить прием антикоагулянтных препа-
ратов и 3—4 дня после операции при-
нимать их в уменьшенной наполовину
дозе. Что касается курящих пациентов,
то им следует прекратить курение за
10 дней до операции и воздерживаться
от него в течение 3 дней после нее
[103].
Противопоказанием к имплантации
является прием алкоголя. При подоз-
рении на злоупотребление алкоголем
пациенты должны быть клинически
обследованы в отношении поражения
печени и поджелудочной железы. У
них должны быть проведены соответ-
ствующие лабораторные исследования
(ферменты печени, протромбиновое
время, уровень креатинина и другие
тесты).
Абсолютно противопоказана зубная
имплантация лицам, принимающих
наркотики. Снижение иммунитета и
нарушение психики не позволяют по-
лучить положительные результаты при
лечении таких пациентов.
4.16. Заболевания,
возникающие на фоне дефектов
и нарушений функций иммунной
системы
В интеграции имплантата в костной
ткани челюстей и его будущем функ-
ционировании в зубных протезах опре-
деляющим является состояние имму-
нитета, который обеспечивает имму-
нологический надзор за всеми чуже-
родными воздействиями. Для оценки
функционального состояния организ-
ма большое значение имеет исследова-
ние иммунитета (24, 104]. Нарушения
его отмечаются при большинстве забо-
леваний и могут быть компенсирован-
ными, субкомпенсированными и де-
компенсированными. Перед зубной
имплантацией прежде всего следует
выделять дефекты и атипии функцио-
нирования иммунной системы. Имму-
нопатология возникает при: 1) инфек-
ционных заболеваниях; 2) аллергиче-
ских и аутоиммунных заболеваниях;
3) лейкопролиферативных неопласти-
ческих болезнях; 4) врожденных де-
фектах иммунной системы.
Кроме того, атипичность функцио-
нирования или иммунная недостаточ-
ность может быть обусловлена: 1) по-
ражением иммунной системы под
влиянием физических или химических
факторов на организм; 2) метаболиче-
ской активностью организма, вызван-
ной нарушением функций гормональ-
ной, сердечно-сосудистой и других сис-
тем, а также дефектами питания; 3) бе-
ременностью, стрессом, экстремаль-
ными условиями, возрастом.
Органические и функциональные
дефекты иммунной системы, как вро-
жденные, так и приобретенные, кли-
нически проявляются выраженной не-
достаточностью иммунитета. Вначале
они могут компенсироваться самой же
иммунной системой, что, как правило,
отражает нормальный иммунитет при
воспалительном заболевании. При ак-
тивной инфекции, продолжительном
заболевании могут наблюдаться исто-
щение и его временная декомпенса-
ция. Иначе говоря, наступает приобре-
тенная иммунная недостаточность [24,
25]. Иммунная недостаточность может
возникать также при врожденных де-
фектах иммунной системы. По этой
причине различают: 1) дефект иммун-
ной системы — компенсированный или
некомпенсированный, врожденный или
приобретенный; 2) иммунную недос-
таточность, проявляющуюся ареактив-
ностью (т.е. истощением иммунологи-
ческих реакций) и токсическим подав-
лением функции.
Иммунная недостаточность может
быть приобретенной и иметь как стой-
кий стереотипный характер, так и вре-
менные проявления. Любые дефекты и
недостаточность иммунной системы
ухудшают ее функционирование, явля-
ясь факторами риска (77]. Именно с
таких позиций следует рассматривать
болезни пациента при решении вопро-
са о зубной имплантации [24, 101].
Нами предложена схема оценки де-
фектов и нарушений иммунитета соот-
ветственно приводимым ниже имею-
щимся заболеваниям ]33, 35].
1. Инфекционный синдром — гнойные
поражения кожи и подкожной жиро-
вой клетчатки, грибковые, вирусные
поражения кожи, слизистых оболо-
чек, зубов, гнойные поражения ЛОР-
органов, инфекционные заболевания
сердечно-сосудистой, дыхательной,
пищеварительной систем, почек и
мочевыводящих путей, а также час-
тые (3—4 раза в год) острые респи-
раторно-вирусные инфекции, реци-
дивирующий герпес.
2. Аллергический синдром с пораже-
нием кожи, легких, сердца, почек,
органов пищеварительной системы.
3. Аутоиммунный синдром: большинст-
во эндокринных болезней, заболева-
ния центральной нервной системы,
ревматические болезни, отдельные
процессы в кроветворной системе.
4. Иммунопролиферативный синдром,
включающий болезни системы
крови, злокачественные новообра-
зования.
5. Наследственная отягошенность, ко-
гда в нескольких поколениях выяв-
ляются иммунная недостаточность
или дефекты иммунной системы,
злокачественные новообразования,
наследственные болезни, в том чис-
ле психические.
Оценивая патологические измене-
ния различных органов и систем орга-
низма, необходимо инфекционные бо-
лезни различной этиологии рассмат-
ривать как проявление иммунной не-
достаточности и дефектов иммунной
системы. Имплантация может быть
произведена после лечения воспали-
тельного заболевания. Болезни, отно-
сящиеся к аллергическим, аутоиммун-
ным синдромам, всегда вызывают на-
рушения иммунитета, что прогности-
чески неблагоприятно для зубной им-
плантации, поэтому при большинстве
из них такое лечение не показано. При
ряде заболеваний этого генеза после
соответствующей подготовки имплан-
тация может быть осуществлена, но
риск недолговечности функциониро-
вания протезов на имплантатах всегда
присутствует. Следует уточнить нали-
чие аллергических реакций, особенно
на металлы [126, 132], так как известны
случаи непереносимости сплавов тита-
на, что делает зубную имплантацию
невозможной.
Иммунопролиферативный синдром
представляет собой иммунопатологию,
при которой приживление имплантата
и его функционирование проблема-
тичны и это лечение не показано. Кроме
того, оперативное вмешательство мо-
жет быть толчком для отягощения ос-
новного заболевания.
Наследственные болезни при им-
плантации должны быть оценены с
точки зрения нарушения функций ос-
новных систем организма и дефектов,
поломок, изменений функции иммун-
ной системы.
Такой подход был подтвержден уче-
никами Т.Г. Робустовой, показавшими
необходимость оценки функциональ-
ного состояния организма с точки зре-
ния состояния иммунитета и его связи
с наследственностью, возрастом, со-
путствующими общими заболевания-
ми [18, 43]. Эти авторы всю гамму па-
тологических процессов в органах и
системах организма оценивают ком-
плексно на основании результатов
клинического и лабораторных иссле-
дований. и среди последних большое
значение придают показателям имму-
нитета.
4.17. Лабораторные
исследования
После оценки жалоб больного и анам-
неза, дополнительных сведений, по-
зволяющих уточнить диагноз заболева-
ния, врач-стоматолог перед импланта-
цией изучает данные диагностических
лабораторных исследований и заклю-
чения специалистов. С учетом того, что
зубная имплантация входит в число
достаточно дорогих операций, допол-
нительные методы обследования, оп-
лачиваемые пациентом, должны про-
водиться с целью подтверждения пред-
полагаемого диагноза, состояния па-
циента и планируемого объема опера-
ции. Наиболее полную информацию о
состоянии крови можно получить пу-
тем стандартного клинического анали-
за крови, определения биохимических
показателей и коагулограммы. Из это-
го перечня показателей стоматолог
должен целенаправленно выбрать тот
или те, которые позволят подтвердить
предполагаемый диагноз или опреде-
лить подготовку к операции импланта-
ции [68].
4.17.1. Клинический анализ
крови
С. Misch [121] отметил, что у 12—18 %
больных, обратившихся к нему для им-
плантации и считавшихся здоровыми,
при клинико-лабораторных исследова-
ниях были установлены системные за-
болевания, многие из которых влияют
на ход операции и отдаленные резуль-
таты. При этом следует иметь в виду,
что пожилые пациенты, у которых по-
казатели крови изменены, составляют
50—60 %, тогда как молодые — 80 %.
В условиях поликлиники перед им-
плантацией, помимо клинического
анализа и определения группы крови,
проводят коагуляционные тесты, ис-
следование иммунограммы, крови на
сифилис, ВИЧ-инфекцию, гепатит А,
В и С, определяют содержание сахара в
крови. Эти исследования нужно вы-
полнять всегда при применении инва-
зивных методов зубной имплантации
196].
При оценке результатов клиниче-
ского анализа крови следует дать ответ
на три главных вопроса для зубной им-
плантации: нет ли изменений красной
и белой крови, нормальны ли тесты на
кровотечение? Это необходимо, по-
скольку изменения в крови могут вли-
ять на исход хирургических манипуля-
ций при постановке имплантата, а в
дальнейшем на его приживление и
функционирование. Необходимо учи-
тывать, что у 12—18 % пациентов при
исследовании крови выявляют недиа-
гностированные заболевания, а среди
пожилых лиц процент таких больных
еще выше.
При клиническом анализе крови не-
обходимо принимать во внимание, что
у мужчин число эритроцитов больше,
чем у женшин. В то же время повыше-
ние числа эритроцитов должно насто-
рожить врача, так как это может быть
признаком эритремии (полицитемии),
врожденных заболеваний сердца, син-
дрома Иценко—Кушинга и сочетаться с
симптомами гипертонической болезни
[16]. Наоборот, снижение уровня эрит-
роцитов может указывать на анемию,
поэтому важно установить его причину.
Анемия у больных с пороками клапа-
нов сердца всегда опасна при имплан-
тации из-за эмболии [28]. Это осложне-
ние может быть спровоцировано отме-
ной антикоагулянтной терапии. Важно
оценить показатели гемоглобина, так
как он составляет почти 95 % сухой
массы красных кровяных клеток. Гемо-
глобин играет значительную роль в
транспорте кислорода к клеткам тка-
ней. В норме уровень гемоглобина у
женшин колеблется от 120 до 160 г/л, у
мужчин — от 135 до 180 г/л. Предельно
допустимый уровень гемоглобина для
остеотомии при имплантации 100 г/л,
хотя считается возможным произво-
дить имплантацию при более низком
содержании гемоглобина, если потеря
крови во время операции будет неболь-
шой [1311. Низкий цветной показатель
также может свидетельствовать об ане-
мии, заболеваниях внутренних органов
в тех случаях, когда возникает кровоте-
чение [65].
Большое значение для предстоящей
имплантации имеет состояние белой
крови — число лейкоцитов и формула
клеток белой крови. Число лейкоцитов
должно быть в пределах 6,0—8,0 • Кг/л,
а формула стабильной. Повышение ко-
личества лейкоцитов, так же как любой
сдвиг лейкоцитарной формулы влево
или вправо, может указывать на скры-
тые очаги инфекции. Неадекватно для
имплантации и снижение числа лейко-
цитов, поскольку это может отразиться
на приживлении имплантата. Значи-
тельное уменьшение числа лейкоцитов
также является тревожным признаком
заболевания крови. С. Misch [121] счи-
тает возможной имплантацию при лей-
коцитозе или лейкопении, но преду-
преждает о большом риске вторичного
инфицирования и замедленном при-
живлении имплантата.
В ходе предымплантанионного об-
следования необходимо оценить пока-
затели свертывания крови: число тром-
боцитов, время кровотечения и про-
тромбиновое время. Предварительно
следует установить, нет ли у пациента
или его родственников склонности к
кровотечению, так как большинство
заболеваний крови, в том числе гемо-
филия, имеют генетические корни.
Необходимо уточнить, принимает ли
пациент лекарственные препараты, ко-
торые могут спровоцировать кровоте-
чение: антикоагулянты, ацетилсалици-
ловую кислоту, антибиотики, в том
числе пролонгированного действия
[55]. Необходимо выяснить у больного,
не было ли у него длительного крово-
течения после удаления зуба, травмы,
операции, а также — наличие ротово-
го, носового или другого кровотечения
в прошлом и настоящем. Имплантация
может быть произведена, если про-
тромбиновое время составляет менее
1,5 нормального показателя. Однако
это положение спорно, особенно в слу-
чаях рассечения мягких тканей на зна-
чительном протяжении и длительных
манипуляций в кости. Если это пред-
полагается, то перед имплантацией
следует прервать антикоагулянтную те-
рапию [139]. Рекомендуется отменять
антикоагулянты только за 34—48 ч до
имплантации, а гепарин — за 12 ч. При
уменьшении дозы препарата или отме-
не его через 2—3 дня анализ на про-
тромбиновое время повторяют. Следу-
ет иметь в виду, что при заболеваниях
печени также наблюдается снижение
количества тромбоцитов.
Скорость оседания эритроцитов
(СОЭ) представляет собой интеграль-
ный показатель, отражающий состоя-
ние организма. Повышение СОЭ без
выраженной клинической картины
указывает на скрытую инфекцию и мо-
жет наблюдаться при системных забо-
леваниях, ряде болезней крови (эри-
тропения), анемии, а также при опухо-
левых процессах. Если в анамнезе име-
ется указание на воспалительный про-
цесс, то повышенное СОЭ свидетель-
ствует о его незавершенности. Во всех
случаях повышения СОЭ пациента
нужно обследовать более детально и
имплантацию производить только по-
сле нормализации СОЭ.
4.17.2. Анализ мочи
Исследования мочи проводят, как
правило, в порядке планового обсле-
дования при имплантационном лече-
нии в стационаре. Анализы мочи несут
в себе больше количественную инфор-
мацию. Они позволяют выявить скры-
тую форму сахарного диабета (наличие
глюкозы и кетоновых тел в суточной
моче), нарушение функции печени
(наличие билирубина) [121]. Наиболее
тревожным показателем является на-
личие белка, большого числа лейкоци-
тов (более 15—20 в поле зрения), эрит-
роцитов. В таких случаях необходимо
обследовать пациента на наличие ин-
фекционных процессов, заболеваний
почек, нарушения обмена. У пациен-
тов с диабетом исследуют мочу на глю-
козу.
Однако рутинные анализы крови и
мочи дают возможность выявить толь-
ко наиболее выраженные изменения:
лейкоцитоз или лейкопению, лимфо-
цитоз или лимфопению, сдвиг лейко-
цитарной формулы влево и вправо, из-
менения числа эритроцитов и содержа-
ния гемоглобина, повышение СОЭ.
Исследование мочи позволяет опреде-
лить наличие белка, лимфоцитов, эрит-
роцитов. почечного эпителия, глюко-
зы, что может указывать на патологию
почек, системные и эндокринные забо-
левания.
4.17.3. Иммунологические
исследования
Для успеха имплантации определенное
значение имеет стабильность иммуно-
логических показателей. Состояние
иммунологических реакций во многом
обусловливает остео- и фиброинтегра-
цию имплантата и его долговечность
при функционировании.
Для оценки иммунитета предложено
достаточно много методов. Долгое вре-
мя иммунокомпетентные клетки опре-
деляли методом розеткообразования.
Мы использовали различные способы
оценки иммунитета перед зубной им-
плантацией, а также в динамике при-
живления и функционирования им-
плантата: метод Манчини, дискретно-
динамический анализ по методу Пет-
рова, с нагрузочными тестами по мето-
ду Лебедева, с использованием моно-
клональных антител. Установлена пря-
мая зависимость выявленных измене-
ний иммунокомпетентных клеток от
характера общих заболеваний.
Исследований по изучению имму-
нитета при зубной имплантации не-
много. Установлена прямая зависи-
мость иммунологических показателей
от сопутствующей патологии, которая
обусловливала тип срашения имплан-
тата с костью и длительность его функ-
ционирования [2, 36]. Оценивая сопут-
ствующую патологию и состояние им-
мунитета, авторы подбирали кандида-
тов для имплантации, проводили пред-
операционную подготовку с коррекци-
ей иммунитета. Это позволило полу-
чить оптимальные результаты имплан-
тации (она была эффективной в 96 %
случаев) и проследить их в течение
15 лет. Именно от состояния иммуни-
тета зависела стабильность остеоинте-
грации имплантатов в форме корня зу-
ба и плоской формы. Реакция иммуни-
тета на оперативную травму и поста-
новку имплантата была адекватной.
Изменения ее параметров, в основном
клеточных, отражали умеренную вос-
палительную реакцию без явлений ин-
токсикации. Стабилизация иммуноло-
гических показателей отмечалась в
среднем через 1—2 мес. Физиологиче-
ская нагрузка на плоские имплантаты
через 1—2 мес и на конструкции в фор-
ме зуба через 4—6 мес не вызывала вы-
раженных изменений иммунитета.
А.И. Матвеева и В.А. Вигдерович
[29], В.А. Вигдерович [10| установили
три типа изменений иммунореактив-
ности после зубной имплантации:уме-
ренную депрессию, умеренную имму-
ностимуляцию и малоизмененную им-
мунореактивность. Выявлена возмож-
ность прогнозирования исхода им-
плантации на основании данных о со-
держании лимфоцитов, Т-клеток и Т-
хелперов. При умеренной иммуности-
муляции отмечено наибольшее число
осложнений имплантации: осложне-
ния заживления мягкой ткани, под-
вижность имплантата в связи с отсут-
ствием плотного соединения его с ко-
стью, в контактной зоне имплантат-
кость — воспалительные явления
вплоть до ограниченного остеомиелита.
При отборе пациентов в повседнев-
ной стоматологической практике ре-
комендуется использовать количест-
венные и качественные показатели им-
мунитета, определяя их методом Лебе-
дева и Понякинои (1987). Иммуно-
грамма дополняет результаты общего
обследования пациента, рутинных ис-
следований крови, заключения спе-
циалистов, что позволяет выявить де-
фект или недостаточность иммунитета,
связанные с общим заболеванием, и
определить, возможно ли произвести
имплантацию, отсрочить ее или она
противопоказана. Таким образом,
можно дать комплексную оценку пока-
заний и противопоказаний к зубной
имплантации. Временная невозмож-
ность имплантации заставляет приме-
нить тактику устранения причинных
факторов, в том числе провести лече-
ние инфекционных заболеваний, кор-
рекцию функций отдельных органов и
систем организма, после чего может
быть выполнена операция [2, 18, 33].
Следует рассматривать комплексно
все составные иммунограммы, особен-
но такие как формула гранулоцитов,
формула субпопуляций лимфоцитов,
определяющих физиологическую ак-
тивность клеток. Наиболее информа-
тивной для диагностики является со-
вокупность изменений иммунологиче-
ских параметров. Конечно, иммуно-
грамма доказательна только при срав-
нении с клиническими проявлениями
болезни. Однако иногда, чтобы обна-
ружить скрытые симптомы болезни
или врожденные дефекты иммунитета,
приходится анализировать иммуно-
грамму. Наиболее информативными
являются резкие сдвиги, например
снижение количества Т-клеток до 50 %
и менее, супрессорная депрессия, ин-
декс нагрузки ниже 2,0. Показатели
иммунограммы наиболее достоверны в
динамике предымплантационного об-
следования, так как любые изменения
организма (в том числе волнение на
приеме у врача) могут влиять на имму-
нитет. Только в том случае, если они
носят стабильный характер, следует
искать причину этого. Иногда иммуно-
логические изменения могут опере-
жать клинические симптомы болезни.
Обнаружение перед имплантацией из-
мененных показателей иммунитета
должно насторожить врача. Снижение
уровня Т-клеток указывает на патоло-
гический процесс в организме. Следует
продолжить клиническое и лаборатор-
ное обследование пациента, а вопрос
об имплантации решать позже. Повы-
шение содержания В-лимфоцитов мо-
жет указывать на какое-то хроническое
заболевание, особенно если при этом
регистрируется увеличение лимфати-
ческих узлов. Кроме того, увеличение
этого показателя говорит об усиленном
метаболизме клеток и выбросе в кровь
тиреоидных гормонов. В связи с этим
нужно всегда исключать заболевания
щитовидной железы.
Увеличение количества В-клеток и
одновременно О-клеток может указы-
вать на раннюю стадию острого лейко-
за или его асимптомные хронические
формы. Повышение уровня В-лимфо-
цитов может отражать также врожден-
ные нарушения иммунитета, и при ре-
шении вопроса об имплантации необ-
ходима специальная диагностика. При
врожденных иммунодефектах диагно-
стически важным является также сни-
жение содержания В-лимфоцитов.
Оно может сочетаться с уменьшением
количества Т-клеток и обшим сниже-
нием уровня лимфоцитов в крови. В
иммунограмме должно настораживать
и появление большого числа плазмати-
ческих клеток. У таких больных можно
предположить перенесенный тяжелый
грипп или другой воспалительный
процесс, который не завершился или
является признаком анемии. Кроме
того, следует исключить миелоз и
плазмоклеточный лейкоз.
Стойкое увеличение количества О-
клеток всегда указывает на продол-
жающийся воспалительный процесс
или заболевание крови типа алейкеми-
ческой формы лейкоза.
Оценивая популяции иммуноком-
петентных клеток, важно обращать
внимание на соотношение Т-хелперов
и Т-супрессоров, особенно на сниже-
ние его до уровня меньше единицы. В
таких случаях можно заподозрить но-
сительство ВИЧ-инфекции, даже если
вирус в крови не найден и отсутствуют
клинические симптомы иммунодефи-
цита. В других случаях следует исклю-
чить такие заболевания, как малярия,
язвенный колит, вирусный гепатит,
инфекционный мононуклеоз.
При решении вопроса об импланта- '
ции важным является индекс нагрузки,
представляющий собой соотношение
Е-РОЛ к Е-РОН. Индекс нагрузки ни-
же 2,0 всегда свидетельствует о нали-
чии хронической инфекции в организ-
ме или о том, что после инфекционно-
го, аллергического заболевания имму-
нитет не восстановился. Низкий ин-
декс нагрузки всегда является неблаго-
приятным диагностическим критери-
ем для имплантации, в связи с чем по-
казано более глубокое обследование
пациента. У таких пациентов необхо-
димо исключить миеломную болезнь,
аутоиммунный вирусный гепатит и за-
болевания печени.
Решение о возможности импланта-
ции, в том числе у пациентов старшей
возрастной группы, необходимо прини-
мать только при компенсации патоло-
гических процессов в органах и систе-
мах организма и стабильных показате-
лях иммунограммы. В случае, если ин-
фекционное заболевание клинически
не диагностировано, иммунограмма,
характеризующая разбалансирование
основных показателей Т-клеточного
иммунитета, отражающая интоксика-
цию, свидетельствует о необходимости
выявления очагов инфекции. Нередко
такие очаги обнаруживают в ЛОР-ор-
ганах [137, 144], на коже, в полости рта
11].
В дополнение к клиническому ана-
лизу крови иммунограмма дает возмож-
ность выявлять недостаточность пита-
ния при снижении содержания Т-су-
прессоров, в первую очередь дефицит
белка. В таких случаях уменьшается ко-
личество Т-клеток и наблюдается лим-
фоцитоз при снижении уровня Т-су-
прессоров и функциональной актив-
ности иммунокомпетентных клеток.
Эти изменения, как и сниженный фа-
гоцитоз, регистрируются при дефици-
те в организме витаминов В12 и С.
Внимание врача должны привлечь
такие изменения в иммунограмме, как
дефицит Т-клеток, увеличение количе-
ства О-клеток и снижение функцио-
нальной активности нейтрофилов. В
таких случаях необходимо исключить
порок сердца.
Мы не производили имплантацию у
тех больных, у которых в ходе предым-
плантационного обследования обнару-
жились дефекты глобулинопродукции.
Существенные сдвиги уровней имму-
ноглобулинов, особенно IgG, застав-
ляют искать причину этого во врож-
денной или приобретенной иммунной
недостаточности. При дефекте продук-
ции IgA иммунная недостаточность не
выявлялась. Комбинированные дефек-
ты иммунопродукции часто сочетались
с бессимптомными бактериальными,
грибковыми, вирусными инфекциями.
В таких случаях имплантацию не про-
изводили.
Таким образом, иммунограмма име-
ла значение для диагностики не только
иммунной недостаточности, но и
скрытых инфекционных заболеваний.
При многолетних наблюдениях, про-
веденных перед зубной имплантацией и
в динамике приживления имплантатов
у большинства подготовленных к опе-
рации пациентов, мы отмечали равно-
направленные нарушения иммунитета,
которые менялись на разных стадиях
приживления имплантата, отражая ин-
теграцию имплантата с костью. При
благоприятном раннем и позднем по-
слеоперационном течении эти измене-
ния отражали нормальное функциони-
рование иммунной системы на повре-
ждение кости — остеотомию и поста-
новку имплантатов. У ряда больных
после операции снижались или повы-
шались отдельные показатели иммуно-
граммы, что свидетельствовало о реак-
ции иммунной системы на оператив-
ную травму. Возникшая у некоторых
пациентов иммунная недостаточность
была временной и обычно стабилизи-
ровалась на 8—12-й неделе после им-
плантации.
Иногда при неадекватной нагрузке
на имплантат появлялись признаки
разбалансирования показателей имму-
нитета, снижался индекс нагрузки, что
свидетельствовало о неблагоприятном
течении регенерации. Это, как прави-
ло, сочеталось с клиническими сим-
птомами воспаления в зоне операции.
При ранней нагрузке на имплантат
иммунологические изменения возни-
кали у небольшого числа больных при
постановке плоских имплантатов. При
нагрузке на имплантаты круглой фор-
мы через 4—6 мес после операции не
выявлено достоверных изменений им-
мунитета.
Оценка иммунитета по иммуно-
грамме является простым и доступным
методом. Утром натощак у пациента
берут из пальца 0,04—0,2 мл крови. Ла-
бораторным путем определяют лейко-
грамму, показатели розеткообразова-
ния и фагоцитоза, а также содержание
иммуноглобулинов и показатели ин-
токсикации организма [24]. При выяв-
лении существенных нарушений им-
мунитета применяют другие, более
сложные методики, из которых наибо-
лее достоверные результаты позволяют
получить методики с использованием
моноклональных антител.
В настоящее время в нашей клинике
разработан простой, быстрый, качест-
венный метод постановки иммунограм-
мы — визуальный стрентавидин-биоти-
новый метод [24а]. На основе этого ме-
тода можно получить показатели суб-
популяций Т- и В-лимфоцитов, ис-
пользуя первичные моноклональные
антитела: Т-лимфоциты, Т-хелперы,
Т-супрессоры. В-лимфоциты, естест-
венные киллеры, а также оценить ко-
личество Т- и В-лимфоцитов методом
розеткообразования с эритроцитами
барана и мыши. Фенотипирование
клеток крови производится, как обыч-
ная процедура иммуноферментного
анализа на планшетах. Это имеет су-
щественное значение как при первич-
ном обследовании при зубной имплан-
тации, так и в процессе контроля за
приживлением конструкции и сужде-
нии о процессе ортопедической реаби-
литации.
Иммунологические исследования
особенно важны в тех случаях, когда
трудно достигнуть контакта с лечащим
общим специалистом, его заключения
носят формальный характер, и опери-
рующему хирургу-стоматологу прихо-
дится брать на себя повышенную от-
ветственность за больного в целом и за
успех имплантации в частности.
4.17.4. Биохимические исследования
При диагностике ряда заболеваний пе-
ред имплантацией, а также при слож-
ной имплантационной хирургии необ-
ходимо проведение биохимических ис-
следований [96, 113].
Наличие белка в сыворотке крови
может свидетельствовать о различных
заболеваниях, нарушениях обмена ве-
ществ. В норме содержание белка в сы-
воротке крови должно быть на уровне
60—78 г/л. Повышение его возможно
при гипериммуноглобулинемии, плаз-
моцитоме, синдроме Шегрена, а сни-
жение — при заболеваниях печени,
алиментарной дистрофии.
Содержание альбумина в сыворотке
крови, в норме составляющее 35—61 г/л
общего белка, чаше понижено при де-
фиците белка в пище, анальбумине-
мии, болезни Иценко—Кушинга, пан-
креатите, хронических заболеваниях
печени, почек, поджелудочной желе-
зы, миеломной болезни, а также скры-
тых инфекционных процессах и сер-
дечной недостаточности. При пониже-
нии уровня альбумина показано более
глубокое обследование по поводу ука-
занных заболеваний и имплантация
должна быть отложена.
В сыворотке крови содержание ар
глобулина (в норме 2,2—4,2 мг/л) мо-
жет быть повышено при воспалитель-
ных заболеваниях внутренних органов,
после лучевого воздействия, при хро-
нической почечной недостаточности и
снижено при некрозах печени и неф-
ротическом синдроме. Количество «2*
глобулина (в норме 7,9—10,9 мг/л) уве-
личивается при системных заболевани-
ях — ревматизме, системной красной
волчанке, циррозе печени, после рент-
геновского облучения, а уменьшается
при сахарном диабете. Содержание р-
глобулина (в норме 10,2—18,3 мг/л) мо-
жет свидетельствовать о ряде заболева-
ний, при которых имплантация не по-
казана: инфекционном гепатите и цир-
розе печени, нефрозе, узелковом пери-
артериите. Уровень Р-глобулина повы-
шен при системных заболеваниях, хро-
нических болезнях печени, злокачест-
венных новообразованиях и др. Им-
плантация возможна только при недос-
таточности витамина С после коррек-
ции уровня р-глобулина. При других
болезнях операция противопоказана.
Из других биохимических показате-
лей для имплантации принципиальное
значение имеют количество глюкозы,
кальция, неорганического фосфора, би-
лирубина, креатинина, кистой фосфа-
тазы [119]. В норме глюкоза содержится
в крови в количестве 3,9—5,8 ммоль/л.
При многих системных заболеваниях,
а также акромегалии, гигантизме, хро-
нических болезнях печени и почек этот
показатель может быть повышен. Не-
благоприятно также снижение содер-
жания глюкозы в крови при врожден-
ных пороках надпочечников, щитовид-
ной железы, поражениях печени, зло-
качественных новообразованиях [63].
Содержание капьция в сыворотке
крови (норма 2,1—2,5 ммоль/л) может
повышаться при системных заболева-
ниях, болезни Бехтерева, болезни Пед-
жета, лейкозах, миеломной болезни, а
снижение регистрируется при хрони-
ческих болезнях почек, печени, подже-
лудочной железы, костей скелета, ал-
коголизме. Все эти заболевания явля-
ются противопоказанием к зубной им-
плантации.
Неорганический фосфор содержится
в крови в количестве 0,87—1,45 ммоль/л.
Повышение его уровня может свиде-
тельствовать о болезни Аддисона, ги-
гантизме, акромегалии, болезни Пед-
жета, миелолейкозе и других заболева-
ниях. Снижение этого показателя на-
блюдается при заболеваниях эндок-
ринной системы. Большинство указан-
ных заболеваний поражают кости ске-
лета и зубная имплантация при них
противопоказана.
Повышение концентрации щелоч-
ной фосфатазы в сыворотке крови на-
блюдается при многих заболеваниях, в
том числе системных с преимущест-
венным поражением костей скелета.
Повышенная ломкость костей может
привести к их перелому, что делает зуб-
ную имплантацию проблематичной.
Неадекватным для имплантации явля-
ется также снижение содержания ще-
лочной фосфатазы (при анемии, гипо-
физарной карликовости, кретинизме,
накоплении в костях радионуклидов).
Содержание креатинина в сыворот-
ке крови в норме составляет 44—
115 ммоль/л. Повышение его наблю-
дается при диабете, уремических син-
дромах, тяжелой сердечной недоста-
точности. В связи с этим необходимо
более глубоко обследовать пациента,
чтобы установить, наступила ли ком-
пенсация функций сердечно-сосуди-
стой системы, почек, печени.
Содержание общего билирубина в
сыворотке крови в норме должно быть
в пределах 8,5—20,5 ммоль/л. Его по-
вышение всегда опасно, так как может
быть проявлением гемолитической бо-
лезни, заболеваний печени, при кото-
рых имплантация не показана.
Помимо перечисленных биохимиче-
ских исследований, при гемолитиче-
ской болезни, инфекционном моно-
нуклеозе, заболеваниях соединительной
ткани рекомендуется определять уро-
вень алан инами нотрансферазы в сыво-
ротке крови. Повышение его подтвер-
ждает наличие указанных выше забо-
леваний, что неприемлемо для зубной
имплантации.
Содержание аспартатаминотрансфе-
разы может увеличиваться при местных
лучевых поражениях, болезнях соеди-
нительной ткани, в том числе мышц,
заболеваниях печени, апкогольной ин-
токсикации. Поскольку это может не-
благоприятно влиять на исход опера-
тивного вмешател1ства, при каждой па-
тологии следует индивидуально решать
вопрос об имплантационном лечении.
При подозрении на коллагенозы,
лимфогранулематоз, ревматоидный
артрит височно-нижнечелюстного сус-
тава следует определять уровень гексоз-
аминов и гексозгликопротеидов в сыво-
ротке крови. Повышение содержания
гсксозаминов (в норме 100—120 мг%), а
также гексозгликопротеидов подтвер-
ждает наличие указанных заболеваний.
Увеличение содержания железа в сы-
воротке крови (в норме 12—32 ммоль/л)
может свидетельствовать об анемиях
различного происхождения. При син-
дроме Шегрена и ряде анемий этот по-
казатель может снижаться.
Повышение уровня мочевой кисло-
ты может указывать на поражение ко-
стного мозга (что значительно влияет
на приживление имплантата), а также
на заболевания почек, печени. Опреде-
лять содержание мочевой кислоты в сы-
воротке крови следует при злоупотреб-
лении алкоголем, после лучевых воз-
действий, при миеломной болезни. Со-
держание ее при таких поражениях по-
вышается (в норме 0,24—0,5 ммоль/л).
Выявление указанных выше биохи-
мических изменений в крови подтвер-
ждает наличие заболевания, что имеет
первостепенное значение при тех бо-
лезнях, при которых имплантация не
показана. При имплантологической хи-
рургии IV степени сложности у отдель-
ных пациентов с сопутствующими бо-
лезнями при госпитализации требуется
проведение комплекса биохимических
исследований, в которых будут получе-
ны такие показатели, как белок, глюко-
за, мочевина, креатинин, щелочная
фосфатаза, билирубин, АсАТ, АИТ, ка-
лий, натрий, всего 12 данных.
4.18. Правила оформления
документов и информированного
согласия пациента на зубную
имплантацию
Хирургический этап зубной импланта-
ции и последующее протезирование
могут быть проведены после оформле-
ния соответствующих медико-юриди-
ческих документов [112, 121]. Мировой
опыт зубной имплантации свидетельст-
вует о том, что отдельные случаи неэф-
фективности такого лечения явились
основанием для претензий и судебных
исков. В США отмечено значительное
число судебных исков в связи с "неоп-
равданной установкой имплантатов,
нанесшей пациентам физический и мо-
ральный ущерб". В 1994 г. суды по та-
ким искам вынесли положительные ре-
шения на сумму более 1,5 млн долларов.
Перед зубной имплантацией врач
должен провести беседу о предстоя-
щем лечении с использованием им-
плантатов. Пациент может быть озна-
комлен с литературой для больных по
этому вопросу. Ему может быть пока-
зан видеофильм, демонстрирующий
хирургический и ортопедический эта-
пы лечения. При этом должны быть
обязательно предложены альтернатив-
ные методы лечения. Только после оз-
накомления пациента с условиями ле-
чения и возможными рисками следует
получить его согласие на хирургиче-
ское вмешательство и уточнить сроки
установления временных и постоян-
ных протезов.
После согласования плана лечения
между врачом или врачами и пациен-
том оформляется документ — договор
об информированном согласии на ле-
чение с использованием зубных им-
плантатов и определяются сроки этап-
ных хирургических и ортопедических
лечебных процедур. Пациент должен
быть ознакомлен с риском и осложне-
ниями в случае неблагоприятного ис-
хода имплантации.
Американская страховая компания
(AAOMS) в 1992 г. разработала форму-
согласие на двухэтапную операцию им-
плантации и ортопедическое лечение.
Аналогичные документы используются
в европейских странах при лечении с
применением имплантатов.
В этом документе больной расписы-
вается под каждым пунктом.
1. Я (имя, фамилия пациента) уполно-
мочиваю доктора (имя, фамилия врача), а
также других лиц, участвующих влечении —
(имена, фамилии других врачей), провести
следующее лечение ... (указывается диагноз
и план лечения) ... (подпись пациента).
2. Необходимые для этого процедуры
мне были объяснены, и я понимаю всю про-
цедуру лечения (описывается подробный
план диагностических исследований, опе-
ративных вмешательств и ортопедических
этапных процедур) (подпись пациента).
экк.
Я понимаю, что постановка имплантата
требует рассечения мягких тканей в полос-
ти рта, сверления кости и введения в нее
имплантата. Я уведомлен о количестве ус-
танавливаемых мне в кость челюсти им-
плантатов, проведении необходимого мне
контроля в послеоперационном периоде,
времени до вскрытия имплантата и изго-
товлении временных и постоянных зубных
протезов. Я согласен с хирургическим лече-
нием и доверяю его провести врачу (имя,
фамилия врача). Я согласен с этапами ор-
топедического лечения и доверяю его про-
вести врачу (имя, фамилия врача) (подпись
пациента).
4. Я понимаю, что имплантат будет за-
крыт и находиться в челюсти в течение ... мес
(проставляется срок) (подпись пациента).
5. Я знаю, что не может быть гарантии
и мне ее не давали о сроке функциониро-
вания имплантата. Я уведомлен, что план
лечения по срокам должен быть выполнен,
иначе имплантат может быть потерян (под-
пись пациента).
6. Врач (имя, фамилия врача) объяснил
мне имеющиеся потенциальные риски при
лечении, среди которых:
а) послеоперационный дискомфорт, бо-
ли и припухлость, которые в течение
нескольких дней потребуют домаш-
него режима:
б) длительное и обильное кровотече-
ние, которое потребует дополнитель-
ного лечения;
в) повреждение соседнего зуба или их
корней;
г) развитие послеоперационной инфек-
ции, которая потребует дополнитель-
ного лечения;
д) могут быть трещины и царапины в
углах рта, которые будут медленно
заживать;
е) после операции может быть ограни-
чение открывания рта в течение не-
скольких дней;
ж) при операции могут быть поражены
нервные ветви и нарушена чувстви-
тельность подбородка, губ, крыла но-
са, десен, языка. Такие поражения
могут держаться несколько недель,
до 6 мес и даже остаться навсегда. В
некоторых случаях поражение нерв-
ных ветвей может потребовать удале-
ния имплантата;
з) постановка имплантата может повлечь
вскрытие верхнечелюстной пазухи,
что потребует дополнительного лече-
ния;
и) я уведомлен, что взятие костного
трансплантата также может иметь
следующие риски:
1) перелом челюсти;
2) другие повреждения.
Подпись пациента.
7. Я уведомлен, что в процессе лечения
может возникнуть необходимость в допол-
нительном хирургическом или ортопедиче-
ском лечении. Я уполномочиваю докторов
(имя, фамилия врача) провести это лечение
(подпись пациента).
8. Я даю согласие на введение лекарств
для премедикации и предупрежден об ос-
ложнениях (боль, развитие гематомы) (под-
пись пациента).
9. Мне объяснили, что при лечении я
буду получать лекарства, вызывающие сон-
ливость, потерю координации, и я преду-
прежден, что в течение ... срока я не сяду за
руль, не нарушу рекомендаций врачей по
послеоперационному поведению (прием
алкоголя, наркотиков, курения, физиче-
ских нагрузок) (подпись пациента).
10. Я предупрежден, что не должен при-
нимать пищу за 8 ч до операции, иначе во
время нее может возникнуть ситуация, уг-
рожающая жизни (подпись пациента).
11. Мне объяснили и я это понял, что
отличный исход лечения не гарантирован и
такой гарантии мне не давали (подпись па-
циента).
12. Я свидетельствую, что умею читать и
писать по-английски и прочитал и подписал
согласие на операцию и лечение (подпись
пациента).
Пожалуйста, обратитесь к врачу, если у
Вас есть какие-либо вопросы, относящиеся
к данному документу.
Подпись пациента или законного опе-
куна
Подпись свидетеля
Подписи врачей
В России до 1996 г. не были разрабо-
таны специальные документы по регла-
ментации отношений между врачом и
пациентом при имплантации. Имплан-
тация проводилась согласно методиче-
ским указаниям по применению зуб-
ных имплантатов, разработанным
В.И. Безруковым и соавт. |5], Т.Г. Ро-
бустовой и соавт. [33], В.И. Пьянзи-
ным [32]. Позднее Т.Г. Робустовой и
А.И. Матвеевой [34] был предложен
проект договора между пациентом и
врачом при зубной имплантации (фор-
ма № 3). В настоящее время этот дого-
вор расширен с учетом сложности хи-
рургии зубной имплантации (форма
№ 3).
Договор на лечение с использованием
имплантатов
1. Ф.И.О. пациента.
2. Мне предложены альтернативные ме-
тоды лечения, но я даю согласие на зубную
имплантацию.
3. Я уполномочиваю врача (Ф.И.О. вра-
ча) провести операции для зубной имплан-
тации.
4. Я уведомлен, что имплантации плани-
руется операция ... степени сложности.
Я знаю, что нс может быть гарантии и
мне ее не давали о сроке функционирова-
ния имплантата. Также я должен соблюсти
все сроки хирургии и ортопедии зубной им-
плантации. иначе имплантат может отторг-
нуться.
5. Мой возраст ... лет, я имею сопутст-
вующие болезни ..., что может осложнить
приживление и функционирование им-
плантата.
6. Я обязуюсь выполнят!, все назначе-
ния врача до и после операции:
а) не принимать пищу за 8 ч до опера-
ции;
б) принимать назначенные лекарства до
и после операции;
в) соблюдать гигиену полости рта;
г) не водить машину после операции в
течение срока, определенного вра-
чом, нс проводить работу, связанную
с физической нагрузкой;
д) не принимать алкоголя, не курить, не
принимать наркотических средств.
7. Я предупрежден, что после операции
имплантации могут быть боль в челюсти,
припухание мягких тканей, ограничение
открывания рта, в области углов рта могут
быть трещины или отек тканей, что потре-
бует соблюдения домашнего режима и вы-
полнения рекомендаций врача.
8. Я предупрежден, что операция при
зубной имплантации может осложниться
кровотечением из раны, воспалением, в ре-
зультате чего потребуется дополнительное
лечение.
9. Я предупрежден, что зубная имплан-
тация на верхней челюсти может ослож-
ниться перфорацией верхнечелюстной па-
зухи, полости носа, в дистальном отделе
нижней челюсти — повреждением нижнего
альвеолярного нерва.
10. Я знаю, что использование биопла-
стических материалов при зубной имплан-
тации может закончиться неприживлением
их, в связи с чем потребуется дополнитель-
ное лечение, в том числе хирургическое.
11. Я свидетельствую, что внимательно
прочел данный документ и подписал согла-
сие на операцию и лечение.
12. Мне объяснили, что лечение будет
многоэтапным и длительным, и никаких
гарантий исхода лечения мне не давали.
13. Я согласен со стоимостью операции
зубной имплантации, количеством и стои-
мостью имплантатов и биоматериалов.
Число
Подпись пациента
Подпись врача или врачей
СПИСОК ЛИТЕРАТУРЫ
1. Абрамов А.А. Обезболивание у паци-
ентов с гипотонической формой ней-
роциркуляторной дистонии при амбу-
латорных стоматологических вмеша-
тельствах: Автореф. дис. ... канд. мед.
наук. — М., 1992. — 19 с.
2. Александровский К).А. Пограничные
психические расстройства. — М.: Ме-
дицина, 2000. — 495 с.
3. Балабалкин М.И. Эндокринные болезни
// Диагностика и лечение внутренних
болезней. — М.: Медицина, 1996. —
Т. 2. - С. 365-465.
4. Безруков В.М., Черникис Ф.С., Су-
ров О.Н., Матвеева А.И. Применение
имплантатов в стоматологии: Методи-
ческие рекомендации. — М., 1987. —
35 с.
5. Безруков В.М., Робустова Т.Г. Обсле-
дование хирургического стоматологи-
ческого больного // Руководство по
хирургической стоматологии и челю-
стно-лицевой хирургии. — Т. 1. — М.:
Медицина, 2000. — С. 54—79.
6. Беляков Ю.А. Стоматологические про-
явления наследственных болезней И
синдромов. — М.: Медицина, 1993. —
255 с.
7. Берденштейн Л.М. Клиника, динами-
ка и терапия дистимии. — М.: Гео-
тар—Медицина, 1998. — С. 136—153.
8. Бизяев А.Ф. Обезболивание у больных
с сопутствующей патологией при про-
ведении операций в условиях стома-
тологической поликлиники: Авто-
реф. дис. ... д-ра мед. наук. — М.,
1989. - с.
9. Войн А.М. Вегетативные расстрой-
ства. - М.: МИА, 1998. - 391 с.
10. Вигдерович В.А. Прогнозирование ре-
зультатов хирургического этапа ден-
тальной имплантации: Автореф. дис. —
канд. мед. наук. — М., 1991. — 24 с.
11. Волкова А.С., Григорчук Ю.Ф., РУ~
зин Г.П. Наследственные синдромы в
стоматологии. — Харьков: Изд-во
ГБФ, 1997. - 144 с.
12. Гембицкий Е.В. Витаминная недоста-
точность (гиповитаминозы и авита-
минозы). Алиментарная дистрофия //
Диагностика и лечение внутренних
болезней. — Т. 3. — М.: Медицина,
1996. - С. 330-350.
13. Гембицкий Е.В. Нейроциркуляторная
дистония // Диагностика и лечение
внутренних болезней. — Т. 1. — М.:
Медицина, 1996. — С. 12—20.
14. Гембицкий Е.В.. Алексеев В. Г. Бронхи-
альная астма // Диагностика и лече-
ние внутренних болезней. — Т. 2. —
М.: Медицина, 1996. - С. 190-207.
15. Гогин Е.Е. Аллергические процессы в
легких // Диагностика и лечение
внутренних болезней. — Т. 2. — М.:
Медицина, 1996. — С. 90—105.
16. Гогин Е.Е. Гипертоническая болезнь и
симптоматические гипертензии //
Диагностика и лечение внутренних
болезней. — Т. 1. — М.: Медицина,
1996. - С. 21-109.
17. Гогин Е.Е., Тюрин В.П. Инфекционные
эндокардиты // Диагностика и лече-
ние внутренних болезней. — Т. 1. —
М.: Медицина. 1996. - С. 300-331.
18. Жусев А.И. Микрониркуляторныс на-
рушения слизистой оболочки полости
рта и их коррекция при эндооссаль-
ной имплантации: Автореф. дис. ...
канд. мед. наук. — М., 1995. — 22 с.
19. Зорян Е.В., Рабинович С.А., Анисимо-
ва Е.Н. и др. Особенности оказания
стоматологической помощи пациен-
там с факторами риска: Методиче-
ские рекомендации. — М.: ВУНМЦ,
1997. - 43 с.
20. Иванов В.С. Заболевания пародонта. —
М.: МИА, 1994. - С. 394.
21. Комаров Ф.И., Калинин А.В. Болезни
желудка и двенадцатиперстной киш-
ки // Диагностика и лечение внутрен-
них болезней. — Т. 3. — М.: Медини-
на, 1996. - С. 34-138.
22. Коняев Е.В. Ишемическая болезнь
сердца. Стенокардия // Диагностика
и лечение внутренних болезней.
Т. 1. — М.: Медицина, 1996. —
С. 110-162.
23. Лазебник Л.В. Остеопороз. Методиче-
ские рекомендации. — М., 1998. — 26 с.
24. Лебедев К.А., Понякина ИД. Иммуно-
грамма в клинической практике. —
М.: Наука, 1990. - 223 с.
24а. Лебедев К.А., Понякина И.Д., Козачен-
ко И. В. Новый этап в постановке им-
мунограммы человека — визуальный
стрсптавидин-биотиновый метод //
Физиология человека. — 2001. —
Т. 27. № 1. - С. 134-139.
25. Лебедев К.А., Максимовский Ю.М., Ро-
бустова Т.Г. и др. Оценка системы за-
щиты организма у стоматологических
больных (значения показателей имму-
нограммы у здоровых людей и анализ
их изменений при стоматологиче-
ской патологии): Методические реко-
мендации. — М., 1994. — 35 с.
26. Максимовский Ю.М., Лазебник Л.Б.,
Лукьянов М.В., Плавунов Н.Ф. Экс-
тренные и неотложные состояния в
практике стоматолога. — М.: ОАО
"Стоматология", 1999. — 111 с.
27. Мартынов И.В., Господаренко А.Л. Ин-
фаркт миокарда // Диагностика и ле-
чение внутренних болезней. — Т. 1. —
М.: Медицина, 1996. — С. 162—204.
28. Мартынов И. В., Господаренко А.Л. На-
рушения сердечного ритма и прово-
димости // Диагностика и лечение
внутренних болезней. — Т. 1. — М.:
Медицина, 1996. — С. 251—300.
29. Матвеева А.И., Вигдерович В.А. Реак-
ция иммунной системы человека на
дентальную имплантацию // Деп. в
НПО "Союзмединформ", № 21803,
09.10.91 г.
30. Насонова В. А., Забродский В. В. Ревма-
тические болезни // Диагностика и ле-
чение внутренних болезней. — Т. 1. —
М.: Медицина, 1996. — С. 457—545.
31. Панин М.Г., Берденштейн Л.М., Кли-
мов Б.А., Михайлова В.В. Методика
психологического обследования боль-
ных с врожденными и приобретенны-
ми дефектами челюстно-лицевой об-
ласти. — М„ 1995. — 27 с.
32. Пьянзин В. И. Медицинская докумен-
тация при зубной имплантации // Но-
вое в стоматол. — 1993, № 1. — С. 36.
33. Робустова Т.Г, Ушаков А. И., Абу Аса -
ли Эяд и др. Клинические, математи-
ческие, иммунологические аспекты
зубной имплантации: Методические
указания. — М., 1987. — 26 с.
34. Робустова Т.Г., Матвеева А.И. Меди-
ко-юридическая документация при
зубной имплантации // Новые концеп-
ции в технологии, производстве и при-
менении стоматологических импланта-
тов. — Саратов, 1996. — С. 33—35.
35. Робустова Т.Г. Подготовка к зубной
имплантации пациентов с соматиче-
скими заболеваниями // Казанск.
вести, стоматол. — 1996, № 2. —
С. 2-4.
36. Робустова Т.Г. Показания и противо-
показания для дентальной импланта-
ции // Новые концепции в техноло-
гии, производстве и применении сто-
матологических имплантатов. — Са-
ратов, 1996. — С. 3—6.
259
37. Робустова Т.Г., Стародубцев В.С. 50.
Обезболивание // Хирургическая сто-
матология. — М.: Медицина, 1996. —
С. 35-99. 51.
38. Робустова Т.Г. Классификация степе-
ни сложности оперативных вмеша-
тельств при зубной имплантации //
Современные проблемы имплантоло- 52.
гии. — Саратов, 1998. — С. 10—13.
39. Робустова Т.Г., Безруков В.М. Зубная
и челюстно-лицевая имплантация //
Руководство по хирургической стома-
тологии и челюстно-лицевой хирур- 53.
гии. — М.: Медицина, 2000. — Т. II. —
С. 406-472
40. Сидоренко Д.В.. Преображенский А.В. 54.
Фармакотерапия гипертонической
болезни // Русский мед. журн. —
1998, № 8. - С. 480-485.
41. Столяренко П.Ю., Кравченко В. В. 55.
Обезболивание в стоматологии у лиц
пожилого возраста. — Самара, 1998. —
69 с.
42. Токмачев Ю.К., Максимовский Ю.М., 56.
Лазебник Л. Б. и др. Неотложные сома-
тические состояния в практике стома-
толога. — М., 1993.
43. Ушаков А.И. Применение стоматоло- 57.
гических эндооссальных имплантатов
у пациентов после одонтогенного ос-
теомиелита нижней челюсти // Ка-
занск. вести, стоматол. — 1996, № 2. —
С. 140.
44. Файнштейн Ф.Э. Гемобластозы. Об- 58.
щие представления об эпидемиоло-
гии, этиологии и патогенезе гемобла-
стозов // Диагностика и лечение
внутренних болезней. — Т. 3. — М.:
Медицина, 1996. — С. 365—368, 59.
45. Файнштейн Ф.Э. Железодефицитные
анемии // Диагностика и лечение
внутренних болезней. — Т. 3. — М.: 60.
Медицина. 1996. — С. 460—465.
46. Хазанов А.И. Болезни печени, желч-
ного пузыря и желчных путей // Ди-
агностика и лечение внутренних бо-
лезней. — Т. 3. — М.: Медицина,
1996. - С. 195-300. 61.
47. Шугайте И.А., Рабинович С.А., Шуль-
гин Е.Г. и др. Обезболивание у паци-
ентов с гипотонической формой ней-
роциркуляторной дистонии при амбу- 62.
латорных стоматологических вмеша-
тельствах: Методические рекоменда-
ции. - М„ 1991. - 28 с.
48. American Dental Association: Accepted 63.
dental therapeutics. — Ed 40. — Chicago:
American Dental Association, 1984. —
420 p.
49. Babbush C. Demtal Implants. The Art 64.
and Science. — Philadelphia: W.B. Saun-
ders. 2001. — 332 p.
Baglink D.J. et al. Systemic factors in al-
veolar bone loss // J. Prosthet. Dent. —
1977. - Vol. 31. - P. 486.
Bain B., Rothwell M., Feher M. et al.
Acute changes in hematological parame-
ters on cessation of smoking // J. Roy.
Soc. Med. - 1992. - Vol. 85. - P. 80.
Bain С., Moy P. The association between
the failure of dental implants and ciga-
rette smoking I I Int. J. Oral Maxillofac.
Impl. - 1993. - Vol. 8, N 6. - P. 609-
615.
Becker D.E. Drug therapy in dentistry //
Westland — Michigan: Hayden-McNeil
Pub., 1995. - P. 42.
Bender I.B.. Seltzer S.„ Yermish M. The
incidence of bacteremias in endodontic
manipulation // Oral Surg. — 1960. —
Vol. 13. - P. 353.
Bennett B. Coagulation pathways: inter-
relationships and control mechanisms //
Semin Hematol. — 1977. — Vol. 14. —
P. 301.
Branemark P.-I., Lindstrom J., Halleho O.
et al. Reconstruction of the defective
mandible // Scand. J. Plast. Reconst.
Surg. - 1995. - Vol. 9. - P. 116-128.
Burkett L. W., Bum C. G. Bacteremias fol-
lowing dental extraction: demonstration
of source of bacteria by means of a non-
pathogen (Serratia marcescons) // J.
Dent. Res. - 1937. - Vol. 16. -
P. 521.
Burrowes P., Wallace C, Davies J., Camp-
bell L. Pulmonary oedema as a radiologic
manifestation of venous air embolism sec-
ondary to dental implant surgery //
Chest. - 1992. - Vol. 101. - P. 561.
Burrows P. Physiologic variants of chron-
ic obstructive lung disease // Chest. —
1970. - Vol. 58 (Suppl 2). - P. 415. ,
Burt VI.., Whelton P., Rocella E J. et al.
Prevalence of hypertension in the U.S.
adult population. Results from the 3rd na-
tional health survey and nutritional exam-
ination survey, 1988—1991 // Hyperten-
sion. - 1995. - Vol. 25. - P. 305-313.
Cann C.E. et al. Quantitative computed
tomography for prediction of vertebral
fracture risk // Bone remodelling. —
1985. - Vol. 6. - P. 1.
Cohen S.G., Glick M. Anticoagulant ther-
apy I I Internal medicine for dentistry /
Eds. L.F. Rose, D. Kaye. — St. Louis:
Mosby, 1990. - P. 374.
Coker N.. Milner P. Elective surgery in
patients with sickle cell anemia // Arch.
Otolaryngol. — 1982. — Vol. 108. —
P. 574.
Conn H. O. Cirrhosis // Deseascs of the
liver. — Ed. L. Schiff. — Philadelphia:
J.B. Lippincott, 1975. — P. 18.
260
65. Coon Ж, Willis P. Hemorrhagic compli-
cations of anticoagulant therapy // Arch.
Intern. Med. - 1974. - Vol. 133. -
P. 386.
66. Corman L., Bolt R.J. Medical evaluation
of the pre-operative patient // Med. Clin.
North Amer. — 1979. — Vol. 63. — P. 6.
67. Council on Community Health Hospital
Institutional and Medical Affairs: Oral
health care guidelines — patients with di-
abetes. — Chicago.: American Dental
Association, 1994. — P. 160.
68. Cygan R., Watzkin H. Stopping and re-
starting medications in the perioperative
period // J. gen. inter, med. — 1987. —
Vol. 2. - P. 270.
69. Dajani A.S. et al. Prevention of bacterial
endocarditis // J.A.M.A. — 1990. —
Vol. 264. - P. 2919.
70. Dajani A.S., Bawdon R.E., Berry M.C.
Oral amoxicillin as prophylaxis for endo-
carditis: what is the optimal dose? //
Clin. Infect. Dis. — 1994. — Vol. 18. —
P. 157-160.
71. Dajani A.S., Taubert K.A., Wilson W. et al.
Prevention of bacterial endocarditis. Rec-
ommendations by the American Heart
Association // J.A.M.A. — 1997. —
Vol. 277(12). - P. 1794-1801.
72. De Bryn H., Collaert B. The effect of
smoking on early implant failure // Clin.
Oral. Impl. Res. - 1994. - Vol. 5. -
P. 260-264.
73. Dempster D. W. Bone remodeling // Des-
orders of bone and mineral metabolisms
I Eds. F.L. Coe, MJ. Favis. — New
York: Raven Press, 1992. - P. 355-380.
74. Djokovic J, Hedley- White J. Prediction of
outcome of surgery and anesthesia in pa-
tients over 80 // J.A.M.A. — 1979. —
P. 242-230.
75. Dufour C. Chronic liver disease and cir-
rhosis. In Everhart J, editor: Digestive
disease in the United States: epidemiolo-
gy and inpact. Superintendent of Docu-
ments / Ed. J. Everhart. — Washington
D C.: Government Printing Office, 1993.
76. Ellies L., Hawker P. The prevalence of
altered sensation associated with implant
surgery // Int. J. Oral Maxillofac. Impl. —
1993. - Vol. 8, N 6.-P. 674-679.
'7. Enneking W. Immunologic aspects of
bone formation in isografts of bone // Ac-
ta. orthop. scand. — 1975. — Vol. 46. —
P. 549.
' 8. Foster E. et al. Risk of noncardiac opera-
tion in patients with defined coronary
disease. The Coronary Artery Surgery
Study (CASS) registry experience //
Ann. thorac. Surg. — 1986. — Vol. 41.
P. 42.
79. Franzen L., Rosenquist J., Rosenquist K.,
Gustafsson I. Oral implant rehabilitation
of patients with oral malignancies treated
with radiotherapy and surgery without
adjunctive hyperbaric oxygen // Int. J.
oral maxillofac. impl. — 1995. — Vol 10
N 2. - P. 183-187.
80. Girdler N. Fatal sequel to dental implant
surgery // J. Oral rehab. — 1994. —
Vol. 21. - P. 721-722.
81. Goldman L. Cardiac risks and complica-
tions of noncardiac surgery // Ann. In-
tern. Med. — 1983. — Vol. 98. — P. 504.
82. Goldman L. et al. Multifactorial index of
risk in noncardiac surgical procedures //
New Engl. J. Med. — 1977. —
Vol. 297. - P. 845.
83. Goldman L., Caldera D. Risks of general
anesthesia and elective operation in the
hypertensive patient // Anesthesiology. —
1979. - Vol. 50. - P. 285.
84. Goldmann H., Shuman A., Demberg G.
Die chirurgische Behandlung von Paro-
dontalerkrankungcn. — Berlin: Quintes-
senz, 1983.
85. Gorman L.M., Lambert P.M., Morris J.F.
et al. The effect of smoking on implant
survival at second stage surgery. IDCRG
interim report no 5 // Impl. dent. —
1994. - Vol. 3(3). - P. 165-168.
86. Grant B.F., Harforf T.C., Dawson D.A. et
al. Prevalence of DSM-IV alcohol abuse
and dependence. United States, 1992 //
Alcohol Health Res. World - 1994. -
Vol. 18. - P. 243-248.
87. Haire-Joshu D. Management of diabetes
mellitus: perspectives of care across the
life span // Ed. D. Haire-Joshu. — St.
Louis: Mosby. — 1992.
88. Heasman PA. The role of nonsteroidal
antiinflammatory drugs in the manage-
ment of periodontal disease // J. Dent.
Res. - 1988. - Vol. 16. - P. 247-257.
89. Henrukson P. Periodontal disease and
calcium deficiency: an experimental study
in the dog // Acta Odontol. Scand. —
1968. - Vol. 26 (suppl. 50). - P. 1-132.
90. Herman W.W., Konzelman J.L. Angina,
an update for dentistry // J.A.D.A. —
1996. - Vol. 127. - P. 98-104.
91. Hupp J. Changing methods of prevention
infective endocarditis following dental
procedures//J. Oral Maxillofac. Surg. —
1993. - Vol. 51. - P. 616.
92. Hupp J. Health status evaluation // Pe-
terson J. et al. Contemporary oral and
maxillofacial surgerv. — St. Louis: Mos-
by, 1994. - P. 27
93. Implant criteria workshop // Dearborn. —
Michigan: American Academy of im-
plant Dentistry. — 1978.
94. Irvine H'.J., Toft AD. The diagnosis and
treatment of thyrotoxicosis // Clin. En-
docrinol. - 1976. - Vol. 5. - P. 687.
95. Johnson A.G., Nguyen TV., Day R.O. Do
nonstroidal antiinflammatory drugs affect
blood pressure? A metaanalysis // Ann.
Intern. Med. — 1994. — Vol. 121. —
P. 289-300.
96. Jolly D.F.. Interpreting the clinical labo-
ratory // Cal. l5ent. Assoc. J. — 1995. —
Vol. 23(11). - P. 32-40.
97. Kellie S.E. Diagnostic and therapeutic
technology assessment (DATTA): Measu-
rement of bone density with dual energy X-
ray absorptiometry (Dexa) // J.A.M.A. —
1992. - Vol. 267. - P. 286-294.
98. Komisar A. Mandibular Reconstruction. —
N.Y. — Stutgart: Thieme, 1997. — P. 311.
99. Korn V.A., Schaffer EM. A comparison
of the postoperative bacteremias induced
following different periodontal proce-
dures // J. Periodontol. — 1962. —
Vol. 33. - P. 226.
100. Lees B., Stevenson J.C. Evaluation of du-
al energy x-ray absorptiometry and com-
parison with dual-photon absorptiome-
try I I Osteoporosis. — 1992. — Vol. 2. —
P. 146-152.
101. Liddle GAV., Melmon K.C. The adrenals
// Textbook on endocrinology. — Ed. 5 /
Ed. R.H. Williams. — Philadelphia:
W.B. Saunders, 1974. - P. 68.
102. Lieber C.S. Medical disorders of alcoho-
lism // New Engl. J. Med. - 1995. -
Vol. 333. - P. 1058-1065.
103. Lind J.. Kramhoft M., Bodtker S. The in-
fluence of smoking on complications af-
ter primary amputations of the lower ex-
tremity // Clin. Orthop. — 1991. —
Vol. 267. - P. 211.
104. Little J.W., Fallace D.A., Miller E.S.,
Rhodus N.Z. Dental management of the
medically compromised patient. — St.
Louis: Mosby, 1997. - P. 668.
105. Loukota R.A., Isaksson S.G., Linner E.L.
et al. A technique for inserting endosseous
implants in the atrophic maxilla in a sin-
gle stage procedure // Brit. Oral Maxillo-
fac. Surg. - 1992. - Vol. 30. - P. 46.
106. Malamed S.F. Physical and psychological
evaluation // Sedation: a guide to patient
management. — Ed 3 // Ed. F. Mala-
mcd. — St. Louis: Mosby, 1995. —
P. 32-62.
107. Marx R., Ames J. The use of hyperbaric
oxygen therapy in bony reconstruction of
irradiated and tissue deficient patient //
J. Oral Maxillofac. Surg. — 1982. —
Vol. 40. - P. 412.
108. Matukas К Medical risks associatd with
dental implants // J. dent. educ. —
1988. - Vol. 12. — P. 745—749.
109. McCarthy F.M. Adrenal insufficiency //
Essential of safe dentistry for the medically
compromised patient / Ed. F.M. McCa-
rthy. — Philadelphia: W.B. Saunders,
1989.
110. McGousar DA. Clinical problems in
Paget's disease affecting the jaws // Brit. J.
Oral. Surg. - 1974. - Vol. 11. - P. 230.
111. McGowan D.A. Dentistry and endocardi-
tis // Brit. Dent. J. — 1990. — Vol. 169. —
P. 69.
112. Miller C.S., Kaplan A.L., Guest G.F. Doc-
umenting medication use in adult dental
patients, 1987-1991 // J.A.M.A. -
1992. - Vol. 123. - P. 41-48.
113. Misch C.E. Medical evaluation of the im-
plant candidate. Part 3. SMA 12/60 // J.
Oral Impl. - 1981. - Vol. 9- - P. 556-
570.
114. Misch C.E. Medical evaluation of the
implant candidate. Part 2 // Int. J. Oral
Maxillofac. Impl. — 1982. — Vol. 2. —1
P. 11-18.
115. Misch C.E. Medical evaluation of the
implant candidate. Part 1: Vital signs and
urinalysis // J. Oral Maxillofac. Impl. —
1987. - Vol 13. - P. 556-570.
116. Misch C., Judy K. Patient dental-medical
implant evaluation form // J. Oral Ma-
xillofac. Surg. — 1987. — Vol. 50
(Suppl. 2). - P. 7-11.
117. Misch C.E. Analysis of medical history
pinpoints conditions that contraindicate
implants // Dentist. — 1989. — March
23-24. - P. 24-28.
118. Misch C.E., Moore P. Steroids and the
reduction of pain, edema, and dysfunc-
tion in implant dentistry // Int. J. Oral.
Maxillofac. Impl. — 1989. — Vol. 6. —
P. 27-31.
119. Misch C.E. Density of bone: effect on
treatment plans, surgical approach, heal-
ing and progressive bone loading // Int.
J. Oral Maxillofac. Impl. — 1990. —
Vol. 6. - P. 23-31.
120. Misch C.E. The pharmacologic manage-
ment of maxillary sinus elevation surgery
// J. Oral Implant. - 1992. - Vol. 18. -
P. 15-23.
121. Misch C. Contemporary implant dentist-
ry. — St. Luois (MO): Mosby-Ycar Book,
1993. - P. 446.
122. Muzyka B.C., Glick M. The hypertensive
denial patient // J. Amer. Dent. Assoc. —
1997. - Vol. 128. - P. 1109-1120. j
123. National Institutes of Health. — N.Y-
American Diabetes Association, 1996.
124. Neary J. Medical Evalution. EndoosseriS
Implant for Maxillofacial Recons-
truction. — Philadelphia — London:
W.B. Saunders, 1995. — P. 81—93.
125. Ortman L.F., Hausman E., Duford R.G.
Skeletal osteopenia and residual ridge re-
sorption //J. Prosthet. Dent. — 1989. —
Vol. 61. - P. 321-325.
126. Panigutti M., Merrit K., Bruner R. el al.
Correlation of allergy, metal levels, im-
plant alloy, and implant damage in pa-
tients undergoing revision joint arthro-
plasty // Implant Retrieval Symposium,
Society for Biomaterials. Transactions. —
St. Charles (Sept. 17-20). — 1992. -
Vol. 15. - P. 7.
127. Pell S., D'Alonzo C.A. Immediate mortality
and five year survival of employed men
with a first myocardial infarction // New
Engl. J. Med. - 1964. - Vol. 270. -
P. 915.
128. Pope J.E., Anderson J.J., Felson D.T.
A meta-analysis of the effects of nonste-
roidal antiinflammatory drugs on blood
pressure //Arch. Intern. Med. — 1993. —
Vol. 153. - P. 477-484.
129. Preber H., Bergstrom J., Linder L. Occur-
rence of pcriopathogenes in smoker and
non-smoker patients // J. Clin. Perio-
dontol. - 1992. - Vol. 19. - P. 667—
671.
130. Redding S.W., Montgomery E D. Dentistry
and systemic diseases. — Portland: Ore.
JBK Pub, 1990. - P. 327-336.
131. Robbins J., Mushlin A. Preoperativc eva-
luation of the healthy patient // Med.
Clin. North Amer. — 1979. — Vol. 63. —
P. 1145.
132. Smith D., Lugowski S., McHugh A. et al.
Systemic metal ion levels in dental im-
plant patients // Int. J. Oral Maxillofac.
Impl. - 1997. - Vol. 12. - P. 828—
834.
133. Smith R., Berger R., Dodson T Risk fac-
tors associated with dental implants in
healthy and medically compromised pa-
tients // Int. J. Oral Maxillofac. Impl. —
1992. - Vol. 7. N 3. - P. 367-372.
134. Sones S., Fazio R., Fang /. Principles and
practice of oral medicine. — Philadel-
phia: W.B. Saunders, 1984.
135. Sones S.T. et al. Comparison of the na-
ture and frequency of medical problems
among patients in general specialty and
hospital dental practices // J. Oral
Med. - 1985. - Vol. 38. - P. 58.
136. Spiekermann H., Donath K., Hassell T.
et al. Color atlas of dental medicine. Im-
plantology. — N.Y.: Thieme, 1995. —
P. 59-76.
137. Stafford C. The clinician view of sinusi-
tis // Otolaryngol, head neck sure. —
1990. - Vol. 103. - P. 870.
138. Steen P., Tinker J., Tarhan S. Myocar-
dial reinfarction after anesthesia and sur-
gery // J.A.M.A. - 1978. - Vol. 239. -
P. 2566.
139. Wahl M.J., Howell J. Altering anti-
coagulation therapy: a survey of physi-
cians // J. Amer. Dent. Ass. — 1996. —
Vol. 127. - P. 625-638.
140. Wakley G.K., Baylink D.J. Systemic influ-
ences on the bone response to dental and
orthopedic implants // J. Oral Impl. —
1998. - Vol. 14. - P. 285-311.
141. Winther B., Gwaltney J. Therapeutic ap-
proach to sinusitis: Anti-infectious therapy
as the baseline of management // Oto-
laryngol. Head Neck Surg. — 1990. —
Vol. 103. - P. 876.
142. Worthington P., Branemark P.-l. Ad-
vanced osseointegralion surgery: applica-
tions in the maxillofacial region. — Chi-
cago: Quintessence, 1992. — P. 276.
143. Zamost B. . Benumof J.L. Anesthesia in
geriatric patients // Anesthesia and un-
common diseases: pathophysiologic and
clinical correlation. — Ed. 2 / Eds.
J. Katz, J.L. Benumof, LB. Kadis. — Phi-
ladelphia: W.B. Saunders. 1976. — P. 315.
144. Zeinreich S. Paranasal sinus imaging //
Otolaryngol. Head Neck Surg. — 1990. —
Vol. 103. - P. 863.
145. WHO Expert Committee on Hyperten-
sion control-Hypertension control. WHO
techn report Series N 862. — Geneva,
1996. (Русский перевод доклада Экс-
пертов ВОЗ. — М., 1997).
Глава 5
ОБЩИЕ ПРИНЦИПЫ ОПЕРАЦИЙ ПРИ ЗУБНОЙ ИМПЛАНТАЦИИ
5.1. Организация работы
при оперативных
вмешательствах с целью
зубной имплантации
Результаты зубной имплантации каж-
дый пациент оценивает по эстетике
поставленного ему протеза, его удобст-
ву и функционированию. При лечении
адентии с помощью зубных импланта-
тов основой планирования служит
правильный выбор протеза, с которым
соотносят вид, число и параметры не-
обходимых для его опоры импланта-
тов, а также углы их постановки. Соот-
ветственно этим данным перед ортопе-
дическим лечением планируют им-
плантационную хирургию. Импланта-
ция состоит из трех главных этапов:
постановки конструкции, постановки
винта, заживления и протезирования.
Диапазон оперативных вмеша-
тельств при зубной имплантации по
тяжести и продолжительности может
быть разным — от небольших и легких
операций до многоэтапных, продол-
жающихся 3 и 4 ч.
Успех зубной имплантации во мно-
гом зависит от асептики и антисепти-
ки, а также от соблюдения всех орга-
низационных правил работы в опера-
ционной поликлинического и стацио-
нарного профиля. При имплантацион-
ных инвазивных вмешательствах необ-
ходимо принимать меры профилакти-
ки таких опасных инфекций, как ту-
беркулез, сифилис, гепатиты, ВИЧ-
инфекция, а также внутрибольничного
инфицирования в условиях поликли-
ники и стационара. Мероприятия по
профилактике инфекции следует про-
водить как в период обследования кан-
дидата на имплантацию, так и особен-
но во время оперативного вмешатель-
ства, а также на ортопедическом этапе
лечения.
264.___________________
5.1.1. Условия установления
имплантатов
Условия для имплантации должны со-
ответствовать утвержденным в 1984 г.
"Санитарным правилам устройства,
оборудования и эксплуатации амбула-
торно-поликлинических учреждений
стоматологического профиля, охраны
труда и личной гигиены персонала".
Оперативные вмешательства при лече-
нии с использованием зубных имплан-
татов производят по правилам, приня-
тым в хирургической стоматологии.
Обследование пациента проводят в
кабинете, отделении хирургической
стоматологии поликлиники или пере-
вязочной стационара.
Хирург-стоматолог работает совме-
стно с врачом-ортопедом. К операции
пациент должен быть санирован, по-
этому в подготовительный период к
работе привлекают терапевта, при не-
обходимости и пародонтолога. В боль-
ших клиниках или специализирован-
ных центрах зубной имплантации це-
лесообразно работать бригадой, где ве-
дущими специалистами являются ор-
топед и хирург, вспомогательными —
терапевт, пародонтолог, гигиенист
стоматологический и зубной техник [7,
17,18,116,167]. Перед операцией спи
мают слепки, изготавливают модели,
акриловые каппы, временные ортопе-
дические зубные протезы-каппы в ка-
бинете ортопедической стоматологии,
а также в зубопротезной лаборатории.
После обследования и подготовки оп-
ределяют день операции. Зубная им-
плантация относится к плановым опе-
рациям. Постановку имплантатов про-
изводят в операционной с соблюдени-
ем правил асептики и антисептики.
Стерильность операционных поме-
щений. В связи с новыми экономиче-
скими условиями в России предпола-
гается, что лечение с использованием
имплантатов (в том числе обследова-
ние, оперативное вмешательство и ор-
топедическое лечение) будет прово-
диться на третьем уровне оказания сто-
матологической помощи, т.е. в узко-
специализированных стоматологиче-
ских учреждениях разных типов хозяй-
ствования: в государственных, акцио-
нерных, частных (имеющих лицензию
на эту деятельность).
В поликлинике операционный блок
должен занимать не менее 5 помеще-
ний:
• помещение для ожидания из расчета
1,2 м2 на одного больного с учетом не
менее 4 больных, одновременно ожи-
дающих приема врача. Допускается
ожидание хирургических больных в
общем помещении поликлиники;
• предоперационная площадью 10 м2;
• операционная с одним стоматологи-
ческим креслом (операционный
стол) площадью не менее 23 м2, а при
установке каждого последующего
кресла (операционный стол) следует
добавлять 7 м2;
• стерилизационная площадью не ме-
нее 7 м,
• комната временного пребывания
больных после операции.
В стоматологических поликлиниках
при наличии хирургического кабинета,
где производят имплантацию, должно
быть не менее 3 помещений:
1) помещение для ожидания больных
(допускается ожидание больных в
общем помещении);
2) комната с вытяжнымшкафом пло-
щадью не менее 10 м2 для стерили-
зации инструментов, приготовления
материалов, подготовки персонала
(мытье рук, переодевание).
3) операционная площадью не менее
14 м* на одно кресло и 7 м2 на каж-
дое последующее кресло для выпол-
нения имплантационных операций.
При IV степени сложности у отдель-
ных больных с сопутствующими за-
болеваниями операции проводят в
челюстно-лицевом отделении ста-
ционара.
В операционной поликлиники и
стационара должны быть соблюдены
правила уборки (предварительная, те-
кущая, послеоперационная, заключи-
тельная и генеральная). Операционная
и стерилизационная должны система-
тически подвергаться бактериологиче-
скому контролю.
Стерильность предоперационных
комнат, операционных залов, материа-
лов и инструментария в поликлинике и
стационаре следует контролировать с по-
мощью бактериологического метода —
посева в аэробных и анаэробных усло-
виях. Бактериологический контроль пу-
тем выделения микроорганизмов про-
водят один раз в 10 дней.
5.1.2. Стерилизация инструментов
и материалов
Важным звеном имплантационной хи-
рургии является стерилизация инстру-
ментов. Больничная стерилизация —
это сложный многоступенчатый про-
цесс, состоящий из предстерилизаци-
онной очистки, упаковки, стерилиза-
ции и доставки от стерилизатора до
больного. Отсутствие или нарушение
одного из компонентов в этой цепочке
делает стерилизацию бессмысленной
]14, 179].
Предстерилизационная подготовка
заключается в механической очистке
инструментов, в том числе режущих, а
также систем для охлаждения тканей в
ходе имплантационной хирургии. Ре-
комендуется вначале мыть весь хирур-
гический инструмент в отдельной ра-
ковине со щетками и растворами 5 г
стирального порошка, 20 г пергидроля
в 975 мл воды или 200 мл 2,5 % пере-
киси водорода, 5 г стирального порош-
ка и 795 мл воды. Затем инструмент за-
мачивают в таких растворах, подогре-
тых до 50 ’С, в течение 15—20 мин и
вновь моют, применяя шетки разных
размеров. Особенно тщательно обра-
батывают инструменты для остеото-
мии, используемые при зубной им-
плантации, кровоостанавливающие за-
жимы, а также инструменты, имеющие
насечки, неровные поверхности, на-
резки, выступы. Дополнительно реко-
мендуется применять ультразвуковую
обработку инструментов ] 14]. С целью
предварительной очистки можно ис-
пользовать ультрафиолетовый очисти-
тель с дезинфицирующим моющим
раствором [116, 224].
Для дезинфекции, очистки и дезо-
дорирования слюноотсосов, охлаж-
дающих систем, электрокоагуляторов
используют 1 % раствор оратрола. Рас-
твор пропускают через систему в тече-
ние 2 мин, погружают в него на 3 ч, а
затем промывают в стерильной про-
точной воде.
Обработанные инструменты стери-
лизуют физическими методами в паро-
вых горячевоздушных стерилизаторах,
путем кипячения, закладывая их в бок-
сы, инфракрасным облучением и хи-
мическими методами с применением
химических препаратов.
Следует иметь в виду, что могут со-
храняться очень долго и плохо подда-
ются обычной стерилизации бактери-
альные эндоспоры столбняка и сибир-
ской язвы, микобактерии туберкулеза,
вирусы, в том числе вирус СПИДа, а
также грибы, вегетативные бактерии
(трепонема, холерный вибрион, стреп-
тококковая инфекция). Наиболее эф-
фективны химические стерилизаторы.
Все перечисленные микроорганизмы,
кроме споровых, уничтожаются дезин-
фектантами высокого и среднего уров-
ня. Дезинфицирующие средства низ-
кого уровня не убивают споры бакте-
рий, микобактерии туберкулеза, ряд
нелипидных вирусов и грибов.
В крупных хирургических стомато-
логических клиниках рекомендуется
использовать низкотемпературную сте-
рилизацию с газами формальдегида
и этиленоксида, с которыми процесс
длится 20 мин.
Режущие инструменты (скальпели,
ножницы, пилки для остеотомии) по-
сле механической очистки и промыва-
ния проточной водой хранят в 96 %
этиловом спирте, а в последние годы
больше пользуются одноразовыми
скальпелями.
При воздушной стерилизации при-
меняют крафт-пакеты, а при паровой —
растительный многослойный перга-
мент. Срок сохранения стерильности
при такой упаковке — до 1 года. Одна-
ко следует иметь в виду, что инстру-
менты могут разорвать пергамент, что
нарушает вакуумную стерилизацию.
Стерилизацию перевязочного и
шовного материала проводят по при-
нятым правилам. Используют также
стерильнопакетированные салфетки,
одноразовые иглы с шовным материа-
лом.
Наконечники микромоторов стери-
лизуют кипячением в вазелиновом
масле с последующим центрифугиро-
ванием.
Системы для охлаждения кости при
имплантации после разъединения всех
частей тщательно моют проточной во-
дой и замачивают в течение 2 ч в по-
догретом до 60 °C 1 % растворе натрия
гидрокарбоната и 1 % растворе наша-
тырного спирта. Все части стерилиза-
ционной системы промывают проточ-
ной водой и кипятят в течение 30 мин,
вновь промывают и повторно кипятят
в течение 20 мин.
При кипячении всех инструментов
используют только дистиллированную
воду', при обработке под струей — воду
из водопровода.
Для стерилизации оттисков, защит-
ных пластинок, капп, зубных шин ис-
пользуют дезинфицирующие средства,
затем все эти предметы промывают
стерильной проточной водой в течение
30 с или погружают в емкость со сте-
рильной водой на 5 мин.
Обработку рук к операции начинают
с их механической очистки при помо-
щи щетки и мыла. Не утратили значе-
ния классические способы обработки
рук по Фюрбрингеру и Альфельду: ру-
ки моют стерильной щеткой с мылом,
после чего ополаскивают водой от кон-
чиков пальцев до локтей. Вытирают
руки стерильной салфеткой, опять же
продвигаясь от кончиков пальцев к
предплечью. Затем так же обрабатыва-
ют руки тампоном, смоченным этило-
вым спиртом, антисептиками (способ
Альфельда), или в течение 1 мин рас-
твором сулемы (1:1000), в течение 3 мин
96 % этиловым спиртом и смазывают
ногтевые фаланги 5 % настойкой йода
(способ Фюрбрингера).
Более распространен способ Спасо-
кукоцкого—Кочергина. После механи-
ческой очистки и обработки 0,5 % рас-
твором нашатырного спирта руки мо-
ют в двух тазах: в первом — до локтей,
во втором — только кисти. Выдирают
руки стерильной салфеткой, продвига-
ясь от кончиков пальцев к запястью-
Тампонами, смоченными в 96 % эти*
ловом спирте, обрабатывают их дваж-
ды по 2,5 мин: первый раз кисти и
нижнюю часть предплечья, второй —
только кисти. Обработку рук заверша-
ют смазыванием 5 % спиртовым рас-
твором йода пальцев и особенно тща-
тельно ногтевых фаланг.
Перед операцией руки обрабатыва-
ют также первомуром (препарат С-4),
который является смесью муравьиной
кислоты (81 мл 85 % кислоты) и пере-
киси водорода (171 мл 33 % раствора),
выдержанной в течение 2 ч в холодиль-
нике. В результате смешения компо-
нентов образуется надмуравьиная ки-
слота, оказывающая бактерицидное
действие. После механической обра-
ботки этим раствором в течение 1 мин
руки обрабатывают при помощи сте-
рильных салфеток. Затем руки вытира-
ют также стерильными салфетками.
Этот способ очень экономичен как по
времени, так и по возможности обра-
батывать в одном тазу руки 5 человек.
Обработку' рук можно проводить
20 % раствором хлоргексидина биглю-
конатом. Механическую обработку рук
щеткой, мылом и проточной водой за-
вершают протиранием их в течение 2—
3 мин стерильными салфетками, смо-
ченными этим раствором.
В последние годы, особенно в усло-
виях поликлиники, широко применяют
ускоренные методы с использованием
препаратов бактерицидного действия
(церигель, 96 % этиловый спирт).
После обработки рук хирург, его ас-
систенты и хирургическая сестра наде-
вают стерильные перчатки.
Хирургические вмешательства при
зубной имплантации проводят в одно-
разовых стерильных перчатках.
5.1.3. Обеспечение стерильности
в ходе операции
Назначенный на имплантацию паци-
ент накануне операции принимает душ
или гигиеническую ванну с обязатель-
ным мытьем волос. В поликлинике он
раздевается до нижнего белья и наде-
вает стерильную рубашку или халат, на
голову — шапочку или марлевую по-
вязку. В стационаре больного приводят
или привозят в предоперационную, где
ему надевают чистое белье свободного
покроя. В день операции подготови-
тельные процедуры проводят в перевя-
зочной, отделении хирургической, те-
рапевтической стоматологии и специ-
альной комнате для выполнения ги-
гиенических манипуляций в полости
рта.
Во время операции хирургу помогают
врач-ассистент, помощник-стоматолог
или опытная медицинская сестра. По-
дачу инструментов, аппаратов и др. в
этой бригаде обеспечивает операцион-
ная сестра. В зависимости от особен-
ностей операции в бригаду могут быть
включены врач-анестезиолог и сестра-
анестезистка. Имплантацию произво-
дят в стоматологическом кресле, в ко-
тором пациент может располагаться
сидя, полулежа или лежа, а также на
операционном столе (рис. 5.1).
Операционное поле обрабатывают
1—3 % спиртовым раствором йода или
раствором йодоната в концентрации
1:45, этиловым спиртом, 1 % раствором
Рис. 5.1. Операция внутрикостной зуб-
ной имплантации: форма одежды врача,
его ассистента, положение больного во
время вмешательства, операционный
стол и инструментарий.
дегмиийода, 0,5 % водно-спиртовым
раствором хлоргексидина. Место опе-
рации изолируют стерильным бельем.
При этапных имплантационных опе-
рациях — работе на участках тела па-
циента для взятия аутотрансплантатов,
работе со стороны наружных покровов
лица, в полости рта — хирурги должны
заново обрабатывать руки, менять пер-
чатки, а стерильная сестра — заново на-
крывать стол.
На покрытом стерильной просты-
ней столе всегда должны лежать шпа-
тель, зеркало, угловой зубоврачебный
и пародонтальный зонды, экскаватор,
различные пинцеты — стоматологиче-
ские, анатомические и хирургические,
в том числе малого размера (глазные),
измерительный прибор, тупые крючки
для оттягивания губ и щек, шприцы с
тупыми иглами, содержащие стериль-
ный дезинфицирующий или другой
раствор (изотонический раствор на-
трия хлорида, раствор Рингера, хлор-
гексидина). На этом же столе раскла-
дывают все инструменты для остеото-
мии — скальпели разных размеров и их
держатель, распаторы разной ширины
и толщины, долота разного размера и
формы, острые крючки небольших
размеров — 4- или 6-зубые тупые
крючки для оттягивания и фиксации
слизисто-надкостничных лоскутов,
кровоостанавливающие зажимы, кост-
ные кусачки, хирургические ложки
разных размеров, молоток, иглодержа-
тель и иглы, ножницы прямые и изо-
гнутые, шовный материал. Соответст-
венно конструкции имплантата на сто-
ле должны быть специальные инстру-
менты. При использовании импланта-
тов плоской формы необходимо иметь
измеритель глубины кости, ручной и
автоматический ретрактор, канальные
остеотомы, специальные канальные
кюретки, постановочные и эвакуаци-
онные инструменты, специальные
"выщипыватели” или "перфораторы”
для слизисто-надкостничных тканей,
щипцы для коррекции тела и опорной
головки имплантата. Применяя им-
плантаты круглой формы, на стериль-
ном столе располагают специальный
набор инструментов для манипуляций
в кости. Их число зависит от особен-
ностей конструкции имплантата и со-
Рис. 5.2. Зубной имплантат в стерильной
упаковке и момент вскрытия контейнера.
ответственно от способа введения его в
кость (см. рис. 5.1).
Во время операции используют мик-
ромотор, слюноотсос, аппарат систе-
мы охлаждения, применяемый при
сверлении кости. Они могут распола-
гаться в модульном блоке стоматологи-
ческой установки или работать авто-
номно в индивидуальной аппаратуре.
К операции аппаратуру подготавлива-
ют по общим правилам; наконечники,
слюноотсосы, приспособления для по-
дачи охлаждения стерилизуют различ-
ными методами в зависимости от кон-
струкции или используют комплек-
тующие элементы.
Имплантат должен быть стериль-
ным, находиться в специальной сте-
рильной ампуле или стерильно пакети-
рован. На ампуле или пакете обознача-
ют его название и размеры (рис. 5.2).
Все примерочные манипуляции с от-
дельными видами имплантатов, в том
числе плоскими или имеющими гид-
роксиапатитное покрытие, проводят с
их стерильным аналогом. После каж-
дой примерки аналог помещают в сте-
рильный 0,12—0,2 % раствор хлоргек-
сидина. При установлении имплантата
его вынимают из ампулы или пакета
специальным держателем или пинце-
том (см. рис. 5.2). Формирование кост-
ного ложа производят последовательно
сменяемыми инструментами набора
производителя имплантатов. Введение
имплантата в костное ложе называют
инсталляцией (от французского слова
"installation", что на русский язык пе-
реводится как "установление"). Терми-
ном "установление" мы будем пользо-
ваться и впредь. Движения, необходи-
мые для фиксации имплантата в кост-
ном ложе, делают без прикасания к его
телу рукой даже в стерильной перчатке.
Однако в отдельных случаях во время
операции возникает необходимость по-
вторной стерилизации имплантата, а
также титановых инструментов. R. Bai-
er и соавт. [52] рекомендуют произво-
дить это радиочастотных» методом.
Перед операцией (за 4 дня) реко-
мендуется назначение гомеопатиче-
ского препарата "Траумель С", дейст-
вующего как противоотечное средство,
улучшающее микроциркуляцию. В
первый день сублингвально 1 таблетку
"Траумеля С" принимают 5 раз, на вто-
рой, третий и четвертый день — 3 раза
в день. После вмешательства в зону
операции по типу инфильтрационной
анестезии вводят 1—2 ампулы препа-
рата.
Предоперационная антибактериаль-
ная терапия за 30—40 мин до вмеша-
тельства состоит из внутримышечного
введения 600 мг раствора линкомици-
на или приема per os рулида (150 мг),
клацида (500 мг) или внутривенно спи-
ромицина (1,5 млн ЕД). Обрабатывают
полость рта перед обезболиванием
0,12 % раствором хлоргексидина или
его производных — элюдрина, корсо-
дила.
Также за 30—40 мин до вмешатель-
ства внутримышечно следует вводить
1 мл гидрокортизона или 8 мг дексаме-
тазона.
Премедикацию проводят всем паци-
ентам: внутривенно вводят 4 мл седук-
сена или реланиума, при III—IV степе-
ни сложности операции дополнитель-
но 5 мл баралгина и 1 мл 0,1 % атро-
пина сульфата. При введении атропи-
на необходимо контролировать пульс.
Если у пациента отмечалась тахикар-
дия, атропина сульфат вводить не сле-
дует.
В случаях выраженного астенонев-
ротического синдрома внутривенное
введение седуксена (0,3 мг/кг) допол-
няли введением лексира (0,5 мг/кг).
Производится дифференцирован-
ная подготовка к операции больных с
различными заболеваниями органов и
систем организма (см. главу 4).
В предоперационной подготовке
особое внимание следует уделять боль-
ным с астеноневротическим и тревож-
но-депрессивным синдромом [1].
5.1.4. Подготовка больного
к операции
В зависимости от возраста больного,
сопутствующих заболеваний, лабора-
торных показателей, в том числе пока-
зателей иммунитета, перед импланта-
ционной хирургией проводят предопе-
рационную подготовку. Наиболее часто
после санации очагов инфекции в ор-
ганизме, согласно показателям имму-
нограммы и степени хронической ин-
токсикации, требуется детоксикацион-
ная терапия. При 1 степени хрониче-
ской интоксикации назначают прием
внутрь витаминов, стимуляторов фаго-
цитоза, пищевых добавок, адсорбен-
тов, гепатопротекторов. В качестве
стимуляторов фагоцитоза назначается
метилурацил, пентоксид, милайф. Ле-
чение продолжается 1—2 мес, в этот
период пациент проводит лечение зу-
бов, пародонта, осваивает приемы ги-
гиены. В предоперационный период
нужно следить за состоянием и функ-
цией желудочно-кишечного тракта, ог-
раничить прием мяса, исключить жа-
реные блюда, увеличить прием жидко-
сти с настоями трав и витаминов, сти-
мулирующих средств, после каждого
приема пищи принимать адсорбенты.
При II степени хронической инток-
сикации лечение дополняется инфузи-
онной терапией: 6 % раствора гемодеза
или реополиглюкина 200- 400 мл, 5 %
раствора аскорбиновой кислоты 4 мл,
6—8 инфузий через день. Эффективно
лазерное или ультрафиолетовое облу-
чение крови. Также применяют питье
настоев трав, повышающих микроцир-
куляцию, функцию печени, мочевыде-
ление. Контроль санации очагов ин-
фекции и детоксикационной терапии
осуществляют по показателям и.мму-
нограммы и биохимических исследо-
ваний.
У пациентов с сердечно-сосудисты-
ми заболеваниями, у людей старшей
возрастной группы подготовка к опе-
рации проводится терапевтом, кардио-
логом в зависимости от степени слож-
ности имплантационной хирургии и
состояния сердечно-сосудистой сис-
темы.
Больным с легкой степенью астено-
невротического синдрома рекоменду-
ется подготовка за 2—3 нед до имплан-
тации, особенно при выполнении вме-
шательств II и III степени сложности.
Стоматолог назначает седативные и ак-
тивизирующие средства растительного
происхождения, витаминные комплек-
сы. В день операции при I и II степени
сложности за 40 мин вводят внутривен-
но 4 мл седуксена или реланиума, 5 мл
баралгина и I мг 0,1 % раствора атро-
пина сульфата. После операции психо-
фармакотерапию продолжают: назна-
чают таблетки седуксена по 0,005 г
2 раза в день, седативные и снотвор-
ные средства растительного происхож-
дения.
При нормализации психического
состояния назначают седативные сред-
ства только растительного происхож-
дения.
Среди лекарственных средств наи-
более эффективны таблетки бромкам-
форы 1—3 раза вдень, настой валериа-
ны, валокордин по 25 мл 1—2 раза в
день; для нормализации сна — экс-
тракт корня валерианы, лиственника
25 мл на ночь, 25—30 капель корвалола
(валокордина) на ночь, нервофлукс
(комплекс экстрактов лекарственных
трав), чайная ложка на стакан воды,
прием в течение суток настойки пус-
тырника, 30—40 капель 2—3 раза в
день. Эти препараты оказывают седа-
тивное, успокаивающее и легкое сно-
творное действие. Одновременно этим
пациентам до имплантации проводит-
ся курс витаминотерапии, рекоменду-
ется прием активизирующих
средств — настойки женьшеня, ли-
монника (30—40 капель 3 раза в день).
Если предполагается имплантаци-
онная хирургия III—IV степени слож-
ности, то, помимо выбранных препара-
тов, за 3 дня до операции необходимо
вводить 0,5 % раствор реланиума, 2 мл
2 раза в день. Остальные рекомендации
до операции и после аналогичны опи-
санным выше.
При астеноневротическом и тревож-
но-депрессивном синдромах в пред-
Э7П
операционную подготовку можно
включать аутотренинг. Наблюдения
показали, что благодаря аутотренингу,
который был начат за 2—3 мес до опе-
рации, больные были психологически
более подготовлены, что позволяло
уменьшать сроки медикаментозной
подготовки и снижать дозы препара-
тов.
Пациенты с тревожно-депрессивным
синдромом легкой степени выраженно-
сти консультировались у психиатра. По
его распоряжению назначали антиде-
прессанты и нейролептики:сонапакс по
25 мг на ночь, азафен по 25 мг 3 раза в
сутки. Одновременно проводили курс
лечения ноотропилом по 0,4 мг 3 раза
в день в течение 1—2 мес. Если в тече-
ние 2—3 нед отмечалось улучшение об-
щего самочувствия, больные станови-
лись более оптимистичными, спокой-
ными, у них нормализовался сон, то
хирургию 111 степени сложности дро-
били на несколько этапов (2 или 3).
Психотропные лекарственные средст-
ва назначались только согласно реко-
мендациям психиатра. Эффективность
лечения контролировали тестом "Шка-
ла общего клинического впечатления".
При оценке пунктов 1; 3.1; 3.2, конста-
тирующих отсутствие положительной
динамики лечения, по рекомендации
психиатра корригировали его. Чаще
назначались активизирующие препа-
раты, витаминные комплексы. Отсут-
ствие положительных результатов бы-
ло основанием для отказа от имплан-
тации и назначения альтернативного
лечения.
5.2. Обезболивание при зубной
имплантации
При подготовке пациента к импланта-
ционной хирургии, премедикации и
обезболивании следует прежде всего
исключить опасность операции для
здоровья пациента. Хирургические
вмешательства проводят под местной
анестезией, в том числе с премедика-
цией или под наркозом. Используют
все методы анестезии и все виды ане-
стетиков, применяемые в хирургиче-
ской стоматологии [8, 22, 27, 165].
5.2.1. Премедикация
Потенцированную местную анестезию
проводят на фоне лекарственной под-
готовки (премедикация), обеспечи-
вающей понижение реакции организ-
ма и общую аналгезию. К такой ком-
бинированной анестезии прибегают
потому, что с помощью только мест-
ных анестетиков устраняется лишь
сенсорный компонент боли, но не уда-
ется воздействовать на ее эмоциональ-
ный и вегетативный компоненты.
Учитывая характер оперативных
вмешательств при постановке имплан-
татов, необходимо с целью потенциро-
ванной анестезии провести медика-
ментозную подготовку и эффективное
местное обезболивание. Психоэмо-
циональное состояние большинства
пациентов устойчивое. Сознавая необ-
ходимость зубной имплантации для
адекватного функционального и эсте-
тического функционирования зубоче-
люстной системы, они помогают себе
и врачу.
В то же время отдельные кандидаты
на зубную имплантацию на приеме у
стоматолога испытывают тревогу,
страх, беспокойство, а иногда могут да-
же находиться в состоянии апатии или
депрессии, что служит проявлением
нервно-психического напряжения или
эмоционального стресса. Вследствие
психоэмоционального напряжения у
них могут появляться симптомы изме-
нения системы регуляции жизненно
важных функций организма: в крови
повышается содержание катехолами-
нов, гистамина, возникает спазм сосу-
дов, нарушаются процессы метаболиз-
ма (возрастает энергопотребление).
Для снятия нервно-психического
напряжения или эмоционального
стресса и изменений регуляции жиз-
ненно важных функций организма сле-
дует проводить медикаментозную под-
готовку. Выбирают лекарственные пре-
параты, воздействующие преимущест-
венно на психоэмоциональнукэ сферу
пациента. Лекарственные средства
должны влиять на разные отделы цен-
тральной нервной системы и различ-
ные уровни проведения болевой чувст-
вительности. Не усиливая местного
действия анестетика, они значительно
повышают эффект обезболивания. Ме-
дикаментозная подготовка к импланта-
ции, местное обезболивание и безбо-
лезненность операции обеспечивают
стойкое функциональное равновесие
организма и общую аналгезию.
Медикаментозная подготовка к им-
плантации с целью сохранения адапта-
ционных механизмов и профилактики
с преимущественным воздействием на
психоэмоциональную сферу значи-
тельно повышает эффект местного
обезболивания. При стабильном пси-
хоэмоциональном состоянии и поло-
жительной реакции пациента на лече-
ние с использованием имплантатов для
потенцированной местной анестезии
применяют транквилизаторы в сочета-
нии с ненаркотическими анальгетика-
ми или с антигистаминными лекарст-
венными средствами и наркотически-
ми анальгетиками. Из транквилизато-
ров рекомендуется назначать внутрь в
виде таблеток элениум, седуксен, три-
оксазин, феназепам.
У пациентов с психоэмоциональны-
ми нарушениями при медикаментоз-
ной подготовке к зубной имплантации
следует учитывать патологические ре-
акции. Если в отсутствие патологиче-
ских психоэмоциональных реакций ме-
дикаментозную подготовку проводят
традиционно, то при указанных реак-
циях премедикацию назначают с уче-
том их типа и степени выраженности.
Прежде всего у таких пациентов долж-
ны быть точно установлены показания
к зубной имплантации. При умеренно
и резко выраженных формах психоэмо-
циональных реакций имплантацию
производят только в случае неэффек-
тивности альтернативного лечения, в
том числе более простых предпротез-
ных оперативных вмешательств.
При четких показаниях к зубной им-
плантации и документальном юриди-
ческом оформлении согласия пациен-
та на лечение (знакомство с этапами
хирургических и ортопедических меро-
приятий, сроками их проведения, а
также сообщение о возможности ос-
ложнений) производят операцию.
Премедикацию проводят после оцен-
ки функционального состояния орга-
низма, учитывая артериальное давле-
ние, частоту сердечных сокращений,
частоту дыхания и психоэмоциональ-
ное состояние, т.е. на основании ком-
плексной оценки результатов диагно-
стических тестов, позволяющих вы-
явить астеноневротический, тревож-
но-депрессивный, ипохондрический и
психоорганический синдромы [3].
Наблюдения за пациентами перед
началом имплантации свидетельству-
ют о том, что все они без исключения
проявляют адекватное отношение к
зубной имплантации. Более того, нару-
шение функции и требований эстети-
ки, неэффективность предшествовав-
шей традиционной терапии, часто не-
однократной, укрепляют их готовность
к лечению с помощью имплантатов. В
то же время анализ комплексной оцен-
ки психического статуса пациентов по-
казал, что у 8 % из них отмечался ас-
теноневротический синдром, у 24 % —
тревожно-депрессивный, тогда как у
остальных 68 % психический статус
был стабильным, отмечалась полная
готовность к операции и последующе-
му ортопедическому лечению [2].
Пациентов со стабильным психо-
эмоциональным состоянием следует
готовить к операции традиционно с
учетом их возраста, сопутствующих за-
болеваний и объема предстоящего опе-
ративного вмешательства. Больным с
астеноневротическим синдромом за
1—3 нед до операции назначают тран-
квилизаторы, антидепрессанты, ней-
ролептики. Дозы подбирают индиви-
дуально. Длительность курса зависит от
степени сложности имплантационной
хирургии: в случаях, когда предстоит
операция I и II степени сложности, ле-
чение продолжают в течение 1 нед, при
III и IV — 2 или 3 нед.
Наблюдение за пациентами с тре-
вожно-депрессивным синдромом сви-
детельствует о том, что хотя перед опе-
рацией у них проявлялось чувство тре-
воги и страха, но случаев отказа от им-
плантации, просьб об использовании
других методов лечения не было. Пред-
операционная подготовка включает
назначение антидепрессантов и нейро-
лептиков за 1 нед до имплантации, а за
10—20 мин до ее начала показано внут-
ривенное введение реланиума.
Пациентам с ипохондрической ре-
акцией зубная имплантация противо-
показана, так как методы их предопе-
рационной подготовки еще не разра-
ботаны. Главная сложность заключает-
ся в трудности общения с ними, невы-
полнении ими рекомендаций по об-
следованию и подготовке полости рта
к операции.
Противопоказанием к зубной им-
плантации могут быть также неадек-
ватные поведенческие характеристики
и установление на основании ком-
плексного обследования истерическо-
го синдрома. Для таких пациентов ха-
рактерно непонимание определенных
требований к лечению с применением
имплантатов, отсутствие четкой воли и
желания пройти длительное лечение.
Больные, у которых при сборе анам-
неза были заподозрены органические
нарушения центральной нервной сис-
темы, должны пройти обследование
психологического статуса по соответ-
ствующим тестам, а также получить у
психиатров заключение о возможности
операции. В литературе данных о зуб-
ной имплантации у таких пациентов
нет.
Методика премедикации и предопе-
рационной подготовки к оперативным
вмешательствам разной степени слож-
ности разработана для пациентов с нор-
мальной психикой, при астеноневроти-
ческом или тревожно-депрессивном
синдроме их проводят после тестирова-
ния.
Перед имплантационной операцией I
и II степени сложности больным с лег-
кой формой асгеноневротического син-
дрома за 30—40 мин до имплантации
седуксен назначают внутрь (0,3 мг/кг),
при умеренной — в виде 0,5 % раство-
ра вводят внутривенно в той же дозе в
одном шприце с 0,1 % раствором атро-
пина (0,6—0,8 мл). При введении атро-
пина необходимо контролировать
пульс. В случае выраженной тахикар-
дии атропин лучше не вводить. В слу-
чаях выраженного астеноневротиче-
ского синдрома внутривенное введе-
ние седуксена (0,3 мг/кг) дополняют
введением лексира (0,5 мг/кг).
Такой же должны быть подготовка
при имплантации III степени сложно-
сти у пациентов с легкими и умеренно
выраженными нарушениями психо-
эмоционального состояния.
При астеноневротическо.м и тревож-
но-депрессивном синдромах должны
быть установлены показания к длитель-
ному хирургическому и ортопедическому
лечению. Необходимо использовать аль-
тернативные методы протезирования.
При принятии окончательного решения
о проведении лечения с использованием
имплантатов, согласно рекомендациям
психоневролога или психиатра, прово-
дят медикаментозную подготовку.
Оперативные вмешательства при
зубной имплантации эффективнее про-
водить с использованием легкой, спо-
койной, приятной музыки, что создает
атмосферу расслабления, успокоения,
улучшает настроение и повышает у па-
циента уверенность в успехе лечения.
5.2.2. Местная анестезия
Местная анестезия осуществляется в
виде инфильтрационного и проводни-
кового обезболивания. При инфильт-
рационной анестезии выключаются
периферические рецепторы, воспри-
нимающие болевые раздражения. При
проводниковой анестезии блокируется
нервный ствол, чаще периферические
ветви тройничного нерва — верхнече-
люстной и нижнечелюстной.
Местные анестетики воздействуют
на мембрану нервной клетки, которая
осуществляет генерирование и переда-
чу нервного импульса. Мембрана пред-
ставляет собой биомолекулярную ли-
пидную основу, расположенную между
мономолекулярными слоями полипеп-
тидов, и обладает свойствами полупро-
ницаемой оболочки. Возбуждение пе-
редается путем поляризации, деполя-
ризации и реполяризации [8].
Взаимодействие местных анестети-
ков с рецепторными образованиями
нервной мембраны приводит к блокаде
проводимости. Она поддерживается за
счет соответствующих связей между
местным анестетиком и фосфолипида-
ми мембраны, что препятствует сво-
бодной проходимости трансмембран-
ных канальцев. Местные анестетики
относятся к синтетическим ароматиче-
ским или гетероциклическим соедине-
ниям и делятся на две основные груп-
пы — эфирные и амидные. Эфирные
соединения являются аминобензойны-
ми кислотами эфира и в настоящее
время мало применяются из-за их ток-
сичности [165].
Из таких препаратов в России ис-
пользуются новокаин в виде 1—2 %
раствора. Высшие дозы для импланта-
ции — 100 мл 1 % раствора и 30 мл 2 %
раствора. Новокаин имеет ряд недос-
татков, а именно: продолжительность
анестезии новокаином не превышает
30 мин. Кроме того, в последние годы
увеличилось число случаев его токси-
ческого действия, когда после анесте-
зии появляются головокружение, сла-
бость, тошнота, бледность кожи, пото-
отделение, возбуждение, тахикардия,
поверхностное дыхание. При выра-
женной реакции организма на новока-
ин перечисленные явления могут усу-
губляться значительным нарушением
дыхания вплоть до апноэ и отека лег-
ких, могут развиваться судороги. Это
может быть связано как с попаданием
новокаина в кровяное русло, так и с
токсической или аллергической реак-
цией организма на анестетик. Аллерги-
ческие реакции на новокаин проявля-
ются в виде таких симптомов, как
бронхоспазм, отек Квинке, высыпания
на коже, зуд, дерматит. Для профилак-
тики осложнений необходимо тща-
тельно изучить анамнез в отношении
переносимости новокаина. Особое
внимание следует обращать на пациен-
тов с болезнями, сопровождающимися
снижением холинэстеразной активно-
сти сыворотки крови, и, возможно,
скрытыми формами тиреотоксикоза,
гепатита и других заболеваний, осо-
бенно аллергической природы.
Для местного обезболивания чаше
применяют неэфирные соединения, от-
носящиеся к амидам, которые в отли-
чие от сложных эфиров не подвергают-
ся гидролизу под действием холинэсте-
разной плазмы крови. Среди них наи-
более распространенными являются
три мекай н (мезокаин), лидокаин (кси-
локаин), артикаин (ультракаин, септо-
нест), бупивакаин (меркаин, карбосте-
зин), мепивакаин (рис. 5.3). Хотя ане-
стетики амидной группы редко вызы-
вают токсическую реакцию, некоторые
из них способны оказывать слабое ва-
зоплегическое и гипотензивное дейст-
вие, несколько снижать сократитель-
Рис. 5.3. Местное обезболивание при
внутрикостной зубной имплантации:
анестетики в карпулах, шприц — держа-
тель карпул, иглы разных размеров.
ную способность миокарда. Это следу-
ет иметь в виду при лечении больных с
сердечно-сосудистыми и почечными
заболеваниями. Кроме того, к отдель-
ным анестетикам этой группы может
быть индивидуальная повышенная
чувствительность.
Тримекаин применяют как местный
анестетик в 1 % и 2 % растворе. Выс-
шая разовая доза его составляет 100 мл
1 % раствора и 20 мл 2 % раствора.
Тримекаин оказывает обезболивающее
действие и превосходит новокаин по
быстроте наступления анестезии в 2
раза, по выраженности обезболиваю-
щего эффекта — в 2—2,5 раза, по про-
должительности анестезии — в 3 раза.
Токсичность тримекаина невелика, ал-
лергические реакции наблюдаются
редко. В случае их развития возникаю-
щие симптомы аналогичны проявле-
ниям токсического действия новокаи-
на. Не рекомендуется вводить триме-
каин одновременно с такими антибио-
тиками, как пенициллин, бициллин,
стрептомицин, так как это может при-
вести к анафилактическим реакциям.
Среди анестетиков наибольшее при-
менение имеет лидокаин (ксилокаин)
в виде 1—2 % раствора. Высшая разо-
вая доза лидокаина составляет 50 мл
1 % или 2 % раствора, но S. Malamed
[165] считает, что максимальная доза
должна составлять 26—35 мл. Лидока-
ин является сильным анестетиком и
обеспечивает более глубокую и про-
должительную анестезию, чем новока-
ин и тримекаин. Аллергические реак-
ции на препарат возникают редко. Од-
нако он токсичен и противопоказан
при сердечно-сосудистых заболевани-
ях, болезнях печени и почек.
Бупивакаин (маркаин, карбостезин)
является сильным анестетиком, пре-
восходя по продолжительности и глу-
бине действия описанные выше, но
при этом токсичнее их. Его применяют
при имплантации в виде 0,25—0,5 % и
0,75 % растворов. Высшая доза бупи-
вакаина 175 мл. При индивидуальной
токсической реакции на препарат раз-
виваются типичные для всех амидных
анестетиков осложнения, но этот пре-
парат считается наиболее безопасным
из них.
Артикаин (ультракаин ДС и ультра-
каин ДС-форте, септонест) является
малотоксичным и высокоэффективным
анестетиком. Он менее токсичен, чем
лидокаин, и его обезболивающий эф-
фект в 5 раз выше, чем новокаина. Ане-
стетик обладает высокой связываемо-
стью с белками и низкой жирораство-
римостью. Это, как и низкая концен-
трация в нем адреналина, обусловлива-
ет его безопасность у пожилых пациен-
тов с сопутствующими сердечно-сосу-
дистыми заболеваниями. Вместе с тем
при нарушениях ритма сердца (тахикар-
дия, тахиаритмия), а также при глауко-
ме ультракаин ДС противопоказан.
Препарат выпускается в виде карпул
ультракаина ДС, содержащего в I мл
40 мг артикаина гидрохлорида, 0,006 мг
эпинефрина (адреналина) гидрохлорШ* |
и 0,5 мг натрия дисульфата. В 1 мл ульт-
ракаина ДС-форте содержится 40 мг
артикаина гидрохлорида, 0,012 мг эпи-
нефрина гидрохлорида и 0,5 мг натрия
дисульфата. Рекомендуется применять
препарат в максимальной одноразовой
дозе 12—14 мл. Однако, по мнению
S. Malamed [165], она составляет 37—
84 мл.
Артикаин редко вызывает осложне-
ния. Для профилактики побочного
действия артикаина необходимо пред-
варительно выяснить, имеется ли у па-
циента повышенная чувствительность
к препарату, а также к эпинефрину.
Имплантацию, особенно с поста-
новкой нескольких имплантатов, а
также с одновременной пластикой,
лучше проводить, обезболивая ткани
ультракаином ДС-форте. При поста-
новке одного имплантата местная ане-
стезия может быть проведена ультра-
каином ДС. Анестезия наступает через
1,5—3 мин, продолжительность ее 1,5 ч
и более.
При использовании для местной
анестезии анестетиков (тримекаин, ли-
докаин, бупивакаин, артикаин) следу-
ет применять препараты, пролонги-
рующие их действие. Сосудосуживаю-
щие лекарственные средства в анесте-
зирующих растворах позволяют умень-
шить токсическое действие местных
анестетиков за счет замедления их вса-
сывания, увеличить выраженность и
продолжительность обезболивания и
благодаря этому повысить эффектив-
ность местной анестезии. Помимо это-
го, сосудосуживающие средства замед-
ляют поступление анестетика в крово-
ток, и возможность развития токсиче-
ской реакции на препарат уменьшается.
К раствору анестетика добавляют
0,1 % раствор адреналина гидрохлори-
да в соотношении 1:100 000, т.е. 1—2
капли на 5 мл анестетика, или 0,02 %
раствор норадреналина в соотношении
1:50 000, а также фелипрессин. Выпус-
каемые в цилиндрических карпулах
(ампулах) анестетики могул содержать
сосудосуживающие вещества (адрена-
лин, норадреналин) в концентрации
1:100 000, а при необходимости и в бо-
лее низкой — 1:200 000. В импланта-
ционной хирургии добавление вазо-
констриктора к анестетику обеспечи-
вает хороший обзор тканей и бескров-
ность операции.
Следует помнить, что введение в
анестетик сосудосуживающего средства
может вызывать токсическую реакцию
в виде тахикардии, гипертензии, голов-
ной боли, чувства беспокойства, тремо-
ра, реже брадикардии. Это связано с
Действием сосудосуживающего препа-
рата на бета-рецепторы и непосредст-
венно с их стимуляцией, что ведет к
Увеличению сердечного выброса и та-
хикардии. Побочные действия сосудо-
суживающих средств могут быть связа-
ны с повышением их концентрации в
растворе анестетика, нарушением пра-
вил анестезии, вследствие чего препа-
рат быстрее попадает в кровеносное
русло. Применение стандартных ампу-
лированных растворов, в которых кон-
центрация сосудосуживающего средст-
ва строго соответствует концентрации
анестетика, позволяет предупреждать
неблагоприятные реакции. В группе
риска лучше применять анестетики без
адреналина, наиболее эффективен 3 %
раствор мепивикаина без вазоконст-
риктора.
Перед введением анестетика по-
лость рта обрабатывают антисептиком.
Для этого эффективнее всего 0,12 %
раствор хлоргексидина. Зубную им-
плантацию осуществляют под провод-
никовой и инфильтрационной анесте-
зией. Для местной анестезии применя-
ют шприцы различной конструкции
(из стекла, пластмассы, стекла и метал-
ла) и емкости (1; 2; 5; 10 и 20 мл), при
имплантации — пластмассовые или
комбинированные шприцы емкостью 2
и 5 мл. Для инфильтрационной анесте-
зии используют иглы длиной около 3 см
и диаметром 0,5—0,7 мм, для провод-
никовой — длиной 4—8 см и диамет-
ром 0,7—1 мм. Острый конец иглы
скошен под углом 45 шлиф скоса
должен иметь вогнутый или плоский
профиль. При имплантации точность
дозировки и нужный объем вводимого
анестетика, меньшую болезненность
лучше всего обеспечивает карпульная
упаковка. Карпулы выпускаются объе-
мом от 0,7 до 2 мл, чаще 1,7—1,8 мл. К
ним придаются одноразовые двухкон-
цевые иглы разного диаметра и длины.
Карпулы с анестетиком и иглы фикси-
руют в металлическом держателе —
шприце, который позволяет быстро и
удобно заменять карпулы. Одноразо-
вые двухконцевые иглы малотравма-
тичны, и инъекция ими менее болез-
ненна. Кроме того, такая комплекта-
ция шприца не позволяет анестетику
возвращаться из ткани в карпулу, обес-
печивает простоту' и надежность аспи-
рационной пробы. Выбор нужного раз-
мера (длина и диаметр) игл создают
оптимальное для имплантации депо
анестетика, снижают степень травми-
рования слизистой оболочки и надко-
стницы вблизи создаваемого для им-
275
плантата ложа и тем самым способст-
вуют адекватному кровообращению на
участке операции.
Обезболивание требует четкого
представления об анатомо-топографи-
ческих особенностях участка кости че-
люсти, на котором предполагается
сформировать ложе имплантата, и об
индивидуальных характеристиках ко-
личества и качества кортикального и
губчатого вещества кости, в том числе
изменениях, произошедших за счет ат-
рофии. Соответственно этому должны
быть выбраны вид анестезии, анесте-
тик, его необходимое количество для
адекватного обезболивания. С.А. Раби-
нович и соавт. [19] рекомендуют в от-
сутствие факторов риска применять
препараты артрикаинового ряда с вазо-
констриктором (адреналином, норад-
реналином, их аналогами) в концен-
трации 1:100 000 или 1:200 000, что да-
ет возможность проводить импланта-
цию безболезненно. При малом расхо-
де анестетика эффект обезболивания
обеспечивается в течение 1—3 ч. Для
пациентов, страдающих артериальной
гипертонией, коронарной недостаточ-
ностью, диабетом, заболеваниями по-
чек, анестетиком выбора является ме-
пивакаин без вазоконстриктора [19].
Инфильтрационную анестезию при
зубной имплантации проводят по об-
щим правилам, но депо анестетика ре-
комендуется создавать под слизистой
оболочкой. Следует помнить, что пи-
тание кости происходит в основном за
счет экстраоссальных сосудов. Не ре-
комендуется вводить анестетик под
надкостницу, так как ее отслоение от
кости может нарушить кровоснабже-
ние участка челюсти и отрицательно
сказаться на приживлении импланта-
та. Не следует также вводить анестетик
внутрикостно, поскольку это всегда
ведет к повреждению костных струк-
тур. Проводить интралигиментарную
анестезию в зоне остеотомии и поста-
новки имплантата необходимости нет.
При инфильтрационной анестезии
количество анестетика и локализация
депо зависят от особенностей после-
дующих разрезов, рассечений и от-
слоений мягких тканей, которые по-
требуются конкретно для каждой им-
плантации и должны соответствовать
особенностям кровоснабжения слизи-
стой оболочки, надкостницы и кости
каждого участка челюсти.
Для инфильтрационной анестезии
лучше использовать короткие иглы
(длиной 16—32 мм, с наружным диа-
метром 0,3—0,4 мм), проводниковой —
длинные (длиной 35, 38, 42 мм, диа-
метром 0,4—0,9 мм). Для полной без-
болезненности вкола иглы и инъеци-
рования в ткани анестетика следует
нужный участок слизистой оболочки
обезболить наложением поверхност-
ного аппликационного лекарственного
средства — 5 % пирамикаиновой мази,
ксилокора, крема "Емла" и др.
Не рекомендуется травмировать тка-
ни иглой, вводя ее несколько раз в од-
но и то же место, меняя ее направление
в тканях. Анестетик надо вводить мед-
ленно, контролируя положение конца
иглы по отношению к сосудам. Попа-
дание анестетика в кровеносное русло
нежелательно, так как вследствие этого
может развиться общая токсическая
реакция, поэтому проводят аспираци-
онную пробу в тканях, где много сосу-
дов и существует опасность внутрисо-
судистого введения.
При установлении нескольких им-
плантатов на верхней челюсти в области
резцов и клыка применяют инфраорби-
тальную анестезию, блокируя внутри-
ротовым способом периферические
ветви подглазничного нерва — малую
"гусиную лапку" и передние верхние
альвеолярные ветви. В силу анастомо-
зирования ветвей малой "гусиной лап-
ки" с правой и левой стороны иногда
приходится проводить инфильтраци-
онную анестезию с противоположной
стороны. Иглу вкалывают около клы-
ка, анестетик впрыскивают в подсли-
зистую ткань у резцов.
Для обезболивания слизистой обо-
лочки с небной стороны анестезию
проводят внутриротовым методом в
области резцового отверстия. Перед
этим обязательно осуществляют ап-
пликационную анестезию резцового
сосочка. Медленно продвигают иглу в
резцовом канале, вводя 0,1—0,3 МЛ
анестетика. На глубине 1 см дополни-
тельно вводят 0,1—0,2 мл обезболи-
вающего раствора для блокирования
веточек нервов, участвующих в иннер-
вании фронтальных зубов. При значи-
тельной атрофии кости, смешении рез-
цового сосочка и соответственно кана-
ла носонебный нерв блокируют внеро-
товым доступом. После аппликацион-
ной анестезии нижних носовых ходов
делают два вкола иглы в области носо-
небного углубления у основания пере-
городки носа и вводят по 0,5 мл ане-
стетика.
На верхней челюсти в районе резцов
и клыка при имплантации не следует
проводить инфильтрационную анесте-
зию. С одной стороны, она может не
дать полного обезболивающего эффек-
та за счет плотной наружной стенки
кости, с другой — может нарушить ар-
хитектонику слизистой оболочки соот-
ветственно зубочелюстному сегменту
ложа имплантата. Это может создать
неправильное представление о величи-
не слизисто-надкостничного лоскута,
что осложнит глухое зашивание раны.
При помощи подглазничной анесте-
зии может также проводиться имплан-
тация в области премоляров с введени-
ем анестетика в устье канала, а также
выключать носонебный и большой
небный нервы. В зависимости от гра-
ниц рассечений мягких тканей в неко-
торых случаях может потребоваться ин-
фильтрационная анестезия в области
моляров. Нежелательно выключение
задних верхних альвеолярных нервов
при помощи туберальной анестезии.
Обезболивание у подглазничного
отверстия позволяет создавать депо
анестетика до входа в канал и тем са-
мым не только адекватно отключать
средние и передние альвеолярные вет-
ви, но и не травмировать сосудисто-
нервный ствол. В области резцов и
клыка иногда также может потребо-
ваться аппликационная анестезия
нижнего носового хода для выключе-
ния веточек, расположенных на дне
верхнечелюстной пазухи.
Проводя имплантацию в области
моляров, следует выключать верхние
задние альвеолярные ветви при помо-
щи туберальной анестезии. Для обез-
боливания слизистой оболочки с неб-
ной стороны осуществляют анестезию
в области большого небного отверстия.
Проводя туберальную анестезию,
следует учитывать степень атрофии аль-
веолярного отростка верхней челюсти и
ориентироваться на скулоальвеоляр-
ный гребень; иглу вкалывают позади
него. Необходимо особенно четко кон-
тролировать продвижение иглы по буг-
ру верхней челюсти кверху, кзади и
внутрь, непрерывно выпуская раствор
анестетика (общее количество 1,7—
1,8 мл). Это в известной мере предот-
вращает повреждение крыловидного
венозного сплетения.
При имплантации в области первого
моляра может возникнуть необходи-
мость в дополнительной инфильтраци-
онной анестезии соответственно зубу
или выключении верхних средних аль-
веолярных ветвей путем подглазничной
анестезии. Это обусловлено тем, что
первый моляр дополнительно получает
веточки от верхних средних альвеоляр-
ных нервов. Наилучший уровень обез-
боливания, асептики достигается при
блокировании задних альвеолярных
нервов внеротовыми способами. При-
меняя внеротовые методы туберальной
анестезии, необходимо определить и
учитывать индивидуальные анатомо-
топографические ориентиры, чтобы
исключить травмирование сосудов.
В отдельных случаях при импланта-
ции на верхней челюсти III и IVстепе-
ни сложности показано выключение
верхнечелюстного нерва в крыловид-
но-небной ямке. При этом наиболее
простым является подскуловой путь по
Брауну или Вайсблату.
Можно использовать подскуловой
путь, вкалывая иглу в области щеки под
нижним краем скуловой кости соответ-
ственно скулоальвеолярному гребню.
Иглу продвигают по мягким тканям
щеки вверх, назад и внутрь на глубину
5 см. проходя между крыловидным от-
ростком основной кости и бугром
верхней челюсти. В крылонебную ямку
вводят 3—5 мл раствора анестетика.
Раствор диффундирует к круглому от-
верстию и блокирует верхнечелюстной
нерв [27].
Для выключения верхнечелюстного
нерва применяют внутриротовой спо-
соб. Иглу вводят через большое небное
отверстие и продвигают вверх на глу-
бину 3 4 см в крыловидно-небном ка-
нале. Раствор анестетика в количестве
2—3 мл диффундирует к круглому от-
верстию, выключая верхнечелюстной
нерв. Если имплантация сопровожда-
ется кровотечением из мелких сосудов
и истечение крови мешает операции,
следует ввести в мягкие ткани анесте-
тик по типу инфильтрационной ане-
стезии.
На нижней челюсти имплантацию
производят также под инфильтрацион-
ной и проводниковой анестезией.
Обезболивание нижнего альвеолярно-
го нерва в области отверстия нижней
челюсти (так называемая мандибуляр-
ная анестезия) осуществляется внутри-
или внсротовым доступом.
При имплантации в районе моляров
дополнительно выключается щечный
нерв. Если же имплантат ставят в рай-
оне медиального корня первого моляра,
необходимо дополнительно провести
инфильтрационную анестезию с языч-
ной стороны соответственно этому уча-
стку челюсти. Делать это необходимо
потому, что в иннервации этого района
участвуют чувствительные волокна че-
люстно-подъязычного нерва [165].
Значительная атрофия нижней че-
люсти затрудняет определение точек
для вкола иглы при мандибулярной
анестезии [8]. Особенно трудно уста-
новить месторасположение височного
гребня. В таких случаях используют
метод Гоу—Гейтса и его модификации
по Рабиновичу [27]. В отдельных слу-
чаях приходится выключать язычный
нерв в дистальном отделе челюстно-
язычного желобка на уровне середины
коронки третьего нижнего моляра.
При имплантации на нижней челю-
сти следует учитывать индивидуальную
анатомию канала нижней челюсти и
его взаимоотношений с будущим им-
плантатом. При опасности поврежде-
ния канала нижней челюсти во время
остеотомии вначале проводят ин-
фильтрационную анестезию. Это по-
зволяет контролировать местоположе-
ние нерва и предупреждать его повре-
ждения. После уточнения во время
операции анатомии канала нижней че-
люсти и его взаимоотношений с им-
плантатом осуществляют проводнико-
вую анестезию — выключение нижне-
го альвеолярного нерва.
Производя имплантацию в подборо-
дочном отделе нижней челюсти, необ-
ходимо выключать подбородочный
нерв. Это может быть сделано внутри-
или внеротовым методом. В отдельных
случаях из-за большого числа анасто-
мозов подбородочный нерв выключа-
ют с обеих сторон. Для точности вы-
ключения подбородочных нервов ре-
комендуется проследить по ортопанто-
грамме ход канала нижней челюсти.
Это важно также для профилактики
повреждения подбородочного нерва.
Во избежание этого осложнения вна-
чале следует провести инфильтрацион-
ную анестезию на участке челюстного
сегмента, где планируется постановка
имплантата.
С большой осторожностью манипу-
лируют в области подбородочного от-
верстия, кпереди и кзади от него. Толь-
ко после уточнения места выхода нерва
и расположения его петли на поверх-
ности челюсти делают проводниковую
анестезию.
При имплантации IV степени слож-
ности может потребоваться выключе-
ние нижнечелюстного нерва у оваль-
ного отверстия по Вайсблату. Выклю-
чают все ткани и органы, получающие
иннервацию от третьей ветви тройнич-
ного нерва. Поскольку могут возник-
нуть общие и местные осложнения, та-
кую анестезию рекомендуется прово-
дить в условиях стационара.
5.2.3. Общее обезболивание
Под общим обезболиванием имплан-
тационная хирургия проводится толь-
ко при нарушениях психоэмоциональ-
ного состояния, в том числе лабильно-
сти психики, а также при непереноси-
мости местных анестетиков. Наркоз и
операцию проводят только при реше-
нии всех медицинских и юридических
вопросов зубной имплантации.
В поликлинике ингаляционный нар-
коз применяется в специальном ане-
стезиологическом кабинете или в опе-
рационной по правилам общего обез-
боливания врачом-анестезиологом и
сестрой-анестезисткой [15, 23]. Ис-
пользуют общий анестетик, обеспечи-
вающий безопасность и непродолжи-
тельный (не более 1,5 ч) посленаркоз-
ный период. Психологическая медика-
ментозная подготовка пациента к нар-
козу и операции дополняется введением
за 45 мин до нее 0,5—1 мл 0,1 % рас-
твора атропина сульфата, а также от-
дельным неуравновешенным больным
за 2—3 дня назначают малые транкви-
лизаторы.
Имплантационную хирургию под
наркозом проводят также в стациона-
ре. Это показано в случаях достаточно
сложных методик операций, в том чис-
ле с одномоментной пластикой ауто-
трансплантатами гребня подвздошной
кости, ребра, малой берцовой или лу-
чевой кости, а также биокомпозицион-
ными материалами. Используют инга-
ляционный эндотрахеальный наркоз.
Преимущество его в стационаре в том,
что может быть увеличено время опе-
ративного вмешательства.
5.3. Особенности операций
при зубной имплантации
Главный фактор успеха хирургических
манипуляций при зубной имплантации
заключается в их безукоризненной и
тщательной технике, обеспечивающей
минимальную травму твердой и мягкой
ткани [ПО, 166, 258]. Оперативные
вмешательства при лечении с помощью
внутрикостных имплантатов должен
проводить врач-стоматолог с опытом
работы по профилю хирургической
стоматологии. Оперирующий хирург
обязан пройти постградуальную спе-
циализацию по хирургической стома-
тологии в клинической ординатуре или
аспирантуре, а его клиническая подго-
товленность должна быть оценена по
высшей квалификационной врачебной
категории. Квалификация специалиста
должна позволять ему работать как в
поликлинике, так и в стационаре.
Хирург-стоматолог работает в кон-
такте с врачами других специально-
стей. Комплексной работой стомато-
логов хирургического, терапевтическо-
го и ортопедического профиля обеспе-
чивается правильный отбор пациен-
тов, должная подготовка их к опера-
ции, адекватность действий как на всех
этапах хирургического и ортопедиче-
ского лечения, так и при последующей
реабилитации и контрольном наблю-
дении [237].
Рис. 5.4. Система охлаждения.
Показания к внутрикостной им-
плантации, тип и число имплантатов,
как и все этапы лечения, устанавлива-
ют после клинического, рентгенологи-
ческого и других исследований [169а].
Перед операцией на основе анато-
мических особенностей челюстей и
окклюзии хирург совместно с ортопе-
дом составляют план лечения и опре-
деляют необходимое количество и рас-
положение имплантатов.
Остеотомия и работа режущим ин-
струментом в кости при имплантации
производятся обязательно с охлажде-
нием (рис. 5.4). В качестве охлаждаю-
щей жидкости используют изотониче-
ский раствор натрия хлорида, рас-
творы Рингера—Локка, хлоргексидина
(0,12 %), элюдрила. Два последних
препарата применяют с изотониче-
ским раствором натрия хлорида 1:3.
Однако следует иметь в виду нежела-
тельное токсическое действие раство-
ров хлоргексидина и его производных
на губчатую кость. Физиодиспенсеры,
через которые подается охлаждающая
жидкость, преимущественно осущест-
вляют наружное охлаждение. Внутрен-
нее или сочетание внутреннего и на-
ружного охлаждения применяют в за-
висимости от характера остеотомии.
Категорически нельзя работать при ос-
теотомии турбиной с подачей воздуха
во избежание воздушной эмболии.
5.3.1. Имплантация конструкций
в форме корня зуба
В настоящее время во всех странах
применяют главным образом имплан-
таты в форме корня зуба. Планирова-
ние лечения проводят по правилам, из-
ложенным в главах 3 и 4. Особого вни-
мания требует стратегия лечения при
адентии [174, 207, 212J. По сравнению
с плоскими конструкциями импланта-
ты в форме корня зуба считаются пред-
почтительными из-за техники остеото-
мии и минимального травмирования
кости при создании ложа [76]. Однако
имплантаты в форме корня зуба уступа-
ют плоским конструкциям в том, что
для них требуется кость большей шири-
ны. Кроме того, на тот же участок при-
ходится ставить большее число имплан-
татов и, как правило, не допускать со-
единения протезов с естественными зу-
бами, хотя отдельные конструкции, та-
кие как JMZ, предназначены для вклю-
чения с зубами. В последние годы это
традиционное правило не соблюдается
многими специалистами. D. Lundgren и
L. Laurell [162] считают возможным
шинировать одиночный внутрикост-
ный имплантат даже с зубами, которые
слегка подвижны. При пародонтите I—
11 степени это позволяет снизить под-
вижность зубов и даже укрепить их.
Имплантаты в форме корня зуба —
винтовые, винтовые самонарезные,
цилиндрические и винтоцилиндриче-
ские (погружные и непогружные) —
применяют соответственно при двух-
этапном или одноэтапном оператив-
ном вмешательстве. Большое значение
имеет дифференцированный подход к
выбору имплантата, его обработке и
покрытию поверхности [114]. Как для
цилиндрических, так и для винтовых
имплантатов, особенно для одиночных
зубов, имеют значение аитиротацион-
280
ные свойства 1160]. Одноэтапные непо-
гружные имплантаты ставят в кость
так, чтобы их надальвеолярная часть
выступала в полость рта. Благодаря
этому не требуется второй хирургиче-
ский этап — вскрытие имплантата. Од-
нако общепризнано, что если позволя-
ют условия лечения, то предпочтитель-
нее использовать погружные имплан-
таты в форме корня зуба. Большинство
авторов считают их более стабильными.
По их мнению, надежность обеспечи-
вают: 1) полное погружение импланта-
та в кость; 2) создание над ними плот-
ного слизисто-надкостничного покро-
ва, исключающего прямой контакт с
ротовой полостью; 3) отсутствие в пери-
од приживления имплантата, т.е. до
второго этапа имплантационной хирур-
гии, функциональной нагрузки. Вместе
с тем в последние 3—4 года все чаще
прибегают к одноразовому вмешатель-
ству и даже применяют его при немед-
ленной имплантации [108а].
Винтовые имплантаты в форме кор-
ня зуба имеют определенные преиму-
щества перед цилиндрическими конст-
рукциями. Их резьбовая поверхность
значительно увеличивает общую пло-
щадь прямого контакта с костью. От-
дельные винтовые имплантаты, напри-
мер "Replace" ("Steri-Oss"), имеют бо-
лее выраженную и, следовательно, бо-
лее агрессивную резьбу в пришеечной
части, что обеспечивает лучшее соеди-
нение с костью. Помимо этого, благо-
даря резьбе они лучше, чем цилиндри-
ческие конструкции, противостоят
вертикальному смещению, силы кото-
рого в процессе реконструкции кост-
ной ткани имеют тенденцию к вытал-
киванию имплантата из ложа. Однако,
учитывая эти достоинства винтовых
имплантатов, следует иметь в виду, что
они более, чем цилиндрические, чувст-
вительны к качеству кости. Установить
винтовые имплантаты в верхнюю че-
люсть значительно труднее, чем в ниж-
нюю. Мы считаем проблематичным
установление винтовых имплантатов в
верхнюю челюсть из-за ее рыхлого
строения и тонкого слоя кортикальной
кости. В частности, фирма "Napbel-
pharma" рекомендовала ставить выпус-
каемые сю имплантаты в форме корня
зуба в кост». верхней челюсти лишь Н
типа только тем хирургам, которые
имеют опыт постановки не менее 20
подобных имплантатов в нижнюю че-
люсть.
Отмечая достоинства винтовых им-
плантатов, нельзя не упомянуть, что
они не лишены некоторых недоспи
ков. Главный из них заключается в
том, что остеотомия и установление
имплантата по сравнению с таковыми
при использовании цилиндрических
конструкций более травматичны и тре-
буют больше времени.
Традиционно имплантаты в форме
корня зуба требуют более длительных
сроков заживления перед окончатель-
ной нагрузкой, хотя в последние годы
мы оспариваем это положение и счита-
ем, что кость классов DI—D4 способна
выдерживать раннюю функциональ-
ную адаптацию. По мнению С. Misch
[176] и J. Lozada (177], имплантат мож-
но подвергать прогрессирующей на-
грузке. Однако, для того чтобы гово-
рить о благоприятном прогнозе, отда-
ленных наблюдений еше недостаточно.
Места установления имплантатов,
их тип и необходимое количество оп-
ределяются при планировании опера-
ции, в ходе клинико-лабораторной диа-
гностики. Решающим является атро-
фия кости челюсти. В зависимости от
степени уменьшения высоты и шири-
ны альвеолярных отростков челюстей
можно прогнозировать число и коли-
чество имплантатов, а также прогноз
операции (рис. 5.5). Следует всегда
быть готовым к тому, что после скеле-
тирования кости даже самая тщатель-
ная предоперационная оценка может
оказаться неточной. В таких случаях
приходится уже в ходе операции кор-
ректировать первоначальный план и
лаже изменять место постановки им-
плантата или угол наклона его ложа.
При установлении имплантатов сле-
дует помнить о необходимой величине
кости между ними и отдельными ана-
томическими образованиями. Эти пра-
вила касаются как винтовых, так и ци-
линдрических имплантатов. Допусти-
мые расстояния от имплантата до от-
дельных анатомических образований
следующие: до канала нижней челюсти
и нижнего альвеолярного нерва — 2 мм,
До подбородочного отверстия — 5 мм,
Рис. 5.5. Оценка возможности установ
ления имплантатов на разных участках
челюстей и прогноз исхода операции,
а — при достаточности кости; б — при атрО'
фин кости (Spiekermann Н. et al., 1995|.
до дна верхнечелюстной пазухи и дна
носа — 1—2 мм [234], резцового
канала — 2 мм (рис. 5.6). Хотя многие
исследователи ставили имплантаты на
меньшем расстоянии от этого отвер-
стия [48, 173, 230], J. Bavitz и соавт.
[57] считают, что повреждения мен-
тального нерва можно избежать, если
дистальная поверхность имплантата
будет находиться не менее чем в 1 мм
от медиальной границы ментального
отверстия. Свой вывод они обосновы-
вают тем, что у 27 изученных ими тру-
пов наименьшее расстояние от нерва
кпереди и медиально по отношению к
б
передней стороне подбородочного от-
верстия составляло 1 мм. Имплантат
не должен располагаться в области рез-
цового сосочка или резцового канала,
и расстояние от основания нижней че-
люсти должно быть не менее 1 мм [48,
73, 230]. Расстояние между импланта-
том и естественным зубом должно со-
ставлять 1—2 мм.
ЭкЭ
Рис. 5.6. Расстояние имплантата от важ-
нейших анатомических структур лицево-
го черепа.
а — канала нижней челюсти; б — подбородоч-
ного отверстия и петли одноименного нерва;
в — дна полости носа; г — дна верхнечелюст-
ной пазухи; д — резцового канала.
Если ставят несколько имплантатов,
то между их краями должен быть про-
межуток, равный их диаметру, но не
менее 3 мм, а расстояние до зуба, ко-
торый будет служить второй опорой
зубного протеза, — не менее 2 мм. Та-
кие расстояния обеспечивают кости
жизнеспособность и облегчают гигие-
ну имплантатов после постановки про-
теза. Для прочности всей конструкции
важно также, чтобы после установле-
ния имплантата с язычной стороны
кости оставалось не менее 1 мм, а с
вестибулярной — не менее 0,5 мм
[178]. Имеется мнение, что это рас-
стояние может быть равно 0,5 мм со
всех сторон, но только в тех случаях,
когда зуб не включен в конструкцию
протеза (рис. 5.7).
Накоплено достаточно сведений об
успешном установлении имплантатов
в форме корня зуба практически во все
костные сегменты челюстей. Небезын-
тересно в связи с этим отметить, что
разработчики таких имплантатов вна-
чале предполагали использовать их
лишь при полной адентии и только на
передних участках верхней и нижней
челюстей в качестве опоры съемных
зубных протезов [40]. Однако очевид-
ные успехи зубной имплантации, ос-
нованные на принципах остеоинтегра-
ции, привели к разработке методов ле-
чения и пациентов с частичной аден-
тией, методик установления имплан-
татов на все участки челюстей, а также
к значительному разнообразию зубных
протезов с опорой на них [67, 122
200].
Вопрос о количестве имплантатов,
которые необходимо установить, дале-
ко не простой. Принято пользоваться
известной рекомендацией: периодон-
тальная поверхность опорных зубов
протеза должна быть не менее, а лучше
более плошади корней зубов, которых
они заменяют [131]. Отсюда следует,
что если протез, кроме имплантата,
опирается и на природный зуб, при
Рис. 5.7. Необходимые величины кости между' имплантатами и зубами [Misch С.,
а — между имплантатом и соседними зубами; б, в — между соседними зубами — опорами зубного
протеза; г — между вестибулярной и оральной стенками альвеолярного отростка.
Рис. 5.8. Выбор количества имплантатов,
а — 8 имплантатов на верхней челюсти для
опоры несъемного зубного протеза; 6 — 6 им-
плантатов на нижней челюсти: I — внешний
вид. П — рентгенограмма, III — на импланта-
тах фиксированы несъемные протезы; в —
2 имплантата на нижней челюсти для опоры
съемного зубного протеза: I — внешний вид.
II — рентгенограмма; г — 6 имплантатов на
нижней челюсти с балочной системой для
опоры съемного зубного протеза (рентгено-
грамма).
расчете надо учитывать также площадь
поверхности его корня.
Однако такая рекомендация не по-
зволяет полностью решить проблему в
отношении имплантатов с покрытием,
благодаря шероховатости которых ре-
альная площадь поверхности, по мне-
нию их разработчиков, увеличивается
в 5 раз по сравнению с той, которую
дают расчеты по длине и диаметру. Од-
нако результаты такого арифметиче-
ского подсчета Н. Spiekermann и соавт.
[223] рекомендуют увеличивать не в 5,
а лишь в 3 раза, поскольку 100 % плот-
ного контакта имплантата с костью
никогда не бывает.
При установлении имплантатов в
форме корня зуба план хирургических
процедур составляют хирург совместно
с ортопедом. В плане учитываются
особенности будущих зубных протезов
с опорой на имплантаты. К сожалению,
условия для установления имплантатов
в форме корня зуба бывают идеальны-
ми весьма редко. У пациентов пожило-
го возраста это чаше всего связано с ат-
рофией кости, у других — с природны-
ми или приобретенными анатомиче-
скими особенностями челюстей и мяг-
ких тканей. На верхней челюсти в связи
с более рыхлым строением кости реко-
мендуется ставить большее число им-
плантатов [8а] (рис. 5.8, а).
Если на нижней челюсти планируют
несъемный протез, то необходимо ста-
вить не менее 5 имплантатов, но, если
позволяют анатомические характери-
стики челюсти, предпочтительнее соз-
давать опору из 6 имплантатов (рис. 5.8,
б). Поскольку съемному протезу, как
правило, требуется меньше опор, в за-
висимости от его конструкции для
опоры могут быть поставлены даже 4, а
также иногда 3 или 2 имплантата
(рис. 5.8, в). При выраженной атрофии
дистальных отделов наиболее надежно
Для фиксации протеза 6 имплантатов,
установленных в области симфиза
(рис. 5.8, г).
С целью увеличения площади кон-
такта с костью рекомендуется для каж-
дого костного сегмента выбирать им-
плантаты максимально допустимых
длины и диаметра. Предельно допусти-
мые размеры имплантатов в форме
корня зуба зависят от количества на-
Рис. 5.9. Поло-
жение апикаль-
ного конца им-
плантата по
отношению к
кортикальной
пластинке.
личной кости, индивидуальных анато-
мических особенностей и степени ат-
рофии различных участков челюстей.
Желательно, чтобы имплантат был
введен через всю костную ткань и его
апикальный конец был в контакте с
кортикальной пластиной или даже час-
тично входил в ее толщу. Чем длиннее
имплантат, тем выше при других равных
условиях его начальная стабильность
(рис. 5.9). При этом, как и при увеличе-
нии его диаметра, возрастает площадь
его контакта с костью. С. Misch [176]
считает, что с увеличением имплантата
в форме зуба на 0,25 мм в диаметре и
3 мм в длину площадь его контакта с
костью увеличивается на 10 %. Пло-
щадь контакта с костью увеличивается
еще больше, если имплантат имеет по-
крытие [84, 130]. При определении
максимально допустимой длины им-
плантата учитывают особенности ана-
томического строения сегментов челю-
стей, на которые будет поставлен им-
плантат, в частности толщину корти-
кальных пластин и губчатого вещества
кости, расстояния до важнейших ана-
томических структур — канала нижней
челюсти, подбородочного отверстия и
петли одноименного нерва, носовой
полости, верхнечелюстной пазухи, рез-
цового канала.
Наименьшая длина основных приме-
няемых в настоящее время имплантатов
в форме корня зуба 10 мм и диаметр 3
и 3,2 мм. Выпускаются также мини-им-
плантаты длиной 7 и 8 мм [100].
Разработчики фирмы "Interpore'' по-
лагают, что выпускаемые ими имплан-
таты длиной 7—8 мм необходимо ис-
пользовать в определенных клиниче-
ских ситуациях: при операциях вблизи
дна полости носа, верхнечелюстной
пазухи, на участках сильно атрофиро-
ванной кости. Однако, по мнению
Н. Spiekermann и соавт. [223], приме-
нять короткие имплантаты следует
Рис. 5.10. Расположение имплантатов на
альвеолярной дуге.
а — правильное; б — неправильное.
только в исключительных случаях.
Кроме выбора конкретного места ус-
тановления имплантата и его размера,
имеет значение расположение несколь-
ких конструкций в альвеолярной дуге.
При расположении имплантатов в ли-
нию компрессионные силы нагрузки
на опорные головки на 20—100 % боль-
ше, чем у имплантатов, которые не об-
разуют прямой линии. Мы рекоменду-
ем по возможности смешать костные
ложа с прямой линии [203] (рис. 5.10).
Одновременно следует на модели отра-
ботать правильные позиции импланта-
тов, их параллелизм, используя акри-
ловую каппу (рис. 5.11, а, б). При ос-
теотомии нужно контролировать на ви-
зиографе или по рентге-
нограмме стояние им-
плантата в кости, парал-
лелизм их и правильные
расстояния между им-
плантатом и соседними
зубами (рис. 5.11, в—е).
Помимо геометриче-
ских размеров кости, на
выбор имплантатов, их
размеры и методику ос-
теотомии оказывают вли-
яние качественные ха-
рактеристики кости и
особенности мест их по-
становки.
Площадь контакта им-
плантата с костью, тре-
буемая для его началь-
ной стабильности и ус-
пешной интеграции, за-
висит от плотности кос-
ти. В рыхлую, непроч-
ную кость следует ста-
вить имплантаты боль-
ших размеров (рис. 5.12,
а). Плотная кость имеет
б
Рис. 5.11. Принцип
параллелизма при ус-
тановлении имплан-
татов в соотношении
с естественными зу-
бами.
а, б — на модели.
ЗЯА
Рис. 5.11. Продолжение.
в, г — неправильное; д, е — правильное.
контакт с имплантатом на меньшей
площади, поэтому при тех же геометри-
ческих характеристиках кости можно
ставить имплантаты меньших размеров
(рис. 5.12, б). Однако следует учиты-
вать, что на величину площади контак-
та с костью влияют не только длина
имплантата и его диаметр, но и мате-
риал, обработка его тела и характер по-
крытия, а у винтовых конструкций,
кроме того, вид и размер резьбы [40,
182, 260|.
Необходимо учитывать индивиду-
альные анатомические особенности
кортикального и губчатого вещества
кости челюстей, прикуса, состояния
зубного ряда, если он присутствует.
Эти особенности отражаются на выбо-
ре системы имплантатов, их размеров
и мест остеотомии. При установлении
в кость шириной 5 мм имплантатов
диаметром 3,5 мм неизбежны трудно-
сти при протезировании.
По данным К. Hiduchi и соавт., че-
рез 3 года после установления имплан-
татов Branemark хорошие результаты
отмечены на верхней челюсти в 92,5 %,
на нижней — в 94,9 % случаев. Неудачи
ЭЯ7
Рис. 5.12. Выбор имплантата ’’Astra Tech" в зависимости от качества кости.
а — большая длина имплантата при рыхлой кости; б — меньшая длина имплантата при плотной
кости.
имплантации были связаны прежде
всего с плохим качеством кости. Раз-
вивающаяся при адентии атрофия кос-
ти может быть различной степени вы-
раженности. На верхнюю челюсть
предпочтительно ставить самонарез-
ные имплантаты, так как кость челю-
сти состоит главным образом из рых-
Рис. 5.13. Изменение оси зуба при атро-
фии кости после его удаления (Misch С.,
1993|.
а — ось зуба на нижней челюсти; б — атрофия
кости после удаления зуба (линия А — пра-
вильный ориентир для установления имплан-
тата; линия В • неправильный ориентир для
установления имплантата).
лого трабекулярного вещества кости с
тонким слоем кортикальной пластин-
ки. На нижней челюсти кость атрофи-
руется примерно на 0,2 мм в год, т.е. в
3—4 раза быстрее, чем на верхней че-
люсти [229]. Край альвеолярной дуги
нижней челюсти меняет угол наклона.
Если при наличии зуба наклон соот-
ветствует линии А (рис. 5.13, а), то по-
сле атрофии следует корректировать
положение имплантата по линии В
(рис. 5.13, б). По разным сторонам
верхней и нижней челюстей скорость
резорбции рахтичная (112, 210]. При
плотном губчатом веществе кости реко-
мендуется ставить винтовые, при рых-
лой кости — цилиндрические или само-
нарезные винтовые имплантаты. Наи-
лучшим образом интегрируют с костью
имплантаты, имеющие титановое или
гидроксиапатитное покрытие. На верх-
ней челюсти приходится ставить боль-
шее число имплантатов, чем на ниж-
ней [131].
На передних участках верхней челю-
сти анатомическими ограничениями
для постановки имплантатов являются
расст ояния от края кости до дна носо-
вой полости и резцового отверстия. В
случае атрофии челюсти эти расстоя-
ния значительно сокращаются. Между
апикальным концом имплантата и
дном носовой полости должно оста-
ваться не менее 1 мм кости. Имплан-
f . f /. %
Рис. 5.14. Влияние атрофии кости на окклюзионные взаимоотношения при установ-
лении имплантатов [Misch С., 1993].
а — нормальное взаимоотношение зубов верхней и нижней челюстей; б — горизонтальное и вер-
тикальное взаимоотношения альвеолярных гребней в начале процесса атрофии кости; в, г —
прогрессирующая атрофия альвеолярного отростка верхней челюсти, которая увеличивает про-
странство между альвеолярными дугами челюстей; д — допустимые размеры кости в дистальных
отделах верхней челюсти; е — атрофия альвеолярного отростка верхней челюсти, при которой
требуется реконструкция для имплантации.
тэты следует ставить по обе стороны от
резцового отверстия, несколько отсту-
пив от средней линии.
Если наблюдается атрофия вестибу-
лярной стенки альвеолярного отростка
верхней челюсти, но общая ширина
кости позволяет использовать внутри-
костный имплантат, следует иметь в
виду, что при остеотомии костное ложе
и конструкция будут еше больше на-
клонены в дистальном направлении.
Перед имплантацией надо реконструи-
ровать вестибулярную стенку альвео-
лярного отростка, иначе неизбежны
биомеханические, пародонтологиче-
ские и эстетические проблемы
(рис. 5.14, а—г). Как указано на
рис. 5.14, д, е, при высоте альвеолярно-
в
Рис. 5.15. Особенности установления
имплантата при атрофии альвеолярного
отростка верхней челюсти.
а — атрофия кости; б — у дна полости носа и
верхнечелюстной пазухи; в — кпереди и кзади
от дна верхнечелюстной пазухи; г — ортопан-
томограмма: имплантаты установлены в без-
опасной зоне между полостью носа и верхне-
челюстной пазухой.
го отростка 12 мм и ширине более 5 мм
можно ставить на эти участки имплан-
таты. В других случаях устанавливать
имплантаты в передние и переднебо-
ковые отделы верхней челюсти, где
кость скомпрометирована в анатоми-
ческом отношении, без реконструкции
не рекомендуется [190, 227], хотя есть
немало сообщений о хорошем клини-
ческом результате такой имплантации
и многолетнем функционировании
конструкций [17]. Наиболее трудно
ставить имплантаты при атрофии аль-
веолярного отростка верхней челюсти:
у дна полости носа и верхнечелюстной
пазухи (рис. 5.15, а, б).
В частности, R. McKinney (167] ре-
комендует для опоры несъемного про-
теза на верхней челюсти ставить не ме-
нее четырех имплантатов такой длины,
которую максимально допускают раз-
меры челюстного сегмента в области
резцов и клыков.
При реконструкции одиночного зу-
ба в передней части верхней челюсти
всегда следует использовать импланта-
ты максимально допустимого диаметра
[82]. Традиционно имплантацию про-
водят не ранее чем через 2—6 мес после
удаления зуба или потери его в резуль-
тате травмы. Учитывая возможные эс-
тетические проблемы при постановке
имплантата в области центральных зу-
бов верхней челюсти, F. Wijs и соавт.
[94] успешно применяли имплантаты
"Tubinger" ("Frialit”). При 4—5-летних
наблюдениях за 101 пациентом они от-
метили хорошие результаты у 87 % из
них [127].
На верхней челюсти имплантаты ча-
ше всего ставят на участках около
верхнечелюстной пазухи (см. рис. 5.15,
б). Даже при пневматическом типе
верхнечелюстной пазухи для установ-
ления имплантатов может быть доста-
точно кости кпереди и кзади от ее бухт
(рис. 5.15, в) и наиболее безопасной
зоной по качеству и количеству кости
является участок между полостью носа
и пазухой (рис. 5.15, г).
При использовании внутрикостных
конструкций большое значение имеет
не только размер кости, прилежащей к
дну верхнечелюстной пазухи, но и тол-
щина ее кортикальной пластинки.
Следует иметь в виду, что дно пазухи
290
Рис. 5.16. Поднятие костной стенки дна
полости носа и дна верхнечелюстной па-
зухи по Branemark и соавт.
а — поднятие костной стенки с помощью ин-
струментов; б — верхушка имплантатов непо-
средственно соприкасается через перфориро-
ванную костную стенку дна пазухи с ее слизи-
стой оболочкой.
может быть неровным и опускаться
вниз к корням зубов или к тонкому
Участку атрофированной кости при
адентии. Именно наличие кости не ме-
нее чем в 1—2 мм от дна верхнечелю-
стной пазухи предохраняет от развития
синусита [248]. Относительно этого
положения существуют и иные мне-
ния. Для верхней челюсти P.J. Brane-
mark и соавт. разработана методика
перфорации кости дна носовой полос-
ти или дна верхнечелюстной пазухи с
целью закрепления в созданном отвер-
стии апикального конца винтового им-
плантата, не проходящего через слизи-
стую оболочку [248, 249] (рис. 5.16). По
сообщениям ряда клиницистов, при
полной перфорации пазухи осложнения
отсутствовали и имплантат даже углуб-
лялся в него на 1—2 мм [73, 248, 249].
Между тем, большинство авторов
придерживаются мнения, что в таких
условиях имплантация возможна толь-
ко при локальном поднятии верхнече-
люстной пазухи гранулами гидрокси-
апатита или трикальций-фосфата [231,
232, 175], а также аутокостью [75], в
том числе гребнем подвздошной кости
[125]. При наличии кости дна пазухи
можно ставить только имплантаты дли-
ной 5, 6 и 7 мм [93].
Следует строго придерживаться пра-
вила параллелизма поставленных им-
плантатов, в том числе при поднятии
дна пазухи [69].
Однако при пневматическом типе
верхнечелюстной пазухи и значитель-
ной атрофии альвеолярного отростка
установить имплантат в правильное
для окклюзии положение можно толь-
ко после предварительного поднятия
верхнечелюстной пазухи, в том числе
дистальной ее части [91, 231, 233].
На верхней челюсти с большими
трудностями приходится сталкиваться
при имплантации на дистальных уча-
стках, где после удаления зубов кость
чаше подвергается атрофии. Она все-
гда хуже по качеству (пространства ко-
стного мозга большего размера, а кор-
тикальная пластинка тоньше и мень-
шей плотности), чем на участков-анта-
гонистах нижней челюсти. Этим глав-
ным образом объясняют более дли-
тельные сроки костной интеграции
имплантата в дистальных отделах верх-
ней челюсти.
Кроме того, в этих отделах наиболь-
шая нагрузка приходится на природ-
ные зубы и имплантаты при функцио-
нировании передают ее на кость.
Именно здесь необходимо, чтобы кон-
такт их с костью был максимальным.
Поскольку на этих участках кость чаше
всего рыхлая и непрочная, предпочти-
тельнее использовать имплантаты мак-
симально допустимой длины и диамет-
ра, контактная поверхность которых
увеличена также благодаря покрытию.
Если количество кости не позволяет
увеличить размеры имплантата, то
можно установить большее число им-
плантатов. Силы нагрузки окажутся
распределенными между ними так же,
как между многокорневыми молярами.
В дистальном отделе верхней челю-
сти имплантация может быть затрудне-
на также из-за близости верхнечелюст-
ной пазухи. В результате ее пневмати-
зации и атрофии кости нередки слу-
чаи, когда костная перегородка между
Рис. 5.17. Установление имплантата
в дистальном отделе верхней челюсти
с опорой на бугор и крыловидный от-
росток основной кости.
а — вад снизу: 1 — бугор верхней челюсти, 2 —
пирамидальный отросток основной кости, 3 —
крыловидный отросток; б — вид сбоку.
телом верхней челюсти и ее пазухой
оказывается слишком тонкой.
Возможны ситуации, в которых пра-
вильное положение имплантата на верх-
ней челюсти достигается благодаря ис-
пользованию бугра или латеральной
пластинки крыловидного отростка кли-
новидной кости и конструкция устанав-
ливается медиодистально. Опора им-
плантата на латеральную пластинку
клиновидной кости может обеспечивать
его стабильность даже при рыхлой кости
бугра верхней челюсти [53] (рис. 5.17).
Поданным Ch. Babschi и соавт. [39],
из 51 имплантата, установленного на
этом участке, отторглись 6. Возмож-
ность использования этого участка
кости для остеотомии подтверждала и
атрофия кости после имплантации, ко-
торая по высоте не превышала 1,3 мм,
а с дистальной стороны — 1,1 мм.
Сложность остеотомии на разных
участках нижней челюсти также не-
одинаковая. Меньше всего проблем
возникает при установлении имплан-
татов в ее переднюю часть, так как кос-
ти здесь, как правило, достаточно и ка-
чество ее чаше хорошее, отчего инте-
грация имплантата протекает быстрее.
Условия для остеотомии с целью уста-
новления имплантатов в форме корня
зуба в переднем отделе нижней челю-
сти считаются адекватными, если вы-
сота альвеолярной части 8 мм и более,
ширина не менее 6—8 мм и даже 5,25
мм, а по гребню на каждый имплантат
вместе с расстояниями до соседних им-
плантатов или зубов приходится не ме-
нее 6,5 мм кости [86, 88]. При высоте
кости 8 мм хорошие результаты получе-
ны в тех случаях, когда ставили самые
короткие имплантаты — длиной 4 мм
[66]. Тем не менее в переднем отделе
нижней челюсти, если есть возмож-
ность, для большей стабильности им-
плантаты желательно вводить через
всю костную ткань, чтобы их апикаль-
ный конец контактировал с нижней
границей кости. Приходится учитывать
и то, что в результате атрофии не толь-
ко кость гребня становится тоньше, но
и меняется ее наклон. В связи с этим
из-за недостаточности кости с вестибу-
лярной стороны имплантата при свер-
лении могут возникнуть проблемы.
На нижней челюсти имплантаты
292
ставят чаще всего между подбородоч-
ными отверстиями, но ряд авторов
считают, что достаточно четырех [64,
66, 107, 222[ или пяти [40[ импланта-
тов. Существует мнение, что при опре-
делении количества имплантатов в
форме корня зуба в переднем отделе
нижней челюсти важно сохранить ме-
жду ними и подбородочным отверсти-
ем расстояние не 3 мм, а 4—5 мм. Что-
бы обеспечить это, лучше сосредото-
чить имплантаты на участке симфиза и
использовать балочную систему: тогда
нагрузка на кость будет минимальной.
Повышенной осторожности на ниж-
ней челюсти требует имплантация на
участках премоляров кпереди от под-
бородочного отверстия, поскольку вы-
ходящий из него подбородочный нерв
может иметь петлю, располагающуюся
на 3 мм кпереди (рис. 5.18, а). Иссле-
дование нижнего альвеолярного нерва
[48 ] показало, что размеры петли под-
бородочного нерва могут значительно
различаться. При рентгенографии, как
правило, получают искаженные вели-
чины. Так, если истинная длина подбо-
родочной петли 6,95 мм, то на рентге-
нограмме 3,45 мм. Это еще раз указы-
вает на необходимость проведения
компьютерной томографии перед им-
плантацией и хорошего обзора кости в
ходе остеотомии. Анатомические пара-
метры можно контролировать также на
визиографе во время операции. Рас-
стояние от имплантата до подбородоч-
ного отверстия должно быть не менее
4—5 мм [104].
Определенные трудности могут воз-
никнуть при установлении импланта-
тов круглой формы на дистальные уча-
стки нижней челюсти. Обычно это свя-
зано с проходящим здесь нижним аль-
веолярным нервом, поражение которо-
П) грозит развитием прозалгии — ане-
Рис. 5.18. Взаимоотношения канала
нижней челюсти с имплантатом.
а -размеры и расположение канала и петли
подбородочного нерва; б — расстояние между
перхушкой имплантата и каналом нижней че-
люсти; в — атрофия альвеолярной части ниж-
ней челюсти; г — рентгенограмма нижней че-
люсти с установленными имплантатами над
Каналом нижней челюсти и кзади подборо-
дочного отверстия.
стезии, гипо- и гиперестезии. Следует
иметь в виду большое анатомическое
разнообразие канала нижней челюсти и
находящегося в нем нижнего альвео-
лярного нерва [115]. Имплантат следует
выбирать такой длины, чтобы между
его апикальным концом и верхним
краем канала нижней челюсти остава-
лось не менее 2 мм кости (рис. 5.18, б).
В противном случае даже при более ко-
ротком имплантате следует произвести
репозицию нерва 1101] или отказаться
от имплантации. При резко выражен-
ной атрофии дистальных участков
нижней челюсти чаще всего ставят ко-
роткие имплантаты, апикальный конец
которых не контактирует с кортикаль-
ным слоем кости (рис. 5.18, в). Однако
именно на эти участки при нагрузке
приходятся максимальные окклюзион-
ные силы. По возможности приходится
увеличивать как число имплантатов,
так и срок их интеграции без нагрузки.
Наиболее трудной, а иногда невозмож-
ной бывает имплантация при значи-
тельной атрофии нижней челюсти
(рис. 5.18, г).
При выборе мест установления им-
плантатов учитывают анатомические
особенности не только кости челюсти,
но и мягких тканей. Резорбция кости
сопровождается атрофией неподвиж-
ной слизистой оболочки, хотя в ней
процесс происходит значительно мед-
леннее (10:0,6) [236]. У некоторых па-
циентов атрофия мягких тканей может
вызвать необходимость оперативного
вмешательства на них перед импланта-
цией [249]. Если позволяют прочие ус-
ловия и план протезирования, то пред-
почтительнее ставить имплантат в мес-
та, покрытые кератинизированной тка-
нью, так как она неподвижна и способ-
на плотнее прилегать к опорной головке
имплантата. В отличие от кератинизи-
рованной слизистой оболочки, приле-
гающей к шейке имплантата, некера-
тинизированная ткань присоединяется
плохо. Кроме того, она часто подвиж-
на, подвержена воспалению; нередко
между ней и имплантатом образуется
карман [12, 18, 169].
Приведенные выше оценки мест ус-
тановления имплантатов и их числа не
должны создать впечатление, что эти
вопросы решает главным образом хи-
рург. В предоперационной подготовке
участвуют врачи разных специально-
стей. Один врач не может быть специа-
листом всех профилей, так как нс мо-
жет не только учесть все аспекты обес-
печения успеха оперативного вмеша-
тельства, но и судить о сроке службы
имплантатов и зубных протезов. Меж-
дисциплинарный подход к выбору мест
постановки и количества имплантатов
в форме корня зуба обязателен.
Двухэтапная имплантация погруж-
ных винтовых и цилиндрических кон-
струкций в форме корня зуба считается
традиционной, и производили ее гораз-
до чаще. На первом хирургическом эта-
пе имплантат ставят в кость, а слизи-
стую оболочку и надкостницу зашива-
ют над ним наглухо. На втором хирур-
гическом этапе имплантаты вскрывают
и на них ставят различные надальвео-
лярные компоненты. Вместе с тем в по-
следние 2—3 года погружные имплан-
таты стали устанавливать за одну хи-
рургическую процедуру, ставят их вро-
вень и выше уровня кости, используя
чресслизистые элементы, этап проте-
зирования начинают через 2,5—3 мес,
возможна также более ранняя, но дози-
рованная и увеличивающаяся нагрузка.
5.3.2. Имплантация винтовых
конструкций
К наиболее распространенным имплан-
татам двухэтапного хирургического ле-
чения относятся системы "Контраст",
"Плазма Поволжья", "ЛИКо”, "Дива-
дент", "Branemark”, "Steri-Oss", "3i“,
"Astra Tech.", "Galsitek", "Core-Vent",
"Frialit" и др.
На первом этапе производят:
1) разрез слизистой оболочки и надко-
стницы до кости и обнажение участ-
ка зубочелюстного сегмента;
2) остеотомию кортикального и губча-
того вещества кости соответственно
виду, диаметру и длине имплантата;
3) установку-погружение в созданное
ложе имплантата методом инстру-
ментального ввинчивания (винто-
вые имплантаты) или инструмен-
тальной постановкой (цилиндриче-
ские имплантаты) с плотной фикса-
цией его в кости;
4) глухое зашивание раны над имплан-
татом или зашивание ее вокруг
чресслизистого удлинителя.
В таком положении имплантат ос-
тавляют без нагрузки в течение 4 мес
на нижней челюсти и 6 мес на верхней.
Это, как считают большинство иссле-
дователей, создает имплантату макси-
мально возможные благоприятные ус-
ловия для приживления, так как на его
контакт с костью длительное время не
оказывается никакого внешнего воз-
действия [40, 43, 66, 74, 120[.
Техника остеотомии у винтовых и
цилиндрических имплантатов в форме
корня зуба, как погружных, так и не-
погружных, имеет ряд особенностей.
У винтовых имплантатов она слож-
нее, чем у цилиндрических, и, помимо
определенных навыков, требует боль-
шего времени. Рекомендации изгото-
вителей имплантатов, касающиеся хи-
рургических манипуляций с ними, мо-
гут быть различными.
Перед началом хирургических дей-
ствий изготавливается пластмассовая
каппа по модели челюсти (рис. 5.19, а)
и проводится ее подгонка к челюсти
(рис. 5.19, б).
Рассечение мягких тканей. Разрезы и
откидывание слизисто-надкостничных
лоскутов проводят традиционно [35,
163]. Вместе с тем A. Cranin и соавт.
[87], придавая большое значение тех-
нике рассечений и отслаивания мягких
тканей, считают, что именно от нее за-
висят адекватность последующей ос-
теотомии, успех имплантации и сте-
пень остеоинтеграции. Следует выби-
рать скальпель с режущей частью нуж-
ного размера и изгиба. Линия разрезов
должна соответствовать размерам опе-
рационного поля, но рассечение и от-
кидывание лоскутов надо проводить
так, чтобы был обеспечен хороший об-
зор [87, 89]. Как показали исследова-
ния микроциркуляторного русла при-
крепленной и свободной слизистой
оболочки, покрывающей альвеоляр-
ный отросток, подбирать виды разре-
зов следует индивидуально [9, 10]. Не-
обходимо учитывать особенности кро-
воснабжения прикрепленной и сво-
бодной слизистой оболочки соответст-
венно функциональному состоянию
Рис. 5.19. Акриловая каппа для установ-
ления имплантата.
а — акриловая каппа после подгонки и поли-
ровки; б — изготовление акриловой каппы на
модели челюсти.
организма и особенностям атрофии
кости, чтобы обеспечить полноценное
кровоснабжение лоскутов и прилегаю-
щих тканей, адекватное зашивание
тканей с надежным закрытием им-
плантатов и последующее благоприят-
ное заживление раны.
При установлении одиночных им-
плантатов можно рассекать ткани, от-
слаивать слизисто-надкостичный лос-
кут только в пределах челюстного сег-
мента (рис. 5.20). В отдельных случаях,
если кость достаточной высоты и ши-
рины и атрофия ее незначительна, воз-
можно даже "выщипывание" или ре-
зекция мукотомом небольшого фраг-
мента слизистой оболочки и надкост-
ницы соответственно диаметру им-
плантата. Короткие рассечения оправ-
даны, если при предоперационной под-
готовке учтены особенности строения
челюсти, ее рельеф и изгибы. Приме-
няют общепризнанные традиционные
рассечения при частичной и полной
адентии. При частичной адентии и по-
становке имплантата на участок отсут-
Рис. 5.20. Рассечение мягких тканей для
установления одиночного имплантата,
а — рассечение тканей в пределах челюстного
сегмента верхней челюсти; б — отслаивание
слизисто-надкостничного лоскута в вестибу-
лярную сторону.
ствующих зубов рассечения тканей
должны обеспечить хороший обзор
кости сегмента челюсти и достаточ-
ность тканей для глухого зашивания
тканей, поэтому при рассечении учи-
тывают возможность мобилизации со-
седних тканей. Однако не следует чрез-
мерно уменьшать разрезы. Чем они
меньше, тем больший опыт требуется
от хирурга при последующих манипу-
ляциях. Достаточно скелетированный
костный сегмент нередко позволяет
избежать многих ошибок при остеото-
мии (перфорация или отлом стенки
костного ложа, травмирование нерв-
ного или сосудистого сплетения). Не
следует полностью исключать возмож-
ность больших рассечений при поста-
новке единичных имплантатов в фор-
ме корня зуба. Кроме того, при боль-
ших дефектах зубных рядов и беззубых
челюстях, когда остеотомию выполня-
ют для постановки трех и более имплан-
татов или значительная атрофия вызы-
вает необходимость визуального осмот-
ра кости, всегда необходимы значитель-
ные рассечения. Поэтому нельзя не со-
гласиться с Е. Kruger [134] и McGowan
[163], которые полагают, что чем боль-
ше рассечения, тем лучше обзор раны
и тем меньше опасность повреждения
соседних анатомических структур, а
также краев раны при последующих
манипуляциях. Выбор линий разрезов
слизистой оболочки и надкостницы
всегда должен быть сообразован с осо-
бенностями кровоснабжения каждого
костного сегмента, прикрепления
мышц на отдельных участках челюстей,
расположения сосудисто-нервных пуч-
ков. Однако таких больших рассечений
и широкого скелетирования кости, как
при постановке плоских имплантатов,
конструкции в форме корня зуба не
требуют.
При частичной адентии верхней че-
люсти могут применяться различные
виды рассечений, как показано на
рис. 5.21.
На верхней челюсти при частичной
адентии приняты следующие разрезы:
рассечения слизистой оболочки и над-
костницы по альвеолярной дуге ближе
к вестибулярной поверхности или, на-
оборот, ближе к небной стороне (см.
рис. 5.21, а, б).
Образуют трапециевидные лоскуты,
которые обеспечивают хороший дос-
туп к кости. Для постановки одного
имплантата формируют языкообраз-
ный лоскут. При рассечении в виде
языка не повреждается краевая десна
около соседних зубов, а перекрытие
лоскутом альвеолярной дуги способст-
вует плотному закрытию имплантата
(см. рис. 5.21, в). В других случаях для
увеличения основания трапециевидно-
го лоскута разрез делают через десне-
вой край зубов с вестибулярной и
оральной стороны (см. рис. 5.21, г).
Для наилучшего обзора операционной
раны иногда производят дополнитель-
ные вертикальные рассечения по на-
правлению к десневой борозде. В таких
случаях слизисто-надкостничный лос-
кут можно максимально отсепариро-
вать в вестибулярную сторону, что од-
новременно позволяет улучшить обзор
в сторону неба. При дистальных де-
фектах зубов и постановке двух-трех
имплантатов используют трапециевид-
ные лоскуты, которые откидывают в
вестибулярную или небную сторону.
Однако рассечение со стороны неба
может привести к повреждению сосу-
дисто-нервного пучка, выходящего из
большого небного отверстия, отчего
ухудшается васкуляризация тканей.
Рассечения с вестибулярной стороны
создают более благоприятные условия
для кровоснабжения лоскута и, следо-
Рис. 5.21. Рассечение слизистой оболоч-
ки и надкостницы на верхней челюсти
при частичной адентии.
а — выкраивание трапециевидного лоскута
с вестибулярной стороны альвеолярного отро-
стка; б — выкраивание трапециевидного лос-
кута с небной стороны альвеолярного отрост-
ка (а, б — оба лоскута могут быть удлинены
разрезом по центру альвеолярной дуги); в, г —
выкраивание лоскута при отсутствии одного
зуба с дополнительными рассечениями по
краю десен соседних зубов с вестибулярной
и небной сторон; д — положение скальпеля
при разрезе по десневому краю естественных
зубов.
Рис. 5.22. Рассечение слизистой оболоч-
ки и надкостницы на верхней челюсти
при полной адентии.
а — по гребню альвеолярной дуги; б — по аль-
веолярному отростку ближе к небной стороне;
в - по альвеолярному отростку ближе к вес-
тибулярной стороне.
вательно, для заживления раны. Если
линия рассечения захватывает сосед-
ние зубы, лучше пользоваться скальпе-
лем серповидной формы, который по-
зволит адекватно рассекать ткани по
гингивальному краю (см. рис. 5.21, д).
На верхней челюсти при адентии
возможны разрезы трех типов: по аль-
веолярной дуге, небное рассечение с
вертикальным поворотом к вершине
дуги по бокам и вестибулярно по гра-
нице между прикрепленной и свобод-
ной слизистой оболочкой с краями,
сходящимися к альвеолярной дуге. Для
постановки нескольких имплантатов
наиболее целесообразно проводить
разрез по альвеолярной дуге, несколь-
ко отступив от ее центра в вестибуляр-
ную или небную сторону, а также сер-
пантинное рассечение. Рассечение в
вестибулярном направлении обеспечи-
вает лучшее кровоснабжение, но при
этом возможны уменьшение свода
преддверия рта и формирование руб-
цов, что ухудшает условия для проте-
зирования (рис. 5.22).
При отслаивании в вестибулярную
сторону слизисто-надкостичного лос-
кута на значительно атрофированной
верхней челюсти необходимо учитывать
прикрепляющиеся здесь мышцы —
поднимающую верхнюю губу и крыло
носа, щечную мышцу. Их следует от-
секать вместе с лоскутом, иначе в даль-
нейшем они будут способствовать под-
вижности ткани и расхождению швов.
Кроме того, нужно иметь в виду, что
слизистая оболочка и надкостница,
покрывающие верхнюю челюсть с вес-
тибулярной стороны, плотно сращены
с костью. Отделять их следует по всей
длине, во избежание разрывов ткани,
прерывистыми движениями, посте-
пенно переходя вверх к дальним участ-
кам. В области свода преддверия рта
под слизистой оболочкой находится
рыхлый подслизистый слой. При от-
слаивании тканей необходимо сколь-
зить инструментом по кости, чтобы
лоскут отделялся на всю толщину.
Хороший обзор операционного по-
ля обеспечивает рассечение с откиды-
ванием мягких тканей в сторону неба.
Это рассечение используют при поста-
новке нескольких имплантатов. Необ-
ходимо учитывать, что в переднем от-
деле верхней челюсти и на уровне пре-
моляров слизистая оболочка и надко-
стница с небной стороны плотно сра-
щены с костью. При отслаивании тка-
ни малоподатливы, могут легко рвать-
ся, особенно вдоль небного шва.
Формирование и отслаивание лос-
кута в небную сторону в дистальном
отделе верхней челюсти производят
легко благодаря выраженному подсли-
зистому слою, облегчающему мобили-
зацию ткани для глухого зашивания
раны.
На нижней челюсти при частичной
адентии и достаточной ширине кости и
маловыраженных атрофических про-
цессах в ней рассечение слизистой обо-
лочки и надкостницы проводят в
оральную сторону; напротив, при атро-
фии кости разрез делают вестибулярнее
(рис. 5.23, а, б). При отсутствии одного
из центральных зубов формируют язы-
кообразный лоскут или дополняют его
рассечениями по десневому краю со-
седних зубов, а при необходимости де-
лают и вертикальные разрезы к своду
преддверия рта (рис. 5.23, в, г).
В дистальных отделах нижней челю-
сти необходим хороший обзор кости,
подбородочного нерва и петли сосуди-
сто-нервного пучка, для чего формиру-
ют трапециевидные лоскуты (рис. 5.23,
д, е). Традиционным в области моля-
ров является образование углообразно-
го слизисто-надкостничного лоскута
(рис. 5.23, ж). При атрофии беззубого
дистального участка нижней челюсти
можно проводить косое рассечение
тканей, что позволит, отогнув лоскут в
язычную сторону, иметь хороший об-
зор кости (рис. 5.23, з).
При частичной адентии нижней че-
люсти и включенных или дистальных
дефектах зубного ряда формируют угло-
образные лоскуты, которые откидыва-
ют к десневой борозде, реже в язычную
сторону. Откидывание в язычную сто-
рону предпочтительнее на участке вто-
рого премоляра и первого моляра, так
как при этом уменьшается опасность
травмирования подбородочного нерва,
а при закрытии раны после остеотомии
лоскут достаточно перекрывает им-
плантат. Однако углообразные рассе-
чения с откидыванием слизисто-над-
костничного лоскута в сторону пред-
дверия рта могут создавать условия для
расхождения краев раны и последую-
щего сужения свода преддверия рта.
При беззубой нижней челюсти рас-
сечения чаще всего делают по центру
альвеолярного гребня или несколько
отступив в вестибулярную или ораль-
ную сторону (рис. 5.24, а—д). При не-
обходимости их дополняют вертикаль-
ными разрезами слизистой оболочки и
надкостницы в сторону преддверия рта
(см. рис. 5.24, б). Такие дополнитель-
ные разрезы рекомендуется делать или
на уровне клыков, первого премоляра,
или соответственно второму, третьему
молярам, что позволит сохранить дос-
таточное расстояние до подбородочно-
го отверстия. В случае, когда необхо-
дим хороший обзор кости, рекоменду-
ется делать трапециевидные разрезы в
вестибулярную или язычную сторону
(см. рис. 5.24, в, г). Необходимо пра-
вильно выбирать скальпель при узкой
альвеолярной дуге и избытке мягких
тканей (рис. 5.24, е), а также при ши-
рокой альвеолярной дуге (рис. 5.24, з).
Эффективны серпантинные рассече-
ния по гребню альвеолярной дуги при
атрофии и рубцовых изменениях мяг-
ких тканей (рис. 5.24, ж).
В подбородочном отделе нижней че-
люсти эффективен дугообразный раз-
рез преддверия полости рта (см. рис.
5.24, д). Слизистую оболочку и надко-
стницу с обеих сторон рассекают гори-
зонтально, не доходя до альвеолярного
гребня, и вниз по направлению к пред-
дверию рта. Широкое основание раз-
реза следует располагать на границе
между прикрепленной и свободной
слизистой оболочками. В случае, если
участок кости, где будут ставить им-
плантаты, приходится на подбородоч-
ные отверстия, ткани лучше рассекать
дистальнее и при отслаивании надко-
стничного лоскута элеватором отде-
лять ветви подбородочного нерва и пе-
ремещать их кзади. Альтернативой мо-
жет быть также рассечение слизистой
оболочки на уровне клыков с боковы-
ми горизонтальными разрезами в обе
стороны. После того как определено
расположение подбородочных отвер-
стий, периост рассекают на уровне
верхушек резцов, после чего надкост-
ницу отделяют от кости.
При атрофии подбородочного отде-
ла нижней челюсти и скошенной
внутрь альвеолярной дуге рассечение и
отслаивание слизисто-надкостничного
лоскута лучше проводить в язычную
сторону (см. рис. 5.24, в). Если атро-
фия выражена значительно, то следует
учитывать близкое прикрепление к
альвеолярному гребню мощных подбо-
родочно-язычных и подбородочно-
подъязычных мышц. Если по альвео-
лярному гребню располагается керати-
низированная и рубцово-измененная,
в том числе избыточная, слизистая
оболочка, следует правильно выбрать
скальпель, лучше с загнутым острым
концом (см. рис. 5.24, е).
При узкой альвеолярной дуге
лучше рассекать ткани над альвеоляр-
ным гребнем скальпелем с более ши-
роким основанием (см. рис. 5.24, з).
Для лучшего обзора альвеолярной
части нижней челюсти лучше рассе-
кать ткани с язычной стороны, отсло-
ив лоскут в вестибулярную сторону
(рис. 5.24, и).
Установление имплантата в подбо-
родочный отдел нижней челюсти тре-
бует уточнения расположения перед-
него брюшка двубрюшной, подборо-
дочно-подъязычной и подбородочно-
язычной мышц. Если они находятся
вблизи альвеолярной дуги, то при от-
кидывании слизисто-надкостничного
лоскута в сторону языка следует лишь
несколько отслоить их от костных тка-
ней. Полностью отсекать их нельзя,
и чаще оснований дзя этого нет, так
как они прикрепляются внизу сим-
физа. Кроме того, их отсечение может
вызвать западение языка, а в дальней-
шем — асфиксию.
Осуществляя скелетирование кости
для постановки имплантатов, следует
максимально бережно отслаивать над-
костницу единым блоком со слизистой
оболочкой, делая это нетравматично,
последовательными и плавными маят-
никообразными движениями по кости,
учитывая расположение складок сли-
зистой оболочки, рубцовых тяжей, мы-
шечных образований, отделяя и отсе-
кая их от кости (рис. 5.25).
При рассечениях, отслоении и отки-
дывании слизисто-надкостничного лос-
кута дзя постановки имплантатов в
подбородочный отдел нижней челюсти
могут обнажаться мышцы, располо-
женные на наружной поверхности кос-
ти. В таких случаях следует отсечь и от-
слоить пучки подбородочной мышцы,
иногда расположенные близко к атро-
фированному гребню альвеолярной
части мышцы, опускающей нижнюю
губу, и мышцы, опускающей угол рта,
иначе под действием этих мышц воз-
можно смещение лоскута в вестибу-
лярную сторону, в результате чего мо-
гут произойти расхождение швов и об-
нажение имплантата (рис. 5.26, а).
В области симфиза и в передних от-
делах тела нижней челюсти при от-
слоении лоскута в сторону языка, что-
бы не поранить ветви язычной арте-
рии, образующие сплетения, распато-
ром или элеватором следует скользить
строго по кости.
В области симфиза из-за находя-
щихся с оральной стороны подъязыч-
ной ветви язычной артерии и ее соус-
тья с подбородочной ветвью лицевой
артерии при рассечениях и отслаива-
нии лоскута или остеотомии могут
быть повреждение сосудов и обильное
кровотечение. Многие клиницисты ре-
комендуют делать небольшие щадящие
разрезы не ниже 1 см от основания
нижней челюсти [80, 175].
В случае необходимости скелетиро-
вания нижней челюсти в области пре-
Рис. 5.23. Рассечение слизистой оболочки и надкостницы на нижней челюсти при
частичной адентии с обязательным сохранением межзубного сосочка.
а, б — выкраивание трапециевидного лоскута в сторону полости рта (а) и в сторону преддверия
рта (б); в, г — выкраивание языкообразного лоскута в сторону полости рта (в) и с боковыми раз-
резами по десневому краю с вестибулярной стороны соседних зубов (г); д, с — выкраивание тра-
пециевидного лоскута с вестибулярной стороны для лучшего обзора подбородочного отверстия
и сосудисто-нервного пучка (д) и дистальным разрезом по десневому краю зубов (с); ж — вы-
краивание углообразного лоскута в дистальном отделе нижней челюсти; з — косое рассечение
мягких тканей в дистальном отделе нижней челюсти.
Рис. 5.24. Рассечение тканей на нижней
челюсти при полной адентии.
а — по центру альвеолярной дуги; б — по греб-
ню альвеолярной дуги в области симфиза с бо-
ковыми разрезами к своду преддверия рта; в —
по альвеолярной дуге ближе к язычной сторо-
не; г — ближе к преддверию рта; д — в области
границы неподвижной и подвижной слизи-
стой оболочки соответственно симфизу; с —
положение скальпеля при узкой альвеолярной
луге и избытке слизистой оболочки; ж — сер-
повидное рассечение по гребню альвеолярной
дуги; 3 — выбор скальпеля при широкой аль-
веолярной дуге; и — рассечение тканей
с язычной стороны.
моляров и первого моляра внимание
фиксируют на локализации подборо-
дочного отверстия и петли подбородоч-
ного нерва ввиду разнообразия анато-
мии и локализации последней. Она мо-
жет располагаться кпереди или книзу, а
при атрофии кости — вдоль гребня аль-
веолярной дуги. Иногда при полной ат-
рофии нижней челюсти нижний луноч-
ковый нерв локализуется даже на вер-
шине альвеолярной дуги. Отслаивать
лоскут следует с большой осторожно-
стью, предварительно установив распо-
ложение подбородочного отверстия,
чтобы обойти его и не травмировать
разветвления подбородочного нерва, а
при атрофии альвеолярной части —
выделять нижний луночковый нерв. В
таких случаях немаловажную роль иг-
рает правильный выбор распаторов и
элеваторов для надкостницы.
При необходимости отслоить слизи-
сто-надкостничный лоскут в области
Рис. 5.25. Отслаивание слизисто-надкостничных лоскутов.
а — с вестибулярной стороны верхней челюсти; б — с вестибулярной стороны нижней челюсти;
в — с язычной стороны нижней челюсти; г — маятникообразные движения при отслаивании сли-
зистой оболочки и надкостницы; д — острый распатор и работа при отслаивании надкостницы.
г
Рис. 5.26. Перемещение мышц на нижней челюсти.
а — обнажение симфиза и граница перемещения вниз подбородочной мышцы: 1 — подборо-
дочная мышца, 2 — линия, до которой мышцу отслаивают; б — перемещение челюстно-подъ-
язычной мышцы: I — челюстно-подъязычная мышца, 2 — линия, до которой мышцу отслаива-
ют; в — перемещение шечной мышцы: 1 — височная мышца, 2 — жевательная мышца, 3 — щеч-
ная мышца, 4 — линия, до которой мышцу отслаивают; г — перемещение мышц при сагитталь-
ном распиле челюсти: 1 — бывшая граница альвеолярной части, подвергшаяся атрофии, 2 — ос-
таточная кость, 3 — челюстно-подъязычная мышца. 4 — щечная мышца.
тела нижней челюсти в язычную сто-
рону, особенно на участке второго мо-
ляра, может потребоваться перемеще-
ние книзу челюстно-подъязычной
мышцы (рис. 5.26, б). При этом следует
исключить возможность ранения языч-
ных артерии, вены и нерва.
Ставя имплантаты на дистальные
участки значительно атрофированной
нижней челюсти, следует учитывать
прикрепление пучков собственно же-
вательной мышцы и щечной мышцы.
Волокна первой часто вплетаются в
ретро.молярную область. При рассече-
нии мягких тканей для постановки им-
плантатов на таких участках волокна
ахи________________________
должны быть отслоены вместе с частью
пучков переднего отдела собственно
жевательной мышцы. Мешающие пуч-
ки отсекают и отслаивают от кости по-
сле того, как мышца обнажится при
отслоении и откидывании слизисто-
надкостничного лоскута. Если мышцу
не видно, то тупым концом распатора,
введенным под надкостницу, ее сме-
шают книзу. В противном случае под
действием мышц лоскуту может гро-
зить смешение в вестибулярную сторо-
ну, что приводит к расхождению швов
и обнажению имплантата.
При установлении имплантатов в
области моляров и премоляров следует
принимать во внимание также щечную
мышцу, которая прикрепляется на на-
ружной поверхности тела нижней че-
люсти и требуется ее перемещение
книзу (рис. 5.26, в). Необходимость
перемещения мышц наглядно показы-
вает на сагиттальный распил нижней
челюсти (рис. 5.26, г).
Формирование костного ложа для
имплантата — следующий этап остео-
томии. Способ создания костного ложа
для имплантатов в форме корня зуба
зависит от их типа и конструкции. При
работе с костью важную роль играют
инструменты для сглаживания кости и
создания ложа для имплантатов. Осо-
бое значение имеет последовательность
действий при остеотомии, для которой
в большинстве случаев требуется ком-
плект оригинальных инструментов,
созданных разработчиками импланта-
тов данного типа. Однако при всем раз-
нообразии инструментария в полной
мере остается справедливым указание
J. Kent и D. Misiek (125], а также Н.
Spiekermann и соавт. |223] о том, что в
остеотомии решающую роль играет
инструмент, режущий кость послед-
ним и окончательно создающий ложе
для имплантата.
Значительную травму кости наносят
плохо заточенные инструменты. В ком-
плект производимых рядом фирм инст-
рументов входят приспособления для
заточки сверл и боров. По той же при-
чине для нарезки резьбы в ложе выпус-
каются одноразовые метчики. Полезно
помечать боры, чтобы знать, сколько
сверлений ими уже было сделано.
Во избежание заражения импланта-
та ни в коем случае нельзя использо-
вать инструменты из нержавеющей
стали. На костной поверхности ложа
имплантата, высверленного борами из
нержавеющей стали, при электронно-
микроскопическом исследовании об-
наруживаются следы металла. По-
скольку контакт разнородных метал-
лов в биологической среде может угро-
жать электролизом и, следовательно,
воспдтением по периметру импланта-
та, ряд производителей стали включать
в комплект режущие инсгрументы из
титана.
Используя различные методы и лю-
бые инструменты, следует выполнять
остеотомию максимально щадяще, так
как после имплантации структура кос-
ти меняется. Чем сильнее травмирова-
но кортикальное и губчатое вещество
кости, тем больше опасность ухудше-
ния интеграции имплантата в кости.
Более того, как отмечает С. Misch
(178], от характера остеотомии зависит
развитие резорбции кости в будущем.
Остеотомию начинают после откилы-
вания слизисто-надкостничного лос-
кута и повторного замера реальной вы-
соты и ширины кости (рис. 5.27, а).
Неровности, выступы, острые края
кости сглаживают при помощи боров,
костных кусачек, костных распаторов,
рашпилей (рис. 5.27, б). Сглаживают
также альвеолярную дугу, если ее край
острый, чтобы площадка, куда будут
ставить имплантат, была шире его диа-
метра.
Нередко имплантации и последую-
щему протезированию препятствуют
выступающие анатомические костные
образования, в том числе экзостозы. В
случае обнаружения больших экзосто-
зов при скелетировании кости нижней
челюсти их удаляют бором, фрезой или
зубным рашпилем. В таких случаях для
лучшего обзора кости мягкие ткани
следует отводить тупым крючком. Де-
лать это нужно с большой осторожно-
стью, чтобы на нижней челюсти не
травмировать язычный нерв, артерию,
вену, а также проток поднижнечелюст-
ной слюнной железы, а на верхней че-
люсти — переднюю небную артерию.
Экзостозы, деформирующие неб-
ный свод, могут располагаться в облас-
ти небного валика твердого неба. В тех
случаях, когда для их уддтения требу-
ется лишь незначительно увеличить
скелетирование кости на небе, опера-
цию выполняют одновременно с им-
плантацией. В других случаях удаление
экзостозов может стать самостоятель-
ной операцией, которую производят
перед имплантацией. Интервал между
операциями составляет 1,5—2 мес.
Если планом лечения предусматри-
вается фиксация на имплантаты съем-
ного протеза, то нередко приходится
корригировать или удалять острую че-
люстно-подъязычную линию, умень-
шать подбородочный бугорок и подбо-
родочный выступ, а также удалять
нижнечелюстной валик. При значи-
тельной атрофии нижней челюсти наи-
более выражена косая линия. Умень-
шение и удаление челюстно-подъя-
зычной линии требуют отслоения мы-
шечных волокон в этой области. В тех
случаях, когда мышца находится вбли-
зи альвеолярной дуги, то при отслаи-
вании слизисто-надкостничного лос-
кута в язычную сторону ее верхние
пучки следует отсепаровывать от кости
и опускать снизу (см. рис. 5.26). Если
косая линия выступает, поверхность ее
острая и болезненная при пальпации,
то ее следует сгладить бором или фре-
зой. При уменьшении подбородочного
бугорка и подбородочного выступа
приходится отсекать часть подборо-
дочно-язычной мышцы и подшивать
ее так, чтобы дно полости рта распола-
галось ниже. Нижнечелюстные валики
(торусы), как правило, удаляют час-
Рмс. 5.27. Определение мест установления имплантата.
а — повторный замер кости; б — сглаживание бором поверхности кости; в — измерение расстоя-
ния между имплантатами; г — наметочные обозначения мест установления имплантатов при по-
мощи бора (вид на поверхности кости и вид при распиле нижней челюсти).
306
тично в пределах, обеспечивающих ус-
ловия, адекватные для протезирова-
ния.
При всех этих хирургических дейст-
виях кусочки кости собирают в сте-
рильную емкость с изотоническим рас-
твором натрия хлорида или в стериль-
ную салфетку дтя последующего при-
менения.
Маркировка мест постановки им-
плантатов. Ее осуществляют для оцен-
ки скелетированной кости как полно-
стью адекватной для имплантации и
протезирования. Измеряют и обозна-
чают нужные расстояния для имплан-
татов (рис. 5.27, в). Кортикальную пла-
стинку маркируют, делая специальным
карандашом метки или бором точки,
небольшие насечки, где должны быть
центры имплантатов. Можно маркиро-
вать точки прямо на поверхности кос-
ти, обозначая бором центр остеотомии
(рис. 5.27, г). Таким же путем, когда
ставят несколько имплантатов, их цен-
гры маркируют последовательно один
за другим. У стандартных имплантатов
системы Branemark диаметром 3,5 мм
расстояние между центрами маркиро-
вочных углублений должно составлять
не менее 7 мм. Место и направление
будущего сверления кости обозначают
на модели (рис. 5.28, а). Остеотомию
желательно производить через акрило-
вую прозрачную каппу, позволяющую
с максимальной точностью создавать
ложе имплантата в соответствии с ок-
клюзией (рис. 5.28, б). Смысл марки-
ровки состоит в том, чтобы при после-
дующей перфорации кортикальной
пластины исключить соскальзывание
конца бора. Это особенно важно тогда,
когда в связи с окклюзией необходимо
установить имплантат не строго верти-
кально, а под некоторым углом.
Сверление направляющих отверстий
Для перфорации кортикальной пла-
стинки кости в месте постановки им-
плантата пользуются круглым бором
(рис. 5.29, а). Остеотомия направляю-
щими сверлами кортикального и губча-
того вещества кости проводится на глу-
бину, соответствующую длине выбран-
ного имплантата (рис. 5.29, б). Сверле-
ние называется направляющим потому,
что по нему контролируют соответствие
утла наклона и линейности булулцих им-
Рис. 5.28. Определение направления ин-
струментов для остеотомии при зубной
имплантации.
а — на модели челюсти через акриловую каппу;
б — на месте операции через акриловую каппу.
плантатов потребностям окклюзии. Для
этого используют специальные направ-
ляющие фрезы, обычно диаметром око-
ло 2 мм (у Branemark pilot drill 1,6 мм),
вращающейся со скоростью, рекомен-
дуемой производителями системы вы-
бранного имплантата. Эта скорость мо-
жет варьировать в значительных преде-
лах. Так, для имплантатов Branemark
она составляет 2000 об/мин, "Inter-
pore", "3i" - 1500 об/мин, "1MZ" -
1000—1500 об/мин, "Core-Vent" ("Para-
gon") — 600—1000 об/мин, "Steri-Oss" —
300 об/мин. При использовании им-
плантатов "Bicon" такую начдльную
скорость постепенно снижают до 30—
50 об/мин.
После окончания первого направ-
ляющего сверления отверстие проверя-
ют, а именно — определяют правиль-
ность его наклона и глубины. При не-
обходимости для контроля делают
рентгеновские снимки, низиографию
а б в г д e
ж з и к л м
308
Рис. 5.29. Этапы установления винтовых имплантатов.
а — перфорация кортикальной пластинки круглым бором; б — остеотомия направляющим свер-
лом: в — расширение коронковой части костного ложа; г — продолжение остеотомии форми-
рующим сверлом; д — зенковка; е — проверка глубины и направления костного ложа; ж — на-
резка резьбы; з — вворачивание по резьбе имплантата; и — установление первичной стабильно-
сти имплантата; к — вворачивание запорного винта; л — вид винтовых имплантатов после уста-
новления и введения запорного винта; м — зашивание мягких тканей нал имплантатами; н —
вид сформированного ложа для имплантатов и проверка параллелизма; о — вил имплантатов по-
сле вворачивания запорного винта; п — рентгенограмма челюстного сегмента после протезиро-
вания на имплантатах Branemark; р — рентгенограмма нижней челюсти с винтовыми импланта-
тами; с — рентгенограмма дистального отдела нижней челюсти с винтовыми имплантатами после
протезирования.
или сопоставляют размеры по компью-
терным томограммам. Правильность
направления сверления чрезвычайка
важна, так как при постановке не-
скольких имплантатов главным ориен-
тиром при всех последующих сверле-
ниях служит направление первого на-
правляющего (наметочного) отверстия.
Для этого в него вставляют специаль-
ную штангу или оставляют в нем бор
диаметром 2 мм, выступающий конец
которого служит ориентиром линейно-
сти. Так же поступают по окончании
сверления каждого следующего на-
правляющего отверстия в кости.
Когда на нижней челюсти имплан-
таты планируется использовать в каче-
стве опор несъемного протеза, первое
направляющее отверстие рекомендует-
ся делать в маркировочное углубление,
расположенное ближе других к сред-
ней линии, и только после того, как
будет проверена его направленность по
отношению к верхней челюсти, про-
должать сверление ближайших и дру-
гих направляющих отверстий, опять же
ориентируясь по первому наметочному
отверстию.
Чтобы более надежно предупредить
соскальзывание конца бора при свер-
лении под углом, некоторые фирмы
выпускают специальные дриль-боры
меньшего диаметра (1 — 1,6 мм). В та-
ких случаях каждое направляющее от-
верстие высверливают двумя борами.
Вначале бором малого диаметра пер-
форируют только кортикальную пла-
стинку. Сверление ведут с наружным и
внутренним охлаждением и при скоро-
сти вращения бора 500—600 об/мин. В
дальнейшем направляющее сверление
проводят фирменной фрезой, бором
диаметром 2 мм или фрезой Ледерман
на всю глубину губчатого вещества кос-
ти соответственно длине имплантата
(см. рис. 5.29, б). На этом этапе ско-
рость вращения бора может быть уве-
личена до 1500—2000 об/мин.
После сверления каждого отверстия,
кроме направления, определяют и его
глубину. Традиционно считают, что
погружные имплантаты в форме корня
зуба необходимо заглублять на 1—2 мм
ниже края кости, иначе из-за неизбеж-
ной резорбции костной ткани в период
приживления возможно их обнажение.
Однако высказываются также проти-
воположные рекомендации [109], а
именно ставить имплантат вровень с
краем кости [79].
Контроль за глубиной сверления на-
правляющих отверстий проводят по
специальным кольцевым меткам на
фрезе. Если же они отсутствуют, мож-
но использовать надетое на нужном
расстоянии от апикального конца бора
стерильное ограничительное кольцо,
которое легко сделать из резинового
катетера соответствующего диаметра
[88|. Ряд фирм выпускает специальные
глубиномеры, с помощью которых од-
новременно проверяют направление и
линейность сверления.
Если при сверлении обнаруживается
ошибка, то корригировать направле-
ние можно повторным сверлением из
того же отверстия фрезой несколько
большего диаметра, но обязательно
меньше того, который требуется для
окончательного создания ложа [111].
Такая коррекция не должна ухудшить
начальную стабильность имплантата. В
случае неудачной коррекции возможна
замена запланированного имплантата
конструкцией большего диаметра. Не
следует также забывать, что у многих
систем имплантатов в форме корня зу-
ба предусмотрены опорные головки с
разными углами наклона. Нередко
ошибка при сверлении может быть
скорректирована с их помощью.
Увеличение диаметра ложа и сверле-
ние формирующими фрезами. При всех
типах имплантатов в форме корня зу-
ба, как цилиндрических, так и винто-
вых, ложе расширяют по окончании
сверления направляющими фрезами.
Этот этап остеотомии заключается в
расширении отверстий формирующими
фрезами постепенно возрастающего
диаметра (рис. 5.29, в, г). Не рекомен-
дуется увеличивать новый диаметр бо-
лее чем на 0,5 мм [88], хотя ряд фирм
в своих рекомендациях не придержи-
вается этого правила. Тем не менее об-
щепризнано, что чем меньше разнятся
диаметры последовательно сменяемых
фрез, тем меньше опасность перегрева
косги и отклонения от правильного ут-
ла наклона при сверлении. С целью
уменьшения такой опасности в процес-
се расширения ложа некоторые фирмы
но
комплектуют инструменты парными
наборами фрез. В каждой паре одна
фреза предназначена для начала свер-
ления. Кончик такой фрезы представ-
ляет собой гладкий штифт того же диа-
метра, что и инструмент, которым было
высверлено ложе. Штифт служит на-
правляющим эле.менто.м для осталь-
ной, режущей части фрезы, диаметр
которой соответствует следующему ша-
гу сверления. Поскольку высверли п>
отверстие на необходимую глубину та-
кой фрезой невозможно, досверливают
ложе второй формирующей фрезой,
диаметр которой соответствует шагу
сверления (см. рис. 5.29, г).
Ошибка в угле наклона имплантата
обнаруживается сразу же после наме-
точного сверления, коррекция обычно
возможна в ходе последующего сверле-
ния. Неправильный наклон уже по-
ставленного имплантата может быть
компенсирован постановкой опорной
головки с соответствующим наклоном
ее коронковой части. Все фирмы вы-
пускают наборы компонентов супраст-
руктуры, которые помогают сохранять
поставленный имплантат. Вместе с тем
глубину, наклон и параллельность
можно корректировать супраструкту-
рой с соответствующим углом наклона.
Расширить костное ложе можно не
только машинным, но и ручным спосо-
бом. В ряде систем имплантатов преду-
смотрен специальный инструмент для
формирования ложа вручную. Такое
расширение, хотя и удлиняет процесс,
зато полностью устраняет опасность
першрева кости и необходимость охла-
ждения.
Некоторые врачи предпочитают ком-
бинированный метод расширения ло-
жа. Вначале они сверлят с помощью
формирующих фрез с ультрамалой ско-
ростью, а последний этап формирова-
ния осуществляют вручную. У имплан-
татов, выпускаемых рядом фирм, для
этого предусмотрен специальный руч-
ной расширитель ложа. Сверление про-
изводят постепенно движениями вверх
и вниз, а костные опилки с режущих
инструментов тщательно собирают,
чтобы использовать при гранспланта-
ции у шейки имплантата. Если при ме-
ханическом расширении ложа не де-
лать поступательно-возвратных движе-
ний, то возникает опасность перфора-
ции и перегрева плотной кости ниж-
ней челюсти, а на верхней челюсти —
создания ложа диаметром, превышаю-
щим нужный.
В отдельных случаях может потребо-
ваться заглубить уже расширенное ло-
же. Делать это теми же фрезами, что и
сверление, не рекомендуется из-за
опасности повредить при их введении
стенки ложа и тем самым изменить его
диаметр. Ложе углубляют только лопа-
стными сверлами диаметром до 1,6 мм
при обильном охлаждении и минималь-
ной скорости вращения (см. рис. 5.29,
г). При окончательном замере глубины
костного ложа из него должны быть
убраны все костные опилки.
Иногда, нарушая классические пра-
вила с целью обеспечения наилучшей
стабильности имплантата на верхней
челюсти, его ставят так, чтобы апи-
кальный конец входил в компактную
кость дна носовой полости или дна
верхнечелюстной пазухи (см. рис. 5.16).
Тогда соответствующую кость созна-
тельно перфорируют, но делают это ис-
ключительно вручную, чтобы не повре-
дить слизистую оболочку и не "прова-
литься" в верхнечелюстную пазуху. За-
тем через просверленное в кости от-
верстие остеотомом с затупленным
концом или кюретажной ложкой слег-
ка приподнимают слизисто-надкост-
ничную выстилку, чтобы имплантат
при постановке не перфорировал ее
[73, 74]. Сверление кости производят
только вручную, чтобы остановиться
сразу, как только кость перфорирова-
на, иначе неизбежны перфорация сли-
зистой оболочки и попадание бора в
верхнечелюстную пазуху.
Следует учитывать также качество
кости. При плотном компактном веще-
стве кости сверлить следует более пре-
рывисто, с обильным охлаждением, но
сохраняя высокую скорость вращения
бора. В губчатом рыхлом веществе кос-
ти, особенно на верхней челюсти, свер-
лить следует с повышенной осторож-
ностью, почти не оказывая давления на
кость и не расширяя непроизвольно
ложе имплантата. В противном случае
возрастает опасность перфорации верх-
нечелюстной пазухи и травмирования
нижнего альвеолярного нерва. В перед-
ней части верхней челюсти опасность
при сверлении может создавать наклон
кости в губную сторону на 30—40 *.
Сверление надо вести осторожными
движениями вверх и вниз, чтобы охла-
ждающая жидкость свободно омывала
кость и режущий инструмент. Важно,
чтобы при сверлении инструмент дви-
гался по прямой, а не по дуге. Это
достигается при движении не кистью, а
плечом. При сверлении боры, фрезы
часто вынимают из кости и очищают
ложе от костных опилок. Это необхо-
димо, поскольку костные опилки, об-
разующиеся при сверлении, заставля-
ют прилагать дополнительные усилия
для вращения бора, отчего на нижней
челюсти возрастает опасность перегре-
ва плотной кости и непроизвольного
увеличения диаметра ложа. Чтобы не
повредить стенки ложа, бор, фрезу вы-
нимают из него еще до окончания вра-
щения, а не после их остановки в кос-
ти. По той же причине следует вводить
в кость уже вращающийся инструмент,
не оказывая давления на него.
При сверлении рекомендуется
обильное орошение стерильным изо-
тоническим раствором натрия хлорида
или раствором Рингера. Охлаждение
может быть наружным или одновре-
менно наружным и внутренним. Оно
должно предотвращать нагрев кости
более чем до 47 ’С. Однако только
внутреннего охлаждения может быть
недостаточно.
При сверлении костного ложа на
верхней челюсти опасность перегрева
кости всегда меньше, так как здесь
кость в основном губчатая. Поскольку
верхняя челюсть представлена преиму-
щественно губчатым веществом, при
вставлении имплантата опасность ком-
прессионного повреждения и перелома
кости всегда меньше, чем на нижней
челюсти.
Несмотря на популярность охлажде-
ния кости при сверлении через нако-
нечник бора, внутреннее охлаждение
имеет значительные недостатки по
сравнению с наружным. При внутрен-
нем охлаждении удаляются далеко не
все костные частицы, образующиеся
при сверлении. Отверстие, через кото-
рое подается охлаждающая жидкость,
нередко частично засоряется, отчего
эффект охлаждения значительно сни-
жается. Помимо этого, после остеото-
мии с наружным охлаждением контакт
новой костной ткани с поверхностью
имплантата больше, чем при сверле-
нии ложа с внутренним охлаждением.
При сверлении неизбежно образова-
ние слоя травмированной, некротизи-
рованной ткани, толщина которого за-
висит от нагрева кости и продолжи-
тельности тепловой травмы. Нагрев
кости усиливается по мере заглубления
режущего инструмента и достигает пи-
ка при первом сверлении направляю-
щей фрезой диаметром 2 мм [83].
Экспериментально и клинически ус-
тановлено, что на нагрев кости при ос-
теотомии влияет ряд факторов, в том
числе инструментарий и характер ис-
пользования его: геометрия и острота
режущей части инструмента, толщина
кортикальной части и плотность кости,
глубина сверления, скорость вращения
бора, фрезы, сила давления на них, воз-
вратно-поступательные движения при
работе с ними, постепенное расшире-
ние ложа, характер охлаждения.
При сверлении кость нагревается не
только режущим концом сверлящего
элемента, но и всей его заглубленной
частью, которая вращается в контакте
со стенками создаваемого ложа. Чтобы
уменьшить нагрев, выпускают боры с
диаметром, основная часть тела кото-
рых имеет несколько меньший диа-
метр, чем их режущая часть. Такие бо-
ры, в частности, входят в комплект ин-
струментов в системе имплантатов
"Maestro System" [177а].
Если при сверлении ложа диаметр
каждого следующего режущего инстру-
мента увеличивается только на 0,5 мм,
то кость нагревается меньше по двум
причинам. Во-первых, каждым бором,
фрезой высверливают меньшее коли-
чество кости. Во-вторых, из-за более
низкого сопротивления продвижению
инструмента каждое сверление про-
должают всего несколько секунд. По-
мимо этих преимуществ, небольшое
увеличение диаметров последователь-
но сменяемых боров или фрез помога-
ют сохранять прицельное направление
сверления. Даже при отклонении свер-
ла легко провести коррекцию.
Если зависимость нагрева от охлаж-
дения, остроты и скорости вращения
сверлящего инструмента признается
всеми, то прилагаемой при этом силе
уделяется мало внимания. Как ни па-
радоксально исследования показали,
что увеличение прилагаемой силы или
скорости заглубления бора снижает
темп нагрева кости. Это происходит за
счет сокращения времени сверления. В
то же время последующее увеличение
исходной силы дает обратный эффект,
т.е. значительное повышение темпера-
туры.
Зенковка. После того как ложе им-
плантата в форме корня зуба расшире-
но до размера, необходимого для на-
резки резьбы, формируют уступ для
коронковой части имплантата, если
это предусмотрено его конструкцией.
Смысл такой операции заключается в
том, чтобы подогнать коронковую
часть ложа под размер и форму шейки
имплантата, это обеспечивает погру-
жение на уровень края кости альвео-
лярной дуги или ниже и плотное при-
легание его шейки к кости. Зенковку
осуществляют конусообразной фре-
зой, форма и размеры режущей части
которой точно соответствуют таковым
шейки имплантата (рис. 5.29, д). Так
же, как до боров и других режущих ин-
струментов, до режущей части зенко-
вочной фрезы нельзя дотрагиваться ру-
ками. Зенковку обычно делают вруч-
ную с большой осторожностью, по-
скольку малейшая неточность может
быть причиной неполного прилегания
шейки к кости и. следовательно, обра-
зования полостей. Во избежание этого
при наличии рыхлой кости на нижней
челюсти и почти при всех ситуациях на
верхней специальная зенковка не ре-
комендуется, следует утапливать шей-
ку цилиндрических имплантатов лег-
кими постукиваниями, а винтовых —
путем их заглубления вворачиванием.
В том и другом случае зенковка допус-
тима, только если это позволяет глуби-
на подготовленного ложа.
Для исключения угловой ошибки
при зенковке, что также ведет к не-
плотному прилеганию шейки к кости,
у зенковочной фрезы имеется направ-
ляющий штифт, диаметр которого точ-
но соответствует диаметру расширен-
ного ложа, а режущая часть — форме
шейки. Сверление режущей частью
фрезы начинают после введения этого
направляющего штифта в ложе. Ско-
рость вращения бора при этом должна
быть такой, которую рекомендуют раз-
работчики данной системы импланта-
тов для сверления в плотной корти-
кальной кости. Наружное или внут-
реннее охлаждение при сверлении
должно быть адекватным.
Глубина зенковки делается такой,
чтобы была обеспечена стабильность
шейки в кортикальной пластине. Иде-
альным вариантом считается зенковка
на половину ее толщины. Во всех слу-
чаях после зенковки на альвеолярном
гребне должна быть сохранена часть
кортикальной пластины для стабилиза-
ции имплантата. Чрезмерное зенкова-
ние может привести к тому, что им-
плантат окажется подвижным. Чтобы
избежать ошибки, после зенковки обя-
зательно убирают из ложа костные
опилки и еще раз с помощью зонда оп-
ределяют глубину ложа и его соответст-
вие имплантату (рис. 5.29, е). Если это-
го не сделать, то может возникнуть
опасность неполной посадки импланта-
та, что всегда грозит разрушением резь-
бы на кости ложа. Ряд систем имплан-
татов ("Плазма Поволжья", "Astra
Tech.", "Bicon”) не требуют предвари-
тельной зенковки и нарезки резьбы. Их
ставят после создания костного ложа
формирующей фрезой (см. рис. 5.29, д).
После зенковки излишки мягкой
ткани вокруг имплантата удаляют, что-
бы они не попали в костное ложе при
установке имплантата. При необходи-
мости края раны истончают.
После каждого этапа формирования
ложа обязательно оценивают его глу-
бину и наклон. Перед замером глуби-
ны из ложа удаляют все костные опил-
ки. Рекомендуется делать рентгенов-
ский снимок или контролировать на
визиографе при вставленном в ложе
боре или специальном глубиномере
правильность наклона, параллельность
(см. рис. 5.29, е).
Нарезка резьбы. Эту манипуляцию
начинают после туалета высверленного
ложа. Для каждой системы импланта-
тов установлен диаметр фрезы, которой
заканчивают расширение ложа перед
нарезкой в нем резьбы. Тем не менее
при последнем сверлении обшим пра-
вилом считается использование фрезы
диаметром на 0,25—0,5 мм меньше, чем
диаметр имплантата (см. рис. 5.29, г).
Нарезку проводят метчиком, диаметр
которого соответствует таковому им-
плантата. Успех нарезки в значитель-
ной мере зависит от остроты метчика,
поэтому многие фирмы предназначают
этот инструмент для одноразового ис-
пользования. Способ нарезки зависит
от качества кости и может быть произ-
веден машинным или ручным спосо-
бом. Если не требуется значительных
усилий, то метчик вращают вручную.
В высверленное до нужного диаметра
ложе метчик вводят с помощью специ-
ального держателя; дотрагиваться ру-
кой даже в перчатке до его режущей
части не следует. С помощью держате-
ля и накинутого на него ключа-тре-
щотки метчик осторожно вращают.
Однако более надежным для сохра-
нения нужного направления при наре-
зе резьбы считается ключ без плеча,
ручка которого располагается непо-
средственно на оси имплантата и име-
ет форму гриба. После нескольких
полных оборотов метчик немного по-
ворачивают в обратную сторону, чтобы
освободить нарезанные ребра от кост-
ных опилок, строго сохраняя то на-
правление оси, при котором произво-
дили нарезку резьбы (рис. 5.29, ж).
По мере заглубления метчика строго
регулируют усилие для его вращения.
Значительное возрастание сопротивле-
ния вращению может быть признаком
введения метчика на всю глубину ло-
жа. Дополнительные усилия неизбеж-
но приводят к срыву резьбы на кост-
ной ткани. Следует помнить, что
большая часть резьбы всегда приходит-
ся на губчатую кость, менее плотную,
чем кортикальное вещество.
При плотной кости, когда вручную
приходится прилагать слишком боль-
шие усилия для вращения метчика, его
можно вставить в наконечник борма-
шины и продолжать нарезку машин-
ным способом. Скорость вращения
метчика при такой нарезке не должна
превышать 15 об/мин. Если кость на
верхней челюсти очень мягкая, то
резьбу в костном ложе метчиком толь-
ко намечают. До конца ее "нарезает"
сам имплантат при окончательном за-
глублении.
Отворачивать метчик для удаления
его из костного ложа следует с осто-
рожностью, чтобы не повредить резь-
бу. После нарезки резьбы проводят
туалет костного ложа и извлекают из
него костные опилки. Однако кровь из
ложа не удаляют, так как в дальнейшем
она способствует процессу костной
интеграции. Костные опилки, находя-
щиеся в продольных полостях метчи-
ка, собирают с соблюдением правил
асептики для заполнения ими про-
странства у шейки имплантата перед
зашиванием мягких тканей.
Нельзя исключить случаи, когда
обычный винтовой имплантат может
быть использован как самонарезной и
необходимость в нарезке резьбы для
него метчиком отсутствует. Чаще всего
это возможно при постановке винто-
вых имплантатов в верхнюю челюсть,
но и на нижней челюсти, когда кость
рыхлая, можно не нарезать резьбу. В та-
ких случаях проводят сверление фрезой
максимального диаметра, рекомендо-
ванной для сверления под метчик, не
зенкуют и ложе под опорную головку и
шейку имплантата. В рыхлой кости реб-
ра имплантата сами "нарезают" резьбу, а
шейка "осуществляет" зенкование.
Следует помнить, что нарезка резь-
бы в костном ложе — операция непро-
стая. На ее успех во многом влияет как
качество кости, так и опыт хирурга.
Сама же резьба на костной стенке не
всегда достаточно прочна. Ряд произ-
водителей, учитывая опасность в силу
разных причин срыва резьбы при ос-
теотомии, предусматривают опреде-
ленные действия. Чаще всего выпуска-
ют запасные имплантаты большего
диаметра. В литературе их нередко на-
зывают имплантатами-дублерами.
Если же имплантат большего диа-
метра поставить невозможно, то кост-
ное ложе следует зашить, закрыть мяг-
кой тканью, наложить на нее швы и от-
ложить имплантацию на 9—12 мес. В
случаях, когда происходит заживление
кости, перспектива повторной остеото-
мии в том же месте благоприятная.
Установление (инстилляция) винто-
вых имплантатов проводится после
проверки достаточности глубины его
ложа. Опасность заключается в том,
что при высверленном на недостаточ-
ную глубину ложе или попадании в не-
го костных опилок попытки устано-
вить имплантат так, как предусмотре-
но его конструкцией, могут привести к
нарушению резьбы на стенках кости.
При установлении винтовых им-
плантатов строго соблюдают правила
асептики. Имплантат должен быть аб-
солютно стерильным; на его поверхно-
сти должен быть только слой кислоро-
да. Дотрагивание до него руками даже
в стерильных перчатках, соприкосно-
вение его с мягкой тканью, инструмен-
тами из другого металла чреваты зара-
жением поверхности имплантата, что
отрицательно влияет на костную инте-
грацию.
В подготовленное ложе винтовой им-
плантат можно ставить вручную или
машинным способом. В том и другом
случае используют специальный держа-
тель, который закрепляют на его корон-
ковой части и на который ставят ревер-
сионный ключ-трешотку для установ-
ления имплантата по резьбе (рис. 5.29,
з, и). После того как имплантат апи-
кальной частью вставлен в ложе, надав-
ливают на держатель пальцем одной
руки, тогда как другой рукой с помо-
щью реверсионного ключа-трещотки
держатель медленно вращают вместе с
прикрепленным к нему имплантатом.
Конструкции держателя постановочно-
го инструмента различны, но в боль-
шинстве случаев используют варианты
замков шестигранной формы.
Ручное вворачивание имплантата
всегда предпочтительнее машинного.
Даже при машинном способе введения
имплантата его окончательное установ-
ление рекомендуется проводить вруч-
ную, так как при этом легче контроли-
ровать правильность заглубления по
резьбе и достижение имплантатом
конца резьбы. При надавливании на
имплантат нужно опасаться увеличе-
ния нагрузки, чтобы не создать в кости
излишнее давление и нс нарушить реб-
ра нарезки на кости.
После окончательного заглубления
имплантата вначале осторожно снима-
ют ключ-трешотку, а затем и сам по-
становочный держатель. После провер-
ки адекватности заглубления в ложе ко-
ронковой части имплантата в его внут-
реннюю резьбу вворачивают запорный
винт (рис. 5.29, к), следя за плотно-
стью посадки последнего. В случае
срыва резьбы при остеотомии необхо-
димо использовать имплантат больше-
го диаметра или имплантат-дублер.
Так, у имплантатов Вгапешагк и "ЗГ
имеются запасные винтовые имплан-
таты диаметром 4 мм для замены стан-
дартных имплантатов диаметром 3,7
мм. Для конструкций с гидроксиапа-
титным напылением фирма "Paragon”,
ныне входящая в компанию "Calcitek",
предусмотрела при нарушении резьбы
на кости замену винтового имплантата
"Core-Vent" цилиндрическим [185]. В
тех же случаях, когда в системе вы-
бранного для постановки имплантата
такие замены не предусмотрены, а по
какой-либо причине при остеотомии
существует опасность срыва резьбы на
кости, целесообразно планировать по-
становку имплантата на ступень ниже
максимально допустимого для данной
ситуации диаметра.
Если у выбранного имплантата таких
дублеров не имеется, то A. Granin и со-
авт. [223] советуют заранее подбирать
соответствующие имплантаты других
фирм. Принцип должен быть следую-
щим: при повреждении резьбы следует
ставить винтовой или цилиндрический
имплантат большего диаметра. Если
же ложе слишком велико для цилинд-
рического имплантата, рекомендуется
применить или цилиндрический им-
плантат большего диаметра, или вин-
товой имплантат также большего диа-
метра. Как уже отмечалось, по поводу
взаимоотношений коронкового края
имплантата и края кости альвеолярного
гребня мнения достаточно противоре-
чивы. Классически полагается заглуб-
лять имплантат на 1—2 мм ниже края
кости. Иногда с эстетической целью
имплантат погружают в кость еще ни-
же, так, чтобы часть его полированной
шейки размером 1 мм оказалась под
краем гребня. Расчет делается на то,
что после приживления край имплан-
тата будет располагаться под слизистой
оболочкой. Однако такое погружение
создает дополнительные трудности на
втором хирургическом этапе. С. Misch
[178] считает, что имплантат должен
быть погружен до края кости, иначе
после постановки опорной головки об-
разуется слой соединительной ткани
толщиной 0,5 мм, что всегда опасно
образованием десневого кармана. Кро-
ме того, как показали Ch. Hammer и
соавт. [169], в заглубленных в кость
имплантатах атрофия происходит ин-
тенсивнее (1,04 мм в год), а в постав-
ленных у альвеолярного края составля-
ет 0,45 мм. Наблюдение за заглублен-
ными имплантатами также показало,
что через 1 год в результате резорбции
высота кости уменьшилась на 2,26 мм,
тогда как в контрольной группе, где,
согласно рекомендации изготовите-
лей, их ставили так, чтобы граница
шейки соответствовала краю гребня,
резорбция составляла только 1,02 мм.
Таким образом, у заглубленных им-
плантатов атрофия захватывала всю ту
часть полированной шейки, которая
погружалась в кость |109]. Поэтому
имплантат должен быть вровень с кра-
ем кости или при одноэтапном вмеша-
тельстве выстоять над ним [108].
Стабильность имплантата должна
быть проверена после его постановки.
Это особенно важно на отдельных уча-
стках верхней и нижней челюстей при
различных характеристиках кости, осо-
бенно тонкого кортикального и рыхло-
го губчатого вещества, а также при из-
менениях вследствие атрофии костной
ткани. Так, при постановке имплантата
на дистальных участках верхней челю-
сти его положение может изменяться.
Если не достигается первоначальная
стабильность имплантата, заживления
мягких тканей над ним не наблюдается,
то следует подумать о создании допол-
нительной опоры для имплантата пу-
тем наращивания кости [128].
Вворачивание запорных винтов осу-
ществляют после туалета внутренней
части имплантата. Запорные винты яв-
ляются временными элементами кон-
струкции, и роль их проста. Они не не-
сут никакой нагрузки и лишь защища-
ют внутреннюю резьбу в коронкой час-
ти имплантата в период его приживле-
ния. Некоторые производители назы-
вают их также винтами заживления
или заглушками. Они могут быть ме-
таллическими или пластмассовыми,
иметь резьбу или вставляться в им-
плантат без нее. Так же, как импланта-
ты, следует ставить только стерильные
запорные винты.
При одновременной установке не-
скольких винтовых имплантатов в ко-
стное ложе их вворачивают последова-
тельно один за другим. Запорные вин-
ты ставят после введения каждого им-
плантата (рис. 5.29, л).
Как указывалось выше, возможна
ситуация, когда необходимо извлечь
имплантат. При этом надо соблюдать
ряд правил: осторожно поставив по-
становочный инструмент на находя-
щийся в кости имплантат, соедините
их путем завинчивания; при помощи
ключа-трещотки под контролем паль-
ца по вертикали имплантата начинают
вращение против часовой стрелки и
извлекают имплантат вместе с поста-
новочным инструментом. Может воз-
никать ситуация, когда образуется де-
фект кости и требуется закрыть его
биоматериалом, в том числе с мембра-
ной |121|.
Зашивание мягких тканей. Эта про-
цедура завершает первый хирургиче-
ский этап. После установки запорного
винта, а при использовании несколь-
ких имплантатов после постановки
всех запорных винтов рану тщательно
промывают. Если мягкая ткань не была
подготовлена на предыдущих этапах
операции, то ее мобилизуют для полно-
го и глухого зашивания раны над им-
плантатом. При избытке мягких тканей
их иссекают, иногда толстые кератини-
зированные края раны истончают [47].
Затем их сопоставляют и рану послой-
но зашивают (рис. 5.29, м). Проверяют
стояние имплантата на визиографе или
по рентгенограмме (рис. 5.29, н, о).
Так же контролируют имплантат после
этапа протезирования (рис. 5.29, п—с).
В зависимости от клинической ситуа-
ции, вида рассечений и состояния мяг-
ких тканей накладывают различные ви-
ды швов, обеспечивающих герметич-
ность раны и хорошее кровоснабжение
(рис. 5.30). Для закрытия имплантата
может потребоваться мобилизация тка-
ней, иногда — выкраивание слизистого
лоскута из соседних областей [113]. Для
уменьшения интенсивности послеопе-
рационного кровотечения и предотвра-
щения образования гематомы приме-
з — наложение узловых швов; б — наложение непрерывного шва; в — наложение непрерывного
шва с фиксацией по краям раны; г — отсроченные поперечно расположенные швы; д — отсро-
ченные горизонтально расположенные швы; е — одиночные узловые, непрерывный и крестооб-
разные швы; ж — узловые швы.
Рис. 5.30. Продолжение.
з — матрацный шов при фиксации трапециевидного лоскута; и — наложение узловых и матрац-
ных швов для фиксации языкообразного лоскута.
Рис. 5.31. Одноэтапное установление одиночного винтового имплантата.
а — отслоение слизисто-надкостничного лоскута, остеотомия, введение имплантата; б — налета
опорная головка, лоскут уложен на место; в - фиксирована временная коронка, выведенная из
прикуса; г — фиксирована постоянная коронка.
няют давящие повязки, которые накла-
дывают на 4—6 ч, а также холод.
В течение 3—4 нед пациент должен
регулярно посещать врача для контроля
за заживлением мягких тканей. В слу-
чае необходимости ему прописывают
антибиотики и болеутоляющие лекар-
ственные средства. Имплантаты оста-
ются в покое на нижней челюсти в те-
чение 3—4 мес и на верхней — 5—6 мес.
На этот период пациент может поль-
зоваться протезами, но обязательно
при условии, чтобы на места постанов-
ки имплантатов не было нагрузки и в
этих местах не могла возникнуть трав-
ма слизистой оболочки. Через 3—6 мес
проводится протезирование с опорой
на имплантаты (см. рис. 5.29, п—с).
Нагрузка на имплантат является
очень важной проблемой. Традицион-
ным считается, что поставленные им-
плантаты должны находиться без на-
грузки 3—4 мес на нижней челюсти и
5—6 мес на верхней челюсти, т.е. это
время, которое нужно для костной ин-
теграции. Многолетние наблюдения
P.-I. Вгапешагк и соавт. [74], R. Adell и
соавт. [40], Т. Albrektson и соавт. [43]
показали эффективность ортопедиче-
ской реабилитации от 15 до 30 лет в
85 % случаев при классических прави-
лах нагрузки на имплантаты (см.
рис. 5.29, п). Вместе с тем A. Pham и
соавт. [193] на основании результатов
клинического и рентгенологического
(в том числе по данным компью терной
томографии) исследований установили
меньшую потерю кости у имплантатов
в форме корня зуба при ранней нагруз-
ке. На верхней челюсти потеря кости
при ранней нагрузке была более значи-
тельной. Кроме того, убыль кости за-
висела от вида имплантата и техники
его введения. Так, ввинчивающиеся
имплантаты ведут к меньшей атрофии
кости, нежели цилиндрические, ставя-
щиеся под давлением. Вместе с тем по-
сле нагрузки на них эта разница исчез-
ла. В случаях установления одиночного
имплантата необходимо сначала фик-
сировать временную коронку, выведен-
ную из прикуса, и только через 4—6 мес
ставить постоянную (рис. 5.31).
Хорошие результаты получил L. Lin-
kow [160] также при ранней нагрузке на
имплантат. J. Hahn [106] считает, что
использование перед зашиванием мяг-
ких тканей ауто- и аллокости, других
биопластических материалов, уклады-
ваемых около основания коронковой
части имплантата, позволяет нагру-
жать его значительно раньше.
5.3.3. Имплантация самонарезных
винтовых конструкций
Самонарезные имплантаты не требуют
предварительной нарезки метчиком в
костном ложе, о чем говорит их назва-
ние. Это ощутимо сокращает время ос-
теотомии. Для установки преимущест-
венно в рыхлую кость применяют по-
гружные и непогружные самонарезные
имплантаты. Проводят остеотомию на-
правляющим и формирующим свер-
лом; зенковка и нарезка резьбы не тре-
буются. Имплантат вводят вручную, в
связи с чем опасность перегрева кости
практически отсутствует [138, 139]. Все
это значительно упрощает установле-
ние самонарезных имплантатов. Тем,
кто начинает заниматься зубной им-
плантацией, рекомендуется приобре-
тать первый опыт при работе с такими
имплантатами, например "Astra Tech.”.
Разрезы мягких тканей, маркировку*
мест постановки и остеотомию прово-
дят обычным порядком, постепенно
увеличивая диаметр бора или фрезы
при расширении ложа. В последний
раз применяют сверло или фрезу диа-
метром на 0,8 мм меньше диаметра са-
монарезного имплантата. Окончив ос-
теотомию, костные опилки из ложа
удаляют, но кровь оставляют. После
проверки достаточности глубины ложа
и правильности его наклона начинают
вводить имплантат. Делают это с со-
блюдением тех же правил, что и при на-
резке в кости резьбы метчиком. Паль-
цем одной руки твердо, но без излиш-
них усилий надавливают на имплантат,
а другой рукой медленно вращают его
до полного заглубления (рис. 5.32).
Зашивание мягких тканей над само-
нарезными имплантатами для одно-
этапного и двухэтапного применения
производят традиционно. Также оди-
наковы сроки приживления всех им-
плантатов и последующие манипуля-
ции с элементами их супраструктуры.
б
Система винтовых самонарсзных
имплантатов хорошо зарекомендавала
себя, о чем свидетельствуют результа-
ты отдаленных наблюдений |40, 118,
119, 209].
5.3.4. Имплантация винто-
цилиндрических конструкций
Методика установления винтоцилинд-
рических имплантатов аналогична эта-
пам остеотомии винтовых конструк-
ций. Нарезка резьбы чаще требуется в
пришеечной части костного ложа.
Особой осторожности требует введе-
ние по нарезке имплантата и обеспече-
ние ему стабильности. Чаще винтоци-
линдрические имплантаты имеют ти-
тановое или гидроксиапатитное по-
крытие; предпочтительнее ручное вве-
дение имплантата (рис. 5.33, а—ж).
В поставленный вровень с поверхно-
стью кости имплантат вворачивают за-
порный винт и рану зашивают наглухо
(рис. 5.33, з). Имплантаты "Steri-Oss",
"Core-Vent", "Calcitek" часто вместо за-
порного винта закрывают чресслизи-
стым удлинителем и тогда рану заши-
вают вокруг них и лечение не требует
второго хирургического этапа. Хоро-
шие результаты получены с винтоци-
линдрическими имплантатами "Плазма
Поволжья" (рис. 5.33, и, к).
Рис. 5.32. Этапы установления винтовых
самонарсзных имплантатов.
а — ручное введение по нарезке имплантата;
б — этапы приживления и нагрузки на им-
плантаты 'Astra Tech." по рентгенограммам;
в — рентгенограмма нижней челюсти с им-
плантатами "Bicon".
5.3.5. Имплантация
цилиндрических конструкций
Места постановки и количество ци-
выбирают
линдрических имплантатов
так же, как для винтовых имплантатов.
Одинакова и методика остеотомии на
таких этапах, как рассечение мягких
тканей, маркировка мест постановки
имплантатов, расширение ложа и зен-
ковка (рис. 5.34, а—и). После подго-
товки костного ложа для цилиндриче-
ских имплантатов из него удаляют ко-
стные опилки, окончательно опреде-
ляют его глубину и направление. От-
сутствие необходимости нарезать в ко-
стном ложе резьбу значительно упро-
щает остеотомию, уменьшает травму
кости и сокращает время операции.
Обычно цилиндрические импланта
ты заглубляют, надавливая на них паль-
rm
Рис. 5.33. Этапы установления винтоцилиндрических имплантатов.
а — остеотомия на11равляюшим сверлом; б — продолжение остеотомии формирующим сверлом;
в — проверка контоором размеров костного ложа; г — нарезка резьбы; д — установление им-
плантата; с — проверка стабильности имплантата; ж — вворачивание запорного винта; з — за-
шивание раны.
Нем или постукивая по ним молотком.
Это можно делать потому, что в кост-
ном ложе отсутствует резьба, которая
значительно способствует начальной
стабильности винтовых имплантатов.
У цилиндрических же имплантатов на-
чальная стабильность в значительной
мере зависит от плотности их поста-
новки в ложе. Главная опасность при
остеотомии, особенно при недостаточ-
ном опыте или использовании неадек-
ватного инструмента, заключается в
создании для цилиндрического им-
плантата ложа диаметром, даже незна-
чительно большим, чем требуется
|131|.
Безусловно, при создании костного
ложа для цилиндрических импланта-
Рис. 5.33. Продолжение,
и — рентгенограмма нижней
челюсти с установленными
имплантатами "Плазма По-
волжья"; к — рентгенограмма
симфиза нижней челюсти с
имплантатами "Плазма Повол-
жья" после протезирования.
который рекомендуется
производителями, а вме-
сто этого легким посту-
киванием ввести в ложе
аналог имплантата. По-
сле удаления аналога в
ложе (также легким по-
стукиванием) следует
ввести цилиндрический
имплантат.
Следовать такой реко-
мендации нужно с чрез-
вычайной осторожно-
стью, особенно если раз-
ница между последним и
предпоследним диамет-
рами боров, которые ре-
комендованы произво-
дителем, значительна.
Попытка усилить кон-
такт имплантата с костью
за счет создания ложа да-
же незначительно мень-
тов следует прежде всего руководство-
ваться рекомендациями их производи-
телей. Однако необходимо помнить,
что рекомендации разрабатывались
если не для идеальных, то по крайней
мере для типовых условий. На практи-
ке же часто приходится наблюдать ано-
малии анатомии челюстей, нередко
значительно изменяющие условия для
имплантации. Нами отмечено, что при
имплантации на верхней челюсти или
рыхлых участках нижней челюсти пер-
воначальная стабильность цилиндри-
ческих имплантатов в большинстве
случаев не достигается, если последнее
сверление осуществляется инструмен-
том, рекомендованным производите-
лем. Из-за плохого качества кости диа-
метр ложа чаше всего оказывается уве-
личенным. Чтобы избежать этого.
N. Granin и соавг. (88J советуют не
сверлить бором последнего диаметра,
шего диаметра, чем диа-
метр имплантата, всегда
сопряжена с большой опасностью,
особенно на нижней челюсти. Как
показывает практика, если имплантат
приходится ставить с приложением
больших усилий, то плотная корти-
кальная пластинка почти всегда значи-
тельно повреждается. Также контро-
лируют стояние имплантата на визио-
графе или, чаще, рентгенограмме
(рис. 5.34, к).
Глубина погружения цилиндриче-
ского имплантата обусловливается его
конструкцией и взаимоотношениями с
мягкими тканями. При постановке ци-
линдрических имплантатов методика
зашивания мягких тканей зависит от
того, погружные они или непогруж-
ные, и одинакова с методиками заши-
вания мягких тканей при постановке
винтовых имплантатов (см. рис. 5.30).
Имеется достаточно много научных
исследований по эффективности ни-
322
е
5
Рис. 5.34. Этапы установления цилинд-
рических имплантатов.
а — перфорация кортикальной пластинки
и части губчатого вещества; б — расширение
устья ложа круглым бором; в — продолжение
остеотомии направляющим сверлом; г — рас-
ширение коронарной части костного ложа;
д — продолжение остеотомии формирующим
сверлом; с — проверка глубины костного ло-
жа; ж — введение имплантата; з — фиксация
имплантата легким постукиванием молотка;
и зашивание раны; к — рентгенограмма
нижней челюсти с установленными импланта-
тами “Core-Vent".
линдрических имплантатов: отечест-
венных ("Плазма Поволжья" [24]) и за-
рубежных ("Core-Vent", "Minimatic”,
"Calcitek", "Frialit" |92, 130, 139] (см.
рис. 5.34, к).
Осложнения при установке имплан-
тата. Во время остеотомии возможны
ряд осложнений. Перфорация дна
верхнечелюстной пазухи, если не по-
вреждены близлежащие мягкие ткани,
обычно больших трудностей не созда-
ет. Можно закрыть перфорационное
отверстие биоматериалом на основе
коллагена или гидроксиапатита и за-
менить имплантат более коротким.
Для профилактики перфорации дна
верхнечелюстной пазухи рекомендует-
ся применять имплантаты меньшей
Длины. Если имплантат введен в пазу-
ху неглубоко и отверстия на его апи-
кальном конце находятся в кости, то
обычно исход операции благоприят-
ный.
Значительной проблемой может
быть перфорация канала нижней че-
люсти 1173]. Если это произошло в хо-
де остеотомии, то имплантат меняют
на более короткий и разобщают сосу-
дисто-нервный пучок биоматериалом
[120, 129]. Так же поступают и тогда,
когда после имплантации перфора-
цию обнаруживают на рентгенограм-
ме и наблюдаются клинические сим-
птомы пропозалгии нижнего луноч-
кового нерва. Однако в этом случае
показана дополнительная операция
для удаления поставленного имплан-
тата [133].
Если явления поражения нерва от-
сутствуют, то проводят мероприятия
с целью его профилактики и наблюда-
ют за динамикой процесса после опе-
рации и ортопедического лечения.
При развитии невропатии через 6—
12 мес решают вопрос об удалении им-
плантата.
323
Нельзя исключить обнажение им-
плантата в результате расхождения швов
мягких тканей. В таком случае наложе-
ния новых швов избегают, чтобы не
увеличивать расхождение. Лечение за-
ключается в полосканиях полости рта
раствором хлоргекседина, использова-
нии местно лекарственных препаратов
на маслянной основе, способствующих
заживлению раны. D. Tolman (1995)
[238], проанализировав 252 сообщения
о результатах постановки имплантатов
в форме корня зуба, отметил, что глав-
ной проблемой было расхождение кра-
ев раны.
Второй хирургический этап. Вскры-
тие погружных винтовых имплантатов
проводят через 3—4 мес на нижней и
через 5—6 мес на верхней челюсти. Хо-
тя этот этап не требует сложных мани-
пуляций с костью, технически он не
менее сложен и занимает немало вре-
мени. На этом этапе выполняют сле-
дующие хирургические манипуляции:
определение местоположения имплан-
татов; их вскрытие; постановку опор-
ных головок или винтов заживления;
зашивание мягких тканей.
Места постановки имплантатов, за-
крытых мягкой тканью, определяют
клинически (рис. 5.35, а), рентгеногра-
фически и при измерении на акриловой
каппе или модели. В отдельных случа-
ях, чтобы обнаружить имплантат, мяг-
кие ткани прокалывают тонкой иглой.
Способы вскрытия каждого имплан-
тата могут быть разными. Если ткань
толстая и пальпировать имплантат не
удается, как невозможно определить
платность прилегания к нему кости,
или имплантат сильно заглублен, то
его вскрывают путем короткого разреза
слизистой оболочки и надкостницы
(рис. 5.35, б). Если имплантат обнару-
жен и закрывающая его ткань оказы-
вается тонкой, то для его вскрытия мо-
жет быть применен перфоратор-муко-
том слизистой оболочки (рис. 5.35, в).
Не пользуются перфоратором тогда, ко-
гда имеются сомнения относительно
состояния тканей контактной зоны и
плотности контакта имплантата с за-
порным винтом. Наилучшим способом
вскрытия является линейный разрез в
центре имплантата. При формировании
лоскута он должен обращен к верхушке
имплантата (рис. 5.35, г). В обоях слу-
чаях стараются сохранить кератинизи-
рованную ткань по краю альвеолярной
дуги. В случаях формирования лоскута
для заживления требуется больше вре-
мени, прикрепленная ткань сохраняет-
ся, количество ее увеличивается и в
дальнейшем около шейки имплантата
не наблюдается рецессии десны. По
данным D. Schart и D. Tarnow [205],
такое вскрытие предотвращает нару-
шение стабильности имплантатов
Branemark. Можно использовать также
только линейный разрез через всю
альвеолярную дугу (рис. 5.35, д).
После того, как мягкие ткани над
имплантатом рассечены, осматривают
слизистую оболочку и надкостницу.
Ткани излишней толщины истончают
(рис. 5.35, е, ж). При применении для
такой операции электроинструмента
касание им имплантата недопустимо.
При наличии нескольких импланта-
тов вместо короткого рассечения над
каждым из них можно проводить
длинное рассечение над всеми конст-
рукциями. Разрез делают по центру
альвеолярной дуги. Слизисто-надкост-
ничные лоскуты отгибают в вестибу-
лярную и оральную сторону или фор-
мируют их трапециевидными и отки-
дывают в сторону преддверия полости
рта. Таким приемом сохраняют цело-
стность прикрепленной слизистой
оболочки и обеспечивают репозицию
ее вокруг супраструктуры при зашива-
нии раны. В случае зашивания тканей
вокруг чресслизистого удлинителя вся
процедура второго этапа заключается в
замене его другими элементами супра-
структуры.
Постановку винтов заживления,
опорных головок осуществляют после
вскрытия имплантата и удаления за-
порного винта. Нередки случаи, когда
новообразованная кость прорастает
над краями запорных винтов. В таких
случаях перед их отворачиванием
кость над ними осторожно удаляют бо-
ром или долотом. Особое внимание
следует уделить вывинчиванию запор-
ного винта, делая вращательные движе-
ния против часовой стрелки. Не следует
прикладывать силу при удалении запор-
ного винта, а нужно фиксировать поло-
жение инструмента по вертикали, при-
дсрживая его пальцем сверху (рис. 5.35,
з, и). После удаления запорных винтов
проводят туалет внутренней резьбы
имплантатов и мягкие ткани вокруг
имплантатов подготавливают к заши-
ванию. При необходимости излишек
тканей иссекают соответственно диа-
метру опорной головки, аткани истон-
чают и фиксируют швами (рис. 5.35,
к), положение имплантата контроли-
руют по рентгенограмме (рис. 5.35, л).
После этого ставят опорные головки у
винтовых и цилиндрических имплан-
татов. Однако практика показала, что
Рис. 5.35. Второй хирургический этап зубной
имплантации Astra Tech.".
а — обнаружение запорного винта; б — иссечение
слизистой оболочки и надкостницы над телом им-
плантата скальпелем; в — иссечение слизистой обо-
лочки и надкостницы мукотомом; г — откидывание
слизисто-надкостничного лоскута; д — вид имплан-
татов после рассечения тканей по центру альвеоляр-
ной дуги; е — удаление избыточной кости над за-
порным винтом; ж — постановка инструмента на за-
порный винт; з — фиксация инструмента на нарезке
запорного винта; и — вывинчивание запорного вин-
та движениями против часовой стрелки; к — вид
имплантатов после удаления запорного винта; л —
рентгенограмма сегмента нижней ЧСЛЮСТМ С I
плантатами после удаления запорного винта.
A2S
1
2
Рис. 5.36. Установление винта заживления.
а — винт заживления; б — установление винта: 1 — вид вскрытого имплантата, 2 — вид уста-
новленного винта заживления; в — вил имплантатов с винтами заживления и супраструктуры
имплантатов после удаления винтов заживления; г — вид имплантата с чресслизистым удли-
нителем; д — вид имплантатов с защитными колпачками после удаления винтов заживления.
при немедленной постановке опорных
головок нередки случаи непроизволь-
ной нагрузки на них, что может задер-
живать заживление мягких тканей во-
круг имплантатов. Экспериментально
доказано развитие периимплантита
при немедленной постановке опорной
головки [226|. Поэтому врачи все чаще
предпочитают не спешить с постанов-
кой опорных головок и на место запор-
ного винта на период заживления мяг-
ких тканей (1,5—3 нед) ставят винт за-
живления — формирователь десны
(рис. 5.36, а, б). Одни авторы называют
его санитарным, гигиеническим, а дру-
гие — формирователем десны, винтом
заживления. Такие винты создают
максимально благоприятные условия
для заживления мягких тканей. По
мнению D. Buser и соавт. [77, 78], от
этого во многом зависят качество тка-
ней имплантационно-десневой связки
и функционирование имплантата в бу-
дущем (рис. 5.36, в—д). Вопрос о воз-
можности постановки временного
протеза в период заживления мягких
тканей решает индивидуально врач-
ортопед.
Постановка опорной головки — важ-
ный этап имплантации. Большое зна-
чение имеет правильный выбор ее дли-
ны и наклона. В противном случае воз-
можны осложнения при постановке
как головки, так и зубного протеза с
опорой на него [97]. Все системы им-
плантатов имеют комплекты супра-
сгруктуры — головки разной длины и
угла наклона (см. рис. 1.26). Необходи-
мо выбрать такую головку, которая на
1—2 мм выступает над альвеолярным
гребнем. Это исключает гипертрофию
десны и полное закрытие ею опорной
головки, а это случается, если головка
слишком короткая [142], на что указы-
вали U. Lekholm и соавт. [141] и что
подтверждено ими микробиологиче-
скими и гистологическими исследова-
ниями [142]. Наиболее точно опреде-
лить адекватную длину опорной голов-
ки каждого имплантата помогает такой
временный элемент, как упоминав-
шийся выше винт заживления, так как
длину головки устанавливают по окон-
чании процесса заживления мягких
тканей и удаления винта.
Опорная головка должна стоять на
имплантате предельно плотно, малей-
шие промежутки недопустимы. Столь
же плотно головка должна прилегать к
компонентам, которые ставят, чтобы
предотвратить ее вращение.
Угол наклона также должен быть
подобран в соответствии с требования-
ми окклюзии. После постановки опор-
ных головок края слизисто-надкост-
ничных лоскутов обрабатывают так,
чтобы они прилегали к опорной голов-
ке плотно, но без угрозы расхождения
швов. На мягкие ткани накладывают
глухие швы хромированным кетгутом,
полиамидной нитью. Чтобы предупре-
дить расхождение краев раны, приме-
няют матрацные швы. На этом этапе
временный протез может быть моди-
фицирован для опоры на головки им-
плантатов, но только с применением
мягких подкладок для уменьшения
давления на мягкие ткани. Через 8—10
дней швы снимают. Если были постав-
лены винты заживления, то через 2—3
нед их удаляют и заменяют опорными
головками. После оценки стояния им-
плантата (или имплантатов) начинают
ортопедическое лечение.
5.3.6. Одноэтапная имплантация
конструкций в форме корня зуба
В середине 90-х годов непогружные им-
плантаты в форме корня зуба применя-
ли значительно реже, чем погружные,
для постановки которых необходимо
двухэтапное оперативное вмешатель-
ство. Вместе с тем благодаря большому
разнообразию супраструктур погруж-
ных имплантатов их начали ставить в
один этап, и эта тенденция находит все
больше сторонников [49а, 108, 108а].
Фирма "1TI Bonefit System" первой на-
чала выпуск одноэтапных имплантатов
в форме корня зуба. Вначале их пусто-
телые цилиндрические конструкции
предназначались главным образом для
постановки на передние участки верх-
ней челюсти. Однако практика показала,
что их имплантация эффективна и на
других участках челюстей. Основными
производителями одноэтапных цилин-
дрических и винтовых имплантатов в
форме корня зуба являются также фир-
мы "Lederman Implant System", "Ha-Ti
Implant System" и "Конмет". Импланта-
ты могут быть пустотелыми или цель-
ными, иметь форму конуса (в том чис-
ле винтовые). На теле могут распола-
гаться разнообразные отверстия, а на
его корональной части — хорошо от-
полированная шейка или чресслизи-
стый удлинитель. Поверхность тела
большинства имплантатов имеет плаз-
менное титановое напыление.
Показания к имплантации непо-
гружных имплантатов при одноэтап-
ном лечении такие же, как и к приме-
нению других конструкций в форме
корня зуба. Хирургические процедуры
при их постановке одинаковы с теми,
которые проводят на первом этапе им-
плантации, когда используют погруж-
ные цилиндрические имплантаты
(рис. 5.37, а—е). При винтовых им-
плантатах этапность остеотомии также
идентична и завершается формирова-
нием резьбы и вворачиванием имплан-
тата. Установление на беззубую верх-
нюю челюсть как винтовых, так и ци-
линдрических непогружных импланта-
тов делают рассечением мягких тканей
по гребню. При имплантации, если
кости достаточно как по ширине, так и
по длине, слизистую оболочку в месте
остеотомии можно иссекать перфора-
тором-мукотомом. Что касается запор-
ных винтов, то их можно ставить двух
размеров: большего, когда требуется,
чтобы мягкие ткани были немного вы-
ше шейки имплантата, и меньшего,
чтобы мягкие ткани при заживлении
не закрыли имплантат. Если же из эс-
тетических соображений последний
вариант использовать невозможно, то
имплантат устанавливают на 1—2 мм в
кость и на него ставят чресслизистый
удлинитель высотой 2—4 мм. С помо-
щью последнего мягкие ткани при за-
Рис. 5.37. Установление погруженных имплантатов.
а — перфорация круглым бором кортикальной пластинки кости; б — расширение коронковой
части костного ложа; к — остеотомия формирующим сверлом; г — проверка глубины и направ-
ления ложа для имплантата; д — введение имплантата путем легкого поколачивания; е — фик-
сация имплантата; ж — рентгенограмма нижней челюсти с имплантатом "ITI”; з — фиксация
опорной головки и балочной системы на имплантаты "ITI*.
328
живлении образуют вокруг имплантата
плотное слизистое соединение.
Применение так называемых по-
гружных имплантатов при одноэтап-
ном вмешательстве требует, чтобы им-
плантат был или на уровне кости, или
возвышался на ней на 1—3 мм. В таких
случаях требуется конструкция с на-
ружным шестигранником [49а]. Высо-
кая эффективность одноэтапных им-
плантатов прослежена в течение 20 лет
у конструкций ”1ТГ, 7 лет — "Конмет"
(рис. 5.37, ж). Также хорошие резуль-
таты при такой постановке получены с
имплантатами "Replace Select” [108а].
При одноэтапной хирургической про-
цедуре вместо запорного винта ставят
формирователь десны [108а].
При одноэтапной хирургической
процедуре с непогружными импланта-
тами рану зашивают наглухо на альве-
олярной дуге и вокруг их надальвео-
лярной части. Особое внимание обра-
щают на положение краев тканей по
отношению к формирователю десны,
трансмукозному удлинителю или шей-
ке имплантата. Принимают меры к
предотвращению заворачивания тка-
ней внутрь и образования кармана [99].
Через 7 дней снимают швы и обсле-
дуют рану. Нередки случаи незначи-
тельного воспаления мягких тканей. В
течение 3 нед пациент посещает врача
для перевязок, а также контроля со-
стояния надальвеолярной части им-
плантата и прилегающей слизистой
оболочки. Через 2—3 нед большие за-
порные винты меняют на малые и па-
циенту рекомендуют самостоятельно с
помощью мягкой зубной щетки под-
держивать гигиену полости рта, чтобы
обеспечивать профилактику образова-
ния зубных бляшек.
Обычно полное заживление мягких
тканей после установления непогруж-
ных имплантатов отмечается через 2—
3 нед. Приживление же имплантатов в
кости во многом зависит от ее качест-
ва. При плотной кости это занимает
3—4 мес, при рыхлой — от 4 до 6 мес.
По истечении указанных сроков после
удаления чресслизистого удлинителя, а
чаше запорного винта малого размера
нередко оказывается необходимой вре-
менная (на 2—3 нед) постановка винта
заживления. После его удаления начи-
нают протезирование, для которого у
имплантатов всех систем предусмотрен
большой выбор супраструктурных эле-
ментов. Клинический опыт многих ис-
следователей убеждает в эффективно-
сти одноэтапного лечения с примене-
нием цилиндрических и винтовых им-
плантатов [79] (рис. 5.37, з). Одноэтап-
ная хирургия для установки импланта-
тов может проводиться и с конструк-
циями в форме корня зуба, предназна-
ченными для двухэтапного хирургиче-
ского лечения. Главным условием та-
кого подхода является наличие кости II
типа и толстая и плотная мягкая ткань
в окружности ложа. После последова-
тельных процедур остеотомии имплан-
тат устанавливают на уровне края кос-
ти или над ним. J. Hahn [108] рекомен-
дует имплантаты "Steri-Oss Replais Se-
lect" с шейкой 2 мм ставить одноэтапно
и протезирование начинать через 2,5—
3 мес. Он отмечал успех и при непо-
средственном пртезировании.
5.3.7. Имплантация конструкций
в форме корня зуба в бугор верхней
челюсти и крыловидный отросток
клиновидной кости, скуловую
кость
Как показала практика, наибольшие за-
труднения возникают при имплантации
в дистальные участки атрофированной
верхней челюсти [51]. У таких пациен-
тов кости под верхнечелюстной пазухой
мало, плотность ее невысока и часто на-
блюдается пневматизация. Единствен-
ным местом, где кость плотная, оста-
ется стык двух анатомических струк-
тур: между передней границей крыло-
видного отростка клиновидной кости и
задней границей бугра верхней челю-
сти. Срединная часть стыка двух ана-
томических структур пирамидального
отростка представляет собой горизон-
тальную часть небной кости. Повы-
шенное внимание к себе пирамидаль-
ный отросток привлекает потому, что
состоит из компактного вещества кос-
ти толщиной несколько миллиметров,
что достаточно для установления им-
плантата, тогда как упоминавшиеся
выше две другие анатомические струк-
туры такой толщины не имеют. В по-
добных ситуациях можно применять
одну из двух методик: поднятие дна
верхнечелюстной пазухи или поста-
новку имплантатов в крыловидный от-
росток, прилегающий к верхней челю-
сти.
При имплантации в крыловидный
отросток перед планированием всеми
возможными способами, включая осе-
вую компьютерную томографию, необ-
ходимо определить местоположение,
качество и количество кости [50]. Оце-
нивают также окклюзию, пространство
для протеза, степень открывания рта,
так как операцию производят под ме-
стной анестезией в дистальной части
верхней челюсти. Тем не менее, как
свидетельствует J. Tulasne [240], в ходе
хирургических манипуляций редко
удается установить имплантат так, как
планировалось. Причина заключается
в том, что подход к кости возможен
только по наклонной в переднезаднем
и нижневерхнем направлении, т.е. по
гипотенузе воображаемого прямо-
угольного треугольника.
Необходимо измерить расстояние от
точки доступа до заднего гребня бугри-
стости верхней челюсти с учетом дли-
ны имплантата (рис. 5.38, а). Цель та-
кого расчета в том, чтобы исключить
дистальное сверление крыловидного
отростка и таким путем избежать кро-
вотечения. При такой технике во вре-
мя операции точно определяют угол,
направление и длину имплантата, кро-
ме того, в данном случае объем остео-
томии меньше.
J. Valeron и J. Velazquez [242] реко-
мендуют следующую методику уста-
новления имплантатов в крыловидный
отросток. Слизистую оболочку и над-
костницу рассекают, отступив от греб-
ня в сторону неба и медиодистально,
не дойдя несколько миллиметров до
последнего оставшегося зуба (рис.
5.38, б). Это позволяет сохранить дис-
тально расположенный десневой сосо-
чек зуба при освобождающих рассече-
ниях в сторону преддверия рта. Слизи-
сто-надкостничный лоскут поднима-
ют, отгибают в сторону преддверия и
удерживают на месте с помощью рет-
рактора, чтобы обеспечить хороший
обзор во время операции. Для опреде-
ления точки доступа к верхней челю-
сти используют акриловый шаблон,
изготовленный с учетом предопераци-
онных оценок. На этом этапе круглым
бором осуществляют перфорацию кор-
тикальной кости.
После этого остеотомию производят
вручную цилиндрическими остеотома-
ми возрастающего диаметра, калибро-
ванными в миллиметрах (рис. 5.38, в).
Первым остеотомом диаметром 0,5 мм,
имеющим режущий конец, входят в от-
верстие, сделанное круглым бором под
тем углом и в том направлении, кото-
рые определены при подготовке к опе-
рации, затем легким постукиванием и
вращением медленно заглубляют инст-
румент в рыхлую кость бугра верхней
челюсти. Продвижение остеотома пре-
кращают, достигнув плотной кости ме-
жду крыловидным и пирамидальным
отростками (рис. 5.38, г). На этом этапе
обязательно производят рентгенограм-
мы, чтобы убедиться в правильности
угла и направления подготавливаемого
ложа, и при необходимости корригиру-
ют их. По миллиметровым отметкам,
имеющимся на каждом остеотоме, точ-
но устанавливают расстояние от места
начала остеотомии до границы плотной
кости, другими словами, определяют
адекватную длину имплантата.
После того как угол, направление и
глубина остеотомии проверены, в сде-
ланное отверстие осторожно последо-
вательно вводят следующие остеотомы
и также легким постукиванием и вра-
щением заглубляют их, стараясь не из-
менить направление и угол начальной
остеотомии. В результате образуется
тоннель диаметром 3 мм. Поскольку
при работе в губчатой кости боры не
используют, потери кости при остеото-
мии не бывает. Каждый последующий
остеотом сдавливает и уплотняет стен-
ки ложа. Клинически, инструменталь-
но во время остеотомии и по предопе-
рационным рентгенограммам и томо-
граммам) определяют величину (»
миллиметрах апикального участка ко-
стного ложа в медиодистальном на-
правлении. Таким образом определяют
длину костного ложа в миллиметрах. К
установленной длине тоннеля следует
добавить количество миллиметров для
заглубления апикальной части им-
плантата. В соответствии с этими раз-
мерами выбирают длину имплантата.
Вставленными в наконечник длинны-
ми круглыми борами, на которых от-
мечена длина имплантата, последова-
тельно сверлят только на протяжении
нескольких последних миллиметров в
костном ложе, т.е. плотную кость для
заглубления имплантата. В результате
имплантат должен быть заглублен апи-
кальной частью в плотную кость, а его
коронковая часть — находиться в кор-
тикальной кости верхней челюсти. Ес-
ли имплантат винтовой, то нарезают
резьбу. Остеотомию следует проводить
с обильным орошением (рис. 5.39, а—е).
Для образования ложа можно исполь-
зовать остеотом (рис. 5.39, ж).
Убедившись в начальной стабиль-
ности имплантата, проводят ревизию
мягких тканей и наглухо зашивают ра-
ну. Остеоинтегрированные импланта-
ты, установленные на этом участке,
хорошо выдерживают нагрузки, види-
мо, потому, что из-за угла наклона на-
грузки не приходились на их ось. Вме-
сте с тем ряд авторов отмечали ослож-
нения у пациентов с критически ма-
лым количеством кости в области бу-
гра верхней челюсти. При вскрытии
имплантата на втором этапе иногда
обнаруживали, что остеоинтеграция
не произошла, и имплантат приходи-
лось удалять.
Преимущество описанной техники
состоит в том, что в отсутствие необ-
ходимости пользоваться серией фрез
при работе в крыловидном отростке и
бугре верхней челюсти в наиболее
трудных анатомических условиях соз-
дается возможность реабилитации без-
зубого дистального участка с помощью
протеза, опирающегося на имплантат
(рис. 5.39, з).
На этот участок можно устанавли-
вать как погружные, так и непогруж-
ные имплантаты. В эксперименте на
собаках при сравнении результатов ус-
тановления погружных и непогружных
имплантатов Branemark установлено,
что через 6 мес имелись признаки не-
глубокого поверхностного воспаления
зажившей слизистой оболочки. Гисто-
логически в соединительной ткани,
примыкающей к эпителию, отмечена
ограниченная аккумуляция воспали-
тельных клеток, а у непогружных
имплантатов — постоянный инфильт-
рат воспалительных клеток в месте со-
единения опорной головки с имплан-
татом. От гребня кости этот инфильт-
рат отделяла зона нормальной соеди-
нительной ткани шириной 0,8 мм.
Клинически и рентгенографически
выявлена потеря гребня кости на про-
тяжении 2,4 мм. Адаптация мягкой
ткани и остеоинтеграция около по-
гружных и непогружных имплантатов
системы Branemark одинакова, что
подтверждено рентгенологически и
морфологически (98].
В случаях чрезмерной атрофии верх-
ней челюсти, сложности дополнитель-
ных операций наращивания кости для
установления имплантата рекоменду-
ются скуловые имплантаты. Эта конст-
рукция разработана P.-I. Branemark и
соавт. [73|.
Авторы вообще считали, что при
адекватной остеотомии на верхней че-
люсти, хорошем здоровье пациента, в
том числе здоровых верхнечелюстных
пазухах и полости носа, перфорация
пазухи не опасна.
Для его установления очень важно
тщательное предоперационное иссле-
дование, обязательно с томографией и
РКТ. Очень важно определение коли-
чества и качества кости в дистальном
отделе верхней челюсти. Ориентиром
места, где делается остеотомия, явля-
ется участок кости под скулоальвео-
лярным гребнем. Предварительные
расчеты для установления скуловых
имплантатов являются необходимыми
для определения наличия слоя кости
от скулоальвеолярного гребня к задней
стенке верхнечелюстной пазухи и да-
лее к телу скуловой кости. U. Okazaki и
соавт. [191а] положительно оценивали
скуловые имплантаты, которые хоро-
шо функционировали в качестве опор
съемного зубного протеза. Ни клини-
чески, ни по данным РКТ никаких
проблем воспалительного и другого ха-
рактера со стороны верхнечелюстных
пазух авторы не отмечали. В случаях
прохождения части тела имплантата
сквозь пазуху разрастаний грануляций,
изменений слизистой оболочки не об-
наруживалось (рис. 5.40).
a
в
Рис. 5.38. Установление имплантата в
дистальный отдел верхней челюсти и
крьиовидный отросток основной кости,
а — анатомические ориентиры: I — крыловид-
ный отросток, 2 — бугор верхней челюсти, 3 —
небная кость; б — линия рассечения мягких
тканей; в — инструменты для остеотомии: ос-
теотомы диаметром от 0,5 до 3 см; г — место,
направление и глубина остеотомии: 1 — вид
сбоку. 2 — вид спереди (Valeron J., Velaqucz J.,
1997].
412
д
Рис. 5.39. Остеотомия в дистальном от-
деле верхней челюсти и крыловидном от-
ростке основной кости.
а — сверление круглым бором малого калибра;
б — работа в кости остеотомами диаметром от
0,5 до 3 мм; в — измерение глубины костного
ложа; г — ориентиры для фиксации имплан-
тата; д — имплантат нужного диаметра и дли-
ны для установления в дистальный отдел верх-
ней челюсти и крыловидный отросток; е —
положение имплантата в дистальном отделе
верхней челюсти и крыловидном отростке ос-
новной кости.
Рис. 5.39. Продолжение.
ж — рентгенологический контроль направле-
ния и глубины сверления кости; з — рентге-
нограмма верхних челюстей с поставленными
имплантатами |Valeron J., Vclaquez J., 1997].
Рис. 5.40. Установление скуловых им-
плантатов.
5.3.8. Имплантация винтовых
и цилиндрических конструкций
с титановым и гидроксиапатитным
покрытием
Наибольшее распространение получи-
ли погружные: "Плазма Поволжья",
"Steri-Oss", "Calcite", "Core-Vent", и не-
погружные: "Конмет", "ПТ, импланта-
ты. Одно из первых сообщений об эф-
фективности имплантатов "Steri-Oss" и
отдаленных результатах их примене-
ния [108] явилось стимулом для широ-
кого распространения этих конструк-
ций [117, 126—128]. Считают, что ста-
бильность винтовых имплантатов с
гидроксиапатитным покрытием выше,
чем титановых, в том числе с плазмен-
ным напылением металла [108а]. Хи-
рургия постановки винтовых имплан-
татов такая же, как просто титановых
конструкций. Наиболее ответствен-
ным моментом является нарезка резь-
бы и введение по ней имплантата. Сто-
ронники винтовых титановых имплан-
татов считают, что гидроксиапатитное
покрытие может скалываться во время
введения, однако опыт многих специа-
листов свидетельствует о значительном
преимуществе имплантатов с таким
покрытием. Поданным J. Hahn [108а],
имплантаты "Steri-Oss" с гидроксиапа-
титным покрытием дали положитель-
ные результаты прижиатения в 97,3 %
случаев, вместе с тем эти же импланта-
ты с титановым покрытием стабильно
соединились с костью в 95,5 % случаев.
Такие же данные приводят Ch. Babusch
[48а] и М. Valcn [244].
Этапы установления имплантата ос-
таются традиционными, но особой ос-
торожности требует вынимание им-
плантата из стерильной упаковки.
Нельзя дотрагиваться до тела имплан-
тата, и противопоказаны какие-либо
примерочные процедуры.
5.4. Имплантация конструкций
плоской формы
Несмотря на то что, как показывает
мировая практика, плоские, или пла-
стиночные, имплантаты в настоящее
время используют значительно реже,
чем имплантаты в форме корня зуба,
они имеют ряд преимуществ, особенно
в сложных клинических ситуациях. В
первую очередь это возможность их
постановки в узкую альвеолярную ду-
гу. Плоские имплантаты нередко уста-
навливают при ширине кости менее
3—5 мм, недостаточной для импланта-
тов в форме корня зуба. Кроме того,
большое значение имеет возможность
в ходе установления подгонять пло-
ский имплантат под контур альвеоляр-
ной дуги простым изгибом и таким же
способом придавать опорным голов-
кам угол наклона, соответствующий
правильной окклюзии [147].
К достоинствам плоских импланта-
тов С. Misch [170] относит также то,
что, во-первых, у них плошадь контак-
та с костью при ее атрофии класса А в
1,5 раза больше, чем у имплантатов в
форме зуба; во-вторых, такой контакт
в 2 раза теснее при атрофии кости
класса В. По мнению автора, возмож-
ность изгибать имплантат по контуру
альвеолярной дуги также способствует
увеличению контакта с наличной ко-
стью. L. Linkow [158] большим пре-
имуществом плоских имплантатов
считает возможность протезирования
уже на 3—4-й неделе после оператив-
ного вмешательства.
Немаловажная особенность плоских
имплантатов заключается и в том, что
в ортопедические конструкции проте-
зов их можно включать в качестве опор
вместе с естественными зубами [30,
144]. Это позволяет уменьшать число
имплантатов, что имеет особое значе-
ние при включенных и дистальных де-
фектах зубов. Высказывается даже мне-
ние, что плоский имплантат вообще не
следует ставить без соединения с есте-
ственным зубом или другим импланта-
том [7, 103], хотя большинство клини-
цистов такого мнения не разделяют и
свидетельствуют об эффективности
имплантации с целью замены одиноч-
ного зуба без опоры протеза на другие
зубы. А.И. Матвеевой [13] разработаны
программы STOM-1 и STOM-2, по ко-
торым оценивается будущая функция
имплантатов с опорой протезов на тка-
ни челюсти (STOM-1) или на ткани че-
люсти и естественные зубы. Это позво-
ляет оптимально определить число им-
плантатов, места их постановки и вы-
бор протезной конструкции.
Вместе с тем большинство исследо-
вателей полагают, что у плоских им-
плантатов имеется такой важный не-
достаток, как их стабилизация в кости
при помощи фиброзной интеграции
[40, 42, 43]. По мнению Т. Aibrektsson и
соавт. [41]. фиброинтеграцию следует
считать лишь фазой реакции организма
на имплантат и потому в будущем нель-
зя исключить его отторжение. Однако
С. Weiss [253] доказал, что для функ-
ционирования имплантата фиброинте-
грация является оптимальной формой
сращения. L. Linkow [146], Р. Schnit-
mann и соавт. [208], К. Kapur [124],
С. Weiss [257], С. Misch [172], L. Linkow
и соавт. [157] добились костной и фиб-
рокостной интеграции плоских им-
плантатов и отметили их долговечность
(5—10 лет) в 90—96 % случаев. По дан-
ным A. Viscido [246] и С. Misch [170],
образующаяся вокруг плоских имплан-
татов костная ткань гистологически
одинакова с костной тканью вокруг им-
плантатов в форме корня зуба. L. Lin-
kow разработал виды имплантатов для
всех участков челюстей [145, 146, 148,
150, 151, 153, 154, 155, 156, 158].
Выбор мест постановки и количества
плоских имплантатов проводят заранее.
L. Linkow [147|, С. Weiss [253], С. Misch
[178] установили показания к имплан-
тации разработанных ими конструк-
ций плоской формы. Для отечествен-
ных имплантатов ВНИИМТ С. Чепу-
лисом и соавт. [36], В.М. Безруковым и
соавт. [1], Т.Г. Робустовой и соавт. [20],
С.Ю. Ивановым и соавт. [11] были
предложены практические рекоменда-
ции в зависимости от формы, высоты и
длины конструкции и места остеото-
мии. А.И. Сидельников [28] определил
математические параметры для остеото-
мии при постановке пластиночных им-
плантатов. Большое значение для разра-
ботки основных принципов оператив-
ной хирургии имели работы А.С. Черни-
киса [37] и О.Н. Сурова [28].
Наиболее эффективно использова-
ние плоских имплантатов при адентии,
когда ширина альвеолярного гребня
составляет 3—5 мм, хотя С. Misch [178]
считает возможным производить опе-
рацию даже при его ширине 2,5 мм.
Расстояние до верхней границы канала
нижней челюсти при этом должно
быть не менее 1 мм. При беззубой ниж-
ней челюсти рекомендуется ставить
имплантат длиной 15 мм с углом на-
клона менее 20 ° и соотношении ко-
ронка : имплантат менее единицы.
Установление плоских имплантатов
на различные участки нижней и верх-
ней челюстей имеет ряд особенностей.
В переднем отделе нижней челюсти
по краям подбородочного симфиза це-
лесообразно устанавливать имплантат
с одной опорной головкой. Это прави-
ло следует соблюдать и при постановке
нескольких имплантатов. При выра-
женном дугообразном изгибе нижней
челюсти в подбородочном ее отделе
может увеличиться биомеханическая
нагрузка на большую по длине им-
плантационную конструкцию, что мо-
жет быть причиной перелома как ее те-
ла, так и опорных головок.
В случаях, когда устанавливают не-
сколько имплантатов, рекомендуется,
чтобы промежуток между ними был не
менее 3 мм, а расстояние до зуба, ко-
торый будет служить второй опорой
зубного протеза, — не менее 2 мм.
Ориентиром для установления им-
плантатов в область премоляров может
быть также расположение подбородоч-
ного отверстия. Кроме того, у отдель-
ных пациентов верхняя точка петли
нижнего альвеолярного нерва может
находиться на 5 мм выше и кпереди от
подбородочного отверстия.
Особенно внимательно следует под-
бирать имплантаты на область второго
премоляра и моляров верхней челюсти.
Имеются различные модификации
предсинусных плоских имплантатов, а
также имплантатов на область бугров
[149, 155, 156, 252, 254].
При установлении имплантата вбли-
зи верхнечелюстной пазухи величину
кости и имплантата рассчитывают так,
чтобы расстояние от края тела конст-
рукции до дна пазухи составляло не
менее 1—2 мм. При подозрении на
перфорацию пазухи проводят традици-
онную диагностику (надувание щек и
констатация прохождения воздуха из
полости рта в полость носа, появление
пузырьков воздуха из глубины костно-
го ложа). Обнаруженное в верхнечелю-
стной пазухе перфорационное отвер-
стие закрывают биоматериалом — гид-
13А
роксиапатитом, гидроксиаполом и др.
Хорошие результаты дают использова-
ние блоков из колапола, коллапана,
остеогена или пластинок деминерали-
зованной кости [2б|, а также пластика
костным аутотрансплантатом [16].
Иногда целесообразно отсрочить им-
плантацию на 6 мес.
5.4.1. Одноэтапная имплантация
конструкций плоской формы
Плоские имплантаты выпускают разъ-
емной и неразъемной конструкции. В
России на первых этапах развития им-
плантации чаше всего ставили одно-
этапные конструкции плоской формы.
Наибольшее применение имеют не-
разъемные конструкции, предназна-
ченные для одноэтапного применения.
Операция их установления заключается
в выполнении следующих приемов:
1) рассечение слизистой оболочки и
надкостницы до кости, отслаивание
от кости слизисто-надкостничных
лоскутов и обнажение зубочелюст-
ного сегмента (рис. 5.41, а—д);
2) остеотомия кортикального и губчатого
вещества кости по вершине альвео-
лярного гребня для создания костного
тоннеля по длине, глубине и ширине
соответствующего размерам плоского
имплантата (рис. 5-41, е—м);
3) погружение имплантата в созданное
ложе и плотная фиксация в нем;
4) глухое зашивание раны над погру-
женным плоским имплантатом или
иссечение слизистой оболочки во-
круг опорной головки (или головок)
и глухое зашивание раны на других
участках рассеченной ткани.
Рассечение мягких тканей. Величина
лоскутов, отслаиваемых от кости при
постановке плоских имплантатов, за-
висит от индивидуальных особенно-
стей челюсти каждого больного, степе-
ни атрофии кости и плана лечения
(размер и количество имплантатов,
места их постановки). Рассечения мяг-
ких тканей следует проводить, придер-
живаясь правил, применяемых при ус-
тановлении имплантатов в форме корня
зуба (см. рис. 5.22, 5.24), но чаще поль-
зуются линейными разрезами по греб-
ню альвеолярной дуги (см. рис. 5.24, а).
На нижней и верхней челюстях боль-
шое значение имеет наклон альвеоляр-
ной части нижней челюсти или альве-
олярного отростка верхней челюсти,
который может быть отклонен в вести-
булярную или оральную сторону. Кро-
ме того, удаление зубов в разные пе-
риоды и атрофические процессы в кос-
ти могут обусловливать разнообразие
контуров остаточной кости, что необ-
ходимо учитывать при рассечениях и
обнажении кости в той или иной сте-
пени.
При одноэтапном оперативном вме-
шательстве разрез принято делать по
центру альвеолярной дуги через слизи-
стую оболочку и надкостницу до кости.
При включении в будущий протез ес-
тественных зубов рассечение тканей не
следует доводить до десневого сосочка.
Дугообразная форма разреза дает воз-
можность отслоить слизисто-надкост-
ничные лоскуты как с вестибулярной,
так и с оральной стороны. Иногда го-
ризонтальную линию разреза по греб-
ню дополняют вертикальными рассече-
ниями в одних случаях в вестибуляр-
ную, в других — в язычную, реже в неб-
ную сторону. Однако С. Weiss [254] не
видит необходимости в этом и считает,
что достаточно делать только горизон-
тальные рассечения, увеличивая их в
длину. Это позволяет также отслаивать
слизистую оболочку и надкостницу в
вестибулярную и оральную стороны.
Рассечение тканей должно с обоих
концов перекрывать предполагаемое
костное ложе имплантатов. О.Н. Суров
[28] рекомендует проводить разрез на
10 мм больше длины имплантата.
Очень важно делать рассечения с
учетом возможных сосудистых измене-
ний прикрепленной и свободной сли-
зистой оболочки, связанных с возрас-
том больного и функциональным со-
стоянием его организма, в том числе
сердечно-сосудистой системы. Такие
изменения мы выявляли перед опера-
цией при прижизненном микроскопи-
ческом исследовании. Нарушение
микроциркуляции в слизистой оболоч-
ке наблюдалось при выраженной атро-
фии кости, давности удаления зубов,
ряде общих заболеваний. Разная сте-
пень выраженности редуцирования ка-
пиллярного кровообращения проявля-
лась уменьшением числа и диаметра
капилляров, изменением их формы и
уменьшением общей площади, осо-
бенно на участке прикрепленной дес-
ны, прерывистостью кровотока в сосу-
дах. Негативные изменения усугубля-
лись при рассечениях по центру альве-
олярной дуги, дополнительных верти-
кальных разрезах и значительном от-
слоении слизисто-надкостничных лос-
кутов [9, 20]. Исследования микроцир-
куляции на этапе приживления им-
плантатов, когда для их постановки
рассечения проводились по альвеоляр-
ному гребню, показали, что с каждой
стороны прикрепленной слизистой
оболочки кровоснабжение восстанав-
ливается автономно и прорастания со-
судов от вестибулярной поверхности к
оральной и в обратном направлении не
происходит. Это послужило основани-
ем для вывода о том, что рассечение по
гребню альвеолярного отростка не все-
гда может оказаться адекватным. Ме-
сто рассечения мягких тканей, как и
величину отслаиваемых лоскутов, сле-
дует выбирать дифференцированно.
При выраженной атрофии кости целе-
сообразнее делать по гребню серпан-
тинные разрезы или вести рассечение,
отступив от центра альвеолярной дуги
в вестибулярную или оральную сторо-
ну. В том и другом случае сосуды про-
растают в обе стороны и кровообраще-
ние восстанавливается полностью.
При двухэтапной хирургической
процедуре постановки имплантата на
нижней челюсти в случае достаточно-
сти ее альвеолярной части рассечение
рекомендуется проводить, отступив в
язычную сторону, а при атрофии де-
лать разрез вестибулярнее гребня. По-
следнее целесообразно по причине то-
го, что на нижней челюсти при потере
зубов в большей степени атрофируется
альвеолярная часть с язычной сторо-
ны. В дистальном отделе нижней че-
люсти атрофия кости может обусло-
вить форму альвеолярной дуги в виде
лезвия ножа или, наоборот, вследствие
атрофии альвеолярная часть гребня
становится плоской. Рассечения с вес-
тибулярной стороны дают возможность
видеть рельеф альвеолярной дуги.
Если имплантат ставят в област и вто-
рого или третьего моляра, то рассечение
слизистой оболочки и надкостницы
следует начинать от ретромолярной ям-
ки. Это позволит сформировать боль-
шой слизисто-надкостничный лоскут,
который можно отсепаровать и ото-
гнуть в язычную сторону. В случае зна-
чительной атрофии дистального участ-
ка нижней челюсти при тонкой слизи-
стой оболочке рассечение лучше начи-
нать вестибулярнее ретромолярной ям-
ки. Благодаря хорошему обзору кости
дистального отдела челюсти по обе сто-
роны альвеолярной дуги отпадает необ-
ходимость отслаивать слизисто-надко-
стничный лоскут в язычную сторону.
Этим создается хороший обзор кости
для остеотомии, а позже — условия для
адекватного зашивания раны.
При имплантации на нижней челю-
сти большое значение имеет количест-
во и качество мягкой ткани, особенно
с вестибулярной стороны. Если при-
крепленной слизистой оболочки в об-
ласти вестибулярной поверхности че-
люсти достаточно, то, как правило,
при формировании лоскута проблем
не возникает. Если же прикрепленной
мягкой ткани недостаточно, она подат-
лива и глубина преддверия рта сниже-
на, то можно ожидать расхождение
швов, отслоение лоскута и осложнения
при заживлении раны. Очень важен об-
зор кости в дистальном отделе нижней
челюсти, особенно при атрофии кости
и выраженном влиянии медиальной
крыловидной мышцы на сформиро-
ванный лоскут. В тех случаях, когда во-
локна этой мышцы входят непосредст-
венно в ретромолярную область, надо
отсепаровать их от кости и лоскута.
Следует иметь в виду, что, посколь-
ку при вестибулярном рассечении раз-
рез, как правило, проводят над наибо-
лее тонким участком кости, может
произойти дигестенция костной ткани.
В этой ситуации также может возник-
нуть вопрос о наращивании кости и
пластике преддверия рта. В таких слу-
чаях отслаивать слизисто-надкостнич-
ный лоскут надо и в язычную сторону,
но очень осторожно, особенно в облас-
ти моляров, во избежание травмы со-
судисто-нервного пучка. На этом уча-
стке надо отметить места отхождения
челюстно-подъязычной мышцы. Ино-
гда при выраженной атрофии кости она
может начинаться у самого края альве-
олярной дуги или даже выступать
вверх. В таких случаях на участке кости,
где будет поставлен имплантат, надо от-
сечь верхние пучки мышцы и сместить
их вниз, иначе возможны расхождение
швов, ретенция слизисто-надкостнич-
ного лоскута и обнажение кости.
При имплантации на нижней челю-
сти обязательно проверяют расположе-
ние и выраженность челюстно-подъ-
язычной линии и прикрепление одно-
именной мышцы. Иногда возникает
необходимость в отсепаровке мышцы
вниз и сглаживании челюстно-подъ-
язычной линии. Острая линия может
быть причиной болевых ощущений.
Атрофия альвеолярной части нижней
челюсти бывает настолько значитель-
ной, что челюстно-подъязычная линия
приближается к альвеолярной дуге.
Кроме того, прикрепляющиеся в этой
области волокна мышцы могут ока-
заться вблизи альвеолярного гребня.
После откидывания слизисто-надкост-
ничного лоскута следует осторожно от-
сечь часть пучков мышцы соответст-
венно месту остеотомии для постанов-
ки имплантата. Откидывание слизи-
сто-надкостничного лоскута в языч-
ную сторону и отсечение верхних пуч-
ков мышцы проводят с осторожно-
стью, чтобы не повредить язычный
нерв (см. рис. 5.26).
Рис. 5.41. Этапы установления имплантатов плоской формы ("Oratronics , Конмст ).
а — линия рассечения слизистой оболочки и надкостницы по гребню альвеолярной дуги; б —
линия рассечения мягких тканей с сохранением межзубного сосочка; в образование трапе-
циевидного лоскута в дистальном отделе нижней челюсти; г — рассечение мягких тканей от рст-
ромоляриой ямки в вестибулярную сторону; д — отслаивание мягких тканей в язычную сторону;
е — перфорация кортикальной пластинки кости шаровидным бором; ж — перфорация корти-
кальной пластинки кости по изгибу альвеолярной дуги соответственно будущему костному ло-
жу; з — соединение отверстий в кости между собой; и — продолжение остеотомии фиссурным
бором на большую глубину губчатого вещества кости; к м — продолжение остеотомии фиссур-
ными борами увеличивающихся размеров для окончательного формирования костного ложа по
ширине и глубине.
339
Кроме того, отслаивая слизисто-над-
костничный лоскут в язычную сторону,
следует не повредить подъязычную
ветвь язычной артерии. При высоком
расположении мыши передней группы
их отделяют книзу, идя по язычной по-
верхности нижней челюсти, также ос-
торожно, поскольку подъязычная ветвь
язычной артерии имеет множество ана-
стомозов с сосудами этих мыши.
При разрезах на нижней челюсти
имеет значение ширина альвеолярной
дуги. Если в дистальном отделе она со-
ставляет 3 мм и более, то рассечение
можно сделать в обе стороны на 1 см
больше длины имплантата. При мень-
шей ширине альвеолярной дуги разрез
начинают в ретромолярной ямке и ве-
дут по язычной поверхности, чтобы от-
слоенный в вестибулярную сторону
слизисто-надкостничный лоскут по-
зволял снять противодействие со сто-
роны щечной мышцы. Дополнитель-
ные рассечения для наилучшего обзора
делают от ретромолярной ямки к ниж-
нему своду и кверху соответственно
ветви нижней челюсти.
В подбородочном отделе локализа-
ция рассечений мягких тканей зависит
также от характера атрофии кости. Для
того чтобы правильно выбрать место и
направление рассечения, прежде всего
следует определить форму альвеоляр-
ной дуги. Если она острая, то разрез
лучше делать в вестибулярную сторону.
При значительной атрофии костной
ткани и плоской форме остаточной
кости необходимо учитывать прикреп-
ление с язычной стороны мощных че-
люстно-подъязычной и подбородочно-
язычной мышц. При атрофии кости
они могут располагаться близко к аль-
веолярной дуге или непосредственно
на ней. В таких случаях целесообразно
делать линейный разрез, отступив от
центра альвеолярной дуги в язычную
или вестибулярную сторону, а также
серпантинный разрез.
При откидывании слизисто-надко-
стничного лоскута на нижней челю-
сти соответственно первому моляру и
второму премоляру обязательно долж-
ны быть обнажены подбородочное от-
верстие и петля одноименного нерва
во избежание их травмирования. В пе-
реднем отделе дополнительные рассе-
чения лучше делать по направлению к
своду преддверия рта у клыка или вто-
рого резца. Вертикальная стенка кор-
тикальной кости переднего отдела
нижней челюсти плотная, поэтому
слизисто-надкостничный лоскут да-
леко отсепаровывать не рекомендует-
ся, так как это может повлиять на пи-
тание кости и, следовательно, на
функцию остеобластов и заживление
раны.
При выраженных нарушениях мик-
роциркуляции прикрепленной слизи-
стой оболочки вертикальные дополни-
тельные рассечения опасны. При по-
мощи фрезы или зубного рашпиля
кость сглаживают. Вместе с тем не ре-
комендуется значительно откидывать
слизисто-надкостничный лоскут в
язычную сторону. Обзор кости и мани-
пуляции с язычной стороны можно
осуществлять тогда, когда рассечения
проведены больше с вестибулярной
стороны, в том числе с захватом тканей
ретромолярной ямки.
При атрофии кости в области второго
премоляра и первого моляра из-за вы-
сокого расположения подбородочного
отверстия и петли подбородочного нер-
ва показано рассечение по центру аль-
веолярной дуги до передней границы
ветви нижней челюсти. Далее линию
разреза ведут латерально и несколько
вверх. Затем осторожно отсепаровыва-
ют слизисто-надкостничный лоскут от
кости, так как надкостница плотно
спаяна с ее кортикальным слоем. Не-
обходимо не допускать разрывов сли-
зисто-надкостничного лоскута. Такое
рассечение позволяет легко отогнуть
слизисто-надкостничные лоскуты в
вестибулярную и язычную сторону.
Большое значение имеет техника от-
слоения слизисто-надкостничного лос-
кута. Прежде всего разрез должен рас-
сечь слизистую оболочку и надкостни-
цу; отслаивать их надо единым блоком
(см. рис. 5.25). Это позволяет обеспе-
чить хороший обзор кости там, где
планируется имплантация, сделать
операцию более бескровной и благода-
ря целостности слизисто-надкостнич-
ного лоскута создать наиболее благо-
приятные условия для заживления ра-
ны и приживления имплантата. Распа-
торы разных размеров применяют в за-
340
висимости от толщины слизистой обо-
лочки и надкостницы.
На нижней челюсти при работе с
язычной стороны следует использовать
распаторы изогнутые, небольшой ши-
рины и толшины. При отслаивании ин-
струмент должен скользить по кости.
Маятниковыми движениями аккуратно
отделяют надкостницу и прилегающую
к ней слизистую оболочку. Особенно
осторожно хирургические манипуля-
ции выполняют в дистальном отделе
нижней челюсти на уровне моляров.
Несколько большей ширины распа-
тор применяют, отсепаровывая слизи-
сто-надкостничный лоскут с вестибу-
лярной стороны нижней челюсти (сле-
дует скользить им по кости). С вести-
булярной стороны нижней челюсти
надкостница имеет наибольшую тол-
щину и легко отслаивается. На уровне
первого моляра и премоляров при от-
слаивании сначала следует обнаружить
подбородочное отверстие, установить
выходящий из него сосудисто-нерв-
ный ствол и отметить расположение
его петли. Отслоение лоскута на уров-
не нерва должно быть щадящим во из-
бежание травмы сосудисто-нервного
пучка и отходящих от него ветвей под-
бородочного нерва.
В переднем отделе нижней челюсти
при работе с язычной стороны следует
пользоваться изогнутым распатором,
так как поверхность кости может быть
вогнутой. С вестибулярной стороны се-
парацию следует проводить осторожно
из-за возможного близкого расположе-
ния петли подбородочного нерва. В
случае атрофии кости подбородочный
нерв может располагаться на гребне
альвеолярного отростка, что следует
иметь в виду как при рассечении, так и
при сепарации слизистой оболочки и
надкостницы.
Иногда перед имплантацией на
нижней челюсти показана пластика
преддверия полости рта или наращива-
ние кости. На верхней челюсти, как и
на нижней, традиционным считается
разрез по альвеолярной дуге. Однако по
соображениям гемодинамики, приве-
денным выше, особенно при атрофии
кости и сниженных показателях крово-
снабжения прикрепленной десны, раз-
рез рекомендуется делать не по центру.
а вестибулярнее в переднем отделе и
ближе к небной стороне — в дисталь-
ном отделе. Следует учитывать нали-
чие в дистальном отделе рыхлого под-
слизистого слоя и отслаивать лоскут
вместе с надкостницей.
На рассечение мягких тканей на
верхней челюсти большое влияние ока-
зывает тот факт, что слизистая оболоч-
ка по сравнению с таковой на нижней
челюсти не столь плотно соединена с
надкостницей и ткани более тонкие.
Слизистую оболочку и надкостницу
следует отсепаровывать единым бло-
ком, применяя широкие распаторы бо-
лее плоской формы. В дистальном от-
деле верхней челюсти при сепарации
слизисто-надкостничного лоскута в
вестибулярную сторону особая осто-
рожность требуется около скулоальве-
олярного гребня, так как при резких
движениях здесь может произойти раз-
рыв надкостницы. При отведении лос-
кута в сторону неба следует учитывать
толстый подслизистый слой. Распатор
должен быть изогнутым и скользить
все время по кости. Кроме того, на
твердом небе надкостница очень плот-
но соединена с костью. Отслаивать ее
надо последовательно по направлению
от альвеолярного отростка к небу.
В переднем отделе верхней челюсти
сепарацию слизисто-надкостничного
лоскута могут затруднить неровности
рельефа кости. Во избежание разрыва
слизистой оболочки и особенно надко-
стницы сепарацию осуществляют ши-
роким распатором, ведя его строго по
кости и выполняя маятниковые движе-
ния или движения строго вверх. На пе-
редних участках верхней челюсти раз-
резы делают, учитывая атрофию кости.
Если потеряны центральные зубы, то,
как правило, атрофия альвеолярного
отростка более выражена с вестибуляр-
ной стороны, и тогда рассечение следу-
ет проводить по гребню альвеолярной
дуги, ближе к небной поверхности. Не-
обходимо фиксировать локализацию
резцового сосочка и при рассечении
тканей следует обойти его спереди. На
уровне клыка и премоляров при отслаи-
вании слизисто-надкостничного лоску-
та может потребоваться отслоение щеч-
ной мышцы, которая при атрофии мо-
жет быть прикреплена близко к краю
остаточной кости и способствовать
расхождению швов. В дистальных отде-
лах верхней челюсти рассечение лучше
проводить в небную сторону. Это по-
зволяет откинуть лоскут в вестибуляр-
ную сторону и получить хороший об-
зор кости для более точной оценки
особенностей атрофии кости.
При имплантации в области премо-
ляров и моляров необходимо преду-
смотреть возможность перфорации
верхнечелюстной пазухи. Рассекать
мягкие ткани следует так, чтобы в слу-
чае необходимости имелся доступ для
поднятия дна верхнечелюстной пазухи.
Отслаивать слизисто-надкостничный
лоскут в дистальном отделе верхней че-
люсти следует широким распатором,
так как при атрофии кости к ней при-
легают внутренняя челюстная артерия и
крыловидное венозное сплетение.
В ряде случаев с вестибулярной сто-
роны верхней челюсти может наблю-
даться близкое прикрепление слизистых
и мышечных тяжей к альвеолярной дуге.
Тогда их отделяют вместе со слизисто-
надкостничным лоскутом. Все эти дей-
ствия позволяют сохранить кровоснаб-
жение слизисто-надкостничного лос-
кута и обеспечивают адекватность за-
шивания раны.
Корригирующие вмешательства на
мягких тканях при имплантации тре-
буют особого внимания к избыточной,
воспалительно-измененной ткани на
гребне альвеолярной дуги. Импланта-
ция на участках таких тканей не пока-
зана. Она может быть проведена на вто-
ром этапе после консервативного лече-
ния или после иссечения воспаленных
тканей скальпелем, удаления их элек-
трокоагуляцией или лазерным скальпе-
лем. В таких условиях имплантация мо-
жет быть проведена после заживления
раны и восстановления в ней адекват-
ного кровоснабжения. Если приходится
иссекать и надкостницу, то импланта-
цию отсрочивают на 8 мес — 1 год.
На верхней и нижней челюстях пре-
пятствием к отсепаровыванию слизи-
сто-надкостничного лоскута могут
быть рубцовые тяжи, складки слизи-
стой оболочки. Мышечные образова-
ния в преддверии рта могут оказаться
настолько выраженными, что потребу-
ется не только их отделение вместе со
слизисто-надкостничным лоскутом, но
и рассечение. Следует иметь в виду, что
такие рассечения слизистых и мышеч-
ных тяжей и складок могут неблаго-
приятно отразиться на кровоснабже-
нии слизисто-надкостничного лоскута.
При обширной зоне рубцовых стяже-
ний в преддверии рта соответственно
зубочелюстному сегменту, где плани-
руется постановка внутрикостных им-
плантатов, необходимо иссечь эти тка-
ни и выполнить пластику встречными
треугольными лоскутами с мобилиза-
цией ткани или возместить дефект сво-
бодным лоскутом слизистой оболочки,
кожи. Имплантация может быть про-
изведена через 1,5—3 мес после опера-
ции на мягких тканях.
Формирование костного ложа. Ос-
теотомию начинают после обнажения
и осмотра кости. Отмечают ее конфи-
гурацию, цвет, консистенцию корти-
кального вещества. Скелетированную
кость повторно измеряют на разных
уровнях альвеолярного отростка верх-
ней челюсти и альвеолярной части
нижней челюсти. Рекомендуется де-
лать повторные замеры кости через ка-
ждые 5 мм [20]. В отдельных случаях на
основании замеров скелетированной
кости приходится изменять первона-
чальный план и использовать имплан-
таты других размеров и форм.
При исследовании контура кости
альвеолярного отростка верхней челю-
сти следует отметить изменения рель-
ефа кости в области клыковой ямки,
всегда сопровождающиеся уменьшени-
ем толщины кости. На нижней челюсти
в области моляров обязательно уточня-
ют рельеф наружного склона альвео-
лярной части, характер вогнутости с
язычной стороны челюсти и располо-
жение челюстно-подъязычной линии.
На этих участках следует сделать по-
вторные замеры кости, чтобы при по-
становке имплантата избежать перфо-
рации. На скелетированной нижней че-
люсти отмечают расположение подбо-
родочных отверстий. При узкой и ост-
рой альвеолярной дуге приходится упло-
щать кость до толщины не менее 3 мм.
С. Misch [171] придерживается мнения,
что остеотомия возможна и при шири-
не кости 2,5 мм. При осмотре кости
следует обратить внимание на ее цвет,
плотность или пористость, а также на
возможные дефекты костной ткани.
Обнаруженные при осмотре кости
отдельные неровности или выступы
следует сгладить. Уплощение кости и
ее сглаживание осуществляют фрезой
или круглым бором с внутренним или
наружным охлаждением. После этих
процедур необходимы повторные за-
меры кости, так как может измениться
ее высота, что потребует применения
более короткого имплантата. Вместе с
тем D. Deporter [93] не рекомендует
уплощать кость, считая это дополни-
тельной травмой.
На выбранных заранее и проверен-
ных после скелетирования местах для
постановки имплантатов отмечают гра-
ницы каждого из них. Такую маркиров-
ку проводят на вестибулярной поверх-
ности альвеолярной дуги специальным
для каждой системы плоских импланта-
тов бором наименьшего диаметра. За-
тем соответственно этим отметкам по
центру альвеолярной дуги в нескольких
местах просверливают кортикальное
вещество кости круглым бором на глу-
бину 5 мм, обязательно с охлаждением.
Контролировать правильность углов
наклона сверления предпочтительно с
помощью акриловой каппы [88].
Губчатое и кортикальное вещество
кости сверлят со средней скоростью
вращения бора 1500—2000 об/мин
[176]. Из отечественных инструментов
для этого применяют твердосплавные
шаровидные и цилиндрические фис-
сурные боры, направляющие фрезы
разных размеров [28, 46, 254]. Для луч-
шего формирования ложа можно ис-
пользовать циркулярную пилу. Работая
ею, костные стенки можно сделать
ровными [6, 20]. Однако циркулярная
пила может применяться, когда все
анатомические параметры ложа хирур-
гу' известны, в том числе изгиб альвео-
лярного гребня. Рекомендуется инди-
видуальная подготовка каждого режу-
щего инструмента (скальпель, ножни-
цы, боры, сверла и др.), включающая
его правку, доводку и полировку.
Делая серию сверлений в кости
круглым бором, хирург отмечает про-
хождение кортикального слоя до губ-
чатого вещества. В кортикальном ве-
ществе кости сверление ведут преры-
висто, с внутренним или наружным ох-
лаждением. Отверстия в кортикальном
веществе, сделанные соответственно
телу имплантата, соединяют фиссур-
ным бором, чтобы образовалась бороз-
да (см. рис. 5.41, и). При этом бор ве-
дут от одного конца будущего ложа до
другого конца плавно, постепенно за-
глубляя его соответственно изгибу аль-
веолярной дуги. Таким путем корти-
кальную пластинку кости разделяют на
вестибулярную и оральную половины.
Правильность сверления контролиру-
ют, пользуясь аналогом имплантата
или измерительным прибором. Реко-
мендуется сделанные по ходу остеото-
мии замеры кости сверять с компью-
терными томограммами каждого блока
и слоя костной ткани [25].
Последующие сверления в губчатом
веществе кости делают фиссурными бо-
рами или фрезами, постепенно увели-
чивая диаметр инструментов. Сверле-
ние ведут с наружным и внутренним ох-
лаждением, с интервалами, прерывисто.
Бор не должен длительное время нахо-
диться на одном и том же месте. Мак-
симально в одном месте сверление до-
пустимо в течение 3 с. Глубину сверле-
ния отмечают на боре заранее в соответ-
ствии с размером и конструкцией плос-
кого имплантата. На этапе остеотомии в
губчатом веществе кости О.Н. Суров
[28] рекомендует уменьшать скорость
вращения режущего инструмента до
1000—1200 об/мин, тогда как С. Misch
[171] на этом этапе допускает повыше-
ние ее до 1500—2000 об/мин.
A. Cranin [88] считает возможным на
этом этапе остеотомии использовать
вместо бора диск "Core-Vent" при зна-
чительно меньшей скорости вращения
и водяном охлаждении. Однако оконча-
тельно открытый тоннель формируют
обязательно бором (см. рис. 5.41, к— м).
При создании костного ложа в виде
открытого тоннеля тщательно контро-
лируют направление сверления по от-
ношению к *наружной и внутренней
пластинкам кортикального вещества
альвеолярного отростка верхней челю-
сти и альвеолярной части нижней че-
люсти. Важно также не только сохра-
нять правильный угол для каждой го-
ловки имплантата, но и соизмерять его
с изгибом альвеолярной дуги. На при-
Рис. 5.42. Формирование кост-
ного ложа для плоского им-
плантата при рыхлой кости до-
лотами [Weiss С., 1982].
а — долота разного диаметра; б —
формирование костного ложа
на верхней челюсти; в — формиро-
вание костного ложа на нижней
челюсти; г — удаление костных
опилок рашпилем.
достаточным, так как на этом
участке альвеолярный отрос-
ток еще наклонен внутрь. Со-
ответственно корригируют на-
клон имплантата (рис. 5.43).
Подгонка и установление им-
плантатов в этой области за-
труднены, и, по мнению
N. Cranin [88], могут быть
сложной задачей, так как ко-
стный сегмент представляет
собой усеченный вверху ко-
нус. После того как имплантат
по изгибу достигнет соответ-
ствия созданному ложу, а
опорная головка приобретет
правильный наклон для окк-
люзии, завершают подготовку
костного ложа. Тоннель об-
мерке аналогов имплантатов может
возникнуть необходимость в их кор-
рекции соответственно изгибу альвео-
лярной дуги, и тогда специальными
крампонными щипцами с титановыми
щечками имплантату придают нужный
угол наклона. Изгиб должен быть
плавным, для чего щипцы по длине
имплантата продвигают постепенно.
Одновременно проверяют параллель-
ность опорной головки (или головок)
имплантата, и при необходимости
придают ей необходимый наклон.
На верхней челюсти костное ложе
формируют так же, как и на нижней,
круглыми и фиссурными борами с обя-
зательным охлаждением. Н. Tatum и со-
авт. [833] считают, что в губчатом ве-
ществе формировать тоннель специ-
альными долотами менее травматично,
чем борами (рис. 5.42). При рыхлой
кости остеотомия для плоского им-
плантата на всю его длину и высоту не-
обязательна.
На передней части верхней челюсти
изгиб имплантата по контуру гребня
альвеолярной дуги может оказаться ис-
следуют на отсутствие в нем выступов,
перфораций и выравнивают его стен-
ки, костным рашпилем убирают кост-
ные опилки. Эти опилки вместе с
опилками, которые снимают с режу-
щих инструментов во время работы с
ними, помещают в стерильную ем-
кость или в стерильную салфетку. Из-
меряют глубину костного ложа. По-
лость тоннеля промывают стерильным
изотоническим раствором натрия хло-
рида. Проверяют соответствие им-
плантата костному ложу на модели. Во
всех случаях пользуются аналогами
имплантата.
Введение имплантата в костное ло-
же проводят после всех примерочных
манипуляций: изгиба по контуру аль-
веолярной дуги (см. рис. 5.43), прида-
ния головке (или головкам) правиль-
ного наклона, коррекции параллелиз-
ма головок на модели и во время при-
мерки в ходе остеотомии (рис. 5.44).
Имплантат вводят в костное ложе спе-
циальным постановочным инструмен-
том. Проводят легкое постукивание
хирурги чески м молотком по краям
Рис. 5.43. Коррекция плоского имплантата соответственно изгибу альвеолярной дуги
и созданному костному тоннелю [Weiss С., 1982|.
а — изгиб альвеолярной дуги верхней челюсти; б — изгиб альвеолярной дуги нижней челюсти;
в — наложение и изгибание тела плоского имплантата; г — инструменты для изгибания.
плечепосадочного инструмента или по
специально затупленному долоту до
тех пор, пока конструкция не встанет в
кости до упора (рис. 5.45; 5.46). Фик-
сируют внимание на уровне погруже-
ния тела имплантата в кости, парал-
лельность и соответствие будущей ок-
клюзии опорных головок, осматрива-
ют мягкие ткани до наложения швов
(см. рис. 5.43, 5.44).
При рыхлой кости на верхней челю-
сти имплантат ставят после вскрытия
только кортикального вещества и при-
дания ложу нужного изгиба, соответст-
вующего альвеолярной дуге. Легкими
постукиваниями хирургическим мо-
лотком по инструменту его заглубляют
до плотной фиксации.
При остеотомии на верхней челю-
сти в области резцов, клыка и премо-
наклона опорных головок плоского им-
плантата [Weiss С., 1987].
а, б — создание параллельности опорных го-
ловок и естественных зубов; в — наложение
шипков на тело и опорную головку; г — при-
дание нужного угла наклона головке; л — про-
верка параллельности имплантатов на верхней
челюсти; е — проверка параллельности им-
плантата на нижней челюсти; ж — положение
тела имплантата в кости верхней челюсти по
отношению к опорной головке; з — наложе-
ние тела имплантата в кости нижней челюсти
по отношению к опорной головке.
ляров следует учитывать, что перед-
няя стенка кости здесь тонкая и аль-
веолярная дуга значительно изогнута.
Во избежание отлома кости остеото-
мию на этом участке выполняют пре-
дельно осторожно, строго по середине
альвеолярной дуги и в глубине губча-
того вещества. Учитывают изгиб дуги
и угол наклона. Для большей ингру-
энтности имплантату придают форму
усеченного конуса. В подобных ситуа-
циях рекомендуется ставить имплан-
таты с одной опорной головкой (рис.
5.47, а).
При постановке имплантата вблизи
верхнечелюстной пазухи величину
кости и размер имплантата рассчиты-
вают так, чтобы расстояние от края
тела конструкции до дна пазухи было
не менее 1—2 мм. При подозрении на
перфорацию пазухи проводят тради-
ционную диагностику(надувание щек
и установление прохождения воздуха
из полости рта в полость носа, появ-
ление пузырьков воздуха из глубины
костного ложа). Обнаруженное пер-
форационное отверстие верхнечелюст-
ной пазухи закрывают биоматериалом
(гидроксиапатит, "Гидроксиапол",
"ОСТИМ-ЮО" и др.). Хорошие резуль-
таты дает использование блоков "Ко-
лапола", "Коллапана", "OsteoGen" или
пластинок деминерализованной кости
[16, 21, 243а], а также пластика кост-
ным аутотрансплантатом [233]. Иногда
целесообразно отсрочить импланта-
цию на 6 мес.
Особенно тщательно следует подби-
рать имплантаты на область второго
премоляра и моляров верхней челюсти.
Известны различные модификации
предсинусных плоских имплантатов, а
также имплантатов на область бугров
[155, 257] (рис. 5.47, б, в).
При рыхлой кости над плечами им-
плантата вокруг опорных головок ук-
ладывают ранее извлеченные кусочки
кости, костные опилки и другие био-
материалы — аллокость, гранулы гид-
роксиапатита.
Рис. 5.45. Фиксация им-
плантата в костное ложе по-
становочным инструментом,
а — на имплантате с одной
опорной головкой; б — на им-
плантате с двумя опорными го-
ловками; в — плечепосадочный
инструмент и молоток; г — ута-
пливание плеча имплантата в
костное ложе, плечепосадоч-
ным инструментом.
Заглублять имплантат в
костное ложе на верхней
челюсти следует без боль-
ших усилий. Если имплан-
тат входит в ложе с трудом,
то установление его прекра-
щают. Имплантат вынима-
ют и временно помешают в
стерильную емкость с изо-
тоническим раствором на-
трия хлорида. Костное ло-
же углубляют, убирая при
этом навесы и выступы
кости. Добившись адекват-
ности костного ложа, им-
плантат вставляют плече-
посадочным инструмен-
том. При установлении
имплантата на нижней че-
люсти фиксируют внима-
ние на достаточных рас-
стояниях от подбородочного отверстия
и канала нижней челюсти (рис. 5.47, г).
Некоторые авторы полагают, что, не-
смотря на необходимость плотного
контакта с костью, в ней вокруг ложа
имплантата даже при плотной кости,
особенно на нижней челюсти, нежела-
тельно создавать ихлишнюю напря-
женность [143]. Конструкция должна
входить в ложе свободно [170]. Плечи
имплантата и основания его опорных
головок во всех случаях должны быть
заглублены на 2—3 мм ниже края кости
(рис. 5.48).
На основе анатомических, антро-
метрических и рентгенологических ис-
следований взаимоотношений канала
нижней челюсти установлена зона
безопасности для постановки имплан-
татов в дистальную часть нижней челю-
сти [170]. С целью определения границ
этой зоны разработана специальная ме-
тодика [173]. Через самую низшую точ-
ку альвеолярного гребня проводят пря-
мую линию А параллельно дистальной
плоскости окклюзии нижней челюсти.
Через верхнюю точку ментального от-
верстия параллельно линии А проводят
линию Б и соединяют их вертикальной
линией В, проходящей через подборо-
дочное отверстие, и вертикальной ли-
нией Г, пересекающей середину перво-
го моляра. Участок кости между линия-
ми А, Б, В и Г считается безопасной зо-
ной для постановки имплантатов, так
как в 100 % случаев между каналом
нижней челюсти и линией Б остается
не менее 2 мм кости. Такое же расстоя-
ние сохраняется в 97,5 % случаев у дис-
тального корня первого моляра. У ме-
диального корня второго моляра оно
отмечается в 43 %, у дистального — в
5,5 % случаев (рис. 5.49, а).
При дистальном дефекте зубов ниж-
ней челюсти предпочтительно исполь-
зовать имплантат с двумя опорными
Рис. 5.46. Установление плоского имплантата в костное ложе,
а — в форме пластины; б — в форме якоря.
штифтами. Установление имплантата
только с одним штифтом показано при
небольших включенных и дистальных
дефектах зубов. При малом количестве
кости в дистальном отделе нижней че-
люсти и близком расположении канала
нижней челюсти L. Linkow [158] реко-
мендует использовать рамус-режущие
имплантаты (вкладки). При неровно-
сти альвеолярной дуги, возникшей за
счет атрофии кости после удаления зу-
ба, этот автор ставит имплантат таким
образом, чтобы его опорные головки
выступали за края дуги. Очень важно
после остеотомии измерить глубину
костного ложа (рис. 5.49, б)
В отсутствие моляров или одного —
двух премоляров нижней челюсти мо-
жет быть несколько решений относи-
тельно постановки имплантатов в дис-
тальном отделе (рис. 5.49, в—е). В от-
сутствие первого и второго моляров
(третий никогда не возмещают) следу-
ет брать в расчет количество корней
больших коренных зубов, на которые
ранее приходилась нагрузка, и поэтому
ставить имплантат с двумя опорными
головками. Располагать их следует со-
ответственно медиальным корням пер-
вого и второго моляров. Расчет должен
делаться так, чтобы имплантат как бы
замешал первый моляр и половину
второго моляра. В такой ситуации вто-
рой опорой становится естественный
второй премоляр. С. Misch [178] счита-
ет, что в такой ситуации лучше форми-
ровать мостовидный протез в виде че-
тырех премоляров.
В случае отсутствия и второго пре-
моляра имплантат ставят так, чтобы
его опорные головки располагались в
области дистального корня первого
моляра и второго премоляра (см.
рис. 5.49, в).
Рис. 5.47. Установление плоского имплантата [Linkow L., 1971|.
а — в области дна полости носа; б, в — верхнечелюстной пазухи; г — канала нижней челюсти.
Более сложная клиническая ситуа-
ция возникает в случае отсутствия пер-
вых и вторых моляров и премоляров
[263J. Имплантат следует устанавли-
вать с опорой в зоне первого премоля-
ра, кпереди от подбородочного отвер-
стия, а вторую опору располагать об-
ласть медиального корня первого мо-
Рис. 5.48. Положение плечей плоского имплантата по отношению к краю кости
[Linkow L., 1971).
а — схема; б — рентгенограмма.
a 1
Рис. 5.49. Установление имплантата плоской формы
в дистальном отделе нижней челюсти.
а — определение безопасной зоны ДЛЯ установления им-
плантата: 1 - - нижний луночковый нерв, 2 — канал нижней
челюсти, 3 — подбородочное отверстие. 4 — безопасная зо-
на, линия А — кортикальная пластинка кости, линия Б —
нижняя граница имплантата; б — измерение глубины ко-
стного ложа; в, г, д — варианты установления имплантатов
плоской формы на участке второго премоляра и первого
моляра: в — канал нижней челюсти находится на 2—3 мм ниже края имплантата, подбородочное,
отверстие — кпереди от него, установлен имплантат на область второго премоляра и первого мо-
ляра, г - канал находится на 3—4 мм or края имплантата, подбородочное отверстие — на I мм
кпереди от края имплантата, установлен имплагггат в области второго премоляра и первого мо-
ляра, д — канал находится на 2 мм ниже, подбородочное отверстие на 1 мм ниже края имплаи*
тага; е — канал находится на 3—4 мм ниже края имплантата, подбородочное отверстие — на
мм ниже края имплантата, установлен винтовой имплантат в области второго премоляра и пер'
вого моляра [Misch С., 199з].
350
Рис. 5.50. Зашивание мягких тканей над установленным имплантатом.
а — иссечение слизистой оболочки и надкостницы у шейки опорной головки; б — наложение
узловых швов на слизистую оболочку' и надкостницу у непогружного плоского имплантата; в —
наложение швов у погружного плоского имплантата.
ляра (см. рис. 5.49, г). В обоих случаях
должно быть соблюдено нужное рас-
стояние от подбородочного отверстия
(5 мм) и канала нижней челюсти (2—4
мм). Это позволяет соединить клык и
имплантат, восстанавливая три зуба.
Однако С. Misch [178] не считает целе-
сообразным брать в качестве опоры
клык, поскольку в таком случае на им-
плантат действуют боковые силы, он
может оказаться недолговечным. Этот
автор рекомендует использовать в та-
ких случаях одновременную постанов-
ку цилиндрического и плоского им-
плантатов (см. рис. 5.49, д). Цилинд-
рический имплантат ставят в области
первого премоляра, а плоский двух-
штифтовый — второго премоляра и
первого моляра. При таком решении
цилиндрический имплантат соединя-
ется с плоским, образуя протез в виде
четырех премоляров.
Обычно все примерочные манипу-
ляции с имплантатом (изгиб по форме
альвеолярной дуги, придание головке
правильного наклона, коррекция па-
раллелизма головок) проводят во вре-
мя примерочных процедур в ходе ос-
теотомии. Однако нельзя исключать,
что при установлении плоских им-
плантатов не возникнет такая непред-
виденная клиническая ситуация, когда
может потребоваться изменить их фор-
му, предусмотренную планом. В таких
случаях коррекцию осуществляют не-
посредственно в ходе операции. Такой
коррекции лучше всего поддаются им-
плантаты из медицинского титана. Их
подпиливают, укорачивают или кусач-
ками удаляют какую-либо их часть.
После этого имплантаты следует поли-
ровать специальным диском с окисью
алюминия, стерилизовать и охлаждать
в изотоническом растворе натрия хло-
рида. Корригированный таким обра-
зом имплантат может быть поставлен в
сформированное костное ложе. Одна-
ко коррекцию у имплантатов с плаз-
менным напылением титана или гид-
роксиапатита не проводят.
Зашивание мягких тканей. Эту проце-
дуру проводят после проверки состоя-
ния мягких тканей и ее достаточности
для зашивания раны. Примерив слизи-
сто-надкостничный лоскут на область
обнаженной кости, иссекают участки
тканей соответственно опорной головке
или опорному штифту (рис. 5.50). Уло-
жив на место слизисто-надкостничный
лоскут, накладывают швы хромирован-
ным кетгутом или полиамидной нитью.
При этом внимательно следят, чтобы
Рис. 5.51. Имплантаты плоской формы, установленные на верхней и нижней челюсти.
слизистая оболочка вокруг опорной го-
ловки не ввертывалась внутрь. Для про-
филактики этого швами несколько
''вывертывают" края раны вокруг опор-
ной головки. В случаях, когда края ра-
ны толстые, слизистая оболочка гипер-
трофирована, перед зашиванием эти
участки истончают. При зашивании
мягкие ткани не следует натягивать,
так как это грозит расхождением краев
раны и обнажением подлежащей кос-
ти. Поэтому при необходимости сли-
зистую оболочку мобилизуют, стараясь
не уменьшить свод преддверия рта.
Данные, полученные L. Linkow 1151J
при статистическом анализе отдален-
ных результатов, свидетельствуют об
эффективности плоских имплантатов,
что подтверждают отечественные авто-
ры [21, 28, 33[ (рис. 5.51).
5.4.2. Имплантация
конструкций плоской формы
с гидроксиапатитным покрытием
Плоские имплантаты с гидроксиапа-
титным покрытием имеют важные
преимущества перед конструкциями
без покрытия: они стимулируют остео-
генез и площадь их контакта с костью
больше. По данным Т. Golec [102], Т.
Golec и Krauser [103], Р. Boyne (70], ин-
теграция таких имплантатов в целом
более стабильна. Это подтверждено
также результатами гистологических
исследований, проведенных в экспе-
рименте S. Cook и соавт. [85].
Методика имплантации конструк-
ций, тело которых покрыто гидрокси-
апатитом, такая же, как при использо-
вании имплантатов без покрытия. Все
процедуры подготовки ложа проводят
с аналогом; имплантат с гидроксиапа-
титным покрытием нельзя изгибать.
Недопустима коррекция имплантата,
так как она заметно ухудшает его ин-
теграцию в кости. Можно лишь осто-
рожно придать опорной головке нуж-
ный угол наклона. Имплантат ставят
только тогда, когда его аналог хорошо
входит в созданное ложе. Нельзя углуб-
лять имплантат поколачиванием мо-
лотком; не следует также вынимать его
из костного ложа. Такие действия не-
избежно приводят к повреждению его
гидроксиапатитного покрытия, а во-
круг скола разрастается грануляцион-
ная ткань, нарушая плотный контакт
имплантата и кости.
Все остальные хирургические мани-
пуляции со слизистой оболочкой и
надкостницей выполняют так же, как
при имплантатах без покрытия гидро-
ксиапатитом.
Кроме гидроксиапатитного покры-
тия, разработаны имплантаты с поли-
мерным покрытием; методика их по-
становки аналогичная [34].
3S3
5.4.3. Двухэтапная имплантация
конструкций плоской формы
В определенных клинических ситуаци-
ях с целью обеспечения костной инте-
грации плоские имплантаты следует на
время полностью погружать в кость и
рану мягких тканей над ними зашивать
наглухо. В течение 3—6 мес импланта-
ты находятся в кости, не контактируя с
полостью рта и не подвергаясь нагруз-
ке. L. Linkow 1149], A. Cranin и соавт.
[88] экспериментально доказали адек-
ватную интеграцию имплантата в кос-
ти и отметили целесообразность двух-
этапного лечения плоскими импланта-
тами у пациентов с общими заболева-
ниями и проходящих лечение кортико-
стероидами (86]. Для имплантацион-
ной хирургии это первый этап лечения.
Хирургические манипуляции на
этом этапе в целом такие же, как при
постановке непогружных плоских
конструкций. Анатомические правила
установления имплантатов в рапич-
ные костные сегменты челюстей, осо-
бенности рассечения, откидывания
лоскутов и остеотомии остаются таки-
ми же, как при использовании непо-
гружных имплантатов. При остеото-
мии отличия имеют только примероч-
ные мероприятия и зашивание раны.
Примерочные действия отличаются
тем, что из-за резьбового соединения
опорной головки с телом имплантата
коррекция ее наклона в рабочем поло-
жении невозможна. Головку с нужным
наклоном подбирают из комплекта,
предоставляемого производителем. За-
падные фирмы производят опорные
головки с наклоном 5; 10 и 15 *. В ходе
последней примерки отмечают место
основания подобранной опорной го-
ловки и соответственно ему бором с
наружным охлаждением убирают
кость с оральной и вестибулярной сто-
роны. Затем имплантат окончательно
ставят в ложе, а установочный инстру-
мент или опорную головку, если ее ис-
пользовали, удаляют и во внутреннюю
резьбу имплантата вворачивают запор-
ный винт.
Вывернутую опорную головку под-
вергают очистке от костных опилок и
кусочков тканей, стерилизуют, пакети-
руют до второго этапа лечения. Жела-
тельно до закрытия раны отметить на
хирургическом шаблоне или акриловой
каппе место, где должна располагаться
опорная головка, чтобы на втором эта-
пе вскрытие участка мягкой ткани для
ее постановки было щадящим.
Рану над имплантатом зашивают на-
глухо непрерывными, матрацными
или узловыми швами. В отличие от
процедуры зашивания мягких тканей
при одноэтапной имплантации края
раны не истончают, а для наилучшего
сопоставления ее краев лишь мобили-
зуют слизистую оболочку без натяже-
ния тканей. Через 7—10 дней ставят
временную каппу или временный про-
тез без нагрузки на имплантат.
Второй хирургический этап начина-
ется через 3—4 мес после оперативного
вмешательства на нижней и через 5—6
мес — на верхней челюсти. После тра-
диционной инфильтрационной ане-
стезии и премедикации, если она не-
обходима, определяют местоположе-
ние запорного винта (или нескольких
винтов) имплантата. Запорные винты
вскрывают, как правило, коротким
рассечением или иссечением только
слизистой оболочки и надкостницы
над ним, затем его обнажают и удаля-
ют. Иногда для удаления запорного
винта приходится убирать круглым бо-
ром кость с вестибулярной и оральной
стороны имплантата. После гигиены
внутренней полости имплантата на не-
го ставят подобранную заранее опор-
ную головку. Обязательно проверяют
правильность ее постановки с точки
зрения окклюзии. При избытке слизи-
стой оболочки вокруг опорной головки
имплантата ее иссекают; иногда при-
ходится истончать края кератинизиро-
ванной ткани. С помощью зонда опре-
деляют достаточность слизистого зам-
ка между внутрикостной и надальвео-
лярной частями конструкции. В от-
дельных случаях вместо опорной го-
ловки на период заживления мягких
тканей (обычно на 3 нед) в имплантат
вворачивают временный винт зажив-
ления — формирователь десны, кото-
рый потом заменяют подобранной
опорной головкой и начинают ортопе-
дическое лечение.
Применение имплантатов плоской
формы остается эффективным мето-
дом. несмотря на критику в последние
годы |3, 5, 7, 11, 13, 21, 28, 50, 88, 208,
255, 256].
5.4.4. Повторная имплантация
конструкций плоской формы
Ее проводят в случае неудачной им-
плантации, сопровождающейся воспа-
лительными явлениями, обнажением
плеча или обоих плеч, а также при за-
болеваниях тканей вокруг имплантата,
в связи с чем может потребоваться его
удаление. При удалении имплантата
проводят ревизию костного ложа, вы-
скабливают грануляционные разраста-
ния, иссекают вросший вглубь эпите-
лий, проводят противовоспалительную
терапию, в том числе местное лечение
раны. Через 1,5—3 мес при хорошем
общем состоянии пациента и полости
рта производят повторную импланта-
цию в два этапа и используют погруж-
ные имплантаты. Можно применять
также имплантаты с гидроксиапатит-
ным покрытием "Конмет" [26]. В таких
ситуациях L. Linkow [155, 160] реко-
мендует применять трехмерные им-
плантаты: двухлопастные, горизонталь-
ный имплантат "Basket" или имплантат
в виде восьмерки.
Повторной имплантации должна
предшествовать тщательная повторная
клиническая, рентгенологическая и
ортопедическая диагностика, в ходе
которой измеряют толщину кости,
слизистой оболочки и расстояние ме-
жду соседними зубами, а также анали-
зируют окклюзионные взаимоотноше-
ния. Вновь уточняют анатомические
особенности строения верхней и ниж-
ней челюстей, взаимоотношения аль-
веолы с верхнечелюстной пазухой, по-
лостью носа, нижним луночковым
нервом. Важно, чтобы кости на дне
альвеолы было достаточно для заглуб-
ления имплантата и расстояние до
нижнего альвеолярного нерва, верхне-
челюстной пазухи и дна полости носа
было не менее 3—4 мм, а до менталь-
ного отверстия — 4—5 мм.
По рентгенологическим данным
(ортопантомограммы, зоннограммы,
прицельные снимки) оценивают со-
стояние кости после удаления имплан-
тата, а при фотометрии исследуют осо-
бенности заполнения ее остеоидной
тканью. Очень важно констатировать
четкий рисунок кости и отсутствие мел-
ких костных осколков в ложе удален-
ного имплантата.
Особое внимание уделяют состоя-
нию мягкой ткани. Она должна быть
здоровой, и ее должно быть достаточно
для закрытия имплантата, глухого за-
шивания раны и ее заживления пер-
вичным натяжением.
Помимо исследования состояния ко-
стных и мягких тканей, перед имплан-
тацией совместно с ортопедом повтор-
но определяют окклюзионные взаимо-
отношения для будущего протезирова-
ния и условия для адекватной нагрузки
на имплантат. Для уточнения окклюзи-
онных взаимоотношений рентгеноло-
гическое исследование в этом случае
желательно проводить с применением
рентгеноконтрастных шариков.
За 2 дня до операции начинают про-
тивовоспалительное лечение, в том
числе антнбиотикотерапию.
При повторной имплантации мяг-
кие ткани рассекают на участке, где
находился удаленный имплантат. Ре-
комендуется формировать слизисто-
надкостничный лоскут, обращенный в
сторону полости рта. При наличии со-
седних зубов рассечение проводят в
стороны по их десневому краю.
После раскрытия кости ложе созда-
ют в основном путем расширения ста-
рого тоннеля, но можно сформировать
и новый тоннель. Возможно также об-
разование в старом ложе индивидуаль-
ных изгибов по форме имплантата.
После остеотомии проводят туалет ко-
стного ложа. Кусочки нормальной кос-
ти собирают и помещают в стерильную
емкость.
В сформированное ложе имплантат
вводят с большой осторожностью. Же-
лательно использовать имплантат боль-
шей высоты или длины, чтобы можно
было дополнительно заглубить его в
кости на 2 мм ниже ее края. Пустоты и
пространства над плечами имплантатов
заполняют биоматериалом: кусочками
кости, костными опилками, гранулами
гидроксиапатита, гидроксиапола, бло-
ками колапола. После установления
имплантатов осуществляют туалет ра-
ны и внутренней части имплантата и
ставят в него запорный винт.
Перед зашиванием раны обязатель-
но проверяют стабильность фиксации
имплантата в кости. Для глухого закры-
тия раны мягкие ткани над импланта-
том подготавливают, проверяют их
длину и достаточность, иногда мобили-
зуют и истончают. Рану зашивают на-
глухо; предпочтительнее накладывать
непрерывные горизонтальные швы.
Второй хирургический этап проводят
через 3—6 мес. Как и при использова-
нии погружных имплантатов, заранее
подбирают опорную головку с нужным
утлом наклона. Примерочные манипу-
ляции при повторной имплантации
должны быть минимальными и щадя-
щими. Во время имплантации плоских
конструкций весьма вероятны перфора-
ция, отлом стенки, нехватка кости, в
связи с чем может потребоваться при-
менение биоматериалов — аутокости,
гидроксиапатита, материалов на основе
коллагена и гидроксиапатита, мембран.
Ими восполняют дефекты в кости при
имплантации [204, 238J.
5.5. Имплантация конструкции
"Ramus blade"
При атрофии кости дистального отдела
нижней челюсти, близости нижнего
альвеолярного нерва R. Roberts пред-
Рис. 5.52. Анатомические ориентиры для
выполнения остеотомии при установле-
нии имплантата "Ramus blade" [Linkow
L, 1976).
г
Рис. 5.53. Этапы погружения имплантата
"Ramus blade" в костное ложе.
а — введение дистального отдела; б — введе-
ние срединного отдела; в фиксация им-
плантата; г — имплантат после фиксации зуб-
ного протеза.
ложена постановка имплантата "Ramus
blade", имеющих высоту 5 мм и длину
30, 35, 40 мм. Аналогичный имплантат
был сконструирован L. Linkow [153,
I54J. Для его постановки делается раз-
рез длиной 3—5 мм на 3 мм латераль-
нее от ретромолярной ямки. Отслоив
слизистую оболочку, обнажают перед-
ний край и внутреннюю поверхность
ветви нижней челюсти. Остеотомию
б
ны.м инструментом имплантат одним
концом вводят в сформированное ложе,
послепенно погружая его среднюю
часть и медиальный конец с опорной
головкой (рис. 5.53, а—в). На этом уча-
стке имплантат должен быть ниже края
кости на 2 мм (рис. 5.53, г). В соответ-
ствии с окклюзией заранее может быть
подогнута опорная головка. Иссекают
слизистую оболочку соответственно по-
ложению и размерам опорной головки.
На слизистую оболочку накладывают
швы, и может быть надета каппа на
3 нед без нагрузки (рис. 5.54, а, б). При
благоприятном послеоперационном те-
чении через 3 нед проводят окончатель-
ное протезирование (рис. 5.54, в).
5.6. Имплантация конструкции
"Ramus frame"
Рис. 5.54. Завершение I и II хирургиче-
ских этапов установления имплантата
"Ramus blade" [Linkow L„ 1976).
a — наложение швов на слизистую оболочку и
надкостницу; б — надевание временной кап-
пы; в — окончательная фиксация несъемного
зубного протеза с опорой на имплантат.
начинают со сверления кортикальной
пластинки кости в верхней точке ретро-
молярной ямки, отступив 2 мм внутрь
от челюстно-подъязычной борозды и
продвигаясь вверх по направлению к
венечному отростку (рис. 5.52). Соеди-
няют перфорационные отверстия меж-
ду собой, образуя борозду, и продолжа-
ют сверление губчатой кости на нужную
глубину. На уровне нижнего третьего
моляра остеотомию производят на глу-
бину 4,5—5 мм. Сверление проводят
при наружном охлаждении. Специаль-
В 1970 г. R. Roberts разработал новую
конструкцию цельнорамочного им-
плантата из нержавеющей стали для без-
зубой нижней челюсти, но не опублико-
вал сообщение об этом [198]. Конструк-
ция получила такое название потому,
что представляла собой три имплантата,
соединенных в единое целое опорной
балкой. Имплантаты на дистальных
концах рамки вставляли на глубину око-
ло 12 мм в ветви челюсти, а плоский им-
плантат в средней части — в симфиз ме-
жду подбородочными отверстиями.
При такой конструкции, как у двухруч-
ной тачки с одним передним колесом,
основная часть нагрузки перераспреде-
лялась на переднюю опору, т.е. на пе-
редний участок челюсти, где атрофия
кости наименее выражена (рис. 5.55).
В 1983 г. рамусный плоский имплан-
тат был усовершенствован A. Streel и
Н. Roberts [198]. Впоследствии мето-
дика его установления была модифи-
цирована R. Roberts.
Постановка имплантата "Ramus
frame" показана при прогрессирующей
атрофии нижней челюсти, когда невоз-
можно применение имплантатов, как
плоских, так и в форме корня зуба.
Обычно у таких пациентов съемные
протезы плохо фиксируются. Только
рамусный имплантат может обеспе-
чить полноценное жевание.
Рис. 5.55. Имплантат "Ra-
mus frame".
а — механический прообраз
имплантата; б — внешний вид
имплантата; в, г — положение
имплантата в нижней челю-
сти (схема и рентгенограмма
H.Tatum и соавт., 1994).
Пациента обследуют и
составляют план лече-
ния. Оценивают рентге-
нологические данные и
модели верхней и ниж-
ней челюстей. Врач-ор-
топед по модели заранее
изготавливает времен-
ный протез. В США око-
ло 10 000 пациентам бы-
ли поставлены такие ра-
мусные имплантаты. Од-
нако оказалось, что не-
достаточно глубокое вве-
дение имплантатов в вет-
ви нижней челюсти не
обеспечивало необходи-
мую прочность и со вре-
менем происходило сме-
щение конструкции, что
вело к вертикальной осад-
ке находившегося спереди
плоского имплантата.
С целью коррекции
этих недостатков Н. Ta-
tum и соавт. 1233] усовер-
шенствовали рамусный
имплантат и предложили
новую методику остеото-
мии. На основании рас-
пилов симфиза и ветвей
нижней челюсти получе-
ны данные для установ-
ления конструкции, по-
зволившей при постанов-
ке заглублять дистальные
имплантаты в ветви ниж-
ней челюсти в среднем на
2 см (рис. 5.56). Наличие
же у отдельных конст-
рукций дополнительных расположен-
ных ниже секторов увеличило суммар-
ную длину обоих дистальных имплан-
татов до 6 см. Увеличение площади по-
верхности для костной интеграции
значительно укрепило всю конструк-
цию в нижней челюсти. На основе ра-
мусного имплантата Robers был пред-
ложен двухмерный имплантат "Tramus
I" и трехмерный "Tramus П” [224].
Для постановки рамусного имплан-
тата должно быть клинически и рент-
генологически оценено количество и
качество кости.
1ST
Рис. 5.56. Распилы нижней челюсти
(Tatum Н. et al., 1994].
а — в области симфиза; б — в области ветви.
Как указывают Н. Tatum и соавт.
[233], диагностический оттиск ниж-
ней челюсти делают таким образом,
чтобы с обеих сторон были отчетливо
видны области ретромолярной ямки,
ретромолярного треугольника и косая
линия, которые отмечают с макси-
мальной точностью. На модели про-
водят линию от передней вершины
ретромолярной ямки к вогнутости на
медиальном склоне, а от нее — вер-
тикаль к косой линии. На пересече-
нии двух линий находится точка,
где должно быть сформировано ложе
дистальных отделов имплантата
(рис. 5.57, а).
Полученные размеры сопоставляют
с данными ортопантомограммы. По
этим параметрам используют рентге-
ноконтрастный маркер, определяют
длину дистальных отделов, срединное
положение ретромолярной ямки и
длину кости, идущей к нижнему участ-
ку шейки мыщелкового отростка ветви
нижней челюсти (рис. 5.57, б).
Дугообразный рамочный имплантат
подгоняют под изгиб альвеолярной ду-
ги верхней челюсти, при этом шейка
средней внутрикостной части для удоб-
ства может быть временно подогнута.
При этой процедуре шейка среднего от-
дела должна располагаться строго над
центром альвеолярной дуги. По модели
врач-ортопед и зубной техник изготав-
ливают временный зубной протез.
В области ретромолярной ямки ша-
ровидным бором на прямом наконеч-
нике через мягкую ткань на кости
сверлят ориентировочное отверстие
латерально по отношению к передней
вершине ямки.
Соответственно этому участку1 мяг-
кие ткани рассекают по остаточной
кости как можно более латерально во
избежание повреждения язычного нер-
ва, а также проводят разрез по гребню
альвеолярной дуги симфиза (рис. 5.57,
в). Распараторами отслаивают слизи-
стую оболочку и надкостницу в щеч-
ную и язычную сторону, обнажая ори-
ентировочную точку сверления в кос-
ти. Начиная с этого участка, в несколь-
ких местах последовательно сверлят
кость на 2—3 мм вверх по ветви ниж-
ней челюсти при обильном охлажде-
нии. Н. Tatum и соавт. [233] рекомен-
дуют делать это круглым бором малого
размера и ориентироваться на языч-
ный склон косой линии. После прохо-
ждения кортикальной пластины свер-
ление в губчатом веществе следует вес-
ти с большой осторожностью, чтобы не
повредить сосудисто-нервный лучок в
канале нижней челюсти.
Ложе в кости расширяют соответст-
венно боковому фрагменту рамочного
имплантата, выполняют примерочные
процедуры с его аналогом. Удерживая
шаблон за ручку так, чтобы она была
параллельна и касалась вершины аль-
веолярного гребня, конец его вводят в
созданное ложе и, слегка постукивая
по нему, продвигают его на глубину
имплантата. Важно, чтобы при всех
этих манипуляциях ручка шаблона ос-
тавалась параллельной альвеолярному
гребню. Плотный участок ложа начи-
нается после того, как будет пройдена
половина ветви, где кость более тон-
Рис. 5.57. Установление имплантата "Ra-
mus frame" (Tatum Н. et al., 1994].
a — маркировка мест остеотомии на гипсовой
модели нижней челюсти; б — на панорамной
рентгенограмме: обозначения мест остеото-
мии; в — места рассечения слизистой оболоч-
ки и надкостницы; г, д — остеотомия в дис-
тальных отделах нижней челюсти; е — остео-
томия в области симфиза.
Рис. 5.57. Продолжение.
ж — введение дистальных и срединного отделов имплантата в костные ложа; з — фиксация им-
плантата в кости; и — рентгеншраммы нижней челюсти с имплантатом "Ramus frame” (1 функ-
ционирующим 12 лет; II — функционирующим 19 лет) (Roberts R., 1998].
И(11)
кая. Авторы рекомендуют шаблон, ис-
пользуемый при остеотомии, время от
времени приподнимать за ручку, чтобы
создать в ложе пространство, необхо-
димое для введения имплантата.
Таким же методом производят ос-
теотомию на противоположной сторо-
не нижней челюсти и ставят шаблон
(рис. 5.57, г, д).
Костное ложе для среднего отдела
рамочного имплантата формируют в
области симфиза нижней челюсти.
Разрез слизистой оболочки и надкост-
ницы делают по гребню альвеолярной
дуги до уровня, соответствующего под-
бородочным отверстиям. Это позволя-
ет обнажить подбородочное отверстие
и петлю одноименного нерва, а при
значительной атрофии — выделить
нижний альвеолярный нерв, который
может располагаться по |ребню кости.
Слизистую оболочку и надкостницу
осторожно отслаивают, обнажают сим-
физ нижней челюсти и оба подборо-
дочных отверстия. Н. Tatum и соавт.
[233] рекомендуют надеть на верхнюю
челюсть протез и по проекции его
средней линии сверлить ориентиро-
вочные отверстия в кортикальном ве-
ществе кости нижней челюсти соответ-
ственно длине шаблона среднего отде-
ла рамочного имплантата. Затем ори-
ентировочные отверстия соединяют
фиссурным бором.
Остеотомию в области симфиза
нижней челюсти рекомендуется вы-
полнять фиссурным бором с большой
скоростью, причем давление на бор
должно быть минимальным, а ороше-
ние обильным. Бором большего диа-
метра расширяют костное ложе
(рис. 5.57, е).
Во время примерочных процедур
шаблон подгибают соответственно из-
гибу альвеолярной дуги и созданному
ложу. Если длина и высота шаблона со-
ответствуют созданному ложу, то лег-
ким постукиванием его ставят в кость
гак, чтобы плечо было ниже альвеоляр-
ного гребня. После плотной фиксации
шаблона в кости его осторожно выни-
мают щипцами и проводят туалет всех
трех костных лож. Затем приступают к
введению рамочного имплантата.
Вначале имплантат вставляют в одну
из ветвей нижней челюсти до самой
дистальной точки, затем — в другую.
При этом, насколько позволяет высота
его передней части, имплантат следует
фиксировать максимально горизон-
тально и параллельно челюсти. В таком
положении находящиеся в боковых вет-
вях имплантаты удерживают специаль-
ным посадочным инструментом, уста-
новленным на шейку переднего им-
плантата в виде хомута. Постукивания-
ми по этому инструменту дистальные
имплантаты окончательно вводят в ло-
жа. Передний имплантат должен занять
положение строго над центром перед-
него ложа.
Сохраняя фиксацию дистальных уча-
стков рамки, передний имплантат лег-
ким постукиванием по посадочному
инструменту вводят в его ложе. Оконча-
тельное плотное положение в костных
ложах ветвей челюсти дистальным им-
плантатам придают постукиванием по
ним вертикально вниз (рис. 5.57, ж, з).
Щели в ложах между костью и им-
плантатами заполняют рассасываю-
щимся биоматериалом из кальций-
фосфата, смешанного с кровью, а над
имплантатами может быть уложен гра-
нулированный гидроксиапатит. Мяг-
кие ткани зашивают наглухо, без натя-
жения. Н. Tatum и соавт. [233] отмеча-
ют возможность образования эпители-
альных карманов в кератинизирован-
ной слизистой оболочке вокруг дис-
тальных имплантатов.
После операции пациенту надевают
временный протез и приступают к ор-
топедическому лечению.
В послеоперационном периоде ре-
комендуется применять холод (пузырь
со льдом) в течение 3 ч. В течение 7—
8 дней показаны антибиотики, аналь-
гетики и витамины. Швы снимают че-
рез 2 нед. Пища должна быть жидкой и
мягкой. Протез на верхней челюсти на
ночь следует снимать. В течение 4 мес
больной должен придерживаться этих
рекомендаций и соблюдать адекватную
гигиену рта. По истечении указанного
срока ставят окончательный протез.
Результаты лечения с рамусным им-
плантатом были проанализированы еще
в 1987 г. R. Roberts [199] (рис. 5.57, и).
Усовершенствование методики и опе-
рации улучшило первоначальные дан-
ные. С 1982 по 1994 г. в США таким
методом было поставлено 145 имплан-
татов. Отмечены хорошие результаты
лечения беззубых нижних челюстей.
А Н. Tatum и соавт. [233] за 20 лет по-
ставили более 900 рамусных импланта-
тов с хорошим результатом. У 29 паци-
ентов имплантаты пришлось удалить, и
у большинства из них они были замене-
ны новыми. Главными причинами не-
удач были инфекция и разрастание гра-
нуляций у основания дистальных им-
плантатов (у 12 пациентов), переломы
имплантатов (у 4, в том числе у 3 вслед-
ствие автомобильной аварии), психи-
ческие нарушения вследствие плохой
адаптации к имплантатам и зубным
протезам на них (у 3 человек), облуче-
ние в связи с наличием злокачествен-
ной опухоли (у 2), а также недостаточ-
ный опыт при первых операциях поста-
новки рамочных имплантатов (8 чело-
век). Разлом рамки у 4 больных ликви-
дировали с помощью электросварки
непосредственно во рту.
Во время и после операции авторы
наблюдали ряд осложнений. У одного
больного в ходе установки имплантата
произошел перелом челюсти, но им-
плантат не был удален, консолидация
перелома и его заживление прошли
нормально. В первые годы примене-
ния рамочных имплантатов у некото-
рых пациентов в послеоперационно\<
периоде наблюдали невропатию ниж-
него альвеолярного и ментального
нервов (парестезии или анестезии).
Однако благодаря усовершенствова-
нию остеотомии авторами, разработав-
шими этот метод (дистальные имплан-
таты стали ставить латеральнее и выше
канала нижней челюсти, а передний
имплантат — выше подбородочных от-
верстий), что позволяет избежать раз-
вития таких осложнений.
Имплантацию рамочными конст-
рукциями считают наиболее эффектив-
ным способом лечения при полной
адентии и значительной атрофии ниж-
ней челюсти [31]. Такие имплантаты
позволяют в один день провести как
необходимое хирургическое, так и вре-
менное ортопедическое лечение. Окон-
чательное протезирование дает высо-
кий функциональный и косметический
результат, а также экономическую вы-
году. Эффективность рамусных им-
плантатов оценена положительно мно-
гими специалистами [31, 58].
5.7. Немедленная имплантация
конструкций в лунку
удаленного зуба
Попытки поставить имплантат в лунку
удаленного зуба делались еще в глубо-
кой древности. Не прекращались такие
попытки в средние века, а также на
всех последующих этапах развития
зубной имплантации. В связи с ЭТИМ
небезынтересно отметить, что первые
конструкции, соответствующие совре-
менным имплантатам, были разрабо-
таны для постановки непосредственно
в лунку удаленного зуба [39] и экспе-
риментально обоснована методика их
постановки [225]. Первые имплантаты
были изготовлены из золота, сплава
металлов — хрома, кобальта, молибде-
на, фарфора. Однако первоначальный
оптимизм был омрачен отторжениех»
имплантатов вскоре после их поста-
новки. Даже когда зубная имплантация
была признана самостоятельным мето-
дом лечения, на конференции в То-
ронто (1978) был введен ряд ограниче-
ний, в том числе при имплантации в
лунку удаленного зуба, но это не оста-
новило исследователей, и эксперимен-
ты с имплантацией в лунку удаленных
зубов продолжались. Предпринима-
лись попытки ставить имплантаты не-
медленно после удаления зубов и через
определенное время. В дальнейшем
первый метод стали называть немед-
ленной, а второй — отсроченной им-
плантацией.
5.7.1. Обоснование немедленной
имплантации, показания
и противопоказания
Общепринятым считается, что после
удаления зубов установление имплан-
татов на верхней челюсти возможно
только через 6 мес, на нижней — через
4 мес, хотя ряд авторов считают, что на-
до ждать 12 мес. Однако в последние
годы хорошие результаты получены
[215] при установлении имплантатов
сразу же после удаления зубов. На раз-
витие методики немедленной имплан-
тации в значительной степени повлиял
первый положительный клинический
опыт, полученный G. Niznik [186], ко-
торый в дальнейшем был подтвержден
экспериментальными морфологиче-
скими и клиническими исследования-
ми [44, 68, 137, 194, 213].
По экспериментальным данным [54,
181, 239], поставленные в лунку зуба
имплантаты в течение 2—3 мес стаби-
лизируются. Морфологически спустя 3
мес выявлено наличие костной ткани
на поверхности имплантатов. Гистоло-
гические и гистохимические исследо-
вания [194], проведенные на собаках,
показали, что интеграция имплантата
и кости при немедленной импланта-
ции больше зависела от анатомической
области, где производили операцию,
чем от хирургических манипуляций.
Немедленная имплантация в альве-
олы конструкций в форме зуба разра-
ботана экспериментально [55, 56, 181]
и внедрена в клиническую практику
многими авторами [44, 49, 68, 138]. В
1991 г. М. Block [68] сообщил о поло-
жительном 8-летнем опыте, в 1996 г.
М. Bijlari [65] — о 3- и 5-летнем успеш-
ном результате немедленной имплан-
тации. У наблюдаемых ими пациентов
клинически и рентгенологически вы-
валено плотное сращение имплантата
и кости, а также адекватное функцио-
нирование зубных протезов с оперой
на них. Столь же успешной в 97,6 %
случаев при 3-летнем наблюдении бы-
ла немедленная имплантация, прове-
денная у 83 пациентов Т.Г. Робустовой
и И.В. Федоровым [24]. Другие публи-
кации [4, 26, 33, 49, 213, 214, 261] также
свидетельствуют о том, что немедлен-
ная и отсроченная имплантация явля-
ется эффективным методом и имеет
определенные преимущества перед об-
щепринятым альтернативным лечени-
ем [10, 49а, 108а].
Однако наряду со сторонниками не-
медленной имплантации имеются и
противники ее. И. Ogiso и соавт. [191]
сравнили клинические результаты не-
медленной и отсроченной на 2 нед им-
плантации в лунки удаленных зубов.
При отсроченной имплантации вокруг
лунки образовались трабекулы и ка-
пилляры, тогда как при немедленной
имплантации такого процесса не отме-
чалось. Кроме того, при отсроченной
имплантации новая кость формирова-
лась быстрее и в больших количествах,
а фиброзная инкапсуляция была выра-
жена меньше. Авторы считают, что от-
сроченная имплантация ведет к наи-
лучшему костному срашению.
F. Takeshita и соавт. [228] также ре-
комендуют воздерживаться от немед-
ленной имплантации. При гистологи-
ческих исследованиях 7 удаленных им-
плантатов с многочисленными сквоз-
ными отверстиями на теле авторы от-
метили значительно выраженное вос-
паление в проросших в них тканях. На
основании этого они не рекомендуют
ставить такие конструкции в заживаю-
щую лунку, поскольку близость кост-
ного ложа к имплантату и мягкой тка-
ни создает условия для воспаления, в
том числе для резорбции гидроксиапа-
титного покрытия имплантата.
Для того чтобы немедленная им-
плантация была успешной, нужны оп-
ределенные условия. Прежде всего не-
обходимо, чтобы у имплантата была
начальная стабильность и чтобы по
вертикали не менее 4 мм его поверхно-
сти находилось в плотном контакте с
костью. Большинство авторов рекомен-
дуют заглублять имплантат так, чтобы
его коронковая часть была на 2 мм ни-
же края альвеолярного гребня. Мягкой
ткани должно быть достаточно для то-
го, чтобы имплантат был полностью
закрыт. Последнее условие поколебле-
но сообщениями о возможности ус-
пешного приживления имплантатов и
при одноэтапном лечении, хотя опыт
такой имплантации пока невелик.
Нами по данной методике установ-
лено более 200 имплантатов, но следу-
ет отметить, что при таком заглубле-
нии конструкции приходилось убирать
кость на втором этапе. В дальнейшем
мы старались не заглублять имплантат
ниже уровня кости, что впоследствии
обеспечивало благоприятные взаимо-
отношения с супраструктурой и созда-
вало прочный слизистый замок у шей-
ки. Первые наши наблюдения свиде-
тельствуют о возможности зашивания
ткани только около надальвеолярной
части имплантата или около супра-
структуры и ранней, но адекватной на-
грузки на конструкцию.
Заживление альвеолы и приживле-
ние имплантата при немедленной им-
плантации происходят одновременно,
в связи с чем уменьшаются объемы
оперативных вмешательств и общий
срок лечения, поскольку нет необходи-
мости ждать 6 мес полного заживления
кости [54, 215]. Кроме того, поставлен-
ный в лунку зуба имплантат предотвра-
щает сужение альвеолы, возникающее
вследствие послеоперационной атро-
фии альвеолярного гребня с вестибу-
лярной и оральной стороны [89].
При немедленном установлении од-
ноэтапных имплантатов после фазы
заживления соединительная ткань раз-
вивается между их апикальной частью
и краем кости, причем наблюдается
выраженная послеоперационная вос-
палительная реакция [26, 38]. В даль-
нейшем соединительная ткань заме-
щается остеоидной тканью. Оссифика-
ция и ремоделирование кости протека-
ют медленнее, а вид соединения и ка-
чество кости при этом различны.
Немедленная имплантация показа-
на при: 1) травме зуба — вывихе и не-
целесообразности его вправления, пе-
реломах средней и верхней частей кор-
ня, особенно косом и со смешением:
2) хроническом периодонтите со зна-
чительным разрушением коронки и
размягчением корня зуба; 3) неэффек-
тивности консервативного лечения зуба
по поводу хронического периодонтита;
4) пародонтите II и Ill степени с атро-
фией кости только по вертикали;
5) дистопии зуба и показании к его
удалению в целях протезирования.
Следует учитывать, что немедленная
имплантация возможна только после
завершения роста кости — в возрасте
старше 18—20 лет и позднее [139]. Не-
медленную имплантацию следует про-
изводить только в тех случаях, когда
сохранилась большая часть вестибу-
лярной стенки кортикальной пласти-
ны. Как правило, при травматической
потере зуба или в результате эндодон-
тических осложнений более тонкая
вестибулярная кортикальная стенка
разрушается в первую очередь при уда-
ре или апикальной инфекции, вследст-
вие чего появляется вогнутость кости.
Для функционирования имплантата
необходима надежная опора с вестибу-
лярной стороны, которая при необхо-
димости создается дополнительными
мерами. Следует иметь в виду, что пла-
нируемый имплантат займет более
дорсальное положение, будет иметь
нежелательный наклон кзади. По-
скольку вестибулярная сторона гребня
не реконструирована, такое положение
имплантата может привести к биоме-
ханическим, пародонтальным и эсте-
тическим нарушениям. В силу этих
причин постановка имплантатов в ана-
томически скомпрометированные мес-
та не рекомендуется.
Противопоказанием к немедленной
имплантации является острый или
обострение хронического воспали-
тельного процесса в периодонте, паро-
донте или ближайшей к альвеоле кос-
ти, в том числе при ее деструкции. В то
же время экспериментальные исследо-
вания [188, 189] и клинический опыт
[187, 259] свидетельствуют о том, что
хронический верхушечный патологи-
ческий процесс не следует безогово-
рочно считать противопоказанием к
имплантации. Успех немедленной им-
плантации, по данным этих авторов,
обеспечивался антибиотикотерапией,
которую начинали за день до операции
и продолжали 8 дней, атравматичным
удалением зуба, тщательной очисткой
его лунки и промыванием растворами
антисептиков и антибиотиков, а также
постановкой имплантатов несколько
большего диаметра, чем диаметр лун-
ки. Мы же считаем, что при такой кли-
нической ситуации показана отсро-
ченная имплантация [120а]. При отбо-
ре пациентов для немедленной им-
плантации мы руководствовались пра-
вилом, что имплантат, введенный в
альвеолу, должен быть углублен в кос-
ти за пределы дна лунки. Поэтому по-
казанием к немедленной имплантации
были хронические формы периодонти-
тов — фиброзный и гранулематозный.
При последнем очаг около верхушки
корня не должен превышать 0,3—0,5
мм в диаметре. Значительные деструк-
тивные изменения без четких границ
при хроническом гранулирующем пе-
риодонтите неблагоприятны для за-
глубления верхушки имплантата.
С такими поражениями пациентов мы
не брали для немедленной импланта-
ции. Именно в таких клинических си-
туациях были показаны медикаментоз-
ная обработка альвеолы после удаления
зуба, заполнение ее биоматериалом с
последующей отсроченной импланта-
цией. Немедленная имплантация не
рекомендуется при патологических из-
менениях мягкой ткани десны или ее
недостаточности для полного или час-
тичного закрытия имплантата и зажив-
ления раны первичным натяжением.
Подготовка пациента к немедленной
имплантации заключается в санации
полости рта и достижении адекватной
гигиены. Оперативным вмешательст-
вам предшествуют традиционная кли-
ническая и рентгенологическая диа-
гностика, а также анализ модели. При
клинической диагностике следует учи-
тывать анатомические особенности
строения верхней и нижней челюстей,
взаимоотношения альвеолы с верхне-
челюстной пазухой, полостью носа,
каналом нижней челюсти. Н. Spiker-
mann [223] рекомендует использовать
все возможные рентгенологические
данные (ортопантомограмма, зоно-
грамма, прицельные рентгенограммы,
а также аналогичные снимки с шабло-
нами). По мнению J. Sevord и соавт.
[213], традиционные рентгенологиче-
ские исследования следует дополнять
сканирующей компьютерной томогра-
фией. Это особенно важно при удале-
нии премоляров и моляров верхней че-
люсти, поскольку на основании орто-
пантомограммы и внутриротовых
рентгенограмм нельзя точно судить о
взаимоотношениях верхнечелюстной
пазухи и стенок альвеолы удаляемого
зуба [72]. Кроме того, прицельные
снимки, зонограммы, ортопантомо-
граммы на 10—20 % искажают величи-
ну корня и кости [25, 121а]. При не-
медленной имплантации рентгеноло-
гические исследования, дополненные
компьютерной томографией [217], по-
зволяют точно определить количество
кости между верхушкой альвеолы и
верхнечелюстной пазухой и, таким об-
разом, исключить вскрытие последней.
Компьютерная томография дает воз-
можность определить запас кости, что
важно для адекватного заглубления им-
плантата, особенно в области дна носо-
вой полости, верхнечелюстной пазухи
и канала нижней челюсти. Необходи-
мо, чтобы кости на дне альвеолы было
достаточно и расстояние от верхушки
имплантата до нижнего альвеолярного
нерва, верхнечелюстной пазухи и дна
носа было не менее 2—4 мм, а до под-
бородочного отверстия — не менее 4—
5 мм.
Нужное расположение имплантата,
его размеры, вид крепления с надаль-
веолярной частью и положение корон-
ки в зубном ряду, а также окклюзию
определяют индивидуально с помо-
щью прозрачной акриловой каппы. Ее
изготовление для выбора будущей ор-
топедической конструкции Н. Spiker-
mann (2231 и другие авторы считают
обязательным.
В последующем наши данные пока-
зали, что сравнение цифровых показа-
телей, установленных по внутрирото-
вым прицельным рентгенограммам, с
размерами корня (длина, ширина его)
были по рентгенологическим данным
занижены по сравнению с истинными
в среднем на 20—25 %.
Ортопантомограмма для немедлен-
ной имплантации дает больше инфор-
мации о расположении канала нижней
челюсти, локализации подбородочного
отверстия, расстоянии от верхушки
корня до дна верхнечелюстной пазухи
и дна полости носа. Однако искажения
истинных размеров верхних резцов и
клыков по данным ортопантомограмм
достигали 40 %, искажения истинных
размеров резцов и клыков на нижней
челюсти — 30 %, верхних премоляров —
35 %, нижних премоляров — 25 %.
Особенно нечетко была видна у этих
зубов замыкательная пластинка альве-
олы. Отмечены такие же искажения
размеров гранулем и других деструк-
тивных очагов у верхушек корней зу-
бов, поэтому необходима сравнитель-
ная оценка показателей прицельных
рентгенограмм и ортопантомограмм
для уточнения величины корней, ана-
томических образований челюстей.
Вместе с тем наиболее достоверную
информацию дает рентгеновская ком-
пьютерная томография. Она позволяла
получить реальные размеры корня,
толщину кости в вестибулярно-небном
и вестибулярно-язычном направле-
нии, а также цифровое выражение этих
параметров. Наиболее точные данные
для предымплантационной диагности-
ки дает двух- и трехмерная РКТ. Одна-
ко на участке верхней челюсти на уров-
не резцов на отдельных томограммах
регистрируются искажения длины
корня, одонтогенного очага деструк-
ции кости и толщины кортикальной
пластинки дна полости носа. Обработ-
ка томограмм в разных проекциях, уве-
личение изображений на них позволя-
ли добиться оптимальных показателей,
идентичных истинным, поэтому в наи-
более сложных анатомо-топографиче-
ских условиях — на верхней челюсти и
на нижней челюсти в области премо-
ляров и моляров — РКТ бывает необ-
ходимым методом диагностики.
Кроме того, РКТ показывает строе-
ние губчатой кости, толщину корти-
кальных пластинок, что имеет важное
значение для выбора конструкции,
диаметра и длины имплантата.
Перед немедленной имплантацией
по общим правилам оценивают функ-
циональное состояние организма, за-
ключения специалистов, прием ле-
карств и данные лабораторных иссле-
дований, оценку санации полости рта и
индекс гигиены. При необходимости
больные готовятся к операции, саниру-
ются очаги инфекции в полости рта и
других органах, проводится общеукре-
пляющая и детоксикационная терапия.
Непосредственно перед операцией
пациент должен почистить зубы и после
этого в течение 1 мин тщательно полос-
кать рот 0,1 % раствором хлоргекседи-
на. Прилегающие участки лица могут
быть обработаны этиловым спиртом и
спиртовым раствором йода.
5.7.2. Немедленная имплантация
конструкций в форме корня зуба
Для немедленной имплантации чаще
всего применяют цилиндрические и
комбинированные имплантаты систе-
мы "Core-Vent" ("Paragon”), самонарез-
ные имплантаты "Lederman Implant
System", "Steri-Oss”, "Tubinger", "Frialit",
"Контраст", "Плазма Поволжья". Для
немедленной имплантации использу-
ют также имплантат "Frialit-1 Tubinger".
Он непогружной, предназначен для
одноэтапного лечения и во время при-
живления коронковая его часть высту-
пает из слизистой оболочки. Однако,
поскольку такая конструкция не ис-
ключала проникновения бактерий,
был разработан имплантат "Friolok-2",
который является погружным и хоро-
шо приживается в закрытой ране.
Наиболее часто немедленную им-
плантацию на верхней челюсти произ-
водят при удалении резцов, клыка и
премоляров. При этом многое зависит
от количества и качества кости в об-
ласти дна носа [122].
При немедленной имплантации в
переднем отделе верхней челюсти в об-
ласти резцов и клыка следует предва-
рительно исследовать мягкую ткань и
измерить толщину слизистой оболочки
кости, а также оценить будущее соот-
ношение ее с имплантатом после его
заглубления. Планируя лечение вместе
с ортопедом, надо определить соотно-
шение тканей и будущего зубного про-
теза на имплантате с линией улыбки.
Врач-ортопед отмечает все это в полос-
ти рта и на восковом шаблоне или луч-
ше на шаблоне из прозрачной акрило-
вой массы. После постановки имплан-
тата в этой зоне между его краем и
дном полости носа должно остаться не
менее 1 мм кости. Имплантация на уча-
стке этой группы зубов непосредствен-
но связана с эстетической зоной верх-
ней губы [83]. Н. Spikermann [223] счи-
тает, что это особенно важно для паци-
ентов с высокой линией улыбки, при
которой обнажается десна у резцов,
клыка и премоляров. В таких случаях
проводящие лечение хирург и ортопед
совместно уточняют вид крепления ко-
ронки на имплантате, положение ее в
зубной дуге, как в горизонтальной, так
и в вертикальной плоскости, а также
симметрию ее с другой стороной.
При планировании немедленной
имплантации важное значение приоб-
ретают ортопедические методы иссле-
дования. Они должны состоять из
оценки межчелюстных взаимоотноше-
ний и прикуса по моделям челюстей и
решать такие задачи:
1. Функционирование имплантата с
единичной коронкой или как опоры
несъемного зубного протеза.
2. Определение угла наклона супра-
структуры имплантата и соответст-
венно определение направления
сверления кости для заглубления
апикального отдела конструкции в
нее. Точности этих расчетов помога-
ет акриловая каппа, изготовленная
по диагностической модели. На ней
отмечаются места постановки им-
плантатов, направление сверления
кости и задается надлежащий угол
его наклона в соответствии с окклю-
зией.
3. Моделирование протеза на аналоге
имплантата и уточнение окклюзи-
онных взаимоотношений.
4. Измерение удаленного зуба, или
корня, или его модели. Диаметр
корня замеряли на четырех уровнях:
в области шейки, второй и третьей
трети, верхушки корня зуба. Данные
замеров сопоставляли с показателя-
ми рентгенограмм, ортопантомо-
грамм, компьютерной томографии.
На основании этих данных оконча-
тельно подтверждалась целесообраз-
ность имплантации, выбирался им-
плантат нужной формы, размеров,
длины и диаметра, определялась зо-
на кости для его заглубления. По
моделям челюстей изготавливались
временная коронка или каппа.
Операция немедленной импланта-
ции проводится после премедикации,
под инфильтрационной и проводнико-
вой анестезией. Используются основ-
ные анестетики: ультракаин, лидока-
ин, бипувикаин и др. Расход анестети-
ка на все этапы немедленной имплан-
тации составлял от 1,7 до 5,1 мл, т.е. от
одной до трех карпул.
Немедленная имплантация состоит
из нескольких этапов.
I этап — рассечение мягких тканей и
откидывание слизисто-надкостнично-
го лоскута.
Рассечение тканей начинают с раз-
реза слизистой оболочки и надкостни-
цы по десневому краю с вестибулярной
и язычной стороны удаляемого зуба.
Затем разрез продолжают в стороны.
Если рядом зубы отсутствуют, то раз-
рез далее проводят по центру альвео-
лярной дуги, а при наличии соседних
зубов — по их десневому краю с вести-
булярной стороны. В отдельных случа-
ях в области моляров разрезы могут
быть продолжены вертикально у сосед-
них зубов и далее вниз к своду пред-
дверия рта. Для наилучшего обзора
кости разрезы делают по десневому
краю с обеих сторон соседних зубов.
Затем осторожно отслаивают слизи-
сто-надкостничные лоскуты. Длина и
форма рассечения и образование сли-
зисто-надкостничного лоскута зависят
от высоты альвеолярного отростка
верхней челюсти и альвеолярной части
нижней челюсти (рис. 5.58).
При длинном альвеолярном отрост-
ке верхней челюсти лучше формиро-
вать языкообразный лоскут через зубо-
десневое соединение удаляемого зуба
(см. рис. 5.58, а). При малой высоте
альвеолярного отростка лоскут должен
быть трапециевидной формы со значи-
тельным наклоном боковых рассече-
ний в стороны от удаляемого зуба (см.
рис. 5.58, б). Уже на этапе рассечений
мягких тканей следует учитывать необ-
ходимую длину для закрытия и глухого
зашивания раны. Поэтому при отслаи-
вании тканей удлиняют лоскут боко-
Рис. 5.58. Рассечения мягких тканей при немедленной имплантации.
а — при длинном альвеолярном отростке; б — при коротком альвеолярном отростке; в, г —
по десневому краю соседних зубов.
выми разрезами к своду преддверия
рта или рассечением по десневому
краю соседних зубов, что позволяет
улучшить условия для глухого зашива-
ния раны (см. рис. 5.58, в, г). В отдель-
ных случаях при широком основании
лоскута надсекают слизистую оболоч-
ку у свода преддверия полости рта, в
результате чего увеличивается длина
тканей и обеспечивается хорошее со-
поставление краев раны.
Толстую слизистую оболочку истон-
чают. В случае обнаружения грануля-
ций у десневого края слизистой обо-
лочки их выскабливают [59].
II этап — удаление зуба или зубов.
Удаление зуба должно быть щадящим,
предусматривающим минимальную
травму альвеолы и окружающей ее кос-
ти. Особое внимание следует уделять
щадящему отсепаровыванию слизи-
стой оболочки от шейки зуба или кор-
ня. При удалении зуба лучше исполь-
зовать отсепаратор и угловые и прямой
элеваторы с тонкими щечками. При
работе надо стараться не травмировать
кость альвеолы. Если зуб подвижен,
его извлекают при помощи щипцов.
Зубы верхней челюсти чаще удаляют
универсальными штыковидными щип-
цами с узкими щечками, выполняя
преимущественно ротационные дви-
жения. При удалении центральной и
боковой группы зубов не рекомендует-
ся делать люксационные движения,
особенно в вестибулярную сторону. На
нижней челюсти легкие люксацион-
ные движения можно проводить при
хорошо обозримой и достаточно тол-
стой вестибулярной стенке альвеолы.
При удатении нижних центральных и
боковых зубов клювовидными щипца-
ми с узкими щечками следует также
использовать ротационные движения.
Многокорневые зубы удаляют по
частям, причем каждый корень отдель-
но путем ампутации. Иногда по частям
удаляют и однокорневой зуб. При уда-
лении двух- или трехкорневых зубов
межкорневые перегородки сохраняют.
Ill этап — туалет костной раны. При
ревизии альвеолы при гранулематоз-
ном или фиброзном периодонтите про-
водили щадящее выскабливание тка-
ней и более активный кюретаж — при
гранулирующем периодонтите. Врос-
шую в полость корня избыточную и
воспалительно-измененную слизистую
оболочку удаляли острой ложкой, как
и грануляции, расположенные удесне-
вого края. Альвеолу промывали рас-
твором хлоргексидина и оставляли в
ране кровоостанавливающую губку,
пропитанную гентамицином. Удален-
ный зуб помешали в емкость с 0,12 %
раствором хлоргексидина или его про-
изводных, после чего, протерев и вы-
сушив корень, измеряли его и, сняв
слепок, изготавливали его модель. На
основании клинических данных, заме-
ра глубины альвеолы и ширины ее
устья, математических расчетов моде-
ли корня зуба, рентгенологических
данных, в том числе результатов ком-
пьютерной томографии, определяли
нужный диаметр и длину имплантата и
возможную величину заглубления его в
кость. Выбор имплантата должен осно-
вываться на следующих критериях:
длина его должна превышать на 2—4
мм длину альвеолы, а диаметр - пре-
вышать на 1—2 мм ширину лунки.
Устье лунки почти всегда будет шире
диаметра имплантата. Если края альве-
олы окажутся острыми, их скусывают
и сглаживают. Иногда может потребо-
ваться уплощение кости, что делают
бором с наружным охлаждением.
IV этап — остеотомия и установле-
ние имплантата.
На заранее отлитых моделях челю-
стей на участок будущей имплантации
изготавливается каппа из прозрачной
акриловой пластмассы.
Совместно с врачом-ортопедом на
моделях челюстей и каппе в местах уда-
ленных зубов при помощи бора созда-
ется отверстие с заранее выбранным
направлением сверления кости и углом
наклона будущего имплантата в соот-
ветствии с окклюзией его надальвео-
лярной части. Выбрав имплантат из тех,
которые были подобраны до операции,
надо проверить глубину лунки, сопо-
ставить ее с данными замеров корня и
показателями рентгенограммы. Опре-
деляют возможный размер кости для уг-
лубления в нее конструкции. Кроме то-
го, проверяют возможные взаимоотно-
шения будущего апикального отдела
имплантата с дном полости носа и верх-
нечелюстной пазухи (рис. 5.59). Также
Рис. 5.59. Необходимые величины кости между верхушкой имплантата, дном полости
носа и верхнечелюстной пазухи при немедленной установке конструкции.
уточняют расстояние альвеолы до под-
борочного отверстия, канала нижней
челюсти. Сверление кости проводят
формирующим сверлом с наружным
охлаждением изотоническим раствором
натрия хлорида. Сформировав ложе по
глубине, с помощью метчика на по-
верхности кости нарезают резьбу, по
которой вкручивают имплантат. Про-
веряют стабильность его фиксации в
альвеоле и участке заглубления в кос-
ти. При наличии пустот у коронковой
части имплантата их заполняют биома-
териалом. Для этого используют разные
комбинации: гидроксиапол с колапо-
лом, стружку деминерализованной кос-
ти с "Bio-Oss" или "Haspet", деминера-
лизованную кость, "Bio-Oss" и "Pep-
Gen Р-15".
V этап — проверка стабильности им-
плантата.
Как уже указывалось выше, имплан-
тат должен быть стабильным. G. Niznik
[186] рекомендует заглублять имплан-
тат на 1—2 мм ниже края кости. Одна-
ко нами отмечено, что на II этапе через
4—6 мес над запорным винтом им-
плантатов образовывалась кость, что
затрудняло его обнаружение. Это так-
же требовало удаления лишней кости,
что вызывало дополнительную травму.
Кроме того, на II этапе лечения при-
ходилось использовать длинные супра-
структуры, а иногда применять проме-
жуточные элементы крепления. По-
следнее может увеличивать влияние
вывихивающего и ротационного мо-
ментов на имплантат. Поэтому в по-
следующем мы устанавливали имплан-
тат на уровне края альвеолы зуба.
После фиксирования имплантата в
костном ложе и проверки его стабиль-
ности, совпадения коронарной части и
края кости проводили заполнение пус-
тот, особенно в устье альвеолы, биома-
териалом. J. Hahn [108а] рекомендует
помещать имплантат на уровне края
альвеолы и вместо запорного винта
ставить формирователь десны. В дру-
гих случаях имплантат ставят над уров-
нем кости с наружным шестигранным
винтом.
VI этап — ушивание раны.
При немедленной имплантации кон-
струкций в форме корня зуба рану за-
шивают наглухо узловыми или матрац-
ными швами (рис. 5.60). Плотное за-
крытие раны достигается мобилизаци-
ей слизисто-надкостничного лоскута с
вестибулярной стороны. Контролиру-
ют стояние имплантата по рентгено-
грамме или на визиографе.
При немедленной имплантации час-
то бывает необходимо восполнить не-
достающие ткани, как костные, так и
мягкие. Иногда восполнять приходится
дефекты в альвеоле, чаше по передней
ее стенке 1121]. Для восполнения кости
применяют аутогенную [68] или алло-
генную кость, их комбинации [62], а
также другие биоматериалы [26]. Наи-
лучшие результаты дает комбиниро-
ванное применение аутокости, аллоко-
сти и гидроксиапатита в пропорции
1:1:1. Можно использовать только гид-
роксиапатит [262].
Для заполнения костных дефектов
при немедленной имплантации широ-
ко применяют аутокость и деминера-
лизованную кость в форме частиц. Са-
мым лучшим пластическим материа-
лом является аутокость. Об успехе ко-
I
Рис. 5.60. Этапы немедленной импланта-
ции.
а — сегмент нижней челюсти с корнем зуба;
б — остеотомия направляющим сверлом для
апикального отдела имплантата; в — продол-
жение остеотомии формирующим сверлом;
г — нарезка резьбы; д - введение и фиксация
имплантата; е — положение имплантата в кос-
ти, заполнение пустот биоматериалом, заши-
вание мягких тканей; ж — вид после операции
и протезирования на имплантатах в области
второго резца и первого премоляра.
стной пластики свидетельствуют дан-
ные биопсии костных блоков с по-
ружными имплантатами, поставлен-
ными в лунки удаленных зубов добро-
вольца. Регенерация костной ткани на-
блюдалась даже при значительных пер-
воначальных вертикальных (от 7 до
5 мм) и горизонтальных (от 1,5 до 4 мм)
Рис. 5.60. Продолжение.
з — ортопантомограмма того же больного;
и — ортопантомограмма: немедленно уста-
новленные имплантаты вблизи верхнечелюст-
ных пазух.
дефектах, заполнявшихся при имплан-
тации аутогенной костью. Новой кост-
ной ткани образовывалось значитель-
но больше при дефектах меньшего раз-
мера. Наиболее выраженный эффект
достигается при восполнении дефек-
тов кости по горизонтали. С этой це-
лью широко применяют также демине-
рализованную кость. Однако мы счи-
таем, что при использовании аллоко-
сти образуется недостаточное количе-
ство новой кости и ее минерализация,
иногда неполная, происходит медлен-
но. По сравнению с применением де-
минерализованной кости результаты
оказались значительно лучше при ком-
бинированном применении этого мате-
риала с коллагеновым трансплантатом,
игравшим роль резорбируемой матри-
цы. В качестве пористой или губкооб-
разной матрицы использовали глико-
протеид сухожилия человека ("Dyna-
Graft-ЗО"). Этот материал имеет гемо-
статические свойства, и при его ис-
пользовании образование новой кости
ускоряется. I (оложительным качест-
вом такого материала является также
то, что при закрытии дефекта, если по-
требуется, его можно растягивать.
Ph. Boyne [70], экспериментируя на
обезьянах с имплантатами десяти типов:
"Branemark", "Core-Vent" ("Srewvent",
"Microvent"), "Calcitek”, "Integral", "IMZ"
и др., с разными покрытиями, отметил
наилучшую интеграцию с гидрокси-
апатитным покрытием. Он пришел к
выводу, что и наполнение лунки уда-
ленного зуба гранулированным гидро-
ксиапатитом перед имплантацией спо-
собствует интеграции. Главным факто-
ром достижения успеха было не то или
иное покрытие имплантата, а помешен-
ные в ложе гранулы гидроксиапатита,
которые способствовали минерализа-
ции и увеличению плотности новой
кости. Гидроксиапатитное покрытие
имплантата Hi-рало кондуктивную, а не
индуктивную роль. Вместе с тем
R. Knox и соавт. [132] установили, что
на поверхностях с гидроксиапатитным
покрытием новая кость образуется бы-
стрее, чем на поверхностях с плазмен-
ным напылением титана. По данным
W. Becker и соавт. [59], имплантат, по-
ставленный в лунку, лучше всего пре-
дохраняет мембрана (e-PTFE), которая
создает барьер, способствует образова-
нию кости в пустотах и усиливает ин-
теграцию конструкции.
Помимо мобилизации слизистой
оболочки, применяют пластику слизи-
стыми лоскутами на ножке со щеки
или неба, а также свободными слизи-
стыми трансплантатами. Для закрытия
имплантата при немедленной опера-
ции после удаления зуба В. Roscnquist
[201] предлагает использовать свобод-
ный слизистый лоскут, взятый со свода
преддверия рта.
Применяя различные системы им-
плантатов при немедленной импланта-
ции в течение 6 лет, мы получили луч-
шие результаты с конструкциями кли-
новидной формы — широкой прише-
ечной частью и небольшим диаметром
апикальной, среди них "Плазма По-
волжья", "Replace", "Astra Tech.".
По мнению J. Krumph и В. Barnett
[136], наиболее безопасна и эффектив-
на немедленная имплантация в области
Рис. 5.61. Немедленная имплантация.
а — положение верхнего первого премоляра; б — альвеола: атрофия вестибулярной стенки; в —
ориентиры правильного положения имплантата и вестибулярной стенки; г — установлен им-
плантат, между ним и вестибулярной стенкой имеется пустое пространство; д — дефект кости
заполнен биоматериалом; е — через 6 мес вскрыт имплантат бокового резца; вид имплантата по-
сле удаления запорного винта; ж — надета опорная головка; з — вид после протезирования.
центральных зубов верхней челюсти.
При имплантации на этих участках они
отметили эффект в 92,7 % случаев.
Многие авторы указывают на возмож-
ность отлома вестибулярной стенки
при удалении резцов или ее малую тол-
щину и косой скос, что при немедлен-
ной имплантации может создавать ука-
занные ранее функциональные и эсте-
тические недостатки. Дефект кости по-
ставленного в альвеолу имплантата за-
крывается "OsteoGen" и кнаружи фик-
сированной поднадкостнично пласти-
ной деминерализованной кости. A. No-
vaes и A. Noracs (189] предлагают в та-
ких случаях использовать имплантат
"IMZ" и вестибулярно производить ре-
конструкцию недостающей кости мем-
браной, пористым гидроксиапатитом
или другим боматериалом (рис. 5.61 —
5.63).
Если на верхней челюсти удаляют
резцы или премоляры, то непосредст-
венно перед имплантацией обязатель-
но уточняют расположение дна поло-
сти носа, верхнечелюстной пазухи по
отношению к верхушке корня зуба,
причем особое внимание обращается
на количество, а также качество кости
между ними. Это наиболее эффектив-
но достигается анализом результатов
компьютерной томографии. Между
верхнечелюстной пазухой и краем за-
глубленного в кость имплантата тол-
щина кости должна быть не менее 1—
2 мм. Атрофия вестибулярной стенки
Рис. 5.62. Атрофия вести-
булярной стенки у верх-
них центральных зубов,
а — положение зуба в альве-
оле; б — величина вестибу-
лярной стенки после удале-
ния зуба; в — полная атро-
фия вестибулярной стенки;
г — вертикальная линия по-
ложения имплантата "FriaHt-
2" при немедленной имплан-
тации: 1 — остаточная атро-
фировавшаяся кость альвео-
лярного отростка, 2 — ори-
ентир положения импланта-
та; л — имплантат 'Frialit-2”
установлен в правильном по-
ложении; е — позиция им-
плантата "Core-Vent" при не-
медленной имплантации; ж —
коррекция кости блоком
биоматериала; з — коррек-
ция кости аутокостью, при-
крытой мембраной; и — ор-
топантомограмма; имплан-
тат в области центрального
резца.
альвеолы также может
потребовать изменения
позиции имплантата и
направления сверления
кости для его заглубле-
ния. Имплантат, уста-
новленный ниже края
кости, всегда требует
использования чресслизистого удли-
нителя (рис. 5.64).
При удалении на верхней челюсти
моляра к немедленной имплантации
прибегают редко, так как в этой зоне,
как правило, оказывается недостаточ-
но кости для фиксации имплантата, а
также мягких тканей для полного за-
крытия раны. В случае, если условия
Для углубления имплантатов в области
моляров оказываются благоприятны-
ми, предпочтительно ставить их в лун-
ку небного корня или межкорневую
перегородку. Сверление при этом сле-
дует вести с большой осторожностью
1207]. Щечные альвеолы заполняют
биоматериалом. На нижней челюсти
также при толстой межкорневой пере-
городке имплантат ставят в нее, а аль-
веолы и пустоты заполняют биомате-
риалом, например "Bio-Oss" (рис. 5.65).
После заглубления имплантата в кость,
обеспечение его стабильности, а также
заполнения пустот вокруг биоматериа-
лом через 6 мес эффект операции поло-
жительный, что подтверждается как
клинически, так и рентгенологически
(рис. 5.66).
I. Barralay [55] указывает на большое
значение формы альвеолы при немед-
ленной постановке цилиндрических и
винтовых имплантатов. Она чаше от-
личается более или менее широким
диаметром в пришеечном отделе аль-
веолы и узким в ее апикальном отделе.
Определенные трудности при имплан-
тации могут возникнуть, если альвеола
сплюснута с боков и имеет овальную
или почкообразную форму. В таких
случаях A. Qualjee и соавт. [195].
G. Gomez-Roman и соавт. [105] реко-
мендуют использовать керамические
имплантаты, размеры которых близки
к параметрам естественных зубов, или
ставить конструкции фирмы "Tubin-
ger", конструкции системы "Lederman",
373
Рис. 5.63. Установление имплантата при
атрофии вестибулярной стенки кости,
а — корень в альвеоле, вокруг нес кость II ти-
па; б — вид альвеолы после удаления луба; в —
остеотомия на 15‘ в небную сторону от оси зу-
ба; г — продолжение остеотомии направляю-
щим сверлом; д — проверка глубины костного
ложа и параллелизма соответственно окклю-
зии; е — окончательная остеотомия форми-
рующим сверлом, введение имплантата и его
фиксация; ж — немедленное установление
временной коронки, выведенной из прикуса.
а Н. Spikermann [223] — системы "На-
ТГ. В то же время G. Niznik [186] полу-
чил хорошие результаты при использо-
вании разработанных им имплантатов с
титановым плазменным напылением
"Core-Vent", S. Ross и соавт. |202] —
имплантатов "Ross TP", G. Gomez-Ro-
man и соавт. [105] — имплантатов "Fri-
alit-2", Т.Г. Робустова, В.М. Безруков
[26] — имплантатов "Плазма Повол-
жья". Тем не менее при узкой альвеоле
предпочтительнее использовать винто-
вые самонарезные имплантаты не-
сколько большего диаметра, тогда как
достаточно широкая альвеола позволя-
ет применять широкие имплантаты.
На нижней челюсти тактика немед-
ленной имплантации не отличается от
той, которая используется на верхней
челюсти. Имплантат заглубляют, ис-
пользуют биоматериалы, а при дефекте
кости более 4 мм прибегают к транс-
плантации.
В области резцов, клыков и премоля-
ров нижней челюсти обычно имеются
хорошие условия для заглубления им-
плантатов в нижележащую кость. Эти
зубы удаляют с большой осторожно-
стью во избежание отлома стенки аль-
веолы, особенно с вестибулярной сто-
роны. В лунку имплантат заглубляют с
учетом возможности потери кости
вследствие атрофии. Особая осторож-
ность требуется при постановке им-
плантата на месте второго премоляра и
первого моляра. На этих участках все
манипуляции с имплантатом, наложе-
ние или введение аллопластических
материалов необходимо соизмерять с
расположением подбородочного от-
верстия и выходящего из него подбо-
родочного нерва, чтобы избежать его
травмирования. Предпочтительно на
таких участках заранее обнажить под-
бородочное отверстие и выделить под-
бородочный нерв.
Если межкорневые перегородки ме-
жду корнями моляров или межзубные
перегородки между моляром и премо-
ляром достаточной толщины, следует
устанавливать имплантаты на эти уча-
стки кости (см. рис. 5.65).
При постановке самонарезного им-
плантата сверление за кортикальную
пластинку альвеолы проводят строго
индивидуально. Если кость рыхлая, то
необходимости в сверлении за корти-
кальную пластинку альвеолы может и
не быть. В таких случаях самонарезной
имплантат за кортикальную пластинку
вворачивают вручную. Цилиндриче-
ский имплантат в рыхлую кость вводят
постановочным инструментом также
вручную и заглубляют до конца легким
постукиванием по нему хирургическим
молотком.
I. Barzilay [54], G. Nail [181] и
М. Block, J. Kent [68] эксперименталь-
но установили, что при немедленной
имплантации происходит уменьшение
количества соединительной ткани, в
том числе кости. Исходя из этого, на-
званные авторы рекомендуют имплан-
тат любого типа погружать ниже края
зубной альвеолы. Для этого его вводят
в лунку так, чтобы круговая связка на-
ходилась выше него на I мм. Кроме то-
го, создают надежное разобщение им-
плантата и альвеолы от ротовой полос-
ти. Однако, по нашим данным, при та-
ком уровне заглубления имплантата
при вскрытии приходится удалять на-
висающие края кости. С этой целью мы
стали использовать переходную часть
Рис. 5.64. Немедленная имплантация,
а — рентгенограмма центрального резца с око-
ловерхушечной кистогранулемой; б — рентге-
нограмма после установления имплантата в
альвеолу центрального резца; в — через 4 мес
фиксирован чресслизистый удлинитель.
17S
Рис. 5.65. Немедленная имплантация по-
сле удаления нижнего первого моляра и
нижнего второго премоляра.
а — установлены имплантаты в межкорнсвую
перегородку и альвеолу второго премоляра;
б — вид имплантатов через 4 мес после второ-
го хирургического этапа; в — рентгенограмма
дистального отдела нижней челюсти после
протезирования на имплантатах.
супраструктуры — чресслизистый уд-
линитель (см. рис. 5.64). Этого можно
избежать, если ставить коронковую
часть имплантата на уровне кости, а в
случае неплотного прилегания к кости
обкладывать его шейку биоматериалом.
После того как имплантат надежно
фиксирован, в него вворачивают за-
порный винт, уровень которого, по ре-
комендации G. Niznik, должен быть на
2 мм ниже края кости. Нами отмечена
большая резорбция кости при таком
заглублении имплантата. Мы исполь-
зовали имплантаты "Плазма Повол-
жья", "Steri-Oss", погружали имплантат
вровень с поверхностью кости, а запор-
ный винт даже несколько выступал над
ней. Пустоты, образующиеся между
стенками альвеолы и имплантатом, за-
полняют гранулами трикальций-фос-
фата [140), гидроксиапатита [243, 261,
262], Тидроксианола" [26], покрывают
мембраной [60], аллокостью [62] (см.
рис. 5.62).
На втором хирургическом этапе (че-
рез 4—6 мес) производят вскрытие им-
376
плантата. Над запорным винтом иссе-
кают мягкие ткани, при обнаружении
нависающих над ним участков кости их
убирают с помощью бора. После удале-
ния запорного винта проводят туалет
внутренней резьбы имплантата и ставят
опорную головку (см. рис. 5.66, а). Если
состояние мягкой ткани такое, что дтя
эпителизации требуется дополнитель-
ное время, то вместо опорной головки
на 3 нед временно ставят винт заживле-
ния. По истечении этого срока оконча-
тельно фиксируют супраструктуру, по-
сле чего начинают протезирование (см.
рис. 5.66, б). Сроки нагрузки на имплан-
тат могут быть сокращены. Мы распола-
гаем 2-летним опытом ранней нагрузки
на имплантат, помещенный в лунку уда-
ленных центральных зубов [26].
Как уже отмечалось, к обязательным
условиям немедленной имплантации
относится применение погружных им-
плантатов для двухэтапного лечения.
Вместе с тем U. Bragger и соавт. [71[,
J. Hahn [108а] сообщали об успешной
постановке непогружных имплантатов
Рис. 5.66. Второй хирургический этап немедленной имплантации.
а — на вскрытый имплантат поставлена опорная головка; б — формирование коронки на модели;
в — вид зубного ряда после протезирования; г — рентгенограмма после протезирования.
"ITI", "Replace" для одноэтапного лече-
ния. Методика их постановки была
традиционной с зашиванием тканей
вокруг малых и больших запорных
винтов, чресслизистого удлинителя
или винтов заживления. В последние
годы как при традиционной импланта-
ции, так и при немедленной стали при-
менять раннюю нагрузку протезными
конструкциями. Большинство авторов
рекомендуют раннее протезирование
даже при кости III и IV типа. В случае
немедленной имплантации ее реко-
мендуется уплотнить остеотомами.
J. Hahn 1108а] получил в 95,9 % поло-
жительные результаты с имплантатами
"Replace". Для немедленного протези-
рования важны следующие условия:
1) хорошая адаптация супраструктуры
к телу имплантата;
2) отсутствие окклюзионной пере-
грузки;
3) отсутствие патологических явлений
со стороны мягких тканей;
4) временный протез должен выстоять
над линией швов.
Вместе с тем, когда после немедлен-
ной установки имплантата ставится
формирователь десны, благоприятно
заживают ткани и сохраняется ста-
бильность конструкции, можно через
3—4 мес и даже раньше поменять вре-
менную коронку на постоянную. Это
сокращает сроки традиционного лече-
ния.
377
5.7.3. Немедленная имплантация
конструкций плоской формы
Традиционно используют главным об-
разом имплантаты в форме корня зуба
в связи с соответствием их формы кон-
фигурации альвеолы. В то же время
имеются сообщения о положительном
опыте применения плоских конструк-
ций при немедленной имплантации [26,
27,157]. Из погружных конструкций ус-
пешно использовали плоские имплан-
таты "Конмет", "ВНИИМТ,
"МЕТТЭМ”, "Oratronic", а из непо-
гружных — "Startanius". Одними из по-
казаний к немедленной имплантации
плоских конструкций являются узкий
альвеолярный отросток верхней челю-
сти или узкая альвеолярная часть ниж-
ней челюсти, а также небольшой раз-
мер лунки удаленного зуба.
Условия, необходимые для успешно-
го приживления плоских конструкций
при немедленной имплантации, одина-
ковы с теми, которые обеспечивают ус-
пех при постановке имплантатов в фор-
ме корня зуба: 1) отсутствие острых
воспалительных и значительных воспа-
лительно-деструктивных изменений в
пародонте; 2) использование преиму-
щественно погружных имплантатов:
3) заглубление плечей имплантата на
2 мм в кортикальную пластинку альве-
олы; 4) обеспечение для них начальной
стабильности в кости; 5) достаточность
мягких тканей для закрытия импланта-
та и зашивания раны наглухо.
Установлению плоских имплантатов
в лунку удаленного зуба должны пред-
шествовать традиционная клиническая
и рентгенологическая диагностика, а
также анализ модели для контроля ок-
клюзионных взаимоотношений при
последующем ортопедическом лече-
нии. Следует учитывать анатомическое
расположение альвеолы по отношению
к кортикальным пластинкам с вестибу-
лярной и оральной стороны челюсти,
взаимоотношение с каналом нижней
челюсти и подбородочным отверстием,
дном верхнечелюстной пазухи и по-
лости носа. Важно, чтобы кости было
достаточно для заглубления импланта-
та, но еще большее значение имеет на-
личие кости спереди и сзади альвеолы
для создания костного тоннеля.
378
Установление плоских имплантатов
в лунку удаленного зуба заключается в
выполнении последовательных хирур-
гических манипуляций. Мягкие ткани
(слизистая оболочка и надкостница)
рассекают по десневому краю с вести-
булярной и оральной стороны удаляе-
мого зуба. При необходимости для
наилучшего обзора кости разрезы мо-
гут быть продолжены в сторону пред-
дверия рта. После рассечений отслаи-
вают слизисто-надкостничные лоску-
ты с наружной и внутренней поверхно-
сти альвеолярного отростка на верхней
челюсти и альвеолярной части нижней
челюсти. Уже на этом этапе мягкие
ткани подготавливают для последую-
щего закрытия имплантата и с этой це-
лью определяют их ширину и длину. В
случае разрастаний грануляций около
шейки зуба их выскабливают и при не-
обходимости истончают толстый слой
слизистой оболочки. При последую-
щем адекватном глухом зашивании ра-
ны нередко приходится прибегать к
дополнительной мобилизации тканей.
Затем производят удаление зуба. Де-
лают это с повышенной осторожно-
стью, стремясь, чтобы травма альвеолы
была минимальной. При люксации и
ротации стенки лунки зуба не должны
повреждаться. Многокорневые зубы
удаляют по частям, предварительно
разделив их корни. В случаях, когда
возникают технические трудности, их
удаляют по частям путем выпилива-
ния, обязательно с охлаждением.
Во время уддтения зуба возможен
отлом стенки альвеолы. Может неожи-
данно обнаружиться дефект кости, вы-
званный маргинальным воспалитель-
ным процессом и атрофией кости. При
немедленной имплантации дефекты
кости диаметром до 4 мм устраняют с
помощью биоматериалов — гидрокси-
апатита или гидроксиапола, блоков из
колапола или коллапана, а также рас-
сасывающихся и нерассасываюшихся
мембран. В случае наличия дефекта
кости размером больше 4 мм рекомен-
дуется выполнять пластику с помощью
аутогенной или аллогенной кости [68].
Ложе для плоского имплантата при
немедленной имплантации создают
следующим образом. В стороны от зуб-
ной альвеолы удаленного зуба в ком-
пактном веществе альвеолярной дуги
круглым бором делают перфорацион-
ные отверстия и соединяют их фиссур-
ным бором. Линии по бокам альвеолы
должны совпадать друг с другом. Через
боковые бороздки кости отверстия в
губчатом веществе углубляют по раз-
меру имплантата с обязательным на-
ружным или внутренним охлаждением
(рис. 5.67, а, б).
В случае удаления дистопированных
зубов ложе для имплантата создают на
участке близлежащей кости. Обязатель-
но проверяют правильность стояния
имплантата с точки зрения будущей на-
грузки в ортопедической конструкции.
Для этого с врачом-ортопедом обсужда-
ют вопрос об угле наклона имплантата
и его надальвеолярной части с целью
достижения адекватной окклюзии.
После завершения остеотомии осу-
ществля ют туалет альвеолы и боковых
тоннелей в кости. Вес примерочные
мероприятия проводят с аналогом им-
плантата. Иногда, чтобы шейка им-
плантата оставалась открытой, при по-
мощи бора с охлаждением приходится
удалять кость альвеолярного гребня с
язычной и вестибулярной стороны, так
как без этой процедуры заглубление
плеч имплантата может быть затрудне-
но. Перед введением имплантата и его
заглублением дно альвеолы выклады-
вают биоматериалом. В созданное ло-
же имплантат погружают с помощью
плечепосадочного инструмента, на ко-
торый надавливают пальцем. Возмож-
но также легкое постукивание по нему
молотком, особенно на заключитель-
ном этапе заглубления. Имплантат
должен быть поставлен так, чтобы его
плечи находились на 2 мм ниже края
кости. Обязательно проверяют, сохра-
нилась ли начальная стабильность им-
плантата (рис. 5.67, в, г).
С имплантата снимают опорную го-
ловку и вместо нее ставят запорный
винт. Оставшиеся вестибулярно и
орально от имплантата пустоты альве-
олы заполняют кусочками аутокости,
собранной при формировании костно-
го тоннеля, или биоматериалом. При
постановке плоского имплантата для
одноэтапного лечения над его плечами
и около шейки также укладывают ку-
сочки кости или биоматериала.
Перед закрытием раны внутреннюю
поверхность слизисто-надкостничных
лоскутов внимательно осматривают,
особенно у десневого края и десневых
сосочков. Если лоскуты не подготовле-
ны заранее, то на этом этапе удаляют
грануляционные разрастания и иссе-
кают вросший эпителий. При необхо-
димости истончают и иссекают их
края, чтобы глухое зашивание раны
было адекватным. Рану зашивают на-
глухо непрерывными узловыми или
матрацными швами (рис. 5,67, д, е).
Контролируют стояние имплантата по
рентгенограмме сразу после операции,
а также в последующем (рис. 5,67, ж, з).
Второй хирургический этап установ-
ления погружных плоских импланта-
тов проводят через 4 мес на нижней и
через 6 мес на верхней челюсти. Запор-
ный винт вскрывают и избыток кости
над ним убирают. После туалета внут-
ренней части имплантата избыток сли-
зистой оболочки у шейки иссекают и
на 2—3 нед ставят на имплантат винт
заживления. После этого винт заменя-
ют опорной головкой и начинают про-
тезирование.
Аналогично описанным выше хи-
рургическим действиям проводится ус-
тановление плоских имплантатов для
одноэтапного лечения. После погру-
жения в костное ложе избыток слизи-
стой оболочки около их опорных голо-
вок иссекают. Слизисто-надкостнич-
ный лоскут укладывают на место и
фиксируют узловыми или матрацными
швами. Если мягкой ткани для закры-
тия имплантата недостаточно, то мо-
билизуют слизистую оболочку с вести-
булярной стороны. При широком устье
альвеолы рекомендуется под лоскут на
альвеолярный гребень вокруг шейки
имплантата ставить рассасывающуюся
или нерассасываюшуюся мембрану.
Если зашить рану наглухо невозможно,
то рекомендуется использовать пласти-
ку слизистым лоскутом на ножке, сво-
бодным слизистым трансплантатом
или применять аллоткань "Alloderm’’,
"Pericardium". В других случаях следует
отсрочить имплантацию или отказать-
ся от нее. Через 3—4 нед после заши-
вания мягких тканей на имплантаты
для одноэтапного применения надева-
ют каппу, которая не должна иметь на-
Рис. 5.67. Остеотомия по-
сле удаления зуба — фор-
мирование ложа для им-
плантата плоской формы,
а — альвеолы после удаления
зуба; б — остеотомия по их
краям; в — установлен им-
плантат, пустоты альвеолы
и наа плечами конструкции
заполнены биоматериалом;
г — в альвеоле установлен
погружной имплантат; л —
альвеола верхнего первого мо-
ляра после удаления; е - уста-
новлен погружной имплантат,
пустоты альвеол заполнены
биоматсриалом, мягкие ткани
зашиты над имплантатом на-
глухо;
ж — рентгенограмма нижней челюсти, имплантат установлен в альвеоле второго маляра;
з — рентгенограмма верхней челюсти, имплантат установлен в альвеоле первого моляра.
грузки. Вопрос протезирования реша-
ют строго индивидуально в зависимо-
сти от клинической и рентгенологиче-
ской стабильности имплантата в кости.
Его проводят через 1,5—2 или 4—6 мес.
В случае неудачи немедленной им-
плантации и подвижности имплантата
рекомендуется удалить его и вновь
произвести операцию после заживле-
ния альвеолы, но не ранее чем через
6 нед. Для стимуляции костеобразова-
ния и профилактики атрофии кости
как по высоте, так и по ширине ис-
пользуют биомагериалы — ауто-, ал-
ло-, ксенотрансплантаты и их комби-
нации.
Имплантация с одновременной
трансплантацией может быть успеш-
ной только тогда, когда обеспечена
полная неподвижность имплантата в
кости, а рана надежно закрыта наглу-
хо. Комбинированная методика им-
плантации с трансплантацией требует
отделять надкостницу от слизистой
оболочки, удлинять слизистый лоскут
для обязательного разобщения альвео-
лы, биоматериала и имплантата фик-
сацией мягких тканей клеем "Epigli",
создавать условия для костной регене-
рации.
При пластике аллокостью период
окончательного созревания кости и ее
минерализации может быть длитель-
ным — от 8—10 до 15—18 мес. При
раннем вскрытии запорного винта
можно видеть еще незрелую волокни-
стую кость на участках трансплантиро-
ванного материала. Процесс остеоин-
теграции происходит быстрее при
комбинированном использовании ау-
то- и аллокости или аллокости с дру-
гими биоматериалами — гидроксиапа-
титом, "Bio-Oss", "Haspet", "OsteoGen"
и др.
Эффективность немедленной им-
плантации может быть повышена пу-
тем постановки нерассасываюшихся и
рассасывающихся мембран. Мембраны
дают возможность использовать им-
плантаты большей длины и диаметра.
При этом необходимо обращать вни-
мание на адекватное положение им-
плантата в лунке, иногда меняя его.
Кроме того, пластика рассасывающей-
ся мембраной эффективно использо-
валась [68] для закрытия раны в ситуа-
циях, когда из-за нехватки ткани было
невозможно ее зашить.
Методика пластики мембраной сле-
дующая. После удаления зуба, поста-
новки имплантата, заполнения пустот
кости гранулами гидроксиапатита
мембрана может быть наложена на де-
фект кости устья лунки, участки скола
стенки альвеолы и другие дефекты. Ее
края должны плотно прилегать к кости
и перекрывать ее дефект на 3—4 мм.
Если мембрана плохо фиксируется,
следует укрепить ее металлическими
микровинтами или шпильками. D. Bas-
er и соавт. [77] считают, что таким об-
разом лучше удерживается и сгусток
крови. Мембрана может быть уложена
вокруг запорного винта. По мнению
этих авторов, утлы мембраны следует
срезать, чтобы избежать травмы слизи-
стой оболочки и, следовательно, инфи-
цирования раны. R. Caudill и R. Meffert
[81] полагают, что открытие окна в
мембране для запорного винта также
может создать опасность попадания
через него инфекции.
При немедленной имплантации в
лунку удаленного зуба U. Bragger и со-
авт. [71] использовали имплантаты
"1ТГ как с одновременной постанов-
кой мембраны, так и без нее. Приме-
нение тране.мукозных имплантатов
"ITI" с мембраной дало хорошие кли-
нические результаты и все параметры
прилегающей мягкой ткани (глубина
кармана, наличие зубной бляшки, ре-
цессия десны и др.) были более благо-
приятными.
W. Becker и соавт. [61] считают, что
использование мембраны при немед-
ленной имплантации оптимизирует
формирование новой кости. Через год
после немедленной постановки 49 им-
плантатов с мембраной они отметили
хороший результат в 93,9 % случаев.
Сравнительная оценка времени нахож-
дения мембраны при приживлении
имплантатов показала, что удаление
мембраны через 4—6 мес на втором хи-
рургическом этапе значительно стиму-
лирует формирование новой кости.
Вместе с тем настораживает приведен-
ный этими авторами факт: в период
между первым и вторым этапами хи-
рургических манипуляций с импланта-
тами 20 из 49 поставленных мембран
обнажились и их пришлось удалить.
Видимо, правило удаления мембраны
через 6 нед оправдано.
Послеоперационное ведение боль-
ных, которым поставлены импланта-
ты, традиционное. После первого эта-
па немедленной имплантации прово-
дят курс антибиотикотерапии, в тече-
ние 2—3 нед делают перевязки. Боль-
ной самостоятельно поддерживает ги-
гиену рта и нс реже одного раза в месяц
посещает врача, который наблюдает за
ходом лечения.
5.8. Отсроченная имплантация
При острых воспалениях в области
удаленного зуба, в случае получения
гнойного секрета из альвеолы вместе с
кистогранулемой или при хрониче-
ском гранулематозном периодонтите
либо его обострении немедленная им-
плантация противопоказана. В такой
ситуации прибегают к отсроченной им-
плантации. Так же поступают при не-
удачной немедленной имплантации,
когда в результате ее не удается достичь
стабильности конструкции в кости.
При отсроченной имплантации пред-
почтительно вводить конструкции в
лунку зуба, потерянного в результате
травмы. Ее проводят через 8—10 нед
после травмы [223]. Показаниями к от-
сроченной имплантации считают так-
же наличие значительного дефекта в
кости после удаления зуба и просвет
альвеолы, значительно больший, чем
диаметр имплантата. По мнению
Рис. 5.68. Отсроченная имплантация,
а — удален зуб, альвеола заполнена биомате-
риалом; б — через 6 нед установлен имплан-
тат; в, г — через 3—6 мес вскрыт имплантат,
установлена супраструктура и поставлена ко-
ронка.
R. Scott и соавт. [218], через 1,5 мес по-
сле удаления зуба остеоидной или не-
зрелой костной ткани образуется доста-
точно для проведения отсроченной им-
плантации. М. Ogiso и соавт. [191] счи-
тают, что достаточно даже 2 нед после
удаления зуба, поскольку к этому вре-
мени уже формируются трабекулы и
капилляры, что необходимо для сра-
щения кости с имплантатом.
5.8.1. Отсроченная имплантация
конструкций в форме корня зуба
Подготовку пациента к отсроченной
имплантации осуществляют традици-
онным методом. Учитывают данные
обследования, проведенного с целью
немедленной имплантации, касаю-
щиеся количества и качества кости и
прилегающей к ней мягкой ткани, ана-
томических взаимоотношений с верх-
нечелюстной пазухой, полостью носа,
каналом нижней челюсти и т. д. После
удаления зуба альвеолу промывают,
временно вводят в нее кусочки губки,
пропитанные гентамицином, затем в
ее устье поверх кровяного сгустка или
смешав с кровью укладывают био.мате-
риал — гидроксиапатит, Тидроксиа-
пол", "Колапол", "Коллапан", демине-
рализованную кость, "Bio-Oss”, "Has-
pet" (рис. 5.68). Важным условием ус-
пеха отсроченной имплантации явля-
ется пластика биоматериалом альвео-
лы удаленного зуба (рис. 5.69). Моби-
лизуют слизисто-надкостничный лос-
кут и рану зашивают наглухо.
Если ширина кости достаточная, то
при отсроченной имплантации приме-
няют погружные имплантаты в форме
корня зуба с гидроксиапатитным по-
крытием — самонарезные или цилинд-
рические. Операцию выполняют в два
этапа. Первый этап проводят через 6 нед
после пластики альвеолы. В этот пери-
од альвеола заполнена остеоидной тка-
нью, которая по периферии имеет мел-
копетлистое строение.
Хирургические приемы при разрезах
и отслаивании слизисто-надкостнич-
ных лоскутов при отсроченной им-
плантации такие же, как и при немед-
ленной. Однако следует помнить, что
после удаления зуба слизистая оболоч-
Рис. 5.69. Подготовка к отсроченной им-
плантации.
а — вид альвеолы после удаления зуба; б —
альвеола заполнена биоматериалом; в — через
6 нед установлен имплантат "Bicon" в остеоид-
ную ткань и через 4—5 мес фиксирована
коронка.
ка и надкостница представляют собой
единый свободный конгломерат, а
прикрепленных мягких тканей стано-
вится меньше, что связано с атрофиче-
скими процессами в кости. Потеря
мягких и костных тканей после удале-
ния зуба, которая, поданным Р. Tetsch
1236], составляет 10:0,6, может созда-
вать трудности при отсроченной им-
плантации, поэтому иссечение мягкой
ткани делают щадяще на глубину до
остеоидной ткани. В связи с этим не-
обходимо, в частности, определить со-
отношение оптимальной длины им-
плантата и будущей высоты коронки.
При соотношении 1:1 функциональная
нагрузка на имплантат и прилежащую
к нему кость будет оптимальной. Им-
плантат вводят в ткани вкручиванием
или легким вколачиванием.
Для углубления имплантата в кость
также используют эти приемы. Если
необходимо сверлить кость, то это де-
лают с наружным и внутренним охла-
ждением. Независимо от типа все им-
плантаты должны быть заглублены за
дно альвеолы. Для улучшения их ста-
билизации в кости, как и при немед-
ленной имплантации, используют
биоматериалы. В случае необходимо-
сти трансплантируют ауто-, алло- и
ксеноткани. Если не хватает мягкой
ткани для глухого закрытия раны, эф-
фективен свободный слизистый лос-
кут, фиксированный швами и клеем
"Epigli". После операции показана
противовоспалительная терапия анти-
биотиками, десенсибилизирующими и
общеукрепляющими средствами, ви-
таминами. Перевязки делают в тече-
ние первых 2—3 нед. Пациент само-
стоятельно поддерживает гигиену по-
лости рта и до второго хирургического
этапа имплантации не реже одного
раза в месяц посещает врача, который
контролирует приживление имплан-
тата.
Второй этап оперативного вмеша-
тельства и ортопедического лечения
проводят через 4 мес на нижней и
через 6 мес на верхней челюсти.
Хирургические манипуляции анало-
гичны тем, которые проводят при не-
медленной имплантации. Так же
вскрывают имплантат, удаляют запор-
ный винт, осуществляют туалет раны и
внутренней части конструкции и на
имплантат временно ставят винт за-
живления.
Через 2—3 нед, необходимых для за-
живления мягких тканей, вместо винта
заживления на имплантат ставят опор-
ную головку и начинают ортопедиче-
ское лечение (рис. 5.70). После окон-
чательного протезирования пациенту
Рис. 5.70. Результат отсроченной им-
плантации.
а — вид альвеолы через 2 нед после удаления
зуба; б — вид зубного ряда после протезиро-
вания на имплантате.
рекомендуются контрольные посеще-
ния врача, в том числе для гигиениче-
ских процедур.
5.8.2. Отсроченная имплантация
конструкций плоской формы
Отсроченная имплантация с постанов-
кой плоской конструкции является
единственным методом лечения при
малом диаметре альвеолы и узкой аль-
веолярной дуге. Помимо этого, к от-
сроченной имплантации с помощью
плоских имплантатов прибегают в слу-
чаях, когда после удаления зуба возник
значительный дефект и невозможно
фиксировать имплантат в форме корня
зуба. Отсроченная имплантация пока-
зана также при воспалительных явле-
ниях в области удаленного зуба, полу-
чении гнойного секрета из альвеолы
при выскабливании гранулемы или
грануляционных разрастаниях, а также
в случае неэффективности импланта-
ции. Отсроченная имплантация пло-
ской конструкцией целесообразна при
удалении моляров, когда диаметр устья
альвеолы в дистальных отделах значи-
тельно превышает диаметр круглого
имплантата. Кроме того, нередко оди-
ночно стоящие моляры бывают накло-
нены, в связи с чем невозможно дос-
тичь правильной окклюзии при поста-
новке имплантата круглой формы не-
посредственно в лунку удаленного зу-
ба. Выход заключается только в фор-
мировании нового ложа. Для имплан-
татов плоской формы в таких случаях
по краям лунки удаленного зуба можно
создать тоннель с необходимым для
правильной окклюзии наклоном. От-
сроченная имплантация плоских кон-
струкций также проводится через 6 нед
после удаления зуба и пластики альве-
олы биоматериалом.
Рассечение мягких тканей и отслаи-
вание слизисто-надкостничного лоску-
та при отсроченном установлении пло-
ских имплантатов имеет ряд особенно-
стей. В частности, это связано с тем,
что используют только погружные им-
плантаты. Для погружных имплантатов
разрез делают языкообразной или тра-
пециевидной формы через слизистую
оболочку и надкостницу на глубину не
более 1—2 мм. На участке альвеолы
ткани щадяще отслаивают острым пу-
тем, сочетая это с движениями распа-
тора. На данном участке разрыв тканей
недопустим. После того как ткани на
месте устья альвеолы отсечены по го-
ризонтали, трудностей с последующим
рассечением и отслаиванием слизисто-
надкостничного лоскута в стороны
обычно не возникает.
Обнажив край альвеолы и близлежа-
щую кость по обе стороны по горизон-
тали, острым бором проводят сверле-
ние кортикальной и губчатой кости с
наружным охлаждением. Затем по аль-
веолярной дуге в обе стороны цен-
тральную часть альвеолы, заполнен-
ную остеоидной тканью, рассекают уз-
ким брюшком скальпеля по вертикали
на всю глубину. От краев образовавше-
гося пространства формируют ложе
для имплантата в стороны по альвео-
лярной дуге. Выполняют примерочные
процедуры с его аналогом, стараясь,
чтобы они не были многократными.
После туалета лунки и боковых тон-
нелей ставят имплантат, постепенно
погружая его легкими постукиваниями
долотом и молотком по его плечам.
Можно пользоваться также плечепоса-
дочным инструментом. Убедившись в
том, что имплантат плотно зафиксиро-
ван в кости и плечи его находятся в ко-
стных тоннелях по бокам лунки уда-
ленного зуба, укладывают костную
стружку, кусочки биоматериала, а в его
тело вворачивают запорный винт. Им-
плантат должен быть заглублен на 2 мм
ниже альвеолярного края.
Мягкие ткани над запорным винтом
и плечами имплантата сопоставляют и
рану зашивают наглухо. Однако следу-
ет иметь в виду, что при отсроченной
имплантации формирование лоскута
для закрытия имплантата может быть
затруднено, так как участок слизистой
оболочки интимно связан в едином
блоке с надкостницей и остеоидной
тканью. При нарушении техники рас-
сечения тканей острым путем они мо-
гут разрываться, отчего потом для за-
крытия раны тканей может не хватить.
По этой причине все манипуляции с
мягкой тканью следует проводить
очень осторожно.
Если для глухого закрытия раны
мягких тканей недостаточно, то стара-
ются мобилизовать подвижную часть
слизистой оболочки или рассекают ее у
свода преддверия рта с обязательным
сохранением достаточного питания от
боковых отделов лоскута. В отдельных
случаях нужно быть готовым формиро-
вать свободные слизистые лоскуты для
закрытия имплантата, фиксации их
швами или соединения клеем "Epigli".
После зашивания раны временные
зубные протезы, каппы могут быть по-
ставлены через 3—4 нед, но без нагруз-
ки на имплантат. Стояние имплантата
в кости контролируют по рентгено-
граммам, на визиографе.
Через 3—4 или 4—6 мес запорный
винт имплантата вскрывают перфора-
тором или скальпелем. При этом иссе-
кают фрагмент мягкой ткани округлой
формы над запорным винтом. Послед-
ний вывинчивают и осуществляют туа-
лет внутренней части имплантата. В за-
висимости от состояния мягких тканей
можно ставить временный винт зажив-
ления или сразу опорную головку. В
последнем случае ортопедическое ле-
чение начинают немедленно. При по-
становке винта заживления к ортопе-
дическому лечению приступают после
его замены на опорную головку (обыч-
но через 3 нед).
Успех как немедленной, так и отсро-
ченной имплантации конструкции в
лунку удаленного зуба обеспечивается
соблюдением всех правил диагности-
ки, подбором имплантатов, шалящим
удалением зуба, успехом пластики
биоматериалом, адекватной остеото-
мией. G. Watzek и соавт. (250J в период
с 1986 по 1993 г., проанализировав ре-
зультаты немедленной и отсроченной
имплантации (134 имплантата) после
удаления зубов, отметили эффект в
97,7 % случаев. Стабильность имплан-
тата, глубину кармана и рентгенологи-
ческие данные авторы оценивали в за-
висимости от степени атрофии кости.
Глубина кармана составляла от 1,3 до
2,6 мм, слой атрофированной кости —
от 0,5 до 1,3 мм. Это явно свидетельст-
вовало о перспективности лечения с
помощью как немедленной, так и от-
сроченной имплантации конструкции
в лунку удаленного зуба.
5.8.3. Временная имплантация
Имплантация зубов в форме корня
зуба требует 4—6 мес до начала окон-
чательного ортопедического лечения.
До него прибегают к ношению капп,
временных зубных протезов. Однако
адаптирование временных протезов с
опорой на периферическую кость че-
люстей не всегда оправдывает себя.
Кроме того, при этом неизбежна трав-
ма участков мягких тканей, закрываю-
щих поставленные в кость импланта-
ты. Рядом фирм разработаны времен-
ные имплантаты (см. рис. 1.11). При
установлении постоянных имплантатов
между ними делается остеотомия кор-
тикального вещества круглым бором и
губчатого вещества — направляющим
сверлом на глубину, на 2—3 мм меньше
длины основных имплантатов. Ручным
способом в созданные ложи вводят вре-
менные имплантаты до их плотной
Рис. 5.71. Временная имплантация.
а — ортопантограмма челюстей до операции; б — после установления постоянных и временных
имплантатов на верхней челюсти.
фиксации в кости (рис. 5.71). Рану за-
шивают традиционным путем, особен-
но тщательно наложив швы между над-
альвеолярной частью временных им-
плантатов. На модели челюсти воспро-
изводится клиническая ситуация и из-
готавливается временный протез. Сра-
зу после операции или через 7—8 дней
можно надевать временный протез, ко-
торый чаще фиксируется на цементе,
реже — на масляном дентине (рис. 5.72).
Нагрузка на протез должна быть щадя-
щей, но эстетика и функция бывают
абсолютно полноценными. На втором
этапе — вскрытия имплантатов — уда-
ляют зубной протез. При этом ряд вре-
менных имплантатов может "уйти" из
кости. Оставшиеся временные им-
плантаты удаляют, если они подвиж-
ны, или срезают до края кости и остав-
386
ляют в ней. Дальнейшее лечение про-
водится традиционно [108а].
Использование временных имплан-
татов открывает широкие перспективы
для повышения эффективности функ-
ции и эстетики, социальной реабили-
тации пациента после первого этапа
имплантации.
5.9. Послеоперационное
ведение больных
После установления имплантатов в
кости и прилежащих мягких тканях
происходят определенные патологиче-
ские изменения. Операционная травма
костных тканей ложа имплантата и со-
седних с ним мягких тканей вызывает
Рис. 5.72. Протезирование на временных
имплантатах.
а — ортопантомограмма с временными и по-
стоянными имплантатами на нижней челю-
сти; б — после операции фиксация зубной
каппы на временных имплантатах.
воспалительную реакцию. Для того
чтобы послеоперационный период
протекал без осложнений, необходи-
мо, чтобы развивающиеся после опе-
рации стадии воспаления, пролифера-
ции и регенерации адекватно заверши-
лись и произошло полное восстановле-
ние травмированных тканей. Наиболее
благоприятно заживление тканей реге-
нерацией; хуже, если образуется руб-
цовая ткань. Характер заживления за-
висит от многих причин и в первую
очередь от индивидуальных особенно-
стей функционального состояния ор-
ганизма и местной тканевой реакции
на операционную травму и импланти-
руемую конструкцию. Исходя из этого,
следует проводить послеоперационное
лечение. После операции нужно на-
значить холод (пузырь со льдом) на 2—
4 ч. В этот день не рекомендуется при-
нимать горячую пищу. Перед тем как
отпустить больного домой, ему накла-
дывают давящую повязку на область
лица соответственно тому участку, где
произведена операция.
Антибактериальную терапию прово-
дят после имплантации. Многие спе-
циалисты рекомендуют начинать ее за
день до операции или в тот же день.
Следует назначить внутрь или внутри-
мышечно антибиотики группы пени-
циллина, макролиды, линкомицин, а
также антибиотики широкого спектра
действия — тетрациклины, аминогли-
козиды, левомицетин. Учитывая осо-
бенности микрофлоры полости рта,
можно одновременно вводить препа-
раты нитазола. Для профилактики по-
бочного действия антибиотиков (пора-
жение слизистой оболочки, аллергиче-
ские реакции) целесообразно приме-
нять леворин, нистатин, ротовые ван-
ночки с лизоцимом, орошение полос-
ти рта интерфероном. Антибактери-
альное лечение осуществляют в тече-
ние 5—8 дней. Первая доза антибиотика
является ударной (превышающей сред-
нюю терапевтическую), которую мы
назначали за 12 или 1 ч до операции.
Мы с успехом использовали препараты
группы макролидов — рулил, клацид,
спиромицин в комбинации с метрони-
дазолом в течение 8 дней. При зубной
имплантации III и IV степени сложно-
сти может потребоваться продление
антибактериальной терапии до 14—
21 дня, а также включение в комплекс
терапии других противовоспалитель-
ных и симптоматических лекарствен-
ных веществ. После установления им-
плантата и сохранения его стабильно-
сти очень важными факторами являют-
ся время нагрузки на него и ее адекват-
ность. Рекомендуется также в течение
1 нед прием мягкой и жидкой пищи,
желательно не есть на той стороне, где
произведена операция.
При перевязках необходимо строго
придерживаться правил асептики и ан-
тисептики. Если при первой, второй пе-
ревязке выражены воспалительные из-
менения в прилежащих мягких тканях,
рекомендуется проведение блокады по
типу инфильтрационной анестезии
(1—2 % раствор лидокаина 1,8—2 мл,
30 % раствор линкомицина 2 мл) или
инъекция под слизистую оболочку 2 мл
препарата "Траумсль". Хорошее дейст-
вне оказывает этот препарат в грану-
лах, которые пациент принимает в те-
чение недели. Если это не делалось в
день операции, можно на 2—3-й день
после нее ввести 1 мл 0,1 % гидрокор-
тизона или 30 мг дексаметазона внут-
римышечно. В послеоперационном пе-
риоде для повышения качества анти-
септической обработки раны использу-
ют различные лекарственные средства:
антисептики, антибиотики, биологи-
чески активные вещества, а также там-
поны, смоченные йодоформом, ксено-
формом, йодистой смесью, маслом ши-
повника, облепихи, бальзамом Кара-
ваева, бальзамом "Спасатель", эмуль-
сией препаратов обезболивающего или
противовоспалительного действия.
Для местной обработки ран после
имплантационной хирургии применя-
ют фурановые препараты, группы ки-
слот, окислители, красители, детерген-
ты, производные хиноксалина, анти-
биотики, препараты нитазола и другие
лекарственные средства против ана-
эробной и аэробной инфекции. Наи-
более выраженный местный эффект
дают группа кислот — 1—3 % водный
раствор борной кислоты, 1—2 % спир-
товой раствор салициловой кислоты,
окислители — 3 % раствор перекиси
водорода, детергенты — 0,12—2 % рас-
твор хлоргексидина и его производ-
ных, производные хиноксалина, пре-
имущественно диоксидина в виде 0,1—
1 % водного раствора. Наиболее эф-
фективны из анестетических препара-
тов производные хлоргексидина —
корсодил, элюдрил, хлоргексидин
глюконат в виде растворов или аппли-
каций геля, проводимых в течение 7—
8 дней. Далее концентрацию растворов
снижают на '/з или у, и продолжают
аппликации до полной эпителизации
раны. Швы снимают на 7—8-й или
11—14-й день в зависимости от вида
шовного материала и состояния после-
операционной раны. Если в области
швов или после их снятия имелись
воспалительные изменения слизистой
оболочки, рекомендуется использовать
самоклеющуюся пленку с лидокаином
и хлоргексидином — "Диплен-ХД". В
дни, когда больной не посещает врача,
он наклеивает ее самостоятельно до
полной эпителизации раны и ликвида-
ции воспаления. При развитии воспа-
лительных явлений в области имплан-
тато-челюстного сегмента делают бло-
кады анестетика с препаратом "Трау-
мель" по типу инфильтрационной ане-
стезии.
К физическим методам антисептики
ран относятся также ультрафиолетовые,
лазерные, ультразвуковые воздействия.
Лазерную терапию с магнитным индук-
тором назначают после имплантации в
течение 10 мин при частоте модуляции
1500 Гц, увеличивая ее до 3000 Гц. Курс
лечения 7—8 процедур ежедневно.
Изучив 42 литературных источника,
Z. Walsh (1992) приводит убедительные
данные об эффективности лазерной те-
рапии после зубной имплантации. Ги-
пербарическая оксигенация улучшает
остеоинтеграцию имплантатов. Проце-
дуры проводят в послеоперационном
периоде в режиме 2—3 атм. Такое лече-
ние также оказывает хорошее действие
перед операцией, в том числе у паци-
ентов, оперированных ранее по поводу
злокачественного новообразования.
Пациент, перенесший зубную им-
плантацию, от 10 дней до 3 нед после
нее находится под наблюдением хи-
рурга-стоматолога. Затем его следует
осматривать по окончании каждого
этапа лечения. После второго хирурги-
ческого этапа и постановки супра-
структуры и ортопедических конструк-
ций зубных протезов больной продол-
жает находиться под наблюдением вра-
чей, осуществляет домашний уход за
полостью рта.
Оценку результатов имплантации
проводят по стандартам Smith—Zarb
(1989) или Misch (1999). Основные
критерии успеха определяются сле-
дующим:
1) неподвижность имплантата;
2) отсутствие кровоточивости им-
плантато-десневого соединения;
3) погружение зонда на 2—4 мм;
4) отсутствие боли и воспаления в
области имплантата;
5) отсутствие деструкции кости У
шейки и тела имплантата;
6) потеря кости в первый год функ-
ционирования 1,49—1,5 мм и после-
дующая потеря кости 0,1 мм за каждый
последующий год;
2ОС
7) высокий уровень гигиены;
8) функциональная и эстетическая
эффективность зубных протезов, опи-
рающихся на имплантат;
9) 95 % успеха при 5-летнем исполь-
зовании имплантатов "Astra Tech.",
"Branemark”, "Maestro System", стан-
дарт успеха 85 % при 10-летнем функ-
ционировании и 80 % — при 15-летнем
функционировании.
Рекомендуется чистить зубы 2 раза в
день и поласкать полость рта после ка-
ждого приема пищи. Не следует приме-
нять пасты, содержащие ионы хлора.
Для чистки съемных протезов и капп
нужно использовать жесткую щетку и
зубной порошок.
В ранние и более отдаленные сроки
после имплантации хирург и ортопед
контролируют состояние мягкой ткани
около шейки имплантата или вокруг
супраструктуры. Приживление имплан-
тата считается хорошим, если через год
глубина десневого кармана и уровень
зубодесневого соединения, ширина ке-
ратинизированной слизистой оболоч-
ки соответствуют нормальным величи-
нам, при зондировании кровотечение
не возникает, при рентгенологическом
исследовании атрофия кости через 1 год
не превышает 1,5 мм, что соответству-
ет норме [92].
На характер послеоперационного
периода и заживление влияет ряд фак-
торов. Прежде всего это хирургическая
техника. При имплантации в результа-
те хирургических манипуляций возни-
кает поверхностный некроз костной
ткани, находящейся в контакте с им-
плантатом. Это происходит в результа-
те нагрева кости при сверлении, даже
адекватном и с охлаждением. Некроти-
ческие изменения кости снижают по-
тенциальные возможности защитной
реакции клеточных элементов в воспа-
лительной фазе после имплантации.
Это может выражаться в задержке или
отсутствии оссификации и привести к
образованию фиброзной ткани вместо
костной. Именно травма считается
главной причиной фиброзной инкап-
суляции имплантата.
Большое значение имеют манипуля-
ции с мягкой тканью — слизистой обо-
лочкой и надкостницей. Не следует
часто касаться краев раны пинцетом,
лишний раз прокалывать их иглой’
При зашивании нужно пользоваться
трехгранными иглами, подбирая раз-
мер и диаметр соответственно региону
имплантации и толщине слизисто-
надкостничных лоскутов. Совмещая
края раны, стремятся предотвратить
натяжение и обеспечить хорошую
фиксацию узлов шва. В отдельных слу-
чаях необходимы отделение надкост-
ницы от слизистой оболочки и послой-
ное зашивание раны, а также истонче-
ние тканей, иссечение их избытка,
особенно кератинизированных участ-
ков. В качестве шовного материала
лучше использовать кетгут, хромиро-
ванный кетгут, синтетические нити.
На приживление имплантата может
влиять ряд других факторов: попада-
ние экзогенной и эндогенной инфек-
ции, особенности функционального
состояния организма и обмена ве-
ществ, от которых зависит остеоинте-
грация имплантата и кости, а также
вид супраструктуры, зубных протезов с
опорой на имплантаты и соответствен-
но нагрузка на них.
В рану инфекция может попадать эк-
зогенным контактным путем (90 % слу-
чаев), в том числе при нарушении сте-
рильности операции, воздушным пу-
тем за счет содержания микроорганиз-
мов и импостационным путем в ре-
зультате инфицирования шовного ма-
териала, зубных имплантатов, биома-
териалов.
При создании барьера экзогенной
инфекции главную роль играют борьба
с образованием зубной бляшки, пре-
дотвращение развития воспаления,
увеличения кармана и последующей
резорбции кости по периметру им-
плантата [184].
Имплантация может осложняться
эндогенной инфекцией, которая свя-
зана с хроническими воспалительны-
ми заболеваниями пациента, аутоин-
фекцией полости рта и носа. Она мо-
жет проникнуть в зону операции с ко-
жи, лимфатическим путем, с блоком
оперированных тканей, реже — гема-
тогенным путем. В послеоперационном
периоде и в дальнейшем при уходе за
полостью рта важно обнаружить ран-
ние признаки воспаления вокруг им-
плантатов — изменения в прилегающих
мягких тканях [184]. По мнению
G. Krekeler и соавт. [135], I. Ericsson и
соавт. [57], LJ. Lekholm и соавт. [141],
Н. Apse [46], J. Srub и соавт. [226],
J. Olive, С. Aparicio [192], A. Behneke и
соавт. [63], к таким показателям отно-
сятся состояние мягких тканей, рент-
генологические и микробиологические
данные, результаты лабораторных ис-
следований жидкости из десневой бо-
розды, данные периотеста.
Проводя клинический контроль им-
плантатов, обращают внимание на ги-
перемию и отечность слизистой обо-
лочки, наличие десквамации или изъ-
язвления на ней. При зондировании
определяют состояние зубодесневого
соединения у имплантата, глубину дес-
невого кармана, наличие патологиче-
ского отделяемого из него, а также зуб-
ных отложений — налета, зубного кам-
ня. Констатируют стабильность или
подвижность имплантата и ее степень.
Клинически решающим фактором ус-
пеха имплантации является сохране-
ние здоровых мягких тканей вокруг
опорных головок [5, 12, 16, 20].
При зондировании глубину погру-
жения пародонтального зонда отмеча-
ют по его делениям. Проводить зонди-
рование вокруг имплантата необходи-
мо с большой осторожностью, чтобы
не повредить его поверхность. Не сле-
дует ориентироваться на глубину бо-
розды около оставшихся естественных
зубов: вокруг имплантатов она, как
правило, больше.
С. Misch [177а] рекомендует в тече-
ние первого года после протезирова-
ния проводить зондирование регуляр-
но через 3—4 мес, чтобы не только во-
время заметить ускорение резорбции,
но и наблюдать за консистенцией мяг-
кой ткани, наличием кровотечения и
выделением патологического экссуда-
та. Что касается допустимой глубины
карманов вокруг имплантатов, то су-
ществуют различные мнения. U. Lek-
holm и соавт. [141] отмечали адекват-
ную стабильность имплантатов с кар-
манами глубиной до 6 мм, при этом
микробиологические, морфологиче-
ские показатели соответствовали нор-
ме [142]. Однако ряд авторов считают,
что допустима глубина карманов не
более 4 мм. При увеличении глубины
до 5—6 мм пациенту трудно поддержи-
вать необходимый уровень гигиены
[95]. Погружение зонда более чем на 4
мм и отсутствие кости на разных уча-
стках вокруг имплантата по горизонта-
ли и вертикали свидетельствуют о па-
тологии. При глубоком погружении
зонда и потере кости как вестибуляр-
но, так и с язычной или небной сторо-
ны необходимо рентгенологическое
исследование.
Отсутствие воспаления, а при зон-
дировании — кровотечения из мягких
тканей вокруг имплантата являются
важными признаками удачной им-
плантации. Кровь при зондировании
может быть первым сигналом неблаго-
получия. Однако нельзя исключать по-
явление крови в результате приложе-
ния к зонду излишнего усилия, кото-
рое не должно превышать 20 г.
Большое значение следует придавать
перкуссии имплантата. Появление глу-
хого звука может ориентировать на раз-
интеграцию имплантата и кости.
Большинство исследователей наи-
более характерным признаком патоло-
гии имплантата считают его подвиж-
ность. Однако незначительная под-
вижность может сочетаться с образова-
нием бессосудистой фиброзной ткани
между имплантатом и костью. В таких
случаях имплантаты и в дальнейшем
будут хорошо функционировать. Кро-
ме того, подвижность имплантата мо-
жет быть обусловлена не всегда удач-
ной супраструктурой имплантата. Да-
же хорошо интегрированные имплан-
таты могут иметь некоторую клиниче-
скую подвижность из-за рыхлости ок-
ружающего их губчатого вещества кос-
ти. Влияние оказывает также и то, вве-
ден или не введен апикальный конец
имплантата в противоположный корти-
кальный слой кости. Клинические дан-
ные контролируют путем рентгенологи-
ческого исследования. При необходи-
мости, особенно в сомнительных случа-
ях при обнаружении воспаления на уча-
стке поставленного имплантата, объек-
тивные данные о состоянии мягких тка-
ней в контактирующей с ним зоне по-
зволяют получить резонансная томо-
графия, цветная визиография. При
значительной подвижности импланта-
та рентгенологически обнаруженная
резорбция кости является важным сиг-
налом неблагополучия. Если такая
подвижность возникла, то прежде все-
го следует исключить окклюзионную
травму. Сложность наблюдения за ди-
намикой резорбции заключается в том,
что начинается она с лицевой стороны
имплантата, тогда как рентгеновские
снимки регистрируют только медиаль-
ные и дистальные уровни кости. Оцен-
ка резорбции с учетом изменения глу-
бины десневых карманов остается на-
дежным методом диагностики.
Обоснованный прогноз импланта-
ции можно делать через I год после его
постановки. Средняя потеря кости че-
рез 1 год после постановки имплантата
и протеза с опорой на них составляет
1,4—1,5 мм. В дальнейшем каждый год
потеря кости по горизонтали у им-
плантата составляет 0,1—0,2 мм. В то
же время в отношении имплантатов
разных систем приводятся как мень-
шие, так и ббльшие цифры, а главное,
резорбция кости регистрируется не
только по горизонтали, но и в верти-
кальном направлении [235]. Однако
ряд авторов приводят и другие цифры:
в первый год потеря кости составляет
0,4—1 мм, на второй и третий — 0,8—
0,6 мм и через 3 года — 1—1,1 мм. Бо-
лее интенсивно кость растет у мужчин,
и соответственно резорбция ее более
выражена у женщин, особенно в воз-
расте 48—57 лет |63, 219, 221]. A. Pham
и соавт. [193] рентгенологически пока-
зали определенную зависимость поте-
ри кости после установления имплан-
тата от нагрузки. В период до 6 мес от-
мечали наибольшую резорбцию кости,
которая уменьшалась после 6—12 мес
при нагрузке и затем в период от 12 до
24 мес была минимальной. Это поло-
жение предопределило возможность
ранней нагрузки на имплантат.
На потерю кости после постановки
имплантата оказывает влияние уро-
вень погружения его в костную ткань.
Большая потеря кости отмечена тогда,
когда он был погружен в нее целиком
(2,26 мм в год), а при соприкосновении
шейки с краем кости убыль ее за год
составляла 1 мм, у системы "IMZ” —
0,45 мм [208]. Кроме того, потеря кос-
ти была различной у винтовых и ци-
линдрических имплантатов, у послед-
них она была выражена более значи-
тельно. После 6-месячной нагрузки
резорбция кости становилась одинако-
вой.
Определенные проблемы при им-
плантации возникают после второго
хирургического этапа — при постанов-
ке опорных головок и супраструктуры.
При постановке винтов заживления и
опорных головок особое внимание
следует обращать на плотность их при-
легания к пришеечной части, хотя за-
тягивать их сильнее, чем рекомендова-
но производителями, не следует, чтобы
не сорвать резьбу у винтовых конст-
рукций и не провернуть цилиндриче-
ские конструкции вокруг оси. Опас-
ность неплотного прилегания заклю-
чается в том, что любые пустоты между
соприкасающимися поверхностями
неизбежно становятся местом скопле-
ния микробов, которые могут быть
причиной воспалительных явлений в
мягких тканях. Опасность особенно
возрастает в тех случаях, когда опорная
головка состоит из нескольких частей,
имеющих резьбовые соединения. Как
показали эксперименты, промежутков
между соприкасающимися поверхно-
стями нельзя полностью избежать при
любой конструкции крепления опор-
ных головок, но при оптимальном за-
тягивании эти промежутки менее 10
мкм. Даже конические крепления, у
которых конус перед плотной поста-
новкой специально охлаждали, оказа-
лись неспособными полностью создать
барьер на пути микробов. В экспери-
менте значительно бблыпая зашита от
проникновения их отмечена только у
имплантатов системы "Frialit-2", у ко-
торых в конструкции крепления опор-
ной головки имелся промежуточный
силиконовый элемент или соединение.
В послеоперационном периоде и на
этапах функционирования имплантатов
обязательно поддержание адекватной
гигиены [108]. Значение гигиены было
подтверждено клиническими данными,
микробиологическими и морфологиче-
скими исследованиями многих авторов
[95, 135, 180, 192, 196, 243. 263]. По-
ставленные имплантаты и зубные про-
тезы с опорой на них требуют как на-
блюдения у врача или зубного гигие-
циста, так и ежедневных самостоятель-
ных процедур, проводимых больным.
По мнению F. Du Coin [95], если осно-
ву успеха имплантации закладывают
врач-хирург и ортопед, то впоследствии
функционирование и долговечность
имплантата зависят от ухода за ними,
осуществляемого в том числе самим па-
циентом, а также от процедур, прово-
димых пародонтологом и гигиенистом.
При диспансерном наблюдении по-
сле имплантации до начала гигиениче-
ских процедур хирург или терапевт (ги-
гиенист) определяет гигиенические и
пародонтологические индексы [45].
Врач-ортопед проверяет адекватность
нагрузки на имплантат или имплантаты.
Для оценки эффективности гигиени-
ческих процедур следует использовать
Рекомендации ВОЗ № 621 (1980),
№ 713 (1983) (ВОЗ. Серия технических
докладов № 621. Эпидемиология,
этиология и профилактика болезней
пародонта. Женева, 1986, 62 с.).
Применяют специальные индексы,
соответствующие количеству и качест-
ву зубных отложений, в том числе тол-
щине и площади зубного налета, его
химической и микробиологической ха-
рактеристике. Для окраски зубов поль-
зуются различными красителями. Наи-
более часто применяют реактив Шил-
лера-Писарева, 1—2 % раствор мети-
ленового синего или краску по пропи-
си Н. Kotzschke (цинка йодид 12 г, йо-
да кристаллического 40 г, стерилизо-
ванной воды 49 мл, глицерина 80 мл), а
также специальные таблетки, которые,
растворяясь в ротовой жидкости, окра-
шивают зубной камень и зубной налет.
После окрашивания зубов и полоска-
ния полости рта стерильной водой ос-
матривают зубы, в том числе коронки
или мостовидные протезы с опорой на
них. Фиксируют внимание на всех пяти
участках зуба: медиальном, дистальном,
срединно-окклюзионном, центральном
и срединно-пришеечном.
При определении окраски отмечают
ее отсутствие или наличие. Согласно
окраске участков зуба, рассчитывают
индекс и эффективность гигиены, ко-
торая может быть отличной, хорошей,
удовлетворительной и неудовлетвори-
тельной.
Можно использовать также методику
окрашивания и определения упрощен-
ного индекса гигиены ИГР-У, OH1-S
по методу Грен—Вермийона. Этим ме-
тодом определяют раздельно наличие
зубного налета и зубного камня у 6 зу-
бов: на щечной поверхности — первых
верхних моляров, язычной поверхно-
сти — первых нижних моляров и зуб-
ной поверхности верхних резцов. Ре-
зультатам дают следующие оценки: 0 —
отсутствие зубного налета; 1 — мягкий
зубной налет покрывает не более 1/з
поверхности зуба; 2 — мягкий зубной
налет покрывает от 1/з до 2/3 поверх-
ности зуба; 3 — мягкий зубной налет
покрывает более 2/з поверхности зуба.
Коды и критерии наличия зубного
камня определяются: 0 — зубной ка-
мень не выявлен; 1 — наддесневой зуб-
ной камень покрывает не более 1/з по-
верхности зуба; 2 — наддесневой зуб-
ной камень покрывает более 1/з но
менее 2/з поверхности зуба; 3 — над-
десневой камень покрывает более 2/з
зуба. Индекс зубного налета или зуб-
ного камня определяют по формуле:
ИГР-У = сУмма значений налета ц.
количество поверхностей
+ сумма значений камня
количество поверхностей ’
Суммарное значение ИГР-У 3,1—6,0
указывает на плохой уровень гигиены,
1,3—3,0 — удовлетворительный, 0,0—
1,2 — хороший.
Значение показателей зубного налета
или зубного камня: 1,9—3,0 — плохие
показатели, 0,7—1,8 — удовлетвори-
тельные и 0,0—0,6 — хорошие.
Можно оценивать индекс гигиены
полости рта (РНР) по методу Подшад-
лея—Халея.
После применения красителей и по-
лоскания водой у 6 зубов визуально ос-
матривают: у 16 и 26 зубов — щечные
поверхности, у 11 и 31 — губные по-
верхности, у 38 и 46 — язычные по-
верхности. Поверхность каждого зуба
условно делят на 5 участков: 1 — меди-
альный, 2 — дистальный, 3 — средин-
но-окклюзионный, 4 — центральный,
5 — срединно-пришеечный.
На каждом участке определяют ко-
ды: 0 — отсутствие окрашивания, 1 —
392
окрашивание любой поверхности. Ин-
декс гигиены определяют по формуле:
ИГ = ЗН/л,
где ЗН — сумма кодов; л — количество
исследованных зубов. Полученный по-
казатель 0 соответствует отличному со-
стоянию гигиены полости рта, а 1 и бо-
лее — неудовлетворительному.
Диагностическую вакуумную пробу
Кулаженко проводить в области им-
плантата не рекомендуется. После ин-
декса гигиены определяют индекс гин-
гивита и пародонтальный индекс по
Русселю, отмечая степень воспаления
соединения десна — имплантат, под-
вижность имплантата, глубину паро-
донтального кармана и состояние мяг-
ких тканей и кости около внутрикост-
ной части имплантата.
Эффективность имплантации кон-
тролируют при помощи прибора "Perio-
test", который позволяет получить объ-
ективные и независимые показатели
десневого индекса [45, 96, 235J. Воз-
раст и пат пациента, так же как шири-
на и длина имплантата, не влияют на
периотест [243]. Замеры с помощью
системы "Periotest" позволяют выявить
начинающуюся подвижность даже то-
гда, когда на рентгенограммах она еще
не определяется. "Periotest" представ-
ляет собой ручной прибор, состоящий
из двух частей: приборного блока ком-
пьютерного анализа и наконечника,
соединенных между собой кабелем.
Наконечник может колебаться со ско-
ростью 4 цикла в секунду. При верти-
кальном положении головы пациента
колеблющийся стержень подносят к
имплантату. Стержень стучит по им-
плантату, но постепенно его колебания
затухают из-за тормозящего воздейст-
вия имплантата и окружающих его тка-
ней. Время, которое необходимо для
прекращения колебаний, называется
индексом периотеста. При индексе +5 и
менее считается, что имплантат остео-
интегрирован. Более высокие показа-
тели свидетельствуют о фиброзной ин-
теграции. Увеличение индекса указы-
вает на возрастание подвижности им-
плантата, причем значительно раньше,
чем соответствующие признаки появ-
ляются на рентгеновских снимках. По-
сле постановки имплантата и его ста-
бильности лучше нагружать его посте-
пенно, контролируя с помощью пе-
риотеста. Результаты измерений выда-
ются в звуковой форме и в виде циф-
ровой информации на дисплее.
Следует иметь в виду, что высокое
значение индекса зубных бляшек на-
прямую связано с высоким десневым
индексом. С наибольшими трудностя-
ми при определении состояния гигие-
ны полости рта врачу приходится стал-
киваться при полной адентии. В таких
случаях прибегают к другим методам:
бактериологическому с выделением
микрофлоры полости рта, химическо-
му для оценки состава ротовой жидко-
сти и др.
Е. Sporlin и Р. Tetsch [220] считают
перспективным исследование жидкости
десневой борозды. Так, уровень гликоз-
аминогликанов отражает характер со-
единения имплантата с костью и может
быть диагностическим тестом [161]. Об-
наружение других лизосомальных про-
тео-, глико- и липолитических фермен-
тов в жидкости десневой борозды мо-
жет указывать на резорбцию кости, что
также можно использовать с диагно-
стической целью [161]. Статистически
установлена прямая зависимость между
объемом жидкости десневой борозды и
степенью резорбции кости [63]. Однако
Т. Rams и J. Link [196], Р. Aspe и соавт.
[46] полагают, что этот метод недоста-
точно точен, поскольку результат зави-
сит от индивидуальных особенностей
микрофлоры полости рта и индекса ги-
гиены. Как полагают G. Krekeler и со-
авт. [135], Р. Apse [46], микробиологи-
ческая диагностика имеет большие
перспективы при оценке здоровья им-
плантата.
Контроль за приживлением имплан-
тата можно вести также по результатам
исследования клеточного состава дес-
невой жидкости, взятой у интегриро-
ванных имплантатов, с комплексом мо-
ноклональных антител. В раннем по-
слеоперационном периоде G. Seymour и
соавт. [218] во всех пробах обнаружили
признаки воспаления. Т-клетки состав-
ляли 50—60 %, В-клетки — 40—50 %. В
динамике костной интеграции им-
плантатов при клинических признаках
воспаления отмечалось повышение со-
отношения СД4 и КД8. Сравнивая ре-
зультаты иммунологического анализа
костно-интегрированных имплантатов
с иммуногистологическими данными,
авторы считают, что поражение мягких
тканей у костно-интегрируемых им-
плантатов представляет собой стабиль-
ный и хорошо контролируемый про-
цесс. Для оценки приживления им-
плантата можно использовать реогра-
фию, фотоплетизмографию. поляро-
графию. прижизненную микроскопию
и допплерографию [4, 9, 13].
После определения индекса гигие-
ны начинают гигиенические процеду-
ры. По мнению F. Du Coin (951, лучше,
если такой контроль и гигиенические
процедуры проводят в клинике, где
при лечении используют имплантаты.
Очень важно, как поставлены имплан-
таты и протезы на них, как проводится
гигиена самим пациентом, а также ка-
чество лечения и его регулярность.
Если пациент носит постоянно фик-
сированные протезы, их надо снимать
один раз в год [169]. Врач должен про-
водить гигиенические процедуры эле-
ваторами и крючками из пластика, а
также применяя ультразвук [180]. Ин-
струменты из нержавеющей стали и
чистого титана оставляют на поверхно-
сти имплантата царапины, которые в
дальнейшем способствуют прилипа-
нию зубной бляшки [156, 243]. В слу-
чае использования инструментов из
медицинского титана, нержавеющей
стали следует делать не горизонталь-
ные или вергикальные движения, а
только точечные, пытаясь удалить ка-
мень, как бы стряхнуть его. При этом
надо стараться не повредить соедине-
ние имплантат — десна.
После механического снятия зубно-
го камня и налета области шеек и го-
ловок имплантатов обрабатывают вра-
щающимся с малой скоростью резино-
вым манжетом, в том числе с пастой
пемзы средней зернистости [169, 241].
Для чистки используют щетку с элек-
трическим приводом. Применяя для
полирования и очистки опорных го-
ловок имплантатов профессиональные
инструменты, P.-I. Branemark после
двухминутной обработки устанавливал
головки пациентам, которые в течение
7 дней гигиенических процедур не
проводили. Последующий осмотр по-
Рис. 5.73. Уход за имплантатами.
а — гигиена пространства у имплантатов под
зубным протезом; б — гигиена балочной сис-
темы с опорой на имплантаты "Astra Tech.".
казал, что от 52 до 55 % поверхности го-
ловок были одинаково покрыты бляш-
ками, хотя степень их полировки была
различной. В последние 10 лет при ме-
стной обработке тканей во всех случаях
предпочтение отдают растворам хлор-
гексидина или его производных. Боль-
ного обучают самостоятельно проводить
гигиенические процедуры. Для этого
используют специально подобранные
зубные шетки, ершики, нити, иногда
мягкие детские щетки (рис. 5.73).
При гигиенических мероприятиях
H.S. Siirila и М. Копопеп [216] реко-
мендуют щетки, а не пасты или гели,
так как они действуют абразивно на
поверхность имплантата и вызывают
его точечную коррозию. Соприкосно-
вение титанового имплантата с паста-
ми, содержащими незначительное ко-
личество натрия фторида, приводит к
изменению цвета металла и наруше-
нию его поверхности [243].
3Q4
Рис. 5.74. Гигиена супраструктуры имплантатов,
а — электрощеткой; б — щеткой и водой с магнитной зарядкой.
R. Meffert [169] рекомендует ис-
пользовать щетки с нейлоновыми во-
локнами, а также электромеханические
щетки, a F. Du Coin |95] — детские
мягкие щетки. Также рекомендуется
применять для самостоятельной гигие-
ны щетки, используемые в ортодонтии,
и нити, а также щетки с магнитно за-
ряженной водой "Hidro Floss”
(рис. 5.74). Ряд исследователей счита-
ют, что механические процедуры
должны быть очень щадящими. В до-
машних условиях комплекс механиче-
ской очистки полости рта от зубных
бляшек дополняют ирригацией, по-
лосканиями, в том числе 0,12 % рас-
твором хлоргексидина. Каждые 3—4
мес больной должен посещать специа-
листов для контроля функционирова-
ния имплантатов. Врач должен вести
протокол реабилитации после зубной
имплантации.
Статистические данные относитель-
но эффективности имплантации про-
тиворечивы. Через 1—3 года успех им-
плантации отмечен в 92—98 % случаев.
Вместе с тем D. McNamara и соавт.
[168] приводят характерную статисти-
ку: в 9 независимых клинических цен-
трах исследовали 510 имплантатов на
нижней и верхней челюстях через 5 лет
после их постановки. Болес 5 % боль-
ных не явились для проверки, более
чем в 6 % случаев имплантация была
неудачной, чаше это наблюдалось на
верхней челюсти.
Участники Международной Гарвард-
ской конференции по зубной имплан-
тации в 1978 г. постановили, что резуль-
тат имплантации может быть оценен
положительно, если имплантат или
имплантаты функционируют в течение
5 лет и зафиксированы хорошая функ-
ция и эстетика. Объектными крите-
риями признаны: 1) потеря кости не
более чем на */з вертикальной высоты
имплантата; 2) хорошо сбалансирован-
ная окклюзия; 3) подвижность им-
плантата в любом направлении не бо-
лее 1 мм; 4) отсутствие признаков вое-
паления; 5) отсутствие повреждения
соседних зубов; 6) отсутствие наруше-
ния чувствительности ветвей тройнич-
ного нерва.
На конференции, состоявшейся в
1987 г., были установлены более жест-
кие требования к оценке успеха зубной
имплантации. Имплантацию считают
успешной при 85 % положительных
результатов лечения в течение 10 лет
[118].
Протокол реабилитации после зубной
имплантации
I. История лечения с применением
зубных внутрикостных имплантатов
II. Наружное исследование челюстно-
лицевой области:
а) пальпаторное исследование ли-
цевых и шейных лимфатических
узлов;
б) пальпаторное исследование слюн-
ных желез;
в) исследование функции височно-
нижнечелюстного сустава, жева-
тельных мышц, ветвей тройнич-
ного и лицевого нервов.
III. Исследование полости рта:
а) осмотр слизистых оболочек, в
том числе у супраструктуры им-
плантатов и зубных протезов с
опорой на них;
б)пальпаторное исследование че-
люстей;
в) осмотр неба, языка, зева, глотки.
IV. Контроль ткйней периимплантаци-
онной зоны:
а) цвет десны;
б) контур десны;
в) глубина кармана;
г) наличие кровоточивости и выде-
лений из него;
д) контроль десневой борозды —
определение гигиенического ин-
декса.
V. Исследование кости имплантато-
челюстного сегмента:
а)рентгенологическое;
б) визиографическое — цветовое,
объемное, цифровое.
VI. Исследование протезов, других зу-
бов, в том числе антагонистов им-
плантатов.
СПИСОК ЛИТЕРАТУРЫ
1. Александровский Ю.А., Берденш-
тейн Л.М., Аведисова А. С. Психофар-
макотерапия пограничных психиче-
ских расстройств. — М.: ГЭОТАР—
Медицина, 1998. — 245 с.
1а. Александровский Ю.А. Пограничные
психические расстройства. М.: Меди-
цина. 2000. — 495 с.
2. Безруков В.М., Черникис Ф.С., Су-
ров О.И., Матвеева А.И. Применение
имплантатов в стоматологии: Методи-
ческие рекомендации. — М„ 1987. —
35 с.
3. Бизяев А.Ф. Обезболивание у больных
с сопутствующей патологией при про-
ведении операций в условиях стомато-
логической поликлиники: Автореф. ...
дис. д-ра мед. наук. — М., 1989.
4. Вигдерович В.А. Прогнозирование ре-
зультатов хирургического этапа ден-
тальной имплантации: Автореф. дис....
канд. мед. наук. — М., 1991. — 24 с.
5. Гветадзе Р.Ш. Комплексная оценка
отдаленных результатов дентальной
имплантации: Автореф. дис. ... канд.
мед. наук. — М., 1996. — 25 с.
6. Гончаров И.Ю., Иванов С.Ю. Совер-
шенствование методики формирова-
ния ложа для дентального пластиноч-
ного имплантата // Современные про-
блемы имплантологии. — Саратов,
1996. - С. 46-48.
7. Гончаров И.Ю. Клинико-лабораторное
обоснование и оптимизация примене-
ния отечественных пластиночных им-
плантатов в стоматологической прак-
тике: Автореф. дис. ... канд. мед.
наук. — М., 1999. — 25 с.
8. Егоров П.М., Рабинович С.А. Оптимиза-
ция выбора метода обезболивания
нижнечелюстного нерва. Методические
рекомендации. — М., 1990. — С. 8.
9. Жусев А.И. Микроциркуляторныс на-
рушения слизистой оболочки полости
рта и их коррекция при эндооссаль-
ной имплантации: Автореф. дис.
канд. мед. наук. — М., 1995. — 22 с.
10. Жусев А.И., Робустова Т.Г., Ушаков А-И-
Микроциркуляция в слизистой обо-
лочке при эндооссальной импланта-
ции // Казанский вести, стоматол. -*
1996. - С. 133-134.
11. Иванов С. К)., Ломакин М.В. Разработ-
ка и опыт применения отечественных
остеоинтегрирусмых стоматологиче-
ских имплантатов системы "ЛИКо". В
кн.: "Современные проблемы им-
плантологии". — Саратов, 1998. —
С. 23-24.
396
12. Кулаков А.А. Хирургические аспекты
реабилитации больных с дефектами
зубных рядов при использовании раз-
личных систем зубных имплантатов:
Автореф. дис.... д-ра мед. наук. — М.,
1997. - 27 с.
13. Матвеева А.И. Комплексный метод
диагностики и прогнозирования в ден-
тальной имплантации: Автореф. дис. ...
канд. мед. наук. — М., 1993. — 36 с.
14. Медведев Ю.Э. Дезинфекция и стери-
лизация // Стоматология для всех. —
1998. - № 2. - С. 36-39.
15. Муковозов И.Н. и др. Особенности
анестезиологического обеспечения в
челюстно-лицевой хирургии. — СПб.:
Специальная литература, 1998. —
С. 34-64.
16. Никитин А.А. Зубные имплантаты при
челюстно-лицевых операциях на че-
люстях // Материалы городской кон-
ференции по имплантологии. — М.,
1997.
17. Параскевич В. Л. Применение порис-
тых дентальных имплантатов из титана
(отдаленные результаты клинических
наблюдений) // Новости стоматоло-
гии. - 1996. - N? 2-3. - С. 54-58.
18. Перова Л. Некоторые организацион-
ные аспекты оказания помощи с при-
менением метода зубной имплантации
в амбулаторной практике // Клин, им-
плант. и стоматол. — 1998. — № 2. —
С. 39-45.
19. Рабинович С.А. и др. Как выбирать
местноанестезирующие препараты //
Клин, стоматол. — 1999. — № 1. —
С. 58-62.
20. Робустова Т.Г, Ушаков А.И., Абу Асали
Эяд и др. Клинические, математиче-
ские, иммунологические аспекты зуб-
ной имплантации: Методические ука-
зания. — М., 1987. — 26 с.
21. Робустова Т.Г, Ушаков А.И. и др. 13-
летний опыт дентальной эндоссаль-
ной имплантации // Казанский вестн.
стоматол. — 1996. — С. 136.
22. Робустова Т.Г Зубная и челюстно-ли-
цевая имплантация. В кн.: Хирургиче-
ская стоматология. — 2000. —
С. 653-665.
23. Робустова Т.Г, Стародубцев В.С. Обез-
боливание. В кн.: Хирургическая сто-
матология. — М.: Медицина, 2000. —
С. 35-99.
24. Робустова Т.Г, Федоров И.В. Немед-
ленная имплантация зубов // Пробл.
стоматол. и нейростоматол. — 1997. —
№ 3.
25. Робустова Т.Г, Федоров ИВ. Отсро-
ченная зубная имплантация // Совре-
менные проблемы имплантологии. —
Саратов, 1998.
26. Робустова Т.Г, Безруков В.М. Зубная
и челюстно-лицевая имплантация //
Хирургическая стоматология и челюст-
но-лицевая хирургия. — 1999 —
С. 1040-1072.
27. Робустова Т.Г, Фех А.Р. Взаимосвязь
параметров мягких тканей лица, ан-
тропометрических показателей лице-
вого скелета, РКТ и МРТ при зубной
имплантации // Вестник Российской
стоматологии. — 2000. — № 5 —
С. 21-23.
28. Суров ОН Зубное протезирование на
имплантатах. — М.: Медицина, 1993. —
205 с.
29. Сидельников А.И. Планирование опе-
рации имплантации с учетом антро-
пометрических параметров лица: Ав-
тореф. дис. ... канд. мед. наук. — М.,
1992. - 20 с.
30. Стреслъ Р. Имплантаты выбор для ка-
ждого типа адентии оральные им-
плантаты Ц Клин, имплантол. и сто-
матол. - 1997. - № 2. - С. 14-24.
31. Стреслъ Р. Лечение полной адентии
нижней челюсти с применением
"Tramus” имплантатов и трехупорных
стабилизирующих рамок // Клин, им-
плантол. и стоматол. — 1998. — N» 2. —
С. 19-23.
32. Ушаков А.И. Применение стоматоло-
гических эндооссальных имплантатов
у пациентов после одонтогенного ос-
теомиелита нижней челюсти // Ка-
занский вестн. стоматол. — 1996. —
№ 2. — С. 140.
33. Ушаков А.И. Сравнительная оценка
применения имплантатов плоской и
круглой формы. Симпозиум по им-
плантологии IV съезда стоматологи-
ческой Ассоциации России. — М.,
1998.
34. Ушаков А.И., Робустова Т.Г. Современ-
ные вопросы стоматологической
имплантологии. — М.: Знание. 1989. —
С. 12.
35. Фиалковский В.В., Иорданишвили А.К.
Операции в полости рта на альвео-
лярных отростках и челюстях. В кн.:
"Клиническая оперативная челюстно-
лицевая хирургия". — СПб.: Специ-
альная литература, 1998. — С. 193—
236.
36. Чепулис С.П., Черникис А.С., Суров О.Н.
Применение металлических импланта-
тов в стоматологии: Методические
рекомендации. — Каунас. 1984. — 42 С.
37. Черникис А.С. Особенности хирургиче-
ских вмешательств при введении эн-
дооссальных, субпериостальных, эн-
додонто-эндооссальных конструкций
металлических имплантатов в целях
ортопедического лечения в стомато-
логии: Автореф. ... дис. канд. мед. на-
ук. — Каунас. 1988. — 28 с.
38. Adams D. The granulomatous inflamma-
tory response // Amer. J. Pathol. —
1976. - Vol. 84. - P. 164.
39 Adams P. Anchoring means for false
teeth // US Patent. N 2.112.007. I
March 22, 1938.
40. Adell R., Lekholm U., Rockier B., Brane-
mark P-L A 15-year study of osscointe-
grated implants in the treatment of the
edentulous jaw // J. Oral Maxillofac.
Surg. - 1981. - N 10. - P. 387-416.
41. Albrektsson T. et al. Osseointegrated tita-
nium implants. Requirements for ensur-
ing a long-lasting, direct bone anchorage
in man // Acta. Orthop. Scand. —
1981. - Vol. 52. - P. 155.
42. Albrektsson T, Zarb G., Worthington P.,
Eriksson A. The long-term efficacy of
currently used dental implants: a review
and proposed criteria of success // I nt. J.
Oral Maxillofac. Impl. — 1986. —
Vol. I.-P. 11-25.
43. Albrektsson T., Sennerby L. Direct bone
anchorage оГ oral implants: Clinical and
experimental considerations of the con-
cept of osseointegration // Int. J. Pros-
thet. - 1990. - Vol. 3. - P. 30-40.
44. Anneroth G., Hedstrom K., Kjeliman O.,
Kandell P., Nordenram A. Endosseous tita-
nium implants in extraction sites // J. Oral
Surg. - 1985. - Vol.14. - P. 50—54.
45. Aparicio C. The use of the Periotest value
as the initial success criteria of an in-
plant: 8 jears peropt // Jat J. Period. Rest
Dent. - 1997.— Vol. 17. — P. 151 —
161.
46. Apse P, Ellen R, Overall C, Zarb G. Mi-
croflora and crevicular fluid collagenase
activity in the osseointegrated dental im-
plant sulcus: A comparison of sites in
edentulous and partially edentulous pa-
tients I I J. Periodont. Res. — 1989. —
Vol. 24. - P. 96-105.
47. Artzi Z., Tai H., Moses O., Kozlovsky A.
Mucosal considerations for osseointe-
grated implants // J. Prothct. Dent. —
1993. - Vol. 70. - P. 427-432.
48. Arzpuman M., Otis L., Kipnis C., Levine D.
Observations of the anterior loop in the
inferior alveolar canal // Int. J. Oral Ma-
xillofac. Impl. — 1993. — Vol. 8, N 3. —
P. 295-300.
49. Ashman A. An immediate tooth root re-
placement: an implant cylinder and syn-
thetic bone combination // J. Oral
Implantol. — 1990. — Vol. 16. — P.
28-38.
49a. Babusch Ch. Dental Implants. The Art
and Science. — Philadelphia — London:
W.B. Saunders Company, 2001. — P. 532.
50. Bahat O. Osseaintegatcd implants in the
maxill tuberosity: report on 45 conscca-
tive patients // Int. J. Oral Maxillofac.
Impl. - 1992; 7; P. 459-467.
51. Bahat O. Treatment planning and place-
ment of implants in the posterior maxil-
lae: report of ansecutive Nobelpharma
implants // Int. J. Ora) Maxillofac.
Impl. - 1993 - Vol. 8. - P. 151-161.
52. Baier R., Carter T., Sorensen S. et al. Ra-
dio frequenca gas plasma (glow discharge)
disinfection of dental operative instru-
ments. including handpieces // J. Oral
Impl. - 1992 - Vol. 18. - P. 236-242.
53. Balshi T., Lee H., Hernandes R. The use
of pterygomaxillary implants in the par-
tially edentulous patient: preliminary re-
port // Int. J. Oral Maxillofac. Impl. —
1995. - Vol. 10, N l.-P. 89-98.
54. Barzilay L, Graser G., Iranpour B., Natiel-
la J., Proskin H. Histologic and clinical
assessment of implants placed in extrac-
tion sockets (abstract 1452) // J. Dent.
Res. — 1990. — Vol. 69 (spec. iss.). —
P. 290.
55. Barzilay I. Immediate implants: their
current status // Int. J. Prosth. —
1993. - Vol. 6. - P.169.
56. Barzilay I., Graser G., Iranpour B. et al.
Immediate implantation of a pure titani-
um implant into an extraction socket: re-
port of a pilot procedure // Int. J. Oral
Maxillofac. Impl. — 1991. — Vol. 6. —
P. 277.
57. Bavitz J., Ham S., Hansen C., Lang M.
An anatomical study of mental neurovas-
cular bundle-implant relationships //
Int. J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 580-582.
58. Beals R., Zejkove M. Tatym custom ram-
us implants multiple options including
treatment for combination cyndroms //
J. Oral Imp. - 1992. - Vol. 18. -
P. 257-262.
59. Becker IK, Becker B. Guided tissue re-
generation for impants placed into ex-
traction sockets and for implant dehis-
cences: Surgical techniques and case re-
ports I/ Int. J. Periodont. Restor. Dent. —
1990. - Vol. 10. - P. 377-391.
60. Becker B., Lynch S., Lekholm U. et al. A
comparison of three methods for pro-
moting bone formation around implants
placed into immediate extraction sockets:
e-PTFE membrane alone, or with cither
PDGF and IGF-1. DFDB // J. Perio-
dontol. - 1992. - Vol. 63. - P. 929.
61. Recker IK, Dahlin C.. Becker B. et al-
Tire use of e-PTFE barrier membranes for
bone promotion around titanium implants
placed into extraction sockets: a prospec-
tive multicenter study // Int. J. Oral Ma-
xillofac. Impl. — 1994. — Vol. 9, N 1. —
P. 31-40.
62. Becker B<, Becker B., Caffesse R. A com-
parison of demineralized Feese-Dricd
Bone and Autologous Bone to Induce
Bone Formation in Human Extraceiion
Sochets // J. Periodontol. — 1994, —
Vol. 65. - P. 1128-1133.
63. Behneke A., Behneke N., d'Hoedt B.,
Wagner M. Hard and soft tissue reactions
to ITI screw implants: 3-year longitudi-
nal results of a prospective study // Int.
J. Oral Maxillofac. Impl. — 1997. —
Vol. 12. - P. 749-757.
64. Bums D., Unger J., Elswick R. el al. Pro-
spective clinical evalutionn of mandibu-
lar implant over den Tures. Part I: reten-
tion, stabulity and tissue pesponsc // J.
Proshct. Dent. - 1995. - Vol. 73 (4). -
P. 354-363.
65. Beine O. Osseointegrated implant system
// Peterson L. et al. Principles of oral
and Maxillofacial Surgery. — Philadel-
phia: J. Zippincott, 1992. — P. 1133.
66. Bijlani M., Lozada J. Immcdiatelly loaded
dental implants — influence of early func-
tional contacts on implant stability, bone
level integrity, and soft tissue quality: A
retrospective 3- and 6-year clinical analy-
sis // Int. J. Oral Maxillofac. Impl. —
1996. - Vol. 11, N I. - P. 126-127.
67. Bolender C. Indications and Contraindi-
cations for Different Types of Implant
Therapy //J. of Dental Eduction. —
1988. - Vol. 52, N 12. - P. 1987-1990.
68. Block M., Kent J. Placement of endos-
seous implants into tooth extraction sites
U J. Oral Maxillofac. Surg. — 1991.—
Vol. 49. - P. 1269-1276.
69. Block M., Winder J. Methods for insur-
ing parallelism of implants placed simul-
taneously with maxillary sinus bone grafts
// J. Oral Maxillofac. Surg. — 1991.—
Vol. 49. - P. 435-437.
70. Boyne P. Hydroxyapatite coatings on
dental implants (bone response to hy-
droxyapatite) //J. Oral Impl. — 1994. —
Vol. 20, N 3. - P. 227-231.
71. Bragger U., Hammerle C., Lang N. Im-
mediate transmucosal implants using the
principle of guided tissue regeneration //
Clin. Oral Impl. Res. — 1996. —
Vol. 7. - P. 368-276.
72. Bragger U., Huge!- Pisoni C., Burgen W. et
al. Correlation between radiographic, cli-
nical and mobility parameters after loading
of oral implants with fixed partial den-
tures. A 2-ycar longitudinal study // Clin.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
Oral Impl. Res. — 1996. — Vol. 7 —
P. 230-239.
Branemark P.-L et al. An experimental
and clinical study of osseointegrated im-
plants penetrating the nasal cavity and
maxillary sinus // J. Oral Maxillofac.
Surg. — 1984. — Vol. 42. — P. 497.
Branemark P.-L, Zarb G., Albrektsson T.
Tissue-integrated prostheses. Osseointe-
gration in clinical dentistry. — Chicago —
London — Berlin: Quintessence, 1985. —
P. 29.
Breine U., Branemark P. Reconstruction
of alveolar jaw bone. An experimental
and clinical study of immediate and per-
formed aullogous bone grafts in combi-
nation with osseointegrated implants //
Scand. J. Plast. Reconstr. Surg. — 1980.
- Vol. 14. - P. 23-48.
Buser D., Schroeder A., Sutter F., Lang N.
The new concept of ITI hollow-cylinder
and hollow-screw implants: part 2. Clinical
aspects, indicationes and early clinical
results // Int. J. Oral Maxillofac. impl. —
1988. - Vol. 3. - P. 173-181.
Buser D., Bragger U., Lang N., Nyman S.
Regeneration and enlargement of jaw bone
using guided tissue regeneration // Clin.
Oral. Impl. Res. — 1990. — Vol. 1. —
P. 22-32.
Buser D., Warrer K., Karring T. Forma-
tion of a periodontal ligament around ti-
tanium implants // J. Periodontol. —
1990. - Vol. 61. - P. 597.
Buser D., Weber H., Lang N. Tissue inte-
gration of non-submerged implants. 1
year results of a prospective study with
100 ITI hollow-cylinder and hollow-srew
implants // Clin. Oral Impl. Res. —
1990. - Vol. l.-P. 33-40.
Carter D., Schwab G., Spengler D. Ten-
sile fracture of cancelions bone // Asta
Onhop. Scand. — 1900. — Vol. 5. —
P. 733.
Caudill R., Meffert R. Histologic analysis
of the osseointegration of endosseous im-
plants in simulated extraction sockets
with or without e-PTFE barriers. Part 1.
Preliminary findings // Int. J. Periodont.
Restor. Dent. — 1991. — Vol. 11. — P-
207-215.
Cawood J., Howell R. A classification of
the edentulous jaws//J. Oral Maxillofac.
Surg. - 1988. - Vol. 17. - P. 232-236.
Chiche G. Esthetics of anterior fixed res-
torations. Carol Streem (IL): Quintes-
sence publishing, 1993.
Cook S., Kay J., Thomas K., J arc ho M.
Interface mechanics and histology of ti-
tanium and hydroxyapatite coated titani-
um for dental implant application // Int.
J. Oral Maxillofac. Impl. — 1987. —
Vol. 2. - P. 15-22.
85. Cook S., Salkeld S., Gaisser D., Wagner
W. The effect of surface macrotexture on
the mechanical and histologic character-
istics of hydroxyapatite-coated dental
implants // J. Oral Impl. — 1993. —
Vol. 19, N 4. - P. 288-294.
86. Cranin A. Endosteal implants in a patient
with corticosteroid Souce // J. Oral
Impl. - 1991. - Vol. 17. - P. 414-417.
87. Cranin A.. Klein M., Sirakian A., Russel
D., Zee C. Comparison of incisions made
for the placement of dental Implants //
JDR. - 1991. - Vol. 70. - P. 279.
88. Cranin A., Klein M., Simons A. Color at-
las of oral implantology. — New York:
Thieme Medical Publishers, Inc., 1993.
89. Cranin A., Sikakian A., Russel D., Klein
M. The Role of Incision Desing and Lo-
cation in the Healing Processes of Alucol
Ridges and Implant Host sites // Int. J.
Oral Maxillfac. Impl. — 1998. — № 3. —
P. 483-491.
90. Daellenbach K., Hyrley E. et al. Forse and
Moment Distribution Amnong Three Ab-
utament Staggered Versus In Zine-Ar-
rangement // Int. J. Oral Maxillofac.
Impl. - 1996. - Vol. 11. - P. 18-29.
91. Dario Z, Englisch R. Achieving implant
reconstration through belateral man-
diburar nerve repositioning // Amer. Den.
Assoc. - 1994. - Vol. 125. - P. 1612.
92. de Leonardis D., Carg A., Pecora G., An-
dreana S. Osscointegratiion or rough ac-
id-etched implants: one-year follow-up of
placement of 100 minimatic implants. —
1997. - Vol. 12. - P. 65-73.
93. Deporter D., Todesean R., Watson Ph. et
al. Use of the Endopore dental implants
to restore single teeth in the maxillai pro-
tocol and early results // Int. J. Oral
Maxillofac. Impl. — 1998. — Vol. 8. —
P. 263-272.
94. Dewijs F, van Dongen R., De l.ange G.,
De Putter C. Front toot teplacement with
Tubinger (Frialit) implants // J. Oral Re-
habililion. - 1994. - Vol. 21. - P. II-
26.
95. DuCoin F. Dental implant hygiene and
maintenance: home and professional care
// J. Oral Impl. - 1996. - Vol. 22. -
P. 72-79.
96. Engelman M., Sorensen J., Moy P. Opti-
mum placement of osseointegrated im-
plants // J. Prosth. Dent. — 1988. —
Vol. 59. - P. 467.
96a. Engelman M. Clinical Decision Maxing
and Treatment Planning in osseointegra-
tion. — Chicago — Berlin: Quintessence,
1996. - P. 320.
97. Ericsson /., l.ekhokm U., Branemark P.-l.
et al. A clinical evaluation of fixed bridge
restorations supported by the combina-
tion of teeth and osseointegrated titani-
um implants // J. Clin. Pcriodontol. —
1986. - Vol. 13. - P. 307-312.
98. Ericsson I., Nilner K„ Klinge B., Glanlz
P. Radiographical and histological char-
acteristics of submeiged and nonsub-
merged titanium implants // Clin. Oral
Impl. Res. - 1996. - Vol. 7. - P. 20-
26.
99. Evasis R. Special report: evaluating the
benefit-risk of denticly inplants provides
informed consent // J. Oral Impl. —
1991. - Vol. 17. - P. 384-389.
100. Fleming A. The endopore dental implant
system: Implant treatment simplificded //
J. Canadian Dental Association. —
1994. _ Vol. 60, N 9. - P. 785-789.
101. Friberg B., Ivanoff C., Lekholm U. Inferi-
or alveolar nerve transposition in combi-
nation with Brancmark implant treat-
ment I/ Int. J. Periodont. — 1992. —
Vol. 12. - P. 441.
102. Gales T. Three years clinical review of
MA coated titanium cylinder implants //
J. Oral Impl. - 1988. - Vol. 14. - P.
437-454.
103. Golec T., Krauser J. Long-term retro-
spective studies on hydroxyapatite-coated
endosteal and subperiosteal implants //
Dent. Clin. N. Amer. — 1992. —
Vol. 1. - P. 39-65.
104. Gowgiel J. The position and course of the
mandibular canal // J. Oral Impl. —
1992. - Vol. 18. - P. 383-385.
105. Gomez-Roman G., Schalte W., d'Hoedt
B., Axman-Kremer D. The Frialit-2 Im-
plant System: Five Year clinical Expe-
riense in Single-Togth and Immedeately
Postextraction Applications // Int. J.
Oral Maxillofac. Impl. — 1997. —
Vol. 12. - P. 229-309.
106. Green J., Vermillion J. The simplified oral
hygiene index // J. Amer. Dent. Ass. —
1964. - Vol. 68, N 1. - P. 7-13.
107. Hahn J. Clinical Three Year Study of the
Sterri-oss Implant // Iя International
Conferense on Oral Implant for
Dentistry. — Tokyo, 1990.
108. Hahn J. Лекции по оральной
имплантологии. — M., 1999.
108a.Hahn J. Single-stage, Immediate loading,
and Ropless Surgery // J. Oral Impl.
2000. - Vol. 26. N 3. - P. 193-198.
109. Hammerle C., Bragger U., Burgen W.,
Lang N. The effect of subcrestal place-
ment of the polished surface of IT (im-
plants on marginal soft and hard tissues //
Clin. Oral Impl. Res. — 1966. — Vol. 7. —
P. 111 — 119.
110. Harte F. Atlas der preprothctischcn
Operationen. — Munchen: Hanser,
1989.
111. Haider R., Watzek G., Plenk H. Effects of
drill cooling and bone stuturc on IMZ
implant fixation // Int. J. Oral Maxillofac.
Impl. - 1993. - Vol. 8. - P. 83-91.
112. Harris IK, Heaney R. Skeletal renewal
and metabolic bone disease // New Engl.
J. Med. - 1969. - Vol. 280. - P. 193—
303.
113. Hertel R., Blijdorp P., Baker D. A pre-
ventive mucosa flap technique for use in
implantology // Int. J. Oral Maxillofac.
Impl. - 1993. - Vol. 8, N 4. -
P. 452-458.
114. Hipp J., Brunski J., Shephard M., Co-
chran G. Finite element models for im-
plants in bone: Interfacial assumption. —
In: E. Schneider, S. Perren (eds). — Bi-
omechanics: Current Interdisciplinary
Research. Dordrecht // Martinus, The
Netherlands: Nyhofif Publishers, 1985. —
P. 447-452.
115. Hobo S., Ichida E., Garcia L. Osseointe-
gration and occlusal rehabilitation. —
Berlin: Quintessenz, 1989.
116. Hupp J. Health status evaluation. — In:
J. Peterson et al. Contemporary oral and
maxillofacial surgery. — St. Louis: Mos-
by, 1994. - P. 27.
117. Jarvho M. Retrospective analysis of hy-
droxylapatite development for oral im-
plant application // Dent. clin. north
amcr. - 1992. - Vol. 36. - P. 19-26.
118. Jemt T., Laney IK, Harris D. et al. Os-
seointegrated implants for single tooth
replacement: a 1-year report from a mul-
ticcntcr prospective study // Int. J. Oral
Maxillofac. Impl. — 1991.— Vol. 6.—
P. 29-36.
119. Jemt T, Linden B., Lekholm U. Failures
and complications in 127 consecutively
placed fixed parial prostheses supported by
Branemark implants; from prosthetic treat-
ment to firstannual chockar // Int. J. Oral
Maxillofac Impl. — 1992. — Vol. 7. —
P. 40-44.
120. Jensen J., Nock D. Inferior alveolar nerve
repositioning in conjunction with place-
ment of osseointegrated implants: a case
report // J. Oral Maxillofac. Surg. —
1987. - Vol. 63. - P. 263.
121. Jovanovic S., Spiekermann H., Richter E.
Bone rcgcration around titanium dental
implants in dehisced defect sites: a clini-
cal study U Int. J. Oral Maxillofac.
Impl. - 1992. - Vol. 7. N 2. -
P. 228-232.
122. Jung K, Han C. A year radiograhpic
evaluatiion of marginal Bone around
dental implants // Int. J. Oral Maxillo-
fac. Impl. - 1996. - Vol. 11. -
P. 811-818.
123. Kapur K. Veterans administration co-op-
erative dental implant study. Comparisons
between fixed partial dentures supported
by blade-vent implants and removable
partial dentures // J. Prothct. Dent. —
1987. - Vol. 59. - P. 499-512.
124. Keller E., Tolman D. Mandibular ridge
augmentation with simultaneous onlay Bi-
as bone graff and ehdoossens implants: a
peliminary report // Int. J. Oral Maxillo-
fac. Impl. — 1992. — Vol. 7. — P. 176—
184.
125. Kent J., Block M. Simultaneous maxillary
sinus floor bone grafting and placement
of hydroxyapatite-coated implants // J.
Oral Maxillofac. Surg. — 1989. —
Vol. 47. - P. 238-242.
126. Kent J., Block M., Finger L et al. Biointe-
grated hydroxyapatite-coated dental im-
plants: five-year clinical observation // J.
>\mer. Dent. Ass. — 1990. — Vol. 121. —
P. 138-144.
127. Kent J., Misiek D. Biomaterials for cranial,
facial, mandibular and TMJ reconstruc-
tion. — In: R. Fonseca, R. Walker (eds):
Oral and maxillofacial trauma. — Phila-
delphia: W.B. Saunders, 1991. —
P. 781-1026.
128. Kinney. Endosteal Dental Implants. —
St. Louis — Baltimore: Mosby. 1991. —
P. 473.
129. Kirsch A., Ackermann K. The IMZ oste-
ointegrated implant system // Dent.
Clin. North Amer -1989. - Vol. 33. -
P. 733.
130. Kirsch A., Ackermann K. IMZ-long-tcrm
survival rates exceed 95 % // Interpore
Update. - 1991. - Vol. 4. - P. 1.
131. Kirsch A. IMZ-manual. — Friedrichs-
feld, 1992.
132. Knox R., Kaudill R., Meffert R. Histologic
evaluation of dental endosseous implants
placed in surgically created extraction
defects // J. Periodont. Rest. Dent. —
1991. - Vol. 11. - P. 365-375.
133. Komisar A., Kyk S., Djoun I. et al. Man-
sibular Reconstruction. — New York —
Stuttgart: Thieme, 1997.
134. Kruger E. Opcrationslehre fur zahnarzte. —
Berlin: Quintessenz, 1982.
135. Krekeler G., Schilli IK, Diemer J. Should
the exit of the artificial abutment tooth
be positioned in the region of the at-
tached gingiva U J. Oral Maxillofac.
Surg - 1985. - Vol. 14. - P. 504—
508.
136. Krump J., Barnett B. The immediate im-
plant: a treatment alternative // Int. J.
Oral Maxillofac. Impl. — 1991. —
Vol. 6, N 1. — P. 19-23.
401
137. Lazzaro R. Immediate implant placement
into extraction sites: surgical and restora-
tive advantages // J. Pcriodont. Rest.
Dent. - 1989. - Vol. 9. - P. 333-343.
138. Ledermann P. Das HA-TI-Konzept.
Neue wege in der implantologic //
Schweiz. Mschr. Zahnheilk. — 1988. —
Vol. 98. — P. 41.
139. I.azarof S., Hobo S., Nowzari H. The im-
mediate load implant system. — Chica-
go — Berlin — London: Quintessence
publ. Co., 1998. - P. 136.
140. LeGeros R. Calcium phosphate materials
in restorative dentistry: a review // Adv.
Dent. Res. - 1988. - Vol. 2. - P. 164-
180.
141. Lekholm U., Adell R., Lindhe J. et al.
Marginal tissue reaction at sseointegrated
titanium fixtures. A cross-sectional retro-
spective study // Int. J. Oral Maxillofac.
Impl. - 1986. - Vol. 15. - P. 53-61.
142. Lekholm U., Ericsson I., Adel R. et al.
The condition of the tissues at tooth and
fixtures abutments supporting fixed
bridges!. A microbiological and hystolog-
ical study // J. Clin. Pcriodontol. —
1986. - Vol. 13. - P. 558-562.
143. Linkow L. Mcsially Tipped Mandibular
Molars // J. Prost. Dent. — 1962. —
Vol. 12. - P. 947-950.
144. Linkow L. The Age of Endosseous Im-
plants I/ Dent. Cone. — 1966. —
Vol. 18. - P. 4-10.
145. Linkow L. Atypical Implantations for
Anatomically Contraindicated Situations
11 Dent. Cone. — 1967. — Vol. 11. —
P. 11-17.
146. Linkow L. The Blade-Vent — a new di-
mention in endosseous implants I I Dent.
Cone. - 1968. - Vol. 11. - P. 3.
147. Linkow L. The Blade-Vent Inplant. Cur-
rent Perspectives // La Promotion
Dentaire. — 1970. — Vol. 10.
148. Linkow L. The endoosseus blads implants
I I Cranin N. Oral Implantologv. —
Springfield. 1971. - P. 161-166.
149. Linkow L. The Two Stage Paiato-I.abial
Juxta-Endosteal Implant Intervention for
Severely Atrophied Edentulous Maxillae
// Dent. Cone. - 1972. - Vol. 12. -
P. 1-12.
150. Linkow L. An Honest Evaluation of
Blade Type Implants // Bull. Hudson
County Dent. Soc. — 1972. — Vol. 41. —
P. 22-24.
151. Linkow L. The Pterygoid Extension Im-
plant, for the Totally and Partially Edentu-
lous Maxillae // Dent. Cone. — 1973. —
Vol. 12. - P. 17-28.
152. Linkow L. Statistical Analyses of 173 Im-
plant Patients // J. Oral Impl. —
1974. — Vol. 4. — P. 540-562.
153. Linkow L. Development of the Five-
Piece Ramus Implant // Int. J. Oral
Maxillofac. Impl. — 1976.
154. Linkow L. Implants for Edentulous Arch-
es. In Essentials of Complete Denture
Prosthodontics by Sheldon Winkler. —
Philadelphia: W.D, Saunders, 1979.
155. Linkow L. Maxillary Pterygoid Extension
Implants: The State of the Art // Dent.
Clin. Non. Amer. — 1980. — Vol. 24.
156. Linkow L. Les Implants Tuberositaires //
Implantologie Orale. — 1981.
157. Linkow L., Donath K., Lemons J. Re-
trieval analysis of a blade implant after
231 months of clinical function // Impl.
Dent. - 1992. - Vol. 1. - P. 37-43.
158. Linkow L. Mandibular Implants //
Calarns. — 1993. — P. 804.
159. Linkow L. The pess-fit anti-rotational
vent-plant cylinder implant // J. Oral
Impl. - 1995. - Vol. 21, N 1. -
P. 40-45.
160. Линков Л., Мохлер M. Обоснование
внутрикостной Blade-Vent импланта-
ции И Клин, имплан. и стомат. —
1998. - № 12. - С. 15-23.
161. Ixist К., Cawood L, Howel R., Embry G.
Monitoring of Tubinger endosseous den-
tal implants by glycosaminoglicans analis
of ginsival crevicullar fluid // Int. J. Oral
Maxillofac. Impl. — 1991. — Vol. 6. —
P. 42-48.
162. Lundgren D., Laurell L. Occlusal aspects
of fixed bridgework supported by endos-
seous implants /I J. Clin. Periodont. —
1993. - Vol. 20.
163. MacGowan D. Atlas chirurgischer ein-
gnfle in der zahnfrztlichen praxis. —
Koln: Deutscher Arzte-Vcriag, 1990.
164. Maeglin В Allgemeine chirurgischc
grundlagen und komplikationen bei der
mplantation // Schweiz. Mschr. Zahn-
heilk. - 1985. - Vol. 95. - P. 838.
165. Malamed S. Handbook of Local An-
esthesia. — Mosby, 1997. — P. 327.
166. Maeglin B. Algemeine chirurgischc
grandlagcn und Konplicationen bei der
Implantation // Schweiz. Mschr. Zahn-
heilk. - 1985. — Vol. 95. - P. 838.
167. McKinney R., Steflik D., Koth D. Evi-
dence for a junctional epithelial attach-
ment to ceramic dental implants: A
transmission electron microscopic study
// J. Periodontol. — 1985. — Vol. 56. —
P. 579-591.
168. McNamara D., van Steenberg he D., Tay-
lor R., Watson R., Hertmann /. A multi-
center Study of Ovcrdcntures Supported
by Branemark Inplants // J. Oral Maxil-
lofac Surg. — 1992. — Vol. 7. —
P. 513-522.
402
169. Molls E., Dunson B., Koch J.P. Evalua-
tion. Diagnosis and Treatment Planning
of Complex Implant Cases. Meeting of
the American Academy of Implant Den-
tristy Atlaud // J. Oral ImpL — 1996. —
Vol. 22, N I. - P. 12-16.
\ 69a. Meffert R. The soft Tiossue Interface in
Dental Implantology // J. Dent.
Educ. - 1988. - Vol. 53.
170. Misch C.E. Osseointegration and the sub-
merged blade-vent implant // J. Houston
Dist Dent. - 1988. - Vol. 12. - P. 12-
16.
171. Misch C.E. Bonedensity, its effect on
treatment planning, surgical appeoract
healing and progressive loading // Int. J.
Oral Maxillofac. Impl. — 1999. —
Vol. 6. - P. 23-31.
172. Misch C.E. A three-dimensional finite el-
ement analysis of two blade implant de-
signs (thesis) // University of Pittsburgh.
November. — 1989.
173. Misch C.E., Crawford E. Predictable
mandibular nerve locatiion: a clinical
zone of safety // Int. J. Oral Implant. —
1990. - Vol. 7(1). - P. 37-40.
174. Misch C. Classifications and treatment
options of the completely edentulous
arch in implant dentistry // Dentist. To-
day. - 1990. - Vol. 10.
175. Misch C. Bone density effect on treatment
plans, surgical approach, healing and pro-
gressive bone loading // Int. J. Oral Ma-
xiliofac. Impl. — 1990. — Vol. 6. —
P. 23-31.
176. Misch C. Divisions of available bone in
implant dentistry Ц J. Oral Maxillofac.
Impl. - 1990. - Vol. 7. - P. 9.
177. Misch C. The pharmacologic manage-
ment of maxiilarysinus clevatin durgery //
J. Oral Impl. - 1992. - Vol. 18. -
P. 15-23.
Ша. Misch C., Hoar J., Beck G. et al. A Bone
Quality-Based Implant System: A Pelim-
inary Report of stage I & stage II //
Impl. Dentistry. — 1998. — Vol. 7,
N I. - P. 35-40.
178. Misch C. Contemporary' implant dentist-
ry. — St. Luois (MO): Mosbv-Year
Book, 1993.
179. Mumford E. Контроль инфекции в сто-
матологии: Пер. с нем. — М.: Квинт-
эссенция, 1994. — С. 183.
180. Muzzin К., Johnson R., Carr Р., Daffron Р.
The dental hygienist’s role in the mainte-
nance of osseoinlegratcd implants // J.
Dent Hvg. - 1988. - Vol. 62, N 9. -
P. 448-453.
181. Nail G., Stain S., Kohn M., Waite D.
Evaluation of endosseous implants
placed in fresh extraction sites in dogs
(abstract 1906) // J. Dent. Res. —
1990. — Vol. 69 (spec. iss.). — P. 347.
182. Nakazato G., Tsuchiya H., Sato M., Ya-
mandi M. In vivoplaque formation on
Implant Material // Int J. Oral Maxillo-
fac. Impl. — 1989. — Vol. 4. — P. 321 —
326.
183. Nentwig G. Praeoperative planung der
spiitversorgung von einzelzahnliicken mit
implantatcn // Dtsch. Zahnarztl. Z —
1983. - N 38. - S. 699.
184. Newman M., Ftemmig T. Periodontal con-
siderations of implants and implant asso-
ciated microbiota // J. Dent. Educ —
1988. - Vol. 12. - P. 738-743.
185. Niznick G. Selection of Implant Desings
Based on Quality of Bone // Internation-
al conference on Oral Implant for
Dcntrystry. — Tokio, 1990.
186. Niznick G. The Core-Vent implant system
U J. Oral Impl. — 1982. — Vol. 10. —
P. 379—418.
187. Novaes A. Jr., Vigidal G., Novaes A. et al.
Immediate implants placed into infected
sites: A histomorphometric study in dogs
// Int. J. Oral Maxillofac. Impl. —
1988. - Vol. 13. - P. 422-427.
188. Novaes A. Jr., Novaes A. IMZ-implant
placed into extraction sockets on ossoci-
ation with membrane therapic (Gengifex
and porus hidroxylapatite a sase report) //
Int. J. Oral Maxillofac. Impl. - 1992. —
Vol. 7. - P. 536-540.
189. Novaes A. Jr., Novaes A. Immediate im-
plants placed into infected sites: A clini-
cal report // Int. J. Oral Maxillofac.
Impl. - 1995. - Vol. 10. - P. 609-
613.
190. Nystrom E., Kahnberg K., Gunne J. Bone
grafts and Brancmark implants in the
treatment of the severely resorbed maxilla:
a 2-year lonitudinal study // Int J. Oral
Maxillofac. Impl. — 1993. — Vol. 8. —
P. 45-53.
191. Ogiso M., Tabata T, Lee R., Borgese D.
Delay method of implantation enhances
implant-bone binding: a comparison with
the conventional method // Int. J. Oral
Maxillofac. Impl. — 1995. — Vol. 10. —
P. 415-420.
191a. Okazaki V„ Nakai H., Hibino И, Heda M.
Evaluation of Maxillory Sinus, Condition
after Ligomaticus Implant Placement //
16th Annual Meeting. — 2001. — Toron-
to, Canada. — P. 64.
192. Olive J., Aparicio C. The Periotest me-
thod as a measure of asseointegrated oral
implant stability // Int. J. Oral Maxillo-
fac. Impl. — 1990. - Vol. 5. - P. 390-
400.
193. Pahm A.. Fiorellin B. et al Longirudinal
Radiographic Study of crectal Bone Lev-
els Adjacent to hon submeijcd Dental
Implants U J. Oral Impl. — 1994. —
Vol. 20, N 1. — P. 26-30.
194. Parr G., Steflik D., Sisk A. Histomorpho-
metric and histologic observations of bone
healing around immediate implants in
dogs // Int. J. Oral Maxillofac. Impl. —
1993. - Vol. 8, N 5. - P. 534- 540.
195. Quayle A., Cawood J., Smith G., Howell
R. The immediate or delayed replace-
ment of teeth by pcrmucosal intra-os-
seous implants: The Tubingen implant
system. Part 2: Surgical and restorative
techniques // Brit. Dent. J. — 1989. —
Vol. 166. - P. 403-410.
196. Rams T Link C. Microbiology of failing
dental implants in humans: electron mi-
croscopic observations // J. Oral
Impl. - 1983. - Vol. 11. - P. 93-100.
197. Roberts H., Roberts R. The ramus endos-
seony implant // J. S. Calif. Dent
Assoc. - 1970. - Vol. 38. - P. 571.
198. Roberts R. History of the Ramus Frame
implannt // Alabama Implant Congress. —
Birmingham — Alabama: May. — 1985.
199. Roberts R. Ramus frame mandibular im-
plant: a 16-year preliminary statistical
tistry // Clark J. Clinical dentrystry. —
California, 1987. - P. 1-11.
200. Roberts WC, Smith R., ZUberman V. et al.
Osseous adaptation to continuous loading
of zigid endoosseus implants // Amer. J.
Orthad. - 1984. - Vol. I. - P. 95-
111.
201. Rosenquist B. A comparison of various
methods of soft tissue management fol-
lowing the immediate placement of im-
plants into extraction sockets // Int. J.
Oral Maxillofac. Impl. — 1997. —
Vol. 12. - P. 43-51.
202. Ross S., Strauss T., Cmssetti H., Gargiulo A.
The immediate placement of an endos-
seous implant into an extraction wound: a
clinical case report using the RosTR sys-
tem // Int. J. Periodont. Rest. Dent. —
1989. - Vol. 9. - P. 35-41.
203. Sailer H. A new method of inserting en-
dosseous implants in totally atrophic
maxillae // J. Cranio-Maxillofac. Surg. —
1989. - Vol. 17. — P. 299.
204. Salman L., Kinney L. Clinical reeaponsc
of hard tissue replacement (HTR) poly-
mer as an implant material in oral sur-
gery patients // J. Oral Impl. — 1992. —
Vol. 18. - P. 24-28.
205. Schart D., Tarnow D. The effect of orestal
versus nucobuccal incisious on the suc-
cess irate of implant osseointegration //
Int. J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 87-100.
206. Schiche G.J.. Block M.S., Pinault A. Im-
plant surgical template fro partially eden-
tulous patients // Int. J. Oral Maxillofac.
Impl. - 1989. - Vol. 4. - P. 289-292.
207. Schiche G. Esthetics of Anterior Fixed
Restorations Carol Stream // Quintes-
sense Publishing. — 1993.
208. Schnitman P. et al. Three-year survival
raates. Blade implants vs. cantilever clinical
trials, abstract // J. Dent. Res. — 1988. —
Vol. 67 (special issue). — P. 347.
209. Schnitman P., Wohrle P., DaSilva J.,
Wang N. Branemark implants loaded at
implant placement: 9-year Follow-up //
Int. J. Oral Maxillofac. Impl. — 1966. —
Vol. 11, N 1. - P. 124.
210. Schroeder A., Suffer E, Klikeler G. Oral
Implantologie. — Stuttgart: Thimc, 1990.
211. Scott R., Razzoog M., Yaman P. Conse-
quences of inadequate bone healing before
implant surgery // J. Prosthet. Dent. —
1989. - Vol. 61. - P. 399-401.
212. Sailer H. К new method of inserting en-
doosseus implants in totally atrophic
maxilla! // J. Cranio-Maxillofac. Surg. —
1989. - Vol. 17. - P. 229-305.
213. Sevor J., Meffert R.. Block M. The imme-
diate placement of dental implants into
fresh maxillary extraction sites // Pract.
Periodont. Aesthet. Dent. — 1991. —
Vol. 3. - P. 55-59.
214. Sevor J., Meffert R., Cassingham R. Re-
generation of dehisced alveolar bone ad-
jacent to endosseous dental implants uti-
lizing a resorbable collagen membrane:
clincal and histological results // Int. J.
Periodont. Rest. Dent. — 1993. —
Vol. 23. - P. 71-83.
215. Shulman L. Surgical considerations for
implant dentistry // J. Dent. Educ. —
1988. - Vol. 52. - P. 712-720.
216. Siirila H., Kononen M. The effect of oral
topical fluorides on the surface of com-
mercially pure titanium // Int. J. Oral
Maxillofac. Impl. — 1991. — Vol. 6,
N 1. - P. 50-54.
217. Silverstein L., Melkonian R., Kurtz/nan D.
et al. Linear tomography in conjunction
with pantomography in the assessment of
dental implant recipient sites // J. Oral
Imp). - 1994. - Vol. 20, N 2. —
P. 111-116.
218. Seymour G., Gemmel E., Lenz L. et al-
Immunohistological Analysis of the In-
flammatory Infiltrates Associated with
osseointegrated Implants // Int. J. Oral
Maxillofac. Impl. — 1989. — Vol. 4. —
P. 191-198.
219. Schnitman P., Wohrle P., DaSilva J
Wang N. Branemark omplants loaded at
implant placement: 9-ycar Follow-up //
Int. J. Oral Maxillofac. Impl. — 1996. —
Vol. 11(1). — P. 124.
220. Sporlein E, Tetsch P. Sulcusfluidmessung
bci titanimplantaten im zahnlosen un-
terkiefer // Z. Zahnarztl. Impl. —
1986. - N 2. - P. 92.
221. Spiekermann H. Endossalc implantatc bci
totalersatz im unterkiefcr // Dtsch.
Zahnarztl. Z. - 1978. - N 33. - S. 473.
222. Spiekermann H., Jansen V., Richter E. A
10-year follow-up study of IMZ and TPS
implants in the edentulous mandible us-
ing bar-retained overdentures // Int. J.
Oral Maxillofac. Impl. — 1995. —
Vol. 10, N 2. - P. 231-243.
223. Spiekermann H., Donath K., Hassell T.,
Jovanovic S.. Richter J. Color Atlas of
Dental Medicine. Implantology. — New
York: Thieme, 1995. — P. 59—76.
224. Street R. Основные принципы успеш-
ной имплантации 11 Клин, имплантол.
и стоматол. — 1998. — Т. 1. — С. 23—
26.
225. Stock Е. Experimental work on a method
for the replacement of missing tenth by
direct implantation of a metal support
into the alveolus // Amer. J. Orthodont.
Oral Surg. - 1939. - Vol. 25. -
P. 467-472.
226. Strub J., Gobarthuel T, Grander U. The
role of attached gingiva in the health of
pcriimplant tissues in dogs. Part 1. Clinical
findings // Int. J. Periodontol. Res
Dent. - 1991. - Vol. 11. - P. 317-333.
227. Staler A., Hill T. Part II: Mandibular re-
constntctiion combined intra-oral and in
vitro plazement of osseointegrated im-
plants intro a free and bascularized bone
graft // J. Oral Impl. — 1992. —
Vol. 18. - P. 45-53.
228. Takeshita E, Kuroki H., Yamasaki A.,
Suetsugu T. Histopathologic observation
of seven removed endosseous dental im-
plants// Int. J. Oral Maxillofac. Impl. —
1995. - Vol. 10, N 3. - P. 367-372.
229. Tallgren A. The continuing reduction of
the residual alveolar ridgem in complete
dentures weares // J. Prosth. Dent. —
1972. - Vol. 27. - P. 120.
230. Tatum O., Lebowitz M. Anatomic consid-
eration for dental implants // J. Oral
Impl. - 1991. - Vol. 17. - P. 16-21.
231. Tatum H. Maxillary and sinus implant
reconstructions // Dent. Clin. North
Amer. -1986. - Vol. - 30. — P. 207-
229.
232. Tatum H. Lecture presented at Alabama
Implant study group. 1977. — Cited in:
D. Smiler, P. Johnson, J. Lozada,
C. Misch, J. Roscnlicht, H. Tatum et
al. — Sinus lift grafts and endosseous im-
plants. Treatment of the atrophic posteri-
or maxilla // Dent. Clin. North Amer. —
1992. — Vol. 36. — P. 151-186.
233. Tatum H., Lebowitz M., Borger R. Resto-
ration of the atrophic, edentulous mandi-
ble /I J. Oral Impl. - 1994. - Vol. 20
N 2. - P. 124-134.
234. Taylor T. Fixed implant rehabilitation for
the edentulous maxilla // Int. J. Oral
Maxillofac. Impl. — 1991.— Vol. 6.—
P. 329.
235. Teerlinck J., Quirynen M., Darius P., van
Steenberghe D. Periotest: an objective
clinical diagnosis of bone apposition to-
ward implants // Int. J. Oral Maxillofac.
Impl. - 1991. - Vol. 6, N 1. - P. 55—
61.
236. Tetsch P. Enossale implantationen in der
zahnheilkunde. — Muchcn: Hanser,
1991.
237. Tetsch P., Ackermann K. Konsensus-Kon-
ferenz zur implantologie / 18.10.1989 in
Mainz // Z. Zahnarztl. Impl. — 1990. —
N 6. - S. 5.
238. Tolman D. Reconstractive procedures
with endosseous implants in grafted
bone: a review of the literature // Int. J.
Oral Maxillofac. Impl. — 1995. —
Vol. 10, N 3. - P. 275-294.
239. Tracy B., Doremus R. Direct electron mi-
croscopy studies of the bone-hydro.xyap-
atite interface // Biomed. Mat. Res. —
1984. - Vol. 18. - P. 719-726.
240. Tulasne J. Osseointegrated fixtures in the
Pterygoid region / In: P. Worthington,
P.-I. Branemark. — Advanced osseointe-
gration surgery'. Applications in the max-
illofacial region. — Chicago: Quintes-
sence, 1992. - P. 182-188.
241. Thompson-Neal D., Evans G., Meffert R.
Effects of prophilactic treatments on titani-
um, sapphired and hydroxyapatite-coated
implants: An SEM study // Int. J. Para-
dont. - 1989. - Vol. 9. - P. 300-301.
242. Valeron J., Velazquez J. Placement of
screw-type implants in the pterygomaxil-
lary-pyramidal region: Surgical procedure
and prelimenary results // Int. J. Oral
Maxillofac. Impl. — 1997. — Vol. 12. —
P. 814-819.
243. Vaan Scatter D., Wilson C. The periotest
method for determining implants success
// J. Oral Impl. - 1991. - Vol. 17. -
P. 410-413.
244. Valen M. The significance of percursores
in your bone augmentation material.
Proceedings of the 44th annual meeting
and symposium. — Boston, 1995. Oct.
26-29. - P. 41.
245. Viscido A. The submerged blade implant —
a dog histologic study // J. Oral Impl. —
1974. - Vol. 5 (2). - P. 195-209.
246. Wagner W. Implantatmatcrialcn. — In:
P. Tetsch. F.ndossale implantationen in der
Zahnheilkundc. — Miinchen: Hansor,
1991.
247. Warner K., Gotfredsen K., Hjoerting-Han-
son E. et al. Guided tissue regeneration
allowing immediate implantation of den-
tal implants into extraction sockets. An
experimental study in the monkey //
Clin. Oral Impl. — 1991. — Res. 2. —
P. 166.
248. Watzek G., Mailath G., Lil W., Matejka
M. Zur problematik der implantologenen
sinusitis // Dtsch. Zahnarztl. Z. —
1988. - N 43. - S. 1345.
249. Watzek G. Endossaie implantatc in der
oralen chirurgie. — Berlin: Quintessenz,
1993.
250. Watzek G., Haider R., Mensdonff-Pouil-
ly N„ Haas R. Immediate and delayed
implantation for complete restoration of
the jaw following extraction of all residual
teeth: a retrospective study comparing dif-
ferent types of serial immediate implanta-
tion // Int. J. Oral Maxillofac. Impl. —
1995. - Vol. 10. - P. 561-567.
251. Weiss C.M. Differential diagnosis and
treatment planning //J. Oral Impl. —
1982. - Vol. 10, N 1.
252. Weiss C.M. The physiologic, anatomic
and physical basis of oral endosseous im-
plant design // J. Oral Impl. — 1982. —
Vol. 10, N 3.
253. Weiss Ch. Tissue integration of dental en-
dosseous implants: Description and com-
parative analysis of the fibro-osscous inte-
gration and osseous integration systems I I
J. Oral Impl. - 1986. - Vol. 12. -
P. 169-214.
254. Ие/sj Ch. A comparative analysis of fi-
broosteal and osteal integration and other
variables that affect long-term bone main-
tenance around dental implants // J. Oral
Imp). - 1987. - Vol. 13. — P. 467-487.
255. Weiss Ch. Fibro-osteal and osteal inte-
gration: A comparative analysis of blade
and fixture type dental implants support-
ed by cliical trials // J. Dent. Educ. —
1988. - Vol. 52, N 12. - P. 706-711.
256. Weiss Ch. Short- and long-term bone
maintenance surrounding fibro-osteal
and osteal integrated dental implants //
J. Oral Impl. — 1989. — Vol. 15, N 3. —
P. 12-18.
257. Weiss Ch. New Advances in Osteointe-
grated and Fibro-osseointeraded Blate
Form Implant System // 1 International
Conference on Oral Implant for
Dentristey. — Tokyo, 1990.
258. Williams D., Roaf R. Implants in surge-
ry. — Philadelphia: W.B. Saunders Co.,
1973.
259. Wilson T., Schenk R., Buser D., Cochran
D. Implants placed in immediate extrac-
tion sites: A report of histologic and his-
tomctric analyses of human biopsies //
Int. J. Oral Maxillofac. Impl. — 1998. —
Vol. 13. - P. 333-341.
260. Worthington P. Clinical aspects of severe
mandibular atrophy. — In: P. Worthing-
ton, P.-I. Brancmark. — Advanced os-
seointegration surgery. — Berlin: Quin-
tessenz, 1992.
261. Yukna R. Clinical comparison of hy-
droxyapatite-coated titanium dental im-
plants placed in fresh extraction sockets
and healed sites // J. Periodontol. —
1991. - Vol. 62. - P. 468-472.
262. Yukna R. Placement of hydroxyapatite-
coated implants into fresh or recent ex-
traction sites // Dent. clin. North
Amer. - 1992. - Vol. 36. - P. 97-116.
263. L'lrn C. et al. Location of the mandibular
canal within the atrophic mandible // J.
Oral Maxillofac. Surg. — 1993. —
Vol. 31. - P. 370-377.
264. U'eda M., Kaneda T, Takahaschi H. Ef-
fect of hyperbaric oxygen therapy on os-
seointegration of titanium implants in ir-
radiated bone: a preliminary report //
Int. J. Oral. Maxillofac Impl. — 1993. —
Vol. 8. - P. 44.
Глава 6
ДОПОЛНИТЕЛЬНЫЕ ОПЕРАЦИИ ПРИ ЗУБНОЙ ИМПЛАНТАЦИИ
В предыдущих главах отмечались тре-
бования и нормы, которым при зубной
имплантации должны отвечать как
мягкие ткани и кость, так и анатоми-
ческие условия. Однако нередко в по-
лости рта выявляют такие отклонения
от нормы, при которых зубная им-
плантация невозможна. В подобной
ситуации показаны предымплантаци-
онные корригирующие оперативные
вмешательства.
В одних случаях могут потребоваться
дополнительные операции на мягких
тканях, покрывающих альвеолярный
отросток верхней челюсти или альвео-
лярную часть нижней челюсти. Такое
случается тогда, когда нет условий для
благоприятного приживления имплан-
тата из-за рубцовых изменений слизи-
стой оболочки, воздействия слизистых
и мышечных тяжей и складок, прикре-
пляющихся мышц либо не хватает тка-
ней для закрытия имплантационной
конструкции, либо имеются дефекты
мягких тканей, покрывающих остав-
шуюся атрофированную кость челюсти.
В других случаях костных тканей может
быть недостаточно или их количество
предельно допустимо и может возник-
нуть вопрос о пластике кости для им-
плантации. Несмотря на возможности
имплантации в атрофированные участ-
ки верхней [95, 208] и нижней челюстей
[271, 288], особое место занимают до-
полнительные операции, выполняемые
с целью увеличения количества кости
альвеолярных отростков челюстей и за-
крытия дефектов кости.
Восстановительные операции на ко-
стных тканях челюстей должны плани-
роваться сообразно классификацион-
ным требованиям [60, 61, 147, 221].
Помимо предымплантационных опе-
ративных вмешательств, как в ходе им-
плантации, так и после нее нередко
выполняют дополнительные корриги-
рующие операции. Операции произво-
дят по правилам, принятым в хирурги-
ческой стоматологии и челюстно-ли-
цевой хирургии [3, 8, 10, 17, 21, 48, 121,
197]. Большинство дополнительных
операций при зубной имплантации
можно разделить на две группы: опера-
ции на мягких тканях полости рта и на
костных тканях челюстей. Все опера-
ции при имплантации производят с
учетом анатомических и физиологиче-
ских особенностей мягких тканей, их
взаимодействия с костными тканями и
имплантатом, а также необходимости
герметичного закрытия последнего в
ротовой полости. Дополнительные
операции на мягких и костных тканях
для зубной имплантации требуют осо-
бенно тщательной оценки здоровья па-
циента [137, 218]. При предымпланта-
ционной хирургии должны быть учте-
ны возможные будущие взаимоотно-
шения с мягкими тканями, прилегаю-
щими к имплантату [34, 82, 83, 299], и
биомеханические нагрузки на конст-
рукции как опоры зубных протезов
[132].
6.1. Дополнительные операции
на мягких тканях полости рта
6.1.1. Адекватность мягких тканей
при зубной имплантации
Успехи зубной имплантации, высокий
процент приживления имплантатов и
их функционирование во многом зави-
сят от адекватного состояния мягких
тканей и их реакции на чужеродное те-
ло [178, 180]. В одних случаях может
наблюдаться нехватка мягкой ткани
для закрытия погружных имплантатов,
в других могут возникать патологиче-
ские изменения слизистой оболочки,
прилегающей к опорной головке им-
плантата (воспаление, рубцевание, ре-
цессия и др.). D. Hoelscher и A. Simons
[156] считают, что многие неудачи зуб-
407
ной имплантации напрямую связаны с
проблемами мягких тканей, поэтому
нередко приходится предварительно
производить такие операции, как вес-
тибулопластика и трансплантация сли-
зистой оболочки. Характерно, что осо-
бенности реакции мягких тканей на
имплантацию рассматриваются иссле-
дователями главным образом как во-
просы о "замке", создаваемом слизи-
стой оболочкой, об эпителии десневой
борозды и непосредственно прилегаю-
щих к имплантату мягкими тканями
[51, 52, 89|. Проблемы с мягкими тканя-
ми при имплантации проявляются в
форме воспаления слизистой оболочки
[201], гиперплазии десны [270], пери-
имплантита с десневой рецессией и од-
новременной потерей кости [215], об-
нажением резьбы на теле имплантата
1157, 160]. Кроме того, после имплан-
тации неизбежно изменяются мягкие
ткани вокруг опорных головок или
штифтов имплантатов [51,63, 103, 130].
Это связано с тем, что в отличие от
природных зубов у имплантатов не бы-
вает истинной круговой связки, которая
бы плотно срасталась с периостом. По
данным экспериментальных исследова-
ний, проведенных D. Steflik и соавт.
[272, 273], у сапфировых имплантатов,
поставленных собакам, циркулярный
эпителий создавал свободный край, со-
стоящий из мерцательного эпителия и
кератинизированной слизистой обо-
лочки. Последняя располагалась около
имплантата вдоль альвеолярной дуги.
G. Baumann и соавт. (1993) [70] счита-
ют, что такое строение идентично
строению периодонтальной связки ес-
тественных зубов. Кроме того, у шейки
имплантата может образоваться эпите-
лиальная ткань в виде слизистого "зам-
ка" или соединения имплантат — десна,
прикрепляющаяся к поверхности тита-
новой или керамической конструкции.
Присоединение эпителиальной мяг-
кой ткани к имплантату происходит
благодаря гемодесмосомам, включаю-
щим базальную пластину [131, 256,
283]. Однако присоединение это выра-
жено чрезвычайно слабо и волокна со-
единительной ткани не могут создать
оппозицию слизистому "замку", что
часто служит причиной воспаления во-
круг имплантата [144, 145].
О развитии воспаления может свиде-
тельствовать лейкоцитарно-плазмокле-
точная инфильтрация в биоптатах дес-
ны через год после имплантации [30].
Однако Ch. Weiss [298], основываясь на
данных о фиброзной интеграции пло-
ских имплантатов, считает, что не сле-
дует отрицательно оценивать интерпо-
зицию фиброзных тканей в виде соеди-
нения вокруг имплантата. По его мне-
нию, такой "замок" адекватен стабиль-
ности имплантата и его функции. Даже
при таком соединении всегда можно
найти ориентированные соединитель-
нотканные волокна, которые проника-
ют к трабекулам костного ложа и на-
правлены вдоль оси имплантата.
При имплантации на верхней челю-
сти коллагеновые волокна идут от кос-
ти альвеолярной дуги на твердое небо
по его подслизистой ткани и вестибу-
лярной поверхности альвеолярного от-
ростка. При таком расположении во-
локон (от имплантата к гребню и далее
в обе стороны вокруг имплантата) соз-
дается "манжетный" барьер. Эта факты
свидетельствуют, с одной стороны, о
постоянном наличии у имплантата со-
единения из коллагеновых волокон, а с
другой — о том, что наличие коллаге-
новых волокон ограничивает долговеч-
ность имплантатов, особенно в отсут-
ствие остеоинтеграции. У таких им-
плантатов подобный ход соединитель-
нотканных волокон выражен более
значительно, чем у остеоинтегриро-
ванных конструкций [78, 86, 294].
При наличии разных мнений об эпи-
телиальном и соединительнотканном
"замке" вокруг имплантатов все иссле-
дователи сходятся в том, что он играет
роль главного барьера для аутоинфек-
ции полости рта. Именно от него зави-
сит долговечность имплантатов. Опре-
деленное влияние на состояние мягких
тканей оказывают остеоинтеграция,
функциональные нагрузки на имплан-
таты как опоры зубных протезов [15,
132, 252, 256, 283] и инфекция, попа-
дающая в благоприятные для ее разви-
тия условия [215]. В то же время нельзя
не отметить, что потеря эпителиального
“замка" не всегда ведет к потере им-
плантата [57, 111]. Как показала прак-
тика, более критическим фактором яв-
ляется развитие грануляционной ткани-
408
E. Bengazi и соавт. [81] исследовали
мягкие ткани при постановке имплан-
татов Branemark и отметили, что через
6 мес на нижней челюсти рецессия дес-
ны была наиболее интенсивной с
язычной стороны. Авторы связывают
это с недостатком подвижной слизи-
стой оболочки при закрытии имплан-
тата. Интересен отмеченный ими факт,
что рецессия десны была более выра-
жена у женщин, причем преимущест-
венно на нижней челюсти. По мнению
этих исследователей, чтобы создать для
имплантата должный биологический
''замок", следует сразу формировать
слизистую оболочку нужной ширины.
Большинство операций на мягких тка-
нях челюстей производят с целью соз-
дания наилучших условий для закры-
тия имплантата, адекватности их при
формировании соединения десна —
имплантат, а также как предпротезные
оперативные вмешательства. Опера-
ции выполняют по правилам, приня-
тым при вмешательствах на мягких
тканях, покрывающих челюсти и сво-
ды преддверия рта, а также согласно
приемам пластической хирургии [3, 17,
21—23, 37, 38, 137—139]. Многие хи-
рургические приемы аналогичны тако-
вым при лечении заболеваний паро-
донта [148, 158]. Опыт выполнения до-
полнительных операций на мягких
тканях при имплантации невелик и
описан лишь в отдельных сообщениях.
М. Block и J. Kent [90] считают, что эти
операции необходимы в том случае, ес-
ли мягкие ткани скомпрометированы,
особенно при имплантации на беззу-
бых челюстях.
Специалист, планирующий рекон-
струкцию нижней или верхней челю-
сти, должен владеть всеми приемами
операций на них и быть готовым оста-
новить кровотечение, сшить сосуди-
сто-нервный ствол нижнего альвео-
лярного или подбородочного нерва,
закрыть перфорацию в канал нижней
челюсти и верхнечелюстную пазуху,
приостановить вмешательство при пе-
реломе челюсти и сделать остеосинтез.
Он также должен владеть техникой вы-
полнения хирургических манипуляций
на тканях подподбородочной, подниж-
нечелюстной, подглазничной, щечной,
височной областей, в крыловидно-
нижнечелюстном и подвисочном про-
странствах.
6.1.2. Пластика уздечки губы и языка
Укороченную уздечку губы, если она
прикреплена к альвеолярной дуге ши-
роким основанием, следует иссечь на
этом участке по эллипсу в направле-
нии к периосту. К надкостнице слизи-
стую оболочку подшивают на всю глу-
бину десневой борозды, а образовав-
шуюся рану ушивают по всей длине
вместе с надкостницей (рис. 6.1). При
гипертрофии уздечки вследствие трав-
мы зубным протезом или воспалитель-
ных изменениях целесообразно сде-
лать углообразно сходящиеся разрезы
от десневой борозды к альвеолярной
дуге соответственно центру прикреп-
ления уздечки. Отслоив треугольный
лоскут на поверхности альвеолярного
отростка, концы его подшивают к над-
костнице на уровне перехода прикреп-
ленной слизистой оболочки к свобод-
ной у десневой борозды. Образовав-
шаяся раневая поверхность заживает
вторичным натяжением.
В других случаях может потребо-
ваться удлинение уздечки губы. Уздеч-
ку рассекают по всей длине и форми-
руют два треугольных лоскута, которые
взаимно перемещают и фиксируют
тонким или хромированным кетгутом
либо синтетической нитью (рис. 6.2).
В интересах имплантации и после-
дующего протезирования иногда необ-
ходимо удлинить уздечку языка. Это
делают аналогично удлинению уздечки
губы. Следует учитывать расположение
подъязычных сосочков во избежание
их травмирования. Если укорочение
уздечки значительное, то ее рассекают
горизонтально (рис. 6.3). При полном
освобождении языка рана приобретает
форму ромба, что благодаря эластич-
ности тканей позволяет наложить
швы, сблизив края раны по вертикали
[21. 126, 159, 288].
Возможно также удлинение языка
посредством пластики треугольными
лоскутами. Для этого производят
длинный разрез через уздечку, форми-
руют два треугольных лоскута, которые
взаимно перемещают и фиксируют
тонким кетгутом или синтетической
Рис. 6.2. Пластика уздечки губы.
а — линия рассечения уздечки и формирование двух
встречных треугольных лоскутов; б — перемещение
и фиксация встречных лоскутов.
Рис. 6.1. Пластика уздечки губы.
а — линия отсечения уздечки губы;
б — подшивание ее к периосту свода
преддверия рта.
Рис. 6.3. Пластика уздечки
языка (а—в).
нитью [17, 21, 139]. И в этом случае не-
обходимо учитывать расположение
подъязычных сосочков, чтобы не трав-
мировать их (см. рис. 6.3).
При прикреплении уздечки к альве-
олярной дуге ее иссекают углообразным
разрезом. Вершина рассечения уздечки
должна быть обращена к альвеолярной
части нижней челюсти. На нижней по-
верхности языка лоскут отслаивают до
полного освобождения языка. Углооб-
разный лоскут подшивают, а рану уши-
вают наглухо (см. рис. 6.1).
6.1.3. Устранение рубцовых тяжей
и складок слизистой оболочки
преддверия полости рта
Очень часто вблизи альвеолярной дуги
или непосредственно к ней прикреп-
ляются слизистые складки, которые мо-
гут послужить причиной осложнений
при имплантации (расхождение краев
раны, обнажение имплантата, рецессия
десны). В отдельных случаях слизи-
стые складки могут быть рубцово из-
менены. Такие дефекты, мешающие
выполнению хирургических манипу-
ляций, а в будущем протезированию,
устраняют рассечением с образовани-
ем симметричных встречных треуголь-
ных лоскутов, которые мобилизуют и
взаимно перемешают (см. рис. 6.2).
Иссечение избытка и воспалительно-
измененных мягких тканей. Атрофия
альвеолярной дуги часто сопровожда-
ется образованием избытка подвижной
слизистой оболочки. При рассечении и
откидывании слизистых лоскутов для
имплантации приходится иссекать эти
участки по альвеолярной дуге, особен-
но если слизистая оболочка плотная и
рубцово изменена, а главное — под-
вижна и не имеет опоры в виде подле-
жащей кости.
К иссечению избытка слизистой
оболочки приступают, только опреде-
лив в соответствии с планом постанов-
ки имплантатов количество тканей для
их закрытия и глухого зашивания ра-
ны. Ткань поднимают пинцетом, фик-
сируют и двумя сходящимися разреза-
ми рассекают до надкостницы. Нож-
ницами иссекают избыток фиброзно-
измененной слизистой оболочки. При-
меряют ткани для будущего закрыва-
ния раны. Затем рассекают надкостни-
цу по ходу альвеолярной дуги [21]. Ос-
теотомию и постановку имплантата за-
вершают глухим зашиванием раны
(рис. 6.4).
В случае, если слизистая оболочка
сращена с надкостницей и имеет вид
подвижного шнура (рис. 6.5, а, б), мяг-
кие ткани рассекают до кости и избы-
ток их вместе с надкостницей иссекают
Рис. 6.4. Иссечение избыточной мягкой
ткани по гребню альвеолярного отростка
а — линия иссечения; б — линия наложения
швов на мягкие ткани над имплантатом.
эллипсообразными сходящимися раз-
резами, окаймляющими патологически
измененный участок. Слизисто-надко-
стничные лоскуты с вестибулярной и
оральной сторон мобилизуют до сопри-
косновения без натяжения с целью дос-
таточного закрытия имплантата.
При значительных размерах участка
избыточной воспаленной ткани прово-
дят обычное иссечение до надкостни-
цы с ушиванием раны узловыми шва-
ми между непогружными элементами
имплантатов (рис. 6.5, в) или непре-
рывными швами над поставленными в
кость имплантатами (рис. 6.5, г). При
нехватке тканей для ушивания раны
без натяжения ее края пришивают к
надкостнице, а образовавшийся де-
фект заживает вторичным натяжени-
ем, однако на этот участок лучше пе-
ресадить свободный лоскут слизистой
оболочки, деминерализованной кожи
или перикарда. Для обеспечения адек-
Рис. 6.5. Иссечение избыточной мягкой
ткани по гребню альвеолярной душ.
а — избыточная мягкая ткань по гребню аль-
веолярной дуги верхней челюсти; б — линия
разреза и иссечения слизистой оболочки и
надкостницы; в — линия разреза над погруж-
ными имплантатами; г — зашивание тканей
нал погружными имплантатами.
411
ватной глубины преддверия рта целе-
сообразно ношение шины или протеза
на мягкой подкладке, который снима-
ют при перевязках или гигиенических
процедурах.
При ношении плохо фиксируемых
зубных протезов, а также их неадекват-
ности нередко происходит изменение
слизистой оболочки на альвеолярной
дуге и своде преддверия рта в виде
фиброзных разрастаний, что является
препятствием к постановке импланта-
та. В таких случаях необходимо иссе-
чение патологической ткани. Наибо-
лее простые методы — электрокоагуля-
ция и лазерное иссечение. Заживление
раны происходит вторичным натяже-
нием под тампоном. При всех хирурги-
ческих манипуляциях нужно преду-
сматривать создание условий для пред-
стоящей имплантации, в том числе об-
разование слизистой оболочки и свода
преддверия достаточной ширины.
Большое значение в развитии гипер-
пластических изменений имеет хрони-
ческая травма, в том числе вызываемая
плохо фиксированными протезами,
которая может быть причиной папил-
ломатоза, чаще поражающего твердое
небо, преддверие полости рта, гребень
альвеолярной дуги. Изменения слизи-
стой оболочки могут усугубляться вос-
палением пораженных тканей.
Следует учитывать гигиеническое со-
стояние полости рта, наличие грибко-
вой инфекции. Перед операцией целе-
сообразно провести консервативное ле-
чение. Более сложно удаление папилло-
матозных разрастаний слизистой обо-
лочки твердого неба. При оперативном
вмешательстве производят коагуляцию,
лазерное иссечение, обработку' жидким
азотом при помощи бора, а также иссе-
чение патологически измененных тка-
ней до надкостницы скальпелем. Обя-
зательно патологоанатомическое ис-
следование тканей. При закрывании
раневой поверхности повязкой и за-
щитной пластинкой (лучше на мягкой
подкладке) создаются благоприятные
условия для заживления раны вторич-
ным натяжением, которое длится око-
ло 4 нед. Однако вновь образованная
ткань может быть неполноценной для
будущей имплантации, поэтому ране-
вую поверхность лучше закрывать сво-
бодным лоскутом слизистой оболочки
или увеличивать ее размер при помощи
эспандеров-мембран (67].
Коррекцию мягких тканей с исполь-
зованием пластических материалов, с
лазерной обработкой или коагуляцией
тканей проводят до имплантации. Зуб-
ную имплантацию осуществляют через
2—3 мес.
6.1.4. Устранение дефекта
слизистой оболочки местными
тканями
Дефект слизистой оболочки после ос-
теотомии и постановки имплантата
может быть закрыт путем мобилизации
неподвижной и подвижной слизистой
оболочки, пересадки свободных слизи-
стых лоскутов или лоскутов слизистой
оболочки на ножке.
При постановке как погружных, так
и непогружных имплантатов требуется
достаточное количество мягких тканей
дтя зашивания раны наглухо или обес-
печения плотного соприкосновения ее
с супраструктурой. В случае нехватки
мягких тканей или их дефекта может
быть несколько решений. Если имеет-
ся возможность, то дефект слизистой
оболочки закрывают путем сближения
се отсепарованных краев. В отдельных
случаях для этого может потребоваться
расслоение слизистой оболочки и над-
костницы. Несмотря на то что слизи-
стая оболочка за счет ее свободных от-
делов обычно позволяет легко закрыть
рану наглухо, может возникнуть опас-
ность натяжения и расхождения швов
вследствие близости мышц, прикреп-
ляющихся к кости. Глухого зашивания
тканей без натяжения можно также
достичь посредством мобилизации с
помощью дополнительных послабляю-
щих рассечений. Эти манипуляции с
мягкими тканями можно производить
одновременно с имплантацией. В тех
случаях, когда коррекция мягких тка-
ней может создать неблагоприятные
условия для приживления имплантата,
его устанавливают через 2—3 мес.
Увеличение количества мягких тка-
ней достигается пластикой с использо-
ванием взаимоперемещаемых треуголь-
ных лоскутов ио методу Лимберга. Од-
Рис. 6.6. Закрытие имплантата лоскутом
слизистой оболочки на питающей ножке,
а — с передней поверхности альвеолярного от-
ростка; б — с неба; в — с языка.
нако неизбежное при этом нарушение
гемодинамики в оперируемых тканях
может отрицательно отразиться как на
заживлении раны первичным натяже-
нием, так и на интеграции имплантата.
Проблематично при такой операции и
создание у непогружного имплантата
адекватного слизистого "замка". Целе-
сообразно вначале выполнить опера-
цию на мягких тканях, а через 2—3 мес
произвести зубную имплантацию.
Небольшие дефекты слизистой обо-
лочки, особенно над погружным им-
плантатом, закрывают лоскутом на
ножке, взятым с вестибулярной по-
верхности альвеолярного отростка, не-
ба или нижней поверхности языка
(рис. 6.6). Это возможно в связи с тем,
что преддверие и полость рта, в том
числе альвеолярный отросток верхней
челюсти и альвеолярная часть нижней
челюсти, покрыты слизистой оболоч-
кой, поверхностный слой которой
представляет собой многослойный
плоский эпителий. На альвеолярном
отростке верхней челюсти неподвиж-
ная слизистая оболочка плотно спаяна
с надкостницей, а подвижная имеет
подслизистый слой. В нем располага-
ется большое количество кровеносных
и лимфатических сосудов, а также мел-
ких серозных и слизистых желез. С
небной стороны слизистая оболочка
также интимно связана с надкостни-
цей, но по краям в дистальных отделах
на уровне верхних моляров имеет под-
слизистый слой. Эта часть хорошо
снабжается кровью благодаря большой
небной артерии, а также анастомозам
сосудов с восходящей небной артери-
ей, идущей от мягкого неба, что дает
возможность использовать указанные
ткани для мобилизации или формиро-
вания лоскутов на ножке.
При образовании лоскутов на ножке
слизистую оболочку и надкостницу на
небе отсепаровывают от кости до боль-
шого небного отверстия. Затем с по.мо-
шью марлевого тампона стараются
атравматично вытянуть сосудисто-
нервный пучок. Если требуется пере-
местить лоскут, то можно бором рас-
крыть кпереди большое небное отвер-
стие и соответственно переместить со-
судисто-нервный пучок медиальное.
Это позволяет более свободно перемес-
тить лоскут, исключить повреждение
сосудов в нем и обеспечить хорошее
питание тканей. Аналогично формиру-
ют лоскут на ножке со слизистой обо-
лочки преддверия рта и щеки (21, 139].
Пластику лоскутами на ножке мож-
но производить непосредственно в хо-
де имплантации или во время предым-
плантанионных хирургических мани-
пуляций с костными трансплантами.
6.1.5. Пластика свободными
слизистыми и кожными
трансплантатами
При зубной имплантации, если не хва-
тает тканей, наиболее часто прибегают
к пластике свободными лоскутами
слизистой оболочки неба (в том числе
его дистальных отделов), щеки, ниж-
ней поверхности языка, неподвижного
слизистого покрова альвеолярных от-
ростков (рис. 6.7).
Пластика свободными слизистыми
трансплантатами. Отсутствие доста-
точной прикрепленной десны обычно
служит показанием к использованию
свободных десневых трансплантатов
[263]. Кроме того, к переносу свобод-
ного слизистого лоскута на участок де-
фекта следует прибегать тогда, когда
рассечение уздечки верхней губы, сли-
зистых оболочек, мышечных рубцовых
тяжей создает постоянное натяжение
эпителия вокруг имплантата.
G. Raghoebar и соавт. [243] наиболее
мобильными для приживления счита-
ют трансплантаты из слизистой обо-
лочки твердого неба. По их данным, ре-
генеративные свойства трансплантатов
повышали путем помещения их в пита-
тельную среду после иссечения. В даль-
нейшем такие трансплантаты с успехом
использовали при имплантации для за-
крытия дефектов слизистой оболочки.
Для взятия с неба лоскутов неболь-
ших размеров участок слизистой обо-
лочки иссекают, отступив от гинги-
вального края и несколько кпереди от
большого небного отверстия. Если тре-
буется достаточно длинный лоскут, то
формировать его можно на всю длину
неба, производя рассечения параллель-
но изгибу зубной дуги, а в центре —
сзади резцового сосочка (рис. 6.8).
С. Ten Bruggenkate и соавт. [282] реко-
мендуют брать трансплантат с неба
равномерной толщины (от 0,8 до 2 мм)
и адекватный соединительной ткани.
Свободный лоскут, взятый в дис-
тальных отделах, как правило, имеет
слой подслизистой ткани. Ихлишнюю
железистую ткань удаляют. При такой
процедуре трансплантаты следует рас-
секать горизонтально, чтобы иметь
возможность закрыть рану меньшим
трансплантатом. На месте установле-
ния имплантата лоскут тщательно
адаптируют к воспринимающему ложу
и фиксируют тампоном, смоченным
йодоформной жидкостью или йоди-
стой смесью. Хорошо фиксируется и
приживает лоскут под пародонтальной
повязкой. Иногда в лоскуте целесооб-
разно сделать несколько перфораци-
онных отверстий, чтобы под ним не
скапливалась кровь и он лучше приле-
пы к раневой поверхности дефекта.
Раневую поверхность на небе закрыва-
ют марлей, пропитанной йодоформ-
ной жидкостью, или тампоном, смо-
ченным йодистой смесью, маслом ши-
повника, облепихи, и закрывают спе-
циально изготовленной защитной пла-
стинкой. Перевязки делают через день
до 10—14-го дня. Слизистая оболочка
обычно хорошо приживает, а рана на
небе благодаря достаточной васкуля-
ризации участка, соответствующего
молярам, быстро эпителизируется.
По тем же правилам формируют
свободные слизистые лоскуты на ще-
ке, нижней поверхности языка, пере-
ходной складке, неподвижной десне
(рис. 6.9). Методика взятия лоскута
слизистой оболочки и укладывания его
на дефект аналогична таковой при
формировании трансплантата на небе.
Хорошие результаты получены
L. Silverstein и соавт. [263] при исполь-
зовании трансплантатов слизистой
оболочки, взятых с десны. По мнению
этих авторов, плотная неподвижная
б
Рис. 6.7. Взятие слизистых лоскутов из полости рта.
а, б — с неба; в — с щечной области; г — с нижней поверхности языка.
слизистая оболочка десны создает на-
дежный антибактериальный "замок” во-
круг оснований головок имплантатов.
Пластику преддверия рта также произ-
водят с использованием свободных лос-
кутов слизистой оболочки (рис. 6.10).
При обширной зоне рубцовых стя-
жений в области преддверия рта опе-
ративное вмешательство направлено
на создание достаточного свода и за-
ключается в рассечении или иссечении
их с некоторым углублением свода,
эпителизации раны под тампоном или
пластике свободными тканевыми лос-
кутами (см. рис. 6.10). Производят так-
же пересадку на образовавшуюся ране-
вую поверхность свободных лоскутов
слизистой оболочки, взятых с неба,
Щеки, нижней поверхности языка (см.
рис. 6.7).
Операции со свободными слизисты-
ми трансплантатами и всстибулопла-
стика могут быть выполнены на трех
этапах лечения: до и после постановки
имплантатов, после первого этапа им-
плантации или второго этапа и уста-
новки опорной головки (57]. В случае,
если предполагается, что значительное
мышечное натяжение приведет к вос-
палительным изменениям и рецессии
тканей вблизи опорной головки,
Z. Campbell и соавт. [110] рекомендуют
производить операцию за 6—7 нед до
постановки имплантатов. Если же
можно не ожидать воспаления, гипер-
плазии ткани, недостаточной вестибу-
лярной глубины и значительного мы-
шечного натяжения, то пересадку сво-
бодного слизистого трансплантата или
вестибулярное расширение можно вы-
полнить вслед за имплантацией перед
протезированием [156].
Рис. 6.8. Взятие слизистых лоскутов с
дистального участка твердого неба
[Block М., Kent J., 1995].
а — линия разреза; б — расслоение слизистой
оболочки и подслизистой ткани.
Свободные слизистые транспланта-
ты пересаживают на все участки верх-
ней и нижней челюстей, но чаще при
имплантации на нижней челюсти. Это
связано с тем, что ее альвеолярная
часть плотно спаяна с надкостницей и
слизистой оболочкой. В свободной
слизистой оболочке, особенно у ниж-
него свода преддверия рта, много сосу-
дов и нервов, в подслизистом слое
большое количество слизистых желез.
Кроме того, прикрепление к нижней
челюсти мимических и жевательных
мышц (собственно жевательная, щеч-
ная, подбородочная, челюстно-подъ-
язычная, подбородочно-подъязычная
и подбородочно-язычная) может спо-
собствовать натяжению слизисто-над-
костничных лоскутов, поэтому при
пластике также отсекают и отслаивают
пучки мышц (рис. 6.11). Особого вни-
мания требует место постановки
трансплантата на нижней челюсти.
Оно должно быть хирургически подго-
товлено. G. Homing и М. Mullen [157]
рекомендуют рассекать отдельно сли-
зистую оболочку и надкостницу, а
R. Carmichael и соавт. [111] — на пол-
ную толщину этих тканей. Обязатель-
но подсекают неглубокие волокна под-
бородочной мышцы, после чего слизи-
стую оболочку подшивают под периост,
чтобы исключить натяжение и переме-
щение лоскута в неправильное положе-
ние [111]. После этого в созданное ло-
же укладывают лоскут, сшивают его с
краями дефекта или склеивают "Epigli".
Пластика преддверия полости рта
подслизистой тканью. Иногда при зна-
чительной атрофии альвеолярного от-
ростка и наличии оставшейся кости те-
ла верхней челюсти перед имплантаци-
ей производят пластику преддверия
полости рта подслизистой тканью
[236]. Обязательным условием выпол-
нения такой операции является доста-
точное количество слизистой оболоч-
ки на верхней губе и в преддверии по-
лости рта. В центре преддверия полос-
ти рта делают вертикальный разрез
слизистой оболочки и отделяют ее от
подслизистой ткани. Затем рассекают
надкостницу в центре и по наружной
поверхности ее делают поднадкостич-
ный тоннель (соответственно тонне-
лям по обе стороны преддверия полос-
ти рта). Подслизистую ткань иссекают
или перемешают вверх на ножке. На
месте рассечений слизистой оболочки
накладывают узловые швы или непре-
рывный шов. На челюсть надевают
шину или старый корригированный
протез, укрепляя его небным шурупом
или путем подвешивания проволочны-
ми швами. Необходимо следить, чтобы
была хорошо зафиксирована глубина
преддверия полости рта. Через 5—6 нед
после заживления раны приступают к
зубной имплантации.
Пластика свободными транспланта-
тами кожи. Большие возможности для
восполнения мягких тканей свободной
и прикрепленной слизистой оболоч-
кой, покрывающей челюсти, дает пе-
ресадка свободных кожных лоскутов —
тонкого или расщепленного. С этой
целью ткани преддверия полости рта
рассекают до надкостницы. Затем оп-
ределяют величину образовавшегося
дефекта и соответственно лоскута, не-
Рис. 6.9. Взятие слизистого лоскута с неподвижной десны.
а — нал поставленным имплаюатом нс хватает мягкой ткани для его закрытия; б — иссечение сли-
зистого лоскута десны с вестибулярной стороны; в — слизистый лоскут уложен и соединен с мяг-
кими тканями узловыми швами над погружным имплантатом; г — то же вокруг непогружного им-
плантата.
обходимого для его закрытия. Тонкий
кожный лоскут по Tirchu или расщеп-
ленный по Blair—Brown лучше вы-
краивать ручным способом, точно оп-
ределив его размеры путем разметки на
коже. Чаще всего для получения транс-
плантата используют кожу живота,
плеча, бедра, заушной, над- или под-
ключичной области. Топкий кожный
лоскут представляет собой эпидермис
и сосочковый слой кожи толщиной
0,2—0,3 мм. Кожный лоскут лучше
брать пилящими движениями лезвия
бритвы [31] или при помощи скальпе-
ля [21]. Важно, чтобы трансплантат ко-
жи был взят ровным слоем, без вскры-
тия подкожной жировой клетчатки. До
момента окончательной фиксации на
месте дефекта выкроенный лоскут по-
Рие. 6.10. Пластика преддверия рта сво-
бодным слизистым лоскутом.
а — линия разреза у альвеолярной дуги верх-
ней челюсти; б — направления отслоения тка-
ней в преддверии рта; в — вид освободивше-
гося пространства преддверия рта; г — свобод-
ный лоскут уложен по своду собственно пред-
дверия рта.
Рис. 6.11. Перемещение челюстно-подъ-
язычной мышцы вниз.
а — положение мышцы у альвеолярного гребня;
б — смешение мышцы к телу нижней челюсти.
мешают в стерильную емкость с изото-
ническим раствором натрия хлорида.
Соответственно дефекту формируют
марлевый валик, накладывают на него
кожный лоскут эпидермальной сторо-
ной к тампону и фиксируют швами
(рис. 6.12).
Лоскут на тампоне укладывают на
место дефекта и фиксируют направ-
ляющими швами для адаптации к ране-
вой поверхности, следя при этом, чтобы
не было избытка тканей или их заворо-
та. Через 10—12 дней (за это время тон-
кий кожный лоскут приживает на мате-
ринской почве) швы снимают, марле-
вый валик удаляют, а поверх лоскута
рыхло укладывают тампон, смоченный
йодоформной жидкостью, который
фиксируют специально изготовлен-
ным формирующим протезом. Вместо
марлевого вкладыша можно использо-
вать пародонтологическую повязку.
Однако в случае применения тонкого
кожного лоскута необходимо, чтобы
давление повязки было небольшим во
избежание образования пролежня или
некроза кожного трансплантата.
У тонкого кожного лоскута есть оп-
ределенные недостатки. Он может изъ-
язвляться, частично расплавляться или
Рис. 6.12. Пластика преддверия рта тонким кожным лоскутом (Орлова К.А., 1969].
а — рассечение рубцов верхнего и нижнего преддверия рта; б — тонкий кожный лоскут фикси-
рован на марлевом вкладыше; в — в ранах преддверия рта фиксирован тонкий кожный лоскут
на марлевом вкладыше
418
сморщиваться. В таких случаях К.А. Ор-
лова [71] рекомендует последующее тра-
нслирование раны в течение 3—4 нед
проводить как с эмульсионными и
масляными повязками, так и с форми-
рующим протезом.
К пересадке расщепленных кожных
лоскутов для увеличения преддверия
рта прибегают реже, поскольку такие
лоскуты состоят из эпидермиса, сосоч-
кового слоя и части сетчатого слоя ко-
жи. Берут лоскут толщиной 0,3—0,6 мм
нужной величины и помешают его на
тампон. После того как лоскут на там-
поне уложен на место дефекта, его фик-
сируют направляющими швами для
адаптации к раневой поверхности, следя
при этом, чтобы не было избытка тка-
ней или их заворота. Через 10—12 дней
швы снимают и марлевый валик удаля-
ют. В рану укладывают тампон, смо-
ченный йодоформной жидкостью, ко-
торый фиксируют специально изготов-
ленным формирующим протезом в те-
чение 2—3 нед. Свободный расщеплен-
ный кожный трансплантат можно фор-
мировать при помощи дерматома, вы-
пускаемого заводом "Красногвардеец''.
При значительной атрофии альвео-
лярной части нижней челюсти, когда
преддверие рта, альвеолярная дуга и
ткани с язычной стороны находятся в
одной плоскости и нет условий для за-
крытия имплантата или введения пла-
стических материалов, прибегают к
пластике по различным методикам, раз-
работанным Н. Obwegeser [236]. Опера-
ции предусматривают увеличение пред-
дверия и полости рта адекватно поста-
новке имплантатов и зубных протезов.
Необходимо, чтобы высота альвеоляр-
ной части нижней челюсти была не ме-
нее 15 мм.
Вначале заготавливают расщеплен-
ный кожный лоскут толщиной не ме-
нее 4 мм, взяв его с участка, не имею-
щего волос. Делают разрез по альвео-
лярной дуге, отсепаровывают ткани —
слизисто-надкостничный лоскут вме-
сте с мягкими тканями и мышцами
(обычно отделяют всю челюстно-подъ-
язычную и верхнюю части подборо-
дочно-язычной мышцы). Ткани отсе-
паровывают по вестибулярной и языч-
ной поверхностям челюсти и подшива-
ют у ее основания. На обнаженный
участок челюсти укладывают кожный
трансплантат, который по краям дол-
жен соприкасаться с перемещенными
слизисто-надкостничными лоскута-
ми, и фиксируют швами (рис. 6.13). За-
тем на нем фиксируют тампон и наде-
вают шину или формирующий протез,
который закрепляют с помощью окру-
жающего шва. Следует обращать вни-
мание на то, чтобы на лоскут не было
давления, а края шины или протеза
достигали всех участков преддверия у
нижней челюсти. Через 7—10 дней ок-
ружающие швы снимают. Последую-
щие перевязки делают через день в те-
чение 2—3 нед до полного приживле-
ния лоскута; гигиенические процедуры
проводят ежедневно. Протез, форми-
Рис. 6.13. Пластика сводов преддверия рта и собственно полости рта расщепленным
кожным лоскутом.
а — линия разреза по альвеолярной луге (стрелками обозначены направления отслоения тканей);
б — в образованное ложе уложен расщепленный кожный лоскут.
руюший контур ткани, периодически
корригируют. Через 2—3 мес осущест-
вляют зубную имплантацию.
Для благоприятного приживления
расщепленного кожного лоскута важны
атравматичность его при взятии, адек-
ватная подгонка к воспринимающему
ложу как по краям, так и по всей по-
верхности, правильное наложение по-
вязки на него и покой в послеопераци-
онном периоде [21]. Расщепленные лос-
куты могут сморщиваться и рубново де-
формироваться, отчего ухудшается пи-
тание надкостницы и кости. Для их при-
живления требуется 2,5—3 нед и более.
Определенную проблему при транс-
плантации может создать усадка транс-
плантатов. Многие исследователи со-
общали, что из-за рубцевания проис-
ходит общая усадка трансплантатов на
20—40 % [31, 157]. Предпринимались
попытки решить эту проблему разны-
ми путями. Для зашиты трансплантата
в первый период его приживления
R. Brygider и С. Bain [103], как и мно-
гие другие клиницисты, применяли
индивидуально подогнанные стенты.
Другие же для сохранения полученной
глубины преддверия предпочитают
расширять имеющиеся зубные грани-
цы и перебазировать мягкие ткани при
помощи вестибулопластики [ПО]. В то
же время нельзя забывать, что хирур-
гические манипуляции с тканями до-
полнительно травмируют их.
Пластика преддверия полости рта
в области верхней челюсти слизистыми
и кожными трансплантатами. В отдель-
ных случаях, когда планируется фикса-
ция съемного протеза на имплантаты
на верхней челюсти, преддверие по-
лости рта недостаточно для адекватной
фиксации зубного протеза и нехватает
слизистой оболочки на верхней губе, а
проведение пластики подслизистой
тканью может привести к укорочению
губы, показана пластика свободным
слизистым или свободным расщеплен-
ным кожным трансплантатом. Для
этого на участке, где глубина десневой
борозды недостаточна, на границе не-
подвижной и подвижной ткани рассе-
кают слизистую оболочку и отсепаро-
вывают губной или щечный край до
уровня, адекватного глубине преддве-
рия рта. В сформированную рану по
своду преддверия полости рта помеща-
ют расщепленный кожный трансплан-
тат, выкроенный соответственно де-
фекту тканей полости рта. Для увели-
чения преддверия полости рта в сфор-
мированное ложе может быть помешен
свободный лоскут слизистой оболочки
в виде подковы, взятый с неба (см. рис.
6.7, б). Кожный или слизистый транс-
плантат фиксируют пародонтологиче-
ской повязкой и дополнительно фор-
мирующим протезом или шиной. Че-
рез 10—12 дней формирующий протез
или шину корригируют. Коррекцию
проводят до 2—3 мес и более. После
заживления раны приступают к зубной
имплантации. При этом способе пла-
стики послеоперационный период бо-
лее длительный, поэтому зубную им-
плантацию проводят в более поздние
сроки.
Можно использовать также лоскут
на ножке, взятый на верхней губе. В та-
ких случаях остается непокрытым уча-
сток периоста, который заживает вто-
ричным натяжением. Во всех случаях
накладывают шину иди протез, кото-
рые фиксируют путем подвешивания
или с помощью небного винта. Через
6—8 нед приступают к имплантации.
Рассекать мягкие ткани для постанов-
ки имплантата следует с большой ос-
торожностью, так как при заживлении
вторичным натяжением слизистая
оболочка тонкая и может разорваться.
Если предполагается, что значитель-
ное мышечное натяжение приведет к
воспдлительным изменениям и рецес-
сии десны вблизи опорной головки, то
оперировать следует за 6—7 нед до по-
становки имплантатов [ПО]. Если же
предоперационные оценки не предпо-
лагают воспаления, гиперплазии тка-
ни, недостаточной вестибулярной глу-
бины и значительного мышечного на-
тяжения, то пересадку свободного сли-
зистого трансплантата или вестибуляр-
ное расширение можно производить
вслед за имплантацией или перед
окончательным зубным протезирова-
нием [156]. Собственный опыт выпол-
нения дополнительных операций на
мягких тканях у 193 больных показал,
что при зубной имплантации такие
операции чаще производят одновре-
менно с имплантацией или на втором
Рис. 6.14. Замещение недостающей мяг-
кой ткани у поставленных имплантатов
трансплантатом деминерализованной
кожи.
Рис. 6.15. Замещение недостающей мяг-
кой ткани на альвеолярном отростке
трансплантатом консервированного пе-
рикарда, укрепленного к надкостнице и
кости винтами.
хирургическом этапе и реже осуществ-
ляют значительную коррекцию мягких
тканей, вестибулопластику, пластику
свободными слизистыми и кожными
трансплантатами, репозицию мышц
как предымплатационное хирургиче-
ское лечение [41].
Пластика лиофилизированными транс-
плантатами кожи, перикарда. Для вос-
полнения недостающих мягких тканей,
создания слизистого "замка" у имплан-
тата трансплантируют лиофилизиро-
ванную кожу [37, 44]. Этот материал
может быть использован при любых
операциях, если возникает дефицит
тканей, в том числе для имплантации.
По данным гистологических исследо-
ваний, проведенных D. Callan [45], "Al-
loderm" содержит донорские клетки и в
течение 2 мес ремоделируется в соеди-
нительнотканный трансплантат, по-
крытый эпителием. Кроме того, "АПо-
derm" не содержит мертвых клеток, не
имеет иммуноконфликтных свойств,
безопасен в отношении передачи ин-
фекции (в том числе ВИЧ) [207]. Дос-
тоинством кожного аллотрансплантата
является и то, что новую ткань по цвету
трудно отличить от соседней слизистой
оболочки (рис. 6.14). Новые возможно-
сти дает консервированный перикард,
которым также можно замещать дефек-
ты слизистой оболочки около постав-
ленного имплантата (рис. 6.15).
При дополнительных операциях не-
обходимо соблюдать основное прави-
ло: хирургические манипуляции (рас-
сечения, сепарация тканей, гомеостаз,
наложение швов) должны быть щадя-
щими. Именно при соблюдении этих
условий обеспечивается плотное со-
единение пересаженных тканей, опор-
ных головок и штифтов имплантатов.
Особенно важны шалящие действия в
области слизисто-надкостничных лос-
кутов, через которые происходит пита-
ние тканей. При хорошем кровоснаб-
жении слизистых лоскутов и целости
периоста сохраняются локальные
функции остеобластов и хорошее кро-
воснабжение.
Нельзя не отметить, что многие ме-
тоды пластики мягких тканей, в част-
ности вестибулопластика, специали-
сты оценивают неоднозначно. Некото-
рые врачи-ортопеды считают, что пла-
стику преддверия полости рта можно с
успехом заменять использованием бо-
лее совершенных опорных головок. По
мнению Z. Campbell и соавт. [ПО],
Н. Tatum [280], весьма опасны те опе-
рации, при которых одновременно с
постановкой имплантатов дополни-
тельно рассекают мягкие ткани и отсе-
паровывают пучки мышц. Эти авторы
выступают за выполнение таких опера-
ций до постановки имплантатов.
Ведение больных после пластики
мягких тканей заключается в примене-
нии холода в течение 2—3 ч после вме-
шательства, назначении обезболиваю-
щих и противоотечных лекарственных
средств, курса антибиотикотерапии
(8 дней), ежедневных перевязках и туа-
лете полости рта 3—4 раза в день.
Обзор медицинской литературы по
зубной имплантации показывает, что
вопросы хирургических манипуляций
на мягких тканях привлекают большое
внимание специалистов и исследовате-
лей, очевидно, потому, что многие
проблемы состояния мягких тканей,
связанные с зубной имплантацией,
требуют изучения.
6.2. Дополнительные операции
на костной ткани челюстей
6.2.1. Адекватность костных тканей
Трудности, с которыми приходится
сталкиваться хирургу при зубной им-
плантации, связаны с изменениями
кости челюстей. Чаше всего установле-
ние имплантатов осложняет убыль
кости. Атрофии кости челюсти могут
способствовать местные факторы, пре-
жде всего такие как потеря зуба, травма
при удалении зуба и потеря одной из
стенок альвеолы, ношение протезов,
особенно плохо фиксированных. У от-
дельных пациентов процессы атрофии
кости могут прогрессировать в связи с
сопутствующими болезнями и функ-
циональными нарушениями — систем-
ными заболеваниями, в том числе ос-
теопорозом костей у женщин в кли-
мактерическом и постклимактериче-
ском периодах. При зубной импланта-
ции, кроме общеорганных и локаль-
ных факторов, вызывающих атрофию
кости, трудности могут обусловить
анатомические особенности челюстей.
Они формируются как в результате ат-
рофических процессов, так и в связи с
особенностями развития костей лице-
вого черепа.
При установлении имплантатов
трудности могут возникнуть из-за не-
ровного рельефа костной ткани. После
удаления зубов альвеолярные возвы-
шения могут чрезмерно выступать.
Кроме того, во время удаления зубов
стенки зубных альвеол (чаше вестибу-
лярные) могут смешаться, создавая не-
ровности кости. Плохие условия для
имплантационной хирургии и после-
дующего протезирования создаются
также при неравномерности атрофиче-
ских процессов в челюстях, происходя-
щих чаше в вертикальном и передне-
заднем направлениях, диспропорции
челюстей, увеличении расстояния ме-
жду альвеолярными дугами и умень-
шении их ширины [52, 60, 61].
На верхней челюсти в месте соеди-
нения двух отростков, образующих
твердое небо, может быть значительно
выражен небный валик (торус). Потеря
центральных зубов может привести к
увеличению альвеолярного отростка и
неправильным окклюзионным взаи-
моотношениям его с аналогичным от-
делом нижней челюсти. В случае поте-
ри моляров верхней челюсти возмож-
ны неблагоприятные взаимоотноше-
ния с зубами-антагонистами как по
высоте, так и по окклюзии. В связи с
этим может потребоваться уменьше-
ние, увеличение или коррекция формы
альвеолярного отростка.
Трудности при установлении им-
плантатов на нижней челюсти возни-
кают вследствие ее атрофии и сужения
альвеолярной части, в результате чего
выступают или могут иметь острый
край подбородочный бугорок, косая
линия и челюстно-подъязычная ли-
ния. Определенные трудности обу-
словлены изменениями надкостницы.
После удаления зубов слизистая обо-
лочка может рубцово изменяться по
гребню альвеолярной дуги, что в свою
очередь отражается на качестве подле-
жащей надкостницы и кости.
Все подобные изменения мягких
тканей способствуют развитию хрони-
ческих процессов в надкостнице, ухуд-
шению кровоснабжения ее и кости,
что может оказать неблагоприятное
влияние как на первичное заживление
послеоперационной раны, так и на
приживление имплантатов.
Атрофия кости может привести к
снижению свода преддверия полости
дээ
Рис. 6.16. Инструменты для
работы с костью.
а — костные кусачки; б — кост-
ный рашпиль; в — костная ло-
вушка; г — долота; д — прибор
для взятия кости.
рта, прикреплению уздечек губ и языка
к гребню альвеолярного отростка. Сли-
зистые и мышечные тяжи могут при-
вести к ухудшению кровоснабжения
надкостницы и кости, что может небла-
гоприятно отразиться на исходе им-
плантации.
Предымплантационные манипуля-
ции на челюстях направлены также на
устранение указанных изменений в
мягких тканях.
При решении вопроса о дополни-
тельном оперативном вмешательстве,
помимо условий, необходимых для им-
плантации и протезирования, учиты-
вают такие психологические факторы,
как понимание больным необходимо-
сти операций на челюсти, функцио-
нальные и эстетические результаты ор-
топедического и хирургического лече-
ния, которые он ожидает. Особенно
важна психологическая подготовка па-
циента в отношении длительного сро-
ка реабилитации.
Для того чтобы принять решение о
выполнении предымплантационного
оперативного вмешательства, хирург
должен детально изучить историю бо-
лезни пациента по правилам, приня-
тым в хирургической стоматологии, и
определить возможную связь измене-
ний кости с обшей патологией.
Операции на кости производят од-
новременно с хирургическими мани-
пуляциями при постановке импланта-
тов или как предымплантационное
оперативное вмешательство. Операции
на верхней и нижней челюстях выпол-
няют традиционно по правилам, при-
нятым в хирургической стоматологии
и челюстно-лицевой хирургии [1, 22,
23,38,48, 137, 197, 210, 211]. Операции
на костных тканях челюстей всегда со-
провождаются вмешательствами на
мягких тканях [102, 107].
При операциях на кости используют
костные кусачки, рашпили, долота с
молотком (рис. 6.16, а, б). Наиболее
щадящими являются манипуляции на
кости с использованием боров, фрез,
сверл при помощи бормашины с обя-
зательным охлаждением. Следует ис-
пользовать костную "ловушку", чтобы
при работе режущими и сверлящими
инструментами собирались костные
опилки, которые потом можно исполь-
зовать при постановке имплантата (рис.
6.16, в). Для формирования трансплан-
татов применяют долота (рис. 6.16, г), а
для взятия кости — прибор "Bone Har-
vester”, подключаемый к бормашине,
работающий на малых оборотах (рис.
6.16, д).
6.2.2. Резекция костной ткани
челюстей
Альвеолотомия, альвеолэктомия. При
деформации альвеолярного отростка,
наличии у него острых краев произво-
дят альвеолотомию и альвеолэктомию.
В том и другом случае откидывают
слизисто-надкостничный лоскут над
пораженным участком кости. Очень
важно, чтобы надкостница была отсе-
парована единым блоком, нетравма-
тично. При помощи костных кусачек,
костного напильника, бора или фрезы
устраняют деформацию кости, сглажи-
вая выступы, острые края, неровности.
При работе с бормашиной обязательно
охлаждение операционного поля путем
ирригации изотоническим раствором
натрия хлорида. При выполнении этих
действий на нижней челюсти следует
обращать внимание на расположение
подбородочного отверстия и выходя-
щий из него сосудисто-нервный пучок.
После того как кость сглажена, при-
ступают к хирургическим манипуляци-
ям для установления имплантатов.
Резекция части альвеолярного отро-
стка верхней челюсти и альвеолярной
части нижней челюсти. Операция пока-
зана в случае избытка тканей и дефор-
мации кости, когда для зубов-антаго-
нистов нет места и оставшейся кости
достаточно для постановки импланта-
тов. В зависимости от задач импланта-
ции и последующего протезирования
на моделях определяют необходимый
объем резекции кости. Рентгенологи-
чески оценивают расположение носо-
вой полости, верхнечелюстной пазухи,
канала нижней челюсти, подбородоч-
ного отверстия, чтобы избежать их по-
вреждения во время операции. Произ-
водят линейный разрез по альвеоляр-
ной дуге, отсепаровывают слизисто-
надкостничный лоскут. Иногда допол-
нительно делают вертикальный разрез
или разрезы, отсепаровывая углооб-
разные или трапециевидные лоскуты.
Избыток альвеолярной части удаляют
костными кусачками, специальными
пилами при малых оборотах с охлаж-
дением или долотом (рис. 6.17). Бора-
ми и фрезами также с охлаждением
сглаживают поверхность кости. Участ-
ку челюсти придают форму в соответ-
ствии с нужными для протезирования
окклюзионными плоскостями альвео-
лярных дуг и необходимыми для уста-
новления имплантатов шириной и вы-
сотой кости. После этого приступают К
формированию ложа для имплантата
(или имплантатов). Избыток мягких
тканей удаляют с таким расчетом, что-
бы края раны сближались без натяже-
ния и полностью закрывали имплан-
тат. На мягкие ткани лучше наклады-
вать непрерывный шов синтетической
нитью [123]. В отдельных случаях опе-
424
Рис. 6.17. Резекция альвеолярной части нижней челюсти.
а — вид до операции: А — линии рассечения мягких тканей, Б — линия резекции кости: б —
после операции.
рации выполняют поэтапно: на первом
этапе осуществляют резекцию кости,
через 3—4 мсс — имплантацию.
Удаление экзостозов и анатомиче-
ских образовании на нижней челюсти.
Операцию выполняют тогда, когда эти
образования имеют большие размеры,
значительно выражены и после уста-
новления имплантатов могут мешать
протезированию.
На нижней челюсти торусы обычно
располагаются на внутренней поверх-
ности кости соответственно малым ко-
ренным зубам. При наличии зубов они
не создают проблем, но в отсутствие
их, особенно при атрофии кости беззу-
бой нижней челюсти, возможны за-
труднения при конструировании съем-
ного протеза с опорой на имплантаты.
Чаще торусы увеличены с обеих сто-
рон. При значительной выраженности
их удаляют за 2—3 мес до импланта-
ции. Если же торус небольшой или од-
носторонний, то избыточную кость
удаляют во время имплантации.
Разрез делают соответственно плану
имплантации. После озжидывания сли-
зисто-надкостничного лоскута обнажа-
ют участок деформированной кости.
Экзостозы осторожно удаляют бором,
фрезой с охлаждением, костным раш-
пилем. При удаление экзостозов альве-
олярной части нижней челюсти с языч-
ной стороны следует отводить мягкие
ткани тупым крючком для улучшения
обзора кости, помня о расположении
вблизи язычного нерва, артерии, вены,
а также протока поднижнечелюстной
слюнной железы. После нивелировки
кости приступают к имплантации (рис.
6.18). В случае необходимости экзосто-
зы можно использовать как костный
материал.
При удалении торусов перед им-
плантацией по гребню альвеолярной
части нижней челюсти делают разрез
длиной 1 — 1,5 см с обеих сторон челю-
сти на уровне премоляров. Затем с
большой осторожностью отслаивают
слизистую оболочку с надкостницей,
поскольку они часто бывают очень тон-
кими. Поднадкостнично можно ввести
анестетик в зону торуса, удерживая
Рис. 6.18. Удаление экзостозов с языч-
ной стороны нижней челюсти.
мягкие ткани тупым крючком. У верх-
ней части торуса бором с охлаждением
на поверхности кости формируют же-
лобок, в который ставят долото и мо-
лотком сбивают выступ. Кость сглажи-
вают и, уложив слизистую оболочку и
надкостницу, проводят по их поверх-
ности пальцем, оценивая результат. На
рану накладывают узловатые или не-
прерывные швы. В подъязычной об-
ласти язычную поверхность челюсти на
12—24 ч закрывают марлевым тампо-
ном, пропитанным йодоформной жид-
костью, маслом облепихи или шипов-
ника, которые предотвращают образо-
вание гематомы, а также оказывают
противовоспалительное и противо-
отечное действие. В случаях, когда им-
плантат может быть опорой несъемно-
го протеза, торусы на нижней челюсти
лучше не удалять, так как они увели-
чивают толщину кости, что особенно
важно при установлении имплантатов
в форме корня зуба.
При небольших экзостозах и недос-
таточной ширине альвеолярного отро-
стка по альвеолярной дуге или соответ-
ствующей поверхности кости, не-
сколько отступив от экзостоза, делают
разрез (или разрезы) слизистой обо-
лочки и надкостницы, поднадкостично
образуют тоннель, в который вводят
гидроксиапатит или другой биомате-
риал и формируют нужной толщины
ровный альвеолярный отросток [88,
89|. Рану на слизистой оболочке заши-
вают (рис. 6.19). Желательно наложе-
ние на нее формирующей пластинки
или повязки. Через 3—6 мес произво-
дят имплантацию.
Рис. 6.19. Расширение и выравнивание
альвеолярной дуги и альвеолярной части
нижней челюсти биоматериалом.
Рис. 6.20. Уменьшение или удаление че-
люстно-подъязычной линии (А — линия
альвеолярного гребня; Б — выступающая
челюстно-подъязычная линия и линия ее
удаления или сглаживания).
Как при имплантации, так и при
фиксации зубного протеза нередко
возникают трудности при выполнении
манипуляций на нижней челюсти в зо-
не челюстно-подъязычной линии в
связи с чем следует уменьшить или
удалить эту линию. Край кости может
быть острым, тонкая слизистая обо-
лочка, покрывающая его, часто изъ-
язвляется, а прикрепляющиеся в этой
области мышечные волокна нередко
служат причиной расхождения швов
над имплантатом.
Уменьшение челюстно-подъязычной
линии чаще выполняют одновременно
с имплантацией, реже — за 2—3 мес до
нее. Если операцию делают перед им-
плантацией, то линейный разрез про-
изводят по вершине гребня с обеих
сторон на уровне премоляров, отслаи-
вают слизистую оболочку и надкостни-
цу, рассекают и отодвигают мягкие
ткани так, чтобы не повредить языч-
ный нерв (рис. 6.20). Мышцу, прикре-
пляющуюся в месте выпячивания или
на острой поверхности линии, отсека-
ют, оставляя в среднем отделе часть
мышц и фасцию. Бором, фрезой с ох-
лаждением или костным рашпилем
снимают выступающую часть кости и
сглаживают ее. Желательно протез или
шину надеть сразу после наложения на
Л
рану узловатых швов и, как указывает
Е. Kruger [197], в соответствии с необ-
ходимых» снижением дна полости рта
увеличить его оральный край.
При атрофии нижней челюсти пре-
пятствием для зашиты мягких тканей
над имплантатом и адекватной фикса-
ции зубного протеза может быть высту-
пающий подбородочный бугорок (под-
бородочный выступ). Если коррекцию
нельзя осуществить во время имплан-
тации, то бугорок, или выступ, умень-
шают перед имплантацией. Для этого
производят разрез по альвеолярной ду-
ге на уровне резцов. С язычной сторо-
ны отслаивают слизисто-надкостнич-
ный лоскут, отсекают верхнюю часть
подбородочно-язычной мышцы и об-
наженный участок подбородочного бу-
горка, или выступа, осторожно удаляют
долотом или костными кусачками, а
бором или фрезой с охлаждением сгла-
живают поверхность кости. Отсечен-
ные пучки мышц подшивают или ос-
тавляют без фиксации так, чтобы дно
полости рта было снижено [159, 288].
Удаление экзостозов в области неб-
ного валика твердого неба. При им-
плантации на беззубой верхней челю-
сти конструирование съемного зубного
Рис. 6.21. Удаление экзостозов в области
небного валика твердого неба.
а — линия разреза мягких тканей; б — удале-
ние фрагментов экзостоза; в — зашивание
мягких тканей.
протеза на имплантатах и оптимальное
пользование им затрудняют экзостозы
торуса — небного валика. Они могут
быть разной формы и конфигурации,
иногда значительно увеличены и, как
правило, деформируют небный свод. В
таких случаях перед имплантацией эк-
зостозы удаляют. С этой целью произ-
водят разрез по средней линии неба с
послабляющими разрезами под углом
30—45* на переднем и дистальном кон-
цах. Слизисто-надкостничный лоскут
отслаивают в стороны и за края берут
его на лигатуры, обнажая основание
костного выступа. Выступ удаляют до-
лотом и молотком, бором или фрезой с
охлаждением. Нередко выступ прихо-
дится распиливать на несколько фраг-
ментов и кусачками, долотом удалять
его по частям. Делать это следует с пре-
дельной осторожностью, чтобы не пер-
форировать дно носовой полости. По-
верхность кости сглаживают и слизи-
сто-надкостничный лоскут укладыва-
ют на место, пальцем прижимая мяг-
кие ткани к поверхности кости. Избы-
ток последних иссекают и на рану без
натяжения ее краев накладывают узло-
вые швы (рис. 6.21). Для профилакти-
ки образования гематомы на область
неба с небольшим давлением наклады-
вают марлевую повязку, пропитанную
йодоформной жидкостью или йоди-
стой смесью, маслом шиповника, об-
лепихи и др. Желательно фиксировать
такую повязку шелковыми швами. Из-
готовленная защитная пластинка долж-
на быть хорошо фиксирована, но не
оказывать лишнего давления во избе-
жание некроза мягких тканей. В после-
операционном периоде делают пере-
вязки, в полости рта проводят гигие-
нические процедуры с целью профи-
лактики воспалительных явлений. Че-
рез 5—6 нед, а иногда и позже присту-
пают к имплантации.
Если удаляют избыточную кость, то
необходимо рассмотреть вопрос об ее
использовании для улучшения рельефа
кости на других участках, например
около шейки имплантата. Ее можно
использовать изолированно в виде раз-
мельченных опилок, маленьких блоков
или в комбинации с аллокостью, син-
тетической костью.
6.2.3. Костная пластика челюстей
Трудности установления имплантатов
при атрофии кости в дистальных отде-
лах челюстей, вблизи нижнего альвео-
лярного нерва и верхнечелюстной па-
зухи привели к развитию такого важ-
ного направления в зубной импланта-
ции, как операции наращивания кости
[101, 138, 139, 178, 189, 207, 271, 278J.
При имплантации реконструктивные
операции производят по общим прави-
лам выполнения костно-пластических
вмешательств [63, 72, 73, 76, 85, 124,
125, 143, 196, 234, 255, 273]. Чтобы уве-
личить высоту и ширину альвеолярно-
го отростка верхней челюсти и атьвео-
лярной части нижней челюсти, осуще-
ствить репозицию нижнего альвеоляр-
ного нерва, поднять верхнечелюстную
пазуху, закрыть дефекты, а также улуч-
шить условия для остеоинтеграции им-
плантационных конструкций, приме-
няют костные аутотрансплантаты и
разнообразные аллопластические ма-
териалы. Широко используют мате-
риалы на основе биокерамики, ксено-
тканей и их комбинации [23].
Как считает F. Harle [148], наращи-
вание кости обязательно, если челюсть
атрофирована до уровня подбородоч-
ного отверстия на нижней челюсти или
до переднего носового остистого отро-
стка на верхней челюсти.
При зубной имплантации часто при-
ходится увеличивать высоту или шири-
ну альвеолярных отростков челюстей,
а также делать то и другое одновремен-
но. Планирование таких операций тре-
бует математического моделирования
будущей реконструкции кости [43].
Часто возникает необходимость в на-
ращивании кости в переднем отделе
верхней челюсти, так как здесь поста-
новка имплантатов может быть затруд-
нена. Это может быть связано не только
с особенностями анатомического строе-
ния кости, но и с требованиями эстети-
ки мягких тканей, которые должны
быть в полной гармонии с прилежащи-
ми природными зубами. Трудности
обычно возникают потому, что потеря
зубов в переднем отделе верхней челю-
сти почти всегда ведет к потере кости
в сагиттальном (переднезаднем) на-
правлении. Тонкая от природы вести-
булярная стенка челюсти атрофируется
быстро, поэтому создается впечатле-
ние, что кость оставшейся атрофиро-
ванной части альвеолярного гребня
смещается к небу. Поскольку при этом
вестибулярная стенка фактически ста-
новится тонкой пластинкой, при им-
плантации возникает проблема с на-
клоном имплантата и фиксацией его в
сагиттальном положении. В связи с
этим при постановке несъемного про-
теза важно сохранить или исправить
вестибулярный контур альвеолярного
гребня. В таких случаях целесообразен
подход для установления имплантата
или имплантатов с поднятием дна по-
лости носа и верхнечелюстного синуса
с небной стороны [173].
При пневматическом типе верхнече-
люстной пазухи или значительной ат-
рофии альвеолярного отростка верхней
челюсти для имплантации может по-
требоваться реконструкция челюсти —
увеличение ее ширины или высоты и
поднятие дна верхнечелюстной пазухи.
Р. Goods и Р. Blijdorp 1142] считают,
что на верхней челюсти при атрофии
альвеолярного отростка IV и V классов
следует применять комбинированную
методику. Именно такие условия обес-
печивают успех имплантации и созда-
ние хороших окклюзионных взаимоот-
ношений для ортопедического лечения.
На нижней челюсти при атрофии
кости также следует увеличивать высо-
ту и ширину кости. Может оказаться
необходимой и репозиция нижнего
альвеолярного нерва, так как при зна-
чительной атрофии нижней челюсти
сосудисто-нервный пучок, проходя-
щий в канале нижней челюсти и выхо-
дящий из подбородочного отверстия,
часто располагается в области зубной
дуги и даже на поверхности челюсти,
мешая установлению имплантата.
Методы костной пластики. Для им-
плантации костную пластику произво-
дят различными методами, используя
традиционные операции на челюстях
[1,21, 137—139]. После анализа дефек-
та кости, уточнения п.пана лечения оп-
ределяют последовательность реконст-
рукции кости и установления имплан-
татов, величину трансплантата и метод
его фиксации, а также выбирают мате-
риал для устранения дефекта кости.
Различают: 1) костную пластику с фик-
сацией трансплантационного материа-
ла "внакладку"; 2) костную пластику с
фиксацией трансплантационного ма-
териала внутрь кости. Костная пласти-
ка внутрь кости предусматривает вы-
полнение вертикальной и горизон-
тальной остеотомии челюсти с транс-
позицией ее фрагментов и заполнени-
ем образовавшихся пространств био-
материалом или остеотомии с надло-
мом стенки кости, ее частичной транс-
позицией и заполнением образовавше-
гося пространства биоматериалом.
Большинство авторов склоняются к
мнению о необходимости применения
двухэтапных вмешательств при вос-
полнении дефекта кости больших раз-
меров. На первом этапе необходимо
проводить костную пластику, через 6—
8 мес — имплантацию.
Костная пластика с фиксацией
трансплантата "внакладку”. Проводят
подготовку участка кости челюсти.
При рассечении мягких тканей важно
предусмотреть достаточность их для
закрытия трансплантата, хорошее их
кровоснабжение. Необходимо, чтобы
ложе и затем трансплантат были на-
дежно изолированы от полости рта.
Костное ложе следует подготовить к
адаптации трансплантата как по вели-
чине, так и по форме. При пластике
альвеолярных отростков челюстей для
увеличения высоты трансплантат укла-
дывают по альвеолярной дуге (рис.
6.22, а). Для увеличения тела нижней
челюсти трансплантат помещают на ее
основание (рис. 6.22, б). В случае ис-
пользования гребня подвздошной кос-
ти трансплантат-накладка может быть
расщеплен [224].
Костная пластика с фиксацией транс-
плантата внутри кости. Методика поме-
щения трансплантата внутрь кости от-
личается от таковой при ее сквозном
дефекте. Вмешательство производят с
распилом, расщеплением материнской
кости челюстей и помещением транс-
плантата внутрь кости (рис. 6.23). Так-
же должно быть достаточно мягких
тканей для закрытия трансплантата.
При подготовке ложа для фиксации
трансплантата остается костная струж-
ка, которую следует уложить в местах
соединения пересаженной ткани и
Рис. 6.22. Пластика нижней челюсти ауторебром внакладку.
а — со стороны альвеолярной части; б — со стороны основания нижней челюсти.
Рис. 6.23. Костная пласти-
ка верхней челюсти внутрь
кости.
а — линия распила кости; б —
фиксация трансплантата
внутрь кости.
фрагмента челюсти. Можно поместить
гранулированные формы биоматериала
внутрь кости — суба игрально.
Горизонтальная и вертикальная ос-
теотомия челюсти с транспозицией ее
фрагментов и заполнением образовав-
шегося пространства биоматериалом.
Остеотомию производят по общепри-
нятым методикам [22, 23, 137, 226].
Увеличения как высоты, так и ширины
кости челюстей можно добиться гори-
зонтальным или вертикальным распи-
лом кости и перемещением верхних и
нижних или наружных и внутренних
сегментов (95, 100, 239]. Возникающие
при этом пространства заполняют био-
430____
материалом (рис. 6.24). Следует учиты-
вать особенности строения альвеоляр-
ного отростка верхней челюсти и аль-
веолярной части нижней челюсти.
Большую проблему при такой пласти-
ке представляют достаточность мягких
тканей для глухого зашивания раны и
хорошее кровоснабжение ее для благо-
приятного заживления. Также важна
подготовка кости материнского ложа к
восприятию пластического материала-
Все эти факторы определяют опти-
мальное ремоделирование кости. Фик-
сация осуществляется костными шва-
ми проволокой, пластинами и винта-
ми, но лучше использовать традицион-
Рис. 6.24. Костная пластика нижней челюсти внутрь кости.
а при горизонтальной остеотомии; б — при вертикальной остеотомии челюсти.
Рис. 6.25. Остеотомия челюсти для расщепления кости,
а — верхней челюсти; б — нижней челюсти.
ные шины, каппы, формирующие по-
вязки или окружающий шов с модифи-
цированным для каждой клинической
ситуации зубным протезом. Чаще про-
изводят вертикальную остеотомию на
верхней и нижней челюстях с транспо-
зицией фрагментов кости и заполне-
нием образовавшегося пространства
био.материалом. Используют набор Ва-
lai (рис. 6.25).
Остеотомия с надломом стенки кости,
ее частичной транспозицией и заполне-
нием образовавшегося пространства
биоматериалом. Вертикальный распил
Рис. 6.26. Остеотомия челюсти с надломом вестибулярной стенки кости.
а — вил альвеолярного отростка; б — расщепление кости и транспозиция вестибулярной стенки;
в — заполнение образовавшегося пространства биоматериалом.
или расщепление кости с сохранением
интимной связи одной из стенок с над-
костницей дает возможность провести
частичную транспозицию и заполнение
образовавшегося пространства биома-
териалом. Это позволяет увеличить
ширину кости для установления им-
плантата (рис. 6.26). Трудности при
выполнении операции могут быть свя-
заны с нехваткой мягких тканей для за-
крытия введенного внутрь кости био-
материала и имплантатов.
Общие правила пластики челюстей и
зубной имплантации. При выполнении
пластики аутокостью, аллогенными,
ксеногенными и синтетическими мате-
риалами для зубной имплантации необ-
ходимо соблюдать следующие правила.
I. Подготовка материнского ложа для
восприятия трансплантируемого ма-
териала: декортикация поверхности
кости, перфорирование кортикаль-
ной пластинки.
2. Плотное прилегание транспланти-
руемого материала к материнской
кости.
3. Фиксация трансплантируемого ма-
териала винтами, пластинами и вин-
тами, имплантатами, металлической
проволокой, мембранами с винта-
ми, мягкими тканями.
4. Использование стимуляторов роста
кости — морфогенетического про-
теина, плазмы крови, обогащенной
тромбоцитами, остеобластных кле-
ток, полипептидов.
5. Подготовка мягких тканей для глу-
хого зашивания раны, а также вы-
полнение пластики мягких тканей.
6. Костную пластику можно произво-
дить одновременно с зубной им-
плантацией при условии, если поло-
вина тела конструкции по вертикали
или горизонтали будет находиться в
материнской кости. В других случа-
ях костную пластику выполняют как
предымплатационную операцию, а
через 4—8 мес осуществляют зубную
имплантацию.
7. При костной пластике должны быть
запрограммированы размеры рекон-
струируемой кости с точки зрения
будущих окклюзионных взаимоот-
ношений и оптимального планиро-
вания ортопедического лечения.
6.2.4. Пластика аутогенными
костными трансплантатами
Костные аутотрансплантаты использу-
ют в зубной имплантологии на базе ос-
новных методов костно-реконструк-
тивной хирургии челюстно-лицевой
области 113, 21—23, 137].
В последнее десятилетие самым бла-
гоприятным для приживления транс-
плантационным материалом считают
аутогенную кость, так как она содер-
жит жизнеспособные остеобласты И
костные стволовые клетки (см. рис.
1.12). Благодаря совместимости тканей
при использовании таких транспланта-
тов исключается отрицательное воз-
действие чужеродных антигенных про-
теинов. Главное преимущество ауто-
генной кости заключается в том, что
она нс вызывает иммунной реакции.
При зубной имплантации стали ис-
пользовать костные аутотранспланта-
a
Рис. 6.27. Материал аутокости скелета
для пластики челюстей.
а — ребра; б — подвздошной кости; в — боль-
шой берцовой кости.
ты из симфиза, ретромолярной облас-
ти, ветви нижней челюсти, бугра верх-
ней челюсти, свода черепа [38, 41а, 65,
118, 138, 152, 225], а также гребня под-
вздошной кости, ребра, большой и ма-
лой берцовых костей (рис. 6.27).
Первые исследования по аутотранс-
плантации кости при зубной имплан-
тации провели В. Terry и соавт. [284],
U. Breine и Р. Branemark [101], Р. Boyne
и R. James [98], R. Fonseca и соавт.
[138], Е. Keller и соавт. [190], R. Listrom
и J. Symington [206]. Полученные ими
результаты экспериментов и клиниче-
ских исследований были обнадежи-
вающими.
Костно-реконструктивные вмеша-
тельства при зубной имплантации не
являются самоцелью. Они способству-
ют созданию благоприятных условий
для последующей имплантации путем
полного замещения дефекта кости.
Необходимо, чтобы костный транс-
плантат по структуре совпадал со сво-
им ложем или был близок к нему и
имел все элементы, обеспечивающие
полную костную интеграцию. Для ус-
пеха имплантации независимо от сро-
ков трансплантации потеря формы и
объема реконструированной кости
должна быть минимальной [47, 128].
Методики наращивания и реконст-
рукции кости челюсти позволяют оп-
ределять место установления имплан-
татов в зависимости не только и не
столько от количества или анатомии
наличной кости, сколько от идеально-
го положения окончательного протеза.
Эго особенно очевидно при импланта-
ции на передних участках верхней че-
люсти, где адекватный контур губ для
такого протезирования можно созда-
вать путем наращивания кости пласти-
ческими материалами.
Операцию формирования транс-
плантата из гребня подвздошной кости
выполняют под общим обезболивани-
ем. Разрез кожи и подкожной клетчат-
ки производят нал гребнем подвздош-
Рис. 6.28. Формирование костного
трансплантата из гоебня подвздошной
кости [Misch С., 1993].
1 — линия разреза мягких тканей; 2, 3 — линии
распила кости.
Рис. 6.29. Формирование костного
трансплантата с передней поверхности
большой и малой берцовой кости.
1 — линия рассечения мягких тканей; 2 — ли-
ния распила кости; 3 — вид костного транс-
плантата.
Рис. 6.30. Формирование костного
трансплантата из ребра.
1 — линия рассечения мягких тканей и разве-
дения краев раны; 2 — линия распила ребра;
3 — вид трансплантата ребра.
ной кости. Обнажив гребень, рассека-
ют надкостницу и распатором отслаи-
вают ее кнаружи и кнутри соответст-
венно длине и величине будущей ре-
зекции кости. При помощи фрез и пи-
лок аппарата 'Medicon'” с охлаждением
выпиливают трансплантат. Кость в об-
ласти возникшего дефекта сглаживают
и рану ушивают полностью (рис. 6.28).
Для формирования костного транс-
плантата используют большеберцовую,
малоберцовую и лучевую кости. Наи-
более эффективно взятие транспланта-
та с передней поверхности большой и
малой берцовой кости (рис. 6.29).
Для пластики используют фрагмент
цельного или расщепленного ребра.
Операцию взятия ребра также выпол-
няют под наркозом. Разрез кожи и
подкожной клетчатки делают по ходу
ребра, чаще VII, VIII или IX, и длиной
на 1—2 см больше, чем нужная длина
трансплантата. По поверхности ребра
рассекают надкостницу и сдвигают ее
вверх и вниз, освободив ребро от мяг-
ких тканей. При взятии целого ребра
отделяют надкостницу с внутренней
стороны реберным распатором и вы-
пиливают или отсекают костными ку-
сачками трансплантат с обоих концов
(рис. 6.30). Если берут только наруж-
ную пластинку ребра, то, обнажив пе-
реднюю поверхность, проводят распи-
лы по верхнему и нижнему краям и
при помощи остеотома расщепляют
ребро до губчатого слоя. Желобоватым
долотом отделяют наружную пластин-
ку ребра, сглаживают острые края кос-
ти и рану зашивают наглухо.
В зависимости от количества необ-
ходимой аутокости ее можно взять с
участка ретромолярной области и пе-
реднего края ветви нижней челюсти.
Разрез производят по наружной стороне
крыловидно-нижнечелюстной складки,
латеральнее ретромолярной ямки и
вниз к переходной складке соответст-
венно второму моляру. Отслаивают
слизистую оболочку и надкостницу и
методом выпиливания при помощи
бормашины формируют трансплантат
из ретромолярной ямки с наружной
кортикальной пластинкой тела ниж-
ней челюсти или эти костные ткани с
участком края ветви нижней челюсти.
При отделении трансплантата пользу-
434
Рис. 6.31. Формирование костного
трансплантата из ретромолярной об-
ласти и ветви нижней челюсти.
а — вид сбоку: 1 — линия рассечения мягких
тканей. 2, 3 — линия распила кости альвео-
лярной части; б — вид сверху: 1 — отслоен-
ный слизисто-надкостничный лоскут, 2 —
вид костного трансплантата; в — отделение
трансплантата долотом.
ются также долотом и молотком. По-
ставив долото перпендикулярно, лег-
кими ударами молотка отделяют кор-
тикальную пластинку. Более выражен-
ный эффект отмечается в том случае,
если у отделенного трансплантата име-
ется также слой губчатого вещества
|152]. Костную рану после отделения
трансплантата заполняют костными
опилками, биоматериалом. Мягкие
ткани зашивают наглухо (рис. 6.31).
Взятие трансплантата с симфиза про-
изводят путем обнажения кости трапе-
циевидным или полукруглым разрезом
мягких тканей на границе прикреплен-
ной и свободной десны длиной 5—7 см
соответственно центральным зубам.
Распатором отслаивают вниз надко-
стницу, обнажают переднюю поверх-
ность симфиза и обозначают нужный
размер трансплантата. По этим грани-
цам шаровидным бором делают не-
сколько отверстий в кортикальном
слое кости.
При помощи фиссурных боров уг-
лубляют отверстия и соединяют их ме-
жду собой. Широким долотом соответ-
ственно боковому размеру трансплан-
тата, осторожно постукивая молотком,
отделяют единым блоком кортикаль-
ную пластинку кости с небольшим
слоем губчатого вещества. Образовав-
шуюся костную рану заполняют кост-
ными опилками, биоматериалом. Сли-
зисто-надкостничный лоскут уклады-
вают на место и фиксируют глухими
швами (рис. 6.32). При исследовании
блоков из симфиза в них обнаружено
не только кортикальное вещество кос-
ти, но и слой губчатого вещества.
_____Д Ч S
Рис. 6.32. Формирование костного транс-
плантата с симфиза нижней челюсти.
1 — линия рассечения мягких тканей; 2 — ли-
ния распила кости.
Рис. 6.33. Формирование костного
трансплантата с бугра верхней челюсти.
1 — линии рассечения мягких тканей; 2 — ли-
нии распила кости.
С бугра верхней челюсти трансплан-
тат берут в виде клинообразного фраг-
мента кортикально-губчатого вещества.
При этом следует ориентироваться на
данные о величине кости в этой облас-
ти, полученные при рентгенографии и
компьютерной томографии, а также
учитывать близость ее к латеральной
стенке верхнечелюстной пазухи.
При формировании костного транс-
плантата в области бугра делают угло-
образной формы разрез через альвео-
лярную дугу или по гингивальному
краю в области второго, третьего моля-
ров верхней челюсти вверх к своду
преддверия рта. Откидывают слизисто-
надкостничный лоскут. По альвеоляр-
ной дуге делают несколько отверстий в
436______________
кортикальном веществе кости и, со-
единив их, образуют неглубокий тон-
нель. Медиально в стенке кости делают
2—3 отверстия и, поставив долото в
желобок, по альвеолярной дуге осто-
рожным постукиванием молотка отде-
ляют трансплантат. Сглаживают края
костной раны, укладывают слизисто-
надкостничный лоскут на место и фик-
сируют его глухими швами (рис. 6.33)
Реже применяют трансплантат со
свода черепа. Кость берут, делая полу-
лунной формы разрез ткани на вы-
бранном участке волосистой части го-
ловы. Рассечения мягких тканей и над-
костницы должны перекрывать грани-
цы костного трансплантата. Кожу,
мышцы и фасцию откидывают единым
лоскутом. Отсепаровав ткани, рассека-
ют надкостницу и, отслоив ее, намеча-
ют границы трансплантата. В корти-
кальном веществе кости делают ориен-
тировочные, а затем соединительные
отверстия. Кость всегда сверлят с на-
ружным охлаждением. Затем при по-
мощи долота берут кортикальную пла-
стинку кости. В костную рану могут
быть уложены костные опилки. Надко-
стницу укладывают на место и фикси-
руют погружными швами. Мягкие тка-
ни зашивают послойно (рис. 6.34).
Для приживления аутокостного
трансплантата большое значение име-
ет плотность его контакта с восприни-
мающим костным ложем и надкостни-
цей. В этом процессе важную роль иг-
рают эндостальные клетки, менее зна-
чительную — клетки костного мозга,
на которые, как установили М. Urist и
соавт. [291], приходится только II %
остеогенеза аутотрансплантата.
В 1937 г. G. Axhauscn [64] выдвинул
теорию о двух фазах костного генеза
при аутотрансплантации кости. В пер-
вой фазе в течение нескольких недель
пересаженные клетки пролиферируют,
образуя остеоидную ткань. Вторая фа-
за начинается на 2-й неделе и выража-
ется в развитии сосудистых реакций и
дифференциации клеток [133]. В ре-
зультате этого образовавшиеся клетки
соединительной ткани стимулируют
появление остеобластов и построение
новой кости. Эти процессы происходят
параллельно резорбции и ремоделиро-
ванию кости, и, как отмечал R. Marx
Рис. 6.34. Формирование костного
трансплантата со свода черепа.
I — линии рассечения мягких тканей; 2 — ли-
нии распила кости.
[212], это органно запрограммирован-
ный процесс.
При зубной имплантации применя-
ют трансплантаты из кортикального
или губчатого вещества кости и комби-
нированные — кортикально-губчатые.
Кортикальные трансплантаты пред-
ставляют собой фрагменты кортикаль-
ного вещества ребра, краевого отдела
гребня подвздошной кости, симфиза и
тела или ветви нижней челюсти, свода
черепа. Губчатые трансплантаты со-
стоят из губчатого вещества кости и
кроветворного костного мозга. Благо-
даря концентрации остеогенных кле-
ток они обладают высокими потенци-
альными возможностями. Их можно
брать из гребня подвздошной кости и
бугра верхней челюсти. Кортикально-
губчатые трансплантаты содержат как
кортикальное, так и губчатое вещество.
Их формируют из гребня подвздошной
кости и расщсплеиного или цельного
фрагмента ребра, реже — из челюстей.
Результаты экспериментального изу-
чения аутокостных материалов свиде-
тельствуют, что губчатое вещество кос-
ти с костным мозгом менее эффектив-
но по сравнению с кортикально-губча-
тыми трансплантатами, поскольку рас-
сасывание и васкуляризация послед-
них происходят быстрее |64]. В то же
время в обоих материалах имеются
желтый костный мозг и жировая ткань,
что не всегда благоприятно для буду-
щего ремоделирования кости.
Кортикально-губчатые блоки легко
моделируются к нужному участку кос-
ти. При взятии таких трансплантатов
следует иметь в виду, что в первый год
кость атрофируется до 2 мм по верти-
кали, а затем — по 0,1 мм ежегодно.
Это особенно важно учитывать в том
случае, если трансплантацию произво-
дят одновременно с имплантацией.
Питание аутотрансплантаты получа-
ют от кости и надкостницы материн-
ского ложа. В кортикальных транс-
плантатах кровоснабжение восстанав-
ливается гораздо медленнее, чем в губ-
чатых. Кроме того, реконструкция кор-
тикальных трансплантатов может при-
вести к образованию в контактной зоне
ложа участков фиброзной ткани, кото-
рая длительное время не ремоделирует-
ся, создавая потенциальную угрозу как
для новых костных образований, так и
для установленного имплантата.
Самым важным условием для ус-
пешного проведения комбинирован-
ной пластики аутогенным трансплан-
татом с одновременной постановкой
имплантата является достаточность
мягких тканей для закрытия как транс-
плантата, так и имплантата. При из-
бытке слизистой оболочки надкостни-
ца на поверхности остаточной кости
всегда плотно сращена с ней и при-
крыть ею трансплантат невозможно.
Кроме этого, отдельные мелкие блоки
и измельченную кость трудно фикси-
ровать и для создания альвеолярного
гребня нужной высоты и ширины тре-
буются формирующие устройства [120].
Однако общепризнано, что костные
трансплантаты (так называемая кост-
ная щебенка) имеют более выражен-
ные остеогенные свойства. Если при-
меняют цельные трансплантаты, то в
их кортикальном слое делают отвер-
стия, чтобы обеспечить наилучший
контакт с окружающими тканями, глав-
ным образом с надкостницей. Именно
по этим соображениям расщепленный
трансплантат делят на блоки, а для
фиксации и придания им нужной фор-
мы используют винты, титановую сет-
437
ку, окружающие швы, формирующие
каппы.
Пластика костными аутотрансплан-
татами с челюстей и свода черепа. Для
реконструкции небольших дефектов
альвеолярного отростка верхней челю-
сти и альвеолярной части нижней че-
люсти наиболее целесообразно брать
костные аутотрансплантаты с челю-
стей и свода черепа. Пластику ауто-
трансплантатами с челюстей произво-
дят в области альвеолярной дуги при ее
сужении или недостаточной высоте
для имплантации. Результат операции
должен отвечать следующим критери-
ям: ширина альвеолярной дуги должна
быть не менее 4,5 мм, высота — не ме-
нее 8 мм. Чаше производят пластику
аутокостью "внакладку".
Наилучшие свойства имеет корти-
кально-губчатый аутогенный транс-
плантат, например с бугра верхней че-
люсти, поскольку трансплантаты из
ретромолярной ямки, симфиза нижней
челюсти, свода черепа представлены
преимущественно кортикальным ве-
ществом кости.
Первыми бугор верхней челюсти с
целью увеличения количества кости
для имплантации использовали
A. Schroeder и соавт. [257], F. Sutter и
соавт. [277]. Они считают, что если пла-
стику и имплантацию производят одно-
временно, следует ставить только такие
имплантаты, которые способны остео-
интегрироваться. В дальнейшем С.
Bruggenkate и соавт. [100] подробно раз-
работали методику использования ауто-
генных костных трансплантатов с бугра
верхней челюсти с последующей поста-
новкой имплантатов "ГП" и "1MZ".
По данным С. Bruggenkate и соавт.,
использование таких трансплантатов
дало следующие результаты. Через 6
мес кость становится гладкой и, хотя
ширина ее за этот период уменьшается
в среднем с 6,5 до 4,6 мм, остается дос-
таточной для постановки имплантатов.
Эти данные были получены в тех на-
блюдениях, когда почти всем пациен-
там ставили по 3 имплантата "IMZ", но
в том случае, если для такого количе-
ства имплантатов кости оказывалось
недостаточно, ставили 2 имплантата.
Больший по размеру трансплантат
для пластики кости при имплантации
Л1Я._______________________
дает кортикальная пластинка нижней
челюсти — тела, ветви, симфиза [171].
Пластику атрофированной верхней
или нижней челюсти аутотранспланта-
том с симфиза и ветви нижней челюсти
также чаше выполняют одновременно
с имплантацией [155, 222]. С. Misch и
соавт. [224] при сравнительном изуче-
нии костных трансплантатов с костей
черепа отметил преимущества кости с
симфиза как по количеству, так и по
простоте техники забора. Хорошие ре-
зультаты получены при пластике аль-
веолярного гребня с использованием
таких трансплантатов [172, 224].
Пластика костными аутотрансплан-
татами гребня подвздошной кости, мало-
берцовой кости, ребра, лучевой кости.
Когда для имплантации требуются
трансплантаты больших размеров, ис-
пользуют костные аутотрансплантаты
гребня подвздошной кости, больше-
берцовой, малоберцовой и лучевой
костей, ребра. Если пластику костными
аутотрансплантатами с челюстей и че-
репа почти всегда производят одновре-
менно с постановкой зубных имплан-
татов, то пластику трансплантатами с
других костей скелета можно выпол-
нять как одномоментно, так и этапно.
Относительно разных подходов к кост-
ной пластике и ее этапности при ис-
пользовании больших костных транс-
плантатов при зубной имплантации
мнения достаточно разноречивы. При
сильно атрофированной верхней челю-
сти для зубной имплантации Н. Sailer
[250] считает наиболее целесообразной
остеотомию по Ле Фор 1 (нижний тип)
с постановкой костного аутотрансплан-
тата в образовавшийся промежуток.
Иной точки зрения придерживаются
Р. Boyne и соавт. [99], Е. Keller и соавт.
1190]. Они считают более целесообраз-
ным в области атрофированной кости
ставить трансплантат "внакладку".
J. Tidwell и соавт. [285] при атрофии
верхней челюсти одинаково успешно
применяли остеотомию по нижнему
типу (для одновременного увеличения
альвеолярного отростка и поднятия па-
зухи трансплантатом губчатого вещест-
ва гребня подвздошной кости) и ком-
бинацию накладной аутотранспланта-
ции кости на альвеолярную дугу с под-
нятием пазухи гидроксиапатитом.
Гребень подвздошной кости при
зубной имплантации используют в ви-
де блока с моделированием к дисталь-
ному отделу альвеолярной части ниж-
ней челюсти или (чаще всего) к дис-
тальному отделу альвеолярного отрост-
ка верхней челюсти [190, 205].
В отличие от принятой в общей хи-
рургии методики при зубной имплан-
тации цельный фрагмент ребра берут
без хряща и используют его горизон-
тальную половину в виде накладного
трансплантата на область альвеоляр-
ной дуги. Срез губчатого вещества кос-
ти обращают к кортикальной поверх-
ности остаточной кости, которой пред-
варительно придают плоскую форму
при помощи бора. Если альвеолярная
дуга достаточно плоская, то в ней свер-
лят отверстия до губчатого вещества,
чтобы поверхность кости обильно омы-
валась кровью. Вторую часть ребра из-
мельчают и мелкими кусочками запол-
няют пустоты по краю контакта кости
и трансплантата. Для фиксации транс-
плантата к кости на нижней челюсти
используют накостные проволочные
шины, винты и накладывают окружаю-
щий шов, в том числе с временной кап-
пой или протезом [198, 284|.
При использовании только наруж-
ной пластинки ребра трансплантат бе-
рут размером на 1—2 см больше, чем
необходимо для увеличения кости по
протяжению. Для того чтобы толщина
фрагмента ребра везде была одинако-
вой, применяют остеотом Костылева.
Затем лишнюю часть полученного
трансплантата отпиливают и измельча-
ют. Наружную пластинку ребра накла-
дывают так же, как описано выше, и в
местах неполного прилегания транс-
плантата укладывают отдельные кусоч-
ки кости. Аналогично осуществляют
фиксацию трансплантата к кости (см.
рис. 6.23). Хорошие результаты полу-
чены при пластике верхней челюсти
ауторебром с одновременной поста-
новкой имплантатов системы Brane-
mark [149]. Наблюдения показали, что
результаты приживления имплантатов,
поставленных в трансплантаты, впол-
не сравнимы с таковыми в случае при-
живления имплантатов, поставленных
непосредственно в кость частично без-
зубой челюсти [208].
При одномоментной костной пла-
стике и имплантации имплантат ставят
одновременно с трансплантатом, фик-
сируя его в последнем и в кости челю-
сти. Вокруг верхнего отдела тела им-
плантата трансплантат можно уклады-
вать единым блоком или отдельными
фрагментами [205]. Имплантат также
можно обкладывать мелкими блоками
или измельченной костью. В первом
случае дополнительной фиксации не
требуется, поскольку трансплантат
фиксируется самим имплантатом. Во
втором случае трудно достигнуть плот-
ного прилегания аутотрансплантата к
кости и имплантату и его укрепляют
фиксирующими элементами. Наилуч-
шую фиксацию обеспечивает титано-
вая сетка.
R. Adell и соавт. [52, 53] сообщили о
результатах костной пластики гребнем
подвздошной кости и имплантации на
верхней челюсти. Если при обычных
имплантациях эффективность лечения
после 4 лет наблюдений у этих авторов
составила 82,1 %, а после 5 лет — 86,1 %,
то при одноэтапной аутотранспланта-
ции и постановке имплантатов — со-
ответственно 75,3 и 75,8 %. При этом в
первый год потеря кости по горизонта-
ли составила в среднем 1,44 мм, а в
дальнейшем — по 0,1 мм в год, что со-
ответствует норме. Однако наилучшая
адаптация имплантата в реконструи-
руемой кости наблюдается тогда, когда
имплантат обложен костной щебен-
кой. Медленнее остеогенез и прижив-
ление конструкции происходят в блоке
кости [205]. Вместе с тем отмечены
случаи, когда вокруг имплантатов, по-
ставленных вместе с костными транс-
плантатами, резорбция кости была вы-
ражена больше, чем вокруг импланта-
тов, поставленных непосредственно в
оставшуюся атрофированную кость
[129]. Резорбция была более интенсив-
ной с вестибулярной поверхности
нижней челюсти и альвеолярного от-
ростка верхней челюсти, при этом от-
мечались подвижность имплантата и
рецессия десны.
Применение аутогенных трансплан-
татов с одновременной постановкой
имплантатов в переднюю часть верх-
ней челюсти может не дать ожидаемого
эстетического результата. Е. Hystrom и
.на
соавт. [162] при наблюдении за паци-
ентами, которым была сделана такая
операция и поставлено 177 импланта-
тов, показали, что за 3 года потеря вы-
соты кости составила в среднем 4,9 мм.
В ряде случаев это привело к потере
опоры верхней губы и смещению носа
и нижней губы книзу и внутрь. Авторы
считают, что пациенты должны быть
заранее предупреждены о возможных
изменениях в мягких тканях.
Несмотря на определенные положи-
тельные результаты первых операций
одновременной трансплантации и им-
плантации [101, 172, 192], большинст-
во исследователей считают, что необ-
ходимо поэтапное лечение и импланта-
цию следует осуществлять через 6 мес
после трансплантации кости. Это про-
диктовано тем, что не всегда удавалось
заранее правильно определить адекват-
ное соотношение размеров трансплан-
тата и имплантата. При таких ошибках
резорбция трансплантата приводила к
негативным последствиям импланта-
ции. Поэтапная операция (вначале
пластика челюсти аутотрансплантатом,
а через 6 мес имплантация) признана
более рациональной [226, 279].
В 1994 г., подведя итоги 6-летнего
опыта пластики атрофированной верх-
ней челюсти накладными трансплан-
татами в форме блоков, взятых с греб-
ня подвздошной кости (субантральное
наращивание), С. Misch и F. Dietsh
[223] отметили преимущества отсро-
ченной имплантации. Всего ими сде-
лано 20 трансплантаций и поставлено
148 имплантатов в форме корня зуба.
Из них 21 был установлен немедленно,
но 2 отторглись (эффективность 90 %).
Остальные 127 имплантатов устанав-
ливали после приживления трансплан-
татов, при этом эффективность по-
этапного лечения составила 99 %.
Скорость резорбции атрофирован-
ной нижней челюсти, реконструиро-
ванной трансплантатом, определялась
Р. Quinn [240] у 5 пожилых пациентов,
у которых до имплантации высота кос-
ти составляла 4—8 мм. Через 4—8 мес
после трансплантации им были по-
ставлены 20 имплантатов, в результате
чего высота кости увеличилась до 24 мм.
За 5 лет кость атрофировалась, и ее вы-
сота стала 19,2 мм, т.е. уменьшилась на
18 %. Уменьшение кости произошло в
основном за счет атрофии ремоделиро-
ванного трансплантата. В меньшей
степени атрофия новой кости выраже-
на при установлении остеоинтегриро-
ванных имплантатов [184]. При ауто-
трансплантации гребня подвздошной
кости и использовании таких имплан-
татов с гидроксиапатитны.м покрытием
D. Dattilo и соавт. [129] отмечали дос-
таточное кровоснабжение аутотранс-
плантата. Приживление в нем имплан-
тата происходило так же, как и в кости
челюсти.
Вместе с тем в ранних исследованиях
М. Fazili и соавт. [135], а затем U. Breine
и P.-l. Branemark [101], R. Listrom и
J. Symington [206] через 6 мес у постав-
ленных в кость челюстей аутотранс-
плантатов наблюдали 50 % резорбцию.
В связи с этим U. Breine и P.-I. Brane-
mark [101] считают, что кости для ауто-
трансплантата надо брать тоже на 50 %
больше, а имплантацию производить
не раньше чем через 3—4 мес (лучше
через 5—6 мес) после трансплантации.
Однако, по мнению М. Fazili и соавт.
[135], на рассасывание кости после ау-
тотрансплантации в значительной ме-
ре влияет и нагрузка. Чем больше
ошибка в нагрузке имплантатов, тем
значительнее атрофия кости. Следует
всегда учитывать вероятность умень-
шения кости при имплантации в ре-
конструированную кость.
Результаты аутотрансплантации и
зубной имплантации нужно оценивать
по следующим критериям: 1) достаточ-
ной высоте и ширине реконструирован-
ной кости, определенных клинически,
по РКТ и МРТ [39]; 2) высокому коэф-
фициенту приживления аутотрансплан-
тата и его интеграции с костью; 3) нор-
мальному состоянию десны, определяе-
мому по десневому индексу и глубине
карманов; 4) рентгенологически под-
твержденному нормальному построе-
нию кости в зоне аутотрансплантации и
имплантации; 5) отсутствию инфекции
и расхождения краев раны; 6) отсутст-
вию поздних осложнений (отторжение
кости, имплантата).
Поэтапное вмешательство — ауто-
трансплантация, а затем имплантация
также имеют ряд недостатков. Во-пер-
вых, неудобна многоэтапность опера-
ции, которая включает формирование
трансплантата из гребня подвздошной
кости или ребра, пластику челюсти
взятой костью; постановку имплантата
после ремоделирования кости и
вскрытие его с последующим протези-
рованием. На все это уходит много
времени. Во-вторых, при реконструк-
ции кости и последующей остеоинте-
грации имплантата всегда существует
опасность попадания инфекции из по-
лости рта. Кроме того, имеется немало
высказываний о том, что из-за слож-
ности операции и вероятности ослож-
нений при зубной имплантации неце-
лесообразно использовать гребень
подвздошной кости, фрагмент малой
берцовой кости и ребра. В то же время
при значительной атрофии кости пла-
стика ее перед имплантацией оправда-
на и целесообразна.
А.Л. Никитин и соавт. [27] предло-
жили производить остеотомию и ста-
вить имплантаты в гребень подвздош-
ной кости, а затем трансплантировать
их на участок дефекта челюсти и ском-
прометированного участка альвеоляр-
ной дуги. Однако при такой транс-
плантации очень трудно, если вообще
возможно, точно реконструировать
участок челюсти, оценить степень ос-
теогенеза пересаженной кости, адек-
ватность окклюзионных соотношений
перенесенного имплантата, а также ре-
шить специфические вопросы ортопе-
дического лечения. И все же прогресс
при таком методе очевиден: сокраща-
ются сроки лечения, отмечается боль-
шая безопасность имплантата на ста-
дии его приживления в трансплантате.
В последние годы началось изучение
вопросов трансплантации васкуляри-
зированных тканей (кость, надкостни-
ца, прилежащие мягкие ткани с сосу-
дами). Доказано, что васкуляризиро-
ванные трансплантаты создают более
благоприятные условия для выживае-
мости остеогенных клеток. Блок мяг-
ких и костных тканей пересаживают в
подготовленное в месте дефекта кост-
ное ложе и воссоздают его кровоснаб-
жение с помощью микрохирургиче-
ских манипуляций. Соединенные ар-
териальные и венозные сосуды обеспе-
чивают адекватное кровоснабжение
как трансплантата, так и восприни-
мающего ложа. Аутотрансплантаты на
сосудистой ножке берут с гребня под-
вздошной кости, ключицы, ребра, ма-
лоберцовой кости, лучевой кости, сво-
да черепа [69, 129, 141]. Наиболее эф-
фективна пластика васкуляризирован-
ными трансплантатами на нижней че-
люсти [150, 158]. Однако для после-
дующей имплантации возникают оп-
ределенные трудности: питание ремо-
делированной кости происходит через
пересаженные мягкие ткани, сложно
моделировать трансплантат к дефекту
кости. Кроме того, при установлении
имплантатов травмирование мягких
тканей, через которые осуществляется
питание кости, столь же нежелательно,
как и травматичное их рассечение и от-
слаивание. Вместе с тем I. Zlotolaw и
соавт. [304] отмечали хороший эффект
ортопедической реабилитации после
пластики нижней челюсти васкулизи-
рованным трансплантатом из малобер-
цовой кости и установления импланта-
тов. Большинство авторов считают, что
успех во многом зависит от вида при-
мененных имплантатов [69, 231].
6.2.5. Пластика аллогенными
костными трансплантатами
Применение аутотрансплантатов при-
знано наиболее эффективным методом
восполнения кости челюстей. Однако
необходимость дополнительной опера-
ции, нередко достаточно травматичной,
способствовала тому, что появилось но-
вое направление — костная пластика
деминерализованными трансплантата-
ми (см. рис. 1.13). Методики ее выпол-
нения разработаны отечественными че-
люстно-лицевыми хирургами [2, 24, 35]
и зарубежными исследователями [54,
55, 79, 80, 96, 97, 104-106, 290-292].
При использовании аллокости матери-
ал должен быть проверен на ВИЧ и дру-
гие вирусы и соответственно стандарти-
зирован [217, 223].
Аллогенный деминерализованный
костный трансплантат играет роль ор-
ганической внеклеточной матрицы, ко-
торая вызывает остеогенез с костного
ложа. Сначала образуется незрелая хря-
щевая ткань, а затем благодаря дея-
тельности остеобластов начинается по-
строение нормальной костной ткани. В
процессе остеогенеза наиболее актив-
ны кортикальные аллотрансплантаты,
так как в этом веществе кости больше
костного протеина. Деминерализован-
ные аллотрансплантаты выделяют та-
кого протеина больше, чем недемине-
рализованные. Новые технологии в
подготовке аллокостных тканей — де-
минерализованного костного матрикса
("ДВМ"), костного морфогенетическо-
го протеина ("BMP") — позволяют по-
высить эффективность использования
этих материалов для пластики при им-
плантации [93, 160, 292[. Особенно
важно, что "ДВМ", "BMP" являются не
только остеокондуктивными, но и ос-
теоиндуктивными [248] (см. рис. 1.13).
R. Loucota и соавт. [208] установили,
что в остеогенезе деминерализованных
трансплантатов большое значение име-
ет васкуляризация того участка кости,
где поставлен имплантат и подсажена
кость. При выраженном кислородном
голодании аллотрансплантатов образу-
ется не кость, а фиброзная или хряще-
вая ткань, что может отрицательно ска-
заться на приживлении имплантата.
Аллотрансплантаты деминерализован-
ной и лиофилизированной кости им-
плантируют, применяя те же методики,
что и при использовании аутокости.
Аллокость можно применять как для
пластики с одновременной импланта-
цией, так и для двухэтапного лечения,
когда вначале восполняют кость, а че-
рез 4—5 мес устанавливают импланта-
ты. Согласно результатам клинических
наблюдений, проведенных в последние
годы, в одних случаях восполнение не-
больших дефектов челюсти возможно
одновременно с имплантацией, в дру-
гих — более целесообразно проводить
двухэтапное лечение: на первом этапе
трансплантацию кости, на втором —
имплантацию. Аллокость при имплан-
тации применяют в виде деминерали-
зованных пластин, блоков, измельчен-
ной кости — стружки разного размера,
геля и порошка. Одной из последних
разработок аллогенной кости является
"Dynagraft" [305] (см. рис. 1.13, б).
Экспериментальное сравнительное
изучение имплантации, произведенной
изолированно и с разными вилами ал-
локости, свидетельствует о более быст-
рой интеграции имплантата с костью
при комбинированном методе с вклю-
чением аллокости [286]. Однако одно-
временная с пластикой кости зубная
имплантация не всегда дает эффект ре-
моделирования кости и остеоинтегра-
ции имплантата. Кроме того, при од-
новременной операции пластики и им-
плантации, как установили D. Smiler и
соавт. [268], нельзя исключить необъ-
яснимое образование костных форми-
рований вместе с обширными участка-
ми фиброзной ткани. Наши наблюде-
ния показали, что поэтапное лечение
может быть длительным и даже через
12—15 мес оссификации аллокости
может не произойти, что затрудняет
второй этап — установление импланта-
та [39].
6.2.6. Пластика заменителями кости
на основе керамиков
Нехватка кости для установления им-
плантатов, травматичность взятия ау-
тотрансплантатов, увеличение сроков
лечения, а иногда и малое количество
материала для трансплантации — все
это привело к разработке и внедрению
в пластическую хирургию биоматериа-
лов на основе фосфата кальция, так
называемых керамиков — трикальций-
фосфата, гидроксиапатита, фтористого
апатита, биосгекла. Середину 70-х и
начало 80-х годов следует признать
временем интенсивных эксперимен-
тальных и клинических разработок с
целью применения пластических мате-
риалов в медицине, в том числе в сто-
матологии. В изучении и практиче-
ском применении пластических мате-
риалов при зубной имплантации заслу-
га принадлежит М. Jarcho и соавт.
[120-122], J. Кау и соавт. [185-189].
R. Cook и соавт. [163—167], J. Lemons
и соавт. [203], S. Nyman и соавт. [234,
235], М. Block и J. Kent [8, 89, 90], S. Jo-
vanovic и соавт. [178—183], а в послед-
ние годы в России А.И. Воложину и
соавт. [5, 6], С.Г. Курдюмову, Г.Н. Вер-
ченко, А.А. Никитину [25, 26], А С.
Панкратову [33] и др.
Это позволило внедрить в кли-
ническую практику гидроксиапол,
мелкодисперсный гидроксиапатит
"ОСТИМ-100", а также гидроксиапа-
тит, включенный в состав "Коллапа-
на", "Колаполола", коллагеновые мем-
браны, гели и др. [4, 7, 9, 11, 14, 16, 19,
20, 42, 50].
М. Jarcho [167] на основании резуль-
татов исследований пришел к выводу,
что пластические трансплантаты на ос-
нове керамики имеют биоактивные
свойства и способствуют прорастанию
кости, М. Block и J. Kent [88] связыва-
ют с пластическими материалами и не-
посредственно гидроксиапатитом ус-
пех остеоинтеграции имплантатов. Од-
нако керамики не содержат протеино-
вых матриц, которым свойственны ос-
теоиндуктивные качества [113]. По
этой причине остеоциты не всегда пол-
ностью восполняют дефект кости и
преобразование новой костной ткани
происходит медленнее, что не всегда
адекватно остеоинтеграции импланта-
та [102]. Это связано с тем, что в остео-
генезе важную роль играют химиче-
ские и физические свойства керамики,
особенно спеченной [302]. У спечен-
ных керамик из гидроксиапатита по-
ристость небольшая, и после поста-
новки на участок дефекта кости ре-
зорбция их менее выражена. Неспе-
ченные виды из гидроксиапатита и
трикальций-фосфата вызывают в тка-
нях более интенсивные биорезорбтив-
ные процессы [167].
На рубеже 70—80-х годов особенно
часто стали применять гидроксиапатит.
Экспериментально доказана хорошая
биосовместимость его в тканях и обра-
зование матрицы для прорастания кос-
ти от материнского ложа [86, 121]. Его
выпускают в виде блоков, гранул, по-
рошка. В зубной имплантации также
применяют синтетические материалы
на основе трикальций-фосфата и дру-
гих аллопластиков ("Hapset", "Augmen”,
"Bone Source", "Norian SRS"). В России
испытывались многие материалы на
основе гидроксиапатита, но для клини-
ческого применения утвержден гидро-
ксиапатит под названием Тидроксиа-
пол". Им широко пользуются для вос-
полнения дефектов кости в предым-
плантационной хирургии и во время
имплантации. Для пластики кости гид-
роксиапатит применяют в форме не-
спсченной керамики (порошок, грану-
лы, нити) и в виде блоков спеченной
керамики [5, 27, 38, 287].
Биоматериалами, наиболее эффек-
тивными при зубной имплантации,
признаны неспеченные керамики на
основе гидроксиапатита. Их применя-
ют для закрытия дефектов кости, за-
полнения пустот между костью и кон-
струкцией, при немедленной имплан-
тации после удаления зуба, в предым-
плантационной хирургии для увеличе-
ния ширины и высоты альвеолярной
дуги, поднятия дна верхнечелюстной
пазухи [26, 87, 167, 224].
6.2.7. Комбинированная пластика
биоматериалами
С целью совершенствования материа-
ла для реконструкции кости при зубной
имплантации исследуют комбинации
различных пластических материалов.
Об успешном применении комбинации
ауто- и аллогенных трансплантатов од-
ними из первых сообщили В. Ham-
mack, W. Enneking [150], J. Wittbjer и
соавт. [300]. По их мнению, аутоген-
ный трансплантат благодаря живым
остеобластам обеспечивает остеогенез,
а адлогенный материал служит струк-
турной опорой. В комбинации адло-
генная кость играет роль стимулятора
протеина в костеобразующих клетках
аутогенного трансплантата и костного
ложа [133]. Имеет значение также раз-
ница в длительности фаз и скорости
реорганизации ауто- и аллогенного
трансплантатов. В процессе двухфаз-
ного моделирования аутокости и обре-
тения ею механической прочности со-
единение взаимодействует с аллоген-
ной костью, в результате чего создается
более стабильный костный конгломе-
рат. Кроме того, благодаря происходя-
щей в результате остеогенеза ауто- и
адлокости синергической реакции с
выраженными сосудистыми измене-
ниями воспроизводится большее коли-
чество кости, чем в каждой отдельно,
особенно аллогенной кости [41, 55]. В
частности, это было отмечено J. Witt-
bjer и соавт. [300] при реконструктив-
ных предпротезных операциях и под-
тверждено в холе предымплантапион-
ного лечения с комбинированным и
раздельным применением аутокости и
деминерализованных кортикальных
пластин [38]. Наиболее успешна такая
комбинация с васкулизированными ау-
тотрансплантатами [150].
Результаты комбинированных транс-
плантаций обычно благоприятные [40,
41]. М. Block и J. Kent [88, 89] при та-
ких трансплантациях отметили умень-
шение средней потери кости почти
вдвое. Несмотря на сообщения о поло-
жительных результатах комбинирован-
ной трансплантации с одновременной
имплантацией, полностью исключать
опасность иммунной реакции через Т-
лимфоциты нельзя. Тем не менее при
необходимости реконструкции челю-
сти для имплантации, если требуются
ауто- и аллотрансплантаты больших
размеров, предпочтительнее поэтапное
лечение, т.е. проведение имплантации
через 4—6 мес, а иногда и более после
трансплантации. Тип и форму транс-
плантата выбирают в зависимости от
результатов реконструкции кости и це-
ли ортопедического лечения. По той
же причине рекомендуется произво-
дить имплантацию остео интегрируе-
мыми имплантатами, предназначен-
ными для двухэтапного лечения. По
нашим наблюдениям, при комбиниро-
ванном применении ауто- и аллокости
успех и величина ремоделированной
кости во многом зависит от соотноше-
ния компонентов тканей (оптимально
1:1). Изменение его возможно только в
отношении увеличения количества ау-
токости [37].
При малом количестве донорской
кости для пластики используют ее
комбинации с другими пластическими
материалами, в частности с гидрокси-
апатитом и грикальций-фосфатом (14,
142]. Успех реконструкции зависит не
только от характеристик кости и кера-
мики, но и от их пропорции в комби-
нации. Основанием для применения
комбинации аутокости и трикальций-
фосфата послужили эксперименты,
проведенные J. Lemons и соавт. [203].
Установлено, что при использовании
аутотрансплантатов костная ткань на
месте ее перелома образуется через 4—6
нед, трикальций-фосфата — через 14—
16 нед, а их комбинации в пропорции
1:1 — практически в те же сроки, что и
при аутотрансплантации, — через 6
нед. Поскольку в этих экспериментах
дальнейшее увеличение доли аллопла-
стика приводило к заметному снижению
остеоиндукции и образованию новых
костных тканей, практическое приме-
нение нашла именно такая пропорция.
К такому же выводу пришли G. De
Lange и соавт. [130], Р. Gooris и Р. Bli-
jorp [142]. В экспериментах на обезьянах
они проследили патоморфоз на ультра-
структурном уровне. При сравнитель-
ном изучении различных пропорций
кости и гидроксиапатита эти исследова-
тели обнаружили, что увеличение доли
гидроксиапатита приводило к образова-
нию фиброзной ткани, которая инкап-
сулировала границы биоматериала.
Иное мнение относительно пропор-
ции аутокости с гидроксиапатитом
сложилось у С. Cobb и соавт. [117].
Экспериментируя на обезьянах, они
отметили, что при соотношении ин-
гредиентов 1:3 структура образующей-
ся кости такая же, как и при пропор-
ции ауто- и аллокости 1:1. Особенно
важно, что при недостаточном количе-
стве аутопластического материала с
увеличением доли гидроксиапатита
намного возрастает объем материала, в
связи с чем значительно расширяются
возможности восполнения дефекта.
При анализе результатов трансплан-
тации аутокости в комбинации с гид-
роксиапатитом и последующей им-
II гантации отмечен достаточно боль-
шой разброс. Так, J. Kent и М. Block
[191] при послеоперационном наблю-
дении от 1 года до 4 лет сообщили, что
эффект достигнут в 100 % случаев.
D. Hall и S. McKenna [149], обобщив
данные других авторов, отметили успех
в 90 % случаев. J. Tidvell и соавт. [285],
проследив результаты в период от 12 до
32 мес, констатировали положитель-
ные результаты в 96 % случаев. Однако
J. Jensen и соавт. [170, 171, 173] имели
только 75 % успех при послеоперацион-
ном наблюдении в течение 10—29 мес.
При сравнении эффективности ис-
пользования гидроксиапатита в ком-
бинации с аутокостью и результатов
применения других керамик вывод не
всегда был в пользу гидроксиапатита. “
частности, к такому заключению при-
шли J. Моу и соавт. [227] при реконст-
рукции верхней челюсти и поднятии
дна пазухи аутокостью с гидроксиапа-
титом. Как показали гистоморфологи-
ческие исследования, результаты были
наилучшими, если вместо гидрокси-
апатита в комбинации с аутокостью
применяли кальциево-фосфатную ке-
рамику'.
Широкое применение комбинации
гидроксиапатита и аллокости нашли
при пластических операциях на челю-
стях для зубной имплантации [192]. Их
использовали для расширения и увели-
чения высоты альвеолярных отрост-
ков, поднятия дна верхнечелюстной
пазухи и при других восстановитель-
ных операциях.
Методика применения комбинации
аллокости с гранулированной керами-
кой одинакова с методиками пластики
аутокостью с аллокостью, аутокостью с
гидроксиапатитом [137]. Очень важно
соотношение аллокости и гидрокси-
апатита, а также размер реконструи-
руемой кости. По данным многих ав-
торов, оптимальным является соотно-
шение 1:1 или 2:1.
Все хирургические манипуляции с
такими пластическими материалами
выполняют с повышенной осторожно-
стью, максимально щадя надкостницу.
Операцию заканчивают глухим заши-
ванием раны.
Наши наблюдения показали, что ко-
личество аутокости может быть неог-
раниченным, но гидроксиапатита
должно быть не более 1А от общего ко-
личества биоматериала [38]. Желатель-
но смешивать биоматериалы с кровью.
Если ее не хватает, то биоматериал
смачивают изотоническим раствором
натрия хлорида, кровью из раны. В та-
ких случаях биоматериал лучше кон-
денсируется около имплантата и кости.
Особенно хороший эффект дает спе-
циально проведенная через центрифу-
гу кровь из вены пациента, когда в ос-
теогенезе участвуют факторы роста
кости — PRP (плазма, обогащенная
тромбоцитами) [213] (см. рис. 1.20).
Пластика биоматсриалами на основе
керамики и ксеноткансй. В последние
годы с успехом производят пластику
материалами на основе гидроксиапа-
тита, других керамик и ксенотканей.
За рубежом, особенно в последние
10 лет, для регенерации кости при им-
плантации широко и успешно приме-
няют биоматериалы "OsteoGen", "Bio-
Oss", "Osteo-Graf, "Bioplan". S. Cook
[122], A. Ashman [59] описали испыта-
ние нового материала для наращивания
кости. Основу его составляют гранулы
гидроксиапатита особой формы, кото-
рые скреплены рассасывающимся
шовным материалом и напоминают
веревочную сетку (см. рис. 1.17, а, б).
Исследования показали, что врастание
кости в такие трансплантаты происхо-
дит значительно быстрее и инфильтра-
ция фиброзной ткани более выражена,
чем у трансплантатов, состоящих толь-
ко из гранул гидроксиапатита.
Большое распространение получил
растворимый "OsteoGen", представ-
ляющий собой костно-индуктивный
протеин из неколлагеновой матрицы,
выпускаемый в виде порошка [253,
293]. При зубной имплантации его
применяют для увеличения высоты и
расширения альвеолярной дуги. С це-
лью наилучшей интеграции материал
укладывают над плечами плоских им-
плантатов, а если обнаруживается не-
плотное прилегание, то вокруг шейки
[293, 296].
Остеоген можно применять для вос-
полнения кости при немедленной им-
плантации, дефекте кости (см. рис.
1.17, в).
Вместе с тем мнения о костеобра-
зующих свойствах "OsteoGen" проти-
воречивы [154, 296].
J. Wagner [295], анализируя резуль-
таты применения растворимого гидро-
ксиапатита "OsteoGen", отметил, что,
хотя чаще приходится использовать
этот аллопластик при поражениях губ-
чатого вещества кости челюсти, в сво-
ей клинической практике он с успехом
пользовался таким материалом в случае
отсутствия большого участка корти-
кальной кости, которая благодаря реге-
нерации "OsteoGen" была заменена ла-
минарной костью с признаками гавер-
совой системы, типичной для корти-
кальной кости. J. Hahn [154] считает,
что материал плохо ремоделируется и
предпочитает другие материалы — "Os-
teo-Grar, "Pep-Gen Р-15", "Bio-Oss"
(см. рис. 1.14).
На широкий рынок выпущен мате-
риал под названием "lnterpore-200".
Основу его и подобных ему пластиче-
ских материалов составляет нераство-
римый производный кораллового ске-
летного карбоната, преобразованного
в неорганический трансплантат гидро-
ксиапатита (см. рис. 1.15, в). Эта ком-
бинированная формация, по мнению
D. Smiller и соавт. [267, 268), имеет
достаточные остеоиндуктивные свой-
ства. Структура его пористая, диаметр
пор порядка 200 мкм. Поскольку на
поры приходится 60 % поверхности,
условия для прорастания кости в этот
материал благоприятны. Эксперимен-
тальные исследования показали, что
остеогенез при этом достаточно тради-
ционный. Вначале возникает выра-
женная сосудистая реакция с образова-
нием фиброзной ткани, а в дальней-
шем — остеобластическая с дифферен-
цировкой клеток. Образование кости
нормального строения и достижение
ею максимального объема происходят
за 12 мес. При пересадке таких алло-
пластиков для увеличения количества
кости и закрытия ее дефекта они под-
вергаются биорезорбции, в ответ на
которую от ложа начинается образова-
ние кости. При имплантации "Inter-
роге-200" получил высокую оценку
клиницистов.
Материалы для восполнения кости
при имплантации можно применять в
комбинации с ауто- и аллокостью.
"Bio-Oss", "Osteo-Graf и "OsteoGen",
"Interpore-200", примененные с ал-
лотрансплантатами из деминерализо-
ванной кости, оказывают остеокондук-
тивное и остеоиндуктивное действие
[54). Еще лучше результаты при ис-
пользовании "Bio-Oss”, "Osteo-Graf и
"OsteoGen", "Колапола", "Коллапана" с
аутокостью, а также ее комбинации с
аллокостью. Наилучшие результаты с
точки зрения количества ремоделиро-
ванной кости получены нами при ис-
пользовании ауто- и аллокости в ком-
бинации с "Osteo-Graf в пропорции
1:1:1 [41].
С целью пластики небольших участ-
ков кости и закрытия дефектов приме-
няют отечественные пластические ма-
териалы на основе гидроксиапатита и
коллагена ("Колапол КП-1-3", "Колла-
пан") (см. рис. 1.17, в). Их используют
для изоляции верхушки имплантата от
дна верхнечелюстной пазухи, нижнего
альвеолярного нерва, восполнения кос-
ти при ее дефекте, закрытия обнажен-
ной поверхности имплантата [24, 28,37].
Рекомендуется комбинировать их с
отечественным мелкодисперсным гид-
роксиапатитом — "ОСТИ М-100", ко-
торый, имея пастообразную конси-
стенцию, увлажняет и пропитывает
гранулы деминерализованной и опил-
ки аутогенной кости, Тидроксиапола",
"Колапола".
Простотой привлекает также приме-
нение при зубной имплантации деми-
нерализованных кортикальных пла-
стин, ’Тидроксиапола" и комбиниро-
ванного трансплантата типа "Колапола
3”. При вскрытии погружных имплан-
татов через 5—6 мес обнаруживали
плотную кость над запорными винта-
ми, которую убирали бором с прило-
жением значительных усилий. Окон-
чательное ремоделирование подсажен-
ных биоматериалов, поданным компь-
ютерной томографии, фоторентгено-
графии позволяло отметить заверше-
ние процесса через 8—12 мес.
В настоящее время сравнимых ре-
зультатов наблюдений применения
"Bio-Oss", "Osteo-Graf, "OsteoGen",
"Колапола", "Коллапана" в комбина-
ции с гидроксиапатитом, деминерали-
зованной костью, аутокостью еше не-
достаточно [38]. Тем не менее такая
комбинация привлекает своей просто-
той, особенно в предымплантацион-
ной и имплантационной хирургии.
В течение 4 лет после применения
комбинаций ауто- и аллокости с алло-
пластиками зарубежных и отечествен-
ных фирм ни у одного материала не вы-
явлено каких-либо преимуществ или
отрицательных качеств. Всегда отмеча-
ется дефицит аутокости. Зарубежные
материалы вводят специальными
шприцами, обеспечивающими стериль-
ность и удобство их применения, отече-
ственные — стерильно пакетированы.
В настоящее время развивается но-
вое направление — использование
биоситаллов, в том числе "Perio Glass ,
"Biogran" при имплантации (см. рис-
1.16). J. Chou и соавт., D. Hunt и соавт-
[160] считают перспективным для вое-
становления кости применение моле-
кулярных биорастворимых синтетиче-
ских костно-тканевых композиций
морфогенетического протеина. Эти
материалы были одобрены IV Между-
народной конференцией Европейских
ассоциаций банков, Академией остео-
интеграции США |1, 32, 65, 154]
6.2.8. Направленная костная
регенерация при помощи мембран
Направленная костная регенерация
представляет собой терапию направ-
ленным костеобразованием. В паро-
донтологии, а затем в зубной имплан-
тации этот метод лечения стали приме-
нять после выхода в свет основопола-
гающих работ G. Murrey и соавт. [228],
A. Melcher и С. Dreyer [216], посвящен-
ных экспериментальному остеогенезу
трубчатых костей. Первыми такой ме-
тод использовали и описали S. Nyman
и соавт. [284], J. Gottlow и соавт. [144],
назвав его вначале контролируемой, а
затем направленной регенерацией тка-
ни. Однако D. Buser и соавт. [107] счи-
тают, что с учетом цели терапии пра-
вильнее и точнее называть такую опе-
рацию направленной регенерацией не
ткани, а кости. Основанием для такого
мнения служит, в частности, тот факт,
что на рубеже 90-х годов получила раз-
витие методика закрытия костного де-
фекта с помощью специального барье-
ра, который создавал максимально бла-
гоприятные условия для роста только
костных клеток — более медленных ос-
теобластов, и предупреждения регене-
рации нежелательных групп клеток,
относящихся к мягким тканям полости
рта, в первую очередь более динамич-
ных фибробластов и эпителиальных
клеток (см. рис. 6.46).
Как отмечает Н. Spiekermann [271], в
практическом применении направлен-
ной костной регенерации особую роль
сыграли эксперименты, проведенные
на рубеже 90-х годов [73, 77, 125, 126,
181, 182).
Для стимуляции процессов регене-
рации периодонта в экспериментах на
животных были использованы различ-
ные материалы, в том числе мембраны
из целлюлозы, полимолочной и поли-
гликолевой кислот, коллагеновые
структуры, полимеры и др. [63, 112,
183, 199]. Установлено, что подсажен-
ные биоткани играют роль защитного
барьера — эспандера, способствующе-
го росту кости [237]. Срединный слой
мембраны не пропускает клетки
внутрь, создавая для них физический
барьер [126, 237].
Первые мембраны для направленной
костной регенерации, получившие ши-
рокое распространение, — e-PTFE, бы-
ли созданы на основе непористого, вы-
сокоплотного политетрафлюорэтилена
и "Millipore filter” ("Gore-Tex Regenera-
tive Material”). Поскольку эти мембра-
ны не растворялись в тканях, их стали
называть нерассасываюшимися, или
нерезорбируемыми (см. рис. 1.18, а).
Гистологический анализ результатов
экспериментальных исследований по-
казал, что материал мембраны био-
инертен, в связи с чем интеграция тка-
ней проходит без осложнений.
Первые эксперименты на кроликах
[124], а затем на собаках [73, 77] и
обезьянах [125], проведенные шведски-
ми учеными, свидетельствовали об эф-
фективности лечения костных дефектов
челюстей путем направленной костной
регенерации. По данным гистологиче-
ских и клинических исследований, без
применения мембран дефект кости за-
полнялся всего на 39 %, тогда как с
мембранами — на 78 % [302].
Гистологическое изучение остеоге-
неза с помощью мембраны показало,
что динамика его та же, что и при ес-
тественном развитии и росте кости, но
с помощью мембраны процесс проис-
ходит значительно быстрее, хотя к 4
мес он еще не заканчивается [254].
Позднее был накоплен значитель-
ный клинический материал, свиде-
тельствующий об эффективности мем-
бран при закрытии дефектов кости и
увеличении высоты и ширины альвео-
лярной дуги для зубной имплантации
[67, 92, 107, 108].
В пародонтологии мембраны e-PTFE
способствовали образованию перио-
донтальной связки, цемента и кости
|73. 144, 145, 303].
Положительные клинические резуль-
таты по применению мембран "Gore-
Tex Augmentation Material" (GTAM) для
регенерации кости вокруг имплантатов
получил R. Lazzara (200]. Позднее при
лечении дефектов кости у имплантатов
диаметром в среднем 4,7 мм мембраны
"Gore-Tex" проходили апробацию од-
новременно в четырех клиниках Шве-
ции. США и Бельгии. Наблюдения про-
водились за 45 пациентами, которым
при имплантации были поставлены та-
кие мембраны. После заживления де-
фект кости в среднем уменьшился до
1,1 мм. На первых этапах 6 мембран об-
нажились. Тем не менее из 55 поставлен-
ных имплантатов через 2 гола удачны-
ми оказались 84,7 % на верхней и 95 %
на нижней челюсти. Такие результаты
свидетельствовали о возможности ле-
чить с помощью этих мембран локаль-
ные дефекты кости вокруг имплантатов
и не прибегать к более сложным вме-
шательствам с наращиванием кости с
помощью биоматериалов [127].
Главным недостатком нерассасываю-
щейся мембраны e-PTFE считается ее
обнажение в период регенерации кости,
вследствие чего наблюдаются ее инфи-
цирование и воспаление [233]. W. Becker
и соавт. [75] сообщают, что по таким
причинам приходилось удалять преж-
девременно до 41 % поставленных
мембран. Это значительно ухудшало
результаты лечения, так как если мем-
брана закрывает дефект в течение всего
срока, то он заполняется новой костью
на 98,6 %, а в тех случаях, когда мем-
брана обнажается и ее удаляют раньше
срока, — только на 41,6 %. Оставлять
обнажившуюся мембрану более чем на
6 нед не рекомендуется. Определен-
ным неудобством является то, что для
закрепления мембран по краю дефекта
необходимы специальные винты или
шпильки. Кроме того, для удаления
мембран требуется дополнительное
оперативное вмешательство.
Попыткой избежать такой дополни-
тельной процедуры стало создание ре-
зорбируемых, или биодеградирующих,
мембран с целью направленной реге-
нерации кости (см. рис. 1.18, б). Пер-
вые рассасывающиеся мембраны, поя-
вившиеся в начале 90-х годов, были
викриловые и коллагеновые (258]. Ма-
териалом для рассасывающейся вик-
риловой мембраны служат комбина-
ции коллагена хряща и рассасываюше-
-ЛЛА_______________
гося синтетического материала "Vicril"
[134, 255, 297]. Благодаря этому синте-
тическому материалу, который являет-
ся производным гликогена и лактида в
пропорции 9:1 ("Polyglastin 910"), мем-
браны обладают большой прочностью.
Главное преимущество этой мем-
браны заключается в саморассасыва-
нии через 6 нед, поэтому нет необхо-
димости в ее удалении [68].
Первые результаты были неутеши-
тельные — при использовании расса-
сывающихся мембран успех отмечен
только в 65 % случаев из-за нагноения
и отторжения [107, 108, 126, 127, 241,
264]. Лучшие результаты получены при
использовании мембраны ("Polyglatin
910") с костью [258], синтетической ко-
ралловой костью (229].
Следует иметь в виду, что примене-
ние таких мембран требует определен-
ных навыков и знаний. R. Schenk и со-
авт. [254], указывая на это, сообщили,
что на первых этапах их применения ре-
зультаты были плохими в 50 % случаев.
Главными причинами этого были раз-
витие воспаления, а также недостаточ-
ная ширина альвеолярной дуги. В ре-
зультате уточнения предоперационных
оценок и совершенствования техники
постановки мембран эти исследователи
сумели добиться успеха с рассасываю-
щимися мембранами в 92 % случаев.
М. Simon и соавт. [265] при сравне-
нии образования кости под рассасы-
вающейся и нерассасываюшейся мем-
браной установили их одинаковую эф-
фективность (95,5 %). Разница была в
качестве кости: под нерассасываюши-
мися мембранами чаше образовыва-
лась трабекулярная кость, под расса-
сывающимися — компактная и более
зрелая кость. Однако мнения клини-
цистов о рассасывающихся мембранах
расходятся и большинство исследова-
телей считают, что они уступают не-
рассасывающимся за счет частого вос-
паления [136, 241]. Однако сама идея
рассасывающейся мембраны остается
весьма привлекательной.
Из резорбируемых мембран при им-
плантации используют также двух-
слойные коллагеновые мембраны, У
которых внутренний слой в целях ак-
тивизации образования клеток соеди-
нительной ткани обработан фактором
роста и фибрином (см. рис. 1.18, в).
Считается, что коллагеновая мембрана
активизирует остеобласты и в большей
степени стимулирует рост кости (20,
230]. Коллагеновая мембрана дает
большие возможности для восстанов-
ления кости альвеолярного сегмента и
приживления имплантата, что под-
тверждается не только клинически, но
и гистологически (199]. Благодаря это-
му успех лечения ими отмечен в 95 %
случаев |271|. Хорошую опенку пату-
чили также коллагеновые мембраны на
основе материала "Collistat" (56, 116|,
но их чаще применяют в пародонтоло-
гии. Возможность использования их
при зубной имплантации пока мало
изучена.
Из числа рассасывающихся коллаге-
новых мембран высокий эффект дает
мембрана "Bio-Gide". Исследования
показали, что дефект кости под ней за-
полняется новой костной тканью ско-
рее, чем под мембраной e-PTFE, при-
чем рассасывание происходит без кли-
нических и иммунологических призна-
ков воспаления даже при неплотном
закрытии раны.
При направленной регенерации кос-
ти делаются также попытки применить
мембраны, армированные тиганом (см.
рис. 1.18, г). Таким мембранам можно
придавать любую форму, и они спо-
собны сохранять ее независимо от то-
го, будет ли дефект заполняться кост-
ным трансплантатом или другим био-
материалом [183].
В качестве рассасывающейся мем-
браны используется ламинированная
деминерализованная лиофилизиро-
ванная кость ("Lambone").
Среди новых технологий рассасы-
вающихся мембран при имплантации
стали применять синтетическую — "An-
ticorb"; комбинации резорбируемого
матрикса и полимолочной кислоты —
"Guidor”; материал из полимолочной и
полигликолевой кислот — "Resolut®";
кальций-сульфат — "Capset", в том
числе в виде нитей; гемостатический
материал на основе целлюлозы — "Sur-
gicel" (199]. Большую перспективу име-
ют новые технологии мембран, осно-
ванных на материалах факторов роста
кости ("Парадоктол", GTR).
Учитывая, что появляется все боль-
ше различных мембран, которые дают
хорошие результаты в клинике (хотя не
всегда известны отдаленные результа-
ты при зубной имплантации), необхо-
димо придерживаться определенных
требований к ним. Мембраны должны:
1) быть биосовместимы; 2) при реорга-
низации препятствовать образованию
фиброзной ткани вместо кости; 3) пре-
пятствовать прорастанию эпителия и
проникновению бактерий; 4) обеспе-
чивать необходимое пространство, в
котором должна происходить костная
регенерация, или плотно соединяться с
подсаженным пластическим материа-
лом; 5) интегрировать в окружающую
костную ткань и плотно прикреплять-
ся к шейке имплантата; 6) при плотном
прикреплении к шейке имплантата об-
разовывать "замок”; 7) соответствовать
окклюзионным задачам при протези-
ровании на имплантатах.
Важнейшим условием успеха на-
правленной регенерации кости являет-
ся создание под мембраной свободного
пространства. С краев кости в это про-
странство начинается рост фиброзной
ткани, сменяющийся остеоиндукцией.
Затем за счет ремоделирования незре-
лой кости и оссификации под мембра-
ной образуется нормальная костная
ткань. Таким образом, от пространства
под мембраной зависит количество ре-
генерируемой кости. Заполнение де-
фекта нужным количеством кости не-
возможно, если мембрана контактиру-
ет с его поверхностью: кость может ре-
генерироваться только до наложенной
непосредственно на дефект мембраны.
Мембрана плотно прикрепляется толь-
ко к краям дефекта кости.
Пространство под мембраной необ-
ходимо также для сохранения в нем
кровяного сгустка, который создает
благоприятную среду для костеобразо-
вания. Если невозможно образовать под
мембраной свободное пространство, то
его создают искусственно. Существует
несколько способов. В одних случаях
мембрану к кости фиксируют металли-
ческими кортикальными крепежными
мини-винтами (107, 108], в других — в
костный дефект укладывают рассасы-
вающиеся костные мембраны и укреп-
ляют биовинзами ("Biopin"), которые,
как и мембраны, рассасываются.
449
Располагая небольшим опытом ис-
пользования мембран при зубной им-
плантации, мы получили лучшие ре-
зультаты с коллагеновыми и костными
мембранами. При недостаточности,
дефекте кости, осложнении зубной
имплантации одна мембрана может
подвергать конструкцию в кости опре-
деленной опасности в связи с ее вос-
палением. Поэтому у нас сложилось
мнение, что при имплантации надо ис-
пользовать мембраны с костеобразую-
щим пластическим материалом. В та-
ком сочетании мембрана играет важ-
ную роль зашиты, барьера, а пластиче-
ский материал — стимулятора образо-
вания и ремоделирования кости у им-
плантата.
Комбинированная пластика мембра-
ной и другими пластическими материа-
лами. Для стимуляции остеогенеза эф-
фективны комбинации мембран и ау-
то-, аллокости или других биоматериа-
лов. Однако результаты использования
их в разных тканях неодинаковы.
Всеми признано, что наилучшим
материалом является аутокость [202]. В
случаях, когда такого материала требу-
ется немного, его можно взять непо-
средственно с операционного поля ко-
стной ловушкой (см. рис. 6.16, в). Если
же необходимо большое количество
кортикальной или губчатой кости, то
материал для трансплантации берут
или с других участков челюстей прибо-
ром для взятия кости (см. рис. 6.16, д):
с бугра верхней челюсти, в ретромоляр-
ной области или с подбородка. S. Jo-
vanovic и М. Nevins 1183] провели срав-
нительное изучение образования кости
под мембраной с аутокостью и без нее.
С одной стороны под мембрану были
заложены костные опилки с подбород-
ка больного, а с другой — под мембра-
ной оставлено пустое пространство.
Там. где были костные опилки, под
мембраной образовались тонкий слой
фиброзной ткани и кость. Там же, где
костные опилки отсутствовали, обна-
ружен толстый слой фиброзной ткани.
Используют также искусственную
кость и различные пластические мате-
риалы с остеокондуктивными и остео-
индуктивными свойствами.
Разные мнения высказываются об ис-
пользовании деминерализованной кос-
ти. Одни исследователи сообщают о
положительных результатах при ее ис-
пользовании с мембранами |232]. Ме-
жду тем эксперименты на животных с
аллокостью при немедленной имплан-
тации закончились неудачей [74].
Такой же была гистологическая
оценка костной интеграции 12 им-
плантатов Branemark с помощью мем-
бран, деминерализованной кости и ау-
тотрансплантатов в экспериментах на
собаках [76]. Было установлено, что де-
фекты кости, заполненные аутогенной
костью, под мембраной замещаются
чистой кортикальной костью на 95 %,
деминерализованной костью с уста-
новленной мембраной — на 75 %, а за-
крытые только одной мембраной — на
80 %. Гистологически остеогенез был
наиболее выражен при пластике ауто-
костью, когда матрица на 61 % состояла
из кортикальной кости. При использо-
вании только мембраны в матрицах бы-
ло 70,2 % кортикальной и 29,8 % губ-
чатой кости. Наименьший остогенез
отмечен при пластике деминерализо-
ванной костью: в матрице содержалось
всего 8,3 % кортикальной кости. Ос-
теогенез аллокости зависит также от
вида мембраны и аллогенного мате-
риала. Деминерализованный костный
коллаген под коллагеновой мембраной
давал образование кости в 93 %, а толь-
ко под мембраной — в 50 % случаев
(91]. Еще более высокий процент по-
лучен при комбинации аллокости с
мембраной "Gore-Tex" [232]. Различно
и отношение к введению гидроксиапа-
тита в созданное пространство под
мембраной. Н. Wachtel и соавт. [294],
используя гидроксиапатит, сумели до-
биться хороших результатов. Применять
гидроксиапатит рекомендует также
N. Granin [123]. Тем не менее Н. Spie-
kertnann [271] советует проявлять при
этом осторожность, учитывая усиление
резорбтивных процессов в кости.
Оригинальный эксперимент с целью
применения мембран и гидроксиапа-
титно-костных трансплантатов прове-
ли Н. Schliephake и соавт. [255]. Блоки
гидроксиапатита (40x10x10 мм) в ка-
честве пористой матрицы были по-
ставлены 5 поросятам под периост
нижней челюсти и закрыты мембра-
ной. Через 5 мес половина каждого
450
блока вместе с приросшей новой ко-
стью была взята в качестве аутогенного
гидроксиапатитно-костного композит-
ного трансплантата и пересажена на
нижнюю челюсть; одновременно был
установлен плановый имплантат.
Спустя 3 мес в верхней трети удален-
ных блоков обнаружена сильно васку-
ляризированная костная ткань. Ре-
зорбция кости оказалась незначитель-
ной и, как показали промежуточные
наблюдения, постепенно уменьша-
лась. Авторы сделали вывод о том, что
методом направленной регенерации
можно культивировать кость нижней
челюсти в пористую матрицу, чтобы в
дальнейшем использовать полученный
а утоге н н ы й гидро кс иапатитно- кост-
ный трансплантат.
Благоприятные результаты интегра-
ции гидроксиапатита с мембраной ус-
тановили в эксперименте I. Seibert и
S. Nyman 1260]. Их данные подтвержда-
ет и тот факт, что мембраны были более
эффективны при использовании им-
плантатов с гидроксиапатитным покры-
тием: новая костная ткань под мембра-
ной заполняла их на 95,17 %, тогда как
под мембраной у имплантатов с титано-
вым напылением — на 82,8 % ]294, 302].
Наилучшие результаты получены
при использовании биоматериалов
"Bio-Oss", "Osteo-Graf', "Гидроксиапо-
ла", "OsteoGen", покрытых мембраной.
После пластики наблюдался неослож-
ненный остеогенез и мембрана служи-
ла хорошим барьером от микрофлоры
полости рта.
Мембрану "Bio-Gide" рекомендуется
применять с бионаполнителем типа
"Bio-Oss", чтобы исключить западение
мембраны в дефект кости, особенно в
тех случаях, когда у него отсутствуют
две или три стенки, хотя при этом не-
избежно уменьшение объема сгустка
крови. Наилучшие результаты регене-
рации кости с рассасывающейся мем-
браной "Bio-Gide" с наполнителем "Bio-
Oss” отмечались при ее использовании в
ходе немедленной или отсроченной им-
плантации (на 95 и 97 % заполнение ко-
стного дефекта соответственно).
N. Naaman и Р. Ouhayoun [229] по-
лучили хороший эффект при примене-
нии натурального коралла с рассасы-
вающейся мембраной.
Несмотря на некоторые негативные
и спорные вопросы по эффективности
мембран при зубной имплантации, их
оценивают положительно в 95 % слу-
чаях [127]. Кроме того, мембраны ус-
пешно применяют для повышения эф-
фективности немедленной импланта-
ции, лечении периимплантита, закры-
тия дефектов кости при постановке
имплантатов [18, 30, 75, 112, 127, 183,
196, 200, 265]. Положительный опыт
направленной регенерации кости при
зубной имплантации свидетельствует о
том, что к применению мембран име-
ется ряд показаний. Их следует ис-
пользовать: 1) при необходимости уве-
личения ширины и высоты кости в
месте постановки имплантата; 2) для
устранения местного дефекта кости, в
частности при плохом ее качестве в
пришеечной части имплантата; 3) при
отломе стенок созданного ложа; 4) в
случае расхождения швов и обнажения
погружных имплантатов или при ре-
цессии слизистой оболочки вокруг
надальвеолярной части непогружных
имплантатов; 5) мембраны наиболее
эффективны с биоматериалами, кото-
рые они укрывают.
При зубной имплантации наиболее
актуально закрытие дефектов ложа для
имплантата, а также восполнение не-
достающей кости на участке, где он бу-
дет установлен, мембраной с биомате-
риалом.
6.2.9. Стимуляция остеогенеза
при дополнительных операциях
Различные костезамешаюшие аутоген-
ные, аллогенные, ксеногенные, синте-
тические биоматериалы и их комбина-
ции всегда следует смешивать с кровью
из дефекта кости, ложа имплантата, с
рассеченных прилежащих мягких тка-
ней, что повышает остеогенез при пла-
стике. Наибольшая эффективность по-
лучена при использовании с биомате-
риалами плазмы крови, обогащенной
тромбоцитами (PRP) [133, 213, 275].
Для получения плазмы, обогащен-
ной тромбоцитами, из вены пациента
берут кровь и помещают ее в емкость —
шприц, пробирку, капельницу. Ем-
кость ставят устойчиво в центрифугу.
451
Центрифугирование производят со
скоростью 2400 об/мин в течение 10
мин. При этом на дне емкости образу-
ются две порции жидкости: нижняя —
густая порция крови с взвесью лейко-
цитов и эритроцитов и верхняя —
плазма, имеющая желтоватый цвет, со-
держащая тромбоциты крови. При по-
мощи шприца отсасывают верхний
слой — плазму и емкость с ней вновь
подвергают ценрифугированию со
скоростью 3600 об/мин в течение 15
мин. В результате в емкости четко вы-
деляются два слоя: нижний — плазма
более насыщенного цвета и густой кон-
систенции — это плазма, обогащенная
тромбоцитами (PRP); верхний — плаз-
ма бледно-желтого цвета с малым со-
держанием пластинок (РРР). При по-
мощи шприца отсасывают нижний
густой слой плазмы (PRP) и помещают
его в фарфоровую чашку, где смеши-
вают с биоматериалом, с которым бу-
дет производиться костнозамещающее
вмешательство (см. рис. 1.20, а).
Всю процедуру взятия крови, цен-
трифугирования, отсасывания отдель-
ных порций крови выполняют по пра-
вилам асептики и контроля инфекции.
Следует использовать цветовую марки-
ровку для игл и емкостей соответствен-
но трем получаемым порциям крови:
1 — взвеси лейкоцитов и эритроцитов;
И — плазмы, обогащенной тромбоци-
тами (PRP), и III — плазмы, бедной
тромбоцитами (РРР).
Пластика биоматериалами — ауто-
костью, аллокостью, ксенотканью,
синтетической костью и их комбина-
циями с использованием плазмы кро-
ви, обогащенной тромбоцитами, уве-
личивает рост кости на 30—40 % [213].
Феномен увеличения роста кости, эво-
люции ее зрелости определяется тем,
что в тромбоцитах плазмы (PRP) ос-
теоиндуктивно действуют ее состав-
ляющие: трансформирующий фактор
роста pi (TGF-Pi); трансформирую-
щий фактор роста р2 (TGF-p2); инсу-
линоподобный фактор роста (IGF).
PRP, как и ее составляющие, входят в
большую корпорацию факторов роста,
присущих пластинам крови, — тром-
боцитарный фактор роста (TDGF).
Эффективность PRP установлена
при дополнительных операциях на
Рис. 6.35. Создание комбинации биома-
териалов со стимуляторами роста кости —
плазмой, обогащенной тромбоцитами.
1 — шприи с плазмой, обогащенной тромбо-
цитами; 2 — чашка с биоматсриалом; 3 — уло-
женная смесь биоматериала с PRP по альвео-
лярной дуге и вокруг шеек пяти имплантатов.
кости для зубной имплантации [66]
(рис. 6.35).
Остеоиндуктивное действие оказы-
вает новый материал из полипептидов
"Pep-Gen Р-15" (с.м. рис. 1.14, в), кото-
рый смешивают с другими остеопла-
стическими материалами, что дает как
количественное увеличение, так и ка-
чественное улучшение кости [32, 154].
Он успешно прошел эксперименталь-
ные испытания [160] и используется
для костной пластики при зубной им-
плантации [93].
В комбинации с различными мате-
риалами для закрытия дефектов и на-
ращивания кости при имплантации
также применяют костный морфогене-
тический протеин ("BMP"). Он являет-
ся мощным фактором роста [93]. Сре-
ди разных фракций "BMP" наибольшее
значение для индукции кости и стиму-
ляции остеобластных клеток имеет
ВМР-2" [102, 160, 251].
Последняя, 16-я, ежегодная конфе-
ренция Академии остеоинтеграции,
проходивший в марте 2001 г. в Торонто
(Канада), одобрил эти новые техноло-
гии наращивания кости при зубной
имплантации [305].
Таким образом, дополнительные
операции по наращиванию кости для
зубной имплантации проводят по пра-
вилам выполнения пластических вме-
452
Рис. 6.36. Пластика ниж-
ней челюсти аутотранс-
плантатом из симфиза,
а — нехватка кости около
установленного имплантата;
б — фиксация кости к вос-
принимающему ложу; в —
имплантаты, установленные
в материнской кости и пере-
саженном трансплантате.
шательств на челюстях. В
одних случаях их осуще-
ствляют как предым-
плантационное вмеша-
тельство, в других — од-
новременно с постанов-
кой имплантата.
Лучшим материалом
для пластики является
аутокость. Вместе с тем
современные техноло-
гии с применением но-
вых аллопластических,
синтетических пластиче-
ских материалов, стиму-
ляторов роста кости соз-
дают большую перспек-
тиву для наращивания
кости одновременно с
зубной имплантацией.
Большим преимуществом является
возможность избежать дополнитель-
ной операционной травмы, особенно
когда вопрос стоит о взятии гребня
подвздошной кости, ребра, фрагмен-
тов большой берцовой или лучевой
кости. Прогрессивным является нали-
чие аутокости в комбинации биомате-
риалов, но уже в таких случаях можно
ограничиться взятием трансплантатов
с челюстей.
Для зубной имплантации проводят:
I) костную пластику сегментов челю-
стей; 2) костную пластику альвеоляр-
ных отростков челюстей; 3) реконст-
рукцию верхней челюсти; 4) реконст-
рукцию нижней челюсти; 5) репози-
цию нижнего альвеолярного и подбо-
родочного нервов.
6.2.10. Пластика сегментов челюстей
Современные технологии с примене-
нием новых биоматериалов позволяют
остсоиндуктивно или остеокондуктив-
но закрывать дефекты кости при ос-
теотомии на первом этапе импланта-
ции, при осложнениях ее в процессе
последующего лечения. При установ-
лении имплантата, немедленной или
отсроченной имплантации часто тре-
буется наращивание кости, закрытие
костного дефекта. Костная пластика
сегмента челюсти чаше проводится од-
новременно с установлением имплан-
тата. Основными материалами для ко-
стной пластики являются аутокость,
заменители кости — аллогенная кость,
гидроксиапатит, трикальций-фосфат и
другие биоматериалы и их комбина-
ции. Особое значение для успеха кост-
ной пластики и имплантации имеют
мембраны, которые изолируют конст-
рукцию и пластический материал и
способствуют реконструкции кости и
остеоинтеграции биоматериала. Повы-
шает эффективность имплантации и
костной пластики добавление стиму-
ляторов роста кости -PRP, морфогене-
тического протеина, "Pep-Gen Р-15".
Увеличение высоты и ширины челю-
стного сегмента. В случаях недостаточ-
ной для имплантации высоты или ши-
рины кости прибегают к пластике ау-
токостью. Фрагмент аутокости, пре-
имущественно с челюстей, чаще фик-
сируют "внакладку" с вестибулярной
стороны верхней или нижней челюсти,
для увеличения ширины или высоты
альвеолярного сегмента его укладыва-
ют на поверхность альвеолярной дуги
(рис. 6.36).
На челюсти подготавливают ложе
для трансплантата. На его поверхности
при помощи бора образуют ряд отвер-
стий в кортикальной пластинке, чтобы
поверхность кости обильно омывалась
кровью (рис. 6.37, а). На подготовлен-
ный участок кости укладывают биома-
териал (рис. 6,37, б). Слизисто-надко-
стничный лоскут мобилизуют и по-
крывают биоматериал. В других случа-
ях для увеличения ширины на подго-
товленную поверхность кости уклады-
вают блок кости. Взятый фрагмент ау-
токости укладывают на скелетирован-
Рис. 6.37. Подготовка кости челюстного
сегмента к пластике.
а — перфорация кортикальной пластинки;
б — наложение биоматериала.
ную вестибулярную поверхность кости
и укрепляют одним или несколькими
винтами (рис. 6.38, а). Костную пла-
стику проводят в одних случаях как
предымплантационную хирургию, на-
пример, как показано на рис. 6.38, б—г,
когда увеличивают суженный альвео-
лярный сегмент. После предымпланта-
ционной костной пластики на нижней
челюсти через 4 мес (рис. 6.39), на
верхней челюсти через 5—6 мес уста-
навливают имплантаты. В других слу-
чаях пластику проводят одновременно
с установлением имплантата или им-
плантатов. Имплантат вводят в альве-
олярный отросток и заглубляют так,
чтобы основная часть поверхности его
тела и верхушка находились в контакте
с костью челюсти, а вестибулярная по-
верхность располагалась в аутотранс-
плантате. Коронковую часть имплан-
тата следует заглубить на 2 мм ниже
края кости, в том числе костного
трансплантата (рис. 6.40). Все пустоты
заполняют костными опилками. В ре-
конструированный таким образом уча-
сток челюсти можно поставить 2 им-
плантата. Если трансплантат расчленяли
на 2—3 фрагмента, то ставят 3 имплан-
тата. После этого слизисто-надкост-
ничный лоскут укладывают на место и
наглухо зашивают. Через 6 мес им-
плантаты вскрывают, удаляют запор-
ные винты и проводят туалет их внут-
ренней части. Удаляют также винты,
крепившие аутотрансплантат. На им-
плантат ставят супраструктуру и рану
вокрут нее зашивают. Если необходи-
мо, то на 3 нед вводят винт заживле-
ния. Протезирование начинают через
3—4 нед.
Пластику челюстного сегмента в пе-
реднем отделе нижней челюсти прово-
дят по той же методике расширения
альвеолярной дуги и увеличения высо-
ты альвеолярной части с одновремен-
ной установкой имплантата. Можно
использовать кортикальный транс-
плантат, взятый с челюсти.
На верхней челюсти для расшире-
ния альвеолярного сегмента разрез де-
лают по изгибу дуги с небной стороны.
Аутотрансплантат чаще берут с подбо-
родочного отдела нижней или с бугра
верхней челюсти. Обычно его уклады-
вают с вестибулярной стороны альвео-
Рис. 6.38. Прсдымплантационная пла-
стика челюстных сегментов.
а — аутотрансплантатом; б, в, г — наложением
на кость биоматсриала и закрытие его мембра-
ной.
Рис. 6.39. Прсдымплантационная пласти-
ка дистального отдела нижней челюсти,
а — вид аутотрансплантата, укрепленного
винтами; б — вид ремоделированной кости че-
рез 4 мес.
лярного отростка верхней челюсти и
фиксируют винтом. Можно поверх ау-
тотрансплантата, перекрывая его, на-
кладывать мембрану, которую с вести-
булярной стороны фиксировать двумя
мини-винтами или шпильками, а так-
же биовинтами. Очень важна подго-
товка мягких тканей для закрытия
мембраны — отслаивание от надкост-
ницы слизистой оболочки и ес моби-
лизация. Сначала над мембраной укла-
дывают надкостницу, затем — слизи-
стую оболочку для глухого закрытия
раны и плотно накладывают узловые и
матрацные швы.
Наращивание кости можно также
проводить с помощью синтетических
биоматсриалов — "Колапола КП-3”,
"Коллапана", "OstcoGen", "Interpo-
ге-200". После откидывания лоскутов
455
Рис. 6.40. Пластика челюстного сегмента с последующей имплантацией.
а — увеличение высоты и ширины кости; б, в — увеличение ширины кости |Block М., Kent J.,
1995]; г — трансплантат укреплен винтом; д — рентгенограмма нижней челюсти с установлен-
ными имплантатами в рсмодслированную кость; е — вид установленных имплантатов через 4 мес
и вскрытых для этапа протезирования.
мягкие ткани подготавливают к адек-
ватному закрытию раны. Затем с целью
обеспечения васкуляризации и про-
никновения исходных костных клеток
круглым бором с обильным орошени-
ем стерильным изотоническим раство-
ром натрия хлорида перфорируют
щечную и язычную кортикальные пла-
стины кости. Накладывают биомате-
риал на подготовленные участки кос-
ти, мобилизуют мягкие ткани и рану
ушивают наглухо. Одновременная ко-
стная пластика и имплантация отлича-
ются тем, что через обе кости — транс-
плантат, уложенный по альвеолярной
дуге, и кость челюсти — проводят ос-
теотомию и ставят имплантат. Послед-
ние могут быть фиксирующими эле-
ментами блоков трансплантата. Если
применяют материал в виде гранул,
пасты, блоков, то ими обкладывают
обнаженную часть имплантата, уплот-
няя и утрамбовывая их, и плотно за-
крывают мягкими тканями. После глу-
хого зашивания мягких тканей накла-
дывают пародонтологическую повязку.
При очень тонкой кости челюсти,
когда в нее невозможно погрузить часть
тела и верхушку имплантата, операцию
выполняют в два этапа: сначала транс-
плантация кости или биоматериала,
через 4—6 мес установление импланта-
та [44) (см. рис. 6.38, 6.39).
Через 4—6 мес ремоделированная и
материнская кость представляют собой
единый массив, который готов для ос-
теотомии и создания ложа для имплан-
тата или имплантатов (см. рис. 6.40).
Аналогично проводят наращивание
кости челюстного сегмента по высоте.
Увеличение недостающей ширины и
высоты челюстного сегмента одновре-
менно с имплантацией или как пред-
ымплантационную операцию всегда
нужно четко планировать, прогнози-
руя будущую величину реорганизован-
ной кости и положение конструкции в
ней. Следует всегда ставить погружные
имплантаты и второй этап проводить
только после рентгенологического
подтверждения остеоинтеграции кон-
струкции. Иногда это может быть бо-
лее чем через 4—6 мес после костной
пластики и имплантации. Увеличение
ширины челюстного сегмента можно
осуществлять вертикальной остеото-
Рис. 6.41. Пластика суженного челюст-
ного сегмента транспозицией вестибу-
лярной и оральной стенок и заполнение
образовавшегося пространства биомате-
риалом.
а — сужение альвеолярного сегмента: 1 — ли-
ния сужения. 2 — линия рассечения мягких
тканей; б — откинут слизисто-надкостничный
лоскут и бором намечена линия остеотомии;
в — направление транспозиции костных сте-
нок; г — установлен имплантат, лоскут уложен
на место и фиксирован швами.
мией, расщеплением кости, транспо-
зицией вестибулярной или оральной
стенки, а также обоих стенок и введе-
нием биоматериала в образовавшееся
пространство внутрь кости (рис. 6.41).
Аналогично для расширения костного
Рис. 6.42. Пластика суженного челюст-
ного сегмента надломом и транспозици-
ей вестибулярной стенки и заполнением
образовавшегося пространства биомате-
риалом.
а — вид суженного челюстного сегмента; б — ли-
ния рассечения мягких тканей; в — направление
транспозиции кости; г — заполнение образовав-
шегося пространства биоматериалом; д — уста-
новлены имплантаты, уложен слизисто-над-
костничный лоскут и фиксирован швами; е —
вид челюстного сегмента через 4 мес.
сегмента производят распил кости по
вертикали и надлом вестибулярной
стенки. При транспозиции необходимо
сохранение ее связи с надкостницей.
Образуется пространство, заполняемое
биоматериалом (рис. 6.42). Особого
внимания требует костная пластика пе-
реднего отдела верхней челюсти для
правильного соотношения зубных дуг.
Пластика челюстного сегмента в пре-
делах одного — трех зубов с одновре-
менной имплантацией должна преду-
смотреть заглубление апикального от-
дела конструкции в материнскую кость
и плотное утрамбовывание биоматериа-
ла во всех пустотах образованного про-
странства. Также рекомендуется ис-
пользование погружных имплантатов.
Коронковая часть имплантата должна
быть или на уровне края кости (и во-
круг нее уложен биоматериал), или на
1—2 мм ниже. Однако в таких случаях
трудно прогнозировать атрофию кости
после операции. Через 4—6 мес неред-
ко приходится убирать навесы кости,
иначе могут возникнуть трудности при
постановке супраструктуры.
Поэтапное хирургическое лечение:
костная пластика, через 4—6 мес им-
плантация и далее через 4—6 мес орто-
педическое лечение, конечно, по дли-
тельности уступает одновременной
пластике и постановке имплантата, но
достаточно надежно для получения
окончательного результата лечения.
Пластика костных дефектов около
имплантатов. Дефекты кости у им-
плантатов могут образоваться при ос-
теотомии, когда отламывается стенка
ложа или ее часть. Кроме того, дефект
кости у имплантата может быть обу-
словлен атрофией кости. Чаще возни-
кают краевые дефекты кости с вестибу-
лярной стороны имплантато-челюст-
ного сегмента. Кроме того, атрофия
кости после удаления зубов может вес-
ти к образованию дырчатого дефекта
или продольного по оси имплантата.
Планирование пластики дефектов
кости у имплантата следует проводить
по классификации Jensen (174] (рис.
6.43).
При пластике дефектов кости био-
материалами следует подготовить уча-
сток кости и мобилизовать мягкие тка-
ни для глухого закрытия раны. Нало-
4SS
Рис. 6.43. Классификация костных дефектов по Jensen.
а — расположение имплантата в кости в норме; б — краевой дефект у корональной части им-
плантата; в — дефект кости по вертикали и горизонтали у тела имплантата; г — тотальный дефект
кости, только верхушка имплантата находится в кости.
жив биоматериал (стружку, гранулы,
пасту) на дефект, плотно утрамбовыва-
ют его. Если используется материал в
виде пластины, блока, их также плотно
адаптируют к дефекту. Эффективно
обильное пропитывание биоматериала
кровью из раны или плазмой крови па-
циента, обогащенной тромбоцитами
(PRP), добавление полипептита "Pep-
Gen Р-15", морфогенетического про-
теина.
В процессе имплантации во избежа-
ние образования дефекта кости биома-
териал следует ставить на участках воз-
можной перфорации, разлома кости.
На верхней челюсти при установке им-
плантата на участок второго премоляра
и первого моляра, учитывая близкое
расположение верхнечелюстной пазу-
хи, прибегают к изоляции верхушки
конструкции или локальному поднятию
ее остеотомо.м и укладывают блок био-
материала. Блоком биоматериала изо-
лируют также канал нижней челюсти.
Изоляции биоматериала и профилакти-
ке его инфицирования способствует са-
моклеющаяся пленка с лидокаином и
хлоргексидином — "Диплен-Дента ХД".
Ею покрывают биоматериал, заводя
края под надкостницу и фиксируя над
ней мягкие ткани глухими швами. При
установке непогружных имплантатов
пленку укладывают над биоматериалом
в виде пончо.
При закрытии дефекта кости зажив-
ление раны и ремоделирование биома-
териала лучше всего происходят под
мембраной.
Постановку нерассасывающейся мем-
браны производят следующим образом.
После рассечения слизистой оболочки
и надкостницы, откидывания лоскутов
дефект кости заполняют биоматериа-
лом и закрывают мембраной. Если ис-
пользуют только мембрану, тщательно
проверяют, имеется ли под нею адек-
ватное пустое пространство и как оно
заполнено кровью, необходимой для
формирования в нем новой кости [92].
Если кортикальное вещество кости
гладкое и на его поверхности не видно
мелких кровоточащих сосудов, осуще-
ствляют поверхностную декортика-
цию. Рекомендуется также орошение
места установления мембраны и транс-
плантата кровью, для чего перфориру-
ют кортикальную пластину [I08J.
Мембрану подрезают так, чтобы она
перекрывала дефект на 3—4 мм по все-
му периметру. После наложения углы
мембраны обязательно срезают, чтобы
они не стали причиной повреждения
мягких тканей. Мембрана должна
очень плотно прилегать к кости у де-
фекта. С этой целью рекомендуется ос-
торожно завести края мембраны под
периост и зашить их рассасывающи-
мися нитками в ключевых точках (рис.
6.44). Мембрану фиксируют прямым
наложением на нее слизисто-надкост-
ничного лоскута или предварительным
прикреплением к кости мини-винтами
либо шпильками, которые способству-
ют также стабилизации сгустка крови
или биоматериала под мембраной
[ 108J. Если же необходимо, чтобы ре-
генерировала кость вокруг коронковой
части установленного имплантата, то
мембрану накладывают на него в виде
пончо и фиксируют на нем запорный
винт, для чего в мембране делают от-
верстие (рис. 6.45). Диаметр отверстия
Рис. 6.44. Закрытие мембраной дефекта
кости около имплантата.
а — введение мембраны под надкостницу и
фиксация ее; б — зашивание мягких тканей
над мембраной.
должен быть таким, чтобы запорный
винт не просто плотно входил в него, а
обязательно вворачивался, поскольку
как в этом случае, так и при использо-
вании мини-винтов и шпилек сделан-
ные ими отверстия могут стать ворота-
ми для проникновения патогенных
микробов, если произойдет обнажение
мембраны. Целесообразно пользовать-
ся мини-винтами из биоматериала, ко-
торые рассасываются и не требуют уда-
ления (см. рис. 1.18, д).
Мембрану следует хорошо закрыть
лоскутом, уложив его так, чтобы он не
был натянут и мембрана не испытывала
лишней компрессии. При закрытии
мембраны большое внимание обраща-
ют на размеры лоскута и его кровоснаб-
жение с целью ускорения заживления и
активизации регенеративных процессов
под мембраной, а также на адекватность
его толщины, достигаемой при необхо-
димости щадящим истончением лоску-
та. После рассечения мягких тканей до
установления имплантата с лоскута
нужно удалить патологические грануля-
ции, которые могут быть источником
инфекции. Особое внимание обраща-
ют на нетравматичность наложенных
швов и их прочность. При закрытии
нерассасываюшихся мембран e-PTFE
шовный материал выбирают главным
образом из-за его инертности и воз-
можности не снимать швы 2—3 нед.
Рис. 6.45. Закрытие дефекта кости и им-
плантата мембраной в виде пончо,
а — поставлен имплантат и дефект с вестибу-
лярной стороны закрыт биоматериалом, сме-
шанным с кровью; б — выкроена мембрана в
виде пончо и поставлена, закрыв дефект кос-
ти. мобилизован слизисто-надкостничный
лоскут; в — вид имплантата и пришеечного
участка коллагеновой мембраны.
ДАЦ
В послеоперационном периоде очень
важны регулярные гигиенические про-
цедуры в полости рта и перевязки (2—
3 раза в неделю). В раннем послеопе-
рационном периоде в области мембра-
ны могут возникать воспалительные
явления, прорезаться ее край или об-
нажиться одна из поверхностей. В та-
ких случаях увеличивают длительность
антибиотикотерапии и проводят мест-
ное противовоспалительное лечение, в
частности накладывают пленку "Дип-
лен-Дента ХД".
Мнения ученых и врачей-практиков
о времени удаления нерассасывающих-
ся мембран противоречивы. Оптималь-
ным сроком удаления мембраны счи-
тают 6—10 нед, так как именно через
10 нед обнаруживается твердая ткань,
клинически схожая с костью, в кото-
рой костный рисунок определяется
при рентгенологическом исследовании
1107]. При удалении мембраны через 4
нед остается рыхлая грануляционная
ткань. Вместе с тем, если ткани ярко-
красные, отечные и слегка кровоточат,
то возможна их регенерация, но следу-
ет исключить их инфицирование и по-
сле зашивания тканей. Через 6 нед
вновь образованные ткани становятся
плотными.
При использовании мембран возмо-
жен ряд осложнений: нагноение в ран-
нем и позднем периодах регенерации,
перфорация и обнажение, неполное
восстановление кости в области дефек-
та, а иногда образование только грану-
ляционной или фиброзной ткани.
Так, S.A. Jovanovic и соавт. [179, 180]
получили хорошие результаты при за-
крытии дефекта кости, но отметили
единичные случаи перфорации мем-
браны в период приживления имплан-
татов.
На основе микробиологических и
клинических исследований Н. Nowzari
и J. Slots [233] сделали вывод, что глав-
ной причиной осложнений и неудач
при использовании мембран e-PTFE
при закрытии дефектов кости при им-
плантации является их инфицирование.
Перед их постановкой рекомендуется
тщательно контролировать микрофло-
ру полости рта. Другой причиной ос-
ложнений считается то, что в течение
всего периода лечения направленная
регенерация кости в высокой степени
зависит от плотности закрытия кост-
ного дефекта мягкой тканью [126, 143,
297]. Даже незначительное расхожде-
ние краев раны может привести к пол-
ной неудаче.
Хирургические действия при поста-
новке рассасывающихся мембран для
закрытия дефектов кости у импланта-
тов такие же, как при постановке не-
рассасывающихся. Рассасывающиеся
мембраны плотно прикрепляют к кра-
ям дефекта так, чтобы создать под ни-
ми свободное пространство, где распо-
лагался бы сгусток, или оно должно
быть заполнено биоматериалом, что
стимулирует рост тканей с краев де-
фекта [75, 144].
Накладывают мембрану так, чтобы
края ее на 3—4 мм перекрывали края
дефекта. Некоторые клиницисты реко-
мендуют делать на мембране горизон-
тальный надрез, облегчающий ее под-
гибание в язычную сторону [254].
Затем мембрану крепят к кости вин-
тами. Для плотной фиксации рассасы-
вающихся мембран в настоящее время
разработаны и используются рассасы-
вающиеся винты ("Bio-Pin") (см. рис.
1.18, д). Мягкие ткани мобилизуют,
укладывают на место и зашивают. Ре-
комендуется накладывать матрацные
швы, которые предохраняют лоскут
от натяжения, обеспечивают плотное
прилегание мембраны к транспланта-
ту, а также препятствуют отеку тканей
в раннем послеоперационном пе-
риоде.
В течение 21 дня мембрана рассасы-
вается, а "тканевая оппозиция" занима-
ет все пространство дефекта, постепен-
но проходя стадии образования, созре-
вания, превращения соединительной
ткани в остеоидную и затем в костную.
Однако реакция тканей на рассасываю-
щиеся мембраны не всегда одинакова.
Материал мембраны может неадекват-
но взаимодействовать с тканевыми фер-
ментами. Из рассасывающихся мем-
бран наиболее эффективны коллагено-
вая или костная мембрана.
Закрытие дефекта кости биомате-
риалом и коллагеновой мембраной тре-
бует глухого зашивания тканей. Для
этого в отдельных случаях приходится
мобилизовать мягкие ткани или рас-
спаивать их, а затем плотно сшивать
надкостницу со слизистой оболочкой
[37]. Вместе с тем при нехватке мягких
тканей для ее закрытия возможно ос-
тавление небольших открытых участ-
ков [179, 235]. В таких случаях дня за-
крытия биоматериала лучше приме-
нять мембраны коллагеновые или ар-
мированные титаном (рис. 6.46).
D. Buser и соавт. [107, 108], S. Jo-
vanovic и М. Nevins [183] считают мем-
брану основным материалом для за-
крытия дефекта кости около имплан-
тата, поскольку такая методика обес-
печивает закрытие сгустка на этом уча-
стке. J. Hahn [154] воздерживается от
применения мембран при импланта-
ции. Он получал постоянно хорошие
результаты, используя материалы "Os-
teo-Graf и "Pep-Gen Р-15" для закры-
тия дефектов кости при имплантации.
Наш опыт свидетельствует, что для за-
крытия дефекта необходим биоматери-
ал, а вопрос о покрытии его мембраной
решается избирательно [37]. Вместе с
тем надо признать, что для восполне-
ния кости, особенно значительных де-
фектов, мембрана не играет основной
роли в костеобразовании, а является
больше зашитой для оптимального ре-
моделирования подсаженного биома-
териала.
Костная пластика при немедленной
имплантации. Уддпение зуба дпя немед-
ленной имплантации может привести к
дефекту кости как у коронковой части,
так и вдоль всей альвеолы. Для закры-
тия дефектов при немедленной им-
плантации в лунку уддтенного зуба так-
же применяют биоматериалы и мембра-
ны [229, 286]. Пустоты у введенного в
альвеолу имплантата заполняют биома-
териалом — опилками ауто- и аллоко-
сти, гидроксиапатитом, трикдтьций-
фосфатом и другими — и закрывают
мембраной. В этом случае мембрана не
Рис. 6.46. Закрытие дефекта кости около имплантата.
а — обнажение вестибулярной поверхности имплантата; б — закрытие дефекта кости биомате-
риалом; в — создание костной стенки костной мембраной; г — фиксация биоматериалов тита-
новой мембраной.
только стимулирует рост кости, но и
препятствует прорастанию эпителия и
предотвращает атрофию альвеолярного
гребня вокруг имплантата (199].
Главное при заполнении пустот био-
материалом и закрытия его мембраной
при немедленной зубной имплантации
заключается в формировании лоскута
и глухом зашивании раны. Если по со-
седству с альвеолой, в которую должен
быть помещен имплантат, имеются зу-
бы, то слизисто-надкостничный лос-
кут удлиняют за счет разрезов с внут-
ренней стороны соседних зубов. В тех
случаях, когда соседние зубы отсутст-
вуют, слизисто-надкостничный лоскут
удлиняют путем увеличения разрезов в
стороны и небольшого рассечения
центральной части надкостницы у сво-
да преддверия рта. В обоих случаях мо-
билизованная часть лоскута должна
перекрывать дефект кости на участок
величиной в один зуб в обе стороны от
удаляемого. Лоскут откидывают только
в вестибулярную сторону. Если удаля-
ют один из премоляров на нижней че-
люсти, то на уровне второго премоляра
и первого моляра обнажают подборо-
дочный нерв. Слизистую оболочку и
надкостницу осторожно отделяют в
язычную сторону только для обзора де-
фекта кости, альвеолы и края альвео-
лярной дуги. При рассечении мягких
тканей желательно сохранить круговую
связку зуба (112, 261]. Зуб удаляют спо-
собами, описанными выше, с большой
осторожностью и с минимальной трав-
мой кости альвеолы. Лучше делать это
путем медиодистальной люксации не-
большими элеваторами. Затем прово-
дят туалет лунки зуба и тампонируют
ее губкой, пропитанной раствором
гентамицина.
Осматривая фрагмент кости альвео-
лы и удаленный корень, учитывают ре-
зультаты рентгенологических исследо-
ваний, еще раз оценивают место для
установления имплантата и размер де-
фекта кости и соответственно подби-
Рис. 6.47. Применение биоматериалов
при немедленной имплантации.
а — пустоты кости в устье альвеолы вокруг
имплантата; б — закрытие раны биоматсриа-
лами и мембраной; в — вид ре моделирован-
ной кости.
463
Рис. 6.48. Немедленная имплантация
с одновременной костной пластикой,
а — немедленная имплантация, видна нехват-
ка кости в устье альвеолы и недостаточная
ширина кости у других установленных им-
плантатов; 6 — вид альвеолярного сегмента
с имплантатами, уложенным биоматериалом,
покрытым коллагеновой мембраной.
рают длину и диаметр имплантата.
Особенно тщательно определяют де-
фект кости, подлежащий закрытию
биоматериалом изолированно или с
мембраной. Обычно он начинается с
вестибулярной стороны альвеолы и пе-
реходит на альвеолярную дугу (рис.
6.47). При немедленной имплантации
чаще ставят конструкцию в форме кор-
ня зуба, реже — плоской формы. Уча-
сток дефекта кости заполняют биома-
териалом, а над ним укладывают мем-
брану, перекрывая его края на 3—4 мм
и плотно фиксируя к кости шпильками
(75]. Погружные имплантаты покрыва-
ют мембраной наглухо, непогружные —
как пончо [40 , 41, 82] (см. рис. 6.45).
Вокруг штифта или опорной головки
слизисто-надкостничный лоскут укла-
дывают на место и без натяжения на-
кладывают узловые швы и 2—3 матрац-
ных. Узловые швы снимают на 7—8-й,
матрацные — на 14-й день. Через 6—10
нед нерастворимую мембрану удаляют.
Имплантат вскрывают через 4 мес на
нижней и 6 мес на верхней челюсти и
на него ставят винт заживления, после
чего начинают протезирование.
При немедленной имплантации в
лунку удаленного зуба применяют
комбинацию биоматериалов. К этому
прибегают в тех случаях, когда диаметр
лунки больше диаметра имплантата
(рис. 6.48). В ступке биоматериал сме-
шивают фарфоровым пестиком и до-
бавляют кровь из альвеолы или плазму,
обогащенную тромбоцитами из крови
больного. После установления и за-
глубления имплантата этой смесью за-
полняют пустоты, покрывают тело им-
плантата, а если он плоский, то и пле-
чи. Смесь накладывают также на де-
фекты кости. Если дефект диаметром
более 1 мм, то предпочтительнее плот-
но закрывать его кортикальной алло-
генной костью и обкладывать ее края
опилками аутокости, а также закры-
вать челюстной сегмент самоклеющей-
ся пленкой "Диплен-Дента ХД". Ком-
бинированную методику постановки
кортикальных аллотрансплантатов с
измельченной аутокостью применяют
также в тех случаях, когда после немед-
ленной имплантации остается краевой
дефект альвеолы, чаще с вестибуляр-
ной стороны. Кроме того, при немед-
ленной имплантации нельзя исклю-
чить ситуацию, при которой заглублен-
ный до конца имплантат все-таки вы-
ступает из-за дефекта кости по краям
лунки. В таких случаях на имплантат
ставят аллотрансплантат или блок дру-
гого биоматериала, края которого об-
кладывают стружкой или опилками ау-
токости, гранулами костных материа-
лов, смоченными жидкими компонен-
тами стимуляторов роста кости — мор-
фогенетическим протеином, гелями,
плазмой, обогащенной тромбоцитами.
Костная пластика при отсроченной
имплантации в лунку удаленного зуба.
Отсроченная имплантация всегда со-
провождается костной пластикой. По-
сле удаления зуба проводят промыва-
ние и щадящий кюретаж альвеолы при
гнойном процессе или активный кю-
ретаж при хроническом деструктивном
процессе. В случае наличия пародон-
тита и разрастаний грануляций их вы-
скабливают у края десны и из приле-
жащей кости, подготавливают мягкие
ткани для глухого зашивания раны.
Альвеолу плотно заполняют биомате-
риалом и на слизистую оболочку и
надкостницу (рис. 6.49) накладывают
швы. Однако после удаления зубов,
помимо пластики альвеолы, могут по-
требоваться расширение альвеолярной
дуги, коррекция контура кости, увели-
чение высоты кости, поэтому, помимо
плотного заполнения биоматериала
альвеолы или альвеол, его распределя-
ют по вестибулярной, язычной или
небной поверхности кости (рис. 6.50) и
затем рану зашивают, мобилизовав
слизистую оболочку. Иногда для буду-
щей имплантации, в том числе из со-
ображений окклюзии, необходимо
создать широкий альвеолярный отрос-
ток после удаления зубов. Особенно
это требуется из функциональных и эс-
тетических соображений в переднем
отделе верхней челюсти. Хорошие ре-
зультаты дает покрытие альвеолы, за-
полненной биоматериалом, мембра-
ной. Действия с нерастворимыми и
растворимыми мембранами проводят
по общепринятым правилам. При бла-
гоприятном заживлении костной раны
через 6 нед можно приступать к остео-
томии и постановке имплантата.
Остеотомию проводят только на-
правляющим и первым формирующим
сверлом. Имплантаты применяют по-
гружные и преимущественно самона-
резные. Если биоматериал был покрыт
нерастворимой мембраной, ее удаляют
при установлении имплантата. При не-
растворимой мембране она через 6 нед
интимно связана с ремоделированной
тканью биоматериала. Остеотомию
проводят также через весь конгломерат
еще незрелой остеоидной ткани. Вто-
рой этап при пластике кости и отсро-
ченной имплантации проводят в зави-
симости от данных рентгенографии,
визиографии через 12—16 нед (рис.
6.51). Аналогично выполняют пластику
ложа имплантата после удаления кон-
струкции при неудачной имплантации.
Дистракция и пластика кости. Но-
вым методом увеличения кости челю-
сти с целью создания достаточного
места для зубного имплантата является
дистракция [115а, 151]. Она основана
на концепции Етизарова, но без созда-
ния компрессии кости. В последние 2
года проведены исследования по при-
менению дистракции кости для зубной
имплантации [115а, 151]. Выполняют
остеотомию только кортикальной кос-
ти. По данным М. Chin [305], остеото-
мия челюстного сегмента и его дистрак-
Рис. 6.49. Подготовка к отсроченной им-
плантации.
а — зубы, подлежащие удалению; б — альвео-
лы центральных резцов заполнены биомате-
риалом; в — на мягкие ткани наложены швы.
465
Рис. 6.49. Продолжение.
г — альвеолы после удаления верхнего второго премоляра и первого моляра, вестибулярная стен-
ка альвеол отсутствует; д — альвеолы заполнены биоматериалом, и костный дефект закрыт мем-
браной; е — вид молодой кости через 3 мес; ж — ортопантомограмма дистального отдела верхней
челюсти, инден имплантат, установленный в ремодслиронанную кость; з — оргопантомограмма
с установленным плоским имплантатом после костной пластики.
466
Рис. 6.50. Этапы отсроченной имплантации.
а — альвеолы удаленных зубов; б - заполнение альвеол биоматсриалом и увеличение ширины
кости; в — вид кости через 6 нед; г — рентгенограмма альвеол с рсмоделированным биомате-
Риалом через 3 мес; д -- вид имплантатов, установленных в области резцов, через 6 мес.
ция ведут к активизации костных клеток
и построению кости в образовавшемся
пространстве без введения биоматсриа-
лов (рис. 6.52). L. Laster, L. Rachmiel,
J.F. Berard (2001) считают возможным
получение высокого эффекта как при
вертикальной, так и при горизонталь-
ной дистракции. Авторы добивались
увеличения кости до 20 мм. Аппарат для
дистракции может одновременно про-
водить вертикальную и горизонтальную
дистракцию. Через 2 мес осуществляют
имплантацию. Возможна усадка кости
на 1—2 мм. Вместе с тем S. Kallur и со-
авт. [305J считают, что дистракцион-
ный остеогенез следует фиксировать и
регулировать ортодонтическими мето-
дами. В таких случаях, по мнению ав-
торов, требуется хирургическая кор-
рекция с наращиванием мягких и ко-
Рис. 6.51. Восполнение альвеолы после удаления зуба "OsteoGen" с последующей от-
сроченной имплантацией.
а — рентгенограмма после пластики кости; б — рентгенограмма через 6 мес. видны имплантаты,
установленные в рсмодслированную кость.
стных тканей при имплантации. Судя
по количеству докладов на конферен-
ции Академии остеоинтеграции по ди-
стракции кости для зубной импланта-
ции [Toronto (Канада), 2001 г.], этот
метод можно считать перспективным.
Однако он требует дальнейших моти-
вированных теоретических и клиниче-
ских исследований.
Ортодонтическое лечение при зубной
имплантации. Как вертикальное, так и
горизонтальное направления остеоге-
неза при наращивании или дистракции
кости делают актуальным ортодонти-
ческое лечение. Н. Spikennann и соавт.
[271] демонстрировали ортопедиче-
ские методы как предымплантацион-
ную подготовку. У пациентов молодого
и зрелого возраста одной из возможно-
стей восполнить дефект зубного ряда
является зубная имплантация. Недос-
таточное место для постановки им-
плантата может быть устранено орто-
донтическими технологиями. В то же
время нарушение соотношения зубных
рядов может обусловить для импланта-
та и протеза с опорой на него опасные
нагрузки, что создает угрозу для его от-
торжения. С целью коррекции прикуса
также эффективным является ортодон-
тическое предымплантационное лече-
ние. Исследования Н. Spiekermann
[271], F. Celenza [305] убедительно сви-
детельствуют об эффективности орто-
донтии перед зубной имплантацией
(рис. 6.53).
6.2.11. Пластика альвеолярного
отростка верхней челюсти
и альвеолярной части нижней
челюсти
Перед пластической операцией, поми-
мо общепринятых клинических и рент-
генологических исследований, следует
особенно тщательно провести ортопе-
дическую диагностику моделей и опре-
делить задачи протезирования на им-
плантатах. Цель реконструкции зави-
сит от результатов диагностического
обследования пациента [90]. Если на
верхней челюсти высота альвеолярного
отростка менее 8 мм, а ширина менее
4 мм, то перед установлением круглых
имплантатов он должен быть увеличен.
По мнению J. Tidwell и соавт. [285], до-
пустимой шириной альвеолярного от-
ростка следует считать 5 мм и только в
случаях, когда она меньше, нужно при-
бегать к его пластике [169]. Методика
реконструкции во многом зависит от
анатомических соотношений альвео-
лярных дуг челюстей, количества и ка-
чества остаточной кости, расположе-
ния канала нижней челюсти и подбо-
родочного отверстия, верхнечелюст-
ной пазухи, дна полости носа.
Вид пластики во многом определя-
ется также классом атрофии кости. Ес-
ли атрофия кости П класса, лучше вос-
полнять кость накладным транспланта-
том. Атрофию кости 111 класса устра-
няют как накладным, так и вставным
468
Рис. 6.52. Дистракция челюстного сег-
мента.
а — снижение высоты кости; б — фиксация
дистракционного аппарата и начало дистрак-
ции; в — результат дистракции — увеличение
высоты кости.
Рис. 6.53. Ортодонтическое лечение при
имплантации.
а. б суженные альвеолярные сегменты в об-
ласти верхних боковых резцов; в, г — вид зуб-
ного ряда и рентгенограммы после протезиро-
вания.
введением биоматериала, а также их
комбинацией.
Костная пластика альвеолярного от-
ростка верхней челюсти и альвеоляр-
ной части нижней челюсти может быть
осуществлена следующими методами:
• пластикой "внакладку'" по гребню
альвеолярной дуги или на одну из
поверхностей ската кости, чаще вес-
тибулярной поверхности;
• пластикой внутрь кости после вер-
тикальной остеотомии и транспози-
ции одной или обеих стенок кости;
• вертикальной остеотомией с надло-
мом одной из стенок и заполнением
образовавшегося пространства био-
материалом.
Пластика альвеолярного отростка
челюсти биоматсриалом "внакладку".
Увеличение высоты альвеолярного от-
ростка проводят накладным транс-
плантатом, уложенным по альвеоляр-
ной дуте. Если реконструкцию альвео-
лярного отростка нужно делать по всей
альвеолярной дуге, требуются транс-
плантаты больших размеров, в основ-
ном гребень подвздошной кости, реб-
ро. Так же, как при пластике челюст-
ных сегментов, следует подготовить
кость к восприятию трансплантата:
сформировать ложе, провести его по-
верхностную декортикацию или пер-
форацию кортикальной пластинки и
обеспечить плотное прилегание пере-
саживаемого материала к материнской
кости [135] (см. рис. 6.37). Трансплан-
тат фиксируется винтами, а если одно-
временно с пластикой ставят имплан-
таты, то они могут служить фиксацией.
Формирование ложа для имплантатов
проводят через обе кости — остаточ-
ную кость челюсти и трансплантат.
При постановке имплантатов на ниж-
ней челюсти важно, чтобы половина
тела конструкции находилась в мате-
ринской кости. Имплантация через
трансплантат, уложенный по альвео-
лярному отростку верхней челюсти,
требует вычислений точных размеров
остаточной кости и соотношения ее с
полостью носа и верхнечелюстной па-
зухой. Имплантация вместе с костной
пластикой и предымплантационное
наращивание кости альвеолярных от-
ростков челюстей требует соблюдения
правила правильного соотношения
зубных дуг, особенно в переднем отде-
ле верхней челюсти. Здесь после утраты
зубов значительно атрофируется вес-
тибулярная поверхность альвеолярно-
го отростка, образуя косой скат.
Увеличение ширины альвеолярного
отростка проводят наложением транс-
плантата на вестибулярную поверх-
ность кости. Костную пластику и им-
плантацию осуществляют чаще в два
этапа (см. рис. 6.40). На верхней челю-
сти следует так рассчитать количество
трансплантируемой аутокости, чтобы
потом имплантат принял правильное
положение ближе к небному отростку
и над областью шейки имплантата
круглой формы или нал плечом пло-
ской конструкции оставалось не менее
2 мм кости [95].
Для наращивания кости на альвео-
лярный отросток верхней челюсти и
альвеолярную часть нижней челюсти
эффективно применение комбинации
ауто- и аллокости [89, 133, 300]. Комби-
нированное использование ауто- и ал-
лотрансплантатов проводится по мето-
дике пластики "внакладку", трансплан-
тат фиксируют винтом. Однако пред-
почтительнее восполнять дефект кости
аллотрансплантатом, а аутокость в ви-
де небольших пластинок, стружки или
небольших кусочков укладывать в ос-
новном по краям дефекта. Имплантат
ставят после ремоделирования кости,
клинического и рентгенологического
подтверждения ее ширины и высоты,
необходимых для постановки конст-
рукции. При одновременной имплан-
тации погружные имплантаты следует
заглублять в кость на 2 мм, так как в те-
чение первого года резорбтивные про-
цессы в кости протекают активно и к
моменту ремоделирования подсажен-
ного биоматериала его коронковая
часть будет вровень с костью. Однако
при немедленной имплантации при
удалении зуба такое углубление бывает
неоправданным. Нам приходилось на
втором хирургическом этапе убирать
навесы кости над запорным винтом и
нередко возникали трудности при по-
становке супраструктуры [40]. Лучшие
результаты оказывались при располо-
жении коронковой части имплантата
вровень с поверхностью кости.
Более щадящим способом костной
пластики альвеолярных отростков че-
люстей следует считать использование
аллокости. Она может помешаться как
"внакладку", так и внутрь кости после
ее расщепления или надлома и транс-
позиции одной из стенок.
Если требуется уплощение альвео-
лярного гребня одновременно с сохра-
нением высоты альвеолярного отрост-
ка, эффективны пластинки кортикаль-
ной аллокости различных способов
консервирования.
Кортикальные пластинки кости так-
же используют для расширения альве-
олярного отростка. Для этого делают
поперечный разрез через слизистую
оболочку и надкостницу на 3—4 мм
кпереди от участка запланированной
реконструкции. Специальными распа-
торами надкостницу аккуратно отслаи-
вают от кости. Создав тоннель под над-
костницей, поверхность кости слегка
препарируют с помощью фрезы, чтобы
заполнить пространство кровью. Од-
нако войти в поднадкостничный тон-
нель трудно, и чаще приходится распа-
тором "поскрести" или "поцарапать"
поверхность кости перед введением
биоматериала [65, 211, 212]. Деминера-
лизованную кортикальную пластину
укладывают так, чтобы она легла на
кость и не было разрывов надкостни-
цы, а линия разреза слизистой оболоч-
ки и надкостницы перекрывала край
аллотрансплантата [204]. Костные пла-
стинки при введении под надкостницу
легко моделировать по контуру альве-
олярной дуги.
Если надкостница по альвеолярной
дуге плотно сращена с костью, то соз-
дание под надкостницей свободного
пространства для введения аллопла-
стического материала является наибо-
лее трудной частью такой операции.
Нередко, чтобы избежать разрыва над-
костницы при формировании тоннеля,
рассекают слизистую оболочку, отслаи-
вают ее от надкостницы и мобилизовы-
вают мягкие ткани. Затем рассекают
надкостницу, отступив от линии разреза
слизистой оболочки, и с большой осто-
рожностью отслаивают от кости, только
на протяжении длины кортикальной
пластинки. В обнаженной кости свер-
лят несколько отверстий, чтобы ее по-
Рис. 6.54. Увеличение высоты и ширины
альвеолярного отростка поднадкостнич-
ным введением гидроксиапатита,
а — верхней челюсти; б — нижней челюсти;
в — альвеолярной части нижней челюсти.
верхность была достаточно покрыта
кровью; если необходимо, уплощают
альвеолярную дугу, после чего уклады-
вают кортикальную пластинку, при-
крывая ее надкостницей.
Деминерализованную кость не только
трансплантируют пластинками и блока-
ми, для пластики также используют ма-
териал в виде стружки разного размера.
Чтобы расширить кость, с их помощью
под надкостницей создают тоннель, в
который специальным шприцем вводят
стружку (рис. 6.54). Главными зада-
дт1
нами при введении стружки являются
правильное отслаивание надкостницы
и формирование нужного контура вве-
денного биоматериала по высоте и ши-
рине.
Отслаивание надкостницы только
по альвеолярной дуге позволяет моде-
лировать введенный аллопластический
материал для достижения требуемой
высоты и оптимальной ширины кости.
Если необходимо увеличить только
высоту альвеолярного отростка, то над-
костницу для образования тоннеля от-
слаивают лишь по альвеолярной дуге. В
тех случаях, когда отросток требуется
расширить для введения гранулирован-
ного биоматериала поднадкостнично,
ее отсепаровывают как с вестибуляр-
ной, так и с небной стороны. Слизи-
стую оболочку легче всего отслаивать с
вестибулярной стороны 1167].
Как на верхней, так и на нижней че-
люсти вестибулярная сторона альвео-
лярных отростков часто атрофирована,
в связи с чем необходима и их рекон-
струкция для имплантации. В таком
случае следует отслаивать надкостницу
от гребня вниз по передней поверхно-
сти и вводить в такой боковой тоннель
биоматериал.
Трудности возникают и при отслое-
нии надкостницы для формирования
тонне.ля в передних отделах верхней и
нижней челюстей, где надкостница
может легко разрываться. Иногда над-
костница рубцово изменена и спаяна
со слизистой оболочкой. В таких слу-
чаях прибегают к разрезам неподвиж-
ной слизистой оболочки и надкостни-
цы. Их расслаивают, а слизистую обо-
лочку мобилизуют. После помещения
биоматериала его закрывают и фикси-
руют надкостницей. Рассеченная над-
костница должна перекрывать расши-
ренную альвеолярную дугу, а ее края
обязательно контактировать с костью.
Слизистую оболочку укладывают на ме-
сто и наглухо зашивают. Во избежание
ее натяжения дополнительно наклады-
вают матрацные швы. В подобной си-
туации эффективнее рассечение сли-
зистой оболочки с одной стороны аль-
веолярной дуги, а надкостницы после
откидывания слизистой оболочки —
с другой. При таком рассечении легче
придать биоматериалу правильную
форму и положение, предупредить по-
следующее смешение его благодаря пе-
рехлесту надкостницы и слизистой
оболочки при его закрытии.
Аналогично введению стружки ал-
локости вводят другие биоматериалы
на основе гидроксиапатита, трикаль-
ций-фосфата, их комбинированных
форм с аллокостью, коллагеном.
Наиболее удачным вариантом дос-
тижения необходимого размера альве-
олярного отростка верхней челюсти
является помещение гранул гидрокси-
апатита под надкостницу в специаль-
ных сетчатых футлярах или тубах ("Рег-
ma Ringe”), которые позволяют с боль-
шой точностью определять на модели
количество гранул гидроксиапатита
для получения кости нужного размера,
а также придавать ремоделируемому
участку кости нужную высоту и шири-
ну (122]. Самая большая трудность за-
ключается в том, чтобы при отслоении
надкостницы сформировать между ко-
стью и надкостницей достаточное про-
странство в виде глухого тоннеля для
введения футляра (рис. 6.55).
При адентии нижней челюсти и зна-
чительной атрофии альвеолярной части
всегда имеется опасность ее перелома.
Поднадкостничное выведение гидро-
ксиапатита или другого материала по-
зволяет в дальнейшем как ставить им-
плантат в области симфиза, так и, уве-
личивая альвеолярную часть, создавать
лучшие условия для фиксации съемно-
го протеза (рис. 6.56). Оптимальную
форму альвеолярной части нижней че-
люсти после введения биоматериала
под надкостницу можно создавать с по-
мощью формирующих валиков, смо-
ченных йодоформной жидкостью. Их
фиксируют окружающим швом или
специальной акриловой шиной.
Альвеолярный отросток может быть
не только узким, но также неровным и
бугристым. В таких случаях биомате-
риал, уложенный как по поверхности
кости, так и поднадкостнично, создает
нужную форму кости (рис. 6.57). Чаше
в таких случаях приходится рассекать
слизистую оболочку и надкостницу и,
подготовив кость, укладывать биома-
териал. Над ним по возможности сши-
вают надкостницу или сближают ее
края с помощью швов. Лоскут слизи-
Рис. 6.55. Пластика альвеолярного отростка верхней челюсти биоматериалом "Реппа
Ringe" фирмы "Ccra-med".
а — схема введения материала через разрез в центре альвеолярной дуги; б создание тоннеля
под надкостницей по альвеолярной дуге через боковые разрезы; в — гранулы гидроксиапатита
в сетчатом футляре; г — протягивание биоматсриала в тоннель; д — фиксация биоматериала; е —
наложение окружающих швов; ж — вид увеличенного альвеолярного отростка и установление
имплантатов; з — вид установленных имплантатов.
Рис. 6.56. Пластика дистальных отделов нижней челюсти.
а — схема надкостничного введения биоматериала; б — вид увеличенной по высоте и ширине
альвеолярной части нижней челюсти; в — рентгенограмма нижней челюсти после пластики ма-
териалом "Регта Ringe" с одновременным установлением 4 имплантатов: г — с одновременным
установлением 3 имплантатов (материал фирмы "Ccra-med").
стой оболочки укладывают так, чтобы
он перекрывал линию соединения над-
костницы. При вестибулярном рассе-
чении тканей для наилучшей гермети-
зации раны накладывают матрацные
швы. Полезным приемом является го-
ризонтальное перекрестное рассечение
тканей: слизистой оболочки — в лин-
гвальную, а надкостницы—в вестибу-
лярную сторону [37]. По такой методи-
ке биоматериал можно вводить под
надкостницу. Это обеспечивает хоро-
ший обзор тканей, щадящее отслаива-
ние надкостницы, оптимальное фор-
мирование ложа для костной пластики
и глухое послойное зашивание тканей.
Если мягких тканей недостаточно, то
биоматериал можно закрыть коллаге-
новой мембраной. Лучший контур аль-
веолярного отростка для зубной им-
плантации формируется тогда, когда
биоматериал покрывают мембраной,
армированной титаном (рис. 6.58).
Количество биоматериала и созда-
ваемый контур альвеолярного отростка
должен соответствовать окклюзион-
ным взаимоотношениям. Трудность
заключается еще в том, что альвеоляр-
ный отросток верхней челюсти или
альвеолярную часть нижней челюсти
нельзя нагружать в послеоперацион-
ном периоде съемным протезом. По-
этому первые 7—8 дней после опера-
ции формирующей является пародон-
тологическая повязка и только позднее
надевают каппу, приспосабливают ста-
Рис. 6.57. Пластика альвеолярного отро-
стка верхней челюсти (схема. Block М.,
Kent J., 1995).
рый съемный протез. Через 4—6 мес в
сформированный альвеолярный от-
росток ставят имплантаты и мягкие
ткани над ними зашивают наглухо.
Уровень шейки имплантата должен
быть на уровне края новой кости. При-
менение новых поколений биомате-
риалов — "МВР", "Pep-Gen Р-15", сме-
шивание аллогенных композиций с
плазмой, обогащенной тромбоцитами,
улучшают ремоделирование кости
(рис. 6.59). Применение стимуляторов
роста кости позволяет одновременно с
пластикой альвеолярных отростков
ставить имплантаты, обязательно ос-
теоинтегрированные и погружные.
Пластика альвеолярного отростка
внутрь кости. Операция предусматри-
вает вертикальную остеотомию, репо-
зицию одной или обеих стенок кости
или надлом одной из них и заполнение
образовавшегося пространства биома-
териалом (см. рис. 6.25, 6.26).
Впервые такую операцию при им-
плантации разработал Н. Tatum [278].
Одним из условий он считал ширину
альвеолярного отростка 3 мм. Позднее
R. Borgner [95] разработал эту опера-
цию для более узких альвеолярных от-
ростков.
Рис. 6.58. Пластика альвеолярного отро-
стка верхней челюсти.
а — биоматериал, увеличивший ширину и вы-
соту кости, частично закрыт мягкими тканями
и титановой мембраной; б — вид увеличенно-
го альвеолярного отростка через 6 мес.
Рис. 6.59. Ремоделирование кости после
пластики нижней челюсти биоматериа-
лом.
а рентгенограмма до операции; б — рентге-
нограмма через 4 мес после операции.
После традиционного обследования
больного на модели оценивают харак-
тер дефекта кости, определяют его раз-
меры. Переносят на модель результаты
клинических и рентгенологических ис-
следований, в том числе показатели
компьютерной томографии. В зависи-
мости от величины и характера дефекта
кости выбирают количество и вид био-
материала, а также имплантат (в форме
корня зуба с учетом его диаметра и
длины или плоский).
Остеотомия со вставной трансплан-
тацией биоматериала и имплантацией
заключается в: 1) рассечении слизистой
оболочки и надкостницы по альвео-
лярному гребню; 2) минимальном от-
слаивании слизисто-надкостничных
лоскутов в вестибулярную, язычную
или небную сторону; 3) остеотомии
кортикального и губчатого вещества
кости по гребню альвеолярной дуги;
4) репозиции костной стенки или над-
ломе вестибулярной или внутренней
стенки и репозиции ее; 5) создании
при помощи направляющей фрезы ло-
жа для апикального отдела импланта-
та, фиксации и углубления последнего;
6) заполнения освободившегося про-
странства блоками, опилками, грану-
лами биоматериала (см. рис. 6.24, а, б);
7) зашивание раны над биоматериалом
и имплантатами.
Мягкие ткани рассекают более ша-
дяще, без вертикальных разрезов сли-
зистой оболочки и надкостницы по на-
правлению к своду преддверия рта. Ес-
ли окклюзионные взаимоотношения
требуют наклона кости в вестибуляр-
ную сторону, то мягкие ткани отслаи-
вают в противоположную сторону и
лишь частично в сторону преддверия
полости рта. Распил кости можно про-
водить специальными пилками из на-
бора фирмы "Medicon" с охлаждением.
Надлом кости лучше делать плоским
долотом. В таких случаях важна его
правильная позиция на кости. По греб-
ню альвеолярной дуги сверлят корти-
кальную кость в нескольких местах. На
эти участки ставят долото и, слегка по-
стукивая молотком, внедряют его в
кость. Последовательно сменяемыми
долотами все большего диаметра перед-
нюю или небную стенку кости смеща-
ют в вестибулярную и небную сторону.
При пластике альвеолярной части
нижней челюсти особой осторожности
требуют дистальные ее отделы, особен-
но при вертикальной остеотомии.
На верхней челюсти реконструкция
альвеолярного отростка требует осо-
бых приемов из-за выраженной атро-
фии и близости полости носа и верх-
нечелюстной пазухи.
Остеотомию и операцию надлома
костной стенки можно проводить спе-
циальными долотами, например "Sys-
tem Uni post" [278]. Имеются другие ви-
ды долот для остеотомии и транспози-
ции кости — "ЗГ, "Steri-Oss”, "Frialit".
В. Рендо и соавт. [36] рекомендуют
операцию по типу "перелом зеленой
ветки" производить при помощи авто-
матического наконечника — молотка
Tosksystem, который, будучи закреплен
в микродвигателе, вместо вращатель-
ных совершает ударно-поступательные
движения. Долото всегда продвигается
по направлению оси планируемого рас-
щепления кости и создает адекватное
для этого давление. Сверлом диамет-
ром 1,8 мм входят в кость на глубину
6 мм. По этому каналу вводят долото и
последовательно расширяют канал. Че-
рез каждые 3—4 мм следует рентгено-
логически или на визиографе контро-
лировать положение долота. Если су-
жение кости было неравномерным, то
авторы рекомендуют использовать до-
лото S-образной формы [132].
Необходимо отметить, что более
просто и предпочтительно делать над-
лом вестибулярной стенки альвеоляр-
ного отростка верхней челюсти и аль-
веолярной части нижней челюсти [172]
(см. рис. 6.26). Внутренняя стенка тол-
ще, плохо поддается воздействию до-
лота, и частичного надлома может не
получиться.
При надломе вестибулярной стенки
кости необходимо, чтобы стенка оста-
в&тась интимно связанной с прикреп-
ляющимся к кости слизисто-надкост-
ничным покровом. Остеотомию мож-
но делать в местах установления им-
плантата на нескольких участках аль-
веолярного отростка. В таких случаях
четко выверяют позицию долота.
При значительной атрофии верхней
челюсти проводят распил по всей аль-
веолярной дуге, надлом кортикальной
пластинки и репозицию ее в небную
сторону. В зависимости от величины
образовавшегося пространства решают
вопрос о сверлении кости для создания
в ее внутреннем слое ложа для имплан-
тата. М. Augthun и соавт. [62] считают,
что при остеотомии и вставной транс-
плантации возможна немедленная им-
плантация, хотя традиционно после
таких операций производят импланта-
цию через 6 мес. Имеются также реко-
мендации относительно установления
имплантатов на ремоделированный
участок в более ранние сроки: на ниж-
нюю челюсть через 3 мес, передние
участки верхней челюсти через 4 мес,
на дистальные участки верхней челю-
сти через 6 мес. Необходимо следовать
именно этим срокам, так как это по-
могает избежать значительных трудно-
стей, с которыми неизбежно приходит-
ся сталкиваться при сверлении ложа
для имплантатов на монолитных кост-
ных участках кости, преобразованных
непористым гидроксиапатитом, "Ос-
теогеном", "Interpore-200". При уста-
новлении имплантата в форме корня
зуба применяют этапные сверла для
создания костного ложа для апикаль-
ного отдела имплантата. Контролиру-
ют глубину и направление канала.
Обязательным условием является то,
что имплантат (или имплантаты) дол-
жен наполовину располагаться в кос-
ти, а передняя поверхность его и все
пустоты должны быть заполнены био-
материалом |127].
В случае установления пластинчато-
го имплантата после транспозиции пе-
редней стенки кости формируют тон-
нель заданной длины и высоты или
внутреннюю часть его. При помощи
аналога проводят все примерочные
процедуры, а затем фиксируют им-
плантат в ложе. В верхнем отделе тела,
главным образом по передней его по-
верхности и около шейки имплантата,
пустые пространства заполняют био-
материалом. Аналоги имплантатов с
покрытием (“Steri-Oss", "Плазма По-
волжья", разъемные конструкции
"Startanius") обязательно сначала при-
меряют на модели и на участке кости,
где воспроизводят операции.
Оригинальную методику использо-
вали Н. Tatum и М. Lebovich [281] для
увеличения альвеолярного отростка и
обеспечения его правильной позиции.
Они увеличивали альвеолярный отрос-
ток верхней челюсти путем остеотомии
только ее вестибулярной стенки и пе-
ремещения ее на область альвеолярной
дуги.
Однако, по мнению R. Borgner [95],
это можно делать только при ширине
кости 3 мм и более. Если альвеолярный
отросток более узкий, то такая пласти-
ка невозможна. Еще ранее М. Block и
J. Kent [89] отмечали, что после уста-
новления имплантата в узкую кость
альвеолярного отростка верхней челю-
сти впереди должно оставаться 2 мм
кости. Другие авторы допускали воз-
можность опоры на небную стенку ос-
тавшейся атрофированной кости без
проведения остеотомии. В таких случа-
ях увеличивают альвеолярный отрос-
ток, выполняя пластику накладными
аутотрансплантатами [109, 114, 138].
Следует отметить, что надлом осу-
ществить трудно, но во всех случаях
место надлома кости должно быть ин-
тимно связано с надкостницей.
Современные технологии примене-
ния биоматериалов позволяют чаше
проводить одновременно пластику
альвеолярного отростка и импланта-
цию [177], а К. Kahnbery и соавт. [184]
рекомендовали в таких случаях ис-
пользовать остеоинтегрированные им-
плантаты и с успехом ставили конст-
рукции Branemark.
В случае наличия широкого про-
странства, заполненного биоматериа-
лом, и малого количества остаточной
кости для углубления имплантата по-
казано двухэтапное вмешательство: на
первом этапе — костная пластика, на
втором — установление имплантатов.
В обоих случаях после пластики или
пластики с одновременной импланта-
цией слизисто-надкостничный лоскут
укладывают на место и фиксируют
швами. R. Borgner [95] сразу посте по-
становки имплантата ставил головку и
моделировал мягкие ткани для заши-
вания вокруг нее. Однако реконструк-
цию альвеолярного отростка по всей
длине с помощью этой методики сде-
лать нельзя, а только на участках кости
в пределах 2—3 альвеолочелюстных
сегментов. Эта операция была описана
477
как "перелом по типу зеленой веточ-
ки". Об успехе таких операций при им-
плантации сообщали Б. Рендо и соавт.
[36], Л. Сильверштейн и соавт. [44],
J. Hahn, L. Silverstein [153].
Помещенный в образованное про-
странство биоматериал можно закры-
вать пленкой "Диплен-Дента-ХД и
мягкие ткани зашивать наглухо. J. Dun-
can [132] рекомендует закрывать места
надлома нерассасывающейся мембра-
ной. Сначала биоматериал плотно за-
крывают мембраной, а потом — надко-
стницей и слизистой оболочкой. Пла-
стику альвеолярных отростков челю-
стей биоматериалами с покрытием их
мембраной можно проводить одновре-
менно с имплантацией. При наращива-
нии кости биоматериалом в виде опи-
лок, гранул, пасты, геля и закрытии их
мембраной вначале в кость следует вво-
дить титановые опорные винты так,
чтобы они выступали и служили мем-
бране опорой. Они могут выступать на
5—11 мм и иметь наклон, соответст-
вующий необходимому рельефу кости.
Затем проводят подгонку мембраны,
размер и форма которой должны обес-
печивать перекрытие уложенного био-
материала на остаточной кости челю-
сти на 3—4 мм во всех направлениях.
Следующий этап заключается в нанесе-
нии биоматериала на кость. Его сме-
шивают с кровью или плазмой, обога-
щенной тромбоцитами, укладывают на
место недостающей кости и прессуют,
чтобы слой его под мембраной был
плотным. Поставленную на место мем-
брану прикрепляют по краю к кости
шпильками или мини-винтами. Если
позволяют условия, то мембрану фик-
сируют специально подготовленными
лоскутами. При необходимости увели-
чить ширину кости мембрана позволя-
ет не уплощать острый альвеолярный
гребень. При достаточной общей вы-
соте альвеолярной части нижней челю-
сти или альвеолярного отростка верх-
ней челюсти, когда ширина гребня со-
ставляет 3—4 мм, а основания — 5 мм
и более, при помощи мембраны и пу-
тем реорганизации биоматериала, кро-
ви, плазмы можно увеличить ширину
площадки, на которую будут ставить
имплантат. После откидывания слизи-
сто-надкостничного лоскута в вестибу-
478
лярную и оральную стороны производят
перфорацию боковых поверхностей
кости для образования сгустков крови
или поверхностную декортикацию ее
для хорошего кровоснабжения биомате-
риала. Через атрофированный гребень
создают ложе и ставят имплантат тради-
ционным путем. Нередко часть перед-
ней или верхней поверхности с обеих
сторон остается открытой, и именно
здесь укладывают биоматериал и закры-
вают его мембраной. Сроки ремодели-
рования биоматериалов различны. Бо-
лее полноценная кость в сроки 4—6 мес
образуется при пластике аутокостью
или комбинациями, в которые она вхо-
дит. Аллокость реконструирую! в сроки
от 4—6 мес до 1—2 лет (см. рис. 6.59).
Так же происходит ремоделирование
гидроксиапатитом и трикальций-фос-
фатом. В построении кости и затем ус-
пешной имплантации придают большое
значение стимуляторам роста кости.
При нарушении окклюзионных взаи-
моотношений вследствие избытка аль-
веолярного отростка верхней челюсти
или альвеолярной части нижней челю-
сти может быть необходима резекция
кости. Хотя такая ситуация бывает не
часто, при остеотомии не должны быть
нарушены дно верхнечелюстной пазу-
хи и канал нижней челюсти. Для пра-
вильной позиции остаточной кости
верхней или нижней челюсти необхо-
димо моделирование ее по форме и в
соответствии с окклюзией с альвеоляр-
ной дугой или зубами-антагонистами
нижней челюсти. После резекции час-
ти альвеолярного отростка могут быть
поставлены имплантаты [84, 168, 190]
Альвеолярные отростки челюстей ча-
ще приходится наращивать в ширину
[249] и гораздо реже — в высоту [239]
По данным одной американской кли-
ники, из 302 операций расширение аль-
веолярного отростка в щечном и ораль-
ном направлениях было произведено У
289 человек (90,6 %), тогда как в высоту
кость наращивали у 13 (9,4 %) [49].
6.2.12. Реконструкция верхней
челюсти
При реконструкции верхней челюсти
чаше используют такие приемы кост-
ной пластики, как наложение транс-
плантата на альвеолярный отросток
(рис. 6.60) и горизонтальная остеото-
мия с введением материала внутрь че-
люсти и субантрально (рис. 6. 61, а—в).
Вмешательство может проводиться в
два этапа — пластика, затем установле-
ние имплантатов и в один этап —
трансплантация внутрь кости с одно-
временным установлением импланта-
тов (рис. 6.61, г). Обязательным усло-
вием реконструкции верхней челюсти
для зубной имплантации является от-
сутствие воспалительных заболеваний
Рис. 6.60. Реконструкция верхней челю-
сти путем выполнения накладной транс-
плантации [Block М., Kent J., 1995].
а — вид атрофированного альвеолярного от-
ростка верхней челюсти; б — подготовка кости
и установление имплантатов в остаточную
кость; в — накладной трансплантат, уложен-
ный на альвеолярной дуге, закрыл обнажен-
ные коронковые части имплантатов.
верхнечелюстной пазухи и носа. Учи-
тывая сложность вмешательств на верх-
ней челюсти, хирург должен не только
владеть амбулаторными операциями на
альвеолярном отростке, но также иметь
квалификацию хирурга, знающего ана-
томию и вмешательства на соседних
областях — полости носа, крыловид-
ных отростках клиновидной кости, ор-
бите. В рахтичных клинических ситуа-
циях хирург должен быть готов к лече-
нию возникающего осложнения. Важ-
ную роль в обеспечении успеха опера-
ций на верхней челюсти имеют инстру-
менты: нужные номера скальпелей,
элеваторы для поднятия слизистой
оболочки верхнечелюстной пазухи, пи-
лящие, режущие инструменты для кос-
ти с обязательным охлаждением.
Имплантация на верхней челюсти
часто затруднена в связи с атрофией
альвеолярного отростка и ее тела. Од-
ним из методов их увеличения являет-
ся вставная трансплантация с одновре-
менной репозицией верхнечелюстной
пазухи. Трансплантат помещают в про-
странство, образованное распилом кос-
ти по Ле Фор 111 (нижнему типу) [168).
Здесь также должны быть предусмотре-
ны плотная фиксация, чаще мини-пла-
стинами и винтами или костным швом
(см. рис. 6.61, б). При такой методике
удается поднять верхнечелюстную па-
зуху и создать условия для постановки
имплантата или имплантатов.
Могут потребоваться поднятие дна
носовой полости и вставная транс-
плантация также для установления им-
плантата (см. рис. 6.23, а). Первыми та-
кую операцию с использованием ауто-
кости из гребня подвздошной кости в
виде накладного трансплантата описа-
ли в 1980 г. Р. Boyne и R. James [98].
^тот же трансплантируемый материал
при некоторых изменениях методики
операции при имплантации успешно
применяли С. Misch [219], R. Adell и
соавт. [52], J. Jensen и соавт. [170],
С. Misch, F. Dietsh [223], D. Hall,
E. McKenna [149], A.A. Никитин [27].
В то же время об отдаленных результа-
тах функционирования имплантатов,
поставленных в реконструированную
кость, многие авторы не сообщали или
подтверждали свои выводы наблюде-
ниями в период от 1 года до 4 лет. Про-
a
в
Рис. 6.61. Реконструкция верхней челюсти вставной трансплантацией [Block М., Kent J.,
1995).
а — линия остеотомии верхней челюсти но нижнему типу; б — остеотомия и транспозиция аль-
веолярного отростка вниз; в — в образовавшееся пространство уложен трансплантат и установ-
лены фиксирующие пластины, укрепленные винтами; г — установлены имплантаты в альвео-
лярный отросток и трансплантат.
следив результаты реконструкций верх-
ней челюсти в течение 10 лет, С. Misch
[219, 224|. М. Block, J. Kent (90] отмс-
тили приживление трансплантатов и
успех имплантации в 100 % случаев.
Большое значение в развитии опера-
ций на верхней челюсти для зубной им-
плантации имели теоретические иссле-
дования и практический опыт Н. Tatum
[278, 280], С. Misch [224), М. Chanavaz
[114, 116]. Они свидетельствуют об эф-
фективности этих операций для зуб-
ной имплантации.
В 1994 г. в Академии зубной им-
плантации, а в 1996 г. в Академии ос-
тсоинтеграции США состоялись спе-
циальные конференции, на которых
были подведены итоги 20-летнего
опыта проведения операций на верх-
ней челюсти для зубной имплантации.
______________________
Главным вопросом было увеличение
кости вблизи верхнечелюстной пазухи.
Были выделены отдельные методы
операций; 1) "поднятие пазухи” и
2) "трансплантация под пазуху". На ос-
новании результатов, прослеженных в
течение многих лет, трансплантация
биоматериалов на верхнюю челюсть
была признана эффективной операци-
ей и рекомендована для широкого вне-
дрения в клиническую практику при
имплантации [84, 95, 155, 242, 279[.
Как отмечали Н. Tatum, М. Block и
J. Kent, на планирование методов опе-
раций в значительной степени влияют
взаимоотношения остаточной кости и
верхнечелюстной пазухи. В одних слу-
чаях они могут считаться нормальны-
ми и при высоте альвеолярного отро-
стка не менее 8 мм, и тогда требуется
только поднять пазуху. Если же внут-
риальвеолярное пространство меньше,
чем в норме, то приходится поднимать
верхнечелюстную пазуху и вводить
внутрь костные трансплантаты. Вместе
с тем даже при высоте альвеолярного
отростка менее 8 мм, но при соотно-
шении кости и дна пазухи, превышаю-
щем норму, возможны три решения. В
одном случае можно ограничиться
только поднятием пазухи (см. рис.
6.23, е), в другом — нарастить альвео-
лярную дугу накладным трансплантатом
(см. рис. 6.60), в третьем — применить
пластику вставным трансплантатом под
пазуху (см. рис. 6.61). При использова-
нии последней методики особого вни-
мания требует фиксация транспланта-
тов, поскольку для пластики вставны-
ми трансплантатами используют боль-
шие фрагменты кости, например греб-
ня большой берцовой кости.
Любая реконструкция верхней че-
люсти, особенно переднего отдела,
требует соблюдения правил эстетики
[109, 137, 176]. Наиболее достоверные
результаты предоперационной диагно-
стики анатомо-топографических осо-
бенностей верхней челюсти получены
нами на основании трехмерных мате-
матических образцов по РКТ и МРТ
[39]. Она показала, что самую большую
проблему для имплантации представ-
ляют дистальные отделы верхней че-
люсти, когда атрофия кости создает
низкое расположение верхнечелюст-
ной пазухи.
Для костной пластики при этих вме-
шательствах использовали различные
пластические материалы. Наилучшим
из них признан гребень подвздошной
кости. Накоплен также значительный
опыт применения ауто- и аллокости,
различных биоматериалов и их комби-
наций: керамики [191, 266, 285], ауто-
кости с деминерализованной аллоко-
стью [89], остеогена с деминерализо-
ванной костью [268, 300], остеогена с
коллагеном [268], остеогена с кровью
[296], аутокости с гидроксиапатитом
[285], а также пористого гидроксиапа-
тита [195], трикальций-фосфата ”Сега-
sorb" [245], других видов биоматериа-
лов в комбинации с плазмой крови,
обогащенной тромбоцитами [66].
J. Kent и М. Block [191], J. Kent и
D. Misiek [192], J. Jensen и соавт. [170—
172], D. Smiller [267], О. Jensen и соавт.
[173—175], К. Blonqvist и соавт. |84],
N. Huzzler и соавт. [161] прослежены
результаты реконструкции верхней че-
люсти и одновременной постановки
имплантатов с использованием ауто- и
аллокости, аллопластических материа-
лов как изолированно, так и в комби-
нации.
Несмотря на приведенные выше, а
также другие данные об успешной пла-
стике верхней челюсти, при зубной
имплантации не представлялось воз-
можным сделать окончательный и
обоснованный вывод о преимуществе
какого-либо материала или их комби-
нации. Слишком о малом числе паци-
ентов, подвергнутых такому лечению,
сообщали исследователи. Исключени-
ем, пожалуй, были только D. Smiller и
соавт. [268], располагавшие данными о
72 пациентах, прослеженными в тече-
ние 6 лет, и S. Sindet-Pedersen и соавт.
[262], представившие данные лечения
98 больных.
В период с 1986 по 1994 г. примене-
ние аутокости и аллопластических ма-
териалов для реконструкции верхней
челюсти перед имплантацией наиболее
детально изучал Н. Tatum [278, 281].
Он пришел к выводу, что наиболее ра-
циональным материалом для увеличе-
ния альвеолярного отростка, тела верх-
ней челюсти, поднятия пазухи являет-
ся гидроксиапатит и комбинация гид-
роксиапатита и аутокости.
На результат пластики верхней че-
люсти и установление имплантатов
большое влияние оказывает степень
резорбции вновь образованной кости.
Именно этими процессами в ремодели-
рованной кости обусловливаются успех
операции и длительность функциони-
рования имплантатов [162]. В первый
год должно атрофироваться 1,49 мм
новообразованного материала, в по-
следующие годы — по 0,1 мм. Вместе с
тем при пластике деминерализованной
костью атрофия может достигать 40 %.
По данным Н. Tatum и соавт. [279],
при использовании гранулированного
гидроксиапатита вновь образованная
кость не подвергается атрофии или со-
храняется до 85 % ее количества. Од-
нако при использовании спеченного
гидроксиапатита пространство запол-
няется костью только на 20—30 % [266,
2681 и несколько лучшая остеоинтегра-
ция (44 %) отмечается при его комби-
нации с аутокостью. Комбинация же
спеченного гидроксиапатита с демине-
рализованной костью также дает не-
благоприятные результаты, так как в
этом случае в новообразованных тка-
нях на кость приходится только 50 %,
а остальную часть составляет фиброз-
ная ткань. Все это надо учитывать при
пластике верхней челюсти разными
материалами.
Реконструкция верхней челюсти для
зубной имплантации предусматривает
следующие вмешательства: 1) подня-
тие верхнечелюстной пазухи; 2) подня-
тие дна носовой полости; 3) транс-
плантация под верхнечелюстную пазу-
ху с поднятием ее или под пазухи и дно
полости носа с поднятием их.
Поднятие дна верхнечелюстной пазу-
хи. Снижение высоты альвеолярного
отростка при значительной атрофии
кости и низкое расположение верхне-
челюстной пазухи могут потребовать
поднятия ее слизистой оболочки с
формированием новой позиции дна
пазухи для установления имплантата.
Операции могут быть выполнены:
1) локальным поднятием слизистой
оболочки в области дна пазухи; 2) под-
нятием ее доступом через переднюю
или латеральную стенку пазухи; 3) эн-
доскопическим поднятием через меди-
альную стенку.
Необходимо учитывать анатомиче-
ские особенности верхнечелюстной
пазухи [111]. Нередко на дне ее имеет-
ся несколько перегородок и углубле-
ний. Ch. (Jim и соавт. [289] обследова-
ли дно пазухи на 41 беззубой верхней
челюсти. Перегородки были обнаруже-
ны в 13 (31,7 %) случаях, чаще всего на
участке между вторым премоляром и
первым моляром. В 26,8 % случаев от-
мечена только одна, в 4,9 % — две пе-
регородки. В основном перегородки
располагались в щечно-небном на-
правлении. Возможной причиной об-
разования перегородок эти авторы
считают различной степени пневмати-
зацию верхнечелюстной пазухи из-за
альвеолярного отростка, пустующего
после удаления зубов.
Рис. 6.62. Локальное
поднятие дна верхне-
челюстной пазухи
при зубной имплан-
тации.
а — перфорация круг-
лым бором кортикаль-
ной пластинки; б — ос-
теотомия направляющим сверлом; в — остео-
томия формирующим сверлом до дна пазухи;
г — поднятие костной стенки дна пазухи до-
лотом; д — установление имплантата и заши-
вание мягких тканей у запорного винта.
Локальное поднятие дна верхнече-
люстной пазухи делают специальными
долотами. Обычно, обозначив по греб-
ню альвеолярной дуги место установ-
ления одного имплантата или несколь-
ких, делают наметочное сверление.
Проверив правильность направления
сверления и параллелизм, не доходя
1 —2 мм до дна верхнечелюстной пазу-
хи, при помощи увеличивающихся по
толщине долот расширяют ложе для
имплантата, приподнимая при этом
костную стенку верхнечелюстной па-
зухи (рис. 6.62, а—д). Диаметр ложа
должен быть на 0,5 мм меньше диамет-
ра выбранного имплантата. Рекомен-
дуется класть под дно пазухи биомате-
риал — аугокость, аллокость, гидро-
ксиапатит, их комбинации. Долотами
Рис. 6.62. Продолжение.
с — остеотомия и поднятие костной стенки дна пазухи долотом; ж — утрамбовывание биома-
тсриала; з — установлен имплантат, стенка дна пазухи поднята биоматсриалом; и — ортопан-
томограмма: видны поднятое дно пазухи и установленные имплантаты; к — ортопантомограмма,
виден пластический материал в альвеоле и дистальном отделе верхней челюсти, с помощью
которого поднято дно пазухи.
материал конденсируется, и дно пазу-
хи поднимается (рис. 6.62, е—з).
Уровень поднятия дна верхнечелю-
стной пазухи повышается с каждой по-
следующей порцией биоматериала.
Проверив глубиномером достаточность
длины ложа для имплантата, произво-
дят чаще ручное, реже с помощью бор-
машины вкручивание винтового им-
плантата, путем легкого постукивания
молотком вводят цилиндрическую
конструкцию. Такая методика пред-
охраняет от перфорации слизистую
оболочку. Установленный имплантат
фиксирует биоматериал (рис. 6.62, и, к).
Можно локальное поднятие верхне-
челюстной пазухи производить долота-
ми увеличивающихся размеров. Ори-
гинальную методику поднятия верхне-
челюстной пазухи предложили
А.А. Никитин и соавт. [27]. Они реко-
мендуют проводить распил по гребню
альвеолярного огростка с репозицией
вестибулярно и орально кортикальных
пластинок оставшейся атрофирован-
ной кости и через образовавшееся про-
странство поднимать верхнечелюст-
ную пазуху. Этот способ позволяет при
помощи биоматсриала расширять аль-
веолярный отросток и поднимать дно
верхнечелюстной пазухи. Во всех слу-
чаях поднятия верхнечелюстной пазу-
хи и установления имплантата их за-
крывают запорными винтами. Корон-
ковый край или край шейки имплан-
тата должен стоять вровень с краем
кости. Рану наглухо зашивают. Через
5—6 мес проводят 2-й этап — вскрытие
имплантата (или имплантатов) и орто-
педическое лечение.
Поднятие слизистой оболочки верх-
нечелюстной пазухи можно произво-
дить по классической схеме Caldwell—
Zuc, когда после остеотомии передней
стенки поднимают вверх слизистую
оболочку дна, устанавливают со сторо-
.IV 1
ны альвеолярного гребня имплантаты
и заполняют пространство между ними
костеобразующим биоматериалом.
Вторым подходом является остеото-
мия латеральной или латерально-пе-
редней стенки верхнечелюстной пазу-
хи, поднятие слизистой оболочки
вверх, установление имплантатов со
стороны альвеолярного гребня и также
заполнение пустот и пространства у
верхушек имплантатов биоматериалом
(рис. 6.63, а). Откидывают слизисто-
надкостничный лоскут в переднеди-
стальном отделе альвеолярного отрост-
ка, образуют костное окно и произво-
дят поднятие слизистой оболочки дна
пазухи (рис. 6.63, б, в). Можно слизи-
стую оболочку дна пазухи приподнять
костной мембраной; образовавшееся
пространство заполняют биоматериа-
лом. Проводят остеотомию и устанав-
ливают имплантат или имплантаты
(рис. 6.63, г, д).
Нами разработан метод эндоскопи-
ческого поднятия слизистой оболочки
дна пазухи через ее медиальную стенку
[41а].
Эндоскоп вводят в естественное от-
верстие в среднем носовом ходу и да-
лее в верхнечелюстную пазуху и за счет
свечения оптико-волоконного освети-
теля можно обозревать ее слизистую
оболочку.
Отчетливо выделяют границы пазу-
хи, что в каждом индивидуальном слу-
чае определяет соотношение дна по-
лости носа и дна верхнечелюстной па-
зухи. Как правило, дно верхнечелюст-
ной пазухи лежит ниже дна полости
носа, образуя костную ступень под оп-
ределенным утлом. При трансназаль-
ном доступе к слизистой дна пазухи
этот угол имеет большое значение, так
как по мере приближения его к прямо-
му становится проблематичным доступ
к слизистой оболочке пазухи и после-
дующее ее поднятие. Визуальный ос-
мотр позволяет определить угол ступе-
ни и ее глубину, которые варьируют от
100 до 140° и от 2 до 9 мм соответст-
венно. Устанавливают индивидуаль-
ные особенности строения верхнече-
люстных пазух и определяют ее наибо-
лее тонкую стенку — медиальная, ла-
теральная или передняя (см. рис. 3.26).
Исходя из этого, выбирают оператив-
ный подход — через латеральную, пе-
реднюю или медиальную стенку (рис.
6.64). Для использования эндоскопи-
ческого метода поднятия дна пазухи
дно полости носа должно быть или на
одном уровне с дном пазухи, или не-
сколько ниже его.
Данные эндоскопии сопостааляют с
РКТ и после обезболивания в естест-
венное отверстие вводят жесткий эндо-
скоп с углом обзора 70°. Делают пунк-
цию верхнечелюстной пазухи в нижнем
носовом ходу и через троакар вводят
элеватор, которым, скользя по внутрен-
ней медиальной и нижней стенкам па-
зухи, отслаивают слизистую выстилку
внутрь и вверх. Как только образуется
маленькая полость между костью дна
пазухи и слизистой оболочкой, начина-
ют гидропрепаровку антисептическим
раствором. Отсосав введенную жид-
кость, вводят шприцем биоматериал,
который должен иметь кашицеобразную
консистенцию (рис. 6.65, а). В качестве
материала использовали "ОСТИ М-100",
Тидроксиапол", деминерализованную
кость "Bio-Oss", "Osteo-Graf. Матери-
ал нужно вводить под контролем объ-
ективного изображения на мониторе
компьютера. Поднятие дна верхнече-
люстной пазухи проводилось в преде-
лах одного — двух зубов соответствен-
но премолярам. У ряда больных сразу
со стороны альвеолярного отростка
формировали ложе для имплантата и
ставили его так, чтобы он плотно фик-
сировался к стенкам кости. Рентгено-
логическая картина остеоинтеграции
биоматериала и ее этапы не отличались
от таковых при обычной методике под-
нятия слизистой оболочки пазухи. У
других больных операцию импланта-
ции производили на втором этапе че-
рез 6—7 мес (рис. 6.65, б, в).
При сроке наблюдения от 6 мес до
2 лет оценка соответствовала критери-
ям хорошего результата: у всех боль-
ных удалось поднять слизистую обо-
лочку верхнечелюстной пазухи с одно-
временной или последующей установ-
кой зубных имплантатов.
Поднятие дна носовой полости. При
установлении имплантатов в области
центральных резцов верхней челюсти
может возникнуть необходимость в
поднятии дна полости носа. Если дно
Рис. 6.63. Поднятие дна верхнечелюстной
пазухи со стороны се латеральной стенки,
а — схема поднятия дна пазухи гидроксиапа-
титом по Tatum (стрелкой указан участок уда-
ляемой стенки); б — образование окна в лате-
ральной стенке пазухи и поднятие слизистой
оболочки дна пазухи гранулированным био-
материалом; в — поднятие слизистой оболоч-
ки дна пазухи костной мембраной; г — орто-
пантомограмма до операции; д — ортопанто-
мограмма после поднятия пазухи и установле-
ния имплантатов.
485
Рис. 6.64. Оперативные доступы при под-
нятии дна верхнечелюстной пазухи по
данным эндоскопического исследования.
1 - через латеральную стенку; 2 — через пе-
реднюю стенку; 3 — через медиальную стенку.
носовой полости ограничивает верти-
кальную высоту кости (менее 12 мм),
то можно приподнять его на несколько
миллиметров долотом и при установ-
лении имплантата изолировать его
верхушку. Следует отметить, что кор-
тикальная пластинка носовой полости
более толстая, менее податливая. Про-
цедура поднятия дна полости носа та-
кая же, как и дна верхнечелюстной па-
зухи [173]. Обозначают по гребню аль-
веолярной дуги место постановки им-
плантата, клинически и рентгенологи-
чески сопоставляют его с участком дна
полости носа. Обязательно учитывают
возможную выраженную атрофию вес-
тибулярной поверхности альвеолярного
отростка на уровне центральных рез-
цов в связи с утратой зубов. Проводят
наметочное сверление и, проверив
правильность направления, долотами
увеличивающихся диаметров расширя-
ют ложе для имплантата. Длина и диа-
метр имплантата должны быть на 0,3—
0,5 мм больше размеров костного ка-
нала. У кортикальной пластинки дна
полости носа легкими постукивающи-
ми движениями поднимают кость. Для
большей упругости под дно кладут блок
биоматериала. Перед введением им-
плантата глубиномером проверяют
длину ложа и соответствие ее длине им-
плантата, а также уровень поднятой ко-
стной стенки дна полости носа — на
визиографе. Чаще ручным способом
ввинчивают винтовой имплантат или
легким поколачиванием вводят цилин-
дрический (рис. 6.66).
Более сложную методику поднятия
дна полости носа применяли М. Block
и J. Kent |89|. Они проводили горизон
тальный распил кости у дна полости
носа, репонировали фрагмент кости на
нужную высоту и 4—5 мм вглубь. В об-
разованное пространство помещали
блок ауто-, аллокости или синтетиче-
ского биоматериала и со стороны греб-
ня альвеолярного отростка проводили
остеотомию и ставили имплантаты.
Реконструкция тела верхней челюсти
с трансплантацией под верхнечелюст-
ную пазуху. Перед операцией реконст-
рукции верхней челюсти с трансплан-
тацией под верхнечелюстную пазуху
клинические данные и результаты
рентгенологических исследований со-
поставляют с моделями челюстей, в
том числе в ортикуляторе. В отдельных
случаях из-за большой толщины сли-
зистой оболочки при осмотре можно
получить неправильное представление
о ширине кости. Избыток подвижной
слизистой оболочки на альвеолярной
дуге всегда должен настораживать.
Наиболее точное предстааление о ко-
личестве и качестве кости и участках
самого низкого расположения дна
верхнечелюстной пазухи дают РКТ и
МРТ. Осматривают полость носа, фик-
сируя внимание на размерах носовых
раковин и расположении носовой пе-
регородки. Результаты осмотра сопос-
тавляют с рентгенологическими дан-
ными. Делать это лучше совместно с
отоларингологом, гак как отдельные
анатомические особенности полости
носа и наличие хронической инфек-
ции могут служить противопоказанием
как к трансплантации под верхнечелю-
стную пазуху, так и к зубной имплан-
тации. На основании результатов ос-
мотра полости носа и его придаточных
пазух возможна коррекция планов зуб-
ной имплантации.
Реконструкция тела верхней челю-
сти с трансплантацией биоматериала
под пазуху возможна несколькими опе-
ративными методами:
Рис. 6.65. Эндоскопическое поднятие
верхнечелюстной пазухи через медиаль-
ную стенку.
а — схема оперативного подхода, гидропрепа-
ровка и введение биоматериала для поднятия
слизистой оболочки дна пазухи: 1 — эндоско-
пическая лампочка, введенная через естест-
венное отверстие в верхнечелюстную пазуху;
2 — отслаивание слизистой оболочки дна па-
зухи инструментом, введенным через нижний
носовой ход; б, в — рентгенограммы до и по-
сле операции.
1) латеральной остеотомией верхней
челюсти и трансплантацией биома-
териала под пазуху (см. рис. 6.63);
2) остеомией верхней челюсти по Ле
Фор 111 по нижнему типу и транс-
позицией под пазуху (см. рис. 6.61);
3) щадящей эндоскопической техни-
кой и трансплантацией биомате-
риала под пазуху через медиальную
стенку.
Латеральная остеотомия и транс-
плантация биоматериала пол пазуху по
методу Tatum проводится следующим
образом: рассекают слизистую оболоч-
ку и надкостницу по гребню альвео-
лярного отростка на уровне моляров
верхней челюсти до бугра и далее вер-
тикально по вестибулярной поверхно-
сти кости к своду преддверия рта. От-
слаивают слизисто-надкостничный
лоскут, обнажая латеральную стенку
пазухи. При помощи линейки и мар-
кировочного карандаша намечают ли-
нию остеотомии. На 5 мм выше края
кости при помощи бора выпиливается
переднезадняя стенка пазухи сзади и
снизу. Остеотомию выполняют круг-
лым бором с большой осторожностью,
чтобы не перфорировать слизистую
оболочку верхнечелюстной пазухи. Ос-
торожно, начиная дистально и снизу,
поднимают и отслаивают слизистую
оболочку пазухи. Продвигаясь элева-
тором по дну пазухи, слизистую обо-
лочку приподнимают вверх и в образо-
вавшееся пространство вводят биома-
териал. Выпиленный фрагмент кости
укладывают на место, рану зашивают
наглухо (рис. 6.67). Через 6 мес прово-
дят остеотомию и постановку имплан-
татов. В последние годы реконструк-
487
Рис. 6.66. Поднятие дна
полости носа [Block М.,
Kent J., 1995J.
а—в — остеотомия со сто-
роны альвеолярного отрост-
ка и укладывание биомате-
риала; г — поднятие дна
полости носа транспланта-
том и установление имплан-
татов.
5—6 мес после транс-
плантации пластиче-
ских материалов и их
ремоделирования.
Итоги реконструк-
ции верхней челюсти
для зубной импланта-
ции подтверждают эф-
фективность операции
(рис. 6.68). Новые био-
материалы, стимулято-
ры роста кости увели-
чивают возможности
цию тела верхней челюсти и установ-
ление имплантатов чаще выполняют в
один этап. Зубная имплантация может
быть проведена непосредственно с ка-
ждым из этих методов, или установле-
ние имплантатов осуществляют через
проведения пластики
одновременно с имплантацией.
Операцию пластики верхней челю-
сти можно проводить аутотрансплан-
татом из гребня подвздошной кости.
Ее выполняют в следующей последова-
тельности. Вначале определяют необ-
ходимый размер ауто-
трансплантата. Следует
иметь в виду, что если
это делают рентгеноло-
гически, то можно ожи-
дать некоторого искаже-
ния истинных размеров
нужной для трансплан-
тата кости. Вначале бе-
рут трансплантат нуж-
ной величины с гребня
подвздошной кости и
Рис. 6.67. Реконструк-
ция верхней челюсти пу-
тем трансплантации
биоматериала под верх-
нечелюстную пазуху,
поднятия ее и выполне-
ния имплантации по
Tatum.
а — схема операции; б —
вид прямо и сбоку после
имплантации: 1 — верхнече-
люстная пазуха. 2 — биома-
тсриал, 3, 4 — имплантаты.
Рис. 6.67. Продолжение,
в — ортопантомограмма: видны ре-
зультаты реконструкции верхней
челюсти, поднятия пазухи и им-
плантации; г — ортопантомограмма
после реконструкции верхних че-
люстей, поднятия пазух и отсрочен-
ной имплантации; д — ортопанто-
мограмма после реконструкции
верхних челюстей, поднятия пазух,
отсроченной имплантации и проте-
зирования на имплантатах.
приступают к операции на
верхней челюсти. Рассекают
мягкие ткани в полости рта.
В одних случаях при отсутст-
вии зубов и двухэтапной опе-
рации это делают на уровне
моляров соответственно лате-
ральной стенке верхней челю-
сти. В других случаях, когда
имплантат (или имплантаты)
ставят одновременно, разрез
соответственно молярам ведут
по центру альвеолярной дуги.
При наличии зубов разрез де-
лают на границе прикреплен-
ной и свободной слизистой
оболочки кпереди от лате-
ральной стенки и параллельно
ей. М. Chanavas [115] считает,
что для сохранения адекват-
ного кровообращения рассе-
чения периоста должны быть
минимальными как по гори-
зонтали, так и по вертикали.
После образования окна раз-
мером 1,5x1,5 или 2x2 см на
1—2 мм выше дна пазухи на
всем ее протяжении распара-
тором осторожно приподни-
мают слизистую оболочку.
В освободившееся на дне про-
странство ставят аутотранс-
плантат. Его подрезают до
нужного размера и укладыва-
ют так, чтобы поверхность
губчатого вещества оказалась
обращенной к дну верхнече-
люстной пазухи [90, 271]. При
немедленной имплантации,
после того как трансплантат
зафиксирован, в нем и оста-
точной кости альвеолярного
отростка при помощи этап-
ных сверл формируют ложе
489.
для имплантата. Очень важно, чтобы
места постановки имплантатов и свер-
ления кости были определены точно и
соответствовали правилам параллелиз-
ма и будущей окклюзии протеза.
М. Block и Т. Goles [881 при таких опе-
рациях считают оптимальными им-
плантаты длиной 13 и 15 мм.
Полученные при сверлении кости
стружку и опилки измельчают и укла-
дывают в пустоты между имплантатом
и трансплантатом. Для кости и дна
верхнечелюстной пазухи имплантаты
становятся фиксирующими устройст-
вами. В других случаях костью ауто-
трансплантата после ее измельчения
заполняют пустоты в медиальной и ла-
теральной частях верхней челюсти под
поднятой слизистой оболочкой пазухи
[12]. Чтобы улучшить фиксацию им-
плантата, можно одной частью кост-
ной пластинки поднять слизистую
оболочку пазухи, создав опору для вер-
хушки имплантата, а другой частью ко-
стной пластинки закрыть дефект пе-
редней стенки. Его можно закрыть так-
же измельченными фрагментами кост-
ной пластинки. Если кости недоста-
точно, то измельченный до стружки
аутотрансплантат смешивают с таким
же количеством деминерализованной
кости или другим биоматериалом и по-
лученной смесью заполняют простран-
ство под поднятым дном пазухи, а так-
же над имплантатами.
Н. Tatum [278—280], используя лате-
ральный подход к пазухе, поднимал ее
дно гидроксиапатитом или гидрокси-
апатитом с аутокостью. Через 6 мес на
ремоделированные участки ставили
имплантаты разработанной Н. Tatum
оригинальной конструкции. Они спе-
циально предназначены для подобных
ситуаций. Имплантаты имели форму
корня зуба, и на их теле были горизон-
тально расположены плоские ребра.
Такая конструкция, с одной стороны,
увеличивала общую площадь прямого
контакта тела имплантата с костью, с
другой — снижала жевательное давле-
ние на него. Остеотомию, производи-
мую для создания ложа имплантата
сверлением с помощью бора, Н. Tatum
считал слишком травматичной и раз-
работал для такой операции специаль-
ные долота. Через 5—6 мес после уста-
новления имплантатов их вскрывали и
начинали ортопедическое лечение (см.
рис. 6.68).
Автор отметил, что под тяжестью
собственной массы введенный биома-
териал может менять первоначальную
форму, отчего при последующем уста-
новлении имплантатов возникают
трудности. В его наблюдениях для фик-
сации слизистой оболочки дна верхне-
челюстной пазухи и введенного мате-
риала следует ввинчивать шурупы со-
ответственно местам установления им-
плантатов в будущем. Через 6 мес их
удаляют и после расширения костного
ложа ставят имплантаты.
Выполняя подобную операцию,
А.А. Никитин [24] вводил имплантаты
сразу, чтобы они служили формирую-
щей подпоркой для дна верхнечелюст-
ной пазухи и гидроксиапатита. Отме-
чена хорошая интеграция имплантатов
в ремоделированной кости на месте
введенного гидроксиапатита. Однако
многие авторы считают, что ставить
имплантаты сразу нельзя, так как в
этот период достаточно активно проте-
кают процессы резорбции и остеогене-
за. Кроме того, вначале транспланта-
ционный материал не способствует
приживлению имплантата. По мнению
этих авторов, необходимо отсрочивать
имплантацию по крайней мере на 90
дней [269].
Если проводят трехэтапное лечение,
то через 6 мес после пластики верхней
челюсти и поднятия пазухи осуществ-
ляют остеотомию и ставят имплантаты,
которые традиционно интегрируют в
новой кости в течение 6 мес. Еше через
6 мес начинают третий этап хирургиче-
ского лечения — вскрытие импланта-
тов и через 3 нед — протезирование.
Тот же метод использовал С. Misch
[219] при лечении 170 пациентов, но
вместо гидроксиапатита он применял
трикальций-фосфат.
Щадящий метод реконструкции верх-
ней челюсти и поднятия дна верхнече-
люстной пазухи предложил J. Hahn
[154]. Костной пластинкой переднела-
теральной стенки он поднимает пазу-
ху, ставит имплантаты со стороны аль-
веолярного гребня, а оставшиеся пус-
тоты у верхушек имплантатов под пла-
стиной заполняет биоматериалом —
Рис. 6.68. Результаты реконструкции
верхней челюсти путем трансплантации
под пазуху, поднятия ее и установления
имплантатов [Tatum Н.. 1986|.
а — внешний вид имплантатов; б — протезы,
фиксированные на имплантатах; в — ортопан-
томограмма после протезирования.
комбинацией аутокости и биопласти-
ческого материала ("Osteo-Graf', "Pep-
Gen Р-15").
По такой же методике реконструи-
руют верхнюю челюсть и поднимают
пазуху другими пластическими мате-
риалами ("Колапол КП-3", "Колла-
пан", деминерализованная кость и их
комбинации) [18, 26, 46].
Другие авторы применяли демине-
рализованную свежезамороженную ал-
локость ("DFDB") и "Osteo-Graf' [223],
аллокость "Dyna-GrafT с плазмой кро-
ви, обогащенной тромбоцитами [102,
213], морфогенетический протеин [ 16о’
193]. Эффективна для изоляции верху-
шек имплантатов, биоматериала и за-
крытия костного окна костная мембра-
на. Она хороню предохраняет биомате-
риал от инфицирования как из полости
рта, так и из пазухи. Всеми авторами
успех был достигнут в 97—98 % случаев.
Опыт, накопленный М. Block и
J. Kent [90], которые за 10 лет произ-
вели у 51 пациента операции пластики
верхней челюсти с поднятием пазухи
аутокостью и установлением 173 им-
плантатов, свидетельствует о том, что
для этих операций целесообразно ис-
пользовать губчатое вещество гребня
подвздошной кости, кортикальную
пластинку подбородочного отдела
нижней челюсти и фрагмент бугра
верхней челюсти в комбинации с де-
минерализованной костью. Результа-
ты, прослеженные в послеоперацион-
ном периоде от 2 до 4 лет, были поло-
жительными в 90 % случаев. Аналогич-
ные результаты были получены други-
ми авторами при пластике аутокостью,
"Колаполом" и закрытии их нерезор-
бируемой мембраной [18], аутокостью
с челюстей [12, 172]. Между тем при
использовании только деминерализо-
ванной кости более чем в половине
случаев через 1 год формировалась
только фиброзная и хрящевая ткань.
Большинство авторов склоняются к
взятию костных трансплантатов с че-
люстей и свода черепа, хотя J. Jensen и
соавт. [172] считают, что материала в
таких случаях недостаточно, a R. Wood
и D. Moore [301] указывают на техни-
ческие трудности взятия аутокости с
челюстей и опасность повреждения
язычного нерва при формировании
трансплантата с ветви нижней челюсти
и ретромолярной области.
Большое значение для реконструк-
ции верхней челюсти и зубной им-
плантации имели данные текстуры
тканей по РКТ и МРТ. Устанавлива-
лось количественное содержание в губ-
чатом веществе клеточных и неклеточ-
ных элементов, определялись структу-
L
ЛИ 1
Рис. 6.69. Контролиро-
вание реконструкции и
поднятия верхнечелю-
стной пазухи по РКТ.
а — РКТ до операции;
б — после операции: вид-
ны поднятое дно пазухи,
увеличенные альвеоляр-
ный отросток и тело верх-
ней челюсти; в — ортопан-
томограмма после установ-
ления имплантатов.
ра трабекул и их минерализация. Наи-
более достоверно степень минерализа-
ции определялась по данным ультра-
звуковой денситометрии. Все тканевые
компоненты оценивались в разных
плоскостях. На основании трехмерно-
го моделирования цветного и текстур-
ного оформления тканей лицевого
черепа нам представилась возмож-
ность видеть верхнечелюстную пазуху
не только снаружи, но также послойно
и изнутри. Нами отдельно выделялись
стенки и дно верхнечелюстной пазухи
и полость носа. Верхнечелюстная пазу-
ха при пневматическом типе строения
имела вид неправильной усеченной
пирамиды (см. рис. 3). Каждая из ее
стенок представляла собой неправиль-
ную трапецию. В альвеолярный отрос-
ток изнутри вдавались альвеолярные
бухты, разделенные перегородками. У
отдельных больных дно пазухи вдава-
лось кзади, образуя небные бухты. На-
ми отмечены индивидуальные особен-
ности и наличие наи-
более тонких стенок
верхнечелюстной па-
зухи, передняя лате-
ральная стенка и бугор
верхней челюсти и ме-
диальная стенка (рис.
6.69).
Новым оператив-
ным доступом является
эндоскопическая ре-
конструкция верхней
челюсти с поднятием
верхнечелюстной пазу-
хи с контролем вмеша-
тельства на мониторе
компьютера.
Для отработки эндо-
скопического метода
нами проведены эксперименты на 9
трупах, в ходе которых разработаны
способы поднятия слизистой оболочки
дна пазухи и эндоскопически ассисти-
рованной реконструкции верхней че-
люсти. Мы поставили перед собой зада-
чи: выявить оптимальное место эндо-
скопического обзора дна верхнечелюст-
ной пазухи, определить наименее трав-
матичное и безопасное место доступа к
дну верхнечелюстной пазухи, разрабо-
тать метод эндоскопической препаров-
ки слизистой оболочки от дна верхне-
челюстной пазухи, обозначить пути
введения биоматериала (см. рис. 3.24).
Обнаружено, что 69,4 % п ш
верхнечелюстных пазух невозможно
визуализировать 4-миллиметровым ри-
носкопом при эндоназальном способе
при резецированной медиальной (но-
совой) стенке верхнечелюстной пазухи
из-за костно-хрящевых образований
грушевидного отверстия и перегород-
ки носа. Примененные нами ориги-
нальные эндоскопы и эндоскопиче-
ские инструменты последнего поколе-
ния, диаметр которых 2 мм и менее, а
угол обзора достигает 70°, позволили
преодолеть этот барьер.
Отработка анатомо-топографических
особенностей пневматического типа
верхнечелюстной пазухи позволило в
клинике разработать методику транс-
назального эндоскопического подхода
через медиальную стенку пазухи.
Для эндоскопического обзора мы
использовали естественное отверстие
верхнечелюстной пазухи в среднем но-
совом ходу, куда вводился жесткий эн-
доскоп диаметром 1,7 мм с углом обзо-
ра 70°. В пазухе эндоскоп устанавли-
вался срезом к альвеолярной стенке.
Надо отметить, что слизистая обо-
лочка верхнечелюстной пазухи у здо-
рового человека более прозрачна для
визуализации действий в слизистом
пространстве, чем мы наблюдали в
эксперименте на биоманекенах.
Операции эндоскопически ассисти-
рованного поднятия дна верхнечелю-
стной пазухи выполнялись под мест-
ной аппликационной анестезией 10 %
раствором лидокаина с адреналином
слизистой оболочки полости носа и
традиционной инфильтрационной
анестезией на верхней челюсти на сто-
роне вмешательства.
Операции производили с использо-
ванием стандартного эндохирургиче-
ского оборудования, в частности пол-
ностью укомплектованной эндохирур-
гической "стойки’' фирмы "Аксиома"
(Россия), жесткого эндоскопа диамет-
ром 2 мм с углом обзора 70°. Операции
производили набором эндохирургиче-
ского инструмента: троакары со штор-
ковыми клапанами, гильзами диамет-
ром 2 мм, с винтовыми фиксаторами;
захваты с твердосплавными накладка-
ми на браншах и аксиальным располо-
жением ручек; пинцеты диаметром
2 мм с одной или двумя активными
браншами, поворотным механизмом и
накидной кремальерой; ножницы
"Metzenbaum" диаметром 2 мм с пово-
ротным механизмом; диссектор "Mary-
land" диаметром 2 мм с поворотным
механизмом; электрохирургический
крючок диаметром 2 мм; зажимы "Bab-
cock" диаметром 2 мм. Для ушивания
слизистой оболочки полости носа руч-
ным швом использовали атравматич-
ный синтетический шовный материал
№ 5/0—4/0 на изогнутых колющих иг-
лах: плетеный рассасывающийся "Poly-
sorb", монофиламентный рассасываю-
щийся "Biosin" ("Auto Suture") и "PDS И”
("Ethicon").
В качестве костезаменителя мы ис-
пользовали "ОСТИМ-100” в комбина-
ции с "Колаполом КП-3", "Коллапа-
ном" или "Bio-Oss" или "Osteo-Graf' в
комбинации с деминерализованной
костью в виде мелкой стружки. Эти ма-
териалы также смешивались со стиму-
ляторами роста кости — PRP и ее со-
ставляющими, полученными из крови
пациента, а также материалом из поли-
пептидов — "Pep-Gen Р-15".
На основании анатомических осо-
бенностей верхнечелюстной пазухи у
каждого пациента мы использовали
эндоскопический способ визуализа-
ции ее. Особое внимание обращали на
акцентирование источника света. Для
обзорного осмотра ставят несколько
виртуальных камер, позволяющих ви-
зуально определить индивидуальную
анатомию пазухи, получить данные о
патологии и норме слизистой оболоч-
ки. выстилающей ее, а также взаимо-
отношении дна с нижним носовым хо-
дом (см. рис. 3.24; 3.26).
Дтя первоначального интраопераци-
онного ориентирования использовали
рентгеноконтрастные метки, которые
мы располагали на внешних стенках
верхнечелюстной пазухи и исследовали
ее. Получив трехмерное изображение
верхнечелюстной пазухи, определяли
наиболее благоприятные подходы —
через латеральную или переднюю стен-
ку или нижний носовой ход (см. рис.
6.64). При наиболее тонкой медиаль-
ной стенке делали коррекцию позиций
меток для начала операции. Операция
возможна только при нахождении дна
носа и дна пазухи на одном уровне и ес-
ли медиальная стенка была самой тон-
кой. Операция проводится аналогично
вмешательству для локального подня-
тия слизистой оболочки верхнечелюст-
ной пазухи, но отделять выстилку надо
по всему дну, до середины передней,
латеральной и частично задней стенки.
Объем вводимого материала всегда в
493
Рис. 6.70. Эндоскопически ассистиро-
ванная реконструкция верхней челюсти
с поднятием верхнечелюстной пазухи,
а, б — схема оперативного доступа через меди-
альную стенку; в — пиропрепаровка, введение
биоматериала и установление имплантатов;
г — компьютерная визуализация операции.
в
3—4 раза больше, чем при локальном
поднятии дна для изоляции верхушек
одного — трех имплантатов от слизи-
стой выстилки пазухи. После традици-
онного обезболивания на уровне ниж-
него носового хода выкраивают П-об-
разный лоскут слизистой оболочки.
Для этого можно использовать диатер-
мокоагуляцию с игольчатым, изогну-
тым и покрытым изоляцией наконеч-
ником, что позволяет бескровно осу-
ществить доступ к медиальной костной
стенке верхнечелюстной пазухи. Объ-
емное свечение пазухи четко определя-
ло место сверления, толщину костных
стенок и глубину пазухи, так как по ме-
ре истончения кости яркость свечения
возрастает.
Посредством острых боров и фрез
производилась перфорация медиальной
костной стенки с продвижением бора
параллельно дну пазухи. Максимально
близко к дну полости носа высверлива-
ли отверстие в кости, которое по мере
необходимости расширяли. После этого
осуществляли ревизию пазухи при по-
мощи эндоскопа с оптикой 70’.
Костное окно должно быть разме-
ром 10*10 мм. Перфорацию медиаль-
ной стенки верхнечелюстной пазухи и
формирование костного окна нужно
осуществлять с особой осторожно-
стью, чтобы нс перфорировать слизи-
стую оболочку пазухи. В отверстие
Рис. 6.71. Планирование и результаты реконструкции верхней челюсти по эндоско-
пически ассистированной технологии.
а — РКТ до операции; б — эндоскопическая картина реконструкции верхней челюсти; в — РКТ
после операции; г — внешний вид имплантатов.
фиксируют трубку диаметром 99 мм,
через которую вводили инструменты
для поднятия слизистой оболочки и
введения биоматериала. При помощи
элеваторов или овальных кюреток от-
слаивали слизистую оболочку. Введя
элеватор в костное окно, продвигали
его от дна носа к дну пазухи. Как толь-
ко образовалось пространство между
костных» дном и слизистой оболочкой
пазухи, начинали гидропрепаровку.
Последнюю сочетали с работой троа-
каром со шторковыми клапанами, ко-
торыми также поднимали слизистую
выстилку на протяжении всего дна па-
зухи. Когда достигали дистальной
стенки, идя по дну эндоскопическим
инструментом и отделяя ткани гидро-
препаровкой, отсасывали жидкость из
пространства. При излиянии крови из-
под оболочки пазухи отсасывание жид-
кости проводили наиболее осторожно,
без особого давления. Под контролем
эндоскопической визуализации посте-
пенно начинали отделять слизистую
оболочку от передней стенки, комби-
нируя действия инструментом и гидро-
препаровку (рис. 6.70, а—в). Когда
слизистая оболочка отделялась от ме-
диальной, нижней, латеральной и пе-
редней стенок пазухи, еще раз отсасы-
вали жидкость и вводили пастообраз-
ный биоматериал. Контролировали его
распределение по всем стенкам пазухи
нижней трети или половины ее. Отде-
ление слизистой оболочки от задней
стенки не проводили инструментом, а
только под небольшим давлением вво-
димым биоматериалом.
В ходе операции мы могли видеть на
экране компьютера расположение ин-
струмента по отношению к стенкам
верхнечелюстной пазухи. Заполнение
пространства под смещенной биомате-
риалом вверх слизистой оболочкой па-
зухи фиксировалось в трехмерной ви-
зуализации (рис. 6.70, г). Это позволя-
ло определять объемность, размеры и
плотность введенного биоматериала,
взаимоотношение с альвеолярным от-
ростком и зубами, что определяло
стратегию будущей зубной импланта-
ции. Убедившись в достаточности вве-
денного биоматериала и правильности
его распределения со стороны альвео-
лярного отростка, устанавливали им-
плантаты (рис. 6.71, а). Удаляли эндо-
скопический инструмент из костного
_______________________________495
окна, слизисто-надкостничный лоскут
укладывали на место и фиксировали
швами. В других случаях имплантацию
проводили через 6—12 мес на основа-
нии оценки ремоделирования биома-
териала и структурной характеристики
новообразованной кости.
Оценку результатов вмешательств
по реконструкции тела челюсти с
трансплантацией биоматериала под
пазуху мы проводили в динамике. Об-
разование костной структуры нами от-
мечено через 6 мес после операции.
Для оценки отдаленных результатов
были использованы рентгенологиче-
ские снимки и эндоскопический ос-
мотр, позволяющие дать в совокупно-
сти объективную оценку процессов ос-
теоинтеграции и состояния слизистой
оболочки верхнечелюстной пазухи (см.
рис. 6.71, а). На рис. 6.71, б представ-
лена эндоскопическая картина дна
верхнечелюстной пазухи через 6 мес
после эндоскопически ассистирован-
ного поднятия слизистой оболочки
верхнечелюстной пазухи трансназаль-
ным доступом, которая не имела при-
знаков васкуляризации и раздражения.
После операции из субъективных
признаков оценивали носовое дыха-
ние, выделения из носа, при одновре-
менной постановке имплантатов —
воспалительные явления в полости
рта, отек мягких тканей носа. В после-
операционном периоде у наших боль-
ных эти явления были не выражены,
при имплантации наблюдался умерен-
ный отек верхнего свода преддверия
рта на стороне операции.
В послеоперационном периоде боль-
ным проводилось контрольное рентге-
нологическое и эндоскопическое ис-
следование верхней челюсти. При не-
обходимости точной топической диа-
гностики выполняли компьютерные
томографические исследования с ис-
пользованием томографа "PHILIPS
TOMOSCAN SR 7000", представляю-
щего собой мультипроцессорную сис-
тему с разделенными функциями сбора
и обработки информации. Наличие ра-
бочей станции "PHILIPS EASY VISION
СТ”, построенной на базе IBM PC/AT
486 DX2 со спецпроцессором и про-
граммами форматирования изображе-
ния EPI и GRASE, позволяло осущест-
влять одновременное сканирование,
просмотр и обработку' получаемых изо-
бражений.
Реконструкция верхней челюсти с
поднятием верхнечелюстной пазухи для
зубной имплантации требует макси-
мально щадящих хирургических мани-
пуляций. Трансплантируемый материал
должен образовывать индуктивно или
кондуктивно кость, способную воспри-
нять и остеоннтегрировать будущий им-
плантат. Резорбция вновь образован-
ной кости в первый год после опера-
ции не должна превышать 1,49 мм, в
последующие — 0,1 мм. Все оператив-
ные вмешательства не должны вызы-
вать воспаления верхнечелюстной па-
зухи.
6.2.13. Реконструкция нижней
челюсти
Костно-пластические операции на
нижней челюсти для зубной импланта-
ции основываются на многолетнем
опыте устранения ее дефектов и дефор-
маций. Как уже упоминалось ранее, ос-
новные методы — это: 1) костная пла-
стика "внакладку" (см. рис. 6.22); 2) ко-
стная пластика внутрь кости (см. рис.
6.23). Для костной пластики внутрь кос-
ти проводят горизонтальную остеото-
мию с транспозицией одной из стенок
вверх или вниз и заполнением образо-
вавшегося пространства биоматериа-
лом. Вертикальная остеотомия на ниж-
ней челюсти делается для транспозиции
остеотомированного фрагмента кнару-
жи или кнутри, а также заполнения об-
разовавшегося пространства биомате-
риалом (см. рис. 6.24 а, б; 6.25, а, б; 6.26,
а—в).
Костная пластика "внакладку",
внутрь кости может увеличивать оста-
точную кость нижней челюсти как в вы-
соту', так и в ширину. После традицион-
ных рассечений мягких тканей и скеле-
тирования кости при костной пластике
"внакладку" со стороны альвеолярной
части нижней челюсти следует слегка
уплощить альвеолярный гребень, что-
бы трансплантат плотно соприкасался
с материнской почвой.
Если одновременно с костной пла-
стикой ставят имплантаты, остеото-
мию проводят через обе кости —
трансплантат и остаточную кость — и
имплантаты будут служить фиксирую-
щими элементами (см. рис. 6.39).
Необходимо, чтобы имплантат был
покрыт пластическим материалом тол-
щиной не менее 1,5 мм. В противном
случае возможны резорбция транс-
плантата и обнажение имплантата
[138]. Желательно, чтобы к имплантату
прилегала поверхность губчатой кости,
так как благодаря этому обеспечивает-
ся наилучшее питание. Однако чаще
вмешательства выполняют в два этапа:
сначала трансплантация, на втором
этапе — имплантация. Фиксация
трансплантата всегда должна быть же-
сткой. Лучше всего плотное прилега-
ние обеспечивают винты. Т. Colins и
соавт. [119] считают оптимальным диа-
метр винта 1,5 мм, а винты большего
или меньшего диаметра склонны ло-
маться или расшатываться. Расстояние
между винтами должно быть не менее
1,5—2 мм. Очень важно правильно за-
шивать рану. Слизисто-надкостнич-
ный лоскут должен быть свободным и
не оказывать давления на трансплан-
тат; фиксируют его как непрерывны-
ми, гак и матрацными швами.
В случае чрезмерной атрофии ниж-
ней челюсти и опасности ее перелома
трансплантат, чаще ребро, укладывают
"внакладку” по альвеолярной дуге опе-
ративным доступом со стороны пред-
дверия рта или наружным разрезом у
основания нижней челюсти. Также
должно быть хорошо подготовлено ко-
стное ложе для трансплантата. В обоих
случаях фиксируют трансплантат ок-
ружающим проволочным швом, мини-
пластинами с винтами (см. рис. 6.23, а,
б). Традиционно операцию выполняют
в два этапа.
Реже производят пластику нижней
челюсти внутрь кости. Введение
внутрь кости чаше проводят при остео-
томии, надломе кости и транспозиции
стенки челюсти.
На нижней челюсти такая операция
возможна только в области симфиза. В
случае, если требуется увеличение ши-
рины нижней челюсти по всей ее длине,
ограничениями могут быть канал ниж-
ней челюсти, подбородочные отверстия
и выходящие из них сосудисто-нервные
Рис. 6.72. Реконструкция нижней челю-
сти и зубная имплантация [Block М..
Kent J., 1995].
пучки. Их выделение и изоляцию при
пластике проводят только при значи-
тельной атрофии нижней челюсти, ко-
гда нижний альвеолярный нерв нахо-
дится на поверхности остаточной кос-
ти. Зарубежный опыт свидетельствует
об успешности таких операций [238,
240, 247, 281] и даже с одновременной
постановкой остеоинтегрированных
имплантатов [139, 140] (рис. 6.72). Все
авторы указывают на трудности в связи
с нехваткой мягких тканей дзя заши-
вания раны. Н. Tatum [281] прибегал к
формированию в начале преддверия
рта тонким кожным лоскутом, а затем
проводил пластику гребнем подвздош-
ной кости. Только на третьем этапе,
приблизительно через 1 год, ставили
имплантаты. С. Misch [224] проводил
имплантацию одновременно с костной
пластикой нижней челюсти и получил
успех в 92 % случаев. R. Fohseca и со-
авт. [139], обобщив сведения о рекон-
струкции нижней челюсти и зубной
имплантации, считают, что единого
подхода нет и все указанные методы
выбираются индивидуально в зависи-
мости от функционального состояния
организма и степени атрофии кости.
6.2.14. Репозиция нижнего
альвеолярного нерва
Показания к репозиции нерва. Обычно
определение показаний связано с труд-
ностями при постановке имплантатов
на дистальные участки нижней челю-
сти. В одних случаях причинами могут
497
быть атрофия альвеолярной части и
близость нижнего альвеолярного нер-
ва, в других — анатомические особен-
ности расположения канала и находя-
щегося в нем сосудисто-нервного пуч-
ка [71, 146J. Такие анатомические осо-
бенности были подтверждены ретро-
спективным анализом 1377 оператив-
ных вмешательств на атрофированной
нижней челюсти у пожилых пациентов
[194]. Анатомические отклонения от
нормы часто обнаруживали J. Stella и
W. Tharanon [274]. Они сообщили, что,
по их наблюдениям, в 40 % случаев
нижний альвеолярный нерв находится
не в канале, а разветвляется в толще те-
ла челюсти, образуя заднее, среднее и
переднее сплетения. Одновременно
было отмечено несовершенство мето-
дов диагностики, так как в 25 % случа-
ев ортопантомограмма искажала ис-
тинные размеры кости нижней челю-
сти и соответственно расположение
нижнего альвеолярного нерва.
Отличается разнообразием анато-
мия как подбородочного отверстия,
так и выходящего из него подбородоч-
ного нерва. Кроме того, на передней
поверхности кости нерв может образо-
вывать петли разных размеров. Наблю-
дения показали, что такие петли харак-
терны для 12 % пациентов. Длина пет-
ли может достигать 5 мм [220]. В связи
с этим небезынтересно отметить, что
если при рентгенографии черепа у лю-
дей изгиб подбородочного нерва отме-
чался на 92—96 % снимков [58], то на
прицельных рентгенограммах — толь-
ко в 56 % случаев. На панорамных
снимках определялся преимуществен-
но изгиб подбородочного нерва кзади.
Отдельные указанные выше анато-
мические особенности репозиции нер-
ва дают возможность не только подби-
рать наиболее адекватные по размерам
имплантаты, но и придавать им нуж-
ное для правильной окклюзии положе-
ние, а надальвеолярной части — пра-
вильный угол. Если имплантаты ставят
в дистальный отдел нижней челюсти,
то до нижнего альвеолярного нерва
должно оставаться не менее 2 мм кос-
ти. В таких случаях репозиция нерва
позволяет использовать всю высоту
кости и ставить имплантаты большей
длины. Кроме того, репозиция сосуди-
сто-нервного пучка предохраняет нерв
от повреждения.
К репозиции нижнего луночкового
нерва и идущих с ним сосудов прибе-
гают в случаях значительной атрофии
альвеолярной части нижней челюсти,
когда сосудисто-нервный пучок нахо-
дится на поверхности альвеолярной
дуги, так как такая клиническая ситуа-
ция создает трудности не только для
имплантации, но и при ношении зуб-
ных протезов. Трудности для зубной
имплантации может также создавать
выход сосудисто-нервного пучка через
подбородочное отверстие, особенно
если для опоры съемного протеза ста-
вят несколько имплантатов.
Репозиция нижнего альвеолярного
нерва. Основная часть хирургических
манипуляций при репозиции делается
для того, чтобы получить удобный дос-
туп к нерву. Они зависят от того, на ка-
кой участок планируется постановка
имплантатов и как располагается ниж-
ний альвеолярный нерв. В случаях по-
становки имплантатов в передний отдел
нижней челюсти рассечения делают по
гребню на тех участках, где отсутствуют
зубы, и ниже десневого края по прикре-
пленной десне. Не следует делать вер-
тикальные рассечения, а также слиш-
ком короткие разрезы, которые при от-
кидывании слизисто-надкостничного
лоскута могут привести к их разрыву. В
случае отсутствия зубов слизисто-над-
костничный лоскут формируется так,
чтобы он перекрывал будущий имплан-
тат и его запорный винт. Откидывание
слизисто-надкостничного лоскута долж-
но сохтать хороший обзор альвеолярной
части нижней челюсти или ее тела, а
также подбородочного отверстия.
При обнажении последнего обраща-
ют внимание на характер разветвления
подбородочного нерва [71]. Если изгиб
нерва на поверхности кости петлеоб-
разный, то нерв отсепаровывают и
фиксируют толстым кетгутом. Это по-
зволяет выделить ветви подбородочно-
го нерва и отодвинуть их кзади, чтобы
получить больше места для постановки
имплантатов в переднем отделе ниж-
ней челюсти. В других ситуациях после
обнажения подбородочного отверстия
устанавливают его направление. Ту-
пым инструментом проверяют ход ка-
498
Рис. j ^^’995]ПОЗИЦИЯ подбоРодочного и нижнего альвеолярного нервов [Block М.,
а — откинут слизисто-надкостничный лоскут, выделен и репонирован кнаружи подбородочный
нерв, проведена остеотомия, начато погружение имплантата в костное ложе; б — нижнечелю-
стной нерв уложен на поверхности кости, имплантат погружен и фиксирован; в — позиция им-
плантата и нижнего альвеолярного нерва после перемещения.
нала и при непрерывном контроле со-
судисто-нервного пучка с помощью
бора осторожно раскрывают подборо-
дочное отверстие.
Защитив нерв сепаратором или отсе-
паратором, прерывистыми движения-
ми бора удаляют переднюю стенку ка-
нала, постепенно освобождая сосуди-
сто-нервный пучок на таком расстоя-
нии, которое необходимо для поста-
новки имплантатов (рис. 6.73, а, б).
Сверление кости и освобождение нерва
рекомендуется проводить с наружным
охлаждением стерильным изотониче-
ским раствором натрия хлорида или
раствором Рингера. Освобожденный
сосудисто-нервный пучок оставляют на
кетгутовой лигатуре. Затем производят
остеотомию и сгавят имплантаты. Со-
судисто-нервный пучок укладывают в
участки канала, нс занятые импланта-
том, а открытый нерв изолируют сна-
ружи от имплантата (рис. 6.73, в).
Высказывается мнение, что прямой
контакт сосудисто-нервного пучка и
слизисто-надкостничного лоскута не-
допустим. Одновременно рекомендует-
ся использовать рассасывающиеся мем-
браны, а также аллогенную кость, био-
материалы на основе гидроксиапатита с
органическими наполнителями и без
них, а также пористые блоки спеченной
керамики и другие материалы [247].
Если имплантат ставят в дистальный
отдел нижней челюсти, то рассечения
тканей делают так же, как описано вы-
ше. Но после обнажения подбородоч-
ного отверстия и выходящего из него
сосудисто-нервного пучка замеры кости
от альвеолярной дуги до ментального
отверстия сопоставляют с результатами
рентгенологических данных о положе-
нии канала нижней челюсти. Соответ-
ственно участку постановки имплантата
фиссурным бором формируют окно то-
го размера, который необходим для ос-
вобождения нерва, мешающего поста-
новке имплантата. После снятия корти-
кального вещества нерв обнажают, вы-
деляют его из канала нижней челюсти и
берут на держалку из толстого кетгута.
После постановки имплантата по обыч-
ным правилам с помощью биоматериа-
лов сначала изолируют имплантат от
нерва, а затем нерв от слизисто-надко-
стничного лоскута.
При значительной атрофии кости,
когда нижний альвеолярный нерв на-
ходится на поверхности альвеолярной
дуги, также проводят рассечения и от-
кидывание слизисто-надкостничного
лоскута. Сосудисто-нервный пучок
выделяют и перемещают вниз по пе-
редней поверхности кости. После это-
го выполняют остеотомию и ставят
имплантаты. Перед зашиванием раны
нерв фиксируют в этом положении и
прикрывают биоматериалом.
После репозиции нерва проводят
общую и местную терапию. Общее ле-
499
чение заключается в назначении анти-
биотиков и других противовоспали-
тельных средств. Лечение антибактери-
альными препаратами особенно целе-
сообразно в тех случаях, когда были ис-
пользованы биорегенерирующие ткани
[274]. Местное лечение заключается в
туалете раны. Больной должен 3 раза в
день полоскать полость рта раствором
хлоргексидина. После заживления ра-
ны и до второго этапа — вскрытия им-
плантата осмотр больного проводят
один раз в месяц.
Прогрессивность методики репози-
ции нижнего альвеолярного нерва при
имплантации не исключает ряда ос-
ложнений. После операции может раз-
виться кратковременная или продол-
жительная парестезия или анестезия.
Большинство специалистов, прово-
дивших репозицию нерва, наблюдали
такие осложнения [140, 194, 220, 247].
Даже при щадящем препарировании
нерва и в отсутствие его травматиче-
ских изменений не исключаются ней-
росенсорные нарушения [214, 220]. В
то же время восстановление нормаль-
ной функции нерва отмечалось через 6
мес [140] и даже в период от 6 мес до
1 года [246]. В раннем послеопераци-
онном периоде обязательна проверка
чувствительной иннервации [276].
Существуют упрощенный и расши-
ренный варианты классификации по-
ражений нижнего альвеолярного нерва
[194, 259, 276], с учетом которых раз-
личают пять степеней. При поражении
I степени наступает временное прекра-
щение проводимости нерва при непре-
рывности структуры осевоцилиндри-
ческих отростков. Морфологически
выявляется разрушение миелинового
слоя нервных волокон вследствие ком-
прессионных воздействий, отека, ин-
фильтрации при оперативном вмеша-
тельстве. Поражения первой степени,
называемые по Seddon нейропраксией,
исчезают через 3—4 нед.
При поражении II степени нижнего
альвеолярного нерва по Seddon полно-
стью нарушается проводимость нерва
и происходит дегенерация сегмента
нерва. Именно этот сегмент перемеща-
ется при травме, но ни наружная обо-
лочка нерва, ни ткани по ходу нервных
волокон не поражаются. Восстановле-
ние нерва происходит через 2—3 мес.
Поражения нерва III, IV и V степени
характеризуются полным анатомиче-
ским прерыванием отдельных фраг-
ментов или всего нерва. В зависимости
от регенерации как отдельных ткане-
вых структур, так и нерва в целом чув-
ствительность восстанавливается пол-
ностью или частично либо не восста-
навливается. Иногда в момент репози-
ции возможна перерезка нерва. В та-
ких случаях производят первичное
восстановление нерва — сшивание его.
Через 7—21 день после перерезки воз-
можно отсроченное восстановление
нерва путем сшивания. В тех случаях,
когда после перемещения нерва насту-
пило поражение, но в раннем после-
операционном периоде степень его не-
известна, прибегают к вторичному
восстановлению. S. Sunderland [276]
считает, что это следует делать через
3—4 мес, когда еше не произошли де-
генеративные и нервно-трофические
изменения. По мнению J. Ruskin [247],
при повреждениях III, IV и V степени
необходимо вторичное восстановление
нерва. Операцию производят с исполь-
зованием микрососудистой техники.
Обязательным условием является от-
сутствие натяжения нерва.
Наиболее перспективен эпиневраль-
ный метод, предложенный R. Mayer
[209]: с помощью микрососудистой
техники концы нерва совмещают так,
как были совмещены до повреждения.
Можно применять периневральный
метод, при котором каждый пучок нер-
ва восстанавливают отдельно. Однако
технически он очень сложен, так как в
нижнем альвеолярном нерве много
пучков небольшого диаметра и сшива-
ние их — весьма долгий и кропотливый
процесс. Кроме того, по данным
S. McKinnon [214], эти методы дают
одинаковые результаты.
Для того чтобы анастомоз был эф-
фективным, достаточно приложить си-
лу 25 G. В случаях нехватки нерва или
при сильном его натяжении рекомен-
дуется трансплантация большого уш-
ного нерва или нерва из икроножной
мышцы [246].
Ведение больных после дополни-
тельных операций такое же, как при
имплантационной хирургии III и IV
степени сложности. После операции
на 2—3 ч назначают холод. Рекоменду-
ются прием жидкой пищи ("челюст-
ной" стол), ежедневные двухразовые
полоскания хлоргексидином в течение
21 дня. За рубежом принято при всех
операциях в области зубов и полости
рта проводить обязательную профи-
лактику эндокардита антибактериаль-
ными препаратами [218, 224]. Курс ан-
тибиотикотерапии при III степени
сложности операции должен продол-
жаться 6—8 дней. При IV степени
сложности и у отдельных больных с со-
путствующими болезнями длитель-
ность антибиотикотерапии может быть
увеличена до 10—12 дней и более. Швы
снимают через 10—12 дней и назнача-
ют масляные повязки на гранулирую-
щую рану. До полной регенерации
кости пациентам запрещается носить
съемные протезы. Исключение может
быть сделано только в тех случаях, ко-
гда протезы специально выполняют
формирующую функцию. Иногда но-
шение протеза возможно, если кость
наращивают лишь на переднем участ-
ке, тогда как на остальной челюсти со-
храняются природные зубы, но и в
этом случае даже после специальной
подгонки протеза разрешается носить
их только по эстетическим соображе-
ниям и при каждом принятии пищи
обязательно снимать. При операциях
на верхнечелюстной пазухе для опо-
рожнения ее в нос закапывают капли.
В это время противопоказаны сморка-
ние, курение, плавание, тем более с
погружением головы в воду. Через день
делают перевязки. Гигиену полости рта
осуществляет сам больной. Швы сни-
мают на 11—14-й день и через 4 нед на-
девают съемный протез.
Во время поднятия верхнечелюст-
ной пазухи нельзя исключать развитие
осложнений. Возможен разрыв ее сли-
зистой оболочки. Как отмечают J. Tid-
well и соавт. [285], чаще это происхо-
дит при хроническом воспалении пазу-
хи. В таких случаях перфорационное
отверстие закрывают блоком ауто- или
аллокости, "Колаполом", "Коллапа-
ном". При случайном вскрытии верх-
нечелюстной пазухи ее инфицирова-
ние может закончиться развитием ка-
тарального гайморита. Синусит легко
купировать противовоспалительной
терапией, которую проводят после
операции. Возможно также расхожде-
ние швов в раннем послеоперацион-
ном периоде. Если линия рассечения
тканей и расхождения швов располо-
жена ближе к оральной стороне, то ос-
ложнение легко устранить вторичным
наложением швов; в других случаях
гранулирование раны происходит вто-
ричным натяжением. Следует иметь в
виду, что чем вестибулярнее делают
рассечения, тем больше опасность рас-
хождения швов и образования свища,
через который возможно инфицирова-
ние трансплантата, что может привес-
ти к его отторжению из-за нагноения.
Поднятие верхнечелюстной пазухи,
трансплантация биоматериалов может
сопровождаться хроническими болями
в данной области. Е. Regev и соавт.
[244] считают, что в таких случаях мож-
но предполагать аспергиллез, особенно
у иммуноскомпрометированного паци-
ента, и тогда необходимо соответст-
вующее противогрибковое лечение.
Ряд операций потребует более частых
перевязок и ухода за ранами. Рекомен-
дуется динамичное наблюдение, в том
числе с контрольной рентгенографией в
случае операций на костных тканях. В
зависимости от результатов операций
на мягких и костных тканях (одновре-
менно с имплантацией или как этап
предымплантационной хирургии) ре-
шаются вопросы временного или по-
стоянного ортопедического лечения.
Широкая разработка и использова-
ние различных материалов с целью об-
разования новой кости открыло значи-
тельные перспективы для зубной им-
плантации и решения функциональ-
ных и эстетических вопросов при ор-
топедическом лечении. Одновременно
совершенствуются методы функцио-
нальной диагностики и наблюдения за
ремоделированием ткани. Для диагно-
стики и контроля остеоинтеграции
перспективны компьютерная и резо-
нансная томография, допплерография,
прижизненная микроскопия. Большой
оптимизм вызывает возможность сле-
дить за метаболизмом кости с помо-
щью скелетной сцинтиграфии [94].
Этот метод позволяет рутинно контро-
лировать остеоинтеграцию и прижив-
ление аутотрансплантатов, а также ко- И.
стную реконструкцию пластическими
материалами. Такой контроль дает воз-
можность безошибочно раньше вскры-
вать имплантаты тогда, когда наступа- 12
ет полная интеграция их с костью
1231].
СПИСОК ЛИТЕРАТУРЫ (
1. Александров Н.М. Операции на верх-
ней челюсти // Руководство по опера- ”•
тивной челюстно-лицевой хирургии /
Под ред. В.В. Балина. — СПб.,
1999. - С. 430-450.
2. Бажанов Н.Н., Тер-Асатуров Г.П.
Применение формалинизированных *5-
гомокостей при костной пластике де-
фектов нижней челюсти: Метод.
рекомендации. — М., 1975. — 28 с.
3. Буриан Р. Атлас пластической
хирургии. — Т. 3. — Прага, 1967.
4. Вигдерович В. А., Дробот ГВ.. Там-
лай М.А., Заварзин М.Н. Клиниче-
ский опыт использования резорби-
руемых мембран для направленной
регенерации тканей пародонта // .«
Пробл. стоматол. и нейростоматол. —
1999. - № 2. - С. 51.
5. Воложин А.И., Нидаль Аль Ахмар, Гри- щ
горьян А.С., Титов М.Н. Некоторые
свойства композиционного материа-
ла на основе полиамидного геля и
тидроксиапола для пластики костных
дефектов // Тез. докл. 1-й Всероссий-
ской научной конференции. — М.,
1997.-С. 15. ,9
6. Воложин А.И., Дьякова С.В. и др. Кли-
ническая апробация препарата на ос-
нове гидроксиапатита в стоматологии
// Новое в стоматологии. — 1993. —
№ 3. - С. 29-31.
7. Грудянов А. И., Ерохин А.И., Новосе- 20.
лов С.П., Чупахин П.В. Сравнительная
оценка эффективности остеотропных
подсадок при проведении лоскутных
операций // Тез. докл. 1-й Всероссий-
ской научной конференции. — М.,
1997. — С. 27.
8. Гуцан А.Э. Справочник челюстно-ли- 21.
цевых операций. — Витебск, 1997.
9. Долголев А.А., Гречишников В.И., За-
мешка Н.Н. Методы коррекции аль-
веолярного отростка биокерамически-
ми материалами при дентальной им-
плантации // Пробл. стоматол. и ней- 22.
ростоматол. — 1999. — № 2. — С. 31.
10. Евдокимов А.И., Васильев ГА. Хирур-
гическая стоматология. — М.; Меди-
цина, 1964.
Жусев А.И. Синуслифгинг: оценка воз-
можности развития метода при при-
менении остеопластических материа-
лов // Инфодент. — 1998. — № 3. —
С. 2-3.
Иванов С.Ю., Ломакин М.В. Денталь-
ная имплантация при низком распо-
ложении верхнечелюстных пазух //
Тез. докл. 1-й Всероссийской научной
конференции. — М.» 1997. — С. 29.
Кабаков БД. Костная пластика ниж-
ней челюсти. — М.: Медицина, 1963.
Кулаков А.А., Курдюмов С.Г. Примене-
ние биокомпозиционных материалов в
практике дентальной имплантации //
Тез. докл. 4-й Международной кон-
ференции. — Саратов, 1998. — С. 119.
Кулаков А.А. Хирургические аспекты
реабилитации больных с дефектами
зубных рядов при использовании раз-
личных систем зубных имплантатов.
Автореф. дис. ... д-ра мед. наук. — М..
1997. - 27 с.
Кулаков А.А. Использование компози-
ций гидроксиапатита при повторных
операциях имплантации // Тез. докл.
1-й Всероссийской научной конфе-
ренции. — М., 1997. — С. 34.
Лимберг А.А. Атлас местно-пластиче-
ских операций. — Л.: Медицина,
1963.
Лосев Ф.Ф. Экспериментально-кли-
ническое обоснование использова-
ния материалов для направленной ре-
генерации челюстной костной ткани
и дефектов различной этиологии: Ав-
тореф. дис. ... д-ра мед. наук. — М.,
1998. - 39 с.
Макунин В.И., Бурдыгин В.Н., Верчен-
ко ГН. Пластика посгрезекционных
дефектов кости материалами на осно-
ве гидроксиапатита // Тез. докл. 1-й
Всероссийской научной конферен-
ции. - М„ 1997. - С. 37.
Мустафаев М.Ш. Экспериментальная
апробация и клиническое примене-
ние биорезорбируемых мембран в
комплексном лечении переломов кос-
тей лицевого скелета и при реконст-
руктивных операциях: Автореф. дис.
... д-ра мед. наук. — М., 1998. — 37 с.
Мухин М.В., Александров Н.М. Обшие
принципы наиболее распространен-
ных пластических операций // Руко-
водство по оперативной челюстно-ли-
цевой хирургии / Под ред. В.В. Бали-
на. - СПб., 1998. - С. 77-130.
Мухин М.В., Александров Н.М. Опера-
ции на верхней челюсти // Руково-
дство по оперативной челюстно-лице-
вой хирургии / Под ред. В.В. Бали-
на. - СПб., 1998. - С. 430-453.
23. Мухин М.В., Александров Н.М. Опера-
ции на нижней челюсти // Руково-
дство по оперативной челюстно-лице-
вой хирургам / Под ред. В.В. Бали-
на. - СПб., 1998. - С. 459- 504.
24. Никитин А.А. Аллопластика височно-
нижнечелюстного сустава: Автореф.
дис. ... д-ра мед. наук. — М., 1987 —
38 с.
25. Никитин А.А., Пьянзин В.И. Одномо-
ментный синуслифтинг с использова-
нием пластиночных имплантатов //
5-й Съезд Стоматологической ассо-
циации России. — М., 1999.
26. Никитин А.А., Пьянзин В.И., Курдю-
мов С.Г. Клиническое применение ос-
теопластических материалов при атро-
фии альвеолярных отростков челюстей
// Тез. докл. 4-й Международной кон-
ференции. — Саратов, 1998. — С. 118.
27. Никитин А.А., Пьянзин В.И., Хлест-
кий Ю.Л. и др. Результаты эндооссаль-
ной имплантации с одномоментной
коррекцией дна гайморовой пазухи //
Тез. докл. 4-й Международной конфе-
ренции. — Саратов, 1998. — С. 17.
28. Никитин А.А., Пьянзин В.И., Xiecm-
кин Ю.Л. и др. Опыт практического
применения препаратов гидроксиапол
и колапол при эндооссальной им-
плантации // Тез. докл. 3-й Междуна-
родной конференции. — Саратов,
1996. - С. 18.
29. Олесова В.Н. Морфологическая харак-
теристика слизистой оболочки полости
рта до и после внутрикостной имплан-
тации в различных условиях тканевого
ложа // Новое в стоматологии. —
1997. - № 6. - С. 26-31.
30. Олесова В.Н. Кащенко П.В. Направ-
ленная костная регенерация в им-
плантологии // Тез. докл. 4-й Между-
народной конференции. — Саратов,
1998. - С. 121.
31. Орлова К.А. Пересадка тонкого кож-
ного лоскута в .полость рта и носа при
рубцах и рубцовых стяжениях: Авто-
реф. дис. ... канд. мед. наук. — М.,
1969. - С. 22.
32. Островский А. Остеопластические ма-
териалы в современной пародонтоло-
гии и имплантологии // Клин, стома-
тол. - 1999. — № 6. — С. 39-52.
33. Панкратов А. С. Лечение больных с
переломами нижней челюсти с ис-
пользованием ОСТИМ-100 (гидро-
ксиапатита ультравысокой дисперсно-
сти) как стимулятора остеогенеза: Ав-
тореф. дис. ... канд. мед. наук. — М.,
1995. - 19 с.
34. Перова М.Д. Профилактика биодегра-
дации тканевых структур вокруг ос-
тсоинтегрированных искусственных
опор И Тез. докл. 4-й Международной
конференции. — Саратов, 1998. —
С. 44.
35. Плотников НА. Костная пластика
нижней челюсти. — М.: Медицина
1979. - 271 с.
36. Рендо Б., Ток В., Финадеева Е., Ток Г.Р.
Ко1ггролируемое наращивание кости
альвеолярного отростка (перелом по
типу "зеленой веточки") в сочетании с
имплантатами // Тез. докл. 4-й Меж-
дународной конференции. — Саратов
1998. - С. 71.
37. Робустова Т.Г. Дополнительные опе-
рации при зубной имплантации //
Пробл. стоматол. и нейростоматол. —
1999. - № 2. - С. 23.
38. Робустова Т.Г., Безруков В.М. Зубная и
челюстно-лицевая имплантология //
Хирургическая стоматология и челю-
стно-лицевая хирургия. — М.: Меди-
цина, 1999.
39. Робустова ЕЕ, Фех А.Р., Гокоева А.А.
Взаимосвязь параметров лица и пока-
зателей компьютерной трехмерной ре-
конструкции для зубной имплантации
// Росс, стоматол. журн. — 2000. —
№ 5. - С. 20-23.
40. Робустова Т.Г., Федоров И.В. Отсро-
ченная зубная имплантация // Тез.
докл. 4-й Международной конферен-
ции. — Саратов, 1998. — С. 33.
41. Робустова Т.Г. Эффективность новых
остеопластических материалов // 5-й
Съезд Стоматологической ассоциа-
ции России. — М., 1999. — С. 26—28.
41а. Робустова Т.Г, ФехА.Р., Ушаков А.И. и
др. Эндоскопически ассистированный
синуслифтинг // Росс, стоматол.
журн. — 2001. — № 3. — С. 21—27.
42. Романов И.В., Воложин А.И., Робусто-
ва Т.Г. и др. Имплантационные био-
материалы на основе гидроксиапатита
и их применение для восстановления
кости челюсти // Тез. докл. 3-й Меж-
дународной конференции. — Сара-
тов, 1996. — С. 20.
43. Сидельников А.И., Эйгин Л.Е. Теорети-
ческое обоснование имплантации био-
материалов для увеличения ширины и
высоты альвеолярной части нижней
челюсти // Тез. докл. 3-й Междуна-
родной конференции. — Саратов,
1996. - С. 35.
44. Сильверштейн Л., Хан Д., Курцман Д. и
др. Улучшение эстетики альвеолярно-
го отростка // Клин, стоматол. —
1999. — Спец, выпуск. — С. 52—55.
45. Сильверштейн Л., Каллан Д., Горн-
штейн А. Использование неклсточного
дермального аллоимплаитата и сводно-
го небного аутотрансплантата // Клин,
стоматол. — 1999. — № 3. — С. 28—31.
46. Темерханов Ф.Т., Анастасов А.Н. При-
менение техники синуслифтинга при
атрофии альвеолярного отростка верх-
ней челюсти И Материалы симпозиу-
ма "Проблемы эффективности стома-
тологической имплантологии”. — М.,
1999.
47. Ушаков А.И., Панин А.М. Замещение
дефектов альвеолярных отростков че-
люстей при амбулаторных хирургиче-
ских операциях // Тез. докл. 1-й Все-
российской научной конференции. —
М., 1997. - С. 45.
48. Фиалковский В В., Иорданишвили А.К
Операции в полости рта на альвеоляр-
ных отростках в челюстях // Клиниче-
ская оперативная челюстно-лицевая
хирургия. — СПб., 1998. — С. 193—
235.
49. Фугаззотто П.А. Использование де-
минерализованной ламинированной
кости для направленной тканевой ре-
генерации: сообщение о 3 случаях //
Пробл. стоматол. и нсйростоматол. —
1999. - № 2. - С. 45.
50. Хлесткий Ю.Л., Пряхин А. Г., Коз-
лов О.А. Опыт практического приме-
нения препаратов на основе гидро-
ксиапатита в амбулаторной практике
и имплантологии // Тез. докл. 1-й
Всероссийской научной конферен-
ции. — М., 1997. — С. 46.
51. Adell R., Lekholm U, Rockier В. et al.
Marginal tissue reactions at osseointc-
grated titanium fixtures. I. A 3-year lon-
gitudinal prospective study // J. Oral
Maxillofac. Surg. - 1986. - Vol. 15. -
P. 39.
52. Adell R.r Lekholm U., Grondahl K. et al.
Reconstruction of severely resorbed
edentulous maxillae using osseointegrat-
cd fixtures in immediate autogenous
bone grafts // Int. J. Oral Maxillofac.
Impl. - 1990. - Vol. 5.-P. 233-299.
53. Adell R., Eriksson B., Lekholm U. et al. A
longterm follow-up study of osseointe-
grated implants in the treatment of total-
ly edentulous jaw // Int. J. Oral Maxillo-
fac. Impl. - 1990. - Vol. 5. - P. 347-
359.
54. Anderson K., Dingwall J., Schmidt J. et al.
The effect of particle size of the heterog-
enous bone transplantation on the host
tissue. II. Histological study // J. Bone J.
Surg. - 1961. - Vol. 43A. - P. 996.
55. Anderson K., Le Cocq J., Adeson IK et al.
Endpoint results of processed heteroge-
nous and homogenous bone transplants
in human: a histologic study // Clin.
Orthop. — 1964. — Vol. 33. — P. 320.
чпд
56. Anderson M., Kosinski T., Mentag P. A
rewiew of the intraosseous coure of the
nerkes of the manilblc // J. Oral Impl. —
1991. - Vol. 17. - P. 394.
57. Artzi Z, Tai H., Moses O., Kozlovsky A.
Mucosal considerations for osscointe-
grated implants // J. Prothet. Dent. —
1993. - Vol. 70. - P. 427-432.
58. Arzouman M., Otis L., Kipnis C., Levine
D. Observations of the anterior loop in
the inferior alveolar canal // Int. J. Oral
Maxillofac. Impl. - 1993. - Vol. 8, N
3. - P. 295-300.
59. Ashman A. An immediate tooth root re-
placement: an implant cylinder and syn-
thetic hone combination // J. Oral Impl.
- 1997. - Vol. 16. - P. 28-38.
60. Atwood D. Reduction of residual ridges.
A major oral disease entily // J. Prosth.
Dent. - 1971. - Vol. 25. - P. 266.
61. Atwood D. Bone loss of edentulous alveo-
lar ridges // J. Periodontol. — 1979. —
Vol. 50. - P. 10.
62. Augthun M., Vildirim M., Dent M. et al.
Healing of bone defects in combination
with immediate implants using the mem-
brane technique // Int. J. Oral Maxillo-
fac. Impl. - 1995. — Vol. 10. - P.
421-428.
63. Aukhil I., Simpson D.. Schaberg T. An
experimental study of new attachment
procedure in beagle dogs // J. Periodont.
Res. - 1983. - Vol. 18. - P. 643-654.
64. Axhausen G. Die histologischen gesetze
der wiedereinheilung replantierier zahne //
Dtsch. Zahn-, Mund- u. Kieferheilk. —
1937. - № 4. - S. 137.
65. Babbush Ch. Dental Implants: principles
and practice. — Philadelphia: W.B. Saun-
ders. 1991.
66. Babbush Ch. The use of platelet richt
plasma with implant reconstructive pro-
cedures. — Buenos Aires, Argentina,
1999. — International College oral im-
plants. World Congress.
67. Bahat O., Handelsman M. Controlcd tis-
sue expansion in reconstructive periodon-
tal surgery // Int. J. Periodont. Rcstor.
Dent. - 1991. - Vol. 11. - P. 33-47.
68. Balshi T, Hernandez R., Cutler R., Hert-
zog C. Treament of osseous defects using
Vicril mesh (polyglastin 910) and the
Branemark implant: a case report // Int. J.
Oral Maxillofac. Impl. — 1991. — Vol. 5,
N 1. - P. 87-91.
69. Battilo D., Misch C., Arena S. Interface
analysis of hydroxyapatite-coated im-
plants in a human vascularized iliac bone
graft // Int. J. Oral Maxillofac. Impl. —
1995. — Vol. 10. — P. 405-409.
70. Baumann G., Rapley J., Hallmon IK,
Mills M. The peri-implant sulcus // Int. J.
Oral Maxillofac. Impl. — 1993. — Vol. 8,
N 3. - P. 264—272.
71. Bavitz J., Ham S., Hansen C., Lang M.
An anatomical study of mental neurovas-
cular bundle-implant relationships //
Int. J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 580-582.
72. Bays R. The pathophysiology and anato-
my of edentulous bone loss // Recon-
structive preprosthetic oral and maxillo-
facial surgery I Eds. R. Fonseca, W.
Davis. — Philadelphia: W.B. Saunders,
1986. - P. 1-17.
73. Becker W., Becker B., Handlesman M. et
al. Bone formation at dehisced dental
implant sites treated with implant aug-
mentation materials: a pilot study in dogs
// Int. J. Periodont. Restor. Dent. —
1990. - Vol. 10. - P. 92-101.
74. Becker B., Lynch S., Lekholm U. et al. A
comparison of three methods for pro-
moting bone formation around implants
placed into immediate extraction sockets:
e-PTFE membrane alone, or with either
PDGF and IGF-1. DFDB // J. Period-
ontol. - 1992. - Vol. 63. - P. 929.
75. Becker IF., Dahlin C., Becker B. et al.
The use of e-PTFE barrier membranes
for bone promotion around titanium im-
plants placed into extraction sockets: a
prospective multicenter study // Int. J.
Oral Maxillofac. Impl. — 1994. — Vol. 9,
N 1. - P. 31-40.
76. Becker W., Schenk R., Higuchi K. et al.
Variations in bone regeneration adjacent
to implants augmented with barrier
membranes alone or with demineralized
freeze-dried bone or autologous grafts: a
study in dogs // Int. J. Oral Maxillofac.
Impl. - 1995. - Vol. 10, N 2. -
P. 143-154.
77. Becker IF., Lekholm U., Dahlin C. The
effect of clinical loading on bone regen-
erated by GTAM-barriers, a study in
dogs // Int. J. Oral Maxillofac. Impl. —
1994. - Vol. 9. - P. 305-313.
78. Becker IF, Becker B., Israelson H. One-
step surgical placement of Branemark
implants: A prospective multicenter study
// Int. J. Oral Maxillofac. Impl. —
1997. - Vol. 12. - P. 452-462.
79. Bell IF. Use of heterogenous bone in oral
surgery // J. Oral Surg. — 1961. —
Vol. 19. - P. 459.
80. Bell IF. Processed heterogenous bone
grafts // J. Oral Surg. — 1968. —
Vol. 26. - P. 342.
81. Bengazi F, Wennstrom J., lekholm U.
Recession of the soft tissue margin at
oral implants. A 2-year longitudinal study
// Clin. Oral Impl. Res. - 1996. -
Vol. 7. - P. 301-310.
82. Berglundh R., Lindhe J., Ericsson I. et al.
The soft tissue barrier at implants and
teeth // Clin. Oral Impl. Res. — 1991. —
Vol. 2. - P. 81-90.
83. Berglundh T., Lindhe J., Marine Ho C. et
al. Soft tissue reaction to the new plaque
formation on implants and teeth // Clin.
Oral Impl. Res. — 1992. — Vol. 3. — p. i.
84. Blomqvist J., Alberins P., Isaksson S. Ret-
rospective analysis of one stage maxillary
sinus augmentation with endosseius im-
plants // Int. J. Oral Maxillofac. Impl —
1996. - Vol. 11. - P. 512-521.
85. Block M., Kent J. Healing of mandibular
ridge augmentation using hydroxyapatite
with and without autogenous bone in dogs
// J. Oral Maxillofac. Surg. — 1985. —
Vol. 43. - P. 3-7.
86. Block M., Kent J., Kay J. Evaluation of
hydroxyapatite-coated titanium dental
implants in dogs // J. Oral Maxillofac.
Surg. - 1987. - Vol. 45. - P. 601-
607.
87. Block M., Delgado A., Fontenot M. The
effect of diameter and length of hy-
droxyapatite coated dental implants on
ultimate pullout force in dog alveolar
bone // J. Oral Maxillofac. Surg. —
1989. - Vol. 48. - P. 174-178.
88. Block M.S., Goles T.S. Hydroxylapatite
and hydroxylapatite coated dental im-
plants for the treatment of the partially
and totally edentulous patient // Modem
Practice in Orthognathic and Reconstruc-
tive Surgery / Ed. W.H. Bell. — Philadel-
phia: W.B. Saunders, 1992. — P. 1264—
1331.
89. Block M., Kent J. Factors associated with
soft- and hard tissue compromise of en-
dosseous implants // J. Oral Maxillofac.
Surg. - 1993. - Vol. 48. - P. 1153—
1160.
90. Block M.S., Kent J.N. Sinus augmenta-
tion for dental implants, the use of au-
togenous bone // J. Oral Maxillofac.
Surg. - 1997. - Vol. 55. - P 1281-
1286.
91. Blumenthal N., Steinberg J. The use of
collagen membrane barriers in conjunc-
tion with combined demineralized bone-
collagen gel implants in human infrabony
defects // J. Pcriodontol. — 1990. —
Vol. 61. - P. 319 - 327.
92. Blumenthal N., Alves M., Cadavid G. Con-
trolled tissue expantion with guided tissue
regeneration // Pract. Periodont. Aesthet.
Dent. - 1991. - Vol. 3. - P. 43-48.
93. Boyne P. Animal studies of application of
rh BMP-2 in maxillofacial recomstruction
// Bone. - 1996. — Vol. 19, Suppl. 1. —
P. 83,
94. Bothe К., Neukam F., Reilmann L. Kno-
chcnszintigraphie bci auflagerungsosteo-
plastiken in kombination mil Brancmark-
implantation // Z. Zahnarztl. Impl. —
1992. - Vol. 8. - P. 30.
95. Borgner R. Clinical experience and Sta-
tistical Analysis of Endoosseous Implants
in the Atrophic Maxilla Meeting of
American Academy of Implant Dentist-
ry. — Atlanta, 1995.
96. Boyne P. Treatment of extravasation cysts
with freeze-dried homogenous bone
grafts // J. Oral Surg. — 1956. —
Vol. 14. - P. 206.
97. Boyne P. Use of freeze-dried homoge-
nous bone grafts in the surgical position-
ing of teeth // J. Oral Surg. — 1957. —
Vol. 15. - P. 231.
98. Boyne P., James R. Grafting of the max-
illary sinus floor with autogenous marrow
and bone // J. Oral Surg. — 1980. —
Vol. 38. - P. 613-616.
99. Boyne P., Cole M., Stringer D., Shafquat J.
A technique for osseous regeneration of
dificient edentulous maxillary ridges // J.
Oral Maxillofac. Surg. — 1985. —
Vol. 43. - P. 87-91.
100. Bruggenkare C., Kraa'ijenhagen H., van
der Kwast Ж et al. Autogenous maxillary
bone grafts in conjunction with place-
ment of ITI endosseous implants. A pre-
liminary report // J. Oral Maxillofac.
Surg. - 1992. - Vol. 21. - P. 81 — 84.
101. Breine U., Branemark P. Reconstruction
of alveolar jaw bone. An experimental
and clinical study of immediate and per-
formed autlogous bone grafts in combina-
tion with osseointegrated implants //
Scand. J. plast. reconstr. Surg. — 1980. —
Vol. 14. - P. 23-48.
102. Boyan B. Scientific Evaluation of Bone
Grafting and Bone Graft Substitutes for
Use Around Implants // 16th Annual
Meeting. — Canada, 2001. — P. 44.
103. Brygider R., Bain C. Custom stent fabrica-
tion for free gingival grafts around os-
seointegrated abutment fixtures I I J. Pros-
thet. Dent. - 1989. - Vol. 62. - P. 320-
322.
104. Burwell R., (Jawland L., Dexter F. Studies
in the transplantation of bone // J. Bone
Jt Surg. - 1963. - Vol. 45. - P. 595.
105. Burwell R. Studies in the transplantation
of bone. VII. The fresh composite hom-
ograft-autograft of cancellous bone //
J. Bone Jt Surg. — 1964. — Vol. 46B. —
P. 110-154.
106. Burwell R. The fate of freeze-dried bone
allograft // Transplant. Proc. — 1976. —
Vol. 8 (suppl. 1). - P. 95.
107. Buser D., Belser U. et al. Localized ridge
augmentation using guided bone regene-
ration. I. Sugical procedure in the maxil-
la // Int. J. Periodont. Rest. Dent. —
1993. - Vol. 13. - P. 29.
108. Buser D., Dula K., Belser U. et al. Loca-
lized ridge augmentation using guided
bone regeneration. II. Surgical procedure
in the mandible // Int. J. Periodont. Rest.
Dent. - 1995. - Vol. 15. - P. 11-29.
109. Buser D. Surgical Handing of Combined
Hard and Soft Tissue Defects in the An-
terior Maxilla // 16th Annual Meeting. —
Canada, 2001. - P. 29.
110. Campbell Z, Simons A., Giordano J. Soft
tissue grafting and vestibuloplasty tech-
nique in association with endosseous im-
plants // J. MI. Dent. Assoc. — 1993. —
Vol. 75. - P. 26-29.
111. Carmichael R., Apse P., Zarb G., McCul-
lock C. Biological, microbiological and
clinical aspects of the peri-implant mu-
cosa // The Branemark osseointegrated
implant / Eds. T. Albrektsson, G.A.
Zarb. — Chicago (IL): Quintessence,
1989. - P. 39-78.
112. Caudill R, Meffert R Histologic analysis of
the osscointegration of endosseous im-
plants in simulated extraction sockets with
or without e-PTFE barriers. Part 1. Pre-
liminary findings // Int. J. Periodont. Rest.
Dent. - 1991. - Vol. 11. - P. 207-215.
113. Chang C., Matukas V., Lemons J. Histo-
logic study of hydroxyapatite as an im-
plant material for mandibular augmenta-
tion U J. Oral Maxillofac. Surg. —
1983. - Vol. 41. - P. 729-737.
114. Chanavaz M. Maxillary Sinus anathomy,
physiology, surgery and bone grafting re-
lated to implantology. Eleven years Surgi-
cal experience //J. Oral Impl. — 1990. —
Vol. 16. - P. 199-209.
115. Chanavaz M. Sinus grafting related to
implantolgy statistical analysis of 15 years
of surgical experience, 1979—1994 // Oral
Impl. - 1996. - Vol. 22. - P. 119-130.
115a.C7irt M. Distraction Osteogenesis and
osscointegration. 16th Annual Meeting. —
Toronto, Canada, 2001. — P. 16.
116. Chung K., Salkin L., Stein M., Freed-
man A. Clinical evaluation of a biode-
gradable collagen membrane in guided
tissue regeneration // J. Periodontol. —
1990. - Vol. 61. - P. 732-736.
117. Cobb C., Eick J., Barker B. et al. Resto-
ration of mandibular continuity defects
using combinations of hydroxyapatite
and autogenous bone: microscopic obser-
vations // J. Oral Maxillofac. Surg. —
1990. - Vol. 48. - P. 268-275.
118. Cochran D., Nummikaski P., Higginbot-
tom F. et al. Evaluation of an endosseous
titanium implant with a sandblasted and
acid-etched surface in the canine mandi-
bit: radiographic results // Clin. Oral
Impl. Res. — 1996. — Vol. 7. — P. 240—
252.
119. Collins T., Brown G., Johnson N. et al.
Team management of atrophic eden-
fulism with autogenous oheag, veheer and
split grafts with endosseous implant. In
Blok M., Kent J. Endoosseous implants
for Maxillofacial reconstruction. — Phi-
ladelphia, 1995.
120. Cook S., Kay J., Thomas K. et al. Varia-
bles affecting the interface strength and
histology of hydroxyapatite coated im-
plant surfaces // Transactions Twelfth
Annual Meeting of the Society of Bio-
materials. — 1986. — P. 14.
121. Cook S., Kay J., Thomas K., J arc ho M.
Hydroxyapatite coated porous titanium
for use as an prthopedic histologic at-
tachment system // Clin. Orthop. Rel.
Res. - 1988. - P. 225-230.
122. Cook S. Evaluation of a hydroxyapatite
(НЛ) resorbable suture implant for alveo-
lar ridge augmentation // J. Oral Impl. —
1994. - Vol. 20, N 4. - P. 292 -298.
123. Cranin A., Klein M., Simons A. Color at-
las of Oral Implantology. — New York:
Thieme Medical Publischers, Inc., 1993.
124. Dahlin C, Sennerby L., Lekholm U. et al.
Generation of new bone around titanium
implants using a membrane technique:
an experimental study in rabbits // Int. J.
Oral Maxillofac. Impl. — 1989. —
Vol. 4. - P. 19-25.
125. Dahlin C., GottlowJ., Linde A., Nyman S.
Healing of maxillary and mandibular de-
fects using a membrane technique. An
experimental study in monkeys // Scand.
J. Plast. Reconstr. Surg. — 1990. — Vol.
24. - P. 13-19.
126. Dahlin C., Linde A., Gott tow J., Nyman S.
Healing of bone defects by guided tissue
regeneration // Plast Rcconstr. Surg. —
1990. - Vol. 24. - P.13.
127. Dahlin C., Lekholm U., Becker IK et al.
Treatment of fenestration and dehiscence
bone defects around oral implants using
the guided tissue regeneration technique:
a prospective multicenter study // Int. J.
Oral Maxillofac. Impl. — 1995. —
Vol. 10, N 3. - P. 312-318.
128. Daniel R. Mandibular reconstruction
with free tissue transfers // Ann. Plast.
Surg. - 1978. —Vol. 1. --P. 346.
129. Datilo D., Misch C, Arena S. Interface
analysis of hydroxyapatite-coated im-
plants in a human vascularized illiac bone
graft // Int. J. Oral Maxillofac. Impl. —
1995. - Vol. 10, N 3. - P. 405-409.
130. de Lange G., de Putter C., de Frost K.
Pcrmucosal dental implant: the relation-
ship between sealing and fixation. Pro-
ceedings of International Congress on
tissue Integration in Oral and Maxillofa-
cial Reconstruction // Exerpta Medica
Curr. / (Clin. Pract. Series). — 1985 —
Vol. 29. - P. 278-287.
131. Donley T., Gillette W. Titanium endos-
seous implant-soft tissue interface: A lit-
erature review. 1991 // J. Periodont —
1991. - Vol. 62. - P. 153-160.
132. Duncar R., Turner C. Mcchanotrasduc-
tion and functional response of bone to
mechanical strain // Calc. Tiss. Int —
1995. - Vol. 57. - P. 344-358.
133. Ellis E. Biology of bone grafting // Se-
lected readings in oral and maxillofacial
surgery. Vol. 2. The Guild for advance-
ment in oral and maxillofacial surgery /
Ed. O'Ryan. — San Francisco, 1991. —
N 1, 2. - P. 1-18, 19-28.
134. Farso-Nielsen F, Karting T, Gogolewski
S. Biodegradable guide for bone regener-
ation I/ Acta Orthop. Scand. — 1992. —
Vol. 63. - P. 66.
135. Fazlli M., van Overvest-Eardmans G.,
Vemooy A. et al. Follow-up investigation
of reconstaction of the alveolar process in
the atrophic mandible // J. Oral Maxillo-
fac. Surg. - 1978. - Vol. 4. - P. 400—
404.
136. Fleisher N., de Wall H.. Bloom A. Regen-
eration of lost attachment apparatus in
the dog using vicryl mesh (polyglactin
910) // Int. J. Periodont. - 1988. -
Vol. 2. - P. 45.
137. Fonseca R., Frost D., Zeitler D., Stoelinga
P. Osseous reconstruction of edentulous
bone loss // Reconstructive preprosthetic
oral and maxillofacial surgery / Eds. R.
Fonseca, W. Davis. — St. louis (MO):
Mosby, 1995. - P. 117-165.
138. Fonseca R.. Davis H., Reitzik M. et al. Os-
scus Reconstruction for Impl. — New
York: Moshy, 1995. - Ch. 15. - P. 383-
479.
139. Fonseca R., Davis H., Traplett G., Bolding
S. Cuided Tissue Regeneration in Associ-
ation with Dental Impl. — New York,
1995. - P. 391-416.
140. Friberg B.. Ivanoff C., Lekholm U. Inferi-
or alveolar nerve transposition in combi-
nation with Branemark implant treat-
ment // Int. J. Periodont. — 1992. —
Vol. 12. — P. 441.
141. Frodel J., Funk G., Capper D. et al. Os-
seointegrated implants: A comparative
study of bone thickness in four vascularized
bone flaps // Plast. Reconstr. Surg. —
1993. - Vol. 92. P. 449.
142. Gooris P., Blijdorp P. Composite grafting
of the maxillary sinus with bone and hy-
droxyapatite // Third International Con-
ference on Preprosthetic Surgery: Ab-
streets (Poster section). — Anthem: The
Netherlands, 1989.
143. Gotfredsen K., Warner K., Hjoreting-
Hansen T. el al. Effect of membranes and
hydroxyapatite on healing in bone de-
fects around titanium implants. An ex-
perimental study in the monkey // Clin.
Oral Implant. Res. — 1991. — Vol. 2. —
P. 172-178.
144. Gottlow J., Nyman S., Karring T, Lindhe J.
New attachment formation as the result
of controlled tissue regeneration // J.
Clin. Periodont. — 1984. — Vol. 11. —
P. 494-503.
145. Gottlow J., Nyman S., Karring T,
Wennstrom J. New attachment formation
in the human periodontium by guided
tissue regeneration. Case reports // J.
Clin. Periodont. — 1986. — Vol. 13. —
P. 604-616.
146. Gowgiel J. The position and course of the
mandibular canal // J. Oral Impl. —
1992. - Vol. 18. - P. 383-385.
147. Gowood J., Howell R. A classification of
theadentulous jaws // J. Oral Maxillofac.
Surg. - 1988. - Vol. 17. - P. 232-236.
148. Harte F. Atlas der praproshtetischen Ope-
rationen. — Miinchen: Hanser, 1989.
149. Hall D., McKenna E. Bone graft of the
maxillary sinus floor for Branemark im-
plants. A preliminary report // Oral and
maxillofacial surgery clinics of North
America. Vol. 3 / Eds. P. Worthington,
O. Beirne. — Philadelphia: W.B. Saun-
ders, 1991.
150. Hammack B., Enneking Ж. Comporative
vascularization of autogenous and ho-
mogenous bone transplants // J. Bone Jt
Surg. - 1960. - Vol. 42A. - P. 811.
151. Hibino V., Watanabe K., Okazaki V. et
al. Alveolar Distraction for Occlusal Re-
construction after Resection of Mandi-
bular Disease // 16th Annual Mining. —
Toronto, Canada, 2001. — P. 19.
152. Heggie A. The use of mandibular bucal
cortical graft in bimaxillary surgery // J.
Oral Maxillofac. Surg. — 1993. —
Vol. 51. - P. 1282-1283.
153. Hahn J. Aesthetic Enhancement of Ante-
rior Dental Implants With The use of
Tapered Osteotomes and Soft-Tissue
Manipulation // dental Surgery prod-
ucts. — 1998. june/july. — P. 4—9.
154. Hahn J. Лекции no оральной имплан-
тологии. — M.: Инфодент, 1999. —
№ 1. - С. 7-9.
155. Hirsch J., Ericsson I. Maxillary sinus aug-
mentation using mandibular bone grafts
and simultaneous installation of implants
// Clin. Oral Impl. — 1991. — Res. 2. —
P. 91-96.
156. Hoelscher D., Simons A. The rationale for
soft-tissue grafting and vestibuloplasty in
association with endosseous implants: a lit-
erature review // J. Oral Impl. — 1994. —
Vol. 20. - P. 282-291.
157. Homing G., Mullen M. Peri-implant free
gingival grafts: rationale and technique /
/ Compend. Contin. Educ. Dent. —
1990. - Vol. 11. - P. 604-609.
158. Hoffman H., Harrison N., Sullivan M. et
al. Mandible reconstruction with vascu-
larized bone grafts // Arch. Otolaryngol.
Hed. Neck Surg. - 1991. - Vol. 117. -
P. 917-925.
159. Howell TH. A. Phase I/II Clinical Trial
to Evaluate a Combination of Recom-
binant Human Platelet-Derired Growth
Factor BB and Recombinant Human In-
sulin-like Growth — I in Plalients with
Periodontal Disease // J. Periodont. —
1994. - Vol. 68. - P. 1186-1193.
160. Hunt D., Joranovic S., Wikesjo U. et al.
Hyalaronax supports rh BMP-2 Induced
Bone Reconstruction of Alveolar Ringe
Defects in Dogs // 16th Annual Mil-
ting. — Toronto, Canada, 2001. — P. 21.
161. Hurzler M., HurzJer M., Kirsch A., Asker-
mann K. et al. Reconstruction of the se-
verely resorbed maxilla with dental im-
plants in the augentated maxi Hare sinus.
A 5-year clinical investigation // Int. J.
Oral Maxillafac. Impl. — 1996. —
Vol. 11. - P. 466-475.
162. Hystrom E., Ahlqqvist J., Kahnberg K.,
Rosenquist J. Autogenous onlay grafts
fixed with screw implants for the treat-
ment of severely resorbed maxillae // J.
Oral Maxillofac. Suig. — 1996. — Vol.
25. - P. 351-359.
163. Jareho M., Bolen C., Thomas M. et al.
Hydroxyapatite synthesis and characteri-
zation in dense polycrystalline form //
J. Mater. Sci. - 1976. - Vol. 11. -
P. 2027.
164. Jareho M., Jasty V., Gumaer K. et al.
Electron microscopic study of a bone-
hydroxyapatite implant interface / Trans-
actions of the 4'" Annual Meeting of the
Society of Biomateriais, 10th Interna-
tional Biomaterials Symposium. — San
Antonio, 1978. — P. 112.
165. Jareho M, Kay J, Drobeck H, Dore-
mus R.H. Hydroxvapatite interface // J-
Bioeng. - 1981. - Vol. 1. - P. 79-92.
166. Jareho M. Calcium phosphate ceramics
as hard tissue prosthetics // Clin. Or-
thop. Rcl. Res. - 1981. - Vol. 57. -
P. 259.
167. Jareho M. Retrospective analysis of hy-
droxyapatite development for oral im-
plant application // Dent. Clin. Amer. —
1992. - Vol. 36. - P. 19-26.
168. Jemt T, Lekholm U. Implant treatment
in edentulous maxillae: a 5-ycar follow-
up report on patients with different de-
grees of jaw resorption // J. Oral Maxil-
lofac. Impl. - 1995. — Vol. 10, N 3. -
P. 303-311.
169. Jemt T, Book K. Prosthesis misfit and
margonal bone loss in edentulous implant
patients // J. Oral Maxillofac. Impl. —
1996. - Vol. 11. - P. 620-625.
170. Jensen J., Krantz Simonsen E., Sindet -
Pedersen S. Reconstruction of the severely
resorbed maxilla with bone grafting and
osseointegrated implants: a preliminary
report // J. Oral Maxillofac. Surg. —
1990. - Vol. 48. - P. 27-32.
171. Jensen J., Sindet-Pedersen S. Autogenous
mandibular bone grafts and osseointe-
grate implants for reconstruction of the
severely atrophied maxilla: A preliminary
report // J. Oral Maxillofac. Surg. —
1991. - Vol. 49. - P. 1277-1287.
172. Jensen J., Sindet-Pedersen S., Oliver A.
Varying treatment strategics for recon-
struction of maxilallary atrophy with im-
plants: results in 98 patients // J. Oral
Maxillofac. Surg. — 1994. — Vol. 52. —
P. 210-216.
173. Jensen O, Perkins S, Van De Water F.
Nasal fossa and maxillary sinus grafting
of implants from a palatal approach // J.
Oral Maxillofac. Surg. — 1992. —
Vol. 50. - P 415-418.
174. Jensen O. Guided bone graft augmenta-
tion. In Buser Dental Guided bone re-
generation in implant dentisstry. — 1994,
quintessence, Chicago. — P. 235—264.
175. Jensen O., Greer R., Johnson L. et at.
Vertical guided bone-graft augmentation
in a new canine mandibular model //
Int. J. Oral Maxillofac. Impl. — 1995. —
Vol. 10. - P. 335-344.
176. Israelson H., Plemons J. Dental implants
regcncratire techniques and periodontal
surgery to restore maxillary anterior es-
thetics // Int. J. Oral Maxillofac. Impl. —
1993. - Vol. 8. - P. 555-561.
177. Isaakson S., Alberins P. Maxillare alveo-
lar ridge augmentation with onlay bone
graft and immediate edcssens implants //
J. Craniomaxillofac. Surg. — 1992. —
Vol. 20. - P. 2-7.
178. Jovanovic S. Presentation at the Acade-
my of osseointegration. — Dallas, 1989.
179. Jovanovic S., Spiekermann IL, Richter E.
Bone regeration around titanium dental
implants in dehisced defect sites: a clinical
study // Int. J. Oral Maxillofac. Impl. —
1992. - Vol. 7, N 2. - P. 228-232.
180. Jovanovic S., Spiekermann H., Richter E.,
Koseoglu M. Guided tissue regeneration
around titanium dental implants // Tis-
sue integration in oral, orthopedic and
maxillofacial reconstraction / Eds. W
Laney, D. Tolman. — Berlin: Quintes-
senz. 1992. — P. 208.
181. Jovanovic S., Kenney E., Carranza F.,
Donath K. The regenerative potential of
plaque-induced peri-implant bone de-
fects treated by a submerged membrane
technique: An experimental study // Int.
J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 13-18.
182. Jovanovic S., Schenk R., Orsini M., Ken-
ney E. Supracrestal bone formation
around dental implants: an experimental
dog study // Int. J. Oral Maxillofac.
Impl. - 1995. - Vol. 10, N 1. -
P. 23-31.
183. Jovanovic S., Nevins M. Bone formation
utilizing titanium-reinforced barrier
membranes // Int. J. Pcriodont. Rest.
Dent. - 1995. - Vol. 15. - P. 57-69.
184. Kahnberg K, Nystrom L, Bartholdsson L.
Combined use of bone graft and Brane-
mark fixtures in treatment of severely re-
sorbed maxillae // Int. J. Oral Maxillo-
fac. Impl. - 1989. - Vol. 4. - P. 247-
304.
185. Kay J., Jareho M., Logan G. et al. Phisi-
cal and chemical characteristics of hy-
droxyapatite coating on metal (AADR
abstract No 472) // J. Dent. Res. —
1986. — Vol. 65 (spec. iss.).
186. Kay J., Jareho M., Logan G. et al. The
structure and properties of HA-coatings
on metal // Biomaterials. — 1986. —
Vol. 13. - P. 9.
187. Kay J., Golec T., Riley R. HA coated
subpcriostil dental implants: Design ra-
tionale and clinical experience // J.
Prosthet. Dent. - 1987. - Vol. 58. - P.
339-343.
188. Kay J. Bioactive surface coatings: cause
for encouragement and caution // J. Oral
Impl. - 1988. - Vol. 14. - P. 43-54.
189. Kay J. Calcium phosphate coatings for
dental implants: current status and future
potential // Dent. Clin. North. Amer. —
1992. - Vol. 36. - P. 1-18.
190. Keller E., van Roekel N., Deyardins R.,
Tolman D. Prosthetic-surgical recon-
struction of the severely resorbed maxilla
with iliac bone grafting and tissue-inte-
grated prostheses // Int. J. Oral Maxillo-
fac. Impl. - 1987. - Vol. 2. - P. 155—
165.
191. Kent J., Block M. Simultaneous maxillary
sinus floor bone grafting and placement
of hydroxyapatite-coated implants // J.
Oral Maxillofac. Surg. — 1989. —
Vol. 47. - P. 238-242.
192. Kent J., Misiek D. Biomaterials for cranial,
facial, mandibular and TMJ reconstruc-
lion Ц Oral and maxillofacial trauma /
Eds. R. Fonseca, R. Walker. — Philadel-
phia: W.B. Saunders, 1991. — P. 781 —
1026.
193. Kessler S. et al. Stimulation of osteoblast-
like cells with rh-TGF-B. rh-FGF. rh-
BMP2 and re BMP4 in an vitro Cells
model Onhopadie. — 2000. — Vol.29. —
P. 107-111.
194. Kipp D., Goldstein B., Weiss C. Dysesthe-
sia after mandibular third molar surgery:
A retrospective study and analis of 1.377
surgical procedures // J. Amer. Dent. As-
soc. - 1980. - Vol. 100. - P. 185-192.
195. Kirsch A., Ackerman K., Hurzler M., Hut-
macher D. Sinus grafting, using porus
nidrox geapatite/ In: Jensen D. The sinus
bone graft. — Chicago, 1998. — Quintes-
sense. — 405 p.
196. Kon S., Ruhen M., Bloom A. et al. Regen-
eration of periodontal ligament using re-
sorbable and non-resorbable membranes.
Clinical, histological and histometric
study in dogs // Int. J. Periodont. Rest.
Dent. - 1991. - Vol. 11. - P. 58-41.
197. Kruger E. Operationslchrc fur zahnarzte. —
Berlin: Quintessenz, 1982.
198. Kondell P., Nordenram A., Moberg S.,
Nyberg B. Reconstruction of the resobed
edentulous maxilla using aytogenous rib
graft and osseointegrated implants // Clin.
Oral Impl. Res. - 1996. - Vol. 7. -
P. 286-290.
199. Krauser J., Gard A. Membrane barriers
for guided tissue regeneration. In Ch.
Babush: Dental implants. The Art and
Science. — Philadelphia, W.B. Saunders
Company. — P. 133—150.
200. Lazzara R. Immediate implant placement
into extraction sites: surgical and restora-
tive advantages // J. Periodont. Rest.
Dent. - 1989. - Vol. 9. - P. 333-343.
201. lekholm U., Ericsson I., Adell S., Slots J.
The condition of the soft tissues at tooth
and fixture abutments supporting fixed
bridges. A microbiological and histological
study I/ J. Clin. Periodont. — 1986. —
Vol. 13. - P. 558-562.
202. Lekovic V., Kenney E., Garranza F.,
Martignoni M The use of autogenous pe-
riosteal grafts as barriers for the treatment
of class II furcation involvements in low-
er molars // J. Periodont. — 1991. —
Vol. 62. - P. 775-780.
203. Lemons J., Ballard J., Culpepper M., Nie-
mann K. Porous tricalcium phosphate ce-
ramic for segmental lessions (abstract) //
First World Biomaterials Congress. —
Baden, 1980.
204. Levin S., Pcewett A., Cook S. The use of a
new form of allograft bone in implanta-
tion or osseointegrated dental implants —
a preliminary report // J. Oral Impl. —
1992. - Vol. 18. - P. 366-371.
205. Z.ew D., Marino A., Startzell J. et al. A
comperativc study of osseintegration of
titanium implants in corticocancellous
block and corticocacellous chip grafts in
canine ilium // J. Oral Maxillofac.
Suig. - 1994. - Vol. 52. - P. 952—
958.
206. Listom R., Symington J. Osseointegrated
dental implants in conjunction with bone
grafts // J. Oral Maxillofac. Sutg. —
1988. - Vol. 17. - P. 116-118.
207. Livesey S. et al. An acellular dermal
transplant processed from human cadav-
er skin retains normal extracellular com-
ponents and ultrastructural characteris-
tics. — New Orlean, USA. — 1994, pre-
sented at the American Association of
Tissue Bank Conference.
208. Loukota R.A., Isaksson S.G., Linner E.L.
et al. A technique for inserting endos-
seous implants in the atrophic maxilla in
a single stage procedure // Brit. J. Oral
Maxillofac. Surg. — 1992. — Vol. 30. —
P. 46-49.
209. Majer R. Applications of microsurgery to
the repair of trigeminal nerve injuries //
J. Oral Maxillofac. Surg. Clin. Amer. —
1992. - Vol. 4. - P. 405-416.
210. Marx R., Kline S. Principles and meth-
ods of osseous reconstruction // Int.
Adv. Suig. Oncol. — 1983. — Vol. 6. —
P. 167-228.
211. Marx R., Wong M. A technique for the
compression and carriage of autogenous
bone during bone grafting procedures //
J. Oral Maxillofac. Surg. — 1987. —
Vol. 45. - P. 988-989.
212. Marx R. Philosophy and particulars of
autogenous bone grafting // J. Oral Max-
illofac. Surg. Clin. Amer. — 1993. —
Vol. 5. - P. 599.
213. Marx R., Carlson E., Eichstaedt R. et al.
Plateletrich plasma // J. Oral Maxillofac.
Surg. - 1998. - Vol. 85. - P. 638-646.
214. McKinnon S. Surgical management of the
peripheral nerve gac // Clin. Plast.
Surg. - 1989. - Vol. 16. - P. 587.
215. Meffert R. How to treat ailing and failing
implants // Implant. Dent. — 1992. —
Vol. 1. - P. 23.
216. Melcher A., Dreyer C. Protection of the
blood clot in healing circumscribed bone
defects // J. Bone Jt Surg. — 1962. —
Vol. 44B. - P. 424.
217. Mellonig J., Prewett A., Moyer M. HIV
inactivation in a bone allograft // J. Per-
iodont. - 1992. - Vol. 63. - P. 979—
983.
218. Misch C., Judy K. Patient dental-medical
implant evaluation form // J. Oral
510
Maxillofac. Surg. — 1987. — Vol. 50
(suppl. 2). — P. 7—11.
219. Misch C. Maxillary sinus augmetation for
endosteal implants: organized alternative
treatment plans // Int. J. Oral Maxillo-
fac. Impl. — 1987. — Vol. 4. — P. 49—
58.
220. Misch C.E., Crawford E. Predictable
mandibular nerve location: a clinical
zone of safety // Int. J. Oral Maxillofac.
Impl. - 1990. - Vol. 7(1). - P. 37-40.
221. Misch C. Divisions of available bone in
implant dentistry // Int. J. Oral Maxillo-
fac. Impl. — 1990. — Vol. 7. — P. 9.
222. Misch C.M., Misch C.E., Resnik R., Is-
mail Y.H. Reconstruction of maxillary al-
veolar defects with mandibular symphysis
grafts for dental implants: a prelimenary
procedural report // Int. J. Oral Maxillo-
fac. Impl. - 1992. - Vol 7, N 3. -
P. 360-366.
223. Misch C.E., Dietsch F. Bone grafting mate-
rials in implant dentistry Ц Impl. Dent. —
1993. - N 2. - P. 158-167.
224. Misch C. Contemporary implant dentist-
ry. — St. Luis: Mosby — Year Book,
1993.
225. Misch C.M. Ridge augmentation using
mandibular ramus bone grafts for place-
ment of dental implants: prevention of a
technique // Pract. Periodont. Acsth.
Dent. - 1996. - Vol. 8, N 2. - P. 127—
135.
226. Misch C., Hoar G., Reck G. et al. A bone
quality-based implant system: A prelimi-
nary report of stage I & stage II // Impl.
Dent. - 1998. - Vol. 7. - P. 35-42.
227. Moy P.K., Lundgren S., Holmes R.E.
Maxillary sinus augmentation: Histomor-
phometric analysis of graft materials for
maxillary sinus floor augmentation // J.
Oral Maxillofac. Surg. — 1993. —
Vol. 51. - P. 857-862.
228. Murray G., Holden R.. Roachlau W. Ex-
perimental and clinical study of new
growth of bone in a cavity // Amer. J.
Suig. - 1957. - Vol. 93. - P. 385—
387.
229. Naaman N., Ouhayoun P. Bone forma-
tion with discs or particles of natural cor-
al skeleton plus polyglastin 910 mesh:
Histologic evaluation in rat calvaria //
Int. J. Oral Maxillofac. Impl. — 1988. —
Vol. 13. - P. 115-120.
230. Nagahara K., Mouri K., Kanematsu N. et
al. Stimulation of in vivo calcification
using collagen membranes cultured with
osteoblastic cells in vitro: a preliminary
report// Int. J. Oral Maxillofac. Impl. —
1995. - Vol. 10, N 1. - P. 109-113.
231. Neukam F., Hausamen. Microvascular
bone grafting techniques in combination
with osseointegrated fixtures // Advanced
Osscointegration Surgery / Eds. P. Wor-
thington, P.-I. Brancmark. — Berlin:
Quintessenz, 1992.
232. Nevins M., Melloning J. Enhancement of
the damaged edentulous ridge to recievc
dental implants: A combination of allo-
graft and Gore-Tex membrane // Int. J.
Periodont. Rest. Dent. — 1992 —
Vol. 12. - P. 97-111.
233. Nowzari H., Slots J. Microbiologic and
clinical study of polytetrafluoroethylene
membranes for guided bone regeneration
around implants // Int. Oral Maxillofac
Impl. - 1995. - Vol. 10, N 1. - P. 67-
73.
234. Nyman S., Gottlow J., k'arring T, Lindhe J.
The regenerative potential of the perio-
dontal ligament: An experimental study
in the monkey // J. Clin. Periodont. —
1982. - Vol. 9. - P. 257-265.
235. Nyman S., Lang N., Ruser D., Rragger U.
Bone regeneration adjacent to titanium
dental implants using guided tissue re-
generation: A report of two cases // Int.
J. Oral Maxillofac. Impl. — 1990. — Vol.
5. - P. 9-14.
236. Ohgeweser M. Surgical correction of
small or retrodisplaccd maxillal // Plast
Reconstr. Surg. — 1969. — Vol. 8. — P.
45-52.
237. Palmer R., Floud P., Palmer P. et al.
Healing of implant dehiscence defects
without expanded polytetrafluoroethyl-
ene membranes: a controlled clinical and
histological study // Clin. Oral Impl.
Res. - 1994. - Vol. 5. - P. 98-104.
238. Pikos M. Vertical Bone Reconstruction
of the Atrophic Posterior Mandible Uti-
lizing mandibular Block Autografts. 16th
Annual Meeting. — Toronto, Canada.
2001. - P. 16.
239. Poticet N., Jirajariyave J. Rehabilitation
of the Atrophic Maxilla using Ligomati-
cus Impl. 16th Annual Meeting. — To-
ronto, Canada, 2001. — P. 18.
240. Quinn P. Resorption rate in atrophic
mandibles reconstructed with inferior
border grafting // Int. J. Oral Maxillofac.
Impl. - 1996. - Vol. II, N I. - P. 127.
241. Quinones C., Caton J., Mota L. et al.
Evaluation of a synthetic biodegradable
barrier to facilitate guided tissue regener-
ation // J. Dent. Res. — 1990. —
Vol. 69. - P. 13-35.
242. Raghoebar G., Rrouwer T, Reintsema H.,
Van Oort R. Augmentation of the maxil-
lary sinus floor with autogenous bone for
placement of endosseous implants: a pre-
liminary report // J. Oral Maxillofac.
Surg. - 1993. — Vol. 51. - P. 1198—
1203.
243. Raghoebar G., Tomson A., Scholma J. et
al. Use of cultured mucosal grafts to cov-
er defects caused by vestibuloplasty: an in
vivo study // J. Oral Maxillofac. Surg. —
1995. - Vol. 53, N 8. - P. 105-10.
244. Regev E, Smith R., Perrott D., Pogrel M.
Maxillary sinus complicationes related to
endosseous implants // Int. J. Oral Ma-
xillofac. Impl. — 1995. — Vol. 10. —
P. 451-461.
245. Reinhardt C., Krensser B. Retrospective
Study of the dental implantation with
sinus lift and Cerasorb® augmentation //
Dent. Impl. - 2000. - N 4. - P. 18-
26.
246. Rosenquist B. Fixture placement posterior
to the mental foramen with transposi-
tioning of the inferior alveolar nerve //
Int. J. Oral Maxillofac. Impl. — 1992. —
Vol. 7, N 1. - P. 45-50.
247. Ruskin J. et al. Inferior Alveolar Nerve
Considerations with Dental Impl. —
1995. - 385 p.
248. Rutherford R., Sampath T, Rueger D.,
Taylor T. Use of bovine osteogenic pro-
tein to promote rapid osscointegration of
endosseous dental implants // Int. J.
Oral Maxillofac. Impl. — 1992. — Vol. 7,
N 3. - P. 297-301.
249. Raghoebar G., Batenburg R., Vissing A. et
al. Augmentation of localized defects of
the anterior maxillary ringe with autoge-
nous bone before insertion of implants //
J. Oral Maxillofac. Surg. — 1996. —
Vol. 54. - P. 1180-1185.
250. Sailer И. N new method of inserting en-
dosseous implants in totally atrophic
maxillae //J. Cranio-Maxillofac. Surg. —
1989. - Vol. 17. - P. 299.
251. Salata L., Craig G., Brook I. Bone heal-
ing following the use of hydroxyapatite or
ionomeric bone substitutes alone or
combined with a guided bone regenera-
tion tcchique: An animal study II Int. J.
Oral Maxillofac. Impl. — 1998. —
Vol. 13. - P. 44-51.
252. Salama H., Salama M. The role of or-
thodontic extrusive remodeling in the en-
hancement of soft and hard tissue Pro-
files prior to implant placement: a sys-
tematic approach to the management of
extraction site defects // Int. Perio. Rest.
Dent. - 1993. - Vol. 13. - P. 312—
333.
253. Sampath L., Reddy A. Dissociation extrac-
tion and reconstitution of extracellular
matrix components involved in local bone
differentiation // Proc. nat. Acad. Sci.
USA. - 1981. - Vol. 78. - P. 7599-
7603.
254. Schenk R., Buser D., Hardwick Ж, Dah-
lin C. Healing pattern of bone regenera-
tion in membrane-protected defects: a
histologic study in the canine mandible //
Int. J. Oral Maxillofac. Impl. — 1994. —
Vol. 9. N 1. - P. 13-29.
255. Schliephake H., Neukam F., Hutmacher D.,
Becker J. Enhancement of bone ingrowth
into a porous hydroxyapatite-matrix us-
ing a resorbable polylactic membrane: an
experimental pilot study // J. Oral Ma-
xillofac. Surg. — 1993. — Vol. 52. —
P. 57-63.
256. Schroeder A. et al. The reactions of bone
connective tissue and epithelium to en-
dosteal implants with titanium sprayed
surfaces // J. Oral Maxillofac. Surg. —
1981. - Vol. 9. - P. 15-25.
257. Schroeder A., Maeglin B., Sutter F. Das
I.T.I.- Hohlzylinderimplantat Type F zur
Prothesenretention beim zahnlosen
Kiefer // Schweiz Mschr. Zahnheilk. —
1983. - N 93. - S. 720-733.
258. Schulz A., Gager A. Guided tissue rege-
neration using an absorbable (polyglac-
tin-910) and osseous grafting // Int.
J. Pcriodont. Rest. Dent. — 1990. —
Vol. 10. - P. 8-17.
259. Seddon H. Three types of nerve injury //
Brain. - 1943. - Vol. 66. - P. 237-
288.
260. Seibert J., Nyman S. Localized ridge aug-
mentation in dogs: a pilot study sing
membranes and hydroxyapatite // J. Per-
iodontol. — 1990. — Vol. 1. — P. 157—
165.
261. Sevor J., Meffert R., Cassingham R. Re-
generation of densced alveolar bone ad-
jacent to endoosseous dental implants
utilizing a resorbable collagen membrane:
clinical and histological results I I J. Peri-
odont. Res. Dent. — 1993. — Vol. 23. —
P. 71-83.
262. Sindef-Pedersen S., Oliver A. Varying
treatment strategics for reconstruction of
maxillary atrophy with implants. Results in
98 patients // J. Oral Maxillofac. Surg. —
1994. - Vol. 52. - P. 210.
263. Silverstein L., Lffkove M., Gamick J. The
use of free gingival soft tissue to improve
the implant / soft-tissue interface // J.
Oral Impl. — 1994. — Vol. 20, N 1. —
P. 36-40.
264. Simion M., Dahlin C., Trisi P., Piattelli A.
Qualitative and quantitative comparison
study on different filling materials used in
bone regeneration: A controlled clinical
study // Int. J. Periodont. Rest. Dent. —
Vol. 14. - P. 199-215.
265. Simon M., Misilano U., Salvato A. Treat-
ment of dehiscences and fenestrations
around dental implants using resorbable
and nonresorbable membranes associated
with bone autografts: A comperative
clinical study // Int. J. Oral Maxillofac.
Impl. - 1997. - Vol. 12. - P. 159—
157.
266. Smiler D., Holmes R. Sinus lift procedure
using porous hydroxyapatite. A prelimi-
nary report // J. Oral Impl. — 1987. —
Vol. 23. - P. 239.
267. Smiler D. Osseointegrated implants in si-
nus lift surgery in patients with severe re-
sorption of the maxilla // Impl. Digest. —
1988. - P. 4-5.
268. Smiler D.. Johnson P., Lozada J. et al. Si-
nus lift grafts and endosseous implants.
Treatment of the atrophic posterior ma-
xilla // Dent. Clin. Amer. — 1992. —
Vol. 36. - P. 151-186.
269. Small S. et al. Augcnting the maxillary si-
nus for implants: report of 27 patients //
Int. J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 523-528.
270. Sones A. Complications with osseointc-
grated implants // J. Prosth. Dent. —
1989. - Vol. 62. - P. 581.
271. Spiekermann H., Donath K., Hassell T. et
al. Color Atlas of Dental Medicine. Im-
plantology. — New York: Thieme.
1995. - P. 59-76.
272. Steflik D., Sisk A., Parr G. et al. Experi-
mental studies of the implant-tissue in-
terface 11 J. Oral Impl. — 1993. — Vol.
19, N 2. - P. 90-94.
273. Steflik D., Parr G., Sisk., Lake E, Hanes
P. Histomorphometry of the dental im-
plant-bone interface: One year result of a
comparative investigation in dogs //
Int. J. Oral Maxillofac. Impl. — 1994. —
Vol. 9. - P. 501-512.
274. Stella J., Tharanon Ж A precise radio-
graphic method to determine the loka-
tion of the inferior alveolar canal in the
posterior edentulous mandible: Implica-
tions for dental implants // Int. J. Oral
Maxillofac. Impl. — 1990. — Vol. 5. —
P. 15-29.
275. Strauss J., Marx R., Carlson E. Platelet
richt plasma: a source of growth factors
for bone reconstruction of the jaws //
J. Oral Maxillofac. Surg. — 1996. —
Vol. 54. - P. 3-37.
276. Sunderland S. Nerves and Nerve injuries.
Ed. 2. — Edinburgh: Churchill Living-
stone, 1978.
277. Sutter E, Schroeder A., Buser D. The new
concept of 1TI hollow-cylinder and hol-
low-screw implants. Part I. Engineering
and design // Int. J. Oral Maxillofac.
Impl. - 1988. — Vol. 3. - P. 161-172.
278. Tatum H. Maxillary and sinus implant
reconstructions // Dent. Clin. North
Amer. — 1986. — Vol. 30. — P. 207—
229.
279. Tatum H. Lecture presented at Alabama
Implant study group. 1977. — Cited in:
Smiler D„ Johnson P., Lozada J. et aL Si-
nus lift grafts and endosseous implants.
Treatment of the atrophic posterior maxil-
la // Dent. Clin. North Amer. — 1992. —
Vol. 36. - P. 151-186.
280. Tatum H. Jr., I.ebowitz M., Tatum H. HI,
Borgner R. Sinus augmentation: rationale,
development, long-term results // N.Y
State Dent. J. - 1993. - Vol. 59. - P
43-48.
281. Tatum H., Lebowitz M., Borger R. Resto-
ration of the atrophic, edentulous mandi-
ble // J. Oral Impl. — 1994. — Vol. 20,
N 2. - P. 124-134.
282. Ten Brugge nkate C, Kraaijenhagen H.,
van der Kwast W et al. Autogenous max
illary bone grafts in conjunction with
placement of ITI endosseous implants. A
preliminary report // J. Oral Maxillofac.
Surg. - 1992. - Vol. 21. - P. 81-84.
283. Ten Cate A. The gingival function // Os-
tcointegtation in Clinical Dentistry /
Eds. P.-I. Branemark et al. — Chicago:
Quintessence, 1985. — P. 145—153.
284. Terry B., Albright J., Baker R. Alveolar
ridge augmentation of the edentulous
maxilla with the use of autogenous ribs
// J. Oral Surg. — 1974. — Vol. 32. —
P. 429-434.
285. Tidwell J., Blijdorp P., Stoelinga P. et al
Composite grafting of the maxillary sinus
for placement of endosteal implants.
A preliminary report of 48 patients //
J. Oral Maxillofac. Surg. — 1992. —
Vol. 21. - P. 204-209.
286. Todescan R., Pilliar R., Melcher A. A
small animal model for investigating en-
dosseous dental implants: effect ofgraft
materials on healing of endosseous, po-
rous-surfaced implants placed in a fresh
extraction socket // Int. J. Oral Maxillo-
fac. Impl. - 1987. - Vol 2, N 4. - P.
217-222.
287. Tomasetti B., Clare M., Riley S. Evalua-
tion of HA/rcsorbablc Sutare Matrix
used with Staple and titanium implants.
3™ International Congress on Prepros-
thetic Surgery. — 1989. — P. 2.
288. Tucker M. ?\mbulatory Preprosthetic Re-
constructive Surgery. Oral Maxillofac.
Surg. — New York: Mosby, 1994. —
P. 1103-1132.
289. Ulm C., Solar P., Krennmair G. et al. In-
cidence and suggested surgical manage-
ment of septa in sinus-lift procedures //
Int. J. Oral Maxillofac. Impl. — 1995. —
Vol. 10. - P. 462-465.
290. Urist M. Bone transplants and implants //
Fundamental and clinical bone physiolo-
gy. — Philadelphia: Lippincott, 1980. —
P. 331.
291. Urist M. Isolation and characterization of
bone morphogenic protein // Biology of
bone grafting: Selected readings in oral
and maxillofacial surgery / Ed. E. Ellis. —
Vol. 2. - 1991. - P. 1-28.
292. Urist M. The search for and discovery
of bone morphogenetic protein (BMP) //
Bone grafts. Derivations and substitutes /
Eds. M. Urist, B. O’Connor, R. Bur-
well. — Oxford: Butterworth—Heine-
mann, 1994. - P. 315-362.
293. Valen M. The significance of percursorcs
in your bone augmentation material. Pro-
ceedingsmof the 44th annual meeting and
symposium. — Boston, 1995. — P. 41.
294. Wachtel H., Langford A., Bemimoulin J.,
Reichart P. Guided bone regeneration
next to osseointegrated implants in hu-
mans // Int. J. Oral Maxillofac. Impl. —
1991. - Vol. 6. - P. 127-135.
295. Wagner J. A clinical and histological case
study using resorbable hydroxyapatite for
the repair of osseous defects prior to en-
dosseous implant surgery // J. Oral
Impl. - 1989. - Vol. 15. - P. 188-192.
296. Wagner Z. A 3 ,/2-Уеаг clinical evalua-
tion of resorbable Hydroxyapatite Osteo-
Gen® (HA Resorb)® used for sinus lift
augmentations in conjunction with the in-
sertion of endosseous implants // J. Oral
Impl. - 1991. - Vol. 17. - P. 152-164.
297. Warrer K., Karring T, Nyman S., Gogo-
levski S. Guided tissue regeneration using
biodegradable membranes of polylactic
acid or polyurethane // J. Clin. Perio-
dont. - 1992. - Vol. 19. - P. 663.
298. IKeiss Ch. A comparative analysis of fi-
broosteal and osteal integration and other
variables that affect long-term bone main-
tenance around dental implants // J. Oral
Impl. - 1987. - Vol. 13. - P. 467-487.
299. Wennstrom J., IJndhe J., Nyman S. Role
of keratinized gingiva for gingival health.
Clinial and histologic study of normal
and regenerated gingival tissue in dogs //
J. Clin. Pcriodont. — 1981. — Vol. 9. —
P. 311.
300. WittbjerJ., Palmer B., Robbin M., Thom-
gren K. Osteogenic activity in composite
grafts of demineralized compact bone
and marrow // Clin. Orthop. Rel. Res. —
1983. - Vol. 173. - P. 229-238.
301. Wood R.M., Moore D.L. Grafting of the
maxillary sinus with intraorally harvested
autogenous bone prior to implant place-
ment U Int. J. Oral Maxillofac. Impl. —
1988. - Vol. 3. - P. 209-214.
302. Zablotsky M., Meffert R., Caudill R.,
Evans G. Histological and clinical com-
parisons of guided tissue regeneration on
dehisced hydroxyapatite-coated and tita-
nium endosseous implant surfaces: a pilot
study // Int. J. Oral Maxillofac. Impl. —
1991. - Vol. 6, N 3. - P. 294-303.
303. 7aner D., Yukna R., Malinin T. Human
freeze-dries dura mater allografts as a
periodontal biological bondage // J. Pc-
riodont. - 1989. - Vol. 60. - P. 617-
623.
304. Zlotolow L, Huryn J., Piro J. et al. Os-
scointegrated implants and functional
prosthetic rehabilitation in microvascular
fibura free flap reconstructed mandibles //
Amer. J. Surg. - 1992. - Vol. 165. -
P. 677-681.
305. 16’" Annual Meeting Academia Osseo-
integration. — Toronto, Canada. March,
2001.
Глава 7
ОСЛОЖНЕНИЯ ЗУБНОЙ ИМПЛАНТАЦИИ
Несмотря на то что зубная импланта-
ция стала почти рутинной операцией, с
ней могут быть связаны разнообразные
осложнения.
В хирургической стоматологии на-
коплен большой опыт предупреждения
и лечения осложнений, возникающих
в ходе операций и в послеоперацион-
ном периоде. При зубной импланта-
ции этот опыт используется полностью
и дополняется практическим опытом
имплантационной хирургии.
Осложнения бывают общими и ме-
стными и могут развиваться как в ходе
хирургических вмешательств, так и в
отдаленные периоды. Их причины,
способы предупреждения и лечения
могут быть различными.
7.1. Общие осложнения
во время операции
В ходе оперативного вмешательства
или по окончании каждого этапа его
хирург-стоматолог, производящий
зубную имплантацию, должен быть го-
тов к общим осложнениям, прогнози-
ровать которые невозможно и прояв-
ление которых, как правило, бывает
спонтанным. При зубной импланта-
ции, как и при других стоматологиче-
ских операциях, у хирурга под рукой
всегда должен быть комплект средств
для оказания первой медицинской по-
мощи и необходимый инструментарий
для применения таких лекарств.
Общие осложнения при зубной им-
плантации могут быть связаны как с
общими соматическими заболевания-
ми, так и с интоксикацией анестетика-
ми. Последние возникают вследствие
передозировки анестетика или адрена-
лина. Кроме того, развитие общих ос-
ложнений может быть связано с пси-
хоэмоциональным состоянием боль-
ного. К наиболее типичным общим ос-
ложнениям относятся обморок, кол-
лапс, интоксикация, а также анафи-
лактический шок, которые возможны
на любом этапе обезболивания и поста-
новки имплантатов. Американский ин-
ститут здоровья и Американская акаде-
мия зубной имплантации в 1994 г. со-
общили о 10 случаях смерти и тяжелых
сердечно-легочных осложнений во вре-
мя имплантационной хирургии [172].
При остеотомии — сверлении кости с
внутренним охлаждением водой во
всех случаях зафиксирована воздушная
эмболия, вследствие чего наступила
смерть [70]. Это осложнение возникает
тогда, когда неправильно сверлят кость
под давлением с охлаждением жидко-
стью. Давление при сверлении намного
превышает давление в венозной систе-
ме. Смесь охлаждающей жидкости с
воздухом под давлением 80 мм рт.ст.
может попасть в венозную систему кос-
ти, а затем в полую вену и сердце. В
связи с этим сверление кости, особен-
но с внутренним охлаждением, не
должно сочетаться с подачей воздуха
[63, 75, 83].
Тактика врача при общих осложне-
ниях имплантации описана в учебни-
ках, в том числе по хирургической сто-
матологии, методических пособиях и
монографиях, а также в главе 4 данной
книги.
7.2. Местные осложнения
во время операции
В развитии местных осложнений ряд
исследователей отмечают влияние
конструктивных особенностей им-
плантата [31, 32, 37, 119]. Другие ука-
зывают на некорректные хирургиче-
ские действия, в том числе перегрев
кости во время остеотомии. Большое
значение имеют нарушение окклюзи-
онных взаимоотношений [7, 27, 28, 45,
73]. Судя по зарубежной медицинской
литературе, чаще всего проблемы воз-
нккают при ослаблении крепящих вин-
тов, вращении опорных головок и не-
удачной эстетике [7, 45, 81, 98, 99]. Тя-
желые осложнения возникают также в
прилегающих к имплантату мягких тка-
нях. Так, в зоне мягких тканей отмеча-
ются воспаление слизистой оболочки,
десневая гиперплазия, периимплантит,
сопровождающийся потерей кости, ре-
цессия десны с обнажением резьбы им-
плантата [17,18, 25, 111, 135, 140].
Все специалисты сходятся во мне-
нии относительно значения гигиены
полости рта в развитии воспалитель-
ных осложнений у имплантатов [15,25,
92. 159].
К местным осложнениям в ходе опе-
ративных вмешательств при зубной
имплантации относятся также отлом
или перфорация кортикальной стенки
кости, вскрытие альвеолы соседнего
зуба, вскрытие верхнечелюстной пазу-
хи, полости носа, нижнечелюстного
канала, травмирование подбородочно-
го сосудисто-нервного сплетения, по-
падание имплантата в мягкие ткани,
верхнечелюстную пазуху, кровотече-
ние, воспалительные явления в тканях
области введенного имплантата в ран-
ние сроки после операции — подвиж-
ность имплантата и поздние осложне-
ния — .мукозит, периимплантит, оттор-
жение имплантата.
7.2.1. Перфорация или отлом
кортикальной стенки кости
Такие осложнения могут возникнуть
вследствие неправильных замеров кос-
ти, при сверлении не в том направле-
нии, в котором расположена остаточ-
ная кость, а также при значительном ее
склерозе и повышенной ломкости. Ес-
ли перфорационное отверстие невели-
ко, имплантат плотно погрузился и хо-
рошо зафиксирован в ложе, то дефект
кости следует устранить с помощью
биоматериалов либо рассасывающейся
или нерассасываюшейся мембраны
[67—69, 100, 126]. При незначительном
дефекте кости можно применить гра-
нулы гидроксиапатит, 'Тидроксиапо-
ла", "ОСТИМ-ЮО" или другие бнома-
териалы, смешав их с кровью, плазмой
крови в стерильной емкости. Получен-
ную массу наносят на участок дефекта
кости и аккуратно фиксируют слизи-
сто-надкостничным лоскутом.
Образовавшийся дефект кости боль-
шого размера закрывают аутокостью,
взятой из подбородочного отдела ниж-
ней челюсти, ретромолярной области
или бугра верхней челюсти. Целесооб-
разна также пластика консервирован-
ной — деминерализованной или лиофи-
лизированной аллокостью. Закрыть де-
фект можно также различными комби-
нациями биоматериалов, таких как "Ко-
лапол", "Коллапан" и др., а также их
комбинацией с гранулированным гид-
роксиапатитом. Во всех случаях необхо-
димы достаточное количество мягкой
ткани и глухое зашивание раны, поэто-
му перед пластикой очень важно оце-
нить состояние слизисто-надкостнич-
ного лоскута. В ряде случаев более на-
дежны его расщепление и закрытие сна-
чала глубокого слоя и соединение над-
костницы, а затем слизистой оболочки,
но обязательно без ее натяжения [25].
При отломе кортикальной стенки и
недостаточной фиксации имплантата
стараются укрепить его блоком ауто-
или аллокости [131]. Если стабиль-
ность не достигается, то операцию
прекращают, имплантат вынимают и
производят пластику кости так, как
описано выше. При этом стараются
увеличить ширину альвеолярной дуги.
Через 4—6 мес оценивают состояние
кости и возможность повторной поста-
новки имплантата. В отдельных случа-
ях отказываются и от нее. Хороший
эффект дает применение мембраны,
которая закрывает дефект кости, пере-
крывая его по краям. Мембраной мо-
жет быть закрыт также биоматериал,
причем она не только обеспечивает его
защиту', но и выполняет фиксирующую
функцию [12, 68, 86]. Повторную им-
плантацию можно проводить и через
6 нед, когда фоторентгенография и
РКТ покажут первичное ремоделиро-
вание подсаженного биоматериала.
7.2.2. Вскрытие альвеолы
соседнего зуба
Как правило, это осложнение свиде-
тельствует о неправильной технике
операции и неадекватности расстоя-
ния от ложа имплантата до соседнего
зуба. В такой ситуации имплантацию
следует прекратить, а дефект боковой
стенки альвеолы закрыть биоматериа-
лами (гидроксиапатитом, "Колапол",
"Коллапан", ауто- или аллокость и др.).
Целесообразно также заполнить час-
тично сформированное ложе для им-
плантата гранулами гидроксиапатита,
перемешанными с кровью или плаз-
мой крови, обогащенной тромбоцита-
ми. Рану мягких тканей ушивают на-
глухо. К обсуждению вопроса об им-
плантации следует вернуться через 2—
3 мес, но только в том случае, если
можно поставить конструкцию на со-
седнем участке кости. Повторную по-
становку имплантата, захватывая уча-
сток, где ранее было сформировано ко-
стное ложе, можно осуществить не ра-
нее чем через 4 мес на нижней и 6 мес
на верхней челюсти. Предварительно
должны быть выверены все расстояния
имплантата от зубов и направление
сверления кости не только клинически
и рентгенологически, но и, лучше, пу-
тем компьютерной томографии. В от-
дельных случаях от имплантации сле-
дует отказаться.
7.2.3. Перфорация
верхнечелюстной пазухи
Постановка имплантатов на участки
верхней челюсти соответственно ма-
лым и большим коренным зубам все-
гда сопряжена с возможностью пробо-
дения дна верхнечелюстной пазухи,
чаще всего при пневматическом типе
ее строения. В одних случаях это про-
исходит из-за неправильного планиро-
вания и формирования костного ложа
для имплантата, если на прицельных
снимках и ортопантомограмме не оп-
ределены истинные размеры кости и ее
отношения с бухтой верхнечелюстной
пазухи. В других случаях перфорация
возникает вследствие травматичного
формирования ложа и большого давле-
ния на тонкую стенку дна верхнечелю-
стной пазухи.
Если перфорирована только костная
стенка дна верхнечелюстной пазухи и
выявляется податливая слизистая обо-
лочка, выстилающая ее, то следует под
верхний конец имплантата положить
фрагмент аутокости, аллотранспланта-
та — лиофилизированной или демине-
рализованной кости, после чего за-
фиксировать имплантат (только по-
гружной) и наглухо зашить рану. Обя-
зательным условием является плотное
стояние имплантата в кости. Антибио-
тикотерапию и другое противовоспа-
лительное лечение проводят в течение
8—10 дней. Рекомендуется закапывать
в нос сосудосуживающие лекарствен-
ные средства. Ежедневно проводят ги-
гиеническую обработку послеопераци-
онной раны. Все эти лечебные меро-
приятия способствуют приживлению
имплантата и профилактике воспали-
тельных явлений в верхнечелюстной
пазухе. Однако при описанной выше
операции с использованием аллокости
приживление имплантата требует боль-
ше времени, так как на остеоинтегра-
цию имплантата и кости могут влиять
резорбтивные процессы в области под-
саженного аллотрансплантата.
В тех случаях, когда в первые 10
дней или через 1—2 мес после имплан-
тации возникают воспалительные яв-
ления на том участке, где поставлен
имплантат, или наблюдаются заложен-
ность носового хода, чувство тяжести в
области верхней челюсти, серозные
или серозно-гнойные выделения из
полости носа, приходится констатиро-
вать острый синусит или обострение
хронического [147]. В таких случаях
необходимо срочно дообследовать
больного, проводить местные блокады
с анестетиком, общую противовоспа-
лительную терапию, лечение серозного
или гнойного воспаления, верхнечелю-
стного синусита путем пунктирования,
промывания, введения лекарственных
веществ в пазуху. Если воспалительные
явления не стихают, то чаще всего при-
бегают к раскрытию раны в полости рта
и удалению имплантата, а затем про-
должают лечение синусита и общую
противовоспалительную лекарствен-
ную терапию.
Закрыть перфорационное отверстие
в верхнечелюстной пазухе можно также
пластическими материалами — блоками
"Колапола", "Коллапана" и других био-
материалов — "Intepore-200", "Grafton",
517
"Cerasorb", "Bio-Oss", "Osteo-Graf', на
которые при постановке будет опи-
раться имплантат. В этом случае после-
операционное ведение больного с по-
мощью антибиотиков, десенсибилизи-
рующих и общеукрепляющих средств и
профилактику воспаления пазухи осу-
ществляют так же, как при использо-
вании ауто- и аллотрансплантатов.
Развитию острого процесса в верхнече-
люстной пазухе после имплантации
вблизи нее или при перфорации дна
может способствовать хронический
гайморит. Если воспаление развивает-
ся в зубочелюстном сегменте, где нахо-
дится имплантат, или в верхнечелюст-
ной пазухе, то терапию проводят так
же, как описано выше (противовоспа-
лительное лечение, удаление имплан-
тата и лечение синусита).
Создать слой кости между апикаль-
ным концом имплантата и слизистой
оболочкой, выстилающей верхнечелю-
стную пазуху, можно при помощи гра-
нул гидроксиапатита и трикальций-
фосфата, блоков биоматериала. Их
смешивают с кровью или плазмой,
обогащенной тромбоцитами, и поме-
щают в стерильную емкость. Специ-
альными остеотомами, например
фирм "31", "Steri-Oss", "Friatec", порци-
ей биоматериала, смешанного с кро-
вью или плазмой, осторожно поднима-
ют участок пазухи. Следующую пор-
цию укладывают поверх первой и ос-
теотомом второго размера продолжают
процедуру. Иногда, если позволяет
диаметр ложа, используют третий ос-
теотом и осторожно, без давления вво-
дят третью порцию. Для наилучшей
фиксации имплантата нужно, чтобы
его диаметр был несколько больше
диаметра созданного ложа, тело после
введения было плотно фиксировано в
кости, а конец касался участка спрес-
сованного биоматериала. Под слизи-
сто-надкостничный лоскут поверх
биоматериала и имплантата фиксиру-
ют мембрану. На контрольном рентге-
новском снимке от верхушки имплан-
тата до дна пазухи должно быть не ме-
нее 2 мм. При непредвиденных ослож-
нениях имплантации такая методика
закрытия перфорационного отверстия
надежно обеспечивает эффект.
И.Ю. Гончаров [2] также сообщал об
успешном использовании костных
матриксов для закрытия перфорацион-
ных отверстий кости. D. Deporter [71]
рекомендовал закрытие перфорации
гранулами гидроксиапатита с исполь-
зованием малых имплантатов фирмы
"Interpore” диаметром 3,5 мм и длиной
6—7 мм.
В ходе хирургической подготовки
костного ложа для имплантата может
быть перфорирована не только кость,
но и слизистая оболочка верхнечелю-
стной пазухи. В такой ситуации необ-
ходимо прежде всего убрать из костно-
го ложа инструмент и тем более им-
плантат. При выделении из костного
ложа крови с пузырьками воздуха не
следует проводить процедуры, приня-
тые для диагностики перфорации (за-
жимание носа и обнаружение выхода
воздуха со свистом из костного ложа).
Достаточно ощущать, что вверху инст-
румент не имеет опоры, и отметить вы-
деление пузырьков воздуха. Следует
убедиться, что через перфорационное
отверстие из пазухи нет гнойных выде-
лений. При одновременной перфора-
ции кости и слизистой оболочки верх-
нечелюстной пазухи в одних случаях
проводят пластику аутокостью, алло-
костью, поставив ее в виде арки по от-
ношению к перфорационному отвер-
стию, в друтих — используют блок "Ко-
лапола", "Коллапана" и других биома-
териалов. В послеоперационном пе-
риоде тактика ведения больного анало-
гична той, которую применяют при за-
крытии дефекта кости без поврежде-
ния слизистой оболочки пазухи. По-
вышенное внимание следует уделять
профилактике синусита.
После закрытия перфорационного
отверстия можно попытаться поста-
вить имплантат вторично. Если кости
достаточно для фиксации, то ставят
имплантат малой длины и диаметром
6—7 мм. Фиксация может быть достиг-
нута, если диаметр созданного ложа
меньше диаметра имплантата. Обяза-
тельно глухое зашивание мягких тка-
ней над имплантатом. В этом случае
пациент должен быть поставлен в из-
вестность о малой эффективности та-
кой процедуры, вероятности непри-
живления имплантата или воспаления.
При развитии воспалительных ослож-
нений имплантат удаляют, пекле чего
проводят лечение местной раны и си-
нусита.
Возможна и другая тактика лечения:
постановку имплантата отменяют,
перфорационное отверстие верхнече-
люстной пазухи закрывают биомате-
риалами по методике, описанной вы-
ше. Имеется положительный опыт за-
крытия перфорационного отверстия и
пластики альвеолярного отростка "Ко-
лаполом" или деминерализованной ко-
стью [27], а также комбинацией раз-
личных биоматериалов ]25]. По дан-
ным сравнительного изучения, наи-
лучшие результаты были достигнуты
при закрытии перфорационного
отверстия и восполнении кости альве-
олярного отростка верхней челюсти
деминерализованными пластинами
кортикального вещества кости. Они
более пластичны, поэтому их легко бы-
ло подгонять под размеры дефекта кос-
ти и без осложнений реконструиро-
вать. Через 6 мес после оценки коли-
чества и качества новообразованной
кости решают вопрос о целесообразно-
сти возобновления имплантации.
7.2.4. Проталкивание имплантата
в верхнечелюстную пазуху
Вследствие неправильных расчетов на-
личной кости и соотношения ее с верх-
нечелюстной пазухой, а также травма-
тичной техники операции возможно
проталкивание имплантата в верхнече-
люстную пазуху. Если имплантат виден
в устье перфорационного отверстия, то
его захватывают пеаном или пинцетом
и удаляют. В случае расположения им-
плантата в пазухе не следует пытаться
извлечь его через перфорационное от-
верстие. Часто имплантат проталкива-
ется в глубину пазухи, ее бухты, поэтому
для его извлечения необходимо прило-
жить большие усилия. При расположе-
нии его около перфорационного отвер-
стия, что определяют по рентгенограм-
ме, предпочтительнее откинуть слизи-
сто-надкостничный лоскут, расширить
перфорационное отверстие, удалить
имплантат и, выполнив пластику дна
пазухи и костного ложа биоматериала-
ми, наглухо зашить рану. В течение
4 нед проводят профилактику воспале-
ния верхнечелюстной пазухи или лече-
ние возникшего серозного или гной-
ного синусита.
При перфорации верхнечелюстной
пазухи имплантатом нельзя исключить
формирование свища. Исходя из кли-
нических и рентгенологических дан-
ных, если хроническое воспаление на-
блюдается только в окружности свища,
выполняют щадящую гайморотомию с
удалением имплантата, пластику дна
пазухи “Колаполом'’, "Коллапаном",
аутокостью, деминерализованной ко-
стью, используя эти биоматериалы
также для восполнения альвеолярного
отростка. При необходимости учиты-
вают уровень дна пазухи и в случае
низкого расположения поднимают его
биоматериалами с учетом будущей им-
плантации. Биоматериал можно за-
крыть нерассасывающейся мембраной
[12]. Через 6 мес на ремоделированный
участок кости можно ставить имплан-
тат. В результате перфорации и протал-
кивания имплантата в верхнечелюст-
ной пазухе может возникнуть хрониче-
ский воспалительный процесс. Поли-
позные изменения имеют диффузный
характер, а инородное тело — имплан-
тат располагается вдали от перфора-
ции. После подготовки больного в ста-
ционаре производят радикальную гай-
моротомию, при которой извлекают
имплантат. При иссечении свища и за-
крытии сообщения полости рта с верх-
нечелюстной пазухой могут потребо-
ваться поднятие дна ее биоматериала-
ми, пластика мягких тканей методом
перемещения слизистых лоскутов из
преддверия рта, щеки, а также слизи-
сто-надкостничного лоскута с неба. Как
при щадящей гайморотомии, так и по-
сле радикального оперативного вмеша-
тельства проводят антибиотикотера-
пию, десенсибилизирующее и общеук-
репляющее лечение в течение 6—8
дней. Обследование через 6—8 мес по-
зволяет решить вопрос об имплантации.
7.2.5. Перфорация дна полости носа
Аналогичная ситуация может возник-
нуть при остеотомии и постановке им-
плантата в передний отдел верхней че-
люсти. Однако костная стенка перфо-
рируется, как правило, вместе со сли-
519
зистой оболочкой полости носа. В та-
кой ситуации лучше отменить имплан-
тацию, так как образовавшийся свищ
дна полости носа плохо поддается ле-
чению, а оперативное вмешательство
достаточно сложное и не всегда эф-
фективно из-за плотного сращения
слизистой оболочки носа с надкостни-
цей и костью. Удалив имплантат, мож-
но уложить на место перфорации блок
"Колапола" или "Коллапана", аллоко-
сти, после чего рану зашить наглухо.
Раневую поверхность в области дна но-
совой полости следует держать под йо-
доформным тампоном до полной эпи-
телизации раны. Решение о повторной
имплантации принимают через 6 мес
после более детального клинико-рент-
генологического обследования паци-
ента, предпочтительно с проведением
компьютерной томографии.
7.2.6. Перфорация канала нижней
челюсти и повреждение нижнего
альвеолярного, подбородочного,
язычного нервов
При зубной имплантации на нижней
челюсти, главным образом в дисталь-
ных отделах ее альвеолярной части, мо-
гут развиться такие осложнения, как
кровотечение, повреждение нижнего
луночкового нерва с последующим его
поражением. В таких случаях следует
приостановить имплантацию, осмот-
реть место перфорации и оценить целе-
сообразность продолжения операции.
При условии, что имплантацию можно
продолжить, целесообразно рассечь
мягкие ткани на большем протяжении,
выделить сосудисто-нервный пучок и
изолировать era биоматериалом. Если
перфорация возникла в районе премо-
ляров и первого моляра, то следует об-
нажить подбородочное отверстие, вы-
делить подбородочный нерв и зафикси-
ровать его на толстой кетгутовой лига-
туре. Затем, защитив нерв распатором,
исследуют ход канала. Прерывистыми
движениями бором удаляют переднюю
стенку канала нижней челюсти, посте-
пенно освобождая сосудисто-нервный
пучок и заходя при этом за уровень пер-
форации. Сверление кости и освобож-
дение нерва лучше проводить при на-
ружном охлаждении стерильным изото-
ническим раствором натрия хлорида
или раствором Рингера. После выделе-
ния сосудисто-нервного пучка его изо-
лируют от места перфорации рассасы-
вающейся мембраной, "Колаполом”
или "Коллапаном", а затем теми же ма-
териалами прикрывают нерв снаружи.
При перфорации канала в районе
второго моляра выпиливают фрагмент
кости соответственно передней стенке
кости, выделяют срединную часть со-
судисто-нервного пучка и без натяже-
ния нерва изолируют биоматериалом
выделенную его часть изнутри, плотно
закрыв место перфорации. Снаружи
нерв также прикрывают биоматериа-
лом. Иногда от сосудисто-нервного
пучка биоматериалом изолируют и
мягкую ткань.
После хирургических манипуляций
продолжают имплантацию и плотно
фиксируют имплантат. При поврежде-
нии канала нижней челюсти рану заши-
вают только наглухо. Мягкие ткани —
слизистую оболочку и надкостницу —
зашивают осторожно, без натяжения.
Необходимо обеспечивать хорошую
изоляцию мягких тканей от сосудисто-
нервного пучка био материалом, а так-
же следить, чтобы лоскут не создавал
компрессию.
В послеоперационном периоде про-
водят противовоспалительное лечение.
Следует применять физические мето-
ды, направленные на улучшение про-
водимости нерва и профилактику деге-
неративных изменений в нем. Все фи-
зические процедуры оценивают с точ-
ки зрения воздействия на имплантат и
выбирают те, которые могут положи-
тельно влиять на его приживление и
способствовать профилактике пораже-
ния нижнего альвеолярного нерва.
Диагностика поражений нижнего лу-
ночкового нерва после репозиции осно-
вывается на определении чувствитель-
ности периферического отдела подбо-
родочного нерва (сенсорный тест), оп-
ределении показателей порога чувст-
вительности при касании острым пред-
метом. Проводят также исследования
при помощи алгометра, рентгенологи -
ческих методов, в том числе визио-
:рафии, компьютерной томографии.
Травматические поражения нижне-
520
го альвеолярного нерва могут быть 5
степеней. При поражении 1 степени на-
ступает временное прекращение про-
водимости нерва без потери непрерыв-
ности структуры осевоцилиндрических
отростков. Морфологически выявляет-
ся разрушение миелинового слоя нерв-
ных волокон за счет компрессионных
воздействий. Повреждение перифери-
ческих ветвей тройничного нерва —
нижнего альвеолярного, подбородоч-
ного, язычного — возможно во время
операции или как следствие послеопе-
рационного отека и инфильтрации.
При перфорации канала нижней челю-
сти и незначительной травме нижнего
альвеолярного нерва, когда отмечается
его анестезия или парестезия, чаще оп-
ределяется именно эта степень пора-
жения (в течение 3—6 нед).
Во время имплантации может про-
изойти перерезка как нижнего альвео-
лярного нерва, так и его перифериче-
ского отдела — подбородочного нерва.
Это наблюдается при перфорации ка-
нала и повреждении сосудисто-нерв-
ного пучка. В таких случаях нужно ис-
пользовать кровоостанавливающую
губку, но без компрессии. Затем следу-
ет осмотреть участок перфорации и
произвести действия, указанные выше.
В первые 2 нед после выделения, ре-
позиции и изоляции нерва проводят
УФ-облучение участка челюсти. Начи-
нают с 2 биодоз, увеличивая продолжи-
тельность каждого последующего облу-
чения на 1—2 биодозы. Дарсонвализа-
цию раны в полости рта можно сочетать
с 3—5 воздействиями с короткой искрой
в течение 3 мин. Последнее способст-
вует наилучшей эпителизации раны.
Для профилактики воспаления в
нерве и его дегидратации назначают
УВЧ по 10 мин в атермической дозе
при выходной мощности до 30 Вт. УВЧ
делают ежедневно 5—10 раз [3].
При выраженной невропатии ниж-
него альвеолярного нерва применяют
терапию импульсными токами: дина-
мическими (2—3 мин со сменой по-
лярности), синусоидальными (в пере-
менном режиме 8—12 мин), флюкто-
ризируюшими (в средней дозе по 8—12
мин), всего 10 воздействий.
Через 14—20 дней для улучшения
кровообращения, трофики, проводимо-
сти нерва проводят электрофорез каль-
ция хлорида, димедрола, йода, витами-
на В], лидазы. Длительность процедуры
20 мин, всего делают 30 процедур. Хо-
рошие результаты дает также воздейст-
вие гелий-неонового и инфракрасного
лазеров. Для лучшего восстановления
нерва и профилактики невропатии
О.И. Ефанов и Т.Ф. Дзанагова [3] ре-
комендуют электрофорез 2 % раствора
новокаина и 6 % раствора витамина В(.
Всего делают 5—10 процедур по 20 мин
каждая. Проводя физиотерапию, необ-
ходимо следить за динамикой местного
статуса со стороны как имплантата, так
и нижнего альвеолярного нерва. От-
дельным пациентам, особенно старше
60—65 лет, можно уменьшить местное
воздействие физическими факторами
и назначить курс инъекций витамина
В], Вб, В|2, лидазы, а после консульта-
ции с невропатологом или стоматонев-
рологом провести курс внутримышеч-
ных инъекций церебролизина. Нерв
хорошо восстанавливается при введе-
нии 0,005 г витамина В? 2 раза в сутки
и 0,1 г витамина С 3 раза в сутки в со-
четании с инъекциями 2 мл 0,5 % рас-
твора дибазола через день [24].
В случае, если через 2—3 мес сим-
птомы поражения нерва сохраняются,
следует предположить II и более высо-
кую степень поражения альвеолярного
нерва. По Н. Seddon, II степень харак-
теризуется дегенерацией сегмента нер-
ва вследствие прекращения его прово-
димости. Однако ни наружная оболоч-
ка, ни ткани по ходу нервных волокон
не поражаются. В сроки более 2—3 мес
показана консультация невропатолога.
Проводить лечение следует согласно
его рекомендациям.
При значительной атрофии нижней
челюсти перерезка нижнего альвеоляр-
ного нерва может произойти во время
рассечения мягких тканей и откидыва-
ния слизисто-надкостничного лоскута.
В таких случаях имплантация должна
быть приостановлена, а пациент на-
правлен к нейрохирургу для первично-
го восстановления нерва, его сшива-
ния. В период от 7-го до 21-го дня по-
сле перерезки прибегают к отсроченно-
му сшиванию. В более поздние сроки,
если это не сделано раньше, осуществ-
ляют вторичное восстановление нерва.
При поражениях нижнего альвео-
лярного нерва 111, IV и V степени по-
катаны применение сложных методов
функциональной диагностики, а также
специальное оперативное и консерва-
тивное лечение, проводимое нейрохи-
рургом. В своей практике мы не встре-
чали таких поражений нижнего альве-
олярного нерва, а в литературе по им-
плантационной хирургии сведений о
них нет.
При рассечении мягких тканей, от-
слаивании слизисто-надкостничного
лоскута в области первого моляра и
второго премоляра, а также кпереди,
кзади и ниже этого участка зубочелю-
стного сегмента может быть поврежден
подбородочный нерв. Чаще при травме
нервного ствола возникает поражение
его I или II степени. Лечение анало-
гично описанному выше при повреж-
дении нижнего альвеолярного нерва. В
случае перерезки ствола подбородоч-
ного нерва, что видно невооруженным
глазом, следует приостановить им-
плантацию и попытаться сшить нерв
или в течение 5—6 дней прибегнуть к
помощи нейрохирурга, который при-
меняет микрохирургическую технику.
Отсроченное сшивание нерва показа-
но в течение 7—21 дня после повреж-
дения. Вторичное восстановление под-
бородочного нерва не производят, а
назначают местную (в том числе с при-
менением физических методов) и об-
щую терапию, направленную на вос-
становление проводимости коллате-
ральных ветвей.
При операции в дистальных отделах
нижней челюсти, особенно при значи-
тельной атрофии кости и нещадящем
отслоении лоскута с внутренней сторо-
ны, может быть поврежден язычный
нерв, вследствие чего и развивается его
парестезия [54]. Диагностика и лече-
ние аналогичны описанным выше при
поражениях нижнего альвеолярного и
подбородочного нервов.
7.2.7. Кровотечение
Кровотечение при зубной импланта-
ции обычно возникает при остеотомии
вблизи крупных сосудов артериального
или венозного типа. Кровотечение из
нижней альвеолярной артерии может
наблюдаться при перфорации канала
нижней челюсти. Остановка его воз-
можна только путем локального нало-
жения гемостатической губки на кро-
воточащий участок. В других случаях,
учитывая интимную связь сосуда и
нерва, образующего сосудисто-нерв-
ный ствол, выделяют сосудисто-нерв-
ный пучок, отделяют артерию и пере-
вязывают ее. При изоляции сосудисто-
нервного пучка с помощью биомате-
риалов вместе с ними используют ге-
мостатическую губку, в том числе с ам-
беном, фибриновую пленку, желати-
новую губку "Кровостан", антисепти-
ческую губку с гентамицином или ка-
наминином [24].
При установлении имплантата и ос-
теотомии в области второго премоляра
и первого моляра на нижней челюсти
может начаться кровотечение из под-
бородочной артерии, которое чаще
всего отмечается при неправильном
выборе места постановки имплантата.
Он должен находиться не ближе 5 мм
от места выхода сосудисто-нервного
пучка из подбородочного отверстия. В
этой области откидывают слизисто-
надкостничный лоскут, благодаря чему
создается хороший обзор подбородоч-
ного отверстия и выходящего из него
сосудисто-нервного пучка. Все это
обеспечивает адекватную остеотомию,
а также профилактику' повреждения со-
судисто-нервного пучка и кровотече-
ния. При кровотечении следует, отде-
лив артерию от нерва, перевязать сосуд
или провести тампонаду его гемостати-
ческой губкой или другими кровооста-
навливающими средствами. С. Теп
Bruggenkate и соавт. [163] отмечали
кровотечение из язычной артерии при
отделении слизисто-надкостничного
лоскута с внутренней стороны нижней
челюсти. В таких случаях удается взять
сосуд на лигатуру и перевязать его. Бо-
лее сложна ситуация, когда ранение
сосуда происходит во время сверления
кости и перфорации язычной стенки.
Следует попытаться остановить крово-
течение тампонадой гемостатической
губкой, а иногда приходится преры-
вать операцию и решать вопрос о пе-
ревязке язычной артерии наружным
доступом или перевязке магистрально-
го сосуда — наружной сонной артерии.
Для таких операций пациент должен
быть госпитализирован в специализи-
рованное челюстно-лицевое стацио-
нарное отделение.
Необходимо иметь в виду, что воз-
можно кровотечение непосредственно
из губчатого вещества кости. При этом
кость сдавливают с учетом создаваемо-
го костного ложа для имплантата, хотя
предпочтительнее делать повязку из
гемостатической губки на 5—10 мин,
после чего продолжать имплантацию.
Наиболее сильное кровотечение на-
блюдается при остеотомии на дисталь-
ных участках верхней челюсти, когда
костное ложе имплантата упирается в
наружную пластинку крыловидного
отростка клиновидной кости и его дно
находится непосредственно на ней.
Кровотечение артериального типа
связано с повреждением верхнечелю-
стной артерии, кровотечение венозно-
го типа — с ранением крыловидного
венозного сплетения. В обоих случаях
рекомендуются тугая тампонада крово-
точащего участка кости гемостатиче-
ской губкой и продолжение импланта-
ции. Обычно каких-либо осложнений
как при кровотечении из этих сосудов
и их остановке, так и при окончатель-
ном приживлении имплантата не на-
блюдается.
При постановке имплантатов в пе-
редний отдел верхней челюсти в облас-
ти резцов возможно кровотечение из
резцового отверстия. Прежде всего сле-
дует обратить внимание на отслоение
слизисто-надкостничного лоскута с
оральной стороны. Если оно сделано
хорошо, то открытый вход в резцовое
отверстие позволяет коагулировать кро-
воточащий сосуд или тампонировать
его маленькими кусочками гемостати-
ческой губки. После такой процедуры
имплантация может быть продолжена.
Длительное кровотечение при ос-
теотомии может быть связано с нару-
шением процесса свертывания крови
или с заболеванием сердечно-сосуди-
стой системы, а также с приемом ле-
карств, подавляющих функцию обра-
зования протромбина. Медицинская
оценка общего состояния пациента и
сопутствующих заболеваний, а также
целенаправленная подготовка к им-
плантации позволяют предупредить
подобные осложнения. В непредви-
денной ситуации в ходе имплантации и
при выявлении недиагностированных
болезней, обусловивших кровотече-
ние, необходимо сразу прекратить по-
становку имплантатов и срочно иссле-
довать свертывающую и противосвер-
тывающую системы крови (разверну-
тая коагулограмма).
Лечение зависит от полученных ре-
зультатов. При низком содержании
протромбина внутримышечно вводят 1
мл 1 % раствора викасола — аналог ви-
тамина К. Инъекции проводят 1—2
раза в день, а затем назначают его в
таблетках по 0,015 г 2 раза в сутки. При
повышенном уровне фибринолитиче-
ской активности крови назначают эпси-
лон-аминокапроновую кислоту внутрь
по 2—3 г 3—5 раз в сутки или капельно
внутривенно вводят 100 мл 5 % раство-
ра этого препарата. При повышенной
проницаемости сосудистой стенки и
кровотечении, связанном с передози-
ровкой антикоагулянтов, целесообраз-
но назначать внутрь рутин по 0,02—
0,05 г 2—3 раза в сутки. Если кровоте-
чение связано с подъемом давления у
больных гипертонической болезнью,
то следует вводить гипотензивные
средства. Снижение артериального
давления ведет к быстрому прекраще-
нию кровотечения.
Если коагулограмму срочно сделать
нельзя, а кровотечение продолжается,
следует принять экстренные меры к его
остановке. Внутривенно вводят 10 мл
10 % раствора кальция хлорида, или
10 мл 10 % раствора калышя глюкона-
та, или 2—4 мл 5 % раствора аскорби-
новой кислоты. Эффективно внутри-
венное введение 2 мл 12,5 % раствора
дицинона. Он быстро прекращает кро-
вотечение, и в последующие 2—3 дня
его вводят внутримышечно по 2 мл или
дают внутрь в дозе 0,5 г каждые 4—6 ч.
В дальнейшем лечение проводят на ос-
новании показателей коагулограммы
124].
При длительном и обильном крово-
течении следует прекратить импланта-
цию. Рану необходимо зашить наглухо
и больного госпитализировать в такое
лечебное учреждение, где в дополнение
к описанному лечению осуществляют
общую гемостатическую терапию. Хо-
рошее гемостатическое действие ока-
зывают прямое переливание крови и
переливание свежецитратной крови.
7.3. Воспалительные
осложнения при зубной
имплантации
Воспалительные осложнения при зуб-
ной имплантации могут быть ранними,
развиваясь в первые дни после опера-
ции. Они могут длиться от нескольких
дней до 2—3 нед. В ходе функциониро-
вания зубных имплантатов даже через
несколько лет после их постановки так-
же могут возникать воспалительные яв-
ления, которые называются поздними.
Долгое время определенной класси-
фикации воспалительных заболеваний
при зубной имплантации не было раз-
работано. Одни авторы выделяли такие
осложнения, как послеоперационное
нагноение, расхождение швов, образо-
вание гематом, подвижность имплан-
тата после его постановки [9, 10]; дру-
гие отмечали подвижность и потерю
имплантата за счет иммунологическо-
го конфликта [1, 14]; третьи указывали
на развитие прогрессирующей под-
вижности имплантата, называя его
"падающим" [124].
А.И. Матвеева и И.В. Балуда [13]
придают большое значение особенно-
стям кровоснабжения и отмечают па-
циентов группы риска со сниженными
резервными возможностями кровотока,
когда опасность неприживления им-
плантата достаточно высока. В 1987 г.
нами выделены заболевания слизистой
оболочки около шейки имплантата —
гингивит и воспаление костного ложа у
имплантата — периимплантит [23].
В США использовали упрощенную
классификацию осложнений при им-
плантации по их клинической картине.
S. Jovanovic и соавт. [101], A. Kirsch
|Ю8], М. Zablotsky [177] все проблем-
ные имплантаты делят на "заболев-
шие", "отторгающиеся" и "отторгну-
тые".
У "заболевшего" имплантата откло-
нения наблюдаются в прилегающих
мягких тканях. Соединение кости с
имплантатом не нарушено.
"Отторгающимся" имплантатом счи-
тается тот, у которого соединение с ко-
стью частично потеряно. У такого им-
плантата нет подвижности, и его мож-
но использовать без соединения с дру-
гими конструкциями или природными
зубами. Причины заболевания могут
иметь микробиологический или функ-
циональный (окклюзионный, биоме-
ханический) характер. Возможны так-
же их различные сочетания. После уст-
ранения причин патологии приживле-
ние имплантатов, особенно с гидро-
ксиапатитным покрытием, может вос-
становиться.
"Отторгнутыми" считаются имплан-
таты, характеризующиеся клинической
подвижностью и нулевым сопротивле-
нием извлечению их из ложа.
В 1988 г. Американская академия
пародонтологии и в 1993 г. Европей-
ская федерация пародонтологии утвер-
дили классификацию воспалений при
имплантации как болезней тканей во-
круг имплантата. В зависимости от па-
тологоанатомических изменений в
тканях вокруг имплантата различают
воспаление слизистой оболочки, при-
легающей к имплантату, — мукозит, и
одновременное воспаление мягкой и
костной тканей, прилегающих к им-
плантату', — периимплантит.
Ведущими факторами развития вос-
палительных явлений после постанов-
ки имплантатов считаются экзогенная
и эндогенная инфекция, травматичная
остеотомия, в том числе перегрев кос-
ти при сверлении, а также чрезмерная
нагрузка на имплантат при его функ-
ционировании в качестве опор зубных
протезов. Мы различаем ранние воспа-
лительные осложнения после остеото-
мии и поздние воспалительные заболе-
вания имплантата — мукозит и пери-
имплантит [25].
7.3.1. Ранние воспалительные
осложнения
Одной из причин развития воспали-
тельных осложнений является несте-
рильность имплантата изначально или
потеря ее во время операции. Стандар-
тизованная стерильность имплантата,
обеспеченная двойной и хорошо гер-
метизированной упаковкой, позволяет
конструкции взаимодействовать с тка-
нями на микробиологически стериль-
ном фоне. Иногда в ходе остеотомии
аутоинфекция из полости рта прони-
кает в операционную рану, но в таких
случаях концентрация бактерий мала и
аутоинфекция легко инактивируется в
операционной ране.
Второй причиной развития ранних
воспалительных явлений может быть
повреждение кости за счет перегрева
или травматичного воздействия на ее
структуры во время остеотомии [16].
Правильная работа режущими инстру-
ментами в кости обеспечивается каче-
ством боров и дрелей, числом оборотов
бормашины, прерывистыми движения-
ми, а также обязательным наружным
или внутренним охлаждением. Нару-
шение этих правил ведет к усилению
некроза кости: между имплантатом и
костью развивается более значительная
воспалительная инфильтрация.
Послеоперационный отек. Из ранних
воспалительных осложнений наиболее
часто встречаются ограниченный по-
слеоперационный отек и инфильтра-
ция слизисто-надкостничного лоскута.
Воспалительные явления после опера-
ции постановки имплантата могут раз-
виваться, не сопровождаясь расхожде-
нием швов. Эти явления — нормальная
реакция тканей на операционную
травму. Для уменьшения степени вы-
раженности этих явлений следует в
первые сутки после операции перио-
дически применять холод и на 2—3 дня
надевать тугую повязку.
Расхождение швов. Отмечается на
3—10-й день после установления им-
плантата и сопровождается ограничен-
ными воспалительными явлениями на
участке слизисто-надкостничного лос-
кута или разлитым воспалением в бло-
ке тканей у имплантата [9, 10]. Харак-
терны боли на этом участке, воспали-
тельная припухлостьтканей,регионар-
ный лимфаденит. Расхождение швов
может быть связано с одних случаях с
недостаточностью мягких тканей, в
других — с инфицированием раны
[114J. Рекомендуется проведение 2—3
блокад анестетика (0,5 % раствор — 12
мл) с гомеопатическим препаратом
"Траумель" (1—2 мл). Ежедневно необ-
ходимы ванночки с 0,12 % раствором
хлоргексидина.
Гнойное воспаление в области им-
плантатокостного сегмента. Клиниче-
ские проявления зависят от выражен-
ности гнойно-воспалительных измене-
ний. В одних случаях наблюдаются
симптомы, схожие с таковыми при
остром периодонтите: боли в области
имплантата, воспалительные измене-
ния прикрепленной слизистой оболоч-
ки, в связи с чем гнойный экссудат про-
рывает швы и выделяется из глубины
тканей. В других случаях возникает ти-
пичная картина острого гнойного пе-
риостита: выраженный отек околоче-
люстных мягких тканей, регионарный
лимфаденит, образование поднадкост-
ничных гнойников соответственно ко-
стному сегменту, где находится им-
плантат |16, 25].
Подвижность имплантата считается
главным, но не очень точным критери-
ем неудачи имплантации. С. Bussing и
соавт. [49], S. Spolein и R. Stein [158]
отмечали вокруг подвижных, чаще ке-
рамических, имплантатов образование
бессосудистой грануляционной ткани,
а неподвижные имели плотный кон-
такт с костью. М. Newman и J. Fleming
[135] считают главной причиной не
подвижность имплантата, а отсутствие
костной или фиброкостной интегра-
ции. D. Buser и соавт. [65, 66] считали
одноэтапную хирургическую процеду-
ру более безопасной в плане развития
воспаления и демонстрировали успех
более чем в 99 % случаев. Вместе с тем
В. Friberg и соавт. [81] с имплантатами
Branemark в 1,5 % случаев не отметили
костной интеграции. Большинство не-
удач было на верхней челюсти при
адентии и преимущественно с коротки-
ми, до 7 мм длиной, имплантатами.
Воспалительные явления, как правило,
возникали после второго хирургиче-
ского этапа при ортопедическом лече-
нии. Еще более низкие показатели ус-
пеха имплантации и неприживления
конструкции Branemark наблюдал
Т. Jemt [96, 97] — 1,9 %. Автор также
отмечает большое число осложнений
на верхней челюсти. Большинство ис-
следователей считают дезинтеграцию
имплантата и кости чаще проблемой
органного характера [122, 169].
Клинические параметры интеграции
имплантата с костью должны допол-
няться рентгенологическими данными
[60, 85], в том числе результатами ор-
топантомографии и компьютерной то-
мографии. Весьма доказательна диа-
гностика воспаления мягких тканей у
имплантата по данным резонансной
томографии [128]. Следует иметь в ви-
ду факт, отмеченный многими автора-
ми: при здоровом костно-интегриро-
ванном имплантате в течение первого
года потеря кости по высоте составляет
1,5 мм, а впоследствии — по 0,1 мм в
год [26, 42].
Отторжение имплантата может раз-
виваться в течение первых 3 нед после
операции. Его принято относить к
проблемам костной интеграции, когда
становится очевидным, что имплантат
неспособен срастись с костью и быть
опорой протеза. Причина этого чаще
всего заключается в неприятии им-
плантата костью хозяина, но может
сказаться также влияние инфекцион-
ных факторов. Такие причины могут
быть взаимосвязанными и взаимозави-
симыми, поэтому нередко требуется
комплексный подход к их устранению.
Ряд заболеваний и вредных привы-
чек, которые не учтены при оператив-
ном вмешательстве, могут сказаться
отрицательно на процессе приживле-
ния имплантата. К таким системным
заболеваниям относятся остеопороз,
диабет и др. (см. главу 4), а к вредным
привычкам — курение и злоупотребле-
ние алкоголем. На регенерацию кости
может влиять предрасположенность к
стрессам, а также ряд, казалось бы,
безвредных для зубной имплантации
лекарств (принимаемые внутрь кон-
трацептивы, кортикостероиды или ан-
тикоагуляционные препараты).
Первым признаком неудачной кост-
ной регенерации и отторжения им-
плантата независимо от того, погруж-
ной он или непогружной, служит его
подвижность, которая, как правило,
связана с потерей контактирующей с
ним кости. Прогрессирующая подвиж-
ность имплантата и воспалительные
явления в прилежащих мягких тканях с
вестибулярной и оральной стороны
(иногда с образованием поднадкост-
ничных гнойников) характеризуют не-
приживление имплантата. На рентге-
новских снимках в том месте, где по-
верхность имплантата должна контак-
тировать с костью, наблюдается про-
светление, свидетельствующее о нали-
чии там слоя мягкой ткани и отсутст-
вии прямого контакта с костью. При
столь явных признаках отторжения
имплантат подлежит удалению.
Микробиологические исследова-
ния, проведенные нами у пациентов с
ранними и умеренно выраженными
симптомами воспаления после им-
плантации, установили, что преобла-
дающей флорой были облигатно-ана-
эробные (56 %) и микроаэрофильные
(5 и 6 %) бактерии. Самую большую
группу микробов составляли Peptoshep-
tococcus, Peptococcus, Р. melaninogeni-
са, Streptococcus, Staphylococcus, а из
микроаэрофильных — Staphylococcus
epide rmid is.
Нами отмечено увеличение количе-
ства факультативно-анаэробных и
аэробных бактерий при выраженном
гнойном воспалении, развившемся в
ранние сроки после установления им-
плантата. I. Safer и соавт. [150] придают
большое значение в развитии воспале-
ния у имплантата актиномицетам и ак-
тинобациллам и рекомендуют увели-
чивать продолжительность курса анти-
бактериальной терапии.
Разлитые воспалительные явления в
области поставленного имплантата мо-
гут сопровождаться образованием оте-
ка, инфильтрацией слизистой оболочки
и надкостницы по обе стороны альвео-
лярного отростка, что напоминает кли-
ническую картину острого остеомиели-
та челюсти [25]. Общие симптомы (по-
вышение температуры тела, недомога-
ние, потеря аппетита, нарушение сна)
выражены незначительно. Имплантат
становится подвижным, перкуссия его
болезненная, из имплантато-десневого
кармана выделяется гной. Если после
проведения противовоспалительных
лечебных мероприятий воспаление не
ликвидируется, приходится имплантат
удалять. После удаления имплантата
воспалительные явления быстро стиха-
ют. В дальнейшем деструктивные изме-
нения вокруг ложа имплантата, образо-
вание секвестров в наших наблюдениях
не обнаруживались [25J.
Лечение ранних воспалительных ос-
ложнений заключается в проведении
4—6 блокад анестетика и "Траумеля"
или линкомицина, антисептической
обработке тканей раствором хлоргек-
сидина и его производных (корсодил,
элюдрин), применении лечебных по-
вязок с рассасывающими мазями,
УФО, магнитной терапии и антибио-
тикотерапии в течение 2—3 нед [29],
полосканий. Прием антибиотиков
продолжать до 14—21 дня с добавлени-
ем препаратов нитазола. Эффективны
инфракрасный лазер, сеансы гиперба-
рической оксигенации [25].
Если перечисленные воспалитель-
ные явления в раннем послеопераци-
онном периоде при установлении по-
гружных имплантата чаше связаны с
нарушением правил остеотомии, то
при непогружных имплантатах может
иметь место постоянное инфицирова-
ние из полости рта, так как их надаль-
веолярная часть выступает в нее, хотя
D. Buser и соавт. (64] не нашли под-
тверждения этому положению. При
развитии воспалительных явлений в
слизистой оболочке пришеечной части
непогружного имплантата заболевание
приобретает хронический характер.
Процесс локализуется в десне у им-
плантата и протекает по типу мукозита.
Если не провести сразу же лечебные
мероприятия, то воспаление будет
прогрессировать, в том числе появля-
ется резорбция кости по периметру
имплантата и развивается псриим-
плантит, который может привести к
его отторжению. S. Dougnerty ]72],
S. Dougnerty и R. Simmons [73] счита-
ют, что при всех указанных воспали-
тельных явлениях необходимо удалить
имплантат.
О прогнозе лечения воспалительных
явлений на ранней стадии приживле-
ния имплантатов высказываются раз-
личные мнения. S. Dougnerty [72],
S. Dougnerty и R. Simmns [73] безогово-
рочно считают, что при всех указанных
выше воспалительных явлениях им-
плантат необходимо удалять. Н. Bosker
и R. Jordan (1991), 13 лет наблюдавшие
за 1356 имплантатами, только у 11 из
них отметили ранние воспалительные
явления, в связи с чем их пришлось
удалить.
7.3.2. Отдаленные воспалительные
осложнения
Отдаленными воспалительными ос-
ложнениями при зубной имплантации
принято считать такие процессы, кото-
рые проявляются уже посте того, как
процесс остеоинтеграции успешно за-
кончился. Такие осложнения могут воз-
никнуть в силу биомеханических, ин-
фекционных причин или их сочетаний.
Поражение тканей вокруг имплан-
тата проявляется в основном прогрес-
сирующей потерей кости и увеличени-
ем глубины десневого кармана. После
имплантации атрофия кости неизбеж-
на, и ее первичная потеря вокруг им-
плантата связана не с бактериями, а
прежде всего с излишней или недоста-
точной нагрузкой на еще не созрев-
шую, полностью не минерализовав-
шуюся кость. Многолетние наблюде-
ния показали, что в норме за первый
год после операции потеря кости долж-
на быть в пределах до 1,5 мм, а затем за-
медлиться и составлять 0,1 мм каждый
последующий год. Следует отметить,
что у имплантатов системы Branemark
резорбция наблюдается только по го-
ризонтали, тогда как при использова-
нии других систем ее отмечают и по
вертикали. Аргументированное объяс-
нение этой разницы пока не дано.
В университете Питсбурга (США)
был проведен анализ информации о
приживаемости зубных имплантатов,
полученной от зубоврачебной службы
Управления по делам ветеранов США
за 1985—1990 гт. Установлено, что
главными факторами приживления
имплантата являются состояние здоро-
вья пациента и техника проведения
операции. Развитие периимплантита и
потеря имплантата зависят от состоя-
ния мягких тканей вокруг имплантата,
конструкции его поверхности, в том
числе его покрытия. В немалой степени
успех имплантации обусловливается
опытом хирурга. Большое значение
придается такому отрицательному фак-
тору, как курение.
По мнению большинства исследова-
телей, есть основание полагать, что при-
рода заболеваний пародонта и тканей
вокруг имплантатов одинакова. R. James
[93, 94, 95] и R. Meffert [125] в десневых
карманах вокруг зубов и имплантатов
обнаружили одинаковые грамотрина-
тельные патогенные микроорганизмы,
однако ряд авторов исключают воз-
можность заражения периимплантат-
ных тканей от соседних естественных
зубов (84].
Этнология и патогенез. Причин вос-
паления в области имплантата не-
сколько: 1) эндогенная и экзогенная
инфекция; 2) плохое качество кости,
которая неспособна быть опорой для
имплантата (например, IV тип кости в
дистальных отделах челюстей, особен-
но при плохой гигиене); 3) проблемы с
мягкими тканями: в одних случаях не-
достаточность их прикрепления к им-
плантату, в других — слишком боль-
шая подвижность; 4) большие окклю-
зионные перегрузки, в том числе из-за
неправильной конструкции протеза,
нарушения соединения имплантатов с
супраструктурой. Окклюзионным пе-
регрузкам многие авторы придают
большее значение, нежели микробно-
му фактору [8, 14, 31, 91].
Инфекционными факторами может
быть изначально попавшая инфекция —
не стерильность имплантата, потеря ее
во время операции с нестерильных ин-
струментов, особенно боров, фрез, и
попадание микроорганизмов из полос-
ти рта. Надежной профилактикой та-
кого инфицирования является стери-
лизация с лазерной обработкой им-
плантатов особенно с титановым или
гидроксиапатитны.м покрытием.
Развитие воспаления во многом за-
висит от гигиены полости рта, наличия
очагов одонтогенной инфекции (рис.
Иными словами, источником ин-
фекции является аутофлора полости
рта. J. Мауо и соавт. [121] считают, что
как здоровым зубам, так и импланта-
там приходится одинаково функцио-
нировать в среде, где имеются разно-
образные как по числу, так и по виду
микроорганизмы. Среди них могут
быть и патогенные, возможен также
переход сапрофитирующих в патоген-
ные формы. Многие ученые придают
большое значение так называемому
замку между имплантатом и полостью
рта [20, 21], 48, 55].
Если механизм "замка" слизистая
Рис. 7.1. Развитие воспаления у имплан-
тата [Spikermann Н. et al., 1995].
а — входные ворота инфекции; 6 — воспале-
ние имплантато-десневого соединения; в —
развитие воспаления в прилежащей к имплан-
ту кости.
оболочка — имплантат не нарушен, то
стерильность контактной зоны им-
плантата и кости сохраняется, ткани не
инфицируются (см. рис. 7.1, б). В дру-
гих случаях микроорганизмы проника-
ют в зону слизистая оболочка — им-
плантат, контакт имплантата и мягких
тканей нарушается и развивается про-
цесс воспаления. Именно при недоста-
точной плотности "замка" инфекция из
полости рта беспрепятственно попадает
в зону контакта кости и имплантата
(см. рис. 7.1, в). При костном срашении
количество микробов, разнообразие их
видов были более стабильными, чем у
имплантатов с фиброинтеграцией.
J. Stub и соавт. [162] не отметили
разницы в прикреплении мягких тка-
ней около костно-интегрированных
имплантатов как в эксперименте на со-
баках, так и в клинической практике.
L. Silverstein и соавт. [155] подчерки-
вают, что от адаптации мягких тканей
к опорной головке имплантата, в том
числе от степени прикрепления, зави-
сит первая линия защиты от развития
периимплантита и соответственно от
последующей потери кости. J. Stub и
соавт. [162] придают большое значение
ширине и высоте прикрепленных мяг-
ких тканей. Учитывая это, следует
иметь в виду необходимость наращива-
ния мягких тканей вокруг имплантатов
для создания надежного "замка" [161].
U. Lekholm и соавт. [115], Р. Apse и
соавт. [41], J. Мауо и соавт. ] 121], как
и многие другие исследователи и кли-
ницисты, определили главные взаимо-
отношения микрофлоры полости рта и
поставленных имплантатов. По дан-
ным Т. Rams и Jr. Link [145], М. New-
man и Т. Fleming [135] и др., в ближай-
шие недели после постановки имплан-
татов в наддесневой бляшке обнаружи-
ваются грамположительные кокки, а в
поддесневой среде — актиномицеты,
лептострептококки, вайлонелла и дру-
гие бактерии, характерные для обыч-
ной флоры полости рта, в том числе
десневых карманов. Иными словами, у
имплантата изначально содержится ес-
тественная флора ротовой полости.
При частичной адентии микрофлора
вокруг имплантатов, в том числе с гид-
роксиапатитным покрытием, идентич-
на микрофлоре оставшихся здоровых
зубов [76]. Однако микрофлора им-
плантатов, поставленных в беззубую
челюсть, отличается от таковой им-
плантатов, поставленных при частич-
ной адентии, так как около них нет па-
тогенных микробов, свойственных
природным зубам [133]. Поэтому счи-
тается, что во всех случаях микрофлора
вокруг имплантатов в основном одина-
кова с микрофлорой полости рта 1142,
143], но в ней всегда присутствуют та-
кие "классические" для внутрикостных
имплантатов патогенные формы, как
S. aureus и Pseudomonas aeruginosa [34,
35]. J. Safer и соавт. [150] придавали
большое значение в развитии воспале-
ния у имплантата актиномицетам и ак-
тинобациллам. На надальвеолярной
части имплантатов колонии микроор-
ганизмов идентичны тем, которые об-
разуются на природных зубах [131].
Одинакова не только их видовая при-
надлежность, но и механизмы образо-
вания. В связи с этим развитие воспа-
ления по периметру имплантата, кото-
рое чаще называют периимплантитом,
имеет тот же патогенез, что и пародон-
тит. Как и при других видах одонтоген-
ного воспаления, важным фактором
является адгезия бактерий, при кото-
рой образуются кратковременные сла-
бые связи. Помимо адгезии в ротовой
полости, непосредственно в слюне
развиваются специфические взаимо-
действия, которые ведут к слипанию
бактерий. Наблюдаются также неспе-
цифические взаимодействия бактерий,
например рецепторная адгезия у стреп-
тококков. По мнению A. Weerkamp и
соавт. [170], адгезивными веществами
являются специфические протеины.
Бактерии обладают избирательной
способностью находиться в различных
тканях полости рта. Отмечая идентич-
ность микрофлоры имплантатов и
природных зубов, С. Sordyl и соавт.
1156] указывают, что в коронковой час-
ти интегрированных имплантатов мик-
рофлора главным образом грампози-
тивная, а грамнегативные образцы вы-
являются в меньшем количестве.
При развитии воспалительных явле-
ний около имплантата характеристика
микрофлоры соответствует таковой
при обострении пародонтита.
Развитие воспаления по периметру
имплантата может быть связано с уров-
нем гигиены и прежде всего с образо-
ванием зубной бляшки [65, 93, 152,
160], а также с неспецифическими и
специфическими реакциями, возни-
кающими под воздействием антиген-
ных субстанций микробных ассоциа-
ций зубной бляшки. При оценке дей-
ствия зубной бляшки следует иметь в
виду микробную нагрузку на ткани у
имплантата 1103].
По мнению A. Weerkamp и соавт.
[170], для образования зубной бляшки
большое значение имеет характер по-
верхности имплантатов. Эти авторы в
эксперименте отмечали, что на шеро-
ховатой поверхности колонии бакте-
рий образуются в 2 раза больше, чем на
гладкой. R. Adell и соавт. [38] устано-
вили более медленное образование зуб-
ной бляшки около шейки с высокой
степенью полировки. Одной из кон-
цептуальных особенностей импланта-
тов в форме корня зуба является хоро-
шо отполированная шейка. Вместе с
тем на поверхности любого материала
бляшки образуются уже через 4 ч, и сре-
ди выделенных микробов преобладают
стрептококковые виды, а через 48 ч
число анаэробов увеличивается. Эти
данные позволили G. Nakazato и соавт.
[ 134] предположить, что образующиеся
микробные ассоциации влияют на
раннюю регенерацию сращения кости,
но не влияют на бактериальную флору
или полное созревание бляшек.
Кроме того, по мнению R. James
[93], G. Dohm и соавт. [74], S. Jovanovic
и соавт. [102], в воспалительных про-
цессах вокруг имплантатов важную
роль играет наличие микрофлоры есте-
ственных зубов с гингивитом и паро-
донтитом. Эти авторы полагают, что
при гингивите и пародонтите бактери-
альная флора может "заражать" им-
плантаты. Наблюдения показали, что в
таких случаях в тканях по периметру
имплантата создаются колонии микро-
организмов, характерные для пародон-
тита [4]. Если активный процесс в па-
родонте отмечен до начала импланта-
ции, то ее не следует производить до
его излечения и стабилизации тканей.
Именно поэтому D. van Steenberghe
[169] считает пародонтальную пробле-
му основной при остеоинтегрировании
имплантатов.
R. Brandes и соавт. [60] установили,
что наложение лигатуры на слизистую
оболочку около имплантата приводит
к периимплантиту. Однако степень по-
тери кости меньше, чем у здоровых зу-
бов [154, 166]. Это имеет принципи-
альное значение для оценки микроб-
ной нагрузки у имплантата и развития
заболевания.
Большое значение для развития вос-
палительного процесса в области ин-
тегрированного имплантата имеют ад-
гезия бактерий и образование зубной
бляшки на его супраструктуре [162,
138, 171, 176], причем чем выше их по-
лировка, тем меньше степень колони-
зации бактерий [59].
На микробный пейзаж могут влиять
и другие факторы, в частности сниже-
ние барьерной функции пародонта у
курильщиков [139], хотя, изучая при-
чины отрицательного влияния курения
на приживление имплантатов, Н. Рге-
Ьег и соавт. [139] не выявили у 82 ку-
рильщиков и 62 некурящих больших
различий в типах и количестве пато-
генных бактерий и преимущественно
выделились Actinobacillus, Actinoinyce-
tetes comitans, Bacteroides gingivalis, Bac-
teroides intermedius. По их мнению,
разница заключается скорее в защит-
ной способности организма. По-види-
мому, курение делает ткани пародонта
более подверженными воздействию
микроорганизмов.
Многочисленные исследования мик-
рофлоры при заболеваниях тканей во-
круг имплантата показали, что среди
обычной микрофлоры по мере развития
воспаления увеличивается число тре-
понем, грамотрицательных анаэроб-
ных бактерий. Из факультативных бак-
терий преобладает альфа-стрептокок-
ковая флора и, как правило, возрастает
количество актиномицетов. Это сви-
детельствует о незрелости зубных бля-
шек [35, 51].
В динамике приживления имплан-
татов в десневых карманах глубиной
более 1—3 мм среди микробов увели-
чивалось число грамотрицательной и
анаэробной микрофлоры, в том числе
обнаруживались окрашенные черным
пигментом бактероиды, фузобактерии
и вибрионы. Именно с этими бакте-
риями М. Newman и Т. Fleming [135],
Н. Preber и соавт. [139] связывают раз-
витие воспаления около имплантатов.
Их обнаружение должно быть основа-
нием для лечения. Это свидетельствует
о важности клинико-микробиологиче-
ской диагностики при имплантации,
тем более что установлена четкая кор-
реляции клинических и микробиоло-
гических показателей. Наиболее де-
монстративны результаты исследова-
ния жидкости десневой борозды и зуб-
ной бляшки [112, 113, 136], а также
электронно-микроскопические дан-
ные (144]. Однако не исключено попа-
дание на участок зубочелюстного сег-
мента, где находится имплантат, мик-
рофлоры от других зубов, в связи с чем
как до, так и после имплантации необ-
ходимы лечение пародонтита и дости-
жение хорошей гигиены полости рта.
Вторым фактором развития воспа-
ления по периметру имплантата явля-
ется нагрузка на имплантат или им-
530
плантаты, на которые опирается зуб-
ной протез (преждевременная нагруз-
ка, неправильно выбранная конструк-
ция зубного протеза, недостатки в вы-
боре супраструктуры или ее элементов,
в том числе в креплении протезов, и
др.). Многие авторы придают большое
значение способу крепления зубного
протеза с супраструктурой имплантата,
а также включению зубов вместе с им-
плантатами как опор ортопедических
конструкций [76, 162, 171, 176]. Стрес-
су кости в связи с неадекватной на-
грузкой придает большое значение
С. Misch [130], но такой критерий, как
образование кармана, он не считает
решающим. Оно, по его мнению, свя-
зано с биологической шириной кости,
что предотвращает ее атрофию, а ре-
шающим фактором является нагрузка
на кость.
Часто биомеханическими причина-
ми отдаленных осложнений могут быть
также недостатки в конструкции про-
тезов и в их подгонке к имплантатам,
которые служат им опорой. Точность
подгонки протеза к опорным головкам
имплантатов должна быть выше, чем
протезов, опирающихся на природные
зубы, так как имплантаты не имеют ва-
лика периодонтальной связки, которая
могла бы в определенной степени ком-
пенсировать окклюзионные ошибки. В
связи с этим большое значение имеет
способ крепления зубного протеза с
супраструктурой. Осложнение может
возникнуть и при слишком большой
нагрузке на имплантат. Причина пере-
грузки может заключаться не только в
конструкции протеза, но и в состоянии
кости, в неправильном определении
оптимального для конкретной ситуа-
ции количества имплантатов, поэтому
они не способны адекватно передавать
кости нагрузку. В результате при функ-
ционировании может начаться раска-
чивание имплантатов, которое может
привести к их опасной подвижности.
Правда, опасность такой подвижно-
сти, как отмечает С. Misch [130], отно-
сительна. Так, подвижность одиночно-
го имплантата в 0,5 мм менее опасна,
чем подвижность в 0,2 мм конструкции
постоянного зубного протеза, опираю-
щегося на 12 имплантатов.
Кроме того, в щели между краем
зубного протеза, особенно несъемного,
и гребнем альвеолы, межзубных и дру-
гих пространствах могут скапливаться
зубные бляшки, остатки пищи. Если
протезная конструкция не позволяет
поддерживать там должную гигиену, то
может возникнуть опасная ситуация
для имплантата.
По мнению R. Yukna [174, 175], пре-
жде всего на биомеханическую пере-
грузку влияет состояние кости. С од-
ной стороны, адекватная фиксация
имплантата в значительной степени за-
висит от качества кости. Из-за природ-
ных, нередко возрастных, качеств кос-
ти не происходит хорошая интеграция
с имплантатом. По мнению J. Kent и
соавт. [106], чем более стабилен им-
плантат и чем больше выражена его
интеграция с костью, тем меньше ве-
роятность развития инфекции [122]. С
другой стороны, имплантаты, получая
нагрузку, по многим причинам (число
имплантатов, конструкция протеза,
окклюзивные соотношения и др.) не
могут адекватно передать ее кости.
Проблемы возникают также в ходе
функционирования имплантатов в
связи с ослаблением крепящих винтов,
вращением опорных головок и неудач-
ной эстетикой [61]. По мнению В. Ran-
ge! и соавт. [146], перегрузка имплан-
татов может быть обусловлена также
расположением имплантата на дис-
тальных участках челюстей. Являясь
опорой зубного протеза, он претерпе-
вает наклонные нагрузки. По данным
этих авторов, 77 % протезов опирались
на 1—2 имплантата и такая нагрузка
должна относиться к группе повышен-
ного риска в связи с наклонными пе-
регрузками. Однако при устранении
таких перегрузок в ходе лечения опас-
ность переломов значительно умень-
шается.
Ихтишняя или ранняя нагрузка ве-
дет к микродвижениям имплантата и
образованию в месте его контакта с ко-
стью пустот, размер которых зависит
от величины нагрузки. Однако только
по этой причине воспалительные про-
цессы возникают редко. Прогресси-
рующая же потеря кости происходит
под воздействием последующих бакте-
риальных факторов [132, 151]. Веду-
тую роль в инфицировании играют
анаэробные .микроорганизмы.
Клиническая картина воспалитель-
ных заболеваний в области функциони-
рующего имплантата. Клиническими
признаками заболевания имплантата
М. Newman и Т. Fleming 1135J считают
степень прикрепления десны, ширину
и высоту уплотненной десны.
Для здоровых тканей вокруг им-
плантата характерен нормальный цвет
слизистой оболочки около его шейки
или супраструктуры. Признаком здо-
ровья тканей является зона десневой
ткани вокруг зубов шириной 2 мм и в
месте ее прикрепления к имплантату —
I мм [111].
Зондирование следует производить
при минимальном погружении инст-
рументов (не более 4 мм). Обязатель-
ным условием является отсутствие
кровоточивости при зондировании.
Кроме того, при пальпации имплантат
должен быть стабилен, а перкуссия как
в горизонтальном, так и в вертикаль-
ном направлении — безболезненна. По
мнению W. Becker и соавт. [50], D. Bar-
ber и соавт. [47], именно этими пара-
метрами характеризуются здоровые
имплантаты. Эти характеристики ис-
пользуются и при оценке состояния
пародонта [4].
В начале развития воспалительных
явлений могут появиться неприятные
ощущения в десне в области имплан-
тата, кровоточивость этого участка при
чистке зубов или гигиенических про-
цедурах, а также неприятный запах изо
рта. Эти симптомы характерны как для
мукозита, так и периимплантита.
Мукозит. Характерно появление бо-
лей. Слизистая оболочка вокруг шейки
или супраструктуры имплантата отеч-
ная, гиперемированная. При зондиро-
вании возникает кровотечение, может
выделяться в небольшом количестве
серозно-гнойный экссудат. Однако
зонд погружается неглубоко, опреде-
ляя нормальную величину десневого
кармана. На рентгенограмме патологи-
ческих изменений в окружности им-
плантата не отмечено. По мнению
многих клиницистов, тонкая слизи-
стая оболочка больше подвержена раз-
витию мукозита. D. Gammage и соавт.
[82], К. Gotofresen и соавт. [86] полага-
ют, что плотная и кератинизированная
слизистая оболочка вокруг имплантата
менее подвержена воспалению.
Мукозит может развиваться при низ-
ком индексе гигиены около опорной
головки имплантата (рис. 7.2). В таких
случаях возникает гиперплазия десны,
т.е. избыточный рост слизистой обо-
лочки. При тщательном уходе и адек-
ватной гигиене J. Kennedy и соавт. 1105]
считают такой процесс обратимым.
Поражение мягких тканей окаю им-
плантата считается наибатее серьезной
проблемой, в значительной мере влияю-
щей на долгосрочный успех импланта-
ции. Однако имеется и другое мнение:
поражение мягких тканей легко подда-
ется лечению и мало влияет на им-
плантат.
Лечение мукозита осуществляют так
же, как начальных форм заболеваний
пародонта. При остром и хроническом
течении заболевания лечение начина-
ют с гигиенических мероприятий: уда-
ляют зубной налет, обрабатывают дес-
невой карман 1 % раствором перекиси
водорода и 0,06 % или 0,12 % раство-
ром хлоргексидина (рис. 7.3). Прово-
дят блокаду анестетиком (5—10 мл 0,5
% раствора лидокаина) и "Траумелем”
или линкомицино.м по типу инфильт-
рационной анестезии. Хорошее дейст-
вие оказывает солкосерилдентальная
адгезивная паста [22]. Одновременно
обращают внимание на гигиеническое
состояние полости рта и обучают па-
циента правильной чистке зубов.
Периимплантит. Патологоанатоми-
ческая картина воспалительных изме-
нений мягких и костных тканей вокруг
имплантата имеет большое сходство с
таковой при пародонтите. Опорные
ткани зуба и имплантата близки друг к
другу, однако вокруг имплантата го-
раздо меньше слоев клеток [55, 64, 66].
Кроме того, коллагеновые волокна, со-
единяющие цемент естественного зуба
с надкостницей альвеолы, идут пер-
пендикулярно, а около имплантата их
значительно меньше, они располага-
ются в коронарной части и отличаются
малоразвитой сосудистой сетью.
S. Jovanovic и соавт. [102] при срав-
нительном микробиологическом, гис-
тологическом, клиническом и рентге-
нологическом изучении тканей вокруг
имплантата установили, что воздейст-
вие зубной бляшки на подэпителиаль-
ную ткань около имплантата ведет к ее
воспалению. Начальные типичные для
воспаления изменения сменяются изъ-
язвлением тканей и постепенным ос-
лаблением их прикрепления. Иначе
говоря, "замок", отделяющий надаль-
веолярную часть имплантата от внут-
рикостной, разрушается, поэтому ин-
фекция по периметру имплантата мо-
жет проникать вплоть до апикальной
его части.
Т. Berglundh и соавт. [56], сравнивая
этот процесс с заболеваниями паро-
донта естественных зубов, отметили,
что около имплантатов количество
воспаленной грануляционной ткани
значительно больше. В результате ак-
тивных воспалительных изменений в
мягких тканях, прилегающих к им-
плантату, развивается остеопластиче-
ская резорбция кости. J. Lindhe и со-
авт. [120] на экспериментальной моде-
ли выявили также изменения в близле-
жащих к имплантату костномозговых
пространствах и костном мозге. Как в
эксперименте 1120], так и в клиниче-
ской практике [101, 102] процессы ат-
рофии кости более выражены около
имплантатов с гидроксиапатитным по-
крытием, чем без такого покрытия.
Вместе с тем, как указывают С. Bussing
и соавт. [49], Е. Sporlein и R. Stein
[158], периимплантит чаше наблюдал-
ся при использовании керамических
имплантатов Тюбингера.
Периимплантит может начинаться и
иметь такие же симптомы, что и муко-
зит. Периимплантит чаще возникает
при поражении мягких тканей около
имплантата [96]. Однако при зондирова-
нии инструмент погружается глубже до-
пустимого уровня. По мнению D. Gam-
mage и соавт. [82], D. Buser и соавт.
[65], нужно обращать внимание на воз-
растающее с каждым посещением па-
циента погружение зонда, считая это
важным признаком разрушения "связ-
ки-замка". R. Brandes [60] указывает на
бесспорное в таких случаях разруше-
ние кости. При зондировании болез-
ненной, отечной слизистой оболочки
обнаруживаются кровотечение из уже
достаточно глубокого десневого кар-
мана и детрит зубной бляшки под мяг-
Рис. 7.2. Мукозит.
Рис. 7.3. Результаты лечения мукозита,
а — до лечения; б — после лечения.
S.33
a
Рис. 7.4. Развитие
периимплантита
[Spikermann Н.
et al., 1995).
а — разрушение им-
плантато-десневого
соединения и пути
внедрения инфек-
ции; б — вертикаль-
ная и горизонталь-
ная резорбция кости.
б
кими тканями, который легко выдав-
ливается наружу. Кроме того, часто на-
блюдаются серозно-гной ное отделяе-
мое из кармана и образование грануля-
ций по периметру имплантата. Такую
же клиническую картину отметили
специалисты и в эксперименте [66].
Все эти признаки периимплантита
наблюдаются при его хроническом те-
чении. Иногда воспалительные явле-
ния в области имплантата протекают
медленно и бессимптомно, боли или
дискомфорт в области имплантата не
отмечаются. При объективном иссле-
довании обнаруживается, что ин-
фильтрация слизистой оболочки в ок-
ружности имплантата и ее гиперемия
выражены незначительно. Результаты
зондирования десневого кармана мо-
гут указывать на незначительное или
большое увеличение; выделения из не-
го скудные. Иногда периимплантит ха-
рактеризуется более активным течени-
ем с развитием поднадкостничных или
поддесневых гнойных очагов [28].
Развитие периимплантита может на-
растать по мере функционирования
имплантата и ношения зубных проте-
зов [38, 39, 98, 173].
Важными клиническими симптома-
ми являются рецессия слизистой обо-
лочки и обнажение шейки имплантата.
Характерная картина изменений
выявляется при зондировании: глуби-
на погружения пародонтального зонда,
отмечаемая по его делениям, более
5 мм, на разных участках вокруг им-
плантата по горизонтали и по вертика-
ли кость отсутствует. О потере кости
или сохранности участков кортикаль-
ного вещества кости как с вестибуляр-
ной, так и с язычной или небной сто-
роны можно судить по глубине погру-
жения зонда.
Объективные данные зондирования
подтверждаются при рентгенологиче-
ском исследовании. Оценивая его ре-
зультаты, следует учитывать, что после
постановки имплантата потеря кости в
первый год обычно составляет 1,49—
1,5 мм, а в дальнейшем атрофия ее зна-
чительно замедляется. Если же рентге-
нограмма свидетельствует о выражен-
ных в количественном и качественном
отношении резорбтивных процессах в
кости, то заболевание имплантата оче-
видно и положительный долгосрочный
функциональный прогноз затруднен.
Согласно Американской и Европей-
ской классификациям, разработанным
пародонтологами, рентгенологически
выявляются следующие четыре харак-
теристики признаков периимплантита:
1) умеренная потеря кости по горизон-
тали и минимальная по вертикали;
2) умеренная или значительная потеря
кости по горизонтали и минимальная
по вертикали; 3) минимальная или
умеренная потеря кости по горизонта-
ли и значительная по вертикали; часто
можно наблюдать симметричную атро-
фию кости вокруг имплантата; 4) зна-
чительная потеря кости по вертикали и
малая по горизонтали. Нередко корти-
кальное вещество кости с вестибуляр-
ной и оральной стороны альвеолярной
дуги на месте имплантата полностью
резорбировано (рис. 7.4).
Рис. 7.5. Рентгенологическая картина периимплантита.
О резорбции кости можно получить
представление при анализе прицельных
рентгено-, зоно- и ортопантомограмм
(рис. 7.5). Самые достоверные количе-
ственные, качественные и анатомиче-
ские характеристики резорбции позво-
ляет получить компьютерная томогра-
фия. Однако рентгенологические дан-
ные не коррелируют с такими показате-
лями, как индекс зубной бляшки, ин-
декс кровотечения из десневой бороз-
ды, глубина зондирования, кератинизи-
рованная слизистая оболочка, и резуль-
татами периотеста. По данным A. Beh-
neke и соавт. [53], реально динамика
потери кости отражалась только на ко-
личестве жидкости в десневой борозде.
Это послужило развитию диагности-
ческих методов по оценке интеграции
имплантата в кости [136, 157].
Заключение на основании зондиро-
вания и рентгенограмм в определен-
ной степени носит субъективный ха-
рактер, поэтому результаты могут быть
разными. Чтобы дать объективную
оценку нарастания резорбции кости,
можно при рентгенографии винтовых
имплантатов использовать в качестве
маркеров вершины ребер их резьбы.
Они хорошо видны на рентгенограм-
ме, расстояние между ними обычно со-
ставляет 0,6 мм. При необходимости
это расстояние, называемое шагом
резьбы, может быть легко проверено
перед постановкой имплантата. Еже-
годное наблюдение за обнажением
резьбы по вершинам ее витков позво-
ляет установить истинную скорость ре-
зорбции кости. В то же время, по мне-
нию С. Misch [130], определить успех
или неудачу по степени резорбции кос-
ти невозможно, поскольку только то-
гда, когда без контакта с костью ока-
жется половина длины имплантата,
следует считать, что риск полной не-
удачи очевиден и отторжение имплан-
тата неизбежно. Е. Rosenberg и М. Perel
[149] главное различие между "оттор-
гающимися" и "отторгнутыми" им-
плантатами видят в клинической мо-
бильности, поскольку рентгенографи-
чески потерю кости регистрируют у то-
го и другого, а зондирование обоих
достаточно глубокое и может сопрово-
ждаться кровотечением или гнойными
выделениями.
Морфологические исследования при
периимплантите характеризуются по-
гружным ростом эпителия, развитием
грануляционной ткани с большим ко-
личеством лимфоидных и плазматиче-
ских клеток, замещающей резорбиро-
ванные участки кости с участием остео-
кластов. Воспалительные изменения по
периметру имплантата могут распро-
страняться на губчатое вещество кости,
вплоть до надкостницы, покрывающей
имплантато-десневой сегмент [43].
При диагностике периимплантита
большое значение имеет характеристи-
ка микробной флоры. На основании
данных клинического обследования,
подтвержденных микробиологически-
ми характеристиками выделенных мик-
робов, можно объективно судить о со-
стоянии имплантата [51]. При исследо-
вании более 40 образцов выделенных
ассоциаций микробов отмечена четкая
закономерность между клинической
картиной "отторжения" имплантата и
присутствием патогенных видов мик-
робов. Для диагностики псриимплан-
тита достаточно объективным методом
является периотест [87]. В норме пока-
затели периотеста равны в среднем
1,74. Электронный прибор, используе-
мый при проведении периотеста, дает
возможность объективно оценивать
патологические реакции периодонта, в
том числе тканевый "замок" около им-
плантата [164, 172].
Существуют и другие методы диаг-
ностики периимплантита: определение
содержания глюкозаминогликанов,
которое повышается при патологиче-
ском процессе около имплантата, со-
провождающемся атрофией кости
[112, 113], показателей перекисного
окисления липидов, содержания фос-
фатидилинозитов в крови [7, 30], гис-
тограммный анализ [19].
Лечение периимплантита осуществ-
ляют так же, как при начальных фор-
мах заболеваний пародонта. При экс-
периментальном обосновании лечения
периимплантита 1. Ericssonet и соавт.
[78] показали, что главными являются
лечение тканей и некротомия у им-
плантата и постоянная гигиена около
него. В результате такого лечения лик-
видируется периимплантит, уменьша-
ется выраженность атрофии кости.
Местную терапию, по мнению авто-
ров, следует дополнять лечением анти-
биотиками, в том числе амоксилином
и метронидазолом. Антибиотикотера-
пию и местное лечение повторяют в за-
висимости от клинических проявле-
ний воспаления около имплантата.
Многие специалисты рекомендуют
при остром и хроническом течении за-
болевания начинать лечение с гигие-
нических мероприятий: удаляют зуб-
ной налет, обрабатывают десневой
карман 1 % раствором перекиси водо-
рода и 0,06—0,12 % раствором хлоргек-
сидина. Обращают внимание на гигие-
ническое состояние полости рта и обу-
чают пациента правильной чистке зу-
бов. Проводят блокаду анестетиком
(5—10 мл 0,5 % раствора лидокаина),
"Траумелем" или линкомицином по
типу инфильтрационной анестезии че-
рез день 5—6 раз. При помощи пласти-
кового инструмента удаляют зубной
налет в окружности имплантата, а так-
же зубной налет и камень с супраст-
руктуры имплантата.
По завершении всех процедур про-
изводят аппликации лекарственных
веществ, в том числе грамицидина, на
имплантат и окружающие его ткани,
накладывают лечебные повязки с 3 %
мазью ацетилсалициловой кислоты
или 5 % бутадионовой мазью, делают
ванночки с раствором хлоргексидина и
его производных, назначают общее ле-
чение десенсибилизирующими, обез-
боливающими и общеукрепляющими
лекарственными препаратами, в том
числе витаминами. Если на имплантат
опирается съемный зубной протез, то
его снимают, очищают в ультразвуко-
вой ванночке или чистят механически
щеткой с натрием гидрокарбонатом.
Уделяют внимание также зубам или
протезам — антагонистам имплантата
и по возможности устраняют травма-
тическую окклюзию.
Лечебные процедуры проводят вна-
чале ежедневно, затем 2—3 раза в не-
делю. При втором и третьем посеще-
нии снова обращают внимание паци-
ента на гигиену полости рта. Механи-
ческую и медикаментозную обработку
слизистой оболочки вокруг импланта-
та дополняют аппликациями витамина
А, масла шиповника, облепихи, солко-
серилдентальной адгезивной пастой и
др. Курс лечения проводят до полной
ликвидации воспалительных явлений.
Гигиенические результаты терапии
периимплантита закрепляют назначе-
нием антибиотиков и метронидазола, а
также ежедневными или проводимыми
через день местными блокадами ане-
стетика (3—6 раз). Из антибиотиков
наилучший эффект дают пенициллин
G, амоксилин, амоксилин в сочетании
с метронидазолом [126]. Вместе с тем
тетрациклин и эритромицин дают бо-
лее низкие результаты на всех этапах
лечения. По мнению В.Н. Царева [34],
В.Н. Царева и В.И. Чувилкина [35],
как для профилактики периимпланти-
та, так и для его лечения наиболее эф-
фективны препараты нового поколе-
ния макролидов. Рекомендуется при-
менять физические методы, в том чис-
ле лазерное воздействие [5]. Хотя лазер
не влияет на флору и не способствует
очищению патологического очага, ус-
тановлено положительное влияние его
на регенеративные процессы как в
мягких тканях, так и в кости. Лучше
использовать инфракрасный лазер по-
сле некротомии, местного применения
антисептических препаратов и общей
антибактериальной терапии.
Для профилактики воспаления с
успехом используют магнитотерапию
[6, II]. Результаты лечения контроли-
руют клинически и рентгенологиче-
ски. Данные, полученные при этих ис-
следованиях, сопоставляют с окклюзи-
онными соотношениями и принимают
меры, чтобы разгрузить имплантат. По
мнению L. Lindquist и соавт. [116, 117],
излишняя нагрузка на имплантат мо-
жет усугубить воспалительный процесс
и усилить атрофию кости. Если нельзя
снять протез и дать отдых имплантату,
то необходимо создать защитные уст-
ройства в виде капп, шин, которые па-
циент будет надевать на период сна.
Консервативное лечение периим-
плантита продолжают и после стаби-
лизации процесса. Пациент должен
один раз в месяц посещать врача для
проведения лечебных процедур и кли-
нико-рентгенологического контроля.
Гигиена имплантата должна быть по-
стоянной. Для профилактики периим-
плантита рекомендуется прием вита-
мина С в течение 3 нед в дозе 3 г в день
[36].
После курса консервативной тера-
пии оценивают состояние мягких тка-
ней и рентгенологически определяют
состояние кости (рис. 7.6).
Рис. 7.6. Патологическая ткань около
имплантата, подлежащая некротомии.
Через 2—3 нед решают вопрос о дос-
таточности мягких тканей для плотно-
го разобщения супраструктуры с им-
плантатом и его ложем. Если мягких
тканей недостаточно, G. Krekeler и со-
авт. [ПО], J. Strub и соавт. [162] реко-
мендуют произвести пластику слизи-
стой оболочки в окружности имплан-
тата дтя увеличения прикрепленной
ткани и профилактики повторных вос-
палительных явлений. Используют пе-
ремещение неподвижной слизистой
оболочки по вертикали (рис. 7.7, а, б)
или горизонтали от соседних естест-
венных и здоровых зубов (рис. 7.7, в,
г). Особое внимание обращают на под-
держание адекватной гигиены. L. Ste-
fani [ 159] считает, что пациент сам дол-
жен тщательно следить за гигиеной по-
лости рта и посещать врача в период
приживления имплантата не реже од-
ного раза в 3 мес, а в дальнейшем —
один раз в 6 мес.
В случаях, если воспалительные яв-
ления не ликвидируются и резорбция
кости увеличивается, показана некро-
томия (см. рис. 7.6). Некротомия и ме-
дикаментозное лечение ведет к ста-
бильности имплантата в ложе.
Рис. ^000^1аСТИКа местными тканями ПРИ рецессии десны у имплантата [Грудянов
а — линии рассечения тканей полуовальной формы; б — лоскут уложен над участком имплан-
тата. покрытого биоматериалом, оставшаяся рана заживает вторичным натяжением; в — линии
рассечения тканей по вертикали; г — лоскут уложен над участком имплантата, покрытого био-
материалом, оставшаяся рана у соседнего здорового зуба заживает вторичным натяжением.
К операции — некротомии патоло-
гических тканей у имплантата — при-
бегают при умеренной или значитель-
ной, но не более 2 м.м [129] горизон-
тальной потере кости, а также при на-
личии одного или двух дефектов кости
по вертикали имплантата. Соблюдая
правила хирургического лечения забо-
леваний пародонта, откидывают сли-
зисто-надкостничный лоскут, чтобы
обеспечить хороший обзор участка по-
раженной кости. Поверхность имплан-
тата чистят, удаляют грануляционные
разрастания из десневого кармана и с
внутренней поверхности мягких тка-
ней. В отдельных случаях требуется ее
истончение, хотя большинство клини-
цистов предпочитают оставлять имен-
но утолщенную и кератинизирован-
ную слизистую оболочку.
Особое внимание обращают на на-
личие зубного камня. Его удаляют как
ручным способом, так и с помощью
вращающегося абразивного устройства
с воздушным приводом. Это следует
делать без давления на имплантат, с
охлаждением, но не более 60 с. Ис-
пользуя воздушно-абразивный аппа-
рат, J. Lozada и соавт. [118] получили
хорошие результаты при снятии проч-
но прикрепленного зубного камня у
имплантатов с титановым и плазмен-
ным титановым напылением. Однако
при такой методике F. Brown и соавт.
[62] не исключают возможности воз-
душной эмболии. Кроме того, приме-
некие неоднородных металлов может
привести к повреждению поверхности
имплантата и гальванической корро-
зии. Противопоказана абразивная об-
работка имплантатов с гидроксиапа-
титным покрытием. С таких импланта-
тов камень удалями ультразвуковым
скайлером с пластиковым наконечни-
ком. Однако S. Jovanovic и соавт. [100]
проводили это и абразивно-машин-
ным аппаратом с охлаждением 10 %
раствором хлорамина.
Выскабливают грануляции из очага и
затем проводят химиотерапевтическую
обработку раны антисептическими ле-
карственными средствами: 1 % раство-
ром перекиси водорода, 1 % раствором
хлорамина, 0,06—0,12 % раствором
хлоргексидина и его производных [29].
Обязательно обрабатывают поверхность
имплантата раствором сверхочищенной
лимонной кислоты. Его наносят на по-
верхность имплантата, в том числе с
гидроксиапатитным покрытием, на
30-60 с [162].
После каждой процедуры с исполь-
зованием лекарств рану орошают изо-
тоническим раствором натрия хлори-
да. Из антибактериальных препаратов
в виде аппликаций применяют губку,
пропитанную гентамицином, или про-
мывают рану раствором грамицидина,
хлоргексидина и его производных.
Особенно хорошо действует грамици-
дин: он не вызывает антибиотикорези-
стентности микробной флоры и оказы-
вает иммуномодулирующее влияние
[34, 35, 153].
Большое внимание следует уделять
сохранению поверхности имплантата.
С одной стороны, это обеспечивается
тщательным снятием зубного камня, с
другой — устранением всех царапин и
неровностей на его поверхности. J. Lo-
zada и соавт. [118] рекомендуют приме-
нять полировочные боры и другие ин-
струменты с обязательным охлаждени-
ем для сглаживания поверхности им-
плантата. Однако G. Hadeen и соавт.
[89] считают, что полировка поверхно-
сти имплантата может иметь и отрица-
тельные моменты, такие как попада-
ние металлических частиц в рану, что
может осложнить раневой процесс.
Они рекомендуют прибегать к полиро-
ванию имплантата абразивными бора-
ми только тогда, когда удалены грану-
ляции и произведена пластика мягких
тканей.
Закрытие костной раны и импланта-
та после указанных лечебных процедур
имеет ряд особенностей. Отделяют
слизистую оболочку от надкостницы,
рассекают лоскут слизистой оболочки
создают различные конструкции лос
кутов, формируют дополнительные
лоскуты на щеке, а также выполняют
пластику свободными лоскутами с дру-
гих участков слизистой оболочки, в
том числе с неба и нижней поверхно-
сти языка. Главная задача рахтичных
транспозиций тканей заключается в
адекватном закрытии участка пораже-
ния кости, обеспечении достаточности
мягких тканей около имплантата и его
супраструктуры.
Эффективность некротомии патоло-
гически измененных тканей около им-
плантата продемонстрировали J. Stub и
соавт. [162] в экспериментах на соба-
ках, когда хирургически были устране-
ны дефекты кости, хотя мелкие карма-
ны все же остались. Клинический опыт
К. Strid [167], R. Adell и соавт. [38],
В. Lehmann [114] и др. также подтвер-
ждает эффективность хирургического
подхода. Однако ни один из авторов
еще не сообщил о достаточно долго
прослеженных результатах такого лече-
ния [172].
В последние 5—6 лет при лечении
периимплантита широко применяется
пластика кости с использованием био-
материалов — гидроксиапатита, алло-
и аутокости, рассасывающихся и не-
рассасывающихся мембран. Пластика
кости показана при умеренных и глу-
боких дефектах кости, в том числе в
области двух и даже трех ее стенок во-
круг имплантата. Обязательным усло-
вием успеха является полное закрытие
дефекта и имплантата биоматериалом
и мембраной, а также мягкими тка-
нями. Необходимо также снять зубной
протез, чтобы обеспечить глухое за-
шивание раны и создать покой им-
плантату.
R. Meffert [123] считает, что при нек-
ротомии для полноценного восстанов-
ления кости и будущего адекватного
функционирования имплантата следу-
ет использовать аллогенные консерви-
рованные и аутогенные костные транс-
плантаты, гранулированные формы
гидроксиапатита, направленную реге-
нерацию при помощи рассасывающих-
ся и нерассасываюшихся мембран
(107, 129, 137]. R. Adell и соавт. [38] в
подобных ситуациях с успехом произ-
водили только резекцию участков вос-
паления и пластику местными тканя-
ми. При обоих подходах должен быть
определен потенциал тканей, контак-
тирующих с имплантатом, главным об-
разом кости, дзя полноценного восста-
новления тканей и адекватной функ-
ции имплантата (см. рис. 7.7).
В последние годы наибольшие успе-
хи в лечении периимплантита достиг-
нуты при пластике с мембранами [67—
69, 99—101]. Перед такой операцией
следует тщательно провести консерва-
тивное и хирургическое лечение, а па-
родонтальный тест должен свидетель-
ствовать о высоком индексе гигиены.
Исследования, проведенные L. Wolin-
sky и соавт. [171] с целью микробиоло-
гической характеристики бактерий и
продуктов их взаимодействия, свиде-
тельствуют о большой опасности бак-
терий, особенно Streptococcus sanguis и
Actinomyces viscosus.
Некротомия и пластика биомате-
риалами могут быть произведены од-
номоментно или в два этапа с интерва-
лом 6 мес. Операцию начинают с отки-
дывания слизисто-надкостничного
лоскута, обнажения участка дефекта
кости и видимой части имплантата. Ре-
зекция патологически измененных
тканей кости и поверхности импланта-
та должна сопровождаться медикамен-
тозной обработкой тканей, как описа-
но ранее. Зубной камень с имплантата
удаляют ручным способом. В случае
необходимости полировки поверхно-
сти имплантата абразивными борами
ее осуществляют на первом этапе, пла-
стику алло- и аутотрансплантатами,
другими биоматериалами, мембранами
или их комбинацией — на втором эта-
пе через 6 мес.
Дальнейшие действия при пластике
зависят от того, какой биоматериал бу-
дет применен для восполнения кости.
S. Jovanovic и соавт. [100] использова-
ли аутогенные костные трансплантаты,
взятые с подбородочного участка ниж-
ней челюсти или бугра верхней челю-
сти. Желательно, чтобы в структуру ау-
тотрансплантата входило не только
кортикальное, но и губчатое вещество.
Интеграция аутотрансплантатов в кос-
ти челюсти и образование ремоделиро-
ванной костной ткани убедительно
прослежены М. Habal и A. Reddi [88].
Эти авторы отметили, что пересажен-
ные аутотрансплантаты хорошо ремо-
делируются.
Для пластики при периимплантите
можно использовать деминерализован-
ные, лиофилизированные или другие
аллотрансплантаты. Правда, В. Веггеу и
соавт. [57] отмечают медленное ремо-
делирование кости при применении
консервированных аллотранспланта-
тов. Более обнадеживающие результаты
получены J. Mellonig и соавт. [126] при
использовании комбинации аллотранс-
плантатов консервированной кости с
мембраной для устранения дефектов
кости при периимплантите.
В последние годы для лечения пери-
имплантита стали широко применять
нерассасывающиеся и рассасывающие-
ся, в том числе коллагеновые, костные
мембраны. Клинические основы уст-
ранения дефектов кости при периим-
плантите при помощи мембран были
разработаны В. Becker и соавт. [52],
S. Jovanovic и соавт. [100] и др.
При экспериментальных исследова-
ниях по остеоинтеграции мембран
С. Dahlin и соавт. [68, 69], S. Jovanovic
и соавт. [101, 102] установили образо-
вание новой кости на месте ее дефекта.
Отмечено большое количество быстро-
растущего кортикального и губчатого
вещества кости под мембраной. Вблизи
имплантата S. Jovanovic и соавт. [101]
наблюдали построение новой кости,
которая создавала опору конструкции.
В экспериментах на собаках М. Hurze-
ler и соавт. [92], проводившие лечение
спровоцированного лигатурой пери-
имплантита, показали, что сама по се-
бе направленная регенерация кости
одинаково результативна независимо
от того, проводится ли она в комбина-
ции с трансплантацией или без нее. Ме-
нее эффективно лечение только транс-
плантатами, еще менее — обработка
раны и некротомия.
Порядок действий при лечении пе-
риимплантита с пластикой биомате-
риалами следующий. За 4—6 нед до
операции снимают зубные протезы с
имплантата или имплантатов, в облас-
ти которых наблюдается периимплан-
тит. Операцию начинают с рассечения
тканей и откидывания слизисто-надко-
стничного лоскута. Проводят туалет
внутренней части имплантата и закры-
вают его запорным винтом. Затем уда-
ляют грануляционные разрастания из
костного очага и прилегающих мягких
тканей, проводят санацию очага, на ме-
сто дефекта кости укладывают биома-
териал и закрывают его мембраной так,
чтобы она на 3—4 мм перекрывала де-
фект кости. Мембрану фиксируют
винтами или специальными шпилька-
ми. При этом следят, чтобы она хоро-
шо соприкасалась с костью и под ней
оставалось место, заполненное кровя-
ным сгустком или биоматериалом. Эф-
фективно использование стимулято-
ров роста кости — плазмы крови, обо-
гащенной тромбоцитами, морфогене-
тического протеина, "Pep-Gen Р-15".
Слизисто-надкостничный лоскут укла-
дывают на место и фиксируют непре-
рывным или матрацными швами. Если
при зашивании тканей имеется натя-
жение и может быть нежелательное
давление на мембрану или если созда-
лась опасность расхождения швов,
лоскут мобилизуют, в том числе за счет
рассечения надкостницы, а также до-
полнительных рассечений и формиро-
вания лоскутов соседних тканей.
В послеоперационном периоде в те-
чение 7—8 дней проводят антибиоти-
котерапию, назначают десенсибилизи-
рующие и общеукрепляющие лекарст-
венные препараты, проводят перевяз-
ки и гигиенические процедуры в по-
лости рта. При благоприятном течении
послеоперационного периода через 6—
12 нед проводят второй этап операции,
на котором нерассасывающуюся мем-
брану удаляют. Затем рану зашивают и
строго соблюдают гигиену.
При благоприятных рентгенологи-
ческих данных через 6 мес имплантат
вскрывают, запорный винт заменяют
формирователем десны для заживле-
ния слизистой оболочки и после
эпитализации раны (обычно через
3 нед) проводят ортопедическое ле-
чение.
S. Jovanovic и соавт. [100] через 6 мес
после операции наблюдали уменьше-
ние глубины кармана до 2,5—2,7 мм. В
70 % случаев на рентгенограммах оп-
ределялось полное заполнение дефек-
тов новой костью.
Пластику рассасывающейся мем-
браной производят по тем же прави-
лам. За 4—6 нед снимают зубной про-
тез и проводят гигиенические и лечеб-
ные мероприятия в полости рта. Опе-
рацию начинают с формирования и от-
кидывания слизисто-надкостничного
лоскута и удаления патологических
тканей в месте дефекта кости, с по-
верхности имплантата и внутренней
поверхности мягких тканей. Мембрану
укладывают на место дефекта так, что-
бы она перекрывала его и хорошо кон-
тактировала с костью по периферии.
Между мембраной, имплантатом и ко-
стной тканью оставляют пространство,
которое должно заполниться биомате-
риалом, смешанным с кровью или
плазмой крови, обогащенной тромбо-
цитами. Над мембраной укладывают
лоскут и фиксируют его швами без на-
тяжения (рис. 7.8).
Поданным N. Fleischer и соавт. [80],
введенные в ткани рассасывающиеся
мембраны вызывают воспалительную
реакцию, но она выражена незначи-
тельно и быстро регрессирует без ос-
ложнений |141], хотя не исключены
обнажение или прорезывание мембра-
ны с перфорацией слизистой оболочки
над ней. В таких случаях мембрану уда-
ляют [46].
При пластике рассасывающейся и
нерассасывающейся мембраной могут
быть использованы биоматериалы: де-
минерализованная кость [126], гидро-
ксиапатит [123], три кальций-фосфат
[44], "OsteoGen" 1168], "Interpore-200",
"Osteo-Graf, "Bio-Oss”, "Cerasorb",
"Grafton", "Коллапан", "БАК", в том
числе смешанные с кровью и стимуля-
торами роста, находящимися в плазме
крови, обогащенной тромбоцитами.
Ими заполняют глубокие дефекты кос-
ти перед постановкой мембраны.
Для успеха направленной регенера-
ции кости большое значение имеют
адекватное зашивание мягких тканей и
Рис. 7.8. Пластика после некротомии
около имплантата биоматериалом, по-
крытым мембраной.
а — обнаженный верхний отдел имплантата;
б — проведена некротомии. уложен биоматс-
I i t I закрытый .мембраной; и иид имплан-
тата в рсмоделированной кости.
создание условий для заживления ра-
ны первичным натяжением. Для этого
в большинстве случаев приходится
создавать различные конструкции лос-
кутов и прибегать к использованию со-
седних участков слизистой оболочки, а
также к пластике свободными лоскута-
ми с других отделов полости рта.
Послеоперационное ведение тради-
ционное с включением курса антибио-
тиков, проведением гигиенических
мероприятий в полости рта и местного
лечения раны. Швы снимают на 11—
14-й день. После пластики мембраной
и биоматериалами имплантат вскрыва-
ют через 4—6 мес. Затем проводят об-
щеизвестные процедуры; удаление за-
порного винта, туалет внутренней час-
ти имплантата, постановку винта за-
живления на 3 нед и протезирование.
Для лечения периимплантита в экс-
перименте испытывался рекомбини-
М2 —
рованпый морфогенетический проте-
ин человеческой кости (rhBMP-2). За-
полнение им дефекта значительно по-
вышало реоссификацию как в преде-
лах дефекта, гак и в границах новооб-
разованной костной ткани, хотя в ре-
зидентской кости остеоинтеграция бы-
ла выражена несколько меньше, чем в
контроле без rhBMP-2. В настоящее
время он получил положительную кли-
ническую оценку |90|.
Если зона резорбции кости состав-
ляет 1/з длины имплантата и более, то
Т. Albrektsson и соавт. (39, 40] считают
необходимым удалить имплантат. Очень
важным и неблагоприятным призна-
ком воспаления является потеря кости
в вырезках, отверстиях и канавках на
его теле и др., которые являются кон-
структивными особенностями им-
плантата и должны обеспечивать его
стабильность. В этих случаях также по-
казано удаление имплантата. Обнару-
жение рентгенологически и при зонди-
ровании дефекта кости (например, ут-
рата анатомической длины одной из
стенок более чем на 50 %) также небла-
гоприятно для имплантата. По мнению
J. Krauscr и соавт. [109], попытки ле-
чить такой процесс консервативно или
хирургическим путем неэффективны,
поэтому имплантат также удаляют.
Прозопалгия нижнего альвеолярного
нерва. Различные нарушения чувстви-
тельности нижнего альвеолярного нер-
ва и других периферических ветвей
тройничного нерва во время операции
могут не отмечаться. Вскрытие канала
или друтих видимых повреждений нер-
ва врач не фиксирует, а прозопалгия на-
ступает сразу или спустя 1—3 нед и даже
более после постановки имплантата.
Наиболее часто чувствительность
нижнего альвеолярного нерва наруша-
ется при постановке имплантатов на
дистальную часть нижней челюсти.
Проведя аналогичные исследования ос-
ложнений в Канаде и Австралии, L.G.
Ellies и P.W. Hawker [77] отметили со-
вершенно одинаковую частоту таких
осложнений (36 %) при постановке
имплантатов на нижнюю челюсть.
Осложнения при немедленной и от-
сроченной имплантации. Помимо пере-
численных общих и местных осложне-
ний, при немедленной и отсроченной
имплантации возникает ряд других ос-
ложнений. Наиболее характерны выра-
женные остеокластические процессы в
лунке и подвижность имплантата. По
наблюдениям М. Block и J. Kent [58],
развитие резорбтивных процессов в
кости после немедленной импланта-
ции происходит преимущественно в
области премоляров нижней челюсти и
сопровождается увеличением подвиж-
ности имплантатов. Предупредить это
явление можно только с помощью не-
рассасывающегося биоматериала, уло-
женного по периметру имплантата.
Особенно важно укладывать биомате-
риал вблизи тонкой стенки альвеолы
или ее дефекта, если таковой имеется,
а также в плотном соприкосновении с
покрывающей их мембраной, если они
применяются для закрытия дефекта
кости. Однако если это не было сдела-
но во время немедленной имплантации
или применение биоматериала не дало
должного эффекта, подвижный им-
плантат удаляют в период от 3 до 6 нед
после операции. Немедленному удале-
нию подвижный имплантат подлежит
в случае развития сильных болей и вы-
раженных воспалительных явлений в
прилегающих к альвеоле тканях. Сразу
же посте удаления имплантата прово-
дят противовоспалительное лечение.
М. Block и J. Kent [52] указывают на
возможность прорезывания имплантата
через ткани, чаще на нижней челюсти с
язычной стороны. Он, как и R. Yukna
[174, 175], Р. Mentag и соавт. [127], ре-
комендуют в таких случаях произво-
дить трансплантацию биоматериалов,
в том числе гидроксиапатита, рассасы-
вающихся и нерассасывающихся мем-
бран.
Ретракция десны у верхнего края
имплантата может привести к враста-
нию эпителия внутрь и образованию
кармана [140]. В таких случаях хоро-
шие результаты дают рассечение врос-
шего эпителия и реставрация кости с
помощью биоматериала или путем на-
правленной регенерации кости мем-
браной [50, 140].
Как уже указывалось, одним из воз-
можных осложнений при немедленной
и отсроченной имплантации может
быть перфорация дна полости носа или
верхнечелюстной пазухи. Во время
операции корригировать этот дефект
можно постановкой блока из биомате-
риала и ставить имплантат большего
диаметра. Если особенности операции
не позволяют осуществить импланта-
цию сразу же после трансплантации, то
блок биоматериала следует закрыть
мембраной и мягкие ткани над ними
зашить наглухо, а вмешательство отло-
жить на 3—6 мес.
В процессе немедленной и отсро-
ченной имплантации нельзя исклю-
чать угрозу травмы нижнего альвео-
лярного нерва и развития прозопалгии.
При такой травме после приживления
имплантата можно предпринять по-
пытку отсепарировать нерв и изолиро-
вать его от имплантата биоматериалом.
Если это невозможно, то имплантат
приходится удалять.
Осложнения могут возникнуть и при
использовании био.материалов в ходе
немедленной имплантации. Послед-
ние эффективны только при механи-
ческой стабильности имплантатов и
плотном прилегании их к кости. Вос-
палительные явления как реакцию на
трансплантируемые материалы можно
предотвратить проти во вое пал ител ь-
ной терапией, в частности местными
блокадами анестетиков и антибиоти-
котерапией. При неэффективности
подобного лечения и выраженности
общих и местных симптомов заболе-
вания проводят ревизию раны с одно-
временным удалением как трансплан-
тационных материалов, так и имплан-
тата.
Перелом, разлом трансплантата. Од-
ними из осложнений зубной имплан-
тации являются перелом и разлом им-
плантата. По мнению В. Rangert и со-
авт. [146), к причинам переломов им-
плантатов относятся перегрузка и воз-
действие боковых сил при наклоне
конструкции. Авторы отметили наи-
большее число переломов имплантатов
(90 %) на дистальных участках челю-
стей. По их мнению, ставить в этом
районе протезы с опорой на I или 2
имплантата всегда рискованно. J. Ross
и соавт. [148] после 5-летнего наблю-
дения за имплантатами также отмеча-
ли перелом и разлом как конструкции,
так и супраструктуры. Наибольшее их
число отмечено в первый год функцио-
нирования имплантатов, и оно значи-
тельно превышало частоту воспали-
тельных осложнений [98, 117]. Пере-
лом и разлом имплантата требуют уда-
ления конструкции, а аналогичные си-
туации с супраструктурой устранимы
заменой ее другими.
Перелом нижней челюсти. Крайне
редким осложнением зубной имплан-
тации является перелом нижней челю-
сти, который может произойти как во
время операции, так и при функцио-
нировании имплантатов в качестве
опор зубных протезов. Факторами рис-
ка являются атрофия челюсти, про-
грессирующий остеопороз кости и пе-
регрузка имплантата. Судя по рентге-
нограммам плоские имплантаты уве-
личивают опасность перелома челю-
сти. Щечно-язычное и переднезаднее
расположение канала нижней челюсти
также могут создавать такую опасность.
Лечение проводят традиционно, как
принято при переломах. Если имплан-
тат в форме корня зуба оказывается в
щели перелома, то он подлежит удале-
нию. Имплантат плоской формы уда-
лять нецелесообразно, поскольку это,
как правило, травматично. Кроме того,
такая форма имплантата может иметь
иммобилизующее значение для фраг-
ментов перелома. J. Кап и соавт. [104]
описали случай перелома нижней
челюсти после постановки 3 имплан-
татов.
Осложнения после дополнительных
операций на мягких и костных тканях.
Осложнения могут возникать при ре-
конструктивных операциях на мягких и
костных тканях, выполняемых с целью
зубной имплантации. На мягких тканях
травмирование лоскута, чрезмерное пе-
рерастяженне тканей и сдавливание со-
судов могут привести к нарушению их
питания — кровообращения и кровото-
ка, что вызывает дистрофический про-
цесс в мягких тканях, частичный или
полный некроз перемешенных лоску-
тов. Такие же осложнения возможны в
случаях пересадки тонких и расщеп-
ленных кожных лоскутов.
При пересадке тонких кожных лос-
кутов могут происходить сильное
сморщивание и нарушение нужного
контура свода преддверия рта. Расще-
пленные лоскуты часто имеют избыток
тканей на границе соприкосновения с
участками слизистой оболочки, что в
дальнейшем может создавать трудно-
сти для протезирования.
Оперативное вмешательство с кост-
нозамещающими трансплантационны-
ми материалами может осложняться
рассасыванием или неполным их ремо-
делированием в кость, воспалительны-
ми яалениями — нагноением транс-
плантата. В случае рассасывания транс-
плантата имплантацию откладывают.
Если одновременно с костной пласти-
кой была выполнена имплантация, то
конструкцию удаляют. При неполной
реорганизации подсаженного материа-
ла в кость следует учесть, что минера-
лизация, например, аллокости может
продолжаться от 12 до 18 мес. Соответ-
ственно этому принимают решение о
постановке имплантата. Необходимо
обеспечить нагрузку каждого подсажен-
ного трансплантата временным проте-
зом, шиной, накладываемой сразу по-
сле операции или через 2—4 нед. В от-
сутствие нагрузки результаты ремодели-
рования трансплантата ухудшаются и,
более того, может возникнуть опас-
ность его частичного или полного рас-
сасывания. А.И. Ушаков и соавт. [33]
рекомендуют при образовании дефекта
кости после пластики заполнение его
клеевой композицией МКАМ. Препа-
рат оказывает антимикробное действие
и стимулирует образование кости.
Среди дополнительных операций для
имплантации наибольшую опасность в
плане развития осложнений представ-
ляет имплантация в дистальные отделы
верхней челюсти с поднятием пазухи.
Об этом пациент должен быть заранее
предупрежден. Воспалительные ослож-
нения при имплантации и трансплан-
тации на верхней челюсти часто связа-
ны с хроническим воспалением пазухи
[165]. Риск неудачи возрастает, если
имплантаты, поставленные в подверг-
шуюся трансплантации верхнюю че-
люсть, имеют в качестве антагонистов
естественные зубы. Перед операцией
следует обсудить вопрос об увеличении
длины и диаметра имплантатов, изме-
нении конструкции протеза для умень-
шения нагрузки и возможности носить
назубные каппы ночью [147|.
Тактика лечения воспалительных
осложнений после костной пластики
такая же, как при воспалительных про-
цессах после имплантации. Арсенал
лекарственных средств и время лече-
ния могут быть увеличены, в том числе
при антибактериальной, детоксикаци-
онной и общеукрепляющей терапии.
Рекомендации для пациента. После
зубной имплантации и дополнитель-
ных операций нужно выполнять сле-
дующее.
1. Пациент должен следовать назна-
чениям врача после операции; держать
определенное число часов (2—3 или
3—4) пузырь со льдом; принимать
жидкую, а затем мягкую пищу; полос-
кать полость рта указанными врачом
растворами соответствующее число раз
в течение дня; принимать рекомендо-
ванные лекарственные препараты, а
также являться в клинику для осмотра,
лечебных процедур.
2. Пациент должен знать о возмож-
ных осложнениях: ранних — после
операции и поздних — в период хирур-
гической и ортопедической реабилита-
ции, обращаться к врачам — хирургу и
ортопеду при их развитии, осуществ-
лять назначенное лечение, неукосни-
тельно выполнять рекомендации вра-
чей.
3. Успех зубной имплантации воз-
можен, если пациент правильно про-
водит рекомендованные врачом гигие-
нические процедуры и регулярно посе-
щает клинику для осмотров и выпол-
нения профилактических лечебных
мероприятий.
4. Согласно особенностям зубной
имплантации и дополнительных вме-
шательств, видов временных и посто-
янных зубных протезов, пациент дол-
жен получить от врачей рекомендации
по уходу за полостью рта в домашних
условиях: вид зубной шетки, пасты,
порошка, эликсиров, нитей, ершиков,
дезодорантов. Срок функционирова-
ния имплантатов и зубных протезов с
опорой на них в большой степени за-
висит от гигиены полости рта.
СПИСОК ЛИТЕРАТУРЫ
1. Вигдерович В.Л. Прогнозирование ре-
зультатов хирургического этапа ден-
тальной имплантации: Автореф. дис.
... канд. мед. наук. — М., 1991. — 24 с.
2. Гончаров И.Ю. Управляемая регенера-
ция кости интсроссальной денталь-
ной имплантации // Казанский вест-
ник стоматологии. — 1996. - № 2. -
С. 135.
3. Ефанов О.И., Дзанагова ГФ. Физиоте-
рапия стоматологических заболева-
ний. — М.: Медицина, 1988.
4. Иванов В.С. Заболевания пародонта. —
М.: ММ ИА. 1998. - 294 с.
5. Иванов С.Ю., Базикян Э.А., Ломакин
М.В. и др. Опыт использования низ-
коэнергетического гелий-неонового
лазера при внутрикостной дентальной
имплантации // Совр. пробл. имплан-
тол. — Саратов, 1998. — С. 83—84.
6. Иванов С.Ю., Ахундов И.Ю., Панин А.М.
Применение магнитостимуляции для
профилактики осложнений при сто-
матологической имплантации //
Совр. пробл. имплантол. — Саратов,
1998. - С. 86-87.
7. Иванов С.Ю., Шарапов Г.И., Калашни-
кова О.Ю. Прогнозирование осложне-
ний стоматологической имплантации
по показателям перекисного окисле-
ния липидов и обмена глутатиона //
Новое в стоматол. — 1999. — № 2. —
С. 74-78.
8. Кауфман С., Мусин М. Принципы
формирования окклюзии при реабили-
тации функции жевания после ораль-
ной имплантации // Клин, имплантол.
и стоматол. — 1997. -№2. - С. 38—
42.
9. Кулаков А.А. Хирургические аспекты
реабилитации больных с дефектами
зубных рядов при использовании раз-
личных систем зубных имплантатов:
Автореф. дис. ... д-ра мед. наук. — М.,
1997. - 27 с.
10. Кулаков А.А. и др. Хирургические ас-
пекты дентальной имплантации: Ме-
тод. рекомендации. — М., 2001. — 26 с.
11. Лепилов В.А., Обычев Н.М. Магнитное
поле в имплантологии поможет ре-
шить проблему номер один // Совре-
менные проблемы имплантологии. —
Саратов, 1998. - С. 123-124.
12. Лосев Ф.Ф., Шарин АЛ. Эффектив-
ность направленной костной регенера-
ции при синуслифтинге и несъемном
протезировании. // V Съезд Стомато-
логической ассоциации России. — М.,
1999.
13. Матвеева А.И., Балуда И.В. Исследо-
вание резервных возможностей сосу-
дов регионарного кровообращения
при выявлении риска возникновения
послеоперационных осложнений в
области имплантации // Деп. в НПО
"Союзмединформ". — № 21867, 1991.
14. Матвеева А.И., Агеенко А.М., Реб-
ров В. И. Рекомендации по профилак-
тике осложнений при ортопедиче-
ском лечении с использованием оте-
чественных имплантатов // 5-й Все-
российский съезд стоматологов. —
М., 1988. - С. 134-140.
15. Мусин М. Вопросы гигиены с точки
зрения современной имплантологии.
Клинические и зуботехнические ас-
пекты И Клин, имплантол. и стома-
тол. - 1997. - № 2. - С. 25-33.
16. Никогда Л.Н., Семенович О.А., Макси-
мова Т.С. Осложнения дентальной
имплантации // Совр. пробл. имплан-
тол. — Саратов, 1998. — С. 32—33.
17. Перова М.Д. О взаимоотношениях не-
которых клинических аспектов и кон-
струкций зубных имплантатов // Но-
вые концепции в технологии, произ-
водстве и применении стоматологиче-
ских имплантатов: Тезисы докладов
3-й Международной конференции. —
Саратов, 1996. — С. 12—13.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
Перова М., Колеснев Ю., Ведерникова А.
Осложнения при использовании ме-
тода зубной имплантации, их анализ
и профилактика // Клин, имплантол.
и стоматол. — 1997. — № 3. — С. 23—
26.
Перова М.Д., Банченко ГВ. Оценка ре-
зультатов дентальной имплантации с
применением гистограммного анали-
за // Клин, имплантол. и стоматол. —
1997. - № 3. - С. 27-33.
Перова М.Д. К вопросу о прикрепле-
нии околоимплантатных мягких тка-
ней // Новое в стоматол. — 1999. —
№ 2. - С. 3-11.
Перова М.Д. К вопросу о профилакти-
ке деструкции околоимплантатных
тканевых структур // Новое в стома-
тол. - 1999. - №2. - С. 33-41.
Портедер X., Хеннинг Г. Солкоссрил-
дентальная адгезивная паста в лече-
нии ран слизистой оболочки полости
рта после имплантации внутрикост-
ных имплантантов // Стоматология. —
1997 - Т. 76. № 3. - С. 26-28.
Робустова Т.Г, Абу-Асали Ияд, Уша-
ков А.И. и др. Отдаленные результаты
стоматологической эндооссальной им-
плантации // Новые концепции в тех-
нологии, производстве и применении
стоматологических имплантатов. —
М., 1996. - С. 35.
Робустова Т.Г, Биберман Я.М. Ослож-
нения, возникающие во время и после
удаления зуба // Хирургическая сто-
матология. — М.: Медицина, 2000. —
С. 130-141.
Робустова Т.Г. Воспалительные ос-
ложнения зубной имплантации //
Вопр. стоматол. и нейростоматол. —
1999. — № 3. — С. 29-32.
Рабухина Н.А., Матвеева А.И. Рентге-
нологический контроль дентальной
имплантации // Стоматология. —
1993. - № 4. - С. 50-53.
Романов И.А., Робустова Т.Г, Аню-
тин Р.Г., Лузина В. В. Применение
препарата колапол для устранения
перфорации дна верхнечелюстной па-
зухи и дефектов альвеолярного отро-
стка верхней челюсти // Стоматоло-
гия. - 1996. - Т. 75, № 5. - С. 48-50.
Самсонов В.Е., Иванов А.П., Васильев
М.В., Медвецкий В. И. Некоторые кли-
нические аспекты в лечении периим-
плантита // Актуальные вопросы сто-
матологической имплантации: Мате-
риалы Второй Международной науч-
но-практической конференции / Под
ред. В.Л. Параскевича. — Минск,
1998. — С. 40-45.
546
29. Сидельников А. И., Амерханов MB.
Применение современных лекарст-
венных средств при дентальной им-
плантации // Совр. пробл. имплан-
тол. — Саратов, 1998. — С. 53—55.
30. Стрельников В., Слюсарь Н., Щерба-
ков А. Прогнозирование результатов
имплантации по данным фосфатид и -
линозитов крови |ФИ] // Клин, им-
плантол. и стоматол. — 1998. — № 4. —
С. 39-42.
31. Трезубов В.Н., Сухарев М.Ф., Шпыно-
ва А.М. Анализ результатов импланта-
ции после непосредственного протези-
рования // Совр. пробл. имплантол. —
Саратов, 1998. — С. 28—29.
32. Сухарев М. Анализ напряженно-де-
формированного состояния кости че-
люстей с полной потерей зубов при
использовании имплантатов различ-
ной формы // Клин, имплантол. и
стоматол. — 1998. — № 4. — С. 52—
57.
33. Ушаков А.И., Панин А.М., Божуков Д.А.,
Ушакова Т.М. Применение препарата
МК-9М для предотвращения после-
операционных осложнений при опе-
рациях на альвеолярном отростке че-
люстей // Совр. пробл. имплантол. —
Саратов, 1998. - С. 51-53.
34. Царев В.Н. Разработка принципов
комплексной бактериологической ди-
агностики и иммуномодулирующей
терапии воспалительных заболеваний
челюстно-лицевой области: Дис....
д-ра мед. наук. М., 1993. — 360 с.
35. Царев В.Н., Чувилкин В.И. Примене-
ние макролидных антибиотиков ново-
го поколения для профилактики и ле-
чения воспалительных осложнений в
стоматологической практике: Методи-
ческие указания. — М., 2000. — 27 с.
36. Abrahamsohn D., Halberstein R., Fregeol-
le S. Vitamin C and dental healing: testing
and placebo effect // Gen. Dentistiy. —
1993. - Vol. 6. - P. 523-527.
37. Abrahamsson T, Berglundh T.,
Wennstrom J., Lindhe J. The peri-im-
plant hard and soft tissues at different im-
plant systems // Clin. Oral. Impl. Res. —
1996. - Vol. 7. - P. 212-217.
38. Adell R., Lekholm U., Rockier B. et al.
Marginal tissue reactions at osseointe-
grated titanium fixtures. I. A 3-year lon-
gitudinal prospective study // J. Oral
Maxillofac. Surg. — 1986. — Vol. 15. —
P. 39.
39. Albrektsson T. A Multicentcr report on
osseointegrated oral implants // J. Pros-
thet. Dent - 1988. - Vol. 60. - P. 75-
80.
40. Albrektsson T., Zarb G., Worthington P
Eriksson A. The long-term efficacy of
currently used dental implants: a review
and proposed criteria of success // Int. J
Oral Maxillofac. Impl. — 1996 —
Vol. 1. - P. 11-25.
41. Apse P., Ellen R., Overall C, Zarb G.
Microflora and crevicular fluid colla-
genase activity in the osseointegrated
dental implant sulcus: A comparison of
sites in edentulous and partially edentu-
lous patients // J. Periodont. Res. —
1989. - Vol. 24. - P. 96-105.
42. Anidson K., Bystedt H., Frykholm A. et al.
A 3-year clinical study of Astra dental im-
plants in the treatment of edentulous man-
dibles // Int. J. Oral Maxillofac. Impl. —
1992. - Vol. 7, N 3. - P. 321-329.
43. Arvidson K., Fartash B., Hilliges M., Kon-
dell P. Histological characteristics of
peri-implant mucosa around Branemark
and single-cristal sapphire implants //
Clin. Oral Implant. Res. — 1996. —
Vol. 7. - P. 1-10.
44. Baldock W., Hutchens L. Jr., McFall W.
Jr., Simpson D. An evaluation of tricalci-
um phosphate implants in human perio-
dontal osseous defects of two patients //
J. Periodontol. — 1985. — Vol. 56. —
P. 1-7.
45. Balshi T. Resolving esthetic complica-
tions with osseointegration: using a dou-
ble-casting prosthesis // Quintess. Int. —
1986. - Vol. 17. - P. 281.
46. Balshi T, Hernandez R. Cutler R., Hert-
zog C. Trcamcnt of osseous defects using
Vicril mesh (polyglastin 910) and the
Branemark implant: a case report // Int.
J. Oral Maxillofac. Impl. — 1991. —
Vol. 6. - P. 87-91.
47. Barber H., Seckinger R., Silverstein K.,
Abughazaleh K. Comparison of soft tissue
healing and osseointegration of IMZ im-
plants placed in one-stage and two stage
techiniques: a pilot study // Implant.
Dent. - 1995. - Vol. V. - P. 11-14.
48. Bauman G., Rapley J., Hallmon W.. Mills
M. The peri-implant sulcus // Int. J.
Oral Maxillofac. Impl — 1993. —
Vol. 8, N 3. - P. 264-272.
49. Bussing C., d'Hoedt B., Schulte W. His-
tologische Untersuchung bei erfolgre-
ichen und gelockerten Zahnimplantaten
aus A1203 Keramic (Tubinger Implantat)
// Z. Zahnarzt. Impl. — 1986. — Ns 2
(Sondcrheft). — S. 48.
50. Becker W., Becker B. Guided tissue re-
generation for impants placed into ex-
traction sockets and for implant dehis-
cences: Surgical techniques and case re-
ports // Int. J. Pcriodont. Res. Dent. —
1990. — Vol. 10. - P. 377-391.
547
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
Becker IK, Becker B., Newman M., Ny-
man S. Clinical and microbiologic find-
ings that may contribute to dental im-
plant failure // Int. J. Oral Maxillofac.
Impl. - 1990. - Vol. 5. - P. 31-38.
Becker B., Lynch S., Lekholm U. et al. A
comparison of three methods for pro-
moting bone formation around implants
placed into immediate extraction sockets:
e-PTFE membrane alone, or with cither
PDGF and IGF-I. DFDB // J. Perio-
dont. - 1992. - Vol. 63. - P. 929.
Behneke A., Behneke N., d'Hoedt B.,
Wagner M. Hard and soil tissue reactions
to 1T1 screw implants: 3-year longitudi-
nal results of a prospective study. // Int.
J. Oral Maxillofac. Impl. — 1997. —
Vol. 12. - P. 749-757.
Berberi A., Le Breton G., Mani J. et al.
Lingual parasthesia following surgical
placement of implants: report of a case //
Int. J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 580-582.
Berglundh R., Lindhe J., Ericsson I. et al.
The soft tissue barrier at implants and
teeth // Clin. Oral Impl. Res. — 1991 —
Vol. 2. - P. 81-90.
Berglundh T., Lindhe J., Marinello C. et
al. Soft tissue reaction to the new plaque
formation on implants and teeth // Clin.
Oral Impl. Res. - 1992. - Vol. 3. - P. 1.
Berrey B., Lord C., Gebhardt M. et al.
Fractures ofallografts. Frequency, treat-
ment and end-results // J. Bone Jt Suig. —
1990. - Vol. 72. - P. 825.
Block M., Kent J. Placement of endosscus
implants into tooth extraction sites // Int.
J. Oral Maxillofac. Impl. — 1991. —
Vol. 49. - P. 1269-1276.
Bollen C., Papaioanno N., Van Sedere J.
et al. The influence ofabutament surface
roughness on plaque accumulation and
periimplant mucositis. // Clin. Oral Im-
plant. Res. — 1996. — Vol. 7. — P. 201—
208.
Brandes R., Beamer B., Holt S.C. et al.
Clinical-microscopic observation of liga-
ture induced "periimplantitis" around os-
seointegrated implants // J. Dent. Res. —
1988. - Vol. 67. - P. 287.
Breeding L., Dixon D., Nelson E., Tietge
J. Torque required to loosen single-tooth
implant abutment screws before and after
simulated function // Int. J. Prostho-
dont. — 1993. — Vol. 6, N 5. — P.
435-439.
Brown F, Ogletree R., Houston G. Pneu-
moparotitis associated with the use of an
air-powder prophylaxis unit // J. Perio-
dont. — 1992. - Vol. 63 - P. 642—
644.
63. Burrowes P., Wallace C., Davies J., Camp-
bell L. Pulmonary oedema as a radiologic
manifestation of venous air embolism
secondary to dental implant surgery //
Chest. - 1992. - Vol. 101. - P. 561.
64. Buser D., Warrer K., Earring T., Stich H.
Titanium implants with a true periodon-
tal ligament: an alternative to osseointe-
grated implants? // Int. J. Oral Maxillo-
fac. Impl. - 1990. - Vol. 5. - P. 113-
116.
65. Buser D., Warrer K., Karring T. Forma-
tion of a periodontal ligament around tita-
nium implants // J. Periodont. — 1990. —
Vol. 61. - P. 597.
66. Buser D., Weber H., Donath K. et al. Soft
tissue reactions to none submerged un-
loaded titanium implants in beagle dogs //
J. Periodont. — 1992. — Vol. 63. —
P. 226-236.
67. Dahlin C., Linde A., Goelow J., Nyman S.
Healing of bone defects by guided tissue
regeneration // Plast. Reconstr. Surg. —
1988. - Vol. 81. - P. 672-676.
68. Dahlin C., Sennerby L., Lekholm U. et al.
Generation of new bone around titanium
implants using a membrane technique:
an experimental study in rabbits //Int. J.
Oral Maxillofac. Impl. — 1989. —
Vol. 4. - P. 19-25.
69. Dahlin C., Gottlow J., Linde A., Nyman S.
Healing of maxillary and mandibular de-
fects using a membrane technique. An
experimental study in monkeys // Scand.
J. Plast. Reconstr. Surg. — 1990. —
Vol. 24. - P. 13-19.
70. Danies J., Campbell L. Fatal air embo-
lism during dental implant sutgery: a re-
port of three cass // Canad. J. Anaest. —
1990. - Vol. 37. - P. 112.
71. Deporter D., Todescan R., Watson Ph. et
al. Use of Endopore denial implant to re-
store single teeth in the maxilla: protocol
and carlv results // Int. J. Oral Maxillo-
fac. Impl. - 1998. - Vol. 13. - P. 263-
272.
72. Dougherty S. Pathobiology of infection in
prosthetic devices // Rev. Infect. Dis. —
1988. - Vol. 10. - P. 1102-1117.
73. Dougherty S., Simmons R. Endogenous
factors contributing to prosthetic device
infections // Infect. Dis. Clin. N.
Amer. - 1989. - Vol. 3. - P. 199-
209.
74. Dohm G., Stender E., Foitzik C. Die
Reinigung von implantat-obcrflachen mil
Straheund Zahn Steinentfemungsger-
traten // Dtsch. Z. Zahnarztl. Impl. —
1986. - Bd 2. - P. 133-139.
75. Dwyer M. Near fatal venous nitrogen/air
embolism occurence while inserting cy-
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
lindrical endosseous oral implants // J.
Periodont. - 1992. - Vol. 63. - P. 63.
Doyle R., Nesbett B<, Taylor K. On the
mechanism of adherence of streptococ-
cus sanguis to hydroxyapatite // FEBS.
Microbiol. Lett. — 1982. — Vol 15 —
P. 1-5.
Ellies L., Hawker P. The prevalence of
altered sensation associated with implant
surgery I I Int. J. Oral Maxillofac. Impl. —
1993. - Vol. 8, N 6. — P. 674-679.
Ericsson L., Lekhokm U., Branemark P.-l.
et al. A clinical evaluation of fixed bridge
restorations supported by me combination
of teeth and osseointegrated titanium im-
plants // J. Clin. Periodont. — 1986. —
Vol. 13. - P. 307-312.
Ericsson /., Persson L. , Berglundh T et al.
The effect of intimicrobial therapy on
periimplantitis lesions // Clin. Oral Impl.
Res. - 1996. - Vol. 7. - P. 320-328.
Fleisher V., de Wall H., Bloom A. Regen-
eration of lost attachment apparatus in
the dog using vicryl mesh (polyglactin
910) // Int J. Periodont. — 1988. —
Vol. 2. - P. 45.
Friberg B., Torsten J., Lekholm U. Early
Failures in 4641 Consecutively Placed
Branemark Dental Implants: A study
From Stag 1 Surgery to the Connection
of Completed Prosthcses // Int. J. Oral
Maxillofac. Impl. — 1991. — Vol. 6. —
P. 142-146.
Gammage D., Bowman A., Meffert R.
Clinical management of failing implants:
Four cases reports // J. Oral Impl. —
1989. - Vol. 2. - P. 124-131.
Girdler N. Fatal sequel to dental implant
surgery // J. Oral Rehab. — 1994. —
Vol. 21. - P. 721-722.
Gouvousis J., Sindhusake D., Yeung S.
Cross-infection From Peridontites sites
to Faloing Implant sites in the Same
Month // Int J. Oral Maxillofac. Impl. —
1997. - Vol. 12. - P. 666-673.
Grondahl R., Lekholm U. The predictive
value of Radiographic Diagnosis of Im-
plant Instability// Int J. Oral Maxillofac.
Impl. - 1997. - Vol. 12. - P. 59-64.
Gotfredsen K., Warrer K., Hjoreting-
Hansen T. et al. Effect of membranes and
hydroxyapatite on healing in bone defects
around titanium implants. An experi-
mental study in the monkey // Clin. Oral
Impl. Res. - 1991. - Vol. 2. - P. 172-
178.
Haas R., Saba M., Mensdorff-Pouilly N.,
Mailath G. Examination of the Damping
Behavior of IMZ implants // Int. J. Oral
Maxillofac Impl. — 1995. — Vol. 10. —
P. 410-414.
88. Habal M., Reddi A. (eds.) Bone grafts
and bone substitutes. — Philadelphia:
W.B. Saunders, 1992.
89. Hadeen G., Ismail Y., Garrana H., Pa-
hountis L. Thrcc-dimentional finite cle-
ment stress analysis of Nobelpharma and
Core-Vent implants and their supporting
structures // J. Dent. Res. — 1988. —
Vol. 67. - P. 286.
90. Hanisch O., Tatakis D.. Boskovic M. et
al. Bone formation and Reosscointegra-
tion in peri-implantitis Defect Following
Surgical hnplatation of rhBMP-2 // Int
J. Oral Maxillofac. Impl. — 1997. —
Vol. 12. - P. 604-610.
91. Heimdahl A., Kondell P., Nord C., Nor-
denram A. Effect of insertion of os-
seointegrated prothesis on the oral mi-
croflora // Schweiz. Dent. J. — 1983. —
Vol. 7. - P. 199-204.
92. Hurzeler M., Quiftones C., Morrison E.,
Caffesse R. Treatment of peri-implantitis
using guided bone regeneration and bon-
egrafts, alone or in combination in bea-
gle dogs. Part 1: Clinical findings and
histologic observations // Int. J. Oral
Maxillofac. Impl. — 1995. — Vol. 10. —
P. 474-484.
93. James R. Periodontal considerations in
implant dentistry // J. Prosthet. Dent. —
1973. - Vol. 30. - P. 202.
94. James R. The support system and peri-
gingival defense mechanism of oral im-
plants // J. Oral Impl. — 1976. —
Vol. 6. - P. 270-285.
95. James R. Peri-implant considerations //
Dent. Clin. N. Amer. - 1980. -
Vol. 24. - P.415.
96. Jemt T. Failures and Complications in
391 consecutively inserted fixed prosthe-
ses supported by Branemark implants in
edentulous jaws: a study of treatment
from the time of prosthesis placement to
the first annual checkup // Int. J. Oral
Maxillofac. Impl. — 1991. — Vol. 6. —
P. 270-276.
97. Jemt T., Lonely W., Harris D. et al. Os-
seointegrated implants for single tooth
replacement: a 1-year report from a mut-
ticenter prospective study // Int. J. Oral
Maxillofac. Impl. — 1991. — Vol. 6. —
P. 29-36.
98. Johansson C., Palmqvist S. Complica-
tiones, supplementary treatment and
maintenance in edentulous arches with
implant supported fixed prosthescs //
Int. J. Prosthodont. — 1990. — Vol. 3. —
P. 89-92.
99. Jovanovic S., Spiekermann H., Richter E.
Bone regcration around titanium dental
implants in dehisced defect sites: a clinical
549
study // Int. J. Oral Maxillofac. Impl. —
1992. - Vol. 7. N 2. - P. 228-232
100. Jovanovic S., Spiekermann H., Richter E.,
Koseoglu M. Guided tissue regeneration
around titanium dental implants //
Laney W.. Tolman D. Tissue integration
in oral, orthopedic and maxillofacial re-
constraction. — Berlin: Quintesscnz,
1992. - P. 208.
101. Jovanovic S., Kenney E., Carranza F,
Donath K. The regenerative potential of
plaque-induced peri-implant bone de-
fects treated by a submerged membrane
technique: An experimental study // Int.
J. Oral Maxillofac. Impl. — 1993. —
Vol. 8. - P. 13-18.
102. Jovanovich S., Kenney E., Donath K. et
al. Plaque-induced periimplant disease in
the mongrel dog. A clinical, microbial,
radiographic and histological study //
UCLA. Master of Science Thesis. —
1994.
103. Ivanoff C., Sennebry L., Lekholm U. In-
fuensc of soft tissue contamination on the
integration of titanium implants // Clin.
Oral. Impl. Res. — 1996. — Vol. 7. —
P. 128-132.
104. Kan J., Losada J., Boyne Ph. et al. Man-
dibular Fracture Alter Endosseous Im-
plant Placement in conjunction With in-
ferior Alveolar Nerve Transposition: A
Patient Triatment Report // Int J. Oral
Maxillofac. Impl. — 1997. — Vol. 12. —
P. 655-659.
105. Kenedi J., Bird Ж, Paleanis K., Dorman
H. К logititudinal evalution of varying
width of attached gingiva // J. Clin. Peri-
odont. - 1985. - Vo). 12. - P. 667.
106. Kent J., Block M., Finger I. et al. Biointe-
grated hydroxyapatite-coated dental im-
plants: five-year clinical observation //
J. Amer. Dent. Assoc. — 1990. —
Vol. 121. - P. 138-144.
107. Kent J., Misiek D. Biomaterials for crani-
al, facial, mandibular and TMJ recon-
struction // Oral and maxillofacial trau-
ma. Eds.: R. Fonseca, R. Walker. —
Philadelphia: W.B. Saunders, 1991. —
P. 781-1026.
108. Kirsch A. Clinical use of the IMZ im-
plant // Presentation at the Academy of-
periodontology. Annual Meeting. — San
Diego, 1989.
109. Krauser J., Berthold P., Tamery I., Seck-
inger R. A SEM study of failed endos-
seous root formed dental implants //
J. Dent. Res. - 1991. - Vol. 70. -
P. 274.
110. Krekeler G., Schilli tK, Diemer J. Should
the exit of the artificial abutment tooth
be positioned in the region of the at-
tached gingiva? U J. Oral Maxillofac.
Surg. - 1985. - Vol. 14. - P. 504—
508.
111. laing N., Bragger U., Walther D. Liga-
ture-induced peri-implant infection in
cynomolgus monkeys. I. Clinical and ra-
diographic findings // Clin. Oral Impl.
Res. - 1993. - Vol. 4. - P. 2-11.
112. Last K, Cawood J., Howell R., Embery G.
Monitoring of Tubiuglh Endoosscus
Dental Implants by Glycosaminoglicans
Analysis of Gingival Crenicular Fluid //
Int. J. Oral Maxillofac. Impl. — 1991. —
Vol. 6. - P. 42-49.
113. Last K, Smith S., Pender N. Monitoring
of IMZ titanium endosseous dental im-
plants by glycosaminoglycan analysis of
peri-implant sulcus fluid // Int. J. Oral
Maxillofac. impl. — 1995. — Vol. 10,
N 1. - P. 58-65.
114. Lehmann B., Bragger U., Hammerle C. et
al. Treatment of an early failure accord-
ing to the principles of guided tissue re-
generation // Clin. Oral Impl. Res. —
1992. - Vol. 3. - P. 43-48.
115. Lekholm U., Ericsson T, Adell S., Slots J.
The condition of the soft tissues at tooth
and fixture abutments supporting fixed
bridges. A microbiological and histological
study // J. Clin. Periodont. — 1986. —
Vol. 13. - P. 558-562.
116. Lindquist L., Carlsson G., Glantz P. Re-
habilitation of edentulous mandible with
a tissue-integrated fixed prosthesis //
Quintessence Int. — 1987. — Vol. 18. —
P. 89-96.
117. Lindquist I.., Rockier B., Carisson
C. Bone resorbtion around fixtures in
edentulous patients treated with mandib-
ular fixed tissue-integrated protheses //
J. Prothet. Dent. — 1988. — Vol. 59. —
P. 59-63.
118. Lozada J., James R., Boskovic M. et al.
Surgical repair ofperiimplant defects //
J. Oral Impl. - 1990. - Vol. 16. -
P. 42—46.
119. Listgarlen M., Lang N., Schroeder H.,
Schroeder A. Periodontal tissues and their
counterparts around endosseous implants
I I Clin. Oral Impl. Res. — 1991. —
Vol. 2. - P. 1-19.
120. Lindhe J., Berlundh R., Ericsson I. et al.
Experimental breakdown ofperiimplant
and periodontal tissues. A study in the
beagle dog // Clin. Oral Impl. Res. —
1992. - Vol. 3. - P. 9-16.
121. Mayo J., Oerding K. Andieu S. Bacterial
biofilm: A soure of contamination in
dental air-water syringes // Clin. Prev.
Dent. - 1990. - Vol. 12. - P. 13-20.
122. Meffert R., Block M., Kent J. What is os-
scointegration? // Int. J. Pcriodont. Res.
Dent. — 1987. — Vol. 7. — P. 9.
123. Meffert R. Treatment of failing dental
implants// Сшт. Opin. Dent. — 1992. —
Vol. 2. - P. 109-114.
124. Meffert R How to treat ailing and failing
implants? // Implant. Dent. — 1992. —
Vol. l.-P. 23.
125. Meffert R. Periodontitis and pcriimplanti-
tis: Evalution one in (sic) the same? //
Pract Periodont. Hesthet. — 1993. —
Vol. 5. - P. 79-82.
126. Mellonig J., Prewett A., Moyer M. HTV
inactivation in a bone allograft // J. Peri-
odont. - 1992. - Vol. 63. - P. 979-
983.
127. Mentag P, Kosinski T, Sowinski L. Dental
implant reconstruction after endodontic
failure: report of case // J. Amer. Dent.
Assoc. - 1990. - Vol. 121. - P. 241-
244.
128. Meredith N., Alleyne D., Cawlly P. Quan-
titative tissue interface using rcsonanse
frequency analisis // Clin. Oral Impl.
Res. - 1996. - Vol. 7. - P. 261-267.
129. Misch C. Contemporary implant dentistry
// St. Louis Mosby Year Book. — 1993.
130. Misch C. Implant protected occlusion a
biomechanical rationale // Compent.
Contill. Educt Dent. - 1994. - Vol. 15
(11). - P. 1330-1344.
131. Misch C., Misch C. The repair of loca-
lized severe ringe defects for implant
placement using mandibular bone grafts
// Impl. Dent. — 1995. — Vol. 4. —
P. 261-267.
132. Mombelli A., van Oosen M., Schurch E.,
Lang N. The microbiota associated with
succesful or failing osseointrgrated titani-
um implants // J. Oral Microbiol. Im-
munol. - 1987. - Vol. 2. - P. 145—
151.
133. Mombelli A., Buser D., Lang N. Coloni-
zation of osseointegrated titanium im-
plants in edentulous patients: earliy re-
sults // Oral Microbiol. Immunol. —
1988. - Vol. 3. - P. 113-120.
134. Nakazato G., Tsuchiya H., Cato M.. Va-
mandi M. In vivoplaque formation in im-
plant material // Int J. Oral Maxillofac.
Impl. - 1989. - Vol. 4. - P. 321-326.
135. Newman M., Fleming T. Periodontal con-
siderations of implants and implant asso-
ciated microbiota // J. Dent. Educ. —
1988. _ vol. 12. - P. 738-743
136. Niimi A., Ueda M. Crevicular Fluid in
the osseointegrated implant sulcus: a pilot
study // Int. J. Oral Maxillofac. Impl. —
1995. — Vol. 10. - P. 434-436.
137. Personn L., Ericsson L, Berglundh T,
Lindhe J. Guided bon regeneration in the
treatment of periimplantitis // Clin. Oral
Impl. Res. — 1996. — Vol. 7. — P. 366—
372.
138. Persson L.. Lekholm U., Leonhardt A.
Bacterial colonization on internal surfac-
es of Branemark system implant compo-
nents // Clin. Oral Impl. Res. — 1996 —
Vol. 77. - P. 90-95.
139. Preber H., Bergstrom J., Linder L. Occur-
rence of periopathogencs in smoker and
non-smoker patients // J. Clin. Perio-
dont. — 1992. — Vol. 19. — P. 667—
671.
140. Quay le A., Cawood J., Smith G., Howell R.
The immediate or delayed replacement
of teeth by permucosal intra-osseous im-
plants: The Tubingen implant system.
Part 2. Surgical and restorative tech-
niques U Brit. Dent. J. — 1989. —
Vol. 166. - P. 403-410.
141. Quinones C., Caton J., Mota L. Evalua-
tion of a synthetic biodegradable barrier
to facilitate guided tissue regeneration //
J. Dent. Res. - 1990. - Vol. 69. - P.
13-35.
142. Quirynen M., Listgarten M. The distribu-
tion of bacterial morphotypes around
natural teeth and titanium implants ad
modurn Branemark // Clin. Oral Impl.
Res. - 1990. - Vol. 1. - P. 8-12.
143. Quirynen M., Marechai M., van Steen-
berghe D. Bacterial colonization of infra-
oral hardsurfaces in vivo: Influences of
surface energy and surface roughness //
Biofouling. — 1991. — Vol. 4. —
P. 187-198.
144. Rams T., Link C. Microbiology of failing;
dental implants in humans: electron mi-
croscopic observations Ц J. Oral Impl. —
1983. - Vol. 11. - P. 93-100.
145. Rams T., Roberts T, Tatum H., Keyes P.
The subgingival micro flora associated
with human dental implants // J. Pros-
thet. Dent. — 1984. — Vol. 51. —
P. 529-534.
146. Rangert B., Krogh P., Langer B., Van
Roekel N. Bending overload and implant
fracture: a retrospective clinical analysis //
Int. J. Oral Maxillofac. Impl. — 1995. —
Vol. 10, N 3. - P. 326-334.
147. Regev E., Smith R., Perrott D., Pogrel
M. Maxillary sinus complicationes relat-
ed to endosseous implants // Int. J. Oral
Maxillofac. Impl. — 1995. — Vol. 10. —
P. 451-461.
148. Roos J., Sennerby L., Lekholm U et al. A
Qualitativa and Quantitative Method for
Evaluating Implant Success: A 5-Year
Retrospective Analysis of me Branemark
Implant // Int J. Oral Maxillofac.
Impl. - 1997. - Vol. 12. - P. 504-
514.
149. Rosenberg E., Perel M. Distinguishing be-
tween failing metal root-form implants
and complete implant failures // Dent.
Impl. Update. — 1993. — Vol. 8. —
P. 53-57.
150. Safer J., Berry C., Wagner M. Antibacte-
rial activity of dental implantations on
actinomyces and actinobacillus // J.
Dent. Res. - 1968. - Vol. 6. - P. 275,
754.
151. Salcetti J., Moriarty J., Cooper L. et al.
The clinical, microbial, and host re-
sponse characteristics of the failing im-
plant // Int. J. Oral Impl. — 1997. —
Vol. 12. - P. 32-42.
152. Sanz M., Newman M., Nachnani S. et al.
Characterization of the subgingival mi-
crobal flora around endosteal sapphire
dental implants in partially edentulous pa-
tients I/ Int. J. Oral Maxillofac. Impl. —
1990. - Vol. 5. - P. 247-253.
153. Sbordone L., Barone A., Ramaglia L. An-
timicrobial susceptibility of periodonto-
pathic bacteria associated with failing
implants // J. Periodont. — 1995. —
Vol. 66. - P. 69-74.
154. Schon S., Holmstrup P., Keiding N.,
Fiehn N. Microbiology of ligature-in-
duced marginal inflammation around os-
seointegrated implants and ankylosed in
cynomolqus monkeys (Macaca fascicula-
ris) // Clin Oral Impl. Res. — 1990. —
Vol. 7. - P. 190-200.
155. Silverstein L., Lefkove M., Gamick J. The
use of free gingival soft tissue to improve
the implant soft-tissue interface // J.
Oral Impl. - 1994. - Vol. 20, N I. -
P. 36-40.
156. Sordyl C., Simons A., Molinari J. The
microbiol flora associated with stable en-
dosseous implants // J. Oral Impl. —
1995. - Vol. 21, N 1. - P. 19-22.
157. Spurlein E., Tetsch P. Sulcusfluidmessung
bei titanimplantaten im zahnlosen unter-
kiefer // Z. Zahnarztl. Impl. — 1986. —
№ 2. - P. 92.
158. Sporlein E., Stein R. Nachuntersuchung
von 100 Tubinger Sofortimplantaten un-
ter Berucksichtigung der parodontalen Sit-
uation, der Belastung und der knuchemen
Integration // Dtsch. Z. Zahnarztl
Impl. - 1987. - № 3. - S. 13-17.
159. Stefani L. The care and maintenance
of the dental implant patient // J. Dent.
Hyg. - 1988. - Vol. 62. - P. 447-466.
160. Stevenson S. The immune response to os-
seochondral allografts in dogs // J. Bone
Jt Surg. - 1987. - Vol. 69. - P. 573.
161. Stetler K., Bissada N. Significance of the
width of keratinized gingiva on the perio-
dontal status of teeth with submarginal
restorations // J. Periodont. — 1987. —
Vol. 58. - P. 696.
162. Strub J., GaberthUel T, Grander U. Die
role der attached gingiva fur die gesund-
heit der periimplantSren gewebe bei
kinderclinische befunde // Int. J. Para-
dox. - 1991. - № 11. - S. 305.
163. Ten Brugge nkate C., Krekeler G., Kraai-
jenhagen H. et al. Hemorrhage of the
floor of the mouth resulting during im-
plant placement: a clinical report // Int
J. Oral Maxillofac. Impl. — 1993. —
Vol. 8, N 3. - P. 329-334.
164. Teerlink J., Quirynen M., Darius P., van
Steenberghe D. Periotest: an objective
clinical diagnosis of bone apposition to-
ward implants // Int. J. Oral Maxillofac.
Impl. - 1991. - Vol. 6, N 1. - P. 55—
61.
165. Tidwell J., Blijdorp P., Stoelinga P. et al.
Composite grafting of the maxillary sinus
for placement of endosteal implants. A
preliminary report of 48 patients // J.
Oral Maxillofac. Surg. — 1992. —
Vol. 21. - P. 204-209.
166. Tillmanns H., Hermann J., Tijfee J. et al
Evalution of three Different Dental Im-
plants in Ligature-Induced Peri-implan-
titis in the Beagle Dog. Part II. Histology
and Microbiology // Int. J. Oral Maxil-
lofac. Impl. — 1998. — Vol. 13. —
P. 59-68.
167. Strid K. Radiogratic procedures. // In P.-
I. Branemark, G. Laro, T. Albrektsson.
Tissue integrated prostheses Osseointe-
gration in clinical dentistry. — Chicago:
Quintessence, 1985. — P. 317—327.
168. Valen M. The significance of percursores
in jour bone augmentation material. Pro-
ceeding smof the 44th annual meeting
and Simposiam. — Boston, 1995. —
P. 41.
169. Van Steenberghe D. Periodontal aspects
of osseointegrated oral implants ad modum
Branemark Ц Dent. Clin. N. Amer. —
1988. - Vol. 32. - P. 355-370.
170. Weerkamp A., Quirynen M., Marechai M.
et al. The role of surface energy in the
early in vivo formation of dental plaque
on human enamel and polymeric sub-
strata I/ Microbiol. Ecol. Health Dis. —
1989. - Vol. 2. - P. 11-18.
171. Wolinsky L, de Camargo P., Erard J.,
Newman M. A Study of in vitro attach-
ment of streptococcus sanguis and actin-
omyces viscosus to saliva-treated titani-
um // Int. J. Oral Maxillofac. Impl. —
1989. - Vol. 4. - P. 27-31.
172. Worthington P. Medicolegal aspects of
oral implants surgery // Britisch Associa-
tion of oral and Maxillofacial Surgeons
Meeting. Oxfort. — 1994. — Abstract 16.
173. Wennstrom J., Bengazi F, Lekholm U.
Tire influence of the masticatory mucosa
on the peri-implant soft tissue condition
552
// Clin. Oral Impl. Res. — 1994. —
Vol. 5. - P. 1-8.
174. Yukna R Clinical comparison of hy-
droxyapatite-coated titanium dental im-
plants placed in fresh extraction sockets
and healed sites // J. Periodont. —
1991. - Vol. 62. - P. 468-472.
175. Yukna R. Placement of hydroxyapatite-
coated implants into fresh or recent ex-
traction sites // Dent. Clin. N. Amer. —
1992. - Vol. 36. - P. 97-116.
176. Zablotsky M., Meffert R., Caudill R.,
Evans G. Histological and clinical com-
parisons of guided tissue regeneration on
dehisced hydroxyapatite-coated and tita-
nium endosseous implant surfaces: a pilot
study // Int. J. Oral Maxillofac.Impl. —
1991. - Vol. 6, N 3. - P. 294-303.
177. Zablotsky M. A Retrospective Analisis of
the Management of Ailing and Faling
Endosseous Dental Implants // Implant
Dentistry. - 1998. - Vol. 7, N 3. - P.
185-189.
ЗАКЛЮЧЕНИЕ
Пока настоящее руководство готови-
лось к изданию, зубная имплантация
во всем мире, в том числе и в России,
продолжала интенсивно развиваться.
Однако представленные в руководстве
классические правила имплантацион-
ной хирургии остались незыблемыми.
Автор стремилась к тому, чтобы, от-
крыв любой раздел, врач мог ознако-
миться с каждом оперативным вмеша-
тельством, производимым при им-
плантации, и увидеть его в иллюстра-
циях "шаг за шагом".
Поданным Всемирной организации
здравоохранения, в мире 80 млн лю-
дей, у которых отсутствуют зубы, не
используют протезы. Имплантация
может помочь в решении этой пробле-
мы, однако при лечении с помощью
внутрикостных зубных имплантатов
возникает ряд проблем. Основными
причинами отказа от имплантации яв-
ляются: 1) боязнь боли; 2) значитель-
ная длительность лечения; 3) высокая
стоимость хирургического и ортопеди-
ческого этапов лечения. В настоящее
время боль можно предотвратить на
этапах имплантационной хирургии и
ортопедического лечения. Продолжи-
тельность лечения при имплантации
может быть уменьшена благодаря при-
менению новых методов: временных
имплантатов, одноэтапного оператив-
ного вмешательства, биоматериалов, в
том числе стимуляторов роста кости,
повышению остеоинтеграции и ран-
ней нагрузке на имплантат.
Высокая стоимость имплантации
обусловлена не коммерциализацией
этого вида лечения, а использованием
дорогостоящих методов диагностики
(цифровая, объемная, цветовая визио-
графия, РКТ и МРТ, УЗИ, прижизнен-
ная микроскопия, реография, миогра-
фия, допплерография), аппаратуры и
материалов на хирургическом и орто-
педическом этапах лечения, необходи-
мостью изготовления временных и по-
стоянных зубных протезов. В зарубеж-
ной практике зубной имплантации
экономические трудности сохранятся,
а в России благодаря развитию эффек-
тивных отечественных имплантатов и
биоматериалов могут быть снижены
денежные затраты на это сложное, тру-
доемкое и дорогостоящее лечение. В
частных клиниках, стоматологических
учреждениях акционерного типа бла-
годаря спонсорской поддержке отдель-
ных пациентов возможно проведение
лечения с использованием импланта-
тов со скидками.
В России проведены исследования с
целью определения нуждаемости насе-
ления в ортопедическом лечении с ис-
пользованием внутрикостных зубных
имплантатов, число больных, которым
необходимо такое лечение, составляет
5—10 % от нуждающихся в зубном
протезировании. Однако провести это
лечение по медицинским и экономи-
ческим соображениям могут только
1,5—3 % пациентов (Кондратьев С.Н.,
2001].
В настоящее время главными прин-
ципами эффективности зубной им-
плантации служат:
• классическая оценка функциональ-
ного состояния организма и уста-
новление противопоказаний к им-
плантации при патологии органов и
систем организма; подготовка к им-
плантационному лечению;
• достаточность кости челюсти по вы-
соте и ширине для установления им-
плантата;
• наличие ортогнатического прикуса
и его разновидностей.
Значительный прогресс в усовер-
шенствовании имплантатов в мире, в
том числе в нашей стране, разработка
и внедрение новых биоматериалов, в
частности стимуляторов роста кости,
рациональное применение при зубной
имплантации местных антисептиков,
антибактериальных препаратов, гор-
мональных препаратов значительно
расширили возможность лечения.
Традиционные методы обследова-
ния дополнены новыми подходами к
оценке качества кости, прилежащих
мягких тканей, сосудистой системы в
зоне предполагаемой операции по раз-
ным параметрам кровообращения. Это
позволило использовать при зубной
имплантации биоматериалы, стимуля-
торы роста кости, физические воздей-
ствия.
Индивидуальный подход к лечению
пациента, комплексная оценка степе-
ни сложности имплантационной хи-
рургии и этапных ортопедических ме-
тодов лечения с опорой на имплантаты
позволили расширить показания к
этой терапии у пациентов, имеющих
сопутствующие болезни. Усовершен-
ствованы медикаментозная подготовка
каждого пациента к операции и веде-
ние его на этапах ортопедического ле-
чения.
Внедрение в мировую практику'
внутрикостной зубной имплантации
наращивания кости, дистракции ее для
увеличения высоты или ширины аль-
веолярного отростка верхней челюсти
и альвеолярной части нижней челю-
сти, предымплантационное ортодон-
тическое лечение позволяют прово-
дить имплантацию, игнорируя класси-
ческие правила, в том числе в условиях
коррекции нарушений прикуса.
В России продолжаются работы по
усовершенствованию существующих и
созданию новых внутрикостных зубных
имплантатов [Иванов С.Ю., 2002; Ку-
лаков А.А., 2002; Кулаков О.Б., 2002;
Ушаков А.И., 2002].
Лучший отечественный имплантат
"Конмет" эффективен в 98 % случаев
при 5-летнем контрольном исследова-
нии и в 96 % — при 10-летнем [Жу-
севА.И., 2001; Сидельников А.И.,
2002]. Усовершенствование этих им-
плантатов и их супраструктуры внуша-
ет большой оптимизм, а экономиче-
ская доступность привлекает как спе-
циалистов, так и пациентов.
Следует отметить, что в последние
2—3 года в нашей стране проводятся
исследования имплантатов, изготов-
ленных из титана [Иванов С.Ю.. Лома-
кин М.В., 2001; Кулаков А.А., Налап-
ко В.И., 2001]. Зарубежные специаписты
совершенствуют геометрию импланта-
тов. Например, фирма "Nobel Bio care"
считает наиболее прогрессивной фор-
му имплантата в виде корня зуба и вы-
пустила "Replais Select", который мож-
но устанавливать при разной высоте
кости. Имплантат характеризуется
низкой микроподвижностью. Его шей-
ка 1,5—2 мм создает индивидуальную
позицию по отношению к десневому
краю. Хирургическое лечение может
быть как двух-, так и одноэтапным.
Улучшено соединение имплантата с
супраструктурой благодаря трем ради-
кальным каналам, длинной внутрен-
ней части и внутреннему трехгранни-
ку. Нами установлена эффективность
выпускаемых этой фирмой импланта-
тов, которые можно применять при не-
медленном временном протезирова-
нии как после удаления зубов, так и в
случаях частичной и полной адентии.
На российском рынке и соответст-
венно в практической стоматологии
хорошо зарекомендовали себя имплан-
таты фирмы "Astra Tech". Подкупает
простота установления и надежность
самой системы имплантатов "Astra".
Благодаря самонарезаюшемуся телу
имплантата с микрорезьбой в прише-
ечной части и макрорезьбой в других
отделах можно создать стабильность в
кости и хорошую последующую остео-
интеграцию. Кроме того, плотные со-
единения с супраструктурой обеспечи-
вают хорошее состояние мягких тка-
ней, отсутствие зазоров между компо-
нентами и, следовательно, высокий
уровень гигиены. Большой выбор суп-
раструктуры позволяет применять им-
плантаты "Astra" в сложных клиниче-
ских ситуациях.
В России продолжают применять
плоские имплантаты, тогда как за ру-
бежом в подавляющем большинстве
случаев используют конструкции в
форме корня зуба. Вместе с тем на ос-
нове имплантата ВНИИМТ В.И. На-
лапко (2001) разработал разборные
конструкции оригинального дизайна с
улучшенными показателями биомеха-
ники, а А.И. Ушаков (2002) — поли-
мерное покрытие плоского тела, повы-
сившее остеоинтеграцию на 96,2 %.
Несмотря на категоричное мнение за-
рубежных специапистов о нецелесооб-
разности использования плоских им-
плантатов, данные отечественных ав-
торов свидетельствуют об их эффек-
тивности и важном преимуществе —
возможности раннего протезирования
с включением естественных зубов в
конструкцию зубного протеза. По дан-
ным А Н. Ушакова (2002), хорошие ре-
зультаты лечения составляют 85—95 %
при 5-летнем контрольном наблюде-
нии; при 10-летне.м — 63—70 % и
50 9—51,5 % (более низкие показатели
связаны с миграцией населения и не-
возможностью контролировать резуль-
таты лечения). Отмечена эффектив-
ность применения методики Фолдя для
подбора имплантата конткретно для ка-
ждого больного. При установлении
плоских имплантатов ранее предложен-
ная циркулярная пила (Ушаков А.И.,
1987] применяется для формирования
костного ложа, что значительно упро-
стило хирургическое вмешательство
(Гончаров И.Ю., 1999]. Кроме того,
для точного формирования костного
ложа по форме и размерам имплантата
разработано специальное приспособ-
ление, а в случаях необходимости не-
стандартного изгиба головки имплан-
тата предложено применять головку с
круглой шейкой, позволяющей произ-
водить изгиб в любой плоскости; при
этом дополнительная обработка конст-
рукции мощными ионными пучками
обеспечивает чистоту поверхности и
позволяет увеличивать угол наклона
головки до 25’ (Гончаров И.Ю., 1999].
Изучены особенности функциони-
рования внутрикостных имплантатов
на нижней челюсти в разных челюст-
ных сегментах в зависимости от со-
стояния костной ткани. Диагностика
напряженно-деформированного со-
стояния костной ткани методом чис-
ленного анализа позволяет определять
оптимальные углы установки имплан-
тата и предельные нагрузки на них.
Определены взаимосвязь диаметра и
длины углов установки и величины на-
пряжений в кости около имплантата и
предложены эффективные подходы к
установке имплантатов и индивидуаль-
но подобранных нагрузок в конструк-
циях зубных протезов (Матвеева А.И.,
Борисов А.Г., 2002]. Полученные дан-
ные согласуются с концепцией С. Misch
(2000), который разработал разные ти-
поразмеры имплантатов в форме зуба
для разных клинических ситуаций в за-
висимости от количества и качества
кости.
Изучена контаминация костного ло-
жа, формируемого для имплантации,
микрофлорой полости рта. В после-
операционном периоде отмечено про-
грессирующее увеличение количества
анаэробных бактерий, в том числе аг-
рессивных видов, что создает возмож-
ность развития воспалительных ослож-
нений. Сравнительная оценка профи-
лактического применения антибиоти-
ков [Царев В.Н., Чувилкин В.И., 2000]
показала высокую эффективность мак-
ролидов ровамицина и кларитромици-
на по сравнению с обычно применяе-
мым линкомицином.
С целью профилактики инфекции на
различных этапах зубной имплантации
для местного применения наиболее эф-
фективны препараты на основе хлор-
гексидина [Царев В.Н., 1997, 2002]. По
растровой электронной микроскопии
установлено, что традиционная гигие-
на после имплантации ведет к повреж-
дению супраструктуры, в связи с этим
предложены разные сочетания полиро-
вочных систем и чистящих приспособ-
лений для минимизации травмы (Боль-
шаков С.В., 2003]. Дтя оценки отдален-
ных результатов зубной имплантации
предложены, помимо традиционных
клинических и рентгенологических ме-
тодов, ультразвуковая остеомегрия [Гве-
тадзе Р.Ш., 1996; Пылков В.И., 2002] и
рентгеновская компьютерная и маг-
нитно-резонансная томография [Робу-
стова Т.Г., Фех А.Р., 20011. Разработан
принцип прогнозирования и профи-
лактики осложнений внутрикостной
зубной имплантации (КИП), основан-
ный на комплексе лечебных мероприя-
тий в предоперационном, операцион-
ном и послеоперационном периодах
[Базикян Э.А., 2001].
В зубной имплантации хорошо заре-
комендовала себя немедленная и остео-
генная имплантация [Робустова Т.Г.,
Федоров И.А., Ушаков А.И., Дробы-
шев А.Ю., 1996—2000], а также повтор-
ная инсталяция конструкции [Кула-
ков А.А., 20021. При подведении ито-
гов работы за 7 лет, в течение которых
осуществлено более 500 имплантаций,
отмечен успех лечения при 3-летнем
контрольном наблюдении в 97,5 % и
при 7-летнем — в 95,9 % случаев [Ро-
бустова Т.Г., Федоров И.А., 2000; Уша-
ков А.И., 2002].
J.Hahn (2002), R.Baer (2003) выдви-
гают принцип не только немедленной
имплантации, но и немедленного про-
тезирования.
Обобщив опыт наращивания кости
для зубной имплантации, мы отдаем
предпочтение отечественным материа-
лам на основе синтетического гидро-
ксиапатита и его композиций с колла-
геном — "Колаполу" КП-2, КП-3, в том
числе с медикаментозными установка-
ми [Курдюмов С.Г., Воложин А.И.,
2002], и "Коллапану" [Верченко Г.Н.,
Никитин А.А., 2002]. Внушают опти-
мизм различные виды материалов, раз-
работанные С.Ю. Ивановым (2002).
Вместе с тем большой опыт исполь-
зования различных зарубежных мате-
риалов позволяет рекомендовать такие
композиции гидроксиапатита, трика-
лоциофосфата, как "Bio-oss", "Oster-
graf’, "Haspet”, полипептиды с остеоин-
дуктивным действием "Pep-Gen Р-15".
Экономические соображения при-
вели нас к комбинации отечественных
и зарубежных материалов. Отдаленные
результаты ремоделирования их и
оценка новообразованной кости как
по количеству, так и по качеству по-
зволяют рекомендовать комбинацию
1:1, а при большем количестве единиц
материалов 1:1:1 и т.д. Не утрачивает
свое значение аутокость, она, как и ал-
локость, может входить в эти пропор-
ции с синтетической костью. Увлече-
ние мембранами с целью создания под
ними кости путем реорганизации сгу-
стка привело к применению их как за-
щитного барьера вместо биоматериала.
Вместо крови из раны для смачивания
биоматериала используют кровь, обо-
гащенную тромбоцитами (PRP). Доро-
гостоящая аппаратура, рекомендуемая
Ch.Babush (2000), R.Marx (1998), G.Uhr
(2000), может быть заменена аппарату-
рой станций переливания крови, отде-
лений детоксикации городских боль-
ниц, где состав плазмы, обогащенной
тромбоцитами, соответствует мировому
стандарту.
Очень важна подготовка костного
ложа для пересадки биоматериалов.
Факторы костного роста — морфогене-
тический белок, трансформирующий
фактор, фактор роста фибробластов,
тромбоцитарный фактор и другие вхо-
дящие в большую семью тромбоцитар-
ных факторов роста (TGF) — всегда
имеются в костной ткани, а при ее по-
вреждении их количество возрастает.
Наиболее активно этот процесс проис-
ходит в губчатом веществе кости, по-
этому следует проводить докортика-
цию кортикального вещества кости
или пластику кости внутрь. Такие опе-
рации, как взятие трансплантата из
гребня подвздошной кости, ребра,
большой, малой берцовой кости, луче-
вой кости, должны быть редкими вме-
шательствами при реконструкции че-
люстей в случае тотальной их атрофии,
после дефектов кости после онкологи-
ческих операций.
Вместо формирования костных
трансплантатов на лицевом и мозговом
черепе при наращивании кости для
зубной имплантации необходимо ис-
пользовать костные опилки и экзосто-
зы, малые фрагменты кости челюстей
нужно извлекать новыми нетравматич-
ными аппаратами, эффективно приме-
нение биоматериалов со стимулятора-
ми роста кости. Именно естественные
факторы роста кости пациента, плазмы
крови, обогащенной тромбоцитами, в
комбинации с современными биомате-
риалами обеспечат адекватное ремоде-
лирование и создание полноценной
кости для имплантации. В решении
этой проблемы мы должны прибли-
зиться к управлению репаративным
остеогенезом для зубной имплантации.
Требуют своего пересмотра тради-
ционные методы реконструкции верх-
ней челюсти и поднятия дна верхнече-
люстной пазухи. В среднем отделе
верхней челюсти необходимо локаль-
ное поднятие дна пазухи остеотомами
для установления имплантата; при
анатомических условиях одноуровне-
вого положения дна носа и дна пазухи
применять щадящий эндоскопический
метод [Робустова Т.Г., Фех А.Р., 2002].
Из различных методов операций на-
ращивания кости наиболее эффектив-
ной является остеотомия с надломом
557
вестибулярной стенки кости и введе-
нием биоматериала внутрь. Последнее
можно проводить одновременно с им-
плантацией [Balci А., 2001; Silverstein,
Hahn J., 2001].
Предымплантационная и импланта-
ционная хирургия позволяет расши-
рить возможности для применения им-
плантатов как опор зубных протезов.
Эти положения могут быть экстрапо-
лированы на всю костно-реконструк-
тивную хирургию. Необходимо разви-
вать .малотравматичную, шалящую им-
плантационную и предымплантацион-
ную хирургию. Современные возмож-
ности диагностики, предымплантаци-
онной подготовки пациентов опреде-
ляют успех лечения и долгосрочный
прогноз. Развитие гигиенических ос-
нов действий врача, самого пациента
во многом определяют сроки функ-
ционирования имплантатов и протезов
на них. Важное значение для увеличе-
ния сроков функционирования им-
плантатов имеет выбор правильной на-
грузки в конструкции зубных протезов.
Необходимо распространение опыта
ортопедических школ проф. А.И. Мат-
веевой, М.З. Миргазизова, В.Н. Олесо-
вой, А.Н. Трезубова, О.Н. Сурова,
J.Hahn, C.Misch, Ch.Babusch, J.F.Be-
rard. Требуется специализация техни-
ков, работающих в бригаде импланто-
логов. Главным направлением при
обучении на стоматологическом фа-
культете должны быть расширение
программы обучения по зубной им-
плантации, постдипломная подготовка
специалистов по ортопедическим и хи-
рургическим вопросам зубной имплан-
тации. Для такого последипломного
обучения необходимо привлекать спе-
циалистов с опытом работы по хирур-
гической или ортопедической стомато-
логии, в том числе окончивших клини-
ческую ординатуру. В комплексной ра-
боте специалистов хирургического и
ортопедического профиля по имплан-
тации зубов важно участие зубных тех-
ников, имеющих специализацию по
зубной имплантации, и гигиенистов
для обучения пациентов уходу за про-
тезами на имплантатах и индивидуаль-
ной гигиене.
Руководство для врачей
Татьяна Григорьевна Робустова
ИМПЛАНТАЦИЯ ЗУБОВ
(хирургические аспекты)
Зав. редакцией Т.П.Осокина. Редактор Г.А.Егорова.
Художественный редактор СЛ.Андреев. Технический редактор И.А.Биркина.
Корректор Л. А. Кокарева.
Оригинальные рисунки выполнены Т.С. Тихомировой.
ЛР № 010215 от 29.04.97. Сдано в набор 23.01.2003. Подписано к печати 28.05.2003.
Формат 70x100/16. Бумага офсетная № 1. Гарнитура Таймс. Печать офсетная.
Усл. псч. л. 45,50. Усл. кр.-отт. 152,58. Уч.-изд. л. 53,41. Тираж 3000 экз. Заказ № 9950.
Г П ордена Трудового
Красного Знамени
издательство «Медицина».
101990, Москва,
Петроверигский пер., 6/8.
Отпечатано с готовых
диапозитивов
в ОАО «Можайский
пол и графи чески й комби нат».
143200, г. Можайск.
ул. Мира. 93.
Крупнейшее издательство медицинской литературы
«Медицина»
Основано в 1918 году
38 научно-практических специализированных медицинских
журналов
официальный переводчик на русский язык литературы
Всемирной Организации Здравоохранения
150 книг ежегодно: учебники, руководства для врачей,
монографии ведущих отечественных и зарубежных авторов
многолетние связи с крупнейшими медицинскими центрами,
учебными заведениями, больницами и врачами России
наши издания — оперативная и надежная информация о новом
в медицине
АДРЕСА И ТЕЛЕФОНЫ ДЛЯ СПРАВОК
Продажа книг издательства без торговой наценки
для индивидуальных покупателей:
Петроверигский пер., 6/8, 4 этаж, к. 478 (м. Китай-город)
Телефон: 924 71 64. время работы: 9.30 - 17.00; обед: 13.00 - 14.00
для оптовых покупателей:
Лазоревый проезд., 3 (м. Ботанический сад)
Телефон: 189 76 85. Время работы: 9.00 - 17.30; обед: 12.30- 13.30
По вопросам размещения рекламы в изданиях издательства
•Медицина» обращаться по телефонам:
923 51 40 (телефон);
923 20 74 (телефон/факс);
928 06 93 (телефон/факс)
КОНМЕТ СГ™Ъ
Комплексная система
дентальных имплантатов ennim?ims5 2°oo
9 видов винтовых и пластиночных имплантатов
позволяют проводить имплантацию во всех клинических
ситуациях, включая узкий альвеолярный гребень
изготовлены из чистого титана с плазменным
напылением титана на эндооссальную часть
удобный титановый инструментарий обеспечивает
малую травматичность хирургической операции
имплантаты линии «эстетик» и «толстяк» позволяют
изготовить коронку правильных пропорций во фронтальном
отделе и в области моляров
большой выбор супраструктур определяет успех ранней
ортопедической реабилитации
приспособления для моделирования обеспечивают
высокую точность выполнения ортопедической
конструкции
ЗАО КОНМЕТ Тел./Факс: (095) 456 00 69
'Мщ
п"«иа1Па ' ’*3»»
Оббеи«ые научные исс /едования и разработки ,. ‘*’“в
системы дентатных импиттатов Xstra lech К 1
испотювании имлшнтатов швисит в большей f"Pll‘n,s
совместимость материала. форма имплант >П9п^И от
гальванического м1мЬекта пои ппо..„. ап,ц. пги>.. ak'>a
га. технического эффекта при применении1 п<**р£?3 2
операции, а также усювия нагрузки ‘“"'"Родных**^
Вее >ти факторы учитывались при pajn ,
,,ы представ тем Ва м краткое описание Vs'ni Т^к
эксклюзивных особенностях, которые
Sjstem над другими системами дента^П пРР»Рит^*
^нтовыхи' \
'"Ч1ЛАНТАТ (Fixture) - самонарстаюшиа
падежную фиксацию в кости с б.i.nollpil„ ВИн^ Pci^
Н|‘1М Р^предед?]
DOhlasf (2) уникальная струюура mJ
высокая степень непосредственного кони WOq* «чпд»,
отсутствие неблаюприятных реакции акги ме*ау КосЗ
имеет в три рай (!) большую биомеханичХ31*48*1 еи« «
обычными титановыми имплантатами 1410 снлу "Ри л
обработкой поверхности. дРУгих произ^
l iMure TiOblast ' (стандартные импланты» пп
конырукций зубных протезов, имеют диаметр 3 5 мм иТ’"
расе ояние между имплантатами (от цента
Fixture Micro Ihread™ - отличительной чертой як™ *
микрорезьоы в цервикальной части, а нижняя часть нмги
резьбу. Вся поверхность имплантата TiOblast™. Такая комби
резьбы обеспечивает уникальное и превосходное закрешн
Имеет тиаметр 3,5. 4.0 ; 4.5 и 5.0; длина от8 мм до 19 мм Имт
и 5.0 ST внут ри имеют конструкцию конического одинадцап
фиксацию абагментов. исключающую момент ротации ври в
Fixture ST" (имплантат одного зуба) применяется при рех
и универсален при использовании как стандартный в мостов
Цервикальная (пришеечная) часть имеет мелкую базовую
апикальная часть имеет стандартную крупную резьбу. Дми
> 0 4 и При благоприятных условиях допускается ои*1
инсталляция сразу послся^^^^^
41) < I ВО Microthread™ (I)
более высокий уровень маргинальной кости,
увеличенная стабильность и качество костной!
ткани. !
- здоровые мягкие ткани.
- отсутствие микрозазоров между компонентами. ___
- перераспределение н.пру тки на прилегающую ко,^ косг*
мсхани'ч скхю сгимуля! рю кости и снижает ур<>*” и „вивере*-’
< ' I' 11'Х к ГУ р\: 1н шин и ассортимею Ра1ИО‘ ^^яст с*16**,
f Abutment (абатмент) пре . о.|Ного И £
. j пен.рально.о винта (п н^*кий10 С-ЙЯ
tfr )i t имеют ко........ м '^Р1ССНы (*
X 1 I Zebra™ - Ф°РмирОрУт)20"''45‘ изк.
g (стандартный абатм уГач _..
Angled Abutment (У’- рг<»’,|е.
7' V s 1 -l I°- обтач"ХксХи'1 съем
/ V аб;,1МСНТЬ' ^brnment. (Чес
- * балочные Ваг АО _ м’Н
Conical Seal О** нТ- Д
Ilf поверхнос1си имплантат. д йcropo’Lpep
If ........... с фиксиР. иИц. -ощ
I прочность и сгабильностьФ’^и « П-п
сравнению с другими с
70 BL
Ml
T,vh "ПР'-1"'
rSSS-»""'
__ ’ ‘.wicHCia-1"
^*’^2^*гзгз и **оп
ыедак^
и.р^иртнинные лап
и ыстну» «*’*•’
'оймбЬ^т^в“-,1’,к
пре*'*”
снэ<--с”че<*
вни*' pjHHl* |р
«попшигнию к .три им qmcm.im III
W всесторонним ассортимент пролмиин i .
I шш.и.рам.юст>. пженееровании прап:1их>вани11 при
ТОЧНОЙ °РИМ'Р‘ОЙ .......................-и.,
7,7^^7иЧе'аНИ*1МП * '
"ОСТЬ паииот ^бра,ь иаи6^1П'1<,ИеИ7‘‘ ^|ИЧ’Р<Л,Ь|"
iXZ? ~ора'ь наиболее приемлемы» х.я нсп
Р»нИченНМе BU(u
***^Чфе£М°* Ноет II
в,р*и>м^